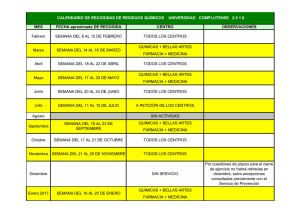
evaluacion de la exposicion de monoxido de carbono en
Anuncio

UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA UNIVERSIDAD DE CUENCA. FACULTAD DE CIENCIAS QUIMICAS. ESCUELA DE BIOQUIMICA Y FARMACIA. “EVALUACION DE LA EXPOSICION DE MONOXIDO DE CARBONO EN CONDUCTORES DE BUSES DE LA EMPRESA DE TRANSPORTE TRANSBAÑOSA” Tesis previa a la obtención del título de Doctor en Bioquímica y Farmacia . AUTORAS: CLAUDIA CARCHIPULLA S. PAULINA ESCOBAR H. DIRECTORA: DRA. RUTH ROSAS C. ASESORA: DRA. LOURDES JERVES. CUENCA-ECUADOR 2006 Claudia Carchipulla Paulina Escobar 1 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA DEDICATORIA Esta tesis y todo el esfuerzo puesto en su realización se lo dedicamos a Dios y a nuestros padres y familiares; por ser los seres más tiernos y sinceros, un tributo a la esperanza amor, ejemplo y perseverancia. Impulsadores para seguir en busca de nuestros sueños e ideales y de un porvenir lleno de profesionalismo, triunfos y honor. Claudia y Paulina AGRADECIMIENTO Gracias a DIOS, por habernos concedido la luz y sabiduría para alcanzar esta nueva meta en nuestras vidas. Claudia Carchipulla Paulina Escobar 2 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA A nuestras FAMILIAS, quienes con su ternura, compresión, ejemplo y amor nos han impulsado para convertirnos en seres emprendedores, y forjadores de nuestros ideales. A la empresa de Transporte “TRANSBAÑOSA” por su desinteresado apoyo y cooperación en la realización de esta tesis, y de manera especial al Ing. DAVID GUTIÉRREZ quien preocupado por el bienestar de la comunidad y las personas que laboran en su empresa, impulso el desarrollo del presente trabajo, además de depositar toda su confianza en el mismo. A la Dra. RUTH ROSAS C., quien supo orientarnos con paciencia, esmero, dedicación, confianza y apoyo para le realización de este trabajo. Claudia y Paulina RESUMEN El monóxido de carbono (CO) es una de los principales contaminantes con capacidad de producir enfermedad cardiovascular de tipo isquémico o de agravar las existentes. El objetivo de este estudio fue conocer qué niveles de carboxihemoglobina (COHb), tienen los conductores de buses de la Empresa de Transporte Urbano “TRANSBAÑOSA” de la ciudad de Cuenca, se determino el % de Saturación de Hemoglobina con Monóxido de Carbono, ya que aparte de que se los considera como gestores de la contaminación, son también personas que se encuentran expuestas a ella, su permanencia por Claudia Carchipulla Paulina Escobar 3 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA largos periodos dentro de los vehículos incide de cierta forma a que sus niveles de Carboxihemoglobina se encuentren alterados. Para la determinación del % de Saturación de Hemoglobina con Monóxido de Carbono se realizaron los siguientes análisis: determinación de hemoglobina, ml CO %, mg CO %; además de datos complementarios a través de un encuesta realizada a los conductores. Subsiguientemente se estableció que los conductores de autobuses presentan valores altos de Carboxihemoglobina que se ven incrementados, por situaciones como sedentarismo, mala alimentación y falta de conocimiento en relación al tema. Todo esto nos lleva a sugerir que la población en general debe poseer un conocimiento mas profundo sobre las consecuencias de la contaminación ambiental y como afecta en su calidad de vida, sin desatender áreas como la actividad física y mental, parte fundamental del desarrollo. Palabras claves: Carboxihemoglobina, monóxido de carbono, conductores, contaminación. Claudia Carchipulla Paulina Escobar 4 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA INDICE CAPITULO I: EL AIRE Y SU CONTAMINACION. 1.1. 1.2. 1.3. 1.3.1. 1.3.2. 1.3.3. Generalidades. Causas de polución y polucionantes Origen de las emisiones contaminantes. Fuentes naturales. Fuentes artificiales. Fuentes relacionadas con el transporte. 1 1 3 4 5 6 CAPITULO II: MONOXIDO DE CARBONO. 2.1. Características y Propiedades. 2.2 Propiedades Físicas y Químicas. 2.3 Propiedades Farmacodinámicas. 7 9 10 CAPITULO III: TRANSPORTE Y DIFUCION EN LA ATMOSFERA. 3.1. Mecanismo de acción. Ciclo del Carbono. 3.2 Distribución y Transformación en el medio 3.3 Absorción y Transformación en el medio 3.4 Monóxido de Carbono permisible 3.5 Evaluación de la exposición. 13 15 16 17 19 CAPITULO IV: TOXICIDAD. 4.1 Intoxicación aguda. 4.2 Intoxicación sobreaguda. 4.3 Intoxicación progresiva. 4.4. Intoxicación crónica. 4.4.1. Exposición crónica. 4.4.2. Inhalación a largo plazo. 4.4.3 Producción Endógena de Monóxido de Carbono. 4.5. Efecto sobre la salud. 4.5.1. Efectos sobre el SNC. 4.5.2. Efectos sobre el sistema Cardiovascular. 4.5.3. Efectos sobre el Pulmón. 4.5.4. Efectos sobre el Riñón. 4.5.5. Otros. 4.6. Metabolismo. 4.7. Excreción. 4.8. Tratamiento. Claudia Carchipulla Paulina Escobar 21 22 22 24 25 25 26 27 27 29 30 30 30 31 32 33 5 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 4.8.1. Primeros auxilios. 4.8.1.1. Indicaciones de tratamiento. 4.8.2. Tratamiento hospitalario. 4.8.2.1. Administración de oxígeno. 4.8.2.2. Corrección de la acidosis metabólica. 4.8.2.3. Otros cuidados. 33 33 34 34 34 34 CAPITULO V: MATERIALES Y METODOS. 5.1. Determinación de monóxido de carbono en sangre por métodos químicos 5.1.1. Método de Microdifusión. 5.2. TECNICA. 5.2.1. Reactivos. 5.2.2. Equipos. 5.3.3. Procedimiento. 5.3.4. Expresión de resultados. 36 36 37 37 37 37 38 CAPITULO VI: RESULTADOS Y DISCUSIONES 41 CAPITULO VII: ANÁLISIS ESTADÍSTICO 7.1. 7.1.1. 7.1.2. 7.2. Casuística Hipótesis. Variables Tabulación de datos. 53 53 54 54 CONCLUSIONES 60 RECOMENDACIONES 62 ANEXOS 63 BIBLIOGRAFÍA. 73 Claudia Carchipulla Paulina Escobar 6 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA INTRODUCCION La contaminación del aire en el Ecuador, primordialmente la que se origina en las grandes ciudades, influye negativamente en forma directa e indirecta la salud, bienestar, economía y calidad del vida de millones de individuos, afectando además las posibilidades de progreso de las ciudades y regiones al impactar sobre su economía y competitividad. Al observar que el hombre al utilizar los recursos naturales para satisfacer sus necesidades productivas, culturales y sociales, establecen, en unos casos, el agotamiento de los recursos, sean renovables o no, y, en otros, el deterioro de éstos. Esto forja situaciones que dan lugar a la destrucción de los ecosistemas y de las especies vivientes correspondientes. El quebranto ambiental constituye una de las preocupaciones esenciales del hombre moderno, como reacción al conocimiento que se tiene sobre el creciente daño que diariamente inflige a la naturaleza, a consecuencia principalmente del crecimiento urbano e industrial. Especial preocupación existe por el aire, el agua y el suelo, elementos básicos que inexplicablemente están interrelacionados con otros recursos de la naturaleza para configurar y resguardar la vida en el planeta. Claudia Carchipulla Paulina Escobar 7 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA El ambiente se considera como contaminado, cuando cambia su composición, directa o indirectamente, por las acciones del hombre, de tal forma que es menos provechoso para cumplir con sus funciones relacionadas con la vida. Son cambios en las propiedades físicas, químicas o biológicas del ambiente, como resultado de las descargas de materiales nocivos o el uso de productos químicos. Así el Ecuador, con sus problemas de contaminación ambiental no han recibido el tratamiento que se merecen. Se ha creído que, dado nuestro incipiente desarrollo industrial y tecnológico, nuestra contaminación también es así. Sin embargo, la realidad nos ha presentado excesivas evidencias de que esto no es cierto, por lo que es ventajoso actuar cuanto antes para evitar una superior destrucción de importantes ecosistemas nacionales. La estimación del riesgo por exposición de concentraciones bajas de monóxido de carbono por parte de población, que incluye personas sanas y enfermas, fumadores y no fumadores, niños y ancianos; sería complicada de evaluar. En general el parámetro de evaluación considera que todo individuo debe ser protegido de exposiciones al monóxido de carbono que generen concentraciones de carboxihemoglobina del 5% durante períodos que no sean temporales y que personas sensibles no sean Claudia Carchipulla Paulina Escobar 8 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA arriesgadas a concentraciones de carboxihemoglobina superiores al 2,5%. Los esfuerzos que el gobierno nacional y los gobiernos locales han ejecutado para enfrentar y solucionar el problema, han sido limitados en términos de recursos, alcance, sostenibilidad y logros. Es importante la incidencia de la mala calidad del aire, producida por emisiones vehiculares, industriales, naturales (entre otras), empeoradas por factores de tipo geográfico, topográfico, morfológico, organizacional, social, económico, etc. Claudia Carchipulla Paulina Escobar 9 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA CAPITULO I EL AIRE Y SU CONTAMINACION 1.1. Generalidades. La atmósfera terrestre está constituida principalmente por nitrógeno (78%) y oxígeno (21%). El 1% restante lo forman el argón (0,9%), el dióxido de carbono (0,03%), distintas proporciones de vapor de agua, y trazas de hidrógeno, ozono, metano, monóxido de carbono, helio, neón, kriptón y xenón. El estudio de muestras indica que hasta los 88 Km. por encima del nivel del mar la composición de la atmósfera es sustancialmente la misma que al nivel del suelo. El movimiento continuo ocasionado por las corrientes atmosféricas contrarresta la tendencia de los gases más pesados a permanecer por debajo de los más ligeros. Otros elementos que en ocasiones constituyen parte de la atmósfera en cantidades minúsculas son el amoníaco, el sulfuro de hidrógeno y óxidos, como los de azufre y nitrógeno cerca de los volcanes, arrastrados por la lluvia o la nieve. 1.2. Causas de polución y polucionantes. La contaminación supone el aumento o a veces la disminución de ciertos componentes de la atmósfera, que no se habría producido sin la actividad humana. Así la contaminación atmosférica se debe a la presencia de sustancias en la atmósfera que resultan de la actividad del ser humano o de Claudia Carchipulla Paulina Escobar 10 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA procesos naturales y que producen efectos negativos en el hombre y en el medio ambiente. La polución de la atmósfera es, ciertamente, un problema anterior a la aparición del automóvil y debe ser considerada desde una óptica particular. Cuando los tubos de escape emiten óxidos de nitrógeno, monóxido de carbono e hidrocarburos, se va acumulando una gran cantidad de contaminación en las áreas urbanas. Las emisiones de óxido de nitrógeno e hidrocarburos también producen los contaminantes secundarios de oxidantes fotoquímicos. La energía residual en forma de ruido y calor también contribuye a aumentar la lista de contaminantes locales. El desarrollo de nuevas industrias introdujo el problema de los productos químicos tóxicos, mientras que la producción de energía nuclear y las pruebas con armas atómicas aportan la radiación ionizante como contaminante. Los tubos de escape de los vehículos emiten entre 150 y 200 compuestos diferentes. De entre ellos, los más representativos serían el monóxido de carbono, los hidrocarburos, los óxidos de nitrógeno y el plomo. Para que se tenga una idea de la importancia del problema, se admite que en París, los automóviles son responsables de, al menos, el 25% de la polución. El impacto de las emisiones de polucionantes en el medio ambiente es distinto según se vierta a mayor o menor altura. La polución producida por una fuente puntual fija, como una chimenea de una fabrica depende de algunos factores Claudia Carchipulla Paulina Escobar 11 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA sobre los que no podemos actuar, como las condiciones climáticas, y de otros sobre los que sí podemos ejercer una acción limitante, como son, el tipo de combustible empleado, la técnica y la altura de la chimenea por la que se emiten los gases. La mejor manera de resolver los problemas de polución atmosférica consiste en adoptar técnicas que la reduzcan desde el comienzo del proceso industrial. Estas tecnologías limpias presentan a menudo un interés adicional al mejorar sensiblemente el rendimiento de la producción. La limitación de las emisiones de partículas por las instalaciones de combustión se puede realizar empleando el combustible menos polucionante disponible o mejorando la combustión mediante técnicas y reglajes apropiados. Hay que asegurar que las modificaciones de las condiciones de combustión no originan un aumento de otros polucionantes, como los óxidos de nitrógeno. Se puede obligar a que en zonas muy polucionantes se utilice combustible de bajo contenido de azufre. Durante todo el año o durante el periodo invernal. 1.3. Origen de las emisiones contaminantes. El cuerpo humano produce de forma continua pequeñas cantidades de CO, como uno de los productos finales del catabolismo de la hemoglobina y otros grupos hem. De esta manera es normal que en un individuo sano exista una Claudia Carchipulla Paulina Escobar 12 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA saturación de carboxihemoglobina del 0.4-0.7%, o que en situación de anemia hemolítica aumente la producción endógena de CO, llegando a una saturación de carboxihemoglobina del 4-6%. Sin embargo, esta producción endógena es raro que pueda provocar síntomas de intoxicación en un sujeto normal. De forma exógena el CO se produce por la combustión de materiales con carbono en ambientes pobres en oxígeno. 1.3.1. Fuentes naturales. Actualmente no se conoce con exactitud la cantidad total de monóxido de carbono producida por fuentes naturales, estimándose fundamentalmente la oxidación del metano en la atmósfera y las emisiones de los océanos en diez veces más que las fuentes artificiales. Por el contrario estudios posteriores estimaron que la producción natural era mucho menor y podría ser inferior a las emisiones generadas por el hombre. Determinaciones del monóxido de carbono producidas por reacciones atmosféricas, fueron descritas calculando que en el hemisferio norte se producen anualmente más de 3 x 109 toneladas métricas de monóxido de carbono por oxidación del metano y de otros cuerpos orgánicos. Otras fuentes generadoras de monóxido de carbono son los incendios forestales y de praderas, volcanes, gas de pantanos y tormentas eléctricas. Además de cierta cantidad generada en las capas superiores de la atmósfera Claudia Carchipulla Paulina Escobar 13 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA por fotodisociación del dióxido de carbono; a las nubes se atribuye la oxidación fotoquímica de materia orgánica, la leve disociación del dióxido de carbono inducida por descargas eléctricas o ambos factores. Por otra parte en el hombre y animales se generan cantidades apreciables del gas como subproducto del catabolismo del hem. 1.3.2. Fuentes artificiales. Las emisiones de monóxido de carbono de fuentes creadas por el hombre llegaron en 1970 a 360 millones de toneladas. En 1973 las emisiones llegaron a 600 millones de toneladas. Los automóviles fueron el principal generador, con el 55% del total de las emisiones, el resto correspondió a otros medios de transporte, procesos industriales, eliminación de desechos, quema de sustancias orgánicas, refinería de petróleo, acerías y molinos de pasta papel entre otros. El empleo de combustibles fósiles, las centrales eléctricas, industrias y hogar generan emisiones de menor envergadura, que pasan a constituir una fuente importante una vez que se combinan. La fundición de hierro, producción de gas, estaciones de servicio automotriz, se cuentan entre las fuentes importantes de exposición laboral al monóxido de carbono. También el humo del tabaco es una importante fuente de monóxido de carbono Claudia Carchipulla en ambientes cerrados, donde Paulina Escobar las concentraciones de 14 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA carboxihemoglobina en fumadores son más elevadas que aquellas que no fuman. 1.3.3. Fuentes relacionadas con el transporte. Si se considera todas las categorías principales de fuentes antropogénicas combinadas, a excepción de la agricultura, el sector del transporte de nuestra economía genera alrededor de un tercio de las emisiones totales de COV, óxidos de nitrógeno y plomo, y más de dos tercios del monóxido de carbono. El CO y los COV (casi todos como hidrocarburos) son productos de una combustión ineficiente, los cuales se eliminarían quemando el combustible hasta CO2 y H2O en el motor del vehículo para producir potencia si es posible. Claudia Carchipulla Paulina Escobar 15 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA CAPITULO II MONOXIDO DE CARBONO. El monóxido de carbono u oxido de carbono es el gas que mas frecuentemente genera problemas tóxicos, tanto en la población común como profesional con riesgo especifico. La ubicuidad de sus fuentes de emisión, su carencia de olor o color favorecen las intoxicaciones accidentales, y su fama como veneno, las suicidas. Es probablemente uno de los primeros tóxicos generados por la actividad humana y quizás el primero cuyos riesgos se han conocido. 2.1. Características y Propiedades. El monóxido de carbono es un gas incoloro, inodoro e insípido, ligeramente menos denso que el aire; comúnmente formado a partir de la combustión incompleta de combustibles y productos que contienen átomos de carbono. Se presenta además en procesos industriales y biológicos. La importancia que posee para la salud, como contaminante atmosférico, es el fuerte enlace de coordinación con el átomo de hierro del complejo proto-hem de la hemoglobina (HbCO), sustancia que disminuye la capacidad en la sangre de transportar oxígeno. Claudia Carchipulla Paulina Escobar 16 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA La presencia de carboxihemoglobina en la sangre altera la disociación de oxihemoglobina, disminuyendo la provisión de oxígeno a los tejidos. La afinidad de la hemoglobina con el monóxido de carbono es de aproximadamente 240 veces superior a su afinidad con el oxígeno; las proporciones en que se encuentran la carboxihemoglobina y oxihemoglobina en la sangre obedecen en parte a las presiones parciales de monóxido de carbono y de oxígeno. Constituye la intoxicación por monóxido de carbono (CO), la causa más frecuente de muerte por tóxicos después de las sobredosis de fármacos en muchos países. A pesar de ser un gas tóxico muy frecuente en el medio industrial, no podemos olvidarlo como una forma de intoxicación habitual en el ámbito doméstico, etc. El CO es el responsable en el 80% de los casos de las alteraciones provocadas por la inhalación de humo en el transcurso de un incendio. Claudia Carchipulla Paulina Escobar 17 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 2.2. Propiedades Físicas y Químicas. Tabla 1 Propiedades Físicas y Químicas .del Monóxido de Carbono Formula Química CO Masa molecular relativa 28.01 Nombre Químico Monóxido de Carbono Punto Critico 140.2 ºC a 34.5 atm. Punto de Fusión 205.1ºC Punto de Ebullición 191.5 ºC Densidad Relativa 1.250 g/l a 0ºC 1 atm. Peso específico Solubilidad en agua 0.967 respecto al aire. 3.54 ml/100 ml a 0ºC2. Elaborado por: Claudia Carchipulla y Paulina Escobar El monóxido de carbono aparece como producto de la combustión compuestos del carbono de en déficit relativo de oxígeno. Tienen carácter reproductor y se comporta como una base débil de Lewis. En presencia de oxígeno se oxida espontánea y lentamente a CO2. Su densidad es 0.967, y extremadamente difusible, llegando a atravesar incluso láminas de hierro calentadas al rojo. Tiende a acumularse en las zonas altas, es poco soluble en agua (25 cc/L), aunque en algunos líquidos como el etanol, acetato de etilo, solución amoniacal del ácido cuproso se disuelve en mayores proporciones. Claudia Carchipulla Paulina Escobar 18 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Arde con llama azul, (2.2 Kcal/ Kg), y en proporciones del 12.5 al 74.2 % puede formar mezclas explosivas con el aire. Su concentración en el aire se expresa como ppm o mg / m3. Forma carbonilos con los metales de transición del grupo d. También puede formar carburos o simplemente reducir algunos óxidos metálicos a temperaturas suficientemente elevadas, por lo tanto que se emplea en la metalurgia extractiva. En la atmósfera se oxida lentamente a CO2. 2.4 . Propiedades Farmacodinámicas. El monóxido de carbono es rápidamente absorbido por los alvéolos, pasando a la sangre donde se une a la hemoglobina. La absorción pulmonar es directamente proporcional a la concentración de CO en el ambiente, al tiempo de exposición así como a la velocidad de ventilación alveolar que a su vez depende del ejercicio realizado durante el tiempo de exposición. Así por ejemplo, en un incendio, un bombero, dada la alta concentración de monóxido respirado y la frecuencia respiratoria secundaria al ejercicio alcanza niveles tóxicos de carboxihemoglobina en muy poco tiempo. Una vez en la sangre el CO se une con la hemoglobina con una afinidad unas 210-270 veces superior a la del oxígeno, formando un compuesto denominado carboxihemoglobina. El resultado de la unión del CO a la hemoglobina es el desplazamiento de la unión del oxigeno con esta. En condiciones normales la cantidad de oxígeno Claudia Carchipulla Paulina Escobar 19 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA que transporta la sangre es de 20 ml/100 ml de sangre completa, de los cuales 18 %, del volumen van unidos a hemoglobina y el resto va disuelto en el plasma. Para una función celular normal es necesario la liberación a nivel periférico de 5 %, lo cual constituye la diferencia arterio - venosa de oxígeno. De forma resumida una vez en contacto con el CO, éste es absorbido hacia la sangre y se une con la hemoglobina desplazando al oxígeno, y, además, el escaso oxígeno transportado es difícilmente cedido a los tejidos para su utilización, provocando todo ello hipoxia. Pero el CO no solo ejerce su acción a nivel de la hemoglobina sino que también es capaz de ligarse a otras hemoproteínas localizadas a nivel tisular como son la mioglobina, la citocromo oxidasa, el citocromo P450 y la hidroperoxidasa. Entre un 15-20% del CO se une a dichas proteínas. La mioglobina se enlaza al CO con una afinidad 40 veces superior a la que tiene el oxígeno por dicha molécula. Dado que la mioglobina constituye un depósito de oxígeno, su unión con el CO provoca al igual que a nivel sanguíneo una disminución del oxigeno acumulado a nivel muscular así como de su liberación de la mioglobina. Además, el CO tiene una afinidad especial por el músculo cardíaco. Así al producirse intoxicación por CO, cuando los niveles de oxígeno sanguíneo vuelven a la normalidad, el monóxido de carbono se libera del miocardio pasando nuevamente a la sangre. Esto explicaría la sintomatología cardíaca como las arritmias, dilatación ventricular, insuficiencia cardíaca. Claudia Carchipulla Paulina Escobar 20 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Otras proteínas con grupos hem son la citocromo oxidasa y el citocromo P450, que también se unen con el monóxido de carbono, de forma competitiva frente al oxígeno. Se ha atribuido a esta asociación la mayor parte de la sintomatología. El CO, una vez en la sangre, una parte se liga a la hemoglobina y el resto permanecería disuelto en el plasma, siendo esta parte la que pasaría al interior de los tejidos y, por tanto, la responsable de la sintomatología a través de su unión con estas enzimas pertenecientes al mecanismo de respiración celular. La afinidad de los citocromos por el monóxido de carbono es similar a la del oxígeno, por lo que los niveles de CO que llegan in vivo a los citocromos no son suficientes para afectar su función. La correlación entre los niveles de Carboxihemoglobina y la clínica no es tan exacta, dependiendo la intensidad de los síntomas y de factores tales como la concentración de monóxido de carbono a la que el paciente está expuesto, la profundidad de la respiración y la frecuencia cardiaca, etc. Claudia Carchipulla Paulina Escobar 21 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA CAPITULO III TRANSPORTE Y DIFUSION EN LA ATMOSFERA 3.2. Mecanismo de acción. Ciclo del Carbono. El carbono es necesario en grandes cantidades como bloque básico de construcción de toda la materia orgánica. La fuente última de carbono es el dióxido de carbono, el cual se transforma en compuestos orgánicos por a fotosíntesis. En la naturaleza, el movimiento de carbono es de la reserva de Dióxido de carbono atmosférico a las plantas verdes y de ahí a los consumidores, y continúa a los organismos microbianos que descomponen la materia orgánica. Las algas y las bacterias autótrofas también incorporan o fijan carbono del CO2 atmosférico para producir carbohidratos y otras sustancias orgánicas complejas. Estas se distribuyen a través de la cadena alimenticia y constituyen los tejidos de la materia viva. Los combustibles fósiles, las rocas de carbonatos y el dióxido de carbono disuelto en los océanos son importantes reservas adicionales de carbono, aunque los dos primeros no son accesibles de manera natural para las plantas y los animales. Estas fuentes “ligadas” de carbono quedan disponibles cuando el CO2 se libera durante la quema de combustibles fósiles y por la acción del CO2 (producto de la descomposición microbiana) que transforma los carbonatos insolubles en bicarbonatos solubles. Claudia Carchipulla Paulina Escobar 22 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA El retorno del dióxido de carbono a la reserva atmosférica se verifica de diversas maneras. Quizá la más conocida es a través de los procesos respiratorios de los humanos y los animales. Sin embargo, con mucho, las cantidades mas grandes de dióxido de carbono regresan a la atmósfera por la actividad de grupos de bacterias y hongos los cuales utilizan materia orgánica muerta como fuente de alimento. Estos microorganismos oxidan la materia muerta, ya sea de forma directa o en varias etapas, obteniendo CO2 y H2O como productos finales, con lo cual completan el ciclo. Otras fuentes que devuelven CO2 a la atmósfera son los incendios forestales y la quema de combustibles fósiles y otra materia orgánica. La quema de turba seca, carbón o petróleo es un ejemplo de la utilización de una biomasa fotosintética antigua como fuente de energía térmica. El carbono se oxida a dióxido de carbono en cada caso. El componente geológico del ciclo del carbono comprende la acumulación, descomposición lenta y compactación del material vegetal par formar turba, carbón, y petróleo, y la acumulación y compactación de conchas de animales y esqueletos microscópicos de diatomeas para formar rocas de carbonatos. El carbonato de calcio también se precipita en aguas dulces cuando las algas extraen CO2 del agua, con lo cual aumenta su pH. Cuando se mezclan con arcilla, estos depósitos forman margas, que con el tiempo se compactan y forman piedra caliza. Enormes depósitos de carbón y gran parte de la piedra caliza se sedimentaron durante el periodo carbonífero, cuando predominaban en la Tierra aguas poco profundas y climas cálidos. El dióxido de carbono Claudia Carchipulla Paulina Escobar 23 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA también se difunde dentro y fuera del agua, en el cual se disuelven para formar ácido carbónico (H2CO3). Este se disocia por una serie de reacciones para formar un ión hidrógeno (H+) y un ion bicarbonato (HCO3-), después de esto se vuelve a disociar para formar un ion hidrógeno (H+) y un ion carbonato (CO3-2). Todas las reacciones son reversibles y dependen de los gradientes de difusión y del pH. La descarga de aguas residuales domésticas y desechos industriales orgánicos aporta grandes cantidades de carbono a las aguas receptoras. La necesidad de reducir la materia orgánica en ella es una de las razones principales por la que se hace el tratamiento de agua residual. Los puntos más importantes que conviene recordar son: todas las plantas verdes terrestres obtienen su carbono del dióxido de carbono gaseoso, las plantas acuáticas lo adquieren de bicarbonatos y los complejos de carbono que se forman en la acumulación y la descomposición lenta son devueltos a sus formas originales por la descomposición microbiana. 3.2. Distribución y Transformación en el medio. Las concentraciones atmosféricas de monóxido de carbono en sitios alejados de fuentes artificiales son bajas y variables. Claudia Carchipulla Paulina Escobar 24 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Las concentraciones de monóxido de carbono en las capas inferiores de la atmósfera varían entre 0,01 a 0,23 mg/m3, también concentraciones de 0,025 a 0,9 mg/ m3 en la atmósfera sobre el Pacífico, entre otras. Las concentraciones de monóxido de carbono son influidas por el origen de las masas de aire, existiendo distribución vertical del gas. En la troposfera se observaron concentraciones medias de 0,11 mg/m3, mientras que en la estratosfera son entre 0,03 y 0,06 mg/m3. Al aumentar la altitud, se produce una disminución gradual de las concentraciones de monóxido de carbono, que varían entre 0,09 mg/ m3, a los 4 Km. y 0,05 mg/ m3 a los 15 Km. 3.3. Absorción y Transformación en el medio. El tiempo de permanencia del monóxido de carbono en la atmósfera es de aproximadamente 0,2 años, donde las concentraciones básicas no aumentan debido a la existencia de diversos mecanismos de barrido y eliminación; estos son la oxidación en la atmósfera y la absorción por el suelo, la vegetación y las aguas. Por su parte los océanos actúan como depósitos del monóxido, donde este gas se disuelve en el agua, a causa del equilibrio existente se disuelve o libera monóxido de carbono con relación a condiciones de presión parcial del gas en la atmósfera y la temperatura del agua. Claudia Carchipulla Paulina Escobar 25 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA El monóxido de carbono producido en la superficie de la tierra se desplaza mediante difusión y las turbulencias a la troposfera y la estratosfera, donde es oxidado por el radical oxidrilo y se convierte en dióxido de carbono CO2. Este proceso explica la oxidación del monóxido de carbono. Los microorganismos del suelo, también metabolizan el monóxido de carbono, los suelos desérticos absorben cantidades menores de monóxido de carbono que los suelos tropicales y los índices de absorción en suelos agrícolas son inferiores a los sin cultivar, debido a la cantidad de materia orgánica disponible en superficie. También existen registros de especies vegetales que pueden eliminar el monóxido de carbono de la atmósfera mediante oxidación y conversión en dióxido de carbono o metano. 3.4. Monóxido de Carbono permisible. Las cifras medias de concentración de monóxido de carbono en las colectividades urbanas a menudo llegan a 50 ppm, debido a los motores de vehículos. Esta es solo una pequeña parte de la situación en la que se encuentran los individuos que viven en este ambiente. En resumen Claudia Carchipulla Paulina Escobar cualquier residente 26 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA urbano se encuentra expuesto a diversos niveles de CO durante todos los días de su vida población en ese ambiente y como las actuales tendencias parecen aproximarse a una urbanización total, es urgente de que lleguen a entenderse bien los efectos de estas concentraciones de CO. Tabla 2 Concentración CO en el Aire Tiempo de Inhalación Síntomas 50 ppm 8 horas Máximo permisible saludables (OSHA) en adultos 200 ppm 2-3 horas Ligero dolor de cabeza ,cansancio, fatiga, náuseas 400 ppm 1-2 horas 3 horas Dolor de cabeza frontal Amenaza para la vida 800 ppm 45 minutos 2 horas 2-3 horas Desvanecimiento, náuseas, convulsiones Inconciencia, Muerte 1600 ppm 20 minutos 1 hora Desvanecimiento, inconciencia muerte 3200 ppm 5-10 minutos 30 minutos Inconsciencia Muerte Fuente: www.cst.cl/monoxido/ Elaborado por: Claudia Carchipulla y Paulina Escobar Los efectos fisiológicos de los niveles de carbono no tóxicos de exposición al monóxido son proporcionales al contenido de carboxihemoglobina de la sangre. Este alcanza un equilibrio después de unas ocho horas de estar en una atmósfera que contenga CO en el ambiente. Claudia Carchipulla Paulina Escobar 27 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 3.6 . Evaluación de la exposición. Los contaminantes emitidos por los transportes en sus diversos tipos forman un número muy reducido de compuestos entre los que se destacan los siguientes. 9 Dióxido de Carbono. 9 Monóxido de carbono. 9 Hidrocarburos poli aromáticos. 9 Hidrocarburos ligeros. 9 Aldehídos. 9 Plomo. Los perjuicios de la contaminación con CO resultan muy difíciles de definir y por lo tanto no han servido para marcar los niveles de seguridad. Sin embargo, existen determinar límites dos pautas seguros que probablemente se utilicen para generales. Estas son la cantidad de CO que retarda los reflejos al conducir un automóvil y la cantidad de CO que pueden tolerar los pacientes de enfermedades del corazón o de los pulmones. La primera exige cantidades masivas de información estadística sobre la relación que hay entre los accidentes y las concentraciones de CO en las autopistas. La segunda se puede deducir actuales. Por ejemplo un 10% de datos de investigaciones de carboxihemoglobina en sangre afecta significativamente el transporte de oxígeno. Claudia Carchipulla Paulina Escobar 28 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Muchos individuos tienen padecimientos físicos que equivalen a una disminución del transporte de oxígeno de un 5%. La exposición a 35 ppm de CO durante un periodo duradero añadiría otro 5% de carboxihemoglobina, creando una situación peligrosa. Los estándares basados en cifras como esta, exigirán reducciones drásticas de la emisión de monóxido de carbono de los automotores en un futuro próximo y, posiblemente , la eliminación del motor de combustión interna en un futuro más distante. Tabla 3 SUSTANCIAS ANALIZADAS MEDIO ANALIZADO VALOR NORMAL AGENTE QUÍMICO MONÓXIDO CARBOXIHEMOGLOBINA SANGRE <1% PROPOSICIÓN OBSERVACIONES DE UNA CONCENTRACIÓN MÁXIMA PERMISIBLE 5% NO FUMADOR DE CARBONO MONÓXIDO DE CARBONO MONÓXIDO DE CARBONO SANGRE NO FUMADOR NO FUMADOR ESPIRADO FUENTE: EVALUACIÓN DE LA EXPOSICIÓN A LOS AGENTES QUÍMICOS EN LA INDUSTRIA TABLA 8 PÁG. 91. LAUWERYS, ROBERT. TOXICOLOGÍA INDUSTRIAL E INTOXICACIONES PROFESIONALES. MASSON S.A. ESPAÑA 1994. Claudia Carchipulla AIRE <0,15 10 ML/100ML ML/100ML <2 PPM 18 PPM Paulina Escobar 29 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA CAPITULO IV TOXICIDAD El monóxido de carbono da lugar a dos tipos de cuadros clínicos. La intoxicación aguda muy frecuente y fácilmente diagnosticable, y la crónica, producida por su absorción continuada durante largos periodos. El complejo sindrómico que estudiaremos como Intoxicación crónica, es polimorfo y tan variable en sus características y circunstancias de presentación, que muchos autores niegan su existencia como cuadro tóxico específico. 4.1. Intoxicación aguda. La forma de presentación de la intoxicación aguda varía dependiendo de muy diversos factores, como la velocidad de absorción del tóxico, el grado de resistencia y adaptación del paciente al monóxido, etc. Así, mientras que en un sujeto fumador, cifras de hasta el 14% de carboxihemoglobina causa apenas síntomas, en un sujeto inadaptado da lugar a un cuadro de embriaguez con náuseas y mareos. Por su mecanismo de acción, aquellos pacientes que sufren trastornos isquémicos cardíacos o neurológicos, usualmente de etiología arteriosclerótica, son mucho más sensibles a su acción. Si la absorción es rápida, los signos del cuadro se centran en SNC y corazón, mientras que si la absorción es lenta, se produce un cuadro más característico, con afectación de otros aparatos y sistemas. Claudia Carchipulla Paulina Escobar 30 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 4.2. Intoxicación sobreaguda. Se produce al respirar atmósferas sumamente contaminadas por monóxido (concentraciones superiores al 30-40 %). La víctima pierde la conciencia durante las primeras inspiraciones, y fallece por parada respiratoria. 4.3. Intoxicación progresiva. Es el cuadro característico de esta intoxicación. La clínica depende de la proporción de carboxihemoglobina/hemoglobina en cada momento, así como de la velocidad de absorción, y generalmente empiezan a manifestarse signos de toxicidad a partir de niveles de carboxihemoglobinemia superiores al 10-15 %. Inicialmente se producen cefaleas frontoparietales de carácter pulsátil, sensación de mareo y vértigos y embotamiento psíquico. Se produce disnea ante esfuerzos moderados, la piel está caliente y seca, e incluso un poco enrojecida por la vasodilatación del lecho vascular. A partir de niveles del 20-30 % de carboxihemoglobinemia, la disnea se hace evidente hasta esfuerzos mínimos. El pulso cardíaco es rápido, el nivel de conciencia empieza a disminuir, la coordinación motora se deteriora progresivamente, y en esta fase la acidosis metabólica es intensa, con hipocapnia, disminución de la reserva alcalina, elevada concentración de ácido láctico, sin gran alteración del anión gap. Claudia Carchipulla Paulina Escobar 31 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Electrocardiográficamente pueden apreciarse en esta fase trastornos isquémicos incluso en personas jóvenes. Si el período de absorción ha sido suficientemente largo, más de 60 minutos, la afección muscular es notable, y aparecen fasiculaciones con una sensación subjetiva de pérdida de fuerza, que en fases más avanzadas de la intoxicación impiden a la víctima huir del lugar de la contaminación. En esta fase el embotamiento psíquico, se hace más intenso y el deseo de dormir es irresistible, pese a la intensa cefalea y sensación de mareo. Los vómitos son frecuentes. Al alcanzar niveles de carboxihemoglobinemia del 30-40 % el nivel de conciencia es muy bajo, y el paciente responde pobremente a los estímulos externos, simulando un cuadro similar al de la embriaguez etílica (embriaguez oxicarbonada). La acidosis metabólica es muy intensa, los trastornos isquémicos cardíacos son una constante incluso en pacientes jóvenes, y la piel empieza a adquirir un color cianótico, efecto del fracaso en la microcirculación, y que contrasta con el rubor anterior. En unos casos incluso llega a causar ampollas similares a las de los quemados en zonas de apoyo. A partir de este momento, el paciente puede entrar en coma, y tras varios episodios convulsivos, como consecuencia de la hipoxia cerebral, se produce la muerte por parada respiratoria. Las tasas medias de carboxihemoglobina encontradas en las intoxicaciones mortales son entre el 50 y el 60 %. Claudia Carchipulla Paulina Escobar 32 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Durante la fase de recuperación es prácticamente constante la aparición de secuelas. En los días siguientes a la intoxicación, el enfermo padece un cuadro neurológico con desorientación, pérdida de memoria, incapacidad de concentración y a veces afectación de los pares craneales y neuritis periféricas. 4.4. Intoxicación crónica. La intoxicación crónica por monóxido de carbono, es un cuadro difícil de valorar y diagnosticar, y que tanto en su evolución, como expresión clínica, puede variar entre muy amplios límites. Los mismos riesgos de exposición hacen desarrollar la enfermedad en unos casos, mientras que en otros parece no tener prácticamente efectos. El cuadro de intoxicación crónica se inicia por trastornos de la personalidad de tipo neurasténico con cefaleas mantenidas y constantes, que al contrario de la intoxicación aguda, no coinciden cronológicamente con las fases de mayor contaminación. Ya en esta fase inicial, el deterioro psíquico del paciente es notable, y sus quejas de pérdida de memoria, falta de capacidad de concentración, pueden valorarse objetivamente mediante el empleo de test psicométricos con escala de deterioro. En la fase siguiente del cuadro se produce un característico trastorno del sueño, clásicamente denominado insomnio pertinaz, ante el cual los antiguos hipnóticos de la familia de los barbitúricos eran inútiles. Sin embargo, los modernos hipnoinductores de tipo benzodiacepínico son más efectivos, y por tanto, el diagnóstico de este signo menos preciso. Claudia Carchipulla Paulina Escobar 33 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Por último, de forma paralela a un mayor deterioro demencial del paciente, aparece un cuadro neurológico de tipo Parkinson. A partir de este momento el Parkinson y el síndrome demencial son irreversibles aunque cese la exposición al tóxico. La alteración, evidenciable por scanner cerebral, de los ganglios básales es el hallazgo más típico en estos enfermos. 4.4.1. Exposición crónica. Se caracteriza por tres síntomas: cansancio, cefaleas y vértigos. La padecen sujetos expuestos en ambientes industriales en los que se genera CO o en el ámbito familiar (personas que por su sedentarismo deben permanecer durante horas frente a una estufa) o en talleres de reparación de motores no convenientemente aireados. En síntesis, en todos aquellos casos en los que se verifique una combustión incompleta, incluyendo el tabaco fumado en distintas formas. 4.4.2. Inhalación a largo plazo. Diversos estudios han mostrado que la Inhalación a largo plazo del monóxido de carbono eleva los lípidos plasmáticos, y por tanto es un factor favorecedor de arteriosclerosis. En nuestra experiencia, para el desarrollo de la forma clínica denominada intoxicación crónica, es necesario que los niveles de carboxihemoglobina sean parte de los superiores al 20% durante la mayor y que el periodo de exposición sea superior a los 10-15 años. Claudia Carchipulla Paulina Escobar 34 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 4.4.3. Producción Endógena de Monóxido de Carbono. El monóxido de carbono se produce en forma endógena por el catabolismo de las cadenas de pirrol, las que se originan en la hemoglobina, mioglobina, citocromos y otros pigmentos que contienen el grupo hem, donde su catabolismo es la principal fuente de producción endógena, además de la peroxidación de lípidos. Existen estimaciones de carboxihemoglobina endógena del orden de 0,1 a 1,0%, con un aumento en casos de anemia hemolítica. El hígado es la principal fuente de monóxido de carbono a consecuencia del aumento de los citocromos inducidos por algunos fármacos; otra fuente es la médula ósea en hemopatías, como anemia sideroblástica con ineficacia de la eritropoyesis. En los neonatos pueden encontrarse concentraciones elevadas de monóxido de carbono, igualmente en mujeres durante la fase progesterónica del ciclo menstrual con un aumento del 100 % del CO de origen metabólico, debido se supone, a una acción inductiva de la progesterona sobre el hepatocito. Dicho porcentaje llega al 200 % en el embarazo de término, atribuyéndose solo un 30 % al feto y el resto a la acción de la hormona citada. Claudia Carchipulla Paulina Escobar 35 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 4.5. Efecto sobre la salud. En intoxicaciones leves o moderadas los síntomas son muy inespecíficos y tan solo la sospecha clínica o el contexto en el que se encuentra el enfermo (incendio, en invierno en casas con estufas de gas, etc.) nos van a hacer buscar la intoxicación por CO. Habitualmente suele confundirse con una intoxicación alimentaria, delirium tremens, intoxicación aguda por etanol o metanol, migraña, ACV, etc. Tabla 4 Efecto Del Monóxido De Carbono En Los Seres Vivos. Condiciones Ambientales Efectos 9 ppm con 8 horas de exposición Norma sobre la calidad del aire ambiente 50 ppm con exposición 6 semanas de Cambios estructurales en el corazón y cerebro de los animales. 50 ppm con 50 min. De exposición Cambios en el umbral de la luminosidad relativa y agudeza visual. 50 ppm con exposición de 8 a 12 Impedimento en el funcionamiento de las horas para los no fumadores pruebas psicomotoras Fuente Tabla 1.4 Efectos sobre la salud del monóxido de carbono y el COHb, pág.45. Wark, K and Warner, C. Contaminación del Aire, Origen y Control. Universidad de Purdue. México 1998. 4.5.1. Efectos sobre el SNC. En intoxicaciones leves se describen fundamentalmente cefalea (secundaria a la vasodilatación refleja a la hipoxia tisular), fotofobia, vértigo, nauseas, irritabilidad. Conforme se va agravando el cuadro llegan a aparecer alteraciones cognitivas, ataxia, convulsiones y disminución del nivel de conciencia, directamente relacionadas con la hipoperfusión y no tanto con los niveles de carboxihemoglobina. Claudia Carchipulla Paulina Escobar 36 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA En intoxicaciones más graves (carboxihemoglobina mayor del 50%) aparecen alteraciones del nivel de conciencia, que pueden acompañarse de convulsiones tónico-clónicas generalizadas, los reflejos osteotendinosos suelen estar aumentados, asociado a rigidez muscular generalizada. En la TAC puede encontrarse edema cerebral difuso como hallazgo muy precoz y en estudios posteriores pueden aparecer lesiones de isquemia cerebral localizadas sobre todo en aquellas zonas de menor aporte sanguíneo como son hipocampo, globo pálido. Estos hallazgos se correlacionan más con el grado de hipotensión que con el de hipoxemia. La historia natural de las alteraciones neurológicas hace que el paciente intoxicado sufra una disminución del nivel de conciencia si el grado de hipoxia es suficiente. Si el paciente no fallece, se recuperará sea tratado o no, pudiendo sufrir un nuevo deterioro tras un intervalo lucido que oscila entre varios días o semanas (sobretodo entre 1-21 días). Es lo que se conoce como "síndrome diferido", que se caracteriza por todo un abanico de alteraciones neurológicas, cognitivas y psiquiátricas más o menos graves como son irritabilidad, cambios del comportamiento, alteraciones de memoria, alteraciones de la marcha, neuropatías, alucinaciones, etc. No se han encontrado indicadores clínicos sobre el riesgo de aparición de dicho síndrome, por lo que hoy se recomienda por todos los autores la Claudia Carchipulla Paulina Escobar 37 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA realización de estudios neuropsiquiátricos sobretodo con test psicométricos tras el tratamiento y pasadas unas 3 semanas de la intoxicación. 4.5.2. Efectos sobre el sistema Cardiovascular. Por efecto tóxico directo sobre el miocardio el CO puede provocar arritmias cardíacas que constituyen la causa más frecuente de muerte precoz en esta intoxicación. Además, la hipoxemia puede desencadenar angor o incluso infarto agudo de miocardio aun en pacientes sanos. En pacientes con antecedentes de cardiopatía isquémica la intoxicación leve puede provocar angina y disminución del umbral de esfuerzo para el desarrollo de cuadro agudo de isquemia miocárdica. Los signos clínicos más frecuentes son hipotensión, taquicardia y depresión de la función miocárdica. Tabla 5 Carboxihemoglobina Nivel de % COHb Efectos < 1.0 No hay efectos aparentes 1.0 a 2.0 Hay evidencia respecto de la conducta 2.0 a 5.0 Efectos sobre el SNC. Efectos en el discernimiento de los intervalos de tiempo, agudeza visual, discernimiento de la luminosidad, y otras funciones psicomotoras > 5.0 Cambios funcionales cardiacos y pulmonares 10.0 a 80.0 Dolores de cabeza, fatiga, somnolencia, coma, fallas respiratorias, muerte. Fuente Tabla 1.4 Efectos sobre la salud del monóxido de carbono y el COHb, pág.45. Wark, K and Warner, C. Contaminación del Aire, Origen y Control. Universidad de Purdue. México 1998. Claudia Carchipulla Paulina Escobar 38 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 4.5.3. Efectos sobre el Pulmón. Respiración superficial, taquipnea y disnea son los hallazgos más usuales, aunque en intoxicaciones leves el examen físico pulmonar suele ser normal excepto en los casos de incendios en los que otros tóxicos suelen estar también implicados. En intoxicaciones graves no es extraño la aparición de edema pulmonar no cardiogénico, así como fallo cardíaco congestivo. Otro efecto de la intoxicación por monóxido de carbono es la hemorragia pulmonar. 4.5.4. Efectos sobre el Riñón. La lesión renal más frecuente es la secundaria a rabdomiólisis y mioglobinuria. El CO, además, por acción directa puede desarrollar necrosis tubular y fallo renal. 4.5.5. Otros. Clásicamente se describía a nivel cutáneo mucoso la piel "rojo cereza" que hoy raramente se ve y aparece en aquellos individuos con niveles de carboxihemoglobina superiores al 40%. Actualmente las alteraciones más frecuentemente vistas son la cianosis y las lesiones ampollosas, que afectan generalmente a las áreas de presión. Claudia Carchipulla Paulina Escobar 39 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Las manifestaciones oftalmológicas más frecuentes son los defectos visuales, ceguera, y hemorragias retinianas. Hallazgos a nivel del sistema audiovestibular son lesiones del laberinto, del octavo par y de los núcleos del troncoencéfalo que se traducen en hipoacusia, ataxia. Además, el hecho de que la frecuencia respiratoria en el niño es mayor que en el adulto hace que la intoxicación por monóxido de carbono en el niño sea más grave que en el adulto aunque ocurra bajo las mismas condiciones. Una especial consideración merece la intoxicación por CO en la mujer embarazada. El monóxido de carbono en la sangre materna atraviesa la placenta hacia el feto por un mecanismo de difusión simple, tardando más tiempo en alcanzar el pico máximo de carboxihemoglobina en el feto y lo mismo ocurre para su eliminación. La hemoglobina fetal tiene aun mayor afinidad por el CO que la hemoglobina materna, por lo que los niveles de carboxihemoglobina pueden ser mayores en el feto que en la madre. 4.6. Metabolismo. El monóxido de carbono carece de características organolépticas, por lo que la víctima no puede percatarse de su presencia en la atmósfera. Su única vía de absorción es la respiratoria, y a través del pulmón tiene una difusibilidad superior a la del oxígeno o el dióxido de carbono. Los factores que regulan la Claudia Carchipulla Paulina Escobar 40 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA velocidad de absorción son la relación superficie pulmonar/masa corporal, el volumen respiratorio/minuto, la perfusión pulmonar, y el gradiente de concentración de CO entre el aire alveolar y la sangre alveolar. Al aumentar cualquiera de estos factores, la velocidad de absorción también aumenta. 4.7. Excreción. La eliminación de monóxido de carbono se produce con rapidez al principio y más lenta al transcurrir el tiempo; cuanto más baja es la concentración inicial de carboxihemoglobina, más lenta será la velocidad de eliminación. La eliminación del monóxido de carbono es regulada por los mismos mecanismos que su absorción. La semivida plasmática de la carboxihemoglobina en condiciones de ventilación normal es de 3-4 horas. Mediante la administración de oxígeno al 100 % se puede reducir a 30-40 minutos, y si se administra en condiciones de hiperbarismo (2.5 atm) a 15-20 minutos. Si bien el monóxido absorbido no es sometido a proceso biotransformativo alguno, algunas sustancias, como el cloruro de metileno puede liberar monóxido en su proceso biotransformativo, y la propia hemoglobina da lugar en su degradación también a monóxido de carbono. Salvo en caso de anemias hemolíticas, este último proceso nunca produce valores superiores al 0.5 % de carboxihemoglobina. Claudia Carchipulla Paulina Escobar 41 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 4.8. Tratamiento. 4.8.1. Primeros auxilios. La primera medida que debe adoptarse ante una intoxicación por monóxido de carbono es separar a la víctima de la fuente de emanación del tóxico. En muchos casos, esta simple medida basta para que se recupere el enfermo. A continuación debe comprobarse la permeabilidad de las vías aéreas, aspecto muy importante pues los vómitos y aspiración de cuerpos extraños es relativamente frecuente, e iniciar la administración de oxigeno al 100 %. Es conveniente recoger una muestra de sangre para poder valorar posteriormente la gravedad de la intoxicación, e iniciar la perfusión lenta de bicarbonato para compensar la intensa acidosis metabólica. Eventualmente, también puede administrarse bolos i.v. de lidocaína (1-2 mg/kg), si se sospecha la existencia de lesión cardíaca isquémica. Para prevenir la asfixia por aspiración de vómitos, es necesario colocar al paciente sobre su costado izquierdo. 4.8.1.1Indicaciones de tratamiento.- Todo paciente con afección del nivel de conciencia o alteraciones isquémicas electrocardiográficas, o con horizontes de carboxihemoglobina superiores al 30 % debe ser sometido a tratamiento y control médico durante la fase de recuperación. En mujeres embarazadas o pacientes con antecedentes graves de patología isquémica cardíaca deben ser sometidos a tratamiento siempre que muestren cifras de carboxihemoglobina superiores al 10 %. Claudia Carchipulla Paulina Escobar 42 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 4.8.2. Tratamiento hospitalario. 4.8.2.1. Administración de oxígeno. Se inicia el tratamiento con oxígeno al 100 %. Dependiendo de la gravedad del cuadro, puede continuarse al 50-60 %, o mantener la misma concentración. En casos graves, o si se dispone de medios para ello, puede administrarse oxígeno al 100 % a 2.5-3 atmósferas de presión. Existen diversos protocolos de tratamiento en hiperbarismo, si bien prácticamente todos se basan en administrar oxígeno al 3 atmósferas hasta descender los niveles de carboxihemoglobina al 30%, y a continuación iniciar la descompresión mantenido la administración de oxígeno. 4.8.2.2. Corrección de la acidosis metabólica.- Este cuadro se caracteriza por una intensísima acidosis metabólica, que debe corregirse parcialmente, pues un pH plasmático ligeramente ácido favorece el desplazamiento a la derecha de la curva de disociación de hemoglobina, y por tanto, la liberación de oxígeno a los tejidos. 4.8.2.3. Otros cuidados.- Como prevención de asfixia por aspiración de vómitos, o de neumonías por aspiración, en los pacientes con alteración de la conciencia debe aspirarse el contenido gástrico. Si se produce rabdomiólisis debe alcalinizarse la orina y mantenerse un elevado volumen de eliminación urinaria durante los días siguientes. Las alteraciones isquémicas cardiacas son muy frecuentes, y por tanto, debe vigilarse la aparición de arritmias mediante monitorización electrocardiográfica. Las lesiones por comprensión de Claudia Carchipulla Paulina Escobar 43 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA troncos nerviosos son frecuentes, y por tanto, deben emplearse colchones antiescaras y tener la precaución de movilizar al enfermo para evitar lesiones por apoyo. Las intoxicaciones por monóxido en casos de incendio suelen tratarse poliintoxicaciones en las que si bien el monóxido es el tóxico más significativo, pueden actuar otros como el HCN, gases irritantes como el fosgeno y cloro gaseoso, vapores nitrosos, etc. Por ello, en estos casos, es necesario el tratamiento de apoyo con broncodilatadores, corticoides, etc. Claudia Carchipulla Paulina Escobar 44 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA CAPITULO V MATERIALES Y METODOS. 5.1. Determinación de monóxido de carbono en sangre por métodos químicos. Los métodos químicos emplean la propiedad del monóxido de carbono de reducir diversas sales metálicas oxidantes. Uno de los elementos metálicos más usados es el paladio II (Pd+2 ), lo cual puede verse en la siguiente reacción: Pd+2 + CO + H2O -------- Pdº + CO2 + 2H+ Este principio constituye la base de diversas metodologías tales como el método de microdifusión. 5.1.1. Método de Microdifusión. Se basa en el poder reductor del monóxido de carbono, el cual al ponerse en contacto con una solución de PdCl2 , reacciona produciendo Pdº. La reacción se realiza en cámaras de Conway que poseen en el compartimento externo la muestra de sangre y el agente liberador (ácido sulfúrico) y en el interno el agente atrapante (PdCl2). En este caso, se produce la captación y oxidación del monóxido de carbono, forzándose la remoción completa del mismo al cabo de un tiempo y temperatura determinados. El exceso de PdCl2 es valorado posteriormente con IK en presencia de goma arábiga. Claudia Carchipulla Paulina Escobar 45 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 5.2. TECNICA. 5.2.1. Reactivos. Solución de cloruro de paladio: disolver 0.222 g de cloruro de paladio en 25 ml. de ácido clorhídrico 0.01N y completar a 250 ml con ácido clorhídrico. Se prepara en el momento. Acido sulfúrico 10% (P/V) Goma arábiga al 0.1% (preparar al momento) Solución de Yoduro de potasio al 15% (P/V) 5.2.2. Equipos. Centrífuga a 5000 rpm. Espectrofotómetro UV visible Cámara de Conway 5.3.3. Procedimiento. En el compartimento interno de la cámara de Conway se colocan 0.5 ml de PdCl2 0.01N y en el externo en sectores separados, 0.25 ml de H2SO4 y 0.25 ml de la muestra (sangre entera). Se cubre con la tapa sellando con cuatro Claudia Carchipulla Paulina Escobar 46 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA gotas de agua, para evitar posibles pérdidas. A continuación, se mezcla la sangre con el ácido sulfúrico mediante un suave movimiento de rotación. Se deja difundir 1 hora a temperatura ambiente. La existencia de monóxido de carbono se evidencia en forma indirecta a través de la aparición de una pátina platina de paladio metálico en el compartimento interno. Con una pipeta capilar se extrae la totalidad de la solución del compartimento interno (Pd º y exceso de cloruro de paladio). Luego se centrifuga con el objeto de separar el precipitado de Pd y se transfiere 0.1 ml del sobrenadante a un matraz de 10 ml. En otro matraz de 10 ml, se coloca 0.1 ml de solución de PdCl2 0.01N (blanco). A cada matraz se agrega 1 ml de solución de goma arábiga al 0.1% y 1 ml de IK al 15 %, se mezcla bien y se lleva a volumen. Se realiza la determinación de la densidad óptica a 500 nm llevando a cero con agua destilada. El exceso de (Pd+2) con el ion ioduro da lugar a la formación del complejo I4Pd =2 . Luego se lee la absorbancia a 500 nm. 5.3.4. Expresión de resultados. A partir de la lectura de absorbancia de la solución blanco, se calcula la concentración de CO en la muestra inicial. mg CO %= DOB- DOX DOB Claudia Carchipulla x 0.053335 X 520 Paulina Escobar 47 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA DOB= Densidad óptica del blanco. DOX= Densidad óptica desconocido. 0.05335= Cantidad de Cloruro de Paladio contenido en 0.1 ml de la solución del reactivo 520= Proviene de multiplicar 20*100*0.26 que son respectiva el factor de la alícuota tomada de la cámara central (0.1 ml / 2 ml); 100 para referir a 100 ml de sangre y 0.26 el factor de conversión de mg Pd++ a mg de CO. Donde DOB y DOX representa la densidad óptica del blanco y la muestra desconocida, respectivamente. El resultado se expresa en ml % considerando el factor de conversión correspondiente, el cual tiene en cuenta el PM CO , el volumen que ocupa un gas en Condiciones Normales de Presión y Temperatura siendo el mismo 0.8 ml/mg. A fin de lograr una adecuada interpretación de los resultados, es conveniente expresar los mismos como % de carboxihemoglobina. Para ello, es necesario conocer el tenor de hemoglobina de la muestra y considerar que 1g de hemoglobina fija 1.34 ml de CO. Por ejemplo, para la muestra # 8 los valores obtenidos son: Hb : 17.70 g/dL DOB: 0.200 Claudia Carchipulla Paulina Escobar 48 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA DOX: 0.154 mg CO % = 0.200-0.154 x 0.05335 x 520= 6.38 0.200 Para expresar en ml CO %, se multiplica por el factor 0.8 que resulta de la relación: 28 mg de CO ocupan 22.4 ml a 0°C y 760 mm de Presión 1 ml de CO ocupa X= 0.8 ml a 0°C y 760 mm de Presión Luego: ml CO % = 6.38 mg CO x 0.8 = 5.106 Para conocer el % de saturación se necesita la concentración de Hb; entonces: 1 g de Hb fija 1.34 ml de CO 17.70 g/dL fijarán x= 23.72 ml de CO Por lo que: 23.72 ml de CO corresponden al 5.106 ml de CO tendrán Claudia Carchipulla Paulina Escobar 100 % de Saturación 21.53 % Saturación 49 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA CAPITULO VI RESULTADOS Y DISCUSIONES Cuadro Nº 1 Parámetros obtenidos en 100 conductores de buses de la Empresa de Transporte “TRANSBAÑOSA” Muestra Hb DOX DOB mg ml ml CO % %CO %CO Fijado Hb Saturación Edad Años Fumador de trabajo # Familiar cigarrillos Fumador 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 16,7 18,7 17 15,1 16,7 20 17,1 17,7 16,4 16,1 17,8 17,4 16,5 16,6 16,2 17,2 17,5 15,4 0,192 0,185 0,184 0,194 0,191 0,157 0,167 0,194 0,188 0,182 0,196 0,19 0,175 0,186 0,199 0,207 0,196 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,24 0,24 0,24 0,24 1,11 2,08 2,22 0,83 1,25 5,97 4,58 0,83 1,67 2,50 0,56 1,39 3,47 1,94 4,74 3,82 5,09 4,63 0,89 1,67 1,78 0,67 1,00 4,77 3,66 0,67 1,33 2,00 0,44 1,11 2,78 1,55 3,79 3,05 4,07 3,70 22,38 25,06 22,78 20,23 22,38 26,80 22,91 23,72 21,98 21,57 23,85 23,32 22,11 22,24 21,71 23,05 23,45 20,64 3,97 6,64 7,80 3,29 4,46 17,81 15,99 2,81 6,06 9,26 1,86 4,76 12,55 6,99 17,47 13,24 17,36 17,93 22 42 27 26 27 40 27 37 22 26 28 49 27 25 25 30 29 27 6 3 3 7 3 12 6 11 5 7 7 12 3 3 5 3 7 7 Si No Si Si No Si Si Si No Si Si No Si Si Si No Si Si 10 0 2 1 0 1 9 7 0 1 6 0 10 4 1 0 3 1 Si No Si Si No No No No Si Si No No Si No No No No No 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 17,8 15,2 15,5 18,3 18 18,1 14,1 14,5 16,8 17,6 17,9 17,4 15,8 17,3 17,4 15,5 17,4 15,6 0,19 0,197 0,199 0,201 0,192 0,196 0,191 0,236 0,202 0,19 0,224 0,201 0,218 0,193 0,207 0,209 0,206 0,211 0,24 0,24 0,24 0,24 0,24 0,24 0,24 0,24 0,24 0,24 0,24 0,24 0,24 0,24 0,24 0,24 0,24 0,225 5,78 4,97 4,74 4,51 5,55 5,09 5,67 0,46 4,39 5,78 1,85 4,51 2,54 5,43 3,82 3,58 3,93 1,73 4,63 3,98 3,79 3,61 4,44 4,07 4,53 0,37 3,52 4,63 1,48 3,61 2,04 4,35 3,05 2,87 3,15 1,38 23,85 20,37 20,77 24,52 24,12 24,25 18,89 19,43 22,51 23,58 23,99 23,32 21,17 23,18 23,32 20,77 23,32 20,90 19,39 19,53 18,26 14,71 18,41 16,78 23,99 1,90 15,61 19,61 6,17 15,47 9,61 18,75 13,09 13,81 13,49 6,61 37 37 27 28 34 27 32 35 28 30 27 28 24 22 24 23 23 27 10 8 9 6 4 3 10 3 7 3 10 10 4 7 8 4 8 5 Si No No Si Si No No No No Si Si Si No Si Si Si Si No 3 0 0 3 3 0 0 0 0 6 2 5 0 1 1 2 5 0 Si No No No No Si No No No Si Si No No No No No No No Claudia Carchipulla Paulina Escobar 50 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Muestra Hb DOX DOB mg ml ml CO % %CO %CO Fijado Hb Saturación Edad Años Fumador de trabajo # Familiar cigarrillos Fumador 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 15,9 18,8 16,9 17,5 16,7 17,7 18,2 14,6 17,7 17,8 16,3 16,7 17,6 17 17,4 16,1 14,8 16 0,201 0,211 0,204 0,178 0,199 0,201 0,192 0,218 0,21 0,216 0,215 0,205 0,203 0,196 0,21 0,198 0,23 0,235 0,225 0,225 0,225 0,225 0,225 0,225 0,225 0,225 0,225 0,225 0,225 0,225 0,225 0,225 0,225 0,225 0,24 0,24 2,96 1,73 2,59 5,80 3,21 2,96 4,07 0,86 1,85 1,11 1,23 2,47 2,71 3,58 1,85 3,33 1,16 0,58 2,37 1,38 2,07 4,64 2,57 2,37 3,26 0,69 1,48 0,89 0,99 1,97 2,17 2,86 1,48 2,66 0,92 0,46 21,31 25,19 22,65 23,45 22,38 23,72 24,39 19,56 23,72 23,85 21,84 22,38 23,58 22,78 23,32 21,57 19,83 21,44 11,11 5,48 9,15 19,78 11,46 9,98 13,35 3,53 6,24 3,72 4,52 8,82 9,20 12,56 6,35 12,35 4,66 2,16 20 32 28 30 25 28 27 29 26 30 31 40 24 28 35 32 23 29 4 6 7 12 6 3 10 7 12 3 10 7 6 7 13 6 3 8 No Si Si Si No No No No Si Si No Si Si Si No Si Si Si 0 1 1 10 0 0 0 0 1 1 0 2 1 4 0 1 5 10 No No No Si Si No Si No No No No No No No No No No No 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 16,2 16,3 16,1 16,4 17,9 17,5 15,3 16,2 15,6 14,9 15,5 15,3 16,4 16,5 14,8 17,1 16,7 14,6 16,3 16,2 15,2 16,6 14,9 16,3 17,2 15,9 15,3 0,233 0,212 0,162 0,237 0,235 0,232 0,233 0,218 0,197 0,156 0,133 0,173 0,156 0,133 0,173 0,169 0,186 0,187 0,18 0,196 0,188 0,192 0,181 0,185 0,156 0,199 0,172 0,24 0,24 0,24 0,24 0,24 0,24 0,24 0,24 0,202 0,202 0,202 0,202 0,202 0,202 0,202 0,202 0,202 0,202 0,202 0,202 0,202 0,202 0,202 0,202 0,202 0,202 0,202 0,81 3,24 9,02 0,35 0,58 0,92 0,81 2,54 0,69 6,32 9,48 3,98 6,32 9,48 3,98 4,53 2,20 2,06 3,02 0,82 1,92 1,37 2,88 2,34 6,32 0,41 4,12 0,65 2,59 7,22 0,28 0,46 0,74 0,65 2,04 0,55 5,06 7,58 3,19 5,06 7,58 3,19 3,63 1,76 1,65 2,42 0,66 1,54 1,10 2,31 1,87 5,06 0,33 3,30 21,71 21,84 21,57 21,98 23,99 23,45 20,50 21,71 20,90 19,97 20,77 20,50 21,98 22,11 19,83 22,91 22,38 19,56 21,84 21,71 20,37 22,24 19,97 21,84 23,05 21,31 20,50 2,98 11,86 33,44 1,26 1,93 3,16 3,16 9,37 2,63 25,32 36,51 15,55 23,00 34,30 16,07 15,83 7,86 8,43 11,07 3,04 7,55 4,94 11,56 8,55 21,93 1,55 16,08 36 28 29 28 29 39 54 35 25 36 34 32 40 30 29 32 27 30 24 29 27 29 23 27 55 24 21 22 10 3 3 6 12 5 6 4 16 10 8 9 10 9 8 7 4 3 3 4 4 3 6 25 3 7 Si Si Si Si Si No Si Si No No Si No No Si Si No Si Si Si Si Si Si No Si Si Si Si 10 1 1 1 1 0 1 1 0 0 2 0 0 4 1 0 1 1 1 1 1 2 0 1 3 1 1 No No No No No No No No No No Si No No No No No Si No No No No Si Si No No No No Claudia Carchipulla Paulina Escobar 51 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Muestra 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 Hb 14,9 16,2 15,7 15,2 16,5 17,3 17,2 16,6 14,9 17,2 16,4 16,3 15,3 16,9 17,6 15,8 15,3 16,1 14,8 DOX 0,17 0,188 0,174 0,163 0,185 0,178 0,187 0,176 0,162 0,221 0,214 0,205 0,199 0,207 0,205 0,233 0,198 0,171 0,224 DOB 0,202 0,202 0,202 0,202 0,202 0,202 0,202 0,202 0,202 0,255 0,255 0,255 0,255 0,255 0,255 0,255 0,255 0,255 0,255 mg ml ml CO % %CO %CO Fijado Hb Saturación 4,40 1,92 3,85 5,36 2,34 3,30 2,06 3,57 5,50 3,70 4,46 5,44 6,09 5,22 5,44 2,39 6,20 9,14 3,37 3,52 1,54 3,08 4,29 1,87 2,64 1,65 2,86 4,40 2,96 3,57 4,35 4,88 4,18 4,35 1,92 4,96 7,31 2,70 19,97 21,71 21,04 20,37 22,11 23,18 23,05 22,24 19,97 23,05 21,98 21,84 20,50 22,65 23,58 21,17 20,50 21,57 19,83 17,61 7,09 14,63 21,04 8,45 11,38 7,15 12,85 22,02 12,84 16,24 19,93 23,78 18,45 18,46 9,05 24,20 33,90 13,61 Edad Años Fumador de trabajo 26 22 24 41 43 22 27 29 25 38 50 32 26 40 29 39 32 28 26 4 3 3 5 10 4 3 3 4 6 10 13 12 5 4 5 4 10 7 Si Si No No No Si No Si No Si Si Si Si No Si Si No No No # Familiar cigarrillos Fumador 1 1 0 0 0 1 0 1 0 10 1 1 2 0 1 1 0 0 0 No No No No No No No No No No No No No Si No No No Si Si Fuente: Formularios de recolección de datos Elaborado por: Claudia Carchipulla y Paulina Escobar Claudia Carchipulla Paulina Escobar 52 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Cuadro Nº 2 Distribución de la concentración de Hemoglobina en 100 conductores de buses de la Empresa de Transporte “TRANSBAÑOSA” g/dL 14 - 14,9 15 - 15,9 16 - 16,9 17 - 17,9 18 - 18,9 19 - 20 Total HEMOGLOBINA FRECUENCIA 11 21 32 29 6 1 100 Porcentaje 11% 21% 32% 29% 6% 1% 100% Fuente: Formularios de recolección de datos Elaborado por: Claudia Carchipulla y Paulina Escobar Hemoglobina: El valor máximo es 20 g/dL, el promedio es 16.5 g/dL y el mínimo 14g/dl. Se ha observado que dentro de los valores normales se encuentra el 64%, con valores superiores al normal tenemos un 7% y valores inferiores al normal no se establecen. Claudia Carchipulla Paulina Escobar 53 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Cuadro Nº 3 Distribución del porcentaje de Saturación de Monóxido de Carbono en 100 conductores de buses de la Empresa de Transporte “TRANSBAÑOSA” % de Saturación de hemoglobina con CO % FRECUENCIA Porcentaje 0 a 10 41 41% 11a 20 43 43% 21a 30 11 11% 31a 40 5 5% Total 100 100% Fuente: Formularios de recolección de datos Elaborado por: Claudia Carchipulla y Paulina Escobar % de Saturación de hemoglobina con CO: El valor máximo es 36.51%, el promedio es 12.41% y el mínimo 1.26%. Se ha observado que dentro de los valores normales se encuentra el 41 %; con valores superiores al normal tenemos un 16% lo que sugiere el desarrollo de una intoxicación crónica. Claudia Carchipulla Paulina Escobar 54 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Cuadro Nº 4 Distribución de los años de trabajo en 100 conductores de buses de la Empresa de Transporte “TRANSBAÑOSA” Años 3 a 5 6 a 10 11 a 25 Total Años de trabajo Frecuencia 42 46 12 100 Porcentaje 42% 46% 12% 100% Fuente: Formularios de recolección de datos Elaborado por: Claudia Carchipulla y Paulina Escobar Tiempo de trabajo: Un 42% de los conductores trabaja de 3 a 5 años, mientras que un 46% trabaja de 6 a 10 años y por último un 12% trabaja entre 11 a 25 años. Claudia Carchipulla Paulina Escobar 55 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Cuadro Nº 5 Distribución según edad en 100 conductores de buses de la Empresa de Transporte “TRANSBAÑOSA” Años 20 - 25 26 - 30 31 - 35 36 - 40 41 - 45 46 - 50 51 - 55 Total EDAD Frecuencia 22 46 13 12 3 2 2 100 Porcentaje 22% 46% 13% 12% 3% 2% 2% 100% Fuente: Formularios de recolección de datos Elaborado por: Claudia Carchipulla y Paulina Escobar Cuadro Nº 6 Distribución del número de pacientes fumadores y no fumadores en 100 conductores de buses de la Empresa de Transporte “TRANSBAÑOSA” Conductores Fumadores y no Fumadores Fumador Frecuencia Porcentaje Si 36 36% No 64 64% Total 100 100% Fuente: Formularios de recolección de datos Elaborado por: Claudia Carchipulla y Paulina Escobar Pacientes Fumadores y No Fumadores: el 36 % del grupo en estudio corresponden al conjunto de los fumadores y un 64 % de ellos no poseen este hábito. Lo cual permite atribuir que los datos obtenidos en relación al % de Saturación de Hb con CO no estén vinculados al hecho de consumir cigarrillos. Claudia Carchipulla Paulina Escobar 56 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Cuadro Nº 7 Distribución del consumo de cigarrillos semanales en los conductores fumadores de la Empresa de Transporte “TRANSBAÑOSA” Cigarrillos consumidos # cigarrillos Frecuencia Porcentaje 1a3 46 71.88% 4a6 10 15.62% 7 a 10 8 12.5% Total 64 100% Fuente: Formularios de recolección de datos Elaborado por: Claudia Carchipulla y Paulina Escobar Consumo de cigarrillos semanales: El 71.88 % de los conductores consumen entre 1 y 3 cigarrillos semanales, el 15.62% consumen lo hacen entre 4 y 6 cigarrillos, y un 12.5 % entre 7 y 10 semanales. En general todo el grupo de fumadores incrementan la disposición a tener niveles elevados de Monóxido de Carbono a diferencia de aquellos que no consumen cigarrillos. Claudia Carchipulla Paulina Escobar 57 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Cuadro Nº 8 Distribución del número de pacientes que realizan recreación en 100 conductores de buses de la Empresa de Transporte “TRANSBAÑOSA” Conductores que realizan recreación Recreación Frecuencia Porcentaje Si 15 15% No 85 85% Total 100 100% Fuente: Formularios de recolección de datos Elaborado por: Claudia Carchipulla y Paulina Escobar Recreación: Un 85% el grupo analizado, no practica ninguna clase de actividad deportiva lo cual favorece en la mayoría de los casos a que sus valores de Saturación estén elevados; el 15 % restante que si esta dedicado a esta actividad beneficia a su estado de salud. Claudia Carchipulla Paulina Escobar 58 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Cuadro Nº 9 Distribución del número de pacientes que son fumadores pasivos en 100 conductores de buses de la Empresa de Transporte “TRANSBAÑOSA” Conductores con familiares fumadores Familiar Frecuencia Porcentaje Si 20 20% No 80 80% Total 100 100% Fuente: Formularios de recolección de datos Elaborado por: Claudia Carchipulla y Paulina Escobar Pacientes Fumadores Pasivos: un 20 % de los pacientes poseen miembros de su familia que son fumadores. El 80 % del resto de pacientes no tienen relación con familiares fumadores. Claudia Carchipulla Paulina Escobar 59 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Cuadro Nº 10 Cuadro comparativo entre niveles de Hb y Promedio de Años de trabajo en 100 conductores de buses de la Empresa de Transporte “TRANSBAÑOSA” Cuadro comparativo entre niveles de Hb y Años de trabajo Hb g/dL Años de Trabajo 14 - 14,9 6 15 - 15,9 6 16 - 16,9 7 17 - 17,9 8 18 - 18,9 5 19 – 20 12 Fuente: Formularios de recolección de datos Elaborado por: Claudia Carchipulla y Paulina Escobar Hemoglobina y Años de Trabajo: Según este cuadro, se puede observar la incidencia directa de los años de trabajo frente a la los niveles de Hb. Los cuales en conductores con 12 años de trabajo expresa un aumento exagerado de Hb, como necesidad compensatoria del organismo de captar oxigeno para la respiración, y evitar la asfixia; por otro lado los conductores con 6 años de trabajo manifiestan valores de Hb, aun dentro de lo establecido como normal, sin embargo conforme los años aumentan existen también un aumento proporcional de glóbulos rojos reflejado como un incremento de Hemoglobina. Claudia Carchipulla Paulina Escobar 60 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Cuadro Nº 11 Cuadro comparativo entre niveles de Hb y Promedio del % de Saturación de Carboxihemoglobina en 100 conductores de buses de la Empresa de Transporte “TRANSBAÑOSA” Comparación entre niveles de Hb y % de Saturación Hb g/dL % Saturación 14 - 14,9 13,52 15 - 15,9 13,79 16 - 16,9 11,92 17 - 17,9 11,39 18 - 18,9 12,56 19 – 20 17,81 Fuente: Formularios de recolección de datos Elaborado por: Claudia Carchipulla y Paulina Escobar Los conductores con niveles de Hb, de entre 19 – 20 g/dl, presentan porcentajes de saturación mayores al máximo permitido, valores que generalmente ya se asocia n con síntomas de intoxicación como dolor de cabeza, mareo, nausea, confusión, debilidad, etc. El resto de conductotes representan un grupo que pese a tener Hb, normales los valores de saturación están también alterados ya que sobrepasan todos al máximo permitido del 10% de Saturación aunque esta resulte asintomático. Sin embargo podemos notar un Carboxihemoglobina de algunos aumento conductores en la Saturación que presentan de valores normales de Hb, esto se podría explicarse en rasgos generales a situaciones como por ejemplo que el CO, es un gas de fácil expulsión del organismo, la práctica de ejercicio, situaciones de sedentarismo, hábitos de fumar etc., que hacen que se produzca una aumento momentáneo de Saturación de Hb con CO, pero sin condicionar un aumento de Hb. Claudia Carchipulla Paulina Escobar 61 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA CAPITULO VII ANÁLISIS ESTADÍSTICO 7.1.Casuística Esta investigación se llevó a cabo con la participación de cien conductores de buses de la Empresa de Transporte “TRANSBAÑOSA” de la ciudad de Cuenca, considerando principalmente aquellos que lleven mayor tiempo trabajando en este oficio. Se realizaron las pruebas a pacientes con edades comprendidas entre 20 y 60 años; y que asimismo tenga un mínimo tiempo de exposición de tres años. Se efectuaron las siguientes determinaciones: Hemoglobina, Determinación de Monóxido de Carbono por el Método de Microdifusión, Determinación del % de saturación de la Hemoglobina con Monóxido de Carbono. Además se realizo una encuesta para determinar datos que se encuentran en el Anexo 1. 7.1.1. Hipótesis. Existe incremento del porcentaje de saturación de Hemoglobina con el monóxido de carbono en los conductores de autobús. Claudia Carchipulla Paulina Escobar 62 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 7.1.2. VARIABLES Dependientes: Parámetro Indicador CO % CO Hb g% Habito de fumar # / semana Independientes: Tiempo para el análisis Menor a 2 horas de muestra recolectada 7.2. Lugar para el muestreo Oficinas de la estación de la empresa Kilómetros recorridos/día Km. Tipo de combustible Clase Tiempo de exposición Horas Edad Años. Lugar de Residencia Urbano/Rural. Recreación Frecuencia Tabulación de datos. Nuestra investigación posee como objetivo comparar el porcentaje de saturación de la Hemoglobina con el monóxido de Carbono, cuyos resultados se pueden observar en la tabla del cuadro # 1, se llevó a cabo una prueba F con el fin de comparar las varianzas de las muestras agrupándolas de dos en dos, y comparando el porcentaje de saturación, de monóxido de Carbono con los años de trabajo, Edades, Recreación, Pacientes Fumadores y No Fumadores, Niveles de Hb; de esta forma podemos verificar si existe o no diferencia significativa. Claudia Carchipulla Paulina Escobar 63 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA AÑOS DE TRABAJO La prueba para determinar el porcentaje de saturación entre los conductores de buses que han trabajado entre 3 y 6 años y los que han trabajado mas de 6 años, reflejo los valores de varianza de 43,95 y 73,77 respectivamente, con un nivel de significación α= 5%. Se realizó la prueba F a fin de determinar si las diferencias son ocasionales, mediante comparación de varianzas Prueba F para varianzas de dos muestras De 3 a 6 años Mas de 6 años Media 10,75190104 14,2901254 Varianza 43,95185425 73,77505164 Observaciones 53 47 Grados de libertad 52 46 F 0,595754978 (F<=f) una cola 0,035498307 Valor crítico para F (una cola) 0,624083896 Hipótesis nula: Ho: σ Conductores con más de 6 años ≥ Conductores de 3 a 6 años S1≥ S2 F PRUEBA= S Más de 6 años S de 3 a 6 años F PRUEBA ≥ F CRÍTICO = 73,7750 43,9518 ⇒ = 1,6785 F CRÍTICO =0,6240 1,6785 ≥ 0,6240 Se acepta la hipótesis, por lo tanto, existe diferencia SIGNIFICATIVA, es decir, las diferencias no son Ocasionales. Claudia Carchipulla Paulina Escobar 64 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA El análisis nos hace concluir que los conductores de buses con más de seis años de trabajo no es similar en comparación a los que tienen entre 3 y 6 años de trabajo, por lo tanto, afirmamos que el % de Saturación de Hb con CO es mayor en los primeros en relación a los que tienen un tiempo de trabajo menor a seis años. CONDUCTORES FUMADORES Y NO FUMADORES La prueba para determinar el porcentaje de saturación entre los conductores de buses que son fumadores y no fumadores, reflejo los valores de varianza de 61,3407 y 60,1933 respectivamente, con un nivel de significación α= 5%. Se realizó la prueba F a fin de determinar si las diferencias son ocasionales, mediante comparación de varianzas Prueba F para varianzas de dos muestras SI NO Media 12,08147032 13,00757079 Varianza 61,34079674 60,19334702 Observaciones 64 36 Grados de libertad 63 35 F 1,019062733 P(F<=f) una cola 0,486254752 Valor crítico para F (una cola) 1,67574533 Claudia Carchipulla Paulina Escobar 65 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Hipótesis nula: Ho: σ Conductores Fumadores ≥ Conductores No Fumadores S1≥ S2 F PRUEBA= S Conductores Fumadores S Conductores No Fumadores F PRUEBA ≥ F CRÍTICO ⇒ = 61,3407= 1,0190 60,1933 F CRÍTICO =1,6757 1,0190 ≥ 1,6757 Se RECHAZA la hipótesis, por lo tanto, existe diferencia OCASIONAL El análisis nos hace concluir que el grupo de conductores fumadores poseen valores similares al grupo de no fumadores en relación al % de Saturación de Hb con CO. CONDUCTORES QUE REALIZAN RECREACION La prueba para determinar el porcentaje de saturación entre los conductores que realizan recreación y los que no la practican, reflejó los valores de varianza de 60,1396 y 66,7013 respectivamente, con un nivel de significación α= 5%. Se realizó la prueba F a fin de determinar si las diferencias son ocasionales, mediante comparación de varianzas Prueba F para varianzas de dos muestras Con Recreación Sin Recreación Media 12,31683187 12,97039597 Varianza 60,13967324 66,70137219 Observaciones 85 15 Grados de libertad 84 14 F 0,901625728 P(F<=f) una cola 0,362209566 Valor crítico para F (una cola) 0,552090562 Claudia Carchipulla Paulina Escobar 66 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Hipótesis nula: Ho: σ Conductores Sin Recreación ≥ Conductores Con Recreación S1≥ S2 F PRUEBA= S Conductores Sin Recreación = 66,7013 S Conductores Con Recreación 60,1396 = 1,1091 F CRÍTICO =0,5520 F PRUEBA ≥ F CRÍTICO ⇒ 1,1091 ≥ 0,5520 Se acepta la hipótesis, por lo tanto, existe diferencia SIGNIFICATIVA, es decir, las diferencias no son Ocasionales. El análisis nos hace concluir que los conductores de buses que realizan recreación no es equivalente en comparación a los que no practican recreación, así que, tanto, afirmamos que el % de Saturación de Hb con CO es mayor en los primeros en relación al segundo grupo. EDAD DE LOS CONDUCTORES La prueba para determinar el porcentaje de saturación entre las edades de los conductores comprendidas entre 20 a 30 años y entre 31 a 55 años expresó los valores de varianza de 54,0617 y 73,7364 respectivamente, con un nivel de significación α= 5%. Se realizó la prueba F a fin de determinar si las diferencias son ocasionales, mediante comparación de varianzas Claudia Carchipulla Paulina Escobar 67 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Prueba F para varianzas de dos muestras 20 a 30 Años 11,78977363 54,06170148 68 67 0,733174262 0,144535254 0,616375411 Media Varianza Observaciones Grados de libertad F P(F<=f) una cola Valor crítico para F (una cola) 31 a 55 Años 13,74318882 73,73649662 32 31 Hipótesis nula: Ho: ( Conductores de 31 a 55 años ≥ Conductores de 20 a 30 años. S1≥ S2 F PRUEBA= S Conductores de 31 a 55 años = 73,7364 = 1,3639 S Conductores de 20 a 30 años 54,0617 ⇒ F PRUEBA ≥ F CRÍTICO F CRÍTICO= 0,6163 1,3639 ≥ 0,6163 Se acepta la hipótesis, por lo tanto, existe diferencia SIGNIFICATIVA, es decir, las diferencias no son Ocasionales. El análisis nos hace concluir que los conductores de buses con edades comprendidas entre 31 a 55 años de edad poseen niveles de Carboxihemoglobina superiores al grupo con edades entre 20 a 30 años. Claudia Carchipulla Paulina Escobar 68 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA CONCLUSIONES Al finalizar este estudio hemos estudiada; presentan en un 69% encontrado que valores de de la población Carboxihemoglobina incrementados hasta un máximo de 36,51% de Saturación de Hemoglobina con CO lo que nos lleva a deducir que existe una incremento en los valores de Saturación con CO. El incremento de este porcentaje de saturación se ve condicionado por el hábito de fumar, que en algunos casos va desde el consumo de 1 a 10 cigarrillos semanales, que influye directamente en la elevación de los niveles de Carboxihemoglobina. A demás, la falta de actividad recreacional por parte de los conductores de bus, no favorece la eliminación del CO del organismo, haciendo que este nivel se mantenga y genere a la vez en algunos casos patologías propias de la intoxicación. La Hemoglobina de la mayoría de los conductores de buses en un 64% se encuentra en valores normales y un 36% de ellos sugieren una polihemoglobulinemia. Los conductores de buses con más de seis años de trabajo tienen valores mayores de saturación de Hb con Monóxido de Carbono en relación a los que han trabajado menos años. El análisis nos hace concluir que el grupo de conductores fumadores poseen valores similares al grupo de no fumadores en relación al % de Saturación de Hb con CO. Claudia Carchipulla Paulina Escobar 69 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Los conductores de buses con edades comprendidas entre 31 a 55 años de edad poseen niveles de Carboxihemoglobina superiores al grupo con edades entre 20 a 30 años, lo que se relaciona directamente con el tiempo de exposición al toxico. A mayor concentración de COHb, la cantidad de Hb total aumenta. Esto parece ser un intento compensatorio de la médula ósea además necesidad del organismo de aumentar glóbulos rojos para de la solventar el transporte de oxígeno. Claudia Carchipulla Paulina Escobar 70 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA RECOMENDACIONES: Ciertos factores como la zona donde habitan, el ser fumadores pasivos, y otros no inciden de manera directa en esta investigación, o no tienen influencia directa en la elevación de los niveles de Carboxihemoglobina, por lo que sugerimos a los estudiantes que continúen con las investigaciones; solo de esta forma lograremos mejorar las condiciones de vida de la población. Los autobuses son la mejor opción para una ciudad como Cuenca, para transportar a la mayoría de habitantes de la urbe que utiliza este sistema , es difícil negarse a esa realidad por lo cual es necesario implementar medidas más estrictas de control ambiental para disminuir la contaminación, y por tanto la intoxicación que afecta tanto conductores como usuarios del servicio. Cambio en la calidad de los combustibles, por uno de mayor octanaje. Mejorar mecanismos de fiscalización. (Inspecciones frecuentes del estado vehicular y control de emanación de gases). Crear un plan de transporte urbano que contenga como meta: o Modernización del parque vehicular. o Restricción vehicular durante episodios críticos (horas en las que el tráfico abunda). Sugerimos que debería realizarse un estudio complementario excluyendo al grupo de los fumadores para detectar de manera más puntual si la intoxicación por CO, se le puede atribuir a la emanación de gases emitidos por los autobuses. Claudia Carchipulla Paulina Escobar 71 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA ANEXOS Claudia Carchipulla Paulina Escobar 72 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA ANEXO 1: Formulario de recolección de datos. Claudia Carchipulla Paulina Escobar 73 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA UNIVERSIDAD DE CUENCA. FACULTAD DE CIENCIAS QUIMICAS. ESCUELA DE BIOQUIMICA Y FARMACIA. Nombre:…………………………… Edad:…………………… Ocupación:………………………… Sexo:……….…………… Fecha / hora de la toma de la muestra:………..……………..……..……………. Zona de la ciudad donde habita:…………………………...……………………… Tipo de vehículo:………………...…Año de vehículo….…………………………... Tipo de combustible que utiliza su vehículo:………… ……...………………… Kilómetros recorridos al día:……………………………………..…………………. Fuma SI NO Cantidad de cigarrillos que consume a la semana:…………………………..…. Hora de consumo del último cigarrillo antes de la toma de la muestra:……… Existen fumadores en su familia:………………………………………………….. Realiza algún tipo de actividad recreacional:……………………………….…... Con que frecuencia:…………………………………………………………………... FIRMA:…………………………………… Claudia Carchipulla Paulina Escobar 74 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA ANEXO 2: Gráficos. Claudia Carchipulla Paulina Escobar 75 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA GRAFICO 1 Distribución de la concentración de Hem oglobina en 100 conductores de buses de la Em presa de Transporte “TRANSBAÑOSA” Porcentaje de conductores % 35% 30% 25% 20% 15% 10% 5% 0% 14 - 14,9 15 - 15,9 16 - 16,9 17 - 17,9 18 - 18,9 19 - 20 Hb Concentración g/dL Fuente: Cuadro Nº 2 Elaborado por: Claudia Carchipulla y Paulina Escobar GRAFICO 2 Distribución del porcentaje de Saturación de Monóxido de Carbono en 100 conductores de buses de la Empresa de Transporte “TRANSBAÑOSA” Porcentaje de conductores % 45% 40% 35% 30% 25% 20% 15% 10% 5% 0% 0 a 10 11a 20 21a 30 31a 40 % de Saturación de Hb con CO Fuente: Cuadro Nº 3 Elaborado por: Claudia Carchipulla y Paulina Escobar Claudia Carchipulla Paulina Escobar 76 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA GRAFICO 3 Distribución de los años de trabajo en 100 conductores de buses de la Empresa de Transporte “TRANSBAÑOSA” 50% Porcentaje de conductores % 45% 40% 35% 30% 25% 20% 15% 10% 5% 0% 3 a 5 6 a 10 11 a 25 Años de trabajo Fuente: Cuadro Nº 4 Elaborado por: Claudia Carchipulla y Paulina Escobar GRAFICO 4 Distribución según edad en 100 conductores de buses de la Empresa de Transporte “TRANSBAÑOSA” 50% 40% 35% 30% % Porcentaje de conductores 45% 25% 20% 15% 10% 5% 0% 20 - 25 26 - 30 31- 35 36 - 40 41- 45 46 - 50 51- 55 Edad-Años Fuente: Cuadro Nº 5 Elaborado por: Claudia Carchipulla y Paulina Escobar Claudia Carchipulla Paulina Escobar 77 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA GRAFICO 5 Distribución del número de pacientes fumadores y no fumadores en 100 conductores de buses de la Empresa de Transporte “TRANSBAÑOSA” Porcentaje de conductores % 70% 60% 50% 40% 30% 20% 10% 0% Si Fumador No Fumador Fuente: Cuadro Nº 6 Elaborado por: Claudia Carchipulla y Paulina Escobar GRAFICO 6 Distribución del consumo de cigarrillos semanales en los conductores fumadores de la Empresa de Transporte “TRANSBAÑOSA” 50 Frecuenciade conductores consumidoresde cigarrillos 45 40 35 30 25 20 15 10 5 0 1 a 3 4 a 6 # Cigarrillos-Semana 7 a 10 Fuente: Cuadro Nº 7 Elaborado por: Claudia Carchipulla y Paulina Escobar Claudia Carchipulla Paulina Escobar 78 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA GRAFICO 7 Distribución del núm ero de pacientes que realizan recreación en 100 conductores de buses de la Em presa de Transporte “TRANSBAÑOSA” Porcentaje de conductores % 90% 80% 70% 60% 50% 40% 30% 20% 10% 0% Si No Recreación Fuente: Cuadro Nº 8 Elaborado por: Claudia Carchipulla y Paulina Escobar GRAFICO 8 Distribución del número de pacientes que son fumadores pasivos en 100 conductores de buses de la Empresa de Transporte “TRANSBAÑOSA” 70% 60% 50% % Porcentaje de conductores 80% 40% 30% 20% 10% 0% Si No Fumador Pasivo Fuente: Cuadro Nº 9 Elaborado por: Claudia Carchipulla y Paulina Escobar Claudia Carchipulla Paulina Escobar 79 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA GRAFICO 9 Cuadro comparativo entre niveles de Hb y Años de trabajo en 100 conductores de buses de la Empresa de Transporte “TRANSBAÑOSA” 12 Promedio Años deTrabajo 10 8 6 4 2 0 14 - 14,9 15 - 15,9 16 - 16,9 17 - 17,9 18 - 18,9 19 - 20 Concentración de Hb g/dL Fuente: Cuadro Nº 10 Elaborado por: Claudia Carchipulla y Paulina Escobar GRAFICO 10 Cuadro Com parativo entre niveles de Hby el % de Saturación de Carboxihem oglobina en 100 conductores de buses de la Em presa de Transporte “TRANSBAÑOSA” 20 18 16 14 12 10 8 6 4 2 0 14 - 14,9 15 - 15,9 16 - 16,9 17 - 17,9 18 - 18,9 19 - 20 Concentración Hb g/dL Fuente: Cuadro Nº 11 Elaborado por: Claudia Carchipulla y Paulina Escobar Claudia Carchipulla Paulina Escobar 80 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA GRAFICO 11 Relación entre Hb y % de Saturación con CO en 100 conductores de buses de la Empresa de Transporte “TRANSBAÑOSA” Cuenca 2006 40 35 30 25 20 15 10 5 0 1 6 11 16 21 26 31 36 41 46 51 56 61 # de Pacientes 66 71 76 81 86 91 96 Hb( g/ dL) %Sat uración Fuente: Cuadro Nº 1 Elaborado por: Claudia Carchipulla y Paulina Escobar Claudia Carchipulla Paulina Escobar 81 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Bibliografía: CAPO, Miguel. Principios de Ecotoxicología. Mc-GRAW- HILL/INTERAMERICANA DE ESPAÑA. Madrid-España . 1ª Edición. 2002. FABRE, Rene y TRHUHAUT, R. Tratado de Toxicología. Héroes S.A. Madrid, 1989. FREJAVILLE, Christoforov y BISMUTH, C. Toxicología Clínica Analítica. Editorial JIMS, Barcelona 4ta Edición.1984. HENRY, Glynn y HEINKE, G. Ingeniería Ambiental, PRENTICE-HALL EDICIONES, México. 2da Edición. 2000. Iovine, Enrique y Selva, Alejandro. EL LABORATORIO EN LA CLINICA. Editorial Médica Panamericana. Argentina. 2ª Edición. 1979. Ladrón de Guevara, J. y Moya, V. Toxicología Médica Clínica y Laboral. Mc-GRAW-HILL/INTERAMERICANA DE ESPAÑA. Madrid-España . 1ª Edición.1995. MERFZ, Edwin. BIOQUIMICA. Publimex S.A. México. 1996. MIHELCIC, James, Fundamentos de Ingeniería Ambiental, ELIMUSA EDICIONES, 2da Edición. México.2001. PLUNKETT, E. Manual de Toxicología Industrial. Ediciones Urno.S.A. Bilbao-España. 2ª Edición.1984. Organización Panamericana de la Salud. Monóxido de Carbono, Criterios de Salud Ambiental 13. Publicación Científica Número 455. 1980. SALVAT, Juan. Salud y Medio Ambiente. Salvat S.A. Ediciones. en colaboración con ala OMS. España. Ultima Edición 1982. Claudia Carchipulla Paulina Escobar 82 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA http://www.lahora.com.ec/noticiacompleta.asp?noid=358725 http://www.edufuturo.com/educacion.php?c=1313 http://www.encolombia.com/medicina/neumologia/neumo13101contenido.htm http://www.hazmat.cl/HTML/Centro_Doc_Monoxido.htm http://tratado.uninet.edu/intoxicacionproductos industriales.html www.nsc.org/ehc/indoor/carb_mon.htm Claudia Carchipulla Paulina Escobar 83 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Claudia Carchipulla Paulina Escobar 84