Control de la documentación del sistema de calidad
Anuncio

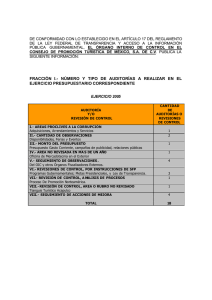
EL PRESENTE DOCUMENTO SE DISTRIBUYE COMO COPIA NO CONTROLADA Y TIENE UNA VIGENCIA DE 2 AÑOS CONTADO A PARTIR DE LA FECHA DE SU APROBACIÓN EL EQUIPO DE GESTIÓN DE LA CALIDAD DEL CENTRO NACIONAL DE SALUD PUBLICA PROCESA LAS PROPUESTAS DE MODIFICACIÓN Y ACTUALIZA LAS EDICIONES VIGENTES DEL PROCEDIMIENTO ELABORADO POR: Centro Nacional de Salud Pública REVISADO POR: Centro Nacional de Salud Pública APROBADO CON: RD 012-2005-DG-CNSP/INS PRA-CNSP-016 REVISIÓN POR LA DIRECCIÓN Edición Nº 01 Página 1 de 8 REVISIÓN POR LA DIRECCIÓN FECHA:2005-12-27 PROCEDIMIENTO EL PRESENTE DOCUMENTO SE DISTRIBUYE COMO COPIA NO CONTROLADA Y TIENE UNA VIGENCIA DE 2 AÑOS CONTADO A PARTIR DE LA FECHA DE SU APROBACIÓN EL EQUIPO DE GESTIÓN DE LA CALIDAD DEL CENTRO NACIONAL DE SALUD PUBLICA PROCESA LAS PROPUESTAS DE MODIFICACIÓN Y ACTUALIZA LAS EDICIONES VIGENTES DEL REVISIÓN POR LA DIRECCIÓN PRA-CNSP-016 Edición Nº 01 Página 2 de 8 INDICE Pág. CARÁTULA 1 INDICE 2 1. OBJETIVO 3 2. ALCANCE 3 3. REFERENCIAS 3 4. DEFINICIONES Y SIGLAS 3 5. RESPONSABILIDADES 4 6. ASPECTOS GENERALES 4 7. DESARROLLO DEL PROCESO 4 7.1. PROGRAMACIÓN DE LA REVISIÓN 4 7.2. ELEMENTOS DE LA REVISIÓN 4 7.3. METODOLOGÍA DE LA REVISIÓN 5 7.4. TRATAMIENTO 5 8. REGISTROS 5 9. ANEXOS 6 PROCEDIMIENTO EL PRESENTE DOCUMENTO SE DISTRIBUYE COMO COPIA NO CONTROLADA Y TIENE UNA VIGENCIA DE 2 AÑOS CONTADO A PARTIR DE LA FECHA DE SU APROBACIÓN EL EQUIPO DE GESTIÓN DE LA CALIDAD DEL CENTRO NACIONAL DE SALUD PUBLICA PROCESA LAS PROPUESTAS DE MODIFICACIÓN Y ACTUALIZA LAS EDICIONES VIGENTES DEL REVISIÓN POR LA DIRECCIÓN 1. PRA-CNSP-016 Edición Nº 01 Página 3 de 8 OBJETIVO Establecer el procedimiento para la revisión del Sistema de Gestión de la Calidad por la Dirección General del CNSP/INS, con el fin de asegurar su continua adecuación y funcionamiento con relación a la política de calidad y sus objetivos; en caso necesario introducir cambios o mejoras necesarias. 2. ALCANCE Se aplica a las unidades orgánicas y funcionales del CNSP/INS que se encuentren dentro del alcance del Sistema de Gestión de Calidad. 3. REFERENCIAS 3.1. NTP-ISO 9000 Sistema de gestión de la calidad. Fundamentos y vocabulario 3.2. MGC-CNSP-001 Manual de Gestión de la Calidad. 3.3. PRA-CNSP-002 Atención de reclamos del cliente. 3.4. PRA-CNSP-005 Evaluación y desarrollo de un proyecto de mejora. 3.5. PRA-CNSP-007 Auditorias internas de calidad. 4. DEFINICIONES Y SIGLAS 4.1. objetivos de la calidad: Algo ambicionado, o pretendido, relacionado con la calidad. 4.2. política de la calidad: Intenciones globales y orientación de una organización relativas a la calidad, tal como se expresan formalmente por la dirección. 4.3. revisión por la dirección: Evaluación formal, efectuada por la dirección de laboratorio, del estado y adecuación del sistema de gestión de la calidad con relación a la política de la calidad y a sus objetivos. 4.4. sistema de gestión de la calidad: sistema de gestión para dirigir y controlar una organización con respecto a la calidad. SIGLAS AC: Acción correctiva. AP: Acción preventiva. CEGC: Coordinador del Equipo de Gestión de la Calidad. CNSP: Centro Nacional de Salud Pública. INS: Instituto Nacional de Salud. NC: No conformidad. PROCEDIMIENTO EL PRESENTE DOCUMENTO SE DISTRIBUYE COMO COPIA NO CONTROLADA Y TIENE UNA VIGENCIA DE 2 AÑOS CONTADO A PARTIR DE LA FECHA DE SU APROBACIÓN EL EQUIPO DE GESTIÓN DE LA CALIDAD DEL CENTRO NACIONAL DE SALUD PUBLICA PROCESA LAS PROPUESTAS DE MODIFICACIÓN Y ACTUALIZA LAS EDICIONES VIGENTES DEL REVISIÓN POR LA DIRECCIÓN PRA-CNSP-016 Edición Nº 01 Página 4 de 8 SGC: Sistema de Gestión de la Calidad. 5. RESPONSABILIDADES 5.1 El Director General es responsable de aplicar las disposiciones establecidas en este procedimiento, aprobar el Programa de Revisión del SGC-CNSP y realizar las revisiones del SGC. 5.2 El personal de las Direcciones Ejecutivas, Equipos Multifuncionales, Laboratorios y unidades funcionales son responsables de presentar los informes correspondientes de acuerdo a lo especificado en el presente procedimiento. 5.3 El CEGC-CNSP es responsable de elaborar el Programa de Revisión del SGC-CNSP, de hacer el seguimiento de la implementación de los proyectos de mejora, así como adecuar la documentación del SGC. 6. ASPECTOS GENERALES 6.1. Las revisiones por la dirección se realizan con una frecuencia anual. El Director General puede incrementar la frecuencia de las revisiones por la dirección con el fin de asegurar el cumplimiento de los objetivos del SGC. 6.2. El Director General ejecuta las revisiones de la política y los objetivos de la calidad cada vez que lo considere necesario o se genere algún cambio en el SGC. 6.3. Para la revisión de los procesos del SGC, el Director General puede seleccionar y delegar a otros directivos que sean competentes e independientes de las actividades objeto de revisión o contratar personal externo calificado para estos fines. 6.4. El personal que participa del proceso de revisión por la dirección asegura el tratamiento confidencial de la información que emane de dicho proceso. 7. DESARROLLO DEL PROCESO 7.1. Programación de la revisión. 7.1.1. El Director General del CNSP solicita al CEGC-CNSP la presentación del Programa de Revisiones por la Dirección. 7.1.2. El CEGC elabora la propuesta del Programa de Revisiones por la Dirección en el formulario respectivo (Anexo A.1), estableciendo los objetivos, alcance y elementos de la revisión. 7.1.3. El Director General revisa el Programa de Revisiones por la Dirección, cualquier observación que tuviera se lo comunica al CEGC-CNSP para su corrección. 7.1.4. Una vez revisado y corregido el Programa de Revisiones por la Dirección, el Director General procede a su aprobación. 7.1.5. El Director General, una vez aprobado el Programa de Revisiones por la Dir.ección, lo deriva a las direcciones ejecutivas para su difusión. PROCEDIMIENTO PRA-CNSP-016 Edición Nº 01 EL PRESENTE DOCUMENTO SE DISTRIBUYE COMO COPIA NO CONTROLADA Y TIENE UNA VIGENCIA DE 2 AÑOS CONTADO A PARTIR DE LA FECHA DE SU APROBACIÓN EL EQUIPO DE GESTIÓN DE LA CALIDAD DEL CENTRO NACIONAL DE SALUD PUBLICA PROCESA LAS PROPUESTAS DE MODIFICACIÓN Y ACTUALIZA LAS EDICIONES VIGENTES DEL REVISIÓN POR LA DIRECCIÓN Página 5 de 8 7.1.6. Los coordinadores de equipo y coordinadores de laboratorio se encargan de la difusión del Programa en un plazo no mayor de 5 días. 7.2. Elementos de la revisión. 7.2.1. La revisión se sustenta pero no se limita al análisis de: - Relación de la política y los objetivos de calidad trazados, con respecto a las necesidades de los clientes. - Seguimiento de Revisiones por la Dirección. - Resultados de las auditorias (internas y externas) de la calidad. - Información adquirida, incluyendo quejas y otros factores pertinentes, de los clientes y otras partes. - Resultados de procesos de mejoramiento continuo. - Indicadores de calidad para monitorear la contribución del laboratorio a la atención de clientes. - Estado de las NC detectadas, AC tomadas y AP requeridas. - Variación en la cantidad de muestras ingresadas y monitoreo del tiempo de ejecución de análisis. - Evaluaciones por organismos externos. - Resultados de los ensayos (nacionales e internacionales). intralaboratorios e interlaboratorios - Necesidades de entrenamiento y capacitación del personal de todos los niveles. - Calibración y función apropiadas de instrumentos, reactivos y sistemas analíticos. - Informes de la implementación del SGC por los directivos y coordinadores. - Evaluación de proveedores internos. - Cualquier otro aspecto de interés específico del Director General, no contemplado en los tópicos anteriores. 7.3. Metodología de la revisión 7.3.1. La reunión se desarrolla en la fecha señalada en el Programa de Revisiones por la Dirección, en la cual participan los responsables de los elementos de la revisión y el Director General. 7.3.2. Cada uno de los responsables realiza una exposición informativa siguiendo el siguiente esquema: - Evaluación de la situación actual. - Propuestas de mejora. 7.3.3. Los hallazgos y las acciones que surgen de las Revisiones por la Dirección son registrados (Anexo A.2). PROCEDIMIENTO EL PRESENTE DOCUMENTO SE DISTRIBUYE COMO COPIA NO CONTROLADA Y TIENE UNA VIGENCIA DE 2 AÑOS CONTADO A PARTIR DE LA FECHA DE SU APROBACIÓN EL EQUIPO DE GESTIÓN DE LA CALIDAD DEL CENTRO NACIONAL DE SALUD PUBLICA PROCESA LAS PROPUESTAS DE MODIFICACIÓN Y ACTUALIZA LAS EDICIONES VIGENTES DEL REVISIÓN POR LA DIRECCIÓN PRA-CNSP-016 Edición Nº 01 Página 6 de 8 7.4. Tratamiento. 7.4.1. El personal del laboratorio correspondiente es informado de los hallazgos y de las decisiones tomadas como resultado de la revisión. La Dirección General asegura que estas acciones son ejecutadas dentro de un periodo de tiempo apropiado y acordado, según lo establecido en los procedimientos PRA-CNSP-005 Evaluación y desarrollo de un proyecto de mejora. 7.4.2. La Secretaría de la Dirección General archiva y conserva adecuadamente los resultados de las revisiones efectuadas y envía una copia al EGCCNSP. 8. REGISTROS La información originada de las revisiones por la dirección, y toda información generada por esta actividad, es registrada en los formularios anexos. 9. ANEXOS ANEXO A: Formularios ANEXO A.1: FOR-002 PRA-CNSP-001 Programa de Revisión por la Dirección. ANEXO A.2: FOR-001 PRA-CNSP-002 Revisión por la Dirección. PROCEDIMIENTO EL PRESENTE DOCUMENTO SE DISTRIBUYE COMO COPIA NO CONTROLADA Y TIENE UNA VIGENCIA DE 2 AÑOS CONTADO A PARTIR DE LA FECHA DE SU APROBACIÓN EL EQUIPO DE GESTIÓN DE LA CALIDAD DEL CENTRO NACIONAL DE SALUD PUBLICA PROCESA LAS PROPUESTAS DE MODIFICACIÓN Y ACTUALIZA LAS EDICIONES VIGENTES DEL REVISIÓN POR LA DIRECCIÓN PRA-CNSP-016 Edición Nº 01 Página 7 de 8 ANEXO A.1 FORMULARIO PROGRAMA DE REVISIONES POR LA DIRECCIÓN Identificación N° Objetivos: Fecha de emisión Alcance: FOR-001 PRACNSP-016 Edición Nº 01 Pág. de Elementos de la revisión: N° Descripción 1. Estado de la política y objetivos de la calidad 2. Seguimiento de Revisiones por la Dirección anteriores 3. Resultados de las auditorias (internas y externas) de la calidad 4. Retroalimentación, incluyendo quejas y otros factores pertinentes, de los clínicos, pacientes y otras partes 5. Resultados de procesos de mejoramiento continuo 6. Indicadores de calidad para monitorear la contribución del laboratorio a la atención de pacientes 7. Estado de las NC detectadas, AC tomadas y AP requeridas 8. Cambios en el volumen, tipo de trabajo realizado y monitoreo del tiempo de ejecución 9. Evaluaciones por organismos externos 10. Resultados de los ensayos intralaboratorios e interlaboratorios (nacionales e internacionales) 11. Necesidades de entrenamiento y capacitación del personal de todos los niveles 12. Calibración y función apropiadas de instrumentos, reactivos y sistemas analíticos 13. Informes del personal directivo y coordinadores 14. Evaluación de proveedores Elaborado por: CEGC-CNSP Responsable Firma Aprobado por: Director General CNSP/INS Fecha Hora Firma PROCEDIMIENTO PRA-CNSP-016 EL PRESENTE DOCUMENTO SE DISTRIBUYE COMO COPIA NO CONTROLADA Y TIENE UNA VIGENCIA DE 2 AÑOS CONTADO A PARTIR DE LA FECHA DE SU APROBACIÓN EL EQUIPO DE GESTIÓN DE LA CALIDAD DEL CENTRO NACIONAL DE SALUD PUBLICA PROCESA LAS PROPUESTAS DE MODIFICACIÓN Y ACTUALIZA LAS EDICIONES VIGENTES DEL REVISIÓN POR LA DIRECCIÓN Edición Nº 01 Página 8 de 8 ANEXO A.2 FOR-002 PRA-CNSP016 FORMULARIO REVISIÓN POR LA DIRECCIÓN Identificación N° Programa de revisión N° Fecha de revisión Edición Nº 01 Pág. de Periodo a revisar: Asistentes: – – – – – – – – Elementos de la revisión: N° Descripción ¿Se requiere tomar alguna acción o asignar algún recurso adicional? SI 1. Comentarios: 2. Comentarios: 3. Comentarios: Revisado por: Director General CNSP/INS Firma NO Responsable Fecha