Presentación Enlaces, estructuras y nomenclatura Archivo
Anuncio

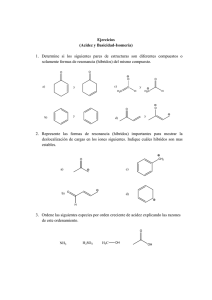
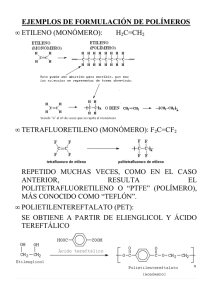
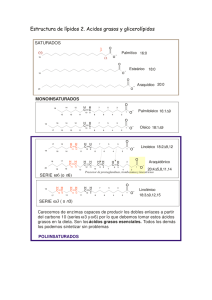
Orbital: región espacio disponible encuentra e-. Isótopos: át = #p+ y ≠ #n° Principio incertidumbre Heisenberg: localización e-. Orbitales degenerados: = E px py pz. Principio Exclusión Pauli: c/orbital 2 e- spin pareado. Principio Aufbau: configuración electrónica de át. Columna tabla periódica: e- valencia. Regla de Hund’s: -e repelen. Regla del octeto: Lewis 1915 formación enlace. Enlace iónico: transfiere Enlace covalente: comparte Estructura de Lewis representación enlace. -e no enlazantes: N, O y X. Enlace múltiple: simple, doble, triple. Valencia: # enlaces que át. Forma Enlace covalente no polar : = át Enlace covalente polar: ≠ át Enlace iónico: NaCl Momento dipolar: medida separación de cargas. Electronegatividad: medida de la capacidad de át de atraer –e. Predecir momento dipolar. Escala Pauling: ↑electronegatividad ↑atracción. Cargas formales: e- contribuye carga c/át CF = #grupo – e- no enlazantes – ½ e- compartidos Estructuras iónicas: cptos O con enlaces iónicos. Resonancia: estructuras cptos representan ≠ formas para estabilizarse. Resonancia Mayor o Menor contribución. Estructuras condensadas Estructuras Lewis Formula molecular: # át c/moléc. Formula empírica: razón relativa elementos presentes Ácidos Arrhenius: + H2O H3O+ Bases Arrhenius: + H2O OH Ácidos Bronsted-Lowry: dona p+ Bases Bronsted-Lowry: acepta p+ Ácidos Lewis: acepta eELECTROFILO Bases Lewis: dona eNEUTROFILO Relaciones estructurales: Electronegatividad: C < N < O < F Estabilidad: -CH3 < -NH2 < -OH < -F Acidez: H-CH3 < H-NH2 < H-OH < H-F Basicidad: -CH3 > -NH2 > -OH > -F Acidez : H-F < H-Cl < H-Br < H-I Tamaño: F- < Cl- < Br- < I- át + át = molécula. Enlace σ: enlace simple . Enlace π: enlace doble y triple. sp3 CH3 - CH3 sp2 sp1 CH = CH CH2 = CH2 Teoría repulsión de pares de e-: lo más alejados posible Moléculas 3D: atrás, adelante Rotación enlace simple: Etano Isómeros: cptos ≠ con = formula molecular (buteno) Isómeros constitucionales: át enlazados≠ Isómeros geométricos-estereosiómeros: át orientados≠ http://www.chem.ucalgary.ca/courses/350 /orgnom/alkenes/alkenes-02.html Universidad de Calgary http://www.chem.ucalgary.ca/courses/350 /orgnom/alkenes/alkenes-03.html Universidad de Wisconsin http://www.chem.uwec.edu/Chem150_S07 /elaborations/unit2/unit2-d-geoisomers.html Universidad de Purdue http://www.chem.purdue.edu/gchelp/cch em/geomi.html Polaridad medida por el momento dipolar µ = ᵟx d carga x distancia En compuestos orgánicos µ=0 enlaces simétricos µ=3,6 enlaces fuerte/ polares • • • Fuerzas dipolo-dipolo Fuerzas de dispersión de London Enlace de Hidrógeno 1. Calcule cuantos protones y neutrones están en el nitrógeno N13 N14 N15 N16 N17 Los anterior se denomina ______________________ 2. Escriba la configuración electrónica de los siguientes elementos: Z = 20 Z=9 Z=3 Z = 13 A que elementos corresponden ________________ Indique el nivel _____ periodo _____________ grupo _________ e- valencia 3. Represente mediante la estructura de Lewis las siguientes moléculas. Ácido cianhídirico HCN Formaldehido H2C=O Amoniaco NH3 Propanol C3H7-OH Dióxido de carbono CO2 Glicina NH2-CH2-C=O-OH 4. Determine la dirección del momento dipolar en los siguientes enlaces: C – Cl N – Cl N–S C–B B – Cl C–N 5. Calcule la carga formal para cada átomo en las siguientes moléculas: NH3 - BH3 CH2 = N+H2 C+H2 - NH2 O H 3C N H2C N O O O N O 6. Determine la mayor o menor contribución en las siguientes estructuras: - HO S O - O O OH HO + S O OH HO O Las anteriores son estructuras de ___________________ +2 S OH - O 7. Escriba la estructura condensada de las siguientes moléculas: 2-ciclohexenol OH HC H2C CH H2C 2-hexene CH CH2 H3C CH CH CH2 3-hexanol CH3-CH2-CH-OH-CH2-CH2-CH3 2-ciclohexenona CH2 H2C C=O H2C CH CH CH2 CH3 8. Determine la formula molecular: %C %H %N % Cl Peso total g 40.0 6.67 0 0 90 32.0 6.67 18.7 0 75 25.6 4.32 15.0 37.9 93 38.4 4.80 0 56.8 125 9. Determine a que tipo de isómero corresponden las siguientes moléculas: (ver dipositivas 16, 17). Ciclohexano y Ciclohexeno Forma silla 10. Explique a que se refieren los siguientes principios Principio incertidumbre Heisenberg: Principio Exclusión Pauli: Principio Aufbau: Regla de Hund’s: Regla del octeto de Lewis: Escala Pauling: Teoria VSEPR: 11. Ordene en las siguientes especies el incremento de la acidez: HF , NH3, H2SO4, CH3OH, CH3COOH, H3O+, H2O NH3 < < H20 < CH3OH, < CH3COOH < H2SO4 < HF 12. Ordene en las siguientes especies el incremento de la basicidad: NH3, CH3O- , H2O, CH3COO-, NaOH, NH2-, HSO4NaOH>NH3>NH2<H2O>CH3O->HSO4- 13. Ordene los siguientes solventes de acuerdo al incremento de la polaridad Hexano, tetracloruro de carbono, acetato de etilo, acetona, agua, cloroformo, etanol, tolueno, metanol, benceno, diclorometano. Y establezca cual tendrá mayor punto de ebullición. Hexano, tolueno, benceno, tetracloruro de carbono, cloroformo, diclorometano, acetato de etilo,acetona, etanol, metanol, agua, cis/trans en alquenos 2 sustituyentes cuando hay tres o más sustituyentes ≠ Z/E, Z zusammen que significa juntos E entgegen que significa opuestos ácido (Z)-3-amino-2-butenoico ácido (E)-3-amino-2-butenoico. Reglas de prioridad de Cahn, Ingold y Prelog. Para cada uno de los dos átomos C del doble enlace se determina individualmente cual de los dos sustituyentes tiene la prioridad más alta. Si ambos sustituyentes de mayor prioridad están en el mismo lado, la disposición es Z. En cambio si están en lados opuestos la dispo 35 Br 17 Cl 9F