temperatura
Anuncio

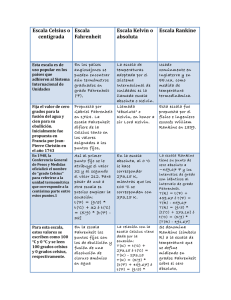
SEGUNDO BLOQUE CALOR Y TEMPERATURA PORCENTAJES EXAMEN TAREAS CLASES LABORATORIO ACTITUD 50% 15% 10% 15% 10% SANCIONES Se tomará asistencia al inicio del módulo. 1 RETARDO -1 decima No se permiten muestras de afecto o agresión física dentro del aula. -1 decima El uniforme debe ser completo y portado correctamente. Evitar palabras antisonantes y comer dentro del aula. -2 decimas No se permite el uso de teléfono celular -3 decimas Mantener el respeto dentro y fuera del aula. -2 decimas LABORATORIO Bata obligatoria. No tiene porcentaje de práctica Jugando con el material o con las mesas de trabajo -3 decimas. Gritos o corriendo en la práctica -3 decimas. Evidencias de la practica debe estar registradas en la libreta. CUESTIONARIO ¿Qué entienden por “calor”? ¿Qué creen que es la temperatura? Explica porque una botella de refresco se rompe cuando se congela dentro de tu refrigerador. Explica los mecanismos por medio de los cuales se produce transferencia de calor. ¿Cómo podemos medir el calor? Un objeto frio puede transferir calor a un cuerpo caliente? Si o no y porque. ¿En qué se basa el funcionamiento de un termómetro? Explica la causa que provoca la dilatación de los cuerpos. Explica porque unas sustancias se calientan más rápido que otras cuando reciben la misma cantidad de calor. Describe cuando cede y cuando absorbe calor un cuerpo. Elaborar un listado de ejemplos explicados sobre los fenómenos causados por el calor y temperatura. INTRODUCCIÓN La sensación de calor o frío está estrechamente relacionada con nuestra vida cotidiana. El hombre primitivo le atribuía propiedades maravillosas al fuego, por lo cual lo consideraba un dios. CALORICO Hacia el siglo XVIII se pensaba que el calor era una sustancia que formaba parte de los cuerpos y que podía fluir de un cuerpo a otro, y a eso se le daba el nombre de calórico. El calórico era una sustancia que al salir enfriaba a un cuerpo, mientras que al entrar lo calentaba; así se creó una teoría que perduró durante muchos años. EN LA ACTUALIDAD Actualmente se interpreta al calor como una energía en tránsito que fluye de cuerpos a mayor temperatura a menor temperatura. La temperatura es una magnitud física que indica que tan caliente o fría está una sustancia y se mide con un termómetro Todavía en el siglo XVIII, no se contaba con una forma de medir con exactitud lo caliente o lo frío de un cuerpo. Un médico estimaba cuánta fiebre tenía un paciente, tocando su frente; un panadero calculaba lo caliente de su horno por el color de las brasas. Lo riguroso del frío invernal se determinaba por el espesor del hielo en los estanques congelados. Era necesaria una forma exacta de describir lo caliente y lo frío de las cosas. TEMPERATURA ¿Por casualidad eres de las personas que prefiere ponerse una chamarra cuando los demás están listos para vestir el traje de baño? ¿Duermes con lo menos posible en la noche, cuando las demás personas tienen frío aun bajo tres cobijas? Esto significa que los términos “frío” y “caliente” son relativos y específicos para cada persona. EXPERIMENTO llena tres recipientes grandes, uno con agua caliente (¡no tanto que puedaquemar!), otro con agua fría, y el tercero con agua tibia. Sumerge tu mano en elrecipiente con agua caliente y la otra mano en el que contiene agua fría durante algunossegundos. Inmediatamente después sumerge ambas manos en el agua tibia: sentirás el agua caliente en la mano queantes estaba en el agua fría y sentirás el agua fría en la mano que sacaste del agua caliente. NOCIONES DE TEMPERATURA Las nociones científicas de calor y temperatura se apoyan en la idea que nos transmiten nuestros propios sentidos. Así, esa sensación del tacto, que permite clasificar los cuerpos en fríos y calientes, da lugar a la idea de temperatura ypor extensión a la de calor. Sin embargo, la Física va más allá de estas nociones intuitivas y busca representacionesque puedan ser expresadas en forma numérica, esto es, como magnitudes o atributos medibles. El desarrollo de una teoría cinética para la materia proporcionó una explicación a la noción de temperatura y a otrosconceptos clave para la comprensión de los fenómenos caloríficos DIFERENCIA ENTRE CALOR Y TEMPERATURA. La temperatura y el calor están muy ligados, pero no son lo mismo. Cuando tocamos un cuerpo lo podemos sentir caliente o frío según la temperatura que tenga, así como su capacidad para conducir el calor. Es por ello que, si coloca sobre una mesa un bloque de madera y una placa de metal, al tocar la placa de metal la siente más fría porque conduce mejor el calor de su cuerpo que la madera, no obstante, los dos tienen la misma temperatura. DEFINICION DE TEMPERATURA. La magnitud física que indica que tan caliente o fría es una sustancia respecto a un cuerpo que se toma como base o patrón es la temperatura. Cuando se suministra calor a una sustancia, no sólo se eleva su temperatura, sintiéndose más caliente, también se producen alteraciones en varias de sus propiedades físicas. Por lo tanto, al variar la temperatura, las sustancias se dilatan o se contraen, su resistencia eléctrica cambia y si se trata de un gas, su presión varía. La temperatura de un cuerpo o un sistema es una propiedad intensiva, ya que no depende de la cantidad de materia ni de su naturaleza, sino del ambiente en que se encuentren. Por lo tanto, una piedra, un trozo de metal o madera, etc; que se localizan en un mismo lugar, por ejemplo en una habitación tendrán la misma temperatura. Sin embargo, la temperatura sí depende del estado de agitación o movimiento desordenado de las moléculas, o sea, del valor de la energía cinética media de las moléculas del cuerpo o del sistema. Por ello, se considera que sus moléculas no tendrían energía cinética traslacional a la temperatura denominada cero absoluto y que corresponde a 0° Kelvin o -273°C. Es muy importante recordar que nuestro organismo no detecta la temperatura, sino pérdidas o ganancias de calor. Cuando sentimos que un cuerpo está muy frío es porque nuestro organismo le está transfiriendo mucho calor; sin embargo, otra persona que esté a menor temperatura, puede sentirlo sólo frío al transferirle una menor cantidad de calor. ESCALAS DE TEMPERATURA Y SUS UNIDADES El alemán Gabriel Fahrenheit, soplador de vidrio y fabricante de instrumentos, fabricó en 1714, el primer termómetro, para ello lo colocó a la temperatura más baja que pudo obtener, mediante una mezcla de hielo y cloruro de amonio (NH4Cl), marcó el nivel que marcaba el mercurio; después al registrar la temperatura del cuerpo humano, volvió a marcar el termómetro y entre ambas señales hizo 96 divisiones iguales. Más tarde observó, que al colocar su termómetro en una mezcla de hielo en fusión y agua, registraba una lectura de 32° F y al colocarlo en agua hirviendo leía 212 ° F. En 1742, el biólogo sueco Andrés Celsius basó su escala en el punto de fusión del hielo (0 ° C), y en el punto de ebullición del agua (100 ° C), a la presión de una atmósfera o sea 760 mmHg, es decir dividió su escala en 100 partes iguales, cada una de 1° C. Años después el Inglés William Kelvin propuso una nueva escala de temperatura, en la cual el cero corresponde a lo que tal vez sea la menor temperatura posible llamada cero absoluto, en ésta temperatura, la energía cinética de las moléculas es cero. El tamaño de un grado de la escala Kelvin es igual al de un grado Celsius y el valor de cero grados en la escala de Celsius equivale a 273 K. Cuando la temperatura se da en Kelvin se dice que es absoluta y ésta es la escala aceptada por el Sistema Internacional de Unidades (SI). Existe otra escala de temperatura usada solo en trabajos científicos denominada Rankine, que también toma como referencia el punto de congelación y ebullición del agua. Al igual que la escala Fahrenheit, la escala Rankine presenta 180 divisiones, siendo el punto de congelación del agua 492 °R y el de ebullición 672 °R. En el cuadro sigueinete se muestra un comparativo entre las 4 escalas. Cero absoluto 0°K P. fusión P. ebullición 273 ° K 373 °K Escala Kelvin Escala Celsius -273° C - 460 ° F 0°R 0° C 0°F 32° F 460 ° R 492 ° R 100 °C Escala Fahrenheit 212°F Escala Rankine 672° R Existe un límite mínimo de temperatura: 0° K = - 273 ° C = - 460 ° F, = 0 ° R pero no hay límite máximo de ella, pues en forma experimental se obtienen en los laboratorios temperaturas de miles de grados, mientras que en una explosión atómica, se alcanzan temperaturas de millones de grados. Se supone que la temperatura en el interior del Sol, alcanzan los mil millones de grados. Conversión de temperaturas de una escala a otra. Aunque la escala Kelvin es usada por el SI, para medir temperaturas, aún se emplea la escala Celsius o centígrada y la escala Fahrenheit, por lo tanto es conveniente manejar sus equivalencias de acuerdo con las siguientes expresiones: 1.- Para convertir de grados Celsius a Kelvin: °K = ° C + 273. 2.- Para convertir de Kelvin a grados Celsius: ° C = °K – 273. 3.- Para convertir de grados Celsius a grados Fahrenheit: ° F = 1.8° C + 32. 4.- Para convertir de grados Fahrenheit a grados Celsius: ° C = ° F – 32 1.8 5.- Para convertir de grados Fahrenheit a Rankine: ° R = ° F + 460. 6.- Para convertir de grados Rankine a Fahrenheit: °F = °R -460. Problemas de conversión de temperaturas de una escala a otra. 1.- Convertir 100 °C a Kelvin: 2.- Convertir 273 °K a °C: 3.- Convertir 0°C a °F : 4.- Convertir 212 °F a °C: ° K = 100 °C + 273 = 373 °K. ° C = 273°K – 273 = 0°C. ° F = 1.8 x 0°C + 32 = 32°F. °C = 212°F – 32 = 100°C. 1.8 El punto de ebullición del alcohol etílico es de 78.5° C y el de congelación de -117° C bajo una presión de una atmósfera. Convertir estas dos temperaturas a la escala Kelvin y a la escala Fahrenheit. ° K = ° C + 273 = 78.5 +273 = 351.5 °K. ° K = - 117° C + 273 = 156 °K. ° F = 1.8 ° C + 32 = 1.8 x 78.5°C + 32 = 173°F. ° F = 1.8 x -117° C + 32 = - 211 + 32 = 179 ° F. El mercurio hierve a 675° F y se solidifica a -38 °F bajo la presión de una atmósfera. Expresar estas temperaturas en grados Rankine, Celsius y Kelvin. ° R = ° F + 460 = 675° F + 460 = 1135 ° R. ° R = - 38 ° F + 460 = 422 ° R. ° C = ° C = ° F – 32 = 675° F – 32 = 357 ° C. 1.8 ° C = - 38 °F – 32 = -38.9 ° C 1.8 1.8 ° K = ° C + 273. ° K = 357 + 273 = 630 ° K. ° K = - 38.9° C + 273 = 234.1 ° K. CALOR Y SUS UNIDADES DE MEDIDA Se le denomina calor, a la transferencia de energía de una parte a otra de un cuerpo o entre distintos cuerpos que se encuentran a diferente temperatura. El calor es energía en tránsito y siempre fluye de cuerpos de mayor temperatura a los de menor temperatura. El calor no fluye desde un cuerpo de temperatura menor a otro de temperatura mayor a menos que se realice un trabajo, tal es el caso del refrigerador. Actualmente, los físicos señalan que un cuerpo no posee calor, sino que tiene energía interna, de tal manera que el calor es la energía calorífica que se transfiere de los cuerpos que están a mayor temperatura a los de menor temperatura, hasta que los cuerpos tienen la misma temperatura. Después de que la transferencia de calor a un cuerpo o sustancia cesa, ya no se le denomina calor y se interpreta como la energía térmica del cuerpo o sustancia de la que se trate. La energía interna de un cuerpo o sustancia, se define como la suma de las energías cinética y potencial de todas las moléculas individuales que lo constituyen. Al suministrar calor a un cuerpo o sustancia, se provoca un aumento en la energía de agitación de sus moléculas, se produce entonces un incremento en la energía interna, y por consiguiente, un aumento en la temperatura. El calor es la magnitud física o parámetro que describe las interacciones de un sistema con otro, dado que corresponde a la cantidad de energía que se transfiere de un sistema a otro. En conclusión: Todo cuerpo o sistema, debido a su temperatura, tiene la capacidad de transferir energía a otro cuerpo o sistema que esté a temperatura más baja. Medición de la temperatura. Para medir la temperatura se utiliza el termómetro. Su funcionamiento se basa en el hecho que se presenta cuando se ponen en contacto dos cuerpos que están a distinta temperatura, después de cierto tiempo alcanzan la misma temperatura, es decir, están en equilibrio térmico. El fenómeno de dilatación de los fluidos se utiliza en la construcción de los termómetros. Existen diferentes tipos de termómetros y el más común es el de mercurio. Dicho instrumento consiste en un tubo capilar que lleva en la parte inferior un bulbo con mercurio, el cual al calentarse se dilata de manera directamente proporcional al aumento de la temperatura, por lo que el ascenso que experimenta el nivel de mercurio por el tubo capilar es el mismo cada vez que se incrementa en un grado su temperatura. De igual modo, el mercurio se contrae en la misma proporción, cada vez que desciende un grado su temperatura. La escala de un termómetro de mercurio puede ser de 357°C a – 39°C. Cuando se requiere medir temperaturas menores de -39°C hasta de -130°C se utiliza el termómetro de alcohol. Para temperatura aún menores, se utiliza el termómetro de tolueno o éteres de petróleo. Cuando se necesita medir temperaturas altas se emplean los termómetros de resistencia. Su funcionamiento se basa en el hecho de que la resistencia eléctrica de un conductor metálico aumenta de manera directamente proporcional al aumento de su temperatura. MECANISMOS POR MEDIOS DE LOS CUALES SEL CALOR SE TRANSMITE DE UN CUERPO A OTRO Formas de propagación del calor. Si dos cuerpos se ponen en contacto y no manifiestan tendencia a calentarse o enfriarse, es porque su temperatura y, por tanto, la energía cinética media de sus moléculas es igual; pero cuando diversas partes de un mismo cuerpo, o varios cuerpos en contacto, están más calientes, todos tenderán a alcanzar la misma temperatura y el calor se propagará de un punto a otro. El calor o energía calorífica siempre se propaga de los cuerpos calientes a los fríos, de tres maneras diferentes: a) Conducción b) Convección c) Radiación. Conducción.- es la forma de propagación del calor a través de un cuerpo sólido, debido al choque entre moléculas. Cuando el extremo de una varilla metálica se ponen en contacto con el fuego, al cabo de cierto tiempo el otro extremo también se calienta. Esto se debe a que las moléculas del extremo calentado por el fuego vibran con mayor intensidad, es decir, con mayor energía cinética. Una parte de esa energía se transmite a las moléculas cercanas, las cuales al chocar unas con otras comunican su exceso de energía a las contiguas, así su temperatura aumenta y se distribuye en forma uniforme a lo largo de la varilla. Esta transmisión de calor continuará mientras exista una diferencia de temperatura entre los extremos, y cesará totalmente cuando sea la misma en todas las partes. Convección.- Es la propagación del calor ocasionada por el movimiento de la sustancia caliente. Al poner agua en un vaso de precipitado y calentarla posteriormente, observamos que transcurrido cierto tiempo comienza un movimiento en el seno (parte interna) del líquido Esto se debe a que al recibir calor el líquido del fondo, la temperatura sube y provoca su dilatación, aumentando el volumen y en consecuencia disminuye la densidad de esa porción, por lo que sube a la superficie y es reemplazada por agua más fría y con mayor densidad. Este proceso se repite con la circulación de masas de agua más caliente hacia arriba y las de agua más fría hacia abajo, provocándose las llamadas corrientes de convección. El calentamiento en los líquidos y gases es por convección. Los vientos son corrientes de convección del aire atmosférico, debido a las diferencias de temperatura y densidad que se producen en la atmósfera. Radiación.- es la propagación del calor por medio de ondas electromagnéticas esparcidas, incluso en el vacío, a una velocidad de 300 mil km/seg. El calor que nos llega del Sol es por radiación, pues las ondas caloríficas atraviesan el vacío existente entre la Tierra y el Sol. A las ondas caloríficas también se les llama rayos infrarrojos, en virtud de que su longitud de onda es menor si se compara con la del color rojo. Todos los cuerpos calientes emiten radiaciones caloríficas, es decir ondas electromagnéticas de energía proporcional a su temperatura. Cuando la radiación de un cuerpo caliente llega a un objeto, una parte se absorbe y otra se refleja. Los colores oscuros son los que absorben más las radiaciones. Por ello, en los climas cálidos se usan con frecuencia ropas de colores claros para reflejar gran parte de las ondas infrarrojas y luminosas que provienen del Sol. Unidades para medir el calor. Como ya señalamos, el calor es una forma de energía llamada energía calorífica. Por lo tanto, las unidades para medir el calor son las mismas del trabajo mecánico y la energía: a) Sistema Internacional de Unidades: Joule = Newton x metro. b) Sistema CGS: Ergio = dina x centímetro = dina. Cm. Aunque existen las unidades anteriores, aún se utilizan unidades como: la caloría y el BTU que a continuación se describirán: Caloría.- es la cantidad de calor aplicado a un gramo de agua para elevar su temperatura 1°C. Kilocaloría.- Es un múltiplo de la caloría y equivale a: 1 Kcal = 1000 cal. El BTU es la unidad para medir el calor en el Sistema Inglés, y dichas siglas son British Thermal Unit, que significa, Unidad térmica Británica, y es la cantidad de calor aplicada a una libra de agua (454 gramos) para que eleve su temperatura un grado Fahrenheit: 1 Btu = 252 cal = 0.252 Kcal La equivalencia entre joules y calorías, es la siguiente: 1 joule = 0.24 cal 1 caloría = 4.2 Joules. PROBLEMA 1 Y 2 1. La longitud de un cable de aluminio es de 30 m a 20°C. Sabiendo que el cable es calentado hasta 60 °C y que el coeficiente de dilatacion lineal del aluminio es de 24x10-6 1/°C. Determine: a) la longitud final del cable b) la dilatacion del cable. 2. Una barra de hierro de 10 cm de longitud esta a 0 °C; sabiendo que el valor de α es de 12x10-6 1/°C Calcular: a) La Lf de la barra y la ΔL a 20 °C; b) La Lf de la barra a -30 °C. RESPUESTA 1 Y 2 1) Lf=30,0285 m ΔL= 0,0288 m 2) 10,0024 cm ΔL = 0,0024 cm PROBLEMA 3 Y 4 3 Una plancha de aluminio tiene forma circular y esta a una temperatura de 50 oC. A que temperatura su superficie disminuirá en un 1%? α aluminio = 0,000011 1/°C 4. Un vendedor de nafta recibe en su tanque 2 000 Lts de nafta a la temperatura de 30 °C. Sabiendose que posteriormente vende toda la nafta cuando la temperatura es de 20 °C y que el coeficiente de dilatacion volumetrica de la nafta es de 1,1x10-3 1/°C. .Cual es el perdida (en litros de nafta) que sufrio el vendedor? RESPUESTA 3 Y 4 22 Lts. Tf=-404,54 °C PROBLEMAS En una lámina de hierro se hace una perforación de 2.5 cm. de diámetro a una temperatura de 15 ºC. ¿Cuánto aumentará el diámetro del orificio al calentar la lámina hasta una temperatura de 150 ºC? Una lámina cuadrada de aluminio de 15 cm. de lado se calienta aumentando su temperatura en 100 ºC. ¿Cuál es la variación de su superficie? Un tanque de gasolina de 40 litros fue llenado por la noche, cuando la temperatura era de 68 °F al día siguiente, el sol había llevado la temperatura a 131 °F. ¿Cuánta gasolina se derramó del tanque? ( γgasolina Respuesta 0.00405m 1.08 x10-4 m2 1.33litros SESION 12 DILATACIÓN IRREGULAR DEL AGUA Todos los líquidos aumentan su volumen cuando aumenta su temperatura, pues su coeficiente de dilatación volumétrica es positivo, excepto el agua. El agua no aumenta su volumen en el intervalo de temperatura de 0 ºC a 4 ºC, aun cuando aumenta su temperatura, más bien, lo que ocurre es que disminuye su volumen. Por encima de los 4 ºC el agua sí se dilata al aumentar su temperatura; si la temperatura decrece de 4 ºC a 0 ºC también se dilata en lugar de contraerse. Debido a esa característica, el agua es más densa a 4 ºC que a 0 ºC; por eso en las zonas donde las temperaturas son muy bajas, los ríos y lagos se congelan en la parte superior, permitiendo la subsistencia de su flora y fauna debajo. CALOR ESPECÍFICO DE LAS SUSTANCIAS Hemos definido una cantidad de calor como la energía térmica requerida para elevar la temperatura de una masa dada. Pero la cantidad de energía térmica para elevar la temperatura de una sustancia varía con materiales diferentes. Por ejemplo, supongamos que tenemos 4 bloques de 1 kg, hechos de diferentes materiales, a una temperatura de 20 ºC y queremos calentarlos hasta 100 ºC. Cada bloque se construye de modo que tienen la misma área en la base, pero sus masas y en consecuencia sus pesos son idénticos y debido a que tienen diferentes densidades, las alturas de los bloques varían. La cantidad de calor que se requiere para aumentar la temperatura desde 20 ºC hasta 100 ºC, varía en cada uno de los bloques. El aluminio absorbe el calor en forma más eficiente que el hierro, CALOR ESPECÍFICO DE LAS SUSTANCIAS Puesto que los bloques de hierro y aluminio absorben más calor que los bloques de cobre y plomo, podríamos esperar que liberaran más calor al enfriarse. Para ver que esto es cierto, cada uno de los bloques (a 100 ºC) se colocan sobre un bloque de hielo. Cada material, con la misma masa, temperatura y sección transversal se sumergirá a diferente profundidad en el bloque de hielo. CALOR ESPECÍFICO DE LAS SUSTANCIAS El hierro y el aluminio funden más hielo y por ello se hunden más profundamente que los otros bloques. Es claro que debe haber alguna propiedad de los materiales que explique las diferencias observadas en la figura. Esta propiedad debe ser una medida de la cantidad de calor Q requerida para cambiar la temperatura de un objeto en una cantidad Δt, pero también debe relacionarse con la masa m del objeto. Llamamos a esta propiedad calor específico, denotado por la letra C. CALOR ESPECÍFICO El calor específico de una sustancia, es la cantidad de calor necesario para elevar la temperatura de una masa unitaria en un grado. La fórmula basada en esta definición, puede escribirse en las siguientes formas útiles: Ce=Calor específico. C=Capacidad calórica. m=masa Q=Calor T= Temperatura. El calor específico se mide en calorías sobre gramo y grado centígrado EJEMPLO: ¿Cuál es el calor requerido (en calorías) para aumentar la temperatura de un lingote de plata de 150 kg de 25 ºC a 400 ºC? RESPUESTA 3.15x106 cal EJEMPLO Halla la cantidad de calor necesario para elevar la temperatura de 100 g de cobre desde 10 ºC a 100 ºC. RESPUESTA 837 cal Calor latente Transformaciones del estado físico de la materia Fusión Solidificación Vaporización Sublimación CALOR SENSIBLE Y CALOR LATENTE El calor sensible es aquel que al suministrarle a una sustancia eleva su temperatura. El calor latente se define como la energía requerida por una cantidad de sustancia para cambiar de fase. La variación de calor no se registra hasta terminada la fusión o evaporación. Calor latente de fusión y de solidificación Es la energía que debe ser absorbida para que se destruyan las uniones de la moléculas de un sólido y pase a estado líquido. Cantidad de calor que requiere una sustancia para cambiar 1 g de sólido a 1 g de líquido sin variar su Se mide en fcalorías/gramos. temperatura. λf=Q Q = mλ m Donde λf= calor latente de fusión en cal/gramo. Q = calor suministrado en calorías. m= masa de la sustancia en gramos. TABLA 2.5 Pg. 119 Calor latente de vaporización y de condensación Por definición el calor latente de vaporización de una sustancia es la cantidad de calor que requiere para cambiar 1 gramo de líquido en ebullición a 1 gramo de vapor, manteniendo constante su temperatura. λ v= Q m Donde λv= calor latente de vaporización en cal/g Q = calor suministrado en calorías m= masa de la sustancia en gramos Q = m λv Tabla 2.6 Pg. 120 EJEMPLOS Calcular la cantidad de calor que se requiere para cambiar 100 gramos de hielo a – 15°C en agua a 0°C. RESPUESTA 8750 CAL PROBLEMA Calcular la cantidad de calor que se requiere para cambiar 100 gramos de hielo a -10° C en vapor a 130 °C. RESPUESTA 73940 cal. Calor absorbido o desprendido Cuando un cuerpo caliente se pone en contacto con uno frío, existe un desequilibrio térmico y, por tanto, se producirá un cambio de calor o energía térmica del cuerpo caliente al frío hasta que igualan su temperatura. En un intercambio de calor, la cantidad del mismo permanece constante, pues el calor transmitido por uno o más objetos calientes será el que reciba uno o más objetos fríos. Esto da origen a la llamada ley de intercambio de calor que dice: en cualquier intercambio de calor efectuado, el calor cedido o perdido es igual al absorbido o ganado. Por lo tanto Calor perdido = Calor ganado EJEMPLO 1 Se tienen 200 gr de un metal a 75 ºC y se ponen en 400 gr de agua a 20 ºC, después de un tiempo la temperatura final de la mezcla en equilibrio térmico es de 22.7 ºC. Determinar el calor específico de ese metal si suponemos que no se pierde calor externo. RESPUESTA 1 0.103 cal/g°C EJEMPLO 2 Una pieza de metal de 50 gr a 95 ºC, se deja caer dentro de 250 gr de agua a 17 ºC y su temperatura se incrementa hasta 19.4 ºC. ¿Cuál es el calor específico del metal? RESPUESTA 0.158 cal/g°C PROBLEMAS A RESOLVER