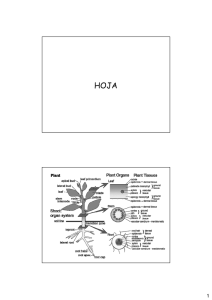
universidad técnica particular de loja área biológica
Anuncio

UNIVERSIDAD TÉCNICA PARTICULAR DE LOJA La Universidad Católica De Loja ÁREA BIOLÓGICA TITULACIÓN DE BIÓLOGO Anatomía foliar de tres especies de Bromeliaceae como componentes de la dieta del oso andino (Tremarctos ornatus) en el Parque Nacional Podocarpus. TRABAJO DE FIN DE TITULACIÓN AUTORA: Vallejo Ochoa, Natalia Salomé DIRECTOR: Moreira Palacios, Máximo Oswaldo, Blgo LOJA - ECUADOR 2014 1 APROBACIÓN DEL DIRECTOR DEL TRABAJO DE FIN DE TITULACIÓN Biólogo. Máximo Oswaldo Moreira Palacios. DOCENTE DE LA TITULACIÓN De mi consideración: El presente trabajo de fin de titulación: Anatomía foliar de tres especies de Bromeliaceae como componentes de la dieta del oso andino (Tremarctos ornatus) en el Parque Nacional Podocarpus realizado por Vallejo Ochoa Natalia Salomé ha sido orientado y revisado durante su ejecución, por cuanto se aprueba la presentación del mismo. Loja, octubre de 2014 f) . . . . . . . . . . . . . . . . . . . . II DECLARACIÓN DE AUTORÍA Y CESIÓN DE DERECHOS Yo Natalia Salomé Vallejo Ochoa, declaro ser la autora del presente trabajo de fin de titulación: Anatomía foliar de tres especies de Bromeliaceae como componentes de la dieta del oso andino (Tremarctos ornatus) en el Parque Nacional Podocarpus de la titulación de Biología siendo el Biólogo. Máximo Moreira Palacios director del presente trabajo; y eximo expresamente a la Universidad Técnica Particular de Loja y a sus representantes legales de posibles reclamos o acciones legales. Adicionalmente declaro conocer y aceptar la disposición del Art. 67 del Estatuto Orgánico de la Universidad Técnica Particular de Loja que en su parte pertinente textualmente dice: “Forman parte del patrimonio de la Universidad la propiedad intelectual de investigaciones, trabajos científicos o técnicos y tesis de grado que se realicen a través, o con el apoyo financiero, académico o institucional (operativo) de la Universidad” f.…………………………………………. Autora: Natalia Salomé Vallejo Ochoa Cédula: 1104362163 III DEDICATORIA La presente investigación va dedicado a mis padres María Teresa y Ángel Isidro (+), ellos han sido un pilar fundamental en este caminar, mi guía, mi cimiento, mis raíces en todos estos años de vida; su apoyo incondicional, sus sabios consejos y enseñanzas me han dado fuerzas para llegar culminar esta etapa y continuar las restantes aventuras que me faltan por vivir, hoy mi Ángel me cuida desde el cielo iluminando mi camino y mi alma, Papá te extraño y te amo, gracias. A mis hermanas; Paola gracias por tu amor, tu protección, tus consejos que han sido fortalezas para continuar; a mi hermana Gabriela que aunque a la distancia siempre me ha brindado su apoyo y amor, a mi hermano Nikolay por estar apoyándome siempre, por tu paciencia, por estar conmigo en cada momento importante de mi vida, han sido, es y serán mi ejemplo a seguir. A mis abuelitos Dorita y Olmedito (+) por consentirme y darme su cariño, sus pláticas me han brindado mucho amor, las bendiciones de cada noche inundaron mi alma de paz. A mi pequeña inspiración Mateo Nikolas por ser mi alegría, ver cómo va cursando sus primeros años de vida me inundan de alegría y me dan endereza para ser cada vez una mejor tía. Natalia Salomé. IV AGRADECIMEINTO Expreso un cordial agradecimiento a la Universidad Técnica Particular de Loja; por haberme permitido ser parte de su alumnado y culminar con éxito mi carrera profesional. A cada uno de mis profesores de la UTPL por brindarme sus enseñanzas y transmitirme sus conocimientos. Un agradecimiento especial al Biólogo Máximo Moreira, por su acertada dirección de la tesis y constate guía, aspectos que ayudaron a culminar el proyecto de tesis.. A la Dra. Lorena Guevara; gracias por brindarme su tiempo, su espacio, y sus conocimientos. Agradezco al Dr. Zhofre Aguirre catedrático de la Universidad Nacional de Loja, y de igual manera al Ing. Bolívar Merino por su asesoría en la identificación de especies, y a Luis Marcelo por su apoyo y colaboración en el trabajo de campo. A mi maestro Carlos Ortega por el apoyo brindado para poder culminar con éxito este proyecto. A todas y cada una de las personas que me brindaron su ayuda reciban un agradecimiento personal de mi parte. Natalia Salomé. V INDICE DE CONTENIDOS CERTIFICACIÓN ................................................................................................................... II DECLARACIÓN DE AUTORÍA Y CESIÓN DE DERECHOS ................................................ III DEDICATORIA ..................................................................................................................... IV AGRADECIMEINTO .............................................................................................................. V RESUMEN EJECUTIVO ........................................................................................................ 2 ABSTRACT ........................................................................................................................... 3 INTRODUCCIÓN ................................................................................................................... 4 CAPÍTULO 1. MARCO TEÓRICO ......................................................................................... 6 1.1 La familia Bromeliaceae ................................................................................................................ 7 1.2 Genero Puya .................................................................................................................................. 8 1.3 Algunos estudios anatómicos en Bromeliaceae............................................................................ 9 1.4 Utilidad de las técnicas histológicas o microhistológicas ............................................................ 10 1.5 El Parque Nacional Podocarpus (PNP) y su especie bandera: el oso de anteojos ...................... 11 1.6. OBJETIVOS .................................................................................................................................. 12 CAPÍTULO 2. MATERIALES Y MÉTODOS ....................................................................... 13 2.1 Selección de especies .................................................................................................................. 14 2.2 Sitios de colección de especímenes ............................................................................................ 15 2.3 Colección de muestras y especímenes (muestreo) ..................................................................... 15 2.4. Evaluación de las estructuras morfológicas de las hojas de bromelias. .................................... 16 2.5 Metodología para diseñar una herramienta para la identificación de bromelias en estudios de dieta de herbívoros ........................................................................................................................... 18 CAPÍTULO 3. RESULTADOS ............................................................................................. 19 3.1. Caracterización anatómica de Puya eryngioides........................................................................ 19 3.2 Caracterización anatómica de Puya maculata ............................................................................ 26 3.3 Caracterización anatómica de Puya nítida .................................................................................. 33 CAPÍTULO 4 DISCUSIÓN ................................................................................................... 44 4.1. Aspectos metodológicos para estudios morfoanatómicos ........................................................ 45 4.2. Implicaciones de los estudios morfológicos ............................................................................... 45 CONCLUSIONES ................................................................................................................ 49 RECOMENDACIONES ........................................................................................................ 50 BIBLIOGRAFÍA ................................................................................................................... 51 1 RESUMEN EJECUTIVO El oso andino Tremarctos ornatus, es una especie clave para la conservación de ecosistemas de altoandinos; por ello, se estudió las estructuras anatómicas de Puya eringioides, Puya maculata y Puya nítida. Se colectaron 10 hojas por especie en el Parque Nacional Podocarpus; luego fueron fijadas en FAA, y se realizaron cortes a mano alzada, macerado y raspado de la epidermis. Se encontró que la epidermis foliar de las tres especies están compuestas por células rectangulares, casi rectas de paredes anticlinales sinuosas, y engrosadas; los estomas están ubicados al mismo nivel que las células epidérmicas; las escamas en las tres especies se distribuyen en hileras longitudinales, pero en P. eryngiodes y P. nítida están formadas por escudos y alas; el parénquima acuífero está muy desarrollado y la forma de sus células es variable; el clorénquima se ubica en la zona inferior contiguo a la hipodermis de la superficie abaxial, alternando con parénquima esponjoso en P. eringiodes y en cámaras ocupadas por células aerenquimáticas irregulares en P. maculata. Los haces vasculares presentan vainas fibrosas conectados entre sí. Palabras claves: páramo, anatomía, dieta de herbívoros, Puya, Ecuador. 2 ABSTRACT The Andean bear Tremarctos ornatus, is a key species for conservation of paramos and andean forests ecosystem. Therefore, we studied the anatomic structure of the Puya eryngioides, Puya maculata and Puya nitida, which constitute the main diet of the Andean bear in the Podocarpus National Park (PNP). Ten leaves of each species of paramos of PNP were collected and after in the laboratory each leaf was divided into middle and basal part; and were fixed in FAA (formaldehyde 5ml, 5ml acetic acid and ethyl alcohol 70% 90ml), and cutting, assembly and analysis was done; the technique used was cut freehand, marinated and hand scraping the epidermis. The leaf epidermis of the three species are composed of rectangular cells, nearly straight anticlinal walls sinuous, thickened. The scales (trichomes) in the three species is distributed in longitudinal rows and consist of shields and wings in P. eryngiodes and P. nitida; its presence is related to the absorption of water and nutrients, and reducing perspiration normal basic qualities of the vegetable species develops. Key words: páramo, herbivorous diet, Puya, Ecuador 3 INTRODUCCIÓN En la presente investigación se estudió las características morfo-anatómicas de tres especies de bromeliáceas pertenecientes al género Puya (Puya eryngioides, Puya maculata y Puya nítida), las cuales están distribuidas en el ecosistema de páramo del Parque Nacional Podocarpus; estas bromelias son parte fundamental de la dieta del oso de anteojos (Tremarctos ornatus), considerada una especie clave para la conservación de los páramos y los bosques nublados del Ecuador. Esta investigación está dividido en cinco capítulos: marco teórico, materiales y métodos, resultados, discusión, y conclusiones. En el marco teórico se presenta una descripción botánica de la familia y del género Puya, se analiza las principales estructuras anatómicas del género; y se argumenta la importancia de este género en la dieta de una de las especies símbolo de los ecosistemas alto andinos como lo es el oso de anteojos. En el segundo capítulo se habla de los materiales y métodos utilizados para realizar la investigación, y se describe el procedimiento metodológico tanto para la colecta del material en campo (hojas de las tres especies de Puya) como del procedimiento en laboratorio que se utilizó para el análisis anatómico de las estructuras celulares de cada una de las especies estudiadas. El capítulo tres sintetiza los principales resultados obtenidos en este estudio, donde se presentan las características del sistema epidérmico, el sistema fundamental y el sistema vascular de cada una de las especies. El capítulo cuatro se hace una discusión de estos resultados. Finalmente, se presentan las principales conclusiones a las cuales se ha llegado en este estudio, así como se plantean algunas recomendaciones relacionadas con aspectos técnicos, metodológicos y de gestión de la información que deberían considerarse. A más de ampliar el conocimiento anatómico de las tres especies del género Puya antes mencionadas; también se generó los insumos necesarios que permitieron construir una clave de identificación anatómica para cada una de las tres especies de bromelias; clave que constituye una herramienta metodológica que podrá ser usada por actores interesados en el conocimiento y manejo de procesos de especies claves y su relación con los ecosistemas que los rodea; como es el caso del manejo del oso de anteojos en los ecosistemas de páramo del Parque Nacional Podocarpus. Estudios relacionados con el conocimiento anatómico de especies vegetales importantes en procesos ecológicos de los ecosistemas como es el caso de especies de puya todavía son 4 incipientes en el Ecuador y sobre todo en la región sur del Ecuador; por ello, el uso de técnicas anatómicas que apoyen a la identificación de especies mediante características anatómicas fue uno de los aspectos que direccionó ésta investigación; pues la funciones están relacionadas con las estructuras celulares y su conocimiento ayuda a mejorar la capacidad entendimiento de los usos actuales. Esta investigación tuvo como finalidad el estudio de las estructuras anatómicas de tres especies de Bromeliaceae del género Puya que constituyen parte de la dieta principal del oso de anteojos en el Parque Nacional Podocarpus. Para lo cual se realizó la caracterización anatómica de las tres especies de Bromeliaceae del género Puya; y se complementó con el diseño de una herramienta (clave anatómica) cuya utilidad será la identificación de las tres bromelias del género Puya en estudios de dieta de herbívoros. La metodología que fue utilizada en esta investigación inició con una revisión analítica de trabajos y publicaciones científicos relacionados con estudios de anatomía foliar de varios grupos de plantas y autores, de ellos se citan: Tomlinson (1969), Bezing (2000), Aoyama y Sajo (2003), Proença y Sajo (2007), Horres et al. 2007, Derwidueé y González (2010); y a partir de este análisis se logró definir el protocolo metodológico para la descripción de estructuras microscópicas y su relación con las características morfológicas. Posteriormente se procedió a realizar salidas de campo a lugares preestablecidos de los ecosistemas de páramo del Parque Nacional Podocarpus sobre la base de los registros de colecciones y existencias de las tres especies de puya seleccionadas para este estudio, donde se colectaron 10 hojas de diez individuos diferentes para cada una de las tres especies. Posteriormente se procedió a realizar el análisis anatómico foliar, para ello se tomó la parte media y basal de cada hoja y luego fueron fijadas en FAA (Formaldehido-ácido acético-etanol) y finalmente se prosiguió a realizar los respectivos cortes y montajes de las muestras para su análisis y descripción. 5 CAPÍTULO 1. MARCO TEÓRICO 6 1.1 La familia Bromeliaceae La familia Bromeliaceae constituye una familia muy diversa (Aguilera et al., 2011) y la más grande de especies endémicas en el Neotrópico. Aproximadamente existen 3.140 especies distribuidas en 56 géneros (Luther, 2006; 2008). Se subdividen en tres subfamilias: Bromelioideae, Pitcairnioideae y Tillandsioideae (Tomlinson, 1969; Stevens, 2001). Sin embargo en los últimos años esta clasificación ha tenido algunos cambios. Para la subfamilia Pitcairnioideae Smith (1974) en su monografía “Flora Neotrópica” agrupa a 13 géneros: Puya (168 especies); Encholirium (14 especies); Fosterella (13 especies); Connellia (4 especies); Cottendorfia (24 especies); Deuterocohnia (7 especies); Abromeitiella (2 especies); Pitcairnia (262 especies); Brocchinia (18 especies); Ayensua (1 especie); Navia (74 especies); Dyckia (106 especies); y Hechtia (45 especies). En total se registras 738 especies. La subfamilia Pitcairnioideae reúne a todos los géneros con especies usualmente provistas de hojas con espinas en sus márgenes sin embargo se presentan excepciones en algunos especies (Manzanares, 2005). Las bromelias son plantas usualmente de hojas arrosetadas, con hábitos, terrestres, saxícolas o epífitas, éstas últimas bien diversas y abundantes en selvas húmedas, es decir comprenden diversos tipos de vegetación y rangos de altitud, desde el nivel del mar hasta los 4000 msnm (Smith y Downs, 1974; 1979; Benzing, 2000). Por esta razón son importantes desde el punto de vista ecológico debido al hábito epífito de muchas de sus especies, así como a las diversas adaptaciones que presentan para vivir en hábitats xéricos (Benzing 2000); como también son de primordial importancia para el funcionamiento de ciertos ecosistemas, ya que contribuyen notablemente a la riqueza de especies, ocupan un lugar importante dentro del ciclo de nutrientes y establecen un gran número de interacciones con otros organismos (Strong, 1977; Castellaro et al. 2007 ). También incluye especies consideradas como plantas suculentas ya que sus hojas presentan estructuras carnosas con caracteres xerofíticos que son capaces de retener agua en sus tejidos (Cruz et al., 2010) poseen parénquima almacenador de agua, tejidos de sostén y tricomas peltados o escamas (Tomlinson, 1969; Benzing, 1976), y estos tienen la propiedad de retener agua y también pueden ser de gran ayuda para ser identificadas entre géneros (Benzing, 1980). 7 1.2 Genero Puya El género Puya fue establecido por Giovanni Ignazio Molina (1737-1829), originalmente identificado como Juan Ignacio Molina, sacerdote jesuita, chileno, misionero, botánico y colector de plantas. Es el segundo género más numeroso de la subfamilia Pitcairnioideae, con 199 especies y 11 variedades (Luther, 2002); y está distribuido a lo largo de la cordillera de los Andes, desde el sur Venezolano hasta el norte de Chile y Argentina. En Ecuador se han registrado un total de 34 especies, una variedad y 2 híbridos naturales entre las especies registradas se consideran que 27 son endémicas (Manzanares, 2005). Son plantas terrestres o saxícolas que forman una densa roseta donde no se almacena el agua de lluvia, es decir sin fitotelma; los asientos de las hojas suelen ser carnosos y constituyen parte del tallo, son gruesos y almacenan los hidratos de carbono necesarios para el momento de floración y fructificación; las láminas de las hojas son triangulares, coriáceas y están provistas de fuertes espinas en sus márgenes que les sirven para protegerse de los animales herbívoros, y no presentan angostamiento en su base. Las flores son grandes, conspicuas y actinomorfas; los pétalos se enroscan después de la antesis; a excepción de la Puya ferruginea que puede tener dos callos verticales cerca de la base, ningún pétalo presenta apéndices; presentan un ovario siempre súpero, y las semillas están provistas de un conspicuo alerón a su alrededor (Manzanares, 2005). Existen dos tipos de Puya, las especies que mueren después de la floración (llamadas monocárpicas) y las que mantienen un continuo desarrollo después de la floración, llamadas policárpicas); en las ultimas se observa un tallo ramificado mientras que en las monocárpicas el tallo es simple (Manzanares, 2005). Según Manzanares (2005), se pueden encontrar dos subgéneros de Puya el Puyopsis y el Puya; el primero, abarca todas las especies de Puya con las ramas completamente fértiles (flores presentes hasta el ápice de las ramas); y el segundo reúne las especies con ramas provistas de un largo ápice estéril (desprovista de flores cerca del ápice de la rama); la mayoría de las especies pertenecen al subgénero Puyopsis y solo nueve han sido incluidas en el subgénero Puya (Smith y Downs, 1974); en el Ecuador todas las especies pertenecen al subgénero Puyopsis. 8 1.3 Algunos estudios anatómicos en Bromeliaceae La familia Bromeliaceae ha sido objeto de investigaciones a nivel anatómico por diversos autores, a continuación se presentan algunas de los más importantes estudios: Tomlinson (1969), caracterizó cada una de las tres subfamilias de Bromeliaceae, basándose en los tricomas, estomas y mesófilos. Benzing (1980; 1990) y Robinson (1969), publicaron los trabajos más comprensivos de anatomía de tallo y hojas de algunas bromelias. Pita y Menezes (2002), reportaron por primera vez, velamen en raíces de especies terrestres de algunos géneros de Pitcairnioideae. Brighigna et al. (1984), reportaron la anatomía foliar tipo Kranz asociada a un metabolismo C4 en especies de Tillandsia. Tomlinson (1969) y Aoyama y Sajo (2003), manifiestan que las hojas presentan caracteres xerofíticos, frecuentemente son suculentas, poseen parénquima almacenador de agua, tejidos de sostén y tricomas capaces de absorber agua y nutrientes. Horres et al. (2007) realizaron el primer análisis filogenético considerando caracteres anatómicos en Bromeloideae, indican que la anatomía puede dar información para discernir grupos a nivel de subgéneros como en Aechmea subgénero Lamprococcus (Beer) Benth y en Aechmea subgénero Pothuava Baker, aunque hay caracteres que han evolucionado independientemente, pero agregan que la anatomía es una fuente de información inexplorada y subutilizada. De esta manera, los análisis morfoanatómicos constituyen una herramienta útil para el estudio y caracterización de este tipo de plantas; de los estudios revisados, se pudo evidenciar que la mayoría han logrado establecer que una estructura característica de esta familia son los tricomas peltados o escamas que pueden ser de gran ayuda para diferenciar a nivel de géneros (Benzing, 1980). 9 1.4 Utilidad de las técnicas histológicas o microhistológicas La técnica histológica se refiere a una serie de pasos ordenados para la obtención de muestras de tejidos que conservan todos sus detalles estructurales para poder estudiar las características morfológicas con la ayuda de un microscopio (Sandoval, 2005). Existen varias técnicas que se utiliza para el procesamiento de los tejidos, éstas dependen de las características que se desea observar. Las técnicas histológicas se las ha aplicado en múltiples disciplinas como en anatomía, fisiología, histoquímica, etnobotánica, ecofisiología, etc. En cada una de ellas, han sido usados para: (i) estudiar las características morfológicas, moleculares, el funcionamiento de órganos, tejidos y una posible relación de sus características morfológicas y su funcionamiento; (ii) también para estudiar los efectos que causa la salinidad y el estrés hídrico en los cambios anatómicos y morfológicos; (iii) conocer aspectos básicos de la biología reproductiva y obtener información más precisa sobre la reproducción de las especies mediante estas técnicas; (iv) así como también para estudiar la composición botánica de la dieta de herbívoros (Sandoval 2005 ; D’ Ambrogio 1970). Además el conocimiento de la histología es esencial para poder comprender los procesos bioquímicos y fisiológicos y para formarse una idea sobres las alteraciones estructurales que dan lugar a cambios funcionales y bioquímicos. Las técnicas microhistológicas han sido ampliamente utilizadas para estudiar la dieta de herbívoros silvestres y domésticos (Sparks y Malechek, 1968; Klee et al., 2000; Holechek et al., 2001; Castellaro et al., 2007). Es por ello, que estas técnicas pueden establecer patrones para identificar, determinar, comparar y cuantificar estructuras particulares de cada una de las especies vegetales (Ortega et al., 1993; Castellaro et al., 2007). Esta técnica consiste en la obtención de tejidos epidérmicos vegetales desde una o más estructuras morfológicas de las principales especies que participan en el medio en que los animales se desarrollan (Borgnia, 2009); además proporcionan datos relevantes para el manejo de los sistemas ecológicos y de las relaciones entre sus componentes (Catán et al., 2003). El estudio de la dieta del oso de anteojos representa un elemento clave para identificar las interacciones y entender mejor la funcionalidad ecosistémica, ya sea en un sistema natural o en diferentes grados de alteración, por lo tanto en términos aplicados puede también representar una interesante herramienta para el monitoreo y la conservación de la biodiversidad (Klee et al., 2000). Estudios recientes de las especies de la familia Bromeliaceae 10 establecen que es una de las especies más usadas en la alimentación del oso de anteojos y cabe mencionar que no se cuenta con una clave de identificación anatómica de las mismas en el Parque Nacional Podocarpus. 1.5 El Parque Nacional Podocarpus (PNP) y su especie bandera: el oso de anteojos El Parque Nacional Podocarpus (PNP) es conocido por su gran biodiversidad y alto grado de endemismo, debido principalmente a su ubicación en la depresión de Huancabamba y al amplio rango altitudinal que va desde los 800 hasta los 3800 msnm (Lozano et al., 2005). En el PNP existen diferentes zonas de vida las cuales son caracterizadas por sus plantas y animales. En sus páramos una de las familias presentes en gran medida son las Bromeliaceae, las cuales constituyen lo más importante de la dieta del oso de andino (Tremarctos ornatus). La alimentación del oso de anteojos se basa principalmente en una dieta de fibra que la obtiene de algunas plantas como las bromelias terrestres y epífitas entre otras (Suárez, 1988; Cuesta et al., 2001; Castellanos et al., 2005; Achig, 2009). A pesar de las espinas en las puyas, las plantas jóvenes son un bocado exquisito para los osos de anteojos (Manzanares, 2005). Estudios recientes de las especies de la familia de Bromeliaceae establecen que es una de las especies más usadas por el oso de anteojos recalcando en abundancia la Puya maculata y la Puya eryngiodes como también se ha reportado el consumo de Puya nítida. Siendo las Bromelias uno de los principales alimentos del oso andino, su estudio y conocimiento de aspectos claves puede resultar clave para el entendimiento de los hábitos alimenticios del oso andino Los hábitos alimentarios proporcionan información crucial de la historia de vida y patrones conductuales de especies de fauna silvestre (Rodríguez et al., 2003). Por ejemplo se ha encontrado que la dieta del oso andino, es básicamente omnívora, y que contiene en gran proporción lípidos y grasas que obtiene de bromelias terrestres y poaceas (Goldstein, 2008), mientras que el azúcar la obtiene de frutos ricos en azúcares (Peyton, 1999). El oso de anteojos tiene una distribución amplia (Castellano, 2003) y es una especie clave para la conservación ya que conservarlo significa conservar muchas especies y extensas áreas de los páramos y los bosques nublados de la región; ésta especie es emblemática y habita en el PNP. Por ser un mamífero grande requiere de grandes cantidades de recursos que, al ser conservados, pueden ser utilizados por otras especies de estos ecosistemas. Los 11 osos viven mayormente en el bosque nublado donde obtienen alimentación y protección; sin embargo cuando el alimento es escaso, este se desplaza al páramo en su búsqueda (Cuesta et al., 2001). 1.6. Objetivos El estudio de la anatomía foliar de tres especies de Bromeliaceae como componentes de la dieta del oso andino en el Parque Nacional Podocarpus se realizó a través del siguiente objetivo general: - Describir las estructuras anatómicas de tres especies de Bromeliaceae del género Puya que constituyen parte de la dieta principal del oso de anteojos en el Parque Nacional Podocarpus. Los objetivos específicos que se plantearon para la presente investigación fueron: 1. Caracterizar anatómicamente las tres especies de Bromeliaceae del género Puya 2. Diseñar una herramienta que pueda ser usada para la identificación de las tres bromelias del género Puya en estudios de dieta de herbívoros. Las hipótesis planteadas y respondidas con este estudio fueron: 1. Cada una de las especies del género Puya estudiadas se identifican en base de sus estructuras anatómicas 2. Las tres especies de puya pueden ser identificadas siguiendo claves anatómicas preestablecidas 12 CAPÍTULO 2. MATERIALES Y MÉTODOS 13 El estudio de la anatomía foliar de tres especies de Bromeliaceae como componentes de la dieta del oso andino, se realizó en dos fases de trabajo. La fase de campo que consistió en la selección de sitios con presencia de las especies seleccionadas y visita a estos ecosistemas para la colección de materia vegetal; y la fase de laboratorio, donde se realizó la caracterización anatómica de cada especie de Puya. El procedimiento y los materiales utilizados en estas dos fases se detallan a continuación: 2.1 Selección de especies En esta investigación se utilizó tres especies del genero Puya (Bromeliaceae), mismas que fueron seleccionadas sobre la base que constituyen una de los principales alimentos del oso andino (Castellanos 2003, Ontaneda y Armijos, 2012). Las especies seleccionadas fueron: Puya eryngioides, Puya maculata y Puya nítida; a continuación se presentan algunas características ecológicas de cada una de las tres especies de Puya. Puya eryngioides.- es una planta de 30-20 cm de largo con la inflorescencia policárpica, tallo ramificado, presenta un follaje denso, subcoriáceo, rosulado y numeroso. La lámina de las hojas tienen forma triangular 15-20 cm de largo, 1-1,5cm de ancho márgenes serrados con espinas 2-3mm de largo, ápice largo acuminado y punzante. La base de la hoja es orbicular 2cm de largo, 3cm de ancho. Esta es una especie endémica del Ecuador, y se distribuye en páramos húmedos de 2500 - 3500 msnm desde las provincias de Loja, Azuay, Zamora Chinchipe. Las principales amenazas son incendios, fragmentación de los bosques y actividades antropogénicas. En 1997 fue clasificada como especie vulnerable y se encuentra en la categoría de preocupación menor (Manzanares y Pitman, 2003). Puya maculata.- es una planta de 100 cm de largo con la inflorescencia monocárpica tallo no ramificado, el follaje es denso, numeroso, punzante. La lamina de la hoja es triangular de 2540 cm de largo, márgenes fuertemente serrados, espinas 10 mm de largo, negras y la base orbicular 4.5cm de largo, 4cm de ancho, y maculada marrón castaño, ápice largo atenuado y punzante. Es endémica de Ecuador, y se encuentra ampliamente distribuida en Azuay, Loja, Morona-Santiago y Sucumbíos en altitudes entre los 3000 y 3500 msnm. Las principales amenaza son incendios forestales y destrucción del hábitat. En 1997 la especie fue clasificada en peligro de extinción, debido a amplios estudios de distribución y en el 2005 fue catalogado en peligro crítico (Manzanares, 2005). Puya nítida.- es una planta de 150-200 cm de largo con la inflorescencia policárpica, rosulada, el tallo 40-60 cm de largo y 20-25 cm de diámetro, es ramificado, el follaje es denso, coriáceo, 14 numeroso, punzante. La lámina de la hoja es triangular 40-60 cm de largo, 3.5-5cm de ancho, arqueada, márgenes serrados, espinas 6mm de largo, marrón castaño, ápice atenuado y punzante La base es suborbicular aproximadamente 9 cm de largo, 7 cm de ancho. Prefiere los ambientes nublados y húmedos, o zonas donde se aglomeran las nubes bajas (Manzanares, 2005). Habita en los páramos aproximadamente a una altitud de 2850 - 3270 msnm 2.2 Sitios de colección de especímenes Sobre la base de información de los estudios realizados por Ontaneda y Armijos (2012), y el proyecto de investigación de la dieta del oso liderado por Cisneros 2014, y del Herbario Reinaldo Espinosa de la UNL, se seleccionaron sitios con presencia de las tres especies. Estos sitios corresponden al sector el Tiro y Cajanuma, los dos dentro del complejo de ecosistemas de páramo del Parque Nacional Podocarpus1 (ver Figura 1). El rango altitudinal de colección está entre los 2800- 3200 msnm Figura 1. Sitios de colección de hojas de las tres especies de Puya, dentro del ecosistema de paramo del Parque Nacional Podocarpus. 2.3 Colección de muestras y especímenes (muestreo) 1 Los páramos son ecosistema compuestos de vegetación herbácea y arbustiva y albergan un alto endemismo, estos cubren 11 mil hectáreas dentro de las 146.280 que tiene el Parque Nacional Podocarpus (ECOLAP y MAE, 2007). 15 La colección de muestras (10 hojas de diferentes individuos de cada especie), se realizó en los dos sectores antes señalados y que se pueden ver en la figura 1. En el sector el Tiro se colectaron muestras de Puya eringioides y Puya nítida; mientras que en el sector de Cajanuma se colectó Puya maculata. Se colectaron 10 hojas de distintos individuos (una hoja por planta), por cada una de las tres especies, bajo el criterio que las plantas estén en excelentes condiciones fitosanitarias, y sin presencia de indicios de plagas y enfermedades; las cuales fueron transportadas al laboratorio de Fisiología Vegetal de la UTPL Posteriormente, de cada hoja se cortó la parte media y basal y fueron fijadas por 7 días en FAA (Formaldehido 5ml, ácido acético 5ml y alcohol etílico 70% 90ml) (Figura 2), para conservar la estructura morfológica. Tanto de la parte media y basal, se prepararon muestras de las partes adaxial y abaxial de la hoja; y además se colectaron muestras de la parte media y el extremo (borde) de las secciones antes indicadas (ver Figura 2) Borde PARTE MEDIA -Extracción de epidermis -Cortes de Secciones transversales/longitudinales Central PARTE BASAL Figura 2. Secciones muestreadas de la hoja de Puya nítida. Se tomaron muestras de la parte media y basal de cada hoja colectada, además se diferenció la parte central y el borde de la hoja. La figura muestra la parte adaxial, sin embargo considerar que se muestreó también la parte abaxial. 2.4. Evaluación de las estructuras morfológicas de las hojas de bromelias. 16 En primer lugar se procedió a la obtención de láminas semipermanentes, a través de cortes paradérmicos transversales y longitudinales. Para los cortes transversales se utilizó la técnica a mano alzada desarrollado por Johansen (1940), a continuación se presenta el resumen del procedimiento que se utilizó para obtener las láminas semipermanentes: - Se seleccionó la región media (es decir la parte más ancha de la lámina) y la región basal de cada hoja. Selección de pequeñas porciones de material vegetal, aproximadamente (1cm x 2cm) de la parte media y del borde de las regiones antes mencionadas. Se prosiguió a cortar con la ayuda de una hojilla de afeitar. Se colocaron cada lámina en hipoclorito de sodio al 5%, por unos tres minutos aproximadamente, hasta ver que el tejido cambia de color. Posteriormente se procedió a lavar las muestras con agua destilada A continuación se tiñeron con azul de toluidina (al 0,01%) por aproximadamente dos minutos, o hasta observar que se tiña la muestra.. Finalmente se montaron en porta objetos utilizando glicerina-agua (1:1) y las preparaciones se sellaron con esmalte transparente para uñas (Salas et al. 2001). Para los cortes paradérmicos (obtención de la epidermis adaxial y abaxial), se realizó a través de macerado con hipoclorito de sodio al 5.5%, a través del siguiente procedimiento: Se colocó las porciones de material vegetal aproximadamente (1cm x 2cm) de la parte media (adaxial y abaxial) en hipoclorito de sodio al 5.5% con agua (1:1) aproximadamente por 48 horas dependiendo de la especie. Luego se lavaron las muestras con agua destilada. Posteriormente, se procedió a separar la epidermis con la ayuda de una aguja histológica. Se tiñeron con azul de toluidina 0.01% por aproximadamente 1 minuto hasta ver que el tejido se tiña. Las muestras se montaron en porta objetos con glicerina-agua (1:1) y se sellaron con esmalte transparente para uñas, siguiendo las recomendaciones de Salas et al. (2001). Para la obtención de láminas a través de cortes longitudinales, se realizó siguiendo el mismo procedimiento que para los cortes transversales. 17 Una vez obtenidas las láminas de cada sección (20 por especie); se procedió a observar la epidermis, cortes transversales y longitudinales tanto adaxiales y abaxiales. Para ello se utilizó un microscopio óptico Labomed Lx 400 con aumentos de 10x, 20x y 40x. Finalmente, se procedió a realizar fotografía de cada estructura observada, en el microscopio axiostar plus con aumentos de 10x, 40x y 100x con cámara digital adaptada al microscopio marca Canon EOS Rebelt t2i con un lente macro Canon 60mm. 2.5 Metodología para diseñar una herramienta para la identificación de bromelias en estudios de dieta de herbívoros. Con la información generada en el primer objetivo, se construyó una clave de identificación para las tres especies de Puya estudiadas. Para ello, se sistematizaron los resultados obtenidos en los diferentes análisis anatómicos foliares, los cuales fueron agrupados siguiendo patrones estructurales y procedimientos estandarizados para la construcción de claves dicotómicas que permitan diferenciar cada especie. Los caracteres de diagnóstico se detallan en las tablas 1, 2 y 3. Las cuales se las puede observar en la sección de resultados. Para el establecimiento de la clave dicotómica se consideraron las siguientes variables: - En la epidermis: tipo de tricoma, ubicación de los estomas (adaxial/abaxial), nivel de estomas en la epidermis, y cámara subestomática - En el sistema fundamental: tipo de parénquima, y grado de lignificación de las paredes. - En el sistema vascular: prolongación de la vaina, y presencia de vaina parenquimatosa. 18 CAPÍTULO 3. RESULTADOS 19 3.1. Caracterización anatómica de Puya eryngioides Tejido epidérmico La parte basal de las hojas de P. eryngioides presentan células de epidermis ovaladas casi planas con lumen reducido, aparentemente incluye cuerpos de sílice casi esféricos (Figura 3) la hipodermis no se distingue claramente de las células del parénquima acuífero en la cara adaxial (Figura 3A), mientras que en la superficie abaxial la hipodermis está formada por una capa de células de forma redondeada con paredes ligeramente engrosadas anticlinalmente y también ligeramente esclerificadas (Figura 3B); y el contorno de la epidermis superior o adaxial es ligeramente ondulado, mientras que el contorno de la superficie inferior o abaxial es lisa. A B Figura 3. Sección transversal de la epidermis de P. eryngiodes. (A) epidermis adaxial con células ovaladas con lumen reducido e hipodermis no diferenciada con el parénquima acuífero; (B) epidermis abaxial con células ovaladas e hipodermis formada por una capa de células ligeramente esclerificadas. Barra = 100um La vista paradérmica de la parte media de la lámina foliar revela que las epidermis adaxial y abaxial, están formadas por células rectangulares de paredes engrosadas, sinuosas en mayor o menor grado, dependiendo de su posición sobre las nervaduras o zonas intercostales (Figura 4A-D). 20 A C B D Figura 4. Vista paradérmica de la lámina foliar de la parte media de la epidermis adaxial y abaxial de P. eryngiodes. (A) células de la epidermis adaxial constituidas por células rectangulares con paredes engrosadas; (B) células de la epidermis abaxial formada por células rectangulares con paredes engrosadas, sinuosas y mostrando el patrón de distribución de estomas; (C) detalle de la superficie adaxial; (D) detalle de superficie abaxial. Barra 100um Además, los cortes transversales revelan que ambas epidermis de la lámina foliar son uniestratificadas con células ovalada a poligonales, con pared tangencial externa y pared radial relativamente delgadas, sin embargo la pared tangencial interna es muy engrosada, formando un lumen muy reducido (Figura 5A y 5B). La hipodermis presenta un número variable de capas que van de dos a tres capas de células, con engrosamiento desuniforme, tienen una pared externa más delgada en comparación con la pared interna y presentan células esclerificadas en la cara abaxial (Figura 5B), mientras que en la cara adaxial la hipodermis presenta una sola capa con células ligeramente esclerificadas, aparentemente las células son más engrosadas en la cara abaxial (Figura 5A). Tanto la epidermis adaxial como la abaxial de la parte media son lisas y no presentan ondulaciones. Y se encuentra revestida por una cutícula engrosada. 21 A B Figura 5. Vista frontal de la lámina foliar de la parte media de la epidermis e hipodermis adaxial y abaxial de P. eryngioides. (A) epidermis de la superficie adaxial con pared tangencial interna muy engrosada, seguida por una capa de hipodermis ligeramente esclerificadas; (B) epidermis e hipodermis abaxial mostrando engrosamiento desuniforme que delimitan un lumen muy reducido con células esclerificadas. Barra = 100um. Las hojas de P. eryngiodes son hipoestomáticas, es decir sus estomas se encuentran únicamente en la cara abaxial, ubicándose en las zonas costales e intercostales de la lámina (Figura 4B). Los estomas están constituidos por cuatro células subsidiarias, dos laterales y dos polares, por lo que se clasifican como tetracíticos (Figura 6A). Con los cortes transversales en la cara abaxial se observó la presencia de cámara subestomática, y además se observó que las células oclusivas presentan engrosamiento de pared y están ubicadas al mismo nivel que las células epidérmicas. csl cst cs B A Figura 6. Vista paradérmica de la parte media de la lámina foliar de P. eryngiodes. (A) detalle del estoma tetracítico formado por cuatro células subsidiarias; csl= célula subsidiaria lateral, cst = célula subsidiaria terminal; (B) estoma al mismo nivel de las células epidérmicas, detallando la cámara subestomática; cámara subestomática=cs. Barra= 50um (Figura A); 100um (Figura B). 22 En la superficie superior de la lámina foliar se presentaron tricomas tipo escamas peltadas, distribuidas en surcos longitudinales y constituidos por un número muy variable de células (Figura 6B). Están compuestos por tres partes: un disco central, un pie o base y un ala, Derwidueé y González (2010). Las células periféricas son alargadas. La base del tricoma está formado por paredes engrosadas, es hundida en depresiones epidérmicas y multicelular compuesta por células esclerenquimáticas tipo esclereidas (Figura 7A-B). A B Figura 7. Vista frontal de la lámina foliar de hoja de P. eryngioides, (A) detalle de la base de la escama peltada compuesto por más de dos células; (B) detalle de la escama pelta (tricoma) con sus alas alargadas. Barra = 100um. Sistema fundamental El mesófilo es el conjunto de tejidos ubicados entre las dos epidermis. Desde la parte adaxial hacia adentro, se encuentra un parénquima acuífero de tamaño variable, seguido de parénquima en empalizada y clorénquima. En la parte media de la lámina, el parénquima acuífero está compuesto por células redondeadas con paredes celulares muy tenues, son translucidas y de diversos tamaños (Figura 8C). A continuación se encuentra el parénquima en empalizada, el cual está formado por células alargadas con un número variado de capas que pueden ser de tres a cuatro células, y finalmente se encuentra el parénquima esponjoso con pequeños espacios intracelulares, el cual está formado por cinco a ocho capas de células y que presenta mayor cantidad de cloroplastos (Figura 8A). En la parte basal de la lámina, se encuentran los haces vasculares en su zona media, y alrededor de estos se encuentra el parénquima acuífero que presenta diferencias de tamaño ya que el de la superficie adaxial las células son grandes y ovaladas con las paredes anticlinales y periclinales ligeramente engrosadas, mientras que en la superficie abaxial las células son pequeñas y redondeadas, ligeramente esclereficadas (Figura 8D). El aerénquima 23 presenta canales longitudinales de aireación situados entre los haces vasculares, estos canales están atravesados por células braciformes irregulares los cuales presentan una ligera prolongación hacia la superficie abaxial (Figura 8B y 8D). pa B es A D C E Figura 8. Vista frontal de la lámina foliar de la parte media y basal de P. eryngiodes. (A) parte media, parénquima en empalizada formado por células alargadas y parénquima esponjoso con pequeños espacios intracelulares; (B) parte basal, aerénquima con canales longitudinales situados entre los haces vasculares; (C) parte media de la lámina foliar mostrando su parénquima acuífero redondeadas con paredes celulares muy tenues; (D) detalle del aerénquima de la parte basal; (E) parte basal de la lámina foliar mostrando el parénquima acuífero formado por células de diferentes tamaños. Barra 100um 24 Sistema vascular En la parte media de la lámina, los haces vasculares son colaterales cerrados de diferentes tamaños pudiendo encontrarse grandes y alargados, pequeños y alargados; y pequeños y cortos, los cuales se encuentran alternados (Figura 9A y Figura 9B). Se encuentran rodeados por fibras en forma de vaina o casquetes fibrosos. La vaina parenquimática está compuesta por células redondeadas de diversos tamaños, a veces es interrumpida por el esclerénquima del haz y se observa que están asociadas a los haces vasculares. Tanto los haces grandes como los pequeños tienen conexión con la epidermis en la cara abaxial, por ello se denominan transcurrentes. Los haces de mayor tamaño se prolongan hacia ambas caras de la epidermis, hacia la cara adaxial colindando con el parénquima acuífero y hacia la cara abaxial contiguo con la hipodermis, mostrando claramente extensiones de las vainas de los haces. En los bordes de la hoja se observó que en ocasiones los haces se conectan entre sí, es decir que existen haces con anastomosis (Figura 9C). Además se observó conexiones entre los haces de mayor a menor longitud a través de las comisuras (Figura 9B). En la parte basal, la haces vasculares están rodeados por fibras, presenta diferentes tamaños, alternándose los más grandes con los más pequeños, los de mayor tamaño están rodeados por células esclerenquimáticas mientras que en los de menor tamaño se extienden hacia la cara abaxial (Figura 8B,D). CH A B 25 AN C Figura 9. Vista frontal de la lámina foliar de P. eryngioides, (A) detalle de los haces vasculares rodeados por fibras en forma de vaina o casquetes fibrosos; (B) detalle de la comisura del haz (CH); (C) detalle de los haces vasculares con anastomosis (AN). Barra = 100um 3.2 Caracterización anatómica de Puya maculata Tejido epidérmico Las epidermis adaxial y abaxial de la parte media están formadas por células rectangulares de paredes ligeramente engrosadas (Figura 9A, B), siendo las células epidérmicas más sinuosas en la cara abaxial (Figura 9B, D). La cutícula es delgada, sin embargo en la superficie abaxial y sobre la cutícula se observa una capa espesa, que podría ser cera (Figura 9B, E). A B 26 C D E Figura 9. Vista paradérmica de la parte media de la epidermis adaxial y abaxial P. maculata (A) superficie adaxial con paredes ligeramente engrosadas; (B) superficie abaxial, con escamas que se distribuyen en hileras longitudinales; (C) detalle de superficie adaxial mostrando las células rectangulares; (D) detalle de la superficie abaxial mostrando las células epidérmicas sinuosas; (E) detalle de la superficie abaxial mostrando una capa espesa sobre la cutícula. Barra = 1ooum En los cortes transversales de la zona media se observó que ambas epidermis de la lámina foliar son uniestratificadas y ligeramente engrosadas. En la cara adaxial las células de la epidermis presentan lumen reducido, mientras que en la cara abaxial la forma de las células son poligonales y aparentemente con presencia de pequeños cuerpos de sílice. Se observa una hipodermis de tipo mecánico, que cumple su función estructural, presentando células rectangulares o poligonales, cuyas paredes se presentan uniformemente engrosadas y ligeramente lignificadas. En la superficie adaxial la hipodermis presenta de una a dos capas de células ligeramente esclerificadas (Figura 10A), mientras que en la superficie abaxial las células de la hipodermis presentan células esclerificadas, rectangulares a poligonales, paredes anticlinales, con un engrosamiento desuniforme, y presenta cuatro capas de células estando más desarrollada en comparación con la cara adaxial (Figura 10B). El contorno de la 27 epidermis adaxial es lisa a ondulada y la epidermis abaxial es fuertemente ondulada (Figura 10). En ambas capas presenta cutícula delgada, sin embargo en la superficie abaxial se observan pequeñas proyecciones. s A B Figura 10. Vista frontal de la epidermis de la parte media de la lámina foliar de Puya maculata. (A) superficie adaxial con células poligonales y mostrando la hipodermis con paredes ligeramente esclereficadas; (B) epidermis de superficie abaxial mostrando cuerpos de sílice (s), e hipodermis desarrollada con células rectangulares a poligonales, además se observa la cámara subestomática; cámara subestomática =cs. Barra = 100um En cortes transversales de la región basal de la hoja de P. maculata se observó que la epidermis es uniestratificada y que las células epidérmicas son casi planas con lumen reducido (Figura 11A-B). La hipodermis adaxial y abaxial presenta una capa de células ovaladas a rectangulares con paredes tangenciales ligeramente engrosadas. La cutícula es gruesa presentando en el contorno de la superficie abaxial una capa de espesor fuera de lo epidérmico, que puede ser cera 28 B A Figura 11. Vista frontal de la epidermis de la parte basal de P. maculata (A) superficie adaxial mostrando la epidermis uniestratificada con lumen reducido e hipodermis con células ovaladas; (B) epidermis abaxial mostrando cutícula espesa e hipodermis con una capa de células. Barra 100um Las hojas de P. maculata son hipoestomáticas, tienen los estomas al mismo nivel de las células epidérmicas. El estoma está constituido por cuatro células subsidiarias dos laterales y dos polares (Figura 12A), la clasificación de éstas estructuras se describe como tetracítico. Los estomas se distribuyen en las crestas a lo largo de las hojas (Figura 12B). La cámara subestomática varía en profundidad y se comunica con el clorénquima. es cst csl t B A 29 Figura 12. Vista paradérmica de la lámina foliar de P. maculata. (A) detalle del estoma tetracítico formado por cuatro células subsidiarias, csl = célula subsidiaria lateral, cst = célula subsidiaria terminal; (B) superficie abaxial, patrón de distribución de estomas (es) y tricomas (t), células epidérmicas de paredes rectangulares y sinuosas. Barra = 50um=A; 100um=B En la superficie superior de la lámina foliar se presentaron tricomas tipo escamas peltadas, los cuales se distribuyen en hileras longitudinales (Figura 12B), las escamas se insertan en los surcos y su porción peltada se extiende sobre las crestas, cubriendo completamente a los estomas. Las escamas están constituidos por un número muy variable de células (Figura 13A, B, C). El escudo que a menudo es asimétrico y aparentemente formado por dos células centrales, de tres a cuatro anillos de células con paredes de forma ovalada, ligeramente interconectadas y dispuestos concéntricamente con las células centrales. Estas escamas se insertan en filas paralelas al eje longitudinal de la hoja (Figura 12B). A B C Figura 13. Detalle de los tricomas de P. maculata. (A-B) vista paradérmica escama peltada, constituido por un número variable de células; (C) detalle de la base del tricoma en vista frontal. (D) detalle de las alas periféricas del tricoma en vista frontal. Barra = 100um Sistema fundamental 30 En la parte media el parénquima acuífero está formado por células aparentemente isodiamétricas, que presentan paredes delgadas con rafidios (estructuras alargadas parecidos a un alfiler de oxalato de calcio) y sin espacios intracelulares (Figura 14). r Figura 14. Detalle del parénquima acuífero formado por células alargadas con presencia de rafidios (r) El clorénquima está formado por células en empalizada que a su vez están formadas por tres a cinco capas de células (Figura 15B), y por células emparejadas que delimitan pequeños espacios de aire con forma isomorfica y con presencia de cloroplastos. Este está constituido por tres a ocho capas de células también llamadas canales de aire o aerénquima (Figura 15A). Estos canales de aire usualmente están continuos a la hipodermis en la superficie abaxial, con células isodiamétricas de proyecciones cortas. Se disponen intercaladamente con los haces vasculares y se extienden de vez en cuando con la hipodermis de la superficie abaxial. Las células del clorénquima se disponen de forma concéntrica alrededor de los haces vasculares. Se observó presencia de canales secretores (cs) dispersos (Figura 15A). ae pe A B Figura 15. Vista frontal de la parte media de la lámina de Puya maculata; (A) detalle del parénquima aerífero con células isodiamétricas, presencia de canales secretores (cs), ae = aerénquima; (B) detalles del parénquima en empalizada formada por células alargadas que se dispone en forma concéntrica alrededor de los haces vasculares, pe= parénquima en empalizada. Barra = 100um. 31 En la región basal el parénquima acuífero está formado por células redondeadas y ubicado en las superficies adaxial y abaxial, presentando rafidios (Figura 16A). El aerénquima está formado por células de forma isodiamétrica de brazos largos con cloroplastos, se ubican en cámaras casi redondeadas a los costados de los haces vasculares (Figura 16B). cac r A B Figura 16. Vista frontal de la parte basal de la lámina foliar de P. maculata. (A) detalle del parénquima acuífero formado por células redondeadas con presencia de rafidios (r). (B) detalle de los canales de aire con cámaras casi redondeadas (cac). Barra = 100um Sistema vascular En la región media los haces vasculares son colaterales cerrados, están conectados con la hipodermis abaxial por células alargadas, dispuestos en una única serie, estos difieren en tamaño y en general los más grandes se alternan con las más pequeños (Figura 15B). Los haces vasculares de mayor tamaño están rodeados parcialmente o completamente por una vaina. Los haces de menor tamaño tienen casquetes que son más alargados que anchos. Se observó haces vasculares transversales o comisuras, que cruzan entre los canales aéreos y 32 parénquima en empalizada, conectando con los principales haces longitudinales (Figura 17 A). En la parte basal los haces vasculares están ubicados en el centro de la lámina, son de tipo colateral varían su tamaño, alternándose los mayores con los menores están rodeados por fibras en forma de una vaina, conectados entre sí (Figura 17B) Los más grandes están rodeados por fibras esclerenquimáticas y externamente por una vaina. Los más pequeños presentan prolongaciones hacia la superficie abaxial. c V B A Figura 17. Vista frontal de los haces vasculares de la parte media y basal de la lámina foliar de P. maculata. (A) parte media, detalle de las comisuras del haz, que se conectan con los principales haces longitudinales; (B) parte basal, detalle de los haces vasculares formados por una vaina (v), conectados entre sí. Barra = 50um (B) 3.3 Caracterización anatómica de Puya nítida Tejido epidérmico La cara adaxial de la epidermis de la parte media presenta células casi isodiamétricas, polimórficas con paredes desigualmente engrosadas (Figura 18A, C), mientras que su cara 33 abaxial está formada por células rectangulares de paredes engrosadas, sinuosas (Figura 18B, D). A C B D Figura 18. Vista paradérmica de la epidermis de la parte media de la lámina foliar de P. nítida. (A) superficie adaxial con células polimórficas con paredes desigualmente engrosadas; (B) superficie abaxial con células rectangulares con paredes engrosadas sinuosas; (C) detalle la epidermis adaxial; (D) detalle de la superficie abaxial. Barra = 100um En los cortes transversales de la región media se observó que ambas epidermis (adaxial y abaxial) de la lámina foliar son uniestratificadas. Las células de la epidermis son redondeadas y más pequeñas en relación con las células de la hipodermis. Las células epidérmicas tienen un lumen reducido debido al engrosamiento de las paredes periclinales internas y anticlinales (Figura 19A). La hipodermis es de tipo mecánica y varia de uno a cuatro capas de células esclereficadas, de forma rectangular con paredes ligeramente engrosadas. En la superficie 34 adaxial la capa de la hipodermis comprende una a tres células, las cuales tienen lumen reducido, menor al observado en las células epidérmicas (Figura 19A). La hipodermis de la superficie abaxial es más desarrollada y está formada por dos a cuatro capas de células (Figura 19B). En los bordes de la lámina se observó que la hipodermis está compuesta por ocho capas de células esclereficadas ligeramente engrosadas y de forma poligonal. Aunque la cutícula es delgada, el contorno de la lámina foliar muestra que es lisa tanto para la superficie adaxial como la abaxial. A B Figura 19. Vista frontal de la parte media de la lámina foliar de P. nítida. (A) superficie adaxial mostrando una hipodermis con células esclereficadas compuesta por dos a cuatro capas de células; (B) superficie abaxial mostrando la hipodermis más desarrollada. Barra = 100um En cortes transversales de la región basal de la hoja de P. nítida se observó una cutícula delgada y además que la epidermis está formada por una capa de células rectangulares con paredes desigualmente engrosadas en ambas superficies y con lumen reducido. Aparentemente se observan cuerpos de sílice de forma esférica (Figura 20B). En la superficie adaxial las paredes son delgadas presentando una hipodermis no muy desarrollada (Figura 20A) como la de la superficie abaxial, además la superficie adaxial está formada por una capa de células, mientras que la abaxial está formada por una a dos capas de células de paredes esclereficadas. 35 A B Figura 20. Vista frontal de la parte basal de epidermis e hipodermis de la hoja de P. nitida (A) superficie adaxial mostrando las paredes delgadas; (B) superficie abaxial mostrando paredes ligeramente engrosadas y esclereficadas. Barra La hoja de P. nítida es hipostomática, encontrandose sus estomas al mismo nivel de las células epidérmicas. Se encuentran ubicados en las zonas costales e intercostales de la lámina. Están constituidos por cuatro células subsidiarias, dos laterales y dos polares, por lo cual se clasifican como tetracítico (Figura 21A). Presenta estomas expuestos, es decir que las escamas de los tricomas no los cubren totalmente. La cámara subestomática (Figura 21B) puede estar parcialmente ocluida debido a la ampliación de las células subsidiarias debajo de las células de guarda. 36 cst csl A B cs Figura 21. Vista paradérmica de la lámina foliar de P. nítida; (A) detalle del estoma tetracítico constituido por cuatro células subsidiarias; csl = células subsidiarias laterales, cst = células subsidiaria terminal; (B) detalle de la cámara subestomática (cs). Barra = 50um (A); 100um (B) Los tricomas, formados de tres partes fundamentales (ala, pedúnculo y disco), son peltados y se encuentran en ambas superficies de la lámina, pero en la superficie abaxial son más abundantes. En ambas partes se distribuyen en hileras longitudinales y se disponen en ranuras en las zonas intercostales, asociados con los estomas. En vista frontal se observa que están localizados en una concavidad de la epidermis (Figura 22A), y sus células del disco aparentemente están formadas por 8 células, rodeadas por 16 células periféricas y una gran cantidad de células que conforman el ala (Figura 22B). A B 37 C Figura 22. Tricoma escamoso de la lámina de P. nítida. (A) vista frontal; (B-C) vista paradérmica que muestra algunas de las células que lo conforman. Barra = 200um (Figura A); 50um (Figura B-C). Sistema fundamental En la zona media el parénquima acuífero está formado por células alargadas, de paredes delgadas y sin espacios intracelulares. Ocupa más de la mitad de la lámina foliar, sus células poseen un citoplasma claro muy vacuolizado y presentan rafidios (Figura 23A). El paso entre el parénquima acuífero a clorénquima en empalizada es abrupto. El clorénquima está formado por células en empalizada y por células que delimitan espacios de aire. El parénquima en empalizada está formado por células alargadas de tres a cuatro capas que se disponen de forma concéntrica alrededor de los haces vasculares (Figura 23B). En el parénquima aerífero los canales de aire están situados entre los haces vasculares. Estos canales están contiguos a la cámara subestomática y están atravesados por diafragmas formados por células braciformes (Figura 23C). A menudo constituyen un largo sistema de aireación (Figura 23D) que se extiende continuamente en casi toda la lámina; éste está formado por células estrelladas con brazos cortos que delimitan grandes espacios de aire o con brazos cortos que forman pequeños espacios, ambos presentan abundantes cloroplastos (Figura 23C). Se distribuyen intercalando con los haces vasculares y se extienden escasamente con la superficie abaxial de la lámina foliar. 38 R A B C D Figura 23. Sección transversal y longitudinal de la parte media de la lámina foliar de P nítida. (A) detalle del parénquima acuífero con rafidios (r); (B) detalle del mesófilo destacando el clorénquima y el aerénquima y la distribución en serie de los haces vasculares; (C) detalle del parénquima aerífero por canales de aire ocupados por diafragmas de células braciformes; (D) detalle del parénquima aerífero, vista longitudinal; barra = 100um En la región basal el parénquima acuífero está formado por células de paredes delgadas anticlinales, además algunas veces constituido por dos tipos de células redondeas y alargadas. El parénquima acuífero está ubicado en ambas superficies, presenta idioblastos con rafidios (Figura 24A). En la superficie adaxial las células son redondeadas y sus paredes anticlinales y periclinales son delgadas; mientras que en la superficie abaxial las células del 39 parénquima acuífero son más alargadas y adyacentes a la hipodermis abaxial, y además se observan redondas hacia el interior del mesófilo (Figura 24A). El clorénquima está formado por células de forma estrellada que delimitan espacios de aire con brazos largos, frecuentemente con cloroplastos, se ubican en columnas alargadas a los costados de los haces vasculares (Figura 24B). En ocasiones estos canales de aire se prolongan hacia la cara abaxial. cac A B Figura 24. Vista frontal de la parte basal de la lámina foliar de P. nítida. (A) parénquima acuífero constituido por dos tipos de células; (B) detalle de las columnas alargadas del aerénquima, L = lumen, EI = espacios intracelulares. Barras: A = 200um; B=50um Sistema vascular La región media presenta haces colaterales cerrados, distribuidos en una serie única y de tamaños variables, unos pequeños y otros más grandes que están de forma alternada (Figura 23B). Están conectados con la hipodermis de la cara abaxial por células redondeadas. Los haces más grandes están parcialmente rodeados por fibras (y en ocasiones completamente rodeados) en forma de una vaina con células casi isodiamétricas y ligeramente engrosadas que también se observan entre el xilema y el floema, además se encuentran cubiertos por una 40 capa de fibras, que pueden extenderse hacia ambas superficies, presentando punteaduras. Los más pequeños están formados por fibras rodeados parcialmente por una vaina con alargadas extensiones hacia ambas superficies (Figura 25). Figura 25. Detalle del haz vascular grande rodeados por en forma de una vaina con células isodiamétricas y ligeramente engrosadas que también se observan entre el xilema y el floema En la parte basal los haces vasculares son de tipo colateral cerrado de tamaños variables alternándose los más grandes con los más pequeños. Los de mayor tamaño tienen gran cantidad de fibras envolviendo a los haces y externamente están rodeados por una vaina con células casi isodiamétricas. Los de menor tamaño están completamente rodeados por una vaina y presentan extensiones de la vaina con paredes engrosadas hacia ambas superficies (Figura 25). 3.4 Diseño de una clave para la identificación de especies del género Puya orientado a estudios de dieta de herbívoros. 41 Con la ayuda de la combinación de las características anatómicas fue posible realizar la clave de identificación para las tres especies estudiadas del género Puya. Se encontraron características particulares en la epidermis de cada una de las especies, las cuales podrían ser utilizadas para su identificación (Tabla 1). En esta vemos que los tricomas son distintos en cada especie. Características Especies Estomas al nivel de la epidermis Presencia de cuernos cuticulares Presencia de cámara subestomática Tabla 1. Características de los estomas y de los tricomas de las tres especies estudiadas. Simbología: ad = adaxial, ab = abaxial; + = presencia, - = ausencia; AL = alargado, SC = semicircular, OB = oblongo Puya eryngioides + - + Puya maculata + + + Puya nítida + - + Presencia de escamas peltadas en la superficie adaxial o abaxial Forma de los tricomas ad AL ab SC ad/ab OB Fuente: Elaboración de la autora También se pudo observar diferencias en las células que conforman la hipodermis tanto en su estructura como en su composición, al igual que la forma del contorno de la epidermis (Tabla 2). Tabla 2. Características del contorno de la epidermis y de la estructura y composición de la hipodermis foliar de las tres especies estudiadas. Simbología: (LO = ligeramente ondula; FO = fuertemente ondulada; L/O = lisa a ondulada; L=lisa; EG = engrosada; LG = ligeramente engrosada; + = presencia; - = ausencia) Especies Características Contorno de la superficie adaxial Media Basal Contorno de la superficie abaxial Media Basal Hipodermis esclereficada adaxial Número de capas de células media basal Paredes de la células Hipodermis esclereficada abaxial Número de capas de células media Basal Paredes de las células Puya eryngioides Puya maculata L LO L L 1 - LG 2-3 1 EN L/O LO FO L/O 1-2 1 EN 4 1 EN Puya nítida + - + - 1-3 1 EN 2-4 1-2 EN Fuente: Elaboración de la autora Por otra parte se observaron las características del sistema fundamental y del sistema vascular de cada una de las especies estudiadas, en los cuales se pudo evidenciar estructuras presentes en una especie y ausentes en la otra (Tabla 3). 42 Tabla 3. Características anatómicas observadas en el sistema fundamental y el sistema vascular de la lámina foliar de las tres especies estudiadas (Simbología: + = presencia) Puya nítida Forma de las células Haces vasculares rodeados completamente por una vaina Columnas alargadas Número de capas de células Canales aeríferos Cámaras casi redondas Parénquima aerífero Canales longitudinales Características Especies Puya eryngioides Puya maculata Parénquima en empalizada Haces vasculares rodeados parcialmente por una vaina Media Basal Media Basal 3-4 Irregulares/ alargadas + - - + + - - 3-5 Isodiamétricas - + - + + + + 3-4 Estrelladas - - + + + + + Fuente: Elaboración de la autora Del análisis y combinación de caracteres morfoanatómicos se determinó la siguiente clave para la identificación de las tres especies del género Puya. 1. Estomas al mismo nivel de las células epidérmicas 2. Parénquima acuífero con idioblastos portadores de rafidios 3. Parénquima en empalizada con 3-4 capas de células ……………………………………………………………………………………..Puya nítida 3. Parénquima en empalizada con 2-3 capas de células 4. Escamas solo en una superficie ………………………………………………………………………………………..Puya maculata 2. Parénquima acuífero sin idioblastos portadores de rafidios 5. Células del canal aerífero con proyecciones cortas isodiamétricas; canales longitudinales ……………………………………………………………………………………….Puya eryngioides 43 DISCUSIÓN 44 A continuación se realiza un breve análisis de los aspectos más importantes de este trabajo investigativo. La discusión se centra por un lado en el proceso metodológico seguido en este estudio; y por otro lado en el análisis y evaluación de las implicaciones de los estudios morfológicos en estudios más aplicados. 4.1. Aspectos metodológicos para estudios morfoanatómicos En general la mayoría de estudios anatómicos inician con la generación de información que sirve como línea de base para futuros estudios aplicativos (Benzing, 1990; Pita y Meneses, 2002; Horres et al., 2007); es decir se orientan a realizar descripciones generales de las estructuras morfológicas de grupos de especies vegetales de interés particular. Los estudios anatómico-descriptivos de especies vegetales han tomado mayor relevancia durante las últimas décadas, especialmente en el neotrópico (Tomlinson, 1969; Brighigna et al., 1984; Benzing, 1990; Pita y Meneses, 2002; Horres et al., 2007), sin embargo en el Ecuador este tipo de investigaciones son todavía incipientes. En la mayoría de estos estudios ha sido muy común utilizar la metodología propuesta por Johansen en 1940, que se denomina cortes a mano alzada, la misma que es muy económica y no requiere de instrumentos sofisticados; pero, también existen otras metodologías que han incorporado instrumentos tecnológicos para mejorar los estudios anatómicos; por ejemplo dentro de estas se menciona la propuesta por D´Ambrogio (1981) quien usa el micrótomo para realizar los cortes; también se menciona las técnicas de fotometría utilizada por Tomlinson (1969), la para la identificación de tricomas, estomas y mesófilos. En este estudio, se usó la metodología propuesta por Johansen en 1940, a pesar de ser una técnica desarrollada a mediados del siglo anterior, sigue siendo una de las mejores opciones por los buenos resultados que se obtienen con ella, y sobre todo por lo sencilla y económica que resulta. 4.2. Implicaciones de los estudios morfológicos Las estructuras observadas en el presente estudio permiten afirmar que las características morfoanatómicas constituyen un insumo importante en la taxonomía y ecología de la familia Bromeliaceae, lo cual coincide con Braga (1977), que menciona la versatilidad estructural de las hojas de Bromeliaceae ya que constituyen una importante fuente de datos que podrían 45 originar teorías de orden filogenético, ontogénico, fisiológico, ecológico y taxonómico; otros estudios complementan esta idea, entre ellos se mencionan los realizados por Tomlinson (1969), Robinson (1969), Aoyama & Sajo (2003), Proença & Sajo (2007) Derwidueé y González (2010). De acuerdo a las observaciones obtenidas en vista paradérmica se pudo evidenciar que la epidermis de las tres especies de Puya están formadas por células rectangulares de paredes engrosadas sinuosas, lo cual también ha sido reportado en otras especies de la familia Bromeliaceae. Las paredes engrosadas y sinuosas se adhieren con las células hipodérmcas, lo cual representa una adaptación para mantener la superficie de contacto con otras células durante la expansión y contracción foliar originadas por variación de turgor (Tomlinson 1969; Krauss 1949; Flores-Vindas 1999; Proença & Sajo 2007). Las escamas foliares como menciona Benzing (1980) son una herramienta útil, es decir son relevantes para poder diferenciar entre especies. Para las especies estudias la distinción entre el disco y el ala no fue tan evidente. Sin embargo este autor menciona que los tricomas peltados cuentan con una o cuatro células centrales o disco central. La distribución de las escamas en las tres especies de Puya fue en hileras longitudinales, lo cual es una las características de la familia Bromeliaceae (Strehl 1983; Benzing et al. 1985; Proença & Sajo 2007; Scatena & Segecin 2005). Sin embargo se observaron patrones en cada especie estudiada, teniendo que las escamas de Puya eryngioides se distribuyen en la superficie adaxial, en Puya maculata en la superficie abaxial y cubren completamente a los estomas, y en Puya nítida se encuentran en ambas superficies, en la superficie adaxial se distribuyen al azar dejando a los estomas expuestos, debido al menor número de escamas. Las escamas cumplen importantes funciones entre las que se destacan: (i) la absorción de agua y nutrientes, (ii) protección, (iii) reflejan la radiación solar y (iv) reducción la transpiración, cualidades básicas y necesarias para el normal desarrolla de las especies vegetales (Tomlinson 1969; Benzing 2000). Por otra parte, una de las características de la subfamilia Pitcairnioideae, es la presencia de los estomas ubicados en la regiones costales e intercostales en la superficie abaxial. Esta ubicación probablemente evita la transpiración excesiva, considerando que las tres especies de Puya se encuentran en condiciones extremas de cambios de temperatura y procesos de transpiración. 46 Es así que las tres especies estudiadas se encontraron los estomas en la superficie abaxial de las láminas foliares y al mismo nivel de las células epidérmicas, este hallazgo también fue observado por Proença & Sajo (2007). La posición de los estomas parece estar más relacionada con la filogenia del grupo, que con las condiciones ambientales donde las especies fueron encontradas (Scatena & Segecin 2005; Proença & Sajo 2007). La hipodermis es esclereficada y está formada por células con paredes engrosadas, este engrosamiento también se observa en el tejido epidérmico, considerándose que puede estar asociado con la reducción de la transpiración, y por ende ayuda a la supervivencia de individuos sujetos a constante estrés hídrico y además ofrece soporte mecánico (Scatena & Segecin 2005). El número de capas de la hipodermis es variable dentro de la familia Bromeliaceae (Tomlinson 1969; Sousa et al. 2005; Almeida 2006). El clorénquima de las tres especies estudiadas está formado por células en empalizada, esto es una característica poco común en la familia de Bromeliaceae y hasta el presente se ha encontrado solo en Puya, Brocchinia, Pitcairnia, Encholirum y Acanthostachys (Tomlinson 1969; Proença & Sajo 2007; Fernándes et al. 2011). Los canales de aire están dispuestos longitudinalmente en cámaras casi redondeadas, delimitados por células emparejadas y en ocasiones están atravesados por diafragmas formados por células braciformes (Aoyoma & Sajo 2003; Scatena & Segecin 2005) su función es facilitar la ventilación de las hoja (Tomlinson 1969; Gilmartin et al. 1989). A menudo estos canales se encuentran conectados con las cámaras subestomática (Proença & Sajo 2007). La conexión entre los canales de aire y la cámara subestomática permite una mayor circulación de gases en el interior de la lámina, además le proporciona una mayor flexibilidad en las hojas (Mauseth 1988). Las células braciformes que atraviesan a los canales de aire pueden ser estrelladas, alargadas o isodiamétricas dependiendo de la especie (Aoyama y Sajo 2003). En Puya maculata y Puya nítida se encontraron rafidios de oxalato de calcio, localizados en el parénquima acuífero también se ha encontrado en los estudios de Proença & Sajo (2007). Según Brighigna et al., (1984) la función de oxalato de calcio es neutralizar la gran cantidad de ácido oxálico producido en las hojas. Estos pueden actuar como mecanismos de defensa en la planta (Ruiz et al., 2002). Algunas funciones adicionales para los cristales son: ayudar a la formación de cámaras aéreas, actuar como soporte estructural o como dispersores o concentradores de los rayos luminosos (Jáuregui-Zúñiga y Moreno 2004). 47 Los haces vasculares están rodeados por células parenquimáticas y fibras que forman una especie de vaina, se distribuyen en una serie única y de tamaños variables como lo establece Krauss (1949). La distribución en una serie única y la presencia de comisura del haz es una característica común en la familia de Bromeliaceae (Reinert et al., 2013; Sousa et al., 2005, Braga 1977). Presentaron extensiones de las vainas de los haces que según Van der Merwe et al. (1994) son comunes en hojas de monocotiledóneas como mencionan estos autores estas estructuras desempeñan un papel primordial en la distribución del agua en el mesófilo, sustentan y protegen a los tejidos vasculares. 48 CONCLUSIONES Luego de haber analizado todas las estructuras anatómicas de las hojas de las tres especies de Puya se puede concluir lo siguiente: - El conocimiento de las características morfoanatómicas de especies vegetales no solo permiten conocer la taxonomía y la autoecología de grupos específicos como en este caso de la familias de las bromeliceas; sino también constituyen insumos básicos para profundizar en el estudio específicos como es el caso de la dieta de herbívoros. - Las tres especies estudias del genero Puya (P. eryngides, P. maculata y P. nítida) presentan una epidermis formada por células rectangulares de paredes engrosadas sinuosas; condición que se ve traducida en que las células se adhieran a las células epidérmicas a la hipodermis. - Las escamas (tricomas) en las tres especies estudiadas se distribuyen en hileras longitudinales, que debe ser considerada como una característica propia de la familia Bromeliaceae. Pero existen pequeñas diferencias entre las especies estudiadas; así por ejemplo la distribución de las escamas de Puya eryngioides es en la superficie adaxial, en Puya maculata en la superficie abaxial y cubren completamente a los estomas, y en Puya nítida se encuentran en ambas superficies. Es decir que esta es una de las características que se puede utilizar para diferenciarlas. - Se determinó que las estructuras típicas (p.ej., la epidermis, la cutícula, el parénquima acuífero, y el parénquima en empalizada); así como las estructuras distintivas (p.ej., los tricomas, canales de aire, y las haces vasculares) de las tres especies de bromelias, pueden ser usadas para construir claves dicotómicas, y constituirse en distintivos que permitan diferenciar especies del genero Puya. 49 RECOMENDACIONES Entre las recomendaciones que han surgido luego de haber culminado ésta investigación, se mencionan las siguientes: Dado que existen pocos estudios relacionados con el conocimiento anatómico de especies vegetales de nuestro país y además conociendo la importancia de los mismos se sugiere continuar con estos estudios, lo cual podrá ayudar en el proceso de identificación de nuestra flora, comprender un poco más de sus adaptaciones en los ecosistemas y seguro será un aporte importante para estudios de dieta de herbívoros. Desarrollar protocolos y manuales para estudios morfoanatómicos donde se incorporen diferentes tipos de técnicas en función de los intereses y objetivos, por ejemplo utilizar técnicas histoquímicas para observar compuestos de plantas y ver niveles de lignificación de las paredes celulares. Articular los resultados resultantes de ésta investigación, con procesos de toma de decisiones, es decir difundir los resultados principales de ésta y otras investigaciones hacia actores encargados de construir instrumentos técnicos y políticos de una manera eficiente. 50 BIBLIOGRAFÍA Aoyama E.M. & Sajo M.G. 2003. Estrutura foliar de Aechmea Ruiz & Pav. subgênero Lamprococcus (Beer) Baker e espécies relacionadas (Bromeliaceae). Revista brasileira de botânica. 26: 461-473. Aguilera A., Guzmán G. & Gonzáles R. 2011. Diversidad y abundancia de la artropofauna en bromelias de bosques de manglar de la bahía de buenaventura (valle, colombia). boletín del museo de entomología de la universidad del valle. 12(1): 1-11. Becking M. 2004. Sistema microregional de conservación Podocarpus. Tejiendo (micro) corredores de conservación hacia la cogestión de una reserva de biosfera cóndorpodocarpus. Programa podocarpus. Loja. Ecuador. Benzing D., Henderson K.; Kessel B. & Sulak J. 1976. The absorptive capacities of bromeliad trichomes. american journal of botany. 63: 1009-1014. Benzing D. 1990. Vascular Epiphytes. General biology and relared biota. Cambridge University Press. USA. pp. Benzing D. 1980. The biology of the bromeliads. Mad River Press, Eureka California USA. pp. Benzing DH. 2000. Bromeliaceae, profile of anadaptive radiation. Cambridge UniversityPress. Cambridge, U.K. 690 pp, Borgnia M. 2009. Estudios aplicados al manejo ambiental en la Reserva Laguna Blanca, Catamarca. Publicación on line de la Universidad de Catamarca: Área Ecología, Editorial Científica UNCA. ISSN 1852-3013. Braga, M.M.N. 1977. Anatomia foliar de Bromeliaceae da Campina. Acta Amazonica 7: 1-74. Brighigna L, Fiordi AC, Palandri MR (1984) Structural characteristics of mesophyll in some Tillandsia species. Phytomorphology 34:191–200 Castellaro G., Squella F., Ullrich R. León F y Raggi S. 2007. Algunas técnicas microhistológicas utilizadas en la determinación de la composición botánica de dietas de herbívoros. Agricultura Técnica. VOL Nº1 p. 86-93. Castellanos A., Altamirano M., Tapia G., 2005. Ecología y comportamiento de osos andinos reintroducidos en la Reserva Biológica Maquipucuna, Ecuador. Implicaciones en la conservación. Politecnica. 26 (1) Biología 6. Catán A., Degano C. & Larcher L. 2003. Modificaciones a la técnica microhistológica de Peña Neira para especies forrajeras del Chaco Semiárido Argentino. Revistas de Ciencias Forestales – Quebracho. 10: 71-75. Cruz S., Garrrido I y Hornung-Leoni C. 2010. Las bromelias como importantes fitotelmata. Bol. Soc. Latin. Carib. Cact. Suc. 7(1) enero-abril. 51 Derwidueé F. & González A. 2010. “Anatomía foliar en Bromeliaceae del nordeste Argentino y Paraguay”. Bonplandia. 19(2): 153-173 D’ Ambrogio A. 1970. Manual de Técnicas en Histología Vegetal. Cátedra de Botánica Agrícola. Facultad de Agronomía. Hemisferio Sur. pp. 83. ECOLAP y MAE 2007. Guía del patrimonio de áreas naturales protegidas del Ecuador. ECOFUND, FAN, DarwinNet, IGM. Quito-Ecuador. Fernandes-Monteiro R., Campostrini-Forzza R. y Mantovani A. 2011. Leaf structure of Bromelia and its significance for the evolution of Bromelioideae (Bromeliaceae). Plant Syst. Springer-Verlag Flores E. 1971. Estudio comparativo de la anatomía foliar de dos especies de Bromeliaceae: Hechtiaglomerata Zucc. y Aechmea mexicana Baker. Editorial San José, Universidad de Costa Rica, CR. pp 74 Flores-Vindas, E. 1999. La planta, estructura y función. Vol II. Libro Universitario Regional. Costa Rica. Pag 883. Goldstein I., Velez X., Paisley S. & Garshelis. 2008. Tremarctosornatus. En: IUCN 2010. IUCN Red List of Threatened Species.Versión 2010.1. www.redlist.org Gilmartin A., Brown G., Varadarajan G., & Neighbours M. 1989. Status of Glomeropitcairnia within evolutionary history of Bromeliaceae. Systematic Botany 14:339-348. Horres R., Zizka G., Kahl G. y Weising K. 2000. Molecular Phylogenetics of Bromeliaceae: Evidence from trmL(UAA) Intron Sequences of the Chotoplast Genome. Plant Biol. 2: 306-315. Horres R., Schulte K., Weising K. & Zizka G. 2007. Systematics of Bromelioideae (Bromeliaceae)—Evidence From Molecular And Anatomical Studies. Aliso 23: 27-43. Horninh-leoni C., Sosa V. 2008. Morphological phylogenetics of Puya subgenus Puya (Bromeliaceae). Botanical Journal of the Linnean Society 156, 93–110 Holechek J.,Pieper R., and Herbel C. 2001. Range management. Principles and practices. 587 p. 4th ed.Prentice Hall, New Jersey, USA. Johansen D. 1940. Plant Microtechnique. Mc Graw Hill, New York. Jáuregui-Zúñiga D y Moreno Cárcamo A. 2004. LA BIOMINERALIZACIÓN DEL OXALATO DE CALCIO EN PLANTAS: RETOS Y POTENCIAL. Departamento de Bioquímica, Instituto de Química, UNAM. Circuito Exterior s/n Ciudad Universitaria. 04510 México D. F. Tel. 5622-4568 Fax. 56162203 Correo E: djauregui@correo.unam.mx Krauss B. 1948. Anatomy of the vegetative organs of the pineapple, Annanas comosus (L.) Merr. Botanical Gazette 110: 159-217. Kraus J. & Arduin, M. 1997. Manual básico de métodos em morfologia vegetal. Seropédica, Edur. 52 Krauss B. 1949. Anatomy of the vegetative organs of the Pineapple, Ananas comosus (L.) Merr. II - The leaf. Botanical Gazette 110: 333-404. Klee G., Pulido R. y J. Chavarría. 2000. Selectividad de ovejas en la utilización de rastrojo de trigo como alimento. Agric. Téc. (Chile) 60:361-369. Lozano P y Bussmann R. 2005 Importancia de los deslizamientos en el Parque Nacional Podocarpus, Loja, Ecuador. Facultad de Ciencias Biológicas UNMSM. Bosques relictos del NO de Perú y SO de Ecuador. Weigend Rodríguez y Arana (Comps.) Rev. perú. biol. 12(2): 195- 202. Versión Online ISSN 1727-9933 Luther H. 2008. An alphabetical list of bromeliad binomials. 11 ed. The Bromeliad Society International, Sarasota Luther H. 2006. An alphabetical list of bromeliad binomials. 10a edición. Bromeliad Society International. Sarasota, Florida, EEUU. 123pp Luther H. 2002. An Alphabetical list of Bromeliad Binomials. Eighth edition. The Marie Selby Botanical Gardens, Sarasota, Florida. Manzanares J.M., 2005. Joyas en la Selva, Bromeliaceae del Ecuador, Parte II, Pitcairnioideae. Imprenta Mariscal. Pág. 241-544. Mauseth J. 1988. Plant Anatomy. The Benjamin/Cummings Publishing Companing, California. p 576. Ontaneda A., y Armijos J. 2012. “Estudio de la composición y variación estacional de la dieta del oso andino Tremarctos ornatus, en los páramos del Parque Nacional Podocarpus – Ecuador”. Tesis de Licenciatura. UTPL. Loja- Ecuador Ortega I., Berger M. & Flores M. 1993. Manual de técnica microhistológica. La Paz - Bolivia.48 pp. Pita P. & Menezes N. 2002. Anatomia da raiz de espécies de Dyckia Schult. f. e Encholirium Mart. ex Schult. & Schult. f. (Bromeliaceae, Pitcairnioideae) da Serra do Cipó (Minas Gerais, Brasil), com especial referência ao velame. Revista Brasileira de Botanica 25:2534. Proença, S. & Sajo M. 2007. Anatomia foliar de Bromélias ocorrentes em areas de cerrado do Estado de Sao Paulo, Brasil. Acta Botanica Brasilera 21: 657-673. Reinert F., LEAL-COSTA M., Junqueira N., and Tavares E. 2013. Are sun- and shade-type anatomy required for the acclimation of Neoregelia cruenta?. Annals of the Brazilian Academy of Sciences. Printed version ISSN 0001-3765 / Online version ISSN 16782690. www.scielo.br/aabc Robinson H. 1969. A monograph on foliar anatomy of the genera Connelia, Cottendorfia and Navia (Bromeliaceae). Smithsonian Contrib. Bot. 2: 1-41 53 Ruiz N, Ward D y Saltz S (2002) Calcium oxalate crystals in leaves of Pancratium sickenbergeri: constitutive or induced defense? Funct Ecol 16: 99-105 Salas J., M.E. Sanabria & R. PIRE. 2001. Variación en el índice y la densidad estomática de plantas de tomate (Lycopersicom esculentum Mill.) sometidas a tratamientos salinos. Bioagro 13: 99-104 Sandoval E. 2005. Técnicas Aplicadas al Estudio de la Anatomía Vegetal. Instituto de Biología. UNAM. Cuadernos 38. México. Sousa G., Maranhão M. & Lapa M. 2005. Anatomia foliar de espécies brasileiras de Aechmea subg. Chevaliera (Gaudich. ex Beer) Baker, Bromelioideae-Bromeliaceae. Revista Brasil. Bot., V.28, n.3, p.603-613. Scatena V., & Segecin, S. 2005. Anatomia foliar de Tillandsia L. (Bromeliaceae) dos Campos Gerais, Paraná, Brasil. Revista Brasileira de Botânica 28: 635-649. Smith L. & Downs J. 1974. Pitcarnioideae (Bromeliaceae). Flora Neotropical Monographs 4: 1-658. Smith L.B. & Downs, R.J. 1979. Bromelioideae (Bromeliaceae). Flora Neotropica Monograph 14: 1493-2142 Stevens P. 2001. Owards. Angiosperm Phylogeny. Sparks, D., and J. Malechek. 1968. Estimating percentage dry weight in diets using a microscopic technique. J.Range Manage. 21:264-265. Strehl T. 1983. Forma, distribuição e flexibilidade dos tricomas foliares usados no filogenia de Bromeliáceas. Iheringia, Serie Botanica 31:105-119. Tomlinson P. 1969. III – Commelinales-Zingiberales. In: C.R. Metcalfe (ed). Anatomy of the Monocotyledons. Clarendon Press, Oxford 3: 1-446. Van Der Merwe. A., Van Der Walt J. & MARAIS E. 1994. Anatomical adaptations in the leaves of selected fynbos species. South African Journal of Botany. 60(2):99-107. 54 ANEXOS Tabla 1. Matriz para la evaluación de las características observadas en la epidermis foliar de las tres especies estudiadas (AB = superficie abaxial; + = presencia y - = ausencia) mismo nivel hundidos Escamas peltados en la superficie Cámara subestomática Características Especies Nivel de estomas en la epidermis Adaxial/ abaxial ambas superficies Forma de los tricomas Puya eryngioides Puya maculata Puya nítida Tabla 2. Matriz para la evaluación de las características anatómicas observadas en la epidermis foliar de las tres especies estudiadas (ligeramente = LG; fuertemente = FT; lisa a ondulada = L/O; engrosada = EG; + = presencia y - = ausencia) Características Especies Contorno de la superficie adaxial Lisa Ondu lada Contorno de la superficie abaxial Lisa Ondula da Hipodermis esclereficada abaxial Hipodermis esclereficada adaxial Número de capas de células Células con paredes engrosad as Número de capas de células Células con paredes engrosa das Puya eryngioides Puya maculata Puya nítida Tabla 3 .Matriz para la evaluación de las características anatómicas observadas de la lámina foliar de las tres especies estudiadas Forma de las células Columnas alargadas Número de capas de células Canales aeríferos Cámaras casi redondas parénquima aerífero Canales longitudinales Características Especies Parénquima en empalizada Haces vascular es rodeados completa mente por una vaina Haces vasculares rodeados parcialmente por una vaina Puya eryngioides Puya maculata Puya nítida 55 A B C Figura 26. Especies seleccionas del genero Puya (Bromeliaceae). (A) Puya eryngioides; (B) Puya maculata; (C) Puya nítida 56