Diapositiva 1
Anuncio
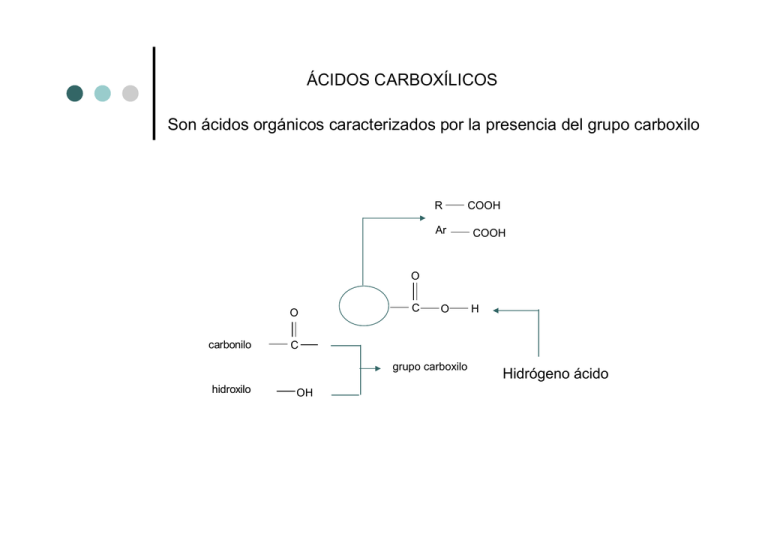
ÁCIDOS CARBOXÍLICOS Son ácidos orgánicos caracterizados por la presencia del grupo carboxilo R Ar COOH COOH O O carbonilo C O C grupo carboxilo hidroxilo H OH Hidrógeno ácido NOMENCLATURA DE LOS ÁCIDOS CARBOXÍLICOS (I) 1. Ácidos carboxílicos alifáticos lineales Fórmula Nombre común Nombre IUPAC ácido fórmico ácido metanoico CH3 - COOH ácido acético ácido etanoico CH3 - CH2 - COOH ácido propiónico ácido propanoico ácido butírico ácido butanoico ácido valeriánico ácido pentanoico ácido caproico ácido hexanoico ácido caprílico ácido octanoico ácido cáprico ácido decanoico ácido láurico ácido dodecanoico ácido mirístico ácido tetradecanoico ácido palmítico ácido hexadecanoico ácido esteárico ácido octadecanoico H - COOH CH3 -(CH2)2 - COOH CH3 -(CH2)3 - COOH CH3 -(CH2)4 - COOH CH3 -(CH2)6 - COOH CH3 -(CH2)8 - COOH CH3 -(CH2)10 - COOH CH3 -(CH2)12 - COOH CH3 -(CH2)14 - COOH CH3 -(CH2)16 - COOH Origen formica (hormigas) acetum (vinagre) proton prion (primer ácido) butyrum (mantequilla) valeriana (planta) capri (olor a cabeza, caper en latín) capri capri NOMENCLATURA DE LOS ÁCIDOS CARBOXÍLICOS (II) 1. Ácidos carboxílicos alifáticos ramificados Fórmula CH3 - CH - COOH Nombre común Nombre IUPAC ácido isobutírico ácido 2-metilpropanoico ácido isovalérico ácido 3-metilbutanoico ácido piválico ácido 2,2-dimetilpropanoico CH3 CH3 - CH - CH2 - COOH CH3 CH3 CH3 - C - COOH CH3 NOMENCLATURA DE LOS ÁCIDOS CARBOXÍLICOS (III) 1. Las posiciones 2 (α), 3 (β), 4 (gama), 5 (delta), etc. 4 5 - C - C - C 3 - etc. delta gama Fórmula CH3 - CH - COOH C beta 2 - C 1 - alfa COOH carboxilo Nombre común Ácido α-bromo propiónico Nombre IUPAC Ácido 2-bromopropanoico Br CH3 - CH - CH2 - COOH Ácido β-hidroxi butírico Ácido 3-hidroxibutanoico Ácido α,α,α-tricloroacético Ácido 2,2,2-tricloroetanoico OH Cl Cl - C - COOH Cl NOMENCLATURA DE LOS ÁCIDOS CARBOXÍLICOS (IV) 1. Ácidos carboxílicos aromáticos derivados del benceno Fórmula Nombre común Nombre IUPAC COOH Ácido benzoico Ácido bencenocarboxílico COOH Ácido p-clorobenzoico Ácido 4-clorobencenocarboxílico Cl COOH CH3 Ácido o-toluico Ácido 2-metilbencenocarboxílico NOMENCLATURA DE LOS ÁCIDOS CARBOXÍLICOS (V) 1. Ácidos carboxílicos aromáticos superiores Fórmula Nombre común Nombre IUPAC COOH Ácido 1-naftoico Ácido 1-naftalenocarboxílico COOH CH3 Ácido 2-metil-4-cloronaftoico Cl Ácido 2-metil-4-cloro-1naftalenocarboxílico NOMENCLATURA DE LOS ÁCIDOS CARBOXÍLICOS (VI) 1. Ácidos dicarboxílicos alifáticos Fórmula Nombre común Nombre IUPAC HOOC - COOH Ácido oxálico Ácido etanodioico HOOC - CH2 - COOH Ácido malónico Ácido propanodioico HOOC - (CH2)2 - COOH Ácido succínico Ácido butanodioico HOOC - (CH2)3 - COOH Ácido glutárico Ácido pentanodioico HOOC - (CH2)4 - COOH Ácido adípico Ácido hexanodioico HOOC - (CH2)5 - COOH Ácido pimélico Ácido heptanodioico NOMENCLATURA DE LOS ÁCIDOS CARBOXÍLICOS (VII) 1. Ácidos dicarboxílicos alifáticos insaturados: isomería cis-trans Fórmula HOOC Nombre IUPAC Ácido maleico Ácido cis-butenodioico Ácido fumárico Ácido trans-butenodioico COOH C C H H HOOC - CH CH - COOH HOOC H C H Nombre común C COOH NOMENCLATURA DE LOS ÁCIDOS CARBOXÍLICOS (VIII) 1. Ácidos dicarboxílicos aromáticos Fórmula Nombre común Nombre IUPAC COOH COOH Ácido ftálico Ácido benceno-1,2-dicarboxílico Ácido isoftálico Ácido benceno-1,3-dicarboxílico Ácido tereftálico Ácido benceno-1,4-dicarboxílico COOH COOH COOH COOH PROPIEDADES FÍSICAS DE LOS ÁCIDOS CARBOXÍLICOS (I) 1. Altamente polares por la presencia del grupo carboxílico 2. Punto de ebullición influido por la formación de puentes de hidrógeno inter e intramoleculares 3. Totalmente solubles en agua hasta C-4, desde C-5 disminuye densidad electrónica la solubilidad en función del tamaño de la cadena unida al negativa carboxilo ácido (sustancia capaz polar de donar iones hidrógeno) O cadena no polar densidad electrónica positiva C O H densidad polar electrónica negativa O H O C R R C O H O Puentes de hidrógeno intramoleculares (con la misma molécula) PROPIEDADES FÍSICAS DE LOS ÁCIDOS CARBOXÍLICOS (II) Formación de puentes de hidrógeno con otras moléculas (Intermoleculares) aceptor H O R O H O H C O O H H O C R H donador La capacidad de formar puentes de hidrógeno de los compuestos carboxílicos tiene gran importancia en: a) punto de ebullición b) solubilidad c) en el medio biológico PROPIEDADES QUÍMICAS DE LOS ÁCIDOS CARBOXÍLICOS (I) 1) La acidez: estabilidad del ion carboxilato por resonancia O R C O O H ácido carboxílico + H O H R C + O H O C ion hidronio O O O R ion carboxilato H H agua ion carboxilato R O + C O ion carboxilato Hibrido de resonancia R C O ion carboxilato Hibrido de resonancia PROPIEDADES QUÍMICAS DE LOS ÁCIDOS CARBOXÍLICOS (II) 2. Efecto de la estructura sobre la acidez: ácidos carboxílicos alifáticos 1. longitud de la cadena (lineal): a mayor número de carbonos disminuye la acidez (*) excepciones a la regla 2. cadena con uno o mas del mismo sustituyente atractor de electrones en la misma posición aumenta la acidez, con mayor sustitución en el mismo carbono 3. cadena (lineal) con un mismo sustituyente atractor de electrones en diferente posición aumenta la acidez, de más (más cerca) a menos (más lejos). 4. cadena con diferente sustituyente atractor de electrones en la misma posición aumenta la acidez: con el sustituyente de mayor electronegatividad Ejemplos de 1 HCOOH CH3COOH CH3CH2COOH CH3CH2CH2COOH CH3(CH2)3 COOH CH3(CH2)4 COOH Ka 1.77 X 10-4 1.76 X 10-5 1.34 X 10-5 1.54 X 10-5 (*) 1.52 X 10-5 (*) 1.31 X 10-5 Ejemplos de 3 CH3CH2CH2COOH CH3CH2CHCl COOH CH3CHCl CH2COOH CH2Cl CH2CH2COOH Ka 1.54 X 10-5 1.38 X 10-3 8.91 X 10-5 3.02 X 10-5 Ejemplos de 2 CH3COOH Cl CH2COOH Cl2 CHCOOH Cl3 C COOH Ejemplos de 4 F CH2COOH Cl CH2COOH Br CH2COOH I CH2COOH O2N CH2COOH Ka 1.76 X 10-5 1.38 X 10-3 5.49 X 10-2 2.20 X 10-1 Ka 2.60 X 10-3 1.38 X 10-3 1.25 X 10-3 6.61 X 10-4 2.09 X 10-2 PROPIEDADES QUÍMICAS DE LOS ÁCIDOS CARBOXÍLICOS (III) 3. Efecto de la estructura sobre la acidez: ácidos carboxílicos aromáticos 1. Los grupos activantes disminuyen la acidez 2. Los grupos desactivantes aumentan la acidez 3. Efecto orto. Casi todos los sustituyentes en orto ya sean activantes o desactivantes aumentan la acidez 4. Por lo general un mismo grupo tiene mayor grado de acidez cuando esta en la posición orto, después en meta y por último en para. Ka de ácidos benzoicos sustituidos en las posiciones orto Activantes -NH2 -OH -OCH3 -CH3 1.60 X 10-5 1.05 X 10-3 8.2 X 10-5 1.24 X 10-4 meta 1.9 X 10-5 8.3 X 10-5 8.2 X 10-5 5.4 X 10-5 para 1.4 X 10-5 2.6 X 10-5 3.3 X 10-5 4.3 X 10-5 1.2 X 10-3 6.7 X 10-3 1.51 X 10-4 3.2 X 10-4 C O Grupos donadores de electrones, desestabilizan al ion y disminuyen la acidez O C O Referencia (ácido benzoico) -H 6.4 X 10-5 Desactivantes -Cl -Br -CHO -CN -NO2 O 1.03 X 10-4 1.1 X 10-3 1.8 X 10-5 2.8 X 10-5 3.9 X 10-4 Grupos atractores de electrones, estabilizan al ion y aumentan la acidez PROPIEDADES QUÍMICAS DE LOS ÁCIDOS CARBOXÍLICOS (IV) 3. La acidez y la estabilización por resonancia: comparación con alcoholes energía R R OH O R O R C ácido O OH Estabilización por resonancia del grupo carboxilo C Estabilización por resonancia del anión carboxilato base O PROPIEDADES QUÍMICAS DE LOS ÁCIDOS CARBOXÍLICOS (V) 4. Valores de Ka y el pKa de algunos ácidos carboxílicos mayor acidez (números negativos) a) ácido bencensulfónico pKa = _ 6.5 b) ácido clorhídrico pKa = _ 7 pKa d) ácido oxálico pKa = 1.27 1 e) ácido malónico pKa = 2.85 1 menor acidez (números positivos) g) ácido tereftálico pKa = 4.46 1 h) fenol i) etanol f) ácido ftálico pKa = 5.04 1 c) ácido sulfúrico pKa = _ 10 pKa = 18 Fórmula Ka pKa F3C - COOH 0.59 0.23 F CH2 - COOH 2.6 X 10-3 2.59 Cl CH2 - OOH 1.4 X 10-3 2.85 Br CH2 - COOH 2.1 X 10-3 2.68 CH3 - COOH 1.76 X 10-5 4.75 1.0 X 10-16 16 CH3 – CH2 - OH pKa = 10 LOS ÁCIDOS CARBOXÍLICOS: METODOS DE OBTENCIÓN (I) 1. Oxidación de alcoholes primarios o de aldehídos 1) oxidación H R C H oxidación OH R C OH 2) oxidación O R C O H R - CH2 - OH R - CHO R - COOH alcohol primario aldehído ácido carboxílico un enlace C - O dos enlaces C - O tres enlaces C - O 1) agentes oxidantes para alcoholes a ácidos carboxílicos: KMnO4, CrO3, 2) agentes oxidantes para aldehídos a ácidos carboxílicos: Ag2O LOS ÁCIDOS CARBOXÍLICOS: METODOS DE OBTENCIÓN (II) 2. Oxidación de grupos alquilo (cadenas laterales primarias y secundarias) en anillos aromáticos (posiciones bencílicas); estabilidad del anillo aromático. CH3 COOH KMnO4 CH2 - CH2 - CH3 COOH KMnO4 CH (CH3)2 KMnO4 Los grupos alquilo terciarios no se pueden oxidar LOS ÁCIDOS CARBOXÍLICOS: METODOS DE OBTENCIÓN (III) 3. Reacción de reactivos de Grignard sobre CO2 (dióxido de carbono): introducción del grupo carboxilo: -COOH O O O C O HX + R - Mg - X C R O - Mg - X R C 4. Hidrólisis de nitrilos (cianuros) en medio ácido o básico O R C N + 2 H2O HX R medio ácido C OH + NH4+ + X OH + MgX2 LOS ÁCIDOS CARBOXÍLICOS: METODOS DE OBTENCIÓN (IV) 5. Por oxidación de alquenos CH3 H C C H H CH3 KMnO4 H C + O + O C O HO CO2 CH3 - COOH CH3 - CH = CH2 6. Reacción del yodoformo: oxidación de metil cetonas O O O HCl 3 I2 C R CH3 R - CO - CH3 metil cetona 3 NaOH C R O R - COO sal del ácido carboxílico + CHI3 yodoformo C R OH R - COOH ácido carboxílico Los derivados de ácido carboxílico (I) nuevo grupo funcional grupo carboxilo O R O OH C se mantiene el grupo carbonilo se modifica el grupo hidroxilo R nuevo sustituyente C se mantienen algunas de las características reactivas del carboxilo O R C O O-R ésteres: O - R en lugar de OH R C C O C R anhídridos: O - CO - R en lugar de OH O O R O X halogenuros de acilo: X en lugar de OH R C NH2 amidas: NH2 en lugar de OH Los derivados de ácido carboxílico (II): el grupo acilo 1. El grupo acilo esta presente en todos los derivados de ácido 2. En cada derivado cambia el carácter electrofílico del carbono O R - COOH ácido carboxílico éster R C R - CO O-R OR O O R C OH anhídrido R C O O R - CO O O R halogenuro de acilo R C C X R O R - CO CO - R X C O grupo acilo amida R C NH2 R - CO NH2 Los derivados de ácido carboxílico (III): el grupo acilo Consideraciones sobre la reactividad mayor reactividad O R C X O R Al ser X más electronegativo, tiene mayor eficacia para sustentar los electrones: mayor poder acilante O O C C R Al ser O electronegativo, tiene buena eficacia para sustentar los electrones: buen poder acilante O R C OR Al ser O electronegativo, tiene buena eficacia para sustentar los electrones: bajo poder acilante ya que el R le quita capacidad O R C NH2 Al ser N menos electronegativo, tiene menor eficacia para sustentar los electrones: muy bajo poder acilante menor reactividad La reacción de acilación (I): Es una reacción de sustitución en la cual se elimina un grupo de un derivado de un ácido (Z) y se adiciona otro grupo (Nu) para dar otro tipo de derivado. donde Nu = nucleófilo O O H - Nu R C Z R C Nu + H-Z la reversibilidad de la reacción depende de los reactivos y de las condiciones de la reacción donde Z = X, OCOR, OR, NHR donde Nu = OH, OCOR, OR, NH2, NHR La reacción de acilación (II): La relación de reactividad entre los distintos acilos mayor O C X O H2O R C O O C reactividad R R O O R C H2O OH R C OR H2O / H+ / OHH2O / H+ / OH- O R C NH2 menor La reacción de acilación (III): El mecanismo de reacción de adición – eliminación: catalizado por el nucleófilo (base) O R O-H O C + Z H - Nu R C + (I) Z R C Z Nu Nu - H (II) intermediario tetrahédrico + R O O-H C Nu R (III) C + Nu - H O + Z R C (IV) Nu + H-Z La reacción de acilación (IV): El mecanismo de reacción de adición – eliminación: catalizado por un ácido + O-H O R C Z + R (I) C + C Z (II) O-H R H - Nu + A H-A O-H Z R + A C Nu - H + Z Nu intermediario tetrahédrico intermediario tetrahédrico (III) (IV) O R C (VI) Nu + H-Z R O-H C (V) Nu + Z Los Nitrilos R – CN (I) 1. Se les considera como derivados de los ácidos carboxílicos a pesar de que no contienen oxígeno en su fórmula 2. Contiene un nitrógeno unido por un triple enlace al carbono, el triple enlace esta formado por dos enlaces pi que rodean a un enlace sigma. 3. El carbono es electrofílico (deficiencia de electrones) R - CN R - CN enlace pi enlace sigma densidad electrónica positiva (electrofílico) densidad electrónica negativa (nucleofílico) R R C enlace pi C N Nu (nucleófilo) N Los Nitrilos R – CN (II) 1. Los nitrilos por hidrólisis ácida o básica dan ácidos carboxílicos 2. Los nitrilos se obtienen de una amida que puede provenir de un ácido carboxílico O O H2O R - CN H2O R - C - NH2 O R - C - OH O 1) NH3 R - C - OH 2) HCl P2O5 R - C - NH2 R - CN Resumen del Tema 1: ácidos carboxílicos 1) Estructura: grupo carboxilo 2) Nomenclatura: ácidos alifáticos y aromáticos 3) Ácidos dicarboxílicos 4) Acidez: factores que afectan la acidez 5) Obtención de ácidos carboxílicos: oxidación, reactivo de Grignard más CO2 e hidrólisis de nitrilos 6) Derivados de los ácidos carboxílicos: ésteres, anhídridos de ácido, halogenuros de acilo y amidas 7) Reacción de acilación: sustitución de un grupo saliente por un nucleófilo 8) Nitrilos: estructura y relación con los ácidos carboxílicos







