Revista de Prensa
Anuncio

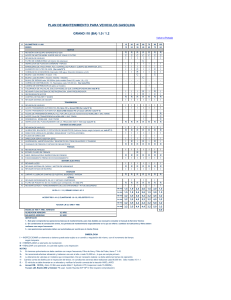
O.J.D.: E.G.M.: Tarifa: Área: DEL 2 AL 8 DE JUNIO DE 2014 50858 No hay datos 322 € 77 cm2 - 10% igadas a emplear procesos de I+D La expiración de patentes y la prolongación en del desarrollo son algunos desencadenantes n investigación clínica. % 35 % 34 % 33 % 32 % 31 % 30 % 29 éxito e ajustado en función de los fracasos Fuente: Tufts Center for the Study of Drug Development. ndencia o de megrupos mitados ando sin ilares de r sostede finans tienen que pagar por los fármacos -incluidas las administraciones, y en Estados Unidos las aseguradoras- rechazan su financiación. FÓRMULAS Entre las estrategias más utilizadas para impulsar el r primeras etapas éxito de la I+D, el Tufts Center destaca el empleo de biomarcadores y objetivos secundarios en la investigación, la incorporación de sistemas de análisis de megabases de datos, la colaboración con otras organizaciones, instituciones académicas y grupos de pacientes, el desarrollo de información genómica personalizada, el uso compartido de forma voluntaria de datos de pacientes y la explosión de información que se ha producido recientemente en el terreno del metabolismo celular, factor que tiene "un importante potencial de transformar los ensayos clínicos". "La industria investigadora está adoptando rápidamente medidas para impulsar las carteras en desarrollo en un contexto en el que muchas patentes están expirando y en que los plazos de desarrollo siguen prolongándose", señala Kenneth Kaitin, director del centro, adscrito a la Universidad de Tufts en Boston y especializado en la elaboración de estudios estratégicos del sector. TASAS DE ÉXITO e la putuación obtenida por cada factor evaluado. 1 2 Entre el 3 y el 13,8% Más del 13,8% en estudios de fase II randomizados 38 a 49 50 ó más 50.000 a 302.000 Menos de 50.000 21 a 44 meses Menos de 21 meses Fuente: Tufts Center for the Study of Drug Development. ón generó tuación al el comener una máxima la que lofactores n margen cada uno riba). ón de las puntuaciones obtenidas por los 61 compuestos analizados reveló que el 57 por ciento de los que al finalizar la fase III tenían una puntuación global de 6 llegaron finalmente al mercado, y los que alcanzaron 7 y 8 llegaron al mercado en un 75 y ciento por cien de los casos. El trabajo del centro recuerda que la tasa de éxito de los ensayos clínicos, que mide el porcentaje de compuestos que finalmente obtienen la aprobación en relación con los que iniciaron el desarrollo, fue del 16 por ciento entre las mayores farmacéuticas en el periodo comprendido entre 1993 y 2004, y ha ido descendiendo desde entonces. También se ha observado que la interrupción del desarrollo de compuestos que se revelan poco prometedores en etapas más tempranas del proceso sigue siendo una de las vías más eficaces para reducir los costes de I+D (ver cuadro de la izquierda). En cualquier caso, un problema importante sigue siendo que algunos candidatos que parecen seguros y eficaces en las primeras etapas se comportan de otra manera cuando llegan a grupos de población mayores. Vía libre para un test de Euroimmun que detecta GMN MADRID REDACCIÓN dmredaccion@diariomedico.com La agencia reguladora estadounidense FDA ha anunciado la aprobación del "primer test que puede ayudar a determinar si la enfermedad de glomerulonefritis membranosa (GMN) se debe al rechazo del organismo de su propio tejido renal o si responde a otra causa, como una infección", según el informe de aprobación de la propia agencia. El test sanguíneo aprobado es el AntiPLA2R IFA, de la compañía estadounidense Euroimmun, y detecta la presencia de un anticuerpo específico para GMN. "El tratamiento de esta enfermedad depende de su causa subyacente", recuerda Alberto Gutierrez, director del Departamento de Diagnóstico In Vitro y Radiológico de la FDA. AMPLIO ENSAYO La revisión de la FDA se ha basado en los resultados de un ensayo clínico con 560 muestras de sangre de las que 275 se obtuvieron de pacientes en los que se sospechaba GMN, mientras que las 285 restantes procedían de pacientes diagnosticados con otras enfermedades renales y autoimmunes que pueden dañar al riñón, como el lupus. El test pudo detectar GMN en el 77 por ciento de las muestras sospechosas y arrojó falsos positivos en menos del 1 por ciento del resto de las muestras, por lo que, según el dictamen de la FDA, resulta una herramienta útil para diferenciar la causa de la patología en la mayoría de los pacientes. En cualquier caso, la agencia señala que el test no se debe usar como única vía para diagnosticar GMN, sino que se deberá recabar información adicional, incluidos los síntomas del paciente y otras pruebas de laboratorio. Fecha: 02/06/2014 Sección: SANIDAD Páginas: 16