Diapositiva 1
Anuncio

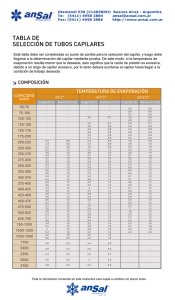
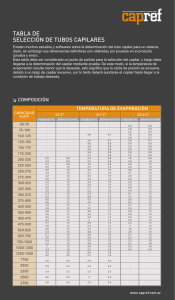
ELECTROFORESIS ELECTROFORESIS Los procedimientos electroforéticos se basan en la migración de iones bajo la acción de un campo eléctrico La separación se logra por las distintas velocidades de migración de las partículas cargadas ELECTROFORESIS Electroforesis clásica Electroforesis capilar ELECTROFORESIS CLÁSICA TISELIUS 1937 libre de transportador buffer + buffer Muestra en buffer con transportador diafragma - + DV ~ 100 V filtro de papel buffer ELECTROFORESIS CLÁSICA Electroferograma de proteínas del suero albúmina a1 a2 b g albúmina globulinas b a1 a2 g ELECTROFORESIS CAPILAR Comprende una familia de técnicas que emplean como celda capilares que contienen amortiguadores donde ocurre la separación electroforética de los componentes de la muestra ELECTROFORESIS CAPILAR CARACTERÍSTICAS GENERALES Incluida dentro de los métodos modernos de detección Emplea tubo capilar para la separación Utiliza campo eléctrico muy alto (~60 kV/m) VENTAJAS Alta eficiencia Muy bajo volumen de muestra (útil para muestras valiosas) Poca cantidad de reactivos (económica) Aplicable a un amplio grupo de compuestos ELECTROFORESIS CAPILAR CONFIGURACIÓN INSTRUMENTAL BÁSICA D CÁTODO (–) ÁNODO (+) RESERVORIO FUENTE DE ALTO VOLTAJE ELECTROFORESIS CAPILAR CONFIGURACIÓN INSTRUMENTAL BÁSICA ELECTROFORESIS CAPILAR PRINCIPIOS DE SEPARACIÓN Migración electroforética FENÓMENOS ELECTROCINÉTICOS Electroendoósmosis (electroósmosis) Electroendoósmosis SÍLICA FUNDIDA LUZ DEL CAPILAR, 20-200m CUBIERTA DE POLIIMIDA Distribución de cargas en capilar de sílica y flujo electroosmótico resultante Si-OH Si-O- + H+ CÁTODO (-) Pared del capilar F.E.O capa de Stern capa difusa ÁNODO (+) Velocidad electroosmótica campo eléctrico eo = veo = eo E veo E Ld/teo Ld L = = DV/L DV teo movilidad electroosmótica eo = dq √ e eo = 4p Unidades v: longitud/tiempo (ej: cm/s) eo : superficie/potencial.tiempo (ej: cm2/V.s) E: potencial/longitud (ej: V/m) : masa/longitud.tiempo (ej: kg/m.s) La eo es igual para todas las especies dentro del capilar Velocidad electroforética campo eléctrico vef = ef E movilidad electroforética ef = vef E q ef = f Ld/tef Ld L = = DV tef DV/L q = 6pr coeficiente de fricción La ef depende de la carga y radio del analito Velocidad neta vneta = veo + vef vneta = (eo+ ef) E ap vneta = ap E Velocidades en presencia de F.E.O. electrodo + eo ef electrodo – neta = eo+ef Migración diferencial de los analitos según su relación carga/radio + N N N + + + + + + + + + N Fenómenos de dispersión–ensanchamiento de picos Perfiles de flujo para líquidos Flujo hidrodinámico: inducido por presión P Flujo electroosmótico + – Fenómenos de dispersión–ensanchamiento de picos Perfiles de flujo para líquidos F.E.O perfil plano EC Flujo laminar perfil parabólico HPLC Flujo electroosmótico Flujo laminar Fenómenos de dispersión–ensanchamiento de picos Causas de ensanchamiento de las bandas x x H = A + B/ + C B = 2 Dt tiempo migración coeficiente de difusión Otras causas: Longitud finita de la muestra sembrada Calentamiento por efecto Joule Dispersión por asimetría Efecto “stacking” (apilamiento) Dispersión debida a la detección Dispersión total s2 = s2D + s2I + s2T + s2A + s2stac + s2D Si consideramos a la difusión longitudinal como la principal causa de ensanchamiento: s2 = 2 Dt = 2 DL/vneta vneta = ap E = ap DV/L s2 = 2 DL2/ ap DV Número de platos teóricos: N = L2/s2 Sustituyendo: N = ap DV/2D RESOLUCIÓN ap(a) ap(b) R= [ap(a)+ ap(b)]/ 2 N = Dap ap recordando que: N = ap DV/2D R= Dap ap ap DV/2D 0.707 Dap R= ap ap D DV N Equipo de electroforesis capilar Sílice fundida/poliimida, vidrio Pirex, teflón 50 cm longitud y 50 m d.i. ánodo cátodo Pt D Pt Fuente de potencial Columnas Recipientes de electrolito Termostatización Detectores FAV 10 – 30 kV i = 500 – 1000 A dH/dt = k E2/L2 Detector Z Inyección de la muestra Hidrodinámica (gradiente de presión entre extremos del capilar) cantidad de muestra inyectada Flujo gravitatorio (sifón) h diferencia de altura w = dgr4 hCti /8L densidad aceleración radio del gravedad capilar presión ley de Poiesuille vacío w = r4 PCti /8L diferencia de presión Inyección de la muestra Electrocinética (diferencia de potencial entre extremos del capilar) Cantidad de soluto inyectada voltaje inyección radio capilar movilidad analito w= r2 V t C L longitud capilar tiempo inyección concentración Técnicas de detección en EC UV-visible Universal Disponible comercialmente Amplia información espectral con detector de diodos en línea Fluorescencia Disponible en algunos instrumentos comerciales Muy sensible Se requiere fluoróforo o derivatización pre o post columna Fluorescencia inducida por láser Muy sensible Longitudes de onda disponibles limitadas Precio elevado Técnicas de detección en EC Potenciometría Se requiere electrodo selectivo de iones Se debe aislar el detector de la FAV Sensible siempre que no hayan iones interferentes Conductividad Universal Bajo costo pero poco sensible Se debe aislar el detector de la FAV Amperometría Muy sensible pero solo utilizable con analitos electroactivos Altamente específico Se debe aislar el detector de la FAV Técnicas de detección en EC Espectrometría de masas Precio muy elevado Interfaz EC-EM complicada Sensible y con información estructural Otras técnicas Índice de refracción, dicroismo circular, Raman absorbancia termoóptica, Modos de aplicación Electroforesis capilar de zona Cromatografía electrocinética micelar Electroforesis capilar en gel Electrocromatografía capilar Enfoque isoelectrónico capilar Isotacoforesis capilar MODOS DE APLICACIÓN USO EN QUÍMICA ANALÍTICA MODOS DE APLICACIÓN Electroforesis capilar de zona (CZE) Capilar lleno de electrolito de fondo y aplicación de campo eléctrico Mecanismo: separación de analitos según su movilidad en solución MODOS DE APLICACIÓN El pH del buffer de fondo es la clave de la separación ya que determina el grado de ionización y por lo tanto la movilidad relativa de los diferentes analitos. Debe tener también baja absortividad a la longitud de onda de detección y baja movilidad electroforética para minimizar el paso de corriente. MODOS DE APLICACIÓN Cromatografía electrocinética micelar (MEKC) Capilar lleno de electrolito de fondo que contiene tensioactivo. Mecanismo: interacciones hidrofóbicas/iónicas de analitos con micelas S S S S S S S S S S S MODOS DE APLICACIÓN Electrocromatografía capilar Capilar funcionalizado con fase estacionaria Mecanismo: interacciones diferenciales de un analito en dos fases Electroforesis capilar en gel Capilar relleno con gel que actúa como tamiz molecular Mecanismo: diferencia de tamaños y carga MODOS DE APLICACIÓN Enfoque isoeléctrico capilar (isoelectroenfoque) Capilar lleno de distintos buffers. Un extremo del capilar sumergido en solución ácida y el otro en solución alcalina. Se genera gradiente de pH a lo largo del capilar. Mecanismo: los analitos migran hasta alcanzar el pH donde son neutros (punto isoeléctrico). Una vez completada la focalización se alcanza un estado estacionario (no fluye corriente en el capilar). Para la detección, las zonas son movilizadas hacia el detector por aplicación de presión al capilar o adición de sal a uno de los reservorios MODOS DE APLICACIÓN Isotacoforesis capilar Mecanismo: separación en el interior de la zona delimitada por dos buffers Se usan dos buffers con distinta movilidad. Se separan aniones o cationes, no ambos. Ej: para separar aniones se elige un “electrolito lider o frontal” cuya forma aniónica posee la mayor movilidad, mientras que el anión del “electrolito terminal” es el más lento. Al aplicar el E los aniones comienzan a migrar al ánodo. El anión lider es el que se mueve más rápidamente, con los demás aniones siguiéndolo detrás. Los analitos se separan en zonas determinadas por sus movilidades, con el anión más rápido del analito moviéndose detrás del electrolito lider. Isotacoforesis capilar Significa electroforésis a velocidad uniforme. Esto quiere decir que el tiempo de recorrido en el capilar bajo condiciones isotacoforética es independiente de la velocidad. Es una técnica de separación por desplazamiento. Antes de iniciar la corrida, el capilar se debe llenar con un electrolito líder en un extremo, de gran movilidad, y debe ser mayor que la de los componentes a separar. Luego se introduce la muestra seguido del electrolito terminal o cola, cuya movilidad debe ser menor que cualquiera de los componentes de la muestra. La selección de los electrolitos guías y terminales depende del conocimiento de los valores de las movilidades y del pKa para todos los componentes de la muestra. En ITP las bandas están siempre en contacto con la zona adyacente. Esta característica es necesaria para mantener la continuidad eléctrica a lo largo del sistema, dado que no hay un electrolito de soporte. ITP puede ser usada para determinar cationes y aniones. Se requiere usualmente corridas separadas para determinar cada forma iónica. Los Isotacoferogramas pueden mostrar diferencias en el orden de migración en presencia o no de EOF. La detección en ITP es usualmente con detectores de "bulk property" de la solución electrolítica. Se ha utilizado detección de conductividad . También se han utilizado detectores térmicos (medida del calor de Joule producido dentro de cada zona) o detectores que miden la caída de voltaje de cada zona. Equipos de electroforesis capilar Ejemplos de electroferogramas Detección de aminas halucinogénicas (hidromorfona, morfina y codeína) en sangre total por EC (nalorfina= estándar interno). Condiciones de separación: capilar 70 cm (60 cm del detector) × 75 um de sílice fundida conteniendo 0.4% de β-CD en 100 nM de fosfato pH = 2.38 a 21 kV; 25 °C, inyección a 10 kV durante 16 s; detección a 200 nm. La recta muestra la respuesta lineal para hidromorfona. . Controles de calidad para drogas básicas en sangre total. Condiciones de separación: capilar de 60 cm (50 cm del detector) × 75 mm de sílica fundida conteniendo 100 nM fosfato pH= 2.38, a 18 kV, 25 °C, inyección a 10 kV por 8–16 s, detección a 200 nm. a) control de calidad de muestra en agua pura; b) control de calidad del extracto, 10 ng de cada droga en sangre porcina; c) control de calida del blanco con 50 ng/mL de estandar interno adicionado