síntesis y evaluación biológica in vitro de compuestos de coordinación
Anuncio

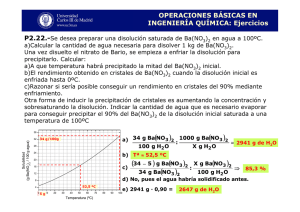
2° Congreso Nacional de Química Médica Flood Garibay y col. SÍNTESIS Y EVALUACIÓN BIOLÓGICA IN VITRO DE COMPUESTOS DE COORDINACIÓN [CU(4,7-DIMETIL1,10-FENANTROLINA)(N-O)]NO3 (CASIOPEINAS®) EN DIFERENTES LÍNEAS TUMORALES HUMANAS b a a a Jessica Flood Garibay , Maria Elena Bravo , Lena Ruiz Azuara . Departamento de Química Inorgánica y Nuclear, División de Posgrados, UNAM.; México, D.F. bLic. En Química, UDLA-P. Santa Catarina Martir, Cholula, Puebla. C.P. 72820 qu117625@yahoo.co.uk RESUMEN El cáncer es una de las principales causas de muerte a nivel mundial1, y en México el 10% del total de muertes anuales son a causa de algún tipo de cáncer2. Uno de los tratamientos de mayor importancia contra el cáncer es la quimioterapia; que es el uso de compuestos químicos que inhiben la proliferación celular3. Todos los compuestos usados en quimioterapia atacan células de rápida proliferación por lo que los efectos secundarios son severos4. Actualmente existen cinco fármacos de origen inorgánico a base de platino aprobados para la práctica clínica; siendo el cisplatino el de más amplio uso5. En general, los tratamientos existentes tienen altos precios y son difíciles de adquirir por la población de escasos recursos. Por lo anterior la Dra. Lena Ruiz Azuára desarrolló en la década de los 80’s la familia de compuestos Casiopeínas® como fármacos antinopleásicos de menor costo6,7. En el presente trabajo se realizó la síntesis de siete compuestos de esta familia, teniendo como ligante diimina la 4,7-dimetil-1,10-fenantrolina y como ligante a-aminoacidato siete distintos a-aminoácidos (Gli, Ala, Ac. A. But, Val, Leu, Isoleu y Norleu). Los compuestos sintetizados de acuerdo con las patentes36 fueron caracterizados por A.E., IR, IR-lejano, UV, UV-visible, EPR, conductimetría y meff. Por último se llevaron acabo pruebas de inhibición de la proliferación celular por el ensayo de Sulforodamina B encontrando que todos los compuestos son activos en las líneas celulares utilizadas, especialmente en HeLa; y en todos los casos superan la actividad inhibitoria del cisplatino. Palabras clave: cáncer, quimioterapia, casiopeínas. INTRODUCCIÓN El cáncer es una de las principales causas de muerte a nivel mundial1, y en México el 10% del total de muertes anuales son a causa de algún tipo de cáncer2. Uno de los tratamientos de mayor importancia contra el cáncer es la quimioterapia3; tratamiento que ataca células de rápida proliferación, por lo que los efectos secundarios son severos4. Actualmente existen cinco fármacos de origen inorgánico a base de platino aprobados para la práctica clínica; siendo el cisplatino el de más amplio uso5. En general, los tratamientos existentes tienen altos precios y son difíciles de adquirir por la población de escasos recursos. Por lo anterior la Dra. Lena Ruiz Azuára desarrolló en la década de los 80’s la familia de compuestos Casiopeínas® como fármacos antinopleásicos de menor costo. Las Casiopeínas ® son una familia de compuestos de coordinación de cobre (II) en cuya esfera de coordinación hay dos ligantes bidentados; un ligante de tipo diimina (N-N) y un segundo ligante de tipo a-aminoacidato (N-O) o donador (O-O)6,7. En el presente trabajo se realizó la síntesis de siete compuestos de esta familia, teniendo como ligante diimina la 4,7-dimetil-1,10-fenantrolina y como ligante αaminoacidato siete distintos α-aminoácidos (Gli, Ala, Ac. A. But, Val, Leu, Isoleu y Norleu). Los compuestos sintetizados de acuerdo con las patentes36 fueron caracterizados por A.E., IR, IR-lejano, UV, UV-visible, EPR, conductimetría y µeff. Por último se llevaron acabo pruebas de inhibición de la proliferación celular por el ensayo de Sulforodamina B 2° Congreso Nacional de Química Médica Flood Garibay y col. encontrando que todos los compuestos son activos en las líneas celulares utilizadas, especialmente en HeLa; y en todos los casos superan la actividad inhibitoria del cisplatino. OBJETIVO Sintetizar, caracterizar y evaluar la actividad biológica in vitro en distintas líneas tumorales humanas de compuestos pertenecientes a la familia de las Casiopeinas® manteniendo el ligante diimina (4,7-dimetil-1,10-fenantrolina) constante y variando la longitud de la cadena carbonada del ligante α-aminoacidato. METODOLOGÍA Síntesis y Caracterización. Los complejos fueron sintetizados según el lo reportado en las patentes8 después de lo cual fueron caracterizados por Análisis Elemental (%C, %H, %N, Analizador Elemental Pager 2000), IR (dilución sólida en KBr, 400-4000 cm-1, Espectrofotómetro fT-IRNicolet Avantar 320), IR lejano (dilución sólida en CsI, 200-650 cm 1 , Espectrofotómetro IR Burker Vector 22), UV (EtOH: 25°C, Espectrofotómetro de Arreglo de Diodos Hewlett Packard 8452a), UV-Visible (muestras en polvo, Espectrofotómetro UVVIS-NIR Carey 5E), EPR (polvos a 25°C y solución MeTOH/H2O 1:1 a 77K; banda X, Espectrofotómetro de Resonancia Paramagnética Electrónica Broker Elexsys E500), Momento Magnético (Balanza de Susceptibilidad Magnética Mkl Sherwood Scientific) y Conductimetría (H2O 1mM, Instrumento de Conductividad YSI 3100). La geometría de los complejos fue determinada calculando los factores isotrópicos del EPR y graficando en gráficas de Symons9. Determinación de la CI50 in vitro. Se utilizó el ensayo de la Inhibición de la Proliferación celular y tinción con Sulforrodamida B en las líneas tumorales humanas HeLa, PC-3, HCT-15 y SKLU-1 adquiridas a la American Type Culture Collection (ATCC)10,11. Las concentraciones utilizadas fueron de 0.01, 0.1, 1.0 y 10.0 µg/ml; como control positivo se utilizó Cisplatino y como control negativo se utilizó H2Odist. La CI50 fue calculada utilizando el método estadístico Probit con el programa Log Probit Análisis by Maximum Likelihood de Novartis. 2° Congreso Nacional de Química Médica Flood Garibay y col. RESULTADOS # Compuesto 1 [Cu(4,7-dm-fen)(Gli)]NO3•2H2O CuC16H20N4O7 2 481.98 [Cu(4,7-dm-fen)(Isoleu)]NO3•3H2O CuC20H30N4O8 7 467.95 [Cu(4,7-dm-fen)(Leu)]NO3•H2O CuC20H26N4O6 6 489.93 [Cu(4,7-dm-fen)(Val)]NO3•H2O CuC19H24N4O6 5 421.90 [Cu(4,7-dm-fen)(Ac.A.But.)]NO3•3H2O CuC18H26N4O8 4 443.87 [Cu(4,7-dm-fen)(Ala)]NO3 CuC17H18N4O5 3 P.M. (g/mol) 517.98 [Cu(4,7-dm-fen)(Norleu)]NO3•2H2O CuC20H28N4O7 499.98 %Obs. %Calc. ∆ %C 43.57 %C 43.29 0.28 %H 4.58 %H 4.54 0.04 %N 12.52 %C 48.24 %N 12.62 %C 48.40 0.10 0.16 %H 4.28 %H 4.30 0.02 %N 13.20 %C 44.67 %N 13.28 %C 44.12 0.08 0.55 %H 5.27 %H 5.53 0.26 %N 12.19 %C 48.67 %N 11.43 %C 48.77 0.76 0.10 %H 5.30 %H 5.17 0.13 %N 11.98 %C 49.63 %N 11.97 %C 49.84 0.01 0.21 %H 5.44 %H 5.44 0.00 %N 11.52 %C 46.42 %N 11.62 %C 46.37 0.10 0.05 %H 6.02 %H 5.84 0.18 %N 10.58 %C 48.02 %N 10.82 %C 48.04 0.03 0.02 %H 5.26 %H 5.64 0.38 %N 11.44 %N 11.21 0.23 Tabla 1. Análisis Elementales, Pesos Moleculares y Rendimientos. ∆ =% Observado - % Calculado %Rend 29.34% 53.67% 70.96% 61.08% 48.46% 11.11% 7.18% 2° Congreso Nacional de Química Médica # (-NH3) (COO - Flood Garibay y col. (C=C) (NO3) (N=C) (N-CU-O) 1579.05 1383.32 871.77 559.25 (CU-N) 539.97 (CUN) 487.90 (CUO) 316.27 1 3305.50 ) 1600.91 2 3253.91 3430.33 1656.60 1577.92 1382.19 871.13 559.25 235.27 539.97 464.76 487.90 279.60 347.12 3 3326.50 1627.90 1580.34 1383.58 869.46 556.49 539.97 466.69 482.12 277.69 320.13 4 3222.45 3305.40 1647.59 1578.15 1385.21 870.94 559.25 539.97 462.83 484.05 325.91 5 3243.35 3440.48 1649.76 1580.34 1383.60 865.30 561.18 430.05 538.04 464.76 484.05 316.13 6 3261.19 3463.93 1615.58 1579.05 1384.23 869.90 557.32 539.97 462.83 484.05 327.84 7 3313.18 1657.52 1579.10 1384.02 869.26 559.25 287.41 538.04 462.83 484.05 322.05 - 466.68 364.48 3243.16 Tabla 2. Señales de IR debido a los ligantes (N-N) y (N-O); así como de coordinación con el centro metálico. # 1 2 3 4 5 6 7 λmax1a ε1 λmax2a ε2 λmax3b Λ µeff (nm) (molL-1cm1 ) 68,550.08 57,754.97 54,836.84 54,922.78 78,201.65 72,021.11 72,930.45 (nm) (molL-1cm1 ) 54,185.55 46,428.56 43,732.78 46,394.81 64,357.72 63,276.15 54,661.98 (nm) (µ µS) (M.B.) 610.94 596.23 626.64 609.54 595.57 605.39 614.79 102.05 104.65 121.55 100.49 100.10 98.25 126.88 1.780 1.895 2.051 1.814 1.771 1.685 1.692 210 210 210 210 210 210 210 274 274 274 274 274 274 274 Tabla 3. Señales de UV , UV-Visible (Reflectancia Difusa),Conductividad (Λ Λ) y Momento Magnético Efectivo (µ µeff). a b a Sólidos # 1 2 3 4 5 6 7 g⊥ 2.0697 2.0603 2.0630 2.0719 2.0696 2.0664 2.0695 g 2.2399 2.2727 2.2490 2.3123 2.3079 2.2905 2.2718 gz 2.239 2.236 2.238 2.236 2.231 2.235 2.236 gx 2.002 2.057 2.058 2.057 2.057 2.057 2.057 gy 2.058 2.003 2.002 2.000 2.000 2.001 2.001 Solución giso 2.081 2.117 2.118 2.117 2.115 2.116 2.117 Az 178.88 182.72 184.77 183.00 186.98 183.00 181.39 Ax 11.7 12.6 12.3 12.5 12.5 12.2 12.4 Aiso 67.43 69.31 69.79 69.33 70.66 69.13 68.73 2° Congreso Nacional de Química Médica Flood Garibay y col. Para predecir la geometría de los compuestos, se calcularon los valores de giso y Aiso (Tabla 4) con las siguientes fórmulas: giso = (g+2g⊥ )/3 Aiso = (A+2A⊥ )/3 giso = (gz+2gx )/3 Aiso = (Az+2Ax )/3 Y se graficaron los valores obtenidos para los compuestos sintetizados en este trabajo en una gráfica de Symons, la cuál muestra compuestos reportados en la literatura cuyos datos de EPR y Rayos X son bien conocidos9. En la gráfica de Symons (Gráfica 1) los compuestos con mismas geometrías forman grupos bien definidos; todos los compuestos sintetizados caen entre los compuestos que presentan geometría cuadrada plana o pirámide de base cuadrada, lo cual sugiere una geometría D4h distorsionada, misma que esta reportada para esta familia de compuestos (cuadrado plano distorsionado)12,13. Gráfica de Symons 2,22 Compuestos Sintetizados Geometría Cuadrada (axial) Geometría Tetrahédrica Geometría Cuadrada Distorsionada Pirámides de Base Cuadrada Compuestos Hexacoordinados 2,20 2,18 giso 2,16 2,14 2,12 2,10 2,08 55 60 65 70 75 80 85 Aiso Gráfica 1. Gráfica de Symons. # 1 2 3 4 5 6 7 * HeLa CI50 CI50 (µ µg/ml) (µ µM) 0.4544 1.0237 0.2513 0.5956 0.7245 1.4788 0.7029 1.5021 0.7344 1.5238 0.3321 0.6413 0.5887 1.1774 5.0573 16.8549 PC-3 CI50 CI50 (µ µg/ml) (µ µM) 0.8308 1.8717 3.2497 7.7025 2.9473 6.0158 1.8782 4.0137 1.0005 2.0758 3.5891 6.9302 2.7705 5.5412 7.2535 24.1746 HCT-15 CI50 CI50 (µ µg/ml) (µ µM) 1.6423 3.7000 5.8910 13.9631 3.3988 6.9374 2.1492 4.5928 3.1386 6.5120 4.1424 7.9987 1.8438 3.6877 SN SKLU-1 CI50 CI50 (µ µg/ml) (µ µM) 2.2069 4.9720 4.0355 9.5651 4.1172 8.4036 4.2041 8.9841 4.1063 8.5196 5.2324 10.1033 4.5448 9.0900 4.9713 16.5684 Tabla 5. Ensayo de la Inhibición celular en HeLa, PC-3, HCT-15 y SKLU. SN= sin respuesta. * = Cisplatino. 2° Congreso Nacional de Química Médica Flood Garibay y col. CONCLUSIONES Los 7 compuestos sintetizados según las patentes8 son compuestos que contienen Cu como centro metálico y se comportan como electrolitos 1:1 de acuerdo a los valores de µeff y conductividad encontrados. Así mismo se encontró en los estududios de IR, IR lejano, UV y UV-visible que los compuestos sintetizados son ternarios presentando en su estructura al ligante diimina a la 4,7-dimetil-1,10-fenantrolina y como ligante aminoacidato los diferentes α-aminoácidos utilizados, y cuya geometría en polvo a temperatura ambiente es cuadrada plana distorsionada (D4h) según los estudios de EPR. La pureza de cada uno de los compuestos fue confirmada por el Analisis Elemental. II En el ensayo in vitro de inhibición del crecimiento celular se encontró que los compuestos ternarios de cobre sintetizados en este trabajo son activos en todas las líneas celulares probadas; mostrando una mayor actividad en HeLa. Igualmente se concluye que los compuestos exhiben una actividad mayor al cisplatino. Por otro lado se encontró que la actividad biológica de los compuestos aumenta al aumentar la cadena lineal principal del αaminoacidato coordinado en las líneas celulares PC-3 y HCT-15. BIBLIOGRAFÍA 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. Organización mundial de la Salud (2002) Cervical Cancer Screening in Developing Countries: Report of a WHO consultation. Organización Mundial de la Salud. Francia. Fernández, C.S. (2005) El IMSS en Cifras. Los Tumores malignos en población derechohabiente, 19902003. Revista Médica del IMSS, 43, 349-356. a King, J.B.R. (2000) Cancer Biology. [2 Edición] Pearson Prentice Hall. Singapore. Fricker, S.C. (1996) Metal Compounds in cancer therapy. Chapman & Hall. USA. Capítulo 1 y 2. McClevert, J.A. & Meyer, T.J. (2004) 9.18 Metal Complexes as Drugs and Chemotherapeutic Agents. Comprehensive Coordination Chemistry II. From Biology to Nanotechnology. Vol.9 Applications of Coordination Chemistry. [Editor del Volumen: Ward, M.D.] Elsevier Pergamon, Reino Unido. Bravo, M.E.; Tovar, A.; Ruiz, M.; Ruiz, R.L.& Moreno, E. R. Diseño, Sintesis y Caracterización de ® compuestos de Coordinación de Cobre Casiopeinas . Memorias de 5ª Jornada de Trabajos en Casiopeínas. Primer Congreso en Casiopeínas. Taxco, Guerrero, 2 a 3 de Diciembre de 2002. p 1-9. Aguilera, E.R.; Martinez, E.M.T.; Mácías, R.L.; Cortés, M.L.; Ortiz, M.R.; Ruiz, R.L. & Garcia, M.I. Estimación del porcentaje de Muerte celular por Apoptosis y Necrosis en Células HeLa, Inducido por cinco Casiopeínas de la Familia III. Memorias de 5ª Jornada de Trabajos en Casiopeínas. Primer Congreso en Casiopeínas. Taxco, Guerrero, 2 a 3 de Diciembre de 2002. p 49-55. Dirección General de Invenciones, Marcas y Desarrollo Tecnológico (SECOFI) Registros Número 18801120579 y 18802-120580. U.S.A. Patent Number 5-107,005. (1992), U.S. Patent Re35, 458, Feb. 18. (1996). Tovar, A.T. (2005) Caracterización cristalográfica y EPR de complejos mixtos de Cu(II) (Casiopeínas) e interacciones con algunas biomoléculas. Facultad de Química, Universidad Nacional Autónoma de México. México, D.F. Skehan, P.; Storeng, R.; Scudiera, D.; Monks, A.; MacMahon, J.; Vistica, D.; Warren, T.J.; Bokesch, H. Kenny, S. & Boyd, R.M. (1990) New Colorimetric Cytotoxicity Assay for Anticancer-Drug Screening. Journal of the National Cancer Institute, 82, 1107-1112. Marquez, A.Q. & Marín, H.A. Curso de Cultivos Celulares. UNEXA, Facultad de Química de la Universidad nacional Autonoma de México, 15-18 Agosto 2000. Gasque, L.; Moreno-Esparza, R.; Ruíz-Ramirez, L. & Medina-Dickenson, G. (1999) Aqua(4,7-diphenyl-1,10pnenantroline)(salicylaldehydato)copper (II) nitrate monohydrate. Acta Crystalografica, C55, 1065-1067. Solans, X.; Gasque, L.; Moreno-Esparza, R.; Ruíz-Ramirez, L. & Martínez, A. (1992) Mixed Chelate Complexes. III. Structures of (L-Alaninato)(aqua)(2,2’-bipyridine)copper(II) Nitrate Monohydrate and Aque(2,2’-bipyridine)copper(II) Chloride Trihydrate. Acta Crystalografica, C48, 1785-1788.