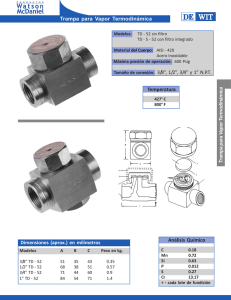
Texto guia
Anuncio

TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani UNIVERSIDAD TÉCNICA DE ORURO FACULTAD NACIONAL DE INGENIERIA INGENIERIA MECÁNICA-ELECTROMECÁNICA 1 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani AGRADECIMIENTO Quiero primero agradecer a Dios por haberme dado la vida, y que siempre va guiándome iluminando mi camino en la vida. A mi carrera de Ingeniería Mecánica – Electromecánica por darme la oportunidad de coadyuvar a la formación de profesionales del mañana. A mi padre, ya que gracias a su constante motivación lleve siempre el compromiso de entrar en la ciencia. 2 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani CONTENIDO CAPITULO 1 CONCEPTOS, DEFINICIONES Y PRINCIPIOS BÁSICOS…………………………………………………………. 1 1.1 Introducción…………………………………………………………………………………............................... 1 1.2 Terminología Termodinámica…………………………………………………………………………………….. 1 1.3 Sistema………………………………………………………………………………………………………………………. 1 1.4 Sistemas Termodinámicos en Ingeniería…………………………………………………………………….. 2 1.4.1 Sistema simple de producción de vapor……………………………………………………………….. 2 1.4.2 Sistema de cogeneración con turbina de gas………………………………………………………… 2 1.4.3 Sistema de calentamiento solar……………………………………………………………………………. 2 1.4.4 Sistema mecánico de refrigeración………………………………………………………………………. 3 1.4.5 Sistema de bomba de calor………………………………………………………………………………….. 3 1.4.6 Sistema aerogenerador eléctrico…………………………………………………………………………. 4 1.4.7 Sistema de desalinización por osmosis inversa…………………………………………………….. 4 1.5 Propiedad………………………………………………………………………………………………………………….. 4 1.6 Propiedades de un sistema……………………………………………………………………………………….. 4 1.6.1 Densidad, densidad relativa y peso específico…………………………………………………….. 4 1.6.2 Temperatura……………………………………………………………………………………………………….. 5 1.6.3 Presión………………………………………………………………………………………………………………… 5 1.6.4 Variación de la presión atmosférica con la altura………………………………………………... 6 1.7 Estado………………………………………………………………………………………………………………….….… 8 1.8 Proceso………………………………………………………………………………………………………………….….. 8 1.9 Ciclo……………………………………………………………………………………………………………………….…. 8 1.10 Equilibrio Termodinámico………………………………………………………………………………….… 9 1.11 Ecuación de estado……………………………………………………………………………………………... 9 1.12 Problemas…………………………………………………………………………………………………….……… 9 CAPITULO 2 PROPIEDADES DE UNA SUSTANCIA PURA………………………………………………………………….…… 15 2.1 Sustancia pura…………………………………………………………………………………………………….…. 15 2.2 Estados de la materia……………………………………………………………………………………………... 15 2.3 Superficie p,v,T……………………………………………………………………………………………………….. 17 2.4 Diagrama Presión temperatura………………………………………………………………………………. 17 2.5 Diagrama presión‐volumen específico…………………………………………………………….……… 18 2.6 Titulo (Calidad)………………………………………………………………………………………………….……. 19 2.7 Talas de propiedades de sustancias puras………………………………………………………….…… 19 2.8 Programa “EES”…………………………………………………………………………………………………..….. 20 2.9 Problemas…………………………………………………………………………………………………………..….. 20 3 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani CAPITULO 3 RELACIONES DE ENERGÍA, TRABAJO Y CALOR…………………………………………………….…………….25 3.1 Introducción……………………………………………………………………………………………………………….25 3.2 Naturaleza de la energía…………………………………………………………………………………………….25 3.3 Medición de la energía……………………………………………………………………………………………….26 3.4 Energía mecánica……………………………………………………………………………………………………….26 3.4.1 Energía cinética……………………………………………………………………………………………………….27 3.4.2 Energía potencial gravitatoria………………………………………………………………………………….27 3.5 Energía interna…………………………………………………………………………………………………………..27 3.6 Trabajo………………………………………………………………………………………………………………………27 3.6.1 Trabajo en las máquinas……………………………………………………………………….…………………27 3.6.2 Trabajo de expansión y compresión………………………………………………………………………..28 3.6.3 Otras formas de trabajo…………………………………………………………………………………………29 3.7 Potencia…………………………………………………………………………………………………………………….29 3.8 Calor………………………………………………………………………………………………………………………….30 3.8.1 Transferencia de calor por conducción…………………………………………………………………..30 3.9 Calor generado por la combustión…………………………………………………………………………….31 3.9.1 Combustible…………………………………………………………………………………………………………..31 3.9.2 Aire de combustión………………………………………………………………………………………………..31 3.10 Eficiencia………………………………………………………………………………………………………………32 3.11 Problemas…………………………………………………………………………………………………………….33 CAPITULO 4 PRIMERA LEY DE LA TERMODINAMICA…………………………………………………………………………. 41 4.1 Introducción…………………………………………………………………………………………………………... 41 4.2 Primer principio de la termodinámica…………………………………………………………………….. 42 4.3 Ecuación de energía de sistemas cerrados……………………………………………………………… 42 4.4 Propiedades de la energía interna………………………………………………………………………….. 43 4.5 Ecuación de energía de un sistema con flujo estacionario………………………………………. 43 4.6 Primera ley aplicada a un proceso…………………………………………………………………………… 43 4.7 Entalpia…………………………………………………………………………………………………………………… 43 4.7.1 Energía de flujo o corriente………………………………………………………………………………….. 44 4.8 Reversibilidad…………………………………………………………………………………………………………. 44 4.9 Irreversibilidad……………………………………………………………………………………………………….. 44 4.9.1 Irreversibilidad interna………………………………………………………………………………………… 45 4.9.2 Irreversibilidad externa……………………………………………………………………………………….. 45 4.10 Calor específico………………………………………………………………………………………………….. 45 4.10.1 Calor específico a volumen constante……………………………………………………………….. 45 4.10.2 Calor específico a presión constante…………………………………………………………..…….. 45 4.10.3 Relación de calores específicos de gases ideales……………………………………………….. 46 4.10.4 Calor específico molar………………………………………………………………………………………. 46 4.10.5 Calor específico variable………………………………………………………………………………….… 46 4 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani 4.11 Principio de conservación de la masa……………………………………………………………. 47 4.12 Problemas…………………………………………………………………………………………………….. 47 CAPITULO 5 GASES IDEALES Y REALES………………………………………………………………………………………… 53 5.1 Gases perfectos o ideales…………………………………………………………………………………. 53 5.2 Ley de Boye y Maiotte……………………………………………………………………………………… 53 5.3 Ley de Charles y Gay‐Lussac…………………………………………………………………………….. 53 5.4 Ley de Avogadro…………………………………………………………………………………………….… 54 5.5 Ecuación de estado de los gases ideales…………………………………………………………… 54 5.5.1 Constante universal de los gases Ru………………………………………………………………. 54 5.5.2 Constante del gas…………………………………………………………………………………………... 54 5.6 Análisis de la composición de las mezclas de gases ideales…………………………….… 55 5.6.1 Ley de Dalton………………………………………………………………………………………………… 55 5.6.2 Ley de Amagat………………………………………………………………………………………………. 55 5.7 Masa molecular de la mezcla…………………………………………………………………………… 55 5.8 Energía interna, entalpía y entropía de mezcla de gases ideales……………………… 56 5.9 Gases Reales……………………………………………………………………………………….…………… 56 5.9.1 Ecuación de estado de VAN DER WAALS…………………………………………………….... 56 5.9.2 Ecuación de estado de Redlich Kwong………………………………………………………….. 56 5.10 Factor de compresibilidad………………………………………………………………………….. 57 5.11 Problemas…………………………………………………………………………………………………… 58 CAPITULO 6 PROCESOS EN GASES IDEALES………………………………………………………………………………. 63 6.1 Introducción…………………………………………………………………………………………………… 63 6.2 Proceso a volumen constante………………………………………………………………………… 63 6.3 Proceso a presión constante………………………………………………………………………….. 64 6.4 Proceso isotérmico………………………………………………………………………………………… 64 6.5 Proceso isentrópico……………………………………………………………………………………….. 65 6.6 Proceso isoentálpico……………………………………………………………………………………… 65 6.6.1 Experimento de Joule‐Thomson…………………………………………………………………. 66 6.7 Proceso politrópico…………………………………………………………………………………………66 6.8 Problemas…………………………………………………………………………………………………….. 67 CAPITULO 7 LA SEGUNDA LEY DE LA TERMODINÁMICA…………………………………………………………… 75 7.1 Introducción…………………………………………………………………………………………………. 75 7.2 Enunciados de la segunda ley de la termodinámica……………………………………… 75 7.2.1 Enunciado de Carnot…………………………………………………………………………………. 75 5 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani 7.2.2 Según Kelvin‐Planck………………………………………………………………………………….. 76 7.2.3 Según Clausius……………………………………………………………………………………………... 76 7.2.4 Según Hatsopoulos‐Keenan………………………………………………………………………….. 76 7.3 Equivalencia de los enunciados………………………………………………………………………. 76 7.4 Procesos irreversibles…………………………………………………………………………………….. 77 7.5 Desigualdad de Clausius…………………………………………………………………………………. 77 7.6 La entropía base de la segunda ley de la termodinámica……………………………….. 78 7.7 Eficiencia o rendimiento de una máquina térmica…………………………………………. 79 7.8 El ciclo de Carnot……………………………………………………………………………………….…… 79 7.8.1 Presión media del ciclo……………………………………………………………………………….. 80 7.9 Ciclo de refrigeración y bomba de calor………………………………………………….……… 80 7.10 Ciclo inverso de Carnot……………………………………………………………………….…….. 80 7.11 Problemas…………………………………………………………………………………………….…... 81 CAPITULO 8 LA ENTROPIAY SU UTILIZACIÓN……………………………………………………………………………. 87 8.1 Introducción…………………………………………………………………………………………………. 87 8.2 Definición de variación de entropía………………………………………………………….…… 87 8.3 Obtención de valores de entropía………………………………………………………………... 88 8.4 Variación de entropía de un gas ideal…………………………………………………………… 88 8.5 Balance de entropía……………………………………………………………………………….…….. 89 8.6 Rendimientos adiabáticos de dispositivos en régimen estacionario……….…….. 89 8.7 Problemas……………………………………………………………………………………………….……. 90 BIBLIOGRAFIA CONSULTADA 6 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani PREFACIO A sugerencia de mis amigos decidí escribir un texto guía de la materia, para hacer una contribución a la biblioteca de la Carrera de Ingeniería Mecánica y que esta se utilice como material de apoyo a los estudiantes que llevan el curso de Termodinámica. Se ilustran los problemas termodinámicos con situaciones reales, de tal manera que las condiciones en que nos encontramos son diferentes a la del nivel del mar. Es importante que los estudiantes entiendan los fenómenos estudiados desde el punto de vista de la experiencia, así serán capaces de aplicar las leyes básicas de la Termodinámica para resolver los problemas que involucran proyectos de ingeniería. Este texto incluye problemas que se puede ver en el curso de un semestre, tiene material selecto que puede ser útil en aplicaciones prácticas sobre temas de vapor y gas, combustión y ciclos de refrigeración. Todos los problemas se realizan en el sistema Internacional de Unidades, de manera que el estudiante esté familiarizado para los repasos o exámenes de Termodinámica. La Termodinámica Técnica desempeña un papel vital en el diseño de múltiples procesos, dispositivos y sistemas, para su uso tanto en el hogar como en la Industria, no está demás decir que la Termodinámica constituye parte de nuestra vida diaria. En ingeniería la Termodinámica Técnica resulta ser, además muy importante en la continua búsqueda de soluciones a los problemas relacionados con la crisis energética, la escasez de agua potable, la contaminación atmosférica, la eliminación de la basura y por naturaleza la protección del ecosistema que es vital para la supervivencia del ser humano. Por eso estudiamos con la mayor importancia en nuestra búsqueda de una mejor forma de vivir. Ing. Carlos Fidel Cruz Mamani 7 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani CAPÍTULO 1 CONCEPTOS, DEFINICIONES Y PRINCIPIOS BÁSICOS OBJETIVOS • Introducir conceptos fundamentales y definiciones usadas en el estudio de la Termodinámica. • Revisar los sistemas de unidades que se utilizarán en el curso. • Explicar los conceptos básicos de la termodinámica, como sistema, estado, equilibrio, proceso y ciclo. 1.1 INTRODUCCIÓN con el sistema en cuestión se conoce como entorno o medio ambiente. La Termodinámica Técnica es una ciencia que estudia macroscópicamente las relaciones de transformación y transferencia de energía ocasionados por los cambios físicos de la naturaleza. A lo largo de la materia se distinguirán tres tipos básicos de sistemas. Un sistema cerrado se define como una cantidad determinada de materia. Dado que un sistema cerrado contiene siempre la misma materia, esto implica que no hay transferencia de masa a través de su frontera. Para el ingeniero el estudiar Termodinámica Técnica es conocer una herramienta analítica, teórica y práctica que le ayuda a interpretar fenómenos naturales desde el punto de vista de las relaciones de materia y energía. Un sistema se denomina abierto si durante el fenómeno en estudio entra y sale masa del mismo. 1.2 TERMINOLOGÍA TERMODINÁMICA Los enunciados de las Leyes de La Termodinámica se expresan con términos referidos al tema como ser: sistema, propiedad, transformación, ciclo, etc. Muchas de las explicaciones se manejan estos términos por lo que es necesario conocer para el avance del curso. Los sistemas abiertos pueden subdividirse en: Sistemas circulantes cuando la cantidad de masa que penetra al sistema es igual a la que sale del mismo durante el fenómeno en estudio. Un sistema abierto está en régimen no permanente cuando solo entra masa a él y no sale, o solo sale y no entra o la cantidad que sale no es igual a la que entra o viceversa. 1.3 SISTEMA En Termodinámica un sistema se define como cualquier conjunto de materia o cualquier región en el espacio delimitado por una superficie o pared llamada frontera del sistema. La pared puede ser real, ejemplo un tanque que contiene un determinado fluido, puede ser imaginaria, como la frontera de determinada cantidad de fluido que circula a lo largo de un tubo. Toda materia que se encuentra fuera de la pared y que interactúan Sistema aislado, que es aquel que no intercambia ni materia ni energía con su entorno. Un ejemplo de este clase podría ser un gas encerrado en un recipiente de paredes rígidas lo suficientemente gruesas (paredes adiabáticas) como para considerar que los intercambios de energía calorífica sean despreciables, ya que por hipótesis no puede intercambiar energía en forma de trabajo. 8 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani 1.4 SISTEMAS TERMODINÁMICOS EN INGENIERÍA Los sistemas termodinámicos de ingeniería están formados por un conjunto de equipos o elementos que realizan la transformación de la energía, a continuación indicamos los que estudiaremos en el curso. 1.4.1 Sistema simple de producción de vapor El objetivo de este sistema es convertir la energía térmica (calor) en energía mecánica, o eléctrica, cuyo uso es mucho más conveniente. En la figura 1.1, el agua entra a la caldera como líquido a alta presión y temperaturas altas después de haber recibido energía térmica de la fuente de calor, el vapor entonces se expande en la turbina (dispositivo de producción de trabajo) a un estado de presión y de temperatura bajas, produciendo durante el proceso trabajo útil. A continuación el vapor que abandona la turbina a presión y temperatura bajas se condensa en el condensador entregando la energía térmica al sumidero de calor. La presión del líquido condensado se eleva con una bomba (dispositivo de absorción de trabajo) a la presión de entrada de la caldera para que el proceso completo se inicie de nuevo. Figura 1.1 Sistema de producción de vapor 1.4.2 Sistema de cogeneración con turbina de gas La cogeneración es un viejo concepto de ingeniería que implica la producción simultánea de energía eléctrica y energía térmica en una sola operación, usando así el combustible de una manera más eficiente que si los productos deseados tuvieran que obtenerse por separado. El corazón de un sistema de cogeneración es un motor primario con calor de desecho a temperatura todavía utilizable, no es sorprendente que las condiciones requeridas por la cogeneración se hayan satisfecho de muchas maneras. Un sistema de cogeneración que utiliza una planta de energía con turbina de gas como 9 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani motor primario se muestra en la figura siguiente. evaporado que viene del evaporador (cámara Sistema de calentamiento solar fría) de modo que el calor que tomó el fluido Un sistema de calentamiento solar se muestra refrigerante en el evaporador pueda ser en la figura 1.3, tiene gran importancia porque disipado a un nivel térmico superior en el se aprovecha la energía solar para calentar condensador. Luego de ello el fluido pasa a agua en paneles solares. El agua caliente se un expansor que es una simple válvula o usa para las duchas, saunas, piscinas, cocina restricción (orificio capilar) de modo que el para lavado de vajillas y llevar por tubos fluido condensado (líquido) a alta presión que para la calefacción radiante, que ayuda a la sale relativamente frío del condensador al climatización de una vivienda. expandirse se vaporiza, con lo que se enfría considerablemente ya que para ello requiere una gran cantidad de calor, dada por su calor latente de vaporización, que toma precisamente del recinto refrigerado. 1.4.3 Figura 1.3 Esquema de un sistema de calentamiento solar. 1.4.4 Sistema mecánico de Refrigeración Un sistema mecánico de refrigeración se emplea para extraer calor de un recinto, disipándolo en el medio ambiente. Es de gran importancia en la industria alimentaria, para la licuación de gases y para la conservación de vapores. En la refrigeración por compresión de vapor se consume energía mecánica en un compresor que comprime el fluido de trabajo 1.4.5 Figura 1.4 Sistema mecánico de compresión de vapor. Sistema de Bomba de calor Si se pretende suministrar calor a una región de alta temperatura, el sistema se llama bomba de calor. En consecuencia, el mismo principio rige el diseño y la operación de los refrigeradores y las bombas de calor. Un sistema de bomba de calor constituido con componentes mecánicos se muestra en la figura 1.5. 10 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani Se conoce como bomba de calor aire-aire debido a que se usa el aire exterior para proporcionar el ingreso de calor en el evaporador y se emplea el aire interior como conductor del calor al espacio que debe calentarse. Figura 1.5 Esquema de un sistema de Bomba de calor. 1.4.6 Sistema aerogenerador eléctrico Un sistema de aerogenerador incorpora una hélice montada en una torre que tiene su generador acoplado al eje de la hélice, aprovechando la fuerza del viento que actúa de forma constante sobre las aspas se genera electricidad de forma que se almacena en un sistema se baterías. Figura 1.6 Sistema aerogenerador eléctrico. 1.4.7 Sistema de desalinización osmosis inversa hiperfiltración) se muestra en la figura siguiente. por Se necesita gran cantidad de agua dulce para beber, para la irrigación y otros fines industriales. En muchas partes del mundo, esta necesidad la satisface la naturaleza con la lluvia. Pero existe escasez de agua en algunas partes del mundo, lo que provoca grandes sufrimientos humanos. Afortunadamente se han desarrollado diferentes métodos para producir agua dulce. Un esquema prometedor de desalinización que aplica el principio de osmosis inversa (también conocido como Figura 1.7 Esquema de un sistema de desalinización de agua. 11 TERMODINÁMICA TÉCNICA 1.5 Ing. Carlos Fidel Cruz Mamani PROPIEDAD Una propiedad es cualquier parámetro o cantidad que sirve para describir a un sistema. Las propiedades comunes son presión, temperatura, volumen, velocidad y posición; el color es importante cuando se investigan la transferencia de calor por radiación. Las propiedades termodinámicas se dividen en dos tipos generales, extensivas e intensivas. Una propiedad extensiva es aquella que depende de la masa del sistema, ejemplos; masa, volumen, cantidad de movimiento y energía cinética. Una propiedad intensiva es la que no depende de la masa del sistema, ejemplos; temperatura, presión, densidad y velocidad. Si dividimos una propiedad extensiva entre la masa, resulta una propiedad específica. El volumen específico se define como el cociente del volumen sobre su masa. 1.6 PROPIEDADES DE UN SISTEMA 1.6.1 Densidad y densidad relativa La densidad se define como la masa por unidad de volumen. (1.1) Para un elemento de volumen diferencial de masa y volumen, la densidad se puede expresar como. (1.2) La densidad de una sustancia depende de la temperatura y la presión. Para los líquidos y sólidos son en esencia sustancias no compresibles y la variación de su densidad con la presión es por lo general insignificante, pero depende más que de la temperatura. En muchos análisis de ingeniería la densidad de una sustancia se da con el nombre de gravedad específica o densidad relativa, y se define como el cociente de la densidad de una sustancia entre la densidad de alguna sustancia estándar a una temperatura específica, (por ejemplo, para el agua a 4 ºC su densidad es 1000 kg/m3). (1.3) El análisis de unidades para la densidad relativa de una sustancia es una cantidad adimensional, sin embargo los textos de Termodinámica dan densidades relativas de algunas sustancias a 0 ºC. El peso de un volumen unitario de una sustancia se llama peso específico y se expresa como. · (1.4) Donde; ρ; es la densidad de la sustancia, en kg/m3 2 g; es la aceleración gravitacional, en m/s . 12 TERMODINÁMICA TÉCNICA 1.6.2 Ing. Carlos Fidel Cruz Mamani Temperatura No hay una definición exacta sobre la temperatura, las personas están familiarizadas con una medida de sensación fisiológica expresada como calor o frío. Gracias a las propiedades de los materiales que cambian con la temperatura se puede establecer una referencia para la medición de la temperatura. A través de la historia se han introducido varias escalas de temperatura que se basan en ciertos cambios de estado como el de congelamiento y ebullición del agua. La temperatura usada actualmente en el sistema internacional es la escala Celsius, y en el sistema Ingles la escala Fahrenheit. La escala de temperatura termodinámica en el sistema internacional es la escala Kelvin desarrollada posteriormente. Entonces las relaciones matemáticas para su conversión corresponden a lo que sigue. La escala Kelvin se relaciona con la escala Celsius mediante. 273.15 º (1.5) La escala Fahrenheit se relaciona con la Celsius. 1.8 32 (1.6) 459.67 (1.7) La escala Rankine se relaciona con la Fahrenheit. La escala Rankine se relaciona con la Kelvin. 1.8 1.6.3 (1.8) Presión La presión se define como la fuerza normal que ejerce un fluido por unidad de área, tiene como unidad el Newton por metro cuadrado (N/m2), también conocida como pascal (Pa). En países de Europa las unidades de presión son el bar, atmósfera estándar y kilogramo fuerza por metro cuadrado y la libra fuerza por pulgada cuadrada. La presión solo se analiza cuando se trata de gas o líquido, mientras que la presión en los sólidos es la fuerza normal. La presión real de una determinada posición se llama presión absoluta, y que para las mediciones se relaciona mediante la siguiente relación. (1.9) é 1.6.4 Variación de la presión atmosférica con la altura El aire que respiramos es un gran océano de gas que rodea la Tierra, y que se estima tiene una profundidad entre 50 y algunos centenares de kilómetros. Fuera de esta capa atmosférica se halla el espacio exterior, llamado éter, donde existe prácticamente un vacío perfecto. La presión va aumentando a medida que nos dirigimos hacia el centro de la Tierra debido al peso de la capa de aire soportada desde arriba. Y conforme baya subiendo en altura la presión atmosférica disminuye. 13 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani Figura 1.8 Alturas de las capas de tropósfera, estratósfera, mesósfera y la ionósfera con respecto a la superficie terrestre. Para fines prácticos se considera al aire como una mezcla compuesta de sólo dos gases, el vapor de agua y el aire seco que comprende el conjunto de todos los demás gases. La presión atmosférica en función de la altura es: · · · (1.10) Donde: P(z); es la presión atmosférica local, en kPa. P0 = 101.325 [kPa] T0 = 293 ºK temperatura normal a nivel del mar. β; es el coeficiente local de variación de la temperatura. R = 287 [J/kg ºK] constante del gas de aire seco. z; altura sobre el nivel del mar, en [m] (1.11) Siendo, T la temperatura promedio local, en ºK. Ya afectando el factor de altura empírico establecido por la Comisión Internacional de Navegación Aérea,1 la presión atmosférica en función de la altura es: · 1 1 2.2569 · 10 · . Kohlrausch, F.; Praktische Physik, Stuttgart, Alemania, 1962, Tomo I, pág. 294. 14 (1.12) TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani El proceso cuasiestático o de cuasiequilibrio, es un proceso ideal, suficientemente lento, en el cual las desviaciones a partir del equilibrio son infinitesimales. La mayoría de los procesos reales son fuera del equilibrio, puesto que el sistema se desvía por más de una cantidad infinitesimal. 1.7 ESTADO En termodinámica se denomina estado a una situación particular de un sistema y está descrita por el valor de sus propiedades. El estado de un sistema es su condición cuando se describe dando valores a sus propiedades en un instante particular. El estado del sistema se representa por un punto en un diagrama p -V. Podemos llevar al sistema desde un estado inicial a otro final a través de una sucesión de estados de equilibrio. 1.9 CICLO Cuando un sistema en un estado inicial determinado experimenta una serie de procesos y regresa al estado inicial del que partió, se dice que el sistema a experimentado un ciclo. El estado final del ciclo tiene propiedades iguales a los valores que tenía al principio. Figura 1.9 Representación de un punto de estado en un diagrama presión ‐ volumen. 1.8 PROCESO Cuando un sistema cambia de un estado a otro, la evolución de estados sucesivos por los que pasa el sistema se denomina proceso. Figura 1.11 Gráfica de ciclos (a) Ciclo de dos procesos b) Ciclo de cuatro procesos. Figura 1.10 Esquema de un proceso Ciclo 15 TERMODINÁMICA TÉCNICA 1.10 propiedades, presión, volumen y temperatura el estado está definido y por lo tanto la tercera propiedad queda determinada. Por lo tanto existirá una función que vincula. EQUILIBRIO TERMODINÁMICO Se puede decir que un sistema está en equilibrio cuando las propiedades no se modifican de punto a punto, y cuando no existe posibilidad de cambio con el tiempo. , , Este concepto general de equilibrio termodinámico implica la coexistencia de tres equilibrios particulares que son: equilibrio mecánico, equilibrio térmico, y equilibrio químico. 0 (1.13) Esta función es lo que se denomina ecuación de estado. La ecuación de estado de un gas ideal es el más conocido es: Está en equilibrio mecánico, cuando la presión tiene el mismo valor en todas partes del sistema o, el valor de la presión en el sistema coincide con la presión que el medio ejerce contra el propio sistema. · · · (1.14) Donde n representa el número de moles, y R la constante universal de los gases que tiene valores R= 0.082 atm L/(K mol) =8.3143 J/(K mol) Está en equilibrio térmico, cuando no hay intercambio de calor con el medio externo. El sistema estará en equilibrio químico, cuando su composición química no se modifica. 1.11 Ing. Carlos Fidel Cruz Mamani 1.12 PROBLEMAS Los problemas que en Termodinámica se estudian, trata sobre la energía por lo que tiene amplia aplicación desde lo microscópico y equipos domésticos hasta los sistemas de generación de potencia. ECUACIÓN DE ESTADO Se denomina ecuación de estado a la relación que existe entre las propiedades p, V, T. Es decir que conocido un par de las tres 16 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani PROBLEMA 1.1 Determine la diferencia de presión entre el tubo de agua y el tubo de aceite (figura 1). La parte superior de la columna de mercurio está a la misma elevación que la media del tubo de aceite. DATOS: 1000 g= 9.81 [m/s2] x1= 4 [m] x2 = 2 [m] Figura 1. SOLUCIÓN: - La variación de presión es debido a la columna de mercurio. · · · · …..….(1) Siendo: ∆ ∆ - · · · · La densidad del mercurio se calcula por. · ……………...…………..…………….(3) 13.6 1000 - 13600 Sustituyendo en (2) se obtiene. - ……..………………….(2) ∆ = 514044 [Pa] Convirtiendo a bar. ∆ = 5,14044 [bar] 17 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani PROBLEMA 1.2 Se conecta un medidor y un manómetro aun recipiente de gas para medir su presión. Si la lectura en el medidor es 80 kPa. Determine la distancia entre los dos niveles de fluido del manómetro si este es a) un líquido mercurio ( =13600 kg/m3) o b) agua (ρ=1000 kg/m3) DATOS: 13600 1000 g= 9.81 [m/s2] Figura 1.2 SOLUCIÓN: - La variación de presión es debido a la columna de mercurio. · · ………………………… (1) · - a) Si el líquido es mercurio se tiene: h= 0.5996 - [m] b) Si el líquido es agua. · h= 8.155 18 [m] TERMODINÁMICA TÉCNICA PROBLEMA 1.3 Ing. Carlos Fidel Cruz Mamani En la figura se muestra un depósito dentro de otro depósito, conteniendo aire ambos. El manómetro A está en el interior del depósito B y su lectura es 1,4 bar. El manómetro de tubo en U conectado al depósito B contiene mercurio. Con los datos del diagrama, determine la presión absoluta en el depósito A y en el depósito B, ambas en bar. La presión atmosférica en el exterior del depósito B es 101 kPa, la aceleración de la gravedad es 9,81 m/s2. D A T O S Pman‐A= 1.4 [bar ] Patm=101 kPa g = 9.81 m/s2 S O L U C I O N Por definición la presión absoluta es. ……………(1) La lectura del manómetro indica una presión y se calcula por: · 9.81 · ………………(2) 13590 0.2 26.663 26663.5 Sustituyendo en (1) 101 26.663 127.663 1,276 Como el depósito A está dentro del depósito B, la presión de este se convierte en Patm, para el depósito A. 1.276 1.4 (P abs)A=2.676 [bar] 19 TERMODINÁMICA TÉCNICA PROBLEMA 1.4 Ing. Carlos Fidel Cruz Mamani El aire atmosférico en la ciudad de Oruro, a 3706 metros sobre el nivel del mar, esta compuesto por aire seco y vapor de agua, calcular la presión atmosférica para la temperatura promedio local 15 ºC. S O L U C I O N La presión atmosférica en función de la altura esta dado por: · · Siendo: · ………………….(1) P0 = 101.325 [kPa] T0 = 293.15 ºK temperatura normal a nivel del mar. R = 287 [J/kg ºK] constante del gas de aire seco. z=3706 [m] altura sobre el nivel del mar. El coeficiente local de variación de la temperatura esta dado por: ……………………(2) 293.15 288.15 3706 0.001349 El exponente es adimensional. · 9.81 0.001349 287 25.335 Ahora aplicando la ecuación (1) se tiene. 101.325 · 293.15 65.52 20 0.001349 3706 293.15 . TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani CAPÍTULO 2 PROPIEDADES DE UNA SUSTANCIA PURA OBJETIVOS • • • Presentar la superficie tridimensional para una sustancia pura, con los diagramas proyectados. Introducir las tablas necesarias para obtener propiedades de sustancias que cambian de fase. Presentar problemas de práctica que ilustran los conceptos estudiados. los gases son más fáciles de describir que los sólidos y que los líquidos. 2.1 SUSTANCIA PURA Una sustancia pura tiene su composición química fija definida en cualquier parte e igualmente unas propiedades físicas definidas. El gas contenido en un recipiente, está formado por un número muy grande de moléculas, 6.02·1023 moléculas en un mol de sustancia. Cuando se intenta describir un sistema con un número tan grande de partículas resulta inútil (e imposible) describir el movimiento individual de cada componente. Por lo que mediremos magnitudes que se refieren al conjunto: volumen ocupado por una masa de gas, presión que ejerce el gas sobre las paredes del recipiente y su temperatura. Estas cantidades físicas se denominan macroscópicas, en el sentido de que no se refieren al movimiento individual de cada partícula, sino del sistema en su conjunto. Una mezcla de varios elementos también califica como una sustancia pura siempre y cuando la mezcla sea homogénea. El aire por ejemplo, es una mezcla de varios gases, pero con frecuencia se considera como una sustancia pura, porque tiene una composición química uniforme. 2.2 ESTADOS DE LA MATERIA La materia está constituida por átomos que están igualmente espaciados de manera continua en la fase de gas. Esta idealización permite tratar a las propiedades como funciones puntuales y suponer que los estados son casi estáticos. El estado en que se encuentra una sustancia va a variar en función de la presión y temperatura a que están sometidas. Así por ejemplo, el anhídrido carbónico es normalmente un gas pero se licua a -60 ºC y se solidifica a -80 ºC, a presión atmosférica normal. El plomo por ejemplo normalmente es sólido, pero se licua a 328 ºC y se vaporiza a 1620 ºC. La materia está en uno de los tres estados: sólido, líquido o gas: En los sólidos, las posiciones relativas (distancia y orientación) de los átomos o moléculas son fijas. En los líquidos, las distancias entre las moléculas son fijas, pero su orientación relativa cambia continuamente. En los gases, las distancias entre moléculas, son en general, mucho más grandes que las dimensiones de las mismas. Las fuerzas entre las moléculas son muy débiles y se manifiestan principalmente en el momento en el que chocan. Por esta razón, El agua que es un elemento que se utiliza en muchas aplicaciones de ingeniería, se encuentra en estado líquido a la temperatura ambiente y la presión atmosférica normal. Si 21 TERMODINÁMICA TÉCNICA la temperatura aumenta a 100 ºC a la presión atmosférica normal a nivel del mar, el agua hierve es decir pasa del estado líquido al estado de vapor o gaseoso. El vapor en el estado gaseoso está constituido por moléculas suficientemente más separadas, y con velocidades moleculares mucho mayores. Ing. Carlos Fidel Cruz Mamani quedando inmovilizando su movimiento a vibraciones. Pero los estados de la materia no solo dependen de la temperatura, sino también de la presión a que están sometidos. Así por ejemplo, si para el agua se aumenta su presión, el punto de vaporización es mayor a 100 ºC y al contrario, si la presión a que está sometida disminuye, puede hervir o cambiar de estado a temperaturas menores a 100 ºC. Para su estudio se construyen líneas que representan su cambio de estado, para el agua en particular se establecen en la figura 2.1. Si por el contrario se enfría el agua hasta 0ºC a presión atmosférica normal a nivel del mar, el agua se solidifica, formándose hielo. Este hielo está constituido por moléculas muy juntas unas con respecto de otras, Figura 2.1 Gráfica del comportamiento del agua. Se observa en la figura 2.1, que a medida que se eleva de temperatura existe un adicionado de calor, a este calor se lo denomina calor sensible y si el calor suministrado es a temperatura constante se denomina calor latente. Calor latente, es el calor que suministrado o sustraído de una sustancia produce un cambio de estado, sin variar la temperatura. En el caso del cambio de estado de sólido a líquido, se denomina calor latente de fusión y se necesitan 80 kcal por cada kg de hielo (sólido) a 0 ºC que pase a 1 kg de agua (líquido) a la misma temperatura. Tan pronto como se haya fundido la última porción de hielo si se sigue agregando calor, la temperatura Calor sensible, es el calor que suministrado a una sustancia o extraído de ella, produce un efecto sensible en la misma, como ser una variación de temperatura. 22 TERMODINÁMICA TÉCNICA del agua comienza a aumentar en la relación de 1 ºC por cada Kcal de calor entregada, este calor es sensible, con un calor específico igual a 1. Cuando se ha alcanzado la temperatura de 100 ºC comienza el proceso de ebullición, si se sigue agregando calor se observará que Ing. Carlos Fidel Cruz Mamani la temperatura deja de aumentar, comenzando la transformación del agua en vapor, el calor agregado es el calor latente de vaporización. Se necesitan 539 kcal para vaporizar completamente 1 kg de agua a 100 ºC. tridimensional. La figura 2.2 muestra un diagrama cualitativo de una sustancia que se contrae al congelarse. 2.3 SUPERFICIE P,V,T Los estados de equilibrio de una sustancia simple compresible pueden representarse como superficie en un espacio Figura 2.2 Diagrama p, v T para una sustancia que se contrae al solidificar. Un punto de estado representado en la figura 2.2 sobre la línea de separación de una región monofásica2 a otra bifásica se conoce como estado de saturación. La línea curva que separa de la región líquido vapor, línea a-m-c, se conoce como línea de líquido saturado y cualquier estado representado por un punto sobre esta línea se conoce como un estado de líquido saturado. De igual manera, los estados representados sobre la curva c-nb, son estados de vapor saturado. líquida y la gaseosa, para la sustancia agua en particular las propiedades del punto crítico son Tc = 373,95 ºC, Pc =22,06 MPa, Vc =0,003106 m3/kg. 2.4 DIAGRAMA PRESIÓN TEMPERATURA La superficie p-v-T puede proyectarse sobre el plano p-v y el plano T-v, y el p-T. En la figura 2.3 (c) un punto de estado a lo largo de la curva de vaporización la presión y la temperatura en este estado se conoce como la presión de saturación y temperatura de saturación, la presión de saturación se conoce también como presión de vapor. Otro estado único de la materia está El punto de estado donde la línea de líquido saturado y vapor saturado se llama punto crítico. La existencia del punto crítico demuestra que la distinción entre la fase 2 - Sustancia que se encuentra en una sola fase. 23 TERMODINÁMICA TÉCNICA representado por el punto triple y señalado como estado triple, implica que en este estado triple coexisten los tres fases. El Ing. Carlos Fidel Cruz Mamani punto triple del agua se le asigna T= 0,01ºC y p = 0,6117 KPa. Figura 2.3 Diagramas p‐ v; T‐v; p ‐T para una sustancia. Donde se puede representar un punto en la región bifásica indicando que es una mezcla líquido y vapor saturados. 2.5 DIAGRAMA PRESIÓN - VOLUMEN ESPECÍFICO En la figura 2.4 se muestra la proyección de la superficie P,v.T sobre el plano P-v. Figura 2.4 Diagrama P‐v de una sustancia que se contrae al solidificarse. En el diagrama presión volumen se observa las regiones de líquido comprimido, zona de líquido-vapor y la región de vapor sobrecalentado. se encuentra, es decir cuando no está a punto de evaporarse. Un líquido a punto de evaporarse se llama líquido saturado, se encuentra en condiciones de equilibrio con su vapor. Se denomina líquido comprimido o líquido subenfriado, a un líquido que está sometido a una presión mayor de equilibrio liquidovapor correspondiente a la temperatura que Un vapor que está a punto de condensarse se llama vapor saturado. 24 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani cálculos, denotamos con el subíndice “fg”, esto es, Se denomina vapor sobrecalentado a un vapor que se encuentra a una temperatura superior a la de equilibrio con su líquido correspondiente a la presión a que está sometido. (2.3) Por lo tanto la ecuación 2.2 es, · Para diferenciar un estado de líquido saturado o vapor saturado, se hace uso del subíndice “f” para indicar que el estado es de líquido saturado, mientras que el subíndice “g” se aplica para señalar un estado de vapor saturado. El subíndice combinado “fg” se utiliza para indicar el cambio de una propiedad de líquido saturado a vapor saturado. (3.4) 2.7 TABLAS DE PROPIEDADES DE SUSTANCIAS PURAS Las propiedades específicas del vapor de agua, tanto del vapor saturado como del vapor sobrecalentado se encuentran en tablas a diferentes presiones y temperaturas. Estas propiedades específicas que se deben conocer son: v ; volumen específico. u ; Energía interna específica 2.6 TÍTULO (CALIDAD) h ; Entalpía específica El título del vapor húmedo es el porcentaje de vapor que contiene una sustancia en su proceso de cambio de fase, normalmente representada mediante el símbolo x, también se expresa en fracción de unidad. El líquido saturado sólo tiene una calidad de 0 % ( x = 0). El vapor húmedo que se genera es un vapor saturado cuyo título es igual a la unidad es decir que no tiene humedad. Matemáticamente se expresa como la fracción de la masa de vapor sobre la masa total de la mezcla. s ; Entropía específica Estas propiedades pueden ser por ejemplo de líquido saturado, de vapor saturado, o de cambio de líquido saturado a vapor saturado. El subíndice “f” se utiliza para indicar: vf; volumen saturado. Conocido el título de un vapor, será posible calcular el valor específico de cualquier propiedad intensiva de una sustancia, en base a las propiedades de vapor saturado y líquido saturado que integran el vapor húmedo. Por ejemplo el volumen específico del vapor húmedo con calidad x valdrá: de líquido uf; energía interna especifica de líquido saturado (2.1) · específico hf; entalpía saturado. específica de líquido sf; entropía saturado. específica de líquido El subíndice “g” se utiliza para indicar: vg; volumen saturado. específico de vapor ug; energía interna especifica de vapor saturado (2.2) hg; entalpía específica de vapor saturado. sg; entropía específica de vapor saturado. La diferencia de los valores de volumen de vapor saturado y volumen de líquido saturado aparecen con frecuencia en los 25 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani Un ejemplo de las propiedades termodinámicas del vapor de agua se muestra en la siguiente tabla. TABLA 2.1 Propiedades del vapor de agua saturada. Se han elaborado tabulaciones para numerosas sustancias de las propiedades termodinámicas p,v,T, y en los capítulos siguientes se estudiaran de otras sustancias. 2.8 PROGRAMA “EES” En lugar de usar tablas para hallar propiedades del vapor, puede usarse el software de programa EES (Engineering Ecuation Solver). Las funciones básicas que vienen en el EES son para la solución de ecuaciones algebraicas, también puede resolver ecuaciones diferenciales y ecuaciones con variables complejas. Tiene muchas funciones de propiedades termo físicas para usar en cálculos de ingeniería. Similarmente las tablas del vapor son obtenidos por funciones de otras propiedades. Figura 2.5 Ventana del software de programa E.E.S. 2.9 PROBLEMAS DE APLICACIÓN 26 TERMODINÁMICA TÉCNICA PROBLEMA 2.1 Ing. Carlos Fidel Cruz Mamani Complete los espacios en blanco en la siguiente tabla de propiedades del vapor. En la última columna describa la condición del vapor. SOLUCIÓN: T, ºC v, m3/kg P, kPa u, kJ/kg Descripción de la fase 140 361,3 0,05 777,68 Mezcla líquido-vapor 155,48 550 0,001097 655,38 Líquido saturado. 225 600 0,4496 500 2500 0,14 3112,1 Vapor sobrecalentado -20 0,1035 1128,28 2346,8 Saturación sólido - vapor Vapor sobrecalentado Cálculo del título o calidad 0,05 0,001080 0,5089 0,001080 0,09633 Cálculo de la energía interna · 588,74 0,09633 · 1961,3 777,67 27 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani PROBLEMA 2.2 Una masa de vapor de agua, inicialmente se encuentra a 3 MPa y 400 ºC (Estado 1), se enfría a volumen constante hasta una temperatura de 200ºC (Estado 2). Después se extrae calor del agua a temperatura constante hasta que se alcanza el líquido saturado (Estado 3). Determínese, a) La presión final en el estado 3, b) La calidad al final del proceso a volumen constante. c) La variación total de volumen específico en m3/kg, d) La variación de energía interna específica en kJ/kg entre los estados 2 y 3, finalmente e) Dibujar un esquema de los procesos en el diagrama Presión-volumen. SOLUCIÓN: a) De tablas de vapor de agua con P1=3 MPa y T1= 400 ºC, el volumen específico es. V1= 0,09936 m3/kg T2= 200 ºC, se obtiene la presión final en el estado 3, que corresponde a. P3= 1,5538 [MPa] 15,538 c) La variación total del volumen específico es: ∆ ∆ ∆ b El estado 2 se encuentra a T2 = 200 ºC y el volumen específico es el mismo del estado 1, 0,09936 0,12736 0,001157 0,09936 0,0982 d) La variación de la energía interna específica se evalúa por 850,65 ∆ 0,001157 0,001157 ∆ X2= 77,8 % 28 2208,26 1357,6 TERMODINÁMICA TÉCNICA PROBLEMA 2.3 Ing. Carlos Fidel Cruz Mamani Un recipiente rígido y aislado contiene al inicio 1.4 kg de agua líquida saturada y vapor de agua a 200 ºC. En este estado el agua líquida ocupa 25 % del volumen y el resto lo ocupa el vapor. Se enciende una resistencia eléctrica colocada en el recipiente y se observa que después de 20 minutos éste contiene vapor saturado. Determine a) el volumen del recipiente, en litros, b) la temperatura final, en ºC, y c) la potencia nominal de la resistencia, en kW. DATOS m=1,4 kg T =200 ºC V= 0,25 VR t = 20 min SOLUCIÓN El volumen específico en el estado final es: a) El volumen del agua líquida ocupa el 25 % del volumen del recipiente. 0.25 0.004503 ……………………….(1) b) De tablas de propiedades de agua saturada, corresponde a temperatura final. De tabla de propiedades del agua saturada con T=200 ºC, se tiene, vf= 0,0011565 [m3/kg] Tfinal = 370.98 ºC Sustituyendo en ecuación (1) 1,4 · 0,0011565 · 0,25 Para un sistema aislado el trabajo eléctrico de la resistencia es. / ……………..(3) El volumen del recipiente es: 0,006476 Donde con temperaturas de T1= 200 ºC , u1= 850.65 [kJ/kg], y T2= 370 ºC, u2= 2228.6 [kJ/kg]. o VR= 6.476 [litros] Sustituyendo en (3) La masa de vapor contenida el 75 % del volumen del recipiente es: . · 1.43812 · 2228.6 850.65 1981.65 kJ ………………………..(2) c) Finalmente la potencia nominal de la resistencia es: Siendo vg=0,1274 m3/kg 1981.65 · kJ 1200 · s 0.038124 kg La masa de la mezcla, 1.4 0.038124 1.43812 kg Ŵ = 1.65 [kW] 29 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani CAPÍTULO 3 RELACIONES DE ENERGÍA, TRABAJO Y CALOR OBJETIVOS • Introducir el concepto básico de Energía y trabajo. • Introducir los conceptos básicos de transferencia de calor incluyendo conducción, convección y radiación. • Presentar ejemplos y problemas de práctica que ilustran los conceptos estudiados. La energía es una propiedad asociada a los objetos y sustancias y se manifiesta en las transformaciones que ocurren en la naturaleza, es decir, la energía se manifiesta en los cambios físicos, por ejemplo, al elevar un objeto, transportarlo, deformarlo o calentarlo. 3.1 INTRODUCCIÓN En la Física se analizan formas de energía como energía cinética y la potencial gravitatoria , así como otras formas de energía incluyen la energía almacenada en una batería energía almacenada en un condensador eléctrico, energía potencial electrostática y la energía química debida al enlace de átomos y entre partículas subatómicas que tiene una gran importancia para el químico. La energía está presente también en los cambios químicos, como al quemar un trozo de madera o en la descomposición de agua mediante la corriente eléctrica. El estudio de los principios de la termodinámica permite relacionar los cambios de estas y otras formas de energía dentro de un sistema con las interacciones energéticas en las fronteras de un sistema. 3.2 NATURALEZA ENERGÍA DE La energía puede existir en varias formas: térmica, mecánica, cinética, potencial, eléctrica, química y nuclear, cuya suma conforma la energía total E de un sistema. Todos los tipos de energía E pueden clasificarse o como energía cinética (Ec) debido al movimiento de un cuerpo, o bien como energía potencial (Ep) debida a la posición de un cuerpo relativa a un campo de fuerzas de otros cuerpos. LA Al mirar a nuestro alrededor se observa que las plantas crecen, los animales se trasladan y que las máquinas y herramientas realizan las más variadas tareas. Todas estas actividades tienen en común que precisan del concurso de la energía. Además los tipos de energía pueden clasificarse o en extrínsecos (ext) o en intrínsecos (int). (3.1) 30 TERMODINÁMICA TÉCNICA De la física clásica puede demostrarse que la energía cinética total de un sistema de partículas puede expresarse como suma de tres términos. , , energía que pueden experimentar cuerpos o sistemas y se los hace dicha medida con algún punto de referencia seleccionado. La unidad de energía que se usó en el pasado y que actualmente se usa en forma de calor es Caloría o kilocaloría y para la energía en forma de trabajo se usaba el kilopondio-metro [kp.m] en el sistema técnico. En el sistema internacional de unidades como unidad de energía se utiliza el Julio, kilojulio, para todas las formas de energía y en casos especiales en kWh (unidad derivada de la energía). , (3.2) La energía potencial total de un sistema puede expresarse como suma de cuatro cantidades separadas. , , , , , (3.3) El Btu es una unidad de energía en forma de calor en el sistema Ingles y se define la cantidad de calor que se suministra a una libra de agua para elevar su temperatura 1º F. Las energías electrostáticas, magnetostática y macroscópica rotacional, no se consideran en este capítulo. Despreciando estos términos la ecuación es: . Ing. Carlos Fidel Cruz Mamani 1 Btu = 0,252 Kcal 1 Btu = 1,055056 KJ . 1 Kcal = 4,186 KJ (3.4) 1 KWh = 3600 KJ 1 KWh = 3412,14 Btu De la ecuación 3.4, los dos últimos términos no se pueden medir directamente, y la suma de estas dos contribuciones microscópicas a la energía se define como energía interna U de la sustancia del sistema. 1 termia = 105 Btu = 1,055x105 KJ (gas natural) (3.5) 3.4 ENERGÍA MECÁNICA La energía mecánica se puede definir como la forma de energía que se puede convertir completamente el trabajo mecánico de modo directo mediante un dispositivo mecánico. Las formas más familiares de energía mecánica son la energía cinética y la energía potencial gravitacional. La función de energía interna, como se ha definido por la ecuación anterior, es una propiedad extensiva, intrínseca de una sustancia en estado de equilibrio. En ausencia de cambios de fase, reacciones químicas y reacciones nucleares, la energía interna U se denomina a veces energía sensible del sistema. La energía mecánica de un fluido en movimiento es: Tomando como base el estudio anterior la ecuación de la energía total de un sistema se convierte en: , , á (3.6) 3.3 MEDICIÓN DE LA ENERGÍA La termodinámica no proporciona información acerca del valor absoluto de la energía total de un cuerpo o sistema, pero sí la variación de energía que se experimenta en los procesos, ya que es más fácil determinar estas variaciones de 31 kJ (3.7) TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani 3.4.1 Energía cinética Un cuerpo de masa “m” tiene energía cinética cuando está sometida a una fuerza que la desplaza con una cierta velocidad, por lo tanto podemos decir que esta energía cinética de dicho cuerpo es el trabajo para que adquiera cierta velocidad. · kJ (3.8) (3.9) 3.4.2 Energía potencial gravitatoria Figura 3.1 Variación de energía interna en un sistema cerrado. La energía que posee un sistema como resultado de su elevación en un campo gravitacional se llama energía potencial y se escribe matemáticamente. 3.6 TRABAJO En termodinámica, el trabajo puede ser considerado como energía que se transfiere a través de la frontera de un sistema, por ejemplo el sistema que contiene gas en un cilindro, tal como muestra la figura 3.2. (3.10) · · kJ (3.11) 3.5 ENERGÍA INTERNA La energía interna de un cuerpo o sistema (fluido de trabajo) se debe a su actividad interna atómica o molecular, es decir, la energía interna de un cuerpo variará si dicho cuerpo se le comunica o extrae por ejemplo calor y trabajo, como muestra la figura 3.1, el proceso de evaporación del agua, debido a esto puede producirse un alejamiento entre átomos o moléculas, lo que se traduciría en una energía potencial interna. También puede producirse al comunicar o extraer energía movimiento en los átomos o moléculas, movimiento de traslación, rotación, o vibratorio traduciéndose en este caso en energía cinética interna. Figura 3.2 sistema cerrado que contiene un gas. La convención escogida para el trabajo positivo es que si el sistema realiza trabajo sobre el entorno, es positivo, por el contrario si se adiciona energía o trabajo al sistema, es trabajo negativo. Las unidades de trabajo en el sistema SI, Newton –metro (N-m) o Joules [J], en el sistema inglés, las unidades son ft-lbf. 1 Btu= 778 ft-lbf 3.6.1 Trabajo en las máquinas En las máquinas alternativas se conocen tres clases de trabajo; Trabajo ideal, trabajo indicado y trabajo al freno (llamado también efectivo, útil, en el eje). 32 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani El trabajo ideal es el que efectúa el fluido operante o sistema en el interior del cilindro sin tomar en cuenta las pérdidas y puede calcularse. El trabajo indicado es el trabajo que efectúa el fluido de trabajo en el interior del sistema tomando en cuenta las pérdidas. El trabajo para el freno o trabajo efectivo, útil o en el eje es el trabajo medido precisamente en el eje de salida del motor. W ; Trabajo ideal (calculable) Wi ; Trabajo indicado (medible) WB ; Trabajo al freno (medido a la salida del motor) 3.6.2 Trabajo compresión de expansión y Se efectúa trabajo cuando al desplazarse el pistón que va desalojando la frontera del fluido operante o sistema desde el estado 1 hasta el estado 2, se dice que ejecuto trabajo de compresión, pudiendo graficarse esta variación de estado que experimenta el fluido operante en un diagrama presión-volumen. Por el contrario si consideramos un gas como fluido operante, de modo que este se encuentra inicialmente comprimido, luego al expandirse efectúa trabajo de expansión. Figura 3.3 Pistón que realiza un trabajo en un proceso de compresión. El trabajo total de compresión o expansión en cuasiequilibrio durante un cambio finito de volumen es el sumatoria de los términos PdV para cada cambio de volumen diferencial. Matemáticamente esto se expresa mediante la relación. / (3.12) Téngase en cuenta que cuando el volumen disminuye, el valor del trabajo es negativo. La presión P debe expresarse en unidades absolutas. Una interacción de trabajo PdV está asociada con un proceso y su valor depende del camino del proceso. 33 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani 3.6.3 Otras formas de trabajo c) Trabajo de un resorte a) Trabajo eléctrico Si se modifica la longitud de un resorte mediante una fuerza de tracción o compresión que produce un desplazamiento, se dice que ha experimentado un trabajo en el resorte, se calcula por la expresión. Cuando se mueve una pequeña carga del punto 1 al punto 2 en un campo electrostático (por ejemplo un circuito eléctrico), el trabajo necesario para mover la carga en el campo se denomina trabajo eléctrico, puede calcularse como. · · (3.17) d) Trabajo hecho sobre barras sólidas elásticas (3.13) En el análisis de pilas químicas, baterías y condensadores, la diferencia de potencial es una propiedad intensiva del sistema. En estas condiciones, el trabajo eléctrico en equilibrio realizado sobre el sistema es. · En la barras elásticas la longitud cambia por el esfuerzo que se realiza sobre el mismo, por lo tanto se dice que ha generado un trabajo elástico, y se calcula por. La velocidad a la que se realiza trabajo sobre o por el sistema se define como la Potencia. En función de la potencia, el trabajo diferencial puede escribirse como. b) Trabajo en el eje (3.19) Puesto que el movimiento rotatorio del eje se suele expresar en función del número de revoluciones por unidad de tiempo n, a menudo es mas fácil calcular la potencia en el eje antes de calcular el trabajo en el eje, puede calcularse por. 2· La potencia mecánica suministrada a un sistema por una fuerza exterior se define como el producto escalar del vector fuerza exterior por el vector velocidad. á · (3.15) 2· · · · · (3.20) En cálculos de ingeniería con frecuencia se utiliza como unidad básica el vatio o también el kilovatio (kW) Si el par es constante durante el proceso, la expresión anterior conduce a. · (3.18) 3.7 POTENCIA Donde dQc es la carga eléctrica transportada bajo el potencial eléctrico (en pilas electroquímicas se denomina fuerza electromotriz), que es el potencial máximo de la pila. Siendo, · Á (3.14) 1W = 1 J/s 1 hp = 0.7455 kW (3.16) 1 hp = 0.7067 Btu/s 34 TERMODINÁMICA TÉCNICA La ecuación 3.21 se conoce como ley de Fourier de conducción de calor. El calor es conducido en la dirección de la temperatura decreciente, y el gradiente de temperatura se vuelve negativo cuando la temperatura disminuye con x creciente. 3.8 CALOR A mediados del siglo XIX se llegó a una verdadera comprensión física sobre la naturaleza del calor, gracias al desarrollo en ese tiempo de la teoría cinética la cual considera a las moléculas como diminutas esferas que se encuentran en movimiento y que por lo tanto poseen energía cinética. La convección es el modo de transferencia de energía entre una superficie sólida y líquido o gas adyacente que está en movimiento, y tiene que ver con los efectos combinados de conducción y movimiento del fluido: mientras más rápido sea éste mayor es la transferencia de calor por convección. Los experimentos del Ingles James P. Joule (1818-1889) publicados en 1843 son los que finalmente convencieron a los escépticos de que el calor no era una sustancia, así que se desechó la teoría del calórico, el calor es una forma de energía que puede existir independientemente de la materia. El hecho de que no haya flujo de energía en forma de calor entre cuerpos que están a igual temperatura se suele llamar principio cero de la Termodinámica, y dice: “Si dos cuerpos están en equilibrio térmico con un tercero, entonces ellos deben estar en equilibrio térmico entre sí”. de calor · por · (3.23) Donde: ,es la emisividad de la superficie. σ; es la contante de constante de StefanBoltzmann. La conducción es la transferencia de energía de las partículas más energéticas de una sustancia hacia las adyacentes menos energéticas como resultado de sus interacciones. La conducción puede ocurrir en sólidos, líquidos o gases; en estos dos últimos la conducción se debe a las colisiones de las moléculas durante su movimiento aleatorio mientras que en los sólidos se debe a la combinación de la vibración de las moléculas en una red y el transporte de energía mediante electrones libres. (3.22) Radiación es la energía que emite la materia en la forma de ondas electromagnéticas (o fotones) como resultados de cambios en las configuraciones electrónicas de los átomos o moléculas. A diferencia de la conducción y la convección, la transferencia de energía por radiación no requiere la presencia de un medio. De hecho, este tipo de transferencia es la más rápida, las ondas electromagnéticas viajan a la velocidad de la luz (c=3x108 m/s) y no experimenta ninguna atenuación en un vacío. La termodinámica analiza la interacción entre el sistema y su entorno que se denomina interacción de calor o transferencia de calor, por eso el calor se puede transferir de tres formas distintas: conducción, convección y radiación. 3.8.1 Transferencia conducción Ing. Carlos Fidel Cruz Mamani 5.67 10 (3.21) 35 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani 3.9 CALOR GENERADO POR LA COMBUSTIÓN existir en estado sólido, líquido y gaseoso, como por ejemplo. La combustión es la reacción química violenta de dos cuerpos el comburente (oxígeno) y el combustible que se produce con gran desprendimiento de calor. Químicamente definimos como una oxidación instantánea del combustible frente al contacto del oxígeno. Gasolina C8 H18 (octano) Gasóleo C12H26 (dodecano) Gas natural CH4 (metano) 3.9.2 Aire de combustión El oxígeno es necesario en toda reacción de combustión. El oxígeno puro se utiliza solamente en aplicaciones especiales como el corte y la soldadura. En la mayoría de las aplicaciones de la combustión es el aire el que proporciona el oxígeno necesario. Se considera que el aire está compuesto de un 21 % de oxígeno y un 79 %de nitrógeno en base molar. Figura 3.4 Proceso de combustión Para los cálculos de combustión la masa molecular del aire se toma igual a 28,97 [kg aire/kmol aire]. En este capítulo tratamos con las reacciones de combustión expresadas en la forma siguiente. Combustible + Comburente --->Productos Con esta idealización la relación molar entre nitrógeno y oxígeno es 0,79/0,21=3,76 Considérese como ejemplos sencillos de combustión completa del hidrógeno y el carbón con el oxígeno. 1 1 1 1 Por tanto cuando el aire suministra el oxigeno en una reacción de combustión, cada mol de oxígeno va acompañado de 3.76 moles de nitrógeno. El aire considerado aquí no tiene vapor de agua. (3.24) (3.25) Cuando el aire presente en la combustión es húmedo, el vapor de agua presente hay que considerarlo al escribir la ecuación de combustión. Se dice que un combustible se ha quemado completamente si todo su carbono se ha transformado en dióxido de carbono, todo su hidrógeno en agua y todo su azufre en dióxido de azufre. El nitrógeno como uno de los productos de la reacción se encuentra a la misma temperatura que los otros productos. Si alcanza una temperatura suficientemente alta, el nitrógeno puede formar compuestos como el óxido nítrico y el dióxido de nitrógeno. Incluso simples trazas de óxidos de nitrógeno presentes en los gases emitidos por los motores de combustión interna, son una fuente de contaminación del aire. 3.9.1 Combustible Es simplemente una sustancia susceptible a ser quemada. En este capítulo se hace énfasis en los hidrocarburos, que contienen carbono hidrógeno. Pueden contener también azufre y otros elementos químicos. Estos combustibles pueden 36 TERMODINÁMICA TÉCNICA Matemáticamente se escribe. Dos parámetros frecuentemente utilizados para cuantificar las cantidades de combustible y de aire en un proceso particular de combustión son la relación de aire-combustible y su inversa la relación combustible-aire. / Ing. Carlos Fidel Cruz Mamani (3.28) é La eficiencia de una bomba expresa la salida de potencia mecánica del fluido sobre la potencia mecánica en el eje. Matemáticamente se escribe. Δ (3.29) (3.26) Una eficiencia de combustión de 100 por ciento indica que el combustible se quema completamente y los gases residuales salen de la cámara de combustión a temperatura ambiente. 3.10 EFICIENCIA Eficiencia indica que tan bien se realiza un proceso de conversión o transferencia de energía. El desempeño o eficiencia se expresa en términos de la salida deseada y la entrada requerida. ñ . í ó (3.30) (3.27) La eficiencia global se caracteriza por el producto de las eficiencias de cada máquina. Por ejemplo de la figura anterior, la eficiencia global del conjunto motor y bomba es: En la figura 3.5 la eficiencia de un motor eléctrico expresa la salida de potencia mecánica en el eje sobre potencia eléctrica requerida del motor para su funcionamiento. Δ é (3.31) Las eficiencias globales están entre 25 y 30 por ciento para motores de automóviles de gasolina, entre 34 y 40 por ciento para los de diesel y entre 40 y 60 por ciento para las grandes centrales eléctricas. Figura 3.5 Esquema de un motor y Bomba 3.11 PROBLEMAS 37 TERMODINÁMICA TÉCNICA PROBLEMA 3.1 Ing. Carlos Fidel Cruz Mamani La figura muestra un colector solar plano cuya superficie es de 3 m2. El colector recibe radiación solar a razón de 470 W/m2. El 40 % de la energía, recibida se pierde por transferencia de calor por el entorno. El resto se utiliza para calentar agua desde 54,5 ºC hasta 71 ºC. El agua pasa a través del colector solar con una pérdida despreciable de presión. Determine la producción de agua caliente, en kg/min, para la operación en estado estacionario. ¿Cuántos colectores de este tipo serian necesarios para producir 150 litros de agua a 71 ºC en 30 min? DATOS: A = 3 m2 R = 470 Qperd = 40 % Te = 54.5 ° Ts = 71 ° SOLUCIÓN La energía recibida por el colector solar es: 3 470 1410 El agua recibe 60% del calor por el colector siendo que 40% es pérdidas. 0.6 0.6 1460 846 ………. (1) Despejando el flujo de masa de agua se tiene. . . ° . ° ……………………(2) -----------------> 0.0122 El flujo de agua convirtiendo a kg/min será: 0.735 Si un solo colector solar produce agua caliente 0.735 [kg/min], para 150 minutos será: º ………………(3) 38 en un tiempo de 30 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani Donde: 5 Sustituyendo en (3) ° N ° 5 0.735 6.8 7 Colectores solares 39 TERMODINÁMICA TÉCNICA PROBLEMA 3.2 Ing. Carlos Fidel Cruz Mamani Una bomba de aceite extrae 35 kW de potencia eléctrica mientras bombea aceite con ρ = 860 kg/m3 a una tasa de 0,1 m3/s. Los diámetros de entrada y salida de la tubería son 8 cm y 12 cm respectivamente. Si el aumento de presión en la bomba se determina como 400 kPa y la eficiencia del motor es de 90 %, determine la eficiencia mecánica de la bomba. (figura-a) DATOS: ρ = 860 kg/m3 C =0.1 m3/s D1= 8 cm D2= 12 cm ∆P= 400 kPa SOLUCIÓN La eficiencia mecánica de la bomba viene expresada por: Δ …………………………… (1) Es conocido la eficiencia del motor eléctrico del 90 % é ……………………………… (2) De donde despejando la potencia en el eje es. é 0.9 35 31.5 La potencia mecánica del fluido se determina por la expresión siguiente. ∆ ………………(3) El flujo de masa se determina por la ecuación del caudal. 0.1 860 86 [kg/s] Siendo: ∆ 400 (Z2-Z1); es despreciable 40 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani Las velocidades se obtienen a partir del caudal. . Por lo tanto: 19.89 . 4 0.1 0.12 8.84 Sustituyendo en la ecuación (3) se tiene. ∆ 86 8.84 400 860 19.89 2 10 26.35 ∆ Finalmente sustituyendo en (1) 26.35 31.5 ηBOMBA = 83.65 % 41 0.8365 * TERMODINÁMICA TÉCNICA PROBLEMA 3.3 Ing. Carlos Fidel Cruz Mamani En una instalación industrial se utilizan 500 lámparas fluorescentes de 40 W para satisfacer los requerimientos de iluminación. Las lámparas se encuentran cerca del final de su periodo de servicio y serán reemplazadas por otras de alta eficiencia de 34 W que operan con los balastros estándar existentes. Las lámparas fluorescentes estándar y las de alta eficiencia se pueden comprar a 12 Bs. y 16 Bs. cada una respectivamente. La instalación opera 2800 horas al año y todas las lámparas se mantienen encendidas durante las horas de uso si el costo unitario de electricidad es de 0,82 Bs /(kW·h) y el factor del balastro es de 1,1(es decir consume 10 % de la potencia nominal de las lámparas), determine cuánta energía y dinero se ahorrará por año como resultado de cambiar a las lámparas de alta eficiencia. DATOS Nº =500 lamp. Pest= 50 W Pefic = 34 W H‐funciona= 2800 h/año S O L U C I Ó N Análisis para las lámparas estándar es el siguiente. º 500 · 20 40 20000 Considerando el factor del balastro 1.1 20 22 La energía consumida es: í . í 22 · 2800 ………………..(1) 61600 ñ ñ El costo de la iluminación de la energía consumida es. ó ó í 61600 ñ 0.82 50512 Análisis para las lámparas de alta eficiencia 42 ………………… (2) ñ TERMODINÁMICA TÉCNICA º 500 · 17 Ing. Carlos Fidel Cruz Mamani 34 17000 Ahora considerando el factor del balastro 1.1 17 18.7 La energía consumida por las lámparas de alta eficiencia es. . í 18.7 · í 2800 52360 ñ ñ El costo de la iluminación por la energía consumida en ecuación 2 se tiene. ó 52360 0.82 ñ 42935.2 ñ Evaluando costo de las lámparas por año. 12 500 16 6000 ñ 500 ñ 8000 ñ ñ La energía ahorrada es. í 40 34 61600 ñ 52360 9240 ñ ñ El ahorro de dinero es. 40 50512 7576.8 42935.2 2000 43 í 34 7576.8 5576.8 ñ ñ TERMODINÁMICA TÉCNICA PROBLEMA 3.4 Ing. Carlos Fidel Cruz Mamani Un aerogenerador tiene una hélice de 2 m de diámetro, será instalada en Potosí en un sitio donde el viento sopla de forma constante a una velocidad promedio de 30 km /h. Determine cuanto de potencia eléctrica puede generar el aerogenerador si se supone que el 30 % de la Potencia máxima del viento real es transformada en electricidad. DATOS D =2 m V= 30 km/h= 8.33 m/s η =30 % h = 4060 [m.s.n.m] altura de Potosi (ciudad) Tprom=7 ºC temperatura local. Patm= 62.43 [kPa] ciudad de Potosi. z = 7 m altura del mástil. SOLUCIÓN La potencia máxima del viento disponible es. · · Donde: 0.77652 3.1416 8.33 La energía cinética del viento es. · ………(2) . La densidad del aire seco en potosí se calcula por. 0.03469 . es decir; . . 0.77652 20.32 , 3.1416 34.69 704.9 El área que atraviesa el viento es. 4 34.69 Sustituyendo en (1) Despreciando la altura del aerogenerador la densidad aproximada es. 2 4 / ……………….(3) · . 20.32 …………(1) Por el concepto de eficiencia 0.30 704.9 Sustituyendo en (2) PELT=211.47 [W] 44 211.47 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani CAPÍTULO 4 PERIMERA LEY DE LA TERMODINÁMICA OBJETIVOS • Aplicar la primera ley a un proceso que comprenda un sistema. • Introducir los conceptos de entalpía y calores específicos. • Presentar problemas de aplicación con la primera Ley de la Termodinámica. cúbicos de gas natural y se evitan la emisión de toneladas de anhídrido. 4.1 INTRODUCCIÓN El consumo energía es uno de los parámetros para medir el progreso y bienestar de una sociedad. América Latina es la parte del mundo que más depende del petróleo. Pero esta fuente de energía se agota en el mundo. El Potencial de energía eólica, geotérmica y de biomasa es enorme en América central y del sur. Cuan importantes serán las energías renovables en el futuro, se estima que hasta el año 2020 el consumo de electricidad aumentará anualmente entre un 3,2 % y un 5,6 %. Figura 4.1 Paneles fotovoltaicos transforman energía solar en eléctrica En la actualidad se sigue buscando otras formas de energía que no conduzcan problemas consigo, como la contaminación, el aumento del efecto invernadero y la perforación de la capa de ozono, precisamente se apuntan a las energías alternativas. que Se puede aprovechar el calor del subsuelo en las zonas donde ello es posible, transformando la energía geotérmica en electricidad. Hablar del término energía indica diversas acepciones y definiciones, relacionadas con la idea de una capacidad para realizar trabajo, transformar, poner en movimiento. No solo la energía solar puede ser empleada para generar electricidad utilizando el efecto fotoeléctrico, sino en paneles solares domésticos que calienta el agua para las duchas. Con ello se ahorran unos metros 45 TERMODINÁMICA TÉCNICA 4.2 PRIMER PRINCIPIO DE LA TERMODINÁMICA Ing. Carlos Fidel Cruz Mamani 4.3 ECUACIÓN DE ENERGÍA DE SISTEMAS CERRADOS SIN FLUJO Este principio o ley de la conservación de la energía expresa lo siguiente: Un sistema es cerrado y sin flujo cuando está contenido en un recinto cerrado por paredes de modo que no existe intercambio de masa con el medio exterior. La expresión matemática de la energía que se define es. “La energía no se crea ni se destruye, solamente se transforma” Mas modernamente se enuncia como primer principio de la termodinámica al siguiente postulado: (4.1) “El trabajo que un sistema intercambia con el medio en una transformación adiabática, depende del estado inicial del que parte y del estado final a que llega; con independencia de los estados intermedios por los que el sistema pasa”. La afirmación anterior es consecuencia de la evidencia experimental iniciada con los experimentos de Joule a principios del siglo XIX. Figura 4.3 Sistema cerrado sin flujo. Si suponemos ahora que el sistema cerrado que consideramos, a descrito un ciclo. Es decir que el estado final coincide con el inicial será U2=U1 y la ecuación se reduce a: (4.2) La anterior ecuación será en consecuencia la expresión matemática del primer principio para el caso de un sistema cerrado que describe un ciclo termodinámico. Figura 4.2 Sistema de bomba de calor. Ya hemos descrito la energía interna como una consecuencia del estado molecular de un sistema dado de un fluido. Ahora bien aceptada la primera ley, demostraremos que como una consecuencia de ella existe la energía interna y es una propiedad. En la figura 4.2, muestra una bomba de calor que recibe energía a partir de un compresor, el cual transfiere al fluido de trabajo elevando su temperatura y presión, este fluido cede su energía al medio que le rodea en forma de transferencia de calor. (4.3) 46 TERMODINÁMICA TÉCNICA 4.4 PROPIEDADES ENERGÍA INTERNA DE Ing. Carlos Fidel Cruz Mamani ∆ LA (4.7) 4.6 PRIMERA LEY APLICADA A UN PROCESO La disminución de energía interna de un sistema cerrado mide el trabajo en una transformación adiabática del mismo. La primera ley de termodinámica se aplica con frecuencia a un proceso cuando el sistema cambia de un estado a otro. Si aplicamos la primera ley a un ciclo compuesto de dos procesos, tal como se muestra en la figura 4.4. (4.4) En un proceso a volumen constante de un sistema cerrado, que sólo puede intercambiar trabajo con el medio por variación de volumen, el calor intercambiado es igual a la variación de la energía interna del sistema. (4.5) 4.5 ECUACIÓN DE ENERGÍA DE UN SISTEMA CON FLUJO ESTACIONARIO Figura 4.4 Ciclo compuesto de dos procesos. (4.8) Se llama flujo estacionario cuando no hay variación de masa y la energía total en el sistema es constante. El cambio es independiente de la trayectoria entre los estados 1 y 2, entonces se tiene. (4.9) La cantidad E representa: energía cinética, potencial, e interna que incluye energía química. (4.10) 4.7 ENTALPÍA La entalpía es una propiedad termodinámica compuesta de energía interna y energía de flujo, y tiene unidades de energía y se designa por la letra “H” , en el sistema internacional la entalpía [kJ]. Figura 4.3 Sistema con flujo estacionario El balance de energía para la figura 4.3, el calor transferido es igual al cambio de la energía cinética, energía potencial gravitatoria, energía interna y una transformación de la energía en trabajo. ∆ ∆ ∆ ∆ (4.11) El trabajo realizado para el proceso a presión constante esta dado. (4.6) Generalmente ΔEp es despreciable y ΔEc en algunos casos es despreciable. (4.12) 47 TERMODINÁMICA TÉCNICA La primera ley se puede escribir entonces. Ing. Carlos Fidel Cruz Mamani 4.9 IRREVERSIBILIDAD Los procesos reales y fenómenos reales son siempre irreversibles (4.13) La cantidad en paréntesis es una combinación de propiedades, entonces es una propiedad denominada entalpía. Por ejemplo si tenemos un sistema cerrado sin flujo donde inicialmente el sistema gas está comprimido en un cilindro mediante un pistón acoplado mediante una biela a un volante. Si dejamos libre el pistón este se desplazará y se producirá trabajo que nos entrega el sistema. (4.14) (4.15) También se puede escribir en diferencial. (4.16) 4.7.1 Energía de flujo o corriente Para introducir o sacar una cierta cantidad de fluido en un sistema de referencia es necesaria una cierta cantidad de energía (p·dv), que se denomina energía de flujo o corriente, llamado también trabajo de flujo o corriente, debido a que es necesario un trabajo para introducir o sacar un fluido en el sistema de referencia. Figura 4.6 Sistema cerrado cilindro pistón Esta energía se acumula en el volante físico como energía cinética, que luego de una vuelta devuelve al sistema la energía en forma de trabajo comprimiéndola, pero el pistón no alcanza el punto de partida inicial sino un punto 1´ debido a las pérdidas que se produce. 4.8 REVERSIBILIDAD Los fenómenos y procesos son reversibles cuando ocurre exactamente igual pero en sentido contrario. Por ejemplo si una canica de vidrio al rebotar alcanzara la misma distancia antes del rebote, entonces tendríamos un fenómeno reversible, pero en realidad no se alcanza la misma altura de donde se dejó caer la canica y por lo tanto es un fenómeno no reversible. 4.9.1 Irreversibilidad interna Se denomina irreversibilidad interna cuando las pérdidas se producen en el interior del sistema. Así por ejemplo la irreversibilidad interna del sistema fluido de la figura anterior (4.6), se debe a las pérdidas por rozamiento o choques de las moléculas del fluido entre sí como también con pared interior del cilindro Un proceso es reversible si partimos de un punto de estado a otro y de este vuelve al punto de estado inicial. 4.9.2 Irreversibilidad externa Existe irreversibilidad externa cuando las pérdidas se producen fuera del sistema considerado por ejemplo si el sistema considerado es la figura anterior (4.6), las pérdidas se producen en el sistema máquina (pérdidas por rozamiento en los puntos A, B, C y D). Figura 4.5 Diagrama p‐v de un proceso reversible 48 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani Para una cv (T) conocida, esto se puede integrar para hallar el cambio de energía interna sobre cualquier intervalo de temperatura para un gas ideal. 4.10 CALOR ESPECÍFICO El calor específico de una sustancia es la variación de calor que experimenta cierta cantidad de su masa al variar su temperatura. (4.20) (4.17) · 4.10.2 Calor específico a presión constante El calor específico determinado experimentalmente tiene valores para diferentes sustancias. El calor específico a presión constante de un gas se puede determinar si a este gas lo encerramos en un cilindro mediante un pistón y en estas condiciones le comunicamos calor a presión constante ya que al desplazarse el pistón se mantiene la presión constante. La variación de calor que experimenta una determinada sustancia conociendo su masa esta relacionado por la expresión matemática siguiente: · (4.18) 4.10.1 Calor específico a volumen constante Para determinar el calor específico a volumen constante de un gas, consideramos este gas contenido en un recipiente de paredes rígidas de modo que no varíe su volumen, en estas condiciones comunicamos calor al gas, donde dicho calor se traducirá en un incremento de la energía interna del gas. Figura 4.8 Sistema cerrado que contiene un gas a presión constante El calor específico a presión constante, se define como: (4.21) En los límites de temperatura se puede hallar la variación de entalpía de un gas. · (4.22) Figura 4.7 Sistema cerrado que contiene un gas. Como u, v y T son todas ellas propiedades, la derivada parcial también es una propiedad y se llama calor específico a volumen constante. 4.10.3 Relación de calores específicos de gases ideales Una relación especial entre cv y cp para gases ideales se obtiene al derivar la relación: h=u+RT, lo cual produce. (4.19) 49 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani (4.23) (4.26) Si se reemplaza dh por cp dT y du por cv dT, y se divide la expresión resultante entre dT, se obtiene. Donde: c ;es el calor específico de la sustancia (4.24) M ; es la masa molecular. En este acápite se introduce otra propiedad del gas ideal conocida como relación de calores específicos k, definida como: 4.10.5 Calor específico variable El calor específico varía en función de presiones y temperaturas. El calor específico a presión constante variará exclusivamente en función de la temperatura de acuerdo a la siguiente ecuación empírica. (4.25) Para el aire usaremos, cv= 0.718 [KJ/kg ºK], (0.171 Btu/lbm-ºR) (4.27) cp= 1.005 [KJ/kg ºK], (0.24 Btu/lbm-ºR) Para el agua, usaremos el valor nominal de 4.18 [KJ/kg ºC] (1 Btu/lbm ºR) Donde, los coeficientes a, b, c, d y e se encuentran en tablas para los diferentes gases. 4.10.4 Calor específico molar Ru = 8,314 [kJ/kmol ºK], es la constante universal de los gases. El calor específico molar es igual al producto de su calor específico por el producto de su masa molecular. Para el análisis consideremos el sistema compuesto de masa contenida en el volumen1, junto con la contenida en el volumen de control fijo, como se muestra en la figura 4.9. 4.11 PRINCIPIO DE CONSERVACIÓN DE LA MASA Cuando se aplique la ecuación de energía a volúmenes de control, con frecuencia es necesario aplicar el principio de conservación de masa cuando se mueve por un volumen en el espacio. Figura 4.9 Sistema de flujo permanente para el análisis de conservación de la masa. 50 TERMODINÁMICA TÉCNICA Las líneas segmentadas limitan el volumen de control. Así, si en el incremento de tiempo ∆t la masa ∆m1 es el pequeño incremento del conducto que entra en el volumen de control, y la masa ∆m2 de la figura 4.8 b sale del volumen de control de tal modo que en el tiempo t+∆t, el sistema ocupa entonces el volumen de control y mas el volumen 2. El principio de conservación de masa exige que la masa del sistema permanezca constante durante su estudio, esto matemáticamente se expresa. (4.28) Se expresa que el gasto másico que entra es igual al gasto másico que sale, más la cantidad de masa almacenada en el volumen de control, y si son múltiples entradas y salidas la expresión es. ∑ ∑ (4.29) Para situaciones de estado estacionario con una entrada y salida en la que la masa y el volumen de control permanecen constantes, la ecuación se reduce a: ∑ ∑ Ing. Carlos Fidel Cruz Mamani (4.30) El gasto másico (también llamado flujo másico) se encuentra por: · · (4.31) También se suele usar la ecuación del gasto volumétrico que se define como el caudal de volumen sobre tiempo. · (4.32) Siendo: A; el área de la superficie por el que pasa la masa, en m2. V; velocidad perpendicular al área, en m/s2. ρ; densidad de la sustancia, kg/m3. 4.12 PROBLEMAS 51 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani Problema 4.1 Dieciséis cubos de hielo, cada uno con una temperatura de -10 ºC y un volumen de 8 mililitros, se agregan a un litro de agua a 20 ºC en el recipiente aislado de la figura 2. ¿Cuál es la temperatura de equilibrio del agua? Utilice (cp)hielo= 2.1 kJ/kg ºC. ρhielo= 917 kg/m3. DATOS VHielo = 16 * 8 ml = 128 =1 ? Teq FIGURA – 2 SOLUCION - Aplicando la 1ra ley de la termodinámica . - (T T mH cH 0 – TH mHielo 0 Donde: mH ρH V = 100 O mH cH 1l 1 Kg 4.186 O K KJ Kg°C Ti = 20 °C mH ρH V = 917 mH cH Kg 128 ml m 0.117376 Kg 2.1 52 KJ Kg°C TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani TH = -10 °C λH - (Teq Kg Ti) = mHielo* CHielo * TH + mHielo Multiplicando m/m (-1) ( )= * * TH mHielo * = mH* CH* TH + mH * TH H H - KJ Ordenando la ecuación: - - 330 F Reemplazando Valores: . K . ° . ° . Teq K . 9.09 ° 53 . ° ° ° TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani Problema 4.2 Un compresor aspira 14.16 m3/min de aire con una densidad de 1.265 Kg/m3 y lo descarga con una densidad de 4.87 Kg/m3. En la aspiración la presión de entrada es de 1.035 bar y a la salida 5.5 bar. El incremento de la energía interna específica es 79 kJ/kg y el calor procedente del enfriamiento del aire es 30 kJ/kg. Despreciando los cambios de las energías potencial cinética, determinar la potencia hecho sobre el aire en kilovatios. D A T O S 14.16 m min V ρ1 de aire 1.265 ρ2 4.87 P1 200 P2 4000 ∆ Figura 4.2 79 30 S O L U C I Ó N - Realizando un balance energético al sistema compresor. … … … … … … 1 ∆ - … … … … … 3 Siendo: ρ - … … … … … … 2 . 0.79 Las energías de flujo. P1 V1 1.035 105 N 3 2 m 0.79 m Kg 1J N m 81.765 P2 V2 5.5 105 N 3 2 m 0.205 m Kg 54 1J N m 1KJ 103 J 1KJ 103 J TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani 112.75 - Sustituyendo en (3). - W = 79 + 112.75 - 81.765 + 30 - W = 140 Multiplicando por (-1). W = -140 El signo (-) significa que se entrega trabajo al sistema. ρ 14.16 m min 1.265 17.91 - La potencia esta dada por: 17.91 140 P = 41.79 [KW] 55 TERMODINÁMICA TÉCNICA Problema 4.3 Ing. Carlos Fidel Cruz Mamani Se desea calentar agua para bañarse en una tina, mediante un calentador eléctrico una cantidad de 200 litros, elevando su temperatura de 10 ºC a 40 ºC. El calentador eléctrico es de inmersión, considerando las pérdidas del calor en un 30 % y el calentamiento debe efectuarse en 30 min. Determinar: a) El costo de la energía utilizada, si el precio unitario de energía es 0,82 [Bs./kW·h] b) La Potencia del calentador, en kW y su resistencia, en ohmios. DATOS: V=200 litros Ti=10 ºC Tf=40 ºC Qperd= 30 % t=30 min. SOLUCIÓN El calor ganado por el agua es: a) El costo de energía utilizada es: Costo = Econsum * Cost.unit Qgan = mH 2O * CH 2O (T f − Ti ) KKKK (1) · Donde: Qgan = 200 Kg * 4,186 200 Costo = 9,97 KW * h *0,82 KJ (40 − 10)º C Kg º C Costo =¨8,175[ Bs ] Re sp. Qgan=25116 [kJ] b) La potencia del calentador es: Considerando la pérdida, por lo que el calentador entrega un calor de: Pelt = η = 100 − 30 = 70% . Pelt = 35880 [kJ] 9,97 KW * h 60 min * 30 min 1h La resistencia del calentador es: Econsum = Qcal Econsum = 35880 KJ * Econsum t Pelt = 19, 94[ KW ] ≈ 20[ KW ] La energía utilizada es: 9.97 Bs KW * h 1KW * h 3600 KJ R = 2, 42[Ω ] Re sp. · 56 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani C APÍTULO 5 G ASES I DEALES Y R EALES OBJETIVOS Presentar las Leyes de gases ideales. Examinar los métodos de análisis del comportamiento de los gases. Modelar el comportamiento de las mezclas de gases ideales en general. 5.1 GASES IDEALES PERFECTOS La ecuación que define el enunciado es: O · Se denominan gases perfectos o ideales a los gases que cumplen con las leyes de GayLussac y Boyle y Mariotte. (5.1) Generalizando para cualquier estado se tiene. . Muchos de los gases reales se encontrarán en condiciones de gas perfecto y cumplirá con suficiente aproximación con las leyes mencionadas, cuando estos se encuentren en un estado alejado de los correspondientes al equilibrio líquido-vapor. Para ello en general debe estar sometido a una presión baja si su temperatura no es elevada. (5.2) 5.3 LEY DE CHARLES Y GAY – LUSSAC La Ley de Charles fue establecida por el Físico Frances Jack Charles, conjuntamente con Louis Gay-Lussac otro Frances, esta Ley tiene dos enunciados que expresamos separadamente: 5.2 LEY DE BOYLE Y MARIOTTE “Si se mantiene constante la presión de una cierta cantidad de gas, la temperatura varía directamente proporcional al volumen en un cambio de estado” Robert Boyle Físico Ingles estableció la Ley que lleva su nombre experimentando con el aire y dice: “Si mantenemos constante la temperatura de una cierta cantidad de gas, la presión varía inversamente con el volumen cuando se produce un cambio de estado o proceso”. Figura 5.2 Un gas que aumenta de volumen al subir la temperatura. La ecuación que define esta Ley es; Figura 5.1 Un gas que está sometido a compresión. 57 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani (5.3) (5.8) Generalizando para cualquier estado se tiene. 5.5 ECUACIÓN DE ESTADO DE LOS GASES IDEALES (5.4) Esta ecuación expresa en una sola fórmula las dos Leyes antes estudiadas, relacionando en una misma ecuación la presión, volumen y temperatura. (LEY DE GAY-LUSSAC) “Si se mantiene constante el volumen de una cierta cantidad de gas, la temperatura varía directamente proporcional a la presión en un cambio de estado”. La ecuación que define esta Ley es; · · · (5.9) · · · (5.10) · (5.5) · (5.11) 5.5.1 Constante universal de los gases “Ru” La constante universal de los gases tiene el mismo valor para todos los gases y la podemos obtener a partir de la ecuación característica de los gases ideales. Generalizando, es: (5.6) 5.4 LEY DE AVOGADRO 0,08314 Amadeo Avogadro (1776-1856) físico italiano estableció la siguiente ley que dice: “Volúmenes iguales de gases ideales a una presión y temperaturas constantes particulares, contiene el mismo número de moléculas” 8.314 1.986 0.730 · ·° ·° ·° · ·° 5.5.2 Constante del gas “R” La constante del gas se determina experimentalmente para cada gas, en condiciones normales o de laboratorio, así por ejemplo para el aire, se tiene las siguientes mediciones. Figura 5.3 Experiencia de la Ley de Avogadro. La ecuación que establece esta ley es. P = 1,01325x105 [N/m2] (5.7) T = 273 ºK (t=0 ºC) v = 0,7735 [m3/kg] Generalizando es: 58 TERMODINÁMICA TÉCNICA Aplicando la ecuación siguiente se tiene: · Ing. Carlos Fidel Cruz Mamani Fuente: Termodinámica Técnica de MoranShapiro, pag. 698 (5.12) 5.6.1 Ley de Dalton R = 287 [J/kg ºK] A principios del siglo XIX, un profesor Ingles de matemáticas llamado John Dalton hizo el descubrimiento de que la atmósfera está compuesta por muchos gases distintos. Encontró que cada uno de estos gases creaba su propia presión y que la presión total era igual a la suma de las presiones parciales. 5.6 ANÁLISIS DE LA COMPOSICIÓN DE LAS MEZCLAS DE GASES IDEALES Generalmente la composición de una mezcla se especifica tanto en función de la masa de cada componente como el número de moles de cada uno de los componentes. Dalton enunció la ley que dice: (5.13) “En una mezcla de gases, la presión total ejercida por la mezcla es igual a la suma de las presiones parciales que cada gas ejercería si estuviese sólo en las mismas condiciones”. Para una mezcla no reactiva de gases, la masa de la mezcla es: (5.14) · Las cantidades relativas de los componentes presentes en la mezcla se pueden describir en términos de fracciones molares. (5.16) · (5.15) “En una mezcla de gases el volumen total que la mezcla ocupa es igual a la suma de los volúmenes parciales correspondientes a cada gas” · 78.08 28.95 0.93 0.03 0.01 · (5.18) Tabla 5.1 Componentes del aire atmosférico. Nitrógeno Oxigeno Argón Dióxido de carbono Neón, helio,y otros (5.17) La ley de Amagat se puede enunciar diciendo: Por ejemplo el aire seco se refiere solamente a la mezcla de componentes gaseosos del aire atmosférico quitando el vapor de agua y los contaminantes. Fracción molar % · 5.6.2 Ley de Amagat En una mezcla de gases que no reaccionan entre sí, cada molécula se mueve independientemente, como si estuviera totalmente aislada. Componente · · · · (5.19) 5.7 MASA MOLECULAR DE LA MEZCLA Definiremos como masa molecular de una mezcla de gases a un número M que cumple con la relación. 59 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani El verdadero comportamiento de los gases reales, para muchos estados se aleja bastante del que expresan las leyes de los gases perfectos. Existen estados para los cuales un gas real es más compresible que un gas ideal, y otros, en el que el gas real es menos compresible que el gas ideal. Este hecho ha motivado la necesidad de encontrar otras ecuaciones de estado que expresan más exactamente el verdadero comportamiento de los gases reales. (5.20) La masa molecular aparente de la mezcla se puede calcular como el promedio de las masas moleculares de los componentes, ponderados por sus fracciones molares respectivas. Por ejemplo para el aire es. 0.7808 28.02 0.2095 32 0.0093 39.94 0.0003 44.01 28.97 5.9.1 Ecuación de estado de VAN DER WAALS 5.8 ENERGÍA INTERNA, ENTALPÍA Y ENTROPÍA DE MEZCLA DE GASES IDEALES La ecuación de estado para gases reales de Van Der Waals ha sido la primera elaborada para tener en cuenta los apartamientos de los gases reales del cumplimiento de la de los gases perfectos. En una mezcla de gases ideales la temperatura T es la misma para todos los gases de la mezcla, que ocupa un volumen V a una presión total P. Aplicando la ley de GibbsDalton, que es una generalización de la ley de Dalton de las presiones aditivas se pueden obtener otras propiedades Termodinámicas de los gases individuales y de la mezcla. · (5.26) Donde: 3 Basándose en la Ley de Gibbs-Dalton la energía total de la mezcla es: 3 8 3 (5.21) (5.22) 5.9.2 Ecuación de estado de Redlich Kwong (5.23) La ecuación de estado de REDLICHKWONG tiene un gran interés por que su precisión es considerable en un amplio intervalo de valores de PvT, especialmente cuando T es mayor que el valor crítico. Redlich y Kwong propusieron en 1949 la siguiente relación: En el análisis energético de sistemas cerrados lo que se necesita es la variación de energía interna. ∆ ∑ ∆ (5.24) ∆ ∑ ∆ (5.25) 5.9 GASES REALES √ 60 (5.27) TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani Donde: · 0.4275 0.086 · 5.10 FACTOR COMPRESIBILIDAD DE En la práctica para el tratamiento de gases reales se usa el llamado factor de compresibilidad que se establece a partir de la ecuación característica de gases ideales. · · (5.28) Figura 5.4 Gráfica del factor de compresibilidad para el gas metano. Se puede escribir la igualdad escribiendo: · · · (5.29) También se puede obtener el factor de compresibilidad cuando se tiene datos de v T o v P. Es mejor utilizar el volumen seudocrítico y que es volumen que ocuparía el gas en el estado crítico si en él se comportara como un gas perfecto. El coeficiente Z no es constante, sino que es función del estado del gas, y se llama factor de compresibilidad. Los valores de Z se tabula en función de los parámetros, presión reducida y temperatura reducida. También se determina en forma experimental y construir un diagrama de coeficiente de compresibilidad válido para todos los gases. · Si denominamos volumen seudorreducido al cociente entre el volumen del gas en un cierto estado y el volumen sudocrítico del mismo. En la figura 5.4 se ilustra una gráfica del factor de compresibilidad para el metano los valores se dibujan contra la presión para varias temperaturas constantes3. 3 (5.30) · (5.31) Con este parámetro seudorreducido se determina el factor de compresibilidad de la mezcla. J.M. Smith “Introducción a la Termodinámica en Ingeniería Química” Ed. McGrawHill. 61 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani Problema 5.1 Un tanque cilindro que contiene 4 Kg de gas monóxido de carbono a ‐50 tienen diámetro interior de 0.2 m y una longitud de 1 m determine la presión, en bar, ejercida por el gas utilizando (a) la ecuación de estado del gas ideal, (b) la ecuación de Van Der Waals (c) la ecuación de estado Redlich‐Kwong (sugerencia, hallar las constantes por tablas). DATOS m=4 CO T = -50 D = 0.2 L=1 SOLUCIÓN - El volumen ocupado por el gas CO es: V - π D 4 3.1416 0.2 4 L 1 m 0.0314 m El volumen especifico molar del gas. V M v M V 28 K K . K 0.2198 K a) La ecuación de estado del gas ideal es: P *V m* R* T … … … … 1 P *M v Ru T … … … … 2 P R T . N . °K K °K K P = 84.35 [bar] 62 8435040.9 N N TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani b) Para el CO, las constantes a y b de la ecuación de VAN DER WAALS, pueden obtenerse directamente de la tabla A – 23. a 1.474 - ; b 0.0395 La ecuación de VAN DER WAALS: … … … … 3 P P N . . K . °K °K K . . P =72.3 c) Las constantes de Redlich – Kwong pueden obtenerse de tabla A-23. ; a 17.22 - 0.02737 La ecuación de Redlich – Kwong. - Sustituyendo valores P=75.1 [bar] 63 ………… 4 TERMODINÁMICA TÉCNICA Problema 5.2 Ing. Carlos Fidel Cruz Mamani Dos depósitos rígidos y aislados están conectados por una válvula. Inicialmente 0,79 kmol de nitrógeno a 2 Atm y 250 ºC llenan uno de los depósitos. El otro contiene 0,21 kmol de oxígeno a 1 Atm y 300 ºK. la válvula se abre y los gases se mezclan hasta alcanzar el estado de equilibrio final. Durante este proceso no hay intercambio de calor o trabajo entre el contenido de los depósitos y el entorno. Determine la temperatura de la mezcla en ºK y la presión de la mezcla, en Atm. Tomar cv=0,742 kJ/kgºK para N2 y cv= 0,655 kJ/kg ºK para el O2. D A T O S nN 2 = 0, 79 [ Kmol ] GAS N 2 PN 2 = 2 [ Atm] TN 2 = 250 [ º K ] nO 2 = 0, 21[ Kmol ] GAS O2 PO 2 = 1 [ Atm ] TN 2 = 300 [ º K ] ⎡ Kg ⎤ M N 2 = 28, 02 ⎢ ( Peso molecular N 2 ) ⎣ Kmol ⎥⎦ ⎡ Kg ⎤ M O 2 = 32 ⎢ ( Peso molecular O2 ) ⎣ Kmol ⎥⎦ S O L U C I Ó N Aplicando la 1ª Ley de la termodinámica al sistema cerrado o o ΔU = Q − W ⇒ U 2 − U1 = 0 KK (1) Donde U1 = mN 2 ∗ CvN 2 ∗ TN 2 + mO2 ∗ CvO2 ∗ TO2 ( ) ( ) U1 = nN 2 * M N 2 * CvN 2 * TN 2 + nO2 * M O2 * CvO2 * TO2 KK ( 2 ) U 2 = nN 2 * M N 2 * CvN 2 * TX + nO2 * M O2 * CvO2 * TX KK ( 3) 64 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani Sustituyendo en las ecuaciones (2) y (3) en (1) ( ) ( ) nN 2 * M N2 * CvN 2 * TX + nO2 * M O2 * CvO2 * TX − ⎡ nN2 * M N 2 CvN 2 * TN2 + nO2 * M O2 CvO2 * TO2 ⎤ = 0 ⎣ ⎦ Despejando Tx se tiene: TX = nN2 * M N2 * CvN2 * TN2 + nO2 * M O2 * CvO2 * TO2 nN2 * M N2 * CvN2 + nO2 * M O2 * CvO2 Kg KJ Kg KJ * 0, 742 * 250 º K + 0, 21 Kmol *32 * 0, 655 *300 º K Kmol Kg ° K Kmol Kg ° K Kg KJ Kg KJ 0, 79 Kmol * 28, 02 * 0, 742 * 0, 655 + 0, 21 Kmol *32 Kmol Kg ° K Kmol Kg ° K 0, 79 Kmol * 28, 02 TX = Tx=260.56 ºK El volumen ocupado por la mezcla es: V = VN 2 + VO2 V= nN2 * Ru * TN2 PN2 + nO2 * Ru * TO2 PO2 KKKK (4) Por las ecuaciones de los gases ideales: Px *V = n * Ru * Tx Px = n * Ru * Tx V Siendo: Px = Px = n = nN 2 + nO2 = 1Kmol n * Ru * Tx nN2 * Ru * TN2 nO2 * Ru * TO2 + PN2 PO2 1Kmol * 260º K =1.61 [Atm] ; 0, 79 Kmol * 250º K 0, 21Kmol *300ºPxK + 2 Atm 1Atm 65 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani CAPÍTULO 6 P ROCESOS EN G ASES I DEALES OBJETIVOS • • • Introducir el análisis de procesos o transformaciones Termodinámicas. Describir el experimento de Joule – Thompson. Presentar ciclos Termodinámicos que involucren procesos transformaciones. 6.1 INTRODUCCIÓN Un ciclo termodinámico es el conjunto de procesos y por lo tanto es necesario conocer estos procesos termodinámicos o cambios de estado que se efectúa en diferentes condiciones. En ingeniería es importante proyectar instalaciones que realicen la transformación de los distintos tipos de energía. Este capítulo trata del análisis de transformaciones a partir de una fuente de energía que mediante algunos dispositivos empleados se realiza el proceso de su transformación principalmente para producir potencia. Por ejemplo el ciclo termodinámico de producción de vapor realiza diferentes procesos para la transformación de la energía térmica en energía eléctrica. Figura 6.2 Ciclo de producción de vapor. 6.2 PROCESO CONSTANTE A VOLUMEN Es un cambio de estado a volumen constante, internamente reversible. Se llama también proceso isométrico o isocórico. Figura 6.3 Diagramas p-v y T-s. Figura 6.1 Producción de vapor simple. 66 TERMODINÁMICA TÉCNICA El trabajo en esta transformación es cero. · 0 El trabajo en esta transformación es el área descrita en el plano p-v. (6.1) · El calor se calcula por la relación siguiente. · (6.2.b) (6.5.a) · Donde: m; es la masa de la sustancia, en kg. Cv; es el calor específico a volumen constante, en [kJ/kg ºK] ∆ ∆ · (6.5.b) Donde: m; es la masa de la sustancia, en kg. cp; es el calor específico a volumen constante, en [kJ/kg ºK] El trabajo para un proceso con flujo estacionario es. ∆ (6.4) El calor para este proceso se calcula por las relaciones siguientes. (6.2.a) · Ing. Carlos Fidel Cruz Mamani Si el proceso se lleva cabo con flujo constante a presión constante la relación de trabajo es: (6.3) ∆ (6.6) Siendo: 6.4 PROCESO ISOTÉRMICO ∆ ; variación de energía de flujo. ∆ ; variación de energía cinética. ∆ ; variación de energía potencial. 6.3 PROCESO CONSTANTE A Se denomina proceso isotérmico a una transformación del gas donde la temperatura permanece constante. En este caso se cumplirá la Ley de Boyle – Mariotte es decir, . PRESIÓN En el plano presión – volumen se representa mediante una curva correspondiente a una hipérbola equilátera. En la figura 6.4, aparece su representación en el diagrama p-v y t-s. En este caso el sistema intercambia trabajo con el medio. Llamado también proceso isobárico. Figura 6.5 Diagrama isotérmico. Figura 6.4 Diagrama p-v y T-s para un proceso isobárico. El trabajo en un proceso isotérmico es: 67 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani Las relaciones de presión, volumen y temperatura para un proceso adiabático son: (6.7) O también: (6.11) (6.8) (6.12) El calor en un proceso isotérmico sin flujo es: (6.9) (6.13) El trabajo en un proceso isotérmico con flujo y despreciando la energía potencial será: ∆ Recordando que el exponente k es, El trabajo en un proceso isoentrópico es. (6.10) (6.14) 6.5 PROCESO ISOENTRÓPICO El proceso isoentrópico significa a entropía constante. Esta transformación se estudiará en muchos de los capítulos siguientes de este texto. O también. 1 (6.15) En cuanto al calor específico de la adiabática, dado que la misma se produce variación de temperatura sin intercambio de calor, será nulo.c adiab= 0 Un proceso isoentrópico es una transformación adiabática internamente reversible. El sistema no intercambia calor con el medio en ningún momento de la misma. En consecuencia, para que una transformacón sea adiabática, deberá cumplirse. 6.6 PROCESO ISOENTÁLPICO La variación de entropía es ∆s = 0 En la figura 6.7 un dispositivo de estrangulación puede hacer una reducción significativa de la presión de manera simple, introduciendo una válvula en el conducto por el que fluye un gas o un líquido. Figura 6.6 Diagrama isoentrópico. Figura 6.7 Dispositivo de estrangulación. El calor es Q = 0 68 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani Escribamos la expresión del primer principio para el sistema circulante: (6.16.a) En nuestro caso, Figura 6.8 Dispositivo de estrangulación. Q=0; por estar aislado térmicamente el conducto. El gas cambió de estado, en 1 tenía una cierta presión p1 y en 2 tiene otra presión p2 diferente, pero no se modificó ni la temperatura ni la entalpía, por tanto se puede afirmar que para los gases perfectos la entalpía es función únicamente de la temperatura, y en consecuencia tendrá una única derivada que será: W=0; porque no existe en el sistema mecanismo de transferencia de energía mecánica. ; por el mismo nivel de referencia. (6.16) (6.19) Aunque las velocidades son relativamente altas en las proximidades de la restricción, las mediciones realizadas corrientes arriba y corrientes debajo de la sección del área reducida mostraran que la variación de la energía cinética específica del gas es despreciable. 6.7 PROCESO POLITRÓPICO Una transformación politrópica es un cambio de estado en el que varía todas las propiedades (presión, volumen, temperatura, entropía, entalpía, etc). También en este proceso existe transmisión o transferencia de calor y para su análisis se lo considera a este proceso como internamente reversible. Por tanto resulta. (6.17) Es decir que el estrangulamiento conduce el gas a un estado con igual entalpía que al inicio de la reducción brusca de presión. En las figuras siguientes mostramos los diagramas p-V y T-s, para un proceso politrópico. 6.6.1 Experimento de Joule-Thomson Joule y William Thomson idearon en 1853 el famoso experimento del tabique poroso, que consiste en un conducto térmicamente aislado, por el que circula o fluye un gas, se coloca un obstáculo que consiste en un tapón poroso, que deja pasar el gas ofreciendo una resistencia de modo que la presión baja ostensiblemente después del tapón. Figura 6.9 Diagrama de un proceso politrópico. 69 TERMODINÁMICA TÉCNICA En las transformaciones politropicas el valor n puede tener cualquier valor, y por la experiencia la relación es especialmente útil cuando 1 n 5/3. Las ecuaciones que rigen este proceso tienen un parecido con las ecuaciones isentrópicas donde el exponente “k” se reemplaza por el exponente “n” que se denomina exponente politrópico. La ecuación diferencial de la politrópica corresponde a: 0 Ing. Carlos Fidel Cruz Mamani Para valores particulares de n , se reduce al siguiente análisis. (6.20) 0 Isobárico En consecuencia las expresiones obtenidas son: 1 Isotérmico Adiabático (6.21) ∞ Isocórico (6.22) (6.23) El trabajo para un proceso politrópico será. (6.24) Sin embargo cuando se conoce datos de presión, conduce a otra ecuación siguiente. 1 (6.24.a) Figura 6.10 Evolución politrópica. El calor para un proceso politrópico con flujo es: 6.8 PROBLEMAS Las ecuaciones desarrolladas en esta sección, se ilustran con los siguientes ejemplos. (6.25) Siendo: (6.26) El trabajo para un proceso politrópico con flujo estacionario es: (6.27) 70 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani Problema 6.1 Un ciclo de aire estándar trabaja con 0,9 kg de aire, que comienza a una presión de 2,75 kg/cm2 abs. a una temperatura de 127 ºC y v1=0,42 m3/kg. El proceso inicia con una transformación isobárica de calentamiento hasta una temperatura de 927 ºC, luego realiza un proceso de enfriamiento a volumen constante hasta la presión de 1 kg/cm2 abs. v3= 1,25 m3/kg, continúa con un proceso de enfriamiento isobárico hasta la temperatura de 27 ºC. Finalmente el ciclo se cierra con un proceso de compresión isentrópica hasta el estado inicial. Determinar. a) La cantidad de calor suministrado y calor cedido. b) La producción de trabajo neto. c) Calcule el rendimiento térmico d) Calcule la variación de entropía en el proceso isométrico. S O L U C I Ó N a) El calor suministrado se realiza en el proceso 1‐2, y se calcula por: Q sum = m ⋅ c p ⋅ (T2 − T1 ) [kJ] ……………(1) Donde: m= 0,9 kg cp= 1,005 [kJ/kg ºK] T2=1200 ºK T1= 400 ºK Qsum = 723,6 [kJ] El calor cedido se realiza en dos procesos 2‐3 y 3‐4, se calcula por: 71 TERMODINÁMICA TÉCNICA Qced = Q2 −3 + Q3− 4 Ing. Carlos Fidel Cruz Mamani Qced = m ⋅ c v ⋅ (T3 − T2 ) + m ⋅ c p ⋅ (T4 − T3 ) [kJ] …………..(2) Siendo: cv= 0,718 [kJ/kg ºK] T4=300 ºK La temperatura T3 se calcula evaluando el proceso2‐3, se tiene: ⎛p ⎞ T3 p = 3 ⇒ T3 = T2 ⎜⎜ 3 ⎟⎟ T2 p 2 ⎝ p2 ⎠ Donde: p3= 1 [kg/cm2] P2= 2,75 [kg/cm2] T3 = 436,36 ºK Sustituyendo en (4) Qced= ‐616.80 [kJ] b) El trabajo neto del ciclo es. W = ∑ Q = Qsum + Qced W= 106.79 [kJ] c) El rendimiento térmico del ciclo es: ηT = ηT = 14,7% Wn Q sum La variación de entropía en el proceso isométrico es: ⎛T ⎞ ΔS = mcv ln⎜⎜ 3 ⎟⎟ ⎝ T2 ⎠ ∆ 0.6537 º 72 TERMODINÁMICA TÉCNICA Problema 6.2 Ing. Carlos Fidel Cruz Mamani El agua contenida en un dispositivo cilindro‐pistón sufre dos procesos sucesivos desde un estado donde la presión inicial es 10 bar y la temperatura es 400 ºC. Proceso 1‐2: El agua se enfría mientras es comprimida a presión constante hasta el estado de vapor saturado a 10 bar. Proceso 2‐3: El agua se enfría a volumen constante hasta 150 ºC. a) Represéntese ambos procesos sobre los diagramas p‐V y T‐V b) Determínese el trabajo, en kJ/kg, para el proceso completo. c) Determínese la transferencia de calor, en kJ/kg, para el proceso completo. S O L U C I O N a) b) El pistón es el único mecanismo de trabajo. - ……………… 1 El proceso 2-3 el volumen s constante por lo tanto dV = 0; - 0 …………………(2) Dividiendo por la masa se tiene: ………….………..(3) - El volumen especifico en el estado 1 se encuentra de tablas de y T1 40 ° Con P1 10 v1 0.3066 - u1 2957.3 En el estado 2, es vapor saturado a P2 10 73 ; v2 0.1944 TERMODINÁMICA TÉCNICA W 10 10 Ing. Carlos Fidel Cruz Mamani 0.1944 0.3066 W 112.2 (El signo menos indica que el trabajo se hace sobre el vapor de agua mediante el pistón). c) El balance de energía para el proceso completo es: u3 – u1 Q – W Q u3 – u1 W ; - Donde : se toman de tablas a 150° 0.1944 1.0905 10 0.3928 1.0905 10 631.68 0.494 2559.5 1583.9 - 0.494 631.98 Sustituyendo valores en el balance de energía. Q 1583.9 – 2957.3 ‐ 112.2 1485.6 Q – (El signo menos señala que la energía es cedida al exterior mediante transferencia de calor). 74 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani Problema 6.2 El diagrama Temperatura – entropía específico (T‐ s), de un ciclo de aire estándar, se muestra en la figura 6.2. El ciclo consta de compresión isentrópica, absorción de calor a volumen constante, expansión isentrópica y cesión de calor a presión constante. Para este ciclo en particular, la relación de compresión en la compresión isentrópica es v 1/v 2 = 8.5. Al comienzo del proceso de compresión, la presión es P1= 100 kPa y la temperatura T1= 300 ºK. El calor absorbido a volumen constante por unidad de masa es 1400 kJ/kg. Determinar: a) El trabajo neto en kJ/kg de aire. b) El rendimiento térmico del ciclo. c) La presión media efectiva, en kPa. d) Realizar el diagrama p ‐ v. S O L U C I Ó N Aplicando la ecuación de estado de un gas ideal. · · ………………………………………(1) Si R=287 [J/kg ºK] para el aire. · 287 300 100 10 0.861 Por la relación de compresión. . . 0.10129 . 2000.72 Para el proceso isentrópico (1‐2) 100 8.5 El proceso 2‐3 es a volumen constante y el calor adicionado es. …………………………….(2) 75 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani Despejando la presión P3 se tiene. 1 7529.4 El calor rechazado esta dado por. …………………………………..(3) La temperatura en el estado 3 es, 7529.4 10 · 0.10129 287 2657.33 ° Para el proceso 3‐4 se tiene la relación siguiente. 2657.33 773.09 ° a) El trabajo neto del ciclo es ∑ , ……………………………(4) 1400 1.005 773.09 300 924.54 b) El rendimiento térmico del ciclo es: c) La presión media efectiva es: 66 % . . . d) Diagrama P‐v pme=436.64 [kPa] 76 . . . TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani CAPÍTULO 7 LA SEGUNDA LEY DE LA TERMODINÁMICA OBJETIVOS • Introducir los conceptos básicos y definiciones requeridos por la segunda ley de la Termodinámica. • Introducir el concepto de entropía. • Presentar el ciclo y la máquina de CARNOT. conversión de una cierta cantidad de calor en trabajo mecánico. 7.1 INTRODUCCIÓN El primer principio de la termodinámica, nos permite afirmar que las diversas formas de energía son equivalentes, pero no nos dice nada en cuanto a la posibilidad de la conversión de un cierto tipo de energía en otro y a las limitaciones que pueden o no existir para dicha transformación. Es el segundo principio el que nos indicará las limitaciones que existen en las transformaciones energéticas. 7.2 ENUNCIADOS SEGUNDA LEY TERMODINÁMICA DE DE Con dicho concepto de máquina térmica el enunciado de Carnot puede expresarse: “Toda máquina térmica requiere para su funcionamiento al menos dos fuentes de calor a diferentes temperaturas. La máquina funcionará tomando calor de la fuente de mayor temperatura, que denominaremos fuente caliente, producirá trabajo y entregará calor a la fuente de menor temperatura, que llamaremos fuente fría”4. LA LA 7.2.1 Enunciado de Carnot Nicolás Léonard Sadi Carnot (1796 - 1832) Para entender adecuadamente el enunciado de Carnot del segundo principio debemos, en primer lugar, definir lo que se entiende en él por máquinas térmicas. Se entiende por máquina térmica todo equipo que transforma calor en trabajo mecánico operando cíclicamente. Es decir, que toda máquina térmica está constituida por ciertos mecanismos y algún fluido que evoluciona en ellos, de manera que al describir dicho fluido un ciclo termodinámico se produce la Figura 7.1 El esquema representativo de una máquina térmica que funciona de acuerdo con el enunciado de Carnot. 4 77 Termodinámica Técnica, Carlos García, Ed. Alsina TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani 7.2.2 Según Kelvin – Planck El enunciado de Kelvin – Planck es el siguiente. “Es imposible construir una máquina con un solo depósito de calor que, mientras funcione siguiendo un ciclo, produzca otros efectos que el de realizar trabajo a base de tomar calor de dicho depósito enfriándolo”. Este enunciado de Kelvin- Planck exige que cualquier dispositivo cíclico que produzca un trabajo neto intercambie calor por lo menos con dos fuentes térmicas a diferentes temperaturas. Figura 7.3 Esquema del enunciado de Clausius. Esta exigencia describe simplemente una máquina frigorífica, un dispositivo que funciona cíclicamente, transfiere energía térmica desde una región de baja temperatura a otra de alta temperatura. Figura 7.2 Esquema del enunciado de Kelvin‐Planck. El postulado exige que los motores térmicos funcionen entre dos cuerpos a diferentes temperaturas. Sin embargo, el cuerpo a baja temperatura no puede ser una fuente de energía como lo es de alta temperatura. 7.2.4 Según Hatsopoulos – Keenan Cualquier sistema con ciertas restricciones especificadas y que tenga un límite superior en su volumen puede, desde cualquier estado inicial, alcanzar un estado de equilibrio estable sin ningún efecto sobre el ambiente. 7.2.3 Según Clausius5 Clausius estudia las posibilidades de intercambio de calor entre dos fuentes a diferentes temperaturas. Un colorario importante del enunciado de Hatsopoulos Keenan es: “Si un sistema esta en equilibrio estable, no puede cambiar a otro estado de equilibrio estable con un trabajo neto de salida como el único efecto externo al sistema”. El mismo expresa. “Es imposible la existencia de un sistema que pueda funcionar de modo que su único efecto sea una transferencia de energía mediante calor de un cuerpo frío a otro más caliente”. 7.3 EQUIVALENCIA ENUNCIADOS LOS La equivalencia entre los enunciados de Carnot, Kelvin y Planck es evidente y no necesita demostración. Para demostrarla equivalencia entre el enunciado de Kelvin – Planck y el de Clausius como se ve en el esquema siguiente. 5 DE Temodinámica, Kenneth Wark 78 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani Figura 7.1 Causa de irreversibilidad por rozamiento. El cuerpo de la posición 1 al ser desplazado a la posición 2 realizó trabajo por la fuerza exterior, este trabajo por el rozamiento se convertirá en energía térmica que inicialmente quedará incorporada al cuerpo y sobre el cual rozó, después de un tiempo esta energía térmica transferirá al medio que le rodea. En resumen los procesos irreversibles incluyen una o mas de las siguientes irreversibilidades Figura 7.4 Esquema de los enunciados de Kelvin – Planck y Clausius. Podemos planear el siguiente Balance de energía para la máquina cíclica es. - Transferencia de calor a través de una diferencia finita de temperaturas. (7.1) - Expansión libre de un gas ó líquido hasta una presión más baja. Pero la energía Q3 se divide en dos. (7.2) - Reacción química espontánea. Además: - Mezcla espontánea de sustancias con diferente composición o estado. Por lo tanto se tiene. - Rozamiento- tanto de deslizamiento como de viscosidad en el seno de un fluido. En conclusión la violación del enunciado de Kelvin – Planck implica violar el enunciado de Clausius. - Flujo de corriente eléctrica a través de una resistencia eléctrica. - Magnetización histéresis. 7.4 PROCESOS IRREVERSIBLES o polarización con - Deformación inelástica. Se dice que un proceso es irreversible si, una vez que el proceso ha tenido lugar, resulta imposible devolver al sistema y a todas las partes del entorno a sus respectivos estados iniciales. 7.5 DESIGUALDAD DE CLAUSIUS Considérese un sistema B, y aplicando la primera ley al sistema, la ecuación es: Un ejemplo de las transformaciones naturales es el rozamiento cuando se produce el desplazamiento de un cuerpo sólido cuando esta en contacto con otro, como se muestra en la figura 7.1. (7.3) 79 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani 7.6 LA ENTROPÍA BASE DE LA SEGUNDA LEY DE LA TERMODINÁMICA Muchos de los fenómenos tienen naturaleza direccional, sin embargo los enunciados presentados necesitan una forma analítica aplicable a los procesos energéticos. Es ahora que se muestra la expresión matemática para la propiedad llamada entropía. Si los procesos son todos reversibles, ningún trabajo neto tendrá que suministrarse, en otras palabras, la integral cíclica de dWA es igual a cero y, por tanto, podemos escribir la expresión de la desigualdad de Clausius: Figura 7.2 Gráfico para la demostración de la desigualdad de Clausius. Los flujos de energía simultáneamente se obtendrá: tienen Esta ecuación conduce a un resultado importante. Si la integral a lo largo del ciclo arbitrario de una magnitud es cero, entonces la magnitud es una propiedad y se le ha dado el nombre de entropía, llamada también Ecuación de la segunda Ley de la Termodinámica. lugar (7.4) Aplicando la primera ley al motor R da: (7.10) (7.5) Sustituyendo el calor que recibe, obtenemos Para un cambio finito e internamente reversible, como se muestra en la siguiente figura. (7.6) Para un sistema A el trabajo total es : (7.7) Concluimos que: ∫ δW A = To ∫ δQs T ≤0 (7.8) Finalmente la relación conocida con el nombre de desigualdad de Clausius, es: δQ (7.9) ∫ Ts ≤0 Figura 7.3 Cambio de entropía en un camino finito. ∆ Donde; 80 (7.11) · · TERMODINÁMICA TÉCNICA Realizando la integración: ∆ · · Ing. Carlos Fidel Cruz Mamani 1-2 Proceso isotérmico de expansión; se expande por que hay disminución de presión y aumento de volumen, en este proceso se suministra calor al fluido operante. (7.12) Así las leyes primera y segunda son semejantes en cuanto a que ambas conducen a la definición del cambio de una propiedad en función de las interacciones de la frontera de un sistema cerrado. 2-3 Proceso isentrópico de expansión; donde el fluido operante al expandirse produce trabajo. 7.7 EFICIENCIA O RENDIMIENTO DE UNA MÁQUINA TÉRMICA 3-4 Proceso isotérmico de compresión; internamente reversible durante la cual se cede un calor al medio exterior. En términos generales el rendimiento es igual al servicio sobre el gasto, es decir la producción obtenida sobre el consumido. 4-1 Proceso isentrópico de compresión; el fluido de trabajo alcanza la temperatura alta inicial. ó El rendimiento térmico de un ciclo será igual a la producción de trabajo de dicho ciclo, es decir, el calor convertido en trabajo sobre el calor consumido, se expresa por la siguiente ecuación: (7.13) Figura 7.4 diagrama P‐V de un ciclo de Carnot. 7.8 EL CICLO DE CARNOT Se mencionó anteriormente que las máquinas son dispositivos cíclicos y que el fluido de trabajo de una de estas máquinas vuelve a su estado inicial al final de cada ciclo. Durante una parte del ciclo el fluido realiza trabajo y durante otra se hace trabajo sobre el fluido. La diferencia entre estos dos momentos es el trabajo neto que entrega la máquina térmica. El ciclo de CARNOT es un ciclo considerado como el de mayor rendimiento térmico, por que el calor convertido en trabajo térmico es mayor con respecto a otros ciclos. Los ciclos ideales de las máquinas térmicas sirven también como patrones de comparación con ciclos reales de estas máquinas. El ciclo de Carnot está compuesto por cuatro procesos. Figura 7.5 Diagrama T-S del ciclo de Carnot. El calor adicionado o suministrado se realiza en el proceso isotérmico de expansión, entonces la relación matemática es: (7.14) 81 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani El calor cedido o rechazado por el ciclo se evalúa por: (7.18) (7.15) La eficiencia o rendimiento del ciclo Carnot se evalúa por: 1 (7.16) Siendo ; , la temperatura de la fuente de mayor temperatura. , es la temperatura de la fuente de menor temperatura. Figura 7.6 Diagrama P-V Para el ciclo de Carnot se conocen las relaciones. 7.9 CICLO DE REFRIGERACIÓN Y BOMBA DE CALOR ; Relación de expansión isentrópica. El segundo principio de la Termodinámica impone límites a las prestaciones de los ciclos de refrigeración y bomba de calor del mismo modo que a las de los ciclos de potencia. ; Relación de compresión isentrópica. ; Relación de expansión isotérmica. Para un ciclo de refrigeración el coeficiente de operación (coeficiente efecto frigorífico) es: ; Relación de compresión isotérmica. 7.8.1 Presión media del ciclo (7.19) En el plano presión –volumen de la figura 7.6, la superficie que encierra el ciclo representa el trabajo de dicho ciclo. Entre los mismos límites de este ciclo con relación a volúmenes podemos traducir dicha superficie en una superficie rectangular, de modo que el lado correspondiente a volúmenes de este rectángulo se designa lo que se llama el volumen de desplazamiento o cilindrada, el lado correspondiente a presiones se denomina presión media del ciclo, entonces el trabajo es. · El coeficiente de operación para un ciclo de bomba de calor es: (7.20) 7.10 CICLO INVERSO DE CARNOT Para introducir algunos aspectos importantes de la refrigeración empezaremos considerando un ciclo de Carnot de refrigeración de vapor. Este ciclo se obtiene invirtiendo el ciclo de Carnot de potencia de vapor. Todos los procesos son internamente reversibles. Además como la transferencia de calor entre el refrigerante y cada foco ocurre sin diferencia de temperaturas, no hay irreversibilidades externas. (7.17) Donde; pmc, es pa presión media del ciclo. VD, es el volumen desplazado. 82 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani El ciclo invertido de Carnot es el ciclo de refrigeración más eficiente que trabaja entre dos temperaturas, por lo tanto es un ciclo ideal. 7-11 PROBLEMAS Figura 7.7 Ciclo de refrigeración de Carnot. Figura 7.8 diagrama T‐s del ciclo inverso de Carnot. Considere la figura 7.7 un sistema ejecutando el ciclo invertido de Carnot, el fluido de trabajo absorbe calor isotérmicamente de una fuente de baja temperatura a TB en la cantidad de Qevap, se comprime isentrópicamente hasta el estado 2 mediante un compresor, en la que la temperatura se eleva hasta TA, rechaza calor isotérmicamente en un sumidero de alta temperatura a TA en la cantidad de Qcond y luego se expande isentrópicamente hasta el estado donde desciende su temperatura. Los coeficientes de desempeño se expresan en términos de temperaturas límites. (7.21) 83 TERMODINÁMICA TÉCNICA Problema 7.1 Ing. Carlos Fidel Cruz Mamani Dos máquinas térmicas reversibles están conectadas en serie entre dos fuentes de calor a temperaturas T1 = 900 ºC y T2 = ‐70 ºC. La fuente de mayor temperatura entrega a la primera máquina una cantidad de calor de 400 kcal, con un rendimiento térmico del 30 %. Determinar: a) La temperatura intermedia Ti a la que cede calor la primera máquina y recibe la segunda. b) El trabajo producido por cada una de las máquinas. c) El calor entregado por la segunda máquina a la fuente fría. d) El rendimiento térmico de toda la instalación. D A T O S T1= 900 ºC =1173 ºK T2= ‐70 ºC = 203 ºK Q 1= 400 kCal 30% Para las máquinas reversibles el rendimiento es: S O L U C I O N a) 1 ; de donde 1 Ti…………………………(1) =821.1[ºK] 1173 1 0.30 El rendimiento de la segunda máquina es. 1 1 b) ………………………..(2) . 0.753 Los trabajos producidos por las máquinas térmicas son. · ; de donde ; c) d) 75.3 % 0.3 400 120 502 .32 Por el primer principio de la termodinámica para la primera MT‐1 400 120 280 Para la segunda máquina el trabajo resulta. · 0.753 280 210.84 882.57 El calor generado por la segunda máquina es: 280 210.84 69,16 ; Q2 289.5 kJ El rendimiento de toda la instalación es: . . . 84 0.83 ηT 83 % TERMODINÁMICA TÉCNICA Problema 7.2 Ing. Carlos Fidel Cruz Mamani Una máquina térmica de Carnot opera entre una fuente caliente a 720 ºC y un sumidero a 27 ºK. Si la máquina térmica recibe calor a una tasa de 600 kJ/min, determine a) La eficiencia térmica, b) La salida de potencia de esta máquina, y c) el flujo de calor que libera la máquina térmica. D A T O S TH=720 ºC= 993 ºK TL=27 ºC= 300 ºK 600 S O L U C I Ó N a) Para las máquinas térmicas la eficiencia es: 1 1 ………………………………(1) 0.698 69.8 % b) La potencia de salida es. , , 0.698 600 ; de donde, 418.8 , 6.98 c) El calor liberado por la máquina es. , 600 418.8 181.2 85 , TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani Problema 7.3 Un ciclo de Carnot trabaja con 0,908 kg de aire, entre los límites de 21º C y 260º C. La presión al principio de la expansión isotérmica es de 30 bar abs. y al final de la expansión isotérmica de 15 bar abs. Calcular: a) b) c) d) e) f) El volumen al final de la compresión isotérmica, en m3. El calor añadido y rechazado, en kJ. El trabajo neto del ciclo, en kJ. El rendimiento térmico. La relación de expansión general. La presión media del ciclo, en bar. S O L U C I Ó N Por la ecuación característica de los gases · · · ………………..(1) . 908 287 533 30 10 0.0463 Por la Ley de Boyle. 2 ; con los datos, 2 0.0463 0.0926 Utilizando ecuaciones isentrópicas, para el proceso 2‐3. ; despejando, 0.0926 86 …………….. (2) 533 294 . TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani 0.4098 Para el proceso 4‐1 es a entropía constante. a) El volumen final en la compresión es. despejando se tiene ………..(3) . 0.0463 0.2049 b) El calor suministrado y cedido se calculan por las siguientes relaciones. · · · · · ………………………(4) · ……………………..(5) Sustituyendo datos del problema, en ecuaciones (4) y (5). . 0.908 0.287 533 96.27 . El calor cedido es, . 0.908 0.287 294 · . 53.11 c) El trabajo neto del ciclo es. 43.17 d) El rendimiento térmico es. 43.17 0.448 96.27 45% e) La relación de expansión general 2 f) La presión media del ciclo es. 43.17 . . . 0.4098 0.0463 87 . . 8.85 . . . 1.187 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani CAPÍTULO 8 LA ENTROPÍA Y SU UTILIZACIÓN OBJETIVOS • • • Desarrollar ecuaciones necesarias para calcular cambios de entropía para varias sustancias. Presentar el concepto de rendimiento adiabático. Realizar problemas de práctica que ilustran los conceptos estudiados. 8.1 INTRODUCCIÓN 8.2 DEFINICIÓN DE VARIACIÓN DE ENTROPIA En este capítulo veremos que el estudio de los sistemas Termodinámicos desde la perspectiva del segundo principio se desarrolla convenientemente en términos de la propiedad entropía. La energía y entropía son conceptos abstractos pero desempeñan papeles importantes en los restantes capítulos. Si un sistema desde un estado 1 pasa a un estado 2, mediante una transformación reversible A, y vuelve de 2 a 1 por otra transformación reversible B, el conjunto de las dos transformaciones constituirá un ciclo reversible, por tanto podemos escribir. La desigualdad de Clausius establece que: 0 0 (8.3) (8.1) F; sirve para recordar que el integrando deberá evaluarse para la frontera del sistema que ejecuta el ciclo. Puede expresarse de modo equivalente como: (8.2) La naturaleza del ciclo ejecutado por el sistema queda indicada por el valor de ơ como sigue: Figura 8.1 Ciclo de dos procesos. Para el segundo ciclo. no se presentan irreversibilidades 0 internas. 0 se presentan (8.4) Sustraendo ecuación (8.4) de (8.3) queda. irreversibilidades internas. (8.5) 0 imposible. 88 TERMODINÁMICA TÉCNICA Conclusión, la integral Ing. Carlos Fidel Cruz Mamani · tiene el mismo valor para todo proceso internamente reversible entre los dos estados. Por definición la variación de entropía esta dada por. · · · La entropía es una propiedad extensiva y en forma diferencial la ecuación de variación de entropía es: · (8.14) 8.4 VARIACIÓN DE ENTROPIA DE UN GAS IDEAL Si se conoce dos estados en un gas ideal es posible calcular la variación de entropía que experimenta el gas en este proceso. (8.7) Las unidades de entropía en el sistema internacional es [kJ7kg] y en el sistema ingles [Btu / ºR]. pueden escribirse Las expresiones de · como propiedades específicas. (8.15) 8.3 OBTENCIÓN DE VALORES DE ENTROPIA (8.16) El valor de la entropía en un estado “y” en función del valor de estado “x” puede calcularse mediante. · Para un gas ideal se tiene, ; · y la ecuación de estado · · , entonces la entropía se transforma en: (8.8) Los valores de la entropía para el agua y los refrigerantes se encuentran ya tabulados. (8.17) (8.18) Los valore de sf y sg están como una función de la presión de saturación o de la temperatura de saturación, por lo que la entropía de la mezcla se calcula por: Los calores específicos están relacionados por la relación de Mayer. (8.19) (8.9) Integrando las ecuaciones anteriores, considerando cp y cv como constantes, las ecuaciones (8.17) y (8.18) se transforman: Para un sistema cerrado la expresión diferencial del balance de energía es: (8.10) · (8.13) Igualando(8.11) y (8.13) se tiene. (8.6) · (8.12) · (8.11) · · Por la ecuación de la entalpía se tiene. 89 (8.20) (8.21) TERMODINÁMICA TÉCNICA Para un gas perfecto, cv como cp son función únicamente de la temperatura, las ecuaciones anteriores se pueden evaluar una vez que se conoce la función de cv y cp con la temperatura. · Δ · ∆ · (8.22) · (8.23) Ing. Carlos Fidel Cruz Mamani 8.5 BALANCE DE ENTROPIA El principio de incremento de entropía para cualquier sistema se expresa como. Entropia Entropia total de total de entrada salida Cambio en la entropía total del sistema O también se puede escribir. Recordando el balance de entropía para sistemas cerrados Δ (8.25) (8.24) Las relaciones de balance de entropía para los volúmenes de control difieren de los de sistemas cerrados en los que involucran un mecanismo más de intercambio de entropía, por lo tanto se tiene. El segundo principio de la termodinámica puede interpretarse como un requisito de que la entropía se genera por irreversibilidades y se conserve sólo en el caso límite en que las irreversibilidades desaparezcan. Como Sgen mide el efecto de irreversibilidades presentes en el interior del sistema durante el proceso, su valor dependerá de la naturaleza del proceso y no sólo de los estados inicial y final. Por tanto no es una propiedad. ∑ ∑ (8.26) Donde los términos del segundo miembro tiene en cuenta la suma del flujo de entropía debido a la transferencia de calor a través de la frontera del volumen de control, el flujo de entropía a causa de un flujo másico y la generación de entropía en el volumen de control como resultado de irreversibilidades. Recordemos; 0 ; proceso internamente irreversible. 0 ; proceso internamente reversible. 8.6 RENDIMIENTOS ADIABÁTICOS DE DISPOSITIVOS EN REGIMEN ESTACIONARIO El valor de Sgen nunca puede ser negativo. La variación de entropía de un sistema puede ser positivo o negativo, y el también cero. El rendimiento adiabático de una turbina, asumiendo que la energía cinética y energía potencial son despreciables es: 0; Proceso reversible, con adición de energía 0; adiabático. ∑ (8.27.a) proceso 0;Proceso extracción de energía. reversible reversible, pero con 90 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani Las toberas son dispositivos esencialmente adiabáticos y se usan para acelerar un fluido, su eficiencia isentrópica está definida como la relación entre la energía cinética real del fluido a la salida de la tobera y el valor de la energía cinética a la salida de una tobera isentrópica para los mismos valores en el estado de entrada y la presión de salida. Δ (8.30) Δ Figura 8.2 Diagrama h-s para los procesos real e isentrópicos de una turbina adiabática. (8.27.b) El rendimiento adiabático de un compresor es. Figura 8.4 Esquema de una tobera. (8.28.a) Por el balance de la energía se tiene. (8.31) Entonces la eficiencia isentrópica de la tobera puede expresarse en términos de la entalpía como. (8.32) 8.7 PROBLEMAS Figura 8.3 Diagrama h‐s para los procesos real e isentrópico de un compresor adiabático. (8.28.b) Cuando son insignificantes los cambios en las energías potencial y cinética de un líquido, la eficiencia isentrópica de una bomba se define de la misma forma. · (8.29) 91 TERMODINÁMICA TÉCNICA Problema 8.1 Ing. Carlos Fidel Cruz Mamani Determinar la variación de entropía específica de aire considerado que sufre un proceso desde T1= 300 ºK y P1= 1 bar, hasta T2=400 ºK y P2= 5 bar considerando constante cp=1.008 [kJ/kg ºK]. S O L U C I Ó N Por la ecuación de variación de entropía para un gas ideal. · ……………………….(1) Sustituyendo valores, el cambio de entropía es entonces. ∆ 1.008 400 300 ° ∆ 0.287 0.1719 ° ° · 5· 1· El signo negativo indica que el cambio de entropía, es por extraer energía del sistema que ocurre durante el proceso de transferencia de calor. Problema 8.2 Calcule el cambio total de entropía si 5 kg de hielo a 0 ºC se mezcla con 10 kg de agua que está inicialmente a 20 ºC. Si no hay transferencia de calor importante desde el recipiente al entorno. (Asumir el calor de fusión del hielo 340kJ/kg y para el agua cagua= 4.18 kJ/kg ºK). DATOS 5 10 20 293° S O L U C I Ó N Por la segunda ley de la termodinámica, el cambio de entropía se define. ∆ ∆ · …………….…………….(1) · 92 …………………….(2) TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani Por la primera ley de la termodinámica ∑ ∑ ………………(3) Por definición de calor ó ……………….(4) ………………(5) Se sabe que el agua solo puede bajar su temperatura hasta 0 ºC. Entonces; 0 pues calculamos cuánto de hielo se funde. Ecuaciones (4) y (5) en (3)y despejando la masa de hielo. · · ó 2.462 Por tanto el calor ganado por el hielo es: 2.462 340 ó 837.08 Sustituyendo en ecuación (2) ∆ 837.08 273 ° 10 · 4.186 ∆ 0.10669 93 ° ° · 273 293 TERMODINÁMICA TÉCNICA Problema 8.3 Ing. Carlos Fidel Cruz Mamani Un flujo de vapor de agua entra a una turbina a una presión de 30 bar, una temperatura de 400 ºC y una velocidad de 160 m/s. El vapor de agua sale saturado a una temperatura de 100 ºC y con una velocidad de 100 m/s. Para la situación estacionaria, la turbina produce un trabajo de 540 kJ/kg de vapor. La transferencia de calor entre la turbina y el medio que le rodea tiene lugar a una temperatura media en la superficie externa de 77 ºC. Determine la entropía generada por un kilogramo de vapor que atraviesa la turbina, en kJ/kg ºK. S O L U C I Ó N El balance de entropía por unidad de tiempo para un volumen de control es: ∑ ∑ ∑ Siendo ∑ …..(1) 0 ∑ ……(2) Siendo: Balance de energía para un sistema abierto con flujo estacionario. , ……………(3) Siendo z2=0 A partir de tablas de vapor de agua se tiene. 3230.9 kJ kg 2676.1 kJ kg Z1= 1.2 [m] Sustituyendo en (3) 94 TERMODINÁMICA TÉCNICA 540 2676.1 22.6117 3230.9 100 160 2 9.81 Ing. Carlos Fidel Cruz Mamani 1.2 10 kJ kg De tablas de vapor de agua se obtiene. 6.9212 kJ kg·°K 7.3549 kJ kg·°K Sustituyendo en (2) 22.6 77 273 7.3549 6.9212 0.4983 kJ kg·°K 95 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani BIBLIOGRAFIA CONSULTADA - Andres Trepp del Carpio “Propiedades termodinámicas del aire en altura e Higrometria altitudinal universal del aire” La Paz‐Bolivia , 2002. - Carlos A.Garcia, “Termodinámica Tecnica” Editorial Alsina, Argentina,2002. - KennethWark‐Donald Richards “Termodinámica” Ed. Mc Graw Hill, México, 2001. - M.J.Moran , H.S. Shapiro, “Termodinámica Técnica” Ed. Reverté, España, 1999. - Merle C. Potter, Elaine P. Scott “Termodinámica” Ed. Thomson, México, 2006. - Smith y Van Dess “Introducción a la termodinámica en Ingeniería Química” Ed. Mc Graw Hill, México , 1997. - Yunus A. Cengel “Termodinámica” Ed. Mc Graw Hill, Quinta Edición, México, 2006. 96 TERMODINÁMICA TÉCNICA Ing. Carlos Fidel Cruz Mamani La piel se arruga, el pelo se vuelve blanco, los días se convierten en años. Pero lo importante no cambia tu fuerza y tu convicción no tiene edad. Tu espíritu es el plumero de cualquier tela de araña. Detrás de cada línea de llegada hay una partida. Detrás de cada logro, hay otro desafío mientras estés vivo. Si extrañas lo que hacías vuelve hacerlo, no vivas de fotos amarillas. Sigue aunque todos esperen que abandones. No dejes que se oxide el hierro que hay en Ti. Has que en vez de lástima te tengan respeto. Cuando por los años no puedas correr, trota, cuando no puedas trotar camina, cuando no puedas caminar usa el bastón. Pero nunca te detengas. Teresa de Calcuta Se terminó de imprimir en el mes de febrero de 2010, Oruro. B O L I V I A 97