Enfermedades genéticas
Anuncio
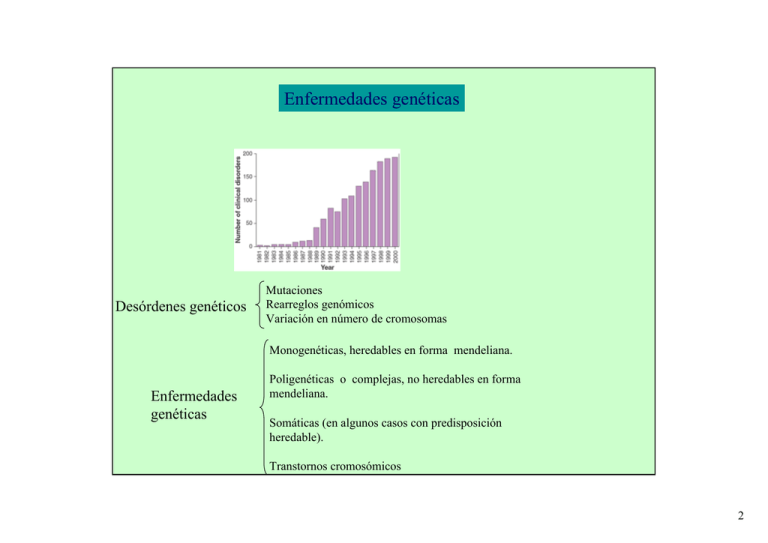
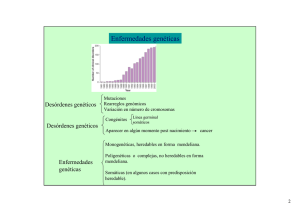
Enfermedades genéticas Desórdenes genéticos Mutaciones Rearreglos genómicos Variación en número de cromosomas Monogenéticas, heredables en forma mendeliana. Enfermedades genéticas Poligenéticas o complejas, no heredables en forma mendeliana. Somáticas (en algunos casos con predisposición heredable). Transtornos cromosómicos 2 Estrategias para la identificación de la/s alteraciones genéticas responsables o que se asocian con una enfermedad genética Clonado de un gen candidato Aneuploidías o translocaciones en meiosis dada una enfermedad genética analizar síntomas y parámetros que caracterizan la enfermedad. Buscar gen candidato Análisis de ligamiento y clonado posicional del gen Alteraciones somáticas Cancer Alteración en cromosomas Comparación de genomas Comparación de transcriptomas Proteómica Patrones de metilación de ADN o histonas. Si dos genes están localizados en el mismo cromosoma, en forma cercana uno del otro es muy probable que se hereden en forma conjunta Estudios de asociación en una población Aplicable a enfermedades Complejas. Marcadores usados: SNP´s Diabetes, asma, autismo, transtornos mentales, lupus, migraña, hipertensión, epilepsia, Alzheimer, etc. Aplicable a enfermedades monogenéticas, algunos cánceres en los que el gen que predispone se hereda en forma mendeliana (gen de Retinoblastoma). Marcadores de posicionamiento usados: RFLP, SSLP´s, otros genes. 3 Marcadores de posicionamiento RFLP 4 Polimorfismos de microsatélites (MSPs): Secuencias repetidas de 2 nucleótidos en tandem. El número de repeticiones es altamente variable. La mayoría es repetición de (dC-dA)n o (dG-dT)n en la cadena complementaria. Ocurre en promedio 1/50 kb en el genoma humano. Microsatélites con 20 o más repeticiones Son altamente polimórficos (10-15 diferentes alelos en la población para cada uno). Se amplifican por PCR, se diferencian por su tamaño en geles de agarosa. Los oligos son complementarios a las secuencias flanqueantes del microsatélite. Existen mapas de RFLPs y de MSPs (2000 marcadores cada 3 cM) para todos los cromosomas humanos. Se estudia en un pedigrí la asociación de un marcador con el fenotipo de la enfermedad. FQ 5 Estrategias para la identificación de la/s alteraciones genéticas responsables o que se asocian con una enfermedad genética Clonado de un gen candidato Aneuploidías en meiosis variación en número de cromosomas dada una enfermedad genética analizar síntomas y parámetros que caracterizan la enfermedad. Buscar gen candidato Análisis de ligamiento y clonado posicional del gen Alteraciones somáticas Cancer Alteración en cromosomas Comparación de genomas Comparación de transcriptomas Proteómica Patrones de metilación de ADN o histonas. Si dos genes están localizados en el mismo cromosoma, en forma cercana uno del otro es muy probable que se hereden en forma conjunta Estudios de asociación en una población Aplicable a enfermedades Complejas. Marcadores usados: SNP´s Diabetes, asma, autismo, transtornos mentales, lupus, migraña, hipertensión, epilepsia, Alzheimer, etc. Aplicable a enfermedades monogenéticas, algunos cánceres en los que el gen que predispone se hereda en forma mendeliana (gen de Retinoblastoma). Marcadores de posicionamiento usados: RFLP, SSLP´s 6 Cancer El desarrollo y evolución de algunos tumores requiere múltiples alteraciones genéticas Proto-oncogenes: por mutación se convierten en oncogenes Participan en crecimiento celular (regeneración de la piel, sangre, etc.) No es más regulable, Estimula sin freno el Crecimiento: Bcl-2, ciclina Inhibe apoptosis Los genes cuya alteración causan cancer estimula crecimiento Genes supresores de tumor: normalmente mantiene bajo el número de células por inhibición del ciclo celular o por promover la apoptosis. Su mutación provoca que no haya más inhibición del crecimiento o que no haya apoptosis de células malignas (p53, gen que codifica para la proteína retinoblastoma) Genes de inestabilidad: normalmente controlan la tasa de angiogenesis mutación genética (genes de reparación de mismatch). Su mutación hace que ocurran mutaciones en proto-oncogenes o en genes supresores. Genes que regulan la mitosis: problemas en segregación de cromosomas y rearreglos 7 Estrategias para la identificación de la/s alteraciones genéticas responsables o que se asocian con una enfermedad genética Clonado de un gen candidato Aneuploidías en meiosis variación en número de cromosomas dada una enfermedad genética analizar síntomas y parámetros que caracterizan la enfermedad. Buscar gen candidato Análisis de ligamiento y clonado posicional del gen Alteraciones somáticas Cancer Alteración en cromosomas Comparación de genomas Comparación de transcriptomas Proteómica Patrones de metilación de ADN o histonas. Si dos genes están localizados en el mismo cromosoma, en forma cercana uno del otro es muy probable que se hereden en forma conjunta Estudios de asociación en una población Aplicable a enfermedades Complejas. Marcadores usados: SNP´s Diabetes, asma, autismo, transtornos mentales, lupus, migraña, hipertensión, epilepsia, Alzheimer, etc. Aplicable a enfermedades monogenéticas, algunos cánceres en los que el gen que predispone se hereda en forma mendeliana (gen de Retinoblastoma). Marcadores de posicionamiento usados: RFLP, SSLP´s 8 Enfermedad determinada por alteraciones genéticas: estudios que se pueden realizar A nivel de proteínas A nivel de ARNm A nivel de ADN Detección de apoptosis 9 A nivel de proteínas: Búsqueda de marcadores: Proteómica, fago display Diagnóstico: Diagnóstico por inmunocitoquímica, inmunohistoquímica Detección por Western blot de proteínas alteradas en tamaño Utilización de Citometría de Flujo 10 Citometría de Flujo Inmunofenotipificación: Identificación de distintas poblaciones celulares y determinación de su estado funcional. ERM 11 Proteómica: análisis de proteínas en gran escala Comparar perfiles de proteínas entre células sanas y enfermas o células enfermas tratadas con distintas drogas Estudiando los datos obtenidos encontrar marcadores que puedan servir para diagnóstico, inferir mecanismo de desarrollo de la enfermedad, encontrar nuevos blancos de drogas y para otro tipo de intervención terapéutica, clasificación de tumores. Bases de datos http://www.expasy.org/ch2d/2d-index.html 12 Phage display: péptidos o anticuerpos que se unen especificamente a células de un tumor: Uso: búsqueda de marcadores para subsiguiente uso en diagnóstico o en terapia. Biblioteca de péptidos en fago Previamente adsorbida con células normales Células cancerosas células normales Péptido seleccionado Péptido control negativo Amplification And purification E. coli 13 Detección de apoptosis Muerte celular programada: cambios morfológicos característicos Aumenta en algunas enfermedades degenerativas Disminuye en algunos cánceres Detección de fragmentos de ADN Detección de células apoptóticas por marcación de extremos de ADN 14 A nivel de ADN: Hibridación, PCR, ligación: Muestra: in situ (localización física), amplificación de ADN de muestra, extracción de ADN, microdisección con rayo laser. Técnicas: variación en número de cromosomas: FISH, CGH, MLPA Rearreglos cromosomales: FISH PCR, RT-PCR (algunas translocaciones) Ganancia o pérdida de genes: MLPA, CGH detección de mutaciones conocidas: PCR-OLA (ensayo de ligación de oligonucleótido, SNuPE (primer extension de un único nucleótido), OSA (hibridación con oligonucleótidos específicos), PASA (amplificación alelo específica), alineamiento competitivo de oligonucleótidos, RFLP, MLPA. Real time PCR. Microarray Se utilizan para detectar: Rearreglos cromosómicos Pérdidas o ganancias cromosomales Mutaciones puntuales y polimorfismos Grado de metilación Permiten: Detección y diagnóstico de desórdenes genéticos que determinan la enfermedad Diagnóstico de individuos portadores de mutación recesiva Diagnóstico prenatal Diagnóstico preimplante en fecundación in vitro (PGD). Mutaciones o alteraciones somáticas: determinación de la base genética de la enfermedad, diagnóstico, clasificación de tumores, ERM, prognosis). Identificación de SNP´s asociados a enfermedades complejas. detección de mutaciones desconocidas: SSCP, RNAsa, clivaje químico, PCR-DGGE. Real time PCR. Determinación de grado de metilación de ADN 15 FISH Utilización de sondas fluorescentes Diagnóstico preimplante, prenatal, cancer Rápida diagnosis de alteración en número de cromosomas: trisomía 21 (Síndrome de Down). trisomía 13 trisomía 18 cantidades anormales de X o Y Diagnóstico de rearreglos cromosomales Linfoma: t(14;18) Leucemia mieloide crónica: t(9;22) Leucemia promielocítica aguda: t(15;17) Linfoma de células de Mantle: t(11;14) Se generan genes híbridos que dan lugar en ocasiones a nuevos mensajeros Otra forma de detectar: PCR, RT-PCR (algunas translocaciones) 2R2G 1R1G2F ERM (enfermedad residual mínima): PCR ó RT-PCR para translocaciones 16 CGH Diagnóstico y búsqueda de marcadores Cambio en el número de copias en el ADN (Ganancia o pérdida) Variación en número de cromosomas duplicación Se puede también hacer sobre un microarray 17 MLPA Multiplex ligation-dependent probe amplification Diagnóstico Cambio en el número de copias en el ADN (Ganancia o pérdida) Número de cromosomas Cambio para la sonda X = Valor del picoX normalizado para muestra paciente Promedio de valor del picoX normalizado para muestra normal Area o altura del pico Suma de las áreas o alturas de todos los picos de la muestra 18 Número de cromosomas Ganancia o perdida de genes 19 A nivel de ADN: Hibridación, PCR, ligación: Muestra: in situ (localización física), amplificación de ADN de muestra, extracción de ADN, microdisección con rayo laser. Técnicas: FISH, CGH, MLPA: rearreglos cromosomales, variación en número de cromosomas. PCR, RT-PCR (algunas translocaciones) Se utilizan para detectar: Rearreglos cromosómicos Pérdidas o ganancias cromosomales Mutaciones puntuales y polimorfismos Grado de metilación detección de mutaciones conocidas: PCR-OLA (ensayo de ligación de oligonucleótido, SNuPE (primer extension de un único nucleótido), OSA (hibridación con oligonucleótidos específicos), PASA (amplificación alelo específica), alineamiento competitivo de oligonucleótidos, RFLP, MLPA. Permiten: Detección y diagnóstico de desórdenes genéticos que Real time PCR. Microarray determinan la enfermedad detección de mutaciones desconocidas: SSCP, RNAsa, clivaje químico, PCR-DGGE. Real time PCR. Determinación de grado de metilación de ADN Diagnóstico de individuos portadores de mutación recesiva Diagnóstico prenatal Diagnóstico preimplante en fecundación in vitro (PGD). Mutaciones o alteraciones somáticas: determinación de la base genética de la enfermedad, diagnóstico, clasificación de tumores, ERM, prognosis). Identificación de SNP´s asociados a enfermedades complejas. 20 Detección de mutaciones desconocidas Clivaje con RNAsa Clivaje qco C T Clivaje con endonucleasa 21 SSCP: polimorfismo conformacional de simple cadena 22 DGGE: Electroforesis en gel con gradiente de desnaturalización 23 A nivel de ADN: Hibridación, PCR, ligación: Muestra: in situ (localización física), amplificación de ADN de muestra, extracción de ADN, microdisección con rayo laser. Técnicas: FISH, CGH, MLPA: rearreglos cromosomales, variación en número de cromosomas. PCR, RT-PCR (algunas translocaciones) Se utilizan para detectar: Rearreglos cromosómicos Pérdidas o ganancias cromosomales Mutaciones puntuales y polimorfismos Grado de metilación detección de mutaciones conocidas: PCR-OLA (ensayo de ligación de oligonucleótido, SNuPE (primer extension de un único nucleótido), OSA (hibridación con oligonucleótidos específicos), PASA (amplificación alelo específica), alineamiento competitivo de oligonucleótidos, RFLP, MLPA. Permiten: Detección y diagnóstico de desórdenes genéticos que Real time PCR. Microarray determinan la enfermedad detección de mutaciones desconocidas: SSCP, RNAsa, clivaje químico, PCR-DGGE. Real time PCR. Determinación de grado de metilación de ADN Diagnóstico de individuos portadores de mutación recesiva Diagnóstico prenatal Diagnóstico preimplante en fecundación in vitro (PGD). Mutaciones o alteraciones somáticas: determinación de la base genética de la enfermedad, diagnóstico, clasificación de tumores, ERM, prognosis). Identificación de SNP´s asociados a enfermedades complejas. 24 detección de mutaciones conocidas Alteración en sitios de restricción 25 26 ASO:uso de oligonucleótidos alelo específicos para análisis de hibridación PCR-ASO 27 28 Amplificación alelo específica (PASA o ARMS) Homocigota normal Heterocigota Homocigota afectado Taq polimerasa no corrige 3´ 5´ y no elonga si no hay complementaridad 29 c b 30 31 Mutation PCR-OLA: Ensayo de ligación de oligonucleótidos T 32 MLPA Fibrosis quística 33 Multiplex PCR PCR por Supresión (Broude et al., 2001) fibrosis quística amplificación alelo específica 34 Primer extension de un solo nucleótido (SNuPE) Maldi Toff MS Hibridación alelo específica Alteración en sitio de restricción Amplificación alelo específica (específicidad en el 3´ y competitiva) SNuPE (primer extensión de un único nucleótido) Amplificacion de sonda ligada 35 A nivel de ADN: Hibridación, PCR, ligación: Muestra: in situ (localización física), amplificación de ADN de muestra, extracción de ADN, microdisección con rayo laser. Técnicas: FISH, CGH, MLPA: rearreglos cromosomales, variación en número de cromosomas. PCR, RT-PCR (algunas translocaciones) Se utilizan para detectar: Rearreglos cromosómicos Pérdidas o ganancias cromosomales Mutaciones puntuales y polimorfismos Grado de metilación detección de mutaciones conocidas: PCR-OLA (ensayo de ligación de oligonucleótido, SNuPE (primer extension de un único nucleótido), OSA (hibridación con oligonucleótidos específicos), PASA (amplificación alelo específica), alineamiento competitivo de oligonucleótidos, RFLP, MLPA. Permiten: Detección y diagnóstico de desórdenes genéticos que Real time PCR. Microarray determinan la enfermedad detección de mutaciones desconocidas: SSCP, RNAsa, clivaje químico, PCR-DGGE. Real time PCR. Determinación de grado de metilación de ADN Diagnóstico de individuos portadores de mutación recesiva Diagnóstico prenatal Diagnóstico preimplante en fecundación in vitro (PGD). Mutaciones o alteraciones somáticas: determinación de la base genética de la enfermedad, diagnóstico, clasificación de tumores, ERM, prognosis). Identificación de SNP´s asociados a enfermedades complejas. 36