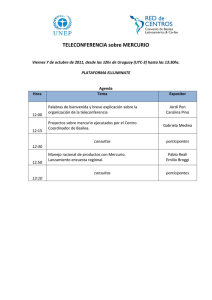
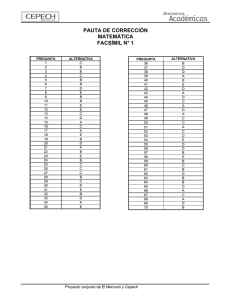
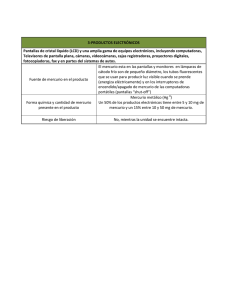
Chillán y Valdivia - Tesis Electrónicas UACh
Anuncio

Universidad Austral de Chile Facultad de Ciencias Agrarias Escuela de Ingeniería en Alimentos Comparación del consumo de alimentos e ingesta de metales pesados de poblaciones de Chile (Chillán y Valdivia) Memoria presentada como parte de los requisitos para optar al título de Ingeniero en Alimentos Loreana María Moreno Beneventi Valdivia – Chile 2013 i INDICE DE MATERIAS Capítulo Página RESUMEN 1 SUMMARY 2 1 INTRODUCCIÓN 3 2 REVISIÓN BIBLIOGRÁFICA 5 2.1 Toxicología alimentaria 5 2.1.1 Ingesta Diaria Admisible (IDA) e Ingesta Diaria Tolerable (IDT) 5 2.1.2 Ingesta Semanal Tolerable Provisional (ISTP) 6 2.2 Arsénico (As) 6 2.2.1 Distribución terrestre del arsénico y sus niveles ambientales 8 2.2.2 Metabolismo y eliminación del arsénico y efectos en la salud 10 2.2.3 Límites internacionales de ingesta para arsénico 11 2.2.4 Situación del arsénico en Chile 12 2.2.5 Contenido en alimentos e ingesta dietética del arsénico 15 2.3 Mercurio (Hg) 16 2.3.1 Características físicas y químicas del mercurio y sus formas de 17 presentación 2.3.2 Fuentes de origen del mercurio 19 ii 2.3.3 Toxicocinética y toxicidad del mercurio 23 2.3.4 Límites internacionales y nacionales de concentración de mercurio 28 en alimentos 2.3.5 Ingestas dietéticas y presencia en los alimentos de mercurio 30 2.4 Estudio de Dieta Total 31 2.4.1 Actualidad en la investigación de contaminantes 32 2.4.2 Tipos de Estudio de Dieta Total 33 3 MATERIAL Y MÉTODO 36 3.1 Estudio de Dieta Total aplicada a las poblaciones de Chillán y 36 Valdivia 3.1.1 Obtención de datos de consumo 38 3.1.2 Número de encuestas a realizar 38 3.2 Metodología 40 3.2.1 Tratamiento del material de laboratorio 40 3.2.2 Adquisición y preparación de las muestras 40 3.2.3 Determinación y cuantificación de arsénico 41 3.2.4 Determinación de la ingesta total de arsénico 42 3.3 Determinación y cuantificación de mercurio 42 3.4 Validación de la metodología 43 4 PRESENTACIÓN Y DISCUSIÓN DE RESULTADOS 45 iii 4.1 Análisis de datos de consumo del Estudio de Dieta Total en las 45 ciudades de Chillán y Valdivia 4.2 Estudios de Dieta Total en Chile y otros países del mundo 50 4.3 Concentraciones de arsénico inorgánico 54 4.4 Estimación de la ingesta de arsénico 55 4.5 Concentración de mercurio en las poblaciones de Chillán y Valdivia 59 4.6 Estimación de la ingesta de mercurio 60 4.7 Comparación de la ingesta de mercurio en distintos países 63 4.8 Análisis comparativo de correlaciones, en el Estudio de Dieta Total 65 de la población de Chillán y Valdivia 5 CONCLUSIONES 72 6 BIBLIOGRAFÍA 73 ANEXOS 84 iv INDICE DE CUADROS Cuadro 1 Página Datos de mortalidad por cáncer de vejiga y pulmón en Chile y en 14 algunas regiones 2 Límites de concentración para mercurio total en alimentos, 28 en alimentos, 28 Ingesta Semanal Tolerable Provisional (ISTP) de mercurio según 29 recomendados por Codex Alimentarius 3 Límites de concentración para metilmercurio recomendados por Codex Alimentarius 4 Comisión FAO/OMS 5 Límites máximos de contenido de mercurio para distintos productos según Reglamento Sanitario de los Alimentos 30 v INDICE DE FIGURAS Página Figura 1 Efectos del arsénico. a) Hiperqueratosis punctata a nivel palmar e un 11 joven de 14 años. b) Hipermelanosis en gota de lluvia en un niño de año y medio. c) Pápulas verrucosas en el dorso de las manos de una paciente femenina de aproximadamente 25 años 2 Imágenes de la enfermedad de Minamata. A. Fotografías expuestas en 24 el Museo de la Enfermedad de Minamata en Japón. B. Sobrevivientes de la enfermedad invitados al Congreso Mundial sobre el mercurio, Minamata, 2001 3 Manifestaciones cutáneas del contacto con mercurio. A. Pulpitis de 27 contacto por mercurocromo (mercromia). B. Eccema de contacto agudo en antebrazo por mercurocromo 4 Esquema de Estudio de Dieta Total, aplicado a las poblaciones de 37 Chillán y Valdivia 5 Grupos de alimentos consumidos por los habitantes de Chillán y 46 Valdivia 6 Diferencia de consumo de los grupos de alimentos en los habitantes 47 de Chillán y Valdivia 7 Comparación de consumo en las poblaciones de Valdivia y Chillán 48 8 Comparación de alimentos consumidos, por grupo, por las poblaciones 48 de Chillán, Valdivia y Santiago 9 Comparación consumo de alimentos de Chile y países del mundo 50 10 Concentraciones de arsénico total en los distintos grupos de alimentos 53 vi en las poblaciones de Chillán y Valdivia 11 Concentración de arsénico inorgánico en los distintos grupos de 55 alimentos en las poblaciones de Chillán y Valdivia 12 Ingesta de arsénico total (µg/persona/día) en las ciudades de Chillán y 56 Valdivia, para cada grupo de alimento 13 Ingesta de arsénico inorgánico (µg/persona/día) en las ciudades de 57 Chillán y Valdivia, para cada grupo de alimento 14 Concentración de mercurio en los distintos grupos de alimentos en las 59 poblaciones de Chillán y Valdivia 15 Ingesta de mercurio (µg/persona/día) en las ciudades de Chillán y 61 Valdivia, para cada grupo de alimento 16 Comparación de consumo en las poblaciones de Chillán y Valdivia 65 17 Concentración de mercurio en los distintos grupos de alimentos en las 66 poblaciones de Chillán y Valdivia 18 Comparación de ingestas de arsénico total entre Chillán y Valdivia 67 19 Comparación de concentración de arsénico inorgánico entre Chillán y 68 Valdivia 20 Comparación de ingestas de arsénico inorgánico entre Chillán y 69 Valdivia 21 Comparación de concentración de mercurio entre Chillán y Valdivia 70 22 Comparación de ingesta de mercurio entre Chillán y Valdivia 71 vii INDICE DE ANEXOS Anexo Página 1 Carta de consentimiento informado 85 2 Encuesta nutricional recordatoria de 24 horas, utilizada en las 87 ciudades de Chillán y Valdivia 3 Consumo de alimentos/persona/día (g) calculado tomando como 94 referencia una persona de 69 kg. de peso 4 Concentración de arsénico total en los distintos grupos de alimentos 103 en las poblaciones de Chillán y Valdivia 5 Concentración de arsénico inorgánico en los distintos grupos de 104 alimentos en las poblaciones de Chillán y Valdivia 6 Ingesta de arsénico total en los distintos grupos de alimentos en las 105 poblaciones de Chillán y Valdivia 7 Ingesta de arsénico inorgánico en los distintos grupos de alimentos en 106 las poblaciones de Chillán y Valdivia 8 Concentración de mercurio en los distintos grupos de alimentos en las 107 poblaciones de Chillán y Valdivia 9 Ingesta de mercurio en los distintos grupos de alimentos en las poblaciones de Chillán y Valdivia 108 1 RESUMEN Hoy en día es de preocupación la contaminación a la que se ven sometidos los alimentos debido al riesgo para la salud humana, es por ello que el objetivo de la presente investigación fue comparar el consumo de alimentos, concentraciones e ingestas diarias de arsénico total, arsénico inorgánico y mercurio en la dieta total de los habitantes de Chillán y Valdivia, y así poder establecer cuáles son los alimentos más consumidos en ambas poblaciones, identificando aquellos que presentan los mayores contenidos de estos metales y determinar el cumplimiento de los datos de su ingesta con el valor de referencia (ISTP) propuesto por FAO/OMS. Para ello, se realizó un estudio de dieta total, basado en una encuesta recordatoria de 24 horas, la que mostró mas de 270 alimentos. De estos se formaron 17 grupos según su similitud de composición química Los 3 grupos más consumidos en Chillán y Valdivia fueron el de bebidas no alcohólicas (equivalente a 30.9% y 28.36%, respectivamente, el grupo pan (equivalente a 14.3% y 12.84%, respectivamente) y el de vegetales (equivalente a 8.3% y 12.7%, respectivamente, de la dieta total). Entre los mayores niveles de arsénico total encontrados están los grupos de pescados y mariscos (1.5 µg/g y 1.8 µg/g para Chillán y Valdivia, respectivamente). Por otra parte, el grupo que presentó los mayores niveles de mercurio fue el de pescados y mariscos (0.02 µg/g en ambas ciudades). En el caso del arsénico inorgánico, la ingesta en Chillán representó el 10.4% y en Valdivia el 13.9% de la Ingesta Tolerable Provisional (ISTP), por lo que se concluye que la ingesta de arsenico, proveniente del consumo de alimentos, tampoco representa riesgo para la salud. En el caso del mercurio, la ingesta de Chillán representó el 31.1% del ISTP y en Valdivia el 11,8% del ISTP, por lo que se concluye que la ingesta de mercurio, proveniente del consumo de alimentos tampoco representa riesgo para la salud. 2 SUMMARY Today it is of concern to the pollution that are under the food and therefore the risk to human health, is therefore the objective of this research was to compare food consumption, concentrations and daily intake of total arsenic , inorganic arsenic and mercury in the overall diet of the inhabitants of Chillán and Valdivia, and thus establish what are the most popular foods in both populations, identifying foods that have the highest content of heavy metals and determine compliance with the data intake of heavy metals with the reference value (ISTP) proposed by FAO / WHO. To do this we conducted a total diet study, based on a survey reminder 24 hours, which showed more than 270 foods which were formed 17 groups according to their similarity in chemical composition, the 3 groups consumed by Chillán and Valdivia were the soft drink (equivalent to 30.9% and 28.36% respectively of the total diet), the bread group (equivalent to 14.3% and 12.84% respectively of the total diet) and vegetables (equivalent to 8.3% and 12.68% respectively of the total diet). Among the largest total arsenic levels found are groups seafood (1,554 ug / g 1.8445 g / g to Chillán and Valdivia respectively). In the case of inorganic arsenic intake Chillán represents 10.4% of the PTWI and Valdivia represents 13.9% of the PTWI, so it is concluded that the intake from food consumption also represents health risk. In the case of mercury, Chillán intake accounts for 31.1% of the PTWI and Valdivia representing 11.8% of the PTWI for mercury, so it is concluded that the intake from food consumption also represents health risk. 3 1 INTRODUCCIÓN El conocimiento de los hábitos alimentarios es fundamental, no sólo para establecer el estado nutricional de la población de interés sino también, para poder establecer las posibles relaciones causales con enfermedades relacionadas con la nutrición y poder definir la política nutricional más adecuada. Los alimentos pueden estar contaminados con sustancias que al ser ingeridas den lugar a intoxicaciones agudas graves. Pero además, desde hace unas décadas y especialmente en las tres últimas, se ha comprobado que ciertos contaminantes químicos tienen un periodo latente de toxicidad de años, a veces hasta 20, durante los cuales el contaminante se va acumulando en el organismo provocando enfermedades cuando su concentración llega a niveles críticos. No se debe olvidar que el hombre se encuentra al final de muchas cadenas alimentarias, por lo que termina expuesto a concentraciones elevadas de agentes tóxicos, debido al proceso de bioacumulación. Dentro de los tóxicos a los cuales se está expuesto, destacan los metales pesados, elementos químicos ampliamente distribuidos en la naturaleza, tanto en suelo como en agua, y en la mayoría de los tejidos animales y vegetales. La reglamentación del país no ha tenido en cuenta la realidad de consumo y contaminación de metales pesados que podrán afectar a la población, por esta razón se hace necesaria una investigación que determine la cantidad de metales pesados que hay en los alimentos de consumo habitual, y que también determine la ingesta de los mismos por parte de la población. En este trabajo se compara la ingesta de metales pesados (arsénico total e inorgánico y mercurio), proveniente del consumo habitual de alimentos, de las poblaciones de Chillán y Valdivia. 4 Hipótesis: El consumo de alimentos y la ingesta de metales pesados (arsénico total, inorgánico y mercurio) en las localidades de Chillán y Valdivia, son similares y cumplen con el valor de referencia (ISTP) propuesto por FAO/OMS. Objetivo general: Comparar el consumo de alimentos y la ingesta de metales pesados (arsénico total e inorgánico y mercurio) en las poblaciones de Chillán y Valdivia. Objetivos específicos Determinar los alimentos más consumidos y la proporción de los mismos en la dieta de los habitantes de ambas poblaciones. Especificar aquellos alimentos que presenten los mayores contenidos de arsénico total, arsénico inorgánico y mercurio, en ambas poblaciones. Determinar el cumplimiento de los datos de ingesta de metales pesados (arsénico total, inorgánico y mercurio) con el valor de referencia (ISTP) propuesto por FAO/OMS. 5 2 REVISIÓN BIBLIOGRÁFICA 2.1 Toxicología alimentaria Una sustancia tóxica, es aquella que al penetrar al organismo humano, por cualquier vía y al ser absorbida, bloquea los mecanismos metabólicos normales. En el caso de los tóxicos alimentarios, la vía de penetración más común, es la oral a través de los alimentos (DÍAZ y GARCÍA, 2003). La toxicología alimentaria es la rama de la ciencia dedicada al estudio de estas sustancias tóxicas, enfocándose en su naturaleza, las fuentes, su formación en los alimentos, niveles de exposición, toxicocinética, efectos biológicos, análisis y legislación de sustancias presentes, de origen natural y antropogénica en los alimentos, con significación para la salud de los consumidores, así como la prevención a través del establecimiento de los límites de seguridad de estas sustancias. Se diferencian dos áreas claras dentro de la toxicología de alimentos: un área alimentaria, cuyo objeto es el estudio del tóxico en el alimento, y un área clínica que investiga la relación tóxico-alimento-hombre (DÍAZ y GARCÍA, 2003; MUÑOZ et al., 2005). Las toxinas presentes en productos alimenticios son un grupo heterogéneo de compuestos con diversos orígenes. Los venenos ambientales más comunes y extensamente distribuidos incluyen al plomo, cadmio, mercurio y arsénico. Éstos contaminantes son persistentes en el tiempo, y cada uno ha sido responsable de intoxicaciones masivas (MUÑOZ et al., 2005). 2.1.1 Ingesta Diaria Admisible (IDA) e Ingesta Diaria Tolerable (IDT). La IDA corresponde a la estimación de la cantidad de una sustancia presente en un alimento y/o en el agua potable, expresada en función del peso corporal, que puede ser ingerida diariamente durante toda la vida sin que se aprecie un riesgo sobre la salud del consumidor y teniendo en cuenta el nivel de conocimiento en el momento de la evaluación. La IDA se emplea con sustancias susceptibles de encontrarse en los alimentos y, por lo tanto, se emplea al referirse a aditivos, residuos de pesticidas y medicinas veterinarias que se encuentran en los alimentos (BEFORD, 2000). Por el 6 contrario, la IDT se utilizan en sustancias que no tienen por qué encontrarse en los alimentos, y corresponde a una estimación de la cantidad de una sustancia presente en el aire, los alimentos y el agua potable que puede ingerirse diariamente a lo largo de la vida sin riesgos visibles en la salud. Las IDT se calculan a partir de las bases de datos de toxicidad de laboratorio a las que se les dan factores de incertidumbre (BENFORD, 2000; ZUKOWSKA y BIZIUK 2008). 2.1.2 Ingesta Semanal Tolerable Provisional (ISTP). Los contaminantes químicos presentes en los alimentos no son deseados y además éstos pueden ser inevitables. Por lo tanto los niveles de contaminantes que no se espera que produzcan efectos nocivos se designan como tolerables (es decir, admisibles) más que aceptables. Los contaminantes como los metales pesados (arsénico, plomo, cadmio y mercurio), pueden acumularse en el cuerpo mediante ingestión continua y durante un largo período de tiempo (BENFORD, 2000). El ISTP es el valor toxicológico de referencia para contaminantes que pueden acumularse en el organismo como los metales pesados. Este valor representa la exposición semanal tolerable para el hombre de aquellos contaminantes inevitablemente asociados al consumo de alimentos por lo demás sanos y nutritivos. El término provisional se refiere a que la evaluación no es definitiva, debido a la escasez de datos fiables sobre las consecuencias de la exposición en el hombre a los niveles previstos que se produzcan a partir de los alimentos y, en consecuencia, se utiliza el término ISTP (JALÓN et al., 1997; ZUKOWSKA y BIZIUK, 2008). 2.2 Arsénico (As) El arsénico es un metaloide de origen natural que tiene una amplia distribución en la corteza terrestre, pudiendo encontrarse en niveles traza en todos los tipos de ambiente (agua, aire y suelo) (PAIVA, 2007). Desde que el arsénico se identificó y aisló por vez primera en 1250 por Alberto Magno, éste se ha utilizado ampliamente debido a sus propiedades medicinales y tóxicas (MANDAL y SUZUKI, 2002). Hasta la década de los años 1940, los compuestos 7 arsenicales eran empleados en el tratamiento de varias enfermedades como la sífilis, la leucemia y la psoriasis; así como agentes antiparasitarios en la profilaxis de la tripanosomiasis y la amebiasis en humanos. La aparición de la penicilina y de otros antibióticos permitió reducir el uso de los compuestos arsenicales en los productos usados como medicamentos. No obstante, cabe resaltar que últimamente se viene utilizando con éxito el trióxido de arsénico en la terapia de algunos tipos de cáncer. Los compuestos de arsénico también se han aplicado en otros campos como la agricultura, la electrónica y la metalurgia y siguen teniendo usos comerciales en plaguicidas, preservantes de la madera y en la producción de vidrio, papel y semiconductores (JAGER y OSTROSKY–WEGMAN, 1997; ATSDR, 2007; TCHOUNWOU et al., 2004). Si bien una gran cantidad del As en el medio ambiente proviene de fuentes naturales (meteorización, actividad biológica, emisiones volcánicas), existe una importante contribución a partir de actividades antropogénicas, tales como procesos industriales (minería, fundición de metales, pesticidas, conservantes de la madera, etc.). El elemento puede estar presente en distintos estados de oxidación (–III, 0, III, V) y en formas inorgánicas y orgánicas, en un amplio rango de concentraciones en aire, agua, suelos, vegetales y animales. (LITTER et al., 2009). Con relación a este aspecto, el arsenito As (III) es la forma inorgánica más tóxica, 10 veces más que el arseniato As (V) (KUMARESAN y RIYAZUDDIN, 2001). Las formas en las que se puede presentar el arsénico: Formas inorgánicas de arsénico. En aguas naturales, el As se encuentra en general como especie disuelta, formando oxianiones. Los estados de oxidación que predominan son As (III) y As (V) y, con menos frecuencia, As (0) y As (–III). El arseniato [As (V)], la especie arsenical más difundida en el medio ambiente, es la mayoritaria en agua y suelos. El arsenito [As (III)] es la forma inorgánica reducida y está presente en forma minoritaria en aguas, suelos y seres vivos (LITTER et al., 2009). El As (III) puede provenir de la reducción biológica del As (V), y predomina en zonas cercanas a industrias con efluentes ricos en As (III), aguas geotermales y ambientes reductores. En general, en aguas superficiales, el As (V) predomina sobre el As (III). En aguas subterráneas pueden encontrarse ambos estados de oxidación ya que las concentraciones de Arsenito [As (III)] y Arseniato [As (V)] 8 dependen de la entrada de As al sistema, de las condiciones redox y de la actividad biológica. En aguas marinas, la especie predominante es el As inorgánico pentavalente, que puede ser transformado a formas orgánicas o reducido biológicamente a As (III) (DAS et al., 2001). Para el arsénico, los términos toxicología y especiación deben ir asociados, empleando la letalidad como criterio de toxicidad, las especies inorgánicas, As (III) y As (V), presentan los menores valores de (LD50) y la suma de ambas se conoce como arsénico inorgánico, el cual está considerado como carcinógeno humano (TCHOUNWOU et al., 2004). Formas orgánicas de arsénico. Los compuestos orgánicos arsenicales contienen arsénico unido a un átomo de carbono por medio de uniones covalentes; el arsénico puede estar tanto en su forma trivalente como pentavalente. Estas especies están ampliamente distribuidas en la atmósfera, en sistemas acuáticos, suelos, sedimentos y tejidos biológicos (LITTER et al., 2009). Las reacciones de metilación mediadas biológicamente que ocurren en organismos terrestres y marinos convierten el arsenito y arseniato inorgánico en compuestos metilados de toxicidad moderada, estos compuestos son precursores de formas orgánicas más complejas y prácticamente no tóxicas, los arsenolípidos, como la arsenobetaína (AB) y la arsenocolina (AC) y los arsenoazúcares (AsAz) (GEBEL, 2001). Las mayores concentraciones de formas metiladas se encuentran a nivel superficial, ya que en la zona fotosintéticamente activa, que tiene además una mayor carga microbiana y presencia de fitoplancton, se produce una mayor transformación del As inorgánico a las especies metiladas (LITTER et al., 2009). 2.2.1 Distribución terrestre del arsénico y sus niveles ambientales. Este metaloide raramente se encuentra en la naturaleza en su forma elemental, presentándose como constituyente de compuestos químicos variados y complejos. Aparece ampliamente en rocas ígneas y sedimentarias, pero su presencia principal es en minerales sulfurados de cobre, plomo, zinc y oro. Cuando está combinado con estos minerales se encuentra en su forma inorgánica mientras que, en su forma orgánica, está combinado con carbono e hidrógeno. Los compuestos en 9 forma inorgánica se encuentran de manera natural en la litósfera (90 % en rocas, suelos, sedimentos), en la atmósfera (7 - 8 %), en la hidrósfera (mares, lagos, cursos superficiales y profundos de aguas) y en la biósfera (PAIVA, 2007). a) Arsénico en aguas. Se han encontrado concentraciones de arsénico muy elevadas en aguas subterráneas destinadas al consumo humano en Nueva Escocia, Canadá y algunos otros países, las cuales se consideran, son producto del intemperismo en pilas de desechos mineros que contienen arsenopirita. En algunos casos, la presencia de arsénico es consecuencia de contaminación natural y en otros por contaminación antropogénica causada principalmente por las actividades agrícolas y ganaderas (FLORES et al., 2009). En aguas, la especie más abundante es el As (V), su presencia se ve favorecida por condiciones oxidantes y pH alcalino. Respecto al As (III) su presencia se favorece con las condiciones opuestas a las de As (V) (CACAO, 2008). b) Arsénico en sedimentos. La concentración media de arsénico en los sedimentos oceánicos se encuentra próxima a los 40 mg Kg -1, siendo menores las concentraciones en las sedimentos de regiones costeras y estuáricas (3-15 mg Kg-1). La actividad antropogénica puede elevar los niveles citados (ARAYA y ORELLANA, 2002). c) Arsénico en organismos marinos. La presencia de arsénico en los organismos marinos fue detectada a principios de este siglo, pero hasta 1969 no se puso de manifiesto que este arsénico se encontraba tanto en forma orgánica como inorgánica. En cuanto al arsénico inorgánico, ha sido siempre considerado por los investigadores como componente minoritario de los productos de la pesca (ARAYA y ORELLANA, 2002). Actualmente se sabe que la mayor parte del As en algas y otros organismos acuáticos como peces y moluscos, lo constituyen compuestos dimetilados, trimetilados y arsenobetaína, arsenoazúcares y arsenolípidos, en general no considerados tóxicos debido a su rápida excreción de manera inalterada tras su ingestión (DIAZ et al, 2008). Sin embargo, SORIANO (2009) señala que en el caso de los arsenoazúcares y arsenolípidos, se sabe que están involucrados en la formación de ácido dimetilarsínico (DMA) en la orina, el cual posee actividad tóxica conocida y podría jugar un papel importante en la carcinogénesis. 10 2.2.2 Metabolismo y eliminación del arsénico y efectos en la salud. POLO (2009), indica que una vez que ingresa el arsénico al organismo por vía digestiva, inhalada o cutánea permanece brevemente en la sangre para distribuirse mayoritariamente en el hígado, riñones, tracto digestivo pero una porción del arsénico es eliminado en forma inorgánica, se considera que la principal respuesta definitiva del organismo es inactivarlo mediante mecanismos de metilación que puede dividirse en dos etapas: Reacciones de reducción para convertir el As+5 en As+3. Reacciones de metilación oxidativa que transforman el As+3. POLO, 2009, también señala que entro los factores que pueden influir en la capacidad de mutilación está la dosis de exposición, una dieta alta en metionina y proteínas y el probable polimorfismo genético unido al sexo y el de las enzimas metilantes (metil transferasa), pues se ha encontrado mayor inducción en mujeres. Cuando la capacidad de este mecanismo de destoxificación es rebasado se presentan factores tóxicos. Por otra parte es conocido desde hace años que la exposición crónica al arsénico por la ingestión de agua puede causar efectos adversos a la salud humana. Gracias a los estudios realizados en 1888 por el investigador Hutchington se tienen los primeros antecedentes históricos que relacionaron la presencia de arsénico en el agua y lesiones en la piel como hiperpigmentación, hiperqueratosis y cáncer cutáneo (STÖHER, 1991). En el año 1913, en Argentina, fueron identificados dos pacientes que presentaban los síntomas de una intoxicación por arsénico, siendo que en un primer momento fue considerada como accidental. El número de casos fue en aumento y la enfermedad llegó a ser conocida como enfermedad de “Bell Ville”, en la provincia de Córdoba, por ser este el lugar donde se registró el mayor número de casos, en regiones rurales, en donde los niveles de arsénico en el agua eran superiores a 1 000 µg/L. En 1917, esta enfermedad pasó a ser conocida como hidroarsenicismo crónico regional endémico (HACRE). Se llegó a la conclusión de que la etiología de la enfermedad era debida a la ingestión de agua con arsénico (ASTOLFI et al., 1982). En Chile, en el año 1923, se describió por primera vez una enfermedad considerada original y característica de este país llamada enfermedad del salitre o cáncer de los salitreros. Las personas presentaban hiperqueratosis y alteraciones degenerativas en la piel (PRUNES, 1939). 11 Actualmente el problema de la presencia de arsénico en el agua de bebida no ha cesado y existen poblaciones expuestas en regiones de: Argentina, Chile, China, Estados Unidos de América, Hungría, India, Japón, México, Taiwán y Vietnam (GALETOVIC y DE FERNICOLA, 2003). El Centro Internacional de Investigaciones sobre Cáncer (IARC) lo ha clasificado en el grupo I, pues se cuenta con pruebas suficientes de la carcinogenicidad en seres humanos. De acuerdo con estudios toxicológicos y epidemiológicos, los niños son más afectados que los adultos ante la misma ingesta de arsénico, siendo las principales rutas de exposición la ingesta e inhalación, principalmente mediante el agua de bebida, lo que provoca el hidroarsenicismo (MONTERO et al., 2010). A continuación se presenta la FIGURA 1, en donde se aprecian los efectos sobre pacientes que ingirieron 1320 µg/L de arsénico en el agua de consumo de un pozo artesanal, durante dos años. FIGURA 1 Efectos del arsénico. a) Hiperqueratosis punctata a nivel palmar en un joven de 14 años. b) Hipermelanosis en gota de lluvia en un niño de año y medio. c) Pápulas verrucosas en el dorso de las manos de una paciente femenina de aproximadamente 25 años. FUENTE: MONTERO et al. (2010) 2.2.3 Límites internacionales de ingesta para arsénico. La Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO) y la Organización Mundial de la Salud (OMS), establecen un valor toxicológico de referencia para la ingesta de arsénico inorgánico, conocida como Ingesta Diaria Tolerable Provisional (IDTP), de 2 μg/kg de peso corporal, cuyo valor representa una estimación de la cantidad de un 12 contaminante presente en los alimentos o en el agua de bebida, que puede ser ingerida todos los días durante toda la vida sin que los riesgos para la salud sean apreciables. Para el caso del arsénico total, la IDTP que establece la FAO/OMS es de 50 μg/kg de peso corporal. La Ingesta Semanal Tolerable Provisional (ISTP), para el arsénico inorgánico es de 15 μg/kg de peso corporal/semana (GAJARDO y VIDAL, 2009). Los mismos autores señalan, que la dosis oral de referencia (DdR; una dosis considerada segura para el consumo diario normal sin efectos adversos para la salud), para el arsénico inorgánico es de 0,3 μg/kg/día, teniendo en cuenta las estimaciones de arsénico en los alimentos (2 μgAs/día) y el volumen de agua consumido (4,5 L/día), según la EPA. Esta DdR se basa principalmente en estudios realizados en una población de Taiwán, algunos de los cuales mostraron un alto nivel de ingesta de arsénico inorgánico (400-600 μg/L), en agua potable. 2.2.4 Situación del arsénico en Chile. En Chile, al igual que en la mayoría de los países en desarrollo, existen múltiples sustancias tóxicas no reguladas emitidas por diversos procesos industriales, una de ellas es el arsénico, emitido fundamentalmente por fundiciones de cobre (ya sea por medio de sus relaves o bien por emisión de gases), las cuales se encuentran distribuidas a lo largo de nuestro país, concentrándose en la II Región de Antofagasta, donde se ha convertido en un serio problema (ARAYA y ORELLANA, 2002). El alto contenido de arsénico observado en esta región está relacionado con el vulcanismo cuaternario característico de los Andes Centrales. Las aguas originadas en las zonas volcánicas de los Andes Centrales, tanto superficiales como de los flujos freáticos, lagunas y géiseres, contienen altas concentraciones de arsénico y de otros elementos como vanadio, flúor y azufre. (PAIVA, 2007). Se puede considerar que las condiciones hidrogeológicas son el origen natural de la contaminación por arsénico de aguas y suelos de la zona, así como de los alimentos cultivados en tales condiciones. En Chile, las concentraciones de arsénico en el agua potable muestran un gradiente que disminuye de norte a sur, siendo la región de Antofagasta una de las que presentan las mayores concentraciones medias de 13 arsénico (BIONDI et al., 1995). Con respecto a lo mismo, CASTRO (2006), señala que en Antofagasta entre 1955 y 1970 encontraron niveles de arsénico en el agua con una media de 0,598 mg/L. Los valores actuales indican una media de 0,04 mg/L. Actualmente, y a pesar de las medidas tomadas, aún se detectan niveles elevados de arsénico en la red de agua que abastece las localidades de esta región y el agua tiene que someterse a tratamientos para alcanzar los límites establecidos por la norma chilena vigente para el agua potable, que recomienda una concentración máxima de 50 μg/L. Sin embargo, durante la década de 1960 ocurrió un grave problema epidemiológico en la región, debido a la contaminación por arsénico del agua de consumo. Así, durante 12 años, de 1959 a 1970, unos 130.000 habitantes estuvieron consumiendo agua con contenidos de arsénico del orden de 800 μg/L, sin que se conociera tal exposición. Los síntomas de toxicidad crónica empezaron a aparecer, especialmente en niños, como manifestaciones dermatológicas (alteraciones pigmentarias, queratosis arsenicales), síndrome de Raynaud y otros problemas cardiovasculares. Para mitigar el problema, se construyeron plantas de abatimiento de arsénico que redujeron significativamente sus niveles en el agua de consumo (BIONDI et al., 1995; MANDAL y SUZUKI, 2002). El CUADRO 1, indica que en el norte de Chile (región de Antofagasta) hay un incremento de las tasas de cáncer de piel, vejiga y pulmón y una mayor mortalidad por estos tipos de cáncer en comparación con el resto del país, lo que se puede asociar con la exposición de los años 60 (SMITH et al., 2000). Además de la contaminación natural, en la región de Antofagasta existe una intensa actividad minera que, de modo general, contamina de forma significativa el aire, aunque también ejerce influencia sobre las aguas, suelos y alimentos, aumentando los niveles de contaminación de la región. En las zonas donde existe actividad minera, la situación de contaminación por arsénico en el aire se agrava en los sitios próximos a los sectores donde se dan emisiones de fundiciones de cobre y de plantas de tueste (BIONDI et al., 1995). 14 CUADRO 1 Datos de mortalidad por cáncer de vejiga y pulmón en Chile y en algunas regiones. Chile, Regiones y Provincias (1976-1991) Lugar Tasa Promedio (desviación estándar) Mortalidad / 100.000 habitantes Cáncer vejiga Cáncer broncopulmonar Chile 1,4 (0,2) 9,9 (0.8) I Región 1,9 (0,7) 13,0 (2,4) II Región 6,2 (1,7) 28,6 (4,49) Antofagasta 8,2 (2,7) 37,6 (5,7) Tocopilla 9,3 (5,8) 36,4 (16,2) El Loa 1,2 (1,1) 9,0 (3,3) III Región 1,8 (0,9) 13,7 (3,2) FUENTE: Adaptado de PAIVA (2007). La Agencia para Sustancias Tóxicas y el Registro de Enfermedades (ATSDR), señala que la concentración de arsénico en el suelo varía con un promedio de 3 a 4 ppm. Sin embargo, los suelos cerca de depósitos geológicos ricos en arsénico, cerca de algunas minas y fundiciones, o en áreas agrícolas donde se usaron plaguicidas con arsénico en el pasado, pueden tener niveles de arsénico mucho más altos (ATSDR, 2007). Las concentraciones de arsénico en el aire no se presentan de forma constante a lo largo del tiempo, debido a la variabilidad de las condiciones meteorológicas y de las emisiones; con todo, mediciones realizadas en el material particulado atmosférico muestran una gran diferencia de concentraciones entre las localidades afectadas directamente por las emisiones de las fundiciones y otras localidades no afectadas. La Comisión Nacional del Medio Ambiente de Chile (CONAMA) viene estudiando 15 diferentes opciones para regular las concentraciones de arsénico en la atmósfera, incluyendo herramientas tales como normas de calidad y normas de emisión (GUTIERREZ y WIERTZ, 1997; ULRIKSEN y CABELLO, 1997). Según CHILE, INSTITUTO NACIONAL DE NORMALIZACION (INN) (2005), oficializó la modificación a la NCh 409/1984, el 27 de Junio de 2006, que regula la calidad del agua potable. Esta norma se aplicó desde el 1° de Enero de 2007, en ella se fija la nueva concentración de arsénico en el agua de bebida de 10 μg/L propuesto por la Organización Mundial de la Salud (OMS). Su aplicación es de 5 años para bajar a 30 μg/L y 10 años para llegar a 10 μg/L. 2.2.5 Contenido en alimentos e ingesta dietética del arsénico. La información disponible sobre contenidos de As en los alimentos y las especies presentes es relativamente escasa. Según ya se ha indicado, los alimentos de origen marino constituyen la principal fuente dietética de As, elemento que se encuentra en distintas formas químicas que difieren en su toxicidad. Por otra parte, las especies químicas de As presentes varían en función de la especie animal considerada (CAMEAN y REPETTO, 2007). Así por ejemplo, el pescado blanco es más rico en As que el azul, pero este tiene un mayor contenido de As-i, lo que se atribuye a la mayor riqueza en el pescado azul de aminas biógenas y otras aminas (análogas de las especies organoarsenicales), que desviarían al arsénico inorgánico de la destoxicación por metilación, favoreciendo la acumulación de este (MUÑOZ et al., 2000). La arsenobetaína es el compuesto organoarsenical mayoritario de los productos de la pesca. En el pescado blanco representa más del 70% del As, le sigue la DMA (≅ 23% As) y un menor porcentaje (< 4% As-t) del resto de especies arsenicales (AC, MMA y TMA +) (SUÑER et al., 2002). Las algas marinas son componentes tradicionales de la dieta de los países asiáticos, mientras que en los países occidentales se utilizan mayoritariamente como ingredientes por la industria alimentaria, aunque en los últimos años se ha incrementado el consumo de ciertas algas por su contenido en fibra, minerales y proteínas, junto a un bajo contenido lipídico (MABEAU y FLEURENCE, 1993), aunque 16 según ya se ha mencionado, las algas pueden contribuir al aporte de As, con un elevado porcentaje de arsénico inorgánico (LAPARRA et al., 2003). En condiciones normales, los alimentos de de origen marino constituyen la principal fuente dietética de As, pero los cereales y otros vegetales procedentes de áreas contaminadas por As, pueden contribuir de forma significativa a su aporte dietético (CAMEAN y REPETTO, 2007). Como sucede en la región preandina de Chile, donde debido a la riqueza en As de sus suelos y acuíferos, los contenidos de As de los vegetales allí cultivados son altos. Dicho As es mayoritariamente As (i), lo que indica una baja tasa de metilación del As (i) procedente del suelo, a diferencia de lo que ocurre en los alimentos de origen marino, en los que predominan las especies organoarsenicales. La presencia de As (i) en los vegetales es motivo de preocupación en poblaciones con dietas ricas en ellos y que además puede que utilicen aguas contaminadas para cocinar (MUÑOZ et al., 2005). Como antecedente, el segundo estudio realizado en Chile para determinar la ingesta de contaminantes químicos mediante el estudio de dieta total, estimó que la tanto la ingesta de As (t) y As (i) de comidas servidas por el Programa de Alimentación Escolar de Chile, son muy inferiores a los límites establecidos por la FAO/OMS, lo que implica que los estudiantes que reciben estos alimentos no están expuestos a un riesgo para la salud (BASTIAS et al., 2010). 2.3 Mercurio (Hg) El mercurio se encuentra presente en todos los compartimentos del medio ambiente (atmósfera, geósfera, hidrósfera y biósfera) y a diferencia de lo que sucede con los compuestos orgánicos su degradación no se produce en el medio. Por lo tanto, la cantidad de mercurio total ha permanecido constante desde la formación del planeta aunque, como es natural, la distribución de este elemento no es uniforme ni homogénea (CABAÑERO, 2005). Es un elemento constitutivo de la tierra (al igual que el plomo, cadmio y todos los metales) y su concentración promedio en la corteza terrestre es de 0,02 [μg/g], el aire contiene un rango de 0,005-0,06[ng/m3], el agua 17 dulce 0,1 y la de mar 0,03 [μg/L]. Como tal, el elemento mercurio no puede descomponerse en sustancias menos tóxicas en el medio ambiente (JARA, 2007). 2.3.1 Características físicas y químicas del mercurio y sus formas de presentación. Es un metal pesado, blanco plateado que, junto al cadmio y zinc, se ubica en el grupo IIB de la tabla periódica. Este metal posee características fisicoquímicas muy especiales como: estado líquido a temperatura ambiente y ser el único conocido en estado líquido a 0ºC, densidad elevada, calor específico poco elevado, líquido muy poco compresible, tensión superficial muy alta, capacidad calorífica muy débil y capacidad de amalgamación con otros metales (OYARZÚN, 2008). OLIVERO y JOHNSON (2002), indican que entre las propiedades químicas más importantes que caracterizan las especies de mercurio (II) y las alquilmercúricas (RHg+) aparece su alta afinidad para formar enlaces covalentes con el azufre. Esta propiedad es la que explica la mayor parte de las propiedades biológicas del metal. El mercurio se genera de manera natural en el medio ambiente y se da en una gran variedad de formas. En su forma pura se le conoce como mercurio “elemental” o “metálico”, representado también como Hg (0). El mercurio puede enlazarse con otros compuestos como mercurio monovalente o divalente (representado como Hg (I) y Hg (II), respectivamente). A partir del Hg (II) se pueden formar muchos compuestos orgánicos e inorgánicos de mercurio (ALBERT, 2001 y ESPAÑOL, 2001). Las formas naturales de mercurio más comunes en el medio ambiente son el mercurio metálico, sulfuro de mercurio, cloruro de mercurio y metilmercurio. Ciertos microorganismos y procesos naturales pueden hacer que el mercurio en el medio ambiente pase de una forma a otra (OYARZÚN, 2008). El mercurio adopta la forma inorgánica cuando se combina con ciertos elementos como oxígeno, azufre o cloro (CAMEAN y REPETTO, 2007). Cuando el mercurio se combina con carbono forma compuestos de mercurio orgánicos, el más común, el metilmercurio, es producido principalmente por organismos microscópicos en el suelo y en el agua. Mientras mayor es la cantidad de mercurio en el medio ambiente, mayor es la cantidad de metilmercurio que estos organismos producen (JARA, 2007). 18 CAMEAN Y REPETTO (2007), señalan que algunos microorganismos acuáticos (bacterias, hongos y fitoplancton) son capaces de metilar el mercurio elemental e inorgánico, pasándolo a su forma orgánica. Por sus características fisicoquímicas y la capacidad de bioacumulación en los organismos vivos, los compuestos orgánicos de mercurio – y en especial, el metilmercurio – son los más tóxicos y pueden provocar graves daños en la salud de las personas expuestas. Desgraciadamente, existen importantes precedentes de contaminación por metilmercurio a través de la dieta. Desde el punto de vista bioquímico, la propiedad química más importante de los compuestos de mercurio, es su alta afinidad por los grupos SH (LÓPEZ y LOZANO, 2006). Mercurio metálico: el mercurio elemental a temperatura ambiente, evapora parcialmente, formando vapores de mercurio los que son incoloros e inodoros. Cuanta más alta sea la temperatura, más vapores emanarán del mercurio metálico líquido. Algunas personas que han inhalado vapores de mercurio indican haber percibido un sabor metálico en la boca. El mercurio se extrae como sulfuro de mercurio (mineral de cinabrio). A lo largo de la historia, los yacimientos de cinabrio han sido la fuente mineral para la extracción comercial de mercurio metálico. La forma metálica se refina a partir del mineral de sulfuro de mercurio calentando el mineral a temperaturas superiores a los 540ºC. De esta manera se vaporiza el mercurio contenido en el mineral, y luego se captan y enfrían los vapores para formar el mercurio metálico líquido (MUÑOZ et al., 2005). Compuestos orgánicos de mercurio: cuando el mercurio se combina con carbono se forman compuestos conocidos como compuestos “orgánicos” de mercurio u organomercuriales. SMOCOVICH (2000), afirma que el metilmercurio es el más peligroso de los compuestos mercuriales debido a su gran estabilidad, solubilidad en lípidos y por poseer propiedades iónicas que le permiten penetrar las membranas de todos los organismos vivientes. Provoca alteraciones del desarrollo normal del cerebro de los lactantes y, a niveles más elevados, puede causar modificaciones neurológicas en los adultos (RUBIO, 2002 19 Compuestos inorgánicos de mercurio o sales mercuriales: algunos de los compuestos inorgánicos de mercurio son: sulfuro de mercurio (HgS), óxido de mercurio (HgO) y cloruro de mercurio (HgCl2). A estos compuestos también se les conoce como sales de mercurio. La mayoría de los compuestos inorgánicos de mercurio son polvos o cristales blancos, excepto el sulfuro de mercurio, que es rojo y se vuelve negro con la exposición a la luz. Algunas sales de mercurio (como el HgCl2) son lo bastante volátiles para existir como gas atmosférico. Sin embargo, la solubilidad en agua y reactividad química de estos gases inorgánicos de mercurio hacen que su deposición de la atmósfera sea mucho más rápida que la del mercurio elemental. Esto significa que la vida atmosférica de los gases de mercurio divalentes es mucho más corta que la del gas de mercurio elemental (OYARZÚN, 2008). 2.3.2 Fuentes de origen del mercurio. Las fuentes de origen, pueden ser naturales o antropogénicas, como es habitual en estos metales tóxicos. (ESCRIBÁ, et al.; 2007). Lo mismo señala USA, AGENCIA PARA SUSTANCIAS TÓXICAS Y EL REGISTRO DE ENFERMEDADES (ATSDR) (1999), donde se afirma que el 80% del mercurio que es liberado por actividades humanas es mercurio elemental liberado al aire, principalmente como consecuencia del uso de combustibles fósiles, la minería, fundiciones y de la incineración de desechos sólidos. Cerca del 15% del total se libera al suelo y proviene de abonos, fungicidas y desechos sólidos municipales (por ejemplo, de basura que contiene baterías, interruptores eléctricos o termómetros). Un 5% adicional es liberado al agua ambiental desde aguas residuales de industrias. PACYNA et al. (2010), señalan que se pueden distinguir dos fuentes antropogénicas de mercurio: Fuentes antropogénicas primarias: son aquellas donde el mercurio de origen geológico se moviliza y se libera al medio ambiente. Las dos principales categorías en este grupo son la minería (tanto para el mercurio como para otros minerales) y la extracción y quema de combustibles fósiles que contienen el mercurio como una huella contaminante. Fuentes antropogénicas secundarias: son aquellas en las que las emisiones se producen por el uso intencional del mercurio, incluyendo su uso en procesos 20 industriales, en productos, aplicaciones dentales o en la minería de oro artesanal. Según CHILE, CORPORACIÓN NACIONAL DEL MEDIO AMBIENTE (CONAMA), (2007), el mercurio se concentra principalmente en el país en la IV Región (Coquimbo posee alrededor de 17 depósitos naturales). Asimismo, las III y IV regiones aparecen como zonas con alto contenido de mercurio en sus costas, mientras que la V y VIII regiones lo hacen por el contenido de mercurio en sus sedimentos marinos. Las emisiones naturales de mercurio están fuera de todo control y deben considerarse como parte del entorno vital a escala local y mundial. Con todo esto, es necesario no perder de vista estas fuentes, pues contribuyen a los niveles ambientales de mercurio. En algunos lugares del mundo las concentraciones de mercurio en la corteza terrestre se elevan de manera natural, y contribuyen a elevar las concentraciones locales y regionales de mercurio en esas áreas (OYARZÚN, 2008). El mercurio es posible encontrarlo en: Mercurio en el aire: La concentración de mercurio varía mucho de unas zonas a otras según sean rurales o urbanas, estén en las proximidades de puntos de emisión concentrada y que éstas sean naturales o antropogénicas (CAUSSY et al., 2003). Pero salvo casos excepcionales, no superan los 50ng/m 3 (MONTEAGUDO, 2002). Las fuentes más importantes de emisión de este elemento al aire son la combustión de combustibles fósiles, la minería y la fundición (CAMEAN y REPETTO, 2007). El mercurio gaseoso elemental se transporta en la atmósfera a escala global y reside en ella por un tiempo aproximado de un año (PACYNA et al., 2010), mientras que el mercurio oxidado (Hg (II)) tiene tiempos de residencia que oscilan entre horas y meses, ya que puede ser depositado con relativa facilidad tanto por vía húmeda como por vía seca (GAONA, X. 2004). Mercurio en ambientes acuáticos: El contenido de mercurio en el agua, se debe principalmente a desechos vertidos de industrias donde se usa este metal en sus procesos tecnológicos (POWER et al., 2002). El mercurio inorgánico o el metal libre, se transforma a mercurio orgánico gracias a la acción de bacterias anaeróbicas productoras de metano, y presentes en el fango 21 depositado en ríos y lagos. (COULTATE, 1998; YAMASHITA et al., 2005 y GIL et al., 2006). El mercurio (y en particular el metilmercurio) presenta una clara acumulación en las cadenas alimenticias costeras. Esta bio-acumulación puede ser separada en dos grandes subgrupos, como son la comunidad de micro-invertebrados presente en los sedimentos bénticos y la comunidad de fitoplancton y zooplancton (así como peces plantívoros y piscívoros) que reside en la columna de agua (GAONA, 2004). Mercurio en ambientes terrestres: Generalmente, las condiciones de los suelos son favorables para la formación de compuestos orgánicos e inorgánicos que forman complejos con aniones orgánicos, pues gran parte del mercurio que se encuentra en el suelo está unido a masa de material orgánico y puede ser lixiviado por la escorrentía cuando se encuentra unido tanto a humus como a suelo en suspensión. Por ello, el mercurio en el suelo terrestre tiene un largo tiempo de residencia y puede ser liberado a las aguas superficiales y otros medios durante largos períodos de tiempos (probablemente cientos de años) (JARA, 2007). Una vez que el mercurio ha sido depositado en el suelo, está sujeto a una amplia gama de procesos de transformaciones químicas y biológicas que pueden influir en la movilización y en la entrada en la cadena trófica o a su unión a la materia orgánica presente en el horizonte superficial del suelo. Su gran movilidad, la afinidad a la materia orgánica y la capacidad de biomagnificación hacen de este uno de los metales más nocivos para la biota (GIL et al., 2010). Mercurio en alimentos: El mayor problema de los contaminantes metálicos existentes en los alimentos, radica en que estos no cambian el aspecto de los alimentos u otras de sus características, por lo que la contaminación no se reconoce a simple vista y pasa inadvertida (OYARZÚN, 2008). Aunque las condiciones locales pueden influir en la exposición al mercurio de ciertas poblaciones, la mayoría de la población está expuesta principalmente al mercurio por medio de los alimentos. Un factor muy importante de los efectos del mercurio en el medio ambiente es su capacidad para acumularse en organismos y ascender por la cadena trófica. Hasta cierto punto, todas las 22 especies de mercurio pueden llegar a acumularse, pero el metilmercurio se absorbe y acumula más que otras especies (CABAÑERO, 2005). Hay que resaltar que los alimentos son los principales contribuyentes a la exposición de mercurio en poblaciones no expuestas, tanto desde un punto de vista ocupacional como ambiental. Los niveles del elemento fluctúan en concentraciones bajas, que están entre 0,005 y 0,075 mg/kg, en una gran variedad de alimentos no habitualmente expuestos al elemento (DIAZ Y GARCIA, 2002). De acuerdo a lo planteado por la Comisión Europea, 2004 citado en BUREAU OF CHEMICAL SAFETY FOOD DIRECTORATE HEALTH PRODUCTS AND FOOD BRANCH (2007), las concentraciones en frutas y verduras son muy bajas, porque la absorción de mercurio por las plantas del suelo también es mínima, pero este puede entrar en el cuerpo humano a través de estos alimentos, cuando sprays que contienen mercurio son aplicados en la agricultura. En cambio, los niveles son más altos en ciertos tipos de peces, aunque los niveles traza se puede encontrar en casi todos los tipos de pescado, que absorben el mercurio de las aguas y de los organismos que consumen. En otros tipos de alimentos tales como la carne, huevos y productos lácteos, se pueden detectar concentraciones de mercurio total, debido posiblemente a residuos de compuestos organomercuriales presentes en piensos, elaborados a partir de harina de pescado o cereales, reportándose concentraciones que varían entre 0,003 a 0,060 mg/kg para la carne 0,003 a 0,043 mg/kg para los huevos y de 0,003 a 0,022 mg/kg para la leche y derivados (DIAZ y GARCIA, 2002). Por lo tanto y según lo señalado por diversos autores entre ellos DASGUPTA et al., (2004) y YAMASHITA et al., (2005), la presencia de mercurio se restringe casi exclusivamente a los pescados donde la mayor parte se encuentra como metilmercurio. Los contenidos de metilmercurio en los peces dependen muchas veces del nivel de contaminación medioambiental, pero su capacidad de bioacumulación hace que los mayores contenidos se presenten en las especies depredadoras que viven más tiempo y alcanzan mayores tamaños como el pez espada o el tiburón. 23 Aproximadamente el metilmercurio constituye un 75% del mercurio total de los pescados (JALÓN et al., 1997). 2.3.3 Toxicocinética y toxicidad del mercurio. La toxicocinética de este metal está determinada por su forma química. Así, del total del mercurio que se absorbe por inhalación, un 60% está en forma de mercurio vapor y el resto se reparte entre mercurio orgánico e inorgánico; sólo un 3% corresponde a la forma particulada. Sin embargo, independientemente de la forma química, un 80% del mercurio inhalado se retiene, y se estima que del vapor del mercurio se absrove casi un 100% a través del alveólo pulmonar. Respecto a la vía digestiva, el mercurio metálico no se absorbe prácticamente por esta vía; los derivados inorgánicos se absorben en un 70% mientras que los orgánicos lo hacen en su totalidad. La abosricón por vía cutánea está limitada a los derivados órgano mercuriales (GRAY et al., 2010). La toxicidad del mercurio es conocida desde la antigüedad, Hipócrates (370 a.C) y Plinio (77 a.C) describieron enfermedades y dolencias que experimentaban los esclavos que trabajaban en minas de mercurio (GAONA, 2004). Hacia el siglo XVIII el mercurio se empezó a utilizar en los sombreros de copa para preservar su firmeza. Este uso provocó que los trabajadores de las fábricas de sombreros se volviesen locos como resultado de la inhalación de los vapores de mercurio, cuyos efectos además eran irreversibles. El irritable “sombrerero loco”, personaje que aparecía en el famoso libro de Lewis Carroll “Alicia en el país de las maravillas”, es un ejemplo de los efectos del envenenamiento por mercurio, describiéndose la irritabilidad como uno de los primeros síntomas de este mal (FERNÁNDEZ, 2006). Debido al creciente uso industrial de este metal en el mundo, han surgido numerosos episodios de contaminación ambiental con envenenamiento en seres humanos. Uno de los primeros y mejor estudiados ocurrió en Japón en 1953 en la bahía de Minamata (FIGURA 2). Una investigación internacional reveló que el mercurio inorgánico allí vertido, procedente de una cercana planta de producción de acetaldehido, había sido convertido en metilmercurio por la acción de microorganismos presentes en los sedimentos. El MeHg formado sufrió procesos de bioacumulación en peces y moluscos 24 que a su vez constituían parte de la alimentación básica de una población cercana. La ingestión de pescado contaminado dio lugar a la aparición de la llamada “enfermedad de Minamata”, cuyos síntomas iban desde la parestesia a defectos graves en recién nacidos e incluso la muerte, todos ellos típicos de envenenamiento por Me Hg (FERNÁNDEZ, 2006). FIGURA 2 Imágenes de la enfermedad de Minamata. A. Fotografías expuestas en el Museo de la Enfermedad de Minamata en Japón. B. Sobrevivientes de la enfermedad invitados al Congreso Mundial sobre mercurio, Minamata, 2001 FUENTE: OLIVERO Y JHONSON (2002). Este fue el primer caso identificado de metilación in situ y bioacumulación del mercurio en peces y así constituye el caso epidémico icono de intoxicación humana masiva por mercurio orgánico a través de la cadena alimentaria. La segunda epidemia de la Enfermedad de Minamata se registró a lo largo del río Agano, Niigata, Japón 25 (OSORES et al., 2010). También se registran las víctimas del envenenamiento masivo que ocurrió en Irak entre 1971 y 1972, cuando se utilizó grano tratado con un fungicida de metilmercurio para preparar pan en ciertas comunidades rurales, y por otra parte de registra intoxicación masiva en grupos de indios canadienses, que estuvieron expuestos durante un largo periodo de tiempo a metilmercurio a través del consumo de pescado (GARCÍA et al., 2006). Según el CENTRO INTERNACIONAL DE INVESTIGACIONES PARA EL DESARROLLO DE CANADÁ (CRDI) (1999), las alteraciones sensoriales, reducción del campo visual, trastornos de coordinación, disartria, alteración auditiva y temblor son algunos de los síntomas más frecuentes en esta enfermedad. La intoxicación transplacentaria del feto es uno de los aspectos más temibles generando Enfermedad de Minamata Congénita mostrando retraso mental, reflejos primitivos, trastornos de coordinación, disartria, deformación de las extremidades, trastorno de crecimiento y movimientos atetósicos e hipersalivación (OSORES et al., 2010). Según OLIVERO y JHONSON (2002), el metilmercurio es acumulado tanto en el cerebelo como en la corteza cerebral donde es fuertemente enlazado a las proteínas a través de los grupos sulfidrilos. Uno de los grandes problemas de este agente tóxico es su alta capacidad para atravesar la barrera placentaria, entre habitantes de Minamata (Japón) contaminados con metilmercurio fue frecuente el nacimiento de niños con microcefalia (disminución en el tamaño del cerebro), ausencia o disminución de la longitud de las extremidades, sordera y ceguera, estos síntomas reciben el nombre de “Enfermedad de Minamata”. El metilmercurio la forma más tóxica puede llegar a causar daños irreversibles, especialmente cuando se trata de niños recién nacidos y mujeres embarazadas, ya que el feto es más susceptible a la exposición al mercurio, debido a que puede penetrar fácilmente la placenta; lo que se traduce en un daño al sistema nervioso central (FLAHERTY et al., 2003; HSU et al., 2006; RONCHETTI et al., 2006; SHIM et al. 2004). La investigación realizada por GOCHFELD (2003), señala la manifestación de parálisis cerebral grave, ceguera y profundo retraso mental, que presentaban al nacer los hijos de mujeres expuestas al MeHg, a través del aporte dietético. 26 Según CAMEAN y REPETTO (2007) no hay evidencias suficientes ni en animales ni en humanos para considerar el mercurio como carcinógeno (grupo 3). Se considera que los niveles normales de Hg en sangre son los inferiores a 10 μg/L, y en orina, aquellos por debajo de 20 μg/L. Como en el resto de metales, para la desintoxicación generalmente se recurre al tratamiento con quelantes. Estudios revelan efectos adversos en el sistema nervioso central y en los riñones de personas expuestas a niveles atmosféricos prolongados de 25-30 [µg/m3], las exposiciones altas también han causado mortalidad. Los efectos observados tanto para el mercurio elemental, como para los compuestos inorgánicos de mercurio son la excreción de proteínas de bajo peso molecular, enzimas asociadas con el funcionamiento de la tiroides, en los índices de abortos espontáneos, genotoxicidad, sistema respiratorio y digestivo, hígado, sistema inmunológico, piel (ver IMAGEN 3), entre otros (JARA, 2007). El riñón es, junto con el sistema nervioso central, un órgano crítico en la exposición al vapor de mercurio, acumula el compuesto inorgánico de mercurio en mayor medida que la mayor parte de los otros tejidos (TRASOBARES, 2010). La inhalación repetida de vapores de mercurio puede comportar un síndrome nefrótico clásico (LAUWERYS, 1994). El mismo autor señala que, el tratamiento con diuréticos mercuriales y la aplicación cutánea de cremas a base de sales de mercurio pueden provocar la misma lesión. GARCÍA et al., (2006), confirman en su estudio que la exposición crónica a vapores de mercurio producen daño renal y que la exposición a mercurio mercúrico causa tubulopatía renal, también puede producir glomerulonefritis de base inmunológica, además el estudio afirma la presencia de síndrome nefrótico en trabajadores expuestos a compuestos mercuriales. En relación a los efectos en la piel, la acrodinia o enfermedad rosa aparece en exposiciones crónicas a mercurio inorgánico, consiste en un eritema de extremidades, tórax y cara con fotofobia, alteraciones del ritmo intestinal, entre muchos otros síntomas (BATALLER Y BALAGUER, 2004). El mercurio también se considera responsable de alergias subcutáneas, esta reacción se ha observado principalmente en odontólogos (LAUWERYS, 1994). En el estudio realizado por MORALES et al., (2008) se describen los casos de tres niños diagnosticados de síndrome del babuino, 27 definido por la aparición de lesiones dermatológicas de morfología y distribución características como consecuencia del contacto con mercurio. FIGURA 3 Manifestaciones cutáneas del contacto con mercurio. A. Pulpitis de contacto por mercurocromo (mercromina). B. Eccema de contacto agudo en antebrazo por mercurocromo (mercromina). FUENTE: ALFONSO et al. (2006). También existen efectos cardiovasculares asociados, algunos signos de la toxicidad cardiovascular de la exposición aguda a mercurio elemental son taquicardia, elevación de la presión sanguínea y palpitaciones (TRASOBARES, 2010). En el estudio realizado por GARCÍA et al., (2007) se concluye que existe asociación entre la exposición a largo plazo al mercurio inorgánico experimentada por los trabajadores de las minas de mercurio y el aumento del riesgo de mortalidad cardiovascular, en particular, del riesgo de muerte por hipertensión y por enfermedad cerebrovascular. Así mismo lo señala el estudio de BOFFETA et al., (2001), en donde se demostró que en los trabajadores de minas europeas de mercurio, aumentó la mortalidad debido a hipertensión y a cardiopatías, y se indicó que esos efectos aumentaban con el tiempo transcurrido desde el primer empleo y con la exposición acumulativa estimada al mercurio. Como ya se ha mencionado, los efectos en la reproducción y el desarrollo son un aumento de abortos espontáneos, anomalías congénitas y una disminución de la fertilidad en las mujeres (TRASOBARES, 2010). Quizás uno de los efectos del metilmercurio que más han impactado a la humanidad ha sido su capacidad 28 teratogénica, que consiste en alteraciones del desarrollo del embrión o del feto lo cual puede generar malformaciones congénitas (OLIVERO Y JHONSON, 2002). 2.3.4 Límites internacionales y nacionales de concentración de mercurio en alimentos. La situación de los contaminantes y la presencia de muchas sustancias en los alimentos, así como su importancia para la salud humana es o ha sido objeto de investigación científica y debate, es por esto que la FAO/OMS ha fijado valores para algunos alimentos como se puede observar en el CUADRO 2 para mercurio total y en el CUADRO 3 para metilmercurio. CUADRO 2 Límites de concentración para mercurio total en alimentos, recomendados por Codex Alimentarius. Hg Total Límites máximos de mercurio (mg/kg) Sal de calidad alimentaria 0.1 Aguas minerales naturales 0.001 FUENTE: FAO/OMS (2008). CUADRO 3 Límites de concentración para metilmercurio en alimentos, recomendados por Codex Alimentarius. Metilmercurio Pescado Peces depredadores FUENTE: FAO/OMS (2008). Concentración de metilmercurio (mg/kg) 0.5 1 29 La FAO/OMS, ha establecido límites de ingesta para mercurio. Dando así un valor límite para mercurio total y su compuesto más tóxico el metilmercurio, este valor es la Ingesta Semanal Tolerable Provisional (ISTP) (JALON et al., 1997). El término ISTP representa la exposición semanal tolerable para aquellos contaminantes inevitablemente asociados al consumo de alimentos. El término provisional se refiere a que la evaluación no es definitiva, debido a la escasez de datos fiables sobre las consecuencias de la exposición en el hombre. Los valores de observan en el CUADRO 4. CUADRO 4 Ingesta Semanal Tolerable Provisional (ISTP) de mercurio según Comisión FAO/OMS. Elemento ISTP (ug / kg peso / semana) Hg Total 5.0 Metilmercurio 1.6 FUENTE: FAO/OMS (2008). La Ingesta Semanal Tolerable Provisional (ISTP) para mercurio es de 5 ug/Kg peso/semana, este valor transformado a días es de 48.57 ug/día, considerando un peso corporal de 64.6 kg, que es el peso medio de los participantes en la Encuesta Nutricional (JALON et al., 1997). En el Reglamento Sanitario de los Alimentos de Chile se hace referencia a los metales pesados y se establece los límites máximos de mercurio (mg/kg) permitidos en el producto final (CHILE, MINISTERIO DE SALUD, 2004). Un ejemplo de estos niveles en algunos alimentos se indica en el CUADRO 5. 30 CUADRO 5 Límites máximos de contenido de mercurio para distintos productos según Reglamento Sanitario de los Alimentos. Alimentos Límites máximos de mercurio (mg/kg) Cereales, legumbres y leguminosas 0.05 Conservas de pescados y mariscos 1.0 Pescado fresco, enfriado y congelado 0.5 talla pequeña Pescado fresco, enfriado y congelado 1.5 talla grande como tiburón y albacora Mariscos frescos 0.5 Sal comestible 0.1 Agua mineral de mesa 0.001 FUENTE: CHILE. MINISTERIO DE SALUD (2010). 2.3.5 Ingestas dietéticas y presencia en los alimentos de mercurio. Los alimentos son sin duda una de las principales fuentes de exposición de mercurio y cabe destacar, que como principal alimento están los pescados, por ende las personas que presentan mayor riesgo son las que basan su dieta principalmente en este tipo de alimento (OYARZÚN, 2008). El Hg y el Hg-i, procedentes de las actividades antropogénicas llegan a las aguas y se depositan en los sedimentos. Parte del Hg reacciona para formar HgS insoluble, y parte es biometilado por acción de las bacterias a MeHg, forma de Hg biodisponible y cuya presencia se amplifica en la cadena alimentaria, de manera que los peces de los niveles altos de la cadena trófica tienen contenidos de Hg 10 6 veces superiores a los del agua donde viven (CAMEAN y REPETTO, 2007). 31 Para la mayoría de la población el pescado es la única fuente dietética significativa de exposición al MeHg (75-95% del Hg del pescado). Una ingesta alta de pescado (incluso de especies con bajos contenidos de Hg) puede provocar una acumulación de MeHg, en un grado capaz de provocar trastornos, y si se trata de mujeres embarazadas, la cesión al feto de cantidades de MeHg suficientes para provocar una alteración en el desarrollo del sistema nervioso (GOCHFELD, 2003). CAMEAN y REPETTO (2007), indican que las ingestas dietéticas de Hg dependerán del consumo de pescado y variarán en función del país y de su dieta. En la mayoría de países, las ingestas medias de Hg son inferiores a la ingesta semanal tolerable provisional, aunque pueden superar el máximo propuesto por los EE UU. La investigación realizada en Chile por MUÑOZ et al. (2005), señala que la mayor concentración de mercurio se presenta en pescados y mariscos (48 ng/g. peso húmedo), con concentraciones seis veces más pequeñas que en los cereales (8 ng/g. de peso húmedo). En España, la ingesta de mercurio es ocho veces mayor, debido al mayor consumo de pescado. En China, el grupo de cereales es la princiàl fuente de mercurio debido al gran consumo de estos alimentos (461.4 g/día), siendo la concentración del metal 12.1 ng/g. peso húmedo. En Huelva también se demostró que el grupo alimenticio comprendido por pescado y marisco es el que tiene una mayor concentración de mercurio total: entre 0,0234 y 0,549 peso fresco (almeja y cazón, respectivamente) (BORDAJANDI et al., 2004). 2.4 Estudio de Dieta Total Los alimentos en algunos casos podrían constituir una fuente de contaminantes químicos, por lo cual se ha hecho imprescindible la aplicación de estudios tendientes a determinar los contenidos de metales y sustancias químicas ingeridas durante el consumo de alimentos (DÍAZ y GARCÍA, 2002) Para mantener un control de los denominados contaminantes químicos, existe el Departamento de Vigilancia de la Seguridad de los Alimentos (perteneciente a la Organización Mundial de la Salud), área encargada del análisis y evaluación de los riesgos para la salud, derivados de la presencia en los alimentos de sustancias 32 potencialmente peligrosas (por ejemplo metales pesados), para posteriormente dar pautas y protocolos de acción en este sentido (FAO/OMS, 2008). Este monitoreo se lleva a cabo mediante la realización de “Estudios de Dieta Total”, método definido como: Plan diseñado específicamente para establecer completa y detalladamente, mediante análisis químico, la ingesta de contaminantes en los alimentos de una persona que consume la dieta típica y, así, poder tomar las medidas necesarias para llevar estos niveles a rangos seguros de ingesta. Por otra parte y, como consecuencia de la información que aporta una Dieta Total, ésta puede informar de la ingesta de nutrientes, con el fin de poder mantener un consumo de nutrientes dentro de los niveles recomendados. Es por esto, que la Organización Mundial de la Salud (OMS), reconociendo la necesidad de disponer de este tipo de datos, en 1985, editó una publicación titulada “Orientaciones para el estudio de las ingestas alimentarias de contaminantes químicos”, la cual pretende promover la realización de estos estudios a nivel mundial, estableciendo criterios homogéneos para permitir la comparación de los resultados obtenidos en cada nación (FAO/OMS, 1985). Para evaluar los potenciales riesgos para la salud asociados a la ingesta de contaminantes químicos que se encuentran en niveles trazas en los alimentos, es necesario determinar la ingesta promedio de los contaminantes y relacionarlos con los niveles toxicológicamente aceptables (Ingesta Semanal Tolerable Provisional -ISTP-) propuesto por la FAO/OMS. Para estimar el riesgo para la salud humana, la FAO/OMS recomienda el uso del enfoque “Dieta Total”, como una de las medidas más eficaces para asegurar que la población no quede expuesta, a través de los alimentos, a niveles tóxicos de productos químicos (MUÑOZ et al., 2000; MUÑOZ et al., 2005 y URIETA et al., 1996). 2.4.1 Actualidad en la investigación de contaminantes. En la actualidad, no es mucho lo que se sabe sobre la relación entre la exposición a contaminantes y su efecto sobre el metabolismo humano. Además cabe mencionar que los contaminantes que se han estudiado en forma individual, lo que es de importancia para conocer la naturaleza de su comportamiento, pero estos contaminantes rara vez actúan aislados. Los efectos 33 y las interacciones de mezclas de residuos químicos tienen una importancia toxicológica mucho mayor (ALLEVA et al., 2006). Debido a causas naturales o antropogénicas (principalmente por la minería), hay un contenido substancial de estos compuestos tóxicos en el ambiente chileno y por lo tanto en diversos alimentos provenientes de varias regiones del país (ROMERO et al., 2003; MANDAL y SUZUKY, 2002). Hasta ahora, los estudios sobre metales pesados en los alimentos chilenos se han realizado como opiniones aisladas, con el fin de diagnosticar la situación de poblaciones específicas y/o productos alimenticios, con excepción del estudio de dieta total realizado en Santiago el año 2005 (MUÑOZ et al., 2005), estudio que utiliza una perspectiva global para evaluar los riesgos de estos metales en los alimentos de Chile ya que las autoridades gubernamentales chilenas no vigilan la ingesta diaria de los metales en los alimentos (MUÑOZ et al., 2005). 2.4.2 Tipos de Estudio de Dieta Total. Existen tres variantes a las que puede aplicarse el término de estudios de dieta total, las cuales son: Método directo (dieta duplicada). La dieta duplicada consiste en el análisis de una réplica de la ración diaria ingerida por los participantes del estudio y tienen la ventaja de que no se necesita conocer los patrones de consumo alimentario y el número de análisis es reducido. Proporciona una información precisa sobre la dosis ingerida de los contaminantes de los alimentos. No obstante, se necesita un gran esfuerzo de los participantes, no siempre fácil de conseguir y no se puede realizar durante periodos de tiempo prolongados. Además parece probado que los patrones alimentarios se modifican durante la prueba. Más que para estudios de consumo medio, son especialmente útiles cuando se trata de estudiar las ingestas de contaminantes muy concretos en grupos especiales de población (cuya representación en un estudio que haya de englobar a toda la población sería muy escasa). El enfoque directo se refiere al análisis de todos los alimentos y bebidas preparadas para el consumo. Por lo tanto, refleja los hábitos alimenticios en la preparación de comida de la población encuestada teniendo en cuenta que pelar, lavar, 34 cocinar, freír, y otras actividades culinarias pueden tener una influencia significativa sobre el contenido de metales pesados en los productos alimenticios. Una serie de documentos sugieren que las diferencias de comportamiento humano, así como los factores socioeconómicos podrían ser agentes que contribuyan a que surjan errores importantes durante la aplicación de este método (JALÓN et al., 1997; ZUKOWSKA y BIZIUK, 2008). Método indirecto (canasta de compra). El estudio de dieta total, más conocido como canasta de compra, se basa en la estimación de la ingesta alimentaria específica en una población definida. Los alimentos abordados son obtenidos a partir de una encuesta recordatoria de 24 horas siendo aplicada a un universo representativo de la comunidad a estudiar (FLORES, 2008; ZUKOWSKA y BIZIUK, 2008). Las encuestas utilizadas en este estudio implican la obtención de una lista para la compra de muestras de alimentos que representen los productos más comúnmente consumidos en una población definida, además reúnen la información necesaria para la preparación de estos alimentos de acuerdo con los procedimientos estándares del hogar, la combinación de alimentos en alimentos compuestos o agregados, y permiten la conformación de cada grupo de alimentos (carnes, verduras, etc.) para medir los niveles de contaminantes en ellos (ZUKOWSKA y BIZIUK, 2008). Por otra parte, el estudio de dieta total proporciona información que es comprensible para el uso de programas de vigilancia de las instituciones gubernamentales (JALÓN et al., 1997; ZUKOWSKA y BIZIUK, 2008). Con esta metodología se obtienen las ingestas medias de la población, pero la relación costo/información obtenida es muy ventajosa al reducirse considerablemente el número de análisis necesarios. Permite evaluar tendencias en las ingestas e identificar los grupos de alimentos que más contribuyen a la ingesta de cada contaminante. Muchos estudios llevados a cabo en otros países utilizan este método (JALÓN et al., 1997). Alimentos individuales. En el Congreso “Estudios de dieta total en Europa” celebrado en Zeist, Holanda en 1987, con el fin de evitar malinterpretaciones, se definió, aparte de los dos métodos anteriormente mencionados, la variante 35 conocida como Alimentos Individuales, método en el cual se analizan los alimentos uno por uno, se identifican directamente los alimentos que más contribuyen a las ingestas de un contaminante o nutriente dado. Permite la estimación no sólo de las ingestas de la media de la población en general sino de las ingestas por estratos de población definidos (por edad, distribución geográfica, etc.) e incluso permite hacer estimaciones precisas de los valores de las ingestas de los consumidores extremos. Se necesitan datos sobre consumo de alimentos y datos analíticos sobre los niveles de cada contaminante en los mismos. Se seleccionan los alimentos mayoritarios de la dieta, que son adquiridos, preparados para su consumo y analizados. Se obtiene mucha más información con respecto a los otros casos, sin embargo su realización significa un elevado costo. Es el sistema utilizado comúnmente por E.E.U.U. (JALÓN et al., 1997). 36 3 MATERIAL Y MÉTODO En Chile, si bien hay estudios que revelan los valores de concentración e ingesta de arsénico y mercurio en alimentos, se desconoce hasta el momento cuál es la relación que existe entre la concentración y la ingesta de metales pesados. Considerando que las costumbres culinarias varían mucho, tanto en el tipo de alimentos como en procedimientos utilizados para su preparación, así como también en la frecuencia en que los alimentos son consumidos, la presente investigación se realizó en base a estudios retrospectivos de concentraciones e ingestas de arsénico y mercurio realizados en un proyecto conjunto de las ciudades de Chillán y Valdivia, donde el método de cuantificación de consumo, la obtención de frecuencia de consumo, así como también las mediciones analíticas se realizaron en las mimas condiciones. Esto permitió comparar dos realidades de la población chilena, la zona central representada por la ciudad de Chillán y la zona sur representada por la ciudad de Valdivia. 3.1 Estudio de Dieta Total aplicada a las poblaciones de Chillán y Valdivia La metodología a utilizar correspondió al esquema de un Estudio de Dieta Total (FIGURA 1), para ello, se diseñó y se realizaron encuestas nutricionales recordatorias de 24 horas, en las cuales se determinaron los alimentos más consumidos y la proporción en que cada uno de estos alimentos formó parte de la dieta total de ambas ciudades. Para llevar a cabo este estudio fue necesario cumplir con los siguientes pasos: a) Aplicación de un estudio de dieta total mediante una encuesta recordatoria de 24 horas. b) Los alimentos mencionados en dicha encuesta fueron transformados a g/persona/día. 37 c) Preparación de la lista de los alimentos más consumidos por las poblaciones en estudio. d) Adquisición de dichos alimentos mediante el sistema de canasta de compra en los lugares habituales de compra de la población. e) Análisis de cada uno de los grupos para determinar la presencia de arsénico y mercurio. f) Determinación de la ingesta total de la población mediante la evaluación de resultados. FIGURA 4 Esquema de Estudio de Dieta Total, aplicado a las poblaciones de Chillán y Valdivia. FUENTE: JALÓN et al. (1997). 38 3.1.1 Obtención de datos de consumo. Para realizar la recopilación de datos se aplicó la encuesta nutricional recordatoria de 24 horas, validada por el estudio realizado por MUÑOZ et al., (2005), previo conocimiento de la carta de consentimiento informado (ANEXO 1), entregada a cada una de las personas encuestadas Mediante este instrumento se recopilaron datos de índole personal como edad, sexo, masa corporal, estatura, entre otros y también hábitos alimenticios, ya que la persona encuestada debió informar todos los alimentos ingeridos 24 horas antes del momento de la encuesta, para así determinar los alimentos consumidos y la proporción en que cada uno de estos alimentos forman parte de la dieta total. Esta encuesta recordatoria de 24 horas (ANEXO 2) se realizó en Chillán en un intervalo de 4 meses (agosto y noviembre 2007) y en Valdivia durante 6 meses (abril – septiembre 2007). Las mismas reciben la información necesaria para obtener los alimentos más consumidos por la población con sus respectivas cantidades de consumo (ANEXO 3), además de los pesos corporales correspondientes a cada persona encuestada. Estos datos fueron promediados para así poder, una vez analizadas las muestras de cada grupo de alimentos, obtener la ingesta requerida por el presente estudio. De las respuestas de los encuestados, fueron obtenidos finalmente 17 grupos de alimentos, agrupados por similitud química y/o física, cada uno de los cuales fue representado por muestras codificadas y preparadas adecuadamente según la metodología aplicada (adaptada de MUÑOZ et al., 2005), para su lectura y análisis. 3.1.2 Número de encuestas a realizar. Para que los resultados sean representativos es necesario determinar el tamaño muestral (n) de la población en estudio. Para ello se utilizó inferencia estadística, estudio que se realiza para conocer parámetros (como proporciones o medias) y que permite obtener “n” número total de encuestados, con un mínimo de parámetros conocidos. Como se sabe el total de ambas poblaciones, 161.529 habitantes en la ciudad de Chillán y 140.559 habitantes en la ciudad de Valdivia, según CHILE, INSTITUTO NACIONAL DE ESTADÍSTICAS (INE), 2002, se puede aplicar: 39 (3.1) Donde: N : Número total de la población Z2 α : Coeficiente de seguridad (1.96 correspondiente a un 95% de confianza) d : Precisión que se desea obtener (5%) p : Proporción esperada (50% = 0.5) q : 1 – p (1-0.5=0.5) Para Chillán según (3.1) n = 383.25 ≈ 383 encuestados en Chillán Para Valdivia según (3.1) n = 383.25 ≈ 383 encuestados en Valdivia Así se obtuvo el número de encuestados para ambas ciudades, representando el 0.23% de la población de total de Chillán y el 0.27% de la población total de Valdivia, en la encuesta no se distinguió entre edades ni clases sociales. 40 3.2 Metodología 3.2.1 Tratamiento del material de laboratorio. Todo el material de laboratorio, ya sea nuevo o usado, luego de ser lavado fue enjuagado con agua ultra pura (18 MΩ cm 1 ) y secado a temperatura ambiente protegiéndolo del polvo. Los reactivos utilizados fueron de calidad para análisis o superior (Merck); se utilizó agua ultra pura obtenida de un desmineralizador de agua (Easy pure mod. LF/D738233) para la preparación de reactivos. El lavado de materiales tuvo como objetivo eliminar cualquier partícula indeseada. El material de vidrio y de plástico utilizado se lavó con agua corriente y detergente alcalino, posteriormente fue enjuagado con agua destilada. Inmediatamente el material fue sumergido con agua ultrapura a fin de eliminar cualquier interferente, así después el material se dejó secar al aire. 3.2.2 Adquisición y preparación de las muestras. Los alimentos fueron adquiridos de lugares habituales de venta al público, llevándose inmediatamente al laboratorio, siendo refrigerados o congelados según su requerimiento, para la posterior preparación de muestras representativas de cada grupo de alimentos conformado anteriormente y con las cuales se realizó la estimación de la ingesta. Los tratamientos de las muestras fueron los siguientes: Muestras cocinadas: Se procesaron de la misma manera que son habitualmente consumidas, descartándose las partes no comestibles y evitando la adición de sal y otras especies que puedan haber aumentado los contenidos metálicos. Las técnicas culinarias utilizadas para su preparación fueron, entre otras, cocinado a la plancha, al vapor, a la cacerola y horno convencional. Muestras en conserva: Las muestras que contenían aceite como líquido de cobertura (atún, bivalvos, y otros productos), fueron drenadas inmediatamente después de abrir y puestas sobre papel filtro para prensarlas y así extraer la mayor cantidad de aceite posible. Por otro lado, las muestras que contenían agua como líquido de cobertura, sólo se les drenó este líquido. 41 Muestras de consumo fresco: Estas muestras estuvieron compuestas principalmente por vegetales, siendo éstos lavados con agua destilada para quitar restos de polvo, seguida por un enjuague final con agua de alta pureza grado reactivo de 18 MΩ cm -1. Fueron seleccionadas las partes comestibles y se desechadas las porciones no comestibles. Para la conformación de las muestras, los alimentos una vez ya habiendo pasado por el tratamiento culinario respectivo, fueron homogenizados en una trituradora de alimentos (Minipimer, Moulinex) y envasadas en frascos plásticos. Cada uno de los grupos estuvo conformado por 3 muestreos diferentes, conteniendo éstos, los mismos alimentos del grupo pero de diferentes marcas comerciales o adquisición y codificados como M1, M2 y M3. Cabe destacar que todos los muestreos fueron trabajados en duplicado, por lo que cada grupo de alimentos estuvo conformado por 6 frascos de muestra. A cada frasco se agregó la cantidad correspondiente al porcentaje en peso calculado para cada producto conformante del grupo, suficiente para obtener 100 g totales de muestra, las que fueron utilizadas para la cuantificación, ambos contaminantes tóxicos requeridos por el presente proyecto académico. Todos los frascos preparados, fueron finalmente puestos bajo condiciones de congelación, para así mantener sus características, tanto físicas como organolépticas, en óptimo estado de conservación hasta su utilización. 3.2.3 Determinación y cuantificación de arsénico. A continuación se detalla el proceso de cuantificación de arsénico inorgánico y total utilizado para la obtención de resultados. Protocolo de determinación de arsénico: Se pesan 0.25 g. de muestra seca (en duplicado) en un vaso de precipitados de 100 mL. de formato alto en balanza analítica (Sartorius mod. 230 S). Se añade 1 mL. de agente mineralizante (Mg(NO3) x 6H2O 20% p/v + MgO 2% p/v) y 5 mL. de HNO3 50% v/v la mezcla se evapora a sequedad empleando una placa calefactora (Gerhardf mod. EV 16), posteriormente se mineraliza en un horno mufla 42 (Termolyne mod. FB 1410M – 26) a 425ºC por un periodo de 12 de horas. En el caso de que las cenizas obtenidas no fueran blancas, se adiciona 5 mL. De HNO3 10% v/v, se evapora a sequedad siguiendo el mismo proceso en el horno mufla. Tras la mineralización, se disuelven las cenizas blancas obtenidas en 5 mL. De HCl al 50% v/v y se añaden 5 mL. de la mezcla reductora (Kl 5% p/v + ácido ascórbico 5% p/v), transcurridos 30 minutos, se filtra la disolución sobre papel filtro (Whathman Nº1) y se afora a 25 mL. Con HCl al 30% v/v (MUÑOZ et al., 2001). Posteriormente el As se cuantifica en las muestras frente a una curva patrón de As (III) mediante el espectrofotómetro de absorción atómica acoplado con generador de hidruro HG-AAS (Varian mod. SpectrAA 55). Preparación de soluciones estándares. Las soluciones estándares que se utilizaron para obtener la curva patrón de As (III) se prepararon utilizando un estándar de As (V) de 1000 µg/mL, de éste se extrajeron alícuotas para obtener concentraciones de 1, 2, 5 y 10 ng/mL respectivamente, a cada una de ellas se añadió 5 mL. de mezcla reductora (Kl 5% p/v + ácido ascórbico 5% p/v) y se aforaron a 25 mL. Con HCl al 30% v/v, posteriormente fueron cuantificadas en el espectrofotómetro de absorción atómica, todos los reactivos utilizados (Merck) son de calidad para análisis. 3.2.4 Determinación de la ingesta de arsénico. La determinación de la ingesta de arsénico se realiza mediante el cruce de los datos analíticos de las concentraciones de arsénico (µg/g) en base húmeda y los datos de la masa total de la porción de una persona (g/porción). 3.3 Determinación y cuantificación de mercurio A continuación se detalla el proceso de cuantificación de mercurio utilizado para la obtención de resultados: Etapa de digestión de las muestras: Se pesaron dos gramos de muestras homogenizada y se depositaron en un vaso precipitado. A continuación se le agregaron 20 mL de HNO3 al 65% v/v. El ácido nítrico fue seleccionado como agente oxidante por su efectividad para disolver la materia orgánica y minimizar 43 así las posibles interferencias producidas por la presencia de residuos orgánicos. Posteriormente se procedió al calentamiento en placa calefactora, por un periodo de tiempo de alrededor de 4 a 6 horas. En caso que el contenido disminuyera mucho se le adicionó 10 mL del mismo ácido. Una vez que el contenido se vuelva a un color translucido, se enfriaron los vasos. Se dejaron reposar toda la noche con el fin de eliminar los vapores nitrosos; posteriormente se filtraron a través de papel Whatman N˚1 sobre matraces de aforo de 25 mL y llevándose a volumen con HCl 5% v/v. Las muestras se analizaron en duplicado. Los blancos se prepararon siguiendo el mismo procedimiento indicado para las muestras. Toda ésta etapa se realizó bajo campana de extracción por los vapores de ácido nítrico concentrado. Preparación de reactivos y patrones de mercurio: El patrón de mercurio se preparó a partir de una solución estándar comercial 1000 mg/L marca Merck, de la cual se prepararon soluciones de 1000 ug/L y 100 ug/L aforados con HCL 5% v/v. A partir de la solución patrón (100 ug/L) se prepararon diferentes concentraciones en HCL 5%, con la finalidad de construir la respectiva curva de calibración. Espectrofotometría de Absorción Atómica con generador de vapor frío. Para la cuantificación de mercurio se empleó un espectrómetro de absorción atómica marca Varian modelo SPECTRA A-55 con generador de vapor frío flujo continuo. Este sistema consta de una bomba peristáltica multi-canal de velocidad variable para distribuir las disoluciones de reactivos y muestra, la cual se controla manualmente alternando entre el blanco y la solución de muestra. El mercurio gaseoso generado desde el separador gas-liquido fue llevado al detector de AAS. El monocromador de espectrómetro de absorción atómica se ajustó a 253,7 nm, se utilizó una lámpara de cátodo hueco de mercurio ajustando la celda de cuarzo tal que la trayectoria de la luz del instrumento pase a través de ella. 3.4 Validación de la metodología. Todo método analítico debe contar con una validación. En la presente investigación esta labor se ha realizado evaluando los parámetros de exactitud y precisión, por 44 medio de adición de estándar As (V) lo cual consistió en seleccionar una muestra de la cual se realizaron 6 réplicas, a 3 de ellas se les adicionó 1 mL. de 125 ng/mL. del estándar de arsénico sobre 0.25 g. de muestra seca, se realizó toda la determinación y se cuantificó su contenido de arsénico, este se comparó con el de las réplicas no adicionadas determinándose así el porcentaje de recuperación (exactitud). A continuación se describen las ecuaciones para el cálculo de exactitud, precisión y límite de detección. Donde: Ma : Muestra con adición M : Muestra sin adición a : Cantidad adicionada Para la evaluación de la precisión (CV %) se calculó la desviación estándar de las muestras con adición. Donde: X : Media de muestra con adición El límite de detección del equipo se determinó realizando seis blancos calculándose su desviación estándar en términos de concentración y multiplicando a la misma por tres (factor que permite asegurar con un 95% que la señal es significativamente diferente a la línea base). En el caso del mercurio, se determinó el límite en el cual el equipo podría leer la concentración mínima (límite de detección), determinar la exactitud mediante el porcentaje de recuperación que tiene la técnica, se espera que se recupere entre un 80 a un 120% de ella, y por último se determina la precisión por medio del coeficiente de variación, que representa el grado de concordancia entre las lecturas que realiza el equipo en las distintas muestras. 45 4 PRESENTACIÓN Y DISCUSIÓN DE RESULTADOS 4.1 Análisis de datos de consumo del Estudio de Dieta Total en las ciudades de Chillán y Valdivia Los antecedentes de consumo de alimentos fueron reportados en la ciudad de Chillán por PEREZ, (2009) y en la ciudad de Valdivia por FLORES, (2008). Dentro del marco de proyecto de Estudios de Dieta Total, en el cual se determinan diferentes compuestos tóxicos tales como acrilamida, plomo, arsénico y mercurio, etc. La determinación de los alimentos consumidos en ambas poblaciones, se visualiza en la FIGURA 5, en donde se observa que, los alimentos consumidos en mayor proporción en ambas ciudades, corresponde al grupo de bebidas no alcohólicas con un valor de 553.1 g/día en Chillán, lo que representa el 30.9% de la dieta y 539.6 g/día en Valdivia, lo que representa un 28.4 % de la dieta; estos valores son ampliamente superiores a los demás que conforman la dieta, posteriormente le sigue el grupo pan con 256.1 g/día en Chillán, equivalente al 12.8% y 244.3 g/día en Valdivia, equivalente al 14.3% de la dieta; finalmente el grupo vegetales figura en Chillán con 149.2 g/día equivalente al 8.3% y en Valdivia 241.3 g/día correspondientes al 12.7%. De los alimentos con menor consumo están los grupos grasas y aceites, que en la ciudad de Chillán se observan 16.4 g/día (0.9% de la dieta) y en Valdivia 15.7 g/día (0.8% de la dieta), el grupo aliños en Chillán muestra 17.8 g/día (0.9% de la dieta) y en Valdivia 24.0 g/día (1.3% de la dieta) y el grupo huevos en Chillán con 28.8 g/día (1.6% de la dieta) y 13,1 g/día (0,7% de la dieta) en Valdivia. Otro grupo de menor consumo pertinente de mencionar es el de pescados y mariscos, 26.7 g/día (1.5% de la dieta) en Chillán y 18.6 g/día en Valdivia (1% de la dieta), a este grupo se asocian altos contenidos de metales pesados (GIL et al., 2006; CAMPBELL et al., 2008; CASTRO y MÉNDEZ, 2008; DOREA, 2008; y RUELAS et al., 2008). 46 FIGURA 5 Grupos de alimentos consumidos por los habitantes de Chillán y Valdivia. Estos mismos datos de consumo, de las dos poblaciones en estudio, se representaron a través de su diferencia (ver FIGURA 6), en donde es posible observar a simple vista las diferencias entre el consumo de los grupos de alimentos en las ciudades de Chillán y Valdivia. Se evidencia el amplio margen de preferencia de consumo para las verduras, papas y leche en la población valdiviana, en cambio en la ciudad de Chillán los azúcares, los huevos y las bebidas no alcohólicas son los alimentos predominantes; sin embargo, no con un margen tanto más amplio de consumo. Así mismo, se observa que el grupo de grasas y aceites y derivados cárnicos no presentan grandes diferencias lo que evidencia que el consumo es muy similar tanto en Chillán como en Valdivia. 47 FIGURA 6 Diferencia de consumo de los grupos de alimentos en los habitantes de Chillán y Valdivia. Asi mismo, los mismos datos de consumo en ambas poblaciones, son representados a través de un gráfico de espina de pescado (ver FIGURA 7), en donde se observa que el consumo de ciertos grupos no difiere mayormente entre sí, y se representa claramente los grupos con mayor consumo en ambas poblaciones como el de bebidas no alcohólicas, pan y verduras, y los de menor consumo en ambas ciudades como aliños, frutas y huevos. 48 FIGURA 5 Comparación de consumo en las poblaciones de Valdivia y Chillán. A continuación se compara el presente estudio de Dieta Total con el realizado previamente en la ciudad de Santiago (MUÑOZ et al., 2005). En la FIGURA 8 se observa que el estudio de Dieta Total realizado en Santiago en el año 2005, presenta valores un tanto diferentes para algunos grupos de alimentos a los obtenidos en los estudios realizados en Chillán y Valdivia, pero para otros grupos de alimentos los valores son muy similares. Por ejemplo el grupo pan, el consumo en Santiago es 242.7 g/día y 256.1 g/día en Chillán y en Valdivia 244.3 g/día, así mismo para el grupo de las papas 137.5 g/día para Santiago y 91.1 g/día para Chillán y 129.0 g/día Valdivia. En cuanto al grupo de mayor consumo para esta investigación, que es de las bebidas no alcohólicas, la cual tuvo un aumento significativo de 1,6 veces más de lo registrado en 49 el estudio realizado en Santiago 2005, con valores de 539.6 g/día para Valdivia, 553.1 g/día en Chillán y 329,8 g/día para Santiago. FIGURA 6 Comparación de alimentos consumidos, por grupo, por las poblaciones de Chillán, Valdivia y Santiago. En cuanto al consumo de pescados y mariscos es bajo, tanto en las ciudades de Chillán y Valdivia, como en la ciudad de Santiago, considerando que este alimento es una fuente importante de ácidos grasos insaturados en especial omega 3. También se puede agregar que el consumo en Santiago (33.1 g/día) y Chillán (26.7 g/día) es mayor que en la cuidad de Valdivia (18,6 g/día). 50 4.2 Estudios de Dieta Total en Chile y otros países del mundo En la FIGURA 9 se muestra una compración del consumo de alimentos en 4 países del mundo, dentro de los cuales está: España realizada en 1991 (URIETA et al., 1991). Gran Bretaña realizada en 1997 (YSART et al., 2000), Japón llevada a cabo en el año 2003 (SAMAMOTO et al., 2005) y Chile, ciudad de Santiago, realizada en los años 2005 (MUÑOZ et al., 2005), Chillán (Chile), en el año 2009 (PEREZ, 2009) y en el 2008, en la ciudad de Valdivia, Chile (FLORES, 2008). FIGURA 7 Comparación consumo de alimentos de Chile y países del mundo 51 Hacer comparaciones con estudios similares hechos en otros países no es fácil. Debido a lo avanzado que está este tema a nivel internacional, muchos de los Estudios de Dieta Total, a diferencia de Chile, se hacen por segmentos de la población, separándola por edades y sexo, por lo que las comparaciones que a continuación se muestran están hechas con la dieta promedio entre mujeres y hombres adultos de los estudios referidos. Sin embargo, los estudios realizados en distintas partes del mundo permiten saber las realidades existentes entre los países. En este sentido, se puede observar que el consumo de alimentos o las preferencias por algún determinado alimento, es lo que marca la diferencia alimentaria entre uno y otro país, por ejemplo la FIGURA 9 muestra que Japón tiene gran preferencia por las bebidas no alcohólicas (600 g/día), cereales (239.5 g/día), vegetales (157.0 g/día) y leche (143.1 g/día); este país al ser comparado con los estudios realizados en Chile presenta consumos similares a sus grupos de preferencia, Chile promedia un consumo de 474.1 g/día en bebidas no alcohólicas, 239.2 g/día en el grupo de vegetales y 124.8 g/día de leche. Sin embargo, la gran diferencia se observa en el grupo pan, en donde Japón presenta 16 g/día siendo uno de los grupos de menor consumo y Chile promedia de 247,7 g/día, siendo uno de los grupos de mayor consumo. Respecto al consumo de pescados y mariscos, Japón tiene un valor de 79 g/día, bastante mayor al que presenta Chile (26.1 g/día promedio). Al comparar a Chile con España, se observa que los españoles tienden a consumir en mayor proporción las frutas (377.0 g/día, valor 3.5 veces mayor que el de Chile), la leche es otro alimento altamente consumido en España (293.7 g/día), dos veces más que en Chile, también destaca como un grupo de gran consumo en España las bebidas alcohólicas (243.1 g/día) sin embargo, Chile presenta un valor promedio 4.5 veces menor (4.5 g/día). Respecto al consumo de pescados y mariscos, España tiene un valor de 89.3 g/día, bastante mayor al que presenta Chile (26.1 g/día promedio). En cuanto a la dieta de los ingleses, ésta se basa en la leche (284.0 g/día), consumo 1.6 veces mayor que el de Chile, otro alimento que destaca su consumo son las papas (133.2 g/día), consumo muy similar al del país (119.2 g/día promedio). Respecto al consumo de pescados mariscos, Gran Bretaña consume 13 g/día, 2.5 veces menos que Chile (26.1 g/día promedio). 52 Por otra parte, Las concentraciones de arsénico total, las cuales se observan en el ANEXO 4 y en la FIGURA 10, muestran que la mínima concentración de arsénico total en la ciudad de Chillán la presentan los grupos de derivados lácteos, frutas y el de leguminosas y nueces con 0.004 µg/g, y el mayor contenido se observa en el grupo de pescados y mariscos con 1.554 µg/g. En la ciudad de Valdivia se observa que el grupo papas presenta la menor concentración con 0.0118 µg/g. y, al igual que en la ciudad de Chillán, el grupo de pescados y mariscos presenta la mayor concentración con 1.8445 µg/g. De acuerdo a los resultados anteriormente expuestos, el grupo de pescados y mariscos, sobrepasa el límite establecido por el Reglamento Sanitario de los Alimentos (RSA) (CHILE, MINSTERIO DE SALUD, 2010) que establece un límite máximo para pescados frescos, enfriados, congelados y en conserva de 1 µg/g. y para moluscos, crustáceos y gastrópodos indica 2 µg/g (arsénico inorgánico) como límite máximo. El hecho de que se encuentren algunos valores sobre los establecidos por el RSA, no es necesariamente perjudicial para la salud de los consumidores de estos productos, ya que la toxicidad del arsénico depende de su estado químico, por lo tanto al ser arsénico total éste puede ser tanto arsénico inorgánico, que es el más dañino, y cuyas especies poseen una Dosis Letal (DL50) cercana a 4.5 µg/g. o arsénico orgánico con una DL50 superior a 890 µg/g. Las especies inorgánicas de arsénico As (III) y As (V) son consideradas las formas más tóxicas. La dosis letal media (DL50) para As (III) es de 34,5 mg kg-1 peso corporal y de 41 mg kg-1 peso corporal para As (V). El ión tetrametilarsonio uno de las especies altamente metiladas presenta una letalidad considerable DL 50 890 mg kg-1 peso corporal un tanto más tóxico que el MMA DL 50 1800 mg kg-1 peso corporal y el DMA DL50 1200 mg kg-1 peso corporal, este último a sido demostrado que es cancerígeno en ratas. (MUÑOZ et al., 1999) Cabe destacar que el límite establecido por el RSA es de 1 µg/g. como arsénico total que corresponde solo a pescados frescos, congelados y conservas, en cambio para mariscos y crustáceos es de 2 µg/g. expresado como arsénico inorgánico, por lo tanto no se tendría una información específica acerca de la concentración máxima que 53 podrían contener los mariscos de arsénico total, lo cual no permite establecer un resultado que asegure la inocuidad del alimento. Si bien es cierto, se ha dicho que los compuestos arseniacales inorgánicos son los más tóxicos, estudios recientes muestran que también existen compuestos organoarseniacales trivalentes (MMA) que han sido reevaluados mostrando una alta toxicidad, incluso mayor a los compuestos inorgánicos de As (III) y As (V) (SUN et al., 2007; HUGHES, 2002), pero todavía se consideran en general a los compuestos inorgánicos de arsénico más tóxicos. FIGURA 8 Concentraciones de arsénico total en los distintos grupos de alimentos en las poblaciones de Chillán y Valdivia 54 Otros estudios han informado la presencia de concentraciones altas de arsénico total tanto en pescados como en mariscos, como es el caso de España, donde las concentraciones encontradas en Cataluña fueron de 3.633 µg/g. (URIETA et al., 1996), en España de 2.210 µg/g. (LLOBET et al., 2003); en el Reino Unido de 4.3 µg/g. (YSART et al., 1999) y en Canadá de 1.662 µg/g. (DABEKA et al., 1993). En el caso particular de Chile, en el estudio realizado por MUÑOZ et al. (2005), se encontró una concentración en promedio de 1.351 µg/g., siendo los productos marinos el grupo de alimentos con el mayor contenido de As total, por lo tanto es importante realizar estudios más en profundidad acerca de este tipo de alimentos ya que pueden presentar un riesgo para la salud al estar contaminados con este metaloide. 4.3 Concentraciones de arsénico inorgánico Las concentraciones de arsénico inorgánico, las cuales se observan en el ANEXO 5 y en la FIGURA 11, muestran que la mínima concentración de arsénico inorgánico en la ciudad de Chillán la presentan los grupos de huevos y verduras, ambos con un valor de 0.002 µg/g., y las mayores concentraciones se observan en los grupos de aliños con 0.043 µg/g., y en el grupo de pescados y mariscos con 0.046 µg/g. Por otra parte, en la ciudad de Valdivia, las frutas presentan la menor concentración con 0.006 µg/g., y el mayor valor se registra en el grupo de productos marinos con 0.043 µg/g., valor muy similar a Chillán. Si bien es cierto, el RSA (CHILE, MINISTERIO DE SALUD, 2010) establece concentraciones de arsénico inorgánico sólo para crustáceos y moluscos (2 µg/g), se debe especificar que todas las concentraciones están por debajo de lo establecido. La normativa chilena debería homogeneizar los límites máximos bajo la forma de arsénico inorgánico, ya que es la más tóxica, como se ha señalado anteriormente. La gran diferencia que existe entre las concentración de arsénico tanto total como inorgánico del grupo pescados y mariscos con respecto al resto de los grupos de alimentos, se puede explicar debido a la fisiología de los mariscos, la que les permite una mayor capacidad de retención de partículas en su organismo, lo que explicaría las altas concentraciones de este metaloide en este tipo de productos (PRENDEZ, 1994 Y MATA, 1995). 55 FIGURA 9 Concentración de arsénico inorgánico en los distintos grupos de alimentos en las poblaciones de Chillán y Valdivia 4.4 Estimación de la ingesta de arsénico La estimación de la ingesta de arsénico se llevó a cabo una vez recopilados los datos de concentración y consumo del mismo en ambas ciudades. A continuación se describe el cálculo realizado para determinar la ingesta tanto de arsénico total como inorgánico: Ingesta (µg/día) = Concentración (µg/g de alimento) * Consumo (g/persona/día) Ejemplo determinación de ingesta de arsénico total en el grupo de aliños de la ciudad de Valdivia: Ingesta As-t aliños (µg / día) = 0.55 µg/g de alimento * 17.8 g/persona/día Ingesta As-t aliños = 9.79 µg / día. 56 Según el ANEXO 6, representado por la FIGURA 12, se observa claramente que el grupo de pescados y mariscos se diferencia de los demás grupos de alimentos en lo que a ingesta de arsénico total se refiere, con 34.31 μg/día en Chillán y en Valdivia con 47.01 μg/día. Una ingesta menor a los pescados y mariscos, se presentan los cereales (Chillán: 5.43 μg/día y Valdivia: 4.28 μg/día), el grupo pan (Chillán: 4.51 μg/día y Valdivia: 5.48 μg/día) y el grupo de bebidas no alcohólicas (Chillán: 0.45 μg/día y Valdivia: 0.84 μg/día). Sin embargo, se debe enfatizar que la FIGURA 12 hace referencia sobre valores de arsénico total, del cual solo una fracción corresponde a su forma inorgánica que es la más tóxica y para la cual está definida la ISTP (15 μg/kg peso corporal/semana). El valor de ingesta de arsénico total en las poblaciones (62.62 μg/día en Chillán y 72.99 μg/día en Valdivia) representan la ingesta del metaloide a través de la dieta total de cada ciudad, por lo que se debería recurrir a una especiación para poder conocer la concentración tanto de las especies orgánicas e inorgánicas. FIGURA 10 Ingesta de arsénico total (μg/persona/día) en las ciudades de Chillán y Valdivia, para cada grupo de alimento. 57 El valor recomendado por la FAO/OMS (1993) de 15 μg/kg peso corporal/semana (ISTP) se traduce en 2.14 μg/kg peso corporal/día (IDTP) de ingesta de arsénico inorgánico y en consideración a un adulto de peso promedio 64.6 kg. se obtiene 136 μg/persona/día. Para arsénico total existen límites establecidos por el RSA solo para pescados frescos, congelados y conservas, para mariscos y crustáceos el límite está expresado como arsénico inorgánico, lo que deja un vacío en lo que respecta a los límites de arsénico inorgánico en pescados, considerada la forma química considerada más tóxica. A continuación se presenta la FIGURA 13, que representa los valores de ingesta de arsénico inorgánico por grupo de alimento de las poblaciones de Chillán y Valdivia (ver ANEXO 7). FIGURA 11 Ingesta de arsénico inorgánico (μg/persona/día) en las ciudades de Chillán y Valdivia, para cada grupo de alimento. 58 Tanto Chillán como Valdivia coinciden en los alimentos que representan la mayor ingesta de arsénico inorgánico, los que corresponden a bebidas no alcohólicas, pan y cereales. En Chillán, las bebidas no alcohólicas evidencian un 21.0% de ingesta de Asi y en Valdivia, un 20%. El pan presenta un 27.3% de ingesta de As-i en la ciudad de Chillán y en Valdivia un 15.7%. El grupo de los cereales en la población de Chillán representa un 8.4% de ingesta de As-i y un 9.4% en Valdivia. La situación del grupo pescados y mariscos, en Chillán y Valdivia presentan un 8.2% y 4.0% respectivamente de ingesta de la forma inorgánica. La ingesta total de arsénico inorgánico en la dieta de la población de Chillán corresponde a 15.12 μg/kg peso corporal/día, en Valdivia resulta ser 1.3 veces mayor con 20.22 μg/kg peso corporal/día, pero ambas poblaciones se encuentran bajo las recomendaciones del comité FAO/OMS (136 μg/kg peso corporal/día). En la Comunidad Autónoma del país Vasco (CAPV) la ingesta media de arsénico total a través de la dieta en el periodo de 1990-1995 ha sido de 297 µg/día (entre 255 y 345 µg/día). Esta ingesta es muy elevada, mucho mayor que la de todos los estudios consultados incluso Japón (280 µg/día). En este caso el hecho de tener ingestas más elevadas se relaciona con diferencias en el consumo de pescado puesto que casi todo el arsénico de la dieta procede de este grupo, los resultados indicaron que un 84-100% del arsénico presente en las muestras de productos pesqueros, estaba en forma de arsenobetaina y que el arsénico inorgánico detectado no alcanzaba el 5% (JALÓN, 2006; CARRIÓN, 2009; MUÑOZ et al., 2005; OMS, 2011; YSART et al., 1999). A pesar de que la ingesta de arsénico total es elevada, la exposición a este elemento no parece presentar un riesgo apreciable para la salud puesto que mayoritariamente se trata de arsénico orgánico. En general las ingestas de arsénico total resultaron mínimas al compararlas directamente con los valores de referencia para el arsénico inorgánico, por lo cual no existe riesgo derivado de la ingesta de este elemento para ninguna de las ciudades estudiadas. 59 4.5 Concentración de mercurio en las poblaciones de Chillán y Valdivia La estimación de la ingesta de mercurio se llevó a cabo luego de recopilar los resultados analíticos del contenido de mercurio encontrado en cada grupo de alimento analizado. En el ANEXO 8 se muestran los niveles de mercurio de cada grupo de alimentos. A continuación la FIGURA 14, grafica la concentración de mercurio en los alimento consumidos por las dos poblaciones. FIGURA 12 Concentración de mercurio en los distintos grupos de alimentos en las poblaciones de Chillán y Valdivia. Al interpretar los resultados de la concentración en los distintos grupos de alimentos de la Dieta Total, se aprecia que la mayor concentración o niveles de mercurio en ambas ciudades se encuentra en el grupo de pescados y mariscos, siendo muy similares 60 (Chillán con 0.022 µg/g y Valdivia con 0.026 ug/g) y resultan ser cifras bastante alejadas de los demás grupos que componen la dieta en ambas poblaciones. La población de Chillán muestra en los grupos de azúcares y aliños concentraciones de Hg notoriamente diferenciadas mostrando 0.02 µg/g en los azúcares y 0.018 µg/g en aliños, sin embargo, estos mismos grupos la población valdiviana presenta concentraciones menores 0.005 µg/g en aliños y 0.003 µg/g en azúcares. En el grupo de cereales, ambas poblaciones muestran concentraciónes de Hg similares, 0.007 ug/g para Chillán y 0.009 ug/g para Valdivia. Los resultados obtenidos son muy similares a los del Estudio de Dieta Total realizado en el año 2005 en Santiago por Muñoz et al., (2005), en donde el grupo que más aporta contenidos de mercurio a la dieta es el de pescados y mariscos (0.048 ug/g) y un segundo lugar para el grupo de cereales (0.008 ug/g) de la misma manera que en este estudio. No obstante en el estudio realizado en la Región Metropolitana la concentración para pescados y mariscos fue de 0.048 ug/g, mientras tanto la realizada en Chillán y Valdivia informa una concentración promedio de 0.024 ug/g para el mismo, siendo casi el doble en la ciudad de Santiago de Chile. No ocurre así lo mismo para los cereales ya que en Santiago el valor registrado fue de 0.008 ug/kg y en las ciudades de Chillán y Valdivia se presenta un promedio de 0.008 ug/g siendo prácticamente iguales. Hay que destacar que si bien el grupo de pescados y mariscos son los que mayor aportan a la dieta, el valor no sobrepasa el límite máximo permitido en Reglamento Sanitario de los Alimentos. Entre los grupos con menor concentración de mercurio están los vegetales con 0.005 ug/g y 0.001 ug/g para Chillán y Valdivia, respectivamente; también está el grupo de bebidas alcohólicas con 0.003 y 0.001 ug/g para Chillán y Valdivia, respectivamente; además del grupo de frutas con 0.004 y 0.003 ug/g para Chillán y Valdivia respectivamente. 4.6 Estimación de la ingesta de mercurio La estimación de la ingesta de mercurio se llevó a cabo luego de conocer los resultados analíticos del contenido de mercurio encontrado en cada grupo de alimento. A continuación se describe el cálculo realizado para determinar la ingesta de mercurio: 61 Ingesta (µg/día) = Concentración (µg/g de alimento) * Consumo (g/persona/día) Ejemplo determinación de ingesta de mercurio en el grupo de aliños de la ciudad de Valdivia: Ingesta Hg Aliños (µg / día) = 0.005 µg/g de alimento * 17.8 g/persona/día Ingesta Hg Aliños = 0.089 µg/persona/día. En el ANEXO 9 se muestra la ingesta de mercurio de cada grupo de alimentos, para ambas ciudades. Estos valores son representados en la FIGURA 15. FIGURA 13 Ingesta de mercurio (μg/persona/día) en las ciudades de Chillán y Valdivia, para cada grupo de alimento. 62 El valor toxicológico de referencia utilizado en este estudio fue el ISTP (Ingesta Semanal Tolerable Provisional), parámetro recomendado por el Comité Experto sobre Aditivos de Alimentos de la FAO/OMS. El ISTP para mercurio, fue fijado en 1972 por la misma organización, el que recomendó que este metal pesado no debía ser ingerido por sobre los 340 μg/semana, de los cuales no más de 224,4 μg/semana deben ser metilmercurio (FAO/OMS, 2008), donde todos los valores anteriores han sido calculados para una persona de 68 kilos, peso promedio de los participantes de la encuesta alimentaria. En 1988, el Comité determinó el ISTP recomendado anteriormente de mercurio y metilmercurio para la población general. Dado que la información recopilada en las encuestas comprende 24 horas, el ISTP se ha derivado a IDTP (Ingesta Diaria Tolerable Provisional), término que equivale a ISTP/7 días. La ingesta diaria de mercurio que aporta el grupo pescados y mariscos fue de 0,5 μg/día en la ciudad de Chillán y 0.4 μg/día en Valdivia (aproximadamente 6.2 % en promedio de la ingesta total de mercurio para ambas ciudades), siendo estos alimentos la fuente más importante de mercurio en la dieta. Sin embargo, debido al bajo consumo de este grupo que existe en las dos ciudades en estudio y pese que es el grupo con mayor contenido de mercurio, los valores de ingesta son bajos. En ambas ciudades, la mayor ingesta diaria de mercurio se le atribuye al grupo de las bebidas no alcohólicas con un valor de 3.72 y 1.13 μg/día (corresponde al 24.6% y 19.6% de la ingesta total de mercurio) para Chillán y Valdivia respectivamente, lo que tiene explicación debido al elevado consumo de este grupo de alimentos, marcando inclusive una diferencia muy significativa para los demás grupos. También se presenta el grupo pan con una ingesta de 2.44 ug/día correspondiente al 16.17% en Chillán y 0.98 ug/día correspondiente al 17.01% de la ingesta total de mercurio, en la ciudad de Valdivia. En ambas ciudades, la menor ingesta diaria de mercurio la tienen los grupos de grasas y aceites y huevos, con valores para el primer grupo de 0.10 μg/día y 0.02 μg/día (equivalente a 0.34% y 0.68 % de la ingesta total de mercurio) para Chillán y Valdivia respectivamente. En el grupo huevos los valores responden a 0.16 y 0.03 μg/día (representando un 1.05% y 0.52% de la ingesta total de mercurio) para Chillán y Valdivia. 63 Cabe mencionar que, en Chillán, los grupos se encuentran entre los valores de ingesta de mercurio de 0,1 y 3.7 μg/día y Valdivia muestra valores entre 0.02 y 1.13 μg/día; esta situación es importante al momento de evaluar la seguridad toxicológica de un alimento, debido a que el mercurio, es el metal pesado que presenta el mayor riesgo para la salud, aún en pequeñas concentraciones. Sin embargo, los resultados obtenidos se encuentran por debajo de los considerados perjudiciales, según FAO/OMS, para el ser humano. Por ello, se hace necesario realizar una continua evaluación de los contaminantes en los alimentos, para asegurarnos de no sobrepasar los niveles considerados como seguros por la FAO/OMS (ISTP). 4.7 Comparación de la ingesta de mercurio en distintos países Según la información recopilada por el siguiente estudio, Chile presenta una ingesta diaria de mercurio baja con respecto a los países que han realizado estos estudios de dieta total, resultado alentador dado que este metal pesado es uno de los más tóxicos existentes en la naturaleza. De todas maneras, se observa la necesidad de dictar directrices en ese sentido, con el fin de mantener los niveles actuales o disminuirlos aún más. Realizando un promedio de ingesta de mercurio, considerando ambas ciudades estudiadas (10.44 μg/día), a través de la dieta total chilena es similar a la de algunos países estudiados como Guatemala (10,8 μg/día), China (10,3 μg/día) y Japón (10,0 μg/día) y España (19,0 μg/día); sin embargo, se observa un aumento en referencia al estudio realizado por MUÑOZ et al., (2005), en Santiago de Chile, en donde la ingesta obtenida fue de 5,0 ug/día. También existen países tales como Suecia con una ingesta de 1,8 ug/día, República Checa 0,7 ug/día, Reino Unido 3,0 y 5,0 ug/día y Nueva Zelanda 4, ug/día. Estos países representan una ingesta menor a la obtenida por Chile, siendo la República Checa (0,7 ug/día) el país con la menor ingesta de mercurio, (JALÓN, 2006). Un estudio de Dieta Total realizado en Korea, arroja un valor de ingesta de 1,61 ug/día; un valor bastante bajo, por ende satisfactorio para la población. Las mayores concentraciones de mercurio fueron encontradas en el grupo de pescados, sin 64 embargo, no tiene mayor importancia, debido a que el consumo de este grupo de alimentos es muy bajo, lo que más contribuye a la ingesta es el consumo de arroz por la población coreana (LEE et al., 2010). Por lo tanto, la ingesta depende tanto de la concentración de mercurio contenida en los grupos de alimentos como del consumo de grupos de alimentos que aporta con la concentración de mercurio. Otro Estudio de Dieta Total realizado en Cataluña, España en la cual se estimó la ingesta de mercurio, abarcando a niños, adolescentes, hombres y mujeres adultos, y personas de la tercera edad, dio como resultado que la mayor ingesta de mercurio la presentaba la población masculina adulta, con 21,2 ug/día (LLOBET et al., 2003). El promedio de la ingesta considerando a los cinco grupos etáreos es de 18,0 ug/día, valor que dobla a Chile; sin embargo, el valor no representa riesgos para la población. En China, un estudio realizado en cuatro localidades diferentes arrojó un ingesta de 8,86 ug/día (LI et al., 2006). Siendo los principales grupos de alimentos que aportan en la ingesta de mercurio los cereales, las verduras y los alimentos del mar. Pero los resultados muestran que la ingesta de mercurio en China es segura y que está lejos de presentar algún daño a la salud. El valor de la ingesta de mercurio obtenido en este estudio es de 10.44 ug/día promedio considerando ambas ciudades (Chillan y Valdivia), como se ha mencionado anteriormente, el cual a su vez representa el 21.3% de la IDTP, por lo cual, la ingesta de Hg no representa mayores peligros de contaminación por mercurio en las poblaciones estudiadas. Sin embargo, es importante que la población chilena siga siendo monitoreada, para mantener de esta forma un control sobre éste compuesto metálico. Si se considerara que si todo el mercurio encontrado fuera metilmercurio, la ingesta aportada por los grupos constituyentes de la dieta representaría un 22.63% de la IDTP, con lo cual se puede afirmar que la población no tiene peligros asociados a este. 65 4.8 Análisis comparativo de correlaciones, en el estudio de Dieta Total de la población de Chillán y Valdivia A continuación se presenta la FIGURA 16 en donde se observa la correlación lineal ascendente positiva entre el consumo de los distintos grupos de alimentos de las poblaciones de Chillán y Valdivia, lo que implica que ambas poblaciones tienen un comportamiento similar referente a sus hábitos de consumo. FIGURA 14 Comparación de consumo en las poblaciones de Chillán y Valdivia. La FIGURA 17 muestra una correlación lineal positiva, el punto ubicado en la parte superior de la recta indica que la mayor concentración de arsénico total se encuentra en el grupo de pescados y mariscos tanto en Chillán como en Valdivia. Por otra parte, en el extremo inferior de la recta se ubican los demás grupos de alimentos agrupados dado su baja y similar concentración de arsénico total. 66 La pendiente de la gráfica señala un coeficiente cercano a 1, lo que permite afirmar que no existen mayores diferencias en las concentraciones de arsénico total en los diferentes grupos de alimentos tanto en Chillán como en Valdivia, considerando que cada punto corresponde al valor medio ± DS. FIGURA 15 Comparación de concentración de arsénico total entre Chillán y Valdivia Lo mismo se observa en la FIGURA 18, en donde se compara la ingesta de arsénico total de ambas poblaciones, cuyos datos también presentan una correlación positiva entre cada punto (valor medio ± DS) y la mayor ingesta la presenta el grupo de pescados y mariscos. En esta gráfica se observa una relación lineal significativa entre las ingestas de arsénico total de ambas ciudades, también así lo confirma el valor del coeficiente de correlación igual a 0.9435, de donde se deduce que existe una fuerte relación lineal 67 positiva entre la ingesta de arsénico en Chillán y la ingesta de arsénico en Valdivia, reflejando que no hay mayores diferencias de los contenidos entre ambas poblaciones. El mayor contribuyente a la ingesta total fue el grupo “pescados y mariscos” con valores de 41.46 [g/per/día] en Chillán y 34.31 [g/per/día] en Valdivia, lo que corresponde a un 26 % y 25 % de la ingesta dietaria total, respectivamente. Sin embargo, se debe hacer notar que las concentraciones de As y la correspondiente ingesta es para As total del cual sólo una fracción corresponde a su forma inorgánica, que es la más tóxica (YSART et al, 1999). 50 y= 1.1739x - 1.3566 R2= 0.9435 Chillán Ingesta As T (µg/dia) 40 30 20 10 0 -10 0 10 20 30 40 Valdivia Ingesta As T (µg/dia) FIGURA 16 Comparación de ingestas de arsénico total entre Chillán y Valdivia. El mismo análisis se realiza para la concentración de arsénico inorgánico, donde se muestra en la FIGURA 19 una correlación un poco menor entre cada punto (valor medio ± DS) con una mayor dispersión de datos de acuerdo a los bajos contenidos de arsénico inorgánico presente en los distintos grupos de alimentos, reflejando que no 68 existen mayores diferencias en los contenidos; sin embargo, destacan en ambas poblaciones el grupo de pescados y mariscos y el grupo de aliños. FIGURA 17 Comparación de concentración de arsénico inorgánico entre Chillán y Valdivia. Para determinar si existe riesgo para la salud de la población, se debe considerar la ingesta y no la concentración. Para ello, se comparó también la ingesta de arsénico inorgánico en ambas poblaciones, indicando que las mayores ingestas de arsénico inorgánico se logran a través de los productos marinos y los aliños, en ambas poblaciones (ver FIGURA 20). 69 FIGURA 18 Comparación de ingestas de arsénico inorgánico entre Chillán y Valdivia El bajo coeficiente de regresión refleja que las ingestas de As I son más dispersas, sin embargo la gráfica nos permite visualizar el solapamiento de los valores de ingesta en todos los grupos a excepción de los grupos Pan y Bebidas no alcohólicas, por lo que se puede afirmar que sólo para este grupo existen diferencias significativas en cuanto a este parámetro. Para el consumo de mercurio se realiza la misma comparación, en donde la FIGURA 21 refleja una mayor dispersión de los datos entre cada punto (valor medio ± DS) con concentraciones del metal muy similares, esto resulta interesante al momento de realizar la comparación dado que durante el estudio se buscó la mayor dispersión posible en las muestras para lograr una mayor representatividad de los datos, destacan las bebidas no alcohólicas y el pan con la mayor concentración en mercurio, cuyos 70 valores están relacionados al consumo superior de estos grupos de alimentos en ambas poblaciones. FIGURA 19 Comparación de concentración de mercurio entre Chillán y Valdivia. La FIGURA 22 presenta la comparación entre la ingesta de mercurio de Chillán y la ingesta de mercurio en Valdivia, y evidencia la gran dispersión de los datos entre cada punto (valor medio ± DS) con una baja correlación, reflejando los diferentes niveles en las ingestas de mercurio de todos los grupos de alimentos en ambas ciudades; sin embargo, el grupo de bebidas no alcohólicas y el grupo pan representan una mayor ingesta del metal tato en Chillán como en Valdivia, lo que también se asocia a su alto consumo en ambas ciudades. 71 FIGURA 20 Comparación de ingesta de mercurio entre Chillán y Valdivia. 72 5 CONCLUSIONES De los resultados expuestos en esta investigación, se puede concluir que: En ambas poblaciones corresponden a bebidas no alcohólicas (equivalente a 30.9% y 28.36% respectivamente de la dieta total), pan (equivalente a 14.3% y 12.84% respectivamente de la dieta total) y vegetales (equivalente a 8.3% y 12.68% respectivamente de la dieta total). Al ser valores muy similares en ambas ciudades la hipótesis se acepta. En ambas poblaciones, pescados y mariscos son los que presentan los mayores niveles de arsénico total; sin embargo, la concentración de arsénico inorgánico es baja, por lo tanto su consumo no resulta riesgoso para la salud. El grupo que más contribuye a la ingesta de mercurio fueron el de bebidas no alcohólicas (1.13 ug/día en Valdivia y 3.72 ug/día en Chillán) seguida por el grupo pan (0,98 ug/día en Valdivia y 2.44 ug/día en Chillán). La ingesta de arsénico inorgánico, a través de la Dieta Total de los habitantes de Chillán, representa el 10.4% del ISTP para arsénico inorgánico. En la ciudad de Valdivia, ésta representa el 13.9% del ISTP para arsénico inorgánico; por lo tanto la ingesta de arsénico total y arsénico inorgánico proveniente del consumo de alimento no representa riesgo para la salud de los habitantes de Chillán y Valdivia. La ingesta de mercurio, a través de la Dieta Total de los habitantes de Chillán representa el 31.1% del ISTP. En la ciudad de Valdivia, ésta representa el 11.8% del ISTP; por lo que la ingesta proveniente del consumo de alimentos no representa riesgo para la salud. 73 BIBLIOGRAFÍA ACADEMIA NACIONAL DE MEDICINA. 2006. Seminario internacional sobre clínica del mercurio. Memorias. Academia Nacional de Medicina. 206p. ARAYA, M y ORELLANA, C. 2002. Estudio de dieta total en la Región Metropolitana: Determinación de la exposición e ingesta de contaminantes químicos (arsénico y plomo) a través de los alimentos. Memoria de título Ing. en Alimentos. Santiago, Chile. Universidad de Santiago de Chile, Departamento de Ciencia y Tecnología de los Alimentos. 135p. ALBERT, P. 2001. Centro Panamericano de Ecología Humana y Salud. Organización Panamericana de la Salud. 310 p. ALFONSO, R.; ESCUTIA, B. y CARNERO, L. 2006. Trastornos cutáneos inducidos por el mercurio. Piel (On line) 21 (02): 86-91. <http://www.elsevier.es/es/revistas/piel-21/trastornos-cutaneos-inducidosmercurio-13084570-la-piel-practica-diaria-2006> (05 may. 2011). ALLEVA, E.; FRANCIA, N.; PANDOLFI, M.; DE MARINIS A.; CHIAROTTI, F. y SANTUCCI, D. 2006. Organochlorine and heavy metal contaminants in wild mammals and birds of Urbino-Pesaro Province, Italy: An analytic overview for potential bioindicators. Achives of Environmental Contamination and Toxicology. 51: 123–134. AGENCY FOR TOXIC SUBSTANCES AND DISEASE REGISTRY (ATSDR). 2007. Arsénico. Resúmen de Salud Pública. (On line). < http://www.atsdr.cdc.gov/es/phs/es_phs2.html> (14 jul.2011). ASTOLFI, E.; BESUSCHINO, S.; GARCÍA, J.; GUERRA, C. Y MACCAGNO, A. 1982. Hidroarsenicismo crónico regional endémico. Buenos Aires: Talleres Gráficos de la Cooperativa Gral Belgrano.144p. 74 BASTIAS, J.; BERMÚDEZ, M.; CARRASCO, J.; ESPINOZA, O.; MUÑOZ, M.; GALOTTO, M. Y MUÑOZ, O. 2010. Determination of Dietary Intake of Total Arsenic, Inorganic Arsenic an Total Mercury in the Chilean School Meal Program. Food Sci Tech Int 16(5): 443-450. BATALLER, S. y BALAGUER, J. 2004. Toxicología clínica. Valencia. Universidad de Valencia. 268p. BENFORD, D. 2000. The Acceptable Daily Intake (IDA). International Life Sciences Institute (ILSI). 38 p. BOUDOU, A. Y RIBEYRE, F. 1997. Aquatic ecotoxicology: from the ecosystem to cellular and the molecular levels. Environ. Sci. 105: 21-35. BOFFETA, P.; SÄLLSTEN, G.; GARCÍA-GÓMEZ, M.; POMPE-KIM, V.; ZARIDZE, D. Y BULBULYAN, M. 2001. Mortality from cardiovascular diseases and exposure to inorganic mercury. Occupational and Environmental Medicine 58: 461-466. BUREAU OF CHEMICAL SAFETY FOOD DIRECTORATE HEALTH PRODUCTS AND FOOD BRANCH. 2007. Human Health Risk Assessment of Mercury in Fish and Health Benefits of Fish Consumption. (On line). Health Canada. < http://intraspec.ca/merc_fish_poisson-eng.pdf> (28 jul. 2011). CABAÑERO, A. 2005. Acumulación-interacción de especies de mercurio y selenio en tejidos animales: desarrollo de nuevas metodologías de análisis. Memoria de título Dr. En Química. Madrid. Universidad Complutense de Madrid, Facultad de Ciencias Químicas. 290p. CAMEAN, A. y REPETTO, M. 2007. Toxicología Alimentaria. España. Díaz de Santos. 705p. CAMPBELL, L.; VERDUNG, P. DIXON, D. y HECKY, R. 2008. Mercurybiomagnification in the food web of Lake Tanganyika (Tanzania, East Africa).Science of the Total Environment. 8 p CARRION, M. 2009. Análisis de la concentración de arsénico en tres alimentos (papas (solanum tuberosum), maíz (zea mays) y leche cruda) producidas en las zonas afectadas por el volcán tungurahua (guanopenipe). Tesis Bioquímico 75 Farmacéutico. Riobamba, Ecuador. Escuela Superior Politécnica de Chimborazo. 136p. CASTRO, M. 2006. Presencia de arsénico en el agua de bebida en América Latina y su efecto en la salud pública. International Congress: Natural Arsenic in Groundwaters of Latin America. City México, México. CASTRO, M. Y MENDEZ, M. 2008. Heavy metals: Implications associated to fish consumption. Environmental Toxicology and Pharmacology. 26: 263 – 271.CLARKON, T., VYAS, J. y BALLATORI, N. 2007. Mechanisms of Mercury Disposition in the Body. Am J Ind Med. 50: 757-764. CAUSSY, D.; GOCHFELD, M.; GURZAU, E.; NEAGU, C. Y RUEDEL, H. 2003. Lessons from case studies of metals investigating exposure, bioavailability and risk. Ecotoxicol Environ Safety 56(1): 45-51. CENTRO INTERNACIONAL DE INVESTIGACIONES PARA EL DESARROLLO (CRDI). 1999. La lucha contra la contaminación del mercurio en el Amazonas. (On line). <http://web.idrc.ca/es/ev-5126-201-1-DO_TOPIC.html> (26 jul. 2011). CHILE, CORPORACIÓN NACIONAL DEL MEDIO AMBIENTE, (CONAMA) 2007. Programa Nacional del Manejo Racional del Mercurio en Chile. Consultado 3/09/2007 http://www.conama.cl/portal/1301/articles-39723_recurso_6.pdf. CHILE, MINISTERIO DE SALUD. 2010. Reglamento Sanitario de los Alimentos (On line). < http://www.dinta.cl/docs/reglamentosanitariodelosalimentos.pdf>. (22 dic. 2011). CHILE, INSTITUTO NACIONAL DE ESTADISTICAS (INE) 2002. COULTATE, T. P. 1998. Manual de química y bioquímica de los alimentos. Zaragoza, España. Acribia 366 p. DABEKA, R.; Mc KENZIE, A.; LACROIX, G.; CLEROUX, C.; BOWE, S.; GRAHAM, R.; CONACHER, H. Y VERDIER, P. 1993. Survey of arsenic in total diet food composities and estimation of the dietary intake of arsenic by Canadian adults and children. Journal of AOAC International. 76: 14-25. 76 DASGUPTA, S. ONDERS, R. GUNDERSON, D.T. y MIMS, S. 2004. Methylmercury Concentrations Found in Wild and Farm-raised Paddlefish. Journal of Food Science. 69: 122 – 125. DÍAZ, O.; ENCINA, F.; RECABARREN, E.; DEL VALLE, S.; PASTENE, R.; MONTES, S. Y FIGUEROA, A. 2008. Estudio de la concentración de arsénico, mercurio, plomo y fenantreno en la macha (Mesodesma donacium). Implicancias alimentarias y toxicológicas. Rev. Chil. Nutr 35 (1): 53-60. DÍAZ, O. y GARCÍA, M. 2002. Avances en Toxicología de Contaminantes Químicos en Alimentos. 2ª ed. Chile, Universidad de la Frontera y Programa Iberoamericano de Ciencia y Tecnología para el Desarrollo (eds.). 123p. DOREA, J. 2008. Persistent, bioaccumulative and toxic substances in fish: Human health considerations. Science of the Totalenvironment. 22 p. ESPAÑOL, S. 2001. Toxicología del mercurio. Actuaciones preventivas en sanidad laboral y ambiental. En: Jornada internacional sobre el impacto ambiental del mercurio utilizado por la minería aurífera artesanal en Iberoamerica. Lima, Perú. 26, 27 y 28 de noviembre. 66 p. FERNÁNDEZ, R. 2006. Desarrollo y aplicación de nuevas metodologías analíticas para el estudio del fraccionamiento y movilidad del mercurio en muestras medioambientales. Tesis Doc. En Quím. Anal. Madrid. Universidad Autónoma de Madrid, Departamento de Química Analítica y Análisis Instrumental. 329p. FLAHERTY, C.; SASS, G. y STILES, K. 2003. Human Mercury Toxicity and Ice Angler Fish Consumption: Are people Eating Enough to Cause Health Problems? Risk Analysis. 23: 497 – 504. FLORES, C. 2008. Estudio de Dieta Total. Estimación de la ingesta de Acrilamida en la población Valdiviana. Tesis, Escuela de Ingeniería en Alimentos. Facultad de Ciencias Agrarias. Universidad Austral de Chile. 81 p. FLORES, E.; ALARCÓN, M.; GONZÁLEZ, E. y OLGUÍN, E. (2003). Arsenic tolerating plants from mine sites and hot springs in the semi Arid region of Chihuahua, México. Acta biotechnol 23, 113–119. 77 FOOD AND AGRICULTURE ORGANIZATION OF THE UNITED NATIONS (FAO). 2008. Manual de Inspección de los alimentos basada en el riesgo. Estudio FAO Alimentación y Nutrición Nº89. (On line) < http://www.fao.org/docrep/011/i0096s/i0096s00.htm> (Noviembre 2011). GAJARDO, C. y VIDAL, L. 2009. Evaluación del riesgo toxicológico por arsénico mediante el uso de orina como biomarcador. Memoria de título Ing. De Ejec. En Amb. Santigo. Universidad de Santiago de Chile, Facultad de Ingeniería. 87 p. GALETOVIC, A. y DE FERNICOLA, N. 2003. Arsénico en el agua de bebida: un problema de salud pública. Revista Brasileira de Ciências Farmacéuticas (Sao Paulo) 39 (4): 365-372. GAONA, X. 2004. El mercurio como contaminante global, desarrollo de metodologías para su determinación en suelos contaminados y estrategias para la reducción de su liberación al medio ambiente. Memoria Grado Dr. En Química. Universidad Autónoma de Barcelona, Departamento de Química. 246p. GARCÍA, M.; BOFFETA, P.; CABALLERO, J.; ESPAÑOL, S. y GÓMEZ, J. 2007. Mortalidad por enfermedades cardiovasculares en los mineros de mercurio. Medicina Clínica (On line) 128 (20): 766-771. <http://www.elsevier.es/es/revistas/medicina-clinica-2/mortalidad-enfermedadescardiovasculares-los-mineros-mercurio-13106327-originales-2007> (06 may. 2011). GARCÍA, M.; BOFFETA, P.; CABALLERO, J.; ESPAÑOL, S. y GÓMEZ, J. 2006. Mortalidad por enfermedades genitourinarias en los mineros del mercurio. Actas Urol. Esp. (España) 30(9): 913-920. GEBEL. T. 2001. Genotoxicity of arsenical compounds. Instituted Journal Environmental Health 203 (3): 249-262. GIL, M.; TORRES, A.; HARVEY, M. Y ESTEVES, J. 2006. Heavy metals in marine organisms from the coastal zone of Continental Argentine Patagonia. Biología Marina y Oceanografía 41(2):167–176. GIL, C.; RAMOS-MIRAS, J.; ROCA-PÉREZ, L. y BOLUDA, R. 2010. Determination and assessment of mercury content in calcareous soils. Chemosphere 78:409–415. 78 GRAY, J.; PLUMLEE, G.; MORMAN, S.; HIGUERAS, P.; CROCK, J.; LOWERS, H. y WITTEN, M. 2010. In vitro studies evaluating leaching of mercury from mine waste calcine using simulated human body fluids. Environ. Sci. Technol 44 (12): 4782-4788. HUGHES, M. 2002. Arsenic toxicity and potential mechanisms of action. Toxicol Lett 133: 1-16. HSU, C.; LIU, P.; CHIEN, L.; CHOU, S. Y HAN, B. 2006. Mercury concentration and fish consumption in Taiwanese pregnant women. International Journal of Obstetrics and Gynaecology 114: 81 – 85. INTERNATIONAL AGENCY FOR RESEARCH ON CANCER (IARC). 2004. Monograph on the Evaluation of Carcinogenic Risk to Humans. Some Drinking Water Disinfectant and Contaminants, Including Arsenic. Vol. 84. Lyon, France: International Agency for Research on Cancer. JARA, C. 2007. Elementos base para la gestión ambiental del mercurio en Chile. Memoria de título Ing. Civil Químico. Santiago. Universidad de Chile, Facultad de Ciencias Físicas y Matemáticas. 146p. JALÓN, M.; URIETA, I.; MACHO, ML. y AZPIRI, M. 1997. Vigilancia de la contaminación químic de los alimentos en la Comunidad Autónoma del País Vasco. Vitoria Gasteiz, Servicio Central de publicaciones del Gobbierno vasco. España. JALON, M. 2006. Estimación de la ingesta de nutrientes mediante los estudios de dieta total. Endocrinología y Nutrición (On line) 52 (5): 300-308. <http://www.elsevier.es/en/node/2046205>. (28 abr.2011). LAPARRA, J.M., VÉLEZ, D., MONTORO, R., BARBERÁ, R. y FARRÉ, R. 2004. Bioaccessibility of total As, inorganic arsenic, As (III) and As (V) in raw and cooked H. fusiforme seaweed: Influence of in vitro gastric and intestinal stage. App Organomet Chem 18: 662-669. LAUWERYS, R. 1994. Toxicología industrial e intoxicaciones profesionales. Barcelona. Masson S.A. 631p. 79 LEE KT, S TANABE & C KOH. 2001. Distribution of organochlorine pesticides in sediments from Kyeonggi Bay and nearby areas, Korea. Environmental Pollution 114: 207-213. LITTER, M.; ARMIENTA, M. Y FARIAS, S (eds). 2009. Metodologías analíticas para la determinación y especiación de arsénico en aguas y suelos. Argentina. CYTED. 242p. LLOBET, J. M.; FALCÓ, G.; CASAS, C.; TEIXIDÓ, A. Y DOMINGO, J. L. 2003. Concentrations of Arsenic, Cadmium, Mercury, and Lead in Common Foods and Estimated Daily Intake by Children, Adolescents, Adults, and Seniors of Catalonia, Spain. Agricultural and Food Chemistry. 51: 831-842. LÓPEZ, J. 2006. Determinante del mercurio como contaminante laboral. Memoria de título Doc. En Farmacia. Madrid. Universidad Complutense de Madrid, Facultad de Farm. 459p. MANDAL, B. y SUZUKY, K. 2002. Arsenic round the World: a review. Talanta 58: 201235. MONTEAGUDO, F. 2002. Evaluación de la contaminación por mercurio en población de mineros artesanales de oro de la comunidad de Santa Filomena – Ayacucho – Perú durante el periodo Agosto 2000 – Septiembre 2001. Tesis Quím. Farm. Lima. Universidad Nacional Mayor San Marcos, Facultad de Farmacia y Bioquímica. 78p. MONTERO, V.; QUESADA, J.; LEDEZMA, A. Y SANDOVAL, J. 2010. Determinación de arsénico en abastecimientos de aguia oara consumo humano de la provincia de Catargo, Costa Rica. Acta Médica Costarricense (Costa Rica). 52 (2): 96101. MORALES, J.; FLETA, J.; AYERZA, A.; DE DIEGO, V.; QUEVEDO, E.; YÉCORA, M. Y OLIVARES, J. 2008. Síndrome del Baduino. Anales Pediatría (Barcelona) 68 (5): 486-489. MORGAN, A. 2001. Effects and health effects. (On line). World Health Organization. <http://www.who.int/water_sanitation_health/dwq/arsenicun3.pdf> (12 jul. 2011). 80 MUÑOZ, O.; BASTÍAS, J.M.; ARAYA, M.; MORALES, A.; ORELLANA, C.; REBOLLEDO, R. Y VELEZ, D. 2005. Estimation of the dietary intake of cadmium, lead, mercury, and arsenic by the population of Santiago (Chile) using a Total Diet Study. Food and Chemical Toxicology. 43: 1647-1655. MUÑOZ, O.; DEVESA, V,; SUÑER, M.; VELEZ,V.; MONTORO,R. Y URIETA,I. 2000. Total and inorganic arsenic in fresh and processed fish products). J Agric Food Chem 48: 4369-4376. OLIVERO, J. y JOHNSON B. 2002. El lado gris de la minería del oro: la contaminación con mercurio en el norte de Colombia. Colombia. Editorial universitaria. 123p. ORELLANA, M. 2008. Análisis de arsénico inorgánico, en el agua de bebida consumida por una muestra de la población de Socaire, II región de Chile. Tesis Ing. De Ejecución En Ambiente. Santiago. Universidad de Chile, Departamento de Ingeniería Geográfica. 166p. ORGANIZACIÓN MUNDIAL DE LA SALUD (OMS). 2011. Water-related diseases: arsenicosis. (On line). < http://www.who.int/water_sanitation_health/diseases/arsenicosis/en/> (05 may. 2011). OSORES, F.; GRÁNDEZ, J. y FERNÁNDEZ, J. 2010. Mercury and health in Madre de Dios: un problema de salud pública. Acta Med. Per. (Perú) 27(4): 310-314. OYARZUN, L. 2008. Estudio de Dieta Total: Estimación de la Ingesta de Mercurio en la Población Valdiviana. Tesis Ing. En Alimentos. Valdivia. Universidad Austral de Chile, Facultad de Ciencias Agrarias. 95p. PACYNA, E.; PACYNA, J.; SUNDSETH, K.; MUNTHE, K.; WILSON, S.; STEENHUISEN, F. y MAXSON, P. 2010. Global emission of mercury to the atmosphere from anthropogenic sources in 2005 and projections to 2020. Atmospheric Environment. 44 (20): 2487 – 2499. PAIVA, L. 2007. Estudio de biomonitorización de una población de trabajadores expuestos al arsénico y caracterización de los posibles factores moduladores del daño genotóxico. Memoria para optar al grado de Doc. En Genética. 81 Universidad Autónoma de Barcelona, Departamento de Genética y Microbiología. 321p. PEREZ, M. 2009. Estudio de Dieta Total en la ciudad de Chillán: Desarrollo y Validación de Método Analítico para la Determinación de Ingesta de Acrilamida Generadas por Procesamiento de Alimentos. Tesis Ing. En Alimentos. Chillán. Universidad del Bío Bío, Facultad de Ciencias de la Salud y los Alimentos. 134p. POLO, M. 2009. Análisis de la concentración de arsénico en tres alimentos: papas (Solanum tuberosum), zanahoria (Daucus carota) y leche cruda producidos en las zonas afectadas por el volcán Tungurahua (Mocha-Quero). Tess Bioq. Farmacéutico. Riobamba. Escuela Superior Politécnica de Chimborazo, Facultad de Ciencias. 133p. PRÉNDEZ, M. 1994. Presencia de Metales Pesados en Áreas Urbanas de Chile. En: Impacto Ambiental de Metales Pesados en Chile. VI Simposio sobre Contaminación Ambiental. 19 y 20 de Abril 1994. 30 – 44 pp. PRUNES, L. 1939. Cáncer de los salitreros o enfermedad del salitre. Rev. Argent. Dermatosifilol. (Buenos Aires) 23 (1): 373-385. RONCHETTI, R.; ZUURBIER, M.; JESENAK, M.; AHMED, U.; CECCATELLI, S. Y VILLA, M. 2006. Children’s health and mercury exposure. Acta Pediatrica. 95: 36 – 44. RUBIO, C. 2002. Ingesta dietética de contaminantes metálicos (Hg, Pb, Cd, Fe, Cu, Zn y Mn) en la Comunidad Autónoma Canaria. Evaluación toxicológica. Tesis Doctoral. España. Universidad de la Laguna, Departamento de Pediatría, Obstetricia, Ginecología y Medicina Preventiva. 185p. RUELAS, J.; MEZA, G. Y PAEZ, F. 2008. Mercury in fish that are of dietary importance from the coasts of Sinaloa (SE Gulf of California). Journal of Food Composition and Analysis. 21: 211–218. SASAMOTO, T.; USHIO, F.; KIKUTANI, N.; SAITOH, Y.; YAMAKI, Y.; HASHIMOTO, T.; HORII, S.; NAKAGAWA, J.; IBE Y IBE, A. 2005. Estimation of 1999 – 2004 dietary daily intake of PCDDs, PCDFs and dioxin – like PCBs by a total diet 82 study in metropolitan Tokyo, Japan. US National Library of Medicine National Institutes of Health (On line) 64(4): 634 – 641. < http://www.ncbi.nlm.nih.gov/pubmed/16376969> (13 nov. 2011). SHIM, S.; DORWORTH, L.; LASRADO, J. y SANTERRE, C. 2004. Journal of Food Science. Mercury and Fatty Acids in Canned Tuna, Salmon, and Mackerel. 69: 681 – 684. SMOCOVICH, M. 2000. Emergencias Químicas Provocadas Por Mercurio y Sus Compuestos. Su Prevención y Control. Tesis Magister en Emergencias Químicas. Buenos Aires. Universidad Nacional de General San Martín. 107p. SORIANO, C. 2009. Utilidad del ensayo de linfoma de ratón en la determinación de los mecanismos de genotoxicidad del arsénico. Espectro mutacional del trióxido de arsénico. Memoria de título Dra. en Genética. Bellaterra. Universidad Autónoma de Barcelona, Departamento de Genética y Microbiología. 183p. STÖHER, G. 1991. Arsenic: opportunity for risk assessment. Arch. Toxicol. (Berlin) 65: 525-53. SUN, G.; XU, Y.; LI, X.; JIN, Y.; LI, B. Y SUN, X. 2007. Urinary Arsenic Metabolites in Children and Adults Exposed to Arsenic in Drinking Water in Inner Mongolia, China. Environmental Health Perspectives. 115(4): 648 – 652. SUNER, M.; DEVESA, V.; CLEMENTE, M.J.; VELEZ, D.; MONTORO, R. y HUANG K. 2002. Organoarsenical species contents in fresh and processed seafood products. Journal of Agricultural and Food Chemistry 50: 924–932. TCHOUNWOU, P.; CENTENO, J. y PATLOLLA A. 2004. Arsenic toxicity, mutagenesis and carcinogénesis – a health risk assessment and management approach. Mol. Cell. Biochem., 255: 47-55. TRASOBARES, E. 2010. Plomo y Mercurio en sangre en una población laboral hospitalaria y su relación con factores de exposición. Memoria Dr. En Farmacia. Madrid. Universidad Complutense de Madrid, Facultad de Farmacia. 326p. URIETA, I.; JALÓN, M.; GARCÍA, J. y GONZÁLEZ DE GALDEANO, L. 1996. Food surveillance in the Basque country (Spain) I. The design of a total diet study.Food Additives and Contaminants. 8: 371-380. 83 USA, AGENCIA PARA SUSTANCIAS TÓXICAS Y EL REGISTRO DE ENFERMEDADES (ATSDR). 2007. Reseña Toxicológica del arsénico. (On line) < http://www.atsdr.cdc.gov/toxprofiles/tp.asp?id=22&tid=3> (05 may. 2011). VALLE, L. y LUCAS, B. 2000. Toxicología de Alimentos. Instituto Nacional de Salud Pública. Centro Nacional de Salud Ambiental. México, D.F. 261p. WORLD HEALTH ORGANIZATION (WHO). 2006. (On line). <http://www.who.int/ifcs/documents/forums/forum5/04_ts_sp.pdf>. (13 jul. 2011). YAMASHITA, Y., OMURA, Y. Y OKAZAKI, E. 2005. Total mercury and methylmercury levels in commercially important fishes in Japan. Fisheries Science. 71: 1029ZUKOWSKA, J. y BIZIUK, M. 2008. Methodological Evaluation of Method for Dietary Heavy Metal Intake. Journal of food science. 73: 21-29. 84 ANEXOS 85 ANEXO 1 Carta de consentimiento informado UNIVERSIDAD AUSTRAL DE CHILE INSTITUTO DE CIENCIA Y TECNOLOGÍA DE LOS ALIMENTOS CONSENTIMIENTO INFORMADO PARA SER ENCUESTADO SOBRE HABITOS ALIMENTICIOS MEDIANTE ENCUESTA RECORDATORIA DE 24 HORAS. Don (ña)_____________________________________ DE _______ AÑOS DE EDAD (Nombre y Apellidos del Encuestado) TELEFONO __________________ Y CON DOMICILIO EN _____________________ Desea que los resultados de esta investigación le sean informados SI____ NO____ Email________________________________@_______________________________ Certifico que he recibido explicaciones tanto verbales como escritas (Anexo 1), sobre la naturaleza y propósitos del Estudio de Dieta total y de la encuesta recordatoria de 24 horas, habiendo tenido ocasión de aclarar las dudas que me han surgido. Por ello, en total conocimiento estoy de acuerdo en: 1. Ser encuestado sobre mis hábitos alimenticios y 2. Permitir que la información obtenida (Sin mi Nombre) sea utilizada para fines de investigación. 86 Estando satisfecho con la información recibida, firmo este consentimiento para participar en el Estudio de Dieta Total. __________________ ____________________ Firma del Encuestado Firma del Encuestador En la ciudad de____________a____/________/20___ 87 ANEXO 2 Encuesta nutricional recordatoria de 24 horas, utilizada en las ciudades de Chillán y Valdivia 88 89 90 91 92 93 94 ANEXO 3 Consumo de alimentos/persona/día (g) calculado tomando como referencia una persona de 69 kg. de peso 1. ALIÑOS Producto Consumo/persona/día (g) Porcentaje (%) Chillán Valdivia Chillán Valdivia Salsa de tomates 4.82 12.5 20.08 69.8 Sopas envasadas 1.78 1.9 7.42 10.9 Sal 6.14 1.8 25.58 10.1 Otros 14.98 1.6 46.92 9.2 Total 27.72 17.8 100.0 100.0 2. AZÚCARES Producto Consumo/persona/día (g) Porcentaje (%) Chillán Valdivia Chillán Valdivia 6.28 30.4 7.30 45.3 S/I 14.4 S/I 21.5 Chocolates 4.88 7.7 5.67 11.5 Mermeladas 2.58 6.5 2.58 9.6 Jaleas 4.45 3.7 5.17 5.5 Otros 3.77 4.4 4.37 6.6 Total ≈ 85.84 17.8 ≈ 100.0 100.0 Pasteles Edulcorantes S/I: Sin información 95 3. BEBIDAS ALCOHÓLICAS Producto Consumo/persona/día (g) Porcentaje (%) Chillán Valdivia Chillán Valdivia Cerveza 23.56 24.9 36.92 49.3 Vino tinto 20.81 14.0 33.35 27.9 Vino blanco 3.59 5.2 5.75 10.3 Malta S/I 2.1 S/I 4.2 Chicha S/I 1.0 S/I 2.1 Otros 4.83 3.2 9.20 6.3 Total ≈ 62.22 50.4 ≈ 100.0 100.0 S/I: Sin información 4. BEBIDAS NO ALCOHÓLICAS Producto Consumo/persona/día (g) Porcentaje (%) Chillán Valdivia Chillán Valdivia Agua 395.73 331.6 69.72 61.5 Gaseosas 113.58 103.0 20.01 19.1 Jugos envasados 12.96 82.2 2.28 15.2 S/I 17.0 S/I 3.2 33.56 5.8 5.91 1.1 ≈ 567.60 539.6 ≈ 100.0 100.0 Agua mineral Otros refrescos Total S/I: Sin información 96 5. CARNES Producto Consumo/persona/día (g) Porcentaje (%) Chillán Valdivia Chillán Valdivia Vacuno 29.57 47.8 43.86 61.7 Pollo 19.45 18.1 28.07 23.3 Cerdo 7.22 8.6 10.42 11.1 Pavo S/I 1.7 S/I 2.2 Otros 3.46 1.3 4.99 1.7 Total ≈ 68.20 77.5 ≈ 100.0 100.0 S/I: Sin información 6. CEREALES Producto Consumo/persona/día (g) Porcentaje (%) Chillán Valdivia Chillán Valdivia Arroz 45.5 44.3 40.73 42.6 Pastas 10.9 21.9 9.8 21.0 Galletas 9.2 17.9 8.3 17.2 Sopaipillas S/I 10.2 S/I 9.8 22.7 4.4 20.3 4.2 S/I 2.3 S/I 2.2 Otros 13.4 3.0 7.5 2.9 Total ≈ 116.7 104.0 ≈ 100.0 100.0 Harina de trigo Galletas trigo salvado de 97 7. DERIVADOS CÁRNICOS Producto Consumo/persona/día (g) Porcentaje (%) Chillán Valdivia Chillán Valdivia Mortadela 4.0 8.8 9.1 21.9 Longanizas 8.7 8.0 20.5 19.9 Paté 9.4 6.9 21.2 17.1 Jamón 7.5 6.5 17.1 16.2 Vienesa 7.7 6.0 17.3 14.9 Hamburguesa 2.5 3.5 5.6 8.6 Otros 3.9 0.6 9.2 1.4 Total ≈ 41.3 40.4 ≈ 100.0 100.0 8. DERIVADOS LÁCTEOS Producto Consumo/persona/día (g) Porcentaje (%) Chillán Valdivia Chillán Valdivia Yogurt 22.02 57.5 12.91 51.0 Queso 37.84 30.2 50.12 26.8 Helado 9.48 9.8 15.83 8.7 Postres 9.76 9.6 16.31 8.5 Crema S/I 3.1 S/I 2.8 Otros 2.90 2.6 4.84 2.3 Total ≈ 82.00 112.8 ≈ 100.0 100.0 98 9. FRUTAS Producto Consumo/persona/día (g) Porcentaje (%) Chillán Valdivia Chillán Valdivia Manzana 23.04 23.3 32.96 26.0 Durazno S/I 10.5 S/I 11.8 Naranja 9.58 10.4 13.71 11.7 S/I 9.9 S/I 11.1 6.40 9.7 9.16 10.8 Uvas S/I 5.4 S/I 6.1 Pera 2.09 5.0 3.00 5.6 Castaña S/I 2.5 S/I 2.8 Piña S/I 1.9 S/I 2.1 Otros 28.77 10.9 41.16 12.2 Total ≈ 69.88 89.6 ≈ 100.0 100.0 Limón Plátano 10. HUEVOS Producto Huevos Total Consumo/persona/día (g) Porcentaje (%) Chillán Valdivia Chillán Valdivia 28.79 13.1 100 100 ≈ 28.79 13.1 ≈ 100.0 100.0 99 11. GRASAS Y ACEITES Producto Consumo/persona/día (g) Porcentaje (%) Chillán Valdivia Chillán Valdivia Mayonesa 3.54 5.9 21.64 37.5 Aceite vegetal 3.85 5.3 23.30 34.0 Mantequilla 4.89 2.5 29.89 15.8 Margarina 1.28 1.7 5.57 10.9 Otros 4.88 0.3 19.59 1.8 Total 82.00 15.7 100.0 100.0 12. LECHE Producto Consumo/persona/día (g) Porcentaje (%) Chillán Valdivia Chillán Valdivia Entera 33.508 63.0 40.48 54.1 Saborizadas 18.324 19.1 22.77 16.4 Leche en polvo 4.660 18.4 5.61 15.8 Leche descremada 16.806 7.4 20.22 6.4 Leche cultivada 3.141 4.7 3.78 4.1 Otros 6.545 3.8 7.873 3.2 Total 82.984 116.4 100.0 100.0 100 13. LEGUMINOSAS Y NUECES Producto Consumo/persona/día (g) Porcentaje (%) Chillán Valdivia Chillán Valdivia Lentejas 7.17 9.5 32.65 37.4 Choclo 5.01 7.9 22.79 31.3 Porotos 13.48 6.3 24.42 24.9 Arvejas 0.79 1.5 3.57 5.9 Otros 3.64 0.1 16.57 0.5 Total 30.09 25.3 100.0 100.0 14. PAN Producto Consumo/persona/día (g) Porcentaje (%) Chillán Valdivia Chillán Valdivia 169 173.8 65.99 71.1 Pan amasado 43.33 44.2 16.92 18.1 Pan integral 5.236 11.5 2.04 4.7 Pan marraqueta 19.24 9.8 7.51 4.0 Otros 19.29 5.0 7.53 2.0 Total 256.09 244.3 100.0 100.0 Pan blanco 101 15. PAPAS Producto Consumo/persona/día (g) Porcentaje (%) Chillán Valdivia Chillán Valdivia Papas 91.10 129.0 100 100 Total 91.10 129.0 100.0 100.0 16. PESCADOS Y MARISCOS Producto Consumo/persona/día (g) Porcentaje (%) Chillán Valdivia Chillán Valdivia Merluza 2.67 4.2 10.01 22.5 Salmón 0.63 4.0 2.35 21.4 Atún S/I 2.1 S/I 11.3 Robalo S/I 2.1 S/I 11.3 Tacas 2.62 1.6 9.80 8.7 Jurel 0.92 1.5 3.43 8.0 Mix mariscos 3.61 0.9 13.54 5.1 Pejerrey S/I 0.8 S/I 4.5 Choritos 3.92 0.5 14.71 2.7 Otros 12.31 0.8 46.15 4.5 Total 26.68 18.6 100.0 100.0 S/I: Sin información 102 17. VEGETALES Producto Consumo/persona/día (g) Porcentaje (%) Chillán Valdivia Chillán Valdivia Tomates 24.00 70.8 16.13 29.4 Lechuga 9.55 38.8 6.42 16.1 Palta 31.39 32.9 21.10 13.6 Arvejas 9.42 32.6 6.33 13.5 Zapallo 14.66 14.8 9.86 6.2 Cebolla S/I 10.8 S/I 4.5 Porotos verdes 6.90 6.2 4.64 2.6 Zanahoria 3.90 5.4 2.62 2.3 Beterragas S/I 5.0 S/I 2.1 Otros 49.32 23.8 32.9 9.9 Total 149.16 241.3 100.0 100.0 S/I: Sin información 103 ANEXO 4 Concentración de arsénico total en los distintos grupos de alimentos en las poblaciones de Chillán y Valdivia. FUENTE: Elaboración propia según datos recopilados en el presente estudio 104 ANEXO 5 Concentración de arsénico inorgánico en los distintos grupos de alimentos en las poblaciones de Chillán y Valdivia. FUENTE: Elaboración propia según datos recopilados en el presente estudio 105 ANEXO 6 Ingesta de arsénico total en los distintos grupos de alimentos en las poblaciones de Chillán y Valdivia. FUENTE: Elaboración propia según datos recopilados en el presente estudio 106 ANEXO 7 Ingesta de arsénico inorgánico en los distintos grupos de alimentos en las poblaciones de Chillán y Valdivia. FUENTE: Elaboración propia según datos recopilados en el presente estudio 107 ANEXO 8 Concentración de mercurio en los distintos grupos de alimentos en las poblaciones de Chillán y Valdivia. FUENTE: Elaboración propia según datos recopilados en el presente estudio 108 ANEXO 9 Ingesta de mercurio en los distintos grupos de alimentos en las poblaciones de Chillán y Valdivia. FUENTE: Elaboración propia según datos recopilados en el presente estudio