Estudio fitoquímico de Compsoneura capitellata (Myristicaceae
Anuncio

Estudio fitoquímico de Compsoneura
capitellata (Myristicaceae), Zanthoxylum
rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible
aplicación como biocontroladores de
Sitophilus sp.
Juliet Angélica Prieto Rodríguez
Universidad Nacional de Colombia
Facultad de Ciencias, Departamento de Química
Bogotá, Colombia
2012
Estudio fitoquímico de Compsoneura capitellata
(Myristicaceae), Zanthoxylum rigidum (Rutaceae) y
Ocotea longifolia (Lauraceae) y evaluación de su
posible aplicación como biocontroladores de
Sitophilus sp.
Juliet Angélica Prieto Rodríguez
Tesis o trabajo de investigación presentada(o) como requisito parcial para optar al título
de:
Doctor en Ciencias Química
Director (a):
Doctor, MSc, Químico. Luis Enrique Cuca Suarez
Línea de Investigación:
Química de Productos Naturales Vegetales
Grupo de Investigación:
Estudio Químico y de Actividad Biológica de Rutaceae y Myristicaceae Colombianas
Universidad Nacional de Colombia
Facultad de Ciencias, Departamento de Química
Bogotá, Colombia
2012
A Dios, a mi familia y a aquellas personas
que directa o indirectamente son parte de
esta realidad.
Agradecimientos
A Dios por ser mi sustento, por darme la vida y por permitirme siempre alcanzar mis
sueños.
A mis padres y hermana por su valioso e incondicional apoyo, por su amor, por aguantar
mis malos ratos, por la paciencia y comprensión en el desarrollo de mi tesis doctoral.
A Javi por estar siempre a mi lado en los momentos más trascendentales de mi vida, por
todo su apoyo, su amor, comprensión, por brindarme siempre lo mejor de sí.
Al profesor LUIS ENRIQUE CUCA SUÁREZ, por la confianza, por las oportunidades
brindadas, su dedicacion, paciencia, amistad y por su valiosa dirección, orientación y
enseñanzas.
A MARÍA JESÚS PASCUAL VILLALOBOS agradezco la oportunidad dada para la
realizacion de la pasantia en su grupo de investigacion, por su asesoría en el desarrollo
de los ensayos de actividad insecticida, por la confianza y amistad brindada.
A los profesores MASSUO KATO y LYDIA YAMAGUCHI por su incondicional ayuda y
soporte científico durante la etapa final de mi trabajo de tesis.
Agradezco a mis amigos de productos naturales vegetales con los que he tenido el placer
de compartir durante esta travesía diferentes momentos (Ludicilla, Moni, Wilman, Oscar,
Jorge, Eris) y a los que sin ser mis amigos, me motivaron a dar lo mejor de mi cada día.
A Oscar le doy un agradecimiento especial por su apoyo incondicional para que mi tesis
llegara a su final, por los jalones de orejas, por las risas, por su apoyo a nivel
investigativo, por ser un amigo incondicional.
A Lola con quien tuve el placer de compartir muchas experiencias personales y
profesionales durante mi pasantía doctoral, le agradezco por su amistad, apoyo,
enseñanzas y consejos.
A los profesores del departamento de química por sus enseñanzas y colaboración
durante el doctorado.
A la UNIVERSIDAD NACIONAL DE COLOMBIA y a COLCIENCIAS por la financiación
del programa doctoral, mediante la convocatoria “Apoyo a la comunidad Científica
Nacional, a través de Doctorados‐Nacionales año 2008”.
VIII
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea
longifolia (Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Al IMIDA por la financiación de los materiales y reactivos utilizados en el desarrollo de mi
pasantía doctoral.
Al LABORATORIO DE RESONANCIA MAGNÉTICA NUCLEAR de la Universidad
Nacional de Colombia por la toma de espectros de RMN.
AL
LABORATORIO
DE
CROMATOGRAFÍA
LÍQUIDA
ACOPLADA
A
ESPECTROMETRÍA DE MASAS (LCMS) de la Universidad Nacional de Colombia por la
toma de los espectros de masas de baja y/o alta resolucion.
Al HERBARIO NACIONAL COLOMBIANO de la Universidad Nacional de Colombia por la
determinacion taxonómica de las muestras vegetales empleadas en el estudio
fitoquimico.
Juliet Prieto
Resumen y Abstract
IX
Resumen
La presente investigación combina estudios fitoquímicos y de actividad insecticida sobre
plagas de almacén, con el fin de contribuir a la búsqueda de compuestos potencialmente
útiles en el sector agrícola. El trabajo comprende aislamiento y caracterización de los
metabolitos secundarios presentes en hojas y madera de C. capitellata (Myristicaceae),
corteza de Z. rigidum (Rutaceae) y corteza de O. longifolia (Lauraceae), caracterización
química de los aceites esenciales de 7 especies pertenecientes a las familias Lauraceae,
Rutaceae y Myristicaceae, y evaluación de actividad insecticida sobre S. zeamais, S.
oryzae y T. castaneum de los extractos, aceites esenciales y compuestos aislados.
El estudio fitoquímico desarrollado en las tres especies objeto de estudio condujo al
aislamiento y caracterización de 38 metabolitos secundarios, entre los que se encuentran
3 metabolitos sin reportes previos en la literatura y que fueron denominados:
(-)-compsoneurósido HCc-9, ácido (-)-rigidunoico Zr-14 y (+)-longifolina Ol-4. La
caracterización química de los aceites esenciales indica que los monoterpenos son los
compuestos más abundantes en los aceites de Z. rhoifolium, Z. monophyllum, O.
longifolia y V. carinata., mientras los aceites esenciales de Z. fagara, Z. fagara y Z.
rigidum están compuestos principalmente por sesquiterpenos. Los resultados de la
evaluación de actividad antialimentaria de los compuestos aislados indican que la
mayoría de las sustancias evaluadas causaron efectos fagodisuasivos bajos (50% < IDA
> 20%) y moderados (70% < IDA > 50%) sobre S. zeamais y T. castaneum, siendo este
último la especie más susceptible. En el screening de toxicidad fumigante de los aceites
esenciales, solo los aceites de V. carinata., O. longifolia y Z. monophyllum exhibieron
toxicidad fumigante contra las tres plagas de almacén.
Palabras clave: Compsoneura, Zanthoxylum, Ocotea, Lauraceae, Myristicaceae,
Rutaceae, Sitophilus, Tribolium.
X
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea
longifolia (Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Phytochemical study of Compsoneura capitellata (Myristicaceae),
Zanthoxylum rigidum (Rutaceae) and Ocotea longifolia
(Lauraceae) and evaluation of their possible application as
biocontrol of Sitophilus sp.
Abstract
The present research combines phytochemical studies and insecticidal activity on stored
pests, with the aim of contributing to the search of potentially useful compounds in the
agricultural sector. The work consists of isolation and characterization of the secondary
metabolites present in leaves and wood of C. capitellata (Myristicaceae), bark of Z.
rigidum (Rutaceae) and bark of O. longifolia (Lauraceae); chemical characterization of the
essential oils of 7 species from the families Lauraceae, Rutaceae and Myristicaceae, and
insecticidal activity evaluation on S. zeamais, S. oryzae y T. castaneum of the isolated
extracts, essential oils and compounds.
The phytochemical study on the three species leads to the isolation and characterization
of 38 secondary metabolites, three of them not previously reported in the literature and
that were named: compsoneuroside HCc-9, (-)-rigidunoic acid Zr-14 and (+)-longifoline
OI-4. The chemical characterization of the essential oils shows that monoterpenes are the
most abundant compounds in the oils of Z. rhoifolium, Z. monophyllum, O. longifolia and
V. carinata, while the essential oils of Z. fagara and Z. rigidum are mainly constituted by
sesquiterpenes. The results from the evaluation of the antifeedant activity of the isolated
compounds shows that most of them caused lower (50% < FDI > 20%) and moderate
(70% < FDI > 50%) fagodisuasive effects on S. zeamais and T. castaneum, with the last
one the most susceptible specie. In the screening of fumigant activity of the essential oils,
only the oils of V. carinata, O. longifolia and Z. monophyllum exhibited fumigant toxicity
against the three stored pests.
Keywords: Compsoneura, Zanthoxylum, Ocotea, Lauraceae, Myristicaceae, Rutaceae,
Sitophilus, Tribolium.
Contenido
XI
Contenido
Pág.
Lista de figuras ............................................................................................................. XIII
Lista de tablas ............................................................................................................ XVII
Lista de abreviaturas................................................................................................... XIX
Producción Científica...................................................................................................... 1
Introducción .................................................................................................................... 1
1.
Estado Actual del Tema ........................................................................................... 5
1.1
Generalidades de la familia Myristicaceae ......................................................... 5
1.1.1 Aspectos generales del género Compsoneura ................................................ 5
1.2
Generalidades de la familia Lauraceae .............................................................. 7
1.2.1 Aspectos generales del género Ocotea ........................................................... 8
1.3
Generalidades de la familia Rutaceae .............................................................. 12
1.3.1 Aspectos generales del género Zanthoxylum ................................................ 13
1.4
Biología y comportamiento de plagas de almacén: Especies del género
Sitophilus y Tribolium .................................................................................................. 22
1.4.1 Insectos del género Sitophilus ....................................................................... 23
1.4.2 Insectos del género Tribolium ........................................................................ 25
1.5
Daños y pérdidas causados por plagas de almacén......................................... 26
1.6
Métodos de control de plagas de productos almacenados ............................... 28
1.7
Insecticidas sintéticos para el control de plagas ............................................... 33
1.7.1 Insecticidas organofosforados ....................................................................... 33
1.7.2 Insecticidas organoclorados .......................................................................... 33
1.7.3 Insecticidas Carbamatos................................................................................ 34
1.8
Insecticidas botánicos ...................................................................................... 35
1.8.1 Piretroides ..................................................................................................... 36
1.8.2 Neem ............................................................................................................. 36
1.8.3 Rotenona ....................................................................................................... 37
1.8.4 Aceites esenciales ......................................................................................... 37
1.8.5 Familias de plantas reconocidas por su utilidad como insecticidas ................ 38
2.
Estudio Fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum
rigidum (Rutaceae) y Ocotea longifolia (Lauraceae), y evaluación de su posible
aplicación como antialimentarios de plagas de almacén. .......................................... 39
2.1
Metodología ..................................................................................................... 43
2.1.1 General.......................................................................................................... 43
2.1.2 Material vegetal ............................................................................................. 44
XII
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
2.1.3 Estudio fitoquímico de hojas de Compsoneura capitellata ..............................44
2.1.4 Estudio fitoquímico de la madera de Compsoneura capitellata.......................47
2.1.5 Estudio fitoquímico de la corteza de Zanthoxylum rigidum .............................49
2.1.6 Estudio fitoquímico de la corteza de Ocotea longifolia ....................................51
2.1.7 Evaluación de actividad antialimentaria ..........................................................54
2.2
Resultados y discusión ..................................................................................... 55
2.2.1 Screening de actividad antialimentaria sobre S. seamaiz ...............................55
2.2.2 Estudio fitoquímico de hojas y madera de C. capitellata .................................57
2.2.3 Estudio fitoquímico de la corteza de Z. rigidum ..............................................86
2.2.4 Estudio fitoquímico de la corteza de O. longifolia .........................................109
2.2.5 Estudio de la actividad antialimentaria de los compuestos aislados .............126
3. Composición química y actividad insecticida de aceites esenciales obtenidos
de algunas especies de las familias Lauraceae, Myristicaceae y Rutaceae ............133
3.1
Metodología .................................................................................................... 136
3.1.1 Análisis químico de los aceites esenciales ...................................................136
3.1.2 Ensayos de actividad insecticida ..................................................................138
3.1.3 Estudio de inhibición in-vitro e in-vivo de la acetilcolinesterasa. ...................142
3.2
Resultados y discusión ................................................................................... 145
3.2.1 Composición química de los aceites esenciales ...........................................145
3.2.2 Toxicidad fumigante de los aceites esenciales y de los monoterpenos y
monoterpenoides activos ........................................................................................153
3.2.3 Toxicidad por contacto de los aceites esenciales .........................................158
3.2.4 Actividad repelente de los aceites esenciales ...............................................160
3.2.5 Actividad antialimentaria de los aceites esenciales y de algunos
monoterpenos .........................................................................................................163
3.2.6 Efecto de los aceites esenciales y de algunos monoterpenos en la
reproducción de T. castaneum ................................................................................166
3.2.7 Estudio de inhibición in-vitro de la acetilcolinesterasa (AChE) ......................172
3.2.8 Estudio de inhibición in-vivo de la acetilcolinesterasa ...................................180
4.
Conclusiones ........................................................................................................184
Bibliografía ...................................................................................................................200
Contenido
XIII
Lista de figuras
Pág.
Figura 1-1 Características morfológicas generales de especies del género Compsoneura.
......................................................................................................................................... 6
Figura 1-2 Características morfológicas generales de especies del género Ocotea. ....... 9
Figura 1-3 Características morfológicas generales de especies del género Zanthoxylum.
....................................................................................................................................... 14
Figura 1-4 Ciclo de vida de insectos plaga del género Sitophilus .................................. 24
Figura 1-5 Ciclo de vida de insectos plaga del género Tribolium ................................... 26
Figura 1-6 Estructura de algunos piretriodes ................................................................. 36
Figura 2-1 Esquema general de extracción, fraccionamiento y purificación de los
metabolitos secundarios presentes en las hojas de Compsoneura capitellata. ............... 46
Figura 2-2 Esquema general de extracción, fraccionamiento y purificación de los
metabolitos secundarios presentes en la madera de Compsoneura capitellata. ............. 48
Figura 2-3 Esquema general de extracción, fraccionamiento y purificación de los
metabolitos secundarios presentes en la corteza de Zanthoxylum rigidum..................... 51
Figura 2-4 Esquema general de extracción, fraccionamiento y purificación de los
metabolitos secundarios presentes en la corteza de Ocotea longifolia. .......................... 53
Figura 2-5 Compuestos aislados de las hojas de C. capitellata. .................................... 57
Figura 2-6 Compuestos aislados de la madera de C. capitellata. .................................. 58
Figura 2-7 Espectro RMN 1H para el compuesto HCc-9 (acetona-d 6 , 400 MHz). ........... 61
Figura 2-8 Espectro de RMN 13C y DEPT 135 del compuesto HCc-9 (acetona-d 6 , 100
MHz) .............................................................................................................................. 61
Figura 2-9 Espectro HMQC para el compuesto HCc-9 (acetona-d 6 , 400 MHz). ............. 62
Figura 2-10 Espectro COSY 1H-1H para el compuesto HCc-9 (acetona-d 6 , 400 MHz). .. 63
Figura 2-11 Sub-estructuras planteadas para el compuesto HCc-9 ............................... 64
Figura 2-12 Espectro HMBC para el compuesto HCc-9 (acetona-d 6 , 400 MHz). ........... 64
Figura 2-13 Principales correlaciones observadas en COSY y HMBC para el compuesto
HCc-9. ............................................................................................................................ 65
Figura 2-14 Espectro NOESY para el compuesto HCc-9 (acetona-d 6 , 300 MHz). ......... 66
Figura 2-15 Estructura tridimensional del conformero más estable del compuesto HCc-9
....................................................................................................................................... 67
Figura 2-16 Estructura del componeurósido HCc-9 ....................................................... 67
Figura 2-17 Espectro de RMN 1H (CDCl 3 , 400 MHz) para HCc-1 .................................. 68
Figura 2-18 Espectro de RMN 13C y DEPT 135 (CDCl 3 , 100 MHz) para HCc-1 ............. 69
Figura 2-19 Espectro de RMN 1H (acetona d 6 , 400 MHz) para HCc-4 ........................... 70
Figura 2-20 Espectro de RMN 13C y DEPT 135 (acetona d 6 , 100 MHz) de para HCc-4 . 70
XIV
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Figura 2-21 Espectro de RMN 1H (acetona d 6 , 400 MHz) para HCc-5............................ 71
Figura 2-22 Espectro de RMN 13C y DEPT 135 (acetona d 6 , 100 MHz) de para HCc-5 . 72
Figura 2-23 Espectro de RMN 1H (acetona d 6 , 400 MHz) de la mezcla de HCc-6 y HCc-7.
....................................................................................................................................... 73
Figura 2-24 Espectro de RMN 13C y DEPT 135 (acetona d 6 , 100 MHz) de la mezcla de
HCc-6 y HCc-7 ................................................................................................................ 73
Figura 2-25 Espectro RMN 1H (CDCl 3 -CD 3 OD, 400 MHz) para HCc-8 .......................... 74
Figura 2-26 Espectro de RMN 13C y DEPT 135 (CDCl 3 -CD 3 OD, 100 MHz) de para HCc-8
....................................................................................................................................... 75
Figura 2-27 Espectro RMN 1H (acetona-d 6 , 400 MHz) para HCc-10 .............................. 76
Figura 2-28 Espectro de RMN 13C y DEPT 135 (acetona d 6 , 100 MHz) de para HCc-10 77
Figura 2-29 Espectro RMN 1H (CDCl 3 , 400 MHz) para MCc-3 ....................................... 78
Figura 2-30 Espectro de RMN 13C y DEPT 135 (CDCl 3 , 100 MHz) de para MCc-3 ........ 78
Figura 2-31 Espectro RMN 1H (acetona-d 6 , 400 MHz) para la mezcla de MCc-4 y MCc-5.
....................................................................................................................................... 79
Figura 2-32 Espectro RMN 13C (acetona-d 6 , 100 MHz) para la mezcla de MCc-4 y MCc5...................................................................................................................................... 80
Figura 2-33 Espectro RMN 1H (acetona-d 6 , 400 MHz) para MCc-6 ................................ 81
Figura 2-34 Espectro RMN 13C y DEPT 135 (acetona-d 6 , 100 MHz) para MCc-6........... 81
Figura 2-35 Espectro RMN 1H (acetona-d 6 , 400 MHz) para MCc-7. ............................... 82
Figura 2-36 Espectro RMN 13C y DEPT 135 (acetona-d 6 , 100 MHz) para MCc-7........... 83
Figura 2-39 Espectro RMN 1H (CD 3 OD, 400 MHz) para MCc-8 ..................................... 84
Figura 2-40 Espectro RMN 13C y DEPT 135 (CD 3 OD, 100 MHz) para MCc-8. ............... 84
Figura 2-37 Espectro RMN 1H (CD 3 OD, 400 MHz) para MCc-9 ..................................... 85
Figura 2-38 Espectro RMN 13C y DEPT 135 (CD 3 OD, 100 MHz) para MCc-9. ............... 86
Figura 2-41 Compuestos aislados de la corteza de Z. rigidum ....................................... 87
Figura 2-42 Espectro RMN 1H para el compuesto Zr-14 (CD 3 OD-D 2 O, 400 MHz). ........ 89
Figura 2-43 Espectro COSY 1H-1H para el compuesto Zr-14 (CD 3 OD-D 2 O, 400 MHz). . 90
Figura 2-44 Espectro RMN 13C y DEPT 135 del compuesto Zr-14 (CD 3 OD-D 2 O, 100
MHz) ............................................................................................................................... 91
Figura 2-45 Espectro HMQC para el compuesto Zr-14 (CD 3 OD:D 2 O, 400 MHz). .......... 92
Figura 2-46 Espectro HMBC para el compuesto Zr-14 (CD 3 OD:D 2 O, 400 MHz). ........... 93
Figura 2-47 Principales correlaciones HMBC para el compuesto Zr-14 .......................... 93
Figura 2-48 Espectro NOESY para el compuesto Zr-14 (CD 3 OD:D 2 O, 300 MHz). ......... 94
Figura 2-49 Espectro de masas de alta resolución obtenido por ESI en modo negativo
para el compuesto Zr-14. ................................................................................................ 95
Figura 2-50 Estructura del ácido (-)-rigidunoico Zr-14 .................................................... 95
Figura 2-51 Espectro de RMN 1H (CDCl 3 , 400 MHz) de la mezcla de Zr-4 y Zr-5. ......... 97
Figura 2-52 Espectro de RMN 13C y DEPT 135 (CDCl 3 , 100 MHz) de la mezcla de Zr-4 y
Zr-5. ................................................................................................................................ 97
Figura 2-53 Espectro de RMN 1H (CDCl 3 , 400 MHz) para Zr-6. ..................................... 98
Figura 2-54 Espectro de RMN 13C y DEPT 135 (CDCl 3 , 100 MHz) para Zr-6. ................ 99
Figura 2-55 Espectro de RMN 1H (CDCl 3 , 400 MHz) para Zr-7. ................................... 100
Figura 2-56 Espectro de RMN 13C y DEPT 135 (CDCl 3 , 100 MHz) para Zr-7. .............. 100
Contenido
XV
Figura 2-57 Espectro de RMN 1H (CDCl 3 , 400 MHz) para Zr-8.....................................101
Figura 2-58 Espectro de RMN 13C y DEPT 135 (CDCl 3 , 100 MHz) para Zr-8 ...............102
Figura 2-59 Espectro de RMN 1H (CDCl 3 , 400 MHz) para Zr-9.....................................103
Figura 2-60 Espectro de RMN 13C y DEPT 135 (CDCl 3 , 100 MHz) para Zr-9. ..............103
Figura 2-61 Espectro de RMN 1H (CDCl 3 , 400 MHz) para Zr-10...................................104
Figura 2-62 Espectro de RMN 13C y DEPT 135 (CDCl 3 , 100 MHz) para Zr-10. ............105
Figura 2-63 Espectro de RMN 1H (acetona-d 6 , 400 MHz) para Zr-11. ..........................106
Figura 2-64 Espectro de RMN 13C y DEPT 135 (acetona-d 6 , 100 MHz) para Zr-11. .....106
Figura 2-65 Espectro de RMN 1H (acetona-d 6 , 400 MHz) para Zr-12. ..........................107
Figura 2-66 Espectro de RMN 13C y DEPT 135 (acetona-d 6 , 100 MHz) para Zr-12 ......108
Figura 2-67 Metabolitos aislados de la corteza de Ocotea longifolia. ............................109
Figura 2-68 Espectro RMN 1H para el compuesto Ol-4 (CDCl 3 , 400 MHz). ..................112
Figura 2-69 Espectro de RMN 13C y DEPT 135 del compuesto Ol-4 (CDCl 3 , 100 MHz)
......................................................................................................................................113
Figura 2-70 Espectro HMQC para el compuesto Ol-4 (CDCl 3 , 400 MHz) .....................114
Figura 2-71 Espectro COSY 1H-1H para el compuesto Ol-4 (CDCl 3 , 400 MHz) ............115
Figura 2-72 Principales correlaciones observadas en HMBC para el compuesto Ol-4. .115
Figura 2-73 Espectro HMBC para el compuesto Ol-4 (CDCl 3 , 400 MHz) ......................116
Figura 2-74 Espectro NOESY para el compuesto Ol-4 (CDCl 3 , 300 MHz) ....................117
Figura 2-75 Estructura de (+)-longifolina Ol-4 ...............................................................117
Figura 2-76 Espectro de RMN 1H (CDCl 3 , 400 MHz) para Ol-1 ....................................118
Figura 2-77 Espectro de RMN 13C y DEPT 135 (CDCl 3 , 100 MHz) para Ol-1 ...............119
Figura 2-78 Espectro de RMN 1H (CDCl 3 , 400 MHz) para Ol-2 ....................................120
Figura 2-79 Espectro de RMN 13C y DEPT 135 (CDCl 3 , 100 MHz) para Ol-2 ...............120
Figura 2-80 Espectro de RMN 1H (CDCl 3 , 400 MHz) para Ol-5 ....................................122
Figura 2-81 Espectro de RMN 13C y DEPT 135 (CDCl 3 , 100 MHz) para Ol-5. ..............122
Figura 2-82 Espectro de RMN 1H (CDCl 3 , 400 MHz) para Ol-6 ....................................123
Figura 2-83 Espectro de RMN 13C y DEPT 135 (CDCl 3 , 100 MHz) para Ol-6 ...............124
Figura 2-84 Espectro de RMN 1H (CDCl 3 , 400 MHz) para Ol-7 ....................................125
Figura 2-85 Espectro de RMN 13C y DEPT 135 (CDCl 3 , 100 MHz) para Ol-7 ...............125
Figura 2-86 Metabolitos secundarios que exhibieron actividad antialimentaria moderada
sobre adultos de T. castaneum .....................................................................................128
Figura 2-87 Metabolitos secundarios que causaron un efecto fagodisuasivo moderado en
adultos de S. zeamais. ..................................................................................................129
Figura 3-1 Graficas de lo resultados del efecto de los aceites esenciales y monoterpenos
en la eclosión de los huevos. A) resultados para la pareja H trat + M trat ; B) resultados para
la pareja H trat + M st ; C) resultados para la pareja H st + M trat ..........................................171
Figura 3-2 Reacción enzimática – Método Ellman .......................................................172
Figura 3-3 Gráficas de velocidad vs concentración de sustrato para diferentes
concentraciones de inhibidor (aceites esenciales y monoterpenos) para la AChE extraída
de S. oryzae. .................................................................................................................174
Figura 3-4 Representaciones de Lineweaver-Burk para diferentes concentraciones de
inhibidor (aceites esenciales y monoterpenos). .............................................................177
XVI
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Figura 3-5 Gráficas de velocidad vs concentración de sustrato para la AChE extraída de
S. oryzae luego del tratamiento con la CL 25 , CL 50 y CL 75 de 4 inhibidores (aceite esencial
de hojas de O. longifolia, α-terpinoleno, α-felandreno y δ-3-careno) ............................. 182
Contenido
XVII
Lista de tablas
Pág.
Tabla 1-1 Usos etnobotánicos de algunas especies del género Compsoneura en
Colombia. ......................................................................................................................... 6
Tabla 1-2 Actividad Biológica de algunos metabolitos secundarios aislados de especies
del género Ocotea. ......................................................................................................... 10
Tabla 1-3 Reportes de actividad biológica para algunas especies del género
Zanthoxylum. .................................................................................................................. 15
Tabla 2-1 Resultados de actividad antialimentaria sobre S. zeamais de los extractos
etanólicos de diferentes especies de las familias Rutaceae, Lauraceae y Myristicaceae 55
Tabla 2-2 Constantes físicas y datos espectroscópicos para Eudesm-11-en-4α-ol HCc-1
....................................................................................................................................... 68
Tabla 2-3 Constantes físicas y datos espectroscópicos para biochanina A HCc-4 ......... 69
Tabla 2-4 Constantes físicas y datos espectroscópicos para la formononetina HCc-5 ... 71
Tabla 2-5 Datos espectroscópicos para la mezcla de los compuestos 3,4dihidroxibenzaldehído (HCc-6) y ácido 15-nor-10-hidroxioplopan-4-oico (HCc-7)........... 72
Tabla 2-6 Constantes físicas y datos espectroscópicos para kaempferol-3-O-(2″,4″-di-Ep-coumaroil)-ramnósido HCc-8 ....................................................................................... 74
Tabla 2-7 Constantes físicas y datos espectroscópicos para (-)-compsoneurósido HCc-9
....................................................................................................................................... 75
Tabla 2-8 Constantes físicas y datos espectroscópicos para afzelina HCc-10 ............... 76
Tabla 2-9 Constantes físicas y datos espectroscópicos para megislactona MCc-3 ........ 77
Tabla 2-10 Datos espectroscópicos para la mezcla de los compuestos MCc-4 y MCc-5 79
Tabla 2-11 Datos espectroscópicos y constantes físicas para 1-(2’,4’-dihidroxifenil)-3(3’’,4’’-metilenodioxifenil)propano MCc-6 ........................................................................ 80
Tabla 2-12 Datos espectroscópicos y constantes físicas para 1-(2’,4’-dihidroxifenil)-3-(2’’metoxi-4’’,5’’-metilenodioxifenil)propano MCc-7.............................................................. 82
Tabla 2-13 Datos espectroscópicos y constantes físicas para cinchonaina Ic MCc-8 .... 83
Tabla 2-14 Datos espectroscópicos y constantes físicas para cinchonaina Id MCc-9 .... 85
Tabla 2-15 Datos espectroscópicos para la mezcla de lignanos savinina Zr-4 e
isosavinina Zr-5 .............................................................................................................. 96
Tabla 2-16 Datos espectroscópicos y constantes físicas para flindersina Zr-6 ............... 98
Tabla 2-17 Datos espectroscópicos y constantes físicas para Dimetilmatairesinol Zr-7 . 99
Tabla 2-18 Datos espectroscópicos y constantes físicas para γ-fagarina Zr-8 ..............101
Tabla 2-19 Datos espectroscópicos y constantes físicas para skimmianina Zr-9 ..........102
Tabla 2-20 Datos espectroscópicos y constantes físicas para (+)-siringaresinol Zr-10..104
Tabla 2-21 Datos espectroscópicos y constantes físicas para cafeato de etilo Zr-11 ....105
XVIII
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Tabla 2-22 Datos espectroscópicos y constantes físicas para 7-hidroxicumarina Zr-12 107
Tabla 2-23 Datos espectroscópicos y constantes físicas para ácido (-)-rigidunoico Zr-14
..................................................................................................................................... 108
Tabla 2-24 Datos espectroscópicos y constantes físicas para ácido 11,13-dihidrocustoso
Ol-1 ............................................................................................................................... 118
Tabla 2-25 Datos espectroscópicos y constantes físicas para Litsealiicolido C Ol-2 ..... 119
Tabla 2-26 Datos espectroscópicos y constantes físicas para (+)-longifolina Ol-4 ........ 121
Tabla 2-27 Datos espectroscópicos y constantes físicas para (+)-hidroxiatractilólido Ol-5
..................................................................................................................................... 121
Tabla 2-28 Datos espectroscópicos y constantes físicas para ocotealactol Ol-6........... 123
Tabla 2-29 Datos espectroscópicos y constantes físicas para kudtdiol Ol-7 ................. 124
Tabla 2-30 Resultados de la actividad antialimentaria sobre S. zeamais y T. castaneum
de los metabolitos secundarios aislados. ...................................................................... 126
Tabla 3-1 Rendimientos y constantes físicas de los aceites esenciales. ....................... 145
Tabla 3-2 Composición química relativa de los aceites esenciales ............................... 146
Tabla 3-3 Resultados del ensayo de toxicidad fumigante de los aceites esenciales sobre
tres plagas de almacén ................................................................................................. 150
Tabla 3-4 Resultados del ensayo de toxicidad fumigante de los compuestos puros sobre
tres plagas de almacén ................................................................................................. 151
Tabla 3-5 Concentración (ppm) de los compuestos puros activos en los aceites
esenciales de hojas de O. longifolia, hojas de V. carinata y frutos de Z. monophyllum. 152
Tabla 3-6 Concentraciones letales (CL 50 ) de los aceites esenciales de O. longifolia, V.
carinata y Z. monophyllum (24 horas) sobre tres plagas de almacén. ........................... 153
Tabla 3-7. Concentraciones letales (CL 50 ) de monoterpenos y monoterpenoides (24
horas) sobre tres plagas de almacén. ........................................................................... 154
Tabla 3-8 Resultados de toxicidad por contacto para los aceites esenciales de hojas O.
longifolia, frutos de Z. monophyllum y hojas de V. carinata sobre tres plagas de almacén.
..................................................................................................................................... 159
Tabla 3-9 Resultados de la actividad repelente de los aceites esenciales de hojas de O.
longifolia, frutos de Z. monophyllum y hojas de V. carinata sobre tres plagas de almacén
..................................................................................................................................... 161
Tabla 3-10 Resultados de actividad fagodisuasiva de los aceites esenciales y
monoterpenos sobre tres plagas de almacén. ............................................................... 164
Tabla 3-11 Resultados del estudio del efecto post-tratamiento de adultos de T.
castaneum con las CL 50 de los aceites esenciales y monoterpenos. ............................. 167
Tabla 3-12 Inhibición de la actividad de la AChE causada por los aceites esenciales y
monoterpenos (CI 50 ) ..................................................................................................... 175
Tabla 3-13 Valores de K M y V max para diferentes concentraciones de las seis sustancias
evaluadas como inhibidores de la AChE extraída de Sitophilus oryzae ........................ 179
Tabla 3-14. Concentraciones letales del aceite esencial de hojas de O. longifolia y de los
monoterpenos δ-3-careno, α-terpinoleno y α-felandreno sobre S. oryzae. .................... 181
Contenido
XIX
Lista de abreviaturas
Abreviatura
AcOEt
AcOiPr
AChE
AcTCh
AE
ANOVA
°C
c
c
CC
CCD
CCDP
CDCl 3
CD 3 OD
CF
CG‐EM
CG/FID
CI 50
CL 25
CL 50
CL 75
CLV
cm‐1
COSY
d
da
dd
DDT
DE
DEPT
D2O
dt
DTNB
E
EdP
EM
EMAR
ES
ESI
EtOH
Término
Acetato de etilo
Acetato de isopropilo
Acetilcolinesterasa
Acetilcolina
Aceite esencial
Análisis de varianza
Grado Celcius
Cuarteto
Concentración
Cromatografía en columna
Cromatografía en capa delgada
Cromatografía en capa delgada preparativa
Cloroformo deuterado
Metanol deuterado
Cromatografía flash
Cromatografía de gases acoplada a espectrometría de masas
Cromatografía de gases con detector de ionización por llama
Concentración inhibitoria del 50%
Concentración letal para el 25% de la población
Concentración letal para el 50% de la población
Concentración letal para el 75% de la población
Cromatografía líquida al vacío
Centímetros inversos
Correlation Spectroscopy
Doblete
Doblete ancho
Doble doblete
Diclorodifeniltricloroetano
Desviación estándar
Distortionless Enhancement by Polarization Transfer
Agua deuterada
Doble triplete
Ácido 5-(3-carboxi-4-nitrofenil)disulfanil-2-nitrobenzoico
Enzima
Éter de petróleo
Espectrometría de masas
Espectrometría de masas de alta resolución
Complejo enzima-sustrato
Ionización por electrospray
Etanol
XX
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Abreviatura
FDI
GABA
HMBC
HMQC
HPLC
HPLC‐UV‐DAD
HR
H st
H trat
Hz
IDA
IE
IK
IMIDA
IOC
IOP
IR
J
KM
LCMS
LC‐MS‐IT‐TOF
m
m/z
MeOH
MHz
M st
M trat
NOESY
ppm
RMN 1H
RMN 13C
rpm
s
sa
t
tR
TIC
UV
V max
1D
2D
[α]
δ
δC
δH
Término
Feeding Deterrent Index
Ácido γ-aminobutírico
Heteronuclear Multiple Bond Correlation
Heteronuclear Multiple Quantum Coherence
Cromatografía líquida de alta eficiencia
Cromatografía líquida de alta eficiencia con detector ultravioleta–
visible de arreglo de diodos
Humedad relativa
Hembras sin tratar
Hembras tratadas
Hertz
Índice de Disuasión Alimentaria
Impacto electrónico
Índice de retención de Kovats
Instituto Murciano de Investigación y Desarrollo Agrario y
Alimentario.
Insecticidas organoclorados
Insecticidas organofosforados
Espectroscopía Infrarroja
Constante de acoplamiento
Constante de Michaelis
Cromatografía líquida acoplada a espectrometría de masas
Cromatografía líquida acoplada a espectrometría de masas
empleando trampa de iones y detección de tiempo de vuelo
Multiplete
Relación masa/carga
Metanol
Megahertz
Macho sin tratar
Macho tratado
Nuclear Overhauser Effect Spectroscopy
Partes por millón
Resonancia magnética nuclear de hidrógeno
Resonancia magnética nuclear de carbono 13
Revoluciones por minuto
Singlete
Singlete ancho
Triplete
Tiempo de retención
Total ion current
Ultravioleta
Velocidad máxima
Unidimensional
Bidimensional
Rotación óptica
Desplazamiento químico
Desplazamiento químico en 13C
Desplazamiento químico en 1H
Producción Científica
Parte de los resultados obtenidos de la presente tesis doctoral han sido objeto de las
siguientes publicaciones:
1.
Prieto, J. A.; Cuca, L. E. (-)-rigidunoic acid and other constituents of the wood bark
of Zanthoxylum rigidum Humb. & Bonpl. Ex Wild. (Rutaceae). Helv. Chim. Acta,
2013. (Sometido).
2.
Prieto, J. A.; Cuca, L. E. A new sesquiterpene lactone and other sesquiterpenoids
from Ocotea longifolia Kunth. (Lauraceae). Biochem. System. Ecol., 2013.
(Sometido).
3.
Prieto, J. A.; Cuca, L. E. (-)-compsoneuroside, a new acid derivative from leaves
from Compsoneura capitellata (A. DC.) Warb (Myristicaceae). Phytochem. Lett.
2013. (Sometido).
4.
Oscar Javier Patiño L., Juliet Angélica Prieto R. and Luis Enrique Cuca S. (2012).
Zanthoxylum Genus as Potential Source of Bioactive Compounds, Bioactive
Compounds in Phytomedicine, Iraj Rasooli (Ed.), ISBN: 978-953-307-805-2, InTech,
Disponible en: http://www.intechopen.com/articles/show/title/zanthoxylum-genus-aspotential-source-of-bioactive-compounds.
5.
Prieto, J. A.; Patiño, O. J.; Delgado, W. A.; Moreno, J. P.; Cuca, L. E. Chemical
composition, insecticide and antifungal activities of the essential oils of fruits of
three Zanthoxylum species from Colombia. Chilean Journal of Agricultural
Research, 2011, 71, 73 – 82.
6.
Prieto, J. A.; Pabón, L. C.; Patiño, O. J.; Delgado, W. A.; Cuca, L. E. Constituyentes
químicos, actividad insecticida y antifúngica de los aceites esenciales de hojas de
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea
longifolia (Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
2
dos especies colombianas del género Ocotea (Lauraceae). Revista Colombiana de
Química, 2010, 39, 199 – 209.
Así mismo se participó como ponente en los siguientes congresos:
1. Prieto, J. A.; Cuca, L. E. Actividad insecticida de aceites esenciales de plantas
colombianas sobre dos plagas de almacén y su posible mecanismo de acción. III
Congreso de Química de Productos Naturales Chileno-Argentino-Hispano - La
Diversidad Química y Biológica. Punta Arenas, Chile, 2012. Participación en
modalidad póster.
2. Prieto, J. A.; Patiño, O. J.; Ávila, M. C.; Delgado, W. A.; Cuca, L. E. Aceites
esenciales de plantas colombianas como agentes fitosanitarios para el control de
plagas de almacén. XI Congreso Colombiano de Fitoquímica. Medellín, Colombia,
2011. Participación en modalidad oral.
3. Prieto, J. A.; Patiño, O. J.; Ávila, M. C.; Delgado, W. A.; Barrera, D. A.; Alvárez, J.
M.; Macías, V. E.; Parra, J. E.; Cuca, L. E. Evaluación de actividad antialimentaria
de extractos de plantas colombianas contra Sitophilus zeamais. XI Congreso
Colombiano de Fitoquímica. Medellín, Colombia, 2011. Participación en modalidad
póster.
4. Prieto, J. A.; Patiño, O. J.; Ávila, M. C.; Delgado, W. A.; Orduz, L. L.; Barrera, D.
A.; Alvárez, J. M.; Macías, V. E.; Parra, J. E.; Cuca, L. E. Screening preliminar de
aceites esenciales como insecticidas volátiles para el control del gorgojo del maíz.
XI Congreso Colombiano de Fitoquímica. Medellín, Colombia, 2011. Participación
en modalidad póster.
5. Prieto, J. A.; Patiño, O. J.; Ávila, M. C.; Delgado, W. A.; Cuca, L. E. Evaluación de
aceites
esenciales
de
aromáticas
tradicionales
como
posibles
agentes
bicontroladores del gorgojo del maíz (Sitophilus zeamais). XXIX Congreso
Latinoamericano de Química. Cartagena, Colombia, 2010. Participación en
modalidad póster.
Producción científica e Introducción
3
6. Prieto, J. A.; Patiño, O. J.; Moreno, J. P.; Delgado, W. A.; Cuca, L. E. Uso potencial
de aceites esenciales de especies del género Zanthoxylum como insecticidas y
antifúngicos. X Congreso Colombiano de Fitoquímica. Popayán, Colombia, 2009.
Participación en modalidad oral. 4° Puesto en la modalidad oral.
7. Prieto, J. A.; Patiño, O. J.; Pabón, L. C.; Delgado, W. A.; Cuca, L. E. Evaluación de
actividad fumigante de aceites esenciales como alternativa para el control del
gorgojo del arroz. X Congreso Colombiano de Fitoquímica. Popayán, Colombia,
2009. Participación en modalidad oral.
Introducción
La agricultura desempeña un papel importante en la supervivencia de los seres humanos
y animales, y además representa un factor económico, social y alimenticio de alta
importancia, particularmente en países en vía de desarrollo como Colombia. Las regiones
tropicales y subtropicales tienen un alto potencial para la producción de alimentos y
pueden producir múltiples cultivos anuales, sin embargo, las condiciones climáticas
agradables de estas zonas hacen que los productos agrícolas que se obtienen en países
tropicales y subtropicales sufran graves pérdidas debido al ataque de plagas, incluso
durante el almacenamiento (Dubey et al., 2011).
El deterioro de los productos alimenticios almacenados se debe principalmente a
insectos plaga, los cuales causan grandes pérdidas, especialmente en áreas húmedas y
cálidas del mundo, calculándose entre 20 y 30% en países tropicales (Rees, 2004). Los
efectos principales del ataque de plagas a granos almacenados son: pérdida de peso,
disminución de poder germinativo y cambios resultantes del calentamiento espontáneo
debido a la actividad de los insectos, y que conllevan a un ataque posterior por hongos,
además de pérdidas de valor nutritivo, sabor y olor (Haque et al., 2000).
Una de las plagas más comunes y que revisten mayor importancia económica y social a
nivel mundial por las pérdidas que producen en cereales como maíz, trigo, sorgo, arroz y
demás granos almacenados, son los insectos del género Sitophilus, conocidos
popularmente como gorgojos. Estos insectos son considerados como una plaga de
infestación primaria que afecta seriamente los granos, reduciendo la cantidad de
producto apto para consumo y la calidad del que queda disponible para comercializar (Liu
y Ho, 1999; FAO, 1983). Los principales representantes de este género son: S. zeamais
(gorgojo del maíz), S. oryzae (gorgojo del arroz) y S. granarius (Rees, 2004).
2
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea
longifolia (Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Los insectos del género Tribolium también son plagas importantes de productos
almacenados a nivel mundial. Estos insectos son considerados una plaga secundaria ya
que son incapaces de dañar el grano sano, limpio y seco. Los principales representantes
de este género son T. confusum y T. castaneum (gorgojo rojo del harina), siendo este
último el más peligroso debido a su capacidad de volar (Rees, 2004; FAO, 1983).
Para evitar o disminuir los efectos adversos que producen estos insectos, los controles
químicos o insecticidas convencionales ha sido la alternativa más utilizada, pero su uso
tiene importantes desventajas, pues muchos poseen efectos tóxicos inherentes que
ponen en peligro la salud de los operadores que los aplican, los consumidores y el medio
ambiente. Además de esto, muchas de las plagas tratadas han empezado a mostrar
resistencia ante algunos de estos plaguicidas, principalmente por su uso indiscriminado
(Kather, 2012; Prieto et al., 2009).
La tendencia actual hacia el mantenimiento de una agricultura sostenible ha conllevado a
buscar nuevas alternativas para reducir la incidencia de plagas y enfermedades que
afectan productos agrícolas sin que se altere el equilibrio en la naturaleza. En general, la
agricultura sostenible busca descubrir y desarrollar estrategias para el control de plagas
que sean de bajo costo y que causen mínimos efectos secundarios en el medio ambiente
(Kather, 2012; Dubey et al, 2011), y que permitan sustituir los productos químicos
utilizados actualmente. Para este fin las plantas pueden ser una fuente potencial para la
búsqueda de agentes fitosanitarios, si se considera que cada una de estas puede
contener centenares de metabolitos secundarios bioactivos y que muchos de estos son
producidos por las plantas como defensa química (Zoubiri y Baaliouamer, 2011; Newman
y Cragg, 2007; Colegate y Molyneux, 2008; Cragg et al., 2005), razón por la que es
importante explorar la actividad plaguicida de los productos obtenidos de plantas.
Actualmente, los estudios fitoquímicos han tomado gran impulso en la búsqueda de
sustancias útiles a nivel agrícola, con el fin de encontrar soluciones económicas y de bajo
impacto ambiental para controlar plagas. La flora colombiana, una de las más diversas a
nivel mundial, posee una amplia variedad de familias de plantas, donde Rutaceae,
Myristicaceae y Lauraceae son representativas. Estas familias se caracterizan por poseer
especies con diversidad de metabolitos secundarios que han mostrado significativa
actividad insecticida, antifúngica y/o antibacteriana. Las anteriores consideraciones
Producción científica e Introducción
3
hacen de estas familias objetos de interesantes estudios fitoquímicos y de actividad
biológica, y además si se tiene en cuenta que en el país a pesar de existir muchas
especies de estas familias no existe un estudio sistemático y químico completo.
En este contexto, el presente trabajo se planteó con el objetivo de contribuir a las
investigaciones dirigidas en la búsqueda de sustancias con posible uso en el sector
agrícola para el control de plagas de almacén, y hace parte de los resultados de
investigación de un macro-proyecto titulado: “Búsqueda de metabolitos secundarios con
propiedades insecticidas pertenecientes a las familias Myristicaceae, Rutaceae y
Lauraceae para el control de insectos plaga del género Sitophilus que atacan cereales
almacenados”, financiado por Colciencias y la Universidad Nacional en la Modalidad
Recuperación Contingente Año 2008.
La selección de las especies vegetales objeto de estudio fitoquímico se hizo con base en
los siguientes criterios: 1) resultados del screening preliminar de actividad antialimentaria
sobre S. zeamais, 2) estudio fitoquímico y cromatográfico preliminar y 3) antecedentes
bibliográficos. Teniendo en cuenta lo anterior, para el desarrollo de la tesis doctoral se
propuso realizar el aislamiento y caracterización de los metabolitos secundarios
presentes en hojas y madera de Compsoneura capitellata, corteza de Zanthoxylum
rigidum y corteza de Ocotea longifolia; la caracterización química de los aceites
esenciales de algunas especies de las familias Rutaceae, Myristicaceae y Lauraceae; y
la evaluación de la actividad insecticida sobre S. zeamais, S. oryzae y T. castaneum de
los extractos, fracciones, aceites esenciales y compuestos aislados.
La tesis doctoral está dividida en tres capítulos. El capítulo 1 describe el estado actual del
tema de trabajo. En el capítulo 2 se describe el estudio fitoquímico realizado en C.
capitellata, Z. rigidum y O. longifolia, junto con los resultado de actividad antialimentaria
sobre dos plagas de almacén de los extractos y compuestos aislados, contribuyendo así
a las investigaciones fitoquímicas y de actividad biológica de las espcies trabajadas. En
el capítulo 3 se presentan los resultados de la composición química y actividad
insecticida de aceites esenciales de algunas especies de las familias Lauraceae,
Myristicaceae y Rutaceae con lo que se contribuye a la caracterización química y
biológica de estas sustancias.
1. Estado Actual del Tema
1.1 Generalidades de la familia Myristicaceae
La familia Myristicaceae comprende aproximadamente 500 especies reunidas en 21
géneros, en donde se destacan especies por su importancia económica como Myristica
fragrans Houtt. (nuez moscada). Las especies de esta familia de angiospermas se
distribuyen a nivel mundial especialmente en regiones tropicales (Doyle et al, 2004;
Sauquet, 2004; Sauquet et al., 2003). Esta familia comprende árboles de gran porte, que
por lo general son de valor económico para la industria maderera. La mayoría de las
especies se caracterizan por la presencia de aceites esenciales en diferentes órganos y
porque de sus follajes y troncos se obtienen resinas o mucilagos, de color rojizo o
amarillento. (Taylor y Devia, 2000; Herrera, 1994).
Los metabolitos secundarios que se han encontrado en diferentes especies de esta
familia comprenden principalmente alcaloides triptamínicos y β-carbonílicos, flavonoides
de diversos tipos (iryantherinas, virolanos, virolanoles, dihidrochalconas, flavanas,
flavonas,
isoflavonas),
lignanos
(diarilbutánicos,
diarilbutirolactónicos
y
diariltetrahidrofuránicos), neolignanos, juruenólidos y tocotrienoles (Bernal y Cuca, 2009;
Martínez, 2000; Miles et al., 1987).
1.1.1 Aspectos generales del género Compsoneura
El género Compsoneura, perteneciente a la familia Myristicaceae, comprende alrededor
de 11 especies distribuidas desde el sur de México hasta la Amazonía de Brasil y Perú.
En Colombia se encuentra especies de este género en 13 de los 32 departamentos,
principalmente en bosques húmedos del Pacífico y la Amazonía (Herrera, 1994).
Las especies de este género son generalmente árboles de hasta 18 metros de altura, con
la corteza marrón, y exudado rojo. Las hojas son oblongo-elípticas, con la base aguda o
atenuada, y el ápice cuspidado y cortamente acuminado. Las inflorescencias son
6
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
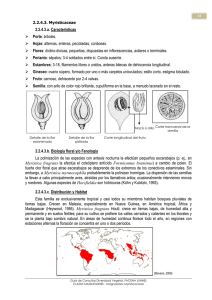
racemosas y se encuentran en las axilas de las hojas o en ramas defoliadas. Las flores
están agregadas al final de las ramas, en grupos de 2-3, y son de color amarillo. Los
frutos son elipsoides de color marrón-rojizo, carnosos y pubescentes en la superficie. En
la Figura 1.1 se ilustran las características morfológicas generales de especies del
género Compsoneura (Herrera, 1994; Chavarro, 1999).
C
B
A
A. hojas alternas, coriáceas, con margen entera, sin estípulas y con el pecíolo fuertemente canaliculado.
B. Las flores están agregadas al final de las ramas, en grupos y son de color amarillo. C. Los frutos son
cápsulas que, al igual que las semillas, son elipsoides a ovoides y subglobosas, presentando una sutura
longitudinal lisa. Las semillas están envueltas por un arilo vistoso, generalmente rojo y carnoso
Figura 1-1 Características morfológicas generales de especies del género Compsoneura.
Las especies del género Compsoneura se han utilizado principalmente con fines
alimenticios y maderables, y en menor proporción con fines medicinales humanos y
mágico-rituales. En la Tabla 1.1 se muestran los principales usos etnobotánicos dados en
Colombia de algunas especies de Compsoneura (Herrera, 1994).
Tabla 1-1 Usos etnobotánicos de algunas especies del género Compsoneura en Colombia.
ESPECIE
C. atopa
C. capitellata
C. rigidifolia
PARTE DE
LA PLANTA
Semilla
Tronco
Alimento
Maderable
Cocida o tostada.
Madera para construcción de casas
Semilla
Alimento
Sin cocer.
Tronco
Fruto
Maderable
Alimento
Construcción de casas.
Sin cocer.
USO
MODO DE USO
LUGAR
Costa Pacífica
Costa Pacífica
Caquetá, etnia
Miraña
Caquetá
Valle
Capítulo 1
7
Medicinal
Paludismo
MágicoRitual
Maderable
Corteza
C. sprucei
Ramas
C. trianae
Tronco
Se toma la infusión de corteza en agua.
Amazonas
Protectores simbólicos.
Amazonas
Tablas para cajas.
Amazonas
Estudios Fitoquímicos en el Género Compsoneura
Son pocos los estudios fitoquímicos realizados en especies del género Compsoneura y
en general se han encontrado compuestos fenolicos, flavonoides, derivados de ácidos y
lignanos. En un estudio realizado con hojas de diferentes especies colombianas del
género Compsoneura
se encontraron principalmente agliconas de flavonoides
(quercetina 1) y ácidos polihidroxilados derivados de ácido cinámico (ácido p-cumárico 2,
ácido caféico 3, ácido ferúlico 4 y ácido sinápico 5) y ácido benzóico (ácido gentísico 6 y
ácido siríngico 7) (Herrera, 1994). En estudio fitoquímico realizado en hojas y corteza de
C. atopa se reportó el aislamiento de dos lignanos diariltetrahidrofuránicos de la corteza,
lignanos conocidos como (+) verrucosin 8 y (+) 3,3-dimetoxilarreatricina 9 (Chavarro,
1999).
O
OH
R1
OH
OH
HO
HO
O
R2
O
OH
R3
2:
3:
4:
5:
OH
OH
O
1
HO
R1 = H; R2 = OH; R3 = H
R1 = H; R2 = OH; R3 = OH
R1 = H; R2 = OH; R3 = OMe
R1 = OMe; R2 = OH; R3 =OMe
HO
6
O
MeO
MeO
OMe
OH
7
O
HO
OMe
OH
MeO
O
HO
8
OMe
OH
9
1.2 Generalidades de la familia Lauraceae
La familia Lauraceae perteneciente a las Angiospermas del Orden Laurales, es una de
las cinco familias con mayor representación en cuanto al número de especies, consta de
56 géneros con más de 4000 especies. Su distribución es cosmopolita, pero
8
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
generalmente se encuentra en regiones tropicales y subtropicales (Van der Werff, 1991).
Las especies de esta familia generalmente son árboles o arbustos con hojas ricas en
glándulas con aceites esenciales (Rowher, 1993; Van der Weff, 1991). En Colombia
están presentes 18 géneros dentro de los que se encuentra Aniba, Cassytha,
Cinnamomum, Cryptocarya, Nectandra, Ocotea, Persea, entre otros. A esta familia
pertenecen diferentes especies de interés económico debido a que de ellas se obtienen
aceites esenciales, especias, frutos comestibles o maderas, siendo Persea americana
una de las especies más representativas, debido a que su fruto (aguacate) es comestible
y se usa para la obtención de aceites con aplicación en la industria cosmética (Pabón,
2009).
Son numerosos los reportes de estudios químicos para especies pertenecientes a la
familia Lauraceae, en los cuales se menciona que los principales componentes de
aceites esenciales corresponden a monoterpenos y sesquiterpenos (Prieto et al, 2010).
Otros metabolitos secundarios de amplia distribución en la familia son: alcaloides de tipo
aporfínico y bencilisoquinolínico (Pabón y Cuca, 2010; Zhao et al., 2006), lignanos (Yang
et al., 2009), neolignanos (Li et al., 2011; Rossi et al., 1997; Rippegur et al., 1996),
flavonoides (Feng et al., 2012; Murai et al., 2008; Rossi et al., 1997) y α-pironas (Nehme
et al., 2002; Cavalheiro y Yoshida, 2000; Drewes et al., 1996).
1.2.1 Aspectos generales del género Ocotea
El género Ocotea, uno de los más abundantes de la familia Lauraceae, cuenta con
aproximadamente 350 especies distribuidas principalmente en America y en Suráfrica.
En Colombia están presentes 35 especies de este género, distribuidas en todo el
territorio colombiano; principalmente en la Región Andina (Pabón y Cuca, 2010). Las
especies de este género se caracterizan por ser árboles o arbustos. Poseen hojas
lanceoladas, alternas, rara vez opuestas. Sus frutos son en forma de baya globosa con
una cúpula carnosa o endurecida que al madurar se torna de color negro. Sus flores se
presentan en panículas, poligamodioicas o bisexuales. Los tépalos de cáliz son 6 y
desiguales, poseen 9 estambres fértiles y anteras con 4 valvas (Van der Weff, 1991). En
la Figura 1.2 se ilustran características morfológicas generales de especies del género
Ocotea.
Capítulo 1
9
C
D
A
B
A. Especies son conocidas como “Aguacatillo” y se caracterizan por ser árboles o arbustos
siempre verdes. B. hojas lanceoladas, alternas, rara vez opuestas. C. Los Frutos son en
forma de baya globosa con una cúpula carnosa o endurecida que al madurar es de color
negro. D. Flores en panículas, poligamodioicas o bisexuales
Figura 1-2 Características morfológicas generales de especies del género Ocotea.
Especies del género Ocotea se caracterizan por su alto contenido de aceites esenciales,
razón por la que son apetecidas en la industria cosmética. La madera de las especies de
este género se caracteriza por su dureza y resistencia al ataque de los insectos, razón
por la que son ampliamente utilizadas con fines maderables; por tal motivo especies
como O. perubela, O. bullata y O. quixos se encuentran protegidas por su tala
indiscriminada (Pabón, 2009; Cárdenas y Salinas, 2006).
En medicina tradicional, las especies de Ocotea también presentan numerosos usos, tal
es el caso de O. quixos, que es utilizada como desinfectante, anestésico local y como
antidiarréico (Ballabeni et al., 2007). O. lancifolia como antiparasitario (Fournet et al.,
2007) y el aceite esencial de O. caparrapi es utilizado para las picaduras de insectos y
mordeduras de serpientes, así como para lesiones epiteliales, bronquitis y tumores
cancerígenos (Palomino et al., 1996).
Actividad biológica para el género Ocotea
Para especies de este género se han realizado varios estudios de actividad que incluyen
evaluación de actividad antiparasitaria, antiplaquetaria, antiinflamatoria, antimicrobiana e
10
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
insecticida principalmente. Por ejemplo, el extracto alcaloidal de O. lancifolia presentó
actividad antiparasitaria contra tres líneas de promastigote del género Leshmania: L.
braziliensis, L. amazonensis y L. donovani (Fournet et al., 2007). Las hojas de O. duckei
presentaron actividad mutagénica contra la especie Salmonella typhimurium (Marques et
al., 2003). La actividad antiinflamatoria ha sido encontrada para la corteza y hojas de O.
bullata (Zchocke et al., 2000), y para el aceite esencial de la especie O. quixos (Bruni et
al., 2004), cuyos componentes principales son trans-cinamaldehído (27.8%) y cinamato
de metilo (21.6%). Para este aceite también se ha reportado actividad antiplaquetaria en
roedores (Ballabeni et al., 2007).
El aceite esencial de hojas de O. longifolia presentó actividad insecticida sobre Sitophilus
zeamais, una importante plaga de productos almacenados (Prieto et al., 2010). El
extracto etanólico y el alcaloide (+)-dicentrina obtenidos de la corteza de O. velloziana
exhibieron actividad insecticida sobre larvas de Aedes aegypti (Garcez et al., 2009). En la
Tabla 1.2, se muestran algunos reportes de actividad biológica para algunas sustancias
aisladas de especies del género Ocotea.
Tabla 1-2 Actividad Biológica de algunos metabolitos secundarios aislados de especies del
género Ocotea.
ESPECIE
O. lancifolia
O. bullata
O. duckei
O. velloziana
SUSTANCIA AISLADA
Alcaloides:
Domesticina
Nordomesticina
Neolignano:
Ocobullenona
Lignano:
Yangambina
Alcaloide:
Reticulina
Alcaloide:
(+)-dicentrina
ACTIVIDAD
REFERENCIA
Actividad Leishmanicida
Fournet et al., 2007.
Actividad antiinflamatoria
Zschocke et al.,
2000.
Actividad antiplaquetaria
Disminución
de
la
coordinación motora
Actividad larvicida contra
Aedes aegypti.
Marques et al., 2007.
Morais et al., 1998.
Garcez et al., 2009.
Estudios Fitoquímicos para el Género Ocotea
El mayor número de reportes para las especies de este género, consisten en la
determinación de la composición química de sus aceites esenciales. El estudio de la
composición del aceite esencial de 10 especies del género Ocotea mostró la presencia
de algunos componentes comunes en todas las especies como β-cariofileno 10, αhumuleno 11, germacreno-D 12, γ-cadineno 13, δ-cadineno 14 (Takaku et al., 2007),
Capítulo 1
11
compuestos que también fueron encontrados en los aceites esenciales de hojas de O.
macrophylla y O. longifolia (Prieto et al., 2010).
10
11
12
13
14
Los lignanos y neolignanos han sido aislados de diferentes especies del género Ocotea,
y prácticamente se han encontrado en todas las partes de la planta (madera, corteza,
raíces, hojas y frutos). Lignanos de tipo tetrahidrofuránico como 2-(2',5'-dimetoxifenil)-3,4dimetil-5-(3", 4", 5"-trimetoxifenil)-tetrahidrofurano 15 han sido aislados de hojas de O.
foetens (López et al., 1995) y lignanos furofuránicos como la yangambina 16 han sido
aislados de las hojas de O. duckei (Marques et al., 2003). Neolignanos benzofuránicos
como la burchelina B 17 han sido encontrados en O. cymbarum y O. catharinensis
(Cabral et al., 2010; Lordello y Yoshida, 1997), y neolignanos biciclo[3.2.1]octánicos,
como la iso-ocobullenona 18 y otras ocobullenonas han sido aisladas de corteza de O.
bullata y de hojas de O. catharinensis (Zschocke et al., 2000; Lordello y Yoshida, 1997,
Drewes et al., 1995).
OMe
OMe
O
OMe
MeO
O
OMe
H
MeO
OMe
OMe
15
H
OMe
O
MeO
16
MeO
O
O
O
OMe
O
O
O
O
O
17
O
18
Alcaloides aporfínicos y bencilisoquinolínicos son los principalmente reportados para
especies del género Ocotea. Varios alcaloides aporfínicos han sido aislados de la
12
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
madera de O. macrophylla, como lo son (S)-3-metoxi-nordomesticina 19, (S)-Netoxicarbonil-3-metoxi-nordomesticina 20, (S)-N-formil-3-metoxi-nordomesticina 21 y (S)N-metoxicarbonil-3-metoxi-nordomesticina
22
(Pabón
y
Cuca,
2010).
Alcaloides
bencilisoquinolínicos como coclaurina 23 y reticulina 24 han sido aislados de O. duckei
(Silva et al., 2002) y de la corteza de O. caparrapi (Cuca, 1980), respectivamente.
OMe
MeO
MeO
MeO
N
R
H
HO
19: R = H
20: R = COOCH2CH3
21: R = CHO
22: R = COOCH3
O
NH
HO
H3CO
HO
OH
23
O
N
HO
24
Los flavonoides son otros metabolitos encontrados en diversas especies del género
Ocotea. En la especie O. vellosiana se han aislado glicósidos de flavonoides como
quercetina 3-O-rhamnósido 25 y astragalina 3-O-β-D-glucósido 26 (Garcez et al., 1995).
En estudios recientes se reporta el aislamiento de quercetina 3-O-β-D-glucosido 27,
quercetina 3-O-β-D-galactósido 28, quercetina 3-O-xilosido 29, de las hojas de O.
corymbosa (de Luca-Batista et al., 2010).
OH
OH
HO
HO
O
OH
OR
OH
O
25: R = Rhamnosa
27: R = Glucosa
28: R = Galactosa
29: R = Xilosa
O
O-Glu
OH
O
26
1.3 Generalidades de la familia Rutaceae
La familia Rutaceae está conformada en su mayoría por árboles, arbustos y enredaderas
leñosas que crecen en regiones tropicales y subtropicales. Está compuesta por
aproximadamente 1815 especies que se distribuyen en 161 géneros (Wei et al, 2012).
Las especies de esta familia son ampliamente conocidas por su importancia económica,
las más notables son las especies del género Citrus que producen tanto los frutos
comestibles comercializables (limones, naranjas, mandarinas, toronjas, etc) y aceites
esenciales utilizados en perfumería. Las especies de Pilocarpus también son
Capítulo 1
13
importantes, pues son fuente de pilocarpina, un fármaco utilizado para tratar el glaucoma,
y las especies de Boronia, Choisya, Poncirus y Skimmia también son conocidas, pues se
utilizan como plantas ornamentales (Seidemann, 2005; Chase et al., 1999).
Los metabolitos más comunes dentro de las especies de esta familia son: alcaloides,
cumarinas, flavonoides, lignanos, terpenos, crómanos y amidas, entre otros (Patiño y
Cuca, 2010; Cuca et al., 1998; Waterman y Grundon, 1983).
1.3.1 Aspectos generales del género Zanthoxylum
El género Zanthoxylum pertenece a la familia Rutaceae, y su nombre se deriva de la
palabra Xanthoxylum que proviene del vocablo griego: "xanthon xylon" que significa
"madera amarilla", y es debido a esto que es común que los autores empleen la palabra
Xanthoxylum ó Zanthoxylum (Chaaib, 2004).
Zanthoxylum comprende alrededor de 549 especies distribuidas a nivel mundial,
principalmente en regiones tropicales y templadas (Global Biodiversity Information
Facility, 2012). Este género incluye árboles y arbustos generalmente dioicos. Las
especies de este género se caracterizan por la presencia de espinas recurvadas a lo
largo del tronco y de las ramas. Las hojas son variadas, pueden ser alternas u opuestas,
simples o compuestas. Las inflorescencias están generalmente en forma de panículas o
umbelas compuestas, axilares o terminales con flores pequeñas. Las flores son
actinomorfas, hermafroditas y unisexuales, raramente bisexuales y generalmente blancas
o verdes. Los frutos son folículos o esquizocarpos, contienen de uno a cinco carpelos,
generalmente aromáticas, y de color rojo o negro con semillas brillantes (Melo y Zickel,
2004, Silva y Paoli, 2000). Las características morfológicas generales de especies del
género Zanthoxylum se muestran en la Figura 1.3 (Patiño, 2004).
Las especies de este género son de importancia económica como fuente de frutos
comestibles, aceites, madera, materias primas para diversas industrias, plantas
medicinales, plantas ornamentales y productos con aplicaciones culinarias. Por ejemplo,
en África se utiliza la madera de Z. gillettii, Z. tessmannii, Z. lemairei y Z. leprieurii en la
construcción de casas, edificios, barcos y muebles de madera decorativos, y de la
industria del papel; mientras que la corteza de raíz y tallo de muchas especies de
14
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Zanthoxylum se emplean como vermífugos, febrífugos y piscicidas (Yang, 2008, Adesina,
2005; Seidemann, 2005).
B
C
D
A
A. Hábito: árboles y arbustos con espinas recurvadas a lo largo del tronco y de las ramas. B. Las hojas son variadas,
generalmente opuestas. C. Los frutos son folículos o esquizocarpos y de color rojo o negro con semillas brillantes.
D. Las inflorescencias están generalmente en forma de panículas o umbelas compuestas, axilares o terminales con flores
pequeñas generalmente blancas o verdes.
Figura 1-3 Características morfológicas generales de especies del género Zanthoxylum.
Las especies de Zanthoxylum también son usadas en el campo de la perfumería y en la
industria alimenticia por los aceites esenciales que se obtiene de hojas, frutos e
inflorescencias. Por ejemplo, los aceites esenciales de Z. xanthoxyloides (Ngassoum et
al., 2003), Z. gillettii (Jirovetz et al., 1999) y Z. simulans (Chyau et al., 1996) han sido
ampliamente usados a nivel industrial. Una característica común de casi todas las
especies del género Zanthoxylum es la capacidad de producir resinas o latex, que
podrían ser utilizadas en la industria farmacéutica como encapsulantes, agentes
emulsionantes o diluyentes. Algunas investigaciones se han llevado a cabo con el latex
recogido de la corteza de Z. tessmannii (Adesina, 2005).
Muchas especies del género Zanthoxylum han sido utilizadas en diferentes partes del
mundo, especialmente en Asia, África y América para tratar diferentes enfermedades en
humanos y animales (Adesina, 2005; Chaaib, 2004; Diéguez et al., 2003; Patiño, 2004).
Las propiedades etnobotánicas principales que son atribuidas a las especies de este
género son: alivio de problemas dentales, tratamiento de malaria, trastornos
Capítulo 1
15
gastrointestinales, gonorrea, reumatismo y enfermedades pulmonares, de la piel y
genitourinarias, uso como anti-diarreico y anti-helmíntico en animales y seres humanos,
febrífugo, antihemorrágico, diurético y anti-convulsivo (Patiño et al, 2012).
Además de las propiedades medicinales, algunas especies del género Zanthoxylum
también se utilizan como materiales de construcción, pesticidas y como colorantes de
textiles. Por ejemplo, se ha reportado que la decocción de hojas y pericarpio de Z.
dipetalum y de Z. hawaiiense (Marr y Tang, 1992) y la decocción de las raíces de Z.
nitidum (Bhattacharya et al., 2009) son utilizados como insecticidas contra diversas
especies de insectos que atacan a los seres humanos y a productos de interés
económico.
Actividad Biológica para el género Zanthoxylum
El género Zanthoxylum es bien conocido por su diversidad química y por sus amplias
aplicaciones etnobotánicas, características que han sido la base para desarrollar diversos
estudios de actividad biológica, que han ayudado a encontrar nuevos extractos y
compuestos bioactivos. Las actividades biológicas de muchas especies de Zanthoxylum
están principalmente asociadas con la evaluación de actividad antimicrobiana,
insecticida, anti-inflamatoria, antioxidante, antiparasitaria, antitumoral, anti-helmíntica y
antiviral, así como estudios de inhibición enzimática y efectos sobre el sistema nervioso
central y sobre componentes celulares de la sangre (Patiño et al., 2012). En la Tabla 1.3
se resumen algunos resultados de ensayos de actividad biológica, principalmente de tipo
insecticida, realizados en algunas especies del género Zanthoxylum.
Tabla 1-3 Reportes de actividad biológica para algunas especies del género Zanthoxylum.
ESPECIE
PARTE EVALUADA
Extracto metanólico y algunos
constituyentes de las raíces
ACTIVIDAD BIOLÓGICA
Actividad antifúngica e
inhibición de la enzima
acetilcolinesterasa.
REFERENCIA
Queiroz et al., 2006
Z. xanthoxyloides
Extractos
metanólicos
hojas, corteza y raíz
Z. usambarense
Z. armatum
de
Extracto metanólico de corteza
de raíz, corteza y hojas.
Aceite esencial de semillas
Actividad insecticida sobre
Sitophilus
zeamais
y
Callosobruchus maculatus
Actividad
antimicrobiana,
insecticida, antiinflamatoria.
Actividad larvicida sobre A.
aegypti, A. stephensi y C.
quinquefasciatus.
Udo, 2011
Matu
2003
y
Staden,
Tiwary et al., 2007
16
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Z. macrophylla
Alcaloides
obtenidos
de
corteza:
arborinina,
tembetarina,
xanthoxolina,
1-hidroxi-3-metoxi-N-metilacridona y magnoflorina.
Z. schinifolium
Extracto metanólico de frutos
Z. limonella
Z. bungeanum
Z. lemairei
Z. piperitum
Aceite esencial
Extracto CH 2 Cl 2 de frutos y
piperitona,
linalool
y
4terpineol
Alcaloides
obtenidos
del
extracto metanólico de raíz:
10-O-demetil-17-Ometilisoarnottianamida,
6acetonil-N-metildihidrodecarina,
nitidina
y
queleritrina
Actividad antialimentaria en
larvas
de
Spodoptera
frugiperda y S. littoralis
Actividad antialimentaria en
larvas
de
Attagenus
unicolor japonicus
Actividad larvicida sobre
Aedes dirus y A. aegypti
Actividad repelente sobre
hormigas
del
género
Crematogaster.
Actividad larvicida
Anopheles gambiae
sobre
Tringali et al., 2001
Han et al., 2006
Pitasawat
2007
el
at.,
Bowers et al., 1993
Talontsi et al., 2011
Actividad repelente contra
Armigeres subalbatus
Nerio et al., 2010
Actividad fumigante contra
Callosobruchus chinensis
Kim et al., 2003
Aceite esencial de frutos
Estudios Fitoquímicos para el Género Zanthoxylum
Los estudios fitoquímicos llevados a cabo en especies de este género han permitido el
aislamiento de alcaloides de diversos tipos, lignanos, cumarinas y amidas; metabolitos
secundarios que tienen importancia quimiotaxonómica para el género Zanthoxylum.
También han sido aislados otros metabolitos como flavonoides, esteroles y terpenos
(Patiño et al., 2012).
Los alcaloides son los compuestos más importantes en el género Zanthoxylum, pues
están presentes en la mayoría de las especies y se han encontrado en todos los órganos
de la planta, siendo abundantes en el tronco y en la corteza de la raíz (Diéguez et al.,
2003). Los alcaloides que principalmente se han reportado en son de dos tipos:
isoquinolínicos (benzofenantridinas, bencilisoquinolinas, aporfiinas, protoberberinas and
berberinas) y quinolínicos (Krane et al. 1984; Waterman y Grundon, 1983; Cordell, 1981).
Las benzofenatridinas son los alcaloides más reportados en el género Zanthoxylum y son
importantes debido a la interesante y variada actividad biológica que han exhibido estas
sustancias (Maiti y Kumar, 2009; Tillequin, 2007, Maiti y Kumar, 2007, Dvorak et al.,
Capítulo 1
17
2006, Nyangulu et al., 2005, Eun y Koh, 2004, Tang et al. 2003; Slaninová et al., 2001,
Simeon et al., 1989). La distribución de este tipo de alcaloides en platas es limitada, y
solo han sido aislados de algunos géneros de las familias Papaveraceae, Rutaceae y
Fumiraceae principalmente, donde son considerados marcadores quimiotaxonómicos
(Krane et al., 1984; Cordell, 1981). Los principlaes representantes de los alcaloides
benzofenantridínicos son: fagaronina 30, nitidina 31, queleritrina 32y sanguinarina 33,
compuestos que han sido aislados de varias especies del género Zanthoxylum (Krane et
al., 1984).
R1
R5
R2
N+
R4
30:
31:
32:
33:
R1 = OH; R2 = OMe; R3 = H; R4 = R5 = OMe
R1 + R2 = OCH2O; R3 = H; R4 = R5 = OMe
R1 + R2 = OCH2O; R3 = R4 = OMe; R5 = H
R1 + R2 = R3 + R4 = OCH2O; R5 = H
R3
Los alcaloides bencilisoquinolinicos también tienen distribución restringida en plantas. En
el género Zanthoxylum no son muy típicos, pero se han encontrado en algunas especies,
como es el caso de los alcaloide cuaternarios (R)-(+)- isotembetarina 34 y (S)-(-)xylopinidina 35 aislados de la corteza de of Z. quinduense (Patiño y Cuca, 2010). Las
berberinas y protoberberinas han sido reportadas en muchas especies del género
Zanthoxylum,
por
ejemplo,
alcaloides
tetrahidroberberínicos
como
N-
metiltetrahidrocolumbamina 36 y N-metiltetrahidropalmatina 37 han sido aislados de
corteza de Z. quinduense (Patiño y Cuca, 2010). La berberina 38 es el alcaloide
generalmente responsable del color amarillo observado en madera y corteza de algunas
especies de Zanthoxylum, como es el caso de Z. monophyllum, especie que es
ampliamente utilizada como colorante (Patiño y Cuca, 2011). En el género Zanthoxylum,
los alcaloides aporfínicos no son los más representativos, pero han sido aislados de
varias especies y son importantes debido a su actividad antitumoral (Adesina, 2005). Por
ejemplo, la N,N-dimetillindicarpina 39, obtenida de la corteza de la raíz de Z.
zanthoxyloides (Queiroz et al., 2006).
18
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
MeO
HO
N+
MeO
N+
MeO
OH
OH
N+
RO
OMe
HO
36: R = H
OMe
34
35
MeO
OMe
37: R = CH3
HO
O
N+
O
38
N+
MeO
OMe
HO
OMe
MeO
39
Los alcaloides quinolínicos son muy comunes en el género Zanthoxylum, y usualmente
se encuentran de dos tipos: furoquinolinas y piranoquinolinas. La mayoría de estos
alcaloides se caracterizan por tener un grupo carbonilo en la posición 2 del núcleo
quinolínico simple y son llamados 2-quinolonas (Waterman y Grundon, 1983). Alcaloides
de este tipo han sido aislados de la corteza de Z. budrunga, encontrando dos
piranoquinolinas: N-metilflindersina 40 y zanthobungeanina 41, junto con dos
furoquinolinas: dictamina 42 y skimmianina 43 (Rahman et al., 2005). De Z simulans
también se han aislado alcaloides piranoquinolínicos como zhantosimulina 44 y
huajiaosimulina 45, los dos con actividad citotóxica (Chen et al., 1994).
OMe
O
40: R = H
41: R = OMe
N
O
42: R1 = R2 = H
R2
O
N
43: R1 = R2 = OMe
R1
R
O
O
O
N
N
O
44
O
45
Alcaloides de tipo bishoderninilterpénicos, indolopiridoquinazolínicos, canthin-6-ona,
quinazolínicos y carbazólicos, entre otros, no son muy comunes en el género
Capítulo 1
19
Zanthoxylum y han sido encontrados en especies muy particulares. Alcaloides
bishoderninilterpénicos como 46 han sido aislados de hojas de Z. integrifoliolum (Liu et
al.,
2000).
Alcaloides
indolopiridoquinazolínicos
como
1-hidroxirutaecarpina
47,
rutaecarpina 48, y 1-metoxirutaecarpina 49 han sido obtenidos de frutos de Z.
integrifoliolum (Sheen et al., 1996). Los alcaloides canthin-6-ona son raros en la familia
Rutaceae, pero se han encontrado en algunos géneros incluyendo Zanthoxylum. Por
ejemplo, de Z. rugosum (Diehl et al., 2000), Z. chiloperone (Ferreira et al., 2002) y Z.
budrunga (Rahman et al., 2005) han sido aislados canthin-6-ona 50 y 5-metoxicanthin-6ona 51. Alcaloides quinazolínicos has sido aislados de Z. budrunga, como es el caso de
lunacridina 52 (Ahmad et al., 2003). Alcaloides carbazólicos como 3-metoxi-9-metil-9Hcarbazol-2-ol 53 se han aislado de madera de Z. rhoifolium (Taborda y Cuca, 2007).
Actualmente, de la corteza de Z. monophyllum fue aislado un alcaloide derivado de
prolina y denominado monophyllidina 54 (Patiño y Cuca, 2011).
OH
N
N
H
O
N
N
N
O
47: R = OH
R
R
48: R = H
46
N
O
50: R = H
51: R = OMe
49: R = OMe
O
OMe
O
N
OMe
HO
N
N
H
N
OH
HO
53
52
54
OMe
O
Diferentes tipos de lignanos han sido reportados en muchas especies de la familia
Rutaceae, pero en el género Zanthoxylum los lignanos más reportados son de dos tipos:
diarilbutirolactónicos
y
2,6-diaril-3,7-dioxabiciclo[3.3.0]octánicos
(Adesina,
2005;
Waterman y Grundon, 1983). Lignanos furofuránicos como syringaresinol 55 fueron
obtenidos de Z. quinduense y Z. monophyllum (Patiño y Cuca, 2010; 2011). De Z
integrifoliolum (Chen et al., 1999), Z. culantrillo (Cuca et al., 1998) y Z. naranjillo (Bastos
et al., 1999) ha sido aislado (+)-sesamina 56. Lignanos diarilbutirolactónicos como (-)cubebina 57 han sido aislados de Z. monophyllum (Cuca et al., 1998) y Z. naranjillo
20
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
(Bastos et al., 1999). Un nor-neolignano, ailanthoidol 58, fue aislado de la madera de Z.
ailanthoides (Sheen et al., 1994).
OMe
O
OH
O
MeO
O
H
O
O
O
HO
O
OMe
H
OH
O
O
H
H
H
H
O
O
55
57
56
O
MeO
O
OH
HO
O
MeO
OMe
58
El género Zanthoxylum se caracteriza por la presencia de diferentes tipos de cumarinas
(simples, lineares, dihidrofurocumarinas, furocumarinas y piranocumarinas). Las
dihidrofurocumarinas lineares y angulares han sido identificadas en diferentes especies
de este género, pero las dihidrofurocumarinas angulares no son comunes en especies de
la familia Rutaceae, razón por la que se conocen como sustancias de valor
quimiotaxonómico para el género Zanthoxylum (Murray et al., 1982; Waterman y
Grundon, 1983). De Z. schinifolium fueron aisladas las terpenilcumarina conocidas como
larcinatina 59, aurapteno 60 y collinina 61 (Tsai et al., 2000). Furanocumarinas con
actividad citotóxica contra diversas líneas tumorales humanas han sido encontradas en
Z. americanum, por ejemplo psoraleno 62 (Saquib et al., 1990).
O
O
OMe
59
O
O
O
O
O
O
R
60: R = H
62
61: R = OMe
Las amidas son compuestos de gran importancia quimiotaxonómica para el género
Zanthoxylum y han sido encontradas principalmente en el pericarpio de los frutos, tallos y
raíces. Este género se caracteriza químicamente por la frecuente acumulación de
O
Capítulo 1
21
alcamidas olefínicas (Adesina, 2005; Chaaib, 2004). Un ejemplo de este tipo de amidas
es el α-sanshool 63, aislado de Z. liebmannianum (Navarrete y Hong, 1996). Otro tipo de
amidas encontradas en especies de Zanthoxylum son las amidas aromáticas descritas en
ocasiones como alcaloides o trans-cinnamoilamidas. Un ejemplo típico de este tipo de
amidas es la syncarpamida 64, aislada de Z. syncarpum (Ross et al., 2004).
MeO
O
O
MeO
N
H
OH
63
N
H
64
En el género Zanthoxylum los flavonoides encontrados principalmente son glicosidos de
flavonas, flavonoles y flavanonas. Los flavonoides encontrados en especies de
Zanthoxylum, al igual que los aislados de otros géneros de la familia Rutaceae, se
caracterizan por estar polimetoxilados (Waterman y Grundon, 1983). Una investigación
llevada a cabo con frutos de Z. integrifoliolum permitió el aislamiento de 3,5diacetiltambuline 65 (Chen et al., 1999).
OMe
OMe
MeO
O
OAc
OAc
O
65
Los esteroles son componentes comunes en la mayoría de las plantas. Mientras que βsitosterol 66 está presente en todas las plantas, el triterpeno lupeol 67 está presente
principalmente en especies del género Zanthoxylum. Lupeol, β-sitosterol, generalmente
asociados con estigmasterol 68, campesterol 69 y β-amirina 70 han sido aislados de
varios órganos vegetales de la mayoría de especies del género Zanthoxylum estudiadas
hasta el momento (Adesina, 2005).
22
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
R
HO
66: R = CH2CH3
HO
67
68: R = CH3
HO
HO
69
70
1.4 Biología y comportamiento de plagas de almacén:
Especies del género Sitophilus y Tribolium
Teniendo en cuenta el número de especies conocidas hasta el momento, los insectos
son las especies más abundantes y diversas a lo largo de la vida de la tierra. Los
insectos se dividen en 32 órdenes, y sólo a tres de ellos, Coleóptera (escarabajos),
Lepidóptera (polillas) y Psocóptera (psócidos o piojos de los libros) pertenecen las
principales plagas de productos almacenados. Insectos de otros órdenes pueden
aparecer en productos almacenados por accidente o debido a que son depredadores de
las plagas de almacén (Rees, 2004).
Desde hace 10000 años la sociedad humana comenzó a producir y almacenar grandes
cantidades de productos orgánicos secos como granos, fibras y pieles; pero estos
nuevos recursos atrajeron a un selecto grupo de insectos que se alimentan de estos
materiales de origen vegetal y animal. Un amplio número de plagas de almacén han sido
asociadas con la actividad humana. Originalmente, muchas especies tenían una
distribución restringida, pero miles de años de comercio han conllevado a una
distribución cosmopolita de la mayoría de las plagas de almacén (Rajendran y Hajira,
2005; Cox y Collins, 2002).
Capítulo 1
23
La infestación de productos almacenados por insectos conlleva a una variedad de daños
y pérdidas económicas. Las regiones tropicales como Colombia, que dependen de la
agricultura, son especialmente vulnerables a las pérdidas ocasionadas por el ataque de
insectos de almacén. Se estima que las pérdidas anuales de productos almacenados en
estas regiones son superiores al 20% (Moreira et al, 2007).
Los insectos que infestan productos almacenados se clasifican de acuerdo a su forma de
alimentación y al entorno en el que habitan, de la siguiente manera: 1) Consumidores de
productos básicos (plagas primarias y secundarias); 2) consumidores de hongos; 3)
depredadores; 4) parasitoides; 5) recolectores de residuos y 6) forrajeros y accidentales
(Rees, 2004). En particular los insectos pertenecientes al los géneros Sitophilus y
Tribolium pertenecen a los consumidores de productos básicos. Este tipo de insectos se
alimentan directamente de un producto, principalmente de semillas y productos derivados
de ellas. Se dividen en plagas primarias (capaces de atacar productos intactos) y
secundarias (requieren de un producto previamente dañado para poder atacarlo) (López,
2008; FAO, 1983).
1.4.1 Insectos del género Sitophilus
Las especies del género Sitophilus, conocidos popularmente como gorgojos, son una de
las plagas más comunes y de mayor importancia económica y social a nivel mundial por
las pérdidas que producen en cereales como maíz, trigo, sorgo, arroz y demás granos
almacenados. Estos insectos son una plaga de distribución cosmopolita e infestación
primaria que causan efectos desfavorables en la calidad, seguridad y conservación de los
granos (Kim et al., 2003; Park et al., 2003; Isman, 2000; Liu y Ho., 1999). Atacan
principalmente cereales, tanto en campo como en almacén. El adulto y las larvas se
alimentan vorazmente de los granos como trigo, maíz, arroz, sorgo, cebada, avena,
centeno. Ocasionalmente se ha encontrado en productos molidos, aunque difícilmente se
multiplica en este medio. La alimentación de las larvas de Sitophilus deja grandes
cavidades dentro de los granos y los adultos al emerger dejan grandes agujeros
irregulares en los granos. Los adultos causan daños posteriores por el ataque de granos
dañados. La infestación por Sitophilus spp. produce una gran cantidad de calor y
humedad, lo que favorece la pérdida de calidad del grano, el crecimiento del hongos y de
poblaciones de otras especies de insectos. Los principales representantes de este
24
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
género son: S. zeamais (gorgojo del maíz), S. oryzae (gorgojo del arroz) y S. granarius
(Rees, 2004). Los insectos del género Sitophilus se clasifican taxonómicamente de la
siguiente manera (Jiménez, 1991):
Reino: Animal
Philum: Artrópoda
Subphilum: Mandibulata
Clase: Insecta
Subclase: Pterigota
Orden: Coleóptera
Suborden: Polifaga
Familia: Curculionidea
Género: Sitophilus
Sitophilus oryzae
Ciclo de vida
En la Figura 1.4 se observa el ciclo de vida de los insectos del género Sitophilus. La
hembra deposita el huevo en pequeñas cavidades escavadas por ella, colocando de 8 a
10 huevos diarios. El huevo mide 0,7 mm aproximadamente, tiene forma ovalada y
eclosiona después de tres a cinco días de ovipositado, dependiendo de la temperatura.
Las larvas son ápodas, pequeñas, de color blanco perlado y cuerpo grueso, con cabeza
pequeña y de forma cuneiforme. Posee cuatro estadios larvales por los cuales pasa en
un período de 19 a 34 días. Las larvas son caníbales, por lo tanto las larvas grandes
pueden comerse a las larvas de menor tamaño.
Figura 1-4 Ciclo de vida de insectos plaga del género Sitophilus
Las pupas recién formadas son de color blanco, con algo de semejanza al adulto, con
cabeza redonda y probosis larga, con patas dirigidas hacia el cuerpo y alas cubriéndolo.
Capítulo 1
25
Tarda de tres a seis días en el proceso de pasar de ninfa a adulto. El gorgojo ya
desarrollado tiene una longitud entre 2,1 y 2,8 mm, de color café oscuro o negro, cuerpo
cilíndrico, cabeza prolongada en pico, soporta un par de mandíbulas resistentes. Los
élitros tienen en sus ángulos posteriores 4 manchas de color rojizo y alas funcionales
(Campbell, 2002; Jiménez, 1991).
1.4.2 Insectos del género Tribolium
El género Tribolium está constituido por aproximadamente 30 especies. Varias especies
de este género están asociadas con productos almacenados; entre ellas se encuentran
T. castaneum (gorgojo rojo del harina) y T. confusum como una de las plagas más
importantes de productos almacenados en todo el mundo, pero la capacidad de T.
castaneum de volar lo hace más peligroso que T. confusum. Estos insectos atacan
prácticamente cualquier material de origen animal o vegetal, pero son especialmente
importantes como plagas de almacén. Se alimentan principalmente de cereales partidos
o dañados por otros insectos, productos de molienda de cereales, harinas, semillas de
oleaginosas y sus productos, galletas, nueces partidas y otros productos suaves o
dañados. Los insectos de este género son considerados como plaga de infestación
secundaria de los cereales ya que es incapaz de dañar el grano sano, limpio y seco.
Tanto el adulto como las larvas se alimentan de cereales partidos o dañados y sus
productos. Se considera una plaga primaria para los productos de molienda de cereales,
legumbres y oleaginosas. Es muy común encontrarlos en molinos de trigo y diversas
fábricas que trabajan con cereales molidos. El daño causado específicamente por este
insecto no es fácilmente identificable. Las infestaciones pueden dar lugar a la
persistencia de olores y colores desagradables en el producto debido a la secreción de
benzoquinonas por las glándulas abdominales. Los insectos del género Tribolium se
clasifican taxonómicamente de la siguiente manera (Rees, 2004; FAO, 1983):
Reino: Animal
Philum: Artrópoda
Subphilum: Hexapoda
Clase: Insecta
Orden: Coleóptera
Suborden: Polifaga
Familia: Tenebrionidae
Género: Tribolium
Tribolium castaneum
26
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Ciclo de vida
La hembra oviposita hasta 450 huevos entre la harina o residuos de los granos. Los
huevos están cubiertos con una secreción pegajosa que permite que se adhiera a la
superficie del huevo de harina u otras partículas, facilitando así la infestación. Los huevos
incuban entre 5 y 12 días, dando origen a larvas son elateriformes pequeñas, delgadas,
cilíndricas que llegan a medir 5 mm de longitud, de color blanco matizado a amarillo. Las
larvas se alimentan de la materia prima infestada y de otros insectos. El canibalismo
entre las larvas y los adultos es común. Las larvas de plena madurez de T. castaneum
llegan a medir hasta 10 mm de largo. La pupa al principio es blanca, gradualmente
cambia a amarillo, después a café y finalmente se transforma en adulto. El ciclo completo
demora de 5 a 8 semanas y los adultos viven de 12 a 18 meses. El cuerpo de los adultos
es de forma alargada y ligeramente plana. Posee antenas que se ensanchan
gradualmente desde la base hasta los extremos, ojos pequeños y redondos. Protórax
densamente cubierto con diminutos puntos negros. Los élitros tienen bandas
longitudinales difíciles de ver a simple vista. El adulto mide de 3 a 4 mm, T. castaneum es
de color café rojizo brillante y T. confusum es de color café opaco (Rees, 2004; FAO,
1983). En la Figura 1.5 se observa el ciclo de vida de los insectos del género Tribolium.
Figura 1-5 Ciclo de vida de insectos plaga del género Tribolium
1.5 Daños y pérdidas causados por plagas de almacén
Debido a las condiciones ambientales existentes en los silos de almacenamiento, la
mayoría de las plagas tienen un desarrollo óptimo y rápido, alcanzando con prontitud la
madurez sexual. Como resultado, la velocidad de crecimiento es muy alta y las
poblaciones aumentan con rapidez, a tal punto que en pocos meses, una sola pareja de
Capítulo 1
27
insectos pude desarrollar una progenie suficiente para infestar varias toneladas de
producto. Los daños causados por una especie insectil, se miden por la intensidad de
daño causado, el cual está en función de la densidad de población de insectos presentes.
A nivel mundial, las pérdidas ocasionadas por los insectos en granos y cereales
almacenados, oscila entre el 10 y 50% de la producción anual. Los daños causados por
los insectos pueden dividirse en dos categorías: daños directos y daños indirectos (De
los Mozos, 1997; Jiménez, 1995).
Daños directos:
Son los daños más notables y son producidos por la alimentación de la plaga sobre el
producto. Pueden ser causados por larvas y adultos, o bien exclusivamente por las
larvas. La mayor parte de los coleópteros de almacén, incluidos Sitophilus spp. y
Tribolium spp., causan daños en estado larval y adulto. Para el caso de estos dos
insectos se tiene que los adultos son longevos y el período de ovoposición muy
prolongado, lo que facilita la proliferación de la plaga (De los Mozos, 1997).
Los daños directos, en general, suelen ser de escasa importancia en comparación con
los daños indirectos. Los daños directos más relevantes sobre los granos y cereales son:
pérdidas de peso, daño en la calidad del producto, contaminación por insectos muertos y
excrementos, y cambios en el valor nutricional (Jiménez, 1995).
Daños indirectos:
Son daños graves en productos alimentarios que causan la inviabilidad total del producto
para el consumo humano o animal. La presencia de deyecciones y otros restos de las
especies infestantes causan una notable pérdida del valor comercial del producto.
Algunos insectos confieren al producto atacado un sabor y olor desagradables, y su
ingestión puede causar serios problemas digestivos en humanos y animales. También es
frecuente que los restos de algunas especies provoquen reacciones alérgicas a las
personas que entran en contacto con los productos atacados (De los Mozos, 1997).
La actividad metabólica de la plaga crea un considerable calentamiento del producto en
la zona atacada. El gradiente de temperatura provoca la condensación de agua en la
periferia de la zona atacada, lo cual favorece el desarrollo de hongos e incluso la
germinación de los granos. Los propios insectos actúan como vectores de esporas
28
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
fúngicas por todo el producto. El desarrollo de hongos supone un grave problema, pues
el producto se contamina con micotoxinas y queda inservible para la alimentación (Rees,
2004; Jiménez, 1995).
Además de los daños directos e indirectos, las plagas de productos almacenados
causan: 1) rechazo por parte de los consumidores, 2) altos costos sociales y jurídicos, 3)
costos asociados con la aplicación de métodos para controlar y prevenir las
infestaciones, 4) riesgos para la salud y el medio ambiente causados por uso de
plaguicidas y fumigantes y 5) serios daños de relaciones comerciales entre países por
temor a la introducción involuntaria de nuevas plagas, lo que conlleva a graves perjuicios
en la economía (Rees, 2004). En Colombia, los daños causados a granos almacenados
por acción de insectos plaga es de gran importancia, ya que origina cuantiosas pérdidas.
Esto se debe principalmente a que en el país las condiciones de almacenamiento no son
adecuadas, debido a que no se cuenta con los recursos necesarios para poder mantener
los granos bajo condiciones específicas de humedad y temperatura, dificultando así el
control de plagas.
1.6 Métodos de
almacenados
control
de
plagas
de
productos
Los primeros indicios de protección de productos almacenados contra el ataque de
insectos provienen de los egipcios. Entre las medidas que adoptaban los egipcios se
citan el lavado con soluciones de carbonato de sodio y la aplicación de diversas
sustancias, de origen animal y/o vegetal, sobre las paredes de los graneros. Los
procesos de fumigación de los granos lo hacían con inciensos preparados a base de
resinas, gomas y especias (De los Mozos, 1997).
Desde los primeros intentos de control de plagas de almacén el hombre ha desarrollado
una variada gama de técnicas de control basadas en el conocimiento de la biología y
comportamiento de las plagas de interés, con el objetivo de disminuir o eliminar los daños
y pérdidas que esas especies ocasionan en la agricultura. Estas técnicas han permitido
abordar el problema de las plagas de productos almacenados desde distintas
perspectivas. Algunos métodos de control son preventivos y su aplicación es siempre
recomendable; y otros son de tipo curativo y deben ser aplicados cuando se ha iniciado
Capítulo 1
29
la infestación si se quiere preservar la integridad del producto almacenado. Los métodos
químicos pueden ser curativos o preventivos (Schöler et al.,1997). Los siguientes son
algunos tipos de métodos de control de plagas de almacén comúnmente usados:
1) Manejo de temperatura y humedad: La temperatura y la humedad son factores
abióticos determinantes en el desarrollo de los insectos. Para prevenir el ataque de
plagas es conveniente mantener los productos almacenados a una temperatura
máxima de 15 °C, temperatura a la cual muy pocas especies pueden desarrollarse.
No obstante, esta es una medida preventiva, pues aunque evita el desarrollo de
algunas plagas, no sirve para desinfestarlo una vez atacado, pues varias especies
son tolerantes al frío (Chown et al., 2011).
2) Almacenamiento hermético y atmósferas controladas: El almacenamiento
hermético se basa en que la actividad respiratoria de las semillas, animales y
microorganismos agota el oxígeno y aumenta el contenido de dióxido de carbono del
ambiente interior de contenedor. Esta atmósfera generada mata las plagas y hongos,
o al menos reduce el crecimiento de sus poblaciones. La eficiencia de este método
depende de la hermeticidad del contenedor, temperatura, humedad del grano,
abundancia inicial de la plaga y periodo de almacenaje. Las técnicas de atmósfera
controladas consisten en la modificación del aire que rodea el producto de forma que
sea letal para las plagas, y están directamente relacionadas con las técnicas de
almacenaje hermético. Las dos técnicas más habituales de conseguir una atmósfera
letal son reducir el contenido de oxígeno y aumentar la proporción de CO 2 . La
atmósfera controlada es un método limpio y puede considerarse como una técnica
de fumigación especializada. La protección puede mantenerse por largos periodos si
el sistema permite conservar adecuadamente las características de la combinación
gaseosa generada (Conyers y Bell, 2007).
3) Radiación electromagnética: Los distintos tipos de radiación permiten enfocar el
problema de control de plagas desde distintas perspectivas, pero su elevado costo y
peligrosidad son los principales limitantes de este método de control.
Las microondas producen un calentamiento proporcional al contenido de agua de los
materiales irradiados, y su aplicación en el control de plagas se basa en que el
30
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
contenido de agua de los insectos es mucho mayor que el de los granos. Las
radiaciones UV-Vis pueden emplearse en el control de plagas de forma indirecta,
pues los insectos tienen picos de receptividad visual a determinadas longitudes de
onda. La atracción de algunos insectos por determinados colores, como el azul o el
amarillo es conocida y empleada para la preparación de trampas cromáticas,
especialmente para el monitoreo de plagas. En condiciones de almacén, la principal
utilidad de este tipo de radiación es la detección precoz de infestaciones (El-Naggar
y Mikhaiel, 2011; Vadivambal et al., 2007).
Los rayos X, α, β y γ son radiaciones que tiene la facultad de ionizar tejidos. Los
rayos γ han sido utilizados ampliamente para el control de plagas, pues provocan
daños irreparables en el ADN y en los fosfolípidos de la membrana celular. Efectos
similares pueden obtener con los rayos α y β, siendo los rayos β los de mayor poder
ionizante y de penetración. Las radiaciones más utilizadas en el control de plagas en
general y de almacén son los rayos γ y los rayos β, que pueden aplicarse en dosis
letales para eliminar de inmediato la plaga infestante o en dosis subletales que
inducen la esterilidad de los individuos irradiados (Hasan et al., 2012; El-Naggar y
Mikhaiel, 2011).
4) Control biológico: Los productos almacenados son ecosistemas característicos
donde varias especies interactúan. Varios grupos de depredadores y parasitoides
aparecen en asociación con las plagas típicas de productos almacenados, y por lo
tanto pueden causar elevadas mortalidades de la plaga. Sin embargo, aunque la
relación depredador-presa establecida permita mantener la plaga controlada, este
proceso tiene dos grandes inconvenientes: 1) existe un conocimiento mínimo de la
fauna útil asociada a las plagas de almacén y 2) los umbrales de daño permitidos en
los productos almacenados son bajos por lo general (De Los Mozos, 1997).
Actualmente, la posibilidad de utilizar cepas de bacterias, hongos y de parasitoides
que sean activos contra coleópteros se ha constituido en una buena posibilidad para
el control de plagas de almacén, como es el caso del hongo Beauveria bassiana
(Lord, 2007; Padín et al., 2002) y del parasitoide Theocolax elegans (Flinn et al.,
2006) que han sido empleados para controlar diferentes plagas de almacén,
incluidos Sitophilus spp. y T. castaneum.
Capítulo 1
31
5) Feromonas: Las feromonas de las principales plagas de almacén se han
identificado y se encuentran disponibles comercialmente. Debido a la especificidad
de estas sustancias, han servido como una herramienta para detectar la plaga en
una etapa temprana, determinar el momento adecuado para aplicar medidas de
control y para establecer el alcance y calidad de una medida de control. El diseño de
trampas con feromonas varía en función de la especie considerada y del objetivo. En
coleópteros, donde tanto larvas como adultos caminan sobre el sustrato o por el
suelo, las trampas más utilizadas son las de papel corrugado tratado con
insecticidas, donde los insectos al penetrar las ranuras de la trampa mueren en el
interior. Adicionalmente, para infectar a una población de plagas con agentes
entomopatógenos, las trampas de feromonas en combinación con virus, hongos y
bacterias son una buena opción (Cox, 2004).
6) Control químico: Los insecticidas sintéticos de contacto y los fumigantes son
todavía las principales sustancias empleadas en la protección de productos
almacenados gracias a su eficacia y bajo costo, pero debido a la estricta
normatividad en relación con los residuos de insecticidas en los productos
alimentarios, la gama de este tipo de productos es cada vez más restringida. Los
insecticidas de contacto son sustancias que tienen mayor poder residual que los
fumigantes y su costo de aplicación es menor. Sin embargo, la eficacia de los
fumigantes es mucho mayor y tienen como ventaja su elevado poder de penetración,
lo que evita el movimiento del producto para realizar el tratamiento. Los tratamientos
con estos productos se pueden emplear como medidas preventivas o curativas, en el
último caso aplicando el insecticida directamente en el grano para acabar con plagas
infestantes, pero este procedimiento tiene amplias restricciones por posibles
residuos y por el uso que se le va a dar al grano (De Los Mozos, 1997).
7) Otros métodos de control: Existen otras técnicas menos conocidas que pueden ser
alternativas de interés para situaciones concretas. Una de estas técnicas se basa en
la aplicación de sustancias abrasivas sobre los granos, con el objetivo de que dañen
las cubiertas cuticulares que protegen a los insectos de la deshidratación. El uso de
tierra de diatomáceas (DEs) para el control de insectos plaga en granos
almacenados ha sido una alternativa promisoria, pues el origen de esta es natural,
no deja residuos en los alimentos y tiene baja toxicidad para los mamíferos. Otra
32
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
ventaja de la tierra de diatomáceas es que tiene un modo de acción único y
específico sobre los insectos: inactiva los lípidos impermeables de la cutícula,
causando la muerte de los insectos por deshidratación. Actualmente se conoce que
las DEs son muy eficaces contra los insectos plaga que afectan productos
almacenados y varias formulaciones de esta sustancia están registradas en el
mundo para su uso directamente sobre los productos básicos. Sin embargo, existen
varios factores que restringen su uso. Uno de los más importantes es que depende
del insecto objetivo, pues la eficacia de las tierras de diatomáceas varía
considerablemente entre especies, o incluso entre diferentes etapas de la vida de la
misma especie (Athanassiou et al., 2007).
En países en desarrollo como Colombia, los métodos físicos de control (manejo de
temperatura y humedad, almacenamiento hermético y atmósferas controladas y radiación
electromagnética) son poco utilizados, ya que los pequeños agricultores carecen de los
recursos económicos para acceder a estos, así como de la información y conocimiento
necesarios para su manejo, por lo tanto, el control de plagas se hace químicamente. En
nuestro país son empleados tres insecticidas sintéticos de alta toxicidad para el control
de plagas de almacén, como lo son Fosfamin, Detiagas y Nuvan 50. Los dos primeros,
son insecticidas que tienen como principio activo el fosfuro de aluminio, el cual al
reaccionar con la humedad del ambiente produce fosfina, gas altamente tóxico que causa
la muerte inminente de los insectos plaga. El problema de estos dos insecticidas es que
su manejo requiere un extremo cuidado por parte de los agricultores, para evitar una
intoxicación que puede desencadenarse en su muerte, además muchas veces la fosfina
producida para aniquilar los insectos no es completamente liberada de los granos
dispuestos para consumo, lo que representa un alto riesgo para los seres humanos
(Killphos, 2012). Por otra parte, Nuvan es un insecticida organoclorado de origen sintético
reviste menor peligro para la sociedad y para el medio ambiente (sin dejar de ser
altamente tóxica), ya que el principio activo de esta sustancia comercial no presenta una
toxicidad tan elevada como la de la fosfina; además es un líquido que puede percibirse y
por lo tanto eliminarse con mayor facilidad (NUVAN® 50 EC, 2012).
Capítulo 1
33
1.7 Insecticidas sintéticos para el control de plagas
Los insecticidas sintéticos más empleados para el control de plagas que afectan tanto a
cultivos como a granos y productos almacenados son los que comúnmente se conocen
como organofosforados, organoclorados y carbamatos.
1.7.1 Insecticidas organofosforados
Se denominan insecticidas organofosforados (IOP) aquellas sustancias orgánicas
derivadas de la molécula del ácido fosfórico. Forman parte de los insecticidas de contacto
al absorberse por intermedio de los lípidos del caparazón de los insectos. Los
conocimientos acerca de la química del fósforo y de compuestos derivados del fósforo se
remontan a comienzos del siglo XIX, pero fue en 1932 cuando se describieron por
primera vez los efectos nocivos de los IOP sobre los seres vivos (Carod, 2002).
Químicamente, los IOP son ésteres, amidas o tioles derivados de los ácidos fosfórico,
fosfónico y tiofosfórico. Se descomponen con mayor facilidad que otros plaguicidas y se
degradan por oxidación e hidrólisis, dando origen a productos solubles en agua,
tentativamente menos persistentes y poco acumulables en el organismo humano. Estas
sustancias se consideran tóxicas por su capacidad de fosforilar la acetilcolinesterasa,
causando la acumulación de acetilcolina conllevando a síntomas y signos de intoxicación
aguda (Carod, 2002; Ramírez y Lascaña, 2001).
Los compuestos organofosforados son principalmente utilizados en la agricultura,
fundamentalmente como insecticidas, y en menor grado como acaricidas, nematocidas,
fungicidas y herbicidas (Coats, 1994).
1.7.2 Insecticidas organoclorados
Los insecticidas organoclorados (IOC) son moléculas orgánicas cloradas de alto peso
molecular que se caracterizan por ser depresores de sistema nervioso central. Estos
compuestos fueron sintetizados a finales del siglo XIX; pero su poder como insecticidas
fue conocido y empleado durante la segunda guerra mundial. El representante más
importante es el diclorodifeniltricloroetano (DDT) (Coats, 1994).
34
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
El uso generalizado de los IOC se debe a dos razones principales; la primera de ellas es
su persistencia y baja biodegradabilidad, sin embargo, esta misma persistencia resulta
perjudicial al dar como resultado una degradación lenta del compuesto. La segunda
razón es el hecho de que la mayoría de los IOC son muy económicos, sobre todo el DDT
(Ramírez y Lascaña, 2001; Wang et al., 2008). En los países tropicales, los IOC son
ampliamente utilizados en los programas de control de vectores de malaria y para el
control de plagas y parásitos que afectan el ganado (Mishra y Sharma, 2011).
Los plaguicidas organoclorados, por su alta persistencia en el medio ambiente y su
liposolubilidad, se acumulan principalmente en el tejido adiposo (Cid et al., 2007). La
frecuencia de uso de este tipo de sustancias es cada vez menor, debido a que muchos
insectos han desarrollado diversos mecanismos de resistencia y a que están siendo
reemplazados por otros insecticidas de similar eficacia pero que son biodegradables y no
persisten en el medio ambiente (Coats, 1994).
1.7.3 Insecticidas Carbamatos
Forman parte de una gran familia de plaguicidas entre los que se hallan herbicidas,
fungicidas e insecticidas (Martínez-Valenzuela y Gómez-Arroyo, 2007; Wan y Harrington,
2000). Los carbamatos se utilizan además de plaguicidas como fármacos para tratar el
Alzheimer y el glaucoma y en medicina veterinaria (Gupta, 2006). Todas estas sustancias
derivan del ácido carbámico
Los plaguicidas carbamatos pueden ser de tres tipos principales (Ramírez y Lascaña,
2001):
a) derivados de ésteres carbamatados, comúnmente usados como insecticidas.
b) derivados del ácido tiocarbámico, utilizados como fungicidas.
c) carbamatos propiamente dichos, que se emplean como herbicidas.
Los carbamatos son menos persistentes que los organoclorados y los organofosforados,
y su mecanismo de acción se basa en la unión reversible de estas sustancias a las
colinesterasas inactivándolas, perdiéndose este efecto espontáneamente en menos de
una hora (Martínez-Valenzuela y Gómez-Arroyo, 2007; Coats, 1994).
Capítulo 1
35
1.8 Insecticidas botánicos
La utilización de extractos de plantas y sus mezclas como insecticidas data de la época
del imperio romano. En el siglo XVII se utilizó la nicotina como controlador de plagas, y
hacia el siglo XIX aparecieron las piretrinas naturales (Pascual-Villalobos, 1996).
Actualmente, existen gran cantidad de materias activas y millares de productos técnicos
para el control de plagas registrados en diferentes países, siendo la tendencia actual la
de elaborar productos cada vez más sofisticados que alteren alguna de las fases del ciclo
normal del insecto (González-Coloma et al., 2010; Belles, 1993).
En la agricultura es necesario el uso de productos fitosanitarios, pues se estima que
todavía el 45% del rendimiento potencial de los cultivos mundiales se destruye debido a
las malezas, plagas y enfermedades antes y después de la recolección. La investigación
y desarrollo de plaguicidas basados en productos naturales busca disminuir los
problemas ocasionados por los plaguicidas sintéticos. Los compuestos naturales se
consideran válidos y útiles si: 1) son muy específicos para una plaga (selectividad), 2)
son menos contaminantes y biodegradables y 3) reducen la peligrosidad para el
consumidor (Pascual-Villalobos, 1996).
La detección e investigación de plantas no tóxicas para el ser humano reduce el riesgo
de descubrir bioplaguicidas tóxicos. La posibilidad de encontrar nuevos biopesticidas se
incrementa con la selección de plantas que se utilizan para alimentos, cosméticos o
especias, o plantas que tradicionalmente han sido utilizados como protectores de
cultivos. Las plantas tienen un excelente historial en el suministro de claves para la
búsqueda de nuevos agentes protectores de cultivos, especialmente en el campo de los
insecticidas (González-Coloma et al., 2010). Esto se puede atribuir a la evolución de los
metabolitos secundarios para la protección de la planta huésped de insectos, patógenos
y competidores de las plantas. Los plaguicidas botánicos también cuentan con la ventaja
de ser compatibles con otras opciones de protección de cultivos que son de bajo riesgo y
aceptables para el manejo de insectos, entre los que se incluyen: el uso de feromonas,
aceites,
detergentes,
hongos
entomopatógenos,
depredadores
y
parasitoides.
Actualmente, se emplean principalmente cuatro insecticidas botánicos, entre los se
encuentran los pretroides, el Neem, la Rotenona y los aceites esenciales de diversas
especies (Isman, 2006; Coats, 1994).
36
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
1.8.1 Piretroides
Las piretrinas, crisantematos y piretratos (Figura 1.6) se extraen de las flores de T.
cinerariaefolium. La flor seca en polvo de T. cinerariaefolium se ha utilizado como
insecticida desde la antigüedad (González-Coloma et al., 2010). Estos insecticidas se
caracterizan por su rápido efecto knockdown, particularmente sobre insectos voladores, y
de hiperactividad y convulsiones en los demás insectos. Los síntomas causados por
estas sustancias son producto de su acción neurotóxica, que genera el bloqueo de los
canales de sodio en los axones nerviosos. Las piretrinas son moderadamente tóxicas
para mamíferos y su principal problema es que son lábiles en presencia de luz UV, lo que
limita su uso a campo abierto (Isman, 2006).
R= -CH3 (crisantematos) o –CO2CH3 (piretratos)
R1= -CH=CH2 (pirectrina) o - CH3 (cineria) o –CH2CH3 (jasmolina)
Figura 1-6 Estructura de algunos piretriodes
1.8.2 Neem
Dos tipos de insecticidas botánicos pueden ser obtenidos de las semillas del árbol de
neem de la India (Azadirachta indica). El aceite esencial de las semillas es uno de estos
insecticidas y es efectivo contra insectos de bajo peso y ácaros. La presencia de grupos
disulfuro en este aceite contribuye significativamente a su bioactividad. El extracto
obtenido con solventes de mediana polaridad a partir del residuo de semillas después de
remover el aceite es el otro insecticida obtenido a partir de neem. Este extracto se
caracteriza por contener el triterpeno azadiractina y más de una docena de análogos de
esta sustancia, siendo estos compuestos los responsables de la actividad insecticida
(Isman, 2006). Los limonoides más importantes extraídos del neem son azadiractina 71,
nimbina 72 y salanina 73. Los productos que contienen azadiractina se pueden utilizar en
una amplia gama de cultivos, incluyendo los vegetales, algodón, té, tabaco, café, plantas
ornamentales y en el sector forestal. La azadiractina tiene dos efectos importantes en los
insectos. A nivel fisiológico esta sustancia bloquea la síntesis y liberación de hormonas
Capítulo 1
37
de muda desde la glándula protorácica, provocando una ecdisis incompleta en insectos
inmaduros. En adultos hembra un mecanismo similar al descrito anteriormente ocasiona
esterilidad. Adicionalmente, la azadiractina es un potente agente antialimentario para
muchos insectos (Isman, 2006). Azadiractina es considerada como no tóxico para
mamíferos y no se espera que tenga efectos adversos en organismos no vegetales o el
medio ambiente (González-Coloma et al., 2010).
71
72
73
1.8.3 Rotenona
Insecticida botánico que ha sido empleado por más de 150 años. La rotenona 74 es una
isoflavona producida en raíces o rizomas de leguninosas tropicales de los géneros Derris,
Lonchocarpus y Tephrosia. La rotenona es un veneno mitocondrial, el cual bloquea la
cadena de transporte de electrones y evita la producción de energía. Como insecticida es
considerado un veneno estomacal, pues debe ingerirse para ser efectivo (Isman, 2006).
74
1.8.4 Aceites esenciales
Los aceites esenciales de plantas se han utilizado desde la antigüedad para el control de
insectos. Estas sustancias están generalmente compuestas por complejas mezclas de
monoterpenos, fenoles y sesquiterpenos, los cuales se caracterizan por su acción
neurotóxica sobre insectos y por la baja toxicidad para mamíferos, y dicho efecto tóxico
está directamente relacionado con el patrón de metabolitos secundarios que los
38
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
componen (Philogéne et al., 2003; Reagnault-Roger, 1997). Debido a las propiedades
físicas de los aceites esenciales éstos pueden ser tóxicos por cuatro vías (Philogéne et
al., 2003):
1) Inhalación: Provocada por su riqueza en compuestos volátiles.
2) Contacto: Los insectos mueren como consecuencia de la formación de una película
impermeable, provocando la asfixia del insecto.
3) Absorción: debido a su carácter lipofílico son absorbidos en la cutícula de los insectos.
4) Ingestión: los insectos sufren intoxicación tras ingerir alimento contaminado con el
aceite.
Los monoterpenos son las principales sustancias responsables de la actividad insecticida
que presentan los aceites esenciales, por ejemplo, las sustancias responsables de la
actividad insecticida del aceite esencial de Rosmarinus officinale es 1,8-cineol, el de
Syzygium aromaticum el eugenol y de Mentha sp. el mentol (Isman, 2006).
1.8.5 Familias de plantas reconocidas por su utilidad como
insecticidas
Actualmente, se conoce que aproximadamente 656 especies de plantas, distribuidas en
110 familias, han presentado significativa actividad insecticida. La familia más que cuenta
con más reportes de actividad insecticida es la Lamiaceae, con 181 especies que poseen
actividad insecticida, representando cerca del 28% de las especies que han presentado
esta actividad (Boulogne et al., 2012). Además de las Lamiaceae, las familias botánicas
más estudiadas por la significativa actividad insecticida de varias de sus especies son:
Meliaceae, Astereaceae, Rutaceae, Leguminosae, Labiatae, Piperarceeae, Lauraceae,
Umbelliferae, Cruciferae, Solonaceae y Euphorbiaceae (Scott et al., 2008; PascualVillalobos, 1996, Yang y Tang, 1988)
2. Estudio Fitoquímico de Compsoneura
capitellata (Myristicaceae), Zanthoxylum
rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae), y evaluación de su posible
aplicación como antialimentarios de plagas
de almacén.
Los productos naturales se han utilizado por miles de años para el beneficio de la
humanidad, ya sea como alimentos, prendas de vestir, cosméticos, construcciones,
herramientas, medicamentos y agentes de protección de cultivos. La importancia de los
productos naturales se debe a que son fuente de nuevos compuestos gracias a: 1) la
producción de diversos metabolitos secundarios bioactivos por parte de las plantas e
invertebrados marinos como defensa química; 2) son fuente de muchos medicamentos
nuevos, algunos de los cuales son inaccesibles por otras vías y 3) pueden proporcionar
las plantillas necesarias para el diseño de nuevos productos en el futuro (Colegate y
Molyneux, 2008; Kaufman et al., 2006; Cragg et al., 2005).
El uso de plantas como fuente de insecticidas naturales tiene su origen en observaciones
empíricas realizadas por el hombre, en donde detectaron que ciertos vegetales se
protegían mejor que otros frente al ataque de insectos, siendo así los insecticidas
botánicos más antiguos que los demás pesticidas. Desde la antigüedad, los griegos,
romanos y chinos utilizaban extractos de plantas para combatir las plagas de sus
cultivos; y actualmente en muchas comunidades indígenas esta práctica aún se mantiene
y representa un recurso renovable, más accesible y económico que los insecticidas
sintéticos (Isman, 2006).
La capacidad que poseen las plantas para defenderse frente a insectos perjudiciales es
el resultado de años de evolución, tiempo en el cual desarrollaron la capacidad de
40
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
producir una diversidad de metabolitos secundarios con funciones diferentes. Estas
sustancias son conocidas como aleloquímicos que pueden clasificarse, según su modo
de acción, como: sustancias defensivas, tóxicas, repelentes, disuasorias de la
alimentación o atrayentes (Cox y Collins, 2002), siendo así las plantas una fuente de
sustancias químicas que podrían ser la base del surgimiento de nuevos productos
insecticidas altamente selectivos, de baja persistencia en el ambiente y con menor
posibilidad de generar fenómenos de resistencia (Caballero-García, 2004).
En la actualidad los insecticidas botánicos más empleados para el control de insectos
son los piretroides, el neem, la rotenona y los aceites esenciales (Isman, 2006), pero su
aplicación ha sido limitada debido a la baja efectividad, pues se tiene conocimiento de
que han empezado a presentarse fenómenos de resistencia de algunos insectos antes
dichas sustancias (Stefanazzi, 2010; Correa et al., 2006; Isman, 2006; Caballero-García,
2004), por el inadecuado uso de estos productos. Este mismo fenómeno se ha
presentado con los insecticidad de origen sintético, acompañado de serios problemas
ambientales y de salud pública (Strand, 2000).
Las anteriores consideraciones hacen cada vez más indispensable la búsqueda de
nuevos agentes fitosanitarios que permitan controlar plagas y enfermedades que afectan
a muchas plantas y productos fuentes de alimento y/o de uso industrial. Para este fin, la
investigación en plantas representa una fuente ptencial para el descubrimiento de nuevas
sustancias, si se considera que cada una de estas puede contener centenares de
metabolitos secundarios. De las 250.000 a 300.000 especies vegetales reportadas,
solamente una pequeña parte ha sido objeto de estudios fitoquímicos y de sus
propiedades biológicas (Tringali, 2001).
Actualmente, los estudios fitoquímicos han tomado gran impulso en la búsqueda de
sustancias con propiedades insecticidas, con el fin de encontrar soluciones económicas y
de bajo impacto ambiental para el control de plagas. Principalmente se reporta el uso de
aceites esenciales de diferentes especies vegetales como insecticidas (Rajendran y
Sriranjini, 2008; Kim et al., 2003; Enan, 2001; Lamiri et al., 2001; Kétïa, et al., 2000;
Regnault-Roger, 1997) y últimamente se han reportado propiedades insecticidas
promisorias para metabolitos secundarios como terpenoides (Sosa y Tonn, 2008; Omar
Capítulo 2
41
et al., 2007), sesquiterpenos (Sosa y Tonn, 2008; Cis et al., 2006), alcamidas (Saadali et
al., 2001), fenilpropenos (Tewary et al., 2006), diterpenos tipo neo-clerodano,
benzopiranos, benzofuranos, fenoles, cumarinas, flavonoides, iridoides (Sosa y Tonn,
2008) y alcaloides (Domínguez et al., 2008; Schardl et al., 2007; Siciliano et al., 2005;
Jinbo et al., 2002; Tringali et al.,2001).
La flora colombiana, una de las más diversas a nivel mundial, posee una amplia variedad
de familias de plantas, donde Myristicaceae, Rutaceae y Lauraceae son algunas de las
más representativas y de importancia económica debido a sus aplicaciones a nivel
alimenticio, industrial y medicinal. Estas tres familias se caracterizan por poseer especies
productoras de aceites esenciales y de metabolitos secundarios como alcaloides,
lignanos, flavonoides y terpenos. A algunos extractos, aceites y compuestos aislados de
especies de estas tres familias se les ha determinado sus propiedades para el control de
plagas.
De las investigaciones en la familia Myristicaceae se ha encontrado que el ácido
anacárdico aislado de Knema elegans presenta actividad insecticida frente al escarabajo
de la papa, Leptinotarsa decemlineata (Schultz et al., 2006). De la especie Virola
calophylla
se
aislaron
tres
alcaloides
5-metoxi-N,N-dimetiltriptamina,
2-metil-6-
metoxitetrahidro-β-carbolina y nicotina y un triterpeno friedelan-3-ona que exhibieron
actividad antialimentaria frente al gorgojo del algodón, Anthonomus grandis (Miles et al.,
1987).
En la familia Rutaceae también se han encontrado sustancias con promisoria actividad
insecticida, por ejemplo, 2-fenilflavona aislada de Sculletaria baicarensis presenta
actividad antialimentaria frente a Spodoptera litoria (Morimoto et al., 2003); (-)-loliolido
aislado de Zanthoxylum setulosum tiene actividad insecticida frente a Atta cephalotes
(Okunade y Wiemer, 1985); fraccinelona y dictamina aislados de Dictamnus dasycarpus,
exhiben actividad antialimentaria frente a Tribolium castaneum y Sitophilus zeamais (Liu
et al., 2002); eritrococamida A aislada de Dinosperma erythrococca presenta actividad
insecticida contra Musca domestica y Heliothis virescens (Latif et al., 1998); entre otros.
En cuanto a las especies de la familia Lauraceae, por ejemplo, de Cinnamomum cassia
se reporta el aislamiento de trans-cinamaldehído, eugenol y salicilaldehído, presentando
42
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
los tres promisoria actividad insecticida frente a Mechoris ursulus (Park et al., 2000). En
Persea americana se menciona el aislamiento de 2-(pentadecil)-furano y 2-(tetradecil)furano, sustancias con actividad insecticida contra Spodoptera exigua (Rodriguez-Saona
et al., 1999) y de Persea indica se reporta el aislamiento de perseanol, el cual posee
actividad antialimentaria frente a Spodoptera lituria (Fraga et al.; 1997).
A pesar de que las especies pertenecientes a estas tres familias han sido objeto de gran
número de estudios fitoquímicos y de actividad biológica, aún hay gran cantidad de éstas
que carecen de estudios de este tipo. En Colombia, a pesar de existir una gran
diversidad de especies de estas familias no existe un estudio sistemático y químico
completo, tal es el caso de Compsoneura capitellata, Zanthoxylum rigidum y Ocotea
longifolia, para las cuales hay escasos o nulos reportes etnobotánicos, químicos y de
actividad biológica. Las anteriores consideraciones hacen de las especies pertenecientes
a las familias Myristicaceae, Rutaceae y Lauraceae objetos interesantes de estudio para
emprender invetigaciones encaminadas en la búsqueda de sustancias con propiedades
para el control de plagas y enfermedades, que tal vez en un futuro puedan ser
empleados como agentes fitosanitarios de uso a nivel agrícola. En este sentido, se
realizó un screening de actividad antialimentaria sobre S. zeamais de varias especies
pertenecientes a las familias objeto de estudio, con el fin de seleccionar las más
promisorias para inicar los estudios fitoquímicos enfocados en contribuir al conocimiento
químico y de actividad biológica de las especies seleccionadas.
En este capítulo se presentan los resultados del estudio fitoquímico realizado en hojas y
madera de C. capitellata (Myristicaceae), corteza de Z. rigidum y corteza de O. longifolia;
así como los resultados de la evaluación de la actividad antialimentaria sobre S. zeamais
y T. castaneum para los extractos, fracciones y compuestos asilados.
Capítulo 2
43
2.1 Metodología
2.1.1 General
Las separaciones cromatográficas en columna se realizaron por efecto de la gravedad
(CC), por aplicación de presión mediante cromatografía flash (CF) y por aplicación de
vacío mediante cromatografía líquida al vacío (CLV). La fase estacionaria utilizada para
el método tradicional de CC fue sílica gel 60 Merck (70-230 Mesh), para la CF fue sílica
gel 60 Merck (230-400 Mesh) y para CLV sílica gel 60HF 254 Merck. Las separaciones
cromatográficas en capa delgada preparativa (CCDP) se realizaron en placas de sílica
gel 60 HF 254 Merck de 1 mm de espesor. Los estudios cromatográficos, el monitoreo de
las cromatografías en columna y preparativa y el control de pureza se realizó por
cromatografía en capa delgada (CCD) empleando cromatoplacas de sílica gel 60 HF 254
Merck, utilizando como reveladores vapores de yodo, luz UV (254 y 365 nm) y
vainillina/H 3 PO 4 . Los solventes empleados para las separaciones cromatográficas fueron
de grado técnico (destilados antes de su uso) y/o grado analítico.
Como control de pureza también se empleó la cromatografía líquida de alta eficiencia
(HPLC) para lo cual se utilizó un cromatógrafo (HPLC-UV-DAD) Merck-Hitachi D-7000,
equipado con un detector de arreglo de diodos L-4500, bomba inteligente L-6200A e
interfase L-6000A, usando una columna analítica de fase reversa C 18 (25 cm x 10 mm) y
una velocidad de flujo de 0,8 mL/min. Se emplearon solventes LiChrosolv (Merck) para el
sistema en fase reversa.
Los espectros de resonancia magnética nuclear de 1H y
13
C, así como los experimentos
DEPT 135, COSY, HMQC y HMBC fueron tomados en un espectrómetro Bruker Avance
400 y Bruker Avance 300, operado a 400 MHz y 300 MHz para 1H y a 100 MHz y 75 MHz
para 13C, respectivamente. Como solventes y patrones internos se emplearon cloroformo
deuterado (CDCl 3 ), acetona deuterada (acetona-d 6 ), metanol deuterado (CD 3 OD) y agua
deuterada (D 2 O) a una temperatura de 25 °C. Los desplazamientos químicos (δ) están
expresados en partes por millón (ppm) y las constantes de acoplamiento (J) en hercios
(Hz). Las multiplicidades están asignadas como sigue: s = singlete, d = doblete, t =
triplete, c = cuarteto, quint = quinteto, m = multiplete, dd = dobledoblete, dt =
dobletriplete, etc. Para los espectros de
13
C se indica entre paréntesis la información
obtenida de los experimentos DEPT y cuando es posible, la asignación de la señal.
44
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Los espectros Infrarrojo (IR) fueron registrados en el espectrómetro Perkin Elmer FTIR
Panagon 500 serie 1000 en película en una celda de KBr y en pastilla de KBr. Solo se
incluyen las absorciones características, estando indicada entre paréntesis la asignación.
La Rotación óptica se determinó en un equipo Atago-Polarimeter Polax-L.
Los espectros de masas de baja (EM) y/o alta resolución (EMAR) fueron realizados por el
Laboratório de Química de Produtos Naturais de la Universidad de Sao Paulo (Brasil) y
por el Laboratorio de Cromatografía Líquida Acoplada a Espectrometría de Masas
(LCMS) de la Universidad Nacional de Colombia usando ionización por electrospray en
modo positivo o negativo, de acuerdo al tipo de compuesto. Los fragmentos significativos
se indican como: m/z (intensidad relativa al pico base = 100), con masa exacta
determinada para el ión molecular (M) o fragmento iónico adecuado.
2.1.2 Material vegetal
Las 11 especies de vegetales empleadas en este estudio (Zanthoxylum rigidum COL
519810, Z. monophyllum COL 517520, Z. rhoifolium COL 522896, Z. quinduense COL
511101, Z. fagara COL 522891, Ocotea longifolia COL 522892, O. macrophylla COL
517191, Compsoneura capitellata COL 519809, Virola elongata COL 572082, V. carinata
COL 563244 y V. peruviana COL 549606) fueron colectadas en diferentes regiones de
Colombia entre los años 2005 y 2008, y fueron determinadas por el Biólogo Adolfo Jara
Muñoz del Herbario Nacional Colombiano del Instituto de Ciencias Naturales de la
Universidad Nacional de Colombia. Un ejemplar de cada espécimen colectado reposa en
el herbario anteriormente mencionado. Los órganos colectados de cada planta se
secaron al aire a temperatura ambiente, después se molieron y se prepararon los
extractos por maceración con etanol al 96%.
2.1.3 Estudio fitoquímico de hojas de Compsoneura capitellata
La especie C. capitellata (A. DC.) Warb (COL 519809) fue colectada por la Bióloga
Adriana Aguilar en agosto de 2006 en la estación el Zafire, en la ciudad de Leticia
(Amazonas).
Capítulo 2
45
Las hojas secas y molidas (2550 g) de C. capitellata fueron extraídas con etanol al 96%
por maceración a temperatura ambiente. El solvente fue evaporado mediante destilación
a presión reducida obteniéndose 163 g de extracto crudo. De este extracto, 100 g se
sometieron a extracción sólido-líquido sucesiva mediante un equipo Soxhlet con éter de
petróleo (EdP), CHCl 3 , AcOiPr y MeOH. Luego de la evaporación de los solventes se
obtuvieron las fracciones denominadas EdP (32,0 g), CHCl 3 (14,8 g), AcOiPr (11,5 g) y
MeOH (32,2 g).
La fracción de EdP (10,0 g) fue sometida a cromatografía en columna (CC) eluyendo con
mezcla de EdP:AcOiPr en polaridad creciente (80:20 a 100), obteniéndose 17 fracciones.
De las fracciones 5 y 6 (900,0 mg) por CC repetitiva con tolueno:AcOiPr (85:15),
hexano:acetona (85:15) y CHCl 3 se obtuvo el compuesto eudesman-11-en-4α-ol HCc-1
como un aceite incoloro (110,0 mg). La fracción 7 se purificó por cromatografía flash (CF)
eluyendo con tolueno:AcOiPr (90:10) para obtener un sólido cristalino blanco
correspondiente a la mezcla de β-sitosterol HCc-2 y estigmasterol HCc-3 (150,0 mg).
La fracción AcOiPr (11,0 g) se sometió a CLV eluyendo con mezcla AcOiPr:MeOH en
polaridad creciente (98:2 a 0:100), obteniéndose 12 fracciones. De la fracción 2 (157,2
mg) utilizando CF repetitiva con hexano:acetona (80:20) y hexano:AcOEt (70:30) como
fases móviles, se obtuvo un sólido rojo correspondiente al flavonoide biochanina A HCc-4
(4,0 mg). Las fracciones 4 y 5 (181,0 mg) fueron purificadas mediante CF eluyendo con
EdP:acetona (70:30) y CHCl 3 :acetona (70:30), obteniéndose el flavonoide formononetina
HCc-5 como un sólido marrón (4,0 mg). Las fracciones 6 y 7 (215,0 mg) se reunieron y
se sometieron a CF con EdP:AcOEt (50:50) y hexano:acetona (60:40), para obtener un
sólido café correspondiente a la mezcla de 3,4-dihidroxibenzaldehído HCc-6 y del
terpenoide denominado ácido 15-nor-10-hidroxi-oplopan-4-oico HCc-7 (6,0 mg). De la
fracción 9 (170,0 mg) por CF eluyendo con CHCl 3 :MeOH (90:10) y hexano:acetona
(40:60) se obtuvo un sólido amarillo correspondiente al flavonoide conocido como
kaempferol-3-O-(2″,4″-di-trans-p-coumaroil)-ramnósido HCc-8 (22,9 mg). La fracción 11
(4,1 g) fue purificada por CLV eluyendo con mezcla AcOiPr:MeOH en polaridad creciente
(95:5 a 0:100) obteniendo 8 fracciones, denominadas 11.1 a 11.8. La fracción 11.2 (1,98
g) fue sometida a CF repetitiva empleando AcOEt:MeOH (95:5), CHCl 3 :MeOH (90:10) y
CHCl 3 :MeOH (85:15) como sistemas de elución, para obtener como un aceite café el
derivado de ácido benzóico denominado (-)-compsoneurósido HCc-9 (10,6 mg), el
46
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
flavonoide afzelina HCc-10 como un sólido naranja (21,6 mg) y un esterol conocido como
glicósido de 3-O-sitosterol HCc-11 como un sólido blanco (10,0 mg). En la Figura 2.1 se
resume el procedimiento llevado a cabo para el aislamiento de los metabolitos
secundarios del extracto etanólico del hojas de C. capitellata.
Hojas secas y
molidas (2550 g)
Extracción con
etanol 96%
Extracto etanólico
(163 g)
BIOENSAYOS
Fraccionamiento por
Soxhlet (100 g)
Fracción EdP
Fracción CHCl3
Fracción AcOiPr
Fracción MeOH
(32,0 g)
(14,8 g)
(11,5 g)
(32,2 g)
BIOENSAYOS
HCc-1
HCc-2
HCc-3
HCc - 4
HCc - 9
HCc - 5
HCc – 10
HCc - 6
HCc - 11
HCc - 7
HCc - 8
Figura 2-1 Esquema general de extracción, fraccionamiento y purificación de los metabolitos
secundarios presentes en las hojas de Compsoneura capitellata.
Capítulo 2
47
2.1.4 Estudio fitoquímico
capitellata
de
la
madera
de
Compsoneura
La madera seca y molida (712,5 g) de C. capitellata (COL 519809) fue extraída con
etanol al 96% por maceración a temperatura ambiente. El solvente fue evaporado
mediante destilación a presión reducida, obteniéndose 26 g de extracto crudo. 23 g de
este extracto se sometieron a extracción sólido-líquido discontinua asistida por
ultrasonido empleando hexano, CHCl 3 , AcOiPr y MeOH como solventes de extracción.
Luego de la evaporación de los solventes se obtuvieron las fracciones denominadas
hexano (600,0 mg), CHCl 3 (800,0 mg), AcOiPr (7,0 g) y MeOH (13,0 g).
La fracción de Hexano (500,0 mg) fue purificada mediante CF eluyendo con mezcla de
hexano:AcOEt (90:10), obteniéndose 15 fracciones. De la fracción 7 (96,7 mg) por CF
con CHCl 3 :acetona (95:5) como fase móvil, se aisló un sólido cristalino blanco
correspondiente a la mezcla de los esteroles β-sitosterol MCc-1 y estigmasterol MCc-2
(48,7 mg). La fracción 8 (118,6 mg) se purificó por CF repetitiva eluyendo con
tolueno:AcOiPr (90:10) y CHCl 3 , para obtener un sólido blanco correspondiente a una
butirolactona denominada megislactona MCc-3 (14,0 mg).
La fracción de CHCl 3 (700,0 mg) fue sometida a CF eluyendo con la mezcla
CH 2 Cl 2 :MeOH (90:10), obteniendo 9 fracciones. De la fracción 2 se obtuvo un sólido
vinotinto correspondiente a la mezcla de las dihidrochalconas 2´,4´-dihidroxi-6´-metoxi3,4-metilenodioxidihidrochalcona
MCc-4
y
2´,4´-dihidroxi-6´-metoxi-3-hidroxi-4-
metoxidihidrochalcona MCc-5 (9,2 mg), mediante la purificación por CF empleando como
solventes de elución hexano:acetona (85:15), CHCl 3 :AcOEt (98:2) y hexano:acetona
(80:20). La fracción 3 se purificó por CF empleando como fase móvil CH 2 Cl 2 :acetona
(80:20),
obteniéndose
los
diarilpropanos
(1-(2,3-dihidroxifenil)-3-(3,4-
metilenodioxifenil)propano MCc-6 como un sólido marrón-rojizo (39,1 mg) y 1-(2’,3’dihidroxifenil)-3-(3’’,4’’-metilenodioxi-6’’-metoxifenil)propano MCc-7 como un aceite rojo
(7,8 mg).
La fracción AcOiPr (6,8 g) fue purificada por CLV eluyendo con mezcla CHCl 3 :MeOH en
polaridad creciente (90:10 a 0:100), obteniendo 5 fracciones. Las fracciones 2 y 3 (3,5 g)
fueron reunidas y sometidas a CF con CH 2 Cl 2 :MeOH (85:15) resultando 15 fracciones,
48
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
denominadas 2.1 a 2.15. Las fracciones 2.7 a 2.10 (1,5 g) fueron reunidas y purificadas
por CF empleando la mezcla CHCl 3 :MeOH (80:20), obteniendo 6 fracciones,
denominadas 2.7.1 a 2.7.2. La fracción 2.7.2 se purificó por CC en fase reversa
empleando RP-18 como fase estacionaria y la mezcla H 2 O:MeOH (60:40) como fase
móvil, obteniendo de esta manera los compuestos cinchonaina Ic MCc-8 como un sólido
crema (281,3 mg) y cinchonaina Id MCc-9 como un sólido marrón (129,8 mg). En la
Figura 2.2 se resume el estudio fitoquímico realizado en la madera de C. capitellata.
Madera seca y
molida (712,5 g)
Extracción con
etanol 96%
Extracto etanólico
(26 g)
BIOENSAYOS
Extracción
sólido-líquido asistida
por ultrasonido (23 g)
Fracción Hexano
Fracción CHCl3
Fracción AcOiPr
Fracción MeOH
(600 mg)
(800 mg)
(7,0 g)
(13,0 g)
BIOENSAYOS
MCc - 1
MCc - 4
MCc - 2
MCc - 5
MCc - 3
MCc - 6
MCc - 8
MCc - 9
MCc - 7
Figura 2-2 Esquema general de extracción, fraccionamiento y purificación de los metabolitos
secundarios presentes en la madera de Compsoneura capitellata.
Capítulo 2
49
2.1.5 Estudio fitoquímico de la corteza de Zanthoxylum rigidum
La especie Z. rigidum Humb. & Bonpl. ex Willd. (COL 519810) fue colectada por el
Químico M.Sc. Wilman Delgado en enero de 2008 en el municipio de Icononzo (Tolima).
La corteza seca y molida (2244 g) de Z. rigidum fue extraída con etanol al 96% por
maceración a temperatura ambiente. El solvente fue evaporado mediante destilación a
presión reducida obteniéndose 117 g de extracto crudo. De este extracto, 100 g fueron
fraccionados por CLV eluyendo con CHCl 3 y mezclas de CHCl 3 :MeOH en polaridad
creciente (90:10 a 0:100), obteniendo 10 fracciones. La fracción 1 (2,48 g) se sometió a
CF repetitiva con sílica gel, usando como sistemas de elución EdP:AcOiPr (90:10) y
Hexano:AcOEt (90:10), obteniéndose un triterpeno como un sólido blanco identificado
como lupeol Zr-1 (150,0 mg).
La fracción 2 (20,0 g) fue sometida a CLV eluyendo con mezcla EdP:AcOiPr en polaridad
creciente (85:15 a 0:100), obteniendo 12 fracciones, denominadas 2.1 a 2.12. Las
fracciones 2.2 y 2.3 fueron reunidas (9,2 g) y purificadas por CF repetitiva empleando
como sistemas de elución CHCl 3 y CHCl 3 :AcOEt (98:2) para obtener el triterpeno
lupenona Zr-2 como un sólido blanco amorfo (2,8 g). La fracción 2.4 (4,9 g) fue sometida
a CF eluyendo con CHCl 3 :AcOEt (95:5), obteniendo nueve fracciones denominadas
2.4.1-2.4.9. De la fracción 2.4.4 se obtuvo un sólido blanco correspondiente al triterpeno
denominado betulina Zr-3 (11,5 mg) mediante CF empleando como fase móvil
hexano:acetona (70:30). La fracción 2.5 (770,0 mg) se purificó por CF sucesiva
empleando como solventes de elución CHCl 3 y mezclas CHCl 3 :AcOEt (95:5),
obteniéndose un sólido verde correspondiente a la mezcla de los lignanos
butirolactónicos conocidos como savinina Zr-4 y 2,3-di-(3',4'-metilenodioxibencil)-2-buten4-olido Zr-5 (33,4 mg). Las fracciones 2.6 y 2.7 (1,8 g) fueron reunidas y purificadas por
CF empleando CH 2 Cl 2 :MeOH (98:2) y hexano:acetona (80:20) como fase móvil para
obtener el alcaloide quinolónico flindersina Zr-6 (25,2 mg) como un sólido amarillo pálido.
Las fracciones 2.9 y 2.10 (617,0 mg) se reunieron y purificaron mediante CF con sílica
gel, eluyendo con CHCl 3 :AcOEt (90:10) para dar 8 fracciones (2.9.1 – 2.9.8), de las
cuales las fracciones 2.9.1 y 2.9.2 (554 mg) fueron reunidas y sometidas a CF repetitivas
empleando como fases móviles CHCl 3 :acetona (95:5), hexano:acetona (60:40) y
CHCl 3 :acetona (98:2) y posterior purificación por CCDP en sílica gel eluyendo con
50
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
CHCl 3 :acetona (98:2) obteniendo así el lignano butirolactónico conocido como (+)dimetilmatairesinol Zr-7 (aceite amarillo; 33,9 mg), y los alcaloides quinolínicos γ-fagarina
Zr-8 (sólido amarillo; 5,1 mg) y skimnianina Zr-9 (sólido amarillo-verdoso; 9,5 mg). La
fracción 2.12 se purificó por CF eluyendo con CH 2 Cl 2 :MeOH (98:2) obteniéndose el
lignano furofuránico denominado (+)-siringaresinol Zr-10 como un aceite amarillo pálido
(30,2 mg).
La fracción 3 (11,3 g) fue sometida a CLV eluyendo con mezcla tolueno:AcOiPr en
polaridad creciente (70:30 a 0:100) para obtener siete fracciones, denominadas 3.1 – 3.7.
La fracción 3.2 (5,4 g) fue purificada por CF sucesivas eluyendo con tolueno:AcOiPr
(7:3), CHCl 3 :acetona (96:4) y CHCl 3 :acetona (90:10) obteniendo los compuestos cafeato
de etilo Zr-11 como un sólido color naranja pálido (130,2 mg) y la cumarina denominada
umbeliferona Zr-12 como un sólido blanco (31,6 mg). La fracciones 3.3 y 3.4 (1,95 g) se
reunieron y sometieron a CF repetitivas empleando como fases móviles hexano:AcOEt
(30:70) y hexano:acetona (60:40) para obtener un sólido blanco correspondiente a un
monoglicérido conocido como monopalmitato de glicerilo Zr-13 (236,3 mg).
Las fracciones 8 y 9 (10 g) se reunieron y la mezcla resultante se fraccionó por CLV
empleando CHCl 3 :MeOH (70:30) como fase móvil para obtener seis fracciones
denominadas 8.1 – 8.6. La fracción 8.4 (795,4 mg) fue purificada mediante CF eluyendo
con mezcla CHCl 3 :MeOH (68:32) para obtener nueve fracciones (8.4.1 – 8.4.9). De la
fracción 8.4.8 (287 mg) se aisló un compuesto derivado de los ácidos caféico y quínico
que fue denominado ácido (-)-rigidunoico Zr-14 (sólido verde; 76,9 mg) al purificarlo por
CF en fase reversa (RP-18) empleando como sistema de elución la mezcla H 2 O: MeOH
(80:20). En la Figura 2.3 se resume el procedimiento llevado a cabo para realizar el
estudio fitoquímico de la corteza de Z. rigidum.
Capítulo 2
51
Corteza seca y molida
(2244 g)
Extracción con etanol
96%
BIOENSAYOS
Extracto etanólico
(117 g)
Fraccionamiento por CLV
(100 g)
CHCL3
MeOH
10 FRACCIONES
Fracción 1
BIOENSAYOS
Zr-1
Zr-2
Zr-5
Zr-8
Zr-3
Zr-6
Zr-9
Zr-4
Zr-7
Zr-10
Fracción 3
Zr-11
Zr-12
Fracciones 8 y 9
Zr-14
Fracción 2
Zr-13
Figura 2-3 Esquema general de extracción, fraccionamiento y purificación de los metabolitos
secundarios presentes en la corteza de Zanthoxylum rigidum.
2.1.6 Estudio fitoquímico de la corteza de Ocotea longifolia
La especie O. longifolia Kunth (COL-522892) fue colectada por el Químico M.Sc. Wilman
Delgado en enero de 2008 en el municipio de Icononzo (Tolima).
La corteza seca y molida (1500 g) de O. longifolia fue extraída con etanol al 96% por
maceración a temperatura ambiente. El solvente fue evaporado mediante destilación a
presión reducida para obtener 78 g de extracto crudo. De este extracto, 60 g se
52
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
fraccionaron por CLV empleando CHCl 3 y mezclas de CHCl 3 :MeOH en polaridad
creciente (90:10 a 0:100) como sistemas de elución, obteniéndose 9 fracciones.
La fracción 1 (6,50 g) se purificó por CLV eluyendo con mezclas hexano:acetona en
polaridad creciente (98:2 a 70:30) obteniendo nueve fracciones denominadas 1.1 – 1.9.
La fracción 1.3 (1,50 g) fue sometida a CF repetitivas empleando las fases móviles
CHCl 3 :AcOEt (99:1) y hexano:acetona (85:15) para obtener el sesquiterpeno conocido
como ácido 11,13-dihidrocostuso Ol-1 como un aceite amarillo (21,9 mg). La fracción 1.4
(673,4 mg) se purificó por CF eluyendo con CH 2 Cl 2 :AcOEt (98:2) para obtener diez
fracciones denominadas 1.4.1 – 1.4.10. La fracción 1.4.5 (55,0 mg) se purificó mediante
CF y CCDP empleando en los dos casos CHCl 3 como solvente de elución, para obtener
un aceite amarillo correspondiente al butanólido denominado Litsealiicolido C Ol-2 (10,5
mg). Las fracciones 1.4.6 y 1.4.7 fueron reunidas (220,0 mg) y sometidas a purificación
por recristalización empleando metanol como solvente, para obtener de esta manera el
compuesto β-sitosterol Ol-3 como un sólido blanco (125,5 mg). La fracción 1.5 (1,24 g)
fue purificada por CF empleando la mezcla CH 2 Cl 2 :AcOEt (98:2) como solvente de
elución para obtener 7 fracciones (1.5.1 – 1.5.7). La fracción 1.5.6 (66,1 mg) se purificó
por CCDP eluyendo con hexano:acetona (80:20) para obtener un aceite amarillo pálido
correspondiente a una sesquiterpenlactona denominada (+)-longifolina Ol-4 (30,2 mg).
Las fracciones 2 y 3 se reunieron (5,1 g) y se sometieron a CLV empleando como fase
móvil mezclas CH 2 Cl 2 :acetona en polaridad creciente (95:5 a 80:20), obteniendo 10
fracciones denominadas 2.1 a 2.10. La fracción 2.2 (189,1 mg) fue purificada por CF
sucesivas eluyendo con CHCl 3 :AcOEt (95:5) y hexano:acetona (80:20), seguido por una
CCDP empleando la mezcla hexano:acetona (80:20) como eluyente, permitiendo así
obtener el sesquiterpeno conocido como (+)-hidroxiatractilólido Ol-5 (38,8 mg). La
fracción 2.4 (558,4 mg) fue purificada por CF eluyendo con la mezcla hexano:acetona
(70:30),
obteniéndose
unos
cristales
de
color
crema
correspondientes
a
la
sesquiterpenlactona denominada ocotealactol Ol-6 (50,5 mg). La fracción 2.5 (388,0 mg)
se sometió a CF empleando la mezcla CHCl 3 :acetona (85:15) como fase móvil,
obteniendo ocho fracciones, denominadas 2.5.1 – 2.5.8. Las fracciones 2.5.4 y 2.5.5
(154,0 mg) fueron reunidas y purificadas por CF sucesivas, empleando como solventes
Capítulo 2
53
de elución las mezclas hexano:acetona (70:30) y hexano:AcOEt (60:40), para obtener de
esta manera el sesquiterpenoide denominado kudtdiol Ol-7 un aceite incoloro (10,7 mg).
La fracción 4 (6,4 g) se purificó por CLV eluyendo con mezclas CHCl 3 :MeOH en
polaridad creciente (98:2 a 90:10) obteniendo cinco fracciones denominadas 4.1 – 4.5. La
fracción 4.3 (437,4 mg) fue sometida CF empleando la mezcla CH 2 Cl 2 :MeOH (90:10)
para obtener ocho fracciones (4.3.1 – 4.3.8). El glicósido de 3-O-sitosterol Ol-8 se obtuvo
como un sólido blanco (50,0 mg) luego de realizar varios lavados con acetona a la
fracción 4.3.5 (150,0 mg). En la Figura 2.4 se resume el estudio fitoquímico realizado en
la corteza de O. longifolia.
Corteza seca y molida
(1500 g)
Extracción con etanol
96%
BIOENSAYOS
Extracto etanólico
(78 g)
Fraccionamiento por CLV
(60 g)
CHCL 3
MeOH
9 FRACCIONES
Fracción 1
BIOENSAYOS
Ol-1
Ol-2
Ol-3
Ol-4
Fracciones 2 y 3
Ol-5
Fracción 4
Ol-8
Ol-6
Ol-7
Figura 2-4 Esquema general de extracción, fraccionamiento y purificación de los metabolitos
secundarios presentes en la corteza de Ocotea longifolia.
54
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
2.1.7 Evaluación de actividad antialimentaria
Para determinar la actividad antialimentaria de los extractos y compuestos se empleo el
método de discos de harina (Xie et al., 1996) con algunas modificaciones. Se preparó
una suspensión agua-harina mezclando 1,0 g de harina de trigo (1,0 g) con 5 mL de agua
destilada agitando con ayuda de ultrasonido. Posteriormente se adicionaron 2 gotas de
Tween 20 y se agitó nuevamente la mezcla. A la suspensión anterior se adicionaron 50
μL de una solución stock del extracto o compuesto, para obtener concentraciones finales
de 1000 y 500 ppm para extractos, 100 y 300 ppm para compuestos puros, agitando la
mezcla final con ayuda de ultrasonido. Alícuotas de 200 μL de la suspensión final se
colocaron en la parte inferior de cajas de Petri de plástico formando discos. Los discos se
dejaron secar a temperatura ambiente por 24 horas y posteriormente se transfirieron a
una incubadora para equilibrarlos a 27 °C y 65-70% HR durante 48 h. Cada disco harina
pesaba entre 36 y 39 mg. Una vez secos los discos, se colocaron en viales de plástico
para pesarlos, y posteriormente se ubicaron dentro de cada vial diez (10) insectos sin
sexar y se pesó el conjunto vial-disco-insectos. Todos los insectos empleados en el
ensayo se mantuvieron sin alimento por 24 horas antes de su uso. El montaje del
experimento se dejó en la cámara de cultivo durante 3 días (27 ± 1 °C y 65 ± 5 % HR). 50
μL de etanol fueron aplicados para producir los discos control. Como control positivo se
empleo el extracto etanólico de semillas de Neem. Para cada ensayo se realizaron cuatro
(4) replicas. Los Índices de Disuasión Alimentaria (IDA) se calcularon comparando los
resultados obtenidos con el alimento tratado con los observados con el alimento sin
tratar, empleando la siguiente fórmula (Liu et al., 2007):
𝐶−𝑇
�
𝐶
𝐼𝐷𝐴 = 100 × �
C= masa consumida de disco control, T= masa consumida de disco tratado
Capítulo 2
55
2.2 Resultados y discusión
2.2.1 Screening de actividad antialimentaria sobre S. seamaiz
Para evaluar la actividad fagodisuasiva sobre S. seamaiz de 18 extractos etanólicos
obtenidos de algunas especies de las familias Lauraceae, Rutaceae y Myristicaceae se
empleó un ensayo de no elección realizado con pequeños discos de harina impregnados
con el extracto a evaluar. El objetivo de este estudio preliminar de actividad
antialimentaria era determinar cual o cuales de los extractos evaluados tienen potencial
para inhibir la alimentación del gorgojo del maíz, y de esta manera seleccionar los más
activos para realizar el estudio fitoquímico. Los resultados del screening preliminar de
actividad antialimentaria se presentan en la Tabla 2.1, donde se reporta el Índice de
Disuasión Alimentaria (IDA), expresado en porcentaje, que causa cada extracto evaluado
sobre S. zeamais.
Tabla 2-1 Resultados de actividad antialimentaria sobre S. zeamais de los extractos etanólicos de
diferentes especies de las familias Rutaceae, Lauraceae y Myristicaceae
No.
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
EXTRACTO
Corteza Zanthoxylum rhoifolium
Corteza Zanthoxylum monophyllum
Corteza Zanthoxylum quinduense
Corteza Zanthoxylum fagara
Corteza Zanthoxylum rigidum
Corteza Ocotea longifolia
Madera Ocotea macrophylla
Hojas Ocotea macrophylla
Hojas Compsoneura capitellata
Madera Compsoneura capitellata
Hojas Virola elongata
Corteza Virola elongata
Madera Virola elongata
Hojas Virola peruviana
Corteza Virola peruviana
Madera Virola peruviana
Corteza Virola carinata
Madera Virola carinata
Control positivo (Extracto semillas Neem)
FAMILIA
Rutaceae
Rutaceae
Rutaceae
Rutaceae
Rutaceae
Lauraceae
Lauraceae
Lauraceae
Myristicaceae
Myristicaceae
Myristicaceae
Myristicaceae
Myristicaceae
Myristicaceae
Myristicaceae
Myristicaceae
Myristicaceae
Myristicaceae
Meliaceae
* Media ± 1DE de las cuatro repeticiones
IDA (%)
-18,1 ± 1,5
68,9 ± 2,4
37,7 ± 1,4
60,9 ± 1,7
76,9 ± 2,9
54,1 ± 1,6
23,9 ± 1,2
12,5 ± 1,4
56,3 ± 2,2
50,4 ± 1,6
19,6 ± 1,6
-4,4 ± 1,0
21,7 ± 1,4
-8,7 ± 1,5
10,9 ± 1,6
14,7 ± 1,7
23,9 ± 2,4
29,0 ± 1,6
61,3 ± 2,2
56
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Los resultados presentados en la Tabla 2.1 muestran que de los 18 extractos evaluados,
seis presentaron actividad fagodisuasiva entre moderada y fuerte (resaltados en rojo en
la tabla), de acuerdo a los criterios establecidos por Liu y colaboradores (2007):
% IDA < 20%
-
No disuasión alimentaria
50% > % IDA ≥ 20%
+
Disuasión alimentaria débil
70% > % IDA ≥ 50%
++
Disuasión alimentaria moderada
% IDA ≥ 70%
+++
Disuasión alimentaria fuerte
Dentro de los extractos que fueron activos, tres pertenecen a especies de la familia
Rutaceae (corteza de Z. monophyllum, Z. fagara y Z. rigidum), uno a la familia Lauraceae
(corteza de O. longifolia) y dos a la familia Myristicaceae (hojas y madera de C.
capitellata), siendo el extracto de corteza de Z. rigidum (IDA = 76,9 %) la sustancia que
más inhibió la alimentación de S. zeamais.
Los resultados de actividad antialimentaria reportados en la Tabla 2.1 corresponden al
primer reporte de efectos inhibitorios de la alimentación sobre insectos de productos
almacenados de los todos los extractos etanólicos evaluados.
Debido a que el desarrollo de este trabajo estuvo enmarcado en un proyecto macro
titulado:
“Búsqueda
de
metabolitos
secundarios
con
propiedades
insecticidas
pertenecientes a las familias Myristicaceae, Rutaceae y Lauraceae para el control de
insectos plaga del género Sitophilus que atacan cereales almacenados” (financiado por
Colciencias y la Universidad Nacional de Colombia), se buscaba trabajar una especie
activa de cada una de las familias objeto de estudio, razón por la que para desarrollar el
estudio
fitoquímico
se
seleccionaron
las
especies
Compsoneura
capitellata
(Myristicaceae), Ocotea longifolia (Lauraceae) y Zanthoxylum rigidum (Rutaceae), que
fueron los especímenes de cada familia que presentaron la actividad antialimentaria más
promisoria. Adicionalmente se seleccionaron estas especies debido a que presentaron un
perfil químico interesante cuando fueron sometidas a estudio cromatográfico preliminar
en CCD y HPLC, y además se tuvo en cuenta que son especies para las cuales hay
escasos o nulos reportes etnobotánicos, químicos y de actividad biológica.
Capítulo 2
57
2.2.2 Estudio fitoquímico de hojas y madera de C. capitellata
La purificación por cromatografía en columna y preparativa sobre sílica gel de las
fracciones de éter de petróleo y acetato de isopropilo, obtenidas a partir del extracto
etanólico de hojas de C. capitellata, condujo al aislamiento e identificación de dos
sesquiterpenos (eudesman-11-en-4α-ol HCc-1, ácido 15-nor-10-hidroxi-oplopan-4-oico
HCc-7), tres esteroles (β-sitosterol HCc-2, estigmasterol HCc-3 y glicósido de 3-Ositosterol HCc-11), cuatro flavonoides (biochanina A HCc-4, formononetina HCc-5,
kaempferol-3-O-(2″,4″-di-trans-p-coumaroil)-ramnósido HCc-8 y afzelina HCc-10), un
bencenoide (3,4-dihidroxibenzaldehído HCc-6) y un derivado de ácido benzóico
((-)-compsoneurósido HCc-9). Las estructuras de los compuestos aislados de las hojas
de C. capitellata se muestran en la Figura 2.5.
OH
H
HO
HO
HCc-3
HCc-2
HCc-1
H
HO
O
HO
OH O
HCc-4
O
H
OH
HO
O
O
O
O
O
H
OH
OH
HCc-5
HCc-6
HCc-7
OH
O
HO
OH
O
O
O
OH O
HO
O
O
O
HO
HO
O
OH
O
OH
O
OH
O
OH
O
OH O
O
HO
OH
O
OH
O
O
HCc-8
HCc-9
HCc-10
Glu-O
HCc-11
Figura 2-5 Compuestos aislados de las hojas de C. capitellata.
OH
58
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
El estudio fitoquímico realizado en las fracciones de hexano, cloroformo y acetato de
isopropilo obtenidas del extracto de la madera de C. capitellata permitió el aislamiento e
identificación de nueve sustancias, entre las que se encuentran dos esteroles (βsitosterol MCc-1 y estigmasterol MCc-2), una γ-lactona (megislactona MCc-3), dos
dihidrochalconas (2´,4´-dihidroxi-6´-metil-3,4-metilenodioxidihidrochalcona MCc-4 y 2´,4´dihidroxi-6´-metil-3-hidroxi-4-metoxidihidrochalcona MCc-5), dos diarilpropanos (1-(2’,4’dihidroxifenil)-3-(3’’,4’’-metilenodioxifenil)propano MCc-6 y 1-(2’,3’-dihidroxifenil)-3-(3’’,4’’metilenodioxi-6’’-metoxifenil)propano MCc-7) y dos cinchonainas (cinchonaina Ic MCc-8 y
cinchonaina Id MCc-9). En la Figura 2.6 se presentan las estructuras de los compuestos
aislados e identificados en la madera de C. capitellata.
OH
12
5
O
HO
HO
HO
OMe
HO
O
HO
O
O
OH
MCc-3
MCc-2
MCc-1
O
OMe
OMe
+
OH
O
OH
MCc-4
MCc-5
O
O
OH
HO
OH
HO
OH
HO
MCc-6
HO
O
HO
O
O
O
OH
O
OH
O
O
O
OH
OH
O
MCc-8
OH
OH
OH
MCc-9
MCc-7
Figura 2-6 Compuestos aislados de la madera de C. capitellata.
El estudio fitoquímico de C. capitellata condujo al aislamiento de una sustancia sin
reportes previos en la literatura y con estructura novedosa, que corresponde a un
derivado de ácido benzóico que fue denominado (-)-compsoneurósido HCc-9. Aunque es
común la presencia de derivados de ácido benzoico en la familia Myristicaceae, no hay
Capítulo 2
59
reportes de sustancias con estructura similar a HCc-9, en la que se tiene un fragmento
de ácido benzoico glicosidado unido a un ácido graso de cadena corta, que tiene como
característica estructural la presencia de un anillo 1,4-dioxánico.
Como resultado del estudio fitoquímico realizado en hojas y madera de C. capitellata
también se pudo determinar la presencia de sesquiterpenos, flavonoides de diversos
tipos, esteroles, γ-lactonas y bencenoides, siendo este el primer estudio químico
reportado para esta especie y para el género. Los metabolitos aislados en esta
investigación han sido reportados previamente en diferentes especies de la familia
Myristicaceae, principalmente en especies de los géneros Iryanthera y Virola, por lo que
los metabolitos secundarios encontrados en este trabjo pueden tener importancia
quimiotaxonómica para la familia y el género.
Los tipos de flavonoides presentes en las especies de la familia Myristicaceae son muy
característicos y en algunos casos pueden ser empleados como marcadores
quimiotaxonómicos de algunos géneros de la familia (Martínez, 2000), por ejemplo los
denominados virolanos, viralanoles e iryantherinas. En la presente investigación se
encontraron diferentes tipos de flavonoides (flavonas, isoflavonas, dihidrochalconas,
glocósidos de flavonas, 1,3-diarilpropanos y cinchonainas) en C. capitellata. Una
característica encontrada en los flavonoides glicosidados es la presencia del azúcar
ramnosa unido al oxígeno del C-3, como es el caso de HCc-8 y HCc-10, que esta de
acuerdo con lo reportado por Martínez en una revisión sobre la distribución de
flavonoides en la familia Myristicaceae (Martínez, 2000). La presencia de 1,3diarilpropanos e isoflavonas está muy restringida en la naturaleza y se encuentran
principalmente en especies de la familia Myristicaceae, razón por la que son conocidos
como marcadores quimiotaxonómicos de esta familia (Martínez, 2000). En este trabajo se
encontraron sustancias de tipo 1,3-diarilpropano (MCc-6 y MCc-7) en la madera e
isoflavonas (HCc-4 y HCc-5) en las hojas de C. capitellata, hecho que amplia la
distribución de estos metabolitos a otros generos de la familia, pues solo habían sido
reportados en especies de Virola, Iryanthera, Otoba, Knema y Pycnanthus. Derivados de
la (-)-epicatequina como las cinchonainas Ic (MCc-8) e Id (MCc-9) aisladas en este
trabajo son características del género Cinchona (Rubiaceae) y su distribución en la
familia Myristicaceae ha sido poco reportada, por ejemplo se han aislado de la corteza de
los tallos de I. megistophylla (Ming et al., 2002).
60
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Las butirolactonas son sustancias restringidas en la naturaleza y son características de
las Angiospermas primitivas, como es el caso de especies de las familias Myristicaceae y
Lauraceae. Este tipo de metabolitos se han encontrado en especies del género
Iryanthera y también fueron encontrados en este estudio en la madera de C. capitellata,
aislándose específicamente megislactona MCc-3, compuesto que fue encontrado
previamente en I. megistophylla (Ming, 2002).
Los compuestos HCc-1 a HCc-11 y MCc-1 a MCc-9 fueron elucidados por métodos
espectroscópicos (RMN 1D y 2D, IR, EM), por comparación con los datos descritos en la
literatura y/o por cocromatografía en CCD con muestras auténticas. A continuación se
describe la elucidación estructural detallada del compuesto HCc-9 que no tiene reportes
previos en la literatura. Los datos espectroscópicos y constantes físicas de los
compuestos conocidos se presentan de manera resumida en las Tablas 2.2 a 2.14, y
adicionalmente los espectros de RMN 1H y 13C se muestran en las Figuras 2.17 a 2.40.
Elucidación estructural del compuesto HCc-9
El compuesto HCc-9 se obtuvo como un líquido viscoso café cuyo espectro IR presentó
bandas en 3100, 2957, 2918, 2851, 1720, 1670, 1597, 1512 y 1267 cm‐1, indicando
presencia de grupos hidroxilo, carbonilos y de aromaticidad en la molécula. La rotación
óptica determinada fue [α]20
-40.3 (c 0.80, MeOH). Los espectros de RMN 1H y
𝐷
13
C
P
(Figura 2.7 y 2.8) presentan señales entre δ H 0 y 9,50, y δ C 10 y 180, respectivamente.
Los desplazamientos observados para las señales sugieren que el compuesto presenta
un anillo aromático, una unidad de monosacárido y una cadena alifática. Las señales con
δ H 6,93 (d, J = 8,7 Hz, 2H), 7,92 (d, J = 8,7 Hz, 2H) y 9,26 (s, 1H) en RMN 1H junto con
las señales en δ C 117,0 (CH), 123,2 (C), 133,8 (CH), 163,9 (C) y 167,4 (C) para
13
C,
indican que el fragmento de la parte aromática corresponde a un derivado de ácido phidroxibenzoico (Dhakal et al., 2008). Este fragmento fue confirmado por las
correlaciones observadas en los experimentos bidimensionales COSY, HMQC y HMBC.
1.36
1.34
1.33
1.32
0.92
0.90
0.88
2.60
2.58
2.56
2.54
2.37
2.36
2.33
2.32
4.97
4.69
4.66
4.65
4.53
4.51
4.51
4.49
6.94
6.91
7.93
7.91
3.85
3.67
3.65
3.63
3.61
3.35
3.34
61
9.27
Capítulo 2
4''
HO
6'
H-5’ y
H-1’’’’
H-4’a
H-7’
3.35
3.34
3.85
4.69
4.66
4.65
4.53
4.51
4.51
4.49
OH
OH
O
O1'
H-8’a
O
3'
1
HO
O
8'
O
4.97
7''
2''
3.67
3.65
3.63
3.61
O
6''
2
CH3 (H-6’’’)
1'''
3'''
5'''
H-2’’ y H-6’’
5.0
4.4
4.6
4.8
4.2
4.0
f1 (ppm)
3.6
3.8
3.4
H-3’’ y H-5’’
9.5
9.0
8.5
7.5
8.0
7.0
6.5
6.0
5.5
5.0
f1 (ppm)
4.5
4.0
3.5
3.0
2.5
2.0
1.5
3.5
5.9
2.9
1.5
1.1
2.6
1.3
1.9
1.0
1.8
1.9
1.1
2.0
0.8
H-O-(C-4’’)
1.0
0.5
0.0
1
15.3
33.7
32.7
29.8
26.7
25.5
24.2
63.5
82.0
81.6
76.9
76.5
76.4
73.5
117.0
123.2
133.8
167.4
163.9
179.1
RMN13C
104.3
Figura 2-7 Espectro RMN H para el compuesto HCc-9 (acetona-d 6 , 400 MHz).
O
6''
7''
HO
4''
6'
8'
O
HO
O
2''
O1'
O
3'
1
OH
OH
O
4C
2
1'''
3'''
C-1
5'''
C-4’’
C-7’’
C-1’’
C-3’’
y
C-5’’
C-2’’
y
C-6’’
DEPT 135
1 CH3
C-4’a
C-6’ a
C-8’
C-6’’’
11 CH
7 CH2
210
200
190
180
170
160
150
Figura 2-8 Espectro de RMN
140
13
130
120
110
100
f1 (ppm)
90
80
70
60
C-1’’’’
50
40
30
20
C y DEPT 135 del compuesto HCc-9 (acetona-d 6 , 100 MHz)
10
62
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Las señales en δ H 3,35 (td, J = 8,8; 8,8; 4,0 Hz, 1H), 3,65 (m, 3H), 3,80 (td, J = 9,2; 4,6
Hz, 1H), 4,52 (d, J = 8,8 Hz, 1H) y 4,97 (t, J = 9,5 Hz, 1H) para RMN 1H y las señales en
δ C 63,5 (CH 2 ), 73,5 (CH), 76,4 (CH), 76,5 (CH), 76,9 (CH), y 104,3 (CH) para 13C, indican
la presencia de una hexosa en forma hemiacetálica. La conectividad de cada hidrógeno
del monosacárido con su respectivo carbono fue establecida por medio del experimento
HMQC (Figura 2.9). Por ejemplo, se estableció que la señal del carbono anomérico en δ C
104,3 (CH) conecta con la señal de hidrógeno en δ H 4,52 (d, J = 8,8 Hz, 1H) y las
señales en δ C 63,5 (CH 2 ) y 76,9 (CH) conectan con la señal de los hidrógenos centrados
en 3,65 (m, 3H).
20
30
40
50
60
70
90
100
f1 (ppm)
80
110
120
130
140
150
160
170
9.5
9.0
8.5
8.0
7.5
7.0
6.5
6.0
5.5
5.0
f2 (ppm)
4.5
4.0
3.5
3.0
2.5
2.0
1.5
1.0
Figura 2-9 Espectro HMQC para el compuesto HCc-9 (acetona-d 6 , 400 MHz).
Con base en el análisis de las constantes de acoplamiento y a las correlaciones
escalares observadas en el experimento COSY (Figura 2.10), se determinó que el
fragmento de monosacárido cíclico corresponde a la β-glucopiranosa (Roslund et al.,
2008). Con este análisis se estableció correlación entre el protón sobre el carbono
Capítulo 2
63
anomérico en δ H 4,52 (d, J = 8,8 Hz, 1H) con el protón en δ H 3,35 (td, J = 8,8; 8,8; 4,0
Hz, 1H), que a su vez correlaciona con el protón en δ H 3,80 (td, J = 9,2; 4,6 Hz, 1H), y el
cual correlaciona con el protón en δ H 4,97 (t, J = 9,5 Hz, 1H) que a su vez correlaciona
con los protones centrados en δ H 3,65 (m, 3H) que corresponden al metino y metileno de
las posiciones 6’ y 1’’’’.
0
1
2
3
5
f1 (ppm)
4
6
7
8
9
10
9.5
9.0
8.5
8.0
7.5
1
7.0
6.5
6.0
5.5
5.0
f2 (ppm)
4.5
4.0
3.5
3.0
2.5
2.0
1.5
1.0
0.5
1
Figura 2-10 Espectro COSY H- H para el compuesto HCc-9 (acetona-d 6 , 400 MHz).
Las señales que aún no se han asignado en δ H 0,90 (t, J = 6,9 Hz, 3H), 1,50 (m, 10H),
2,36 (m, 1H), 2,56 (m, 1H), 3,85 (td, J = 6,5; 2,2 Hz, 1H) y 4,69 (m, 1H) para hidrógeno,
junto con las señales en δ C 15,3 (CH 3 ), 24,2 (CH 2 ), 25,5 (CH 2 ), 26,7 (CH 2 ), 29,8 (CH 2 ),
32,7 (CH 2 ), 33,7 (CH 2 ), 81,6 (CH), 82,0 (CH) y 179,1 (C) para
13
C, indican que el
fragmento alifático puede corresponder a un ácido carboxílico lineal de diez átomos de
carbono, en cuya cadena alifática hay dos carbonos oxigenados. En el experimento
COSY (Figura 2.10) se observan las correlaciones escalares entre el protón en δ H 3,85
(td, J = 6,5; 2,2 Hz, 1H) con los protones en δ H 1,50 (m, 10H) y del protón δ H 4,69 (m,
1H) con los hidrógenos de un metileno en posición α al carbonilo con δ H 2,36 (m, 1H) y
64
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
2,56 (m, 1H). Esto sugiere que los carbonos oxigenados del ácido graso deben
corresponder a los carbonos β y γ respecto al carboxilo (Silverstein y Webster, 1996). El
análisis realizado hasta el momento permite plantear tres subunidades presentes en el
compuesto HCc-9 y que se ilustran en la Figura 2.11.
O
H OH
O
O
HO
HO
O
O
H O
H
H
O
O
OH
H
O
Figura 2-11 Sub-estructuras planteadas para el compuesto HCc-9
Para unir los fragmentos propuestos, se realizó el análisis de las correlaciones a larga
distancia observadas en el experimento HMBC (Figura 2.12).
10
20
30
40
50
60
70
90
100
110
120
130
140
150
160
170
180
9.5
9.0
8.5
8.0
7.5
7.0
6.5
6.0
5.5
5.0 4.5
f2 (ppm)
4.0
3.5
3.0
2.5
2.0
1.5
1.0
Figura 2-12 Espectro HMBC para el compuesto HCc-9 (acetona-d 6 , 400 MHz).
0.5
f1 (ppm)
80
Capítulo 2
65
En el espectro HMBC (Figura 2.12) se observa la correlación de los hidrógenos en δ H
7,92 (d, J = 8,7 Hz, 2H) con el carbono en δ C 167,4 (C), que corrobora la asignación de
un carbono carboxílico sobre el anillo aromático, y se observa correlación de este
carbono con el hidrógeno en δ H 4,97 (t, J = 9,5 Hz, 1H) de la glucopiranosa, lo que indica
que el azúcar esta unido al derivado de ácido benzoico por el oxígeno ubicado en el
carbono 4. Por otro lado, se observa la correlación del hidrógeno ubicado sobre el
carbono anomérico en δ H 4,52 (d, J = 8,8 Hz, 1H) con uno de los carbonos oxigenados
del fragmento de ácido carboxílico hacia δ C 82 (CH), y del hidrógeno sobre el carbono γ
del ácido alifático en δ H 3,85 (td, J = 6,5; 2,2 Hz, 1H) con el carbono anomérico en δ C
104,3 (CH), lo que indica que la glucopiranosa está unida al ácido carboxílico alifático
mediante un oxígeno presente entre el carbono anomérico y el carbono oxigenado en
posición γ respecto al carboxilo. En el experimento COSY se puede observar la
correlación entre los hidrógenos en δ H 4,52 (d, J = 8,8 Hz, 1H) y 3,85 (td, J = 6,5; 2,2 Hz,
1H); así como la correlación entre el hidrógeno en δ H 4,69 (m, 1H) y el hidrógeno en δ H
3,35 (td, J = 8,8; 4,0 Hz, 1H), confirmando que el azúcar esta unido al ácido graso a
través de los oxígenos en las posiciones β y γ, formándose así otro ciclo como se
muestra en la Figura 2.13, en donde se resumen algunas de las correlaciones
observadas en COSY y HMBC.
O
O
OH
HO
OH
O
HO
O
O
O
HMBC
COSY
Figura 2-13 Principales correlaciones observadas en COSY y HMBC para el compuesto HCc-9.
El análisis espectroscópico realizado conduce a que el compuesto presenta una fórmula
molecular de C 23 H 32 O 10 , consistente con 8 grados de insaturación y que está de acuerdo
con el análisis realizado por EMAR con ESI en modo positivo, en donde se observaron
iones pseudomoleculares con fórmula molecular de C 23 H 32 O 10 Na (m/z 491,1888
[M+Na]+, calculado para C 23 H 32 O 10 Na, 491,1893) y de fórmula C 23 H 33 O 10 (m/z 469,2062
[M+H]+, calculado para C 23 H 33 O 10 , 469,2073).
66
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Para determinar la estereoquímica del compuesto se utilizó el modelamiento molecular
computacional junto con el experimento NOESY. El modelo molecular se realizó con el
programa PC Spartan Pro 2005 para determinar el conformero más estable y visualizar la
molécula en su forma tridimensional. El resultado obtenido indica que la conformación
más estable de los ciclos fusionados de seis miembros es en forma de silla.
1.0
1.5
2.0
3.0
3.5
4.0
4.5
5.0
5.5
5.5
5.0
4.5
4.0
3.5
f2 (ppm)
3.0
2.5
2.0
1.5
1.0
Figura 2-14 Espectro NOESY para el compuesto HCc-9 (acetona-d 6 , 300 MHz).
En el experimento NOESY (Figura 2.14) se observan correlaciones espaciales entre el
protón anomérico en δ H 4,52 (d, J = 8,8 Hz, 1H) con los protones en δ H 3,80 (td, J = 9,2;
4,6 Hz, 1H) y en 3,65 (m, 3H), y del protón en δ H 3,35 (td, J = 8,8; 4,0 Hz, 1H) con el
protón en δ H 3,85 (td, J = 6,5; 6,5; 2,2 Hz, 1H), el cual a su vez correlaciona con el protón
en δ H 4,69 (m, 1H). Lo anterior confirma que el monosacárido es la β-glucopiranosa e
indica que los hidrógenos sobre los carbonos β y γ respecto al carboxilo están en
posición synperiplanar entre ellos y respecto al hidrógeno de la posición 8a, estando de
este modo de acuerdo al conformero más estable calculado con el programa
f1 (ppm)
2.5
Capítulo 2
67
computacional y cuyos resultados se ilustran en la Figura 2.15, donde se resaltan las
correlaciones observadas en el espectro NOESY.
Figura 2-15 Estructura tridimensional del conformero más estable del compuesto HCc-9
La estereoquímica propuesta fue asignada teniendo en cuenta las correlaciones
establecidas con el experimento NOESY, la estereoquímica de la β-D-glucopiranosa y el
valor de la rotación óptica (York et al., 1997). De este modo, HCc-9 fue identificado como
ácido (2’R, 3’S, 4’aS, 6’R, 7’R, 8’R, 8’aR) 2-(3’-hexil-8’-hidroxi-7’-(4’’-hidroxibezoiloxi)-6’(hidroximetil)hexahidro-4’aH-pirano[2’,3’-b][1’,4’]dioxin-2’-il)
acético,
denominado
(-)-
compsoneurósido (Figura 2.16). Este compuesto presenta una estructura inusual que no
ha sido previamente reportada en la literatura, originándose por biosíntesis mixta
mediante la condensación de un éster β-D-glucosídico del ácido p-hidroxibenzoico y un
ácido graso con insaturación o dihidroxilación poco comunes en las posiciones β y γ.
Ácidos grasos beta gama insaturados con isomería cis han sido reportados previamente
en microalgas y bacterias marinas, siendo estas sustancias precursoras de macrólidos
(Dewick, 2009). En esta investigación se reporta por primera vez la presencia en plantas
de metabolitos secundarios derivados de ácidos grasos beta gama insaturados, lo que
sugiere que este tipo ácidos no son exclusivos de organismos marinos.
O
O
HO
OH
HO
O
O
HO
O
O
Figura 2-16 Estructura del componeurósido HCc-9
68
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
DATOS ESPETROSCÓPICOS COMPUESTOS CONOCIDOS AISLADOS DE HOJAS Y
MADERA DE C. capitellata
Tabla 2-2 Constantes físicas y datos espectroscópicos para Eudesm-11-en-4α-ol HCc-1
Nombre:
Eudesm-11-en-4α-ol HCc-1
15
Estado físico
9
1
5
3
Aceite translúcido
Fórmula molecular
7
13
11
H
OH
14
C 15 H 26 O
Peso molecular
222.3 g/mol
Rotación óptica
[α]20
: +26.1°(c 0.35, CHCl 3 )
𝐷
IR: ν (cm-1) = 3392 (O-H), 3086 (=C-H), 2945 (C-H), 1645 (C=C), 1388 (HC-H),1235 (C-O) cm-1.
12
RMN 1H (400 MHz, CDCl 3 ): δ 4,70 (m, 2H, H-12), 1,88 (m, 4H, H-3 y H-6), 1.74 (s, 3H, H-13), 1,55 (m, 3H, H-2 y H-8a),
1,41 (m, 3H, H-1 y H-9a), 1,25 (m, H-1, H-5a), 1,18 (m, 2H, H-8b y H-9b), 1,11 (s, 3H, H-14), 1,03 (m, 1H, H-7), 0,88 (s,
3H, H-15).
RMN 13C (100 MHz, CDCl 3 ): δ 150,7 (C-11), 108,1 (C-12), 72,2 (C-4), 54,9 (C-5), 46,3 (C-7), 44,6 (C-9), 43,4 (C-3), 41,1
(C-1), 34,6 (C-10), 26,8 (C-8), 26,0 (C-6), 22,7 (C-14), 21,1 (C-13), 20,1 (C-2), 18,7 (C-15).
1.74
1.56
1.55
1.54
1.54
1.44
1.42
1.41
1.40
1.25
1.24
1.20
1.19
1.11
1.03
0.88
4.71
4.69
4.69
Datos descritos en la literatura: Corbett y Smith, 1967.
15
9
1
5
3
7
13
H-14
11
H-15
H
OH
14
12
H-13
7.5
7.0
6.5
6.0
5.5
5.0
4.0
3.5
f1 (ppm)
1
3.0
2.5
2.0
4.04
4.67
3.96
3.85
1.32
3.92
4.84
4.5
2.93
2.00
H-12
1.5
Figura 2-17 Espectro de RMN H (CDCl 3 , 400 MHz) para HCc-1
1.0
0.5
34.6
26.8
26.0
22.7
21.1
20.1
18.7
54.9
72.2
108.1
RMN13C
46.3
44.6
43.3
41.1
69
150.7
Capítulo 2
15
9
1
5
3
7
13
C-5
11
H
OH
14
C-4
12
C-11
C-7
DEPT 135
C-15
C-12
170
160
150
140
130
120
110
C-2
100
Figura 2-18 Espectro de RMN
90
80
f1 (ppm)
70
60
50
40
30
20
10
13
C y DEPT 135 (CDCl 3 , 100 MHz) para HCc-1
Tabla 2-3 Constantes físicas y datos espectroscópicos para biochanina A HCc-4
Nombre:
HO
8
O
4
OH
2
1'
3'
O
5'
O
Biochanina A HCc-4
Estado físico
Sólido rojo
Fórmula molecular
C 16 H 12 O 5
Peso molecular
284,1 g/mol
Punto de fusión
211 – 213 °C (Acetona)
IR: ν (cm-1) = 3420 (O-H), 2935 (C-H), 1657 (C=O), 1611 (C=C), 1551
(C=C), 1510 (C=C), 1234 (C-O), 1118 (C-O).
RMN 1H (400 MHz, acetona-d 6 ): δ 12,99 (s, 1H, OH), 8,20 (s, 1H, H-2), 7,55 (d, J = 8,8 Hz, 2H, H-2’, H-6’), 7,00 (d, J =
8,8, 2,2 Hz, 2H, H-3’, H-5’), 6,43 (sa, 1H, H-8), 6,41 (sa1H, H-6), 3,84 (s, 3H, OCH 3 ).
RMN 13C (100 MHz, acetona-d 6 ): δ 182,6 (C-4), 166,2 (C-7), 164,9 (C-5), 161,7 (C-4’), 160,0 (C- 9), 155,5 (C-2), 132,1
(C-2´y C-6’), 125,2 (C-3), 124,8 (C-1’), 117,7 (C-4a), 115,5 (C-3’ y C-5’), 100,9 (C-6), 95,5 (C-8), 56,6 (OCH 3 ).
Datos descritos en la literatura: Dos Santos et al., 1995; Braz Filho et al., 1976.
70
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
8
HO
O
3.84
7.01
6.99
6.43
6.29
2
4
OH
8.20
8.01
7.80
7.78
7.56
7.53
9.85
12.99
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
1'
3'
O
OCH3
O
5'
H-2’
H-6’
H-3’
H-5’
OH
11.5
10.5
9.0
8.5
7.5
7.0
f1 (ppm)
8.0
6.5
3.27
1.13
1.14
3.50
1.05
0.36
1.22
2.37
9.5
6.0
5.5
5.0
4.5
4.0
3.5
3.0
2.5
2.0
1.5
15.32
12.5
24.26
13.5
0.99
0.83
H-6
H-8
1.0
0.5
1
HO
8
O
56.59
95.50
2
4
OH
133.78
132.10
125.20
124.80
117.67
115.53
166.18
164.89
161.69
160.06
155.52
182.57
192.02
RMN13C
100.89
Figura 2-19 Espectro de RMN H (acetona d 6 , 400 MHz) para HCc-4
1'
3'
O
C-2’
C-6’
O
5'
C-3’
C-5’
OCH3
C-6
C-8
C-4
DEPT 135
230
220
210
200
190
180
170
160
150
Figura 2-20 Espectro de RMN
140
13
130
120
110
f1 (ppm)
100
90
80
70
60
50
40
30
20
10
C y DEPT 135 (acetona d 6 , 100 MHz) de para HCc-4
0
Capítulo 2
71
Tabla 2-4 Constantes físicas y datos espectroscópicos para la formononetina HCc-5
Nombre:
8
HO
O
7
Estado físico
1
Sólido marrón
2
9
Fórmula molecular
2'
10
6
Formononetina HCc-5
4
3
1'
3'
5
O
4'
6'
O
5'
C 16 H 12 O 4
Peso molecular
268,1 g/mol
Punto de fusión
258 – 260 °C (Acetona)
IR: ν (cm ) = 3416 (O-H), 2950 (C-H), 1659 (C=O), 1611 (C=C),
1561 (C=C), 1501 (C=C), 1243 (C-O), 1117 (C-O).
-1
RMN 1H (400 MHz, acetona-d 6 ): δ 8,17 (s, 1H, H-2), 8,06 (d, J= 8,8 Hz, 1H, H-5), 7,56 (d, J = 8,8 Hz, 2H, H-2’, H-6’), 7,00
(dd, J = 8,8, 2,2 Hz, 1H, H-6), 6,97 (d, J = 8,8, 2H, H-3’, H-5’), 6,90 (d, J = 2,2 Hz, 1H, H-8), 3,83 (s, 3H, OCH 3 ).
RMN 13C (100 MHz, acetona-d 6 ): δ 175,4 (C-4), 161,5(C-7), 159,8 (C-4’), 154,4 (C-9), 152,5 (C-2), 132,0 (C-2’ y C-6’),
129,5 (C-5), 126,6 (C-3), 125,9 (C-1’), 117,0 (C-10), 116,7 (C-6), 115,4 (C-3’ y C-5’), 104,2 (C-8), 56,6 (4-OCH 3 )
3.83
7.01
7.01
6.99
6.98
6.97
6.91
6.90
7.57
7.55
8.07
8.05
8.17
8.07
8.05
8.01
7.57
7.55
7.01
7.01
6.99
6.98
6.97
6.91
6.90
Datos descritos en la literatura: Zhao et al., 2009; Tolleson et al, 2002; Herath et al., 1998.
4’ OCH3
8
HO
O
7
1
H-3’
2
9
H-2’
2'
10
6
4
3
1'
3'
5
H-5
H-8
H-6
O
4'
6'
O
5'
8.1
8.0
7.9
7.8
7.7
7.6
7.5 7.4
f1 (ppm)
7.3
7.2
7.1
7.0
6.9
14
13
12
11
10
9
8
7
3.49
3.50
1.15
1.00
1.07
15
2.18
H-2
6
f1 (ppm)
1
5
4
3
2
1
0
-1
Figura 2-21 Espectro de RMN H (acetona d 6 , 400 MHz) para HCc-5
-2
-3
-4
72
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
8
HO
O
7
1
56.5
80.3
80.0
79.7
104.2
2
9
2'
10
6
116.7
115.4
RMN13C
132.0
129.5
161.5
159.8
154.4
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
4
3
1'
C-2 y
C-6
3'
5
O
4'
6'
O
5'
C-9
C-7
DEPT 135
C-3 y
C-5
4-O-CH3
210
200
190
180
170
160
150
140
Figura 2-22 Espectro de RMN
130
120
110
f1 (ppm)
100
90
80
70
60
50
40
30
20
10
13
C y DEPT 135 (acetona d 6 , 100 MHz) de para HCc-5
Tabla 2-5 Datos espectroscópicos para la mezcla de los compuestos 3,4-dihidroxibenzaldehído
(HCc-6) y ácido 15-nor-10-hidroxioplopan-4-oico (HCc-7)
H
O
13
12
11
Nombre:
O
OH
H
7
4
Estado físico
5
10
OH
HCc-6
14
OH
Sólido café
3
1
HO
3,4-dihidroxibenzaldehído (HCc-6) y ácido 15nor-10-hidroxioplopan-4-oico (HCc-7)
H
HCc-7
Fórmula molecular
C 7 H 6 O 3 y C 14 H 24 O 3
Peso
138,0 y 240,2 g/mol
Datos para HCc-6 (desde la mezcla) = RMN H (400 MHz, acetona-d 6 ): δ 9,77 (s, 1H, CHO), 8,01 (s, 1H, OH), 7,36 (d, J =
1.9 Hz, 1H, H-2), 7,33 (dd, J = 8,0; 1.9 Hz, 1H, H-6), 6,99 (d, J = 8,0 Hz, 1H, H-5). RMN 13C (100 MHz, acetona-d 6 ): δ
192,2 (CHO), 153,5 (C-4), 147,6 (C-3), 131,9 (C-1), 126,4 (C-6), 117,2 (C-5), 116,2 (C-2).
1
Datos para HCc-7 (desde la mezcla): RMN 1H (400 MHz, acetona-d 6 ): δ 2,40 (ddd, J = 10,9; 9,6; 5,5 Hz, 1H, H-5), 1,84
(m, 1H, H-11), 1,72 (m, 2H, H-9a y H-1), 1,56 (m, 2H, H-8), 1,48 (m, 2H, H-2), 1,43 (m, 1H, H-6), 1,39 (m, 1H, H-9b), 1,28
(m, 2H, H-3), 1,15 (m, 1H, H-7), 1,12 (s, 3H, H-14), 0,90 (d, J = 6,8 Hz, 3H, H-12), 0,73 (d, J = 6,8 Hz, 3H, H-13); RMN 13C
(100 MHz, acetona-d 6 ): δ 179,8 (C-4), 73,1 (C-10), 58,8 (C-6), 51,4 (C-7), 50,0 (C-1), 49,5 (C-5), 44,0 (C-9), 30,9 (C-3),
30,4 (C-11), 27,2 (C-2), 24,6 (C-8), 23,2 (C-12), 21,4 (C-14), 17,0 (C-13).
Datos reportados en la literatura para HCc-6 Mulvena et al., 1969 y para HCc-7: Brown et al., 2003.
2.43
2.41
2.40
2.40
2.39
2.39
2.38
2.36
7.36
7.35
7.35
7.34
7.33
7.32
7.00
6.98
9.77
H
13
12
O
1.84
1.71
1.51
1.48
1.39
1.38
1.28
1.12
0.91
0.89
0.74
0.72
73
8.01
Capítulo 2
11
O
OH
H
7
4
5
HO
14
OH
OH
HCc-6
3
1
10
H
H-14
HCc-7
H-12
H-13
10.0
9.5
9.0
8.5
8.0
7.5
7.0
6.5
6.0
5.5
5.0
f1 (ppm)
4.5
4.0
3.5
3.0
2.5
2.78
5.18
3.52
2.89
1.35
3.23
4.72
0.86
5.46
4.39
1.00
1.87
0.41
0.92
10.5
1.80
H-5
2.0
1.5
1.0
0.5
0.0
1
H
O
27.1
24.6
23.2
21.4
17.0
51.4
50.0
49.5
44.0
58.8
73.1
117.2
116.2
126.4
131.9
147.6
153.5
RMN13C
179.8
192.2
Figura 2-23 Espectro de RMN H (acetona d 6 , 400 MHz) de la mezcla de HCc-6 y HCc-7.
13
12
11
O
OH
H
7
4
5
10
HO
14
OH
CHO
HCc-6
C-4
3
1
OH
C-6
H
C-13
C-10
HCc-7
DEPT 135
C-9
220
210
200
190
180
170
160
Figura 2-24 Espectro de RMN
150
13
140
130
120
110
f1 (ppm)
100
90
80
70
60
50
40
30
20
C y DEPT 135 (acetona d 6 , 100 MHz) de la mezcla de HCc-6 y
HCc-7
74
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Tabla 2-6 Constantes físicas y datos espectroscópicos para kaempferol-3-O-(2″,4″-di-E-pcoumaroil)-ramnósido HCc-8
3'
HO
9
OH
1'
O
5'
Estado físico
1
10
OH
O
O
5''
1''''
9''''
5''''
7''''
O
1''
3''
1'''
9'''
Sólido amarillo
OH
O
3''''
HO
3'''
3
6
kaempferol-3-O-(2″,4″-di-E-p-coumaroil)ramnósido HCc-8
Nombre:
5'''
Fórmula molecular
C 39 H 32 O 14
Peso molecular
724,2 g/mol
Punto de fusión
Se descompone a 230°C antes de fundir
7'''
O
OH
O
O
RMN 1H (400 MHz, CDCl 3 -CD 3 OD): δ 7,67 (d, J = 8,7 Hz, 2H, H-2’, H-6’), 7,57 (d, J= 15,9 Hz, 1H, H-7’’’’), 7,49 (d, J =
15,9 Hz, 1H, H-7’’’), 7,37 (d, J = 8,6 Hz, 2H, H-2’’’, H-6’’’), 7,32 (d, J = 8,6 Hz, 2H, H-2’’’’, H-6’’’’), 6,93 (d, J = 8,7 Hz, 2H,
H-3’, H-5’), 6,75 (d, J = 8,6 Hz, 2H, H-3’’’, H-5’’’), 6,72 (d, J = 8,6 Hz, 2H, H-3’’’’, H-5’’’’), 6,29 (d, J = 2,0 Hz, 1H, H-6), 6,25
(d, J = 15,9 Hz, H-8’’’’), 6,18 (d, J = 2,0 Hz, 1H, H-8), 6,16 (d, J = 15,9 Hz, H-8’’’), 5,63 (sa, 1H, H-1’’), 5,48 (sa, 1H, H-2’’),
4,88 (t, J = 9,8 Hz, 1H, H-4’’), 4,09 (dd, J = 9,8, 3,4 Hz, 1H, H-3’’), 3,35 (m, 1H, H-5’’), 0,84 (d, J = 6,2 Hz, 3H, H-6’’).
RMN 13C (100 MHz, CDCl 3 -CD 3 OD): δ 177,8 (C-4), 167,6 (C-9’’’’), 167,0 (C-9’’’), 163,9 (C-7), 161,4 (C-5), 159,8 (C-4’’’),
159,3 (C-4’’’’), 159,3 (C-4’), 157,7 (C-9), 156,9 (C-2), 146,3 (C-7’’’), 145,9 (C-7’’’’), 133,5 (C-3), 132,5 (C-2’ y C-6’), 130,5
(C-2’’’ y C-6’’’), 130,0 (C-2’’’’ y C-6’’’’),125,7 (C-1’’’ y C-1’’’’), 121,1 (C-1’), 115,6 (C-3’ y C-5’), 115,4 (C-3’’’ y C-5’’’), 114,9
(C-3’’’’ y C-5’’’’), 113,5 (C-8’’’), 113,3 (C-8’’’’), 104,9 (C-10), 98,9 (C-1’’), 97,9 (C-6), 94,0 (C-8), 73,5 (C-4’’), 71,7 (C-2’’),
68,3 (C-5’’), 67,8 (C-3’’),16,8 (C-6’’).
HO
9
1.09
O
3''''
7.40
1.89
1.93
2.07
1.11
7.55 7.50 7.45
f1 (ppm)
7.35
6.30
6.29
6.27
6.23
6.18
6.17
6.14
6.76
6.74
6.74
6.71
6.94
6.92
0.85
0.84
3.36
3.35
3.34
OH
O
O
7''''
O
1''
5''
9''''
5''''
7.60
4.11
4.10
4.08
4.08
10
OH
H-7’’’
3'''
3
6
3''
1'''
9'''
H-3’ y
H-5’
5'''
H-3’’’ y H-5’’’
H-8’’’, H-8 y
H-8’’’’
H-6
7'''
O
OH
O
O
7.0
7.30
6.9
6.8
4.02
H-2’’’’ y
H-6’’’’
1''''
7.65
OH
5'
1
H-2’’’ y
H-6’’’
HO
7.70
1'
O
4.44
H-2’ y
H-6’
H-7’’’’
4.90
4.88
4.85
6.30
6.29
6.27
6.18
6.17
5.62
5.48
5.48
5.48
6.94
6.76
6.74
6.74
7.38
7.36
7.33
7.30
3'
2.00
7.51
7.47
7.60
7.56
7.69
7.67
7.69
7.67
7.60
7.56
7.51
7.47
7.38
7.36
7.33
7.30
7.26
Datos descritos en la literatura: Lee et al., 2008; Jagan Mohan Rao et al., 2002; Fiorini et al., 1998
6.7
6.6
6.5
f1 (ppm)
6.4
6.3
6.2
6.1
H-6’’
H-1’’
H-4’’
H-2’’
H-3’’
8.5
8.0
7.5
6.5
5.5
5.0
1
4.5
f1 (ppm)
4.0
3.5
3.11
1.03
1.59
0.96
0.84
6.0
1.07
4.02
2.00
7.0
4.44
2.07
1.11
1.09
3.86
H-5’’
3.0
2.5
2.0
1.5
Figura 2-25 Espectro RMN H (CDCl 3 -CD 3 OD, 400 MHz) para HCc-8
1.0
0.5
0.0
16.8
73.5
71.7
68.2
67.7
98.9
97.9
94.0
133.5
132.5
132.4
130.5
130.0
125.7
121.1
146.3
145.9
115.6
115.4
113.5
113.3
104.9
75
167.6
167.0
163.9
161.4
159.8
159.3
157.7
156.9
177.8
Capítulo 2
RMN13C
C-3’ y C-5’
C-6’’
C-4
C-1’
C-10
3'
DEPT 135
C-3’’ y C-5’’
HO
1'
O
9
OH
5'
1
10
OH
1''''
9''''
7''''
170
180
160
150
140
130
Figura 2-26 Espectro de RMN
120
110
100
f1 (ppm)
90
80
70
60
O
O
1''
5''
5''''
190
OH
O
O
3''''
HO
C-7’’’ y C-7’’’
3'''
3
6
3''
1'''
9'''
5'''
7'''
O
OH
O
O
50
40
30
20
10
13
C y DEPT 135 (CDCl 3 -CD 3 OD, 100 MHz) de para HCc-8
Tabla 2-7 Constantes físicas y datos espectroscópicos para (-)-compsoneurósido HCc-9
Nombre:
O
6''
7''
HO
HO
6'
8'
O
OH
O
O1'
Líquido viscoso café
Fórmula molecular
C 23 H 32 O 10
OH
Peso molecular
468,2 g/mol
[α]20
:
𝐷
Rotación óptica
3'
1
Estado físico
O
2''
4''
(-)-compsoneurósido HCc-9
O
2
Datos EMAR
1'''
3'''
5'''
-40.3 (c 0.80, MeOH)
Masa calculada para C 23 H 33 O 10 469,2073
observada 469,2062
IR: ν (cm-1) = 3100 (OH), 2957 (C-H), 2918 (C-H), 2851 (C-H), 1720 (C=O), 1670 (C=O), 1597 (C=C), 1512 (C=C) y 1267
(C-O).
RMN 1H (400 MHz, acetona-d 6 ): δ 9,27 (s, 1H, 4’’-OH), 7,92 (d, J = 8,7 Hz, 2H, H-2’’ y H-6’’), 6,92 (d, J= 8,7 Hz, 2H, H-3’’
y H-5’’), 4,97 (t, J = 9,5 Hz, 1H, H-7’), 4,69 (m, 1H, H-2’), 4,52 (d, J = 8,8 Hz, 1H, H-4’a), 3,85 (td, J = 6,5, 2,2 Hz, 1H, H3’), 3,80 (td, J = 9,2, 4,6 Hz, 1H, H-8’), 3,65 (m, 3H, H-6’ y H-1’’’’), 3,35 (td, J = 8,8, 4,0 Hz, H-8’a), 2,56 (m, 1H, H-2a),
2,36 (m, 1H, H-2b), 1,50 (m, 10H, H-1’’’ hasta H-5’’’), 0,90 (t, J = 6,9 Hz, 3H, H-6’’’).
RMN 13C (100 MHz, acetona-d 6 ): δ 179,1 (C-1), 167,4 (C-7’’), 163,9 (C-4’’), 133,8 (C-2’’ y C-6’’), 123,2 (C-1’’), 117,0 (C3’’ y C-5’’), 104,3 (C-4’a), 82,0 (C-3’), 81,6 (C-2’), 76,9 (C-6’), 76,5 (C-8’a), 76,4 (C-7’), 73,5 (C-8’), 63,5 (C-1’’’’), 33,7 (C2), 32,7 (C-1’’’), 29,8 (C-2’’’), 26,7 (C-3’’’), 25,5 (C-4’’’), 24,2 (C-5’’’), 15,3 (C-6’’’).
Elucidación estructural por análisis espectroscópico descrita en las páginas 60 – 67.
76
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Tabla 2-8 Constantes físicas y datos espectroscópicos para afzelina HCc-10
3'
HO 7
9
afzelina HCc-10
Estado físico
O
3
O
O
1''
5
Sólido naranja
5'
1'
1
OH O
Nombre:
OH
OH
5'' 3''
OH
Fórmula molecular
C 21 H 20 O 10
Peso molecular
432,1 g/mol
Punto de fusión
Se descompone a 220°C antes de fundir
IR: ν (cm-1) = 3425 (O-H), 2942 (C-H), 1669 (C=O), 1605 (C=C), 1519
(C=C), 1464 (C=C),1230 (C-O), 1110 (C-O).
OH
RMN 1H (400 MHz, acetona-d 6 ): δ 7,85 (d, J = 8,8 Hz, 2H, H-2’, H-6’), 7,02 (d, J = 8,8 Hz, 2H, H-3’, H-5’), 6,47 (d, J = 2,0
Hz, 1H, H-8), 6,26 (d, J = 2,0 Hz, 1H, H-6), 5,53 (sa, 1H, H-1’’), 4,45 (m, 1H, H-3’’), 4,23 (sa, 1H, H-2’’), 3,80 – 3,30 (m,
2H, H-4’’ y H-5’’), 0,90 (d, J = 5,8 Hz, 3H, H-6’’).
RMN 13C (100 MHz, acetona-d 6 ): δ 180,3 (C-4), 166,0 (C-7), 164,2 (C-5), 161,9 (C-4’), 159,4 (C-2), 159,0 (C-9), 136,7
(C-3), 132,7 (C-2’ y C-6’), 123,5 (C-1’), 117,3 (C-3’ y C-5’), 106,8 (C-10), 103,5 (C-1’’), 100,5 (C-6), 95,5 (C-8), 74,0 (C3’’), 73,1 (C-4’’), 72,5 (C-2’’), 71,6 (C-5’’),18,7 (C-6’’).
HO 7
O
9
1'
1
3
5
OH O
0.90
0.89
3.35
3.33
3.32
3.31
3.77
3.75
3.71
3.70
3.69
3.66
5.53
4.49
4.46
4.45
4.44
4.43
4.23
4.13
4.12
4.11
4.10
3.77
3.75
3.71
3.70
3.69
3.66
3.35
3.33
3.32
3.31
3.07
7.03
7.01
6.47
6.47
6.27
6.26
4.23
4.13
4.12
4.11
4.10
3'
4.49
4.46
4.45
4.44
4.43
7.86
7.84
12.70
Datos descritos en la literatura: Soliman et al., 2002; Matthes et al., 1980.
OH
5'
O
O 1''
OH
4.5
4.1
4.3
3.9
f1 (ppm)
2.11
2.95
0.95
1.72
OH
OH
1.92
5'' 3''
3.7
3.5
3.3
H-6’’
H-3’ y
H-5’
13.0
12.5
12.0
11.5
11.0
10.5
10.0
9.5
9.0
8.5
8.0
7.5
1
7.0
6.5
f1 (ppm)
6.0
5.5
5.0
4.5
4.0
3.5
3.05
2.11
2.95
H-1’’
1.72
1.92
0.83
H-6
0.98
0.99
2.02
2.00
1.05
H-8
1.01
H-2’ y
H-6’
OH (C-5)
3.0
2.5
Figura 2-27 Espectro RMN H (acetona-d 6 , 400 MHz) para HCc-10
2.0
1.5
1.0
0.5
18.7
77.9
74.0
73.9
73.1
72.5
72.3
71.6
65.5
106.8
103.6
100.5
95.5
117.3
123.5
132.7
180.3
RMN13C
136.7
77
166.0
164.2
161.9
159.4
159.0
Capítulo 2
C-6
C-4
DEPT 135
3'
HO
7
C-1’
C-3
9
O
3
5
OH O
OH
C-2’ y C-6’
5'
1'
1
C-10
C-3’ y C-5’
O
C-6’’
OH
O 1''
C-1’’
C-8
5'' 3''
OH
OH
210
200
190
180
170
160
150
140
Figura 2-28 Espectro de RMN
130
120
110
f1 (ppm)
100
90
80
70
60
50
40
30
20
10
13
C y DEPT 135 (acetona d 6 , 100 MHz) de para HCc-10
Tabla 2-9 Constantes físicas y datos espectroscópicos para megislactona MCc-3
Nombre:
25'
26'
16'
5
18'
14'
Estado físico
OH
1'
12
O
Fórmula molecular
2 34
1
O
5
megislactona MCc-3
Sólido blanco
C 31 H 58 O 3
Peso molecular
478,4 g/mol
Punto de fusión
51 – 53 °C (CHCl 3 )
Rotación óptica
[α]20
: - 8,1°(c 0.5, CHCl 3 )
𝐷
EM-IE: m/z (%) = 478 (90), 450 (53), 432 (20), 129 (43), 116 (10), 99 (20), 97 (25), 95 (30), 83 (50), 69 (80), 57 (100)
IR: ν (cm-1) = 3420 (O-H), 2942 (C-H), 1757 (C=O), 1460 (C=C), 1377 (H-C-H), 1319 (H-C-H), 1195 (C-O)
RMN 1H (400 MHz, CDCl 3 ): δ 5,34 (dt, J = 10,5, 4,6 Hz, 2H, H-17’ y H-18’), 4,63 (dq, J = 6,5, 4,6 Hz, 1H, H-4), 4,20 (d, J
= 2,7 Hz, 1H, H-3), 2,53 (m, 1H, H-2), 2,01 (m, 4H, H-16’ y H-19’), 1,72 (m, 1H, H-1’a), 1,57 (m, 1H, H-1’b), 1,48 (m, 2H,
H-2’), 1,40 (d, J = 6,5 Hz, 3H, H-5), 1,37 – 1,20 (m, 38H, H-3’ hasta H-15’ y H-20’ hasta H-25’), 0,87 (t, J = 6,7 Hz, 3H, H26’).
RMN 13C (100 MHz, CDCl 3 ): δ 177,6 (C-1), 129,9 (C-17’ y C-18’), 78,2 (C-4), 74,1 (C-3),.49,2 (C-2), 31,9 – 29,4 (C-3’
hasta C-15’ y C-20’ hasta C-25’), 29,3 (C-2’), 28,5 (C-1’), 27,3 (C-16’), 27,2 (C-19’), 14,1 (C-5), 13,9 (C-26’).
Datos espectroscópicos descritos en la literatura: Ming et al., 2002.
78
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
1.58
1.57
1.56
1.55
1.48
1.41
1.39
1.25
0.89
0.88
0.86
2.01
2.00
2.54
2.54
2.53
4.20
4.19
5.34
4.64
4.63
4.62
4.61
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
5.34
4.64
4.63
4.62
4.61
4.20
4.19
H-3’ hasta H-15’
y
H-20´hasta H-25’
25'
H-17’ y
H-18’
26'
16'
OH
14'
1'
18'
5
2 34
12
O
1.08
1.00
1.97
5.2
5.0
4.8
f1 (ppm)
5
O
H-3
H-4
5.4
1
4.4
4.6
4.2
H-5
H-26’
H-16’ y
H-19’
H-1b
H-2
7.0
6.5
6.0
5.5
5.0
4.5
4.0
f1 (ppm)
3.5
3.0
2.5
2.0
3.24
2.09
3.33
38.22
1.26
4.21
1.13
1.08
1.00
1.97
7.5
H-1a
1.5
1.0
0.5
1
13
RMN C
25'
26'
16'
5
31.9
29.8
29.7
29.6
29.5
29.5
29.4
29.3
29.3
28.4
27.2
27.2
14.1
13.9
49.2
74.1
78.2
177.6
129.9
Figura 2-29 Espectro RMN H (CDCl 3 , 400 MHz) para MCc-3
OH
14'
1'
18'
2 34
12
1
O
O
C-3’ a C-15’ y
C-20’ a C-25’
5
C-2
C-1
DEPT 135
C-17’ y C-18’
C-26’
C-3
C-4
190
180
170
160
150
140
130
120
Figura 2-30 Espectro de RMN
110
13
100
f1 (ppm)
90
80
70
60
50
40
30
C y DEPT 135 (CDCl 3 , 100 MHz) de para MCc-3
20
10
Capítulo 2
79
Tabla 2-10 Datos espectroscópicos para la mezcla de los compuestos MCc-4 y MCc-5
HO
5'
5
OMe
O
3'
Nombre:
O
2
OH O
MCc-4
5'
HO
2´,4´-dihidroxi-6´-metoxi-3,4metilenodioxidihidrochalcona (MCc-4) y
2´,4´-dihidroxi-6´-metoxi-3-hidroxi-4metoxidihidrochalcona (MCc-5)
Estado físico
5
OMe
OMe
3'
C 17 H 16 O 6 y C 17 H 18 O 6
OH
2
OH O
Fórmula molecular
Sólido vino tinto
Peso
MCc-5
316,1 y 318,1 g/mol
Datos para MCc-4 (desde la mezcla) = RMN 1H (400 MHz, acetona-d 6 ): δ 13,90 (s, 1H, OH), 6,80 (sa, 1H, H-2), 6,75 (d, J =
8.0 Hz, 1H, H-5), 6,73 (d, J = 8.0 Hz, 1H, H-6), 6,04 (sa, 1H, H-5’), 5,96 (sa, 1H, H-3’), 5,94 (s, 2H, OCH 2 O), 3,89 (s, 3H,
OCH 3 ), 3,27 (t, J = 7,5 Hz, 2H), 2,88 (t, J = 7,5 Hz, 2H); RMN 13C (100 MHz, acetona-d 6 ): δ 206,0 (C=O), 169,3 (C-6’),
166,6 (C-4’), 165,5 (C-2’), 149,5 (C-3), 147,6 (C-4), 137,6 (C-1), 123,0 (C-5), 110,7 (C-2), 109,8 (C-6), 106,8 (C-1’), 102,7
(OCH 2 O), 97,8 (C-3’), 92,9 (C-5’), 57,2 (OCH 3 ), 47,7 (CH 2 ), 32,1 (CH 2 ).
Datos para MCc-5 (desde la mezcla) = RMN 1H (400 MHz, acetona-d 6 ): δ 13,90 (s, 1H, OH), 6,80 (sa, 1H, H-2), 6,75 (d, J =
8.0 Hz, 1H, H-5), 6,73 (d, J = 8.0 Hz, 1H, H-6), 6,04 (sa, 1H, H-5’), 5,96 (sa, 1H, H-3’), 3,89 (s, 3H, OCH 3 ), 3,75 (s, 3H,
OCH 3 ), 3,27 (t, J = 7,5 Hz, 2H), 2,88 (t, J = 7,5 Hz, 2H); RMN 13C (100 MHz, acetona-d 6 ): δ 206,0 (C=O), 169,3 (C-6’),
166,6 (C-4’), 165,5 (C-2’), 149,5 (C-3), 147,6 (C-4), 137,6 (C-1), 123,0 (C-5), 110,7 (C-2), 109,8 (C-6), 106,8 (C-1’), 97,8 (C3’), 92,9 (C-5’), 57,2 (OCH 3 ), 57,1 (OCH 3 ), 47,7 (CH 2 ), 32,1 (CH 2 ).
Datos reportados en la literatura Martínez y Cuca, 1989; Kawanishi et al., 1990.
HO
5'
OMe
OH
O
5
O
3'
O
2
MCc-4
HO
5'
5
OMe
3'
OH
2
O
OMe
OH
MCc-5
1
Figura 2-31 Espectro RMN H (acetona-d 6 , 400 MHz) para la mezcla de MCc-4 y MCc-5.
80
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
5'
HO
5
OMe
O
3'
O
2
OH O
MCc-4
HO
5'
5
OMe
OMe
3'
OH
OH
2
O
MCc-5
Figura 2-32 Espectro RMN
13
C (acetona-d 6 , 100 MHz) para la mezcla de MCc-4 y MCc-5.
Tabla 2-11 Datos espectroscópicos y constantes físicas para 1-(2’,4’-dihidroxifenil)-3-(3’’,4’’metilenodioxifenil)propano MCc-6
Nombre:
Estado físico
HO
6'
4'
2'
OH
4''
6''
1
O
O
3
Fórmula molecular
1-(2’,4’-dihidroxifenil)-3-(3’’,4’’metilenodioxifenil)propano MCc-6
Sólido marrón-rojizo
C 16 H 16 O 4
Peso molecular
272,1 g/mol
Punto de fusión
99 – 100 °C
2''
IR: ν (cm-1) = 3305 (O-H), 2932 (C-H), 1605 (C=C), 1550 (C=C), 1495
(C=C),, 1464 (C=C), 1423 (H-C-H), 1205 (C-O), 1140 (C-O).
RMN 1H (400 MHz, acetona-d 6 ): δ 8,04 (sa, 4’-OH) , 7,95 (sa, 1H, 2’-OH), 6,87 (d, J = 8,1 Hz, 1H, H-6’), 6,73 (d, J = 1,3
Hz, 1H, H-2’’), 6,72 (d, J = 7,7 Hz, 1H, H-5’’), 6,66 (d, J = 7,7 Hz, 1H, H-6’’), 6,38 (d, J = 2,2 Hz, 1H, H-3’), 6,27 (dd, J =
8,1, 2,2 Hz, 1H, H-5’), 5,92 (s, 2H,- O-CH 2 -O-), 2,58 – 2,52 (m, 4H, H-1 y H-3), 1,84 (m, 2H, H-2).
RMN 13C (100 MHz, acetona-d 6 ): δ 158,3 (C-4’), 157,6 (C-2’), 149,5 (C-4’’), 147,4 (C-3’’), 138,5 (C-1’’), 132,2 (C-6’), 122,9
(C-6’’), 121,3 (C-1’), 110,5 (C-5’’), 109,7 (C-2’’), 108,2 (C-5’), 104,4 (C-3’), 102,6 (-O-CH 2 -O-), 37,0 (C-3), 34,0 (C-1), 30,8
(C-2).
Datos descritos en la literatura: Salazar et al., 1988; Díaz y Díaz, 1986.
2.58
2.56
2.55
2.53
3.75
6.88
6.86
6.73
6.73
6.71
6.67
6.65
6.38
6.38
6.28
6.28
6.26
6.26
5.92
-O-CH2-O-
HO
6.28
6.28
6.26
6.26
6.38
6.38
6.73
6.73
6.71
6.67
6.65
6.88
6.86
4''
6''
6'
4'
2'
O
O
1
3
2''
OH
H-2’’ y
H-5’’
H-6’
1.84
81
8.04
7.95
Capítulo 2
H-3’
H-6’’
H-5’
6.8
1.01
0.91
1.74
1.02
6.9
1.00
H-1 y
H-3
6.7
6.6
6.5
f1 (ppm)
6.4
6.3
6.2
OH (C-4)
OH (C-2’)
9.5
9.0
8.5
7.5
8.0
7.0
6.5
6.0
2.14
4.16
1.91
1.01
1.00
0.96
0.93
1.02
1.74
0.91
H-2
5.5
5.0
f1 (ppm)
4.5
4.0
3.5
3.0
2.5
2.0
1.5
1.0
0.5
1
C-4’ y
C-2’
30.8
37.0
110.5
109.7
108.2
104.4
102.6
122.9
121.3
132.2
138.5
RMN13C
149.5
147.4
158.3
157.6
207.3
Figura 2-33 Espectro RMN H (acetona-d 6 , 400 MHz) para MCc-6
C-1
C-1’
C-1’’
C-4’
C-3’
DEPT 135
HO
2'
4''
6''
6'
4'
C-6’ C-6’’
O
C-3’
O
1
3
2''
OH
(-O-CH2-O-)
C-3
210
200
190
180
170
160
150
140
Figura 2-34 Espectro RMN
130
13
120
110
f1 (ppm)
100
90
80
70
60
50
40
C-2
30
C y DEPT 135 (acetona-d 6 , 100 MHz) para MCc-6.
20
10
82
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Tabla 2-12 Datos espectroscópicos y constantes físicas para 1-(2’,4’-dihidroxifenil)-3-(2’’-metoxi4’’,5’’-metilenodioxifenil)propano MCc-7
1-(2’,4’-dihidroxifenil)-3-(2’’-metoxi-4’’,5’’metilenodioxifenil)propano MCc-7
Nombre:
3''
5'
HO
MeO
O
O
3'
1
OH
6''
3
Estado físico
Aceite rojo
Fórmula molecular
C 17 H 18 O 5
Peso molecular
302,1 g/mol
EM-IE: m/z (%) = 302 (43), 165 (100).
IR: ν (cm-1) = 3325 (O-H), 2942 (C-H), 1605 (C=C), 1550 (C=C), 1495 (C=C),, 1464 (C=C), 1423 (H-C-H), 1235 (C-O),
1160 (C-O).
RMN 1H (400 MHz, acetona-d 6 ): δ 6,88 (d, J = 8,1 Hz, 1H, H-6’), δ 6,69 (s, 1H, H-6’’) y 6,61 (s, 1H, H-3’’), 6,37 (d, J = 2,4
Hz, 1H, H-3’), 6,27 (dd, J = 8,1; 2,4 Hz, 1H, H-5’), 5,88 (s, 2H, -OCH 2 O-), 3,75 (s, 3H, OCH 3 ), 2,55 (m, 4H, H-1 y H-3) y
1,79 (m, 2H, H-2).
RMN 13C (100 MHz, acetona-d 6 ): δ 158,3 (C-2’), 157,6 (C-3’), 154,3 (C-2’’), 147,9 (C-4’’), 142,7 (C-5’’), 132,0 (C-6’), 125,0
(C-1’’), 121,6 (C-1’), 111,2 (C6’’), 108,2 (C-5’), 104,4 (C-3’), 102,7 (O-CH 2 -O), 96,6 (C-3’’), 57,7 (O-CH 3 ), 32,6 (C-3), 31,5
(C-1), 31,0 (C-2).
1.79
2.56
2.55
2.54
3.75
6.38
6.37
6.28
6.28
6.25
5.88
6.89
6.87
6.69
6.61
6.61
Datos descritos en la literatura: Braz Filho et al., 1973.
3''
5'
HO
MeO
O
O
3'
6''
6.38
6.37
6.28
6.28
6.26
6.25
6.69
6.61
6.61
3
6.89
6.87
OH
1
OCH3 (2’)
H-6’’ H-3’’
H-3’
H-6’
H-5’
H-1 y H-3
7.5
7.0
6.5
6.0
5.5
5.0
4.5
1
4.0
f1 (ppm)
H-2
3.5
3.0
2.5
2.06
4.05
3.01
1.91
0.98
0.96
1.00
0.97
0.91
OCH2O (4’’ y 6’’)
2.0
Figura 2-35 Espectro RMN H (acetona-d 6 , 400 MHz) para MCc-7.
1.5
1.0
32.6
31.5
31.0
57.7
96.6
111.2
108.2
104.4
102.7
121.6
125.0
132.0
142.7
RMN13C
147.9
83
158.2
157.6
154.3
Capítulo 2
3''
5'
HO
MeO
O
O
3'
OH
1
6''
3
C-2
C-1’’
C-2’’ C-4’’ C-5’’
C-3’
C-2’
C-1’
DEPT 135
O-CH3
C-6’
C-6’’
C-3’’
C-5’
O-CH2-O
210
200
190
180
170
160
150
140
Figura 2-36 Espectro RMN
130
120
110
f1 (ppm)
100
90
80
70
60
50
40
30
20
13
C y DEPT 135 (acetona-d 6 , 100 MHz) para MCc-7.
Tabla 2-13 Datos espectroscópicos y constantes físicas para cinchonaina Ic MCc-8
HO
Nombre:
OH
3''
5''
HO
1''
Estado físico
7
7''
9''
O
Fórmula molecular
9
O
5
10
5'
O
1
3
OH
1'
OH
3'
OH
cinchonaina Ic MCc-8
Sólido crema
C 24 H 20 O 9
Peso molecular
452,1 g/mol
Punto de fusión
> 280 °C (MeOH)
Rotación óptica
[α]20
: - 23,1 (c 0.5, MeOH)
𝐷
IR: ν (cm-1) = 3300 (O-H), 2912 (C-H), 1733 (C=O), 1600 (C=C), 1433 (C=C), 1360 (H-C-H), 1109 (C-O) cm-1.
RMN 1H (400 MHz, CD 3 OD): δ 7,00 (dd, J = 1,5, 9,0 Hz, 1H, H-6’’) , 6,77 (d, J = 1,5 Hz, 1H, H-2’’), 6,76 (d, J = 9,0 Hz,
1H, H-5’’), 6,61 (d, J = 8,1 Hz, 1H, H-5’), 6,53 (d, J = 2,1 Hz, 1H, H-2’), 6,45 (dd, J = 8,1, 2,1 Hz, 1H, H-6’), 6,21 (s, 1H, H8), 4,84 (sa, 1H, H-2), 4,54 (da, J = 7,2 Hz, 1H, H-7’’), 4,25 (m, 1H, H-3), 3,06 (dd, J = 15,7, 7,2 Hz, 1H, H-8’’a), 2,87 (m,
3H, H-8’’b y H-4).
RMN 13C (100 MHz, CD 3 OD): δ 170,9 (C-9’’), 157,1 (C-7), 153,4 (C-9), 152,0 (C-5), 146,3 (C-3’), 145,8 (C-4’), 145,7 (C3’’), 145,1 (C-4’’),135,3 (C-1’’), 131,7 (C-1’), 119,4 (C-6’’), 119,3 (C-6’), 116,6 (C-2’’), 116,0 (C-5’), 115,3 (C-5’’), 115,0 (C2’), 106,2 (C-6), 105,2 (C-10), 96,5 (C-8), 80,1 (C-2), 66,9 (C-3), 38,6 (C-8’’), 35,4 (C-7’’), 29,5 (C-4).
Datos descritos en la literatura: Nonaka y Nishioka, 1982.
84
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
HO
H-2’’ y
H-5’’
3.08
3.07
3.04
3.03
2.87
3.31
4.25
4.24
4.84
6.53
6.53
6.62
6.60
6.78
6.77
6.77
6.46
6.46
6.44
6.44
6.98
6.97
6.78
6.77
6.77
6.62
6.60
6.53
6.53
6.46
6.46
6.44
6.44
6.21
6.98
6.97
4.55
4.54
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
OH
3''
5''
H-5’
HO
H-2’
H-6’
1''
7
9
H-6’
7''
7.0
6.9
6.7
f1 (ppm)
6.8
6.6
1.02
0.99
1.18
1.76
1.04
9''
6.5
O
5
10
5'
O
1
O
OH
1'
3
3'
OH
OH
6.4
H-8
H-8’’b y
H-4
6.0
5.5
5.0
4.5
f1 (ppm)
H-3
4.0
3.5
2.48
1.10
1.10
H-8’’a
1.10
1.01
6.5
1.64
7.0
0.98
1.76
1.18
0.99
1.02
7.5
8.0
1.04
H-7’’
3.0
2.5
2.0
1.5
1
29.5
35.4
38.6
66.6
79.7
96.3
106.1
105.3
119.3
119.2
116.5
116.0
115.1
115.1
132.0
135.4
146.3
146.0
145.8
145.1
157.3
153.4
152.1
170.8
Figura 2-37 Espectro RMN H (CD 3 OD, 400 MHz) para MCc-8
RMN13C
C-6’’ y
C-6’
C-9’’
C-6
C-1’’ C-1’
C-7
DEPT 135
HO
C-10
OH
3''
5''
HO
1''
7
9
7''
9''
O
5
O
10
5'
O
1
OH
C-8
OH
1'
3
3'
C-2
C-7’’
C-3
OH
C-8’’
180
170
160
150
140
130
120
Figura 2-38 Espectro RMN
110
13
100
90
f1 (ppm)
80
70
60
50
40
C-4
30
C y DEPT 135 (CD 3 OD, 100 MHz) para MCc-8.
20
10
Capítulo 2
85
Tabla 2-14 Datos espectroscópicos y constantes físicas para cinchonaina Id MCc-9
HO
5''
HO
1''
Estado físico
7
O
Sólido marrón
Fórmula molecular
9
7''
9''
cinchonaina Id MCc-9
Nombre:
OH
3''
10
5
5'
O
Peso molecular
1
O
OH
1'
3
3'
OH
C 24 H 20 O 9
OH
452,1 g/mol
Punto de fusión
178-180 °C (MeOH)
[α]20
:
𝐷
Rotación óptica
+ 27,3 (c 0.50, MeOH)
IR: ν (cm-1) = 3400 (O-H), 2942 (C-H), 1748 (C=O), 1605 (C=C), 1464 (C=C), 1380 (H-C-H), 1110 (C-O) cm-1.
RMN 1H (400 MHz, CD 3 OD): δ 6,82 (sa, 1H, H-2’’) , 6,70 (m, 2H, H-5’ y H-5’’), 6,62 (d, J = 1,8 Hz, 1H, H-2’), 6,60 (da, J =
8,2 Hz, 1H, H-6’’), 6,53 (dd, J = 8,2, 1,8 Hz, 1H, H-6’), 6,23 (s, 1H, H-8), 4,81 (sa, 1H, H-2), 4,42 (d, J = 5,9 Hz, 1H, H-7’’),
4,17 (m, 1H, H-3), 2,87 (m, 4H, H-4,H-8’’).
RMN 13C (100 MHz, CD 3 OD): δ 170,8 (C-9’’), 157,3 (C-7), 153,4 (C-9), 152,1 (C-5), 146,3 (C-3’), 146,0 (C-4’), 145,8 (C3’’), 145,1 (C-4’’),135,4 (C-1’’), 132,0 (C-1’), 119,3 (C-6’’), 119,2 (C-6’), 116,5 (C-2’’), 116,1 (C-5’), 115,1 (C-5’’), 115,1 (C2’), 106,1 (C-6), 105,3 (C-10), 96,3 (C-8), 79,7 (C-2), 66,6 (C-3), 38,2 (C-8’’), 35,1 (C-7’’), 29,2 (C-4).
2.90
2.85
3.31
4.17
4.43
4.42
6.54
6.54
6.52
6.52
6.63
6.62
6.61
6.71
6.70
6.69
6.68
6.82
6.82
6.71
6.70
6.69
6.68
6.63
6.62
6.61
6.54
6.54
6.52
6.52
6.23
Datos descritos en la literatura: Nonaka y Nishioka, 1982.
HO
OH
3''
H-5’ y
H-5’’
H-2’’
5''
HO
H-2’
1''
H-6’’
H-6’
6.75
6.70
6.65
f1 (ppm)
6.60
6.55
O
5
10
5'
O
1
OH
1'
3
O
1.16
2.24
2.30
1.20
6.80
9
7''
9''
6.85
7
3'
OH
OH
6.50
H-8
H-4 y H-8
H-3
8.0
7.5
7.0
6.5
6.0
5.5
5.0
4.5
f1 (ppm)
1
4.0
3.5
4.96
1.17
1.38
1.30
1.70
1.00
1.20
2.30
2.24
1.16
H-7’’
3.0
2.5
Figura 2-39 Espectro RMN H (CD 3 OD, 400 MHz) para MCc-9
2.0
1.5
1.0
86
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
29.2
35.1
38.2
66.9
80.1
96.5
106.1
105.2
119.4
119.3
116.6
116.0
115.3
115.0
131.7
135.3
157.1
153.4
153.4
152.0
151.9
146.3
145.8
145.7
145.1
170.9
170.9
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
RMN13C
C-6’’ y
C-6’
C-9’’
DEPT 135
C-7
HO
C-6
C-10
C-1’’ C-1’
OH
3''
5''
HO
1''
7
9
7''
9''
O
5
O
10
OH
C-2
C-7’’
C-3
OH
1'
3
C-8
5'
O
1
3'
OH
C-4
C-8’’
180
170
160
150
140
130
120
Figura 2-40 Espectro RMN
110
100
90
f1 (ppm)
80
70
60
50
40
30
20
10
13
C y DEPT 135 (CD 3 OD, 100 MHz) para MCc-9.
2.2.3 Estudio fitoquímico de la corteza de Z. rigidum
La purificación por técnicas cromatográficas de las fracciones obtenidas a partir del
extracto etanólico de la corteza de Z. rigidum condujo al aislamiento e identificación de
catorce compuestos (Figura 2.41), entre los que se encuentran tres alcaloides (flindersina
Zr-6, γ-fagarina Zr-8 y skimnianina Zr-9), cuatro lignanos (savinina Zr-4, 2,3-di(3',4'metilenodioxIbencil)-2-buten-4-olido Zr-5, (+)-dimetilmatairresinol Zr-7 y (+)-siringaresinol
Zr-10), una cumarina (umbeliferona Zr-12), tres triterpenos (lupeol Zr-1, lupenona Zr-2 y
Betulina Zr-3), un monoglicérido (monopalmitato de glicerilo Zr-13) y dos derivados de
ácido (cafeato de etilo Zr-11 y ácido (-)-rigidunoico Zr-14).
Capítulo 2
87
OH
O
HO
HO
Zr-2
Zr-1
Zr-3
O
O
O
O
O
O
Zr-4
O
O
O
O
O
O
+
O
Zr-5
O
O
N
H
O
O
O
Zr-7
Zr-6
O
O
O
O
O
OH
O
O
O
N
N
H
O
O
O
O
O
H
O
OH
Zr-9
O
O
HO
O
OH
(CH2)14
OH
HO
O
OH
Zr-12
Zr-11
Zr-10
O
O
O
HO
HO
Zr-8
HO
O
O
OH
O
Zr-13
Zr-14
OH
OH
Figura 2-41 Compuestos aislados de la corteza de Z. rigidum
De los metabolitos aislados e identificados en la corteza de Z. rigidum, solo el triterpeno
lupeol Zr-1 ha sido previamente reportado en la corteza de la raíz de esta especie
(Moccelini et al, 2009), siendo este el primer reporte de la presencia de los otros 13
compuestos en Z. rigidum. De acuerdo con el estudio fitoquímico realizado en la corteza,
se concluye que todos los tipos de metabolitos encontrados en ésta han sido
previamente reportados en especies de la familia Rutaceae, incluyendo el género
Zanthoxylum, excepto el compuesto denominado ácido (-)-rigidunoico Zr-14 que no
presenta reportes previos en la literatura, estando así estos resultados de acuerdo con la
quimiotaxonomía de la familia y del género (Grycová et al., 2007; Adesina, 2005; Krane,
et al., 1984; Waterman y Grundon, 1983).
88
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Es importante resaltar que de acuerdo a los metabolitos encontrados en la corteza de Z.
rigidum se puede concluir que esta especie biosintetiza principalmente alcaloides
derivados del ácido antranílico, como lo son los alcaloides quinolinicos e isoquinolonicos
encontrados en este estudio, a diferencia de especies como Z. quinduense (Patiño y
Cuca, 2010a; Patiño y Cuca, 2010b), Z. nitudum (Geng et al., 2009; Yang et al., 2008; Hu
et al., 2007) y Z. rhoifolium (de Moura et al., 1997), entre otras, que se sintetizan
principalmente alcaloides bencilisoquinolínicos, biosintetizados a partir del aminoácido
tirosina.
Las estructuras de los compuestos Zr-1 a Zr-14 fueron determinadas mediante análisis
espectroscópico, por comparación con los datos descritos en la literatura y/o por
cocromatografía en CCD con muestras auténticas. A continuación se describe la
elucidación estructural del ácido (-)-rigidunoico Zr-14. Los datos espectroscópicos de los
demás compuestos aislados de Z. rigidum se presentan de manera resumida en las
Tablas 2.15 a 2.23 , acompañados de los espectros de RMN 1H y RMN
13
C de cada
sustancia, que se presentan en las Figuras 2.51 a 2.66.
Elucidación estructural del compuesto Zr-14.
El compuesto Zr-14 es un sólido amorfo de color amarillo-verdoso que se descompone a
250°C antes de fundir (CH 3 OH) y da prueba positiva con cloruro férrico, indicando así la
posible presencia de hidroxilos fenólicos en su estructura. Su espectro IR se caracteriza
por presentar señales indicativas de grupos hidroxilo (en 3415 cm-1, banda ancha de
estiramiento O-H y en 1279, 1231 cm-1 señales por tensión C-O), de grupos carbonílicos
(señales intensas en 1660 y 1645 cm-1, características de estiramientos C=O), de grupos
alifáticos (señales en 2919, 2851 cm-1 por tensiones C-H y en 1450, 1355 cm-1 por
flexiones en el plano H-C-H) y de aromáticos (señales en 1600, 1498 y 1462 cm-1
debidas a las tensiones C=C en aromáticos).
Su espectro de RMN 1H (Figura 2.42) presenta señales que integran para un total de 12
protones, entre las que se destacan las señales para un anillo aromático trisustituido en δ
6,76 (d, J = 8,2 Hz, 1H), 6,87 (da, J = 8,0 Hz, 1H) y 7,00 (sa, 1H) que indican la presencia
de dos hidrógenos en posición orto y uno en posición meta respecto a uno de ellos.
2.09
3.81
3.81
3.79
3.78
4.26
4.25
5.33
5.32
5.30
5.29
5.28
5.26
6.25
6.21
7.00
6.88
6.86
6.77
6.75
89
7.49
7.45
Capítulo 2
OH
7'
9'
O
6'
1'
8'
6.25
6.21
H-5’
1
6
7
OH
O
3.81
3.81
3.79
3.78
OH
4.26
4.25
OH
5.33
5.32
5.30
5.29
5.28
5.26
6.88
6.86
6.77
6.75
7.00
7.49
7.45
H-2’
5
O
3'
H-7’
2
3
4
4'
2'
OH
HO
5'
H-8’
H-6’
H-5
H-4
H-3
7.5
7.3
7.1
6.9
6.7
f1 (ppm)
6.5
6.3
5.4
5.2
5.0
4.8
4.4
4.6
f1 (ppm)
4.2
4.0
3.8
8.0
6.5
6.0
5.5
5.0
4.5
f1 (ppm)
4.0
4.81
1.14
1.06
7.0
1.14
7.5
0.94
1.06
1.06
0.96
8.5
1.00
H-2 y H-6
3.5
3.0
2.5
2.0
1.5
1.0
0.5
1
Figura 2-42 Espectro RMN H para el compuesto Zr-14 (CD 3 OD-D 2 O, 400 MHz).
También en el espectro se destacan las señales en δ 6,23 (d, J = 15,9 Hz, 1H) y 7,48 (d,
J = 15,9 Hz, 1H) que por su multiplicidad y desplazamiento corresponden a los protones
en posición trans sobre un doble enlace, y dada la diferencia entre los desplazamientos
de estas dos señales sugieren la presencia de un fragmento de carbonilo α,β-insaturado
siendo estos hidrógenos los ubicados sobre los carbonos en posiciones α y β,
respectivamente. Se observan también señales en la región alifática del espectro en: δ
5,30 (dt, J = 10,9; 10,9; 4,9 Hz, 1H), 4,26 (d, J = 2,3 Hz, 1H), 3,80 (dd, J = 9,6; 2,7 Hz,
1H) y 2,09 (m, 4H), donde por su desplazamiento las tres primeras corresponden a
hidrógenos ubicados sobre carbonos alifáticos oxigenados y cuyas señales en general
sugieren la presencia de un fragmento de ácido quínico en la molécula (Eliel and Bello,
1997). El espectro COSY 1H-1H (Figura 2.43) permitió determinar las correlaciones
escalares existentes entre los protones sobre carbonos vecinos, lo que permitió
corroborar la presencia de un anillo aromático trisustituido y de un fragmentó de ácido
0.0
90
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
quínico en la molécula. En la Figura 2.43 se ilustran las correlaciones existentes entre las
señales de hidrógeno que permitieron corroborar la presencia de ácido quínico en la
molécula, observándose la correlación del protón en δ H 3,80 (dd, J = 9,6; 2,7 Hz, 1H) con
las señales de los protones en δ H 5,30 (dt, J = 10,9; 10,9; 4,9 Hz, 1H) y 4,26 (d, J = 2,3
Hz, 1H), las cuales correlacionan con la señal de los grupos metilenos centrada en δ H
2,11 (m, 4H).
2.0
2.5
3.0
3.5
4.0
5.0
5.5
6.0
6.5
H
HO
7.5
7.0
6.5
6.0
1
5.5
5.0
4.5
f2 (ppm)
4.0
H
7.0
H
OH
7.5
8.0
OH
3.5
8.5
3.0
2.5
2.0
1.5
1
Figura 2-43 Espectro COSY H- H para el compuesto Zr-14 (CD 3 OD-D 2 O, 400 MHz).
Del análisis de los espectros RMN 13C y DEPT 135 (Figura 2.44), se observan en total 16
señales de carbonos para el compuesto Zr-14 de las cuales dos corresponden a
carbonos tipo metileno con δ C 38,0 (CH 2 ) y 39,7 (CH 2 ), que por sus desplazamientos
sugieren que se encuentran cercanos a heteroátomos; ocho señales son debidas a
carbonos tipo metino con δ C 71,9 (CH), 72,4 (CH), 74,0 (CH), 115,3 (CH), 115,7 (CH),
116,8 (CH), 123,4 (CH) y 147,2 (CH), que de acuerdo a sus desplazamientos las tres
primeras corresponden a carbonos alifáticos oxigenados y las restantes corresponden a
f1 (ppm)
4.5
Capítulo 2
91
carbonos olefínicos y/o aromáticos; seis corresponden a carbonos cuaternarios con δ C
79,1 (C), 127,7 (C), 145,7 (C), 148,5 (C), 169,7 (C) y 180,8 (C), siendo las dos últimas
OH
7'
9'
O
5'
8'
3
4
4'
2'
O
3'
OH
C-9’
OH
HO
6'
1'
39.7
38.0
79.1
74.0
72.4
71.9
116.8
115.7
115.3
127.7
123.4
148.5
147.2
145.7
RMN13C
169.7
180.8
señales características de carbonos carbonílicos de tipo ácido.
2
5
1
6
7
OH
O
OH
C-3’
C-1’
C-4’
C-8’
C-7
C-1
6C
DEPT 135
C-7’
C-6’
C-5’
C-5
C-4
C-2’
C-3
8 CH
2 CH2
C-6
C-2
190
180
170
160
150
140
Figura 2-44 Espectro RMN
130
120
110
100
90
f1 (ppm)
80
70
60
50
40
30
20
10
13
C y DEPT 135 del compuesto Zr-14 (CD 3 OD-D 2 O, 100 MHz)
Las señales con δ C 38,0 (CH 2 ), 39,7 (CH 2 ), 71,9 (CH), 72,4 (CH), 74,0 (CH), 79,1 (C) y
180,8 (C), son consistentes con el fragmento de ácido quínico, el cual se caracteriza por
la presencia de un ciclo de seis átomos de carbono con un carbono carboxílico y cuatro
carbonos alifáticos oxigenados. Las señales con δ C 115,3 (CH), 115,7 (CH), 116,8 (CH),
123,4 (CH), 127,7 (C), 145,7 (C), 147,2 (CH), 148,5 (C) y 169,7 (C), son consistentes con
lo analizado en RMN 1H y sugieren la presencia de un fragmento similar al del ácido
caféico (Sun et al., 2006), que se caracteriza por la presencia de un anillo aromático
trisustituido con dos sustituyentes oxigenados y otro correspondiente a una cadena
insaturada de tres átomos de carbono con un grupo carboxilo.
0
92
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Con el espectro HMQC (Figura 2.45) se estableció la conectividad de cada hidrógeno con
el carbono al que está unido, por ejemplo en el espectro se observan las conectividades
del protón en δ H 7,48 (d, J = 15,9 Hz, 1H) con el carbono en δ C 147,2 (CH), del protón en
δ H 5,30 (dt, J = 10,9; 10,9; 4,9 Hz, 1H) con el carbono en δ C 71,9 (CH) y de los protones
en δ H 2,11 (m, 4H) con los carbonos en δ C 38,0 (CH 2 ) y 39,7 (CH 2 ). Las correlaciones
observadas en el espectro de HMQC se ilustran en la Figura 2.45.
30
40
50
60
70
90
100
OH
H
HO H
O
H
H
OH
H
O
OH
OH
110
OH
H
O
120
130
140
150
7.5
7.0
6.5
6.0
5.5
5.0
4.5
f2 (ppm)
4.0
3.5
3.0
2.5
2.0
Figura 2-45 Espectro HMQC para el compuesto Zr-14 (CD 3 OD:D 2 O, 400 MHz).
Mediante el experimento HMBC (Figura 2.46) se realizó la ubicación de los sustituyentes,
la confirmación de los fragmentos propuestos y la asignación de los carbonos
cuaternarios. De este modo, por ejemplo, se confirmó la presencia de los fragmentos de
ácido caféico y de ácido quínico que por las correlaciones observadas a tres enlaces
entre los protones del anillo aromático con δ H 6,87 (da, J = 8,0 Hz, 1H) y 7,00 (sa, 1H)
con el carbono aromático en δ C 148,5 (C), y el cual a su vez correlaciona con el
hidrógeno en δ H 3,80 (dd, J = 9,6; 2,7 Hz, 1H) del fragmento de ácido quínico,
f1 (ppm)
80
Capítulo 2
93
permitieron unir el fragmento de ácido quínico por la posición 4 al hidroxilo ubicado en la
posición 4’ del ácido caféico. Algunas correlaciones observadas en el espectro de HMBC
se ilustran en la Figuras 2.46 y 2.47.
40
50
60
70
80
90
110
120
130
140
150
160
170
180
8.5
8.0
7.5
7.0
6.5
6.0
5.5
5.0
4.5
f2 (ppm)
4.0
3.5
3.0
2.5
2.0
1.5
1.0
Figura 2-46 Espectro HMBC para el compuesto Zr-14 (CD 3 OD:D 2 O, 400 MHz).
OH
H
H
OH
OH
O
OH
H
H
O
OH
H
O
OH
Figura 2-47 Principales correlaciones HMBC para el compuesto Zr-14
La estereoquímica de los carbonos C-4, C-5 y C-3 fue establecida por el experimento
NOESY (Figura 2.48). En el espectro se observa correlación entre los hidrógenos H-4 y
f1 (ppm)
100
94
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
H-5 (δ 3,80 (dd, J = 9,6; 2,7 Hz, 1H) y 4,26 (d, J = 2,3 Hz, 1H, H-5)), pero no fue
observada correlación de estos hidrógenos con H-3 (δ 5,30 (dt, J = 10,9; 10,9; 4,9 Hz,
1H)). De acuerdo a lo observado en NOESY, a las multiplicidades y constantes de
acoplamiento observadas entre H-4 y H-5, se puede establecer que estos hidrógenos
están en posiciones ecuatoriales; por lo tanto H-3 está en posición trans respecto a H-4 y
H-5.
2.0
O
2.5
HO
OH
3.0
3.5
H
O
H
4.0
H
H
HO
4.5
H
OH
5.0
H
OH
HO
f1 (ppm)
H
5.5
O
6.0
6.5
7.0
7.5
8.0
8.0
7.5
7.0
6.5
6.0
5.5
5.0
f2 (ppm)
4.5
4.0
3.5
3.0
2.5
2.0
Figura 2-48 Espectro NOESY para el compuesto Zr-14 (CD 3 OD:D 2 O, 300 MHz).
Por análisis de EMAR la fórmula molecular fue establecida como C 16 H 17 O 9 (m/z
353,0890 [M-H]-, calculado para C 16 H 17 O 9 , 353,0873) y es consistente con el resultado
del análisis espectroscópico realizado. En el espectro de masas obtenido (Figura 2.49)
además de observarse el ión molecular, se observa el ión con m/z 191,0563 [M-163]originado por la pérdida de la unidad de ácido caféico. El análisis realizado por EMAR
confirma la estructura propuesta para el compuesto Zr-14.
Capítulo 2
95
Intens.
x105
-MS, 1.54min #92
353.0890
3
2
1
191.0563
421.0633
341.0878
0
150
200
250
300
350
400
450
m/z
Figura 2-49 Espectro de masas de alta resolución obtenido por ESI en modo negativo para el
compuesto Zr-14.
Teniendo en cuenta que los centros quirales presentes en la molécula del compuesto Zr14 provienen del residuo de ácido quinico, se decidió determinar la rotación óptica de
este compuesto con el objetivo de comparar el signo de la rotación obtenido con los
reportados para el ácido quínico y derivados para de este modo establecer la
estereoquímica de todos los centros quirales del compuesto Zr-14. La rotación óptica
determinada fue [α]20
– 33,6 (c 1.0, MeOH), y por comparación con los signos reportados
𝐷
R
para el ácido quínico y derivados (Jung et al., 2011; Jassbi, 2003; Dürüst et al., 2001),
permitió la identificación del compuesto Zr-14 como ácido (1s n ,3R,4s n ,5R)-4-{4-[(E)-2carboxietenil]-2-hidroxifenoxi}-1,3,5-trihidroxiciclohexanocarboxílico
denominado
ácido
(-)-rigidunoico y para el que no se han encontrado reportes en la literatura (Figura 2.50).
OH
OH
HO
O
OH
O
OH
O
OH
Figura 2-50 Estructura del ácido (-)-rigidunoico Zr-14
En la familia Rutaceae se encuentran ampliamente distribuidos compuestos de tipo
fenilpropano, al igual que en diferentes especies del género Zanthoxylum, aunque no es
común encontrar fenilpropanos unidos a derivados del ácido shikimico, similares a Zr-14
(Braga et al., 2012; Chen et al., 2012; Ito et al., 2000; Adesina et al., 1998). Teniendo en
cuenta la estructura y de acuerdo a los metabolitos aislados en este trabajo se puede
96
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
deducir que Zr-14 es originado por los precursores ácido caféico y ácido quínico,
sustancias que se unen posiblemente por un mecanismo biosintético similar al que se
lleva a cabo cuando se produce la O-glicosilación. Estos dos precursores mencionados,
también participan en la biosíntesis de metabolitos secundarios como: lignanos,
cumarinas y alcaloides quinolínicos (Dewick, 2009), sustancias que también fueron
aisladas de la corteza de Z. rigidum.
DATOS ESPETROSCÓPICOS COMPUESTOS CONOCIDOS AISLADOS DE
CORTEZA DE Z. rigidum
Tabla 2-15 Datos espectroscópicos para la mezcla de lignanos savinina Zr-4 e isosavinina Zr-5
7
O
7
9
3
1
O
9´
5
1´
1
O
O
7´
O
9
3
9´
5
1´
Zr-4
O
O
7´
5´
O
O
Estado físico
Sólido verde
O
3´
Zr-5
Savinina Zr-4 y 2,3-di(3',4'metilenodioxIbencil)-2-buten-4-olido Zr-5
O
O
3´
5´
Nombre:
Fórmula
molecular
Peso
C 20 H 16 O 6 y C 20 H 18 O 6
352,3 y 354,4 g/mol
Datos para Zr-4 (desde la mezcla) = RMN 1H (400 MHz, CDCl 3 ): δ 7,49 (sa, 1H, H-7’), 7,07 (d, J = 8.1 Hz, 1H, H-6’), 7,03
(sa, 1H, H-2’), 6,87 (d, J = 8.1 Hz, 1H, H-5’), 6,72 (d, J = 7,91 Hz, 1H, H-5), 6,66 (sa, 1H, H-2), 6,63 (d, J = 7,91 Hz, 1H, H6), 6,04 (s, 2H, 3’-4’-OCH 2 O), 5,93 (d, J = 2,1 Hz, 2H, 3-4-OCH 2 O), 4,24 (m, 2H, H-9), 3.73 (sa, 1H, H-8), 2,98 (dd, J = 4,4,
14,2 Hz, 1H, H-7a), 2,58 (dd, J = 10,1, 14,2 Hz, 1H, H-7b); RMN 13C (100 MHz, CDCl 3 ): δ 172,4 (C-9’), 149.1 (C-3), 148,3
(C-3’), 147,9 (C-4), 146,5 (C-4’), 137,2 (C-7’), 131,4 (C-1), 128,1 (C-1’), 126,0 (C-6), 125,8 (C-8’), 122,0 (C-6’), 109.1 (C-5),
108,7 (C-5’), 108,6 (C-2), 108,4 (C-2’), 101,6 (OCH 2 O), 101,0 (OCH 2 O), 69,5 (C-9), 39,8 (C-7), 34,1 (C-8).
Datos para Zr-5 (desde la mezcla): RMN 13C (100 MHz, CDCl 3 ): δ 174,6 (C-9´), 159,7 (C-8),148,1 (C-5), 147.8 (C-5´),
146.8 (C-4), 146.2 (C-4´), 131.6 (C-1), 129,3 (C-1´), 126,7 (C-8’),121.5 (C-6), 121,4 (C-6´), 109.0 (C-2), 108.8 (C-2´), 108.6
(C-7), 108.3 (C-7´), 101.1 (OCH 2 O), 100,9 (OCH 2 O), 71.1 (C-9), 33,2 (C-7), 29,2 (C-7´).
Datos reportados en la literatura para Zr-4: Shieh et al., 1990 y para Zr-5: Almtorp et al., 1991.
6.66
6.64
6.62
1´
7´
1´
O
3´
5´
O
O
O
3.00
2.99
2.97
2.96
O
3.60
3.61
0.95
1.93
9´
5
O
5´
H-6
H-6´
7´
O
O
3´
H-2
H-5
H-5´
1
9´
5
9
3
O
O
O
H-2´
7
9
1
2 OCH2O
2.61
2.58
2.57
2.55
6.74
6.72
6.88
6.86
7.08
7.06
7.03
7
3
O
OCH2O (3’-4’)
3.00
2.99
2.97
2.96
2.61
2.58
2.57
2.55
3.60
4.25
7.08
7.06
7.03
6.88
6.86
6.74
6.72
6.66
6.64
6.03
5.93
5.92
97
7.49
7.48
Capítulo 2
H-7b
H-7a
H-9
9.0
8.5
8.0
6.5
6.0
5.5
f1 (ppm)
5.0
4.5
3.5
1.00
1.00
0.97
4.0
0.95
0.33
7.0
1.95
7.5
1.92
2.61
1.98
1.00
3.64
9.5
0.98
0.33
H-7´
3.0
2.5
2.0
1.5
1.0
1
RMN13C
7
O
39.8
37.5
69.4
109.1
108.7
108.6
108.4
101.7
101.0
131.4
128.1
126.0
125.8
122.0
137.2
172.4
149.1
148.3
147.9
146.5
Figura 2-51 Espectro de RMN H (CDCl 3 , 400 MHz) de la mezcla de Zr-4 y Zr-5.
9
3
7
O
1
O
1
9´
5
1´
7´
9
3
O
O
O
9´
5
O
1´
7´
3´
5´
O
3´
5´
O
O
O
O
C-9’
C-9’
C-8
DEPT 135
C-8
C-6’
C-7’
C-9
C-7’
OCH2O
C-9
170
160
150
140
130
Figura 2-52 Espectro de RMN
120
13
110
100
f1 (ppm)
90
80
70
60
50
40
30
C y DEPT 135 (CDCl 3 , 100 MHz) de la mezcla de Zr-4 y Zr-5.
98
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Tabla 2-16 Datos espectroscópicos y constantes físicas para flindersina Zr-6
Nombre:
4'
5'
5
Estado físico
4
1'
2
7
N
H
8
Solido amarillo pálido
2'
O 3'
6
Flindersina Zr-6
Fórmula molecular
C 14 H 13 NO 2
Peso molecular
227,1 g/mol
Punto de fusión
183 – 185 °C (CHCl 3 )
O
EM-IE: m/z (%) = 227 (67), 212 (100), 198 (20), 183(18).
IR: ν (cm-1) = 3050 (N-H), 1720 (C=O), 1650 (C=C), 1590 (C=C), 1270 (C-O), 1115 (C-O)
RMN 1H (400 MHz, CDCl 3 ): δ 7,88 (dd, J = 8,0 y 1,0 Hz, 1H, H-8), 7,46 (t, J = 7,5 Hz, 1H, H-7), 7,37 (d, J = 8,1 Hz, H-5),
7,18 (t, J = 7,5 Hz, H-6), 6,77 (d, J = 10,0 Hz,1H, H-1’), 5,55 (d, J = 10,0 Hz, 1H, H-2'), 1,53 (s, 6H, H-4' y H-5')
RMN 13C (100 MHz, CDCl 3 ): δ 162,6 (C-2). 157,7 (C-4), 137,9 (C-8a), 130,8 (C-7), 126,1 (C-1'), 122,4 (C-5), 122,1 (C-6),
117,1 (C-2'), 116,1 (C-8), 115,2 (C-3), 105,7 (C-4a), 79,1 (C-3'), 28,3 (C-4', 5').
1.53
5.56
5.54
H-4’ y
H-5’
6.78
6.76
7.20
7.18
7.16
7.48
7.47
7.45
7.39
7.37
7.47
7.45
7.39
7.20
7.18
7.16
6.78
6.76
7.88
7.88
7.86
7.86
7.88
7.88
7.86
7.86
Datos espectroscópicos descritos en la literatura: Cuca et al., 1998.
4'
5'
O
H-8
H-6
H-7
5
H-5
6
H-1’
7.8
7.7
7.6
7.4 7.3 7.2
f1 (ppm)
7.5
1.00
1.05
0.98
1.20
1.12
8
7.9
7.1
7.0
6.9
6.8
2'
1'
2
7
8.0
3'
4
N
H
O
6.7
8.5
8.0
7.5
7.0
6.04
1.07
1.00
1.11
0.98
1.05
1.20
H-2’
6.5
6.0
5.5
5.0
4.5
f1 (ppm)
1
4.0
3.5
3.0
2.5
2.0
Figura 2-53 Espectro de RMN H (CDCl 3 , 400 MHz) para Zr-6.
1.5
1.0
0.5
28.3
79.0
130.8
137.9
RMN13C
117.1
116.1
115.2
99
126.1
122.4
122.1
Capítulo 2
4'
5'
O
5
4
6
1'
2
7
C-3’
C-4’ y
C-5’
2'
3'
N
H
8
O
C-1’
C-3
C-8a
C-4a
C-4
DEPT 135
C-5 y
C-6
C-7
C-2’
C-8
160
155
150
145
140
135
130
125
120
115
110
105
100
Figura 2-54 Espectro de RMN
95
90
85
80
f1 (ppm)
75
70
65
60
55
50
45
40
35
30
25
20
15
10
13
C y DEPT 135 (CDCl 3 , 100 MHz) para Zr-6.
Tabla 2-17 Datos espectroscópicos y constantes físicas para (+)-dimetilmatairesinol Zr-7
O
7
9
3
1
O
Nombre:
O
9´
5
1´
7´
O
3´
5´
O
O
Estado físico
Fórmula molecular
(+)-dimetilmatairesinol Zr-7
Aceite incoloro
C 22 H 26 O 6
Peso molecular
386,4 g/mol
Rotación óptica
[α]20
: + 20,1 (c 1.0, CHCl 3 )
𝐷
IR: ν = 3030 (=C-H), 2935 (C-H), 1740 (C=O), 1608 (C=C), 1512 (C=C), 1480 (C=C), 1251 (C-O), 1190 (C-O) cm-1.
RMN 1H (400 MHz, CDCl 3 ): δ 6,66 (m, 6H), 4,11 (sa, 1H, H-9a), 3,84 (sa, 13H, H-9b; 4OCH 3 ), 2,93 (sa, 2H, H-7’), 2,54
(m, 4H, H-7; H-8; H-8’).
RMN 13C (100 MHz, CDCl 3 ): δ 178,6 (C-9’), 148,9 (C-3; C-3’), 147,8 (C-4; C-4’), 130,4 (C-1), 130,1 (C-1’), 121,3 (C-6’),
120,5 (C-6), 112,3 (C-2’), 111,7 (C-2), 111,2 (C-5’), 111,0 (C-5), 71,2 (C-9), 55,8 (OCH 3 ), 46,5 (C-8’), 41,0 (C-8), 38,1 (C7’), 34,4 (C-7).
Datos espectroscópicos descritos en la literatura Arimotto et al., 1996; Gomes Heleno et al., 2006.
100
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
7
O
1
O
9´
5
2.58
2.49
9
3
O
2.93
3.84
3.82
6.75
6.67
6.55
6.47
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
1´
7´
OCH3
O
3´
5´
O
O
H
aromáticos
H-7’
H-7; H-8 y
H-8’
7.5
7.0
6.5
6.0
5.5
5.0
4.5
f1 (ppm)
4.0
3.5
4.51
2.06
0.94
5.91
8.0
13.92
H-9a
3.0
2.5
1.5
2.0
1
41.0
38.1
34.4
46.5
55.8
71.2
112.3
111.7
111.2
111.0
121.3
120.5
130.4
130.1
148.9
147.8
147.8
178.6
Figura 2-55 Espectro de RMN H (CDCl 3 , 400 MHz) para Zr-7.
RMN13C
O
7
9
3
1
O
O
9´
5
1´
7´
C-9’
O
C-1
C-1’
3´
5´
O
O
DEPT 135
OCH3
C-6
C-6’
C-7’
C-9
190
180
170
160
150
140
130
120
Figura 2-56 Espectro de RMN
110
100
f1 (ppm)
13
90
80
70
60
50
40
C y DEPT 135 (CDCl 3 , 100 MHz) para Zr-7.
C-7
30
1.0
Capítulo 2
101
Tabla 2-18 Datos espectroscópicos y constantes físicas para γ-fagarina Zr-8
3
11
Estado físico
5
10
7
12
N
Sólido amorfo de color amarillo pálido.
6
2
O
γ-fagarina Zr-8
Nombre:
O
9
8
O
Formula molecular
C 13 H 11 NO 3
Peso molecular
229,2 g/mol
Punto de fusión
140-141°C (CHCl 3 )
EM-IE: m/z (%) = 229 (96), 228 (58), 214 (100), 200 (43), 199 (10).
IR: ν (cm-1) = 1640 (C=N), 1568 (C=C), 1500 (C=C), 1256 (C-O), 1090 (C-O)
RMN 1H (400 MHz, CDCl 3 ): δ 7,84 (dd, J = 8,6; 1,0 Hz, 1H, H-5), 7,64 (d, J=2,8 Hz, 1H, H-2), 7,35 (t, J=8,1 Hz, 1H, H-6),
7,08 (d, J=2,8 Hz, 1H, H-3), 7,06 (d, J= 7,7 Hz, 1H, H-7), 4,44 (s, 3H, 4-OCH 3 ), 4,08 (s, 3H, 8-OCH 3 )
RMN 13C (100 MHz, CDCl 3 ): δ 163,3 (C-12), 156,9 (C-4), 154,6 (C-8), 143,9 (C-2), 137,6 (C-9), 123,5 (C-6), 119,7 (C11), 114,1 (C-5), 107,7 (C-7), 104,6 (C-3), 103,9 (C-10), 59,0 (4-OCH 3 ), 56,0 (8-OCH 3 ).
4.08
4.44
7.86
7.85
7.83
7.83
7.65
7.64
7.37
7.36
7.33
7.08
7.07
7.07
7.05
Datos espectroscópicos descritos en la literatura: Cuca et al., 1998; Ito et al., 1998.
7.08
7.07
7.07
7.05
7.37
7.36
7.33
7.65
7.64
7.86
7.85
7.83
7.83
OCH3 (4)
O
3
OCH3 (8)
11
10
5
6
2
H-2
N
9
8
O
7.7
7.6
7.4
7.5
f1 (ppm)
2.11
1.03
0.97
H-7
1.00
7.8
7
12
H-6
H-5
7.9
O
H-3
7.2
7.3
7.1
7.0
H-3
H-2
H-6
H-5
10.0
9.5
9.0
8.5
8.0
7.5
7.0
6.5
6.0
5.5
f1 (ppm)
1
5.0
4.5
3.11
3.07
2.11
1.03
0.97
1.00
H-7
4.0
3.5
3.0
2.5
Figura 2-57 Espectro de RMN H (CDCl 3 , 400 MHz) para Zr-8
2.0
1.5
1.0
102
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
56.0
59.0
107.7
104.6
103.9
114.1
119.7
123.5
137.5
143.9
RMN13C
156.9
154.6
163.2
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
O
3
11
10
5
6
2
O
7
12
N
C-4 C-8
C-10
C-11
C-9
8
O
OCH3 (4)
C-12
9
DEPT 135
OCH3 (8)
C-6
C-5
C-7
C-3
C-2
170
180
160
150
140
130
120
Figura 2-58 Espectro de RMN
110
100
f1 (ppm)
90
80
70
60
50
40
30
20
13
C y DEPT 135 (CDCl 3 , 100 MHz) para Zr-8
Tabla 2-19 Datos espectroscópicos y constantes físicas para skimmianina Zr-9
Nombre:
O
3
11
10
Estado físico
5
7
12
N
Solido amorfo de color amarillo-verdoso.
6
2
O
Skimmianina Zr-9
9
8
O
O
Formula molecular
C 14 H 13 NO 4
Peso molecular
319,3 g/mol
Punto de fusión
177-179°C (CHCl 3 )
EM-IE: m/z (%) = 259 (97), 258 (21), 244 (100), 230 (43), 228 (10).
IR: ν (cm-1) = 1620 (C=N), 1575 (C=C), 1509 (C=C), 1270 (C-O), 1098 (C-O)
RMN 1H (400 MHz, CDCl 3 ): δ 8,01 (d, J = 9,4 Hz, 1H, H-5), 7,58 (d, J=2,8 Hz, 1H, H-2), 7,23 (d, J=9,4 Hz, 1H, H-6), 7,04
(d, J=2,8 Hz, 1H, H-3), 4,43 (s, 3H, 4-OCH 3 ), 4,10 (s, 3H, 8-OCH 3 ), 4,03 (s, 3H, 7-OCH 3 ).
RMN 13C (100 MHz, CDCl 3 ): δ 164,4 (C-12), 157,2 (C-4), 152,1 (C-9), 143,0 (C-2), 141,5 (C-7), 141,0 (C-8), 118,1 (C-5),
114,9 (C-11), 112,1 (C-6), 104,6 (C-3), 102,0 (C-10), 61,6 (8-OCH 3 ), 59,0 (4-OCH 3 ), 56,8 (7-OCH 3 ).
Datos espectroscópicos descritos en la literatura: Liu et al., 2009; Cuca et al., 1998.
4.11
4.03
4.43
7.24
7.22
7.04
7.04
7.58
7.58
103
8.03
8.00
Capítulo 2
O
7.04
7.04
7.24
7.22
7.58
7.58
8.03
8.00
3
11
10
7
N
12
OCH3 (4) OCH3 (8)
H-2
7.7
7.8
7.4
7.6
7.5
f1 (ppm)
H-2
H-5
7.3
8
O
0.98
1.17
2.27
1.09
0.80
0.93
0.10
0.85
0.86
7.9
8.0
O
9
OCH3 (7)
H-3
H-6
6
2
O
H-5
5
7.2
7.1
7.0
H-6
9.5
9.0
8.5
7.5
8.0
7.0
6.5
6.0
5.5
f1 (ppm)
5.0
2.86
2.92
3.00
2.97
3.08
3.09
2.27
1.09
0.98
1.17
0.91
0.93
0.85
0.86
H-3
4.5
4.0
3.5
3.0
2.5
2.0
1.5
1.0
1
61.6
59.0
56.8
104.6
118.1
114.9
112.1
143.0
141.5
152.1
157.2
RMN13C
164.3
Figura 2-59 Espectro de RMN H (CDCl 3 , 400 MHz) para Zr-9.
O
3
11
10
5
6
2
O
7
12
N
O
9
OCH3 (4)
8
O
C-9
C-12
C-4
C-11
C-8
C-10
DEPT 135
OCH3 (8)
C-5
C-2
OCH3 (7)
C-3
C-6
180
170
160
150
140
130
120
Figura 2-60 Espectro de RMN
110
13
100
f1 (ppm)
90
80
70
60
50
40
C y DEPT 135 (CDCl 3 , 100 MHz) para Zr-9.
30
20
104
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Tabla 2-20 Datos espectroscópicos y constantes físicas para (+)-siringaresinol Zr-10.
Nombre:
O
3´
9
1
5
7 O
Aceite amarillo pálido
Formula molecular
5´
O
H
H
O
Estado físico
OH
O 7´ 1´
(+)-siringaresinol Zr-10
C 22 H 26 O 8
Peso molecular
9´
418.4 g/mol
[α]25
:
𝐷
Rotación óptica
HO
+42.1°(c 0.40, CHCl 3 )
IR: ν (cm-1) = 3420 (O-H), 2942 (C-H), 1605 (C=C), 1519 (C=C), 1464
(C=C), 1420 (H-C-H), 1380 (H-C-H),1230 (C-O), 1110 (C-O) cm-1.
3
O
RMN 1H (400 MHz, CDCl 3 ): δ 6,57 (s, 4H, H-2, H-6, H-2’, H-6’), 5,56 (sa, 2H, OH), 4,73 (d, J = 4,2 Hz, 2H, H-7, H-7´),
4,27 (dd, J = 9.0, 6.8 Hz, 2H, H-9 eq , H-9´ eq ), 3,90 (m, 2H, H-9 ax , H-9´ ax ), 3,89 (s, 12H, OCH 3 ), 3,09 (m, 2H, H-8, H-8´).
RMN 13C (100 MHz, CDCl 3 ): δ 147,1 (C-3, C-5, C-3’, C-5’), 134,3 (C-4, C-4’), 132,1 (C-1, C-1’), 102,7 (C-2, C-6, C-2’, C6’), 86,0 (C-7, C-7´), 71,8 (C-9, C-9´), 56,4 (OCH 3 ), 54,3 (C-8, C-8´).
3.89
4.28
4.27
4.26
4.73
4.72
5.56
6.57
3.09
3.09
Datos descritos en la literatura: El-Hassan et al., 2003; Ayres y Loike, 1990.
3´
4 OCH3
3.89
4.28
4.27
4.26
4.73
4.72
3.09
3.09
9
5´
O
H
1
5
OH
O 7´ 1´
H
O
O
7 O
9´
HO
H-7
H-7´
O
2.2
7.5
7.0
6.5
6.0
5.5
H-9
H-9´
5.0
4.5
f1 (ppm)
1
H-8
H-8´
4.0
2.2
14.8
4.1
8.0
H-7
H-7´
2.0
OH
1.9
H-2
H-6
H-2´
H-6´
1.8
1.8
1.9
14.8
H-9
H-9´
8.5
3
H-8
H-8´
3.5
3.0
2.5
2.0
1.5
Figura 2-61 Espectro de RMN H (CDCl 3 , 400 MHz) para Zr-10.
1.0
0.5
71.8
86.0
134.3
132.1
147.1
RMN13C
56.3
54.3
105
102.7
Capítulo 2
3´
9
1
5
OH
5´
O
H
H
O
OCH3
O 7´ 1´
O
7 O
9´
HO
O
C-3 y C-5
C-3’ y C-5’
3
C-7 y
C-7’
C-4 y
C-4’
C-1 y
C-1’
DEPT 135
C-2 y C-6
C-2’ y C-6’
C-8 y
C-8’
C-9 y
C-9’
160
155
150
145
140
135
130
125
120
115
110
105
Figura 2-62 Espectro de RMN
100
95
90
85
f1 (ppm)
80
75
70
65
60
55
50
45
40
35
30
25
20
13
C y DEPT 135 (CDCl 3 , 100 MHz) para Zr-10.
Tabla 2-21 Datos espectroscópicos y constantes físicas para cafeato de etilo Zr-11
Nombre:
O
6
Estado físico
7
5
9
O 1'
2'
Cafeato de etilo Zr-11
Sólido amorfo de color naranja pálido.
Formula molecular
C 11 H 12 O 4
2
HO
OH
Peso molecular
208,1 g/mol
Punto de fusión
166-167°C (Acetona)
IR: ν (cm ) = 3343 (OH), 2955 (C-H), 1704 (C=O), 1600 (C=C), 1545 (C=C), 1255 (C-O), 1098 (C-O).
-1
RMN 1H (400 MHz, acetona-d 6 ): δ 7,53 (d, J = 15,9 Hz, 1H, H-7), 7,16 (d, J = 2,0 Hz, 1H, H-2), 7,03 (dd, J = 8,2; 2,0 Hz,
1H, H-6), 6,87 (d, J = 8,2 Hz, 1H, H-5), 6,27 (d, J = 15,9 Hz, 1H, H-8), 4,18 (c, J= 7,1 Hz, 2H, H-1’), 1,26 (t, J= 7,1 Hz, H2’).
RMN 13C (100 MHz, acetona-d 6 ): δ 168,4 (C-9), 149,6 (C-4), 147,2 (C-3), 146,5 (C-7), 128,5 (C-1), 123,5 (C-6), 117,3 (C5), 116,7 (C-8), 116,0 (C-2), 61,5 (C-1’), 15,6 (C-2’).
Datos espectroscópicos descritos en la literatura: Xiang et al., 2011; Zhang et al., 2012.
106
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
1.26
4.20
4.19
4.17
4.15
6.29
6.25
6.88
6.86
7.16
7.16
7.55
7.51
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
O
6
7
5
9
O 1'
2'
2
HO
H-2’
OH
H-1’
H-2
H-8
H-5
H-7
9.0
8.5
7.5
8.0
7.0
6.5
4.4
2.2
1.0
1.0
1.0
1.0
1.0
H-6
6.0
5.5
5.0
4.5
f1 (ppm)
4.0
3.5
3.0
2.5
2.0
1.5
1.0
0.5
1
15.6
61.5
117.3
116.7
116.0
128.5
123.5
RMN13C
149.6
147.2
146.5
168.4
Figura 2-63 Espectro de RMN H (acetona-d 6 , 400 MHz) para Zr-11.
O
6
7
5
9
O 1'
2'
2
HO
C-5, C-8 y
C-2
OH
C-3
C-9
C-4
C-2’
C-1
DEPT 135
C-6
C-7
C-1’
210
200
190
180
170
160
150
140
130
Figura 2-64 Espectro de RMN
120
13
110
100
f1 (ppm)
90
80
70
60
50
40
30
20
C y DEPT 135 (acetona-d 6 , 100 MHz) para Zr-11.
10
0
Capítulo 2
107
Tabla 2-22 Datos espectroscópicos y constantes físicas para 7-hidroxicumarina Zr-12
Nombre:
5
4
6
7-hidroxicumarina Zr-12
Estado físico
3
Sólido amorfo de color amarillo.
Formula molecular
1
HO
O
8
O
C9H6O3
Peso molecular
162,0 g/mol
Punto de fusión
225-227°C (descomposición)
IR: ν (cm-1) = 3180 (OH), 1718 (C=O), 1680 (C=C), 1574 (C=C) 1238 (C-O), 1130 (C-O).
RMN 1H (400 MHz, acetona-d 6 ): δ 7,87 (d, J = 9,5 Hz, 1H, H-4), 7,51 (d, J = 8,5 Hz, 1H, H-5), 6,85 (dd, J = 8,5; 2,3 Hz,
1H, H-6), 6,76 (d, J = 2,3 Hz, 1H, H-8), 6,17 (d, J = 9,5 Hz, 1H, H-3).
RMN 13C (100 MHz, acetona-d 6 ): δ 163,0 (C-2), 162,1 (C-7), 157,9 (C-9), 145,7 (C-4), 131,4 (C-5), 114,7 (C-6), 113,8 (C3), 113,6 (C-10), 104,2 (C-8).
5
6.18
6.16
6.86
6.85
6.84
6.83
6.76
6.75
7.52
7.50
7.88
7.86
Datos espectroscópicos descritos en la literatura: Kim et al., 2006.
4
6
3
1
HO
O
8
O
H-3
H-5
H-8
H-4
9.0
8.8
8.6
8.4
8.2
8.0
7.8
7.6
7.4
7.2
7.0
f1 (ppm)
1
6.8
1.0
1.0
1.0
1.0
1.0
H-6
6.6
6.4
6.2
6.0
5.8
Figura 2-65 Espectro de RMN H (acetona-d 6 , 400 MHz) para Zr-12.
5.6
5.4
5.2
108
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
104.2
114.7
113.8
113.8
131.4
145.7
RMN13C
157.9
162.1
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
5
4
6
3
1
HO
C-5
C-7
O
8
C-10
O
C-6
C-9
C-2
DEPT 135
C-4
C-3
C-8
210
200
190
170
180
160
150
140
Figura 2-66 Espectro de RMN
130
120
110
f1 (ppm)
100
90
80
70
60
50
40
30
20
13
C y DEPT 135 (acetona-d 6 , 100 MHz) para Zr-12
Tabla 2-23 Datos espectroscópicos y constantes físicas para ácido (-)-rigidunoico Zr-14
Nombre:
Estado físico
OH
9'
O
7'
1'
6'
3
4'
3'
OH
O
1
5
OH
sólido amorfo de color amarillo-verdoso
Formula molecular
OH
HO
Ácido (-)-rigidunoico Zr-14
7 OH
O
C 16 H 18 O 9
Peso molecular
354,1 g/mol
Punto de fusión
250°C (Descomposición)
Rotación Optica
[α]20 D – 33,6 (c 1.0, MeOH)
Datos EMAR
Masa calculada para C 16 H 17 O 9 353,0873
observada 353,0890
IR: ν (cm-1) = 3415 (OH), 2919 (C-H), 2851 (C-H), 1660 (C=O), 1645 (C=O), 1600 (C=C), 1498 (C=C), 1450 (H-C-H),
1250 (C-O), 1231 (C-O).
RMN 1H (400 MHz, CD 3 OD-D 2 O): δ 7,48 (d, J = 15,9 Hz, 1H, H-7’), 7,00 (sa, 1H, H-2’), 6,87 (da, J = 8,0 Hz, 1H, H-6’),
6,76 (d, J = 8,2 Hz, 1H, H-5’), 6,23 (d, J = 15,9 Hz, 1H, H-8’), 5,30 (td, J = 10,9; 10,9; 4,9 Hz, 1H, H-3), 4,26 (d, J = 2,3
Hz, 1H, H-5), 3,80 (dd, J = 9,6; 2,7 Hz, 1H, H-4), 2,09 (m, 4H).
RMN 13C (100 MHz, CD 3 OD-D 2 O): δ 180,8 (C-7), 169,7 (C-9’), 148,5 (C-4), 147,2 (C-7’), 145,7 (C-3), 127,7 (C-1’), 123,4
(C-6’), 116,8 (C-5’), 115,7 (C-2’), 115,3 (C-8), 79,1 (C-1), 74,0 (C-4), 72,4 (C-5), 71,9 (C-3), 39,7 (C-2), 38,0 (C-6).
Elucidación estructural por análisis espectroscópico descrita en las páginas 88 – 96
Capítulo 2
109
2.2.4 Estudio fitoquímico de la corteza de O. longifolia
El estudio fitoquímico de la corteza de O. longifolia, permitió el aislamiento e
identificación de ocho sustancias (Figura 2.67), entre las que se encuentran dos
sesquiterpenoides (ácido 11,13-dihidrocostuso Ol-1 y kudtdiol Ol-7), una lactona
(litsealiicolido
C
Ol-2),
tres
sesquiterpenlactonas
((+)-longifolina
Ol-4,
(+)-
hidroxiatractilólido Ol-5 y ocotealactol Ol-6) y dos esteroles (sitosterol Ol-3 y sitosterol-3O-glicósido Ol-7). De los ocho compuestos aislados, el compuesto denominado (+)longifolina Ol-4 no presenta reportes previos en la literatura. Todos los metabolitos
aislados e identificados en la corteza de O. longifolia se reportan por primera vez para la
especie, siendo este trabajo el primer reporte de la composición química de la corteza de
O. longifolia. Los tipos de metabolitos encontrados han sido previamente reportados en
especies de la familia Laureaceae, estando así estos resultados de acuerdo con la
quimiotaxonomía de la familia.
O
HO
O
O
OH
Ol-2
Ol-1
HO
Ol-3
OH
O
OH
O
O
O
O
O
OH
OH
Ol-6
Ol-5
Ol-4
HO
OH
Ol-7
Glu-O
Ol-8
Figura 2-67 Metabolitos aislados de la corteza de Ocotea longifolia.
Los metabolitos de tipo esteroidal y sesquiterpénico han sido ampliamente reportados en
la familia Lauraceae y de igual forma en el género Ocotea (Garcez et al., 2010; Chavez et
al., 1995; Pereira et al., 1995), pero las sesquiterpenlactonas no se han reportado
110
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
ampliamente como constituyentes químicos de especies de Ocotea, solo se tiene un
reporte de la presencia de una sesquiterpenlactona conocida como ocotealactol en la
corteza de O. guianensis (Roque et al., 1978). Dichas sustancias se encuentran
ampliamente distribuidas en especies de los géneros Linderia, Litsea, Neolitsea y Laurus,
pertenecientes a la familia Lauraceae (Jullianti et al., 2012; Sumioka et al. 2011; Gan et
al., 2009; Barla et al., 2007; Ohno et al., 2005; Li, 1992), donde en los tres primeros
géneros se han encontrado principalmente sesquiterpenlactonas lineales, mientras que
en el género Laurus se han reportado sesquiterpenlactonas angulares.
De acuerdo a los estudios filogenéticos realizados para la familia Lauraceae, se
encuentra que la especie objeto de estudio pertenece al complejo Ocotea, el cual se
encuentra dentro del clado Persea-Laurae (Chanderbali et al., 2001). La información
anterior sugiere que en principio se esperaba encontrar que los componentes químicos
de la corteza de O. longifolia fueran del mismo tipo que los que se han reportado para
diversas especies que pertenecen al complejo Ocotea. En esta investigación en la
especoe O. longifolia se encontraron metabolitos de tipo sesquiterpenlactona, sustancias
que no corresponden a compuestos comúnmente encontrados como constituyentes
químicos de especies de los géneros pertenecientes al complejo Ocotea (Endlicheria,
Ocotea, Aniba, Kubitzkia, Licaria, Pleurothrium, Paraia, Nectandra, Aiouea, Dicypellium y
Umbellularia), pero sí han sido encontrados en especies pertenecientes al complejo
Laureae, que también se encuentra dentro del clado Persea-Laureae. Los resultados de
este estudio pueden llegar a tener relevancia quimiotaxónomica para el género Ocotea y
en general para la familia Lauraceae, pues este es el segundo reporte de metabolitos tipo
sesquiterpenlactona en especies de este género y por lo tanto en el complejo Ocotea.
Los compuestos Ol-1 a Ol-8 fueron elucidados por métodos espectroscópicos (RMN 1D y
2D, IR, EM), por comparación con los datos descritos en la literatura y/o por
cocromatografía en CCD con muestras auténticas. A continuación se describe la
elucidación estructural del compuesto Ol-4. Los datos espectroscópicos y constantes
físicas de los compuestos conocidos se presentan de manera resumida en las Tablas
2.24 a 2.29, y adicionalmente en las Figuras 2.76 a 2.85 donde se muestra los espectros
de RMN 1H y 13C de dichos compuestos.
Capítulo 2
111
Elucidación estructural del compuesto Ol-4.
El compuesto Ol-4 es un aceite amarillo pálido. Su espectro IR tomado en película se
caracteriza por presentar señales indicativas de la presencia de un grupo carbonílico tipo
γ-lactona (señal intensa en 1742 cm-1, características de estiramientos C=O), de grupos
alifáticos (señales en 2850-2940 cm-1 por tensiones C-H y en 1450, 1380 cm-1 por
flexiones en el plano H-C-H) y de alquenos (señales en 3040-3070 y 1650-1630 cm-1
debidas a las tensiones =C-H y C=C en alquenos, respectivamente). La rotación óptica
determinada fue [α]20
+23,1 (c 0.50, CHCl 3 ).
𝐷
P
Su espectro RMN 1H (Figura 2.68) presenta señales entre δ H 1,00 y 6,00 que integran
para 17 protones y que indican que el compuesto es alifático insaturado. En el espectro
se destacan las señales desplazadas a campo bajo que sugieren hidrógenos sobre
carbonos con hibridación sp2 o unidos a heteroátomos en δ 5,03 (d, J = 1,4 Hz, 1H), 5,16
(d, J = 2,4 Hz, 1H), 5,22 (d, J = 1,4 Hz, 1H) y 5,72 (s, 1H). De estas, las señales en δ
5,03 (d, J = 1,4 Hz, 1H) y 5,22 (d, J = 1,4 Hz, 1H) de acuerdo al desplazamiento,
multiplicidad y constante de acoplamiento sugieren la presencia de un doble enlace
terminal. También en el espectro se observan señales de hidrógenos para dos grupos
metilo en δ 1,26 (s, 3H) y en δ 2,00 (s, 3H).
En los espectros RMN
13
C y DEPT 135 (Figura 2.69) se observan señales para 15
carbonos, de las cuales dos corresponden a carbonos tipo metilo con δ 8,4 (CH 3 ) y 22,6
(CH 3 ) corroborando lo observado en RMN 1H; cuatro señales debidas a carbonos tipo
metileno con δ 22,2 (CH 2 ), δ 36,7 (CH 2 ), 40,9 (CH 2 ) y 109,4 (CH 2 ), corroborando esta
última la presencia de un doble enlace terminal; tres señales son debidas a carbonos tipo
metino con δ 52,3 (CH), 63,6 (CH) y 120,0 (CH), que de acuerdo a sus desplazamientos
las dos primeras corresponden a carbonos alifáticos cerca a heteroátomos y la última a
un carbono olefínico; seis corresponden a carbonos cuaternarios con δ 38,4 (C), 122,5
(C), 145,6 (C), 146,6 (C), 148,0 (C) y 171,2 (C). La señal en 171,2 (C) soporta la
presencia de un grupo γ-lactona observado en IR. También del análisis de RMN
13
C y
DEPT 135 se deduce que el compuesto presenta tres dobles enlaces, uno terminal, uno
parcialmente sustituido y otro totalmente sustituido (Silverstein y Webster, 1996).
112
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
1.26
1.70
1.67
2.42
2.39
2.39
2.38
2.19
2.00
5.22
5.22
5.16
5.16
5.03
5.02
5.72
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
CH3 (14)
14
O
7
O
1.70
1.67
5
2.00
12
3
2.19
9
2.42
2.39
2.39
2.38
1
CH3 (13)
H
15
OH
13
H-5
H-2
H-3
2.5
2.4
H-1
2.3
2.2
2.1
2.0
1.9
f1 (ppm)
1.8
1.7
1.6
1.5
H-9
CH(15b)
H-6
8.0
7.5
7.0
6.5
6.0
5.5
5.0
4.5
4.0
f1 (ppm)
3.5
3.0
2.5
2.0
4.86
5.34
1.24
1.47
3.53
1.18
1.07
1.05
1.10
1.00
CH(15a)
1.5
1.0
0.5
0.0
1
Figura 2-68 Espectro RMN H para el compuesto Ol-4 (CDCl 3 , 400 MHz).
Las señales de RMN
13
C junto con el análisis EMAR con ESI en modo positivo conducen
a la fórmula pseudomolecular C 15 H 19 O 3 (m/z 247,1346 [M+H]+, calculado para C 15 H 19 O 3 ,
247,1334), consistente con 7 grados de insaturación. El análisis realizado sugiere que el
compuesto corresponde a una sesquiterpenlactona de tipo eudesmanólido que es
coherente con lo reportado en la familia Lauraceae para este tipo de compuestos, donde
este tipo de metabolitos se han reportado principalmente en los géneros Linderia,
Neolitsea y Laurus (Jullianti et al., 2012; Sumioka et al. 2011; Gan et al., 2009; Barla et
al., 2007; Ohno et al., 2005; Li, 1992).
8.4
22.6
22.2
40.9
38.4
36.7
52.6
63.5
109.4
122.5
119.9
148.1
146.5
145.6
13
RMN C
113
171.2
Capítulo 2
C-10
6C
C-4
C-11
C-8
C-7
C-12
2 CH3
14
DEPT 135
1
9
12
3
5
C-14
O
7
O
C-6
3 CH
C-13
C-5
C-9
H
15
OH
13
4 CH2
C-1 C-3
C-15
180
170
160
150
140
130
120
Figura 2-69 Espectro de RMN
110
100
90
f1 (ppm)
80
70
60
50
40
C-2
30
20
10
0
13
C y DEPT 135 del compuesto Ol-4 (CDCl 3 , 100 MHz)
El análisis de los espectros COSY, HMQC Y HMBC permitió asignar las señales de
hidrógeno y carbono en la estructura y elucidar totalmente el compuesto Ol-4 como una
sesquiterpenlactona de tipo eudesmanólido hidroxilada en C-6. Con el espectro HMQC
(Figura 2.70), se realizó la conectividad de cada hidrógeno con el carbono al cual está
unido, por ejemplo en el espectro se observan las conectividades de los protones en δ H
5,03 (d, J = 1,4 Hz, 1H) y 5,22 (d, J = 1,4 Hz, 1H) con el carbono en δ C 108,4 (CH 2 ), que
soporta la presencia de un doble enlace terminal; del protón en δ H 5,16 (d, J = 2,4 Hz,
1H) con el carbono en δ C 63,6 (CH) y del protón en δ H 2,19 (sa, 1H) con el carbono en
δ C 52,3 (CH), correlaciones que confirman la presencia de un grupo hidroxilo en la
molécula. Las correlaciones observadas en el espectro HMQC se ilustran en la Figura
2.70.
114
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
0
10
20
30
40
50
60
80
90
100
f1 (ppm)
70
110
120
130
140
150
160
170
7.0
6.5
6.0
5.5
5.0
4.5
4.0
3.5
f2 (ppm)
3.0
2.5
2.0
1.5
1.0
0.5
0.0
Figura 2-70 Espectro HMQC para el compuesto Ol-4 (CDCl 3 , 400 MHz)
El espectro COSY 1H-1H (Figura 2.71) permitió establecer la correlación escalar existente
entre los protones en δ H 2,19 (sa, 1H, H-5) y 5,22 (d, J = 1,4 Hz, 1H, H-15) que
contribuyó a la ubicación del grupo hidroxilo en C-6 y que fue confirmada por las
correlaciones observadas en HMBC entre los protones con δ H 5,16 (d, J = 2,4 Hz, 1H, H6) y los carbonos con δ C 38,4 (C-10), 145,6 (C-4) y 148,1 (C-7), que a su vez permitieron
ubicar el doble enlace terminal en las posiciones 4 y 15, y el doble enlace sustituido en
las posiciones 7 y 11.
Capítulo 2
115
0
O
O
1
H
OH
H
2
3
f1 (ppm)
H
4
5
6
7
6.0
5.5
5.0
4.5
1
4.0
3.5
3.0
f2 (ppm)
2.5
2.0
1.5
1.0
0.5
1
Figura 2-71 Espectro COSY H- H para el compuesto Ol-4 (CDCl 3 , 400 MHz)
Adicionalmente las correlaciones en HMBC entre los protones con δ H 5,72 (s, 1H) y los
carbonos con δ C 40,9 (CH 2 -1), 52,3 (CH-5) y 148,0 (C-7) permitieron ubicar la otra
insaturación en las posiciones 8 y 9 del núcleo base. De manera similar fueron ubicados
los dos grupos metilos en las posiciones 11 y 14. Las correlaciones observadas en el
espectro HMBC se presentan en las Figuras 2.72 y 2.73.
O
O
H
OH
Figura 2-72 Principales correlaciones observadas en HMBC para el compuesto Ol-4.
116
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Figura 2-73 Espectro HMBC para el compuesto Ol-4 (CDCl 3 , 400 MHz)
La estereoquímica de C-5, C-6 y C-10 fue establecida por el experimento NOESY (Figura
2.74). Se observa correlación entre los hidrógenos H-5 y H-6 (δ 2,19 (sa, 1H, H-5) y 5,16
(d, J = 2,4 Hz, 1H, H-6)), pero no fue observada correlación de estos con los hidrógenos
del grupo CH 3 ubicado sobre el C-10 (1,26 (s, 3H)). De acuerdo a lo observado en
NOESY, a las multiplicidades y constantes de acoplamiento observadas entre δ 2,19 (sa,
1H, H-5) y 5,16 (d, J = 2,4 Hz, 1H, H-6), se puede establecer que los hidrógenos H-5 y H6 están en posiciones ecuatoriales; por lo tanto el grupo CH 3 -14 estaría en posición trans
respecto a H-5 y H-6.
Capítulo 2
117
O
OH
O
H
H
1.0
1.5
2.0
2.5
3.5
f1 (ppm)
3.0
4.0
4.5
5.0
5.5
6.0
5.6
5.2
4.8
4.4
4.0
3.6
3.2
f2 (ppm)
2.8
2.4
2.0
1.6
1.2
Figura 2-74 Espectro NOESY para el compuesto Ol-4 (CDCl 3 , 300 MHz)
La estereoquímica absoluta fue asignada teniendo en cuenta las correlaciones
establecidas con el experimento NOESY y el valor de la rotación óptica. De esta forma la
estructura de Ol-4 fue establecida como la de una sesquiterpenlactona lineal tipo
eudesmanólido
identificada
como
(4S,8aS)-4-hidroxi-3,8a-dimetil-5-metilidene-
4a,5,6,7,8,8a-hexahidronafto[2,3-b]furan-2-(4H)-ona, que fue denominada (+)-longifolina
(Figura 2.75).
O
O
H
OH
Figura 2-75 Estructura de (+)-longifolina Ol-4
118
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
DATOS ESPETROSCÓPICOS COMPUESTOS CONOCIDOS AISLADOS DE
CORTEZA DE O. longifolia
Tabla 2-24 Datos espectroscópicos y constantes físicas para ácido 11,13-dihidrocustoso Ol-1
Nombre:
14
Estado físico
9
1
5
3
Ácido 11,13-dihidrocustoso Ol-1
Aceite amarillo
Formula molecular
7
C 15 H 24 O 2
13
11
Peso molecular
236,2 g/mol
Rotación óptica
[α]20
: +22,3 (c 0.50, CHCl 3 )
𝐷
H
12
15
HO
O
RMN 1H (400 MHz, CDCl 3 ): δ 4,73 (d, J = 1,5, 1H, H-15a), 4,44 (d, J = 1,5, 1H, H-15b), 2,36 (m, 3H, H-11; H-3), 2,02 (m,
2H, H-6), 1,80 (da, J = 11,8, 1H, H-5), 1,58 (m, 4H), 1,27 (m, 6H), 1,20 (d, J = 7,0, 3H, H-13), 0,71 (s, 3H, H-15).
RMN 13C (100 MHz, CDCl 3 ): δ 182,5 (C-12), 150,9 (C-4), 105,4 (C-15), 49,6 (C-5), 45,3 (C-11), 41,8 (C-1), 40,9 (C-7),
40,8 (C-9), 36,9 (C-3), 36,0 (C-10), 27,0 (C-6), 26,1 (C-8), 23,5 (C-2), 16,2 (C-14), 13,9 (C-13).
0.71
1.27
1.21
1.19
1.58
1.82
1.79
2.02
2.36
2.36
4.44
4.44
4.73
4.73
Datos descritos en la literatura: Bohlmann y Jakupovic, 1979; Dreyer, 1987.
14
9
1
5
3
7
13
11
H
12
15
HO
O
H-14
H-13
5.4
5.2
5.0
4.8
4.6
4.4
4.0
3.8
3.6
3.4
3.2
3.0 2.8
f1 (ppm)
1
2.6
2.4
2.2
2.0
1.8
1.6
1.4
Figura 2-76 Espectro de RMN H (CDCl 3 , 400 MHz) para Ol-1
1.2
2.82
3.89
1.86
2.98
4.2
1.10
H-5
H-11
H-3
0.94
1.00
H-15
1.0
0.8
0.6
0.4
29.7
27.0
26.1
23.5
49.5
45.3
41.8
40.9
40.9
36.9
36.0
150.9
182.5
RMN13C
16.2
13.9
119
105.4
Capítulo 2
14
9
1
5
3
7
13
11
H
12
15
HO
C-10
O
C-6, C-8 y
C-2
C-11
C-4
C-12
DEPT 135
C-13
C-15
C-5
C-7
C-1
C-15
190
170
180
160
150
140
130
120
Figura 2-77 Espectro de RMN
110
C-9
100
f1 (ppm)
90
80
70
60
50
40
C-3
30
20
10
13
C y DEPT 135 (CDCl 3 , 100 MHz) para Ol-1
Tabla 2-25 Datos espectroscópicos y constantes físicas para Litsealiicolido C Ol-2
O
O
1
16
14
12
10
8
6
5
3
OH
Nombre:
Litsealiicolido C Ol-2
Estado físico
Aceite amarillo pálido
Formula
molecular
C 17 H 28 O 3
Peso molecular
280,2 g/mol
Rotación óptica
[α]20
: +37,2 (c 0.50, CHCl 3 )
𝐷
EM-IE: m/z (%): 262 (30) [M-H 2 O], 237 (63), 219 (10), 140 (25) 123 (43),110 (35), 97 (30), 83 (28), 70 (100), 57 (45), 43
(35).
IR: ν (cm-1) = 3420 (OH), 2965 (C-H), 2920 (C-H), 1780 (C=O), 1678 (C=C), 1615 (C=C), 1420 (H-C-H), 1388 (H-C-H).
RMN 1H (400 MHz, CDCl 3 ): δ 7,11 (td, J = 8,0; 8,0; 2,1 Hz, 1H, H-6), 5,26 (sa, 1H, H-3), 4,97 (m, 1H, H-5a), 4,74 (m, 1H,
H-5b), 2,53 (dd, J = 14,8; 7,3 Hz, 1H, H-7a), 2,45 (dd, J = 14,8; 7,3 Hz, 1H, H-7b),1,55 (m, 2H, H-8), 1,26 (m, H-16), 0,90
(t, J = 6,8 Hz, 3H, H-17).
RMN 13C (100 MHz, CDCl 3 ): δ 166,6 (C-1), 157,7 (C-4), 150,2 (C-6), 127,3 (C-2), 91,3 (C-5), 66,5 (C-3), 31,9 (C-15), 29,7
(C-7), 29,6 (C-8), 29,6 (C-9), 29,5 (C-10), 29,5 (C-10), 29,4 (C-11), 29,3 (C-12), 28,3 (C-13), 28,3 (C-14), 22,7 (C-16), 14,1
(C-17).
Datos descritos en la literatura: Cheng et al., 2010.
120
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
14
12
10
8
0.91
0.90
0.88
1.28
O
1
16
2.50
2.47
5.28
4.98
4.97
4.97
4.97
4.75
4.74
4.74
7.13
7.12
7.11
7.10
7.09
7.08
O
1.55
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
5
3
OH
6
H-17
7.5
8.0
6.5
7.0
4.5
f1 (ppm)
5.0
4.0
3.5
3.0
2.5
2.0
4.8
22.8
2.5
1.0
1.0
5.5
6.0
2.4
H-7
1.0
0.9
8.5
H-5
H-3
H-6
1.5
1.0
0.5
1
RMN13C
O
14
12
10
8
14.1
31.9
29.7
29.7
29.6
29.6
29.5
29.4
29.4
29.3
28.3
22.7
66.5
O
1
16
77.3
77.0
76.7
91.3
127.3
150.2
157.7
166.6
Figura 2-78 Espectro de RMN H (CDCl 3 , 400 MHz) para Ol-2
5
3
OH
6
C-17
C-4
C-2
C-1
DEPT 135
C-3
C-6
C-5
170
160
150
140
130
120
110
100
Figura 2-79 Espectro de RMN
90
80
f1 (ppm)
13
70
60
50
40
30
20
C y DEPT 135 (CDCl 3 , 100 MHz) para Ol-2
10
Capítulo 2
121
Tabla 2-26 Datos espectroscópicos y constantes físicas para (+)-longifolina Ol-4
Nombre:
(+)-longifolina Ol-4
Estado físico
Aceite amarillo
14
1
Formula molecular
O
9
O
12
3
5
7
Peso molecular
Rotación óptica
H
OH
15
13
C 15 H 18 O 3
Datos EMAR
246,1 g/mol
[α]20
:
𝐷
+23,1 (c 0.50, CHCl 3 )
Masa calculada para C 15 H 19 O 3 247,1334
observada 247,1346
IR: ν (cm-1) = 3392 (O-H), 2850-2940 (C-H), 1742 (C=O), 1620 (C=C), 1450 (H-C-H), 1388 (H-C-H),1235 (C-O) cm-1.
RMN 1H (400 MHz, CDCl 3 ): δ 5,72 (s, 1H, H-9), 5,22 (d, J = 1,4 Hz, 1H, H-15a), 5,16 (d, J = 2,4 Hz, 1H, H-6), 5,03 (d, J
= 1,4 Hz, 1H, H-15b), 2,40 (m, 1H, H-1a), 2,19 (sa, 1H, H-5), 2,07 (m, 1H, H-1b), 2,00 (s, 3H, H-13), 1,61 (m, 4H, H-2 y
H-3), 1,26 (s, 3H, H-14).
RMN 13C (100 MHz, CDCl 3 ): δ 171,2 (C-12), 148,1 (C-7), 146,5 (C-8), 145,6 (C-4), 122,5 (C-11), 119,9 (C-9), 109,4 (C15), 63,5 (C-6), 52,6 (C-5), 40,9 (C-1), 38,4 (C-6), 36,7 (C-3), 22,6 (C-14), 22,2 (C-2), 8,4 (C-13).
Elucidación estructural por análisis espectroscópico descrita en las páginas 111– 117.
Tabla 2-27 Datos espectroscópicos y constantes físicas para (+)-hidroxiatractilólido Ol-5
Nombre:
Estado físico
14
1
OH
H
15
Solido cristalino de color crema
C 15 H 18 O 3
O
9
O
5
3
Formula molecular
(+)-hidroxiatractilólido Ol-5
12
7
13
Peso molecular
246,1 g/mol
Rotación óptica
[α]20
: + 48.1 (c 1.0, CHCl 3 )
𝐷
IR: ν (cm-1) = 3392 (O-H), 2850-2940 (C-H), 1742 (C=O), 1620 (C=C),
1450 (H-C-H), 1388 (H-C-H),1235 (C-O) cm-1
RMN 1H (400 MHz, CDCl 3 ): δ 4,85 (s, 1H, H-15a), 4,58 (s, 1H, H-15b), 2,60 (dd, J = 13,2; 3,2 Hz, 1H, H-2a), 2,40 (m, 2H,
H-3a,: H-2b), 2,30 (d, J = 13,7 Hz, 1H, H-9a), 1,99 (m, 1H, H-5), 1,83 (sa, 1H, H-14), 1,78 (s, 3H, H-13) 1,62 (m. 4H, H-1
y H-6), 1,51 (d, J = 13,7 Hz, 1H, H-9b),1,02 (s, 3 H, H-14).
RMN 13C (100 MHz, CDCl 3 ): δ 172,6 (C-12), 161,2 (C-7), 148,6 (C-4), 121,9 (C-11), 106,8 (C-15), 103,8 (C-8), 51,7 (C5), 51,2 (C-9), 41,3 (C-1), 36,7 (C-10), 36,1 (C-3), 24,6 (C-2), 22,3 (C-6), 16,5 (C-14), 8,1 (C-13).
Datos descritos en la literatura: Hikino et al., 1964; Endo et al., 1979.
122
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
14
1.02
1.99
1.84
1.83
1.78
1.78
1.63
1.62
2.62
2.61
2.59
2.58
OH
1
O
9
O
5
3
4.58
4.85
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
12
H-13
7
H
H-14
13
15
H-3a y
H-2b
H-15a
H-9a
H-15b
7.0
6.5
6.0
5.5
5.0
0.92
2.03
1.16
4.5
4.0
f1 (ppm)
3.5
3.0
2.5
3.24
7.5
8.0
1.40
1.04
2.87
3.08
1.32
8.5
1.04
1.00
H-2a
2.0
1.0
1.5
0.5
0.0
1
8.1
16.5
24.6
22.3
41.3
36.7
36.1
51.7
51.2
121.9
148.6
161.2
172.6
RMN13C
106.8
103.8
Figura 2-80 Espectro de RMN H (CDCl 3 , 400 MHz) para Ol-5
C-10
C-4
C-8
C-11
C-7
C-12
14
DEPT 135
1
OH
O
5
3
H
C-14
O
9
12
7
13
15
C-9
C-15
190
180
170
160
C-13
C-5
150
140
130
120
110
Figura 2-81 Espectro de RMN
100
90
f1 (ppm)
13
80
70
60
50
C-1 C-3
C-6
C-2
40
30
20
C y DEPT 135 (CDCl 3 , 100 MHz) para Ol-5.
10
0
Capítulo 2
123
Tabla 2-28 Datos espectroscópicos y constantes físicas para ocotealactol Ol-6
Nombre:
Ocotealactol Ol-6
Estado físico
14
Formula molecular
OH
1
O
9
12
OH
+26.1°(c 0.5, CHCl 3 )
IR: ν (cm-1) = 3402 (O-H), 2850-2940 (C-H), 1745 (C=O), 1610 (C=C), 1448
(H-C-H), 1378 (H-C-H),1225 (C-O) cm-1.
13
15
264,1 g/mol
[α]20
:
𝐷
Rotación óptica
7
H
C 15 H 20 O 4
Peso molecular
O
5
3
Solido cristalino de color crema
RMN 1H (400 MHz, CDCl 3 ): δ 5,20 (sa, 1H, H-15a), 5,08 (sa, 1H, H-6), 4,96 (sa, 1H, H-15b), 2,35 (m, 2H, H-9b, H-5),
1,98 (m, 1H, H-9a), 1,83 (s, 3H, H-13), 1,74 (sa, 1H, H-1a) 1,60 (m, 4H), 1,23 (s, 3H, H-14), 1,19 (m, 4H).
RMN 13C (100 MHz, CDCl 3 ): δ 172,4 (C-12), 157,2 (C-7), 146,3 (C-4), 123,0 (C-11), 109,4 (C-15), 104,7 (C-8), 66,7 (C6), 54,7 (C-5), 51,2 (C-9), 44,0 (C-10), 36,8 (C-1), 36,3 (C-3), 22,1 (C-2), 20,0 (C-14), 8,1 (C-13).
1.97
1.96
1.83
1.74
1.62
1.57
1.56
1.23
1.19
1.18
2.35
3.21
5.20
5.20
5.08
4.96
4.95
Datos descritos en la literatura: Roque, 1978.
H-13
14
1
OH
O
9
O
5
3
12
H-14
7
H
OH
13
15
H-9a y
H-5
H-6
7.5
7.0
6.5
6.0
5.5
5.0
4.0
3.5
f1 (ppm)
1
3.0
2.5
2.0
1.5
Figura 2-82 Espectro de RMN H (CDCl 3 , 400 MHz) para Ol-6
4.45
1.98
4.5
1.14
2.89
1.12
4.26
H-15b
1.00
0.98
0.96
H-15a
1.0
0.5
124
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
8.1
22.1
20.0
44.0
36.8
36.3
54.7
51.1
66.7
109.4
104.7
123.0
146.3
157.2
RMN13C
172.4
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
C-10
C-4
C-11
C-7
C-12
C-6
C-8
DEPT 135
14
1
OH
O
9
C-14
O
5
3
7
H
OH
13
15
C-9
C-1
C-3
C-2
C-15
190
180
170
160
C-13
C-5
12
150
140
130
120
110
Figura 2-83 Espectro de RMN
100
90
f1 (ppm)
80
70
60
50
40
30
20
10
0
13
C y DEPT 135 (CDCl 3 , 100 MHz) para Ol-6
Tabla 2-29 Datos espectroscópicos y constantes físicas para kudtdiol Ol-7
Nombre:
14
1
3
Estado físico
HO
9
5
7
11
Aceite incoloro
Formula molecular
C 15 H 26 O 2
12
OH
Peso molecular
Rotación óptica
15
kudtdiol Ol-7
13
238,2 g/mol
[α]20
:
𝐷
+33.6 (c 1.0, CHCl 3 )
IR: ν (cm-1) = 3420 (O-H), 2964-2840 (C-H), 1648 (C=C), 1364 (C-O), 1135 (C-O)
RMN 1H (400 MHz, CDCl 3 ): δ 4,73 (sa, 1H, H-15a), 4,42 (sa, 1H, H-15b), 3,56 (m, 2H, H-12), 2,32 (m, 1H, H-5), 2,01 (m,
2H, H-3), 1,80 (m, 2H, H-6), 1,62 (m, 4H), 1,27 (m, 5H), 1,16 (s, 3 H, H-13), 0,72 (s, 3 H, H-14).
RMN 13C (100 MHz, CDCl 3 ): δ 151,0 (C-4), 105,3 (C-15), 74,8 (C-11), 68,6 (C-12), 49,8 (C-5), 45,0 (C-7), 41,8 (C-1),
41,0 (C-9), 36,9 (C-3), 36,0 (C-10), 25,3 (C-6), 23,5 (C-2), 21,4 (C-8), 20,3 (C-13), 16,3 (C-14).
Datos descritos en la literatura: J. de Pascual et al., 1978; Bohlmann y Jakupovic, 1979, Barrero et al., 2009.
0.72
2.01
1.99
1.81
1.78
1.62
1.61
1.27
1.16
1.15
1.12
4.42
4.42
3.64
3.61
3.49
3.46
2.33
2.30
125
4.73
4.72
Capítulo 2
H-13
14
1
3
5
H-14
HO
9
7
11
12
OH
13
8.0
7.5
7.0
6.5
6.0
5.5
5.0
4.5
4.0
f1 (ppm)
3.5
2.5
3.0
2.0
5.43
3.11
1.34
3.38
H-6
4.39
H-3
1.72
H-5
2.38
1.96
H-12
0.85
1.00
H-15a H-15b
1.36
15
1.5
1.0
0.5
0.0
1
25.3
23.5
21.4
20.3
16.3
49.8
45.0
41.8
41.0
36.9
36.0
68.6
74.8
105.3
RMN13C
151.0
Figura 2-84 Espectro de RMN H (CDCl 3 , 400 MHz) para Ol-7
14
1
3
HO
9
5
7
12
11
OH
15
C-14
C-5
13
C-10
C-4
C-11
DEPT 135
C-13
C-7
C-9
C-15
170
160
150
140
130
120
110
Figura 2-85 Espectro de RMN
C-12
100
13
90
f1 (ppm)
80
70
C-1
60
50
40
C-6
C-8
C-2
C-3
30
C y DEPT 135 (CDCl 3 , 100 MHz) para Ol-7
20
10
126
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
2.2.5 Estudio de la actividad antialimentaria de los compuestos
aislados
La actividad fagodisuasiva de los metabolitos secundarios aislados de hojas y madera de
C. capitellata y de las cortezas de Z.rigidum y O. longifolia fue evaluada con un ensayo
de no elección realizado con pequeños discos de harina tratados con las sustancias de
interés. Los índices de disuasión alimentaria causados sobre S. zeamais y T. castaneum
después de ser alimentados con dieta tratada con los compuestos a unas
concentraciones de 100 y 300 ppm se presentan en la Tabla 2.30.
Tabla 2-30 Resultados de la actividad antialimentaria sobre S. zeamais y T. castaneum de los
metabolitos secundarios aislados.
MUESTRA
eudesm-11-en-4α-ol HCc-1
Mezcla β-sitosterol HCc-2 y estigmasterol
HCc-3
biochanina A HCc-4
formononetina HCc-5
Mezcla 3,4-dihidroxibenzaldehído HCc-6 y
ácido compsoneurico HCc-7
kaempferol-3-O-(2″,4″-di-trans-p-coumaroil)rhamnósido HCc-8
(-)-compsoneurósido HCc-9
azfelina HCc-10
glicósido de 3-O-sitosterol HCc-11
Mezcla β-sitosterol MCc-1 y estigmasterol
MCc-2
megislactona MCc-3
Mezcla 2´,4´-dihidroxi-6´-metil-3,4metilenodioxidihidrochalcona MCc-4 y 2´,4´dihidroxi-6´-metil-3-hidroxi-4metoxidihidrochalcona MCc-5
1-(2,3-dihidroxifenil)-3-(3,4metilenodioxifenil)propano MCc-6
1-(2,3-dihidroxi-6-metoxifenil)-3-(3,4metilenodioxifenil)propano MCc-7
cinchonaina Ic MCc-8
cinchonaina Id MCc-9
lupeol Zr-1
lupenona Zr-2
IDA (%)
T. castaneum
67,2 ± 8,7
58,2 ± 6,0
66,1 ± 6,1
54,8 ± 5,2
69,6 ± 4,5
54,1 ± 7,3
71,2 ± 8,5
59,9 ± 5,4
30,3 ± 2,8
21,8 ± 3,9
52,0 ± 8,4
41,8 ± 4,9
40,3 ± 3,2
31,5 ± 2,6
46,3 ± 8,0
44,1 ± 7,4
39,0 ± 8,8
36,2 ± 9,3
54,8 ± 5,2
66,1 ± 6,1
59,9 ± 8,0
40,7 ± 6,8
CONCENTRACIÓN
(ppm)
300
100
300
100
300
100
300
100
300
100
300
100
300
100
300
100
300
100
300
100
300
100
S. zeamais
53,6 ± 4,5
33,3 ± 8,3
24,4 ± 1,1
12,5 ± 5,6
39,3 ± 8,2
20,8 ± 6,9
36,3 ± 3,7
29,4 ± 0,6
24,7 ± 1,1
15,2 ± 1,6
34,7 ± 4,5
23,8 ± 4,3
51,9 ± 1,6
44,8 ± 1,9
35,0 ± 2,1
28,4 ± 5,5
20,8 ± 2,6
14,9 ± 3,6
24,4 ± 1,1
12,5 ± 5,6
37,6 ± 5,5
21,1 ± 6,4
300
44,2 ± 4,0
68,9 ± 6,0
100
28,1 ± 5,5
54,8 ± 6,4
300
100
300
100
300
100
300
100
300
100
300
45,5 ± 1,0
30,7 ± 2,0
55,4 ± 2,0
38,3 ± 2,5
42,9 ± 2,1
34,0 ± 4,1
28,1 ± 4,0
16,2 ± 2,3
22,4 ± 0,4
18,5 ± 0,5
33,3 ± 2,9
61,6 ± 1,0
52,5 ± 4,5
67,8 ± 8,5
39,0 ± 1,7
26,0 ± 6,8
24,3 ± 6,4
23,7 ± 3,4
18,1 ± 2,6
24,2 ± 2,1
20,5 ± 1,5
36,7 ± 4,3
Capítulo 2
127
betulina Zr-3
Mezcla de savinina Zr-4 y 2,3-di(3',4'metilenodioxibencil)-2-buten-4-olido Zr-5
flindersina Zr-6
(+)-dimetilmatairesinol Zr-7
γ-fagarina Zr-8
skimnianina Zr-9
(+)-siringaresinol Zr-10
cafeato de etilo Zr-11
umbeliferona Zr-12
monopalmitato de glicerilo Zr-13
ácido (-)-rigidunoico Zr-14
ácido 11,13-dihidrocostuso Ol-1
litsealiicolido C Ol-2
β-sitosterol Ol-3
(+)-longifolina Ol-4
(+)-hidroxiatractilólido Ol-5
ocotealactol Ol-6
kudtdiol Ol-7
glicósido de 3-O-sitosterol Ol-8
100
300
100
300
100
300
100
300
100
300
100
300
100
300
100
300
100
300
100
300
100
300
100
300
100
300
100
300
100
300
100
300
100
300
100
300
100
300
100
25,4 ± 3,2
61,4 ± 1,0
23,8 ± 4,3
33,0 ± 2,3
19,1 ± 2,5
45,5 ± 2,6
27,4 ± 3,0
41,9 ± 1,5
29,7 ± 2,6
27,7 ± 1,0
14,5 ± 1,1
32,3 ± 1,5
27,4 ± 3,0
25,1 ± 2,5
11,9 ± 2,0
51,8 ± 3,0
41,9 ± 3,7
46,5 ± 5,2
39,3 ± 3,5
40,9 ± 2,5
29,7 ± 5,5
55,8 ± 3,7
39,3 ± 1,5
50,2 ± 0,6
46,5 ± 4,3
48,5 ± 1,0
43,2 ± 1,1
31,4 ± 1,5
25,7 ± 8,6
59,4 ± 2,0
43,2 ± 8,3
45,2 ± 5,5
35,6 ± 2,0
47,9 ± 4,9
39,3 ± 4,0
57,4 ± 2,0
51,2 ± 0,6
21,3 ± 1,6
15,4 ± 3,1
26,0 ± 4,3
52,2 ± 8,9
52,0 ± 8,4
19,2 ± 6,4
18,6 ± 1,7
39,0 ± 7,8
26,6 ± 1,0
35,0 ± 2,0
39,5 ± 3,5
37,3 ± 3,4
24,3 ± 6,4
27,1 ± 5,1
39,5 ± 4,3
29,9 ± 5,2
37,9 ± 4,3
45,9 ± 2,9
20,1 ± 2,2
47,2 ± 3,8
28,9 ± 2,9
44,0 ± 2,9
23,9 ± 2,6
52,2 ± 2,9
29,6 ± 2,9
42,1 ± 5,8
44,0 ± 1,1
50,3 ± 4,7
32,1 ± 1,9
51,6 ± 4,7
44,0 ± 1,1
47,8 ±6,6
30,8 ± 1,1
50,9 ± 6,8
38,4 ± 6,1
43,4 ± 6,8
14,5 ± 6,1
42,1 ± 4,4
23,9 ± 1,1
38,0 ± 7,2
35,2 ± 8,5
Los resultados presentados en la Tabla 2.30 muestran que la mayoría de las sustancias
evaluadas sobre las dos plagas de almacén causaron efectos fagodisuasivos bajos (50%
< IDA > 20%) y moderados (70% < IDA > 50%) con las dosis evaluadas. También se
puede observar que de las dos plagas tratadas, T. castaneum fue la que sufrió mayores
efectos fagodisuasivos cuando el alimento fue tratado con las sustancias de interés.
De las 37 sustancias evaluadas, 15 presentaron actividad antialimentaria moderada
sobre T. castaneum y solo 9 presentaron una actividad similar sobre S. zeamais. En las
Figuras 2.86 y 2.87 se presentan las estructuras de las sustancias que fueron activas
sobre T. castaneum y S. zeamais respectivamente.
128
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
OH
HO
HO
HCc-3
HCc-2
HCc-1
OH
HO
O
HO
OH O
O
HO
HCc-4
O
OH O
HCc-5
O
OH
O
O
O
O
O
O
HO
O
OH
O
OH
O
O
HCc-8
O
O
OH
Ol-2
Ol-5
OH
O
OH
OH
OH
HO
O
OH
O
O
OH
HO
12
5
O
MCc-3
OH
Zr-14
Zr-3
HO
OMe
O
OH
HO
O
O
OMe
+
OH
OH
O
MCc-5
MCc-4
HO
OMe
MCc-6
MCc-5
O
HO
O
O
O
OH
MCc-6
O
OH
MCc-7
Figura 2-86 Metabolitos secundarios que exhibieron actividad antialimentaria moderada sobre
adultos de T. castaneum
Al observar las estructuras de los compuestos que presentaron un efecto fagodisuasivo
moderado sobre T. castaneum es posible notar que una amplia variedad de sustancias
pueden inhibir considerablemente la alimentación de este insecto, por lo tanto no se
puede decir que una entidad estructural específica o que sustancias con ciertos patrones
de sustitución sean las responsables de los efectos fagodisuasivos causados en el
Capítulo 2
129
insecto. Es importante resaltar que la formonetina HCc-5 fue la única sustancia que
causó un efecto fagodisuasivo fuerte sobre T. castaneum a una concentración de 300
ppm. Entre las sustancias activas se encuentran flavonoides, esteroles, terpenos,
lactonas y diarilpropanos, donde la mayoría de los metabolitos activos promisorios contra
T. castaneum fueron aislados de hojas y madera de C. capitellata.
O
O
HO
HO
O
OH
HCc-1
OH
O
O
O
O
OH
O
HO
O
OH
MCc-8
HCc-9
OH
O
OH
OH
HO
O
O
O
HO
OH
HO
O
OH
OH
OH
Zr-11
Zr-14
Zr-3
O
HO
O
OH
HO
O
OH
Ol-4
Ol-1
Ol-7
Figura 2-87 Metabolitos secundarios que causaron un efecto fagodisuasivo moderado en adultos
de S. zeamais.
Ahora, al observar las estructuras presentadas en la Figura 2.87 que corresponden a las
sustancias que presentaron los mayores efectos antialimentarios en S. zeamais es
posible notar que las sustancias activas también son diversas a nivel estructural,
encontrando que entre dichas sustancia se hallan sesquiterpenpoides, triterpenoides,
derivados de ácido caféico y diarilpropanos.
De los sesquiterpenoides que exhibieron actividad antialimentaria sobre S. zeamais, es
posible deducir que la presencia del núcleo eudesmano en este tipo de metabolitos
secundarios es necesaria para que se presente el efecto antialimentario, pues los 4
sesquiterpenoides que presentaron actividad sobre este insecto tienen en común la
presencia del núcleo eudesmano en su estructura. Otra característica estructural que
130
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
puede estar relacionada con la actividad antialimentaria causada por estas sustancias es
la presencia del doble enlace terminal que aparece en todos los compuestos
sesquiterpénicos activos, como puede verse en las estructuras de los sesquiterpenos
mostradas en la Figura 2.87. Vale la pena resaltar que las sesquiterpenlactonas Ol-5 y
Ol-6 que también tienen un núcleo de tipo eudesmano y el doble enlace terminal
exhibieron un IDA superior al 45% sobre S. zemais, hecho que confirma que las
características estructurales mencionadas anteriormente están relacionadas con la
actividad antialimentaria causada en adultos de S. zeamais.
Los resultados de la actividad antialimentaria sobre el gorgojo del maíz también sugieren
que los compuestos tipo fenilpropanoide o derivados de ácido con unidades C 6 -C 3
tienden a causar efectos inhibitorios en la alimentación de estos insectos, pues los dos
compuestos aislados que contienen en su estructura una unidad C 6 -C 3 proveniente de
ácido caféico o cinámico (Zr-9 y Zr-20) presentaron actividad antialimentaria moderada
sobre S. zeamais; por lo tanto, la presencia de la unidad C 6 -C 3 parece estar relacionada
directamente con esta actividad.
Comparando ahora la actividad exhibida por los 4 extractos etanólicos de las tres
especies vegetales trabajadas (Tabla 2.1) con los resultados de actividad antialimentaria
de los metabolitos aislados, es posible afirmar que se encontró por lo menos uno de los
metabolitos responsables de la actividad presentada por cada extracto. Para el caso de
los extractos de hojas de C. capitellata (IDA = 56,3%), madera de C. capitellata (IDA =
50,4%) y corteza de O. lonfifolia (IDA = 54,1%) se encontraron metabolitos secundarios
que exhibieron actividad antialimentaria comparable a la obtenida con el extracto que los
contenía; mientras que para el extracto de corteza de Z. rigidum, que presentó un efecto
antialimentario fuerte (IDA = 76,9%), las sustancias activas obtenidas de éste
presentaron una actividad antialimentaria moderada, hecho que conlleva a pensar que la
fuerte disuasión alimentaria que causó el extracto sobre los adultos de S. zeamais puede
deberse a efectos sinérgicos y/o aditivos de la actividad que presenta cada metabolito
secundario contenido en el extracto.
De acuerdo con los resultados encontrados, se aprecia que es posible reducir
notablemente el grado de alimentación de los insectos plaga con varios de los
Capítulo 2
131
compuestos aislados en la investigación fitoquímica de las especies objeto de estudio.
Los efectos fagodisuasivos causados por los compuestos activos pueden influir
negativamente en la reproducción de los adultos, en la emergencia, crecimiento y
desarrollo de las nuevas generaciones de insectos, efectos que solo podrían se
causados por la falta de alimento, pues no se observó mortalidad de los insectos
después de ingerir el alimento tratado.
Los resultados obtenidos en este estudio de actividad antialimentaria sobre S. zeamais y
T. castaneum contribuyen al conocimiento de las propiedades biológicas de las muestras
evaluadas, confirman y complementan los resultados obtenidos por otros investigadores
y constituyen el primer reporte de efectos fagodisuasivos sobre insectos de productos
almacenados para la mayoría de las sustancias ensayadas.
La actividad antialimentaria preliminar exhibida por varios de los compuestos evaluados
los hace promisorios para continuar con ensayos de actividad más específicos, con el
objetivo de obtener resultados más completos que permitan determinar si dichas
sustancias pueden llegar a convertirse en nuevos agentes fitosanitarios y/o en
compuestos plantilla para el diseño de nuevos agroquímicos para el control de plagas de
productos almacenados.
3. Composición química y actividad insecticida
de aceites esenciales obtenidos de algunas
especies
de
las
familias
Lauraceae,
Myristicaceae y Rutaceae
Actualmente, la protección de productos almacenados frente al ataque de insectos plaga se
realiza casi exclusivamente a través de la utilización de fumigantes, debido a que estas
sustancias permiten controlar un amplio espectro de plagas de almacén gracias a la
capacidad de los gases de penetrar a través de los empaques, paredes y otras áreas lo cual
sería complicado mediante otras técnicas (Stefanazzi, 2010; Ducom, 2006). Sin embargo, la
mayoría de los productos utilizados para tal fin han tenido que ser retirados del mercado
debido a serios inconvenientes tales como contaminación del medio ambiente, presencia de
residuos en los alimentos, costos elevados y efectos negativos sobre la salud humana
(Navarro, 2006). Estas razones han hecho a iniciar la búsqueda de nuevos fumigantes que
permitan controlar las plagas sin causar problemas de contaminación ambiental y de salud
pública; y para este fin los productos obtenidos de las plantas pueden ser una buena
alternativa.
Las plantas producen una amplia gama de compuestos orgánicos que parecen no estar
relacionados directamente con su desarrollo, pero que tienen importantes funciones
ecológicas, entre las que se destacan: 1) proteger a las plantas de depredadores y
organismos patógenos; 2) atraer insectos polinizadores o dispersores de semillas; 3) regular
los procesos de evaporación de agua y 4) ser útiles como mecanismos de defensa y de
comunicación con otros organismos (alelopatía) (Taiz y Zeiger, 2002).
Actualmente, la investigación en productos naturales ha tomado gran impulso en la
búsqueda de sustancias con propiedades insecticidas, con el fin de encontrar soluciones
134
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
económicas y de bajo impacto ambiental para el control de plagas. Principalmente se reporta
el uso de aceites esenciales de diferentes especies vegetales como insecticidas (Rajendran
y Sriranjini, 2008; Kim et al., 2003; Enan, 2001; Lamiri et al., 2001; Kétïa, et al., 2000;
Regnalut-Roger, 1997).
En la naturaleza, los aceites esenciales (AE) juegan un papel importante en la protección de
las plantas, actuando como agentes antimicrobianos, insecticidas y como antialimentarios de
herbívoros; además, son sintetizados por las plantas para atraer a algunos insectos
polinizadores y para controlar la pérdida de agua (Bakkali et al., 2008). Con base en estas
propiedades, los AE se han empleado a nivel medicinal, a nivel agrícola y en la industria
cosmética y de alimentos (Lock de Ugaz, 1988).
El uso de AE como insecticidas para proteger cereales y legumbres especialmente de los
insectos plaga de almacén es una práctica tradicional en muchos países de Asia y África,
pues es un método económico para la protección de las semillas almacenadas en los
hogares y en pequeñas granjas (Shaaya et al., 1997). En la actualidad, las propiedades que
exhiben estas sustancias, incluyendo su elevada volatilidad, han sido tenidas en cuenta para
el desarrollo de estrategias de control de plagas que afectan a cultivos y productos de interés
económico y alimentario, empleandolos como fumigantes. Las investigaciones enfocadas en
el uso de AE como fitosanitarios han establecido una relación directa entre la resistencia de
las plantas a diferentes plagas y la secreción de aceites esenciales, encontrando que las
plantas más eficientes para el control de insectos son las plantas aromáticas (RegnaultRoger, 1997).
Hasta el momento, es escasa la información disponible respecto a los mecanismos de acción
de los AE sobre los insectos; sin embargo, se conoce que algunos aceites o sus
constituyentes producen síntomas específicos que sugieren efectos neurotóxicos (Isman,
2006; Kostyukovsky et al., 2002). Muchos aceites también resultan ser tóxicos a través del
contacto directo o mediante la penetración al organismo por vía respiratoria (López et al.,
2008; Kordali et al., 2006; Negahban et al., 2007; Shaaya et al., 1997); otros afectan la
fisiología nutricional de los insectos ya sea modificando su comportamiento (antialimetarios)
Capítulo 3
135
o produciendo efectos tóxicos luego de la ingestión (Benzi et al., 2009; Pungitore et al., 2005;
Huang et al., 2000); y otros AE han demostrado ser altamente efectivos por su acción
repelente (Nerio et al., 2010; Ukeh et al., 2009; Ogendo et al., 2008). Todas estas
observaciones permiten deducir que los AE presentan una amplia gama de actividades sobre
los insectos, razón por la que podrían ser utilizados como agentes fitosanitarios
ambientalmente seguros para el control de plagas, pues es de esperarse que los
compuestos obtenidos de plantas tengan como ventaja, sobre los fumigantes comerciales,
que posean baja toxicidad para mamíferos y rápida degradación (Philogéne et al., 2003).
Las familias Myristicaceae, Rutaceae y Lauraceae se caracterizan por tener especies con
importante contenido de aceites esenciales, razón por la cual estas especies pueden ser
fuente de compuestos bioactivos con acción fumigante, que tal vez en un futuro puedan ser
empleados como agentes fitosanitarios para el control de plagas y enfermedades a nivel
agrícola.
De la familia Myristicaceae se han adelantado algunos estudios de actividad insecticida,
encontrándose que el aceite esencial de hojas de la especie Myristica fragrans (conocida
como nuez moscada) presenta una significativa actividad insecticida contra Acanthoscelides
obtectus (Regnault-Roger, 1997), Tribolium castaneum, Sitophilus zeamais (Huang et al,
1997), Lymantria dispar (Kostic et al., 2013), S. oryzae (Kim y Park, 2008) y Lycoriella
ingenua (Park et al., 2008).
En diferentes especies de la familia Rutaceae también se han realizados estudios enfocados
en la búsqueda de sustancias con actividad insecticida. Por ejemplo, el aceite esencial de
Citrus bergamia ha presentado actividad repelente sobre diferentes plagas de almacén
(Cosimi et al., 2009); el aceite esencial de la cáscara del fruto de C. aurantium presentó
actividad tóxica y repelente sobre adultos de Meligethes aeneus (Pavela, 2011); los aceites
esenciales de hojas de Clausena anisata y C. dentata han presentado actividad larvicida
sobre diferentes especies de mosquitos vectores de enfermedades tropicales (Govindarajan
et al., 2010; Rajkumar y Jebanesan, 2010). Los aceites esenciales de diversas especies del
género Zanthoxylum también han sido evaluados como insecticidas, encontrando que los
aceites obtenidos de Z. piperitum (Kamsuk et al., 2006), Z. limonella (Koul et al., 2008), Z.
136
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
articulatum (Feitosa et al., 2007) y Z. armatum (Tiwary et al., 2007) han exhibido actividad
insecticida sobre diferentes insectos portadores de enfermedades. Para los aceites
esenciales de hojas y frutos de Z. schinifolium se reporta que han presentado actividad
insecticida contra el gorgojo del maíz, S. zeamis (Wang et al., 2011).
De otra parte, los aceites esenciales de especies de la familia Lauraceae han demostrado
poseer interesantes propiedades insecticidas, como es el caso de varias especies del género
Cinnamomun que han mostrado excelente actividad insecticida contra S. oryzae y
Callosobruchus chinensis (Kim et al., 2003). El aceite esencial de Litsea cubeba también ha
presentado actividad insecticida frente a plagas de almacén como S. zeamais y T.
castaneum (Liu et al., 2007).
En este capítulo, se presenta la composición química de los aceites esenciales de diferentes
especies de las familias Myristicaceae, Rutaceae y Lauraceae y su evaluación como posibles
agentes fitosanitarios para el control de Sitophilus zeamais, S. oryzae y Tribolium
castaneum.
3.1 Metodología
3.1.1 Análisis químico de los aceites esenciales
Material Vegetal
Las especies Ocotea longifolia Kunth (COL 522892), Zanthoxylum monophyllum (Lam.) P.
Wilson (COL 517520), Zanthoxylum fagara (L.) Sarg. (COL 522891) y Zanthoxylum rigidum
Humb. & Bonpl. ex Willd. (COL 519810) fueron colectadas en enero de 2008 en el municipio
de Icononzo (Tolima). Las muestras vegetales fueron colectadas por el Químico M.Sc.
Wilman Delgado. La especie Virola carinata. (COL 563244) fue colectada en Puerto López
(Meta) por el Químico M.Sc. Wilman Delgado. Zanthoxylum rhoifolium Lam. (COL 522896)
fue colectado en febrero de 2008 en el municipio de Fusagasugá, Cundinamarca, Colombia.
La muestra fue colectada por el Químico Ph.D. Oscar Patiño.
Capítulo 3
137
Extracción de Aceites Esenciales
El material fresco (2 Kg aprox.) de cada especie fue sometido a destilación por arrastre con
vapor durante 2 horas. Los aceites esenciales obtenidos fueron secados sobre sulfato de
sodio anhidro y almacenados entre 0-5 ºC, para su posterior análisis.
Preparación de la Muestra
Las muestras de aceites esenciales para el análisis CG-EM se prepararon disolviendo 25,0
μL de AE en n-hexano hasta un volumen final de 1,0 mL.
Las curvas de calibración con los monoterpenos y monoterpenoides se construyeron a partir
de soluciones stock entre 2000 ppm y 100 ppm de cada monoterpeno. Se prepararon
soluciones de diferentes concentraciones (2000 ppm, 1000 ppm, 500 ppm, 200 ppm, 50 ppm
y 5 ppm) que fueron analizadas por CG/FID. Los monoterpenos y monoterpenoides de
referencia empleados fueron: α-terpinoleno, δ-3-careno, α-felandreno, 1,8-cineol, γ-terpineno,
α-terpineno y (+)-limoneno.
Análisis por CG-EM
La separación y análisis de los aceites esenciales se llevó a cabo por CG-EM empleando un
cromatógrafo de gases Agilent Technologies 7890AGC con detector selectivo a masas
Hewlett Packard 5973. El espectrómetro de masas fue operado a 70 eV en modo full scan y
los espectros de masas fueron adquiridos entre 35 y 450 m/z.
La separación en la columna apolar se hizo con una columna capilar RTX-5MS (60 m × 0,25
mm × 0,25 micras), con inyección en modo Split (20:1) por 1,5 minutos. Las temperaturas de
la cámara de ionización, el inyector y la línea de transferencia fueron 185, 250 y 285 °C,
respectivamente. La temperatura en el horno fue programada como sigue: desde 50°C (2
min) hasta 160°C (5 min) a 4 °C/min, posteriormnte la temperatura se aumento hasta 220°C
(5 min) a 2,5 °C/min, y finalmente un aumento hasta 280 °C (5 min) a 8 °C/min, para un
tiempo total de corrida de 74 min. Se inyectó 1 μL de cada solución analizada.
138
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Para el análisis de los aceites esenciales con la columna polar se empleó una columna
capilar Carbowax (30 m × 0,25 mm × 0,25 μm), con inyección en modo Split (20:1) por 1,5
minutos. Las temperaturas de la cámara de ionización, el inyector y la línea de transferencia
fueron 185, 250 y 285 °C, respectivamente. La temperatura en el horno fue programada
como sigue: desde 40°C (5 min) hasta 250°C (10 min) a 4 °C/min, para un tiempo total de
corrida de 68 min. Se inyectó 1 μL de cada solución analizada.
Determinación de los Componentes de los Aceites Esenciales
La determinación de los constituyentes químicos fue basado en la comparación de los
espectros de masas y los índices de retención con los obtenidos de las librerías Wiley 138 L,
NBS 75KL, SDBS y NIST 0.8 y los publicados por Adams, 1995. Los índices de retención
(IK) se calcularon de acuerdo a lo reportado en la literatura y teniendo en cuenta los tiempos
de retención de una serie homóloga de patrones de hidrocarburos desde C10 hasta C26,
corridos en el CG-EM bajo las mismas condiciones operacionales que los AE.
Análisis por CG/FID
Las curvas de calibración construidas con los monoterpenos se realizaron en el equipo
Agilent Technologies 7890AGC con columna capilar (RTX-5MS, 60 m × 0,25 mm × 0,25
micras) directamente acoplado a un detector de ionización de llama (FID) a 300 °C. Las
condiciones de análisis fueron: temperatura del inyector 250 °C; columna: 50 °C (5 min)
hasta 144 °C 8 °C/min (0 min), posteior aumento hasta 190 °C 3 °C/min (0 min), aumentando
finalmente hasta 280 °C 8 °C/min (10 min); split 20:1 durante 2 min. Se empleó helio como
gas portador con flujo constante de 1 mL/min. Se inyecta 1 µL de la solución a analizar.
3.1.2 Ensayos de actividad insecticida
Cría de Insectos
S. zeamais se obtuvo de una colonia mantenida en el Laboratorio de Productos Naturales del
Departamento de Química de la Universidad Nacional de Colombia – Sede Bogotá. Los
insectos se alimentan de granos de maíz libres de insecticidas. El pie de cría es mantenido
Capítulo 3
139
en la oscuridad bajo condiciones de humedad y temperatura controladas en una cámara de
cultivo (27 ± 1 °C y 65 ± 5 % HR).
S. oryzae se obtuvo de una cría stock mantenida en el Laboratorio del Equipo de
Fitoquímicos Naturales del Instituto Murciano de Investigación y Desarrollo Agrario y
Agropecuario (IMIDA). Los insectos se alimentan con granos de arroz libres de insecticidas y
se mantiene en una cámara de cultivo bajo condiciones de temperatura y humedad
controladas (24 ± 1 °C y 65 ± 5 % HR).
T. castaneum se obtuvo de una cría stock mantenida en el Laboratorio del Equipo de
Fitoquímicos Naturales del Instituto Murciano de Investigación y Desarrollo Agrario y
Agropecuario (IMIDA). Los insectos se alimentan con harina de trigo mezclada con levadura
de cerveza (95/5 %P/P) y se mantiene en una cámara de cultivo bajo condiciones de
temperatura y humedad controladas (27 ± 1 °C y 65 ± 5 % HR).
Los insectos adultos de las tres especies, entre 10-15 días de edad, fueron utilizados para
los ensayos de actividad insecticida.
Ensayo de Actividad Fumigante
Para determinar la toxicidad volátil de los aceites esenciales y de 9 compuestos
(monoterpenos y monoterpenoides), se emplearon dosis de aceite entre 0,5 - 11 µL (22,7 500 μL/L aire) y 0,2 - 2 µL (20 - 90 mg/L aire) de los compuestos puros, cantidades que
fueron aplicadas en a discos de papel filtro Wathman 1 de 2 cm de diámetro colocados en un
vial de cristal de 1,5 mL de volumen colocado a su vez en otro vial de mayor tamaño (22
mL), tapado con tapón rosca, junto con 10 insectos de la especie a ensayar. En el caso de T.
castaneum no hubo contacto entre los insectos y el disco donde se había aplicado el
producto. Para las especies del género Sitophilus se ensayaron dos situaciones, una como la
descrita anteriormente, en la que se producía un contacto entre los insectos y el disco, y otra
en la que se evitaba el contacto cubriendo la parte superior del vial pequeño con tela de
visillo (Pascual-Villalobos et al., 2004). Como controles positivos se emplearon Fosfamin ®
con fosfina como ingrediente activo (100 μg/L aire) y Nuvan 50 ® que contiene clorvox como
140
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
ingrediente activo (50 μL/L aire). El control negativo se realizó de la misma manera, pero sin
la aplicación de ninguna sustancia. El ensayo se realiza bajo condiciones controladas de
temperatura y humedad (27 ± 1 °C y 65 ± 5 % HR). Cada ensayo se realizó por triplicado. La
mortalidad de los insectos fue determinada a las 24 h. Los insectos se consideraron muertos
cuando no se observa movimiento de las patas y/o de las antenas cuando se hace una
punción al insecto con un alfiler entomológico. El análisis probit fue usado para determinar
los valores de CL 25 , CL 50 y CL 75 (Finney, 1971).
Ensayo de Actividad Antialimentaria
Para determinar la actividad antialimentaria de los aceites esenciales y de los monoterpenos
se empleo el método de discos de harina (Xie et al., 1996) con algunas modificaciones. La
harina de trigo (1,0 g) se agitó con ayuda de ultrasonido en 5 ml de agua destilada para
formar una suspensión harina-agua, posteriormente se adicionaron 2 gotas de Tween 20.
Alícuotas de 200 μL de esta suspensión (después de ser agitada) se colocaron en el centro
de una caja de Petri de plástico formando discos. Los discos se dejaron secar a temperatura
ambiente por 24 horas y posteriormente se transfirieron a una incubadora para equilibrarlos a
27 °C y 65-70% HR durante 48 h. Cada disco harina pesaba entre 36 y 39 mg. Una vez
secos los discos, se impregnaron con 50 μL de la solución stock de los aceites esenciales
(500 ppm) o compuestos puros (300 ppm y 100 ppm), preparadas en una mezcla etanolaceite de oliva (85:15). El etanol se deja evaporar por 5 minutos. Los discos se colocaron en
viales de plástico para pesarlos, posteriormente se ubican dentro de cada vial diez (10)
insectos sin sexar, y se pesa el conjunto vial-disco-insectos. Todos los insectos empleados
en el ensayo se mantuvieron sin alimento por 24 horas antes de su uso. El montaje del
experimento se dejó en la cámara de cultivo durante 3 días (27 ± 1 °C y 65 ± 5 % HR). Las
mismas cantidades de la mezcla etanol:aceite de oliva fueron aplicadas para producir los
discos control. Como control positivo se empleo el extracto etanólico de semillas de Neem.
Para cada ensayo se realizaron cuatro (4) replicas. Los Índices de Disuasión Alimentaria
(IDA) se calcularon comparando los resultados obtenidos con el alimento tratado con los
observados con el alimento sin tratar, empleando la siguiente fórmula (Liu et al., 2007):
𝐼𝐷𝐴 = 100 × �
𝐶−𝑇
�
𝐶
Capítulo 3
141
Ensayo de Toxicidad por Contacto
La toxicidad por contacto de los aceites esenciales sobre adultos de S. zeamais, S. oryzae y
T. castaneum se determinó aplicando tópicamente sobre el tórax dorsal de los insectos
diferentes dosis de aceite esencial (0,1 – 0,2 μL). Como control se emplearon insectos sin
tratar. Tanto los insectos tratados y los insectos control fueron transferidos a viales de vidrio
(10 insectos/ vial) que contienen alimento. Los viales se mantienen en la cámara de cultivo
bajo condiciones de temperatura y humedad controladas (27 ± 1 °C y 65 ± 5 % HR). Cada
ensayo se realiza por triplicado. La mortalidad de los insectos se determina a las 24 y 96
horas después de iniciado el ensayo (Lui et al., 2007). Los porcentajes de mortalidad se
calculan con la fórmula de corrección de Abbot:
%𝑀𝑜𝑟𝑡𝑎𝑙𝑖𝑑𝑎𝑑 = 100 × �
Ensayo de Actividad Repelente
𝑀𝐶 − 𝑀𝑇
�
𝑀𝐶
Para evaluar la repelencia de los aceites esenciales se empleo un bioensayo de elección. La
mitad de los discos de papel de filtro de 9 cm de diámetro (Whatman 1) fueron tratados con
500 μL de soluciones en acetona de los aceites esenciales (0.063 – 0,0252 µL/cm2),
posteriormente se dejo evaporar el solvente por un período de 3 minutos en una cabina de
extracción. La mitad de la parte inferior de una caja de Petri se cubrió con el papel de filtro
tratado, mientras que la otra mitad se cubrió con la mitad de un disco de papel de filtro
impregnado con acetona. Diez adultos sin sexar fueron puestos en el centro de la caja de
Petri, se cerró la caja y se selló con parafilm. El número de insectos presentes en las dos
mitades de los discos de papel se registró después de 2 y 24 horas del inicio del ensayo. Se
realizaron cinco réplicas para cada concentración evaluada, ensayando 50 adultos de cada
insecto por concentración de aceite. El ensayo se realiza bajo condiciones controladas de
temperatura y humedad (27 ± 1 °C y 65 ± 5 % HR). El Porcentaje de Repelencia (PR) se
calculó empleando la siguiente fórmula: PR = (C-T) / (C +T) x 100, donde C = número de
insectos en la zona no tratada y T = número de insectos en el área tratada (Nerio et al.,
2009). Como control positivo se empleó el repelente comercial Stay Off® que tiene como
principio activo una formulación al 15% de IR3535 (etil-3-(N-acetil-N-butilamino)-propionato),
evaluado con las mismas concentraciones que los aceites esenciales.
142
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Ensayo de Inhibición de la Reproducción de Tribolium castaneum – Efecto posttratamiento
Para determinar el efecto de los aceites esenciales y de los monoterpenos en la
reproducción de T. castaneum, se sexaron los insectos en estado de pupa. Las pupas
hembras y macho se pusieron en dieta nueva, manteniendo separadas las hembras de los
machos. Una vez emergidos los adultos, los machos y las hembras, por aparte, se
sometieron al ensayo de toxicidad fumigante empleando como concentración de tratamiento
la CL 50 determinada para los aceites y monoterpenos en el primer ensayo descrito. Pasadas
las 24 horas del ensayo de actividad fumigante, se seleccionaron las hembras y los machos
sobrevivientes para formar las siguientes parejas: 1) H Tratada +M Tratado , 2) H SinTratar +M Tratado , 3)
H tratada +M SinTratar y 4) H SinTratar + M SinTratar (pareja control). Cada pareja se ubicaba en un vaso
de plástico con dieta. Por 5 días se permite que la hembra y el macho estén en contacto con
el objetivo de que copulen y la hembra deposite los huevos sobre el alimento. Pasados los 5
días, se retiran los insectos adultos y se hace el conteo del número de huevos. 10 días
después del conteo de los huevos (a los 15 días de iniciado el ensayo), se cuenta el número
de larvas y/o huevos presentes en cada vaso de dieta. A los 25, 35 y 45 días después de
iniciado el ensayo, se continúa haciendo el conteo de número de insectos en cada estado:
adulto, pupa, larva y/o huevo. Para cada pareja, con cada una de las sustancias evaluadas,
se hicieron 10 replicas. El ensayo se realiza bajo condiciones controladas de temperatura y
humedad (27 ± 1 °C y 65 ± 5 % HR), manteniendo los vasos de dieta en la cámara de cultivo
(Vayias y Athanassiou, 2004).
3.1.3 Estudio
de
inhibición
acetilcolinesterasa.
in-vitro
e
in-vivo
de
la
General
Para medir la aparición de color se utilizó un espectrofotómetro UV-Visible PharmaSpec UV1700 Shimadzu. Se emplearon celdas de cuarzo y las lecturas se realizaron a 25 °C y 412
nm por un periodo de 15 minutos.
Capítulo 3
143
Los monoterpenos, el ioduro de acetiltiocolina (AcTCh), el DTNB (ácido ditionitrobenzoico) y
la acetilcolinesterasa comercial (electric eel) fueron suministradas por Sigma Aldrich Química
S.A. La bacitracina y el hidrocloruro de benzamidina fueron suministrados por Acros
Organics.
Extracción de la enzima
Para la extracción de la enzima se pesaron 1,8 g de adultos de S. oryzae vivos, los cuales
fueron triturados en un mortero junto con 10 mL de una solución de buffer fosfato (0,1 M,
pH= 8) que contiene 0,1% P/V de bacitracina y 0,3% P/V de hidrocloruro de benzamidina.
Una vez triturados los insectos, se centrifuga la suspensión obtenida por 90 minutos a
18.912 rpm manteniendo la temperatura a 4 °C. Después de centrifugar, se filtra la solución
sobre lana de vidrio para retirar los residuos de los insectos. El extracto enzimático obtenido
se almacena a 0 °C, para su posterior uso en los ensayos de inhibición de la
acetilcolinesterasa (Keane y Ryan, 1999).
Método de Ellman
Para el estudio de la inhibición de la acetilcolinesterasa se siguió el método de Ellman
(Ellman et al., 1961). Se evaluó la inhibición que provocan los tres aceites esenciales activos
en el ensayo de actividad fumigante y 3 monoterpenos (α-felandreno, δ-3-careno y αterpinoleno) sobre la enzima acetilcolinesterasa extraída de adultos de la especie S. oryzae.
Se utilizó como sustrato el ioduro de acetiltiocolina (AcTCh), el cual por hidrólisis enzimática
produce un mercaptano que en presencia del ácido ditionitrobenzoico (DTNB) da lugar a dos
compuestos; uno de ellos, el ácido 5-tio-2-nitrobenzoico, cromóforo de intenso color amarillo
que presenta su máximo de absorción a 412 nm.
La reacción de inhibición se realizó en las celdas de cuarzo del espectrofotómetro. El
volumen total de la reacción fue de 3 mL. Cada celda contenía: 1,5 mL de buffer fosfato 0,1
M pH=8, 1 mL de solución del aceite esencial (50 – 200 ppm) o terpénica (0,5 – 2 mM), 200
μL de sustrato (1-10 mM), 200 μl de DTNB (10 mM) y 100 μl de extracto enzimático. Las
lecturas de la actividad enzimática se registraron a 412 mn a una temperatura de 25 °C, por
144
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
un periodo de 15 minutos. Los blancos se realizaron de la siguiente manera: 2,4 mL de buffer
fosfato 0,1 M pH=8, 100 μL de etanol, 200 μL de sustrato (1-10 mM), 200 μl de DTNB (10
mM) y 100 μL de extracto enzimático (0,5 U/mL). Cada ensayo se realizó por duplicado.
Ensayo in-vivo para determinar el efecto de aceites esenciales y monoterpenos
sobre la actividad enzimática de la acetilcolinesterasa
En este ensayo se utilizaron insectos adultos de S. oryzae y se evaluó el efecto del aceite
esencial de hojas de O. longifolia y de los monoterpenos α-felandreno, δ-3-careno y αterpinoleno.
Para
determinar
el
efecto
in
vivo
de
estas
sustancias
sobre
la
acetilcolinesterasa, los adultos de S. oryzae fueron tratados por un período de 24 h con las
concentraciones CL 25 , CL 50 y CL 75 determinadas en el ensayo de toxicidad volátil para cada
sustancia. Se trataron 900 insectos con cada concentración. Pasadas las 24 horas, se
extrajo la enzima de los insectos vivos y muertos resultantes después del ensayo de
toxicidad volátil. La actividad enzimática de la enzima extraída se determinó por el método de
Ellman descrito anteriormente. Como control se utilizó la enzima obtenida de 900 insectos
adultos que no fueron tratados.
Análisis estadístico
Los datos se presentan como media ± 1DE. La significancia estadística fue determinada por
las pruebas de Duncan y Tukey; el análisis de varianza ANOVA se utilizó para determinar si
existe una diferencia estadísticamente significativa entre los resultados obtenidos en
ensayos de actividad insecticida. La significancia estadística fue aceptada a P < 0,05.
Capítulo 3
145
3.2 Resultados y discusión
3.2.1 Composición química de los aceites esenciales
Se realizó el estudio de los metabolitos secundarios volátiles presentes en siete (7) aceites
esenciales obtenidos de seis especies pertenecientes a las familias Rutaceae, Lauraceae y
Myristicaceae. En la Tabla 3.1 se relacionan los rendimientos de extracción de los aceites
esenciales y las constantes físicas determinadas para cada aceite. Los mayores
rendimientos de extracción se obtuvieron a partir de hojas de O. longifolia (1,75%) y frutos de
Z. monophyllum (0,88%), mientras que el rendimiento más bajo se obtuvo partiendo de hojas
de Z. rigidum (0,07%).
Tabla 3-1 Rendimientos y constantes físicas de los aceites esenciales.
ACEITE
Frutos de Z. rhoifolium
Frutos Z. monophyllum
Frutos Z. fagara
Hojas Z. fagara
Hojas Z. rigidum
Hojas O. longifolia
Hojas Virola carinata
FAMILIA
Rutaceae
Lauraceae
Myristicaceae
% RENDIMIENTO
0,46
0,88
0,55
0,18
0,07
1,75
0,42
DENSIDAD
RELATIVA (25°C)
0,8941
0,9277
0,9630
0,9083
ND*
0,8758
0,8409
ÍNDICE DE
REFRACCIÓN (25°C)
1,4479
1,4770
1,4992
1,4977
ND*
1,4864
1,4955
* Constantes físicas No Determinadas (ND) debido a consistencia resinosa del aceite esencial.
Todos los aceites esenciales se analizaron por CG-EM en dos columnas, una polar: DBCARBOWAX y otra apolar: RTX-5. La determinación de los componentes de los aceites se
realizó con base en criterios cromatográficos (IK) y espectroscópicos (EM, IE, 70 eV). El
análisis por CG-EM de los aceites esenciales permitió la determinación de 66 sustancias,
donde los metabolitos secundarios volátiles identificados en cada aceite esencial
corresponden al 80-99% de la composición total y los componentes no identificados
corresponden principalmente a sesquiterpenos. En la Tabla 3.2 se presentan los
componentes determinados en cada uno de los aceites esenciales, según su orden de
elución en la columna DB-5, con sus respectivos índices de retención y cantidades relativas
determinadas con el detector selectivo a masas.
Tabla 3-2 Composición química relativa de los aceites esenciales
I K*
N°
COMPUESTOS
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
α-Tujeno
α-Pineno
Canfeno
Sabineno
β-Pineno
β-Myrceno
α-Felandreno
δ-3-Careno
α-Terpineno
o-Cimeno
Limoneno
β-Felandreno
1,8-Cineol
Z-β-Ocimeno
E-β-Ocimeno
γ-Terpineno
Trans-4-thujanol
α-Terpinoleno
Cis-4-thujanol
2-Ciclohexen-1-ol
Terpinen-4-ol
α-Terpineol
Dihidroneoisocarveol
Acetato de sabineno hidratado
Geraniol
2-Undecanona
δ-Elemeno
α-Cubebeno
α-Copaeno
Acetato de geranilo
β-Elemeno
γ-Cariofileno
α-Gurjuneno
β-Cariofileno
α-Cariofileno
γ-Elemeno
α-Humuleno
Alloaromadendreno
DB-5
929
937
950
978
983
990
1002
1009
1016
1023
1032
1034
1037
1044
1053
1065
1072
1091
1100
1125
1176
1191
1229
1254
1256
1294
1337
1359
1375
1387
1398
1404
1409
1417
1422
1433
1453
1459
DB-WAX
Frutos Z.
rhoifolium
1024
1019
1119
1107
1163
1177
1147
1185
1250
1195
1165
1200
1224
1216
1230
Frutos Z.
monophyllum
1,6
3,1
Frutos Z.
fagara
Área (%)
Hojas Z.
fagara
2,9
0,1
4,6
4,1
2,8
0,2
6,6
5,6
0,9
0,5
0,8
0,1
59,0
0,8
1,0
0,9
1,4
21,5
9,2
0,5
0,7
2,5
6,3
0,5
9,2
0,6
3,5
3,5
1,2
0,4
1500
1649
1826
Hojas
V. carinata
0,5
0,9
4,7
3,6
0,7
0,4
0,9
0,5
0,2
0,2
0,2
0,6
1,4
0,1
0,7
0,8
1,3
0,8
0,7
0,4
74,0
1,9
0,3
0,7
0,3
0,8
1,8
2,2
2,9
0,1
4,9
0,3
0,1
2,2
61,5
0,6
1,7
1593
1630
1809
1680
1648
Hojas O.
longifolia
0,4
4,0
0,2
25,7
1276
1475
1432
1462
1480
1678
1491
Hojas Z.
rigidum
0,4
0,1
0,4
0,4
0,9
1,2
0,3
0,8
1,0
2,7
5,3
2,8
0,4
0,2
1,5
0,5
0,3
0,5
1,6
1,6
2,7
0,1
14,1
2,0
0,4
0,2
0,7
Capítulo 3
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
58
59
60
61
62
63
64
65
66
67
68
69
70
71
β-Cadineno
γ-Muuroleno
Germacreno D
(+)-epi-biciclosesquifelandreno
β-Salineno
Biciclogermacreno
Valenceno
Germacreno A
α-Muuroleno
γ-Cadineno
Isobutiralo de geranilo
α-Panasinseno
δ-Cadineno
Cadina-1,4-dieno
α-Cadineno
Elemol
Germacreno B
Trans-1-nerolidol
Germacreno D-4-ol
(-)-Espatulenol
Guaiol
10-α-Eudesm-4-en-11-ol
γ-Eudesmol
Hinesol
tau-muurolol
Torreyol
β-Eudesmol
α-Cadinol
5-Neo-cedranol
Acetato de cariofileno
E,E-Farnesol
Acetato de α-bisabolol
Acetato de E,E-farnesilo
Monoterpenos
Sesquiterpenos
TOTAL
147
1470
1474
1479
1481
1485
1488
1491
1495
1499
1510
1514
1519
1522
1529
1533
1547
1552
1560
1573
1576
1601
1623
1631
1637
1640
1644
1649
1654
1680
1701
1725
1794
1850
-------
1790
1701
1690
1644
1699
1705
1787
20,8
9,3
2,3
0,4
6,0
3,1
1,5
5,8
11,1
12,2
0,5
0,5
0,8
2,5
1,4
0,4
1730
1775
3,7
3,3
15,8
2,0
3,2
4,1
0,4
0,4
8,4
0,8
0,5
21,1
17,0
2,7
0,9
0,8
1,3
3,2
5,2
1,0
3,6
8,2
5,1
0,6
1,7
0,2
1,5
5,3
0,3
1,8
1765
2030
1692
2040
0,9
2060
1,2
1,9
0,3
2066
2208
2092
2212
2215
1,6
0,4
0,9
4,1
2279
1,3
-------
1,6
13,1
0,8
80,2
17,0
97,2
71,7
18,6
90,3
0,2
0,3
7,1
87,6
94,7
1,0
1,1
0,8
0,5
0,8
4,8
0,4
13,6
73,5
87,1
14,9
69,1
84,0
93,1
5,6
98,7
66,2
26,4
92,6
Como se observa en la Tabla 3.2 los monoterpenos representan más del 70% de la
composición química de los aceites de frutos de Z. rhoifolium (80,2%), frutos de Z.
monophyllum (71,7%), hojas de O. longifolia (93,1%) y hojas de V. carinata (66,2%), y menos
del 15% de la composición de los aceites esenciales de frutos de Z. fagara (7,1%), hojas de
Z. fagara (13,6%) y hojas de Z. rigidum (14,9%), siendo los sesquiterpenos los componentes
mayoritarios de estos tres últimos aceites, representando el 87,6%, 73,5% y 69,1% de la
composición total, respectivamente.
Los cinco aceites esenciales extraídos de especies del género Zanthoxylum presentan
diferencias apreciables en cuanto a la composición química, sin embargo, los constituyentes
volátiles encontrados han sido previamente reportados en otras especies de este género
(Moura et al., 2006). En el aceite esencial de frutos de Z. rhoifolium fue posible determinar la
presencia de ochos compuestos, siendo componentes mayoritarios: β-myrceno (59,0%), βfelandreno (21,5%), germacreno D (9,3%) y biciclogermacreno (3,1%). La abundancia de
monoterpenoides y sesquiterpenoides en este aceite esencial está de acuerdo a lo
presentado en una investigación previa de la composición química del aceite esencial de
frutos de Z. rhoifolium (Gonzaga et al., 2003). Sin embargo, la composición química
encontrada en esta investigación fue diferente a la reportada por Gonzaga, particularmente
respecto a los constituyentes mayoritarios, sugiriendo una variabilidad considerable en la
composición química de las muestras vegetales estudiadas, debido a la influencia del
ambiente químico y ecológico en el que se encuentra cada planta (Spitaler et al., 2006).
De las 33 sustancias determinadas en el aceite de frutos de Z. monophyllum, los
componentes mayoritarios fueron sabineno (25,7%), 1,8-cineol (9,2%), trans-4-thujanol
(9,2%) y cis-4-thujano (6,3%). El aceite esencial de frutos Z. fagara contiene principalmente
germacreno D-4-ol (21,1%), elemol (8,4%), α-cadinol (8,2%), germacreno D (6,0%),
biciclogermacreno (5,8%), tau-muurolol (5,2%) y 5-neo-cedranol (5,1%). En el aceite esencial
de hojas de Z. rigidum se pudo determinar la presencia de 28 compuestos, siendo los
Capítulo 3
149
constituyentes mayoritarios α-pineno (4,1%), β-pineno (5,6%), β-cariofileno (4,9%), γelemeno (14,1%), germacreno D (12,2%), α-muuroleno (15,8%) y β-eudesmol (4,8%).
Los componentes mayoritarios encontrados en el aceite de hojas de Z. fagara son: δcadineno (17,0%), germacreno D (13,1%), biciclogermacreno (11,1%), β-pineno (6,6%), βcariofileno (5,3%) y tau-muurolol (5,3%). En este aceite se pudieron determinar 20
compuestos, siendo los sesquiterpenos las sustancias más abundantes. El carácter
sesquiterpénico de este aceite esencial está de acuerdo con uno de los reportes
bibliográficos que describe la composición del aceite de hojas de Z. fagara, en este caso
obtenido por hidrodestilación (Pino et al., 2005), pero la composición química encontrada en
este trabajo es cuantitativamente diferente. En otra investigación se reporta que el aceite
esencial de hojas de Z. fagara obtenido por arrastre con vapor está compuesto
principalmente por monoterpenoides (Setzer et al., 2005).
Para el aceite esencial de hojas de O. longifolia se encuentra que los monoterpenos son los
componentes más abundantes, representando el 93,1% de la composición total. De las 22
sustancias identificadas en el aceite, los componentes mayoritarios fueron α-felandreno
(4,7%), α-terpinoleno (74,0%) y δ-3-careno (3,6%). El aceite esencial de O. longifolia es
netamente de tipo terpenoide, coincidiendo con la naturaleza de los aceites esenciales de
diferentes especies de Ocotea de Costa Rica (Chaverri et al., 2011; Chaverri y Cicció, 2007;
Takaku et al., 2007; Chaverri y Cicció, 2005). Algunas especies del género Ocotea tienen
características químicas diferentes a las encontradas para el aceite de hojas de O. longifolia.
Diferentes estudios de los aceites esenciales de especies de Ocotea de Sur América y de
África, indican que dichos aceites se caracterizan por la presencia de fenilpropanoides como
safrol, O-metileugenol, cinamaldehídos y otros derivados de ácido benzoico (Guerrini et al.,
2006; Pino et al, 2004; Menut et al., 2002; Lorenzo et al., 2001), que son los compuestos
volátiles con olores distintivos de dichas especies, como es el caso del olor y sabor a canela
del aceite esencial de hojas de O. quixos (Bruni et al., 2004).
En el aceite esencial de hojas de V. carinata se logró determinar la presencia de once
compuestos, entre monoterpenos y sesquiterpenos. Los componentes mayoritarios
150
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
corresponden a E-β-ocimeno (62,1%) y β-cadineno (20,8%). Son pocos los reportes sobre la
composición química de aceites esenciales de especies del género Virola, y en estos se
indica que dichos aceites contienen principalmente monoterpenos y sesquiterpenos, y en
menor proporción fenilpropanoides. En el aceite esencial de hojas de V. carinata no se
pudieron identificar compuestos de tipo fenilpropanoide, como los que han sido encontrados
en otras especies del género (Lopes et al., 1999; Lopes et al., 1997).
Este trabajo constituye el primer reporte de la composición química de los aceites esenciales
de frutos de Z. monophyllum, frutos de Z. fagara, hojas de Z. rigidum y hojas de O. longifolia.
Los perfiles cromatográficos obtenidos para cada aceite esencial en la columna RTX-5 se
encuentran en el Anexo A.
Con el objetivo de evaluar la aplicabilidad de los aceites esenciales como insecticidas, se
realizó un ensayo de toxicidad fumigante de los aceites sobre tres plagas de almacén: S.
zeamais, S. oryzae y T. castaneum, a una concentración máxima de 500 μL/L aire, para
seleccionar los aceites con promisoria actividad. En la Tabla 3.3 se presentan los resultados
de la actividad insecticida evaluada, expresados en porcentajes de mortalidad.
Tabla 3-3 Resultados del ensayo de toxicidad fumigante de los aceites esenciales sobre tres plagas
de almacén
ACEITE ESENCIAL
Hojas O. longifolia
Hojas V. carinata.
Hojas Z. rigidum
Hojas Z. fagara
Frutos Z. fagara
Frutos Z. monophyllum
Frutos Z. rhoifolium
% Mortalidad a las 24 h de tratamiento (500 μL/L aire) *
S. zeamais
S. oryzae
T. castaneum
70 ± 0 c
76 ± 6 a
100 ± 0 a
80 ± 7 b
76 ± 9 a
88 ± 5 b
0±0e
0±0c
6±5d
0±0e
0±0c
0±0d
0±0e
0±0c
0±0d
90 ± 0 a
82 ± 5 a
94 ± 6 ab
35 ± 5 d
36 ± 6 b
28 ± 8 c
* Media ± 1DE de las tres repeticiones
Los resultados del ensayo de actividad fumigante indican que tres de los siete aceites
esenciales evaluados presentan actividad insecticida promisoria, pues exhiben porcentajes
de mortalidad superiores al 60% a la dosis evaluada, siendo la especie T. castaneum la más
sensible al tratamiento con los aceites esenciales. Los aceites de hojas de O. longifolia,
Capítulo 3
151
hojas de V. carinata y frutos de Z. monophyllum corresponden a las sustancias con las que
se obtuvieron los mejores resultados de actividad insecticida. Debido a que estos tres aceites
son interesantes para continuar con estudios de actividad insecticida más específicos, se
decidió hacer un estudio para identificar algunos de los compuestos responsables de la
actividad insecticida exhibida por los tres aceites esenciales mencionados anteriormente.
Para ello, se adquirieron algunos de los componentes de tipo monoterpeno o
monoterpenoide presentes en los aceites esenciales, siendo importante resaltar que solo fue
posible adquirir los componentes mayoritarios del aceite esencial de hojas O. longifolia y uno
de los componentes mayoritarios del aceite de frutos de Z. monophyllum, correspondiendo
las demás sustancias a los componentes minoritarios. En total fueron 8 los compuestos que
se adquirieron, que corresponden a: α-terpinoleno, δ-3-careno, α-felandreno, α-terpineno, γterpineno, β-mirceno, (+)-limoneno y 1,8-cineol. El objetivo de adquirir los compuestos puros
era determinar la actividad fumigante de cada uno a una concentración máxima de 90 mg/L
aire sobre las tres plagas de almacén y posteriormente cuantificar los compuestos activos en
cada uno de los aceites esenciales en los que estuvieran presentes. En la Tabla 3.4 se
presentan los resultados de la evaluación de la toxicidad fumigante de los nueve compuestos
puros, evaluados a una concentración de 90 mg/L aire.
Tabla 3-4 Resultados del ensayo de toxicidad fumigante de los compuestos puros sobre tres plagas
de almacén
COMPUESTO
α-terpinoleno
δ-3-careno
α-felandreno
α-terpineno
γ-terpineno
β-mirceno
(+)-limoneno
1,8-cineol
% Mortalidad a las 24 h de tratamiento (90 mg/L aire) *
S. zeamais
S. oryzae
T. castaneum
73 ± 6 b
80 ± 0 d
97 ± 6 ba
80 ± 0 ba
83 ± 6 dc
90 ± 0 bc
77 ± 6 ba
87 ± 6 bdc
100 ± 0 a
90 ± 0 ba
97 ± 6 ba
87 ± 6 c
87 ± 6 ba
90 ± 0 bac
97 ± 6 ba
0±0c
0±0e
10 ± 0 d
83 ± 6 ba
87 ± 6 bdc
100 ± 0 a
97 ± 6 a
100 ± 0 a
100 ± 0 a
* Media ± 1DE de las tres repeticiones
Los resultados del ensayo de toxicidad fumigante realizado con los compuestos puros sobre
las tres plagas de almacén indican que siete de los nueve compuestos evaluados causaron
152
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
mortalidades superiores al 70% sobre los insectos del género Sitophilus y mortalidades
superiores al 85% en T. castaneum, siendo β-mirceno el compuesto inactivo.
Teniendo en cuenta los resultados de actividad insecticida obtenidos con los nueve
compuestos evaluados, se decidió hacer la cuantificación de α-terpinoleno, δ-3-careno, αfelandreno, α-terpineno, γ-terpineno, (+)-limoneno y 1,8-cineol que fueron las sustancias
activas. Para realizar la respectiva cuantificación de los compuestos mencionados, se
construyó una curva de calibración con cada uno de los compuestos, empleando en cada
caso ocho concentraciones comprendidas entre 5 y 2000 ppm (Las curvas de calibración
construidas con cada compuesto se encuentran en el Anexo B). En la Tabla 3.5 se presentan
los resultados de la cuantificación de los compuestos activos en los aceites esenciales de
frutos de Z. monophyllum, hojas de O. longifolia y hojas de V. carinata.
Tabla 3-5 Concentración (ppm) de los compuestos puros activos en los aceites esenciales de hojas de
O. longifolia, hojas de V. carinata y frutos de Z. monophyllum.
COMPUESTO
α-terpinoleno
δ-3-careno
α-felandreno
α-terpineno
γ-terpineno
(+)-limoneno
1,8-cineol
CONCENTRACIÓN (% P/V) *
Frutos
Hojas
Z. monophyllum
O. longifolia
0,73 ± 0,02
55,59 ± 0,12
--2,33 ± 0,06
0,92 ± 0,02
3,94 ± 0,08
1,32 ± 0,05
1,18 ± 0,04
2,56 ± 0,04
0,79 ± 0,04
--1,43 ± 0,06
8,39 ± 0,06
---
Hojas
V. carinata
----------1,59 ± 0,05
---
* Media ± 1DE de las tres repeticiones
Una vez caracterizados los siete aceites esenciales estudiados y realizada la cuantificación
de los componentes presentes en los aceites con actividad fumigante sobre las tres plagas
de almacén, se continuó trabajando con las sustancias activas, realizando ensayos de
actividad insecticida más específicos.
Capítulo 3
153
3.2.2 Toxicidad fumigante de los aceites esenciales y de los
monoterpenos y monoterpenoides activos
Los toxicidad fumigante de los aceites esenciales de hojas de O. longifolia, hojas de V.
carinata y frutos de Z. monophyllum y de los siete compuestos activos fue evaluada sobre las
tres plagas de almacén empleando diferentes dosis de cada sustancia. Los resultados de
este estudio se presentan en las Tablas 3.6 y 3.7, donde se reportan los valores de CL 50 .
En la Tabla 3.6 se observa que los aceites esenciales tienen CL 50 inferiores a 300 µL/L aire,
siendo el aceite de frutos de Z. monophyllum la sustancia más activa sobre las dos especies
del género Sitophilus, mientras que el aceite de hojas de O. longifolia presentó la actividad
fumigante más fuerte sobre adultos de T. castaneum (CL
50
= 36,0 µL/L aire). La actividad
fuimigante de estos aceites está directamente relacionada con su composición química, pues
al estar compuestos principalmente por sustancias volátiles y lipofílicas como los
monoterpenoides, pueden penetrar en los insectos rápidamente e interferir en sus funciones
fisiológicas (Negahban et al., 2006), siendo ésta la posible razón de la acción fumigante que
están ejerciendo sobre los tres insectos plaga evaluados.
Tabla 3-6 Concentraciones letales (CL 50 ) de los aceites esenciales de O. longifolia, V. carinata y Z.
monophyllum (24 horas) sobre tres plagas de almacén.
Aceite
Hojas O. longifolia
Frutos Z. monophyllum
Hojas V. carinata
S. zeamais
280,5
(212,2 – 350,3)
73,3
(69,8 – 79,2)
125,8
(101,2 – 172,5)
CL 50 (µL/L aire) (LC* 95%)
S. oryzae
T. castaneum
271,3
36,0
(205,5 – 364,1)
(33,6 – 38,4)
59,7
69,8
(53,9 – 65,3)
(65,9 – 73,9)
185,7
75,6
(149,0 – 221,5)
(71,5 – 80,4)
* Entre paréntesis se encuentra el rango de Límite de Confianza del 95%
La Tabla 3.7 resume los resultados de actividad fumigante de los siete monoterpenoides y
monoterpenos presentes en los aceites esenciales.
154
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Tabla 3-7. Concentraciones letales (CL 50 ) de monoterpenos y monoterpenoides (24 horas) sobre tres
plagas de almacén.
Compuesto
α-terpinoleno
δ-3-careno
α-felandreno
α-terpineno
γ-terpineno
(+)-limoneno
1,8-cineol
S. zeamais
80,6
(74,9 – 102,2)
57,6
(51,8 – 62,7)
72,7
(61,9 – 85,4)
56,2
(52,9 – 60,2)
45,9
(41,9 – 50,9)
41,4
(35,6 – 46,4)
28,3
(22,3 – 34,5)
CL 50 (mg/L aire) *
S. oryzae
77,3
(68,9 – 99,2)
47,3
(43,2 – 51,9)
69,3
(59,9 – 83,4)
48,0
(42,7 – 56,3)
43,2
(39,4 – 47,3)
39,4
(34,9 – 44,6)
24,9
(19,6 – 29,4)
T. castaneum
37,1
(34,1 – 40,2)
44,0
(39,0 – 50,4)
25,6
(22,6 – 28,3)
28,8
(26,5 – 31,9)
24,2
(21,1 – 27,2)
22,8
(19,9 – 25,6)
33,9
(30,9 – 36,7)
* Entre paréntesis se encuentra el rango de Límite de Confianza del 95%
Los efectos tóxicos del aceite esencial de frutos de Z. monophyllum pueden ser atribuidos a
la presencia de algunas sustancias nocivas para coleópteros como: 1,8-cineol, terpinen-4-ol,
α-terpineno (Kordali et al., 2006; Lee et al., 2001), α-terpinoleno, α-felandreno (Park et al.,
2003) y γ-terpineno (Kim et al., 2010; Lee et al., 2004), compuestos que han causado
mortalidades superiores al 70% en especies del género Sitophilus y/o Tribolium a dosis
inferiores a 50 mg/ L aire. La actividad fumigante del aceite de Z. monophyllum también está
relacionada con la presencia de sabineno, pues esta sustancia es el componente mayoritario
de dicho aceite, y además en un estudio de actividad insecticida realizado con este
compuesto sobre S. zeamais se encontró que el sabineno causa un efecto tóxico fuerte
sobre estos insectos (CL 50 = 9,2 mg/ L aire) (Wang et al., 2011). Debido a que con la CL 50
del aceite esencial de Z. monophyllum no se alcanzan a aplicar las CL 50 de los
monoterpenos y monoterpenoides responsables de la actividad insecticida, es posible afirmar
que la toxicidad fumigante del aceite es el resultado de la acción sinérgica de los
compuestos activos y posiblemente de otras sustancias que ayudan a potenciar la actividad.
La actividad fumigante del aceite esencial de hojas O. longifolia puede ser atribuida a la
presencia de (+)-limoneno (Fang et al., 2010; Lee et al., 2001), α-terpinoleno, α-felandreno,
Capítulo 3
155
α-terpineno y γ-terpineno, sustancias que han mostrado poseer importantes propiedades
insecticidas contra diversos insectos plaga de almacén, incluidos los insectos evaluados en
este trabajo. La actividad de este aceite esencial también se debe a la presencia del
monoterpeno δ-3-careno, sustancia para la cual no se han reportado estudios de actividad
insecticida sobre los insectos de almacén objeto de estudio, pero que ha exhibido actividad
insecticida contra larvas de Aedes aegypti (Cheng et al., 2009) y sobre larvas y adultos del
gorgojo de la papa Leptinotarsa decemlineata (Kordali et al., 2007). En este trabajo se
reporta por primera vez la actividad fumigante del δ-3-careno contra S. zeamais, S. oryzae y
T. castaneum. Con la CL 50 determinada para el aceite de O. longifolia se logra aplicar una
concentración superior a la CL 50 determinada para el α-terpinoleno, y concentraciones
mucho menores a la CL 50 de (+)-limoneno, α-felandreno, α-terpineno y γ-terpineno, lo que
indica que la actividad fumigante presentada por el aceite esencial de hojas de O. longifolia
se debe principalmente al efecto tóxico del α-terpinoleno sobre los insectos, y que las demás
sustancias contribuyen en menor medida a dicho efecto. El hecho de que con la CL 50 del
aceite se obtenga una concentración superior a la CL 50 del α-terpinoleno, sugiere también la
posible presencia de efectos antagonistas de algunos componentes del aceite esencial.
La toxicidad exhibida por el aceite de hojas de V. carinata puede atribuirse a la presencia de
Z-β-ocimeno (Sosa et al., 2012; Ogendo et al., 2008) y (+)-limoneno, compuestos que han
presentado actividad insecticida promisoria sobre diferentes plagas de productos
almacenados. Teniendo en cuenta la CL 50 encontrada para este aceite esencial, se tiene que
al aplicar esta cantidad la concentración de Z-β-ocimeno y (+)-limoneno que se obtiene es
muy inferior a la CL 50 reportada y encontrada para estas sustancias, indica que la fuerte
acción fumigante del aceite está relacionada con la presencia de estos dos compuestos y
que puede deberse también a un efecto tóxico que tenga el componente mayoritario (E-βocimeno) sobre los insectos y/o al efecto sinérgico que puede existir entre las sustancias
activas presentes en el aceite esencial.
Como se observa en la Tabla 3.7, en este trabajo se verificó la actividad fumigante de la
mayoría de los compuestos a los que se les puede atribuir la actividad insecticida exhibida
por los aceites esenciales. Es importante resaltar que de los siete compuestos encontrados
156
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
activos, el 1,8-cineol fue el monoterpeno más activo contra S. oryzae (CL
y S. zemais (CL
castaneum (CL
50
50
50
= 24,9 mg/L aire)
= 28,3 mg/L aire); y (+)-limoneno la sustancia más activa contra T.
= 22,8 mg/L aire).
Adicional a la determinación del efecto fumigante de los aceites esenciales de hojas de O.
longifolia, hojas de V. carinata y frutos de Z. monophyllum sobre tres plagas de almacén, se
realizó un estudio del comportamiento de los insectos por un período de 8 horas, mientras
eran tratados con las CL 50 de los aceites, con el objetivo de determinar si estas sustancias
causaban un efecto “knockdown”. Las observaciones se registraron después de 1, 3, 6 y 8
horas de haber iniciado el tratamiento con el aceite esencial, tomando como muestra 100
insectos para el tratamiento con cada aceite.
Con los insectos del género Sitophilus se obtuvieron las siguientes observaciones generales,
que fueron comunes para los tres aceites esenciales:
• 1 Hora: Todos los insectos están vivos. La mayoría están aglomerados a un lado del
vial, ubicándose unos sobre otros. No suben por las paredes del vial. Su movimiento es
rápido, pero no muy coordinado. Tienen dificultad para reincorporarse. Algunos insectos
se encuentran dentro del vial de menor tamaño.
• 3 Horas: Todos los insectos siguen vivos. El movimiento es lento. La mayoría se
encuentran boca-arriba y les cuesta mucho trabajo reincorporarse. Algunos tienen la
mandíbula un poco inclinada hacia el abdomen. Los movimientos de la mayoría son
descoordinados.
• 6 Horas: Siguen vivos todos los insectos. No pueden permanecer por mucho tiempo en
pie. Algunos insectos solo mueven las patas y la cabeza cuando son estimulados. Es
más evidente la dificultad que poseen los insectos para caminar y reincorporarse.
• 8 Horas: Todos vivos. El 90% están boca-arriba y presentan mucha dificultad para
levantarse. Aproximadamente el 60% mueve las patas y la cabeza solo cuando son
estimulados. Algunos presentan movimientos aleatorios y repentinos, como si estuvieran
convulsionando. El 30% de los insectos tiene las patas flexionadas y no pueden
Capítulo 3
157
estirarlas con facilidad. Siguen aglomerados a un lado del vial. El 10% que puede
caminar lo hace lentamente.
Es importante resaltar que tanto S. zeamais como S. oryzae al ser tratados con el aceite de
hojas de O. longifolia, después de seis horas presentan una secreción amarilla en la parte
baja del abdomen y en la mandíbula.
De acuerdo a las observaciones realizadas sobre el comportamiento de los insectos durante
las primeras 8 horas del ensayo de toxicidad fumigante, es posible afirmar que los aceites
esenciales de hojas de O. longifolia, hojas de V. carinata y frutos de Z. monophyllum no
tienen efecto “knockdown” sobre los insectos del género Sitophilus estudiados, pero a
medida que avanza el tiempo de exposición de los insectos a cada aceite esencial se hacen
más evidentes los efectos tóxicos de dichas sustancias, hasta llegar al punto de inmovilizar
los insectos sin causar aún su muerte.
Para el caso de T. castaneum, se encontraron las siguientes observaciones, comunes para
los tres aceites esenciales, durante las 8 primeras horas del ensayo de toxicidad fumigante
empleando la CL 50 de cada aceite:
•
1 Hora: Todos los insectos están vivos. Presentan dificultad para ponerse en pie. Su
movimiento es rápido, pero descoordinado.
•
3 Horas: Todos los insectos siguen vivos. El movimiento es lento. Algunos presentan
movimientos intermitentes que solo se producen cuando se mueve fuertemente el vial.
Aproximadamente el 30% de los insectos tienen la cabeza ligeramente inclinada hacia
el abdomen. Siguen presentando dificultad para dar la vuelta.
•
6 Horas: Siguen vivos todos los insectos. Aproximadamente el 50% de los insectos no
pueden caminar, moviendo solo las patas cuando son estimulados. El otro 50% camina
lentamente y detienen su marcha constantemente. Algunos insectos que no pueden
caminar presentan una evidente inflamación en el abdomen que se nota a simple vista,
pues sale de los élitros.
•
8 Horas: Todos los insectos vivos. Los insectos que pueden caminar, caminan hacia
atrás con mucha dificultad y en zig-zag. El 70% de los insectos solo se mueven al ser
158
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
estimulados por el movimiento fuerte del vial y están boca-arriba. Se les nota inflamado
el abdomen y tienden a tomar una coloración café oscura en el abdomen y tórax.
Las anteriores observaciones indican que los aceites esenciales estudiados no tienen un
efecto “knockdown” en adultos de T. castaneum, pero es evidente que a medida que pasa el
tiempo el abdomen de los insectos se inflama (saliéndose de los élitros) y que su
comportamiento cambia continuamente, síntomas que son causados por los efectos tóxicos
de los aceites esenciales en esta plaga.
Los resultados hasta aquí presentados indican que los aceites esenciales de hojas de O.
longifolia, hojas de V. carinata y frutos de Z. monophyllum son sustancias con acción
fumigante promisoria para el control de insectos plagas como S. zeamais, S. oryzae y T.
castaneum, las cuales no ejercen efectos “knockdown” en los insectos tratados. El estudio de
actividad fumigante realizado en este trabajo sobre las tres plagas de almacén corresponde
al primer reporte de actividad insecticida de los aceites esenciales evaluados.
3.2.3 Toxicidad por contacto de los aceites esenciales
Independiente de la variabilidad química de los aceites esenciales, el efecto tóxico de estas
sustancias depende también de la vía de entrada al insecto. Los aceites pueden actuar sobre
el organismo al ser inhalados por vía respiratoria, absorbidos a través de la cutícula y/o al ser
ingeridos con la dieta. Con el objetivo de determinar si la mortalidad observada en el ensayo
de toxicidad fumigante era causada por el efecto nocivo de los vapores del aceite o era
producida por algún tipo de contacto del insecto con el aceite, se evaluó la toxicidad por
contacto de los aceites esenciales de hojas de O. longifolia, frutos de Z. monophyllum y hojas
de V. carinata sobre las tres plagas de almacén. En la Tabla 3.8 se presentan los resultados
del ensayo de toxicidad por contacto obtenidos con los tres aceites sobre las tres plagas,
expresados como % mortalidad.
Capítulo 3
159
Tabla 3-8 Resultados de toxicidad por contacto para los aceites esenciales de hojas O. longifolia,
frutos de Z. monophyllum y hojas de V. carinata sobre tres plagas de almacén.
ACEITE
Hojas
O. longifolia
Frutos
Z. monophyllum
Hojas
V. carinata
Cantidad
Aplicada
(µL)
% Mortalidad
S. zeamais
24 h
96 h
% Mortalidad
S. oryzae
24 h
96 h
% Mortalidad
T. castaneum
24 h
96 h
0,20
17 ± 6 c
80 ± 0 a
10 ± 0 bc
80 ± 0 a
7±6a
13 ± 5 a
0,15
13 ± 5 dc
63 ± 5 bc
7±6c
50 ± 0 c
0±0b
3 ± 3 ba
0,10
3±5e
27 ± 6 f
0±0c
17 ± 6 e
0±0b
0±0b
0,20
33 ± 5 a
53 ± 5 dc
27 ± 6 a
47 ± 6 c
0±0b
10 ± 0 ba
0,15
20 ± 0 bc
47 ± 6 de
10 ± 0 bc
40 ± 0 dc
0±0b
3 ± 3 ba
0,10
10 ± 0 dce
40 ± 0 e
7±6c
33 ± 5 d
0±0b
0±0b
0,20
33 ± 5 a
73 ± 5 ba
33 ± 5 a
67 ± 6 b
0±0b
3 ± 3 ba
0,15
30 ± 0 ba
60 ± 0 c
20 ± 0 ba
50 ± 0 c
0±0b
3 ± 3 ba
47 ± 6 de
10 ± 0 bc
40 ± 0 dc
0±0b
3 ± 3 ba
0,10
20 ± 0 bc
* Media ± 1DE de las tres repeticiones
Como se observa en la Tabla 3.8, después de 24 horas de aplicados los aceites esenciales
(tres dosis diferentes) sobre el tórax de los adultos de T. castaneum, S. zeamais y S. oryzae,
se encuentra que los porcentajes de mortalidad son bajos y no comparables con los
observados en el ensayo de actividad fumigante, lo que indica que el contacto de los
insectos con el aceite no es el causante de su muerte. Adicionalmente, como se mencionó
en la metodología, para el caso de T. castaneum en el ensayo de toxicidad fumigante no se
permitió el contacto de los insectos con el papel que contenía el aceite, lo que confirma que
la muerte de los insectos fue causada por la inhalación de los aceites esenciales. Para el
caso de los insectos del género Sitophilus se evaluaron dos condiciones, una en la que el
insecto podía entrar en contacto con el papel que contenía el aceite y otra, en la que se hizo
una modificación, evitando que el insecto entrara en contacto con el aceite, y en ambas
situaciones se obtuvieron los mismos valores de CL 50 con los tres aceites, hecho que
confirma que el efecto tóxico de los aceites es principalmente causado por la inhalación de
los vapores de los aceites.
El insecto más susceptible al contacto con los aceites esenciales fue S. zeamais, seguido de
S. oryzae, mientras que T. castaneum mostró ser bastante resistente al contacto con los
aceites esenciales, obteniéndose solo una mortalidad del 6,7% con la máxima dosis aplicada
del aceite del hojas de O. longifolia, y mortalidades nulas con los otros dos aceites. Pasadas
160
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
96 horas después de aplicados los aceites, se aprecia que la mortalidad de los insectos del
género Sitophilus aumenta considerablemente, obteniéndose las mortalidades más altas con
el aceite esencial de hojas de O. longifolia. En el caso de T. castaneum la mortalidad
también aumenta a las 96 horas, sin embargo los valores de % de mortalidad siguen siendo
muy bajos (<15%).
La baja mortalidad observada en los adultos de T. castaneum puede deberse a que en la
cutícula de este insecto es más resistente a ser traspasada por lo compuestos tóxicos
presentes en los aceites, lo cual podría explicarse por la presencia sustancias que tienen la
capacidad de solubilizar y retener dichos compuestos evitando que ingresen al organismo,
hecho que debería verificarse experimentalmente mediante un análisis de la cutícula de los
tres insectos plaga.
Los resultados de toxicidad por contacto de los aceites esenciales de hojas de O. longifolia,
frutos de Z. monophyllum y hojas de V. carinata sobre S. oryzae, S. zeamais y T. castaneum
presentados en este trabajo constituyen el primer reporte de esta actividad para los aceites
mencionados.
3.2.4 Actividad repelente de los aceites esenciales
La búsqueda de alimento, la selección de lugares adecuados para la oviposición, la
búsqueda de pareja y la respuesta a sustancias atrayentes y/o repelentes por parte de los
insectos depende en gran medida de la quimiorrecepción a distancia (olfato) y de contacto
(gusto). Debido a esto, el comportamiento de los insectos depende más de las señales
químicas que de otro tipo de estímulo (Dahanukar et al., 2005). Con el objetivo de determinar
si los aceites esenciales tienen efectos atrayentes o repelentes sobre los insectos plaga
objeto de estudio, se evaluó la actividad repelente de los aceites esenciales de hojas de O.
longifolia, frutos de Z. monophyllum y hojas de V. carinata empleando el método de área de
preferencia. En la Tabla 3.9 se presentan los resultados de actividad repelente obtenidos con
los tres aceites esenciales, expresados como % de repelencia.
Capítulo 3
161
Como se observa en la Tabla 3.9, todos los aceites esenciales presentaron alguna actividad
repelente sobre las tres plagas de almacén, siguiendo una directa relación dosis-respuesta.
El aceite esencial de hojas de V. carinata presentó la mayor actividad repelente sobre las
tres plagas, exhibiendo porcentajes de repelencia (%R) superiores a 55% en las dos
primeras horas de ensayo, y %R superiores a 65% a las 24 horas de iniciado el ensayo. El
efecto repelente más fuerte de este aceite esencial se presentó sobre los adultos de T.
castaneum, mientras que los adultos de S. oryzae fueron los insectos sobre los que tuvo el
menor efecto repelente. Los resultados obtenidos con el aceite esencial de hojas de V.
carinata en los dos tiempos de exposición estudiados fueron similares, encontrándose
efectos repelentes ligeramente mayores a las 24 horas. Los %R obtenidos con este aceite
esencial fueron mejores que los obtenidos con el repelente comercial IR3535 en todas las
concentraciones evaluadas.
Tabla 3-9 Resultados de la actividad repelente de los aceites esenciales de hojas de O. longifolia,
frutos de Z. monophyllum y hojas de V. carinata sobre tres plagas de almacén
ACEITE
Concentración
(%)
S. zeamais
2h
24 h
52 ± 8 bc
48 ± 8 c
0,252
Hojas
42 ± 8 c
38 ± 5 dc
0,126
O. longifolia
26 ± 9 de
20 ± 0 fe
0,063
40 ± 0 dc 32 ± 8 de
0,252
Frutos
24 ± 9 fe
18 ± 5 fg
0,126
Z. monophyllum
10 ± 7 f
6±5g
0,063
82 ± 5 a
0,252
72 ± 5 a
Aceite hojas
66 ± 6 b
0,126
60 ± 0 ba
V. carinata
50 ± 7 c
0,063
46 ± 6 bc
0,252
48 ± 9 bc 40 ± 7 dc
IR3535
0,126
18 ± 5 fe
14 ± 5 fg
0,063
12 ± 5 fe
10 ± 7 fg
* Media ± 1DE de las cinco repeticiones
% REPELENCIA
S. oryzae
2h
24 h
42 ± 5 cb
38 ± 5 b
32 ± 5 cd
24 ± 6 c
20 ± 0 ef
14 ± 6 dc
28 ± 5 ed
22 ± 5 c
12 ± 8 f
8±5d
0±0g
- 20 ± 0 e
56 ± 9 a
66 ± 9 a
48 ± 8 b
40 ± 0 cb
24 ± 6 c
20 ± 0 ef
44 ± 6 b
38 ± 8 b
14 ± 5 f
12 ± 5 dc
10 ± 6 gf
6±5d
T. castaneum
2h
24 h
86 ± 6 b
92 ± 5 ba
52 ± 5 e
58 ± 5 e
30 ± 10 f
36 ± 6 f
100 ± 0 a
100 ± 0 a
80 ± 7 bc
84 ± 6 bc
60 ± 7 de
66 ± 9 e
100 ± 0 a
100 ± 0 a
92 ± 5 ba
100 ± 0 a
60 ± 7 de
68 ± 8 de
80 ± 7 bc
76 ± 5 dc
70 ± 7 dc
68 ± 5 de
50 ± 7 e
44 ± 6 f
El aceite esencial de frutos de Z. monophyllum fue el aceite que presentó el menor efecto
repelente sobre los insectos del género Sitophilus, obteniéndose %R iguales o inferiores a
40% en todas las concentraciones evaluadas, siendo menores que los valores encontrados
para estas dos plagas con el repelente comercial IR3535, obteniendo los mayores %R
después de dos horas de tratamiento. Es importante resaltar que con este aceite, a la
mínima concentración evaluada, mostró propiedades atrayentes de los adultos de S. oryzae
162
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
después de 24 horas de exposición a esta sustancia. Para el caso de T. castaneum, el aceite
de frutos de Z. monophyllum también exhibió una fuerte actividad repelente con todas las
concentraciones de aceite evaluadas, obteniendo %R superiores a los encontrados para este
insecto con el repelente comercial IR3535.
Con el aceite esencial de hojas de O. longifolia se obtuvo una actividad repelente moderada
sobre S. zemais y S. oryzae, presentando porcentajes de repelencia menores o iguales a
52% con las tres concentraciones evaluadas, tanto a las 2 como a las 24 horas,
obteniéndose efectos repelentes similares a los causados por el repelente comercial. Para el
caso de T. castaneum, el aceite esencial causó altos porcentajes de repelencia (≥ 85%) a la
máxima concentración evaluada tanto a las 2 como a las 24 horas. Con las otras dos
concentraciones, la actividad repelente del aceite fue moderada. Con el aceite de hojas de
O. longifolia se obtienen efectos repelentes más fuertes sobre T. castaneum que los
causados por el repelente comercial.
Los efectos repelentes de los aceites esenciales de hojas de O. longifolia y frutos de Z.
monophyllum se redujeron en algunos casos con el paso del tiempo, lo que podría deberse a
que los efectos protectores de estos aceites se desvanecen rápidamente debido la
volatilización de los principios activos, pues como se pudo observar en la Tabla 3.2, estos
aceites están compuestos principalmente por monoterpenoides de bajo peso molecular
altamente volátiles, lo que facilita su difusión y dilución continua en las corrientes de aire
circundantes (Caballero-Gallardo et al., 2011; Nerio et al., 2010; Oyedele et al., 2002). Por
esta razón en la literatura (Nerio et al., 2010) se propone que las formulaciones basadas en
aceites esenciales para el control de insectos se preparen con matrices que permitan la
liberación controlada de las sustancias de interés, para de esta forma reducir las pérdidas de
los principios activos y prolongar los efectos repelentes.
Los resultados de actividad repelente obtenidos con los tres aceites esenciales sobre las tres
plagas de almacén constituyen el primer reporte de actividad repelente de los aceites
evaluados e indican que estas sustancias presentan promisoria actividad repelente sobre los
insectos, en algunos casos ejerciendo una mayor actividad que el producto comercial
Capítulo 3
163
IR3535, lo que los convierte en una posible alternativa frente a los productos comerciales
para el control de las tres plagas objeto de estudio.
3.2.5 Actividad antialimentaria de los aceites esenciales y de
algunos monoterpenos
Las sustancias antialimentarias se caracterizan por modificar el comportamiento de los
insectos provocando la disuasión de la alimentación (actividad antialimentaria o
fagodisuasiva). La definición anterior, excluye a las sustancias que inhiben la alimentación de
los insectos al actuar sobre el sistema nervioso central (después de la ingestión o por
absorción), y a sustancias que tienen toxicidad sub-letal para el insecto (Koul et al., 2005). La
actividad fagodisuasiva de las sustancias puede clasificarse como nula, débil, moderada o
fuerte teniendo en cuenta los valores de los índices de disuasión alimentaria (IDA) de
acuerdo a los criterios establecidos por Liu y colaboradores (2007), que se presentan a
continuación:
% IDA < 20%
-
No disuasión alimentaria
50% > % IDA ≥ 20%
+
Disuasión alimentaria débil
70% > % IDA ≥ 50%
++
Disuasión alimentaria moderada
% IDA ≥ 70%
+++
Disuasión alimentaria fuerte
Para evaluar la actividad fagodisuasiva de los aceites esenciales y de tres monoterpenos se
empleó un ensayo de no elección realizado con pequeños discos de harina. Los índices de
disuasión alimentaria causados sobre S. zeamais, S. oryzae y T. castaneum después de ser
alimentados con dieta tratada con los monoterpenos (100 y 300 ppm) y los aceites
esenciales de hojas de V. carinata, frutos de Z. monophyllum y hojas de O. longifolia (1000 y
500 ppm) se presentan en la Tabla 3.10. Es importante resaltar que no se obtuvo mortalidad
de los insectos con los tres aceites esenciales y los tres monoterpenos evaluados durante las
72 horas que duró el ensayo, lo que indica que ninguna de las sustancias evaluadas causa
efectos tóxicos post-ingesta en los insectos plaga objeto de estudio.
164
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
En la Tabla 3.10 se observa que el aceite esencial de frutos de Z. monophyllum a la máxima
concentración evaluada (1000 ppm) causa los mayores efectos fagodisuasivos sobre los tres
insectos, produciendo índices de disuasión alimentaria (IDA) inferiores a 45% en los insectos
del género Sitophilus, valores que corresponden a una actividad antialimentaria débil,
mientras que sobre adultos de T. castaneum se obtuvo un IDA de 71,3% indicando una
actividad antialimentaria fuerte. Cuando la concentración de este aceite esencial disminuye
en el alimento (500 ppm), la actividad disminuye drásticamente, a tal punto que la actividad
antialimentaria pasa de débil a nula en el caso de S. oryzae y S. zeamais, y de fuerte a débil
en el caso de adultos de T. castaneum.
Tabla 3-10 Resultados de actividad fagodisuasiva de los aceites esenciales y monoterpenos sobre
tres plagas de almacén.
ÍNDICE DISUASIÓN ALIMENTARIA - IDA (%) *
CONCENTRACIÓN
(ppm)
S. zeamais
S. oryzae
T. castaneum
Aceite hojas
O. longifolia
1000
40,0 ± 1,1 c
47,0 ± 1,4 b
32,6 ± 0,2 dc
500
27,5 ± 0,8 d
34,5 ± 0,6 c
25,6 ± 0,3 def
Aceite frutos
Z. monophyllum
1000
44,7 ± 1,3 b
42,5 ± 1,2 b
71,4 ± 0,3 a
500
8,7 ± 0,4 g
5,4 ± 0,2 f
30,7 ± 0,2 dc
Aceite hojas
V. carinata
1000
27,1 ± 0,7 d
25,4 ± 0,8 d
36,3 ± 0,8 c
500
15,4 ± 0,8 f
12,8 ± 0,7 e
26,7 ± 0,6 de
300
20,8 ± 1,7 e
24,8 ± 3,7 d
18,1 ± 4,2 gf
100
13,9 ± 1,5 f
15,9 ± 2,5 e
12,9 ± 1,5 gh
300
45,7 ± 2,7 b
43,1 ± 4,4 b
20,7 ± 4,7 gef
100
43,7 ± 2,4 cb
42,6 ± 3,4 b
13,1 ± 3,2 gh
300
28,1 ± 0,9 d
29,3 ± 1,7 dc
19,3 ± 2,4 gef
100
8,9 ± 1,0 g
10,5 ± 3,0 fe
8,5 ± 1,6 h
500
60,1 ± 3,0 a
55,5 ± 4,5 a
* Media ± 1DE de las cuatro repeticiones
46,7 ± 8,3 b
SUSTANCIA
α-terpinoleno
α-felandreno
δ-3-careno
Extracto Neem
El aceite esencial de hojas de V. carinata fue el aceite que causó el menor efecto
fagodisuasivo sobre los tres insectos, presentando una actividad antialimentaria débil a la
máxima concentración evaluada, siendo más activo sobre T. castaneum. Con este aceite
también se encuentra que al disminuir la concentración, la actividad disminuye
considerablemente.
Capítulo 3
165
Para el caso del aceite esencial de hojas de O. longifolia se encuentra que también presenta
actividad antialimentaria débil sobre las tres plagas de almacén, causando los mayores
efectos fagodisuasivos sobre adultos de S. oryzae (IDA = 47,0%) a las dos concentraciones
evaluadas. Con este aceite esencial también se observa una clara y directa relación dosisrespuesta, pero en este caso al disminuir la dosis de 1000 a 500 ppm no se pierde
completamente la actividad como en el caso de los otros dos aceites esenciales, pues la
actividad sigue siendo débil sobre las tres plagas. Debido a que fue posible conseguir
comercialmente los componentes mayoritarios de este aceite, que corresponden a αterpinoleno, δ-3-careno y α-felandreno, decidimos evaluar la actividad fagodisuasiva de estas
sustancias para determinar si eran responsables de la actividad antialimentaria exhibida por
el aceite esencial de O. longifolia. Como se observa en la Tabla 3.10, los tres monoterpenos
presentaron actividad antialimentaria débil sobre los insectos del género Sitophilus a la
concentración de 300 ppm, siendo α-felandreno el compuesto más activo y α-terpinoleno el
menos activo. Para el caso de T. castaneum se encontró que se obtuvo una actividad
antialimentaria muy débil con α-felandreno a la concentración de 300 ppm, mientras que no
se registró actividad fagodisuasiva con los otros dos monoterpenos. La actividad
antialimentaria de α-terpinoleno y δ-3-careno también presenta una directa relación dosisrespuesta con los tres insectos; y para α-felandreno se encuentra que al disminuir la
concentración de este compuesto en el alimento la actividad antialimentaria se mantiene. Los
anteriores resultados indican que la actividad antialimentaria que presenta el aceite esencial
de hojas de O. longifolia sobre S. oryzae y S. zeamais esta dierctamente relacionada con la
presencia de α-terpinoleno, δ-3-careno y α-felandreno en este aceite, pues estos tres
compuestos causaron algún grado de inhibición de la alimentación de dichos insectos. Para
el caso de T. castaneum, es posible inferir que de los tres monoterpenos evaluados sólo el αfelandreno parece estar relacionado con la débil actividad antialimentaria que presentó el
aceite sobre esta plaga.
De acuerdo con los resultados encontrados, se puede notar que es posible reducir
notablemente el grado de alimentación de los insectos plaga con los tres aceites esenciales
a una concentración de 1000 ppm y con α-felandreno a una concentración de 300 ppm,
hecho que puede influir posteriormente en la reproducción de los adultos y/o en la
166
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
emergencia, crecimiento y desarrollo de las nuevas generaciones de insectos, efectos que
solo podrían se causados por la falta de alimento, más no por la toxicidad de los aceites y
monoterpenos, ya que no se observó mortalidad de los insectos después de ingerir el
alimento tratado durante los tres días que duro el ensayo.
El estudio de actividad antialimentaria sobre S. zeamais, S. oryzae y T. castaneum realizado
en este trabajo, corresponde al primer reporte de efectos fagodisuasivos sobre insectos de
productos almacenados de los aceites de hojas de V. carinata, frutos de Z. monophyllum y
hojas de O. longifolia, y de los compuestos α-terpinoleno, δ-3-careno y α-felandreno.
3.2.6 Efecto de los aceites esenciales y de algunos monoterpenos
en la reproducción de T. castaneum
Las sustancias esterilizantes o inhibidoras de la reproducción son sustancias químicas que
detienen o afectan negativamente la capacidad reproductiva evitando la producción de
óvulos o esperma, ya sea causando la muerte de los espermatozoides y los óvulos después
de que hayan sido producidos, por la producción de mutaciones letales, o porque dañan
gravemente el material genético en el esperma y óvulos (Collins, 2006). La información sobre
el efecto de sustancias naturales quimioesterilizantes en insectos de productos almacenados
es limitado (Khater, 2012; Papachristos y Stamopoulos, 2002; Fields et al., 2001; RegnaultRoger y Hamraoui, 1995). La búsqueda de sustancias quimioesterilizantes es de interés para
los programas integrados de control de plagas, pues con estas sustancias es posible evitar la
proliferación de las plagas e interrumpir su ciclo de vida, y además reducir la posibilidad de
aparición de resistencia por parte de las plagas.
Teniendo en cuenta las anteriores consideraciones, y con el objetivo de evaluar los efectos
post-tratamiento de los aceites de hojas de O. longifolia, hojas de V. carinata y frutos de Z.
monophyllum y de tres monoterpenos en adultos de T. castaneum, se estudió el efecto de
estas sustancias en la reproducción y ciclo de vida de T. castaneum, luego de que hembras y
machos por separado se trataran con la CL 50 de cada una de las sustancias evaluadas. En la
Tabla 3.11 se presentan los resultados de las cuatro lecturas del número de huevos y/o
insectos (larva, pupa o adulto) que se obtuvieron para cada una de las parejas formadas con
Capítulo 3
167
los adultos de T. castaneum (hembras y machos) tratados, durante los 45 días que duro el
estudio de los efectos post-tratamiento.
Tabla 3-11 Resultados del estudio del efecto post-tratamiento de adultos de T. castaneum con las
CL 50 de los aceites esenciales y monoterpenos.
Muestra
Pareja
CONTROL
M st y H st
H trat. y
M trat.
H trat. y M st
# de huevos y/o insectos
5 días
15 días
25 días
35 días
45 días
61 H
45 L
10 A + 35 P
45 A
45 A
48 H
29 L
18 A + 11 P
29 A
29 A
53 H
42 L
20 A + 22 P
42 A
42 A
H st. y M trat
H trat. y
M trat.
H trat. y M st
46 H
35 L
19 A + 16 P
35 A
35 A
8H
--
--
--
--
7H
5L
3A+2P
5A
5A
H st. y M trat
H trat. y
M trat.
H trat. y M st
18 H
9L
2A+7P
9A
9A
0
0
0
0
0
0
0
0
0
0
22 H
6L
1A+5P
6A
6A
α-terpinoleno
(37,1 mg/ L aire)
H st. y M trat
H trat. y
M trat.
H trat. y M st
18 H
12 L
3A+9P
12 A
12 A
24 H
18 L
5 A + 13 P
18 A
18 A
21 H
11 L
2A+9P
11 A
11 A
δ-3-careno
(44,0 mg/ L aire)
H st. y M trat
H trat. y
M trat.
H trat. y M st
3H
1L
1P
1A
1A
13 H
10 L
10 P
10 A
10 A
17 H
8L
8P
8A
8A
α-felandreno
(25,6 mg/ L aire)
H st. y M trat
H trat. y
M trat.
H trat. y M st
15 H
9L
9P
9P
9A
35 H
25 L
25 P
15 A + 10 P
25 A
H st. y M trat
45 H
30 L
30 P
10 A + 20P
30 A
Aceite hojas
O. longifolia
(36,0 μg/ L aire)
Aceite frutos
Z. monophyllum
(69,8 μg/ L aire)
Aceite hojas
V. carinata
(75,6 μg/ L aire)
En la tabla anterior se observa que el ciclo de vida de T. castaneum se lleva a cabo en 35
días, de acuerdo a los resultados obtenidos con el control. Teniendo en cuenta lo anterior, se
encuentra que con los tres aceites esenciales y con los monoterpenos α-terpinoleno y δ-3careno el tiempo del ciclo de vida de T. castaneum no se ve afectado, pues al igual que en el
control, la emergencia de los adultos se obtiene a los 35 días. Para el caso de α-felandreno
se observa que el ciclo de vida del insecto se alarga en un período de 10 días, pues a los 35
días solo han emergido entre el 20% y el 50% de los adultos, obteniéndose la emergencia
168
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
total de adultos a los 45 días. En la Tabla 3.11 también se observa que con todas las
sustancias con las que fueron tratados los insectos hembras y machos de T. castaneum se
logra inhibir en algún grado la oviposición, siendo el aceite de hojas de V. carinata la
sustancia que más inhibe este proceso.
Los resultados obtenidos con el aceite esencial de hojas de O. longifolia indican que este
aceite inhibe moderadamente la oviposición de T. castaneum cuando se han tratado las
hembras y los machos y cuando solo han sido tratados los machos. Cuando se tratan solo
las hembras con el aceite, la inhibición de la oviposición es baja. De acuerdo a lo anterior, se
puede deducir que el efecto del aceite sobre los machos es mayor que sobre las hembras,
hecho que se evidencia al comprar los resultados obtenidos para la pareja H st + M trat con los
de la pareja H trat + M st , pues se observa que la inhibición de la oviposición con la primera
pareja es superior al 20%, mientras que con la segunda la inhibición es del 13%. Cuando los
insectos hembra y macho son tratados, la inhibición de la oviposición es similar a la obtenida
con la pareja en la que solo el macho fue tratado.
Para el caso de los monoterpenos mayoritarios del aceite esencial de hojas de O. longifolia,
se encuentra que con δ-3-careno la inhibición de la oviposición es superior a 70% para las
tres parejas, siendo el monoterpeno más activo. Con el α-terpinoleno los porcentajes de
inhibición son ≥ 60% para las tres parejas analizadas. El α-felandreno resultó ser el
monoterpeno que menos inhibe la oviposición, obteniéndose los mejores resultados con la
pareja formada por los dos insectos tratados (inhibición del 75,5%).
Con el aceite esencial de frutos de Z. monophyllum se logró obtener una inhbición de la
oviposición superior al 72% para las tres parejas estudiadas. Comparando los resultados
obtenidos con las tres parejas con los obtenidos para la pareja control, se encuentra que
tanto la hembra como el macho sufren serias afectaciones en su capacidad de reproducirse,
pero las hembras son las que más tienen afectada su fecundidad, pues al comparar el
número de huevos puestos por la hembra de la pareja H st + M trat con los de la pareja H trat +
M st, se observa que para la primera pareja se obtiene una mayor oviposición (inhibición del
72,1%), mientras que para la segunda pareja se obtiene una inhibición del 88,5%.
Capítulo 3
169
El aceite esencial de hojas de V. carinata inhibió completamente la oviposición de las
hembras de las parejas conformadas por H trat + M st y H trat + M trat , e inhibió en un 63,9% la
oviposición de la hembra de la pareja H st + M trat . De acuerdo a los resultados anteriores, es
posible inferir que la fecundidad de la hembra es la que se ve más afectada al ser tratada
con la CL 50 de este aceite esecial. Los porcentajes mencionados anteriormente se calculan
de acuerdo al número de huevos puestos por la hembra en cada pareja analizada
comparados con los huevos puestos por la hembra de la pareja control.
Analizando ahora la fertilidad o viabilidad de los huevos puestos por la hembra de cada una
de las 3 parejas analizadas después de que los insectos fueran tratados con la CL 50 de los
tres aceites esenciales y los tres monoterpenos, se encuentran los resultados que aparecen
en la Figura 3.1, en donde se muestra el porcentaje de eclosión de los huevos
correspondientes a cada pareja de acuerdo a la sustancia con la que fueron tratados los
insectos, comparando en todos los casos con el porcentaje de eclosión de los huevos
correspondientes a la pareja control que tienen un porcentaje de eclosión del 73,8%.
En la Figura 3.1A se observa que cuando las hembras y los machos fueron tratados con la
CL 50 de cada sustancia evaluadas, se reduce apreciablemente la fertilidad de los huevos.
Con el aceite de O. longifolia el porcentaje de eclosión se reduce un 13%, y con los
componentes mayoritarios de este aceite la reducción del porcentaje de eclosión se da de la
siguiente manera: con α-terpinoleno se reduce en 7%, con δ-3-careno se reduce un 40% y
con α-felandreno el % de eclosión se reduce en 13%. De acuerdo con los resultados
anteriores, se puede afirmar que los tres componentes mayoritarios del aceite de O. longifolia
contribuyen en el efecto negativo sobre la fecundidad y la fertilidad que ejerce esta sustancia
en adultos de T. castaneum. Observando ahora el porcentaje de eclosión encontrado para el
aceite de Z. monophyllum se encuentra que no hubo eclosión de los huevos, lo que indica
que este aceite además de inhibir fuertemente la oviposición también es responsable de la
infertilidad de los pocos huevos que la hembra de T. castaneum es capaz de poner cuando
se tiene la pareja conformada por el macho y hembra tratados. El porcentaje nulo de
170
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
eclosión obtenido con el aceite de hojas de V. carinata era de esperarse, pues esta sustancia
inhibió completamente la oviposición en la pareja conformada por hembra y macho tratados.
A
% ECLOSIÓN
% de eclosión de los huevos correspondientes a las
parejas en las que hembra y macho han sido tratados
80
70
60
50
40
30
20
10
0
SUSTANCIA
B
% ECLOSIÓN
% de eclosión de los huevos correspondientes a las
parejas en las que solo la hembra ha sido tratada
80
70
60
50
40
30
20
10
0
SUSTANCIA
% de eclosión de los huevos correspondientes a las
parejas en las que solo el macho ha sido tratado
% ECLOSIÓN
C
80
70
60
50
40
30
20
10
0
SUSTANCIA
Capítulo 3
171
Figura 3-1 Graficas de lo resultados del efecto de los aceites esenciales y monoterpenos en la
eclosión de los huevos. A) resultados para la pareja H trat + M trat ; B) resultados para la pareja H trat +
M st ; C) resultados para la pareja H st + M trat
Los resultados presentados en la Figura 3.1B correspondientes al efecto de los aceites y
monoterpenos en la viabilidad de los huevos ovipositados por las hembra de las parejas en
las que solo ha sido tratada la hembra con la sustancia de intéres, indican que a pesar de
que la oviposición se redujo con las seis sustacias evaluadas, el porcentaje de eclosión de
los huevos obtenido para el tratamiento con los aceites esenciales de hojas de O.longifolia y
frutos de Z. monophyllum y con los tres monoterpenos, no presento diferencias significativas
con el porcentaje de eclosión de los huevos puestos por la hembra de la pareja control.
Estos resultados sugieren que el hecho de que la fecundidad de la hembra se reduzca por la
acción de las sustancias mencionadas (posiblemente por inhibir la producción de óvulos), no
implica que los huevos ovipositados sean inviables. Para el caso del aceite esencial de hojas
de V. carinata, se esperaba que el porcentaje de eclosión fuer igual a 0,0%, pues como se
observa en la Tabla 3.12, no hubo oviposición de la hembra de la pareja H trat + M st .
En la Figura 3.1C se observa que la viabilidad de los huevos que oviposita la hembra de las
parejas en las que el macho ha sido tratado disminuye significativamente con los aceites
esenciales de hojas de V. carinata y frutos de Z. monophyllum y con los tres monoterpenos
evaluados. En este caso con el aceite de V. carinata se obtiene el porcentaje de eclosión
más bajo (27,3%), mientras qe con α-felandreno la fertilidad de los huevos se reduce solo en
un 7% respecto al control. Teniendo en cuenta los resultados observados en la Figura 3.1B y
3.1C, es posible intuir que se afecta más la calidad de los espermatozoides cuando el macho
esta expuesto a estas sustancias que la calidad de los óvulos cuando la hembra es tratada,
pues para el último caso no se observó reducción el los porcentajes de eclosión. Es
importante resaltar que al tratar los machos con el aceite esencial de hojas de O. longifolia
no se observa reducción del porcentaje de eclosión de los huevos con respecto al control.
Observando nuevamente los resultados mostrados en la Tabla 3.12 se puede ver que una
vez eclosionados los huevos, el desarrollo de los insectos no se ve interumpido en la todas
las parejas analizadas, pues el número de adultos emergidos es igual al número de huevos
viables, lo que indica que el efecto inhibitorio de la reproducción causado por las sustancias
172
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
evaluadas se evidencia en la inhibición de la oviposición y en la disminución del % de huevos
viables.
La implicación práctica de anteriores hallazgos es que cuando T. castaneum está expuesto a
los vapores de los aceites esenciales y monoterpenos evaluados, se puede lograr un control
satisfactorio aún cuando algunos insectos sobrevivan al tratamiento.
3.2.7 Estudio de inhibición in-vitro de la acetilcolinesterasa (AChE)
La acción de los aceites esenciales y de sus componentes en los insectos podría ser
neurotóxica, causando síntomas similares a los producidos por pesticidas organofosforados y
carbamatos (Isman, 2000), hecho que está relacionado con la inhibición de AChE (Ryan y
Byrne, 1988). Teniendo en cuenta estas consideraciones y con el objetivo de conocer el
posible mecanismo de acción de las sustancias que exhibieron promisoria actividad
fumigante sobre las tres plagas de almacén, se estudió la inhibición de la AChE causada por
los aceites de frutos de Z. monophyllum, hojas de V. carinata y O. longifolia y los
monoterpenos α-terpinoleno, δ-3-careno y α-felandreno.
Para el estudio de la inhibición de la enzima se empleó el método de Ellman, siguiendo la
reacción enzimática que se presenta en la Figura 3.2.
H2O
+
(CH3)3N-CH2CH2-S-CO-CH3
Inhibidor
(CH3)3N-CH2CH2-S
+
CH3COO
+
2H
AChE
OH
HO
+
O
O
DTNB
O2N
S
S
NO2
HO
O
S
O
O2N
HO
+
O2N
Figura 3-2 Reacción enzimática – Método Ellman
S-S-CH2CH2-N(CH3)3
Capítulo 3
173
El comportamiento cinético de la reacción esta descrito por la ecuación de Michaelis-Menten,
que relaciona la velocidad de reacción con la concentración del sustrato:
𝑉=
𝑉𝑚𝑎𝑥 [𝑆]
𝐾𝑀 + [𝑆]
En la Figura 3.3 se presentan los resultados obtenidos al representar la velocidad frente a la
concentración de sustrato cuando la reacción enzimática (con la enzima extraída del insecto)
se lleva a cabo en presencia de un inhibidor (aceite esencial o monoterpeno) a diferentes
concentraciones.
En las gráficas mostradas en la Figura 3.3 se encuentra que se obtienen curvas bien
definidas de forma sigmoidea, lo que confirma que la reacción enzimática estudiada presenta
una cinética Michaeliana, en donde conforme va amentando la concentración de sustrato
aumenta también la velocidad de reacción. En las gráficas también es posible notar que al
aumentar la concentración del inhibidor disminuye apreciablemente la actividad enzimática,
observando claras diferencias entre las velocidades de reacción obtenidas para el control y
las obtenidas con las sustancias empleadas como inhibidores a diferentes dosis.
Teniendo en cuenta los resultados obtenidos sobre los efectos de cada uno de los
inhibidores en la AChE, se calcularon las concentraciones inhibitorias 50 (CI 50 ) para cada
sustancia evaluada. En la Tabla 3.12 se presentan los valores de CI 50 para los tres aceites y
los tres monoterpenos evaluados como inhibidores de la AChE obtenida de S. oryzae.
174
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Figura 3-3 Gráficas de velocidad vs concentración de sustrato para diferentes concentraciones de
inhibidor (aceites esenciales y monoterpenos) para la AChE extraída de S. oryzae.
De los aceites esenciales evaluados, el aceite de hojas de V. carinata fue que el causó la
mayor inhibición de la enzima a las concentraciones evaluadas, exhibiendo una CI 50 = 43,82
ppm. El efecto causado por este aceite puede deberse a la presencia de compuestos como
α-pineno, β-pineno y limoneno, monoterpenos que han producido efectos inhibitorios sobre la
Capítulo 3
175
enzima AChE obtenida de diferentes fuentes (Arruda et al., 2012; Aazza et al., 2011;
Miyazawa y Yamaguji, 2005). Este es el primer reporte de la actividad inhibitoria de la AChE
para el aceite esencial de hojas de V. carinata.
Tabla 3-12 Inhibición de la actividad de la AChE causada por los aceites esenciales y monoterpenos
(CI 50 )
SUSTANCIA EVALUADA
Aceite frutos Z. monophyllum
Aceite hojas V. carinata
Aceite hojas O. longifolia
δ-3-careno
α-terpinoleno
α-felandreno
CI 50 *
228,85 ± 33,85 ppm
43,82 ± 3,23 ppm
96,11 ± 2,91 ppm
0,45 ± 0,13 mM
2,26 ± 0,37 mM
1,30 ± 0,07 mM
* Media ± 1DE de las repeticiones
Observando ahora los resultados obtenidos con el aceite esencial de hojas de O. longifolia y
con los tres monoterpenos mayoritarios de dicho aceite, se encuentra que tanto el aceite
como los compuestos puros (δ-3-careno, α-terpinoleno y α-feladreno) inhiben la enzima,
siendo el δ-3-careno el compuesto que mayor efecto inhibidor exhibió (CI 50 = 0,45 mM); por
lo tanto es posible afirmar que estos tres monoterpenos son responsables de la actividad
exhibida por el aceite esencial. En estudios previos sobre el poder inhibitorio de la
acetilcolinesterasa por diferentes monoterpenos biciclícos, se reportó que el δ-3-careno
inhibió fuertemente la AChE extraída de eritrocitos bovinos (Miyazawa y Yamaguji, 2005). La
actividad inhibitoria exhibida por el aceite de O. longifolia también puede estar relacionada
con la presencia de α-pineno, β-pineno, γ-terpineno y limoneno, monoterpenos que han
mostrado poseer efectos inhibidores sobre la enzima AChE (Öztürk, 2012; Aazza et al.,
2011; Lopéz y Pascual-Villalobos, 2010). Los resultados descritos anteriormente constituyen
el primer reporte del efecto inhibidor de la AChE por parte del aceite esencial de hojas de O.
longifolia y de los monoterpenos α-terpinoleno y α-felandreno.
El aceite de frutos de Z. monophyllum (CI 50 = 228,85 ppm) fue el aceite que causó la menor
inhibición de la enzima extraída de S. oryzae, pues para alcanzar una inhibición del 50% de
la actividad enzimática fue necesario utilizar concentraciones más altas que las empleadas
con los aceites de O. longifolia y V. carinata. Los componentes mayoritarios del aceite de Z.
176
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
monophyllum, sabineno y 1,8-cineol, han presentado promisoria actividad inhibitoria de la
AChE (Menechini et al, 2009; Aazza et al., 2011, Orhan et al., 2008), así como algunos
monoterpenos y monoterpenoides minoritarios de este aceite como son: α-pineno, αfelandreno, α-terpineno, γ-terpineno, α-terpinoleno y terpinen-4-ol. Teniendo en cuenta las
anteriores consideraciones se esperaba que este aceite presentara un fuerte efecto inhibidor
de la enzima, pero no se observó un efecto inhibitorio fuerte, como se puede evidenciar en
los resultados descritos. Lo anterior conduce a concluir que los demás compuestos
presentes en el aceite pueden estar ejerciendo un efecto antagonista o que no se está
presentando un efecto aditivo de la actividad exhibida por lo monoterpenos activos presentes
en el aceite de frutos de Z. monophyllum. Estos resultados constituyen el primer reporte de
actividad inhibitoria de la AChE causada por el aceite esencial de frutos de Z. monophyllum.
Para calcular los parámetros cinéticos de la enzima en cada uno de los casos evaluados, se
hizo la linealización de la ecuación de Michaelis-Menten empleando la representación de
Lineweaver-Burk como herramienta gráfica:
1� = 𝐾𝑀�
1
𝑉
[𝑆] 𝑉𝑚𝑎𝑥 + �𝑉𝑚𝑎𝑥
En esta linealización se representa gráficamente 1/V frente a 1/[S], obteniéndose una recta
cuya abscisa en el origen corresponde a –1/K M , la ordenada en el origen es 1/V max y la
pendiente es igual a K M /V max . De esta forma, a partir de los datos experimentales se
calcularon gráficamente los valores de K M y V max para la AChE.
Cuando existe inhibición enzimática se hallan los valores de aparentes de K M y V max , que
corresponden a valores que incluyen los correspondientes efectos del inhibidor y que varían
con la concentración de éste, contrario a lo que ocurre con los valores de K M y V max de la
enzima cuando no está presente el inhibidor, los cuales se mantienen constantes. Las
variaciones de los valores de las constantes cinéticas, así como la representación de
Lineweaver-Burk permiten identificar el tipo de inhibición que está causando sobre la AChE
cada una de las sustancias evaluadas.
Capítulo 3
177
Figura 3-4 Representaciones de Lineweaver-Burk para diferentes concentraciones de inhibidor
(aceites esenciales y monoterpenos).
En la Figura 3.4 se presentan las gráficas obtenidas al representar los inversos de la
velocidad de reacción frente a los inversos de la concentración de sustrato para diferentes
concentraciones de cada una de las 6 sustancias evaluadas como inhibidores. En general,
las gráficas muestran que la pendiente de la recta que corresponde a la enzima control es
178
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
menor en todos los casos, y que conforme va aumentando la concentración de inhibidor se
hace mayor la pendiente.
Observando el comportamiento de las gráficas se encuentra que los tres aceites esenciales y
los monoterpenos α-terpinoleno y δ-3-careno producen una inhibición enzimática mixta, pues
las tres rectas se cortan en puntos diferentes a la intersección en el eje X o en el eje Y,
hecho que indica que estos inhibidores se unen tanto a la enzima (E) como al complejo
enzima-sustrato (ES), interfiriendo con la unión del sustrato a la enzima, hecho que se
evidencia con un aumento en el valor de K M ; además dificulta la actividad del complejo ES
causando una disminución en el valor de la V max (Nelson y Cox, 2004). Para el α-felandreno
se observa que las tres rectas se cortan en el intercepto con el eje Y, hecho que indica que
esta sustancia ejerce una inhibición no competitiva, donde el inhibidor puede interactuar con
la enzima libre y con el complejo ES sin afectar la afinidad aparente de la enzima por el
sustrato, es decir, que se mantiene constante el valor de K M pero causa una disminución de
la V max a medida que aumenta la concentración de inhibidor (Mikkelsen y Cortón, 2004).
Con el objetivo de verificar mediante los valores de las constantes cinéticas reales y
aparentes los tipos de inhibición causados por cada una de las sustancias evaluadas, se
calcularon los valores de K M y V max para cada caso, valores que se presentan en la Tabla
3.13.
Los valores de las constantes cinéticas de la reacción enzimática en presencia y ausencia de
inhibidor confirman que todas las muestras evaluadas exhiben una inhibición reversible,
donde los aceites esenciales de hojas de V. carinata, frutos de Z. monophyllum y hojas de O.
longofolia, junto con los monoterpenos α-terpinoleno y δ-3-careno causan una inhibición
mixta sobre la AChE extraída de S. oryzae; mientras que el monoterpeno α-felandreno
origina una inhibición enzimática de tipo no competitivo.
Capítulo 3
179
Tabla 3-13 Valores de K M y V max para diferentes concentraciones de las seis sustancias evaluadas
como inhibidores de la AChE extraída de Sitophilus oryzae
SUSTANCIA
Control
Aceite O. longifolia
Control
Aceite V. carinata
Control
Aceite
Z. monophyllum
Control
α-felandreno
Control
α-terpinoleno
Control
δ-3-careno
CONCENTRACIÓN
0 ppm
50 ppm
100 ppm
0 ppm
50 ppm
100 ppm
0 ppm
100 ppm
200 ppm
0 mM
0,5 mM
2,0 mM
0 mM
0,5 mM
2,0 mM
0 mM
0,5 mM
2,0 mM
K M (mmol/L)
1,206
1,392
1,439
1,254
2,566
3,065
0,799
0,885
1,000
1,662
1,641
1,699
1,036
1,073
1,204
1,471
8,261
10,000
V max (mmol/ min*mL)
0,0246
0,0172
0,0130
0,0250
0,0105
0,0055
0,0211
0,0167
0,0132
0,0275
0,0210
0,0060
0,0226
0,0197
0,0125
0,0254
0,0112
0,0066
Ahora, teniendo en cuenta la estructura de los tres monoterpenos evaluados como
inhibidores de la AChE, podemos afirmar que la presencia del biciclo en el δ-3-careno (CI 50 =
0,45 mM), que fue el compuesto más activo, es importante para que se presente una fuerte
inhibición de la enzima. Comparando ahora la estructura del α-felandreno (CI 50 = 1,30 mM)
con la del α-terpinoleno (CI 50 = 2,26 mM), encontramos que la única diferencia entre estos
dos compuestos es la ubicación de los dobles enlaces, donde el α-felandreno posee dos
enlaces dobles endocíclicos conjugados, mientras que el α-terpinoleno tiene un doble enlace
endocíciclico y uno exocíclico no conjugados; y de acuerdo a los resultados obtenidos con
estos dos compuestos podemos concluir que los compuestos con dobles enlaces
endocíclicos conjugados causan mayor efecto inhibidor de la AChE, y que los dobles enlaces
exocíclicos causan una disminución en la actividad inhibitoria de la enzima.
La acetilcolinesterasa (AChE) juega un papel importante en las sinapsis colinérgicas
esenciales para los insectos y animales superiores. La inhibición de esta enzima causa la
acumulación de acetilcolina en las sinapsis, manteniendo la membrana post-sináptica en un
estado de estimulación permanente, lo que resulta en una falta general de coordinación en el
180
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
sistema neuromuscular, y que finalmente puede conllevar a la muerte (Rattan, 2010). De
acuerdo con los resultados mostrados sobre los efectos de los aceites esenciales y
monoterpenos objeto de estudio sobre la AChE estraída de S. oryzae, se encuentra que
estas sustancias ejercen una inhibición reversible de la acetilcolinesterasa, efecto que está
directamente relacionado con el comportamiento descoordinado de los insectos observado
durante el tiempo que están expuestos a estas sustancias, lo que permite concluir que uno
de los mecanismo de acción de estas 6 sustancias es la inhibición de la enzima AChE.
Sin embargo, es importante tener en cuenta que los aceites esenciales y los monoterpenos
al ser sustancias altamente volátiles y lipofílicas pueden penetrar dentro de los insectos
rápidamente e interferir en varias de sus funciones fisiológicas, lo que conlleva a que estas
sustancias puedan tener diferentes mecanismos de acción que generalmente son difíciles de
identificar. Por esta razón, otros modos de acción que pueden exhibir las sustancias
evaluadas es el bloqueo de los receptores GABA (reduciendo la inhibición neuronal y
causando la hiper-excitación del sistema nervioso central, convulsiones y la muerte) y la
inhibición de los receptores octopaminérgicos que desempeñan un papel clave como
neurotransmisores, neuromoduladores y neurohormonas en invertebrados (Rattan, 2010).
3.2.8 Estudio de inhibición in-vivo de la acetilcolinesterasa
Teniendo en cuenta que para validar la inhibición in vitro de la AChE exhibida por alguna
sustancia se debe demostrar mediante un ensayo apropiado el efecto in vivo que causa
dicha sustancia sobre el organismo de interés (Keane y Ryan, 1999), se desarrolló un
ensayo in vivo para confirmar el efecto inhibitorio de la AChE observado in vitro con los
aceites esenciales y monoterpenos. En este caso solo se pudo determinar el efecto in vivo
del aceite esencial de hojas de O. longifolia y de los monoterpenos δ-3-careno, α-terpinoleno
y α-felandreno, debido a que eran las únicas sustancias de las que se tenía una cantidad
suficiente para realizar el ensayo in vivo sobre adultos de S. oryzae.
Para realizar el estudio de inhibición de la actividad de la AChE in vivo, se determinaron en
primer lugar las concentraciones letales 25 y 75 (CL 25 y CL 75 ) sobre S. oryzae, en el ensayo
de toxicidad fumigante, para cada una de las sustancias que iban a ser probadas en el
Capítulo 3
181
ensayo in vivo. En la Tabla 3.14 se presentan las CL 25 , CL 50 y CL 75 para el aceite de hojas
de O. longifolia, δ-3-careno, α-terpinoleno y α-felandreno.
Tabla 3-14. Concentraciones letales del aceite esencial de hojas de O. longifolia y de los
monoterpenos δ-3-careno, α-terpinoleno y α-felandreno sobre S. oryzae.
SUSTANCIA
Aceite O. longifolia
α-terpinoleno
δ-3-careno
α-felandreno
CL 25 (μL/ L aire)*
CL 50 (μL/ L aire)*
CL 75 (μL/ L aire)*
118,51
(62,87 – 163,57)
62,21
(49,34 – 74,42)
46,05
(39,46 – 50,42)
56,83
(46,80 – 65,77)
271,33
(205,47 – 364,11)
98,74
(82,04 – 132,26)
55,24
(50,46 – 60,55)
82,07
(70,98 – 98,80)
621,19
(442,86 – 1228,95)
156,71
(120,29 – 266,56)
66,26
(60,46 – 77,61)
118,54
(98,52 – 162,27)
* Entre paréntesis se encuentra el rango de Límite de Confianza del 95%
Una vez determinadas las CL 25 , CL 50 y CL 75 , se trataron 900 insectos con cada una de las
concentraciones letales de las cuatro sustancias por un período de 24 horas. Al finalizar el
tiempo expisición de los insectos a cada uno de los fumigantes, se procedió a extraer la
enzima AChE de los insectos tratados (incluyendo vivos y muertos) para determinar el efecto
que tubo cada sustancia a determinada concentración sobre la actividad de la enzima.
Para determinar la actividad enzimática de la AChE extraída de los insectos tratados y sin
tratar se empleo el método colorimétrico de Ellman. En la Figura 3.5 se presentan los
resultados obtenidos al representar la velocidad de reacción frente a la concentración de
sustrato cuando la reacción se llevo a cabo con cada una de las enzimas extraídas de los
insectos tratados y sin tratar.
182
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Figura 3-5 Gráficas de velocidad vs concentración de sustrato para la AChE extraída de S. oryzae
luego del tratamiento con la CL 25 , CL 50 y CL 75 de 4 inhibidores (aceite esencial de hojas de O.
longifolia, α-terpinoleno, α-felandreno y δ-3-careno)
En los resultados mostrados en la Figura 3.5 se observa una tendencia a disminuir la
actividad de la AChE con las tres dosis evaluadas in vivo de cada inhibidor, comparado con
la actividad de la AChE control.
En general, de acuerdo con los resultados mostrados en las gráficas de Velocidad vs [S], se
puede decir que las 4 sustancias evaluadas inhiben la acetilcolinestersa in vivo, siendo la
inhibición dependiente de la concentración de inhibidor con la que se traten los insectos.
Estos resultados sugieren que después de tratar a S. oryzae con las diferentes
concentraciones letales, las sustancias evaluadas logran alcanzar el cerebro del insecto e
inhibir la AChE, hecho que es consistente con la inhibición de la enzima evidenciada en el
ensayo in vitro. Por lo anterior, se puede concluir que los monoterpenos α-terpinoleno, α-
Capítulo 3
183
felandreno y δ-3-careno son los responsables de la inhibición in vivo e in vitro que causa el
aceite esencial de hojas de O. longifolia, ya que se encontró que estos compuestos también
son capaces de inhibir la enzima en ambos casos.
Es importante anotar que en el ensayo in vivo se esperaba encontrar un comportamiento
similar al observado en el ensayo in vitro, pero en este caso se encuentra que la inhibición
que se obtiene in vivo con las diferentes concentraciones del aceite y del α-terpinoleno es
mayor que la observada en el ensayo in vitro, mientras que con el δ-3-careno se obtiene una
inhibición in vivo menor que la observada en el ensayo in vitro. El efecto observado con δ-3careno conllevan a pensar que la inhibición in vivo de la AChE causada por esta sustancia
puede estar produciendo un efecto compensatorio en el insecto, hecho que conlleva a que
éste sintetice una mayor cantidad de enzima en respuesta a su propia inhibición. Otra razón
por la que se puede estar disminuyendo la actividad del δ-3-careno in vivo es que dicha
sustancia puede estar siendo metabolizada por el insecto antes de alcanzar el cerebro,
teniendo así una menor cantidad disponible de sustancia capaz de inhibir la AChE (Perry et
al., 2002).
Los anteriores resultados confirman que el mecanismo de acción del aceite esencial de hojas
de O. longifolia, y de los monoterpenos α-terpinoleno, α-felandreno y δ-3-careno es la
inhibición de la AChE, y constituyen el primer reporte del efecto inhibitorio de la AChE in vivo
para estas 4 sustancias.
4. Conclusiones
El presente estudio realiza un aporte a las investigaciones en fitoquímica y propiedades
biológicas de las familias Myristicaceae, Lauraceae y Rutaceae presentes en Colombia,
mediante el aislamiento y caracterización de los metabolitos presentes en hojas y madera de
C. capitellata, corteza de O. longifolia y Z. rigidum; la caracterización química de los aceites
esenciales de algunas especies de estas familias; y la evaluación de la actividad insecticida
sobre plagas de almacén. Los resultados obtenidos en esta investigación permiten concluir:
•
El trabajo fitoquímico desarrollado en C. capitellata contribuye al conocimiento
químico de la especie y del género, pues no hay reportes fitoquímicos previos para
éstos. Mediante este trabajo se aisló un nuevo compuesto denominado (-)compsoneurósido HCc-9 junto con 19 compuestos conocidos, los cuales pueden
tener relevancia quimiotaxonómica para el género y la familia Myristicaceae.
•
El estudio fitoquímico desarrollado en la corteza de Z. rigidum permitió el aislamiento
de una nueva sustancia denominada ácido (-)-rigidunoico Zr-14 y de trece
compuestos conocidos correspondientes a tres alcaloides, cuatro lignanos, una
cumarina, tres triterpenos, un monoglicérido y un derivado de ácido caféico, siendo
trece de éstos reportados por primera vez para la especie, contribuyendo de esta
forma a las investigaciones químicas en el género Zanthoxylum.
•
La investigación fitoquímica llevada a cabo en la corteza de O. longifolia condujo al
aislamiento de una nueva sesquiterpenlactona denominada (+)-longifolina Ol-4 junto
con 7 compuestos conocidos entre los que se encuentran sesquiterpenos, lactonas,
Capítulo 4.
185
sesquiterpenlactonas y esteroles. Todos los metabolitos aislados se reportan por
primera vez para la especie. Estas susntancias pueden tener importancia
químiotaxonómica para el género, principalmente las sesquiterpenlactonas, pues este
tipo de compuestos no se han reportado ampliamente es especies del complejo
Ocotea.
• El presente trabajo también contribuyó a la caracterización química de aceites
esenciales de especies pertenecientes a las familias Lauraceae, Rutaceae y
Myristicaceae, siendo este el primer reporte de la composición química de los aceites
esenciales de frutos de Z. monophyllum, frutos de Z. fagara, hojas de Z. rigidum,
hojas de O. longifolia y hojas de V. carinata.
• Esta investigación también hace aportes al conocimiento de las propiedades
biológicas de especies de las familias Lauraceae, Rutaceae y Myristicaceae, por
medio de la evaluación de la actividad antialimentaria sobre T. castaneum y S.
zeamais de extractos y compuestos puros aislados de C. capitellata, Z. rigidum y O.
longifolia, encontrándose que la mayoría de los compuestos que exibhieron actividad
sobre las dos plagas causaron efectos fagodisuasivos entre bajos (50% < IDA > 20%)
y moderados (70% < IDA > 50%), siendo T. castaneum el insecto más susceptible.
•
El screening de toxicidad fumigante sobre 3 plagas de almacén de 7 aceites
esenciales obtenidos de diferentes especies de las familias Rutaceae, Lauraceae y
Myristicaceae permiten concluir que solo los aceites de hojas de V. carinata., hojas de
O. longifolia y frutos Z. monophyllum exhiben toxicidad fumigante contra las tres
plagas causando mortalidades superiores a 70%, actividad que se debe
principalmente al efecto nocivo que tienen sus vapores, pues no se evidenció una
mortalidad importante al ser evaluados como repelentes, antialimentarios y tóxicos
por contacto.
•
Se pudo determinar que α-terpinoleno, α-felandreno, δ-3-careno, α-terpineno, γterpineno, limoneno y 1,8-cineol son algunos de los compuestos responsables de la
186
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
actividad insecticida que presentan los aceites esenciales de hojas de V. carinata.,
hojas de O. longifolia y frutos Z. monophyllum, resultados que no han sido
previamente reportados para algunos de estos compuestos.
•
Se determinó que uno de los posibles mecanismos de acción de los aceites de hojas
de V. carinata., hojas de O. longifolia y frutos Z. monophyllum sobre T. castaneum
consiste en inhibir la reproducción de los adultos sobrevivientes luego de ser tratados
con la CL 50 de cada sustancia, observándose la mayor inhibición con el aceite de
hojas de V. carinata.
•
El estudio de la inhibición de la acetilcolinestresa obtenido de S. oryzae permite
concluir que el efecto tóxico de los aceites y monoterpenos (α-terpinoleno, αfelandreno, δ-3-careno) se puede deber a la inhibición que causan estas sustancias
en la enzima, donde los aceites de hojas de V. carinata., hojas de O. longifolia y
frutos Z. monophyllum y los monoterpenos α-terpinoleno y δ-3-careno producen una
inhibición reversible mixta, mientras que el compuesto α-felandreno causa una
inhibición enzimática no competitiva.
•
El estudio in vivo de la inhibición de la AChE realizado con el aceite de O. longifolia y
los monoterpenos mayoritarios de este aceite permite confirmar que el mecanismo de
acción de estas sustancias sobre S. oryzae está directamente relacionado con la
inhibición reversible de la enzima.
Anexos.
187
A. Perfiles cromatográficos obtenidos
para los aceites esenciales en la
columna RTX-5MS
188
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Perfil cromatográfico obtenido para el aceite esencial de hojas de Virola carinata.
Anexos.
189
Perfil cromatográfico obtenido para el aceite esencial de frutos de Zanthoxylum fagara.
190
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Perfil cromatográfico obtenido para el aceite esencial de hojas de Zanthoxylum fagara.
Anexos.
191
Perfil cromatográfico obtenido para el aceite esencial de hojas de Zanthoxylum
rigidum.
192
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Perfil cromatográfico obtenido para el aceite esencial de frutos de Zanthoxylum
monophyllum.
Anexos.
193
Perfil cromatográfico obtenido para el aceite esencial de frutos de Zanthoxylum
rhoifolium.
194
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Perfil cromatográfico obtenido para el aceite esencial de hojas de Ocotea longifolia.
Anexos.
195
B. Curvas de calibración construidas
para la cuatificación de los siete
monoterpenoides activos
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
196
Curva de calibración para el δ-3-careno
140000000
y = 63131x - 3E+06
R² = 0,988
120000000
Área del pico
100000000
80000000
60000000
40000000
20000000
0
-20000000
0
500
1000
1500
2000
2500
Concentración (ppm)
Curva de calibración para el α-terpinoleno
140000000
120000000
y = 59088x - 1E+06
R² = 0,993
Área del pico
100000000
80000000
60000000
40000000
20000000
0
0
500
1000
1500
Concentración (ppm)
2000
2500
Anexos.
197
Curva de calibración para el β-felandreno
100000000
y = 47945x - 2E+06
R² = 0,999
Área del pico
80000000
60000000
40000000
20000000
0
0
500
-20000000
1000
1500
2000
2500
Concentración (ppm)
Curva de calibración para el α-terpineno
140000000
120000000
y = 60019x - 3E+06
R² = 0,997
Área del pico
100000000
80000000
60000000
40000000
20000000
0
-20000000
0
500
1000
1500
Concentración (ppm)
2000
2500
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
198
Curva de calibración para el γ-terpineno
140000000
120000000
y = 65902x - 5E+06
R² = 0,994
Área del pico
100000000
80000000
60000000
40000000
20000000
0
-20000000
0
500
1000
1500
2000
2500
Concentración (ppm)
Curva de calibración para el 1,8-cineol
120000000
100000000
y = 54417x - 3E+06
R² = 0,996
Área del pico
80000000
60000000
40000000
20000000
0
0
-20000000
500
1000
1500
Concentración (ppm)
2000
2500
Anexos.
199
Curva de calibración para el Limoneno
160000000
140000000
y = 69262x - 5E+06
R² = 0,996
120000000
rea del pico
100000000
80000000
60000000
40000000
20000000
0
-20000000
0
500
1000
1500
Concentración (ppm)
2000
2500
200
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Bibliografía
Aazza, S.; Lyoussi, B.; Miguel, M. G. Antioxidant and Antiacetylcholinesterase Activities of
Some Commercial Essential Oils and Their Major Compounds. Molecules. 2011, 16, 76727690.
Adams, R. P.; Identification of Essential Oil Components by Gas ChromatographyQuadrupole Mass Spectrometry. Academic Press: San Diego. 1995.
Adesina, S. K. The Nigerian Zanthoxylum: Chemical and Biological Values. Afr. J. Trad. CAM.
2005, 2, 282-301.
Adesina, S.; Reisch, J. Arnottianamide and other constituents of Zanthoxylum gillettii root. J.
Nat. Prod .1998, 51, 601- 602.
Ahmad, M. U.; Rahman, M. A.; Hug, E.; Chowdhury, R. Alkaloids of Zanthoxylum budrunga.
Fitoterapia. 2003, 74, 191-193.
Almtorp, G. T.; Hazell, A. C.; Torssel, K. B. G. A lignan and pyrone and other constituents
from H yptis capitata. Phytochemistry, 1991, 30,2753 – 2756.
Arimoto, M.; Yamaguchi, H.; Nishibe, S. Structure Elucidation and Synthesis of the Lignans
from the Seeds of Hernandia ovigera L. Studies in Natural Products Chemistry, 1996, 18, 551
– 606.
Arruda, M.; Viana, H.; Rainha, N.; Neng, N. R.; Rosa, J. S.; Nogueira, J. M. F.; Barreto, M.D.
Anti-acetylcholinesterase and Antioxidant Activity of Essential Oils from Hedychium
gardnerianum Sheppard ex Ker-Gawl. Molecules. 2012, 17, 3082-3092.
Athanassiou, C. G., Kavallieratos, N. G., Meletsis, C. M. Insecticidal effect of three
diatomaceous earth formulations, applied alone or in combination, against three storedproduct beetle species on wheat and maize. J. Stored Prod. Res. 2007, 43, 330-334.
Bibliografía
201
Ayres, D. C.; Loike, J. D. Lignans. Chemical, Biological and Clinical Properties. Cambridge
University Press. 1990. pp. 208-213.
Bakkali, F.; Averbeck, S.; Averbeck, D.; Idaomar, M. Biological effects of essential oils – A
review. Food Chem. Toxicol. 2008, 46, 446–475.
Ballabeni, V.; Tognolini, M.; Bertoni, S.; Bruni, R.; Guerrini, A.; Moreno G.; Barocelli, E.
ntiplatelet and antithrombotic activities of essential oil from wild Ocotea quixos (Lam.)
Kosterm. (Lauraceae) calices from Amazonian Ecuador. Pharmacological Res. 2007, 55, 2330.
Barla, A.; Gülaçtı,T.; Oksüz, S.; Tümen, G.; Kingston, D. Identification of cytotoxic
sesquiterpenes from Laurus nobilis L. Food Chem. 2007, 104, 1478–1484.
Barrero, A. F.; Herrador, M. M.; Arteaga, P.; Catalán, J. V. Ilicic Acid as a Natural Quiron for
the Efficient Preparation of Bioactive α- and β-Eudesmol. Eur. J. Org. Chem. 2009, 3589–
3594.
Bastos, J. K.; Albuquerque, S. y Silva, M. L. A. Evaluation of the Tripanocidal Activity of
Lignans Isolated from the Leaves of Zanthoxylum naranjillo. Planta Med. 1999, 65, 541-544.
Belles, X. Tendencias y contradicciones en el diseño de insecticidas. Phytoma España. 1993,
45, 2-7.
Benzi, Verónica; Stefanazzi, N; Ferrero, A. A. Biological activity of essential oils from leaves
and fruits of pepper tree (Schinus molle L.) to control rice weevil (Sitophilus oryzae L.). Chil.
J. Agr. Res. 2009, 69, 154-159.
Bernal, F. A.; Cuca, L. E. Chemical constituents from Iryanthera ulei Warb. Biochem. Syst.
Ecol. 2009, 37, 772–775.
202
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Bhattacharya, S., Zaman, K.., Ghosh, A. K. Histological and Physico-chemical Evaluation of
Zanthoxylum nitidum Stem Bark. Ethnobotanical Leaflets, 2009, 13, 540-547.
Bohlmann, F.; Jakupovic, J. Neue sesquiterpene, triterpene, flavanone und andere
aromatische verbindungen aus Flourensia heterolepls. Phytochemistry. 1979, 18, 1189-1194.
Bolougne, I.; Petit, P.; Ozier-Lafontaine, H.; Desfontaines, L.; Loranger-Merciris, G.
lnsecticidal and antifungal chemicals produced by plants: a review. Environ. Chem. Lett.
2012, 10, 325–347.
Bowers, W. S.; Ortegox, F.; You, X.; Evans, P. H. Insect repellents from the chinese prickly
ash Zanthoxylum bungeanum. J. Nat. Prod. 1993, 56, 935-938.
Braga, P.; Severino, V.; de Freitas, S.; da Silva, M.; Fernandes, J.; Vieira, P.; Pirani, J.;
Groppo, M. Dihydrocinnamic acid derivatives from Hortia species and their chemotaxonomic
value in the Rutaceae. Biochem. Syst. Ecol. 2012, 43, 142–151.
Braz-Filho, R.; Pedreira, G.; Gottlieb, O. R.; Maia, J. G. S. Isoflavones from Virola caducifolia.
Phytochemistry. 1976, 15, 1029-1030.
Braz-Filho, R.; Frota leite, M. F.; Gottlieb, O.R. Constitutions of diarylpropanoids from Virola
multinervia. Phytochemistry, 1973, 12, 417 - 419
Brown, G.; Liangc, G. D.. Terpenoids from the seeds of Artemisia annua. Phytochemistry
2003 ,64, 303–323.
Bruni, R.; Medici, A.; Andreotti, E.; Fantin, C.; Muzzoli, M.; Dehesa, M.; Ramagnoli, C.;
Sacchetti, G. Chemical composition and biological activities of Ishpingo essential oil, a
traditional Ecuadorian spice from Ocotea quixos (Lam.) Konsterm. (Lauraceae) flower calices.
Food Chem. 2004, 85, 415-421.
Bibliografía
203
Caballero-Gallardo, K., J. Olivero-Verbel and E.E. Stashenko, 2011. Repellent activity of
essential oils and some of their individual constituents against Tribolium castaneum Herbst. J.
Agric. Food Chem. 2011, 59, 1690-1696.
Caballero-García, C. Efectos de terpenoides naturales hemisintéticos sobre Leptinotarsa
decemlineata (SAY) y Spodoptera exigua (HUBNER) (Lepidoptera:Nocturnae).Tesis de
Doctorado, Facultad de Ciencias Biológicas. Universidad Complutense de Madrid, 2004, pp.
107.
Cabral, M. M. O.; Barbosa-Filho, J. M.; Maia, G. L. A.; Chaves, M. C. O.; Braga, M. V.; De
Souza, W.; Soares, R. O. A. Neolignans from plants in northeastern Brazil (Lauraceae) with
activity against Trypanosoma cruzi. Exp. Parasitol. 2010, 124, 319-324.
Campbell, J. F. Influence of Seed Size on Exploitation by the Rice Weevil, Sitophilus oryzae.
Journal of Insect Behavior, 2002, 15, 429 – 445.
Cárdenas, D.; Salinas, N. 2006. Libro Rojo de las Plantas de Colombia- Especies
maderables amenazadas. I, Instituto Amazónico de Investigaciones Científicas SINCHI,
Bogotá D.C, pp. 134- 135
Carod, E. Insecticidas organofosforados. “De la guerra química al riesgo laboral y
doméstico”. MEDIFAM, 2002, 12, 333-340.
Cavalheiro, E. J.; Yoshida, M. 6-[ω-arylalkenyl]-5,6-dihydro-α-pyrones from Cryptocarya
moschata (Lauraceae). Phytochemistry. 2000, 53, 811 – 819.
Chaaib, K. F. Investigation Phytochimique d’une Brosse à Dents Africaine Zanthoxylum
zanthoxyloides (Lam.) Zepernick et Timler (Syn. Fagara zanthoxyloides L.) (Rutaceae).
Thèse de doctorat. Faculté des Sciences de l’Université de Lausanne. 2004, pp. 11-44.
204
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Chanderbali, A., Werff, H. V. d., Renner, S. Phylogeny and historical biogeography of
lauraceae: Evidence from the chloroplast and nuclear genomes. Annals of the Missouri
Botanical Garden, 2001, 88, 104-134.
Chase, M. W.; Morton, C. M.; Kallunki, J. A. Phylogenetic relationships of Rutaceae: a
cladistic analysis of the subfamilies using evidence from RBCL and ATPB sequence variation
Am. J. Botany. 1999, 86, 1191-1199.
Chavarro, C. Estudio químico de los extractos etanólicos de hojas y corteza de Compsoneura
atopa (Myristcaceae). Tesis de grado, Departamento de Química, Universidad Nacional de
Colombia. Bogotá. 1999.
Chaverri, C.; Cicció, J. F. Essential oils of the genus Ocotea (Lauraceae) in Costa Rica, Part
1. Ocotea brenesii Standl. Rev. Biol. Trop. 2005, 53, 431-436.
Chaverri, C; Cicció, J. F. Essential Oils from Ocotea austinii C. K. Allen (Lauraceae) from
Costa Rica. J. Essent. Oil Res. 2007, 19, 439-443.
Chaverri, C; Díaz, C; Cicció, J. F. Chemical Analysis of Essential Oils from Ocotea gomezii
W.C. Burger and Ocotea morae Gómez-Laur. (Lauraceae) Collected at “Reserva Biológica
Alberto M. Brenes” in Costa Rica and their Cytotoxic Activity on Tumor Cell Lines. J. Braz.
Chem. Soc. 2011, 22, 741-745.
Chavez, J. P.; Gottlieb, O. R.; Yoshida, M. 10-desmethyl- 1-methyl-eudesmanes from Oco
tea cor ymbosa. Phytocheraistry, 1995, 39, 849-852.
Chen, I,-S., Chen, T.-L., Chang, Y.-L., Teng, C.-M., and Lin, W.-Y. Chemical Constituents and
Biological Activities of the Fruit of Zanthoxylum integrifoliolum. J. Nat. Prod. 1999, 62, 833837.
Bibliografía
205
Chen, I. S.; Wu, S.-J.; Lin, Y.-C.; Tsai, I.-L.; Seki, H.; Ko, F.-N.; Teng, C.-M. Dimeric 2Quinolone Alkaloid and Antiplatelet Aggregation Constituents of Zanthoxylum simulans.
Phytochemistry. 1994, 36, 237-239.
Chen, Y.; Lee, M.; Hsu, C.; Wei, C.; Tsai, Y. Methyl Cinnamate Inhibits Adipocyte
Differentiation via Activation of the CaMKK2−AMPK Pathway in 3T3-L1 Preadipocyte. J.
Agric.Food Chem. 2012, 60, 955−963.
Cheng, S. S.; Chua, M. T.; Chang, E. H.; Huang, C. G.; Chen, W. J.; Chang, S. T. Variations
in insecticidal activity and chemical compositions of leaf essential oils from Cryptomeria
japonica at different ages. Bioresource Technol. 2009, 100, 465–470.
Cheng, M-J.; Wang, T-A.; Lee, S-J.; Chen, I-S. A new butanolide and a new secobutanolide
from Litsea lii var. nunkao-tahangensis. Nat. Prod. Res. 2010, 24, 647–656.
Chown, S. L.; Sorensen, J. G.; Terblanche, J. S. Water loss in insects: An environmental
change perspective. J. Insect Physiol. 2011, 57, 1070 – 1084.
Chyau, C.-C.; Mau, J. L.; Wu, C.-M. Characteristics of the steam- Distilled Oil and Carbon
Dioxide Extract of Zanthoxylum simulans Fruit. J. Agric. Food Chem. 1996, 44, 1096-1099.
Cid, F. D.; Antón, R. I.; Caviedes-Vidal, E. Organochlorine pesticide contamination in three
bird species of the Embalse La Florida water reservoir in the semiarid midwest of Argentina.
Sci. Total. Environ. 2007, 385, 86-96.
Cis, J., Nowak, G., Kisiel, W. Antifeedant properties and chemotaxonomic implications of
sesquiterpene lactones and syringin from Rhaponticum pulchrum. Biochem. System. Ecol.
2006, 34, 862-867.
Coats, J. R. Risks from natural versus synthetic insecticides. Annu. Rev. Entomol. 1994, 39,
489-515.
206
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Colegate, S. M.; Molyneux, R. J. An Introduction and Overview. En S. M. Colegate; R. J.
Molyneux,
(Eds),
Bioactive
Natural
Products:
Detection,
Isolation,
and
Structural
Determination. Segunda Edición. CRC Press. New York. 2008, pp. 1-3.
Collins, D. A. A review of alternatives to organophosphorus compounds for the control of
storage mites. J. Stored Prod. Res. 2006, 42, 395 – 426.
Conyers, S. T.; Bell, C. H. A novel use of modified atmospheres: Storage insects population
control. J. Stored Prod. Res. 2007, 43, 367 – 374.
Corbett, R. E.; Smith R.A.J. Selin-11-en-4α-ol from the essential oil of Podocarpus
dacrydioides. Tetrahedron Lett. 1967, 11, 1009-1012.
Cordell, A. G. Introduction to Alkaloids -A Biogenetic Approach. John Wiley & Sons. New
York. 1981, pp. 509-517.
Correa, A.; Santos, J.; Cordeiro, E.; Guedes, R. Fluctuating asymmetry in pyrethroir-resistant
and -susceptible populations of the maize weevil (Sitophilus zeamais).9th Internationa
Working Conference on Stored Product Protection. Pest resistance to Pesticides and Control
Measures. Conference Papers, 2006, pp. 285-291.
Cosimi, S.; Rossi, E.; Cioni, P. L.; Canale, A. Bioactivity and qualitative analysis of some
essential oils from Mediterranean plants against stored-product pests: Evaluation of
repellency against Sitophilus zeamais Motschulsky, Cryptolestes ferrugineus (Stephens) and
Tenebrio molitor (L.). J. Stored Prod. Res. 2009, 45, 125-132.
Cox, P. D. Potential for using semiochemicals to protect stored products from insect
infestation. J. Stored Prod. Res. 2004, 40, 1 – 25.
Cox, P. D.; Collins, L. E. Factors affecting the behaviour of beetle pests in stored grain, with
particular reference to the development of lures. J. Stored Prod. Res. 2002, 38, 98-115.
Bibliografía
207
Cragg, G. M.; Kingston, D. G. I.; Newman, D. J. (Eds). Anticancer Agents from Natural
Products. Taylor & Francis Group, New York. 2005, pp. 1-3.
Cuca, L. E.; Martinez, J. C. y Monache, F. D. 7,9’-Epoxilignan and other Constituents of
Zanthoxylum culantrillo. Phytochemistry. 1998, 47, 1437-1439.
Cuca, L. Hidroxiotobaina y reticulina obtenidos de Ocotea caparrai. Rev. Latinoamer. Quim.
1980, 11, 110-111.
Dahanukar, A.; Hallem, E. A.; Carlson, J. R. Insect chemoreception. Curr. Opin. Neurobiol.
2009, 15, 423-430.
De Los Mozos, M. Plagas de los productos almacenados. Bol. S. E. A. 1997, 20, 93-109.
De Luca-Batista, A. N.; Batista, J. M.; López, S. N.; Furlan, M.; Cavalheiro, A. J.; Siqueira, D.
H.; da Silva, V.; Nunomura, M. S.; Yoshida, M. Aromatic compounds from three brazilian
Lauraceae species. Quím. Nova. 2010, 33, 321-323.
De
Moura,
N.;
Ribeiro,
H.;
Machado,
E.;
Ethur,
E.;
Zanatta,
N.;
Morel,
A.
Benzophenanthridine alkaloids from Zanthoxylum rhoifolium. Phytochemistry. 1997, 46, 14431446.
Dewick, P. M. 2009. Medicinal Natural Products – A biosynthetic approach. Third Edition.
John Wiley & Sons, Great Britain, pp. 67, 90.
Dhakal, R. C.; Rajbhandari, S.: Kalauni, S. K.; Awale, S.; Gewali, M. B. Phytochemical
Constituents of the Bark of Vitex negundo L. J. Nepal Chem. Soc. 2008, 23, 89 – 92.
Díaz, P.P.; Díaz, A.M. Diarylpropanes from the wood of Iryanthera grandis. Phytochemistry,
1986, 25, 2395 - 2397.
208
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Diéguez-Hurtado, R.; Garrido-Garrido, G.; Prieto-González, S.; Iznaga, Y.; González, L.;
Molina-Torres, J.; Curini, M.; Epifanio, F.; Marcotullio, M. C. Antifungal Activity of Some
Cuban Zanthoxylum Species. Fitoterapia. 2003, 74, 384-386.
Diehl, E. E.; Poser, G. L.; Henriques, A. T. Constituents of Zanthoxylum rugosum St.-Hil &
Tul. Biochem. System. Ecol. 2000, 28, 275-277.
Domínguez, D., Reina, M., Santos-Guerra, A., Santana, O., Agulló, T., López-Balboa, C.,
González-Coloma, A. Pyrrolizidine alkaloids from Canarian endemic plants and their
biological effects. Biochem. System. Ecol. 2008, 36, 153-166.
Dos Santos, S. A.; De Carvalho, M. G.; Braz-Filho, R. Unambiguous 1H- and
13
C- NMR
assignments of isoflavones from Virola caducifolia. J. Braz. Chem. Soc. 1995, 4, 349 – 352.
Doyle, J. A.; Sauquet, H.; Scharaschkin, T.; Thomas, A. L. Phylogey, molecular and fossil
dating, and biogeographic history of Annonaceae and Myristicaceae (Magnoliales). Int. J.
Plant Sci. 2004, 165, S55-S67.
Drewes, S. E.; Horn, M. M.; Sehlapelo, B. M.; Ramesar, N.; Field, J. S.; Shaw, R. S.; Sandor,
P. Iso-ocobullenone and a neolignan ketone from Ocotea bullata bark. Phytochemistry. 1995,
38, 1505 – 1508.
Drewes, S. E.; Horn, M. M.; Wijewardene, C. S. α-pyrone from Cryptocarya latifolia – a
structural isomer of umuravumbolide. Phytochemistry. 1996, 41, 333 – 334.
Dreyer, D. L. 11,13-Dihydrocostus Acid from Holocarpha virgata. Biochem. Syst. Ecol. 1987,
15, 661.
Dubey, N. K.; Shukla, R.; Kumar, A.; Singh, P.; Prakash, B. 2011. Global Scenario on the
Application of Natural Products in Integrated Pests Management Programmes. En: Natural
Products in Plant Pest Management. Nawal K. Dubey (Ed). CABI, UK. pp. 1 -20.
Bibliografía
209
Ducom, P. J. F. The Return of the Fumigants. 9th International Working Conference on
Stored Product Protection. 2006, pp. 510 – 516.
Dürüst, N.; Özden, S.; Umur, E.; Dürüst, Y.; Küçükislamoglu, M. The Isolation of Carboxylic
Acids from the Flowers of Delphinium formosum. Turk J Chem. 2001, 25, 93-97.
Dvořák Z.; Kubáň V.; Klejdus B.; Hlaváč J.; Vičar J.; Ulrichová J.; Šimánek V. Quaternary
Benzo[c]phenanthridines Sanguinarine and Chelerythrine: A Review of Investigations from
Chemical and Biological Studies. Heterocycles. 2006, 68, 2403-2422.
EI-Hassan, A.; EI-Sayed, M.; Hamed, A. I.; Rhee, I. K.; Ahmed, A. A.; Zeller, K. P.; Verpoorte,
R. Bioactive Constituents of Leptadenia arborea. Fitoterapia. 2003, 74, 184-187.
Eliel, E. L.; Bello-Ramirez, M. (-)-Quinic acid: configurational (stereochemical) descriptors.
Tetrahedron Asymmetry., 1997, 8, 3551-3554.
Ellman, G.L.; Courtney, D.; Andres, V.; Featherstone, R.M. A new and rapid colorimetric
determination of acetylcholinesterase activity. Biochem. Pharmac. 1961, 7, 88–95.
El-Naggar, S. M.; Mikhaiel, A. A. Disinfestation of stored wheat grain and flour using gamma
rays and microwave heating. J. Stored Prod. Res. 2011, 47, 191 – 196.
Enan, E. Insecticidal activity of essential oils: octopaminergic sites of action. Comparative
Biochemistry and Physiology Part C. 2001, 130, 325-337.
Endo, K.; Taguchi, T.; Taguchi, F.; Hikino, H.; Yamahara, J.; Fujimura, H. Antiinflammatory
principles of Antractylodes Rhizomes. Chem. Pharm. Bull. 1979, 27, 2954 – 2958.
Eun, J.-P.; Koh, G. Y. Suppression of Angiogenesis by the Plant Alkaloid, Sanguinarine.
Biochem. Biophys. Res. Commun. 2004, 317, 618-624.
210
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Fang , R.; Jiang, C. H.; Wang, X. Y.; Zhang, H. M.; Liu, Z. L.; Zhou, L.; Du, S. S.; Deng, Z. W.
Insecticidal Activity of Essential Oil of Carum Carvi Fruits from China and Its Main
Components against Two Grain Storage Insects. Molecules. 2010, 15, 9391-9402.
FAO. 1983. Distribución e importancia de los insectos que dañan granos y productos
almacenados en Chile. Disponible en: http://www.fao.org/docrep/x5053S/x5053s03.htm
(Consultada 8 de mayo de 2012).
Feitosa, E. M. A.; Arriaga, A. M. C.; Lemos, T. L. G.; Lima, J. Q.; Nunes e Vasconcelos, J.;
Oliveira, M. C. F.; Santiago, G. M. P.; Nascimento, R. F. Zanthoxylum articulatum Engler
(Rutaceae) Essential Oil: Chemical Composition and Larvicidal Activity. J. Essent. Oil Res.
2007, 19, 384-386.
Feng, R.; Guo, Z. K.; Yan, C. M.; Li, E. G.; Tan, R. X.; Ge, H. M. Anti-inflammatory flavonoids
from Cryptocarya chingii. Phytochemistry. 2012, 76, 98 – 105.
Ferreira, M. E.; Rojas, A.; Torres, S.; Inchausti, A.; Nakayama, H.; Thouvenel, C.;
Hocquemiller, R.; Fournet, A. Leishmanicidal Activity of Two Canthin-6-one Alkaloids, Two
Major Constituents of Zanthoxylum chiloperone var. angustifolium”. J. Ethnopharm. 2002, 80,
199 - 202.
Fields, P. G.; Xie, Y. S.; Hou, X. Repellent effect of pea (Pisum sativum) fractions against
stored-product insects. J. Stored Prod. Res. 2001, 37, 359 – 370.
Finney, D. J.; Probit Analysis. Cambridge University Press: London. 1971. pp. 68-72.
Fiorin, C.; David, B.; Fourasti, I.; Vercauteren, J. Acylated kaempferol glycosides from Laurus
nobilis leaves. Phytochemistry. 1998, 47, 821 – 824.
Flinn, P. W.; Kramer, K. J.; Throne, J. E.; Morgan, T. D. Protection of stored maize from
insect pests using a two-component biological control method consisting of a hymenopteran
Bibliografía
211
parasitoid, Theocolax elegans, and transgenic avidin maize powder. J. Stored Prod. Res.
2006, 42, 218-225.
Fournet, A.; Ferreira, M.; Arias, A; Guy, I.; Guinaudeau, H.; Heinzen, H. Phytochemical and
antiprotozoal studies of Ocotea lancifolia. Fitoterapia. 2007, 78, 382-384.
Fraga, B. M.; González-Coloma, A.; Gutiérrez, C.; Terrero, D. (1997). Insect Antifeedant
Isoryanodane Diterpenes from Persea indica. J. Nat. Prod. 1997, 60, 880-883.
Gan, L.; Zheng, Y.; Mo, J.; Liu, X.; Li, X.; Zhou, C. Sesquiterpene Lactones from the Root
Tubers of Lindera aggregata. J. Nat. Prod. 2009, 72, 1497–1501.
Garcez, F.; Garcez, W.; Hamerski, L.; Miranda, A. Eudesmane and rearranged eudesmane
sesquiterpenes from Nectandra cissiflora. Quim. Nova. 2010, 33, 1739-1742.
Garcez, W. S.; Garcez, F. R.; da Silva, L. M. G. E.; Hamerski, L. Larvicidal activity against
Aedes aegypti of some plants native to the West-Central region of Brazil. Bioresource
Technol. 2009, 100, 6647–6650.
Garcez, W. S.; Yoshida, M.; Gottlieb, O. Benzylisoquinoline alkaloids and flavonols from
Ocotea vellosiana. Phytochemistry. 1995, 39, 815 – 816.
Geng Di; Li, D.; Shi, Y.; Liang, J.; Min, Z. A New Benzophenanthridine Alkaloid from
Zanthoxylum nitidum. Chin. J. Nat. Med.. 2009, 7, 274-277.
Global Biodiversity Information Facility: Biodiversity occurrence data, En: GBIF Data Portal.
Marzo 20, 2012, Disponible en: http://data.gbif.org/species/.
Gomes Heleno V. C.; da Silva R.; Pedersoli S.; Albuquerque S.; Bastos, J. K.; Andrade, M.
L.; Donate, P. M.; da Silva, J.; Callegari, J. L. Detailed 1H and 13C NMR structural
assignment of three biologically active lignan lactones. Spectrochimica Acta Part A. 2006, 63
234–239
212
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Gonzaga, W.A.; Weber, A.D.; Giacomelli, S.R.; Simionatto, E.; Dalcol, I.I.; Machado, E.C.;
Morel, A.F. Composition and antibacterial activity of the essential oils from Zanthoxylum
rhoiflium. Planta Med. 2003, 69, 773-775.
González-Coloma, A.; Reina, M.; Díaz, C. E.; Fraga, B. M. 2010. Natural Products-Based
Biopesticides for Insect Control. En: Comprehensive Natural Products II: Chemistry and
Biology, Volume 3: Development & Modification of Bioactivity. Lewis Mander y Hung Wen Liu
(Eds). Elsevier, Oxford: 3, 237 – 268.
Govindarajan, M. Chemical composition and larvicidal activity of leaf essential oil from
Clausena anisata (Willd.) Hook. f. ex Benth (Rutaceae) against three mosquito species. Asian
Pac. J. Trop. Med. 2010, 874-877.
Guerrini, A.; Sacchetti, G; Muzzoli, M; Moreno Rueda, G.; Medici, A.; Besco, E.; Bruni, R.
Composition of the Volatile Fraction of Ocotea bofo Kunth (Lauraceae) Calyces by GC-MS
and NMR Fingerprinting and Its Antimicrobial and Antioxidant Activity. J. Agric. Food Chem.
2006, 54, 7778 - 7788.
Gupta, R. C. 2006. Classification and uses of organophospates and carbamates. En:
Toxicology of Organophosphate & Carbamate Compounds. Ramesh C. Gupta (Ed). Elsevier.
USA.
Han, M. K.; Kim, S. I.;Ahn, Y. J. Insecticidal and antifeedant activities of medicinal plant
extracts against Attagenus unicolor japonicas (Coleoptera: Dermestidae). J. Stored Prod.
Res. 2006, 42, 15-22.
Haque, M. A.; Nakakita, H.; Ikenaga, H; Sota. N. Development-inhibititing activity of some
tropical plants against Sitophilus zeamais Motschulsky (Coleoptera: Curculionidae). J. Stor.
Prod. Res. 2000, 36, 281-87.
Bibliografía
213
Hasan, Md. M.; Todoriki, S.: Miyanoshita, A.; Imamura, T. Age- and time interval-specific
gamma radiation-induced DNA damage in adult maize weevils, Sitophilus zeamais
Motschulsky, assessed using comet assays. Mutat. Res.–Genetic Toxicol. Environ. Mutagen.
2012, 741, 95 – 100.
Herarth, H. M. T. B.; Dassanayake, R. S; Priyadarshani, A. M. A.; De Silva, S.; Wannigama,
G. P.; Jamie, J. Isoflavonoids and a pterocarpan from Gliricidia sepium. Phytochemistry.
1998, 47, 117 – 119.
Herrera, M. M. La familia Myristicaceae. Posibilidades de uso múltiple y sostenido en
bosques húmedos tropicales de Colombia. Tesis de grado en Biología. Universidad Nacional
de Colombia. Bogotá, 1994.
Hikino, H.; Hikino, Y.; Yosioka, I. Studies on the constituents of Antractylodes. IX. Structure
and Autoxidation of Atractylon. Chem. Pharm. Bull. 1964, 12, 755 – 760.
Hu, J.; Zhang, W.; Shen, Y.; Zhang a, C.; Xu, L.; Liu, R.; Wang, B.; Xu, X. Alkaloids from
Zanthoxylum nitidum (Roxb.) DC. Biochem. Syst .Ecol. 2007, 35,114-117.
Huang, Y.; Lam, S. L.; Ho, S. H. Bioactivities of essential oil from Elletaria cardamomum (L.)
Maton. to Sitophilus zeamais Motschulsky and Tribolium castaneum (Herbst). Journal of
Stored Products Research. 2000, 36, 107-117.
Huang, Y.; Tan, J. M. W. L.; Kini, R. M.; Ho, S. H. Toxic and Antifeedant Action of Nutmeg Oil
Against Tribolium castaneum (Herbst) and Sitophilus zeamais Motsch. J. stored Prod. Res.
1997, 33, 289-298.
Isman, M. B. Botanical Insecticides, Deterrents, and Repelents in Modern Agriculture and an
Increasingly Regulated World. Annu. Rev. Entomol. 2006, 51, 45-66.
Isman, M. B. Plant essential oils for pest and disease management. Crop Prot. 2000, 19, 603608.
214
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Ito, C.; Itoigawa, M.; Otsuka, T.; Tokuda, H.; Nishino, H.; Furukawa, H. Constituents of
Boronia pinnata. J. Nat. Prod. 2000, 63, 1344-1348.
Ito, A.; Shamon, L. A.; Yu, B.; Greenwood, E. M.; Lee, S. K.; van Breemen, R. B.; Mehta, R.
G.; Farnsworth, N. R.; Fong, H. H. S.; Pezzuto, J. M.; Kinghorn, A. D. Antimutagenic
constituents of Casimiroa edulis with potential cancer chemopreventive activity. J. Agric. Food
Chem. 1998, 46, 3509-3516.
J. de Pascual, T.; Barrero, A. F.; San Feliciano, A.; Grande, M.; Medarde, M. Kudtdiol, new
sesquiterpene alcohol from Jasonia glutinosa. Tetrahedron Lett. 1978, 43, 4141- 4144
Jagan-Mohan-Rao, L.; Yada, H.; Ono, H.; Yoshida, M. Acylated and Non-Acylated Flavonol
Monoglycosides from the Indian Minor Spice Nagkesar (Mammea longifolia). J. Agric. Food
Chem. 2000, 50, 3143 – 3146.
Jassbi, A. Secondary Metabolites as Stimulants and Antifeedants of Salix integra for the Leaf
Beetle Plagiodera versicolora. Z. Naturforsch. 2003, 58, 573-579.
Jiménez, G. Evaluación de la posible actividad insecticida del extracto de granos de
Chenopodium quinoa W. sobre Sitophilus oryzae L. en granos almacenados de maíz, arroz
y sorgo. Tesis de grado en Ingeniería Agronómica. Facultad de Agronomía, Universidad
Nacional de Colombia. Bogotá. 1995, pp 1-34.
Jiménez, J.M. Evaluación de la posible actividad insecticida de los extractos de Senna
spectabilis I. y de Ricinus communis L. sobre Sitophilus oryzae L. en maíz almacenado.
Tesis de grado en Ingeniería Agronómica. Facultad de Agronomía, Universidad Nacional de
Colombia. Bogotá, 1991.
Jinbo, Z., Mingan, W., Wenjun, W., Zhiqing, J., Zhaonong, H. Insecticidal sesquiterpene
pyridine alkaloids from Euonymus species. Phytochemistry. 2002, 61, 699-704.
Bibliografía
215
Jirovetz, L.; Buchbauer, G.; Fleischhacker, W.; Ngassoum, M. B. Analysis of Leaf Volatiles of
Zanthoxylum gilletii Used in Folk Medicine of Cameroon. Planta Med. 1999, 65, 181-183.
Jullianti, E.; Jang, K.; Lee, S.; Lee, D.; Mar, W.; Oh, K.; Shin, J. Sesquiterpenes from the
leaves of Laurus nobilis L. Phytochemistry 2012, 80, 70–76.
Jung, H.; Nurul, M.D.; Kwon, Y.; Jin, S.; Son, Y.; Park, J.; Sohn, H.; Choi, J. Extraction and
identification of three major aldose reductase inhibitors from Artemisia Montana. Food Chem.
Toxicol. 2011, 49, 376-384.
Kamsuk, K.; Choochote, W.; Chaithong, U.; Jitpakdi, A.; Tippawangkosol, P.; Riyong, D.;
Pitasawat, B. Effectiveness of Zanthoxylum piperitum-derived essential oil as an alternative
repellent under laboratory and field applications. Springer-Verlag. 2006.
Kather, H. F. Prospects of botanical biopesticides in insect pest management. Journal of
Applied Pharmaceutical Science. 2012, 2, 244 – 259.
Kaufman, P. B.; Kirakosyan, A.; McKenzie, M.; Dayanandan, P.; Hoyt, J. E.; Li , C. The Uses
of Plant Natural Products by Humans and Risks Associated with Their Use. En L. Cseke; A.
Kirakosyan; P. Kaufman; S. Warber; J. Duke; H. Brielmann, (Eds), Natural Products from
Plants. CRC Taylor & Francis. New York. 2006, pp. 442–468.
Kawanishi, K.; Takagaki, T.; Hashimoto, Y. Dihydrochalcones from Iryanthera sagotiana.
Phytochemistry. 1990, 29, 2735 -2736.
Keane, S.; Ryan, M. F. Purification, characterisation, and inhibition by monoterpenes of
acetylcholinesterase from the waxmoth, Galleria mellonella (L.). Insect Biochem. Molec. Biol.
1999, 29, 1097–1104.
Kétïa, S. M., Vincent, C., Schmit, J. P., Ramaswamy, S., Bélanger, A. Effect of various
essential oils on Callosobruchus maculates (F.) (Coleoptera: Bruchidae). J. Stor. Prod. Res.
2000, 36, 355-364.
216
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Khater, H. F. Prospects of botanical biopesticides in insect pestmanagement. J. App. Pharm.
Sci. 2012, 2, 244 – 259.
Killphos. Fosfuro de Aluminio. FAX México, S.A. (www.faxsa.com.mx/Fosf_MT/KillPhMT.pdf).
Consultada Marzo 20 de 2012.
Kim, J.; Park, I. K. Fumigant toxicity of Korean medicinal plant essential oils and components
from Asiasarum sieboldi root against Sitophilus oryzae L. Flavour Frag. J. 2008, 23, 79-83.
Kim, S. I.; Roh, J. Y.; Kim, D. H.; Lee, H. S.; Ahn, Y. J. Insecticidal activities of aromatic plant
extracts and essential oils against Sitophilus oryzae and Callosobruchus chinensis. J. Stored
Prod. Res. 2003, 39, 293-303.
Kim, J. S.; Kim, J. C.; Shim, S. H.; Lee, E. J.; Jin, W. Y.; Bae, K.; Son, K. H.; Kim, H. P.;
Kang, S. S.; Chang, H. W. Chemical Constituents of the Root of Dystaenia takeshimana and
Their Anti-Inflammatory Activity. Arch Pharm. Res. 2006, 29, 617-623.
Kim, S. I.; Yoon, J. S.; Jung, J. W.; Hong, K. B.; Ahn, Y. J.; Kwon, H. W. Toxicity and
repellency of origanum essential oil and its components against Tribolium castaneum
(Coleoptera: Tenebrionidae) adults. J. Asia Pacific Entomol. 2010, 13, 369–373.
Kordali, S.; Aslan, I.; Calmasur, O.; Cakir, A. Toxicity of essential oils isolated from three
Artemisia species and some of their major components to granary weevil, Sitophilus
granarius (L.) (Coleoptera: Curculionidae). Ind. Crop Prod. 2006, 23, 162–170.
Kordali, S.; Kesdek, M.; Cakir, A. Toxicity of monoterpenes against larvae and adults of
Colorado potato beetle, Leptinotarsa decemlineata Say (Coleoptera: Chrysomelidae). Ind.
Crop. Prod. 2007, 26, 278–297.
Bibliografía
217
Kostíc, I.; Petrovíc, O.; Milanovíc, S.; Popovíc, Z.; Stankovíc, S.; Todorovíc, G.; Kostic, M.
Biological activity of essential oils of Athamanta haynaldii and Myristica fragrans to gypsy
moth larvae. Ind. Crop. Prod. 2013, 41, 17–20.
Kostyukovsky, M.; Rafaeli, A.; Gileadi. C.; Demchenko, N.; Shaaya, E. Activation of
octopaminergic receptors by essential oil constituents isolated from aromatic plants: possible
mode of action against insect pests. Pest. Manag. Sci. 2002, 58, 1101–1106.
Koul, O. 2005. Insect Antifeedants. CRC Press, Bota Racon, FL. pp. 1 – 6.
Koul, O.; Walia, S.; Dhaliwal, G. S. Essential Oils as Green Pesticides: Potential and
Constraints. Biopestic. Int. 2008, 4, 63–84.
Krane, B. D.; Fagbule, M. O.; Shamma, M. The Benzophenanthridine Alkaloids. J. Nat. Prod.
1984, 47, 1-43.
Lamiri, A., Lhaloui, S., Benjilali, B., Berrada, M. Insecticidal effects of essential oils against
Hessian fly, Mayetiola destructor (Say). Field Crops Research. 2001, 71, 9-15.
Latif, Z., Hartley, T. G., Rice, M. J., Waigh, R. D., and Waterman P. G. Novel and Insecticidal
Isobutylamides from Dinospema erythrococca. J. Nat. Prod. 1998, 61, 614-619.
Lee, S. S.; Lin, H. C.; Chen, C. K. Acylated flavonol monorhamnosides, α-glucosidase
inhibitors, from Machilus philippinensis. Phytochemistry. 2008, 69, 2347 – 2353.
Lee, B. Y.; Anni, P. C.; Tumaalii, F.; Choi, W. S. Fumigant toxicity of essential oils from the
Myrtaceae family and 1,8-cineole against 3 major stored-grain insects. J. Stored Prod. Res.
2004, 40, 553–564.
Lee, B. Y.; Choi, W. S.; Lee, S. E.; Park, B. S. Fumigant toxicity of essential oils and their
constituent compounds towards the rice weevil, Sitophilus oryzae (L.). Crop Prot. 2001, 20,
317 – 320.
218
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Li, W. Sesquiterpene lactones from the root of Neolitsea acutotrinervia. J. Nat. Prod. 1992,
55(11), 1614-1619.
Li, Y.; Cheng, W.; Zhu, C.; Yao, C.; Xiong, L.; Tian, Y.; Wang, S.; Lin, S.; Hu, J.; Yang, Y.;
Guo. Y.; Yang, Y.; Li, Y.; Yuan, Y.; Chen, N.; Shi, J. Bioactive Neolignans and Lignans from
the Bark of Machilus robusta. J. Nat. Prod. 2011, 74, 1444–1452.
Liu, Z. L.; Ho, S. H. Bioactivity of the essential oil extracted from Evodia rutaecarpa Hook f. et
Thomas against the grain storage insects, Sitophilus zeamais Motsch and Tribolium
castaneum. J. Stor. Prod. Res. 1999, 35, 317-328.
Liu, S. L.; Tsai, I. L.; Ishikawa, T.; Harayama, T.; Chen, I. S. Bishordeninyl Terpene Al ka
loids from Zanthoxylum integrifoliolum. J.Chin.Chem.Soc. 2000, 47, 571–574.
Liu, Z. L., Xu, Y. J., Wu, J., Goh, S. H., Ho, S. H. Feeding Deterrents from Dictamnus
dasycarpus Turcz Against Two Stored-Product Insects. J. Agric. Food Chem. 2002, 50, 14471450.
Liu, Z.L.; Goh, S. H.; Ho, S. H. Screening of Chinese medicinal herbs for bioactivity against
Sitophilus zeamais Motschulsky and Tribolium castaneum (Herbst). J. Stored Prod. Res.
2007, 43, 290–296.
Liu, Z. L.; Chu, S. S.; Jiang, G. H. Feeding deterrents from Zanthoxylum schinifolium against
two stored-product insects. J. Agric. Food Chem., 2009, 57, 10130–10133.
Lock de Ugaz, O. Investigación Fitoquímica: Métodos en el estudio de productos
naturales.Primera Edición. Editorial Fondo. Lima-Perú.1988, pp. 31–34.
Lopes, N. P.; Kato, M. J.; de A. Andrade, E.H.; Maia, J. G. S.; Yoshida, M.; Planchart, A. R.;
Katzin, A. M. Antimalarial use of volatile oil from leaves of Virola surinamensis (Rol.) Warb. by
Waiãpi Amazon Indians. J. Ethnopharm. 1999, 67, 313–319.
Bibliografía
219
Lopes, N. P.; Kato, M. J.; de Aguiar Andrade, E.H.; Soares, J. G.; Yoshida, M. Circadian and
seasonal variation in the essential oil from Virola surinamensis leaves. Phytochemistry. 1997,
46, 689-693.
López, H.; Valera, A.; Trujillo, J. Lignans from Ocotea foetens. J. Nat. Prod., 1995, 58, 782785.
López, M. D. Toxicidad Volátil de Monoterpenoides y Mecanismos Bioquímicos en Insectos
Plaga del Arroz Almacenado. Tesis de Doctorado, Departamento de Química Agrícola,
Geología y Edafología, Facultad de Química, Universidad de Murcia, Murcia. 2008. pp. 27–
32.
López, M.D.; Jordán, M. J.; Pascual-Villalobos, M. J. Toxic compounds in essential oils of
coriander, caraway and basil active against stored rice pests. J. Stored Prod. Res. 2008, 44,
273-278.
López, M.D.; Pascual-Villalobos, M.J. Mode of inhibition of acetylcholinesterase by
monoterpenoids and implications for pest control. Ind. Crop. Prod. 2010, 31, 284–288.
Lord, J. C. Desiccation increases the efficacy of Beauveria bassiana for stored-grain pest
insect control. J. Stored Prod. Res. 2007, 43, 535-539.
Lordello, A. L. L.; Yoshida, M. Neolignans from leaves from Ocotea catharinensis Mez
(Lauraceae). Phytochemistry, 1997, 46, 741-744.
Lorenzo, D.; Loayza, I.; Leigue, L.; Frizzo, C.; Dellacassa, E.; Moyna, P. Asaricin, the Main
Component of Ocotea opifera Mart. Essential Oil. Nat. Prod. Lett. 2001, 15, 163-170.
Maiti, M., Kumar, G. S. Biophysical Aspects and Biological Implications of the Interaction of
Benzophenanthridine Alkaloids with DNA. Biophysical Reviews and Letters, 2009, 1, 119129.
220
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Maiti, M.; Kumar, G. S. Molecular Aspects on the Interaction of Protoberberine,
Benzophenanthridine, and Aristolochia Group of Alkaloids with Nucleic Acid Structures and
Biological Perspectives. Med. Care Res. Rev. 2007, 27, 649-695.
Marques, R.; Batistuzzo, S.; Silva, C.; Barbosa, J.; Fassarella, L. Evaluation of the mutagenic
potential of yagambin and of the hydroalcoholic extract of Ocotea duckei by the Ames test.
Mutation Research / Genetic Toxicology and Environmental Mutagenesis 2003, 536, 117120.
Márquez, R., Rosa, C., Mercado, A. Actividad antifúngica del extracto total en etanol de las
hojas frescas de Pedilanthus tithymaloides L Poit (Ultimorrial). Scientia et Technica. 2007, 13,
155-159.
Marr, K. L.; Tang, C. S. Volatile Insecticidal Compounds and Chemical Variability of Hawaiian
Zanthoxylum Rutaceae Species. Biochem.System.Ecol. 1992, 20, 209-217.
Martínez, J. C. Distribution of flavonoids in the Myristicaceae. Phytochemistry. 2000, 55, 505–
511.
Martínez, J.C.; Cuca, L.E. Dihidrochalcona en Corteza de Iryanthera laevis. Revista
Colombiana de Química.1989, 18, 37 - 46.
Martínez-Valenzuela, C.; Gómez-Arroyo, S. Riesgo genotóxico por exposición a plaguicidas
en trabajadores agrícolas. Rev. Int. Contam. Ambient. 2007, 23, 185-200.
Matthes, H. W. D.; Luu, B.; Ourisson, G. Cytotoxic components of Zingiber zerumbet,
Curcuma zedoaria and C. domestica. Phytochemistry. 1980, 19, 2643 – 2650.
Matu, E. N.; Staden, J. Antibacterial and Anti-inflammatory Activities of Some Plants Used for
Medicinal Purposes in Kenya. J. Nat. Prod. 2003, 87, 35-41.
Bibliografía
221
Melo, M. F. F.; Zickel, C. S. Os Gêneros Zanthoxylum L. e Esenbeckia Kunth (Rutaceae) no
Estado de Pernambuco, Brasil. Acta Bot. Bras. 2004, 18, 73-90.
Menichini, F.; Tundis, R.; Loizzo, M. R.; Bonesi, M.; Marrelli, M.; Statti, G. A.; Menichini, F.;
Conforti, F. Acetylcholinesterase and butyrylcholinesterase inhibition of ethanolic extract and
monoterpenes from Pimpinella anisoides V Brig. (Apiaceae). Fitoterapia. 2009, 80, 297 –
300.
Menut, C.; Bessière, J. M.; Hassani, M. S.; Buchbauer, G.; Schopper, B. Chemical and
biological studies of Ocotea comoriensis bark essential oil. Flavour Fragr. J. 2002, 17, 459–
461.
Mikkelsen, S. R.; Cortón, E. 2004. Bioanalytical Chemistry. Wiley Interscience, John Wiley &
Sons, INC. pp. 16 – 38.
Miles, D. H., Ly, A. M., Randle, S. A., Hedin, P. A., Burks, M. L. Alkaloidal Insect Antifeedants
from Virola calophylla Warb. J. Agric. Food Chem. 1987, 35, 794-797.
Ming, D. S.; López, A.; Hillhouse, B. J.; French, C. J.; Hudson, J. B.; Neil, G. H. Bioactive
Constituents from Iryanthera megistophylla. J. Nat. Prod. 2002, 65, 1412-1416.
Mishra, K.; Sharma, R. C. Assessment of organochlorine pesticides in human milk and risk
exposure to infants from North-East India. Sci. Total Envron. 2011, 409, 4939 – 4949.
Miyazawa, M.; Yamafuji, C. Inhibition of Acetylcholinesterase Activity by Bicyclic
Monoterpenoids. J. Agric. Food Chem. 2005, 53, 1765-1768.
Moccelini, S. K., da Silva, V. C., Ndiaye, E. A., de Sousa, P. T., Vieira, P. CEstudo
Fitoquímico das Cascas das Raízes de Zanthoxylum rigidum Humb. & Bonpl. Ex Willd
(Rutaceae). Quimica Nova, 2009, 32, 131-133.
222
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Morais, L. C. S. L.; Barbosa-Filho, J. M.; Almeida, R. N. Central depressant effects of
reticuline extracted from Ocotea duckei in rats and mice. J. Ethnopharmacol. 1998, 62, 57-61.
Moreira, M. D.; Picanço, M. C.; de Almeida Barbosa, L. C.; Carvalho, R. N.; Ribeiro de
Campos, M.; Silva, G. A.; Martins, J. C. Plant compounds insecticide activity against
Coleoptera pests of stored products. Pesq. agropec. bras., Brasília, 2007, 42, 909-915.
Morimoto, M., Tanimoto, K., Nakano, S., Osaki, T., Nakano, A., Komai, K. Insect Antifeedant
Activity of Flavones and Chromones against Spodoptera lituria. J. Agric. Food Chem. 2003,
51, 389-393.
Moura, N. F.; Strapazzon, J.; Loro, F.;Morel, A. F.; Flach, A. Composition of the leaf oils of
Rutaceae: Zanthoxylum hyemale A. St. Hill. Z. rhoifolium Lam. and Z. rugosum A. St Hill et.
Tul. J. Essent. Oil Res. 2006, 18, 4-5.
Mulvena, D.; Webb, E. C.; Zerner, B. 3,4-dihydroxybenzaldehyde, a fungistatic substance
from green Cavendish bananas. Phytochemistry. 1969, 8, 393-395.
Murai, Y.; Kokubugata, G.; Yokota, M.; Kitajima, J.; Iwashina, T. Flavonoids and anthocyanins
from six Cassytha taxa (Lauraceae) as taxonomic markers. Biochem. Syst. Ecol. 2008, 36,
745 – 748.
Murray, R.D.H., Méndez, J., Brown, S.A. The Natural Coumarins. Ocurrence, Chemistry and
Biochemistry. John Wiley & Sons LTD. 1982, pp. 343-345
Navarrete, A. y Hong. E. Anthelmintic properties of α-sanshool from Zanthoxylum
liebmannianum. Planta Med. 1996, 62, 250-251.
Navarro, S. New global challenges to the use of gaseous treatments in stored products. 9th
International Working Conference on Stored Product Protection. 2006. 495-509.
Bibliografía
223
Negahban, M.; Moharramipour, S.; Sefidkon, F. Chemical Composition and Insecticidal
Activity of Artemisia scoperte Essential Oil against Three Coleopteran Stored-Product
Insects. J. Asia-Pacific Entomol. 2006, 9, 381-388.
Negahban, M.; Moharramipour, S.; Sefidkon, F. Fumigant toxicity of essential oil from
Artemisia sieberi Besser against three stored-product insects. J. Stored Prod. Res. 2007, 43,
123–128.
Nehme, C., Moraes, P., Cavalheiro A. Intrapopulational variability of styrylpyrones in leaves of
Cryptocarya moschata Nees (Lauraceae) from Carlos Botelho State Park. Biochem. Syst.
Ecol. 2002, 30, 613-616.
Nelson, D. L.; Cox, M. M. 2004. Lenhinger Principles of Biochemistry. 4a edición. Editorial
Omega. pp. 191 – 225.
Nerio, L. S.; Olivero-Verbel, J.; Stashenko, E. Repellent activity of essential oils: A review.
Bioresource Technol. 2010, 101, 372-378.
Nerio, L. S.; Olivero-Verbel, J.; Stashenko, E. Repellent activity of essential oils from seven
aromatic plants grown in Colombia against Sitophilus zeamais Motschulsky (Coleoptera). J.
Stored Prod. Res. 2009, 45, 212 – 214.
Newman, D. J.; Cragg, G. M.; Natural Products as Sources of New Drugs over the Last 25
Years. J. Nat. Prod., 2007, 70, 461–477.
Ngassoum, M. B.; Essia-Ngang, J. J.; Tatsadjieu, L. N; Jirovetz, L.; Buchbauer, G.; Adjoudji,
O. Antimicrobial Study of Essential Oils of Ocimun gratissimum Leaves and Zanthoxylum
xanthoxyloides Fruits from Cameroon. Fitoterapia. 2003, 74, 284-287.
Nonanka, G. I.; Nishioka, I. Tanins and related compounds, VII. Phenylpropanoid-substituted
Epicatechins, Cinchonains from Cinchona succirubra. Chem. Pharm. Bull. 1982, 30, 4268 –
4276.
224
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
NUVAN® 50 EC. www.ceba.com.co/novartis.htm (Consultada el 20 de Abril de 2012).
Nyangulu, J. M.; Hargreaves, S. L.; Sharples, S. L.; Mackay, S. P.; Waigh, R. D.; Duval, O.;
Mberu, E. K.; Watkins, W. M. Antimalarial Benzo[c]phenanthridines. Bioorg. Med. Chem. Lett.
2005, 15, 2007-2010.
Ogendo, J.O.; Kostyukovsky, M.; Ravid, U.; Matasyoh, J.C.; Deng, A.L.; Omolo, E.O.; Kariuki,
S.T.; Shaaya, E. Bioactivity of Ocimum gratissimum L. oil and two of its constituents against
five insect pests attacking stored food products. J. Stored Prod. Res. 2008, 44, 328–334.
Ohno, T.; Nagatsu, A.; Nakagawa, M.; Inoue, M.; Li, Y.; Minatoguchi, S.; Mizukamie, H.;
Fujiwara, H. New sesquiterpene lactones from water extract of the root of Lindera
strychnifolia with cytotoxicity against the human small cell lung cancer cell, SBC-3.
Tetrahedron Lett. 2005, 46, 8657–8660.
Okunade, A. L., Wiemer, D. F. (-)-Loliolide, an Ant-repellent compound from Zanthoxylum
setulosum. J. Nat. Prod. 1985, 48, 472-473.
Omar. S., Marcotte, M., Fields, P., Sanchez, P. E., Poveda, L., Mata, R., Jimenez, A., Durst,
T., Zhang, J., MacKinnon, S., Leaman, D., Arnason, J. T., Philogéne, B. J. R. Antifeedant
activities of terpenoids isolated from tropical Rutales. J. Stor. Prod. Res. 2007, 43, 92-96.
Orhan, I.; Aslan, S.; Kartal, M.; Sener, B.; Baser, K. H. C. Inhibitory effect of Turkish
Rosmarinus officinalis L. on acetylcholinesterase and butyrylcholinesterase enzymes. Food
Chem. 2008, 108, 663 – 668.
Oyedele, A.O., Gbolade, A.A., Sosan, M.B., Adewoyin, F.B., Soyelu, O.L., Orafidiya, O.O.
Formulation of an effective mosquito-repellent topical product from Lemongrass oil.
Phytomedicine. 2002, 9, 259–262.
Bibliografía
225
Ozturk, M. Anticholinesterase and antioxidant activities of Savoury (Satureja thymbra L.) with
identified major terpenes of the essential oil. Food Chem. 2012, 134, 48 – 54.
Pabón, L. C.; Cuca, L. E. Aporphine alkaloids from Ocotea macrophylla (LAURACEAE).
Quim. Nova. 2010, 33, 875-879.
Pabón, L.C. Estudio químico del tallo y volátiles de las hojas de Ocotea macrophylla
(Lauraceae) y evaluación de actividad biológica. Tesis de Maestría. Departamento de
Química. Universidad Nacional de Colombia, Bogotá. 2009, pp. 6 – 11.
Padín, S.; Dal Bello, G.; Fabrizio, M. Grain loss caused by Tribolium castaneum, Sitophilus
oryzae and Acanthoscelides obtectus in stored durum wheat and beans treated with
Beauveria bassiana. J. Stored Prod. Res. 2002, 38, 69-74.
Palomino, E., Maldonado, C., Kempff, M., Ksebati, M., Caparratriene, an Active
Sesquiterpene Hydrocarbon from Ocotea caparrapi. J. Nat. Prod. 1996, 59 pp 77–79.
Papachristos, D.P.; Stamopoulos, D. C. Repellent, toxic and reproduction inhibitory effects of
essential oil vapours on Acanthoscelides obtectus (Say) (Coleoptera: Bruchidae). J Stored
Prod Res. 2002, 38, 117-128.
Park, I. K., Lee, H. S., Lee, S. G., Park, J. D., Ahn, Y. J. Insecticidal and Fumigant Activities
of Cinnamomum cassia Bark-Derived Materials against Mechoris ursulus (Coleoptera:
Attelabidae). J. Agric. Food Chem. 2000, 48, 2528-2531.
Park, I. K.; Lee, S. G.; Choi, D. H.; Park, J. D.; Ahn, Y. J. Insecticidal activities of constituents
identified in the essential oil from leaves of Chamaecyparis obtuse against Callosobruchs
chinensis (L.) and Sitophilus oryzae (L.). J. Stored. Prod. Res. 2003, 39, 375-384.
Park, I.K.; Kim, J. N.; Lee, Y. S.; Lee, S. G.; Ahn, Y. J.; Shin, S. C. Toxicity of Plant Essential
Oils and Their Components Against Lycoriella ingenua (Diptera: Sciaridae). J. Econ. Entomol.
2008, 101, 139-144.
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
226
Pascual-Villalobos, M. J. (1996). Plaguicidas naturales de origen vegetal: Estado actual de la
investigación. Ministerio de Agricultura, Pesca y Alimentación – Instituto Nacional de
Investigación y Tecnología Agraria y Alimentaria (INIA). Madrid, España. p.p. 6-18.
Pascual-Villalobos, M. J.; Ballesta-Acosta, M. C.; Soler, A. Toxicidad y repelencia de aceites
esenciales en plagas de almacén del arroz. Bol. San. Veg. Plagas. 2004, 30, 279-286.
Patiño, O. J. Estudio Fitoquímico Parcial de Zanthoxylum quinduensis (Rutaceae). Tesis de
grado, Departamento de Química, Universidad Nacional de Colombia, Bogotá. 2004. pp. 256.
Patiño, O. J., Cuca, L. E. Monophyllidin, a New Alkaloid L-Proline Derivative from
Zanthoxylum monophyllum (Rutaceae). Phytochem. Lett. 2011, 4, 22-25.
Patiño, O. J., Cuca, L. E. Isoquinoline Alkaloids of Zanthoxylum quinduense (Rutaceae).
Biochemical Systematic and Ecology, 2010, 38, 853-856.
Patiño, O. J.; Cuca, L. E. Chemical constituents of the wood from Zanthoxylum quinduense
tul. (Rutaceae). Quim. Nova. 2010, 33, 1019-1021.
Patiño, O. J.; Prieto, J. A.; Cuca, L. E. Zanthoxylum Genus as Potential Source of Bioactive
Compounds. In: Bioactive Compounds in Phytomedicine,. Iraj Rasooli (Ed.), InTech, 2012,
p.p.
185-210.
Disponible
en:
http://www.intechopen.com/books/bioactive-compounds-in-
phytomedicine/zanthoxylum-genus-as-potential-source-of-bioactive-compounds.
Pavela, R. Insecticidal and repellent activity of selected essential oils against of the pollen
beetle, Meligethes aeneus (Fabricius) adults. Ind. Crop. Prod. 2011, 34, 888– 892.
Pereira, J.; Gottlieb, O.; Yoshida, M. 10-Desmethyl- 1-methyl-eudesmanes from Ocotea
corymbosa. Phytochemistry. 1995, 39(4), 849-852.
Bibliografía
227
Perry, N. S. L.; Houghton, P. J.; Jenner, P.; Keith, A.; Perry, E. K. Salvia lavandulaefolia
essential oil inhibits cholinesterase in vivo. Phytomedicine. 2002, 9, 48 – 51.
Philogéne, B. J. R.; Regnault-Roger, C.; Vincent, C. 2003. Productos fitosanitarios
insecticidas de origen vegetal: promesas de ayer y de hoy. En: Biopesticidas de Origen
Vegetal. Philogéne, B. J. R.; Regnault-Roger, C.; Vincent, C. (Eds). Ediciones Mundi-Prensa,
España.
Pino, J. A.; Agüero , J.; Marbot R.; Fernandes, P. Composition of the Essential Oil of
Zanthoxylum fagara (L.) Sargent. from Cuba. J. Essent. Oil Res. 2005, 17, 413-414.
Pino, J. A.; Fernandes, P.; Marbot, R.; Fontinha, S. S. Chemical Composition of the Leaf Oil
of Ocotea foetens (Alt.) Benth. et Hook. From Madeira. J. EssenT. Oil Res. 2004, 16, 131132.
Pitasawat, B.; Champakaew, D.; Choochote, W.; Jitpakdi, A.; Chaithong, U.; Kanjanapothi,
D.; Rattanachanpichai, E.; Tippawangkosol, P.; Riyong, D.; Tuetun, B.; Chaiyasit, D. Aromatic
plant-derived essential oil: An alternative larvicide for mosquito control. Fitoterapia. 2007, 78,
205-210.
Prieto, J. A.; Pabón, L. C.; Patiño, O. J.; Delgado, W. A.; Cuca, L. E. Constituyentes
químicos, actividad insecticida y antifúngica de los aceites esenciales de hojas de dos
especies colombianas del género Ocotea (Lauraceae). Rev. Colomb. Quim. 2010, 39, 199–
209.
Prieto, J. A.; Patiño, O. J.; Pabón, L. C.; Delgado, W. A.; Cuca, L. E.; Ávila, M. C. Evaluación
De Actividad Fumigante De Aceites Esenciales Como Alternativa Para El Control Del Gorgojo
Del Arroz. Biotecnología en el Sector Agropecuario y Agroindustrial. 2009, Memorias X
Congreso Colombiano de Fitoquímica, pp. 54 – 55.
Pungitore, C. R.; García, M.; Gianello, J. C.; Tonn, C. E.; Sosa, M. E. Lethal and sublethal
effects of triterpenes from Junellia aspera (Verbenaceae) on the grain storage insect
228
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Tribolium castaneum (Coleoptera: Tenebrionidae). Rev. Soc. Entomol. Argent. 2005, 64, 4551.
Queiroz, E. F.; Hay, A.-E.; Chaaib, F.; Diemen, D.; Diallo, D.; Hostettmann, K. New and
Bioactive Aromatic Compouns from Zanthoxylum xanthoxyloides. Planta Med. 2006, 72, 746750.
Rahman, M. M.; Islam, M. A.; Khondkar, P.; Gray, A. I. Alkaloids and Lignans from
Zanthoxylum budrunga (Rutaceae). Biochem. Syst. Ecol. 2005, 33, 91-96.
Rajendran, H.; Hajira, K. M. Insect infestation in stored animal products. J. Stored Prod. Res.
2005, 41, 1-30.
Rajendran, S., Sriranjini, V. Plant products as fumigants for strored-product insect control. J.
Stor. Prod. Res. 2008, 44, 126-135.
Rajkumar, S.; Jebanesan, A. Chemical composition and larvicidal activity of leaf essential oil
from Clausena dentata (Willd) M. Roam. (Rutaceae) against the chikungunya vector, Aedes
aegypti Linn. (Diptera: Culicidae). J. Asia Pacific Entomol. 2010, 13, 107–109.
Ramírez, J. A.: Lascaña, M. Plaguicidas: clasificación, uso, toxicología y medición de la
exposición. Arch. Prev. Riesgos Labor. 2001, 4, 67-75.
Rattan, R. S. Mechanism of action of insecticidal secondary metabolites of plant origin. Corp.
Prot. 2010, 29, 193 – 920.
Rees, D. Insects of Stored Products. CSIRO Publishing. 2004, p.p. 1-3, 46-51,114-119.
Regnault-Roger, C. The potencial of botanical essential oils for insect pest control. Integrated
Pest Management Reviews. 1997, 2, 25-34.
Bibliografía
229
Regnault-Roger, C.; Hamraoui, A. Fumigant toxic activity and reproductive inhibition induced
by monoterpenes on Acanthoscelides obtectus (Say) (Coleoptera), a bruchid of kidney bean
(Phaseolus vulgaris L.). J. Stored Prod. Res. 1995, 31: 291-299.
Rippegur, H., Sung, T., Adam, G. Neolignans and sesquiterpene from Caryodaphnosis
tonkinensis. Phytochemistry. 1996, 42, 1167-1169.
Rodríguez-Saona, C. R., Maynard, D. F., Phillips, S., Trumble, J. T. Alkylfurans: Effects of
Alkyl Side-Chain Length on Insecticidal Activity. J. Nat. Prod. 1999, 62, 191-193.
Roque, N. The chemistry of Brazilian Lauraceae. Part L. The structure of ocotealactol, a new
eudesmanolide. Revista latinoamericana de química. 1978, 9, 25 – 27.
Roslund, M. U.; Tähtinen, P.; Niemitz, M.; c and Sjöholm, R. Complete assignments of the 1H
and 13C chemical shifts and JH,H coupling constants in NMR spectra of D-glucopyranose
and all D-glucopyranosyl-D-glucopyranosides. Carbohyd. Res. 2008, 343, 101–112.
Ross, S. A.; Sultana, G. N.; Burandt, C. L.; ElSohly, M. A.; Marais, J. P.; Ferreira, D.
Syncaparmide, a New Antiplasmodial (+)-Norepinephrine Derivative from Zanthoxylum
syncarpum. J. Nat. Prod. 2004, 67, 88-90.
Rossi, M. H.; Yoshida, M.; Soares Maia, J. G. Neolignans, styrylpyrones and flavonoids from
an Aniba species. Phytochemistry. 1997, 45, 1263 – 1269.
Rowher, J. 1993. Lauraceae. En: The families and genera of vascular plants II. Flowering
plants-Dycotiledons, Kubitzki, K., Rowher, J.G. y Bittrich, V. (Eds). Springer-Verlag. Berlin,
45-65.
Ryan, M. K.; Byrne, O. Plant-insect coevolution and inhibition of acetylcholinesterase. J.
Chem. Ecol. 1988, 14, 1965–1975.
230
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Saadali, B., Boriky, D., Blaghen, M., Vanhaelen, M., Talbi, M. Alkamides from Artemisia
dracunculus. Phytochemistry. 2001, 58, 1083-1086.
Salazar, L.M.; Cuca, L.E.; Martínez, J.C.1,3-Diarilpropanos en Madera de Iryanthera tricornis.
Revista Colombiana de Química. 1988,17, 23 - 37.
Saquib, Q. N.; Hui, Y.-H.; Anderson, J. E.; Mclaughlin, J. L. Bioactive Furanocoumarins from
the Berries of Zanthoxylum americanum. Phytotherapy Res. 1990, 4, 216-219.
Sauquet, H. Systematic revision of Myristicaceae (Magnoliales) in Madagascar, with four new
species of Mauloutchia. Bot. J. Linn. Soc. 2004, 146, 351–368.
Sauquet, H.; Doyle, J. A.; Scharaschkin, T.; Thomas, B.; Hilu, K. W.; Chatrou, L.W.; Thomas,
A. L. Phylogenetic analysis of Magnoliales and Myristicaceae based on multiple data sets:
implications for character evolution. Bot. J. Linn. Soc. 2003, 142, 125–186.
Schardl, C., Grossman, R., Nagabhyru, P., Faulkner, J., Mallik, U. Loline alkaloids:
Currencies of mutualism. Phytochemistry. 2007, 68, 980-996.
Schöler, M.; Prozell, S.; Al-Kiishi, A. G.; Reichmuth, CH. Towards biological control as a
major component of integrated pest management in stored product protection. J. Stored Prod.
Res. 1997, 33, 81-97.
Schultz, D., Olsen, C., Cobbs, G., Stolowich, N., Parrott, M. Bioactivity of Anacardic Acid
against Colorado Potato Beetle (Leptinotarsa decemlineata) Larvae. J. Agric. Food Chem.
2006, 54, 7522-7529
Scott, I. M.; Jesen, H. R.; Philogené, B. J. R.; Arnason, J. T. A review of Piper spp.
(Piperaceae) phytochemistry, insecticidal activity and mode of action. Phytochem. Rev. 2008,
7, 65–75.
Bibliografía
231
Seidemann, J. World Spice Plants: Economic Usage, Botany, Taxonomy. Springer-Verlag,
Berlin. 2005, p.p 399-402.
Setzer, W. N.; Schmidt, J. M.; Eiter, L. C.; Haber, W. A. The Leaf Oil Composition of
Zanthoxylum fagara (L.) Sarg. from Monteverde, Costa Rica, and its Biological Activities. J. of
Essent. Oil Res. 2005, 17, 333-335.
Shaaya, E.; Kostjukovski, M.; Eilberg, J.; Sukprakarn, C. Plant Oils as Fumigants and Contact
Insecticides for the Control of Stored-product Insects. J. stored Prod. Res. 1997, 33, 7-15.
Sheen, W. S.; Tsai, I. L.; Teng, C. M.; Chen, I. S. Nor-neolignan and phenyl propanoid from
Zanthoxylum ailanthoides. Phytochemistry. 1994, 36, 213-215.
Sheen, W. S.; Tsai, I. L.; Teng, C. M.; Ko, F. N.; Chen, I.-S. Indolopyridoquinazoline Alkaloids
with Antiplatelet Aggregation Activity from Zanthoxylum integrifoliolum. Planta Med. 1996, 62,
175-176.
Shieh, H. L.; Cordell, G. A.; Lankin, J. D. C.; Lotter, H. The Liquid, Solid, and Molecular Force
Field Calculated Conformations of Savinin. J. Org. Chem. 1990,55, 5139-5145
Siciliano, T., De Leo, M., Bader, A., De Tommasi, N., Vrieling, K., Braca, A., Morelli, I.
Pyrrolizidine alkaloids from Anchusa strigosa and their antifeedant activity. Phytochemistry.
2005, 66, 1593-1600.
Silva, I.; Barbosa, J; Silva, M.; Lacerda, C.; da-Cunha, E. Coclaurine from Ocotea duckei.
Biochem. Syst. Ecol. 2002, 30, 881-883.
Silva, L. L.; Paoli, A. A. S. Caracterizacaò Morfo-Anatômica da Semente de Zanthoxylum
rhoifolium Lam.-Rutaceae. Revista Brasileira de Sementes. 2000, 22, 250-256.
Silverstein R.; F.Webster, 1996. Spectrometric identification of organic compounds. Sixth
edición, John Wiley & Sons, Inc. New York, pp. 200-202.
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
232
Simeón, S.; Rios, J. L., Villar, A. Pharmacological Activities of Benzophenanthridine and
Phenanthrene Alkaloids. Pharmazie. 1989, 44, 593-597.
Slaninová,
I.;
Táborská,
E.;
Bochořáková
H.;
Slanina,
J.
Interaction
of
Benzo[c]phenanthridine and Protoberberine Alkaloids with Animal and Yeast Cells. Cell
Biol.Toxicol. 2001, 17, 51-63.
Soliman, F. M.; Shehata, A. H.; Khaleel, A. E.; Ezzat, S. M. An Acylated Kaempferol
Glycoside from Flowers of Foeniculum vulgare and F. Dulce. Molecules. 2002, 7, 245 – 251.
Sosa, M. E.; Lancelle, H. G.; Tonn, C. E.; Andres, M. F.; Gonzalez-Coloma, A. Insecticidal
and nematicidal essential oils from Argentinean Eupatorium and Baccharis spp. Biochem.
Syst. Ecol. 2012, 43, 132 – 138.
Sosa, M., Tonn, C. Plant secondary metabolites from Argentinean semiarid lands: bioactivity
against insects. Phytochem. Rev. 2008, 7, 3-24.
Spitaler, R.; Schlorhaufer, P.D.; Ellmerer, E.P.; Merfort, I.; Bortenschlager, S.; Stuppner, H.;
Zidorn, C. Altitudinal variation of secondary metabolite profiles in flowering heads of Arnica
montana cv. ARBO. Phytochemistry. 2006, 67, 409-417.
Stefanazzi, N. Aceites esenciales, una herramienta alternativa en el manejo integrado de
plagas de grano almacenado. Tesis de Doctorado, Universidad Nacional del Sur, Bahía
Blanca – Argentina. 2010, pp. 5 – 8; pp. 29 – 62.
Strand, J. F. Some Agrometeorological Aspects of Pest and Disease Management for the
21st Century. Agr. Forest Meteorol. 2000, 103, 73-82.
Sumioka, H.; Harinantenaina, L.; Matsunami, K.; Otsuka, H.; Kawahata, M.; Yamaguchi, K.
Linderolides A–F, eudesmane-type sesquiterpene lactones and linderoline, a germacrane-
Bibliografía
233
type sesquiterpene from the roots of Lindera strychnifolia and their inhibitory activity on NO
production in RAW 264.7 cells in vitro. Phytochemistry. 2011, 72, 2165–2171.
Sun, L. X.; Fu, W. W.; Ren, J.; Xu, L.; Bi, K. S.; Wang, M. W. Cytotoxic Constituents from
Solanum Lyratum. Arch Pharm Res., 2006, 29, 135-139.
Taborda, M. E.; Cuca, L. E. Un Nuevo Alcaloide Carbazólico de Zanthoxylum rhoifolium.
Scientia et Technica. 2007, 13, 191-192.
Taiz, L.; Zeiger, E., Plant Physiology, 3ª ed., Sinauer Associates, Inc. Publishers Sunderland,
Massachusetts, EE.UU., 2002, pp.283-307.
Takaku, S.; Haber, W.; Setzer, W. Leaf essential oils composition of 10 species of Ocotea
(Lauraceae) from Monteverde, Costa Rica. Biochem. Syst. Ecol. 2007, 35, 525-532.
Talontsi, F. M.; Matasyoh, J. C.; Ngoumfo, R. M.; Chepkorir, R. Mosquito larvicidal activity of
alkaloids from Zanthoxylum lemairei against the malaria vector Anopheles gambiae. Pestic.
Biochem. Physiol. 2011, 99, 82-85.
Tang, W.; Hemm, I.; Bertram, B. Recent Development of Antitumor Agents from Chinese
Herbal Medicines; Part I. Low Molecular Compounds. Planta Med. 2003, 69, 97-108.
Taylor, C. M.; Devia, W. La familia de árboles tropicales Myristicaceae en el departamento
del Valle del Cauca, Colombia. Biotta Colombiana, 2000, 1, 106–108.
Tewary, D. K., Bhardwaj, A., Sharma, A., Sinha, A. K., Shanker, A. Bioactivity and structure–
activity relationship of natural methoxylated phenylpropenes and their derivatives against
Aphis craccivora Koch (Hemiptera: Aphididae). J. Pest. Sci. 2006, 79, 209-214.
Tillequin, F. Rutaceous Alkaloids as Models for the Design of Novel Antitumor Drugs.
Phytochem. Rev. 2007, 6, 65-70.
234
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Tilley, D. R.; Casada, M. E.; Arthur, F. H. Heat treatment for disinfestation of empty grain
storage bins. J. Stored Prod. Res. 2007, 43, 221 – 228.
Tiwary, M.; Naika, S.N.; Tewary, D. K.; Mittal, P.K., Yadav, S. Chemical composition and
larvicidal activities of the essential oil of Zanthoxylum armatum DC (Rutaceae) against three
mosquito vectors. J. Vect. Borne. Dis. 2007, 44, 198-209.
Tolleson, W. H.; Doerge, D. R.; Churchwell, M. I.; Marques, M. M.; Roberts, D. W.
Metabolism of Biochanin A and Formononetin by Human Liver Microsomes in Vitro. J. Agric.
Food Chem. 2002, 50, 4783 – 4790.
Tringali, C., Spatafora, C., Calí, C., Simmonds, M. Antifeedant constituents from Fagara
macrophylla. Fitoterapia. 2001, 72, 538-543.
Tsai, I.-L., Lin, W.-Y., Teng, C.-M., Ishikawa, T., Doong, S.-L., Huang, M.-W., Chen, Y-C.,
Chen, I.-S. Coumarins and Antiplatelet Constituents from the Root Bark of Zanthoxylum
schinifolium. Planta Medica, 2000, 66, 618-623.
Udo, I. O. Potentials of Zanthoxylum xanthoxyloides (LAM.) for the control of stored product
insect pests. Journal of Stored Products and Postharvest Research. 2011, 2, 40-44.
Ukeh, D. A.; Birkett, M. A.; Pickett, J. A.; Bowman, A. S.; Mordue Luntz, A. J. Repellent
activity of alligator pepper, Aframomum melegueta, and ginger, Zingiber officinale, against the
maize weevil, Sitophilus zeamais. Phytochemistry. 2009, 70, 751–758.
Vadivambal, R.; Jayas, D. S.; White, N. D. G. Wheat disinfestation using microwave energy.
J. Stored Prod. Res. 2007, 43, 508 – 514.
Van der Werff.H. New species of Lauraceae from Ecuador and Perú. Ann. Missouri. Bot.
Gard, 1991, 78, 377-387.
Bibliografía
235
Vayias, B. J.; Athanassiou, C. G. Factors affecting the insecticidal efficacy of the
diatomaceous earth formulation SilicoSec against adults and larvae of the confused flour
beetle, Tribolium confusum DuVal (Coleoptera: Tenebrionidae). Crop Prot. 2004, 23, 565–
573.
Wan, C. Harrington, P. B. Screening GC-MS data for carbamate pesticides with temperatureconstrained–cascade correlation neural networks. Anal. Chim. Acta. 2000, 408, 1-12.
Wang, C. F.; Yang, K.; Zhang, H. M.; Cao, J.; Fang, R.; Liu, Z. L.; Du, S. S. Wang, Y. Y.;
Deng, Z. W.; Zhou, L. Components and Insecticidal Activity against the Maize Weevils of
Zanthoxylum schinifolium Fruits and Leaves. Molecules. 2011, 16, 3077-3088.
Wang, X.; Li, X.; Cheng, H.; Xu, X.; Zhuang, G.; Zhao, C. Organochlorine pesticides in
particulate matter of Beijing, China. J.Hazard. Mater. 2008, 155, 350-357.
Waterman, P. G.; Grundon, M. F. Chemistry and Chemical Taxonomy of the Rutales.
Academic Press, London. 1983.
Wei, L.; Wang, Y. Z.; Li, Z. Y. Floral ontogeny of Ruteae (Rutaceae) and its systematic
implications. Plant Biol. 2012, 14, 190-197.
Xiang, M.; Su, H.; Hu, Yan, J. Isolation, identification and determination of methyl caffeate,
ethyl caffeate and other phenolic compounds from Polygonum amplexicaule var. sinense. J.
Med. Plant Res., 2011, 5, 1685-169111
Xie, Y. S.; Bondnaryk, R. P.; Fields, P. G. A rapid and simple flour-disk bioassay for testing
substances active against stored-products insects. Can. Entomol. 1996, 128, 865-875.
Yang, C.; Cheng, M.; Chiang, M.; Kuo, Y.; Wang, C.; Chen, I. Dihydrobenzo[c]phenanthridine
Alkaloids from Stem Bark of Zanthoxylum nitidum. J. Nat. Prod. 2008, 71, 669–673.
236
Estudio fitoquímico de Compsoneura capitellata (Myristicaceae), Zanthoxylum rigidum (Rutaceae) y Ocotea longifolia
(Lauraceae) y evaluación de su posible aplicación como biocontroladores de Sitophilus sp.
Yang, L. J.; Chen, W.; Luo, Y. P.; Li, G. P.; Yang, X. D.; Li, L. Lignans and ketonic
compounds from Litsea chinpingensis (Lauraceae). Biochem. Syst. Ecol. 2009, 37, 696 –
698.
Yang, R. Z., Tang, C. S. Plant used for pest control in China: a literature review. Economic
Botany. 1988, 42, 376-406.
Yang, X. Aroma Constituents and Alkylamides of Red and Green Huajiao (Zanthoxylum
bungeanum and Zanthoxylum schinifolium). J. Agric. Food Chem. 2008, 56, 1689-1696.
York, W. S.; Hantus, S.; Albersheim, P.; Darvill, A. G. Determination of the absolute
configuration of monosaccharides by NMR spectroscopy of their per-O-(S)-2-methylbutyrate
derivatives. Carbohyh. Res. 1997, 300, 199-206.
Zhao, O., Zhao, Y., Wang, K. Antinociceptive and free radical scavenging activities of
alkaloids isolated from Lindera angustifolia. J. Ethnopharm. 2006, 106, 408-413.
Zhao, S.; Zhang, L.; Gao, P.; Shao, Z. Isolation and characterisation of the isoflavones from
sprouted chickpea seeds. Food Chem. 2009, 114, 869-873.
Zoubiri, S.; Baaliouamer, A. Potentiality of plants as source of insecticide principles. J. Saudi
Chem. Soc. 2011, In Press, doi:10.1016/j.jscs.2011.11.015.
Zschocke, S.; Drewes, S.; Paulus, K.; Bauer, R.; Staden, J. Analytical and pharmacological
investigation of Ocotea bullata (black stinkwood) bark and leaves. J. Etnopharm. 2000, 71,
219-230.


![7. Pulmonaria L. [ ] Hierbas perennes, setoso](http://s2.studylib.es/store/data/005012436_1-7868654166fb79d6b627ed29f641c6d2-300x300.png)