Nota de prensa - Universidad de Oviedo
Anuncio

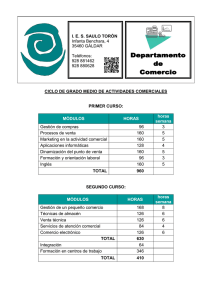
Nota de Prensa Un estudio describe cómo funciona un canal proteico relacionado con el control del ritmo cardiaco La revista Nature Communications publica un artículo de investigadores de la Universidad de Oviedo sobre el mecanismo de funcionamiento de un canal de potasio de las células del corazón El trabajo, coordinado por los profesores Pilar de la Peña y Francisco Barros, ha sido realizado en colaboración con científicos del Instituto Max Planck Oviedo, 9 de abril de 2015. La revista Nature Communications acaba de publicar un estudio sobre el funcionamiento de las proteínas ether-a-go-go llevado a cabo por investigadores de la Universidad de Oviedo. La función de estas proteínas en seres humanos se ha relacionado con distintos procesos, pero el trabajo del equipo, coordinado por Pilar de la Peña y Francisco Barros, en colaboración con científicos del Instituto Max Planck, se centra en el canal denominado hERG, implicado en el control del ritmo cardiaco. De hecho, la alteración funcional de hERG es una de las causas más frecuentes de arritmias cardíacas que desembocan en la llamada muerte súbita. Las proteínas ether-a-go-go deben su curioso nombre al hecho de que cuando algunos de sus miembros, presentes en la mosca del vinagre (Drosophila melanogaster), tienen ciertas mutaciones, se originan alteraciones neurológicas que provocan una vibración o "bailoteo" característico de las patas. En humanos, las proteínas ether-a-go-go también se asocian con la transmisión de los impulsos nerviosos, la secreción de hormonas como la insulina y la proliferación de células tumorales. El trabajo desarrollado por el grupo de Receptores hormonales y canales iónicos ha descrito el mecanismo por el que estas proteínas, que actúan como canales, abren y cierran permitiendo el paso de potasio en función de los cambios de potencial eléctrico en las células cardíacas. Los datos del nuevo estudio refutan las teorías sostenidas hasta ahora sobre el mecanismo de apertura y cierre de estas proteínas. Las proteínas ether-a-go-go constan de dos módulos funcionales: un sensor de voltaje que comprende aproximadamente la primera mitad de la proteína y que detecta los cambios de voltaje a través de la membrana, y un segundo módulo poro, que conduce Oficina de comunicación comunica@uniovi.es Nota de Prensa los iones potasio y en el que existe una compuerta que se abre y cierra en función del voltaje. Una de las incógnitas fundamentales es saber cómo ocurre la comunicación entre ambos módulos. Hasta ahora se asumía que el acoplamiento entre ambos se producía de forma mecánica, mediante el lazo proteico que los une y que actuaba como una palanca para transmitir los movimientos del sensor a la compuerta. El trabajo con canales en los que el lazo proteico ha sido roto, interrumpiendo la comunicación entre ambos módulos, revela que a pesar de dicha interrupción los canales responden al voltaje y abren y cierran de forma prácticamente normal. De hecho, los datos más recientes del equipo apuntan a que el mecanismo de acoplamiento entre los módulos se basa en interacciones específicas entre determinadas regiones de los mismos, sin necesidad de una continuidad física entre ambas mitades de la proteína. Dejando aparte las implicaciones fisiológicas y patológicas que tiene el conocimiento del modo de operación de estas relevantes proteínas, estos resultados abren nuevas y aún inexploradas cuestiones como si es posible que estas sofisticadas maquinarias moleculares procedan realmente de la fusión de módulos originalmente independientes en algún punto del proceso evolutivo. O, por ejemplo, cuándo, dónde y cómo son capaces las células de hacer interaccionar ambos módulos si éstos son sintetizados como dos moléculas independientes y no como una proteína continua. Artículo en Nature Communications Voltage-dependent gating of KCNH potassium channels lacking a covalent link between voltage-sensing and pore domains Éva Lörinczi, Juan Camilo Gómez-Posada, Pilar de la Peña, Adam P. Tomczak, Jorge Fernández-Trillo, Ulrike Leipscher, Walter Stühmer, Francisco Barros & Luis A. Pardo http://www.nature.com/ncomms/2015/150330/ncomms7672/abs/ncomms7672.html Financiación de la investigación Proyectos de investigación CONSOLIDER- INGENIO MICINN CSD2008-00005 Subvención Gobierno del Principado de Asturias SV-PA-13-ECOEMP-69 Oficina de comunicación comunica@uniovi.es