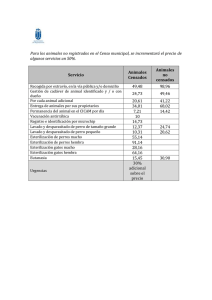
Descarga - Revista Farmespaña Industrial
Anuncio

FI SALAS BLANCAS ESTERILIZACIÓN GESTIÓN DE EQUIPOS VALIDACIONES Y CERTIFICACIONES REGULATORY AFFAIRS lifescienceslab SOFTWARE DE LABORATORIO TRATAMIENTO DE AGUAS AÑO IX NOVIEMBRE/DICIEMBRE 2015 Nº 70 Revista Profesional para Proveedores de la Industria Farmacéutica y Tecnología de Laboratorio FI Revista Profesional para Proveedores de la Industria Farmacéutica y Tecnología de Laboratorio Estimado lector: A punto de dejar atrás 2015, entramos de lleno en la época en la que todos solemos repasar cómo nos ha ido el año, con una mezcla de nostalgia por lo que dejamos atrás y de esperanza por lo que está por venir. Desde el equipo de redacción de Farmespaña Industrial estamos seguros que 2016 será un año lleno de novedades, al menos por nuestra parte, y deseamos compartirlas con todos ustedes. El próximo año vendrá de la mano de FarmaForum 2016, en la que Farmespaña Industrial participará como colaborador y que vendrá cargado de novedades entre las que se encuentra una sección específica dedicada a Cosmética, Cosmética Forum. TCI C/ Berlín, nº45. Polígono Ind. Ciudad de Parla 28983 – Parla (Madrid) FI Abandonamos 2015 con una edición muy especial, ya que con ella nuestra publicación cumple los 70 números. Debemos, por tanto, agradecer a todos los que nos han acompañado a lo largo de este camino; colaboradores, profesionales, asociaciones y, por supuesto, nuestros lectores, que incondicionalmente han estado ahí, con esa exigencia imprescindible para que el equipo de Farmespaña Industrial busque superarse en cada número. En esta edición, además de las secciones dedicadas a las novedades del sector y a las principales asociaciones profesionales, hemos querido abordar varios temas de gran interés; desde validaciones, certificaciones y regulación hasta esterilización en AÑO IX NOVIEMBRE/DICIEMBRE 2015 Nº 70 Revista Profesional para Proveedores de la Industria Farmacéutica y Tecnología de Laboratorio SALAS BLANCAS ESTERILIZACIÓN GESTIÓN DE EQUIPOS VALIDACIONES Y CERTIFICACIONES Tlf.: 91 664 46 37 Fax: 91 605 11 07 REGULATORY AFFAIRS lifescienceslab SOFTWARE DE LABORATORIO TRATAMIENTO DE AGUAS info@tci-ingenieria.es www.tci-ingenieria.es FI Revista Profesional para Proveedores de la Industria Farmacéutica y Tecnología de Laboratorio FARMESPAÑA INDUSTRIAL no se hace responsable de las opiniones emitidas por los autores, colaboradores y anunciantes, cuyos trabajos publicamos, sin que esto implique necesariamente compartir sus opiniones. Queda prohibida la reproducción parcial o total de los originales publicados sin autorización expresa por escrito. ISSN-1699-4205 DL: M-15766-2005 autoclaves, diseño de salas blancas, cómo abordar la fabricación de productos altamente activos o peligrosos o las posibilidades que ofrece la redistribución de equipos industriales. En nuestro suplemento LifeSciencesLab, hemos incluido dos artículos, uno sobre cómo lidiar con algunos de los problemas más habituales con el apoyo de un software de laboratorio y otro sobre tratamiento de aguas en analizadores clínicos. Esperamos que disfruten de estas fechas y volver a encontrarnos, con fuerzas renovadas, en 2016. Bienvenidos a Farmespaña Industrial. AGENDA EMPRESAS, EQUIPAMIENTOS Y SERVICIOS AEPIMIFA VALIDACIONES Y CERTIFICACIONES ESTERILIZACIÓN SALAS BLANCAS REGULATORY AFFAIRS SALAS BLANCAS CASO PRÁCTICO GESTIÓN DE EQUIPOS INDUSTRIALES lifescienceslab NOTICIAS DEL SECTOR SOFTWARE DE LABORATORIO TRATAMIENTO DE AGUAS GUÍA DE SERVICIOS ÍNDICE DE ANUNCIANTES Editor: Eugenio Pérez de Lema Consejo Asesor: Coordinación: Gisela Bühl D. Sergi Roura, Director Gral. Grifols. Director Financiero: Carlos Fernández D. Rogelio Pardo, Director Gerente Madrid NETWORK BIOCLUSTER. Redacción: Dr. Alejandro Gesteira Tel. + 34 600 392 754 alejandro@farmaindustrial.com D. Eduardo Gaspar, Director ADF Tecnogen. y Circagen y miembro de BioMadrid. Director Comercial: Marcos Muiños Tel. + 34 986 19 12 93 marcos@farmaindustrial.com D. Eduardo Sanz, Senior Advisor. D. Aser Alonso Responsable de Ingeniería de Proceso de Alcon España. Publicidad: Sonkyong Cho Kim Tel: + 34 91 630 85 91 son@farmaindustrial.com Mª Teresa Martín Tel: + 34 91 89 65 668. mariateresa@farmespana.com Diseño y maquetación: Daniel C. Bernardo Edita: OMNIMEDIA S.L. · C/ Rosa de Lima 1 bis. Edificio Alba, oficina 104 28290 Las Matas (Madrid) · Tel: 902 36 46 99 · Fax: 91 630 85 95 info@grupo-omnimedia.com · www.grupo-omnimedia.com Farmespaña Industrial es miembro de la Asociación Española de Editoriales de Publicaciones Periódicas, que a su vez es miembro de FIPP. 4 6 18 22 24 42 46 48 50 54 59 60 65 69 74 82 AGENDA PHARMAPACK 2016 Descripción: Feria europea de envase y embalaje farmacéutico Organizadores: UBM Lugar: Paris Expo Fecha: 10 y 11 de febrero de 2016 +Info: www.pharmapackeurope.com Descripción: Foro de la industria farmacéutica, biofarmacéutica, cosmética y tecnología de laboratorios Organizadores: FarmaForum Lugar: Madrid, Palacio Municipal de Congresos. Fecha: 2 y 3 de marzo de 2016 +Info: www.farmaforum.es, comercial@ farmaforum.es Descripción: Evento para la industria farmacéutica, nutracéutica y del cuidado personal. Organizadores: Pharmintech Lugar: Feria de Bolonia Fecha: 13 al 15 de abril de 2016 +Info: www.pharmintech.it TECHNOPHARM ANALYTICA SYMPOSIUM AEFI SIL 2016 BIOSPAIN CPHI WORLDWIDE BARCELONA Descripción: International Trade Fair for Life Science Process Technologies Organizadores: Nürnberg Messe GmbH Lugar: Exhibition Centre Nürnberg, Alemania Fecha: 19 al 21 de abril de 2016 +Info: www.technopharm.de Descripción: 18º Salón Internacional de la Logística y la Manutención Organizadores: El Consorci Barcelona Lugar: Fira de Barcelona (Barcelona) Fecha: 7 al 9 de julio de 2016 +Info: www.silbcn.com/es EXPOSÓLIDOS Descripción: Salón Internacional de la tecnología y el procesamiento de sólidos Organizadores: Profei s.l Lugar: La Farga de L’Hospitalet, Barcelona Fecha: 14 al 16 de febrero de 2017 +Info: www.exposolidos.com 4 PHARMINTECH 2016 ESPECIAL LOGÍSTICA Y DISTRIBUCIÓN Descripción: Feria internacional para la tecnología de laboratorio, análítica y biotecnología Organizadores: Messe München GmbH Lugar: Messe München, Munich Fecha: 10 al 13 de mayo de 2016 +Info: www.analytica.de Descripción: 8ª Reunión internacional de Biotecnología Organizadores: Asebio Lugar: Bilbao Fecha: del 28 al 30 de septiembre de 2016 +Info: www.biospain2016.org BIOTECHNICA Descripción: Principal evento europeo de la industria biotecnológica y de ciencias de la vida. Organizadores: Deuche Messe Lugar: Hannover Fecha: 16 al 18 de mayo de 2017 +Info: www.biotechnica.de Descripción: 36 Symposium de la Asociación de Farmacéuticos de la Industria Organizadores: AEFI Lugar: Madrid, Hotel Novotel Madrid Fecha: 7 y 8 de junio de 2016 +Info: administracion.centro@aefi.org Descripción: Feria internacional de la industria farmacéutica Organizadores: UBM Lugar: Fira de Barcelona Fecha: 4 al 6 de octubre de 2016 +Info: www.cphibarcelona.b-network.com EXPOQUIMIA Descripción: Encuentro Internacional de Química Organizadores: Fira Barcelona Lugar: Barcelona Fecha: 2 al 6 de octubre de 2017 +Info: www.expoquimia.com FARMESPAÑA INDUSTRIAL î ACTUALIDAD Válvula aséptica con membrana BBWP Quilinox, S.L. presenta la válvula aséptica con membrana Bardiani BBWP, fabricada bajo las normas 3A-FDA y EHEDG, permitiendo que se utilice en industrias farmacéutica, química fina y alimentaria. Está diseñada para garantizar la estanqueidad aséptica gracias al aislamiento total de los componentes en contacto con el producto y del ambiente exterior, mediante el uso de una membrana en tfm, ideal para productos viscosos, ofreciendo intercambiabilidad con la válvula de asiento simple BBZP. Características técnicas: w Material cuerpo en contacto producto a-316L (1.4404) w w w w w w w w Material membrana en contacto producto: PTFE/EPDM. Material juntas en contacto producto (homologación FDA) EPDM, FKM, MVQ, HNBR y PTFE. Acabado superficial en contacto producto ra.0,8µ. Otros acabados bajo demanda. Presión máxima producto 8 bar (116psi) Temperatura máxima producto: 140ºc -10ºc. Actuador neumático de simple efecto. Automatización, detectores inductivos, electroválvula, ASI bus. Certificación TR CU de Tecfluid para los mercados de Rusia, Bielorrusia y Kazajstán Tecfluid ya dispone de la certificación TR CU que permite el suministro de nuestros productos en los mercados de Rusia, Bielorrusia y Kazajstán. Mientras que el marcado CE aplica a los productos fabricados por Tecfluid S.A. que cumplen con los requisitos de la Directiva Europea de Presión (PED) Nº 97/23/ CE para su comercialización en la Unión Europea, en el caso de los mercados de 6 NOVIEMBRE/DICIEMBRE15 Rusia, Bielorrusia y Kazajstán resulta de aplicación el marcado EAC según la regulación técnica TR CU. De esta forma los equipos Tecfluid saldrán ya de las instalaciones de la empresa con el marcado EAC incorporado. Esta certificación permitirá a Tecfluid S.A. dar un nuevo paso en la comercialización de nuestros productos de medición de caudal y nivel en todo el mundo. El futuro del desarrollo de negocio en los genéricos en el sector farmacéutico Enmarcado en el contexto de los Encuentros Farmaforum, el día 13 de noviembre, en el Rafael Hoteles Ventas de Madrid, tuvo lugar una jornada enfocada en analizar la situación actual y las nuevas tendencias del desarrollo de negocio de los medicamentos genéricos. El seminario fue impartido por Concha Almarza, General Manager de IMS Health España, y Eduardo Sanz, Director General de Pharma Plan. Al evento asistieron Directores Generales, Directores comerciales, Directores de Desarrollo de Negocio, Directores de Business Intelligence, Directores de marketing y Jefes de ventas de los principales laboratorios farmacéuticos. El programa trató el Desarrollo de Negocio en el sector Farma y el análisis de la teoría de los vasos comunicantes: Innovadores, Genéricos, Consumer Healthcare, Biosimilares, etc. Analizará la situación actual y las nuevas tendencias en mercados, áreas terapéuticas, productos y tecnologías. Durante la jornada, se repasaron los principales drivers en el desarrollo de negocio y finalizó con un debate abierto. FARMESPAÑA INDUSTRIAL Veolia Water Technologies realiza una instalación para el tratamiento de los efluentes de Merck con tecnología de lecho móvil Se trata de una solución modular, basada en la tecnología de lecho móvil AnoxKaldnes™, que permite la eliminación biológica de los compuestos orgánicos en un reducido espacio de implantación. La filial española de Veolia Water Technologies ha resultado adjudicataria de un nuevo contrato para el diseño e instalación de una planta biológica para el tratamiento del efluente de la factoría de Merck en Tres Cantos, Madrid. Esta instalación consistirá en una planta modular Mb-brx, basada en la tecnología de lecho móvil AnoxKaldnes™ MBBR, una nueva tecnología específicamente desarrollada por Veolia Water Technologies para el tratamiento de los efluentes industriales con elevadas concentraciones de compuestos de alta biodegradabilidad y caudales relativamente pequeños Diseñada para el tratamiento de 90 metros cúbicos al día, la nueva planta permitirá a Merck tratar los vertidos de la fábrica, reduciendo al 50% la DQO del efluente. Gracias al diseño modular de la solución Mb-brx, la capacidad de tratamiento de la instalación puede ser fácilmente ampliable para hacer frente a futuros incrementos de producción y, además, la modularidad reduce el espacio de implantación de forma considerable frente a otras tecnologías. Con este pedido, Merck renueva su confianza en Veolia Water Technologies como tecnólogo de referencia para el tratamiento de agua. En el año 2008, la filial española de Veolia se encargó del diseño e instalación de una planta de producción de agua purificada con una capacidad de 7,5 metros cúbicos a la hora, también para la factoría de Tres Cantos. REPARACION / MANTENIMIENTO DE EQUIPOS ELECTROMEDICOS. CUMPLIMOS CIRCULAR DEL MINISTERIO DE SANIDAD Y CONSUMO 3 / 2012 LABORATORIO ACREDITADO EN METROLOGíA. REGISTRO INDUSTRIAL REVISIONES ELÉCTRICAS. EN BAJA TENSIÓN. LINEAS EN ALTA TENSION EMPRESA AUTORIZADA ESPECIALISTA IBTE 1086 D:C:E Nº 7163 ACTUALIZACIÓN DE LAS INSTALACIONES A LA NORMATIVA ACTUAL. VALIDACION, CUALIFICACIÓN Y AUDITORIAS: QUIROFANOS, CAMPANAS DE FLUJO, VITRINAS EXTRACCION, ESTERILIZADORES. AMBIENTE CONTROLADO (SALAS BLANCAS, AREAS LIMPIAS). ARMARIOS DE SEGURIDAD, CABINAS DE BIOSEGURIDAD CLASE 3, HIGIENE, SEGURIDAD Y MEDIO AMBIENTE. MONITORIZACION AGENTES QUIMICOS. REAL DECRETO374/2001. CAPACIDAD PARA MEDIR DE FORMA SIMULTÁNEA MAS DE 50 AGENTES. MEDICIONES CAMPOS ELECTROMAGNETICOS. VENTA DE EQUIPOS DE PROTECCION (EPIS) CALZADO, BOTAS, GUANTES NITRILO, MASCARILLAS FFP 1/2/3 CASCOS, GAFAS, SEÑALES, PANTALLAS DE SOLDADURA, LAVAOJOS BUZOS, EQUIPOS ANTICAIDAS, BATAS, TAPONES, DERRAMES ETC. REF A-2CV, MASCARILLA RETENCION DE FORMALDEHIDO, QUIMICOS. ENTREGA EN MENOS DE 24 HORAS. MAS DE 700 REFERENCIAS. NO HAY PEDIDO MINIMO. PRECIOS DIRECTAMENTE DE FABRICA. FARMESPAÑA INDUSTRIAL C/ Velázquez, Nº119 - 3ºF 28006 Madrid Tel. / Fax: 91 564 86 31 - Urgencias: 626 70 76 46 NOVIEMBRE/DICIEMBRE15 Email: p.isabel@picweb.es www.picweb.es 7 î ACTUALIDAD Dara Pharmaceutical Packaging presenta su equipo SYX-E-OR. Máquinas llenadoras – cerradoras para colirios y sprays nasales La máquina que le presentamos es una combinación de llenadora - cerradora compacta, para trabajar viales y frascos en vidrio, plástico o bien metal, para el acondicionado automático de todo tipo de productos líquidos, semisólidos o productos en polvo, en zona estéril o sala limpia. Para producciones de hasta 9.000 unidades por hora. Volúmenes de dosificación desde 0,1 hasta 1.050 ml. Su diseño ha sido realizado conforme a las normas cGMP y de la US FDA en especial correspondencia con las exigencias de la industria farmacéutica, biotecnológica, cosmética, química e industrias afines. 8 NOVIEMBRE/DICIEMBRE15 La estación de llenado está equipada con bombas peristálticas SpeedFill para productos líquidos o con dosificadores volumétricos para productos semisólidos o en polvo. Utilizando elementos de construcción “CIPSIP” no es necesario desmontar las piezas de conducción del producto para su limpieza y esterilización. La estación de pick & place coloca los obturadores y tapones de manera secuencial sobre el frasco. La manipulación de los elementos de cierre se realiza por vacío. La estación de cerrado está equipada con un cabezal a rosca servo accionado, para cierres a rosca difíciles. Todos los cierres de uso corriente pueden ser tratados sin problemas, tales como: w Cierres a presión / rosca. w Cierres childproof. w Bombas spray / dosificadoras. w Aplicadores de gotas. La alimentación de los diferentes tipos de obturadores y tapones se realiza automáticamente mediante alimentadores vibradores, construidos en acero inoxidable AISI-316L. Para trabajar en zona estéril disponemos de diferentes unidades de flujo laminar o RABs adaptadas a cada tamaño de máquina. El aire estéril que se genera asegura una extracción continua y eficaz de partículas y microorganismos fuera del área de trabajo. Con la utilización de un aislador, la zona estéril se limita al área de trabajo de la máquina llenadora - cerradora, permitiendo trabajar fuera de zona estéril, respetando los estándares de la industria farmacéutica. Equipamientos opcionales: w IPC para el control de la dosis por peso. w Gaseado antes, durante o después del proceso de llenado. w Tolva vibradora para aumento de autonomía en la alimentación de obturadores y tapones. w Expulsión de frascos con defectos de proceso. w Software para la documentación de todos los datos relevantes de la producción de acuerdo 21CFR parte 11. w Flujo laminar / RABs / Aislador. w Validación IQ / OQ. w Impresión / Codificación. Para más información www.dara-pharma.com FARMESPAÑA INDUSTRIAL Lecturas fiables en superficies reflectantes mediante filtro de polarización Una nueva serie de lectores de códigos basados en cámara, ahora vienen equipados con una tecnología especial de filtro de polarización, que expande significativamente el área de aplicación de los dispositivos. Esto es debido a que los códigos de barras y los códigos Data Matrix se encuentran ubicados en lugares soleados, superficies reflectantes, que pueden interferir significativamente en la lectura de los mismos. Los nuevos lectores de códigos son fiables en la supresión de este tipo de reflejos e incluso permiten rápidas y fiables lecturas sobre material metálico. Los nuevos lectores de códigos 1D y 2D de las series OPC120W y OPC120P de Pepperl+Fuchs cubren una gama excepcionalmente amplia de aplicaciones. Los modelos OPC120W ofrecen una excelente relación costebeneficio y son todoterrenos adecuados para una serie de aplicaciones estándar a velocidades normales. El modelo OPC120P es perfecto para tereas más complejas: Puede manejar aplicaciones de alta velocidad con movimientos de hasta 10 m/s ó 100 lecturas/s, y está equipado con la exclusiva tecnología de filtro de polarización. Se garantiza una fiable lectura del código sobre superficies altamente reflectantes, tales como metales, plásticos, PCBs, bajo películas, y en superficies curvas. Otros aspectos destacados de este dispositivo son una entrada de FARMESPAÑA INDUSTRIAL encoder para sincronización y la capacidad de leer códigos de barras de hasta 200 mm de longitud a través de la captura de imágenes múltiples. La alta profundidad del foco permite lecturas sobre una gran distancia sin necesitar de hacer cambios de parámetros. Además, los lectores de código están disponibles en un rango de interfaces que incluye PROFINET, RS232, y Ethernet. Los dispositivos de la serie OPC120 leen DataMatrix, Código 2/5, Código 39, Código128, EAN13, y simbologías del Código Pharma. Además, pueden detectar varias texturas, fechas de caducidad, y la presencia y posición de los logos. Los lectores de códigos se caracterizan por muchos otros aspectos: Éstos incluyen una mejora del código en la salida, guardando automáticamente los patrones de fallo, formateando la cadena de salida, y la función de código partido. Estas funciones se pueden aplicar a un máximo de cuatro regiones separadas de la imagen capturada. Su amplia variedad de características y la protección IP67 nos indican que los nuevos lectores de códigos son adecuados para una amplia gama de aplicaciones e industrias. NOVIEMBRE/DICIEMBRE15 9 î ACTUALIDAD QbD Pharmaceutical Services S.L presenta SMART QbD™ en Pharmaprocess Alicia Tébar, Directora de QbD Pharmaceutical Services S.L, participó en la última edición de Pharmaprocess. La ponencia en torno al tema “QbD at minimum or full application” se centró en presentar la metodología SMART QbD™ que esta consultoría aplica para dar soporte a sus clientes en departamentos de desarrollo, transferencias, industrialización y producción dentro de sus proyectos Quality by Design. SMART QbD surge de la experiencia de más de 10 años en proyectos de implantación que permiten identificar las estrategias que funcionan en la práctica. Herramientas eficientes, tanto de risk analysis como de diseño de experimentos, son la clave para re-aprovechar el conocimiento generado y no inventar la rueda cada vez. Con una amplia cartera de clientes en España y Sudamérica, y abriendo mercado en Europa, QbD Ph. Services S.L se consolida en el sector de la asesoría técnica especializada para el sector Life Sciences. HallTech lanza la gama de luminarias LED industriales de la empresa Dialight en España y Portugal Dialight fabrica luminarias LED (opciones ATEX) con rendimientos muy altos – hasta 140 lúmenes por vatio que reduce enormemente el coste de iluminación comparado con luminarias convencionales - con retornos de inversión típicamente de uno a tres años. Las garantías ofrecidas para estos productos son de 5, 7 y 10 años. Ventajas específicas de la gama de luminarias LED Dialight: w Los mejores rendimientos del mercado: hasta 145 lúmenes/vatio w Las garantías más largas del mercado: 5, 7 y hasta 10 años, según modelo w w w w w w w Versiones para naves altas (hasta 30m) y bajas Modelos para montar en techos, paredes, farolas y también transportables Una propuesta de valor añadido: Más de 10 años de iluminación sin necesidad de mantenimiento Calidad lumínica: mejora en la seguridad Menores costes de explotación: retorno de la inversión (ROI) más rápido Menor consumo de energía (más del 50% de reducción) Reducción significativa de la emisión de CO2. TECNISECO en la 25º Asamblea General de AEPIMIFA Como Socio Protector, Tecniseco Ingenieros acudió el pasado 12 de noviembre a la vigésimo quinta Asamblea General de Socios de AEPIMIFA (Asociación Española de Profesionales de la Industria Farmacéutica, Alimentaria, Cosmética y Afines) que tuvo lugar en El Palacio de la Misión de la Casa de Campo en Madrid. Al igual que en ediciones anteriores, contó con un stand para interactuar con los socios y clientes del sector farmacia y alimentación que acudieron a la cita, pudiendo disfrutar de una interesante jornada amenizada con 10 NOVIEMBRE/DICIEMBRE15 la charla de Carlos Hernández sobre “El Optimismo Inteligente” o “Cómo ver el vaso medio lleno”. “Cada año vemos reforzados los lazos profesionales y personales entre todos los socios y profesionales del sector que acudimos año tras año a esta cita, lo que sin duda nos enriquece mutuamente”. AEPIMIFA tiene varias jornadas y eventos previstos para los próximos meses en los que Tecniseco tiene intención de participar activamente. Pueden consultarlos en su página web: http://www.aepimifa.org/es/. FARMESPAÑA INDUSTRIAL Ramos S.T.S. Protection, pioneros y con capacidad de desarrollo de los nuevos trajes de protección para la nueva unidad de aislamiento del hospital Gómez Ulla A raíz del brote del virus Ébola, las instituciones y organismos se han venido preparando para presentes y futuras crisis químico-biológicas; por ello Ramos S.T.S. en colaboración con Indutex y DuPont, han desarrollado las escafandras Tychem® C A.M. BWP y Jetguard® A.M. cubriendo así las exigencias de riesgo, maniobrabilidad en entorno Medico-Sanitario y ergonómicas. Esta escafandra de presión positiva (+) se ha desarrollado para el entorno médico-sanitario cubriendo riesgos biológicos y/o químicos. Surge de la idea de mejorar la calidad y seguridad de las personas a la hora de realizar un trabajo de alto riesgo para la salud del trabajador sanitario en este caso. Los Equipos están desarrollados en tejidos Tychem® C, SprayGuard® y JetGuard®. En este caso, se ha creado específicamente para la Unidad de Aislamiento del hospital Gómez Ulla. Estos equipos aportan los máximos niveles de protección frente a exposiciones FARMESPAÑA INDUSTRIAL Químicas, Biológicas y Nucleares, conforme al tipo de aplicación y Traje, bien sean de presión positiva mediante trajes ventilados por aporte de aire 240 ± 5 litros/minuto (con filtros montados) o trajes no ventilados. La Escafandra es de tipo ventilado, de posicionamiento DORSAL y utiliza un sistema de filtración de la atmósfera contaminada formado por un electroventilador con filtros. Aplicaciones básicas: w Desinfección. w Servicios de emergencia: limpieza de derrames, intervenciones en accidentes. w Industria petroquímica. w Tratamiento de metales. w Minería. w Elaboración, transporte y manipulación de productos químicos. w Aplicaciones militares. w Tratamiento de desechos. w Tratamiento de aguas. w Operaciones de lacado. w Temple y revenido aplicación de PCB. NOVIEMBRE/DICIEMBRE15 11 î ACTUALIDAD FREEZEDRY Solutions incorpora la tecnología de medida de temperatura inalámbrica TEMPRIS en su laboratorio de I+D para procesos de liofilización FREEZE DRY Solutions (marca comercial que engloba los servicios dedicados a procesos y equipos de liofilización de la empresa COMPLIANCESERVICES) inauguró a mediados del 2014 el laboratorio de I+D el cual cuenta con un liofilizador piloto de 0,5 m2 de superficie de placas. El desarrollo y optimización de ciclos de liofilización tiene como objetivo la obtención de un producto que cumpla los atributos críticos de calidad (apariencia, humedad final, impurezas…) en el menor tiempo posible. Con el objetivo de poder tener información cada vez más real de lo que está pasando dentro de un vial durante un el El mismo sensor puede utilizarse para un equipo de laboratorio o un equipo industrial. w Lectura puntual en el centro y punto más bajo del vial. Esta tecnología permitirá por un lado conocer de forma fiable la temperatura del frente de sublimación al final del secado primario (peor caso), así como agilizar de forma significativa el proceso de escalado del ciclo de liofilización desarrollado a equipos industriales. Con la incorporación de esta tecnología, FREEZEDRY Solutions pretende potenciar de forma muy clara los servicios enfocados al asesoramiento en procesos de liofilización para dar respuesta a una demanda creciente del mercado. w proceso de liofilización se ha incorporado la tecnología de medida de temperatura TEMPRIS. Una herramienta PAT que aporta información muy valiosa del proceso. El sistema de medida TEMPRIS, desarrollado específicamente para aplicación en procesos de liofilización por la empresa IQmobile, aporta un gran número de ventajas respecto al sistema de medida de temperatura de producto convencional. Entre las ventajas más significativas cabe destacar: w Su fácil manipulación, debido a que se trata de un sensor inalámbrico y de dimensiones reducidas. w El sensor no está alimentado eléctricamente, por lo tanto no aporta calor al producto. European Robotics Challenges califica a Ulma e IK4-Tekniker como principal finalista en el proyecto de entorno colaborativo ULMA Handling Systems colabora con IK4-Tekniker (centro tecnológico) con el objetivo de alcanzar un entorno colaborativo persona-máquina en la nueva revolución INDUSTRY 4.0 cuyo objetivo se centra en eliminar barreras en el entorno de trabajo. El proyecto ha sido elegido como mejor consorcio por EUROC, entre los 5 finalistas de los 15 participantes. ULMA Handling Systems e IK4Tekniker colaboran en un proyecto persona-máquina con el sello INDUSTRY 4.0 en EUROC (European Robotics Challenges), donde han sido proclamados finalistas como el mejor consorcio (RSAII) para desarrollar el proyecto “FLECOOP: Sistema flexible de picking unitario en entornos colaborativos para la 12 NOVIEMBRE/DICIEMBRE15 preparación de pedidos en centros de distribución”. Reconocidas firmas como Airbus o Peugeot Citroën son algunas de las cinco empresas que han sido nombradas como finalistas junto con ULMA-IK4-Tekniker. Actualmente todos ellos se encuentran inmersos en la segunda fase del programa, del cual, pasarán a la tercera y última fase dos proyectos, en el que deberán desarrollar físicamente el prototipo propuesto, siendo proclamados como mejores proyectos en diciembre del 2016. El reto consiste en obtener un prototipo de picking unitario automático en entornos colaborativos persona-máquina para la preparación de pedidos en centros de distribución. Hoy en día, el 90% de los pedidos se preparan por los trabajadores del almacén, el cual es un proceso arduo y monótono, que además no añade valor al producto. El planteamiento principal es proporcionar una solución híbrida, en el que robots y humanos comparten el mismo espacio de trabajo, combinando una alta automatización, monitorizando el área de trabajo y garantizando en todo momento la seguridad en el puesto de trabajo. La detección de los objetos que manipula el robot se realiza mediante visión 2D y 3D que permiten una manipulación automática para operaciones de pick & place. El proyecto permitirá evaluar la viabilidad, aceptación y eficacia de este nuevo concepto de trabajo, entornos colaborativos robot-humano y sin barreras físicas. Por lo que se reducirá el número de errores, el coste del proceso de picking, el espacio requerido en comparación con soluciones tradicionales con robots, se mejorarán las condiciones de trabajo. FARMESPAÑA INDUSTRIAL GSK España cuenta con el mayor número de certificaciones de su sector Con la participación de todos los sectores de la empresa, desde los dos centros de investigación y desarrollo ubicados en Tres Cantos hasta las fábricas de Aranda de Duero y Alcalá de Henares y la división comercial, incluidas todas las filiales comercializadoras, la principal motivación de GSK no es sólo el beneficio empresarial sino también la responsabilidad ética de proteger a las personas y al medio ambiente. Es por ello que en un estudio comparativo entre farmacéuticas ubicadas en España, GSK es la compañía con más Certificaciones en Medio Ambiente, Seguridad, Salud, Bienestar, Sostenibilidad e Igualdad. La empresa Psyma, agencia de Investigación de Mercados especializada en el sector farmacéutico, ha sido la encargada de llevar a cabo el análisis comparativo entre las 10 compañías farmacéuticas más relevantes con presencia en nuestro país analizando todas las unidades de negocio en todas las regiones donde tienen presencia. Las certificaciones comparadas, dentro de cada categoría, han sido: w Medio Ambiente: ISO 14001, EMAS y Flota ecológica w Seguridad, Salud y Bienestar: OHSAS 18001 y Modelo de Empresa Saludable w Distintivo de igualdad GSK España cuenta con todas y cada una de ellas, por lo que salir “tan bien posicionados de un análisis como éste, demuestra que somos una empresa con un grado de madurez muy elevado y que siempre hemos trabajado para buscar la excelencia en lo que hacemos” ha dicho Ana Ferrón, Gerente de Medio Ambiente, Seguridad, Salud, Bienestar y Sostenibilidad de GSK España. El Sistema EMAS es una normativa de la Unión Europea que reconoce a todas aquellas organizaciones que cuentan con un Sistema de Gestión Medioambiental verificado mediante auditorías externas. La adhesión a este sistema es voluntaria y en su implantación las organizaciones se comprometen a la mejora continua. EMAS propone una sistemática eficaz y flexible para ayudar a las organizaciones a gestionar y mejorar, de manera continua, su impacto ambiental, asegurando así un comportamiento excelente en este ámbito. La certificación de GSK España al Sistema EMAS llegó en el año 1999, siendo la primera compañía farmacéutica en España que se certificó en este Sistema y este año la Compañía ha sido distinguida con un certificado conmemorativo por su adhesión desde hace más de 15 años. Durante la participación de GSK España en la conferencia “20 years of premium environmental management - High Level Conference on EMAS: Environmental management in a circular economy - demonstrated opportunities, benefits and challenges for the private sector” se destaca el enfoque de GSK en su cadena de valor explicando el compromiso de la Compañía en reducir su huella de carbono y alcanzar el objetivo de ser neutral en el año 2050. La gama más amplia de palets de plástico. Ingeniería al servicio del cliente. CABKA es uno de líderes mundiales en la fabricación de palets de plástico: desde palets robustos para aplicaciones de reutilización a palets ligeros y encajables y soluciones a medida. Nest i1 BPP i9 Hygienic E7.3 Nest E3.2 FARMESPAÑA INDUSTRIAL Endur E7.1 H1 Nest C5.2 Eco E5 Nest US5 CABKA Spain S.L.U. Calle Cervantes 2, pta.1 46007 Valencia | España Teléfono_ +34.96.110.2431 NOVIEMBRE/DICIEMBRE15 13 E-Mail_ sales-es@cabka-ips.com cabka-ips.com î ACTUALIDAD Abierto el plazo de inscripciones a FarmaForum 2016 La organización de Farmaforum 2016 ha presentado oficialmente el programa de conferencias para el Congreso y los talleres técnicos que las principales compañías del sector celebrarán de forma paralela. Además, ya es posible inscribirse, tanto para el Congreso como para la exposición comercial y los talleres. El Congreso, que contará con algunos de los ponentes más destacados del sector, acercará, como en ocasiones anteriores, las últimas novedades y tendencias tanto en Mercado y Negocio Farmacéutico como en Tecnología Farmacéutica: 2 de marzo: w Medicamentos Biosimilares: presente y futuro. Ángel Luis Rodríguez de la Cuerda, Director general de BioSim (Asociación Española de Biosimilares). w Nuevos entrantes en el cuidado de la Salud. Dolores Mateos-Aparicio, Socia de Ascendo Consulting. w Impacto de la biotecnología en la sostenibilidad del sistema sanitario: realidad actual y medidas para futuro. Julio Maset, Director científico-corporativo en Infarco-Cinfa. w Herramientas de Gestión para el Cumplimiento continuo de exigencias y requisitos en la Industria Farma-Cosmética. Carmen López Trujillo, Responsable en Ingerfarma (Grupo Ingertec). w Data Integrity, un nuevo enfoque de la gestión de datos. Fernando Geijo, Manager of QA in R&D en Azbil Telstar Technologies. w Mesa redonda ISPE ESPAÑA. 14 NOVIEMBRE/DICIEMBRE15 w w w w w w w Networking PartyPatrocinado por MONTAJES DELSAZ / VALTRIA. 3 de marzo: Nuevo Anexo 15 de la Guía de NCF: Novedades en relación a la validación y cualificación. Cristina Gómez-Chacón Galán, Jefe de área, área de inspección, departamento de inspección y control de medicamentos en la AEMPS. Contract Manufacturing Organization. Dr. Tomás Olleros, Presidente de Farmasierra Foro de eficiencia industrial. Un caso de éxito en el sector industrial farmacéutico español. Nacho Llubiá, Socio Director de Manageart. Excelencia a través de las personas. Ismael de los Mozos, Director de planta en GSK Aranda. Principios de la Industria Farmacéutica para la gestión de la cadena de suministro responsable. Enric Bosch, Senior EHS Manager-Supplier Qualification and Auditing en Boehringer Ingelheim. Ingeniería Farmacéutica del s.XXI. Alberto Carazo, Director de Asesoría Farmacéutica en Ingelyt; Miguel Ruiz, Responsable de Departamento HVAC en Ingelyt;y José González Díaz, Consejero de BOD. w Mantenimiento en la Industria Pharma en la próxima década. José Luis Llerena w Entender y Gestionar Riesgos cuando se adopta tecnología de un solo uso en un proceso farmacéutico. Raquel Campos Sánchez, Biopharma Spain Marketing Manager en Pall España. w Desarrollo y Optimización de procesos de liofilización en la Industria Regulada GMP. Jaume Vallet Xicoy, Gerente de Compliance, Consulting and Engineering. Los talleres técnicos organizados por profesionales del sector tratarán, asimismo, algunos de los temas más relevantes desde una perspectiva práctica: 2 de marzo: w Evaluación formal de riesgos de Excipientes (Azierta) w Gestión de riesgos en calidad (COFM) w Medical Devices- Nuevos Reglamentos (Telstar technologies) w Diseño de una estrategia fiscal a la Innovación y cesión de intangibles (SCA Asesores, S.A. y Clarke Modet) w Contaminación Cruzada: verificaciones ambientales (Qualipharma) w Actualización de la US FDA: inspecciones recientes y hot topics (BEC Spain SL / BEC USA) w Ingeniería farmacéutica siglo XXI. BIM (Building Information Modeling) (B.O.D. Arquitectura e Ingeniería, S.A.) 3 de marzo w Riesgo químico en el sector farmacéutico y cosmético: normativas y buenas prácticas (Prevor) w Aplicación de las tecnologías de un solo uso en las etapas de la formulación y el llenado (Pall Life Sciences) w CONEXO- Solución Global para Trazabilidad en válvulas de diafragma asépticas. La unión entre calidad, proceso y logística (ELION – GEMÜ) w Evaluación Clínica, Análisis de Riesgos y Diseño de un Producto Sanitario (Azierta) Por otro lado, la reserva de stands para la exposición comercial ya ha superado todas las expectativas, con más de un 80% adjudicado, lo que augura que esta edición será un éxito. FARMESPAÑA INDUSTRIAL Farmavenix y Cofares Estudios y Proyectos, presentes en el III Congreso de Logística Farmacéutica del CEL El 25 y 26 de noviembre se celebró en Madrid el III Congreso de Logística Farmacéutica Hospitalaria, organizado por el Centro Español de Logística (CEL) en la Universidad de Alcalá de Henares, en el que se debatieron las claves de la externalización de actividades logísticas en el ámbito hospitalario. La jornada, cofinanciada por el Ministerio de Fomento y varias empresas del sector, entre ellas, Farmavenix y Cofares Estudios y Proyectos, incluyó ponencias de distintos expertos de los sectores de logística hospitalaria, tanto públicos como privados, de varios países (Italia, Francia, España y Brasil). Todos ellos coincidieron en destacar las ventajas que conlleva una externalización eficiente de las actividades de logísticas hospitalarias, actividades sujetas a una innovación continua en aras a mejorar la eficiencia de las cadenas de suministro. Destacó la intervención de Mayuli Lurbe Fonseca, directora de la empresa brasileña Unihealth, quien disertó acerca de la logística intrahospitalaria y la importancia del uso de la tecnología para la seguridad del paciente. En su intervención, Lurbe Fonseca puso el acento en los gastos que anualmente experimenta el sector de la salud en Sudamérica, particularmente en Brasil, y cómo la tecnología logística, bien aplicada, puede repercutir de manera positiva en la economía de los Sistemas de Salud mediante una reducción de costes, la optimización de la gestión de los medicamentos y un aumento de la calidad del abastecimiento, así como de la seguridad y acceso al medicamento por parte de los pacientes, que son los beneficiarios más importantes de esta tecnología. Farmavenix organizó, para todos los participantes, una visita a la plataforma logística que el Grupo Cofares tiene en Marchamalo, Guadalajara, en la que además están las instalaciones de Profarco y OFSA Devoluciones (logística inversa). El almacén de Farmavenix es un centro logístico de 9.000 m2, en proceso de ampliación a más de 16.000 m2, que tiene una capacidad de almacenamiento de 40.000 huecos de palets, y que ya en 2014 recibió el Premio CEL Empresa por su proyecto de Eficiencia Logística e Innovación Tecnológica, gracias al cual el Grupo Cofares pudo ampliar los servicios logísticos integrales que presta al sector farmacéutico (laboratorios especialmente). Por su parte, Cofares Estudios y Proyectos es la empresa del Grupo Cofares que ofrece asesoría en logística especializada para una amplia gama de sectores, tanto en España como en otros países, exportando su conocimiento mediante proyectos específicos para cada tipo de cliente. Actualmente desarrolla su actividad en países como Colombia, México, Honduras, Portugal, Ecuador y Brasil, además de en nuestro país. Our Sterilization Experience is at your Service Un sólido sistema de calidad, combinado con nuestra experiencia, nos convierte en el más eficaz y competitivo socio para sus proyectos de productos estériles. Esterilización por radiación de: • Material de acondicionamiento primario. • Apis, excipientes y producto terminado. • Productos veterinarios. • Productos sanitarios y de laboratorio. ISO 13485, ISO 11137, FDA Type V, NCF (GMP) FARMESPAÑA INDUSTRIAL Asesoría y Consultoría • Cursos in Company • Dossier de Esterilización NOVIEMBRE/DICIEMBRE15 15 IONISOS IBERICA: Rocinante, 50 • 16400 Tarancón-Cuenca • 969 320 496 • www.ionisos.es • info@ionisos.es î ACTUALIDAD Festo: sistemas según el principio de modularidad Los fabricantes del sector de la automatización de procesos industriales deben acostumbrarse cada vez más a la fabricación de una mayor diversidad de productos en lotes más pequeños. Por este motivo, los sistemas que funcionan según el “principio de modularidad” son la respuesta acertada. Los usuarios pueden añadir o quitar módulos según sus necesidades. Esto únicamente se logra con la automatización modular. La plataforma de automatización CPX de Festo es el módulo principal, que sigue el lema de “multiplicar el número, en vez de escalar” (numbering-up en vez de scale-up). Los equipos de producción versátiles y constituidos por módulos, exigen unidades independientes, provistas de inteligencia artificial. Es aquí donde convergen la automatización de procesos de fabricación y la de procesos continuos, tal como lo plantea Industria 4.0, la cuarta revolución industrial. La digitalización y la inclusión en redes permiten conectar fiablemente módulos automatizados de nivel de campo con sistemas de control superior, estableciéndose una comunicación entre todas las unidades, así como los sistemas constituidos por módulos forman un conjunto fijo y, a la vez, modificable. La solución: Industria 4.0 Para que las empresas industriales del sector de la automatización de procesos sigan siendo competitivas en mercados cada vez más volátiles, es necesario disponer de procesos de producción más versátiles, tal como se prevén en “Industria 4.0”. Para ello es indispensable contar con equipos de producción capaces de adaptarse a circunstancias cambiantes, que puedan configurarse y organizarse a sí mismos y que, además, cuenten con un alto grado de interconexión. Y tratándose de equipos utilizados para la fabricación de lotes pequeños de productos diferentes, es necesario organizar por módulos los procesos y las funciones de partes del equipo completo. Los sistemas de control central existentes no son apropiados para la automatización de equipos constituidos por módulos. La transmisión de datos entre los sistemas de mando y de observación, así como la comunicación con los controladores suele organizarse a través de protocoles específicos del fabricante. Sistema modular e inteligente Los equipos del futuro serán modulares. Cada módulo incluye el sistema de 16 NOVIEMBRE/DICIEMBRE15 automatización completo que necesita para ejecutar su tarea. La automatización también podría estar a cargo de un sistema de control central. Pero tal sistema no prevé el funcionamiento de equipos constituidos por módulos, en los que éstos se sustituyen con frecuencia. Los módulos utilizados en sistemas de automatización de procesos requieren de sistemas de automatización pequeños e independientes. Con soluciones mediante módulos individuales, descentralizados e inteligentes, puede prescindirse de la programación y la configuración del software correspondiente a la aplicación. Los módulos pueden integrarse de manera muy sencilla en la solución completa de producción automatizada. De esta manera es posible agregar una gran cantidad de módulos automatizados, sin que por ello sea necesario ampliar la técnica de automatización del equipo completo. “De lo que se trata es de la ampliación o modificación sencillas de los equipos, sin que sea necesario recurrir a sistemas técnicos grandes y sofisticados. Es decir, buscar el numbering-up (multiplicar el número) en vez del scale-up (escalar)”, explica el Dr. Eckhard Roos, director de cuentas clave en el sector de automatización de procesos industriales de Festo. Plataforma de automatización CPX La plataforma de automatización CPX de Festo demuestra una vez más ser el módulo esencial de un sistema de automatización por módulos. Puede acoger en su plataforma la parte neumática con sus versiones en IP65/67, diversos controladores, así como IO remotas para numerosos sensores (por ejemplo, supervisión de presión, de temperatura). De esta manera es posible, entre otros, configurar plataformas modulares móviles (Skid) en sistemas de tratamiento de agua de diverso tipo, según lo exija la aplicación concreta. Estos Skids, en este caso sistemas de filtración plenamente transportables, son especialmente útiles en aplicaciones en las que el consumo de agua es relativamente bajo, y para las que deben prepararse diariamente hasta 1.000 m³ de agua. Con los filtros transportables, la puesta en funcionamiento del sistema de producción de agua puede hacerse muy rápidamente. Variantes de Skids: Mientras que, por ejemplo, los Skids de bombas necesitan una cantidad reducida de válvulas modulares agrupables en la parte neumática de la plataforma CPX/ MPA, los Skids de módulos de filtración requieren de entradas y salidas analógicas para controlar la presión. Los módulos algo más complejos, como, por ejemplo, un módulo de limpieza (CIP-Skid) que incluye partes del equipo y recipientes que contienen detergentes y otros fluidos para mezclar soluciones utilizadas para la limpieza, necesitan módulos de automatización adicionales en la plataforma CPX/ MPA, tales como entradas analógicas para medir temperaturas o controladores para la técnica proporcional. FARMESPAÑA INDUSTRIAL FARMESPAÑA INDUSTRIAL NOVIEMBRE/DICIEMBRE15 17 î AEPIMIFA De izquierda a derecha, Yves Billiet, Eugenio Pérez de Lema y José Cristobal. ASAMBLEA GENERAL DE AEPIMIFA 2015 En la tarde-noche del jueves día 12 de noviembre tuvo lugar la Asamblea General de Aepimifa. El evento se celebró en “El Palacio de la Misión”, ubicado en la madrileña Casa de Campo. E l Presidente, D. José Cristóbal Gil, se encargó de abrir la misma dando la bienvenida a los asistentes y exponiendo el guión previsto a desarrollar durante la jornada. A continuación D. David Calvo, administrador de Aepimifa, se encargó de explicar el proceso llevado a cabo en la organización de las elecciones a la Junta Directiva. Al no haberse presentado más candidaturas que la actual, quedó directamente proclamada la Junta con la siguiente composición: w Presidente: D.José Cristóbal, Laboratorios Rovi. w Vicepresidente: D.José Luis Moral, Abbott Laboratories w Secretario: D.Yves Billiet, AFI-Global w Tesorero: D. David Peña, Lilly w Vocal 1: D. David Alujas, OCS w Vocal 2: D. José Bueno, Chr Hansen w Vocal 3: Xavier Graciá, Laetus 18 NOVIEMBRE/DICIEMBRE15 Vocal 4: José Ignacio Fulgueira, Laboratorios Servier Su elección se produce acorde con lo establecido en los Estatutos de la Asociación, por un periodo máximo de tres años. D. David Peña continuó exponiendo las cuentas de la Asociación. Explicó que el esfuerzo realizado en este año 2015 ha supuesto un déficit en las cuentas que no se producía en años anteriores. La Asociación invirtió principalmente en la celebración de eventos como Farmaforum, la visita a la planta de Laboratorios Esteve, el taller w de Hablar en Público, el desarrollo de un plan de marketing, diferentes colaboraciones en otras jornadas celebradas, así como en los gastos habituales de Administración y suscripción de sus socios a la revista Farmaespaña Industrial. Especialmente significativo fue el gasto realizado en la organización de la última Asamblea. Eugenio Pérez de Lema, director del comité organizador de Farmaforum 2016, explicó a los asistentes cuáles serán las principales novedades de la próxima edición del que ya es el principal evento del sector. Éstas, así como el acuerdo suscrito por la Asociación con Farmaforum para la colaboración en la organización del congreso y la difusión del evento entre sus asociados, fueron acogidas con enorme interés entre los socios allí presentes. Posteriormente D. José Cristobal explicó detalladamente los eventos organizados en 2015. También adelantó algunas FARMESPAÑA INDUSTRIAL Cena de confraternización. Carlos Hernández Fernández, Cómo ver el vaso medio lleno. D. Yves Billiet. D. José Cristóbal. D. José Luis Moral. de las ideas que se tienen para llevar a cabo en 2016. Entre otras, destaca una visita a una planta europea, la colaboración nuevamente en Farmaforum, la organización de un curso de “Lean Manufacturing” así como otro de “Quality Risk Management”. A continuación, y siguiendo el planteamiento inicial de la Jornada, tuvo lugar la celebración de las elecciones. Al darse por canceladas las votaciones, por haberse presentado sólo una lista, se procedió a disfrutar del café entre los asociados asistentes, antes de comenzar la conferencia sobre FARMESPAÑA INDUSTRIAL La jornada transcurrió en un ambiente distendido. LA ASAMBLEA GENERAL DE AEPIMIFA SE CONSOLIDA AÑO A AÑO COMO CITA OBLIGADA DENTRO DEL SECTOR positivismo de Carlos Hernández titulada “Cómo ver el vaso medio lleno”. Carlos Hernández, haciendo uso de sus dotes de buen comunicador, y gracias a su dilatada experiencia como docente, consiguió hacer pasar una entretenida e interesante jornada a los presentes. Todos los asistentes pudieron además llevarse un ejemplar gratuito de su libro “Optimismo para torpes, Ser feliz, una cuestión de actitud” por cortesía de Aepimifa. Como en otras ocasiones, el encuentro terminó con una cena de confraternización entre aquellos asociados que quisieron quedarse a la misma. La Asamblea General de Aepimifa se consolida año a año como cita obligada dentro del sector NOVIEMBRE/DICIEMBRE15 19 antía î VALIDACIONES Y CERTIFICACIONES Confianza en los laboratorios, seguridad Isabel de la Villa en las medidas. Jefe del departamento de Sanidad Entidad Nacional de Acreditación, ENAC Calibración Acreditada MEDICAMENTOS SEGUROS: LA ACREDITACIÓN AL SERVICIO DE LA CONFIANZA DEL PRODUCTO FARMACÉUTICO ¿Son seguros los fármacos que consumimos? ¿Podemos confiar en las materias primas de los componentes de estos fabricantes? ¿Son sus proveedores de confianza? El sector farmacéutico necesita dar una respuesta afirmativa a estas cuestiones que garantizan la seguridad al consumidor. L a confianza en la calidad y seguridad de un producto farmacéutico es una máxima de toda la cadena de mercado, desde el proceso de fabricación, incluyendo los ensayos de control de calidad de las materias primas y el producto terminado, hasta el almacenamiento y distribución para hacerlo llegar al usuario final en óptimas condiciones. Cada uno de estos elementos es imprescindible para garantizar el acceso a productos farmacéuticos de calidad en interés de la protección y promoción de la salud de las personas. La legislación europea1 establece una serie de medidas de control y evaluación para conseguir estos objetivos. Así, el fabricante del medicamento debe comprobar, mediante auditorías trienales, que el proveedor de principios activos los produce cumpliendo las Normas de Correcta Fabricación (NFC). Estas auditorías pueden realizarse tanto por el propio fabricante como a través de un servicio externalizado. Asimismo, a lo largo del proceso de fabricación se realizan análisis y ensayos para determinar las características y calidad tanto de las materias primas como de los productos terminados. Para dar máximas garantías a esta estructura, es fundamental garantizar que estos mecanismos de control y evaluación (ensayos sobre los productos farmacéuticos, auditorías a proveedores, etc.) se realicen de forma rigurosa, con competencia e imparcialidad. Para ello, existe una herramienta establecida a escala internacional, la acreditación, creada con el objetivo de generar confianza sobre la actuación de las organizaciones que realizan actividades de 22 NOVIEMBRE/DICIEMBRE15 evaluación, como las auditorías, y ensayos (análisis químicos, microbiológicos, etc.). La acreditación es un mecanismo independiente, riguroso y global que evalúa y reconoce la competencia técnica de dichas organizaciones y se lleva a cabo conforme a normas internacionales. Esta actividad la realiza el correspondiente organismo nacional de acreditación, en España es la Entidad Nacional de Acreditación (ENAC)2. En el ámbito de los medicamentos el fabricante contrata en muchos casos a empresas externas especializadas en auditorías para evaluar el cumplimiento de las NCF en lugar de llevar a cabo las auditorías a proveedores de materias primas por sus propios medios. Con este sistema de evaluación es fundamental garantizar el rigor y la competencia técnica de las empresas que realizan dichas evaluaciones y es donde juega un papel fundamental la acreditación. Para ello, ENAC, en colaboración con la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), ha establecido un esquema de acreditación por el que se evalúan estas empresas utilizando como referencia la norma UNE-EN ISO/IEC 17020. Dos empresas españolas cuentan con esta acreditación: Forum Auditorías y Auditgmp Pharma S.L. acreditadas en 2013. Por otra parte, la realización de los ensayos sobre los productos para determinar sus características o el cumplimiento de determinados requisitos establecidos en normas o especificaciones, deben realizarse por laboratorios que garanticen resultados correctos o lo que es lo mismo, por un laboratorio técnicamente competente. La acreditación de laboratorios de ensayos mediante la norma internacional UNEEN ISO/IEC 17025 es la herramienta que proporciona la seguridad de que los ensayos realizados son fiables. Mediante un proceso de evaluación técnica altamente especializado se comprueba que los laboratorios disponen de personal cualificado y con experiencia, disponen de los equipos e infraestructuras necesarias, aplican métodos validados sometidos a programas de evaluación de la calidad de los resultados y garantizan la trazabilidad de las mediciones y calibraciones que realizan. La Norma UNE-EN ISO/ IEC 17025 también exige que el laboratorio disponga de un sistema de gestión de la calidad definido por la norma propia. Esta norma es aplicable a cualquier laboratorio que realiza ensayos como parte del control de calidad interno de la producción, laboratorios externos de apoyo en las actividades de control, etc. En España, dado que su objetivo es salvaguardar las garantías y la seguridad de los medicamentos y productos sanitarios, los laboratorios de control oficial de la AEMPS están acreditados por ENAC desde el año 2003 según la norma UNE-EN ISO/IEC 17025 (División de Productos Biológicos y Biotecnología y de la División de Química y Tecnología Farmacéutica) Referencias: 1 Directivas 2001/83/CE y 2011/62/UE 2 Real Decreto 1715/2010 FARMESPAÑA INDUSTRIAL Instrumentación y sistemas para la industria farmacéutica Validación de procesos térmicos IBERFLUID junto a su representada ELLAB se posicionan como un referente en las validaciones de procesos térmicos para la industria farmacéutica. Dataloggers Tracksense Pro Comunicación inalámbrica en tiempo real. Temperaturas de trabajo: -80ºC a 400ºC Esterilización con vapor. Liofilización. Despirogenización. Óxido de etileno y H2O2. Cámaras de estabilidad. Ultracongeladores. Sede Central Barcelona +34 933 333 600 iberfluid@iberfluid.com Delegación Centro Alcobendas (Madrid) +34 916 611 717 madrid@iberfluid.com Delegación Norte Basauri (Vizcaya) +34 946 715 012 nor@iberfluid.com www.iberfluid.com Delegación Sur Sevilla +34 955 452 780 sevilla@iberfluid.com Delegación Portugal Lisboa +351 210 993 616 portugal@iberfluid.com î ESTERILIZACIÓN D. Carlos Mingo Pascual Ldo. en C. Químicas y Director Comercial de la empresa Controltecnica LA ESTERILIZACIÓN FÁCIL, SEGURA, PRECISA, REPRODUCIBLE Y VALIDABLE E l proceso de esterilización en autoclave puede resultar difícil en algunas ocasiones. Por ejemplo, cuando esterilizamos líquidos o sólidos (instrumentación, vidrio, filtros o textiles) para su posterior uso en el laboratorio, el proceso de esterilización debe asegurar la esterilización del producto, siempre reproducible. En los productos esterilizados para su uso en laboratorio no se puede testar la esterilidad a posteriori, ya que dicho test podría contaminar de nuevo el producto, impidiendo su posterior utilización. La validación de los procesos se ha convertido en una materia importante a la hora de asegurar resultados reproducibles que puedan ser verificados. Es más, deben considerarse los aspectos relativos a la seguridad durante el autoclavado, y en particular, cuando se esterilizan líquidos. Normalmente la esterilización se lleva a cabo a temperaturas de 121°C, lo que corresponde a una presión de vapor aproximada de 2 bares. Estas altas temperaturas y la consiguiente presión pueden Figura 1. Proceso de esterilización / Fases. Línea azul: Temperatura en el interior de la cámara del autoclave (recipiente a presión). Línea roja: temperatura medida en el interior del líquido. 24 NOVIEMBRE/DICIEMBRE15 considerarse un riesgo potencial importante para el usuario si el autoclave tiene defectos de diseño o la esterilización no se realiza correctamente. Esterilización de líquidos y líquidos de desecho en frascos La esterilización de líquidos es una de las tareas más demandadas hoy en día en los laboratorios. Pero este proceso puede conllevar mucho tiempo, los frascos deben permanecer abiertos o ventilados y parte del líquido puede llegar a ebullición y evaporarse o incluso los frascos pueden estallar debido a esta ebullición. Otro problema a tener en cuenta es saber si el líquido del interior de los frascos ha alcanzado la temperatura requerida de esterilización (ej. 121°C) o cuándo debería ser seguro sacar los frascos del autoclave, una vez completado el proceso de esterilización. Observando el proceso de esterilización para líquidos, éste se divide en tres fases: 1. Fase de calentamiento hasta alcanzar el equilibrio (H) 2. Fase de esterilización, por ejemplo a 121°C durante 20 min.(S) 3. Fase de enfriamiento hasta alcanzar una temperatura segura para retirar el material esterilizado. (C). La Figura 1 detalla las fases individuales en forma de gráfico. La línea azul representa la temperatura registrada en el recipiente situado en el interior del autoclave; la línea FARMESPAÑA INDUSTRIAL Amo mi pipeta electrónica porque no causa lesiones ni dolor. #passionforscience Picus® NxT. La pipeta electrónica más liviana. Evite el RSI gracias una ergonomía única. Acelere su rutina con flujos de trabajo personalizados y cumpla con las regulaciones más estrictas gracias a una calibración acreditada en 3 puntos. Comparta su #passionforscience en www.passionforscience.com Pesaje | Agua de Laboratorio | Centrifugación | Manejo de líquidos | Filtración | Análisis Microbiológico | Servicios ESTERILIZACIÓN de la resistencia de los microorganismos a eliminar, éstos se inactivarán sólo en parte. Medición de la temperatura en un frasco de referencia Midiendo la temperatura del interior de un frasco de referencia mediante un sensor introducido en el mismo, se puede determinar la temperatura exacta del líquido que se desea esterilizar y así se podría regular el proceso de esterilización. La esterilización en sí comenzará sólo cuando el líquido del frasco de referencia haya alcanzado la temperatura de esterilización. El frasco de referencia deberá rellenarse con agua. Es crucial que el tamaño y el llenado del frasco de referencia se corresponda con el tamaño y el frasco más grande y con más líquido que se quiera esterilizar. Figura 2. Medición de la temperatura. roja representa la temperatura registrada en el líquido. Se puede apreciar claramente que el recipiente alcanza la temperatura deseada mucho más rápido, mientras que el líquido que permanece en el interior de los frascos, necesita más tiempo para alcanzar la temperatura de esterilización. Durante la fase de calentamiento, la energía térmica del vapor se transfiere a los frascos, lo que conlleva una condensación del vapor. Dicho proceso de condensación y su consiguiente transferencia térmica requiere de tiempo, explicando así el lapsus de tiempo que existe entre el calentamiento del recipiente y el calentamiento de los líquidos de su interior. El tiempo requerido para alcanzar las mismas temperaturas en el interior y exterior de los frascos se denomina “tiempo de equilibrio”. Muchos de los autoclaves utilizados hoy en día en los laboratorios aún no están equipados con un medidor de temperatura en un frasco de referencia, por lo que la temperatura exacta del líquido que se quiere esterilizar no se está midiendo, y no se puede utilizar este dato para regular el procedimiento de esterilización. Estos autoclaves comienzan la fase de esterilización una vez que se ha alcanzado la temperatura en los recipientes, luego no se toma en 26 NOVIEMBRE/DICIEMBRE15 consideración el lapsus de tiempo existente entre el calentamiento de los frascos y el calentamiento del líquido en sí. De este modo, los líquidos no alcanzarán la temperatura de esterilización deseada y en consecuencia, la efectividad biológica del proceso de esterilización no se podrá asegurar. Dependiendo LA NORMA DIN EN 61010-2-040 ESTIPULA QUE LOS AUTOCLAVES USADOS PARA LA ESTERILIZACIÓN DE LÍQUIDOS DEBEN ESTAR EQUIPADOS CON DISPOSITIVOS DE SEGURIDAD Y PREVENCIÓN DE APERTURA DE LA PUERTA PREVIA A QUE LOS LÍQUIDOS HAYAN ALCANZADO LA TEMPERATURA SEGURA DE EXTRACCIÓN Temperatura de extracción segura El sensor de temperatura que mide en el interior del vaso de referencia es necesario para asegurarnos que se ha alcanzado la temperatura de esterilización en el líquido a esterilizar. Pero también es necesario para retirar los vasos del autoclave de forma segura una vez finalizado el proceso de esterilización. En el interior del autoclave, los líquidos se han calentado hasta temperaturas considerablemente superiores a la temperatura de ebullición (100°C). El calor transferido al interior de los líquidos, junto con el exceso de presión, podría ocasionar considerables peligros para el usuario. Por ejemplo, podría darse una ebullición retardada, lo que significa que el líquido empezaría a bullir de forma repentina cuando se abriera el autoclave. Esta ebullición instantánea generará una onda de presión consistente en vapor y líquido caliente, erupcionando de los vasos. ¡1 litro de agua generaría 1000 litros de vapor! Debido al potencial riesgo de peligro de explosión de recipientes, los autoclaves utilizados para la esterilización de líquidos deben estar sujetos a las correspondientes regulaciones y normas. La norma DIN EN 61010-2-040 estipula que los autoclaves usados para la esterilización de líquidos deben estar equipados con dispositivos de seguridad y prevención de apertura de la puerta previa a que los líquidos hayan alcanzado la temperatura segura de extracción. Una extracción segura se define de forma estándar cuando la temperatura es 20°C inferior a la temperatura de ebullición del agua a temperatura y presión atmosférica. Esto significa que la extracción de seguridad se da a los 80°C. Los autoclaves FARMESPAÑA INDUSTRIAL SALAS LIMPIAS Ingeniería, diseño, fabricación, instalación y mantenimiento. NUEVA DELEGACION Calle Miño 1, Edificio 6, Nave 5, Bajo A Polígono Industrial "La Raya" 28816 - Camarma de Esteruelas Madrid Tel. +34 91 134 27 68 Especializados en la fabricación a medida de Cabinas de Pesada y Protección, Flujos laminares, Duchas de Aire, SAS... Venus, 55-B, Pol. Ind. Can Parellada, 08228 Terrassa, Telf. +34 93 784 28 25 Visita nuestra Web www.igunapharma.com info@igunapharma.com ESTERILIZACIÓN Figura 3. Enfriamiento con soporte de presión. modernos están equipados con bloqueos de la puerta dependientes de la temperatura y presión internas. Esto previene la apertura del autoclave cuando la presión aún es alta y los líquidos no han alcanzado la temperatura segura de extracción de 80°C. El enfriamiento de los líquidos hasta la temperatura segura de extracción puede conllevar bastante tiempo. Un tamaño de autoclaves utilizado con frecuencia en los laboratorios es aquel con una capacidad de recipientes de aproximadamente 150 litros. En este tipo de autoclaves, llenos de botellas con líquido a esterilizar, el total del ciclo de esterilización podría llevarnos hasta 10 horas. Lo que significaría que en un día de trabajo, no podríamos llevar a cabo más de una esterilización completa. Por ello es recomendable equipar el autoclave con un sistema de enfriamiento que reduzca considerablemente el tiempo necesario para esterilizar el lote y que prevenga las desventajas de la esterilización de líquidos. Enfriamiento rápido – máxima productividad y seguridad Los sistemas de re-enfriamiento para autoclaves básicamente distinguen entre dos tipos de sistemas de refrigeración: a. Enfriamiento por evaporación – ebullición del líquido durante la fase de enfriamiento b. Enfriamiento por radiación – calor irradiado por el líquido, no hay ebullición del líquido con este sistema de refrigeración 28 NOVIEMBRE/DICIEMBRE15 Figura 4. Ultracooler. EL ENFRIAMIENTO RÁPIDO CON SOPORTE DE PRESIÓN SUPONE UNA GANANCIA SUSTANCIAL EN LA PRODUCTIVIDAD, YA QUE EL TIEMPO DEL PROCESO EN COMPARACIÓN CON LA AUTO-REFRIGERACIÓN SE REDUCE CONSIDERABLEMENTE a) El enfriamiento por evaporación suele ser el tipo de enfriamiento más usado en los autoclaves. Puede ser: w Auto-enfriamiento, liberando vapor lentamente w Enfriamiento por ventilación de aire – el aire ambiente frío es impulsado hacia los recipientes desde el exterior w Refrigeración por agua sin soporte de presión Todos los sistemas de enfriamiento comentados anteriormente tienen serias desventajas en la esterilización de líquidos y pueden conllevar peligro, si el proceso de esterilización no se lleva a cabo de forma adecuada, ya que este tipo de enfriamiento requiere que el líquido se enfríe pasando por el punto de ebullición. 1. Cuando los líquidos bullen durante la fase de enfriamiento, se pierde parte del líquido. La pérdida de líquido suele rondar entre el 3 y el 10%, pero puede ser considerablemente superior, dependiendo del contenido del líquido. Especialmente, si el contenido de proteínas del líquido es alto, éste tenderá a hervir incluso más, incrementando de nuevo la perdida de líquido. 2. Como los líquidos deben hervir para enfriarse, los botes sólo podrán llenarse hasta la mitad o hasta una tercera parte de ellos para prevenir la pérdida de líquido durante la ebullición. Esto conlleva, por una parte, una considerable pérdida en la productividad, ya que el 50-70% de la capacidad de los botes se pierde. 3. Por otra parte, seguramente no podamos prevenir que los líquidos se derramen por la ebullición, y deberemos limpiar el autoclave para evitar que los líquidos, como por ejemplo aquellos hechos con Agar, se introduzcan en el interior de la válvula de drenaje y la obstruyan cuando se enfríen y solidifiquen. 4. Los líquidos sólo podrán hervir si están abiertos, por lo que los botes deberán estar abiertos o por lo menos ventilados (tapa entre-abierta). Si nos olvidamos de ventilar los botes o lo hacemos de forma indebida, el líquido no podrá hervir durante la fase de enfriamiento y no se enfriarán. Una vez que el vaso de FARMESPAÑA INDUSTRIAL Figuras 5 y 6. Ineficaz eliminación del aire. referencia haya alcanzado la temperatura de 80°C y el autoclave nos permita abrirlo, los vasos cerrados herméticamente aún conservarán la temperatura de esterilización con su consiguiente presión. Esto plantea un peligro considerable, ya que estas botellas pueden explotar durante la retirada del autoclave y el líquido contenido en el mismo puede evaporarse espontáneamente–similar a una ebullición retardada. Recuerden que 1 litro de agua genera 1.000 litros de vapor. Por ello se recomienda, al adquirir un autoclave, definir exactamente qué aplicación se utilizará y cómo debe estar equipado el mismo con lo que respecta a la productividad y seguridad. b) Enfriamiento por radiación (Enfriamiento rápido con soporte de presión) Tiene ventajas considerables en comparación con la refrigeración por evaporación. Durante el enfriamiento rápido con soporte de presión, el recipiente se enfría a través de toda su superficie gracias a serpentines de enfriamiento conectados externamente con agua fría. Antes de que la refrigeración se active después de la fase de esterilización, el vapor del interior de los recipientes a presión se sustituye por aire comprimido filtrado estéril. Este aire presurizado evita de forma segura que el líquido llegue a ebullición durante la fase de enfriamiento. El calor se transfiere desde el líquido a las paredes frías del recipiente por medio de radiación, enfriándolas. FARMESPAÑA INDUSTRIAL productividad. Podrá incluso utilizar botellas herméticamente cerradas; luego abrir o ventilar las botellas ya no será necesario. Figura 7. Vaciado completo. El enfriamiento rápido con soporte de presión supone una ganancia sustancial en la productividad, ya que el tiempo del proceso en comparación con la auto-refrigeración se reduce considerablemente. Considerando que la auto-refrigeración requiere hasta 10 horas en un proceso general de esterilización, el tiempo de enfriamiento por enfriamiento rápido con soporte de presión puede reducirse hasta un 60% en función de la cantidad de líquidos procesados. Por otra parte, todos los peligros e inconvenientes descritos en la refrigeración por evaporación (ebullición tardía, la pérdida de líquido, durante la ebullición, sin refrigeración en el interior de los botes herméticamente sellados) se eliminan de forma fiable, ya que el líquido no hierve. Este tipo de refrigeración permite que las botellas se llenen hasta su nivel máximo, ganando Optimizar aún más los ciclos Los nuevos autoclaves permiten optimizar aún más el enfriamiento de líquidos en módulos. Esto aumenta aún más la productividad, e influye en la calidad de los líquidos a esterilizar. Muchos de los líquidos contienen ingredientes que no son muy termoestables. Los líquidos deben ser esterilizados, el tiempo, sin embargo, que estarán expuestos al calor, debe ser tan corto como sea posible de modo que los componentes termolábiles no sufran impactos negativos. Módulo 1 – Ventilador radial El ventilador radial genera una corriente de aire en el interior de los recipientes del autoclave durante la fase de enfriamiento. Esta corriente de aire obliga al calor de las paredes del recipiente a enfriarse por enfriamiento rápido con presión de apoyo. Este proceso acortará el tiempo de enfriamiento hasta en un 70% en comparación con la auto-refrigeración. Módulo 2 – Ultracooler (Ultraenfriamiento) El ultracooler es un intercambiador adicional de calor enfriando las paredes con agua y está integrado directamente en el interior del autoclave. Por medio de una transferencia térmica mejorada sustancialmente, el tiempo de enfriamiento puede NOVIEMBRE/DICIEMBRE15 29 ESTERILIZACIÓN reducirse hasta en un 90% con respecto a la auto-refrigeración. Esterilización de sólidos y bolsas de desechos Cuando esterilizamos sólidos (por ejemplo, instrumentos, material de vidrio, puntas de pipeta en cajas, filtros y textiles), así como residuos en bolsas de destrucción hay que asegurarse de que una atmósfera de vapor se está construyendo exactamente sobre y dentro del producto a esterilizar. Muchos autoclaves no eliminan el aire de forma fiable del autoclave y del producto. Si el aire permanece dentro del autoclave y del producto, el efecto de la esterilización no será posible, ya que sólo el vapor transporta la energía térmica requerida para desactivar de forma fiable los microorganismos. Eliminación del aire ineficaz Las ilustraciones 5 y 6 muestran una eliminación de aire ineficaz utilizando el ejemplo de una caja con puntas de pipeta y bolsas de desecho. Si el autoclave se calienta simplemente, el aire se desplaza y una atmósfera de vapor se acumula dentro del recipiente del autoclave pero el aire permanecerá en el interior del producto a esterilizar impidiendo que el vapor entre donde se necesita su energía térmica para conseguir un efecto esterilizante. A la misma temperatura en forma de vapor (por ejemplo, 121°C), el aire contiene sólo una fracción de la energía térmica requerida. Para productos que no pueden ser esterilizados dentro de una atmósfera de vapor, hay esterilizadores de aire caliente– sin embargo, se esterilizan a temperaturas más altas (180–250°C) que requieren mucho más tiempo (hasta varias horas de esterilización). El efecto de esterilización del aire a temperaturas de 121°C–134°C no está determinado en la praxis. Eliminación eficaz del aire Para una eliminación completa y reproducible del aire del autoclave y del producto a esterilizar, deberá llevarse a cabo un pre-fraccionamiento del vacío. Por tanto, el autoclave deberá estar equipado con un sistema de vacío. Durante la fase de calentamiento, van teniendo lugar los ciclos de vacío para la eliminación eficaz del aire, seguido de inyecciones de vapor. Por lo general, se aplica un triple fraccionado de pre-vacío–dependiendo del producto, sin embargo, podrían ser necesarias más fracciones. 30 NOVIEMBRE/DICIEMBRE15 EL TRBA 100– REGLAMENTO TÉCNICO DE MATERIALES BIOLÓGICOS DE TRABAJO–EXIGE QUE EN LOS LABORATORIOS DE NIVEL DE SEGURIDAD S2 EL AIRE DE ESCAPE DE UN AUTOCLAVE DEBA SER ENTENDIDO COMO AIRE POSIBLEMENTE CONTAMINADO Secado de objetos sólidos – Superdry (Supersecado) Los sólidos como se suelen colocar en el interior de un horno de secado después del proceso de esterilización. Los nuevos autoclaves permiten el secado de sólidos directamente después del proceso de esterilización. Esterilización y secado en un solo proceso. Así, no sería necesario el manejo de los materiales esterilizados, lo que podría producir una re-contaminación. Esterilización de sustancias biológicas peligrosas La esterilización de sustancias biológicamente peligrosas es un reto especial. Durante la fase de calentamiento, el aire del interior del autoclave se sustituye con vapor. El aire se desplaza del autoclave y se libera a la habitación donde esté instalado. El TRBA 100–Reglamento Técnico de Materiales Biológicos de Trabajo–exige que, en los laboratorios de Nivel de seguridad S2, el aire de escape de un autoclave debe ser entendido como aire posiblemente contaminado por microorganismos procedentes del producto esterilizado. Debe utilizarse, pues, un proceso adecuado. En el caso de autoclaves, se utiliza generalmente la filtración. Por tanto, el autoclave deberá estar equipado con un filtro de escape de aire. Todo el aire contaminado desplazado desde el autoclave pasa al filtro siendo retenidos los microorganismos en él. El filtro se esteriliza „in-line“ durante el proceso de esterilización para desactivar los microorganismos retenidos en el mismo. La norma TRBA 100 hace referencia sólo al aire de escape liberado, pero no al condensado recogido. Durante el proceso de esterilización, el vapor se condensa en el producto a esterilizar y se convierte de nuevo en agua (condensado). Este agua también puede estar contaminada por microorganismos. Por lo que el condensado debe permanecer dentro del autoclave durante el proceso de esterilización y también debe ser esterilizado „in line“ antes de ser drenado. Cualificación y validación Durante la cualificación se verifica si un equipo es adecuado para el uso que se le quiere dar así como el proceso a llevar a cabo – por ejemplo un proceso de esterilización – considerando el producto a ser esterilizado con un resultado continuo (reproducible). Generalmente, el proceso de cualificación se divide en 3 partes básicas: 1. IQ – Cualificación de la instalación: verifica que el equipo ha sido fabricado e instalado de acuerdo a sus especificaciones. 2. OQ – Cualificación de la operación: verifica que el equipo trabaja generalmente de acuerdo a las funciones especificadas. 3. PQ – Cualificación del Rendimiento: verifica que el dispositivo, con el producto a tratar, funciona de acuerdo con las especificaciones. El objetivo de la cualificación y validación es una prueba documentada de que un dispositivo es adecuado para su uso previsto. El efecto del proceso de esterilización en el autoclave se verifica durante la OQ y PQ (con material a esterilizar) por medio de data loggers externos de temperatura y presión, así como usando bio-indicadores basados en Bacilus Stearothermophilus. Mientras que los data loggers (registradores de datos) externos de temperatura y presión proporcionan evidencia de que el controlador del autoclave muestra y documenta valores fiables así como de que éste lleva a cabo la esterilización dentro de los valores de tolerancia, los bio-indicadores proporcionan evidencia de la eficiencia biológica. Ensayos en Autoclaves según Normas de Farmacopea Por último, cabe destacar la necesaria flexibilidad que se requiere en la configuración de los autoclaves para poder adaptarse al cumplimiento de programas y test específicos como los dictados por las normas de Farmacopea (ejemplos: 3.2.1 Recipientes de vidrio para uso farmacéutico, 3.2.9 cierres de goma para recipientes de preparaciones parenterales, polvos o liofilizados en polvo, etc.) FARMESPAÑA INDUSTRIAL Tratamiento por rayos gamma Co-60 Dedicados al servicio de la irradiación Método efectivo Fácil de monitorizar No precisa cuarentena Rápido y fiable Esterilización final Productos sanitarios Ausencia de residuos La primera empresa española en tratamiento por rayos gamma. Desde 1970. Autorizaciones: 4824PS NCF: 4156-E RSIPAC B-001/05 Productos farmacéuticos Productos cosméticos Productos alimentarios Certificación: ISO 13485:2003 Investigación (polen, electrónica,...) La única planta industrial de tratamiento por rayos gamma de Co-60 en España Aragogamma, S.A. Crta. de Granollers-Cardedeu, Km. 3,5 08520 Les Franqueses del Vallés Barcelona +34 93 849 66 39 Oficinas: Salvador Mundí, 11 08017 Barcelona +34 93 204 97 03 www.aragogamma.com info@aragogamma.com î ESTERILIZACIÓN M.L. Bernuzzi R&D Manager, Fedegari Autoclavi SpA www.fedegari.com CÓMO DESARROLLAR UNA ESTRATEGIA DE LIMPIEZA EFECTIVA Son diversos los aspectos a tener en cuenta en el desarrollo de un procedimiento de limpieza. Se trata de un elemento multidisciplinario que implica a diversas áreas de la empresa: desde Regulaciones a Ingeniería, pasando por el Laboratorio de Control de Calidad y Producción. Las aportaciones de la unión de estas áreas pueden conducirnos a un proceso de limpieza robusto y reproducible. E l proceso de limpieza es una práctica esencial en cualquier actividad farmacéutica: es imposible producir medicamentos en condiciones de suciedad, incluso cuando ésta no es evidente. Definir la diferencia entre esterilización y tratamiento de limpieza es importante para entender en profundidad los principales problemas y peculiaridades a la hora de definir una estrategia de limpieza. Esterilizar Limpieza automática Limpieza manual In-place cleaning Out-of-place cleaning Equipo dedicado Equipo no dedicado Superficies de contacto indirecto con el producto Superficies de contacto con el producto Fábrica de riesgo bajo Fábrica de riesgo elevado Equipamiento menor Equipamiento superior Medicamentos de riesgo bajo Medicamentos de riesgo elevado Ámpliamente caracterizado Poco caracterizado Formulaciones líquidas Formulaciones sólidas Producto de limpieza fácil Producto de limpieza difícil Materiales con superficie suave y no porosa Materiales porosos Instalación de producción dedicada Instalación multi-producto Producción no estacionalizada Producción estacionalizada Tabla 1. Espectro de limpieza – Artículo Técnico número 29 de la PDA. 32 NOVIEMBRE/DICIEMBRE15 significa destruir o desactivar microorganismos: conocemos el objetivo y podemos definirlo en términos de números (UCF/unidad) y resistencia (D, z). La definición de un producto/ítem estéril (PNSU – Probabilidad de Unidad No Estéril o SAL – Nivel de Seguridad de Esterilidad) es probabilística, pero universalmente aceptada. La cinética de los procesos de esterilización estándar es perfectamente conocida y como resultado también lo es la determinación de la dosis letal a administrar. Por otra parte, en un proceso de limpieza, el llamado “enemigo” no está definido y, en cualquier caso, puede variar en cada caso: residuos de un producto procesado anteriormente, diluyentes, solventes, químicos varios, lubricantes, suciedad genérica, m.o., etc. No existe una definición absoluta de limpieza. La cinética de un procedimiento de limpieza es desconocida y, como consecuencia, FARMESPAÑA INDUSTRIAL EQUIPOS DE PROCESO Alta Contención Estéril Sistemas para transferencia y manipulación de sólidos con necesidad de Contención. Maquinaria de proceso para producción de fármacos estériles líquidos y liofilizados. Otros Equipos y Servicios Ingeniería, Automatización y Componentes para proceso y servicios. Proyectos llave en mano. Trabajamos con los mejores fabricantes e Ingenierías Europeas BAUSCH Advanced Technology Group Farmacéutica • química • biotecnoloGía www.branir.com • Tel: 606 704 739 • jrp@branir.es ESTERILIZACIÓN la definición de “dosis de limpieza” es indeterminada. En estas condiciones incluso los organismos regulatorios encuentran problemas. En esencia, permiten a los productores una amplia flexibilidad para establecer sus propias especificaciones de limpieza. La FDA, por ejemplo, no define métodos para validar un proceso de limpieza. Sus inspectores tienen que evaluar la lógica utilizada para marcar los límites de limpieza, asegurando que la base es científicamente justificable y basada en un conocimiento adecuado de los materiales implicados. El artículo técnico número 29 de la PDA sugiere un espectro de limpieza que incluye criterios para el desarrollo de un programa de limpieza, características de equipos, características del producto y/o formulación y características del proceso y/o producción (ver Tabla 1). Todos los factores listados en la Tabla 1 influyen en la capacidad de limpieza del proceso a considerar. Su importancia puede tener un impacto distinto en cada caso de estudio. El espectro de limpieza puede ayudarnos a evaluar los factores que más afectan al proceso y a su vez permiten a cada productor establecer una escala de prioridades y esbozar una lógica del sistema de limpieza. Como se puede ver, hay muchos aspectos a tener en cuenta cuando se aborda el proceso de limpieza y, como primer elemento, se debe considerar si realizar el proceso “In-place – (CIP)” o “Out of place – (COP)”. Principales aspectos para distinguir/ condicionar un proceso de limpieza 1. Punto de limpieza: CIP vs. COP El proceso CIP se realiza sobre el equipo en su ubicación y configuración habitual. El proceso puede ser tanto manual como automático y suele realizarse para componentes grandes y equipos: reactores de fermentación, secadores de lecho fluido, etc. El COP suele realizarse para partes más pequeñas, que son llevadas a un área dedicada. Normalmente son aparatos o partes de menor tamaño, fácilmente desmontables y de limpieza difícil. El transporte en sí mismo conlleva una atención especial para identificar el elemento y sus componentes (de hecho acostumbra a implicar operaciones de desmontaje) y precauciones contra la contaminación cruzada durante el transporte, secado final y almacenamiento tras 34 NOVIEMBRE/DICIEMBRE15 Fig. 1 Pieza de un Sistema de encapsulación: considerablemente crítico debido al montaje de partes en un único elemento que no puede desmontarse para el tratamiento. la limpieza. El COP de objetos fácilmente transportables a menudo se realiza con equipos totalmente automáticos. Cuando tratamos varios objetos que no resultan claramente similares, una cuidadosa clasificación en familias es necesaria para obtener resultados uniformes. Si se siguen todas las precauciones, el procedimiento puede ser muy efectivo y repetible. 2. Limpieza automática vs. manual La limpieza manual es bastante común, pero los retos que suponen la ineficiencia, inconsistencia y las dificultades de trazar y documentar el proceso, son a menudo mencionados. El riesgo de contaminación cruzada aumenta si la limpieza se lleva a cabo con equipos manuales o semi-automáticos, dado el margen de error que aporta el operario responsable de dicha actividad. Normalmente, los sistemas automáticos no implican intervención humana más allá de seleccionar el ciclo, iniciar el equipo y detenerlo al acabar. Para la validación de la limpieza, al igual que para la validación de otros procesos, al final del mismo se deben ofrecer datos científicos que muestren que el sistema funciona como esperado con un resultado consistente de acuerdo con los requerimientos predeterminados. El uso de la automatización ofrece datos fiables, uniformidad y robustez del proceso para ciclos y parámetros de control y monitorización. Como consecuencia, la estandarización y reproducibilidad de los procedimientos pueden facilitar el proceso de validación. Otro punto a considerar, sobre todo en cuanto a validación, es la efectividad total del proceso. ¿Ha tenido que ser fregado a mano para una limpieza efectiva? Para la mayoría de cargas, se sugiere el uso de racks con boquillas de spray especiales. Estos dispositivos, diseñados para lavadoras automáticas, están desarrollados para alcanzar todas las superficies de la carga y personalizados para peculiaridades de limpieza, simplificando aún más su validación incluso para los casos más complejos (ver apartado Diseño y rendimiento de equipos). Además, un sistema de limpieza automático ofrece diversas ventajas en cuanto a reducción total del tiempo de proceso, optimización de los flujos de material, trazabilidad y documentación, mayor rendimiento y reducción total de los costes energéticos y operativos. 3. Lugares críticos vs. no críticos El riesgo varía en función de: w Identificación de un peligro w Posibilidad de detector un peligro w Exposición a un peligro identificado Los lugares donde un residuo puede crear un alto nivel de contaminación se consideran puntos de riesgo elevado. Por ejemplo, una aguja de un sistema de llenado. Aquellos puntos críticos donde la acumulación de contaminante es mayor o la limpieza es más difícil (debido a una accesibilidad limitada o por el tipo de material) requieren una atención especial, correspondiéndole unos niveles de aceptación específicos del límite de residuos. En el ejemplo de la Figura 1, las partes utilizadas en la producción de cápsulas están contaminadas con una gelatina de color llamativo y muy difícil de limpiar, sobre todo en las piezas internas y juntas. El problema se solucionó con el uso combinado de vapor y aire comprimido durante el proceso de limpieza. Fedegari ha desarrollado un enfoque de limpieza específico y a medida, basado en un efecto bubbling dentro del plato (centrado en la acción mecánica). Dos barras con boquillas fijadas en la parte inferior de la cámara inyectan agua desionizada, vapor y aire comprimido. 4. Producción estéril vs. no estéril Tal y como se ha comentado anteriormente, una actividad de limpieza puede llevarse a cabo como un paso preliminar. Si un sistema o pieza de un equipo o herramienta se utiliza para la producción de medicamentos estériles, la esterilización debe programarse tras la limpieza. En este caso, para alcanzar la reducción del bioburden durante los procesos de limpieza es “preparatoria” para la siguiente reducción del SAL a 10-6. A su vez, eliminando la suciedad, se priva al microorganismo de un medio de crecimiento y de un medio de protección del agente biocida. Los residuos de material orgánico pueden causar un fallo del tratamiento de inactivación de carga microbiana. FARMESPAÑA INDUSTRIAL ESTERILIZACIÓN Ante la creciente demanda de flexibilidad y efectividad de costes en la producción farmacéutica, Fedegari ha desarrollado, por ejemplo, un autoclave de lavado y esterilizado. Es capaz de operar en diferentes modos para optimizar procesos donde limpieza y esterilización son necesarios. Este equipo ofrece características y funciones típicas de un esterilizador a vapor en una lavadora a chorro, utilizando vapor para mejorar las funciones de lavado y desgrasado y aspiración para el secado. Además, resulta un equipo más respetuoso con el medio ambiente gracias a un consumo de energía inferior al de las alternativas tradicionales. 5. Consideraciones de los equipos: sistemas de producción dedicados vs. no dedicados w Productos difíciles de eliminar: tipo tar, caucho, etc. w Elementos difíciles de limpiar: filtros, estructuras tipo convoluted con lumens peuqeños w Productos de alta actividad/riesgo elevado Los procedimientos de limpieza deben minimizar los límites residuales de principios de riesgo elevado/alta actividad que puedan contaminar lotes de producto. Cuando un mismo equipo es utilizado para diferentes formulaciones de producto, la prevención de riesgo de residuos se convierte en una prioridad. En esos casos, los sistemas para prevención de contaminación cruzada deben adoptarse y mantenerse rigurosamente. Es más, para sistemas OS PROCEDIMIENTOS L DE LIMPIEZA DEBEN MINIMIZAR LOS LÍMITES RESIDUALES DE PRINCIPIOS DE RIESGO ELEVADO/ ALTA ACTIVIDAD QUE PUEDAN CONTAMINAR LOTES DE PRODUCTO de producción no dedicados, el diseño de racks de lavado (por ejemplo, unidades de limpieza de piezas) debe modificarse de acuerdo con la carga. 6. Prevenir errores de funcionamiento a través de un tratamiento de limpieza adecuado El CFR (Code of Federal Regulation) 21 parte 211.67, “Actuales buenas prácticas de producción para productos farmacéuticos acabados” dice sobre los equipos de limpieza y mantenimiento: (a) Los equipos y utensilios deben ser limpiados, mantenidos y, según la naturaleza del medicamento, sanitizados y/o esterilizados a intervalos apropiados para prevenir fallos o contaminación que pudiera alterar la seguridad, identidad, potencia, calidad o pureza del producto más allá de la oficial o de los requerimientos establecidos. Primero, el proceso de limpieza debería asegurar la seguridad y calidad del medicamento producido. En cualquier caso, una Figura 2. Cupón ensuciado con Diprosteno – ajuste fino del proceso de limpieza de una pieza en el departamento de I+D de Fedegari. 36 NOVIEMBRE/DICIEMBRE15 estrategia de limpieza debe considerar el desarrollo más adecuado, evitando daños y contaminación sobre las piezas tratadas y al equipo de limpieza. Como consecuencia, temperatura, presión, flujo y agresividad de los agentes químicos aplicados durante el proceso deben ser realizados a medida y validados de acuerdo con el tipo de carga y producción. Por ejemplo, Fedegari ha desarrollado recientemente una serie de lavadoras industriales utilizando su experiencia con vapor para reducir la necesidad de detergentes y agentes químicos, manteniendo a su vez la efectividad en la limpieza. Una estrategia de limpieza adecuada es estudiada por el departamento de I+D para cada caso, asegurando un equilibrio correcto entre parámetros de proceso (como presión, temperatura, etc.) y objetivo de limpieza. 7. Aspectos de la proliferación microbiana Aquellos elementos susceptibles de ser limpiados deben ser almacenados en seco, para evitar el riesgo de crecimiento microbiológico. Humedad elevada, fisuras, grietas y superficies muy rugosas que puedan no secarse perfectamente al final de la fase de secado representan serias amenazas para la proliferación de microorganismos. Durante el desarrollo de una estrategia de limpieza, una compañía farmacéutica debe establecer el plazo de tiempo oportuno entre la limpieza y su reutilización (CLEAN HOLD TIME) y entre el fin de uso del equipo y el inicio de la limpieza (DIRT HOLD TIME). Este procedimiento se aplica para optimizar el resultado de la limpieza y reducir el riesgo de proliferación microbiológica. Establecimiento de un procedimiento de limpieza La limpieza debe eliminar diferentes tipos de suciedades, incluyendo residuos de productos previamente procesados (principios activos, excipientes, solventes, etc.), detergentes, sanitizantes utilizados como adyuvantes y contaminación microbiológica en general. Además de la “suciedad sólida” y “suciedad líquida”, existen casos intermedios, como emulsiones, dispersiones, suspensiones, geles, cremas, ungüentos, etc. En resumen, un procedimiento de limpieza debe tener en cuenta: w Los tipos de suciedad a eliminar FARMESPAÑA INDUSTRIAL Iluminación LED Industrial y Áreas Peligrosas Luminarias LED de alto rendimiento (hasta 140lm/W) Temperaturas desde -40°C hasta +65°C Resistentes a golpes y vibraciones Versiones para zonas ATEX Operación instantánea de encendido / apagado Luminaries de hasta 60,000 lúmenes para naves altas Garantía de 5,7 y 10 años, según modelo L70 clasificado para > 100.000 horas @ 25°C ambiente Superior índice de reproducción cromática (IRC) en comparación con HPS, LPS y MV Contacto: Juan Solá Tel: 620 838 814 Info@dialight-iberica.com www.dialight-iberica.com distribuidos por ESTERILIZACIÓN Los equipos/elementos a limpiar (cantidad de objetos a tratar, uniformidad, tipo, forma, tamaño, geometría, convolutions, material de construcción, soldaduras, fragilidad) w Manipulación de los residuos del proceso w Resultado esperado El tipo de suciedad influye en la elección del agente de limpieza. En todo caso, el agente debe ser efectivo sacando residuos y también debe: ser compatible con los materiales, fácilmente removible, no tóxico, no volátil, no inflamable y posiblemente poco espumoso. Sacar la suciedad puede condicionarse a la naturaleza del ingrediente activo, por los excipientes y/o por la degradación del producto. La elección del agente limpiador debe basarse en una lógica científica. Hay diversos tipos de agentes limpiadores (que se pueden combinar o de uso individual): w Agua de diversas purezas (cuanto más baja es la conductividad del agua, menor es el riesgo de ver halos que aparecen en el objeto tratado por los depósitos de sal), fría o caliente w Solventes orgánicos w Detergentes ácidos o básicos w Agentes complejantes orgánicos/ inorgánicos. w Agentes dispersantes, surfactantes, humectantes. w Sanitizadores de varios tipos. w Vapor de agua presurizado o agua sobrecalentada. w 1. La “química” del producto como guía para la elección del proceso y detergente Actualmente, las “Políticas del medio ambiente” de las compañías llevan a una búsqueda de sistemas de limpieza que precisan de un menor uso de agentes químicos y, por tanto, un menor impacto medioambiental. Mientras los productos solubles en agua pueden requerir solamente el agua como “detergente”, otros productos Figura 3. Rueda de acero en la que hay que eliminar el Carbapenemo. lipofílicos representan un mayor reto en el momento de reducir o eliminar el uso de agentes químicos. Los corticosteroides, por ejemplo, que crean una película tipo “gripping film” sobre la superficie de acero en las que se depositan, pueden ser un desafío (ver Fig.2). Los agentes químicos son la solución clásica en este caso específico: vapor que ablanda esta película, seguida de un tratamiento con agua a unos 100 ºC, como alternativa válida. Para este caso específico, el agua sobrecalentada también puede eliminar la suciedad depositada. En todo caso, es importante señalar que el resultado positivo de un proceso de limpieza a menudo depende de si el equipo de limpieza se ha hecho a medida. Por ejemplo, si los chorros de agua no son dirigidos adecuadamente para impactar con las superficies sucias, el resultado podría no ser óptimo. En ocasiones, el uso de altas temperaturas – o no uso de las mismas – en los distintos pasos del proceso pueden dificultar alcanzar el objetivo en vez de ayudar al mismo. Conocer la estructura química del Suciedad Solubilidad Eliminación Cambios por calor Azúcares Soluble en agua Simple Caramelización, más difícil de limpiar Proteína Insoluble en agua Difícil Desnaturalización, más difícil de limpiar Soluble en alcalino Muy poco soluble en ácidos Tabla 2. 38 NOVIEMBRE/DICIEMBRE15 producto a extraer puede ayudarnos a evitar errores. Pueden verse varios ejemplos en la tabla 2: en el caso de azúcares y proteínas es preferible un proceso de limpieza que no utilice altas temperaturas. 2. Piezas/equipos grandes vs. pequeños Esta definición puede no ser clara, puesto que no está relacionada con el reto que supone la limpieza. Equipos o herramientas pequeñas pueden constituir un riesgo elevado considerando la necesidad de asegurar una limpieza efectiva para cada elemento individualmente. Normalmente, la limpieza de un equipo grande es individual y está sujeta a procedimientos SOP (Standard Operating Procedure – Procedimiento Operativos Estándar) específicos, mientras que las herramientas menores pueden agruparse, sobre todo si la operación de limpieza se realiza con máquinas automáticas. 3. Superficies El tipo de superficie y acabado afecta la capacidad de limpiar el material. Dependiendo del nivel de rugosidad (Ra), la superficie presentará mejores o peores valores para los contaminantes, incluyendo los biológicos. Si, por ejemplo, una superficie de acero pulida tiene un menor grado de rugosidad que un acero sin pulir, resulta en un proceso de limpieza más sencillo. Los rasguños, ralladas y grietas en el material son difíciles de limpiar, especialmente en materiales porosos como los filtros, que FARMESPAÑA INDUSTRIAL THE NEW FE SERIES NEW FE SERIES + Design – Simplicity as a key to efficiency + 360° accessibility + Guaranteed easy and safe operation www.fette-compacting.com ESTERILIZACIÓN Figura 4. En gris, Sistema de inyección del medio de limpieza dentro de los canales de la rueda de acero. El sistema es también útil para transportar aire comprimido durante la fase de secado de la carga. al ser delicados requieren de precauciones específicas. 4. Diseño y rendimiento de equipos La complejidad de los equipos y piezas, de aquellas herramientas para limpieza, la forma “convoluted” de algunas estructuras y la presencia de recovecos puede dificultar alcanzar el objetivo de limpieza definido. La validación de la limpieza suele relacionarse con las superficies en contacto con el producto, pero es difícil excluir migraciones de contaminantes hacia regiones que en teoría no están en contacto, sobre todo si están segregadas y donde puede acumularse (p.e., las juntas y sus asientos). Esto conduce a una necesidad de aparatos de limpieza dedicados a la pieza/piezas y que puedan asegurar que el medio de limpieza llega a todas las superficies a tratar. Su personalización es a menudo un elemento clave para un buen resultado de limpieza. Así, no solamente el proceso, sino también el equipo son desarrollados a partir del elemento a limpiar. La presión de trabajo, los fluidos de proceso, el tipo e inclinación adecuada de las boquillas –de donde sale el medio de limpieza–, o el receptáculo de las piezas a limpiar (en este caso, una unidad de limpieza de piezas) son algunos de los elementos clave para la definición del equipo de limpieza y los procesos consiguientes. Un interesante caso que ilustra el uso de un accesorio diseñado a medida para obtener unos mejores resultados de limpieza puede verse en la Figura 3. Esta rueda de 40 NOVIEMBRE/DICIEMBRE15 HOY EN DÍA EL ASPECTO MEDIOAMBIENTAL DE CADA PROCESO ES UN PUNTO CRUCIAL. DE ESTA MANERA, LAS PRÁCTICAS DE LIMPIEZA DEBEN CONSIDERAR TAMBIÉN EL PROCESAMIENTO DE LOS RESIDUOS. SI EL PRODUCTO A LIMPIAR ES PELIGROSO, EL RESIDUO PRODUCIDO DURANTE CADA FASE DE LA LIMPIEZA DEBE SER TRANSFERIDO HACIA UN DEPÓSITO ESPECIAL PARA REALIZAR UNA INACTIVACIÓN POSTERIOR acero, con unos canales interiores complejos y agujeros a limpiar, es un buen ejemplo de una carga complicada en la que el resultado del proceso está inevitablemente ligado a un estudio del equipo de limpieza. Dada la complejidad estructural de la carga, se ha desarrollado una “araña de distribución” (Fig.4) con pequeños agujeros a lo largo de los brazos de acero para permitir la inyección del medio de limpieza en los canales. El aparato es utilizado también para alimentar el aire a través de la pieza durante la fase de secado. Esta solución a medida resultó ser esencial para la limpieza efectiva de las zonas internas de la rueda. 5. Procesamiento de residuos Hoy en día el aspecto medioambiental de cada proceso es un punto crucial. De esta manera, las prácticas de limpieza deben considerar también el procesamiento de los residuos. Si el producto a limpiar es peligroso, el residuo producido durante cada fase de la limpieza debe ser transferido hacia un depósito especial para realizar una inactivación posterior. Si no hay problemas en este mismo sentido, el residuo libre puede convertirse en un modo de medir la efectividad de la limpieza: extrayendo una pequeña cantidad y tras analizarla con sistemas de monitorización en línea, puede darnos una idea del nivel de ingrediente activo extraído y/o del detergente utilizado Referencias CFR–Code of Federal Regulations Title 21, Volumen 4 Parte 211–Current good manufacturing practice for finished pharmaceutical; revised as of April 1, 2014 -11 Technical Report no. 29–Points to Consider for Cleaning Validation–revisado 2012 Technical Report no. 49–Points to Consider for Biotechnology Cleaning Validation–2010 Brugali G. “Biofilm e protocollo di detergenza e disinfezione delle superfici ed attrezzature in ambito alimentare” Igiene Alim.–Disinfest. & Ig. Amb. Mayo/Junio 1999, páginas 13-16 FARMESPAÑA INDUSTRIAL Inspired by nature, driven by innovation Efficient processes are key to preserving natural product quality in the biopharmaceutical industry. We provide innovative answers to achieve this. Ingeniería. Ingeniería de procesos. Gestión de proyectos. Sistema de aguas. IV Solutions plants. Consultoría Biofarmacéutica. Análisis de requerimientos regulatorios en instalaciones (EMA, FDA). Grifols Engineering We know how. Escalado de procesos biotecnológicos. Sistemas de contención. Desarrollo de Maquinaria. CIP, SIP. Purificaciones biológicas. Dosificación estéril (GSF®). Dosificación aséptica de bolsas. Grifols Engineering, S.A. Can Guasch, 2, 08150 Parets del Vallès, Barcelona - SPAIN Tel. [34] 935 710 868 Fax [34] 935 710 393 www.grifolsengineering.com Avda de Fuentemar, 31 28823 Coslada (Madrid) - SPAIN Tel: [34] 917 479 466 5555-Valley Boulevard, Los Angeles California 90032 - USA Tel. (323) 227 7016 Fax (323) 441 7928 î SALAS BLANCAS Francisco Martínez Responsable de Oficina técnica fmartinez@Ingelyt.com MATERIALES PARA LA CONSTRUCCIÓN DE LOCALES DESTINADOS A FABRICACIÓN DE MEDICAMENTOS Capítulo 2: Falsos techos Como continuación al capítulo 1, vamos a tratar de describir y tratar otro apartado importante de los cerramientos de una sala limpia, como son los falsos techos. Si nos atenemos a lo que indican las normas, los falsos techos tienen que cumplir los mismos requisitos que las paredes verticales, en cuanto a la clase de limpieza, efectos de abrasión, métodos de limpieza y desinfección… e igualmente tienen que estar diseñados para permitir una limpieza y mantenimiento eficaces. C umpliendo estos requisitos, en los falsos techos podemos hacer dos grandes distinciones. w Por su acabado, pueden ser continuos, sin perfilería vista, o modulares, con la perfilería de soportación vista. w Por su transitabilidad, pueden ser visitables o no visitables. Dentro de estas dos categorías e incluso como combinación de ambas, existen diversos modelos de techo. Vamos a intentar hacer un listado de los mismos, describiendo sus principales características y sus ventajas e inconvenientes. Techos continuos La principal característica de este tipo de techos es la ausencia de perfilería vista de soportación. El falso techo queda como una continuidad, sin posibilidad de desmontar parte del mismo para acceder a la zona técnica. El acceso a la misma se tendrá que realizar o bien mediante el desmontaje de algún elemento de difusión o iluminación, o bien mediante la instalación 42 NOVIEMBRE/DICIEMBRE15 de registros en el mismo o a través del forjado. Otra característica de este falso techo es la posibilidad de su montaje de una manera independiente de los cerramientos verticales, pudiéndose montar antes que las divisiones de las salas. Por último, el falso techo puede permitir, dependiendo de la estructura de montaje, su transitabilidad para realizar mantenimientos sin interferir en el funcionamiento de la sala. Como principal desventaja podemos citar que el acceso al falso techo tiene que hacerse desde puntos dispuestos a tal efecto, siendo necesario la instalación de varios de esos puntos, por la dificultad de paso entre el forjado y el falso techo por las instalaciones existentes (conductos, tuberías,…). Panel metálico Es probablemente el acabado más utilizado en la construcción de las salas limpias. Normalmente es realizado con panel sándwich metálico, con distintos espesores y materiales de aislamiento. El acabado Panel metálico. exterior consiste en una chapa de acero prelacado, de un espesor mínimo de 0,5 mm, aunque lo recomendable es la utilización de un espesor de chapa de 0,6 mm. En cuanto al aislamiento utilizado, los más comunes son el PUR (poliuretano expandido), el PIR (espuma rígida poliisocianurato), Lana de roca, EPS (poliestireno expandido) o XPS (Poliestireno extruido) Referente a los espesores, para instalar falsos techos transitables, es recomendable el irse a espesores superiores a los 60 mm. Para falsos techos no transitables, podemos trabajar en espesores de 30 a 50 mm. FARMESPAÑA INDUSTRIAL Para darle una continuidad al falso techo, la junta entre paneles se sella mediante aplicación de siliconas neutras. Este tipo de falso techo es válido para cualquier clasificación de sala limpia, pudiéndose utilizar tanto en salas de poca exigencia medioambiental (salas ISO9 o ISO8) como en salas de máxima exigencia (ISO7 o ISO5). En cuanto a su clasificación al fuego, este tipo de falso techos pueden fabricarse desde una clasificación A2s1d0, con la utilización de lana de roca como aislamiento, a clasificaciones inferiores como un Bs1d0 con el uso de poliestireno (extruido o expandido) o Bs2d0 con poliuretano. Panel fenólico La utilización de paneles continuos con acabado en laminado fenólico no suele ser recomendado, por su mal comportamiento al trabajar de manera horizontal. De todos modos, en algunas ocasiones es necesario su utilización, por las condiciones que puedan darse dentro de la sala (agentes químicos que afecten a la chapa de acero, por ejemplo). En esos casos los vanos no deben ser muy grandes y en ningún caso se podrá transitar por encima de él. Placa de pladur Este tipo de acabado permite la instalación de un falso techo con ausencia de juntas. Para que sea válido para la construcción de una sala limpia, debe estar acabado con alguna pintura que no desprenda partículas o debe ser recubierto con material plástico (tipo PVC continuo, vinilo,…) El techo continuo de pladur, garantiza la hermeticidad del mismo, con ausencia total de juntas. Por el contrario necesita un mantenimiento continuo, para evitar la aparición de grietas o fisuras. No permite el acceso a la zona técnica, al no ser pisable. Otra desventaja es que no es “obra seca”. Su montaje es bastante sucio y cualquier reforma en el mismo provoca incomodidades en el desarrollo de la producción. Propio forjado En alguna ocasión, el falso techo de la sala limpia puede realizarse mediante la construcción de un forjado técnico, estando todas las instalaciones por encima del mismo y haciéndose los pasos necesarios en el mismo, para la instalación de elementos de difusión e iluminación. El acabado superficial sería mediante aplicación de pinturas no porosas y que nos desprendan partículas, del tipo epoxi, por ejemplo. FARMESPAÑA INDUSTRIAL Propio forjado. La ventaja de esta solución es que todo el mantenimiento de la sala se puede realizar desde la planta técnica, sin afectar al funcionamiento de la sala. Como principal desventaja, a parte de los costes de construcción, es la dificultad de realización de cualquier reforma en el mismo. Además, es necesario su mantenimiento continuo, para evitar la aparición de grietas y fisuras en la pintura. Techos modulares Estos falsos techos se construyen mediante la instalación de una retícula de perfilería y su cierre con placas de distintos tipos, acabados y modulaciones. Su principal característica es que permite registrar el falso techo desde cualquier punto de la sala limpia. Son techos muy útiles para zonas con poca altura de forjado, porque permite el mantenimiento de la sala y el acceso a todos los elementos que existen en el falso techo (válvulas, compuertas,…). Todas las juntas entre el perfil y la placa deben se sellados con algún tipo de silicona neutra o fungicida. Los perfiles más habituales son de chapa de acero lacado o de aluminio. Las modulaciones suelen ser de 600 x 600 mm, 1.200 x 600 mm y de 1.200 x 1.200 mm, aunque por necesidades puntuales de alguna zona, pueden adaptarse a cualquier medida. Dependiendo de la perfilería y la placa utilizada, pueden ser visitables o no visitables (transitable o no transitable). Modular con panel metálico Este falso techo se realiza con panel sándwich metálico, con acabado en chapa de acero lacado de 0,6 mm e interior de aislamiento rígido (poliestireno expandido (EPS) o extruido (XPS), poliuretano, lana de roca, poliisocianato (PIR),…) y una retícula de aluminio lacado. Dependiendo de la densidad del aislamiento y el espesor del panel, este tipo de techo puede ser transitable. Normalmente se utilizan espesores de panel iguales o superiores a 50 mm para hacerlos transitables. La modulación más habitual es de 1.200 x 1.200 mm, permitiendo este tipo de techo Modular con panel metálico. adaptarse a otras modulaciones, según necesidades de la sala o de las instalaciones. Todos los elementos de techo (luminarias, difusores, filtros,…) quedan integrados, pudiéndose colocar en el centro de las placa o apoyándose en el perfil de aluminio. En cuanto a la reacción al fuego, dependerá del panel instalado, consiguiéndose clasificaciones de As2d0 en el caso del panel metálico con lana de roca a Bs1d0 con poliestireno. Este tipo de techo es válido para clasificaciones por niveles de partículas de sala iguales o superiores a clase B, o ISO5. Todas las juntas entre panel y perfil van selladas con silicona especial. Modular con placa de fibra mineral Para zonas con menos exigencias de clasificación se puede utilizar un falso techo modular realizado con perfilería de chapa de acero lacada y placa de fibra mineral y acabado vinílico. La modulación de este techo es de 1.200 x 600 mm y 600 x 600 mm. La perfilería utilizada es la estándar de techos tipos Armstrong, normalmente de ancho 24 mm. Las placas utilizadas son diversas, siendo las más usadas de lana de roca de baja densidad o fibra mineral prensada y acabado superficial en vinilo. También es muy usual la placa de pladur también con acabado superficial en vinilo. Este tipo de falso techo es usado en salas con pocos requerimientos, normalmente para salas con clasificación ISO8 o superior. La junta de la placa y la perfilería se sella con silicona apta para su uso en la sala limpia. Uno de los problemas de este tipo de falso techo es el posible deterioro de la placa, por su manipulación incorrecta. Aunque la gran ligereza de la placa, facilita dicha manipulación y permite la conservación de la misma. Además, no puede ser transitable y la clasificación al fuego dependerá de la placa utilizada. Modular con placa de melamina Con este tipo de placas se pueden realizar falso techo con perfilería de chapa lacada, en modulación de 600 x 600 mm, y NOVIEMBRE/DICIEMBRE15 43 SALAS BLANCAS Modular con placa de fibra mineral. Modular con placa de melamina. con perfilería de aluminio, en módulos de 1.200 x 1.200 mm. La placa está formada por dos láminas de 0,8 mm de melamina y el interior está formado por aglomerado. El aglomerado de madera es inerte, no permitiendo el desarrollo de colonias microbiológicas en él. Dependiendo del espesor de la placa, pueden conseguirse techos transitables. El principal problema de este falso techo es que el aglomerado es un material no hidrófugo, por lo que en caso de algún derrame accidental de líquido, puede deteriorar la placa. TIPO Igual que todos estos tipos de techo, la junta de la placa y el perfil se sella con siliconas especiales. Este tipo de techo era más utilizado hace unos años. Aunque se sigue utilizando en algunos casos, en la actualidad es más común el uso de techos metálicos. Lo habitual es su uso en salas de clase ISO8 o superior, aunque en alguna ocasión se instalan en salas de clase ISO7 o grado C. Modular con placa de laminado fenólico En la actualidad se están desarrollando soluciones de falsos techos realizados con placa formado por plancha de laminado fenólico de 0,8 mm y aislamiento en poliestireno o lana de roca. Este falso techo confiere un buen acabado superficial, a la vez que, dado que se usan espesores pequeños (15-20 mm), la placa tiene muy poco peso, lo que facilita el montaje y posteriores trabajos de mantenimiento. La perfilería usada es de chapa de acero lacada de 24 mm, y la modulación más habitual es de 1.200 x 600 mm, aunque también puede usarse en módulos de 600 x 600 mm. Estos techos no son transitables. Pueden usarse en salas con clasificación ISO8 (o clase D) o superior MODELO ACABADO SUPERFICIAL AISLAMIENTO TIPO PERFIL MODULACIONES TRANSITABILIDAD CLASIFICACION Metálico Chapa de acero de 0,6 mm Lana de Roca Sin perfil visto. Junta sellada. 1.200 x distintos largos Para espesores >50 mm y con insertos TODAS Metálico Chapa de acero de 0,6 mm EPS / XPS Sin perfil visto. Junta sellada. 1.200 x distintos largos Para espesores >60 mm y sin insertos TODAS Metálico Chapa de acero de 0,6 mm PUR/PIR Sin perfil visto. Junta sellada. 1.180 x distintos largos Para espesores >60 mm y con insertos TODAS Laminado fenolico Placa de resina de 3 mm. Lana de roca/ EPS/ XPS Sin perfil visto. Junta sellada. 1.270 x 3.000 mm. No es posible TODAS Pladur Pintura epoxi, vinilo, PVC Sin perfil ni junta. N/A No es posible ISO 8 / clase D o superior Propio forjado Pintura epoxi, vinilo, PVC Sin perfil ni junta. N/A Según características del mismo ISO 8 / clase D o superior Metálico Chapa de acero de 0,6 mm Lana de roca Perfil de aluminio 1.200 x 1.200 mm Para espesores >50 mm Para espesores >50 mm Metálico Chapa de acero de 0,6 mm EPS / XPS Perfil de aluminio 1.200 x 1.200 mm Para espesores >50 mm Para espesores >50 mm Fibra mineral Vinilo Lana de roca/ Pladur/ fibra mineral Perfil de chapa de 24 mm. 600 x 600 mm ó 1.200 x 600 mm No ISO 8 / clase D o superior Melamina Lamina de 0,8 de melamina Aglomerado de madera Perfil de chapa de 24 mm. 600 x 600 mm No ISO 8 / clase D o superior Melamina Lamina de 0,8 de melamina Aglomerado de madera Perfil de aluminio 1200 x 1200 mm Para espesores >15 mm ISO 7 / clase C o superior Laminado fenólico Lamina de 0,8 de HPL Lana de roca/ EPS/ XPS Perfil de chapa de 24 mm. 600 x 600 mm ó 1.200 x 600 mm No ISO 8 / clase D o superior Continuo Modular 44 Modular con placa de laminado fenólico. NOVIEMBRE/DICIEMBRE15 FARMESPAÑA INDUSTRIAL î REGULATORY AFFAIRS Marta Vila Ramos y Fran Catalá Socios de McCrowley & Hughes www.mccrowleyandhughes.com ¿POR QUÉ NO ME ENTIENDES CUANDO TE HABLO DE REGULATORY AFFAIRS? Módulo 1, fraccionamiento, variaciones, RAEFAR, DCP… podemos seguir rellenando líneas y líneas con términos que a la gran mayoría de las personas que trabajan en el sector Farma les producen incomprensión (por no utilizar un adjetivo más “agresivo”). Las personas que trabajamos en el área de Regulatory Affairs hemos conseguido, muy a nuestro pesar, que algunos de nuestros compañeros y jefes sientan aburrimiento cada vez que les intentamos explicar parte de nuestro trabajo. ¿Y esto por qué? ¿En qué hemos fallado para que un tema tan estratégico y con tanto impacto en el negocio sea considerado como algo administrativo y no merecedor de la atención del oyente? ¿Qué podemos hacer para intentar remediarlo o, al menos, minimizar esa sensación de estar tan poco valorado? V ayamos por partes. Ante un problema de esta índole, lo primero que debemos hacer es reflexionar sobre cómo hemos podido llegar a esta situación, 46 NOVIEMBRE/DICIEMBRE15 descubriendo cuáles son las posibles causas que lo han originado. A continuación recogemos las que surgieron en el debate del tema con algunos de nuestros clientes: 1. Uso abusivo de terminología técnica. En ocasiones (por no decir casi siempre) empleamos unos términos que, aunque para nosotros resultan básicos, el resto de compañeros no conocen o no están familiarizados con ellos. En definitiva, no empatizamos con la persona que está al otro lado de la mesa y eso provoca que, al minuto dos de la conversación, le hayamos “perdido”. ¿Por qué no intentamos hablar como las personas normales? ¿Qué pasaría si en lugar de fraccionamiento dijéramos “separar la información en diferentes apartados”? 2. Falta de foco en el negocio. Empezamos a hablar de variaciones o de procedimiento y nos olvidamos de lo más importante: el negocio. ¿Realmente pensamos que a nuestro oyente le interesa si hemos utilizado un procedimiento descentralizado? ¡NO! Lo que quiere saber es cuándo va a poder comercializar el producto. Tenemos que salir de nuestra pequeña cueva y FARMESPAÑA INDUSTRIAL pensar que hay vida más allá de ella. Una vida que es incluso más importante y se llama VENTAS. Con esto no quiero decir que nuestro papel sea secundario, sino que debemos tener el negocio “entre ceja y ceja”, de manera que todas nuestras actuaciones vayan encaminadas a maximizarlo, respetando las reglas del juego. 3. Excesiva humildad. Siempre he defendido y defenderé la importancia de la humildad, entendida como “no creerse más que los demás”. Pero este concepto no está en absoluto reñido con poner en valor lo que hacemos. En nuestra área solemos “ningunear” una gran parte de nuestro trabajo diario olvidándonos de su verdadera importancia. ¿Nuestros compañeros se dan cuenta que una gestión eficiente en la tipificación de la variación puede suponer un ahorro de muchos miles de euros? Y por no hablar del incremento en el volumen de facturación gracias a haber conseguido una aprobación antes de lo previsto. 4. Dedicación a tareas administrativas en lugar del foco en la dimensión estratégica del área. Todos sabemos que nuestros equipos están infradimensionados para hacer frente a la ingente carga de trabajo que nos invade todos los años y también somos conscientes que el siguiente año necesitaremos más gente porque habrá más trabajo. En este contexto, ¿nos hemos planteado alguna vez hacer más trabajo con menos recursos y menos costes?¿es esto realmente posible? Con todo el respeto del mundo, SÍ es posible. El problema es que el día a día nos impide tener una visión global/ estratégica del área. Lo perfecto sería intentar hacer una reflexión sobre la estructura actual del equipo y adónde me gustaría llegar. ¿Quiero contar con un gran equipo experto en realizar fraccionamientos o cargar en RAEFAR? ¿O prefiero tener un pequeño equipo de personas que piensen en cómo tipificar una variación, identificar oportunidades de negocio…? Una vez comentadas algunas de las causas que han llevado a nuestra área a ser considerada como un “mal necesario” en las compañías, deberíamos tener una actitud de cambio para poder invertir esta tendencia y conseguir posicionarnos como lo que realmente somos: un departamento estratégico imprescindible para el éxito de FARMESPAÑA INDUSTRIAL la empresa. Para ello, planteamos una serie de sugerencias: w Utiliza un lenguaje corriente y comprensible, evitando tecnicismos y ambigüedades w Pon el foco en el negocio, intentando responder a las preguntas que te planteen tus interlocutores w Ensalza las bondades de tu trabajo mencionando las consecuencias del mismo (reducción de los plazos, incremento de ventas, menor pago de tasas…) w No pidas más recursos ni incrementes el coste del departamento. Está comprobado que puedes hacer más y mejor, con menos recursos. Céntrate en la parte estratégica, que es la que de verdad añade valor y te permitirá posicionarte entre tus compañeros. La parte más administrativa la pueden hacer otros mejor y más barato. En definitiva, somos de las personas que creen firmemente en la importancia del departamento de Regulatory Affairs y Quality Assurance, pero sólo desde un punto de vista estratégico. Si no conseguimos posicionarnos como referente en la Compañía, seguiremos siendo el departamento que habla en chino y sólo plantea problemas retrasando siempre el lanzamiento de los productos. Es decisión de cada Responsable de Regulatory tomar uno u otro camino w NOVIEMBRE/DICIEMBRE15 47 î SALAS BLANCAS Richard Denk SKAN AG Allschwil, Suiza. TCI es representante de SKAN. FABRICACIÓN DE PRODUCTOS FARMACÉUTICOS ALTAMENTE ACTIVOS O PELIGROSOS Con nuevos tratamientos para el cáncer y nuevas generaciones de antibióticos en desarrollo, cada vez se fabrican más productos farmacéuticos altamente activos o peligrosos. Además de la protección del producto durante todo el proceso de fabricación, es también importante la protección activa de las personas involucradas y asegurar una limpieza a fondo durante el cambio de productos. Abordar estas demandas exige medidas de seguridad, tales como la transferencia estanca del producto, que a menudo se asegura por medio de aisladores de acero inoxidable, o sistemas de esclusa y descontaminación adecuados. Con el fin de cumplir con los requisitos de limpieza y facilitar los cambios frecuentes de producto, resulta necesario un diseño higiénico, así como la integración de boquillas de limpieza. E l nivel necesario de protección personal está determinado por el Límite de Exposición Ocupacional (ver pirámide). El LEO (Límite de Exposición Ocupacional) (OEL; Occupational Exposure Limit) se expresa en microgramos por metro cúbico de aire. Ésta es la concentración máxima a la que el personal de producción puede estar expuesto, de media, durante una jornada de ocho horas, como parte de una semana de 40 horas, sin sufrir daños como resultado de su trabajo (también en términos de vida completa dedicada a trabajar con esta sustancia). Muchas sustancias muy activas o peligrosas exigen un LOE de 1-10 microgramos/m3 o incluso en el rango de nanogramos. Sustancias altamente activas o peligrosas incluyen hormonas, citostáticos y antibióticos, así como las sustancias mutagénicas, tóxicas para la reproducción y teratogénicas. Para aquellos que no tienen experiencia en la contención, es difícil de entender si es mucho o poco un determinado número de microgramos por metro cúbico. Para tener una idea de las cantidades 48 NOVIEMBRE/DICIEMBRE15 Figura 1: Pirámide de Contención, estándar de la industria desarrollada por Richard Denk de SKAN AG. involucradas, tomemos a modo de ejemplo un comprimido edulcorante artificial, como los que se utilizan para endulzar el té o el café. Estos por lo general pesan aproximadamente 1 gramo, por lo tanto un microgramo sería una millonésima parte del comprimido. Para lograr una concentración de 1 microgramo/m3 (que correspondería al LEO permitido para el personal), necesitaríamos, por tanto, 1 millón de metros cúbicos de aire. Esto corresponde aproximadamente al volumen del edificio Empire State en Nueva York. A la vista del hecho de que ahora hay una amplia gama de diferentes sustancias muy activas o peligrosas, las Bandas de Exposición Ocupacional (BEOs) (OEBs; Occupational Exposure Bands) se han introducido, además de los límites de exposición profesional (LEOs). Las sustancias se clasifican en un conjunto de bandas (BEO 1 a BEO 6, por ejemplo) y a cada banda se le asigna un rango de LEO. BEO 1, por ejemplo, cubre el rango de 1000-5000 microgramos/m3, mientras que BEO 6 tiene un umbral de menos de 200 nanogramos/ m3 (véase la Fig. 1). Estos LEOs y BEOs se muestran en la Pirámide de Contención, que fue desarrollada por Richard Denk de SKAN AG y se ha convertido en un estándar de la industria. Las BEOs sirven para clasificar los productos farmacéuticos en términos de toxicidad y constituyen las bases para el diseño de líneas de producción en la que estos productos pueden ser fabricados de forma segura. Asegurando estos umbrales se FARMESPAÑA INDUSTRIAL satisface la demanda de sistemas cerrados seguros y fiables, y que no sólo cumplan con los valores límite de exposición en cada puesto de trabajo, sino que también cumplan plenamente con los requisitos de buenas prácticas de fabricación (BPF) (GMP; good manufactiring practice). El nivel más alto de diseño de contención combinado con el cumplimiento de las normas BPF más estrictas garantiza un proceso seguro para la fabricación de productos farmacéuticos altamente activos o peligrosos. Los siguientes sistemas de contención garantizan el trasvase seguro de productos que contengan sustancias muy activas o peligrosas: proceso como parte del tratamiento del aire en el aislador. Para los productos con niveles bajos de energía de ignición (MEI) (MIE; Minimum Ignition Energy), el proceso completo también puede ser inundado con nitrógeno y monitorizado. Aislador de dispensación Al comienzo del proceso farmacéutico, el ingrediente farmacéutico activo (API; Active Pharmaceutical Ingredient) y los excipientes se pesan de acuerdo a la formula. Cuando se trata de contención, se debe prestar atención especial a los APIs, algunos de los cuales están clasificados como altamente activos o peligrosos, y requieren un nivel extremadamente alto de contención en el rango bajo de nanogramos (BEO 6). Tomemos el ejemplo de contención en este rango (LEO inferior a 100 nanogramos/m3) para dispensar un API muy activo en un sistema de transporte interno. El API se entrega en una bolsa que se inserta en el aislador a través de una esclusa de materiales. Un sistema de revestimiento continuo se conduce desde la esclusa en la cámara principal del aislador, formando una barrera adicional entre la contención inicial en la esclusa de materiales y la de alta contención en la cámara principal. El API se transfiere a través de un sistema de recubrimiento continuo a la cámara principal, donde se pesa la sustancia activa o altamente peligrosa. El API también se examina en la cámara principal antes de ser transferido a su propio sistema de transporte interno, que en este caso es un contenedor con un sistema de válvula activa y pasiva. Los requisitos BPF son también particularmente importantes, además de la contención necesaria para la protección personal. Para cumplir estos requisitos, además de un diseño higiénico para una limpieza sencilla del aislador, se suministra un sistema completo de lavado in situ (WIP - Washing In Place) junto con el tratamiento de aire para acondicionar el aire en el aislador. La temperatura y humedad se controlan durante todo el Figura 2. FARMESPAÑA INDUSTRIAL Aislador para procesos en etapas intermedias y para el producto listo para su envasado Las diferentes etapas intermedias de producción farmacéutica comprenden la progresión desde los gránulos hasta el comprimido acabado y todas requieren una contención desde una etapa del proceso hasta la siguiente. En el rango bajo de nanogramos, se requiere un nivel particularmente elevado de contención en la fabricación de sustancias muy activas o peligrosas. En el siguiente ejemplo, los gránulos se tamizan a una bolsa, que se transfiere a una prensa de comprimidos. La prensa de comprimidos cuenta con otro aislador para dispensar los gránulos y, una vez que se han prensado los comprimidos, colocarlos en otra bolsa que se transfiere a continuación a la etapa de envasado. Figura 3. Aislador de trasvase de sustancias muy activas o peligrosas. Embalaje de sustancias muy activas o peligrosas La contención se debe aplicar desde el pesaje de la sustancia activa o altamente peligrosa hasta el envasado y sólo puede ser reducida una vez que los comprimidos se han sellado en envases blister, etc. En las instalaciones de alta contención de envasado blister mostradas, se han tomado todas las precauciones de seguridad necesarias. Los comprimidos se colocan en la cámara principal a través de un aislador de trasvase y, a continuación, se abre la bolsa de comprimidos y se colocan los comprimidos en un alimentador de comprimidos automático. Una vez que los comprimidos han llegado a la pieza moldeada de los envases blister, se examinan en el túnel de inspección y luego se sellan en la estación de sellado, manteniéndose el más alto nivel de contención hasta ese momento. Una vez que los comprimidos se han sellado de forma segura en la estación de sellado, el riesgo de la exposición al polvo se reduce, y se pueden aplicar las buena prácticas de la ingeniería (GEP - Good Engineering Practice). Figura 4. Instalación de envasado de alta contención Resumen La fabricación de sustancias altamente activas o peligrosas es un proceso complejo que debe ser meticulosamente planificado tanto en términos de la distribución del producto como en el trasvase entre los distintos procesos farmacéuticos. La limpieza de los procesos y de los sistemas de contención es también de gran importancia, sobre todo en el caso de instalaciones de usos múltiples utilizadas para la fabricación de una gama de diferentes productos. Un proyecto de contención exitoso comprende aspectos de la ingeniería básica a través de la ingeniería de detalle, así como una evaluación detallada del riesgo. Una vez que un sistema de contención se ha implantado, debe ser validado en términos del LEO requerido, y los procedimientos operativos estándar (SOPs; Standard Operating Procedures) deben estar preparados para la manipulación y la limpieza del sistema NOVIEMBRE/DICIEMBRE15 49 î CASO PRÁCTICO Ana Fernández García Ingeniero de Proyectos - TELSTAR Fotos cedidas por Margarita Morquillas CONSTRUCCIÓN DE UNA PLANTA DE PRODUCCIÓN BIOTECNOLÓGICA BAJO EL MODELO DE GESTIÓN EPCM La farmacéutica alemana Merck ha realizado una importante inversión en su fábrica de Tres Cantos para ampliar y adecuar las instalaciones existentes con el fin de aumentar en un 50% la producción de la hormona de crecimiento recombinante, que se comercializa bajo el nombre de Saizen. La planta biotecnológica madrileña produce el 100% de la producción mundial de la hormona de crecimiento del grupo. A principios de 2014, Merck confió en Telstar para la ejecución del proyecto bajo el modelo EPCM (Engineering, Procurement and Construction Management) que, a diferencia de un EPC o un “llave en mano”, se trata de un contrato de servicios profesionales. En un proyecto EPC (Engineering, Procurement and Construction), el contratista se responsabiliza de la ejecución de la construcción, así como de las compras y el desarrollo de la ingeniería de detalle, mientras que en el modelo de gestión EPCM, el proveedor se responsabiliza del desarrollo de la ingeniería, asesora al cliente en la gestión de compras y, en el ámbito de la construcción, su cometido se focaliza en su gestión (supervisión, control presupuestario y planificación) en nombre del cliente final. Telstar ha brindado en este proyecto su experiencia en la ejecución de proyectos en las industrias farmacéutica y biotecnológica a Merck, acompañándole y asesorándole en las diversas fases por las que atraviesa un proyecto de esta envergadura, pasando eslabón a eslabón en la cadena de valor. 50 NOVIEMBRE/DICIEMBRE15 El proyecto se dividió en dos fases, una primera de desarrollo de ingeniería conceptual, básica y de detalle, y una segunda de gestión de compras, supervisión de la obra y dirección facultativa. En la primera fase fue fundamental el desarrollo conceptual y Value Engineering, puesto que Merck barajaba dos diferentes opciones de ejecución del proyecto: diseño de una nueva unidad de fabricación en un edificio ubicado en una finca anexa a la planta de Tres Cantos o la remodelación del edificio donde se ubica la actual planta de producción. Ambas opciones ofrecían condicionantes y ventajas muy diferentes (inversión, licencias administrativas, afectación a la producción existente, paradas de planta, logística de la futura de producción…) y el desarrollo de las ingenierías de ambas opciones facilitaba la toma de la decisión más correcta. El éxito de esta fase se alcanzó principalmente por: w Un sólido trabajo en equipo MerckTelstar, que permitió canalizar de una forma fluida los requerimientos de los distintos departamentos de Merck (Producción, Ingeniería, Mantenimiento, Calidad,...) w El trabajo en un entorno de Value Engineering, donde se revisan de una forma constante alternativas técnicas que puedan ofrecer ahorros de inversión u optimizaciones de operación sin afectar a requerimientos de producto. w El desarrollo de la ingeniería sobre un modelo BIM (Revit y Plant 3D), que permite una perfecta sincronización espacial de las distintas instalaciones evitando incidencias e interferencias que, detectadas durante la fase de ejecución de obra, pueden conllevar retrasos y problemas de calidad. Durante la segunda fase, Telstar colaboró estrechamente con Merck en la gestión de compras, asumiendo la tramitación y análisis técnico y económico de las ofertas de distintos suministradores, con el fin de facilitar la elección de la contratación más oportuna y se responsabilizó de la supervisión técnica y dirección facultativa de los trabajos y su puesta en marcha con una presencia permanente en la fase de ejecución. FARMESPAÑA INDUSTRIAL Ingeniería básica y de detalle La ingeniería básica se inició con el desarrollo de dos opciones en paralelo: albergar la nueva zona de producción en un almacén en semisotáno, con el reto de conseguir espacio para zonas técnicas y oficinas en la parcela existente, y construir una nueva planta de producción en la parcela adyacente. La opción finalmente retenida por Merck fue la remodelación y ampliación de sus propias instalaciones, más compleja desde el punto de vista de ingeniería pues afectaba a diversas zonas y a casi todas las instalaciones de la actual planta. Para albergar la nueva zona de fabricación, se adecúa un almacén existente de 970 m2 en semisótano y se reubican una sala de documentación, una cámara fría y varios congeladores. La ampliación cuenta con salas blancas de clase D para Upstream, Downstream y preparación de Buffer, tres cámaras calientes y dos cámaras frías, zonas de lavado y esterilización dedicadas, y los airlocks de material y personal. Ya en los orígenes del proyecto, Merck identificó la necesidad de ampliar laboratorios de QC y, en consecuencia, el área de oficinas. Todo ello supuso diseñar y posteriormente construir edificios anexos al existente: En el Oeste, un edificio de planta rectangular de dos alturas para albergar oficinas, adosado a un almacén en su fachada Norte y al edificio de producción existente en su fachada Este, conectando éstos últimos con la recepción, que se reforma para ser utilizada como acceso a ambos edificios. En el Este, un edificio anexo al actual edificio de producción -en concreto a la zona a acondicionar como nueva área de fabricación-, para albergar los nuevos climatizadores y cuadros eléctricos, además de un edificio de menor dimensión para la instalación de agua para inyectables dedicada a la nueva zona de producción. Finalmente, en azotea, la construcción de una sala de calderas. Telstar contó para el proyecto con un equipo multidisciplinar de 10 personas, especialistas en las distintas áreas (consultor farmacéutico, ingenieros especialistas de HVAC, servicios industriales, arquitectura cleanroom, clean utilities, proceso, electricidad y control…) y el empleo de las ultimas herramientas de diseño BIM (Revit y Plant 3D), generando primeramente P&ID inteligentes seguidos del desarrollo de una maqueta virtual. BIM (Building Information Modeling) es una metodología de trabajo que se basa en la integración, en una base de datos, de la geometría tridimensional del edificio con FARMESPAÑA INDUSTRIAL Sala Materíal Estéril. Edificio Oficinas. Pasillo. NOVIEMBRE/DICIEMBRE15 51 CASO PRÁCTICO Izquierda, sala WFI. Derecha, preparación Buffer. toda la información asociada al mismo: materiales y sus propiedades físicas, calidades, mediciones, instalaciones, etc. El desarrollo de proyectos de diseño y construcción de instalaciones críticas con un alto grado tecnológico e innovador ha evolucionado en los últimos años, incorporando distintas herramientas BIM que facilitan una revisión integral y conceptual de un proyecto antes de iniciar la ejecución, permiten visualizar previamente el resultado final, anticipar y resolver problemas técnicos e interferencias antes de comenzar la obra e introducir mejoras funcionales, de seguridad y estéticas en fases tempranas del proyecto -cuyo impacto económico puede ser cuantificado previamente-. El esfuerzo se desplaza de las etapas ulteriores del proyecto (ejecución, puesta en marcha, validación) a las primeras etapas (diseño, procurement), consiguiendo de este modo tener los riesgos identificados y estudiados con anterioridad y, gracias a ello, potencialmente bajo control. Para el proyecto desarrollado para Merck, el diseño BIM ha permitido afrontar el reto de albergar en un espacio reducido la instalación de todos los equipos de servicios auxiliares, la instalación de todos los elementos en un escaso falso techo y la integración de instalaciones en salas de proceso, incluso un año antes de acometer la fase de ejecución. Durante la fase de ingeniería, la metodología Value Engineering fue aplicada en la revisión de las soluciones técnicas seleccionadas, con el objetivo de optimizar el diseño desde un punto de vista no solo de inversión sino de costes de operación y mantenimiento y, en este sentido, Merck siempre ha apostado por la búsqueda del aumento de la eficiencia energética como paso adicional al cumplimiento de los requerimientos. 52 NOVIEMBRE/DICIEMBRE15 Zona de producción Las salas de proceso disponen de un gran número de ventanas, lo que proporciona una sensación de amplitud para los trabajadores que pueden fácilmente ver las salas de producción adyacentes, así como la posibilidad de hacer un recorrido del proceso desde el pasillo sin acceder a las mismas. En búsqueda de la eficiencia energética, toda la iluminación de la zona es LED, con sensores de presencia en la mayor parte de las salas. Los cerramientos han sido construidos con paneles tipo sándwich con alma de lana de roca, que proporcionan un excelente comportamiento al fuego, así como buenas resistencias térmica y acústica. La climatización de la zona de producción ha sido diseñada para conseguir clase D, con filtración HEPA terminal. Los cuatro climatizadores que dan servicio a la zona poseen ventiladores EC y estanqueidad L1. La red de conductos ha sido testeada para verificar el cumplimiento de un nivel estanqueidad clase C, de acuerdo a la norma UNE-EN 1507. El aporte de frío y calor se ha diseñado como un sistema de caudal variable. Las dos cámaras frías y las tres cámaras calientes poseen climatizadores dedicados con estrictos rangos de temperatura de operación: 7±3ºC, 7±5ºC y 36±0.5ºC. El control de presiones diferenciales se consigue con CAV instaladas en columnas de retorno elevadas. La planta cuenta además con un sistema de monitorización de presiones que recoge las señales de apertura de puertas y activa avisos sonoros superado cierto tiempo preseleccionado. Para las formulaciones y las etapas de CIP de las instalaciones de Preparación de Medios, Harvest y Downstream, se han diseñado dos lazos de agua para inyectables, uno a 80ºC con 11 puntos de uso y otro a 25ºC con 14. Desde el lazo de WFI a 80ºC existente, se abastece un depósito de acumulación de 10.000 litros, que alimenta posteriormente los nuevos lazos. El lazo frío consta de un enfriamiento en dos etapas, la primera con agua procedente de una torre de refrigeración y la segunda con agua glicolada. Incluye dos puntos a 7ºC, que se enfrían con intercambiadores dedicados de punto de uso. Todo el diseño se ha realizado considerando válvulas de diafragma Zero Dead Leg. Para dar servicio a las zonas de lavado y a la instalación de Preparación de Buffer, se ha diseñado la ampliación del lazo de agua purificada existente incluyendo 6 nuevos puntos de uso provisto de válvulas Zero Dead Leg y la ampliación del bombeo. Las instalaciones de proceso han consistido en diversos reactores de producción para la Preparación de Medios, Harvest y Preparación de Buffer, con sus correspondientes líneas de transferencia y sets de filtración esterilizante. El diseño íntegramente elaborado en 3D a partir de P&IDs inteligentes, especifica materiales de altas prestaciones cumpliendo los estrictos estándares de calidad de Merck, con instalación de válvulas multivías en puntos críticos del trasvase de soluciones. El CIP de los reactores se realiza mediante soluciones básicas y ácidas previamente preparadas en una unidad de CIP centralizada ubicada en el edificio anexo de zona técnica, que atiende las peticiones de los distintos consumidores. Servicios industriales Aprovechando la ampliación de consumidores de potencia calorífica, Merck incluyó en el alcance del proyecto la sustitución de sus calderas de vapor y de agua FARMESPAÑA INDUSTRIAL de calefacción por unas nuevas unidades para dar servicio, no sólo a la zona ampliada, sino a todo el complejo. Una vez más en el criterio de selección, los costes de operación y eficiencia han sido primordiales. Se han instalado dos generadores de vapor acuotubulares redundantes de circulación forzada altamente eficientes en consumo de combustible. La elección de equipos de Clase Primera ha permitido aligerar los cerramientos de la caseta de calderas de nueva construcción en azotea. En el diseño de la red de distribución de vapor, se ha considerado poder funcionar con los nuevos generadores y los antiguos durante una fase transitoria previa a su desmantelamiento. En el diseño de la red de condensados se ha estudiado el aprovechamiento del revaporizado. La producción de agua de calefacción se ha diseñado con calderas de condensación de alto rendimiento. Para satisfacer la nueva demanda de agua enfriada, se ha instalado una planta enfriadora gemela a la existente y ampliado el bombeo y el colector. Edificio de oficinas La estructura del edificio de oficinas está conformada por fachadas de paneles prefabricados de GRC (hormigón reforzado con fibra de vidrio) y paneles de aluminio anodizado tipo Alucobond en color blanco. El frontispicio Sur cuenta con una carpintería de aluminio de forjado a forjado con una malla de sombreo arquitectónica de chapa perforada blanca con motivos decorativos, que aporta estética la cara más visible del edificio a la vez que difumina la luz natural en los espacios interiores. El diseño ha buscado un edificio funcional de estancias multiuso. Todas las salas son acristaladas con amplios espacios abiertos que han sido concebidos para su uso como zona de oficinas o impartir conferencias o formación. Se complementan con pequeños espacios ideados para su uso como salas de reuniones y buscan proporcionar mayor confidencialidad. La climatización del edificio se ha diseñado como un sistema multizona formado por 18 fancoils con 4 tubos, con control independiente de temperatura por zona y sistema de recuperación de calor del aire primario. Los equipos seleccionados están provistos de motores de velocidad variable LEC que garantizan hasta un 75% menos de consumo de energía y regulación auto-adaptativa del caudal de aire del 0% al 100% y bajo nivel sonoro. FARMESPAÑA INDUSTRIAL Espacio abierto para formación Gestión de compras Telstar ha colaborado con Merck en el proceso de selección de los adjudicatarios de las distintas instalaciones. Tras una paquetización de los trabajos, se establecieron “Vendor List” de al menos 3 candidatos y se desarrollaron dosieres de documentación técnica incluyendo especificaciones técnicas y funcionales, pliegos de condiciones generales y técnicas, planos y mediciones, de forma que todos los participantes pudieran ofrecer los mismos servicios y las mismas calidades, para poder realizar una comparativa objetiva. Las ofertas fueron comparadas económica y técnicamente. La selección se basó en los resultados de un análisis de riesgos más allá de los aspectos económicos, en términos de solvencia, capacidad técnica para desarrollar el proyecto, capacidad para el cumplimiento de plazos, equipo humano destinado al proyecto entre otros. Fase de ejecución La ejecución del proyecto se ha realizado en dos fases. La primera ha abarcado la construcción del edificio de oficinas y los edificios auxiliares para zonas técnicas y la segunda fase ha consistido en la adecuación del almacén en semisótano, la ejecución de todas sus instalaciones de proceso y la ampliación de los servicios industriales. Como parte del alcance del EPCM, Telstar ha prestado sus servicios de supervisión de obra y coordinación de seguridad y salud. El gran reto de la ejecución se ha producido durante la parada de producción de verano, dos semanas durante las cuales se han coordinado los trabajos de ampliación de los cuadros eléctricos generales, y las conexiones a las redes existentes de gas natural, agua potable, descalcificada, enfriada, glicolada, de torre, de calefacción, vapor industrial y condensados, en ciertos casos picajes, en otros modificaciones o sustituciones de colectores. En cuanto a fluidos farmacéuticos, durante este mismo período, se ha ampliado el lazo de agua purificada incluyendo los nuevos 6 puntos de uso para la zona nueva de producción (instalación completa mecánica y de control, y su validación), y se han hecho las conexiones al ramal de vapor puro y al lazo de agua para inyectables a 80º existentes. Conclusión La estrategia de ejecución del proyecto elegida por Merck, en forma de contratación de un servicio EPCM a Telstar y adjudicaciones de diversos contratos (instalación, instalación+ servicios o suministro de equipos) en paquetes por disciplinas tras una cuidadosa selección de proveedores, así como la profesionalidad y capacidad de trabajo en equipo demostrada por todas las partes involucradas, ha permitido a la compañía alemana materializar su proyecto más complejo de los ejecutados en los últimos años con un máximo grado de éxito en términos de calidad, tiempos e inversión NOVIEMBRE/DICIEMBRE15 53 î GESTIÓN DE EQUIPOS INDUSTRIALES Ben Potenza Vicepresidente de Marketing en EquipNet Inc. DESBLOQUEANDO LA EFICIENCIA DE NEGOCIO A TRAVÉS DE GESTIÓN DINÁMICA DE ACTIVOS Las empresas farmacéuticas españolas se enfrentan actualmente con dificultades en el desarrollo clínico debido a las regulaciones establecidas por entidades locales. Dichas dificultades hacen que estas empresas vean claras oportunidades de desarrollo de sus negocios en los mercados exteriores a través de las exportaciones. En este artículo se expone la importancia de la planificación de los activos para las empresas farmacéuticas, lo cual puede jugar un papel importante en el desarrollo continuo del negocio. Cómo aumentar las probabilidades del éxito en esta era de transformación Durante la última década, el crecimiento del mercado farmacéutico español ha sufrido una notable desaceleración debido a que la industria de salud española ha llegado a ser una de las más reguladas a nivel mundial. Las medidas austeras implementadas por el gobierno español y el objetivo de minimizar los costes de la salud pública han provocado un dramático descenso en los ingresos de las compañías farmacéuticas. Como resultado, el mercado proyecta seguir en decremento alcanzando un descenso de hasta 22.6 billones de dólares en los próximos cinco años 1. Bajo el compromiso de proveer atención sanitaria pública a una población en la que predominan las personas ancianas, el gobierno español promueve de manera activa el uso de medicamentos de bajo coste o genéricos para poder afrontar dichos 54 NOVIEMBRE/DICIEMBRE15 DENTRO DE UN ENTORNO INTERNACIONAL MUY DINÁMICO, ES DE ESPERAR QUE LAS COMPAÑÍAS FARMACÉUTICAS TENGAN LA NECESIDAD DE CAMBIOS CONTINUOS DE SUS EQUIPOS DE LABORATORIO Y PRODUCCIÓN, LOS CUALES FORMAN UNA PARTE ESENCIAL DE SUS OPERACIONES DEL DÍA A DÍA costes. Cabe decir que España está entre los países que han adoptado políticas favorables para el uso de estos medicamentos genéricos, solicitando a los profesionales de la salud que sustituyan los productos de marca por estos últimos. Este país realiza la producción propia de genéricos lo cual constituye un 18 % del mercado local español. Las empresas españolas farmacéuticas y biofarmaceuticas no solo se enfrentan al desarrollo y adaptación de su mercado local sino del internacional debido a una demanda similar de genéricos en mercados tales como Japón, Italia, Polonia y Francia, cuyos gobiernos han tomado medidas similares a las del Gobierno Español en lo que se refiere al consumo de medicamentos genéricos. Se espera que el valor del mercado global para genéricos alcance los $283 billones en el 2018, creciendo anualmente en promedio del 11% (TCCA). FARMESPAÑA INDUSTRIAL PHARMINTECH 2016. N E V E R S T O P I N N O VAT I O N . BOLOGNA, 13 - 15 APRIL 2016 WWW.PHARMINTECH.COM In conjunction with: With the patronage of: UCIMA Italian Packaging Machinery Manufacturers Association Organised by: With the contribution of: GESTIÓN DE EQUIPOS INDUSTRIALES El desarrollo en la atención sanitaria pública y el acceso a la misma predicen un desarrollo futuro del mercado farmacéutico en otros mercados tales como Estados Unidos, Latinoamérica, Asia y Australia. El cambio más rápido se espera en los países de oriente medio y África, debido al crecimiento de su población, y por supuesto China basado en el esquema de un plan de desarrollo para su sanidad pública. Una oportunidad significativa Dentro de un entorno internacional tan dinámico, es de esperar que las compañías farmacéuticas tengan la necesidad de cambios continuos de sus equipos de laboratorio y producción, los cuales forman una parte esencial de sus operaciones del día a día. Debido a los continuos cambios de la industria farmacéutica las compañías buscan maneras de adaptarse y ganar mercado mediante adquisiciones, joint ventures, relocalizaciones y apertura de nuevos mercados. Las empresas farmacéuticas se enfrentan con un doble reto, por una lado tienen la necesidad de invertir en nuevos equipos para adaptarse a los requisitos cambiantes de producción, mientras que por otro se encuentran con equipos antiguos que pasan a estar en desuso. Estas empresas tienen activos distribuidos en diferentes ubicaciones a nivel internacional, lo que les supone millones de euros invertidos en estos activos sin usar. Encuestas globales de la industria indican que un promedio del 10% de los activos de las compañías está en desuso y que la mayoría de los gerentes de las compañías no tienen un conocimiento claro de estos activos que están sin producir. Esto indica una clara oportunidad y la necesidad de la gestión de dichos activos. Solución Flexible Las mejores prácticas en la gestión de activos excedentes han evolucionado en las últimas décadas. Las compañías especializadas en este tipo de servicios emplean expertos de la industria farmacéutica y Project Managers experimentados, lo que les lleva a convertirse en líderes de este campo. Estas compañías ofrecen una variedad de servicios que les hace diferenciarse de la típica empresa de subastas. Véase figura 1. Cómo hacer el mejor uso de sus activos existentes La reubicación de equipos inactivos de laboratorio y de producción debe ser el 56 NOVIEMBRE/DICIEMBRE15 Figura 1. A la reubicación de equipos le sigue la venta, subasta y liquidación lo que presenta un modelo idóneo para la gestión integral de los activos excedentes. primer paso para cualquier empresa que quiera realizar el mejor uso de su inversión. En vez de deshacerse de sus equipos inactivos, la empresa puede reciclar ese equipo y darle actividad en alguna de sus otras plantas. Sin embargo, la redistribución de estos equipos no se puede lograr sin que exista una plataforma central de rastreo, instalada dentro de las ubicaciones de la compañía. Antes de tomar cualquier otra decisión, como la de avanzar con una venta externa, los usuarios deben tener la capacidad de publicar, rastrear, identificar y redistribuir internamente equipos que no se estén utilizando en su ubicación actual a otras facilidades de su propia empresa donde los puedan necesitar. Sin embargo, la reubicación no puede ser llevada a cabo con éxito y de forma consistente a menos que exista un sistema central de rastreo que incluya todas las localizaciones de la compañía. Para ello, las empresas están dotando a los usuarios de sencillos, aunque robustos, programas que les permiten publicar, seguir, identificar y reubicar internamente equipos que no están siendo utilizados en su ubicación actual antes de tomar cualquier decisión sobre pasar a la venta externa. Estas plataformas disponen de sistemas de gestión de flujos de tareas, múltiples niveles de acceso para responsables de planta y ejecutivos a lo largo de toda la cadena de negocios, funcionalidades de búsqueda en profundidad y especificaciones de listado exhaustivas, proporcionando aquella información que permite que la compañía conozca exactamente los equipos de los FARMESPAÑA INDUSTRIAL que dispone y donde se encuentran ubicados. Consecuentemente, los laboratorios farmacéuticos pueden así evaluar si poseen equipos que se encuentran inactivos en alguna ubicación, ya sea o bien porque la producción ha decrecido o porque la compañía se ha fusionado, que puedan ser movidos a otras de sus plantas. La venta o disposición de la maquinaria es el siguiente paso lógico cuando la reubicación no es posible. El auge del internet ha visto el desarrollo de varias páginas web que cumplen con esta necesidad, sin embargo cuando se trata de la venta de un equipo de alto valor y tan especializado es necesario el toque humano de un experto en la venta de este tipo de equipos vía internet. Para las compañías, normalmente el interés de recuperar la mayor cantidad monetaria por sus equipos excedentes es prioridad frente al tiempo en la que se tarda en realizar dicha actividad. Sin embargo existen ocasiones en la que el tiempo juega un papel importante, como por ejemplo en un cierre de planta. En esta ocasión la compañía necesita que los equipos se vendan a la brevedad posible para el desalojo de dicho lugar. En este caso la subasta es la vía principal para conseguir el objetivo. El diseño y desarrollo de una subasta requiere de varios factores. Un especialista debe aconsejar en la forma apropiada en cada uno de los casos. Las opciones pueden ser online, en vivo/webcast, sobre cerrado o venta privada. El éxito de dicha subasta dependerá del proveedor que se utilice. EquipNet y su larga historia en la industria farmacéutica realizando este trabajo a nivel mundial hace que esta sea una empresa bien posicionada para ofrecer consejos expertos a compañías operando en este sector. En todas las compañías existen activos de poco valor los cuales es mejor tratar a través de la liquidación, donación, chatarra y/o reciclaje ambiental. El modelo en práctica: La perspectiva del vendedor Una multinacional farmacéutica contrató a EquipNet para la liquidación de todos los activos pertenecientes a una planta que decidieron cerrar. El proyecto requería el desalojo de 2000 activos en un periodo de tiempo muy corto y antes de la total demolición de dichas instalaciones. La fase inicial del proyecto se concentró en la reubicación de los activos principales y la identificación de los equipos que habían sido requeridos. Seguidamente se FARMESPAÑA INDUSTRIAL realizó el inventario y tasación de cada uno de los equipos. Aproximadamente 90 % de estos activos fueron redistribuidos entre las plantas de la propia multinacional. Los activos sobrantes fueron publicados para la venta en la web de EquipNet. Mediante la utilización de una extensa base de contactos propiedad de Equipnet se consiguió la venta de todos los equipos superando el valor tasado. Un total de 900 equipos fueron vendidos a través de ventas negociadas y una subasta online, entregando ventas que superaron 700.000 Dólares, lo que duplicó las expectativas del cliente. Además de la relocalización de equipos con un valor de millones de dólares, se realizó un total en ventas de $3.3 millones USD. Y cabe destacar que se logró el desalojo de los equipos en el plazo determinado de ma nera que todos los edificios quedaron desalojados para su demolición a tiempo. Compra de Equipos de Segunda Mano Desde hace mucho tiempo ha habido usuarios de equipos de segunda mano. Empresas emprendedoras y laboratorios de universidades con pocos recursos económicos eran los compradores habituales de dichos equipos usados. Sin embargo en los últimos años esta tendencia se ha traspasado a empresas de mayor tamaño y con mayores recursos económicos utilizando la compra de equipos usados como una estrategia para incrementar la rentabilidad del programa de activos en sus plantas y recortar el coste de equipamiento de sus laboratorios. Las principales compañías de la industria farmacéuticas reconocen las ventajas de comprar lotes usados para equipar sus nuevas instalaciones a la hora de expandirse a nuevas áreas de producción y a territorios internacionales. La posibilidad de ahorrar entre 50-70 % del coste de nuevos equipos es, definitivamente, un factor muy atractivo para estas compañías. Los presupuestos se pueden extender aún más y disponer de ese dinero ahorrado en artículos adicionales. Asimismo, los equipos de segunda mano están generalmente disponibles inmediatamente y su entrega se puede realizar al momento de completar la compra, algo que no se puede garantizar al comprar un equipo nuevo. Los puntos positivos superan cualquier desafío potencial que pueda ocurrir. Cuando se compran equipos de segunda mano, existen muchos factores que pueden preocupar a las personas que se encuentran vendiendo activos, es importante trabajar con alguien con los conocimientos técnicos de los equipos, con alguien que entienda la industria y pueda estimar el valor del mercado con exactitud. Los compradores potenciales también pueden recibir el conocimiento de la industria y a la asesoría de aliados especialistas antes de realizar una compra, con el fin de minimizar el riesgo. En la práctica, es esencial que los compradores realicen investigaciones detalladas para obtener la mayor cantidad posible de información en áreas como el consolidado histórico del mantenimiento y operaciones realizadas por el comprador. En gestión de activos los peritos también pueden asistir con la transferencia de cualquier garantía disponible del proveedor al comprador e informarle sobre los procesos de logística internacionales durante la relocalización de los equipos. Resumen Mientras las compañías farmacéuticas se esfuerzan por combinar los objetivos operacionales adecuados con el crecimiento continuo, cada vez más compañías se unen a la revolución de los equipos de segunda mano y continúan cosechando los frutos financieros mediante la relocalización, compra y venta de equipos usados para producción y laboratorio. Sin embargo, este planteamiento proactivo de la gestión de activos no siempre está libre de obstáculos. En un mercado internacional que está experimentando una transformación radical con la imposición de un alto número de normativas y retos económicos, es necesario tener un aliado con conocimiento de la industria para tener éxito. Un aliado que ofrezca la experiencia necesaria para reconocer equipos de valor, oportunidades de relocalización y progresar con la disposición de activos no deseados, proporcionando mayor retorno económico para la empresa que vende sus excedentes y proporcionando equipos más rentables para el comprador Referencias – 2015 Global life sciences outlook: Adapting in an era of transformation, http://www2.deloitte. com/de/de/pages/life-sciences-and-healthcare/ articles/2015-global-life-sciences-outlook.html – 2015 Global life sciences outlook: Adapting in an era of transformation, http://www2.deloitte. com/de/de/pages/life-sciences-and-healthcare/ articles/2015-global-life-sciences-outlook.html NOVIEMBRE/DICIEMBRE15 57 Medical DISTRIBUCIÓN FARMACÉUTICA CON NOSOTROS ESTÁ CONTROLADO +2ºC/+8ºC +15ºC/+25ºC 916 696 828 stxmedical.com lifescienceslab Suplemento de Investigación, Analítica, Diagnóstico y Control en el Laboratorio NOV-DIC45 s y/o transportables para la producción de agua s, utilizando para ello la tecnología globalmente ación), que tiene como principal ventaja el sumiumpliendo en todo momento con las Normas de undial de la Salud (OMS-WHO). supplying water al e internacional, la solución ha sido reconocida cas e innovadoras a nivel mundial por la entidad producción es uno de los retos más importantes adecuada en las manos adecuadas puede liderar Distribuidor / Representante ing water Soluciones modulares para el suministro de agua AGUA POTABLE AGUA RESIDUAL REGENERACIÓN ••• ACTUALIDAD Dara Pharmaceutical Packaging presenta su equipo SX-50 SpeedFill. Dosificadora peristáltica de sobremesa El dosificado peristáltico se ha convertido en poco tiempo en el sistema preferido por la industria farmacéutica, ya que aporta esterilidad, flexibilidad y fácil limpieza, gracias a que el fluido únicamente está en contacto con el interior del tubo y la aguja de dosificado. La máquina que se presenta es una llenadora peristáltica de sobremesa, para un dosificado exacto y de alta calidad, en frascos, tubos y viales. El diseño del equipo se ha realizado para su uso en área estéril, conforme a las normas cGMP y de la US-FDA en especial correspondencia con las exigencias de la industria farmacéutica. La SX-50 está propulsada mediante un potente servomotor, capaz de aceptar hasta 3 cabezales en serie. El cuerpo del cabezal es monobloque, está construido en una sola pieza para una mejor asepsia. El cabezal peristáltico bombea los fluidos de manera suave y progresiva, sin romper la cadena molecular de los mismos, es excelente para dosificar sólidos en suspensión, vacunas, tejidos celulares y otros fluidos sensibles. Se trata de un equipo construido con los mejores componentes estándar de mercado, así elementos como el servomotor, reductor, pantalla táctil o PLC de control son elementos de fácil reposición en su área geográfica, facilitando un mantenimiento sencillo y rápido. Los tubos “Platinium Cured Silicone” se fabrican en sala aséptica y son de fácil esterilización mediante autoclave o mediante radiación por rayos gamma. El equipo está diseñado para funcionar de forma indepen60 NOVIEMBRE/DICIEMBRE15 diente o ser parte de una máquina llenadora industrial, totalmente automática. Todos los parámetros de producción son almacenados en la memoria del sistema, parámetros tales como: • Volumen de dosificado. • Cinemática del proceso de llenado, control individual de las rampas de aceleración y desaceleración. • Intervalo de tiempo entre dosificación. • Parámetros de calibración. • Función anti-goteo “drip-free”. • Velocidad de producción. Se regulan automáticamente y son asociados a cada programa de dosificado. El equipo puede almacenar hasta 200 programas de lotes de producción diferentes. Equipamientos opcionales: • Agujas, soporte y tubos de dosificado. • Cabezal peristáltico adicional, hasta 3 cabezales en serie. • Conexión a micro balanza y re-calibrado automático del volumen a dosificar. • Cabezal peristáltico construido íntegramente en acero inoxidable AISI-316L. • Software para la documentación o impresión de todos los datos relevantes de la producción. • Ejecución eléctrica antideflagrante Xproof. • Validación IQ / OQ. Para más información www.dara-pharma.com Iguña Pharma, en el Laboratorio Territorial del Área Metropolitana Norte del ICS Iguña Pharma ha sido una de las adjudicatarias de la obra de construcción del Laboratorio territorial del ICS (Instituto Catalán de la Salud) en el área Metropolitana Norte situado en el Hospital Germans Trias de Badalona (Barcelona). Esta obra supondrá la gestión de un gran volumen de análisis clínicos del área Metropolitana Norte y consta de 1.300 m2 de superficie a reformar en la planta primera del edificio del hospital. Toda la arquitectura de panel farmacéutico seguirá las más estrictas normas de seguridad farmacéutica y biotecnológica. Este laboratorio de primer nivel internacional en fase de construcción, cuenta con el sistema Modular Clean Panel de Iguña Pharma. Este sistema cumple con las máximas exigencias solicitadas en cuanto a cumplimiento de normativas EU-GMP e ICH Q7A, así como ofrece máximas prestaciones en cuanto a modularidad en la ejecución de salas pen- sando siempre en la flexibilidad que necesita un laboratorio para adaptarse a sus procesos en constante desarrollo. Iguña Pharma se ha distinguido por ofrecer proyectos integrales a sus clientes, aportando soluciones y experiencia, desde el diseño conceptual y la puesta en marcha y validación de las salas limpias hasta la fabricación de materiales propios. Durante todo el proceso se cuenta con único proveedor e interlocutor, aspecto que agradecen los clientes. Iguña Pharma, con más de veinticinco años de experiencia a sus espaldas, ha destacado por su reputación en el área de instalación y montaje, pero actualmente sus proyectos la han dotado de una potente área de ingeniería. Además, debido a su dilatada trayectoria en el sector, Iguña Pharma ha permitido ofrecer propuestas personalizadas ajustadas a las necesidades singulares de cada proyecto. FARMESPAÑA INDUSTRIAL ACTUALIDAD Control de la esterilización con 3M™ Indicador Biológico ATTEST™ En los procesos de esterilización es muy importante asegurar que el proceso se ha realizado de forma correcta. En este sentido Bioser S.A dispone del indicador biológico 3M™ Attest™ que está específicamente diseñado para el control de procesos de esterilización por vapor u óxido de etileno. Se trata de un vial que se introduce dentro del autoclave junto con el material a esterilizar y está formado por un medio de enriquecimiento y esporas de Geobacillus stearothermophilus. Después de la esterilización, el vial se activa para poner en contacto el medio de cultivo con la tira de esporas procesada y se incuba durante 48 horas a una temperatura de 56°C. Un cambio de púrpura a amarillo indica un resultado Aumentando la precisión en el pesaje mediante la reducción de estática Junto a las nuevas balanzas SemiMicro Explorer®, Ohaus ha presentado el Ionizador ION-100ª, que optimiza la precisión de los resultados a la hora de pesar las muestras muy pequeñas por la mitigación de las cargas estáticas que pueden conducir a inexactitudes. ION-100A elimina la estática en contenedores de plástico y vidrio que son particularmente propensos a atraer cargas estáticas. El ionizador ION-100A se utiliza con una balanza OHAUS agregando un nivel adicional de seguridad para factores externos que no afectan la exactitud de los datos de pesaje. Las características estándar incluyen: • Tecnología neutralizadora de estática libre de ventilador sin interrupción para la muestra — Los electrodos del ION-100A generan continuamente iones biFARMESPAÑA INDUSTRIAL polares mediante una corona DC (tecnología libre de ventilador). Los iones positivos y negativos son creados por dos electrodos que dirigen el aire ionizado sobre la muestra. A través de esta tecnología libre de ventilador, el ION-100A neutraliza cargas estáticas sin la producción de corrientes de aire. • Motor fácilmente reemplazable de larga duración — el ionizador cuenta con electrodos de larga duración, con vida útil estimada de 15.000 horas, pueden ser reemplazados fácilmente si es necesario. • Diseño versátil y compacto — La altura y el ángulo del ionizador se pueden ajustar para una alineación óptima con la balanza, mientras que su pequeño tamaño ocupa un espacio mínimo en la mesa de laboratorio. positivo debido al crecimiento de las esporas. Si no hay cambio de color significa que el proceso de esterilización ha sido correcto y por tanto las esporas han sido destruidas. El indicador biológico de 3M™ permite una interpretación objetiva del proceso de esterilización y cumple con los requisitos de la norma UNE EN ISO 11138. Promoviendo la seguridad en el laboratorio Ortoalresa, siguiendo con su compromiso de incrementar la protección del usuario y el entorno del laboratorio, ha desarrollado un accesorio, el Gas Release System (GRS), que protege a los usuarios del laboratorio de los aerosoles nocivos que se producen en ciertos procesos de centrifugado, ya sea en condiciones normales (prevención de riesgos) o ante un incidente en el proceso (minimizando los efectos) evacuando estos gases a un área segura. Con esto se consigue mantener la seguridad a distintos niveles: • A nivel de usuario: evitando inhalación de ga- ses nocivos. • A nivel del laboratorio: evitando la dispersión de aerosoles al ambiente, previniendo así reacciones en cadena. • En las condiciones óptimas de trabajo del resto de los equipos anexos. El GRS se propone actualmente como un accesorio para la gama de centrifugas para petróleos de Ortoalresa, la serie Digtor 21 C, pero dado el éxito de este accesorio a la hora de prevenir situaciones de riesgo en el laboratorio, próximamente el resto de nuestra gama de centrífugas contarán con la preinstalación para el mismo. NOVIEMBRE/DICIEMBRE15 61 ACTUALIDAD Rainin TerraRack™ ideal para instalaciones centrales de PCR Las gradillas de puntas de pipeta Rainin TerraRack™ lanzadas al mercado recientemente por METTLER TOLEDO están resultando muy populares en la Instalación central de Investigación y Diagnóstico de PCR en tiempo real en la Universidad de California, Davis. El laboratorio, parte de la facultad de Veterinaria, realiza ensayos de diagnóstico molecular para consultas de veterinarios en todo EE.UU., así como la extracción de ácido nucleico y qPCR para estudios de investigación externos, confían en las pipetas Rainin de alta calidad y en las puntas BioClean™ para asegurar el pipeteado exacto y seguridad de la muestra. La directora del laboratorio Samantha Mapes explicó: “Hemos usado las pipetas únicas y multicanales Rainin Pipet-Lite™ durante alrededor de 12 años, y siempre hemos estado muy satisfechos tanto con su precisión como con la ergonomía”. “Como instalación central, utilizamos grandes cantidades de puntas y el reciclaje es una cuestión muy importante para los negocios aquí en California. METTLER TOLEDO sugirió que intentáramos utilizar las gradillas para puntas Rainin TerraRack para reducir la eliminación de residuos de la facultad, y han sido ideales para nosotros. Son mucho más ligeras y fáciles de reciclar que las gradillas de puntas tradicionales y, a pesar de no parecer tan sólidas, han resistido muy bien las actividades diarias. No hemos conseguido resquebrajar ni hundir ni una sola gradilla todavía, a pesar de que la mayor parte del tiempo no usamos los soportes TerraBase™. Cada caja de puntas llega pre-esterilizada, y el diseño de tapa evita la contaminación, incluso si las puntas permanecen almacenadas durante varios meses, lo que claramente es una consideración importante en un laboratorio de PCR. En general, estamos muy impresionados, y uno de nuestros técnicos a tiempo parcial ya ha empezado a cambiar el otro laboratorio en el que trabaja a las cajas de puntas TerraRack”. Roche lanza el nuevo analizador cobas c 513 para responder al aumento de la demanda de pruebas de HbA1c en diabéticos Estas son algunas de las principales características del analizador cobas c 513: • Análisis de HbA1c para identificación del riesgo, diagnóstico y seguimiento de personas con diabetes. • Dos veces más volumen de procesado —con 400 resultados de paciente por hora— en el mismo espacio. • Capacidad para un mayor número de pruebas • Notificación directa de resultados. El pasado mes de octubre, Roche presentó su nueva solución específica de alto volumen de procesado para 62 NOVIEMBRE/DICIEMBRE15 pruebas de HbA1c, el analizador cobas c 513, disponible en los países que aceptan la certificación CE. “El aumento del número de diabéticos plantea un desafío a los profesionales sanitarios y supone una carga significativa para los sistemas de salud —explica Roland Diggelmann, director operativo (COO) de Roche Diagnostics—. Con el sistema cobas c 513, Roche está satisfaciendo las crecientes necesidades específicas de nuestros clientes”. El nuevo analizador cobas c 513 de Roche sustituye al actual analizador específico para HbA1c, el COBAS INTEGRA 800 CTS, que ha venido ofreciendo una solución eficaz, firmemente establecida en el mercado. El analizador cobas c 513 incrementa aún más la eficiencia de los laboratorios al duplicar el volumen de procesado del INTEGRA 800 CTS —que ya se situaba a la cabeza del mercado— pasando de 200 a 400 resultados de paciente por hora. El cobas c 513 alcanza este rendimiento ocupando el mismo espacio. El analizador cobas c 513 notifica los resultados directamente, lo que minimiza los riesgos de malinterpretación y hace innecesaria una inter- pretación manual de los resultados, con el consiguiente ahorro de tiempo y recursos del laboratorio sin perjuicio de una calidad elevada de los resultados. Además, el analizador cobas c 513 permite cargar simultáneamente un mayor número de pruebas, lo que ahorra espacio en el laboratorio, libera recursos y facilita el flujo de trabajo. El nuevo analizador permite, además, el análisis en tubos cerrados, lo que reduce el tiempo de operaciones manuales, evita la contaminación de las muestras y garantiza la seguridad del personal del laboratorio FARMESPAÑA INDUSTRIAL ACTUALIDAD CELGENE, nueva presidencia de ASEBIO La Asociación Española de Bioempresas (ASEBIO) ha renovado su presidencia, vicepresidencias y vocalías en la Junta Directiva en el marco de la celebración de la Asamblea General. Tras la aprobación de la Asamblea, Celgene, representado por Jordi Martí, vicepresidente y director general de Celgene España, ha obtenido la presidencia de ASEBIO, en sustitución de MSD represen- tada por Regina Revilla. Junto a Jordi Martí, compartían su candidatura como vicepresidentes Carlos Buesa, director general de Oryzon Genomics (vicepresidencia primera) Carmen Eibe, directora del departamento de coordinación de proyectos de PharmaMar (vicepresidencia segunda) y Daniel Ramón, consejero delegado de Biópolis (vicepresidencia tercera), quienes Merck completa la adquisición de Sigma-Aldrich Merck, compañía líder en ciencia y tecnología, ha anunciado el mes pasado que ha completado la adquisición de Sigma-Aldrich por 13.100 millones de euros, tras la aprobación final de la transacción por parte de la Comisión Europea. En junio de este año, la Comisión Europea ya otorgó la aprobación condicional a la operación, sujeta a la liquidación de ciertos activos de Sigma-Aldrich. Así, el pasado 20 de octubre, Merck anunció un acuerdo de venta de parte de los negocios de disolventes y productos inorgánicos de Sigma-Aldrich a Honeywell. Tras la aprobación de la transacción por parte de la Comisión Europea, Merck ha completado todos los requisitos para finalizar la adquisición de Sigma Aldrich. La venta formal culminará el 18 de noviembre, cuando se produzca la salida de Sigma-Aldrich de la bolsa de valores NASDAQ. “Hemos alcanzado la recta final y estamos preparados para completar la mayor adquisición en nuestros casi 350 años de histo- FARMESPAÑA INDUSTRIAL ria”, anuncia Karl-Ludwig Kley, CEO y presidente del Comité Ejecutivo de Merck. “Con esta operación, Merck se convierte en líder de una industria, la de ciencias de la vida, de 130.000 millones de euros, y lo hace con 20.000 personas, 300.000 productos y miles de patentes que, juntos, ayudarán a nuestros usuarios a encarar las mayores dificultades asociadas a las ciencias de la vida a partir de soluciones innovadoras”. El 22 de septiembre de 2014, Merck y Sigma-Aldrich anunciaron que habían llegado a un acuerdo definitivo por el cual Merck adquiriría todas las acciones en circulación por un valor de 140 dólares cada una. La aprobación última de la Comisión Europea sigue a la conformidad de la operación por parte de los accionistas de SigmaAldrich en una reunión extraordinaria celebrada el 5 de diciembre de 2014, así como al cumplimiento de otras condiciones, como las aprobaciones antitrust de países como Estados Unidos, China y Japón. por lo tanto también han resultado elegidos. Además, la Asamblea General de ASEBIO ha renovado vocalías de su Junta Directiva. Los socios que pasarán a ocupar nuevas vocalías en la Junta son AB Biotics, Grifols, Ingenasa, Esteve, MSD y NeuronBio, y continúan en el cargo 3P, Amgen, Ferrer, Genetrix, Merck y Vivia Biotech. Jordi Martí, tras su elección como presidente durante dos años, agradeció su apoyo a todos los socios presentes en la Asamblea. Según sus palabras “ASEBIO se ha convertido en uno de los grandes referentes dentro del sector, gracias a su compromiso con la biotecnología, y las cifras de los últimos quince años avalan este crecimiento exponencial. Uno de los principales retos para esta nueva legislatura será el de trabajar de forma transversal con todos los socios, desde las pequeñas PYMES hasta las grandes compañías que componen ASEBIO, escuchando sus necesidades y luchando por sus intereses”. “Vivimos un momento de grandes cambios dentro del sector. Por este motivo, necesitamos continuar creciendo como una Asociación fuerte y cohesionada, que posicione la biotecnología como herramienta clave para el desarrollo científico en nuestro país y que potencie la participación de las empresas asociadas en proyectos internacionales para incrementar la competitividad de la I+D+i”, explicó. Entre los objetivos estratégicos de esta candidatura destacan: • Conseguir los cambios normativos, legislativos y financieros que permitan mejorar el desarrollo de la biotecnología y la capacidad de crecimiento de las empresas, fortaleciendo para ello la posición institucional de forma proactiva y reactiva de la Asociación. • Apostar decididamente por la internacionalización tanto en el mercado latinoamericano como europeo, coordinados con Europabio. • Liderar la transformación del sector hacia las grandes tendencias internacionales, como la compra pública innovadora, la bioeconomía, etc. Entre sus líneas de trabajo fundamentales se encuentran transformar la gestión y la cartera de servicios de la Asociación hacia una nueva oferta de servicios que se ajuste de una forma más eficaz a los retos y necesidades presentes y futuros de las empresas asociadas; mejorar los canales de participación y contribución a iniciativas internas por parte de los asociados; abrirse a nuevos mercados con nuevos servicios que permitan apoyar el crecimiento del sector a través de alianzas internacionales y nacionales; potenciar la participación de las empresas asociadas en proyectos y redes internacionales como mejor herramienta para incrementar la competitividad de la I+D, abrirse a mercados y alcanzar nuevas fuentes de financiación; potenciar la comunicación como herramienta de influencia y visibilidad en todos los ámbitos políticos, económicos y sociales e incrementar la representatividad y el peso del sector biotecnológico a través de ASEBIO en todas las instituciones. NOVIEMBRE/DICIEMBRE15 63 ••• SOFTWARE DE LABORATORIO El coste creciente de los problemas cotidianos del laboratorio y cómo evitarlos Si ha trabajado en un laboratorio, sabe de primera mano lo frenético, acelerado y abrumador que puede resultar en ocasiones. Y, hoy más que nunca, los recortes en los presupuestos fuerzan a muchos directores de laboratorio y analistas a hacer más con menos. Esto redunda en que muchos se sienten como si estuviesen continuamente apagando un incendio. Sin embargo, existe una salida a esta situación, que comienza por tener una visión del laboratorio más global, solucionando primero los problemas evidentes y cotidianos. Trish Meek, Director of Product Strategy at Thermo Fisher Scientific. Después de pasar un sinfín de horas observando los laboratorios de forma global, resulta evidente que la mayor parte –sí, eso significa la mayoría– sigue ignorando al menos un “problema cotidiano”, a pesar de los costes significativos asociados a ello. Este artículo espera cambiar esta situación arrojando algo de luz sobre cinco de los problemas más frecuentes a los que se enfrentan todos los laboratorios. 64 NOVIEMBRE/DICIEMBRE15 Todos estos problemas tienen en común que incluyen numerosas subtareas y requisitos que, a menudo, entorpecen el contexto más amplio. Es la versión de laboratorio en la que los árboles no dejan ver el bosque. Profundicemos un poco en estos problemas cotidianos y veamos cuáles resultan familiares y cómo podemos adaptarlos según el tamaño de su laboratorio. Problema número uno: mala gestión del inventario Admítalo, en algún momento ha realizado pedidos urgentes para su laboratorio. Tal vez no lo haya hecho este trimestre pero si ha pagado dinero extra para recibir un producto con envío exprés o ha contratado un servicio de mensajería pri- vada porque se ha quedado sin un producto inesperadamente “le ha pillado el toro”. Veamos por qué puede resultar un problema. La mayor parte de los laboratorios gestionan un inventario de productos químicos o consumibles (todo lo que no son sustancias químicas y que puede usarse y desecharse). Dentro de estas dos amplias categorías, se encuentran los consumibles de gran valor que pueden adquirirse puntualmente así como productos químicos que se utilizan mucho o que se terminan a menudo, etc. El inventario varía entre laboratorios pero, a menudo, resulta bastante predecible en cada laboratorio, ya que cada uno realiza análisis determinados con flujos de trabajo constantes. Tomemos como ejemplo un consumible de valor como una bandeja de pocillos desechable. En el caso de que su laboratorio analice rutinariamente muestras para E. Coli., ya sabe lo que se necesita para cada flujo de trabajo y cuántos análisis se realizan al año, de modo que debería saber cuántas bandejas mantener en el inventario. Si lo sabe, el primer paso del proceso es realizar un presupuesto por adelantado basado en los archivos históricos. Asimismo, tener excedentes de inventario “por si acaso” no es una buena opción y nunca es una buena práctica empresarial. La elaboración del presupuesto no es más que el primer paso para una gestión disciplinada del inventario. Llevar un seguimiento de lo que se ha usado, cuándo y por quién es FARMESPAÑA INDUSTRIAL SOFTWARE DE LABORATORIO otro paso fundamental y que, sin embargo, se suele pasar por alto. ¿Por qué es importante esta información? Porque el personal del laboratorio está conformado por seres humanos y las personas cometen errores, emprenden acciones impredecibles y protegen su terreno con egoísmo, aunque con nobleza. Los viales de cromatografía de gases (CG) son un buen ejemplo. Dado que se trata de un producto con una gran demanda, los técnicos de laboratorio tienden a esconderlos o a guardar provisiones de ellos. A pesar de que actúan sin malicia, un técnico que guarda un vial de CG está causando un perjuicio costoso al laboratorio. En primer lugar, si se acaban las existencias, puede conllevar efectos en cadena en FARMESPAÑA INDUSTRIAL otros análisis, lo cual afectará a la productividad general. En segundo lugar, el técnico que observe que se terminan los viales seguramente realizará un encargo urgente para minimizar el efecto, lo cual puede significar pagar un precio doble al añadirse costes de envío urgente. Si esto sucede con poca frecuencia, el efecto es insignificante pero si esta situación se produce con demasiada frecuencia se puede convertir en un problema caro. La respuesta evidente es un mejor presupuesto y un seguimiento, y es ahí donde un sistema de gestión de información de laboratorio (LIMS) resulta muy efectivo. Sin embargo, son muchos los que emplean hojas de cálculo, aunque la sensación de seguridad sea falsa. A pesar de que tampoco resulta sencillo gestionar el inventario con un software, las hojas de cálculo simplemente no son lo suficientemente dinámicas para establecer un sistema de gestión del inventario que apoye de modo proactivo la planificación/elaboración del presupuesto y que ofrezca una precisión al minuto. Con el LIMS Thermo Scientific SampleManager, por ejemplo, los laboratorios pueden realizar un seguimiento detallado del inventario como parte de un programa de gestión de laboratorio exhaustivo. Incluso pueden crearse alertas por niveles de existencias. La moraleja consiste en que lo que hay en juego en la gestión del inventario es algo más que una leve molestia Los encargos urgentes salen caros pero el tiempo de inactividad del técnico y de la máquina como resultado de haberse agotado los consumibles es incluso más caro. Por otra parte, adoptar un nuevo enfoque para la gestión del inventario con tecnología, preferiblemente un LIMS que pueda realizar otras muchas tareas en el laboratorio, es algo que ya no se puede seguir pasando por alto. Problema número dos: No detectar tendencias analíticas Identificar errores es complicado. Es más, el enfoque de los laboratorios también es propenso al error, comenzando por el hecho de que se centra en solucionar errores a posteriori. El enfoque debe consistir en predecir y evitar errores, incluso los pequeños y que parecen irrelevantes. Los errores que enmascaran problemas de NOVIEMBRE/DICIEMBRE15 65 SOFTWARE DE LABORATORIO QA/QC, por ejemplo, pueden engendrar problemas mucho mayores y sistémicos o crear lagunas productivas que pueden llegar a requerir una reconfiguración costosa. Pero cómo saber si un experimento está fuera de especificación, o si muestra una tendencia en esa dirección, resulta especialmente complicado. Piense en un analista que realiza 50 análisis o más cada semana con hojas de cálculo en papel, ¿cómo se puede pretender que esta persona detecte tendencias casi imperceptibles, especialmente si no las está buscando? No puede y tampoco es justo que toda esta responsabilidad recaiga sobre una única persona. Los analistas, los directores y los técnicos de laboratorio son personas con una gran formación y excepcionalmente cualificadas pero no se puede permitir que actúen a su total discreción. Incluso a una eminencia con amplia experiencia y los mejores resultados es fácil que se le escapen patrones y tendencias de datos sutiles, especialmente a la escala en que trabajan la mayor parte de los laboratorios. Y, en aquellos casos en que se puede llevar a cabo, el análisis es retrospectivo, tal vez semanas después de un experimento. Cuando se identifica un error demasiado tarde, el daño ya está hecho. El control de calidad estadística (SQC) debe incorporarse obligatoriamente en cualquier tecnología que emplee el laboratorio cada día. El LIMS Thermo Scientific SampleManager, por ejemplo, incluye esa opción en su sistema de gestión de información de laboratorio (LIMS). Lo que hace es detectar tendencias de disconformidad antes de que lleguen a umbrales predeterminados. Ésta es la ventaja para el laboratorio: el control en tiempo real con algoritmos estadísticos es crucial para la toma de deci66 NOVIEMBRE/DICIEMBRE15 siones. Los analistas pueden y deben observar las tendencias de los datos mientras se está realizando el experimento, no semanas más tarde. Los errores menores no pueden considerarse triviales. Un error no detectado puede costar miles de euros o más en productividad perdida, retiradas de producto, pérdida de consumibles y mucho más. Detectar incluso los errores más pequeños cuando se producen, porque su LIMS le alerta o porque un SOP le exige que revise datos en determinados intervalos, es de una importancia clave en los laboratorios de hoy día, que sufren limitaciones de personal y donde se trabaja a un ritmo muy elevado. Importante: los seres humanos no pueden reunir la capacidad de un LIMS y de un SQC. Si confía en el papel y en análisis post-mortem, se está perdiendo detalles que pueden convertirse en problemas mayores. Problema número tres: SOP no controlados Lleva tiempo desarrollar y documentar procedimientos operativos estándar (SOP), pero no hacerlo es la receta del desastre. Los laboratorios no pueden tolerar que no se apliquen siempre los mismos procedimientos, aunque en un primer momento algunas ideas innovadoras puedan prometer un ahorro de tiempo. Solo cabe la innovación en un laboratorio si, y solo en este caso, pasa por el rigor del proceso del SOP. Todos los laboratorios cuentan con un técnico o analista “innovador” que presume de encontrar atajos, pero a menos que cumpla un SOP, todo lo que tenemos es un analista “fuera de control”. Los SOP electrónicos (ESOP) son el sistema de defensa del laboratorio frente a los trabajadores fuera de control. Con SOP definidos en el LIMS SampleManager, por ejemplo, se produce un flujo de trabajo estricto con acciones técnicas correctivas claramente definidas para garantizar la coherencia y el cumplimiento del protocolo. Si no existen, o si los SOP en papel no son prácticos, claros o no se comprenden, resulta fácil que un analista se equivoque, incluso inconscientemente. Deben tenerse en cuenta cuatro aspectos importantes al elaborar los ESOP: exhaustividad, estandarización, distribución y cumplimiento. El rendimiento del laboratorio depende del éxito del laboratorio en abordar estos imperativos. • Exhaustividad: dedique tiempo a la elaboración de cada ESOP. Y cuanto más detallado sea, mejor. A menudo, las subfases pequeñas son las que generan innovadores fuera de control y -rompen la continuidad. • Estandarización: no evite la innovación si tiene sentido, pero no deje de actualizar los ESOP existentes, para que todo el personal pueda utilizarlos. Un LIMS es una herramienta perfecta para garantizar que se estandarizan los SOP. • Distribución: más complicado si todavía utiliza SOP en papel. En cualquier caso, asegúrese de que el personal conoce y comprende cada SOP. Un LIMS lo facilita, por supuesto, porque se integra en el proceso desde el principio. • Cumplimiento: el personal del laboratorio debe ser responsable de cada SOP. Deben seguir cada paso, de lo contrario se convierte en una mera sugerencia. El requisito de que los analistas introduzcan datos a medida que se generan, por ejemplo, no solo elimina errores e identifica tendencias proactivamente y mejora el QA/ QC, sino que también ayuda al laboratorio a cumplir los requisitos descritos en normas como la ISO 17025. Decir que los SOP representan uno de los cinco problemas principales que deben abordarse en un laboratorio no es nada nuevo. Algo diferente sería recomendar cómo crear estos SOP, distribuirlos y realizar el seguimiento para la productividad y el cumplimiento legal. Numerosos laboratorios siguen utilizando papel, lo cual les supone una clara desventaja. Y todavía son más los laboratorios que no actualizan o exigen el cumplimiento de los SOP conforme pasa el tiempo. Sin embargo, la buena noticia es que la tecnología, en forma de LIMS, ha evolucionado hasta un punto en que gestionar los SOP resulta más sencillo y más eficiente que nunca. Problema número cuatro: Trazabilidad de las mediciones Gestionar el inventario y elaborar, repartir y realizar el seguimiento de los SOP electrónicamente han demostrado ser factores de éxito en cualquier laboratorio. Si hace esto bien, es probable que se encuentre en una buena posición para la trazabilidad de las mediciones. Sin embargo, si no cuenta con una visión en tiempo real del inventario y el personal no cumple los ESOP, especialmente aquellos relacionados con la introducción de datos durante el experimento, puede no ser capaz de encontrar la causa raíz de un mal resultado, lo cual puede suponer un problema, sobre todo con la validez legal de los datos. Un laboratorio puede ser responsable de cientos de análisis a la semana, o incluso más, y un análisis no es solo un análisis, es la suma de numerosas partes. ¿Dónde se ha originado una muestra, cuál es el historial de mantenimiento del instrumento utilizado, qué reactivos y normas se emplearon FARMESPAÑA INDUSTRIAL SOFTWARE DE LABORATORIO en el análisis, cuándo se certificó por última vez el analista y qué proveedor suministró los consumibles? Sin respuestas a estas preguntas entre otras, defender una medición analítica puede resultar prácticamente imposible. Defender los datos implica estudiar minuciosamente los pasos dados, algunos de los cuales están tan implantados en la estructura del laboratorio y en su flujo de trabajo que puede resultar imposible aislarlos. Como buscar una aguja en un pajar. Imagínese tener que revisar notas manuscritas de analistas y no encontrar lo que puede haber fallado, es frustrante. Pero también, costoso: normalmente, los analistas pasan un cuarto de su tiempo productivo recabando datos para defender un resultado. Defender los datos es complicado, pero no es una opción. Afortunadamente, la tecnología puede realizar un trabajo de fondo que puede reducir drásticamente el tiempo, el gasto y la exasperación asociados a la defensa de los resultados. El software de gestión de datos permite aumentar el rendimiento cuantificable, al reducir un 25 por ciento el tiempo que debe dedicar a la defensa de los datos. ¿Qué podría hacer si tuviese otra hora o más cada día? El LIMS ha avanzado mucho desde que los laboratorios confiaron en ellos solo para la gestión de muestras básicas y la realización de informes. En la actualidad, el LIMS se extiende en la empresa. Todavía está ubicado en el laboratorio, pero integra datos de MRP, ERP y de otros sistemas de la empresa de modo que presentan un impacto directo en la defensa de resultados. Se han terminado las búsquedas en diferentes ubicaciones, a menudo en combinación con notas manuscritas, hojas de FARMESPAÑA INDUSTRIAL cálculo e informes: todo lo que necesita para defender los resultados ya está bien organizado para un análisis y la elaboración de un informe rápidos. Problema número cinco: Mantenimiento malinterpretado Cuando muchos laboratorios piensan en un análisis de tendencia, con frecuencia no lo asocian con el mantenimiento del instrumento; sin embargo, esto es un error. Este elemento refleja el desconocimiento de la importancia del mantenimiento, especialmente del preventivo. Una historia reciente de una directora de laboratorio muestra la importancia de pensar estratégica y proactivamente respecto al mantenimiento. Un cromatógrafo de gases dejaba de funcionar constantemente, incluso 12 horas en un momento dado. Después de sufrir varios incidentes con intervalos de inactividad costosos y frustrantes, la directora de laboratorio aisló el problema. Pronto se dio cuenta de que, si hubiese observado detenidamente las mediciones del área, hubiese detectado un patrón problemático emergente. Para ella, fue un “momento eureka”: “Recabamos todos estos datos a medida que avanzaba el experimento, ¿por qué no los utilizamos nunca?” Los datos, como las mediciones del área, la conductividad inicial y el tiempo de retención aportan pruebas valiosas que, si se analizan y emplean para realizar tendencias, pueden revelar mucho sobre la salud de un instrumento. Los LIMS como SampleManager ofrecen opciones que permiten a los usuarios controlar la salud del instrumento, de modo que puede asignarse el trabajo con mayor eficacia en un programa de mantenimiento regular. Se notifica el mantenimiento programado a los usuarios, in- cluso las averías por desgaste, de modo que el mantenimiento puede programarse antes de que la avería se convierta en un problema. Pero los laboratorios tienen la posibilidad de “afinar” todavía más sus instrumentos a través de los datos. Los analistas le dirán que conocen sus instrumentos, pero en ocasiones las señales son demasiado sutiles para detectar el error antes de que se produzca y el instrumento deje de funcionar. Y con numerosos laboratorios trabajando con recién titulados, nuevos contratados y demás personal que no esté familiarizado con un tipo de instrumento (o incluso un instrumento en concreto), confiar en las sensaciones es arriesgado. Para comprender lo que le está diciendo un instrumento, es mejor confiar en los datos: si fija un punto de muestra y vigila una posible desviación se está proporcionando a sí mismo un sistema de aviso temprano, lo cual puede hacerse fácilmente en un LIMS. Los datos existían antes del software, pero hasta la aparición de los LIMS y de otros sistemas, los laboratorios pasaron gran parte de su tiempo mirando atrás. En el caso del mantenimiento, puede haber producido algunas buenas prácticas, pero no ha ayudado a evitar tiempos de inactividad y malos resultados. Ahora podemos hacerlo y ya podemos conocer nuestros instrumentos y tomar decisiones con datos como nunca antes. Conclusión: Pasos pequeños crean grandes cambios Visito muchos laboratorios de numerosos sectores y veo que la mayor parte todavía lucha con problemas básicos que llevan muchos años suponiendo quebraderos de cabeza para los laboratorios. Además, en la actualidad, el ritmo es incluso más frenético y las exigencias al director y a los analistas son mayores. Por ello, más que nunca, ha llegado el momento de volver a lo básico pero sin ser básico. Los laboratorios deben acoger la tecnología disponible para tener un enfoque mucho más estratégico, proactivo e inteligente ante lo que muchos pueden considerar rutina. Los problemas cotidianos presentan consecuencias importantes, especialmente cuando se acumulan. Detener esta acumulación, bola de nieve, cascada o confluencia de problemas es complicado sin contar con los datos y, tal vez lo más importante, sin un modo sistemático de analizar tendencias y transgresiones. Al enfocarnos en los problemas comunes anteriores, esperamos haber proporcionado un punto de partida para descubrir las deficiencias de su laboratorio o sus laboratorios NOVIEMBRE/DICIEMBRE15 67 ••• TRATAMIENTO DE AGUAS Cómo evitar los problemas causados por las bacterias en los analizadores clínicos Los laboratorios biomédicos con gran carga de trabajo son un enlace vital en la gestión de la atención sanitaria de los pacientes. Esos laboratorios suelen funcionar 24 horas al día, siete días a la semana para proporcionar a los médicos los resultados de sus pacientes lo antes posible, y a menudo en unas pocas horas. En entornos como esos, hay poco margen para la ineficacia o la duda respecto a la fiabilidad de los resultados de los análisis clínicos realizados en el laboratorio. Figura 1. La fosfatasa alcalina como enzima de detección en métodos bioquímicos. Maryse Gauthey Baraou y Stéphane Mabic, PhD Lab Water Bussines Field Millipore S.A.S. Saint-Quentin-en-Yvelines, Francia Claves para obtener resultados clínicos precisos Puede resultar evidente que analizadores de gran calidad y con buen mantenimiento, así como personal del laboratorio profesional y competente son esenciales para asegurar resultados constantemente exactos y aumentar al máximo el tiempo de funcionamiento del analizador clínico. Otro factor menos obvio, pero muy importante, sin embargo, es la 68 NOVIEMBRE/DICIEMBRE15 calidad de los reactivos, entre ellos el agua, usados para alimentar el analizador. Proporcionar agua de calidad adecuada para los ensayos clínicos es fundamental para obtener resultados fiables y constantes a lo largo del tiempo. Sin embargo, antes de poder utilizar agua potable del grifo para alimentar un analizador clínico, deben eliminarse diversos tipos de contaminantes para conseguir un grado de pureza adecuado para los análisis. En particular, es crucial conseguir un bajo recuento de bacterias en el agua purificada, ya que las bacterias pueden contaminar el analizador, y generar numerosas interferencias en los análisis bioquímicos e inmunoquímicos. Múltiples efectos de las bacterias: cómo y dónde Las bacterias gramnegativas, como Ralstonia pickettii, Sphingomonas paucimobilis, Caulobacter crescentus y Pseudomonas aeruginosa, pueden reproducirse y contaminar el analizador clínico1-3. Estas bacterias crecen en los tubos, el interior del depósito, las rampas de filtración, las muestras y las agujas de los reactivos. Pueden encontrarse elevadas concentraciones de bacterias, de 10⁵ a 10⁶. Las bacterias liberan enzimas y ácidos orgánicos pequeños, como el oxalato y el piruvato, que interfieren en diversos ensayos, provocando calibraciones inestables del analizador, elevada absorbancia de los blancos, desviaciones de los valores de referencia y errores en los valores medios de los pacientes. Interferencia en los ensayos químicos En el ensayo de determinación de calcio con arsenazo III, las proteínas bacterianas se unen al Ca, modificando la concentración del analito en la muestra de suero. En el ensayo potenciométrico del potasio, se observaron elevados coeficientes de variación (CV) y FARMESPAÑA INDUSTRIAL TRATAMIENTO DE AGUAS la necesidad de recalibración después de que los instrumentos estuvieran en modo en espera; estos problemas se desvanecían después de aclarar el equipo y de utilizarlo durante algún tiempo3. Interferencias en los enzimoinmunoanálisis (EIA) El uso de la fosfatasa alcalina (ALP) como una enzima de detección es común en numerosos métodos biomédicos, entre ellos el enzimoinmunoanálisis y las sondas de ácidos nucleicos marcados con ALP. La mayor parte de los ensayos de este tipo se realizan utilizando intestino de ternera (CIP). La ALP bacteriana liberada tras la proliferación de especies bacterianas en agua purificada puede crear interferencias con el intestino de ternera en los enzimoinmunoanálisis, donde se utiliza para generar señales: luz UV/visible, fluorescencia o quimioluminiscencia. Ejemplos de esos ensayos son la cascada de amplificación bioquímica cTnI para la detección UV/visible, la inmunoquímica basada en el 4-metilumbeliferil fosfato (MUP) para detección mediante fluorescencia y la inumoquímica basada en el AMPPD para detección mediante quimioluminiscencia. Figura 2. Ejemplo de diseño de un sistema de purificación de agua eficaz para usar con analizadores clínicos. Figura 3. Evolución de los recuentos bacterianos con el tiempo en un sistema de purificación de agua sin tratamiento UV en comparación con un segundo sistema en el que se usa tratamiento UV. Generación de turbidez Las bacterias en elevadas concentraciones pueden comportarse como partículas, interfiriendo en los ensayos turbidimétricos y afectando a la detección a 340 nm. también el riesgo de que puedan quedar trazas del agente sanitizante utilizado, como el NaOCl, el H2O2 o el ácido peracético, en el sistema de fluidos del analizador. Esos oxidantes interfieren en los ensayos en los que se emplean NAD+/NADH y en la detección espectrofotométrica a 340 nm (G6PD, GHB, amoniaco, ALT, LDH). Mantenimiento más frecuente del equipo Los analizadores y las unidades de purificación de agua deben ser descontaminados para reducir las interferencias bacterianas. Esto produce una pérdida de tiempo para el personal del laboratorio bioquímico, así como un tiempo de parada del analizador. Existe Protección contra las bacterias con una combinación de tecnologías de purificación En el ámbito de los laboratorios biomédicos, los sistemas de purificación de agua eficaces suelen utilizar una combinación de tecnologías de purificación. Este enfoque reduce con eficacia los niveles de to- FARMESPAÑA INDUSTRIAL dos los tipos de contaminantes (iones, compuestos orgánicos, bacterias, partículas, sílice) y asegura a la vez una calidad constante del agua dispensada al analizador. Para abordar de manera específica la presencia y los efectos de las bacterias, se dispone de una serie de técnicas de purficación*. * En lo que respecta a este artículo comentaremos solo las técnicas de purificación que afectan de manera específica al control bacteriano. Sin embargo, tenga en cuenta que al elegir un sistema de purificación de agua para usar con un analizador clínico, se recomienda vivamente seleccionar un sistema que incorpore también en la cadena de purificación de agua tecnologías sólidas y fiables como la ósmosis inversa (RO) y la electrodesionización (EDI) Lámparas ultravioleta germicidas Una potente tecnología de purificación es el tratamiento con luz ultravioleta (UV). Se utilizan lámparas UV germicidas a 254 nm para inactivar las bacterias en el agua purificada y por tanto evitar la formación de biopelícula. El tratamiento con UV altera la estructura del ADN bacteriano, evitando el crecimiento de los microorganismos4-5.Para reducir al mínimo el riesgo de crecimiento bacteriano, el tratamiento con lámpara UV suele realizarse antes de guardar el agua y, en algunos casos, en el tanque de almacenamiento, así como du- (véase el esquema de sistema de purificación de agua anterior). NOVIEMBRE/DICIEMBRE15 69 TRATAMIENTO DE AGUAS Contaminación bacteriana: una debilidad de los sistemas de desionización (SDI) de mantenimiento sencillo Debe observarse que los sistemas de purificación del agua que contienen tecnología de desionización de mantenimiento sencillo (SDI, por sus siglas en inglés) pueden correr el riesgo de experimentar contaminación bacteriana. Aunque las resinas de intercambio iónico hacen un trabajo eficiente de eliminación de iones del agua de alimentación, no eliminan otros contaminantes no iónicos presentes en el agua de alimentación. Estas moléculas orgánicas actúan luego como nutrientes para las bacterias, tanto en el tanque de SDI como en el agua liberada por el sistema de SDI. Figura 4. Trío de tanques de almacenamiento de diseño inteligente con capacidades de 30, 60 y 100 litros. rante la recirculación en el lazo de distribución del agua. La importancia de los tanques de almacenamiento Un tanque moderno y de diseño inteligente para almacenamiento de agua puede también ayudar a reducir el crecimiento bacteriano y la degradación de la pureza del agua con el tiempo. Una elección rigurosa de materiales de calidad para los tanques de depósito, junto con un diseño cuidado y la protección apropiada frente a los contaminantes del aire, pueden asegurar una calidad constante del agua durante su almacenamiento. Las características de un tanque de almacenamiento bien diseñado son: • Cuerpo de plástico moldeado por soplado, que reduce las asperezas en la superficie, así como las oportunidades de que las bacterias se unan a las paredes del tanque de almacenamiento. • Fondo de forma cónica que permite un drenaje completo. • Paredes del tanque opacas para evitar la estimulación 70 NOVIEMBRE/DICIEMBRE15 del crecimiento bacteriano por la luz solar y artificial. • Instalación de una lámpara UV para reducir el crecimiento bacteriano en el tanque de almacenamiento y para evitar la formación de biopelícula. • Disponibilidad de procedimientos de sanitización que proporcionan detalles sobre cómo limpiar el depósito; la sanitización regular ayuda a mantener una buena calidad del agua con el tiempo. Figura 5. Una válvula de muestreo sanitario puede proporcionar análisis microbiológicos fáciles y fiables del agua de alimentación del analizador producida por el sistema de purificación del agua. Figura 8. Crecimiento bacteriano en una partícula de resina de intercambio iónico. Algunos de los problemas vinculados al diseño y el mantenimiento de los tanques de SDI son los siguientes: • Los ácidos y bases fuertes empleados para regenerar las resinas son bactericidas, pero con su uso repetido también dañan las partículas de resina. • No existe mantenimiento de sanitización. • Los tanques de SDI (recipientes de resina de intercambio iónico) no se descontaminan. • Las bombas y válvulas utilizadas para que el sistema de SDI funcione no se descontaminan. • Cuando se estanca el agua en los tanques de SDI, esto fomenta el crecimiento bacteriano. • Los filtros de 0,22 µm son obligatorios para la producción de agua CLRW, pero se obstruyen rápidamente por las partículas de resina dañadas y por las bacterias6. Cualquier parte de la unidad de purificación que no se esterilice es una fuente de recontaminación rápida del agua y del analizador clínico. Resinas de intercambio iónico nuevas y recirculación automática Dependiendo del tipo de análisis, el analizador clínico y el laboratorio, esta agua que se guarda transitoriamente en el depósito puede o bien utilizarse directamente para abastecer al analizador o bien purificarse más. La purificación añadida para alcanzar la calidad de agua de grado reactivo para laboratorio (CLRW) según las directrices del Clinical and Laboratory Standards Institute® (CLSI®) implica el uso de resinas de intercambio iónico (IEX) nuevas, que reducen la FARMESPAÑA INDUSTRIAL TRATAMIENTO DE AGUAS concentración de iones a un valor muy bajo. El uso de esas resinas de gran calidad, así como la recirculación intermitente, contribuyen a evitar el crecimiento bacteriano en las partículas de resina con el tiempo. Filtración 0,22 µm En la cadena de purificación de agua, puede utilizarse también filtración selectiva por membrana (0,22 µm) para el control bacteriano. Normalmente se coloca una membrana de filtración de 0,22 µm en la salida del sistema de purificación para asegurar un recuento bajo constante de bacterias (< 10 ufc/ml) en el agua liberada al analizador. Ultrafiltración para eliminar los productos secundarios de las bacterias Como se ha comentado antes, las cepas bacterianas pueden liberar fosfatasa alcalina (ALP) en el agua purificada, produciendo así interferencias en los ensayos en los que se emplea la ALP en enzimoinmunoanálisis (EIA). Para eliminar con eficacia la ALP potencialmente liberada por las bacterias, puede instalarse un ultrafiltro en la salida de la unidad de purificación, justo antes de que el agua se distribuya al analizador. Las pruebas realizadas para comparar la eficacia de la ultrafiltración con un límite de 13 kDa con una unidad de filtración de 0,22 µm demostraron que la ultrafiltración produce agua «sin ALP». En otro ensayo, se demostró la eficacia de un ultrafiltro en la estabilidad del blanco durante un ensayo de cTnl (troponina cardiaca). Cuando se comparó con un filtro convencional de 0,22 µm, pudo observarse una gran mejora en la intensidad del blanco y la uniformidad de los valores. FARMESPAÑA INDUSTRIAL Figura 6. Se filtró una disolución de prueba (300 unidades de ALP disuelta en 200 l de agua Milli-Q®) en el dispositivo de ultrafiltración Biopak® (presión de liberación 1 bar, caudal 1,4 l/minuto). Resumen: Una combinación de elementos permite hacer frente con eficacia a las bacterias La combinación de diversos elementos en un sistema de purificación de agua ofrece una solución adecuada para suministrar agua a los analizadores clínicos. Son los siguientes: • Diseño global de la unidad de purificación de agua (filtración general, lámpara UV, depósito específico, lazo de recirculación, resinas nuevas). • Procedimiento adecuado y eficaz de sanitización. • Selección del filtro final más eficiente. Cuando se combinan, estos elementos contribuyen a mantener las bacterias bajo control, a maximizar el tiempo de funcionamiento del analizador clínico y a proporcionar agua que cumpla la norma de calidad CLSI® CLRW con una concentración bacteriana constante inferior a 10 ufc/ml Figura 7. Comparación de la ultrafiltración y la filtración convencional por 0,22 µm para un ensayo de la cTnl. Referencias bibliográficas 1. K Kamiyama et al. Sources of bacterial contamination of autoanalyzers and counter measures. JJCLA, Vol 27, 5, 684- 689, 2002. 2. J Bole; S Mabic. Utilizing ultrafiltration to remove alkaline phosphatase from clinical analyzer water. Clin Chem Lab Med, v. 44, n. 5, p. 603-8, 2006. 3. J Shepherd; Brian Baldwin. Interference in Measurement of Potassium Caused by Bacterial Contamination of an Analyzer. Clin. Chem. 50, No. 12, 24632464, 2004. 4. B Durbeej; L A Eriksson. Reaction mechanism of thymine dimer formation in DNA induced by UV light. J. Photochem. Photobiol. A. Chemistry, 152, 95-101, 2002. 5. I Kano; D Darbouret; S Mabic. UV technologies in water purification systems. The R&D Notebook Vol 10, Millipore S.A.S. 6. CLSI® – Clinical and Laboratory Standards Institute®. Preparation and testing of reagent water in the clinical laboratory. Approved guideline. 4th ed. CLSI ® document C3-A4 [ISBN 1-56238-610-7], 2006. NOVIEMBRE/DICIEMBRE15 71 FI Nº 67 O 2015 AÑO IX JULIO/AGOST Revista Profesional para Proveedores de la Industria Farmacéutica y Tecnología de Laboratorio Programa editorial 2016 CPHI ENTREVISTA A JULIO MASET CONTROL DE CALIDAD NORMATIVA Y LEGISLACIÓN GUÍA DE PROVEEDORES DE LA INDUSTRIA FARMACÉUTICA ENERO- FEBRERO lifescienceslab Cierre 12-02-2016 • ESPECIAL FARMAFORUM (Madrid, 2-3 Marzo) • ESPECIAL COSMÉTICAFORUM • Tecnología cosmética • Automatización de procesos • Robótica • Tecnología de laboratorios I • Software para laboratorios I • Ingeniería farmacéutica I • Etiquetado y codificación I • Filtración I BIOTECNOLOGÍA MARZO- ABRIL Cierre 08-04-2016 • ESPECIAL CONGRESO ANUAL AEFI • ESPECIAL SIL (Barcelona 7-9 junio) • Logística y distribución • Envase y embalaje I • Automatización de almacenes • Salas blancas I • Tratamiento de aguas I • Higiene, seguridad y medio ambiente ESPECIAL INGENIERÍA FARMACÉUTICA Cierre 13-05-2016 • Asociaciones de ingeniería • Ingenierías • Salas blancas • Climatización • Automatización de procesos • Tratamiento de aguas • Suministros industriales • ¿Quién es quién en la ingeniería farmacéutica? JULIO-AGOSTO Cierre 13-07-2016 • ESPECIAL BIOSPAIN 2016 (Bilbao 28-30 septiembre) • ESPECIAL BIOTECNOLOGÍA • ESPECIAL CPHI BARCELONA (4-6 octubre) • Filtración II • Drug Delivery systems • Software para laboratorios I • APIS • Contratación a terceros • Ingeniería farmacéutica y Mantenimiento II • Eficiencia energética en los laboratorios • GUÍA DE PROVEEDORES DE LA INDUSTRIA FARMACÉUTICA SEPTIEMBRE-OCTUBRE Cierre 07-10-2016 • ESPECIAL FERIA EMPACK • Envase y embalaje II • Etiquetado y codificación II • Logística y distribución II • Tecnología de laboratorios II • Equipamiento para salas blancas • Mobiliario para laboratorio NOVIEMBRE- DICIEMBRE Cierre 09-12-2016 • Salas Blancas II • Esterilización II • Validaciones y certificaciones II • Tratamiento de Aguas II • Ensayos clínicos • Contratación a terceros II • Tratamiento de sólidos MAYO-JUNIO Cierre 10-06-2016 • Validaciones, certificaciones I • Consultoría y formación • Normativa, registros y legislación • Microbiología • Tratamiento de gases • Esterilización I • Climatización • Cosmética: Fabricación a terceros + información Editor EUGENIO PÉREZ DE LEMA direccion@lifescienceslab.com Tlf. 916308591 Director comercial MARCOS MUIÑOS DOCAMPO marcos@farmaindustrial.com Tlf. 672050625 Responsable editorial ALEJANDRO GESTEIRA PONCE alejandro@farmaindustrial.com Tlf. 600392754 www.farmaindustrial.com OMNIMEDIA S.L. C/ Rosa de Lima 1 bis. Edificio Alba, ofic. 104. 28290 Las Matas (Madrid). Tel: +34 902 36 46 99 Fax +34 91 630 85 95 E-mail: info@grupo-omnimedia.com. Web: www.grupo-omnimedia.com DELEGACIÓN GALICIA Rúa Loureiro 23. 36800 Redondela, Pontevedra. Tlf 672050625. Fax. 916 308 595 Publicidad SONKYONG CHO KIM son@farmaindustrial.com Tlf. 916308591 MARÍA TERESA MARTÍN mariateresa@farmespana.com Tlf. 918965668 FI • Farmespaña industrial, con una tirada de 6.000 ejemplares (versión digital 9.000), es distribuida de forma nominal y gratuita entre los principales cargos y departamentos en la industria farmacéutica, veterinaria, cosmética y biotecnológica. Calidad, ingeniería, logística, operaciones, dirección técnica, registros, farmacovigilancia, compras, gerencia, envasado y otros departamentos reciben de forma puntual la publicación, así como los miembros de las principales asociaciones e instituciones relacionadas con la industria farmacéutica y biotecnológica. OSTO O/AG AÑO LI IX JU FI ra ional pa Profes Revista Nº 67 l Revista Profesiona de dores Provee ogía de Tecnol tica y rmacéu stria Fa la Indu ENVASE Y AÑO IX MAYO /JUNI O 2015 torio Revista Profesiona l para EMBALAJE Y LOGÍSTICA DISTRIBUCIÓN VERY CAS SALAS BLAN CLIMATIZACIÓN Y NORMATIVA LEGISLACIÓN I CPH EVISTA ENTR ET MAS LIO L DE NORMATIVA, REGISTROS Y LEGISLACIÓN lab lifesciences A JU ESTERILIZACIÓN DIAGNÓSTICO Y MOLECULAR RES BIOMARCADO C DE GUÍA EDORES IA R VE PRO INDUST A C DE LA ACÉUTI M FAR M ENTREVISTAS AD CALID Y ATIVA NORM LACIÓN LEGIS Tipo de inserción: offset positivo Tamaño de corte: 210 mm ancho x 297 mm alto Encuadernación: fresada Labora DRUG DELI SYSTEMS RO CONT Características técnicas Laboratorio y Tecnología de Farmacéutica FI res de la Industria para Proveedo 2015 Y CM A INDUSTRIAL ¿A QUIÉN VA DIRIGIDA? Nº 65 BRIL 2015 ZO/A AÑO IX MAR AÑO IX Nº 66 FARMESPAÑA INDUSTRIAL es la revista órgano difusor de AEPIMIFA, Asociación española de profesionales de la ingeniería y mantenimiento de la industria farmacéutica, alimentaria y afines. F+I FARMESPAÑ FI FARMESPAÑA + INDUSTRIAL 2016 Revista profesional de Proveedores de la Industria Farmacéutica y Tecnología de Laboratorio ESPECIAL ¿QUIÉ N ES QUIÉN EN LA INDUSTRIA FARMACÉUTICA? MY CY CMY K lifescienceslab TRATAMIENTO DE AGUAS slab ience lifescCNOLOGÍA BIOTE REVISTA Tirada 6.000 ejemplares Periodicidad Bimestral + Número Especial BOLETÍN ELECTRÓNICO Periodicidad quincenal | Más de 9.000 contactos del sector | Tarifas “Emailing” Personalizado 1.700€ Tarifas publicitarias Portada Desplegable portada Interior portada Contraportada Encarte Página completa ½ página ¼ página Doble página Módulo triple (GUÍA DE SERVICIOS) Módulo doble (GUÍA DE SERVICIOS) Módulo sencillo (GUÍA DE SERVICIOS) 161 x 224 Consultar 210 x 297 210 x 297 Consultar 210 x 297 210 x 148,5 / 105 x 297 210 x 75 420 x 297 180 x 65 55 x 150 55 x 65 3.100€ 2.900€ 2.000€ 2.500€ 2.000€ 1.400€ 975€ 700€ 2.100€ 1.200€ / año 800€ / año 550€ / año Medidas en mm, ancho por alto. Los originales deben incluir 3 mm de sangre por cada lado. Formatos aceptados: PDF / JPG Publicidad online Promocione su empresa en nuestra página web y en el newsletter semanal. Visítenos en wwww.farmaindustrial.com TARIFAS WEB 1 mes 3 meses 6 meses 1 año 500€ 1.000€ 1.300€ 1.900€ TARIFAS BOLETÍN (QUINCENAL) 1 mes 3 meses 6 meses 1 año 500€ 1.000€ 1.300€ 1.900€ BANNER DESTACADO EN WEB Y BOLETÍN 3 Meses 6 meses 1 año 1.000€ 1.500€ 2.500€ Proveedores de la Industria Farmacéutica y GUÍA DE SERVICIOS FARMESPAÑA INDUSTRIAL pone a su disposición la forma más práctica de localizar a sus proveedores organizados por sectores de actividad. Las páginas de servicio más completas con empresas fabricantes de equipos, productos y de servicios para la industria farmacéutica y sectores afines. INFÓRMESE EN EL TELÉFONO 986 19 04 88 Y EN NUESTRA WEB www.farmaindustrial.com Tarifas 2015 inserción anual Módulo sencillo (55 x 65 mm) Módulo doble (55 x 150 mm) Módulo doble (117,5 x 65 mm) Módulo triple (180 x 65 mm) Datos a cumplimentar en los módulos Razón social Teléfono y fax Domicilio www Distrito/Población mail CONSULTORÍA Y VALIDACIONES 74 NOVIEMBRE/DICIEMBRE15 DESINFECCIÓN 550 800 800 1200 euros euros euros euros ASESORÍA Y SERVICIOS FARMESPAÑA INDUSTRIAL ASESORÍA Y VALIDACIONES ENVASE Y EMBALAJE ENVASE Y EMBALAJE EQUIPAMIENTO PARA LABORATORIO EQUIPAMIENTO PARA LABORATORIO AQUÍ SU PUBLICIDAD POR 550 € / AÑO FARMESPAÑA INDUSTRIAL NOVIEMBRE/DICIEMBRE15 75 GUÍA DE SERVICIOS EQUIPAMIENTO DE LABORATORIOS EQUIPAMIENTO DE LABORATORIOS & We are specialized in fine size reduction equipment CONTAINMENT SYSTEMS for many industrial applications. Micronization & Containment Solutions F.P.S. Food and Pharma Systems s.r.l. - Via Vandelli, 20 - 22100 - Como - Italy Tel. +39 031 543429 www.foodpharmasystems.com - sales@foodpharmasystems.com EQUIPOS 76 NOVIEMBRE/DICIEMBRE15 FILTRACIÓN HIGIENE INDUSTRIAL FARMESPAÑA INDUSTRIAL ETIQUETA INGENIERÍA Y CONSULTORÍA EXCIPIENTES MAQUINARIA MAQUINARIA DE ENVASADO Y PROCESO Pharmaceutical Filling Lines • Maquinaria de proceso y envasado automático para la industria farmacéutica, biotecnológica y cosmética. • Máquinas individuales o líneas completas para el llenado y cerrado de productos líquidos, semilíquidos y en polvo, en condiciones estériles. • Máquinas llenadoras/cerradoras para frascos, viales, cárpulas, jeringas, IV Bags… • Flujos RABs. laminares (LAF), • Aisladores de alta contención. • Máquinas automáticas de inspección de ampollas, viales y jeringas. Dara Pharmaceutical Packaging Pol. Ind. Coll de la Manya Galileo Galilei, 5-19 08403 Granollers (BARCELONA) SPAIN Tel. +34 938 718 784 Fax +34 938 718 375 www.dara-pharma.com FARMESPAÑA INDUSTRIAL NOVIEMBRE/DICIEMBRE15 77 GUÍA DE SERVICIOS INGENIERÍA, SALAS Y EQUIPOS FARMACÉUTICOS MATERIAL DE LABORATORIO 78 NOVIEMBRE/DICIEMBRE15 ROBÓTICA LOGÍSTICA SALAS LIMPIAS FARMESPAÑA INDUSTRIAL SALAS LIMPIAS SALAS LIMPIAS FARMESPAÑA INDUSTRIAL SEGURIDAD INDUSTRIAL SERVICIOS NOVIEMBRE/DICIEMBRE15 79 GUÍA DE SERVICIOS PACKAGING PACKAGING TRATAMIENTO DE AGUAS SUMINISTROS INDUSTRIALES SUMINISTROS INDUSTRIALES SUMINISTROS INDUSTRIALES El reflejo de una Gran Experiencia. Departamento propio de Ingeniería. Fabricamos Equipos de Proceso e Ingeniería para Laboratorios. Camino de Valdecabañas, 30 28500 Arganda del Rey - Madrid Tel: +34 91 872 83 36 - Fax: +34 91 870 64 22 info@prenitor-inox.com - www.prenitor.com T I N S M A C A L® 80 NOVIEMBRE/DICIEMBRE15 FARMESPAÑA INDUSTRIAL TRADUCCIONES VALIDACIONES De especialistas para especialistas Proyectos multilingües 25 años de experiencia Servicios lingüisticos y editoriales para la industria farmacéutica Tlf: +34 91 173 40 72 www.amr-traducciones.com amrtradu@amr-traducciones.com SUMINISTROS INDUSTRIALES VALIDACIÓN Y CONSULTORÍA VALIDACIONES Consultoría Sistemas de calidad. Registros / Farmacovigilancia. Seguridad e higiene / Asesoría ambiental. Cualificaciones Cualificación servicios: control ambiental, cabinas, aire comprimido y gases. Cualificación/Mapeos de temperatura. Cualificación de fluidos GMP, CIP/SIP. Cualificación de equipos de producción. Cualificación de instrumentos analíticos. Validación Validación de procesos de limpieza. Validación de procesos de recepción, almacenaje y expedición. Validación de métodos analíticos. Validación de sistemas informáticos. Calibración de instrumentación Calibración de contadores de partículas. Calibración de instrumentación. Formación Programas de formación. Cursos técnicos especializados. MADRID - BARCELONA 902 901 769 qualipharma@qualipharma.es www.qualipharma.es FARMESPAÑA INDUSTRIAL NOVIEMBRE/DICIEMBRE15 81 ANUNCIANTES AD-TECH . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de servicios AMR . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de servicios ARAGOGAMMA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 31 AZIERTA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de servicios BRANIR. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 33 BURDINOLA. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de servicios CABKA SPAIN . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 13 CAMPAK . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de servicios CILIT-BWT. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de servicios COMPLIANCE . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de servicios CONFECCIONES ÁNADE. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 11 DARA PHARMACEUTICAL . . . . . . . . . . . . . . . . . . . .Guía de servicios ELIS. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .45, Guía de servicios ETIQUETAS VINALOPO . . . . . . . . . . . . . . . . . . . . . .Guía de servicios FETTE. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 39 FIKE . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de servicios FILTROS CARTÉS . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de servicios FREEZEDRY . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de servicios GRIFOLS ENGINEERING. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 41 HALL TECH . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 37 IBERCONDOR . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de servicios IBERFLUID . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 23 IGUÑA MONTAJES . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 27 INGECLIMA . . . . . . . . . . . . . . . . . . . . . . . . . . . . .35, Guía de servicios INGENIERÍA Y QUALIFICACIÓN . . . . . . . . . . . . . . .Guía de servicios IONISOS. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 15 LA ALBERCA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de servicios LLEAL . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de servicios MATACHANA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de servicios MERCK – MILLIPORE . . . . . . . . . . . . . . . . . . . . . . . .Guía de servicios MOBELMOL. . . . . . . . . . . . . . . . . . . . . . . . . . . . . .9, Guía de servicios MONTAJES IGUÑA . . . . . . . . . . . . . . . . . . . . . . . . .Guía de servicios MOSCA DIRECT . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de servicios MP CONTROL . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de servicios PANREAC QUIMICA . . . . . . . . . . . . . . . . . . . . . . . . .Guía de servicios PHARMAQUALITY EUROPE . . . . . . . . . . . . . . . . . . .Guía de servicios PHARMINTECH . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 55 PIC . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7 PRENITOR INOXIDABLES . . . CONTRAPORTADA, Guía de servicios QTI . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de servicios QUALIPHARMA . . . . . . . . . . . . . . . . . . . . . . . . . .5, Guía de servicios QUILINOX . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de servicios ROMMELAG . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de servicios SARTORIUS . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 25 STÄUBLI ESPAÑOLA . . . . . . . . . . . . . . . . . . . . . . . .Guía de servicios STX . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 58 TCI . . . . . . . . . . . . . . . . . . . . . . . . . . . . . PORTADA, Guía de servicios TECNICA DE FLUIDOS . . . . . . . . . . . . . . . . . . . . . . .Guía de servicios TECNICOS EN CALIBRACIÓN Y MONTAJE . . . . . .Guía de servicios TECNOPRODUCTS . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de servicios ULMA PACKAGING . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de servicios VALIDATEC . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de servicios FI VALTRIA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Interior de portada VESTILAB . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .26, Guía de servicios VIASTORE . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de servicios Revista Profesional para Proveedores de la Industria Farmacéutica y Tecnología de Laboratorio www.farmaforum.es info@farmaforum.es www.farmaforum.es/cosmetica comercial@farmaforum.es III Foro de la industria farmacéutica, biofarmacéutica, cosmética y tecnología de laboratorio 2-3 Marzo 2016 Patrocinador Palacio Municipal de Congresos de Madrid El reflejo de una Gran Experiencia. Departamento propio de Ingeniería. Fabricamos Equipos de Proceso e Ingeniería para Laboratorios. Equipo de formulación con Pulmones de Llenado. Mezclador de Ensayos. Equipo de formulación sobre plataforma. Camino de Valdecabañas, 30 - 28500 Arganda del Rey - Madrid Tel: +34 91 872 83 36 - Fax: +34 91 870 64 22 info@prenitor-inox.com - www.prenitor.com T I N S M A C A L®