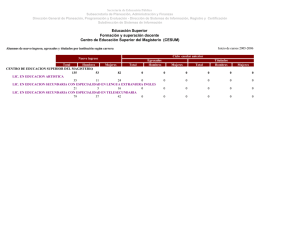
CIENCIAS NATURALES Y EDUCACION AMBIENTAL
Anuncio

PGF03-R03 Volta: inventor de la pila:"he investigado mucho, ahora ya veo a Dios en todo CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11ª 1 PGF03-R03 Lo que hoy entendemos por el término Química Orgánica no se comprendía como tal hace simplemente un poco más de 100 años. Veamos algo de historia los hitos más importantes en la forja de esta disciplina, sin ánimo de ser exhaustivo, son los siguientes: Finales del XVIII El enigma de la Química Orgánica: La fuerza vital. Se observa que los compuestos orgánicos están formados por un número muy limitado de elementos. Principios del XIX Se intuyen ciertos visos de ordenamiento estructural. Se establece la ley de proporciones múltiples. 1820’s Síntesis de la úrea: se tiende el puente entre la Química Inorgánica y la Orgánica. Se mejora la precisión del análisis elemental. Se produce una complicación insospechada: la isomería. 1830’s Los radicales orgánicos como un principio de ordenación. El descubrimiento y la profusión de los radicales orgánicos. 1830’s-1840’s Orden entre los radicales orgánicos: la sustitución. Definición de radicales derivados. 1840’s-1850’s Ordenación por tipos de compuestos. La unificación de radicales y tipos. 1850’s Estructura interna de los radicales: la tetravalencia del carbono y su capacidad para formar cadenas. 1860’s Primeras formulaciones modernas. 1870’s Estructura tetraédrica del carbono: isomería óptica. 1880’s Estructura hexagonal del benceno. 1930’s-1940’s Planteamiento de la Teoría de la Resonancia. Desarrollo de la Espectroscopia de rayos X. Desarrollo de la Espectrometría de masas. 1950’s Análisis conformacional: estereoquímica del ciclohexano. Descubrimiento de la Resonancia Magnética Nuclear. 1990´s Descubrimiento de los fullerenos. La importancia de la Química Orgánica radica en que más del 95% de las sustancias químicas conocidas son compuestos del carbono y más de la mitad de los químicos actuales en el mundo se denominan a sí mismos químicos orgánicos. Todos los compuestos responsables de la vida (ácidos nucleicos, proteínas, enzimas, hormonas, azúcares, lípidos, vitaminas, etc.) son sustancias orgánicas. ¿Por qué el carbono como origen de la vida? Por que puede formar una mayor variedad de compuestos que otros elementos, por su poder de autosaturación. Excepto el silicio, es el único elemento con esta característica. Pero los compuestos silicio-silicio no permanecen inalterables en contacto con la atmósfera terrestre cargada de oxígeno, ya que se oxidan formando sílice, SiO 2 , principal ingrediente de la arena y el cuarzo, pero incapaz de dar sustento a la vida. Por lo menos en la tierra. El progreso de la Química Orgánica permite profundizar en el esclarecimiento de los procesos vitales. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11ª 2 PGF03-R03 Tabla de Contenido UNIDAD I: LA QUÍMICA DEL CARBONO ................................................................................ 4 LA QUÍMICA ORGÁNICA ..................................................................................................... 5 COMPUESTOS ORGANICOS .............................................................................................. 6 HIDROCARBUROS SATURADOS ..................................................................................... 11 PROPIEDADES FÍSICAS DE LOS ALCANOS ................................................................... 13 HIDROCARBUROS INSATURADOS.................................................................................. 18 PROPIEDADES FÍSICAS DE ALQUENOS Y ALQUINOS .................................................. 18 PROPIEDADES QUÍMICAS DE LOS ALCANOS................................................................ 22 UNIDAD II: HIDROCARBUROS AROMÁTICOS .................................................................... 30 CONCEPTO DE PETRÓLEO ............................................................................................. 31 PROPIEDADES QUÍMICAS DE LOS ALQUENOS Y ALQUINOS ...................................... 34 LA QUIMICA DEL BENCENO ............................................................................................. 44 PROPIEDADES FÍSICAS Y QUÍMICAS DEL BENCENO ................................................... 46 UNIDAD III: GRUPOS FUNCIONALES .................................................................................. 57 GRUPOS FUNCIONALES .................................................................................................. 58 ALCOHOLES ...................................................................................................................... 62 ALDEHÍDOS Y CETONAS .................................................................................................. 68 LAS AMINAS ....................................................................................................................... 73 LAS AMIDAS ....................................................................................................................... 79 ÉTERES .............................................................................................................................. 82 ÁCIDOS CARBOXÍLICOS Y DERIVADOS ......................................................................... 86 ÉSTERES ........................................................................................................................... 93 NITRILOS............................................................................................................................ 96 UNIDAD IV: COMPUESTOS BIOLÓGICOS ......................................................................... 105 ¿CÓMO SE DESARROLLA LA BIOQUÍMICA? ................................................................ 106 PROTEÍNAS ..................................................................................................................... 107 CLASIFICACIÓN DE LAS PROTEÍNAS ........................................................................... 110 ESTRUCTURA DE LAS PROTEÍNAS .............................................................................. 112 HIDRATOS DE CARBONO. .............................................................................................. 116 ESTRUCTURA DE LOS CARBOHIDRATOS ................................................................... 117 LÍPIDOS ............................................................................................................................ 122 BIBLIOGRAFÍA ..................................................................................................................... 144 WEBGRAFIA ........................................................................................................................ 145 CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11ª 3 PGF03-R03 UNIDAD I LA QUÍMICA DEL CARBONO Propósito: Identificar las principales características que hacen del carbono el centro de estudio de la química orgánica, las principales funciones químicas orgánicas, estructura y nomenclatura IUPAC respectivamente. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11ª 4 PGF03-R03 LA QUÍMICA ORGÁNICA “ La Química Orgánica actual es suficiente para volverle a uno loco; me produce la impresión de una primitiva selva tropical atestada de las cosas más curiosas, una maleza ilimitada y monstruosa sin salida posible y en la que da pánico entrar” Un desesperado y melancólico F. Wöhler , en carta dirigida a J. Berzelius (1835) La Química Orgánica estudia los compuestos del carbono, en principio provenientes de organismos vivos, que ha derivado en la determinación de estructuras, estudios mecanísticos y obtención de compuestos de interés como: medicamentos, fibras textiles, polímeros, agroquímicos, colorantes, adhesivos, aditivos, conservantes de alimentos y catalizadores industriales y la Química Inorgánica las entidades atómicas o moleculares no orgánicas. Ambas comprenden la obtención de compuestos por síntesis o bien por hemisíntesis a partir de fuentes naturales, hasta sus propiedades químicas (reacciones), pasando previamente por la caracterización estructural , el estudio de sus propiedades físicas y el análisis y control de pureza de los mismos. La química orgánica se constituyó como disciplina en los años treinta. El desarrollo de nuevos métodos de análisis de las sustancias de origen animal y vegetal, basados en el empleo de disolventes como el éter o el alcohol, permitió el aislamiento de un gran número de sustancias orgánicas que recibieron el nombre de "principios inmediatos". La aparición de la química orgánica se asocia a menudo al descubrimiento, en 1828, por el químico alemán Friedrich Wöhler, de que la sustancia inorgánica cianato de amonio podía convertirse en urea, una sustancia orgánica que se encuentra en la orina de muchos animales. Antes de este descubrimiento, los químicos creían que para sintetizar sustancias orgánicas, era necesaria la intervención de lo que llamaban ‘la fuerza vital’, es decir, los organismos vivos. El experimento de Wöhler rompió la barrera entre sustancias orgánicas e inorgánicas. Los químicos modernos consideran compuestos orgánicos a aquellos que contienen carbono e hidrógeno, y otros elementos (que pueden ser uno o más), siendo los más comunes: oxígeno, nitrógeno, azufre y los halógenos. Por ello, en la actualidad, la química orgánica tiende a denominarse química del carbono. Relevancia científica y económico-social: la Química es una de las disciplinas más antiguas, las primeras publicaciones científicas regulares de la misma se remontan a mediados del siglo pasado, en revistas que aún existen y con alto nivel de impacto. Con posterioridad a la Segunda Guerra Mundial y hasta mediados o fines de los años 70, la química evidenció un marcado desarrollo. Impulsados por la guerra fría y la carrera espacial, los departamentos de química en instituciones académicas, laboratorios nacionales y centros de Investigación en Estados Unidos crecieron en forma significativa. Esta tendencia expansiva se reflejó también en el resto del mundo, y en particular en la Argentina. Sin embargo, en los años 90 la ciencia y la tecnología comenzaron a experimentar una serie de profundos cambios, tal como se refleja en el informe del Coloquio Presidencial CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11ª 5 PGF03-R03 norteamericano Shaping the Future: The Chemical Research Environment in the Next Century (Abril de 1994). En dicha reunión, 40 participantes de la industria, las universidades (administradores e investigadores), los laboratorios de investigación y el gobierno de EE.UU. analizaron los siguientes hechos significativos: reducciones de los presupuestos para Investigación y Desarrollo (I+D) en las mayores corporaciones; presión en el Congreso y en el Público por investigación más aplicada en las Universidades; disminución de puestos de trabajo para profesionales con doctorado en Química; globalización de la I+D; aumento de la desconfianza pública respecto de los productos de la industria Química; declinación del apoyo político a la ciencia básica en Universidades y Laboratorios Nacionales. Entre las razones que llevaron a tal escenario figuran el fin de la Guerra Fría, la globalización de la economía y el aumento en las exigencias ambientales sobre la producción. Además, muchos procesos químicos fueron reemplazados por la biotecnología en los últimos veinte años, y el crecimiento de las áreas interdisciplinarias hizo que la ingeniería incursionara en materiales, micromecánica, mecánica estadística molecular, etc., y la Física hiciera lo propio en aspectos químicos de la Física del sólido y de la materia condensada. Por otro lado, en muchos países se observaba una disminución de la matrícula en carreras de Química. Pesaba sobre ella el estigma de la contaminación ambiental, aunque también debe comprenderse que la Química como disciplina tiene una gran responsabilidad social. Así como el uso indiscriminado de sustancias químicas pudo haber sido responsable del deterioro del ambiente, ya se está tomando conciencia que la aplicación racional de los conocimientos químicos es la mejor herramienta disponible para limpiar al planeta. La Química, por ejemplo, describió el mecanismo del agotamiento de la capa de ozono y el rol de los clorofluorocarburos (CFC) en dicho agotamiento. Debe destacarse en relación con este tema la importancia de la medición de especies químicas y la descripción cinética a nivel molecular de las reacciones entre los gases involucrados, ambos aportes de la Química. Nótese que tres Premios Nobel en Química en los últimos años han estado relacionados con el problema ambiental. 1. reflexiona sobre la lectura anterior y consigna 3 conclusiones personales, sobre esta. 3. elabora en tu cuaderno un mentefacto conceptual acerca de la Química Orgánica. 4. ¿Cuáles fueron los aportes a la química de F. Wöhler y por qué manifiesta su fobia a la química inorgánica en el encabezado? pág anterior. 5. ¿Qué estudia la química orgánica? 6. Mencione las principales diferencias entre química orgánica e inorgánica? COMPUESTOS ORGANICOS HIDROCARBUROS Los hidrocarburos son compuestos orgánicos formados únicamente por átomos de carbono e hidrógeno. Consisten en un armazón de carbono al que se unen átomos de hidrógeno. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11ª 6 PGF03-R03 Forman el esqueleto de la materia orgánica. También están divididos en abiertas y ramificadas. Los hidrocarburos se dividen en 2 que son aromáticos y alifáticos. Los alifáticos son alcanos, alquenos y alquinos cuyas fórmulas generales son CnH2n+2, CnH2n y CnH2n-2, respectivamente. Las intoxicaciones por hidrocarburos tienden a causar cuadros respiratorios relativamente severos. La gasolina, el queroseno y los aceites para pulir muebles, que contienen hidrocarburos, son los agentes más comúnmente usados en las intoxicaciones. El tratamiento a menudo requiere intubación y ventilación mecánica. Inducir el vómito en estos sujetos está contraindicado porque puede causar más daño esofágico. Según la estructura de los enlaces entre los átomos de carbono, se clasifican en: Hidrocarburos acíclicos, alifáticos, unalifáticos, o de cadena abierta: estos a su vez se dividen en: o Hidrocarburos saturados (alcanos o parafinas), que no tienen enlaces dobles, triples, ni aromáticos, sólo múltiples enlaces individuales, y de cadena. o Hidrocarburos insaturados, que tienen uno o más enlaces dobles (alquenos u olefinas) o triples (alquinos o acetilénicos) entre sus átomos de carbono. Hidrocarburos cíclicos, hidrocarburos de cadena cerrada que a su vez se subdividen en: o Cicloalcanicos, que tienen cadenas cerradas de 3, 4, 5, 6, 7 y 8 moléculas de carbono saturados o no saturados. o Hidrocarburos aromáticos no saturados, que poseen al menos un anillo aromático además de otros tipos de enlaces. Los hidrocarburos extraídos directamente de formaciones geológicas en estado líquido se conocen comúnmente con el nombre de petróleo, mientras que los que se encuentran en estado gaseoso se les conoce como gas natural. Los hidrocarburos constituyen una actividad económica de primera importancia, pues forman parte de los principales combustibles fósiles (petróleo y gas natural), así como de todo tipo de plásticos, ceras y lubricantes. CARACTERISTICAS DEL ATOMO DE CARBONO El átomo de carbono, debido a su configuración electrónica, presenta una importante capacidad de combinación. Los átomos de carbono pueden unirse entre sí formando estructuras complejas y enlazarse a átomos o grupos de átomos que confieren a las moléculas resultantes propiedades específicas. La enorme diversidad en los compuestos del carbono hace de su estudio químico una importante área del conocimiento puro y aplicado de la ciencia actual. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11ª 7 PGF03-R03 Configuración electrónica del Carbono z=6 CONFIGURACIÓN ELECTRÓNICA El átomo de carbono constituye el elemento esencial de toda la química orgánica, y dado que las propiedades químicas de elementos y compuestos son consecuencia de las características electrónicas de sus átomos y de sus moléculas, es necesario considerar la configuración electrónica del átomo de carbono para poder comprender su singular comportamiento químico. Se trata del elemento de número atómico Z = 6. Por tal motivo su configuración electrónica en el estado fundamental o no excitado es 1s2 2s2 2p2. La existencia de cuatro electrones en la última capa sugiere la posibilidad bien de ganar otros cuatro convirtiéndose en el ion C4cuya configuración electrónica coincide con la del gas noble Ne, bien de perderlos pasando a ion C4+ de configuración electrónica idéntica a la del He. En realidad una pérdida o ganancia de un número tan elevado de electrones indica una dosis de energía elevada, y el átomo de carbono opta por compartir sus cuatro electrones externos con otros átomos mediante enlaces covalentes. Esa cuádruple posibilidad de enlace que presenta el átomo de carbono se denomina tetravalencia. ENLACES: Los cuatro enlaces del carbono se orientan simétricamente en el espacio de modo que considerando su núcleo situado en el centro de un tetraedro, los enlaces están dirigidos a lo largo de las líneas que unen dicho punto con cada uno de sus vértices. La formación de enlaces covalentes puede explicarse, recurriendo al modelo atómico de la mecánica cuántica, como debida a la superposición de orbitales o nubes electrónicas correspondientes a dos átomos iguales o diferentes. Así, en la molécula de metano CH4 (combustible gaseoso que constituye el principal componente del gas natural), los dos electrones internos del átomo de C, en su movimiento en torno al núcleo, dan lugar a una nube esférica que no participa en los fenómenos de enlace; es una nube pasiva. Sin embargo, los cuatro electrones externos de dicho átomo se mueven en el espacio formando una nube activa de cuatro lóbulos principales dirigidos hacia los vértices de un tetraedro y que pueden participar en la formación del enlace químico. Cuando las nubes electrónicas de los cuatro átomos de hidrógeno se acercan suficientemente al átomo de carbono, se superponen o solapan con los lóbulos componentes de su nube activa, dando lugar a esa situación favorable energéticamente que denominamos enlace. Hibridación pero…¿qué es hibridación? se habla de hibridación cuando en un átomo, se mezcla el orden de los electrones entre orbitales creando una configuración electrónica nueva, un orbital híbrido que describa la forma en que en la realidad se disponen los electrones para producir las propiedades que se observan en los enlaces atómicos. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11ª 8 PGF03-R03 La teoría fue propuesta por el químico Linus Pauling y tiende a describir con gran eficacia la estructura de ciertos compuestos orgánicos tales como los enlaces dobles de los alquenos. Orbitales: los electrones de un átomo tienen la tendencia de ubicarse en orbitales específicos alrededor del núcleo, lo cual se enuncia en la ecuación de Schrödinger. Los detalles sobre número y orientación de electrones en cada orbital dependen de las propiedades energéticas descritas por los números cuánticos. El primer orbital, el más cercano al núcleo es el llamado 1s y solo puede ser ocupado por dos electrones. Un átomo con un solo electrón (hidrógeno) y uno con dos electrones (helio) ubican su(s) electrón(es) en este orbital. Un átomo con tres (litio) y cuatro (berilio) electrones tendrá que ubicar el tercer y cuarto electrón en el siguiente orbital, llamado 2s, el cual también solo acepta dos electrones. HIBRIDACIÓN SP³ El átomo de carbono tiene seis electrones: dos se ubican en el orbital 1s (1s²), dos en el 2s (2s²) y los restantes dos en el orbital 2p (2p²). Debido a su orientación en el plano tridimensional el orbital 2p tiene capacidad para ubicar 6 electrones: 2 en el eje de las x, dos en el eje de las y y dos electrones en el eje de las z. Los dos últimos electrones del carbono se ubicarían uno en el 2px, el otro en el 2py y el orbital 2pz permanece vacío (2px¹ 2py¹). El esquema de lo anterior es (cada flecha un electrón): Para satisfacer su estado energético inestable, un átomo de valencia como el del carbono, con orbitales parcialmente llenos (2px y 2py necesitarían tener dos electrones) tiende a formar enlaces con otros átomos que tengan electrones disponibles. Para ello, no basta simplemente colocar un electrón en cada orbital necesitado. En la naturaleza, éste tipo de átomos redistribuyen sus electrones formando orbitales híbridos. En el caso del carbono, uno de los electrones del orbital 2s es excitado y se ubica en el orbital 2p z. Así, los cuatro últimos orbitales tienen un electrón cada uno: El estímulo para excitar al electrón del 2s al 2p z es aportado por el primer electrón en formar enlace con un átomo con este tipo de valencia. Por ejemplo, el hidrógeno en el caso del metano. Esto a su vez incrementa la necesidad de llenado de los restantes orbitales. Estos nuevos orbitales híbridos dejan de ser llamados 2s y 2p y son ahora llamados (sp3: un poco de ambos orbitales): De los cuatro orbitales así formados, uno (25%) es proveniente del orbital s (el 2s) del carbono y tres (75%) provenientes de los orbitales p (2p). Sin embargo todos se sobreponen CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11ª 9 PGF03-R03 al aportar la hibridación producto del enlace. Tridimensionalmente, la distancia entre un hidrógeno y el otro en el metano son equivalentes e iguales a un ángulo de 109°. Hibridación sp2 En la hibridación trigonal se hibridan los orbitales 2s, 2p x y 2 py, resultando tres orbitales idénticos sp2 y un electrón en un orbital puro 2pz . Hibridación sp2 El carbono hibridado sp2 da lugar a la serie de los alquenos. La molécula de eteno o etileno presenta un doble enlace: un enlace de tipo σ por solapamiento de los orbitales híbridos sp 2 un enlace de tipo π por solapamiento del orbital 2 pz El enlace π es más débil que el enlace σ lo cual explica la mayor reactividad de los alquenos, debido al grado de insaturación que presentan los dobles enlaces. El doble enlace impide la libre rotación de la molécula. Hibridación sp Los átomos que se hibridan ponen en juego un orbital s y uno p, para dar dos orbitales híbridos sp, colineales formando un ángulo de 180º. Los otros dos orbitales p no experimentan ningún tipo de perturbación en su configuración. El ejemplo más sencillo de hibridación sp lo presenta el etino. La molécula de acetileno presenta un triple enlace: a. b. un enlace de tipo σ por solapamiento de los dos enlaces de tipo π por solapamiento de los orbitales 2 p. orbitales híbridos sp Sistemas de Nomenclatura Orgánica Los químicos han ideado sistemas que facilitan la identificación y escritura de los más de 10 millones de compuestos orgánicos conocidos. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11ª 10 PGF03-R03 No es necesario saber todos los nombres de las sustancias orgánicas, sino que basta con recordar las reglas básicas de los sistemas de nomenclatura que se aplican para nombrar los hidrocarburos y, luego, hacer extensivas estas reglas a las demás funciones orgánicas. Para nombrar los compuestos orgánicos, se conocen dos sistemas de nomenclatura: común y IUPAC. Sistema de Nomenclatura Común Cuando las sustancias orgánicas eran muy pocas, resultaba más fácil nombrarlas pues bastaba con emplear los nombres comunes con los que se conocían. Así, como por ejemplo, la urea debía su nombre a que era aislada de la orina; la morfina, que es un analgésico, fue aislada en 1805 de la amapola y recibió este nombre en honor a Morfeo, dios griego del sueño. Sin embargo, a medida que la química orgánica fue desarrollándose, el número de sustancias se hizo mucho mayor y, en el siglo XIX, surgió la necesidad de inventar un método sistemático para identificar y formular las sustancias orgánicas. Sistema de nomenclatura IUPAC Este sistema fue desarrollado por la Unión Internacional de Química Pura y Aplicada, y permite asignar nombres a todos los grupos funcionales y a todas las sustancias orgánicas, por más complejas que sean sus estructuras, con sólo aplicar algunas reglas muy sencillas. Para nombrar los hidrocarburos ramificados, es necesario conocer primero el siguiente concepto; el nombre IUPAC para un alcano de cadena lineal consta de dos partes: el prefijo que indica el número de átomos de Carbono y un sufijo (ano), que indica que el compuesto es saturado. Los grupos Alquilo: si a un hidrocarburo saturado (alcano) se le extrae un átomo de Hidrógeno, la estructura parcial que queda se denomina grupo alquilo. Por ejemplo, si tenemos el alcano Metano CH4 , al extraer un Hidrógeno la estructura parcial que queda es CH3-, que corresponde a un grupo alquilo, para nombrarlos, se sustituye la terminación ANO por ILO o IL. En el ejemplo anterior, el grupo alquilo se denomina Metil o Metilo. HIDROCARBUROS SATURADOS Alcanos Los alcanos son compuestos con fórmula molecular CnH2n+2. El hidrocarburo más simple es el metano CH4 (n=1). Los hidrocarburos de cadena lineal se denominan hidrocarburos normales. Los cuatro primeros miembros de la familia de hidrocarburos lineales son los siguientes: CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11ª 11 PGF03-R03 metano CH4 etano CH3CH3 propano CH3CH2CH3 butano CH3(CH2)2CH3 Tabla 1. Alcanos con nombres propios. Existe un único hidrocarburo con la fórmula molecular CH4, uno sólo con la fórmula molecular C2H6 (el etano), uno sólo con la fórmula molecular C3H8 (el propano), pero sin embargo existen dos alcanos con la fórmula molecular C4H10: el butano y el 2-metilpropano: Dos compuestos químicos diferentes con la misma fórmula molecular se denominan isómeros. El número de alcanos isoméricos aumenta al aumentar número de átomos de carbono. En la tabla se indican los puntos de fusión y de ebullición, así como el número de isómeros de algunos alcanos de cadena lineal. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11ª 12 PGF03-R03 PROPIEDADES FÍSICAS DE LOS ALCANOS n Nombre Fórmula n Nombre Fórmula 5 pentano CH3(CH2)3CH3 17 heptadecano CH3(CH2)15CH3 6 hexano CH3(CH2)4CH3 18 octadecano CH3(CH2)16CH3 7 heptano CH3(CH2)5CH3 19 nonadecano CH3(CH2)17CH3 8 octano CH3(CH2)6CH3 20 eicosano CH3(CH2)18CH3 9 nonano CH3(CH2)7CH3 21 heneicosano CH3(CH2)19CH3 10 decano CH3(CH2)8CH3 22 docosano CH3(CH2)20CH3 11 undecano CH3(CH2)9CH3 23 Tricosano CH3(CH2)21CH3 12 dodecano CH3(CH2)10CH3 24 Tetracosano CH3(CH2)22CH3 13 tridecano CH3(CH2)11CH3 25 pentacosano CH3(CH2)23CH3 14 tetradecano CH3(CH2)12CH3 30 triacontano CH3(CH2)28CH3 15 pentadecano CH3(CH2)13CH3 40 tetracontano CH3(CH2)38CH3 16 hexadecano CH3(CH2)14CH3 50 pentacontano CH3(CH2)48CH3 Tabla 2. Nomenclatura de los alcanos superiores. NOMENCLATURA DE ALCANOS Y CICLOALCANOS CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11ª 13 PGF03-R03 El sistema IUPAC establece una serie de reglas encaminadas a facilitar la nomenclatura de los hidrocarburos saturados o alcanos y posteriormente es aplicable a cualquier otra función orgánica. Entre las reglas IUPAC, están: Se identifica la cadena continua más larga de átomos de Carbono presente en la molécula y se emplea el nombre de esa cadena como parte principal. Si existen dos cadenas diferentes de igual tamaño, se escoge como principal la tenga mayor número de ramificaciones. Se numeran los átomos de la cadena principal, comenzando por el extremo más cercano al primer punto de ramificación. Se identifica y se numera cada sustituyente o ramificación de acuerdo con su punto de unión en la cadena principal. Si hay dos sustituyentes en el mismo carbono, se asigna a ambos el mismo número. Se indica el número de veces que se repite dicho sustituyente con un prefijo (di, tri, tetra, etc.) y la colocación de cada uno de ellos, mediante el número correspondiente. Los números que indican la localización de los sustituyentes se colocan delante de los nombres de dichos sustituyentes, separándolos con un guión. En el caso de encontrarse dos o más sustituyentes iguales, los números que indican su posición van separados por comas; luego, se coloca un guión. El orden en que se nombran los sustituyentes es arbitrario, aunque puede utilizarse el orden alfabético o el orden de complejidad del mismo (del más simple al más complejo).EJ: Los cicloalcanos Son hidrocarburos cíclicos (la cadena se cierra sobre sí misma formando un anillo) y su fórmula molecular general es CnH2n. Los cicloalcanos monocíclicos no sustituídos se CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11ª 14 PGF03-R03 nombran agregando el prefijo ciclo al nombre del alcano lineal con el mismo número de átomos de carbono. Ejemplos: CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11ª 15 PGF03-R03 3,4-dietiloctano 3-etil-2-metilpentano 4-isopropilheptano 4-isopropil-5-ter-butilnonano 4-etil-2,4-dimetilnonano 4-(2-metilpropil)-octano Entre paréntesis se encuentra un radical complejo unido a la posición 4 de la cadena principal. La posición 1 del radical complejo es el carbono por donde se une a la principal. EJEMPLO: CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11ª 16 PGF03-R03 1. Escriba las fórmulas para los alcanos y alquenos dependiendo del caso, cuyo número de carbonos sea: 5, 10, 18 y 21. 2. Escriba las fórmulas para cada uno de los siguientes casos: 2,3,3-trimetilhexano 1-cloro-4-etil-2,3-dimetilnonano 3,4,4-tribromooctano 2-cloro-3,3-dimetilpentano 1- cloro- 2, 2- dimetil-propano 3. Establezca la nomenclatura IUPAC para las siguientes cadenas de hidrocarburos. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11ª 17 PGF03-R03 HIDROCARBUROS INSATURADOS PROPIEDADES FÍSICAS DE ALQUENOS Y ALQUINOS Punto de ebullición.Los puntos de ebullición de los alquenos no ramificados aumentan al aumentar la longitud de la cadena. Para los isómeros,el que tenga la cadena más ramificada tendrá un punto de ebullición más bajo. Solubilidad.Los alquenos son casi totalmente insolubles en agua debido a su baja polaridad y a su incapacidad para formar enlaces con el hidrógeno. Estabilidad.: Cuanto mayor es el número de grupos alquilo enlazados a los carbonos del doble enlace (más sustituido esté el doble enlace) mayor será la estabilidad del alqueno. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 18 PGF03-R03 NOMENCLATURA DE ALQUENOS, CICLOALQUENOS Y ALQUINOS Los alquenos son hidrocarburos con enlaces dobles carbono-carbono. Se les denomina también olefinas. El alqueno más simple es el etileno cuya fórmula molecular es C2H4. El doble enlace se representa, en una estructura de Lewis, mediante dos pares de electrones entre los átomos de carbono Los alquenos son una clase de hidrocarburos que poseen en su estructura, al menos, un doble enlace Carbono – Carbono (-C=C-). El primer miembro de esta serie de compuestos es el eteno o etileno (H2C=CH2), y para nombrarlos, si la cadena es normal o lineal, basta con contar el número de carbonos de la cadena, indicar la posición del doble enlace ésta y darle la terminación eno al nombre del hidrocarburo: CH2=CH- CH2- CH3 H3C-CH=CH- CH2- CH3 1-buteno o simplemente buteno 2-penteno CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 19 PGF03-R03 Si el alqueno presenta ramificaciones, se escoge la cadena más larga que contenga el doble enlace y, al aumentar la cadena, el carbono 1 será el del extremo más próximo a dicho enlace. La posición se indica con el número menor de los dos que contienen el doble enlace. Para lo demás, se siguen las reglas anteriores: CH3-CH=CH-CH- CH2-CH- CH2- CH3 CH3 CH3 4,6-dimetil-2-octeno CH2=C-CH= CH2 CH3 2-metil-1,3-butadieno En el último ejemplo se emplea el sufijo dieno para denotar la presencia de dos dobles enlaces. Los alquinos son hidrocarburos que poseen en sus moléculas, al menos, un triple enlace entre átomos de Carbono. Para nombrar este tipo de hidrocarburos, se siguen las mismas normas que para los alquenos, cambiando la terminación eno por ino. Los alquinos responden a la fórmula CnH2n-2 y se nombran sustituyendo el sufijo -ano del alca-no con igual número de carbonos por -ino. Regla 2. Se elige como cadena principal la de mayor longitud que contiene el triple enlace. La numeración debe otorgar los menores localizadores al triple enlace. Regla 3. Cuando la molécula tiene más de un triple enlace, se toma como principal la cadena que contiene el mayor número de enlaces triples y se numera desde el extremo más cercano a uno de los enlaces múltiples, terminando el nombre en -diino, triino, etc. Regla 4. Si el hidrocarburo contiene dobles y triples enlaces, se procede del modo siguiente: 1. Se toma como cadena principal la que contiene al mayor número posible de enlaces múltiples, prescindiendo de si son dobles o triples. 2. Se numera para que los enlaces en conjunto tomen los localizadores más bajos. Si hay un doble enlace y un triple a la misma distancia de los extremos tiene preferencia el doble. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 20 PGF03-R03 3. Si el compuesto tiene un doble enlace y un triple se termina el nombre en -eno-ino; si tiene dos dobles y un triple, -dieno-ino; con dos triples y un doble la terminación es, -eno diino Los cicloalquenos son moléculas de fórmula molecular global CnH2n-2. Para nombrar los cicloalquenos se asignan los locantes 1 y 2 a los carbonos del doble enlace. La dirección de numeración se elige de manera de dar los menores locantes a los sustituyentes del anillo, en la primera diferencia. Ya que el doble enlace siempre está en posición 1 no es necesario especificarlo en el nombre. En cicloheptenos y anillos más pequeños no es necesario especificar isomería geométrica ya que los hidrógenos o sustituyentes del doble enlace siempre se encontrarán en posición cis. Ejemplos: 1. Escribe la estructura y proporciona el nombre IUPAC de un alcano o cicloalcano con fórmula: a) b) c) d) e) C5H12 que solo tenga átomos de hidrógeno primarios. C5H12 que solo tenga un átomo de hidrógeno terciario. C5H12 que solo tenga átomos de hidrógeno primarios y secundarios. C5H10 que solo tenga átomos de hidrógeno secundarios. C6H14 que solo tenga átomos de hidrógeno primarios y terciarios. 2. Escribe las fórmulas de los isómeros estructurales que se generan a partir del compuesto de fórmula molecular C7H16 y establece el nombre de cada uno según las reglas IUPAC 3. a) b) c) d) Dibuja la estructura de los siguientes compuestos: 8-etil-3-propil-6-isopropil- 9,13-dimetil-11terbutil-2,11-pentadecadieno-4-ino 4,5-dimetil-1,3-heptadieno 4-cloro-5-metil-6-6propil-1,4,6-octatrieno 2,2,3,3-tetrametilbutano 4. Escribe los nombres según la IUPAC, para las siguientes estructuras CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 21 PGF03-R03 5. Formula los siguientes alcanos utilizando la notación de líneas Zig – Zag. a) 2,4-dimetilhexano. b) 4- etil-5 -isopropil-3-metil-8-propilundecano 4. Formula los siguiente alquenos utilizando la notación de líneas Zig – Zag ó esqueleto. a) 3-etil-6-metil-2-hepteno b) 1,3-pentadieno c) 1,3,5 hexatrieno 5. Formula los siguientes alquinos utilizando la notación de líneas Zig – Zag. a) 7,7-dimetil-3-etil-4-nonino b) 1-buten-3-ino c) 3-propil-1,5-heptadiino PROPIEDADES QUÍMICAS DE LOS ALCANOS Las principales reacciones de los alcanos son: 1. Combustión: Los alcanos reaccionan con el oxígeno para producir dióxido de carbono, agua y calor. Así el metano combuste según la reacción: calor La reacción de combustión del etano se representa así: CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 22 PGF03-R03 calor La energía que se desprende se debe al exceso de ésta durante el rompimiento o formación del enlace 2. halogenación. La reacción del metano con el cloro produce una mezcla de productos clorados cuya composición depende de la cantidad de cloro agregado y de las condiciones de la reacción. La reacción de monocloración del metano es la siguiente: Las reacciones de halogenación radicalaria de alcanos son de utilidad sintética limitada. Por ejemplo la cloración del propano proporciona una mezcla de cloruro de npropilo y de cloruro de isopropilo: En la cloración del propano, el átomo de hidrógeno secundario se separa con mayor frecuencia porque el radical secundario y el estado de transición que conducen a él, tienen menor energía que el radical primario y su estado de transición. A continuación, se representa un perfil de energía de reacción para el primer paso de propagación en la formación del cloropropano y del 2 cloropropano. La energía de activación para la formación del radical secundario es ligeramente menor, y por tanto se forma con más rapidez que el radical primario. 3. Hidrogenación catalítica de alquenos: Catalizador R-CH=CH2 + H2 ------------------------ R-CH2-CH3 Alqueno Catalizadores: Ni, Pt ó Pd 4. Reacción de Wurtz: 2R-X + 2Na -> R-R + 2NaX Haluro Alquilo 5. Hidrólisis de Reactivos de Grignard: Eter seco R – X + Mg ____________ R – Mg X React. Grignard. X = cl, Br, I R- MgX + H2O ___________ R – H + MgXOH Alcano CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 23 PGF03-R03 Reducción de Haluros de Alquilo: R-X + H2 -> R-H + HX Alcano 1. Completar las siguientes reacciones de alcanos: 2. Escribe las fórmulas y completa las reacciones que se sugieren a continuación, empleando las reglas de la nomenclatura IUPAC. Luego, clasifícalas según el tipo. Butano + cloro gaseoso 2,3 Dimetil pentano + hidrogeno Butano + sodio metálico Ciclohexano + níquel 3,4- dimetil octano + bromo Ciclopentano + cloro Ciclobutano+ cloro Octano + oxigeno pentino + 2 hidrógenos buteno+ hidrogeno CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 24 PGF03-R03 PREGUNTAS TIPO ICFES 1. En los compuestos orgánicos, cada tipo de carbono y sus hidrógenos correspondientes tienen reactividad propia y diferente el uno del otro, en el orden siguiente C terciario > C secundario > C primario Si se tiene la siguiente reacción: Con base en la información anterior, el producto X que se produce en mayor proporción es 2. En el análisis elemental de un compuesto orgánico se estableció que existe la siguiente relación entre los átomos de carbono e hidrógeno que lo conforman: por cada átomo de carbono en una molécula del compuesto hay 2 de hidrógeno. De acuerdo con el análisis, es probable que la fórmula del compuesto sea RESPONDE LAS PREGUNTAS 3 Y 4 DE ACUERDO CON LA SIGUIENTE INFORMACIÓN El proceso de halogenación del 1- propino se lleva a cabo mediante 2 reacciones consecutivas de adición, como se muestra en el siguiente esquema CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 25 PGF03-R03 3. Suponiendo rendimiento del 100%, para producir un mol de A. 4 moles de 1- propino y 2 moles de cloro gaseoso B. 2 moles de 1 - propino y 4 moles de cloro gaseoso C. 1 mol de 1 - propino y 2 moles de cloro gaseoso D. 2 moles de 1 - propino y 2 moles de cloro gaseoso 4. Si se lleva a cabo un proceso de halogenación utilizando Es probable que al finalizar el paso 2 del proceso se obtenga 5. En una molécula orgánica, los átomos de carbono se clasifican de acuerdo con el Número de átomos de carbono a los que se encuentran enlazados, como se muestra a Continuación 6. De acuerdo con lo anterior, es válido afirmar que existe carbono de tipo cuaternario en la estructura de A. 1 - penteno B. 2 - metíl - 2 - butanol C. 2,2 - dimetíl hexano D. 3 - propanona 7. En la siguiente figura se representa la forma en la que se disponen los orbitales de 2 Átomos de carbono en un compuesto orgánico CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 26 PGF03-R03 De acuerdo con la figura, el compuesto orgánico es 8. Observe con detenimiento las siguientes estructuras carbonadas. De las fórmulas químicas anteriores, las que representan hidrocarburos saturados son A. 1 y 3 B. 2 y 4 C. 3 y 4 D. 1 y 2 RESPONDE LAS PREGUNTAS 9 a la 10 DE ACUERDO CON LA SIGUIENTE INFORMACIÓN Para la síntesis de los alcanos se tienen los siguientes métodos: 1. Hidrogenación catalítica de alquenos: Catalizador R-CH=CH2 + H2 ------------------------ R-CH2-CH3 Alqueno Catalizadores: Ni, Pt ó Pd 2. Reacción de Wurtz: 2R-X + 2Na -> R-R + 2NaX Haluro Alquilo CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 27 PGF03-R03 3. Hidrólisis de Reactivos de Grignard: Eter seco R – X + Mg ____________ R – Mg X React. Grignard. X = cl, Br, I R- MgX + H2O ___________ R – H + MgXOH Alcano 4. Reducción de Haluros de Alquilo: R-X + H2 -> R-H + HX Alcano 9. Se dispone de 123 gramos de CH3-CH2-CH2-Br (bromo propa-no) y 165 gramos de CH3CH2-CH2-CH2-CH2-CH2-Br (bromo hexano) y exceso de hidrógeno y sodio y se puede utilizar sólo uno de los métodos descritos para producir la mayor cantidad de n-Hexano posible. De acuerdo con esto, el método a utilizar debe ser el A. 4 porque la relación del reactante al producto es 1:1 B. 2 porque la relación del reactante al producto es 1:2 C. 4 porque se requiere menor masa de hidrógeno D. 2 porque no se requiere hidrógeno 10. De los cuatro métodos descritos puede decirse que las reacciones de haluros de alquilo son en general reacciones de: a. Adición. b. Sustitución y adición. c. Sustitución. d. Catálisis. CONTESTA LAS PREGUNTAS 11 Y 12 ESTRUCTURAS DE ACUERDO CON LAS SIGUIENTES 11. Una de las características de los compuestos orgánicos es que poseen carbonos primarios (enlazados a un átomo de carbono), secundarios (enlazados a dos átomos de carbono), terciarios (enlazados a 3 átomos de carbono) y cuaternarios (enlazados a 4 átomos de carbono). De acuerdo con esta información es válido afirmar que: A. Z posee más carbonos terciarios y la misma cantidad de carbonos primarios que Y B. Z posee más carbonos secundarios y la misma cantidad de carbonos terciarios que Y C. Z y Y poseen la misma cantidad de carbonos terciarios y diferente cantidad de carbonos cuaternarios. D. Z y Y poseen la misma cantidad de carbonos terciarios y secundarios. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 28 PGF03-R03 12. El punto de fusión de los alcanos aumenta de acuerdo a la cantidad de átomos de carbono que posee, pero disminuye con el aumento, tipo y ubicación de ramificaciones en la cadena principal. Teniendo en cuenta ésto, es válido afirmar que el punto de fusión de A. Z es mayor que el de Y, debido a que Z tiene más átomos de carbono B. Z es menor que el de Y, ya que Z presenta una cadena principal más corta y el mismo número de ramificaciones que Y C. Z es igual al de Y, ya que las dos estructuras representan el mismo compuesto D. Z es menor que el de Y, debido a que Z tiene más ramificaciones que Y. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 29 PGF03-R03 UNIDAD II HIDROCARBUROS AROMÁTICOS Propósito: Determinar las principales características tanto físicas como químicas de los hidrocarburos aromáticos en general y derivados del benceno. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 30 PGF03-R03 Concepto de Petróleo E l petróleo es un líquido aceitoso, inflamable, cuyo color varia de incoloro a negro y está formado por una mezcla de hidrocarburos, principalmente de alcanos de cadena recta. El número de átomos de carbono de estos hidrocarburos llega a pasar hasta los 70 (combustibles pesados y asfalto).Otras veces contiene pequeñas cantidades de compuestos orgánicos que poseen nitrógeno, oxigeno o azufre. También se han encontrado metales como el vanadio. La composición del petróleo varía de un lugar a otro, e inclusive de un pozo a otro. Algunos petróleos contienen cicloalcanos, que en la industria petrolera se conocen con el nombre de naftenos. La palabra petróleo proviene del vocablo latino petroleum, el cual, a su vez, está formado por dos términos, petra que significa piedra y oleum que traduce aceite; en resumen, petróleo significa aceite de piedra (aceite de roca). Origen del Petróleo y del gas natural La teoría actual de origen orgánico recibe unánime aceptación, tanto por parte de los químicos, como de los geólogos e ingenieros de petróleo. Esta teoría indica que el gas natural y el petróleo provienen de la descomposición (específicamente fermentación) anaeróbica ( en ausencia de oxigeno) microbiana de grandes masas de plancton (plantas y animales marinos microscópicos), que exigieron hace millones de años (durante el periodo carbonífero, hace 280 a 345 millones de años), los cuales quedaron atrapados en formaciones rocosas en el fondo de los mares antiguos, bajo la acción de altas presiones ejercidas por los sedimentos acumulados sobre ellos y altas temperaturas. El gas natural y el petróleo producidos, o se quedaron en el lugar donde se acumularon en depósitos subterráneos, formando los yacimientos secundarios. Esta teoría en los momentos se apoya en el hecho de que los fangos colectados en las partes más profundas del Mar Negro, contienen hasta un 25% de materia orgánica y el 10% de esta ya ha sido trasformada en hidrocarburos pesados solubles en benceno. Además, la solución obtenida es verde y contiene indicios de clorofila. Extracción del Petróleo La perforación es el único medio que garantiza si existe petróleo en el subsuelo. Para ello se perfora un orificio con una barrera de hierro, a la cual se le van enroscando tubos de acero. Cuando el pozo hace contacto con el yacimiento, el petróleo asciende violentamente por la tubería debido a la presión del gas. Junto con el petróleo sale cierta cantidad de gas disuelto y algo de agua salada. Esto es lo que constituye la extracción natural. Refinación del Petróleo El petróleo extraído de los yacimientos a través de los pozos, se le denomina Crudo. En esta forma no puede utilizarse. Como ya sabemos el petróleo es una mezcla de hidrocarburos y CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 31 PGF03-R03 para transformarlo en los productos que derivan de él, hay que aplicarle un conjunto de procesos, a los cuales se le da el nombre de Refinación. Estos procesos se realizan en complejos industriales, llamados refinerías. L os crudos se clasifican atendiendo a su peso específico. Para ello se usa una unidad internacional llamada El Grado A.P.I. (American Petroleum Institute). El proceso inicial y fundamental de la refinación es la destilación fraccionada, la cual se ejecuta en una columna de destilación fraccionada. El crudo se calienta a 460ºC y se hace entrar en columna de fraccionamiento, la cual está dividida internamente en pisos o platos. Como cada componente del crudo posee su propio punto de ebullición, los más volátiles se separan y ascienden por la columna. A medida que van alcanzando cierta altura, se van condensando en los respectivos platos y se extraen por tuberías laterales. De esta forma, se logran separar los diferentes componentes del crudo como gases (metano, etano, propano y butano), gasolina, Kerosén, gasoil, combustible pesado entre los cuales se tienen aceites combustibles y asfalto. Los procesos de separación y transformación del petróleo E l petróleo crudo una vez extraído del pozo, sube por los cabezales de producción que se encuentran ubicados en la parte superior (boca del pozo) del pozo. Este crudo sigue un trayecto y va a un tren de separadores que se encuentran ubicados en los campos de producción. Debido a que el petróleo en su forma natural se encuentra en los pozos acompañado de gas, agua, sedimentos e impurezas, debe ser separado de cada uno de estos elementos, He allí donde aparecen los trenes de separadores, los cuales son unas especies de tanques donde el petróleo crudo entra por la parte superior y debido a la gravedad él se va separando. Los sedimentos se van al fondo, el agua se queda en la parte media entre los sedimentos y el crudo y el gas en la parte superior. Este crudo una vez que sale del separador, sale acompañado con el gas. Este gas se separa del crudo mediante dispositivos especiales para esta tarea, donde el gas es secado o atrapado por medio de absorción ó adsorción. Una vez que el crudo se encuentra totalmente limpio, se transporta por medio de oleoductos a los puntos de refinación ó refinarías. Los procesos de refinación son muy variados y se diferencian unos de otros por los conceptos científicos y tecnológicos que los fundamentan para conformar una cadena de sucesos que facilitan: · La destilación de crudos y separación de productos. · La destilación, la modificación y la reconstitución molecular de los hidrocarburos. · La estabilidad, la purificación y mejor calidad de los derivados obtenidos. Todo esto se logra mediante la utilización de plantas y equipos auxiliares, que satisfacen diseños y especificaciones de funcionamiento confiables, y por la introducción de substancias apropiadas y/o catalizadores que sustentan reacciones químicas y/o físicas deseadas durante cada paso del proceso. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 32 PGF03-R03 CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 33 PGF03-R03 a) ¿Qué propiedades físicas presenta el petróleo? b) ¿Cuál es el origen del petróleo? c) ¿A qué se le denomina crudo y en donde se encuentra? d) ¿cómo se obtiene gas natural? e) Realice un mentefacto procedimental mostrando como se realiza la exploración y extracción del crudo. f) ¿cuáles son los derivados del petróleo? ¿para qué nos sirven? g) ¿En que se diferencian los diferentes combustibles? h) ¿cómo se convierte el crudo en derivados como gasolina, olefinas entre otras? i) ¿Porque crees que es importante el petróleo? j) Consulta la importancia del petróleo en el mundo actual. PROPIEDADES QUÍMICAS DE LOS ALQUENOS Y ALQUINOS REACCIONES DE ALQUENOS A diferencia de los alcanos, los alquenos presentan una elevada reactividad química con diversos reactivos. Las reacciones de los alquenos son mayoritariamente reacciones de adición, contrariamente a las reacciones de sustitución típicas de los alcanos. Cuando un reactivo con dos partes (A y B) llamado adendum, en condiciones adecuadas, entra en contacto con un alqueno, se produce la ruptura del doble enlace carbono-carbono y cada uno de los miembros del adendum se "adiciona" al respectivo enlace libre de cada átomo de carbono para formar el producto final, que contiene todos los átomos de los dos reactivos envueltos. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 34 PGF03-R03 REGLA DE MARKOVNICOV En las reacciones de adición a enlaces dobles o triples, la parte positiva del reactivo(H+) se adiciona al carbono que tenga mayor número de hidrógenos”. LEY DE KHARASCH Al adicionar una molécula de haloácido (HBr, Hl, HCl) a un alqueno en presencia de O 2 o peróxido, la adición es contraria a la regla de Markownikoff ó Markovnicov”. HIDROGENACIÓN Un alqueno se convierte fácilmente en el alcano correspondiente al adicionar hidrogeno a los dobles enlaces carbono – carbono: la reacción se realiza en presencia de catalizadores metálicos. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 35 PGF03-R03 HALOGENACIÓN: El cloro y el bromo, en disolventes polares inertes, se adicionan en la oscuridad a los alquenos formando dihaluros (Derivados dihalogenados). HIDRATACIÓN Los alcoholes inferiores se separan por hidratación directa de alquenos en la presencia de ácidos como catalizadores. Ejemplo: ADICIÓN DE HALOÁCIDO: Con excepción del HF, los demás halogenuros de hidrogeno (HCl, HI, HBr) reaccionan con los alquenos produciendo halogenuros de alquilo. En la adición del haluro de hidrogeno a los alquenos ordinarios, el H se une al átomo de carbono que tiene más hidrogeno, formando el ión carbonilo más estable. Los productos formados de acuerdo con esta regla se conocen como productos de Markovnikov. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 36 PGF03-R03 MÉTODOS DE OBTENCIÓN DE ALQUENOS Deshidrohalogenación de Haloalcano: El método implica la eliminación de una molécula de haluro de hidrógeno ( HCl, HBr, HI) eliminación que se efectúa calentando el haloalcano con una solución concentrada de KOH en etanol. El ión hidroxilo atrae un H y el ión K al halógeno del carbono adyacente de donde fue extraído el H. Ejemplo: ALCOHOL Deshidratación de Alcoholes: Esta reacción implica la eliminación de una molécula de agua. El ácido sulfúrico H2SO4 (HOSO3H), suministra el H que cataliza la reacción . El protón del ácido que inicia la reacción se recupera cuando termina la reacción: REACCIONES DE LOS ALQUINOS Los alquinos se hidrogenan con dos equivalentes de hidrógeno, en presencia de un catalizador metálico finamente dividido, para formar alcanos. Los catalizadores más utilizados son: platino, paladio, rodio .. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 37 PGF03-R03 HIDROGENACION Hidratacion de Alquinos Los alquinos reaccionan con ácido sulfúrico acuoso en presencia de un catalizador de mercurio para formar enoles. El enol isomeriza (tautomeriza) rápidamente en las condiciones de reacción para dar aldehídos o cetonas Adicion de Haluros de Alquilo De forma similar a los alquenos, los alquinos adicionan haluros de hidrógeno (HBr, HCl, HI) al triple enlace para formar haluros de alquenilo. El mecanismo de la reacción transcurre a través de un carbocatión, formado en el carbono más sustituido del triple enlace. Por tanto, se trata de una reacción regioselectiva que sigue la regla de Markovnikov, adicionando el halógeno al carbono más sustituido del alquino. Halogenación de Alquinos Los alquinos reaccionan con cloro y bromo para formar tetrahaloalcanos. El triple enlace adiciona dos moléculas de halógeno, aunque es posible parar la reacción en el alqueno añadiendo un sólo equivalente del halógeno. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 38 PGF03-R03 Ozonólisis de Alquinos Los alquinos reaccionan con ozono para formar ácidos carboxílicos. En esta reacción se produce la ruptura del triple enlace, transformándose cada carbono del alquino en el grupo carboxílico. 1. Escribe la ecuación que representa la hidrogenación completa del 1- pentino. 2. Escribe la ecuación completa de la combustión del gas propano. 3. Asignar el nombre de las siguientes reacciones y completarlas: RESPONDA LAS PREGUNTAS 4, 5 y 6 DE ACUERDO CON LA SIGUIENTE INFORMACIÓN En la Anterior tabla aparecen algunas funciones químicas orgánicas CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 39 PGF03-R03 El siguiente diagrama de flujo indica una serie de reacciones: 4. Completa las reacciones con la letra correspondiente a la función que aparece en la tabla de datos. 5. ¿Qué nombre reciben cada una de las reacciones anteriores. 6. Realice la reacción entre L KMnO4 concentrado y caliente. 7. Si se pone a reaccionar S con HCl ¿Cuál sería el producto de la reacción? 8. Para los siguientes compuestos realizar las reacciones Halogenación, adición de HB, ozonólisis e hidratación. de hidrogenación, a) 4- etil - 1- Penteno b) 3,3 – dimetil- 1 hepteno c) 2,5- dimetil- 3- hexeno d) 3- etil- 2- metil- 1 - hepteno e) 3,4- dimetil- 2- buteno f) 2,2- dimetil – 4 – noneno 9. Llevar a cabo las siguientes reacciones: a) 1- octino + NaOH b) 1- bromo- 3 –hexino + 2H2 c) 4 – pentino + 2HCl d) 5,6-dimetil-3-heptino+ 2 Cl2 e) 6,6-dietil-4-nonino + 2 HCl f) 2-heptino + 2 H2 CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 40 PGF03-R03 ESTRUCTURA Y NOMENCLATURA DE AROMÁTICOS Compuestos aromáticos, en química orgánica, un grupo amplio de compuestos que contienen anillos cerrados de átomos de carbono. Los compuestos aromáticos presentan gran estabilidad por tener la estructura resonante asignada al benceno. Algunos anillos aromáticos pueden contener también un átomo de oxígeno o de nitrógeno. Originalmente el término estaba restringido a un producto del alquitrán mineral, el benceno, y a sus derivados, pero en la actualidad incluye casi la mitad de todos los compuestos orgánicos; el resto son los llamados compuestos alifáticos. Entre los compuestos aromáticos importantes se encuentran todas las hormonas y vitaminas, excepto la vitamina C; prácticamente todos los condimentos, perfumes y tintes orgánicos, tanto sintéticos como naturales; los alcaloides que no son alicíclicos (ciertas bases alifáticas como la putrescina a veces se clasifican incorrectamente como alcaloides), y sustancias como el trinitrotolueno (TNT) y los gases lacrimógenos. Ciertos derivados de los compuestos aromáticos tienen propiedades y nombres especiales. Por ejemplo, la presencia del grupo hidroxilo en el anillo da lugar a un fenol. Benceno, líquido incoloro de olor característico y sabor a quemado, de fórmula C 6H6. La molécula de benceno consiste en un anillo cerrado de seis átomos de carbono unidos por enlaces químicos que resuenan entre uniones simples y dobles. Cada átomo de carbono está a su vez unido a un átomo de hidrógeno. Aunque insoluble en agua, es miscible en cualquier proporción con disolventes orgánicos. El benceno es un disolvente eficaz para ciertos elementos como el azufre, el fósforo y el yodo, también para gomas, ceras, grasas y resinas, y para los productos orgánicos más simples. Es uno de los disolventes más empleados en los laboratorios de química orgánica. El benceno tiene un punto de fusión de 5,5 °C, un punto de ebullición de 80,1 °C, y una densidad relativa de 0,88 a 20 °C. El benceno puro arde con una llama humeante debido a su alto contenido de carbono. Mezclado con grandes proporciones de gasolina constituye un combustible aceptable. En Europa era frecuente añadir al benceno mezclado con tolueno y otros compuestos asociados al combustible de los motores, y sólo recientemente se ha tenido en cuenta su condición de agente cancerígeno. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 41 PGF03-R03 El benceno fue descubierto en 1825 por el científico inglés Michael Faraday, pero hasta 1842 en que se descubrió la existencia del benceno en el alquitrán de hulla, no pudo disponerse de él en grandes cantidades. Una tonelada de carbón transformada en coque en un horno produce unos 7,6 litros de benceno. En la actualidad se obtienen del petróleo grandes cantidades de benceno, ya sea extrayéndolo directamente de ciertos tipos de petróleo en crudo o por tratamiento químico del mismo (reforming y ciclación). La estructura de la molécula de benceno es de gran importancia en química orgánica. El primero en formular la teoría de la estructura de anillo de resonancia descrita anteriormente fue el químico alemán August Kekulé von Stradonitz, en 1865. Por diversos motivos, los científicos del siglo XX tuvieron dificultades para asimilar esta idea, y desarrollaron en su lugar una descripción molecular orbital de los electrones orbitando por toda la molécula en vez de por los átomos de carbono. En la década de 1980, tras nuevos estudios, se ha vuelto a la descripción de Kekulé, aunque con los electrones en órbitas deformadas alrededor de sus átomos concretos. El benceno se emplea como disolvente en muchas actividades industriales, como la fabricación del caucho y de calzados, y en la producción de otros compuestos importantes: estireno, fenol y ciclohexano, por ejemplo. Es esencial en la fabricación de detergentes, plaguicidas, disolventes y quitapinturas. Se encuentra presente en los combustibles (en la gasolina, por ejemplo, hasta en un 5%). Efectos sobre la salud El benceno suele penetrar en el organismo por inhalación, aunque también puede hacerlo a través de la piel. La exposición a bajas concentraciones de vapores de benceno o al líquido que ha penetrado por la piel puede causar mareos, delirio, cefalea, pérdida de apetito y trastornos gástricos. Igualmente, la exposición puede irritar la nariz y la faringe. Una exposición a altas concentraciones de benceno puede originar irregularidades en el ritmo cardiaco que pueden tener un desenlace fatal. La exposición repetida puede dañar la médula ósea y, dado el carácter hematopoyético de este tejido, puede provocar anemia aplásica. También puede provocar la muerte. Cuando la exposición al benceno ha sido suficientemente prolongada (años o incluso sólo meses), pueden surgir a largo plazo efectos sobre la salud. El benceno se comporta como carcinógeno (provoca cáncer). Hay pruebas suficientes de que el benceno causa leucemia en los trabajadores expuestos al mismo. Muchos científicos afirman que, en lo que respecta a la exposición a los carcinógenos, no existe una concentración de estos que sea realmente segura. El benceno puede provocar defectos congénitos en los animales. Hasta que se cuente con ensayos complementarios, deberemos manejarlo con mucha precaución, pues se trata de un posible agente teratógeno para el ser humano igualmente. En varios países el uso y la comercialización del benceno está sujeto a unas restricciones muy estrictas. Prácticas y controles en el lugar de trabajo Como disolvente, es posible substituir el benceno por varios compuestos menos peligrosos. El tolueno es un disolvente parecido; presenta los efectos adversos generales de los disolventes, pero, según se ha demostrado, no provoca cáncer ni deteriora la médula ósea. Un disolvente utilizado con frecuencia como alternativa a los más peligrosos es el aguarrás mineral. Disolventes menos volátiles, como el xileno y el mesitileno, presentan el mismo perfil de propiedades que el tolueno. Jamás CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 42 PGF03-R03 se utilizará como substituto la gasolina: puede contener benceno, tetraetil-plomo u otros compuestos peligrosos. Medidas técnicas: Se trata del modo más eficaz de reducir la exposición cuando no es posible prescindir del benceno. Se pueden confinar las operaciones en las que éste intervenga y/o instalar un sistema de ventilación aspirante en el lugar en el que se produzcan las emisiones químicas. Cuando las operaciones transcurren en medios aislados, se logra reducir la exposición. Equipos de protección personal (para vías respiratorias, por ejemplo): a veces, son necesarios si bien su eficacia es menor. No obstante, las recomendaciones han sido establecidas sólo como guía y cada situación presentará sus requisitos particulares. Para el benceno, se utiliza una máscara provista de un filtro de tipo A (apropiado para disolventes orgánicos con un punto de ebullición superior a 650 °C). El uso inadecuado del respirador resulta peligroso. Lo mejor sería utilizar un casco con entrada de aire fresco y una careta que funcionara con presión positiva, que insuflara aire limpio procedente del interior del casco o de una cubierta exterior. No todos los tipos de guantes pueden resistir la capacidad con que el benceno disuelve muchos materiales. Se recomienda utilizar guantes Viton o de PVA (a pesar de que su resistencia al benceno es limitada). Cuando se contamine la ropa, el operario deberá cambiarse de inmediato con objeto de evitar la absorción del producto por vía cutánea. Donde transcurra la manipulación del benceno (u otros disolventes peligrosos), se prohibirá tomar alimentos o bebidas, así como fumar. Manipulación y almacenamiento Los vapores de benceno son más densos que el aire, de modo que pueden desplazarse al ras del suelo y llegar hasta una fuente de ignición distante. En los lugares donde se manipule, utilice o almacene benceno, quedará prohibido fumar o emplear llamas libres. El almacenamiento tendrá lugar en recipientes herméticamente cerrados, dentro de una zona fresca, bien ventilada y alejada del calor. Los recipientes metálicos deberán estar conectados a tierra con objeto de evitar chispas por cargas electrostáticas que representarían una fuente de ignición. Se prestará atención a los equipos eléctricos, que deberán ser resistentes a las explosiones. El benceno sufre una violenta reacción con oxidantes como los permanganatos, los nitratos, los peróxidos, los cloratos y los percloratos. Ante un accidental derrame de benceno, se deberá adoptar las siguientes medidas: Restringir el acceso de personas a la zona del derrame, salvo que lleven equipo protector. Retirar cualquier fuente de ignición. Ventilar la zona del derrame o fuga. Recoger el líquido con un material adsorbente inerte (vermiculita, arena seca, tierra, etc.) y depositar los residuos en contenedores sellados. No verter el benceno en la red de alcantarillado: se trata de un residuo peligroso que puede provocar explosiones. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 43 PGF03-R03 En el caso de vertidos de gran magnitud, la limpieza deberá correr a cargo de expertos del departamento de bomberos. Clasificación y etiquetado El benceno está clasificado como tóxico y fácilmente inflamable en la CE. Las etiquetas de los frascos u otros recipientes deben llevar los símbolos que indiquen los riesgos correspondientes a `fácilmente inflamable' y `tóxico'. Son aplicables las frases R y S (de riesgo y seguridad) siguientes: R45 Puede causar cáncer. R11 Fácilmente inflamable. R48/23/24/25 Tóxico: riesgo de efectos graves para la salud en caso de exposición prolongada por inhalación, contacto con la piel e ingestión. Evítese la exposición. Recábense instrucciones especiales antes del S53 uso. S45 En caso de accidente o malestar, acúdase inmediatamente al médico (si es posible, muéstrele la etiqueta). Durante el transporte, los contenedores deben mostrar el número 1114 de Naciones Unidas, a efectos de identificación, y el símbolo correspondiente a la clase de peligro (en el caso del benceno: Clase 3, líquidos inflamables). 1. Realiza la estructura de KEKULE para el benceno, hacer énfasis en la resonancia de los dobles enlaces. 2. ¿Qué propiedades físicas posee el benceno? 3. Mencione 5 propiedades químicas del benceno. 4. ¿Cuál es la importancia de estudio de la estructura del benceno? 5. En la industria ¿ qué usos tiene el benceno? 6. ¿cuál es la fuente de obtención del benceno? 7. ¿Qué efectos nocivos presenta el benceno para la salud humana? Mencione mínimo 10. 8. ¿Qué medidas de precaución se requieren para la manipulación de compuestos orgánicos en el laboratorio? 9. Desarrolla un mentefacto conceptual sobre los hidrocarburos aromáticos. LA QUIMICA DEL BENCENO Una clase especial de hidrocarburos insaturados cíclicos es conocida como hidrocarburos aromáticos. El más simple de ellos es el benceno (C6H6), el cual posee la estructura de un anillo plano como se ve en la figura. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 44 PGF03-R03 En el modelo de electrones localizados el enlazado del benceno, presenta estructuras resonantes del tipo mostrado en la figura La mejor descripción del benceno asume que los orbitales híbridos sp 2 de cada carbono son empleados para formar los enlaces sigma C-C, C-H, con los orbitales 2p de cada carbono empleados para formar orbitales moleculares pi. La deslocalización de estos orbitales pi es conocido usualmente como un círculo dentro del anillo. La deslocalización de los electrones pi hace al anillo de benceno comportarse un poco diferente a los hidrocarburos insaturados. Como vimos de manera previa, los hidrocarburos insaturados caen rápidamente en reacciones de adición, el benceno no. De manera más común el participa en reacciones de sustitución donde átomos de hidrógeno son reemplazados por otros átomos, por ejemplo Las reacciones de sustitución son características de hidrocarburos saturados, y las reacciones de adición son características de los insaturados. El hecho de que el benceno CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 45 PGF03-R03 reaccione más como un compuesto saturado indica la mayor estabilidad de los electrones pi deslocalizados (sistema). PROPIEDADES FÍSICAS Y QUÍMICAS DEL BENCENO La nomenclatura de los derivados del benceno es similar a la nomenclatura para los sistemas saturados de anillos. Si hay más de un sustituyente, los números son empleados para indicar la posición de los mismos. Por ejemplo el compuesto 1,4-dibromobenceno: Otro sistema de nomenclatura use al prefijo orto (o-) para dos sustituyentes adyacentes (en las posiciones relativas 1 y 2), meta (m-) para dos sustituyentes con un carbono de por medio entre ellos (para las posiciones relativas 1 y 3), y para (p-) para dos sustituyentes opuestos el uno del otro (para las posiciones relativas 1 y 4). Cuando el benceno es empleado como sustituyente, es llamado el grupo fenilo. El benceno es el hidrocarburo aromático más simple. Compuestos aromáticos más complejos pueden verse como un número de anillos de benceno fusionados. FORMULA ESTRUCTURAL NOMBRE USO O EFECTO Naftaleno Material de partida para colorantes Antraceno Colorantes Fenantreno Colorante, explosivos y síntesis de drogas 3,4benzopireno Cancirogénico activo encontrado en el humo de cigarrillo y smog. Derivados monosustituidos del benceno se nombran de la misma forma que otros hidrocarburos pero usando benceno como nombre padre. Bencenos sustituidos por grupos alquilo se nombran de dos formas diferentes dependiendo del tamaño del grupo alquilo. Si el sustituyente es pequeño (seis átomos de carbono o menos) el compuesto se nombra como un benceno sustituido por el grupo alquilo, por ejemplo, etilbenceno. Si el sustituyente tiene CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 46 PGF03-R03 más de 6 carbonos, el compuesto se nombra como un alquilo sustituido por el benceno, por ejemplo, 2-fenildecano. Cuando el benceno se considera un sustituyente, se utiliza el nombre fenil en el nombre del compuesto. Existen también muchos otros compuestos con nombres comunes que son aceptados por la IUPAC. Algunos de ellos son los siguientes. Bencenos disustituidos se nombran utilizando los prefijos orto-, meta- y para- o simplemente o-, m- y p- como se ilustra a continuación: Bencenos con más de dos sustituyentes se nombran numerando la posición de cada sustituyente del anillo. La numeración se hace de tal forma que resulten los números más bajos posibles. Los Sustituyentes se listan alfabéticamente en el nombre del compuesto. También se puede usar como nombre padre del compuesto el nombre común de un benceno monosustituido (tolueno, fenol, anilina, etc.). En este caso, el sustituyente principal es el que le da el nombre CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 47 PGF03-R03 característico al compuesto; como -OH para el fenol y -NH2 para la anilina, y siempre recibe el índice 1. Note que nombres como bromobenceno y nitrobenceno (terminados en benceno) no se pueden usar de esta manera. A continuación se ilustran los nombres comunes de algunos compuestos aromáticos policíclicos: Reacciones químicas de los Arenos Dentro de las más representativas tenemos: Hidrogenación: R R + 3H2 ----------------------100 C / 100 atm CH3 CH3 + TOLUENO 3H2 ------------------------100 c/ 100 atm METIL CICLO HEXANO CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 48 PGF03-R03 Halogenación: CH3 + CH2X X2 -----------U.V. + HX CH – CH3 Cl. CH2CH3 + Cl2 -------------------U.V. ETIL BENCENO + HCl 2 CLORO ETIL BENCENO Oxidación con permanganato de potasio. KMnO4 CH3 C= O OH + KMnO4 CH3 --------------- C= O OH PARA DI METIL BENCENO ACIDO BENZOICO. Los fenoles ó Estructura química del fenol El fenol en forma pura es un sólido cristalino de color blanco-incoloro a temperatura ambiente. Su fórmula química es C6H5OH, y tiene un punto de fusión de 43ºC y un punto de ebullición de 182ºC.34. El fenol es un alcohol. Puede sintetizarse mediante la oxidación parcial del benceno. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 49 PGF03-R03 El fenol es una sustancia manufacturada. El producto comercial es un líquido. Tiene un olor repugnantemente dulce y alquitranado. Se puede detectar el sabor y el olor del fenol a niveles más bajos que los asociados con efectos nocivos. El fenol se evapora más lentamente que el agua y una pequeña cantidad puede formar una solución con agua. El fenol se inflama fácilmente, es corrosivo y sus gases son explosivos en contacto con la llama. El fenol se usa principalmente en la producción de resinas fenólicas. También se usa en la manufactura de nylon y otras fibras sintéticas.El fenol es muy utilizado en la industria química, farmacéutica y clínica como un potente fungicida, bactericida, antiséptico y desinfectante, También para producir agroquímicos, poli carbonatos, en el proceso de fabricación de ácido acetilsalicílico (aspirina) y en preparaciones médicas como enjuagadientes y pastillas para el dolor de garganta. De ser ingerido en altas concentraciones, puede causar envenenamiento, vómitos, decoloración de la piel e irritación respiratoria. Desafortunadamente es uno de los principales desechos de industrias carboníferas y petroquímicas; como consecuencia el fenol entra en contacto con cloro en fuentes de agua tratadas para consumo humano, y forma compuestos fenilclorados, muy solubles y citotóxicos por su facilidad para atravesar membranas celulares. Nylon Nylon Densidad 1150 kg/m³ Conductividad eléctrica(σ) 10-12 (m·ohm)-1 Conductividad térmica 0.25 W/(m·K) El nylon (de la marca comercial registrada: nylon, es un polímero artificial que pertenece al grupo de las poliamidas. Se genera formalmente por policondensación de un diácido con una diamina. El más conocido, el PA6.6 es por lo tanto el producto formal del ácido butandicarboxílico (ácido adipínico) y la hexametilendiamina. El descubridor del nylon y quien lo patentó primeramente fue Wallace Hume Carothers. A la muerte de éste, la empresa Du Pont conservó la patente. Los Laboratorios Du Pont, en 1938, produjeron esta fibra sintética fuerte y elástica, que reemplazaría en parte a la seda y el rayón. El nylon es una fibra textil elástica y resistente, no la ataca la polilla, no requiere de planchado y se utiliza en la confección de medias, tejidos y telas de punto, también cerdas y sedales. El nailon moldeado se utiliza como material duro en la fabricación de diversos utensilios, como mangos de cepillos, peines, etc. Con este invento, se revolucionó en 1938 el mercado de las medias, con la fabricación de las medias de nailon, pero pronto se hicieron muy difíciles de conseguir, porque al año siguiente los Estados Unidos entraron en la Segunda Guerra Mundial y el nylon fue necesario para hacer material de guerra, como cuerdas y paracaídas. Pero antes de las medias o de los CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 50 PGF03-R03 paracaídas, el primer producto de nylon fue el cepillo de dientes con cerdas de nylon. Las primeras partidas llegaron a Europa en 1945. Punto de fusión y solubilidad El nailon es soluble en fenol, cresol y ácido fórmico. Su punto de fusión es de 263 ºC. Comportamiento Es termoestable, ya que se deja fumar y disolver. Tiene una buena resistencia a los aceites, las grasas, los solventes y los álcalis pero no a los ácidos que le hidrolizan. Resistencia Química Compuesto Valor Alcoholes Buena Cetonas Buena Grasas y Aceites Mala Halógenos Mala Hidrocarburos Aromáticos Buena Resistencia Su viscosidad de fundido es muy baja, lo cual puede acarrear dificultades en la transformación industrial, y su exposición al intemperie puede causar una fragilización y un cambio de color salvo si hay estabilización o protección previa. Al nylon se le puede agregar fibra de vidrio para proporcionar un incremento en la rigidez. Es un polímero cristalino ya que se le da un tiempo para que se organice y se enfríe lentamente, siendo por esto muy resistente. Las cadenas de nylon con un número par de átomos de carbono entre los grupos amida son más compactas y sus puntos de fusión serán más altos que los nylon con un número impar de átomos de C. El punto de fusión disminuye y la resistencia al agua aumenta a medida que aumenta el número de grupos metileno entre los grupos amida. OH ONa + NaOH ------------Fenoxido de sodio ONa Cl + 3 Cl2 ------------------- Cl Cl OH + Cl2 ----------------CCl4 OH 2,4,6, Tricloro Fenol. OH OH Cl + Cl O – Cloro Fenol P- Cloro Fenol CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 51 PGF03-R03 1. Desarrolla los mentefactos conceptuales que se muestran a continuación. AROMATICOS CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 52 PGF03-R03 FENOLES 2. Construir las siguientes estructuras: a) 1-etil-2-butilbenceno b) Orto-clorobenceno c) 3-bromo-5-cloro-nitrobenceno d) Nitronaftaleno e) Para metil anilina f) Meta cloro fenol g) 2- metil - fenol 3. Asignar el nombre IUPAC a los siguientes derivados del benceno: CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 53 PGF03-R03 a. b. c. d. 4. Realizar las siguientes reacciones y nombrar los productos obtenidos: Tolueno + HNO3 ( en presencia de ácido sulfúrico como catalizador) Fenol + Br2 Tolueno + Cl2 Anilina + HNO3 ( en presencia de ácido sulfúrico como catalizador) PRUEBA ICFES 1. Se sabe que el radical -Br induce a las mismas posiciones que el radical -CH3. Es correcto afirmar que el radical metilo (-CH3) es un orientador: A. orto y meta B. meta y para C. para y orto D. orto, meta y para 2. De acuerdo con el procedimiento, la reacción que se debe llevar a cabo para la producción de nitrobenceno es CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 54 PGF03-R03 3. En el análisis de un hidrocarburo cíclico, se determinó que correspondía a la fórmula Molecular C6H12. De acuerdo con esto, su fórmula estructural es 4. Para sustituir el anillo aromático del tolueno es necesario: a. Oxidarlo. b. Halogenarlo. c. Hidrogenarlo. d. Acidificarlo. 5. Cuando se halógena un areno en presencia de luz ultravioleta el halógeno realiza: a. Desplazamiento. b. Sustitución. c. Combinación. d. Doble sustitución. 6. En la Oxidación del para dimetil benceno obtenemos. a. Acido benzoico. b. Acido Para benzoico. c. Acido Benzoato. d. Sal acida del benceno. 7. En la Obtención de un éter a partir de un fenol es necesario: a. Agregar una base + haluro de alquilo. b. Agregar un Acido + haluro de alquilo. c. Agregar una Base + Acido. d. Agregar un Acido + una sal. 8. A partir de un fenol para la obtención de un éter es necesario primero: a. Acidificarlo. b. Basificarlo. c. Obtener una sustancia neutra. d. No es necesario tener una medida de PH específica. 9. Las estructuras de resonancia del benceno fue dada por un químico de apellido Kekule. Dichas estructuras especifican: a. la posición del anillo aromático. b. La posición de los enlaces sigma. c. la posición de los dobles enlaces. d. la Posición de los carbonos en el anillo aromático. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 55 PGF03-R03 10. En la halogenación de un fenol en presencia de tetracloruro de carbono como catalizador ayuda a la formación de dos compuestos distintos los cuales presentan una posición determinante dentro del anillo aromático, la cual corresponde a. a. Orto. b. Meta c. Para. d. Orto y Para. 11. Nombre IUPAC del siguiente derivado del benceno a. b. c. d. 2-etil-1,4-dimetilbenceno 1,4-dimetil-2-etilbenceno ,4-dimetil-3-etilbenceno ,4-dimetil-3-etilbenceno 12. El compuesto a. b. c. d. aromático recibe el nombre de: o-yodoanilina o-yodonitrobenceno dibromoanilina yodobenceno 13. Estructura correspondiente al meta xileno: B A C D 14. La siguiente reacción se lleva a cabo bajo la adición de: a. b. c. d. Peróxido y un haluro de alquilo Haloácido y halógeno Agua y ácido Agua y halógeno CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 56 PGF03-R03 UNIDAD III GRUPOS FUNCIONALES Propósito: Identificar las propiedades físicas y químicas de los grupos funcionales orgánicos. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 57 PGF03-R03 GRUPOS FUNCIONALES Un grupo funcional es un átomo o grupo de átomos que le confieren a la molécula una forma especial de reaccionar. Para nombrar correctamente una molécula que contiene grupos funcionales lo primero que hay que hacer es identificarlos: Grupos funcionales más importantes Clase Grupo funcional alcanos ninguno alquenos C (homo) aromáticos C C Ejemplo CH3-CH3 Etano CH3CH=CH 2 C C Propeno CH3 C C C CH3 Tolueno (hetero) aromáticos alquinos haluros de alquilo C C C N C C C CH3 N 3-Metilpiridina CH3 N CH3C CCH3 2-Butino CH3CH2Br C -Cl, -Br, I, -F Bromuro de etilo OH alcoholes fenoles -OH CH3CH2OH Etanol éteres -O- Fenol CH3CH2OCH2CH3 Dietiléter CH3NH 2 aminas primarias NH2 Metilamina aminas secundarias NH (CH3)2NH Dimetilamina aminas terciarias N tioles -SH (CH3)3N Trimetilamina CH3CH2SH Etiltiol CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 58 PGF03-R03 sulfuros -S- aldehídos O C ésteres amidas haluros de acilo anhídridos Dimetilsulfuro CH3COH Etanal H O C cetonas ácidos carboxílicos (CH3)2S O C O C O C CH3COCH3 Propanona CH3COOH Acido acético OH CH3COOCH2CH3 Acetato de etilo O CH3CONH 2 N Acetamida O C X X=Cl, Br, I O O C C O nitrilos -C N nitroderivados -NO2 CH3COCl Cloruro de acetilo CH3COOCOCH 3 Anhidrido acético CH3CN Acetonitrilo CH3NO 2 Nitrometano Una vez reconocidos los grupos funcionales que contiene una molécula hay que determinar cuál es la función principal, según el siguiente orden: ORDEN DE PREFERENCIA (PRIORIDAD) 1.- Ácidos (carboxílicos > sulfónicos) 2.- Derivados de ácidos (anhídridos > ésteres > haluros de acilo > amidas > nitrilos) 3.- Aldehídos > cetonas 4.- Alcoholes > fenoles > tioles 5.- Aminas 6.- Éteres > tioéteres 7.- Alquenos > alquinos 8.- Halogenuros de alquilo La función principal determina: El nombre del compuesto La cadena carbonada principal, que debe ser la más larga posible que contenga la función principal Los números localizadores de los sustituyentes y funciones secundarias CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 59 PGF03-R03 NOMENCLATURA DE LOS GRUPOS FUNCIONALES Clase alcoholes, fenoles Principal (P) Secundaria (S) Ejemplos CH3CH2OH (P) etanol OH -ol -hidroxiN (S) 4-hidroxipiridina O H3CH2C CH2CH3 (P) dietil éter OCH3 éteres éter -oxi-, (S) metoxibenceno aminas primarias aminas secundarias CH3CH2NH2 (P) etilamina -amina -aminoHOCH2CH2NH2 (S) 2-aminoetanol -amina -dialquilamino- H N H3CH2C CH2CH3 (P) dietilamina HOCH2CH2N CH3 CH3 aminas terciarias (S)2-dimetilaminoetanol CH2CH3 CH3CH2N CH2CH3 -amina (P) trietilamina O H3 C C H (P) etanal O C aldehídos -al carbaldehído -formil- H (P) ciclohexano carbaldehído C O OH C H O (S) ácido 4-formilbenzoico O cetonas -ona cetona -alcanoil-oxo- H3 C C CH3 (P) propanona O H3 C C CH3 (P) dimetilcetona CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 60 PGF03-R03 C O OH C CH3 O (S) ácido 4-etanoilbenzoico O O H3C C H2C C OH (S) ácido 3-oxobutanoico ácidos carboxílicos ácido... -oico -carboxi- O H3C C OH (P) ácido etanoico O H3C C O CH2CH3 ésteres -ato de -ilo (P) acetato de etilo O H3C C H2 O O C C OH -alcoxicarbonil- (S) ácido etoxicarbonilacético O H3C C NH2 (P) etanamida SO3H amidas -amida -carbamoilO N H CH3 (S) ácido 3-carbamoilbencenosulfónico H3C C N (P) etanonitrilo OH nitrilo -nitrilo -ciano- C N (S) 2-cianociclohexanol nitroderivados -nitro- O O N CH2CH2OH (S) 2-nitroetanol CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 61 PGF03-R03 ALCOHOLES En química se denomina alcohol (del árabe al-khwl لوحكلا, o al-ghawl لوغلا, "el espíritu", "toda sustancia pulverizada", "líquido destilado") (ver origen del término en la desambiguación) a aquellos hidrocarburos saturados, o alcanos que contienen un grupo hidroxilo (-OH) en sustitución de un átomo de hidrógeno enlazado de forma covalente. Los alcoholes pueden ser primarios, secundarios, o terciarios, en función del número de átomos de hidrógeno sustituidos en el átomo de carbono al que se encuentran enlazado el grupo hidroxilo. A nivel del lenguaje popular se utiliza para indicar comúnmente a una Bebida alcohólica, que presenta etanol. Historia La palabra alcohol proviene del árabe «al» (el) y «kohol» que significa «sutil». No se tienen referencias claras, pero se cree que el descubridor de este compuesto pudo haber sido el alquimista Marco Vinicio Gómez G. Derivado de Alcoholes Primarios metano H4C metanol H3C-OH etano H3C-CH3 etanol H3C-CH2-OH propano H3C-CH2-CH3 propan-1-ol H3C-CH2-CH2-OH propeno metilpropano (H3C)2=CH-H3C prop-1-en-1-ol H3C-CH=CH-OH prop-2-en-1-ol H2C=CH-H2C-OH Secundarios Terciarios propan-2-ol H3C-CH(OH)-CH3 prop-1-en-2-ol H3C-C(OH)=CH2 metilpropan-1-ol (H3C)2=CH-H2C-OH metilpropan-2-ol (H3C)3≡C-OH NOMENCLATURA DE ALCOHOLES Común (no sistemática): anteponiendo la palabra alcohol y sustituyendo el sufijo -ano del correspondiente alcano por -ílico. Así por ejemplo tendríamos alcohol metílico, alcohol etílico, alcohol propílico, etc. IUPAC: sustiyendo el sufijo -ano por -ol en el nombre del alcano progenitor, e identificando la posición del átomo del carbono al que se encuentra enlazado el grupo hidroxilo. Cuando la molécula alcohólica es sustituyente, se emplea el prefijo hidroxiSu punto de ebullición es 110 grados Celsius Formulación Los alcoholes responden a la fórmula general CnH2n+1OH CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 62 PGF03-R03 Propiedades generales Los alcoholes primarios y secundarios son líquidos incoloros y de olor agradable, solubles en el agua en cualquier proporción y menos densos que ella. Los terciarios en cambio son todos líquidos. ALCOHOLES PRIMARIO: CH3OH SECUNDARIO: CH3 – CH – OH CH3 TERCIARIO: OH CH3 – C – CH3 CH3 Fuentes Muchos alcoholes pueden ser creados por fermentación de frutas o granos con levadura, Pero solamente el etanol es producido comercialmente de esta manera, Principalmente como combustible y como bebida. Otros alcoholes son generalmente producidos como derivados sintéticos del gas natural o del petróleo. Usos Los alcoholes tienen una gran gama de usos en la industria y en la ciencia como solventes y combustibles. El etanol y el metanol pueden hacerse combustionar de una manera más limpia que la gasolina o el gasoil. Por su baja toxicidad y disponibilidad para disolver sustancias no polares, el etanol es utilizado frecuentemente como solvente en fármacos, perfumes y en esencias vitales como la vainilla. Los alcoholes sirven frecuentemente como versátiles intermediarios en la síntesis orgánica. REACIONES DE LOS ALCOHOLES: Existen tres reacciones principales a) Adicion de haloácidos: Los Alcoholes primarios, secundarios y terciarios forman halogenuros de alquilo cuando reaccionan con HI, HBr o HCl. Por lo general, cuando se usa HCl se le añade ZnCl 2 (reactivo de Lucas), para acelerar la reacción. Esterificación Los ésteres se obtienen por reacción de ácidos carboxílicos y alcoholes en presencia de ácidos minerales. La reacción se realiza en exceso de alcohol para desplazar los equilibrios a la derecha. La presencia de agua es perjudicial puesto que hidroliza el éster formado. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 63 PGF03-R03 OXIDACIÓN: Los alcoholes primarios pueden oxidarse a aldehídos y los alcoholes secundarios, a cetonas. Estas oxidaciones se presentan en la forma siguiente: Los alcoholes terciarios no se oxidan, pues no hay hidrógeno que pueda eliminarse del carbono que soporta el grupo hidroxilo Las oxidaciones de los alcoholes primarios metanol y etanol, por calentamiento a 50º C con dicromato de potasio acidificado ( K2Cr2O7) producen formaldehído y acetaldehído, respectivamente: CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 64 PGF03-R03 OBTENCION DE ALCOHOLES. LiAlH4 R – C = O -------------------Hidruro de litio H y Aluminio. Aldehído R – CH2OH Ejemplo: CH3 CH2C = 0 -------------------LiAlH4 H R–C= 0 R Cetona ---------------LiAlH4 CH3 – CH2 – CH2OH . Propanol. R – CH – R Alcohol Secundario. OH Ejemplo: CH3 – C = 0 ----------------LiAlH4 CH3 – CH – CH3 . CH3 2 – Propanol. OH Propanona OH R – C = C – R + H2O --------- R – CH – C – R R – C – X ------------- R – C – OH + NaX CH3 – CH = CH2 + H2O ------- CH3 – CH NaOH Propeno. OH ADICION DE UNA BASE A UN ALCANO HALOGENADO CH2 H 2 Propanol. REGLA MARKOVNIKOVV. Ejemplo: NaOH CH3CH2CH2Br _________ CH3 CH2 CH2 OH + NaBr H2o R R – C = O + RMgX ____ R-C- O MgX _____ R – C- OH H H REACTIVO DE GRIGNARD A UN ALDEHIDO EJEMPLO: CH3 H2O CH3C=O + CH3MgCl _____ CH3 - C – O – MgCl ______ CH3CH – OH H H ETANALDEHIDO 2 PROPANOL CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 65 PGF03-R03 H CH3 H2O HC = O + CH3MgCl _____ H – C – O MgCl ______ H – CH – OH H METANAL 2 PROPANOL. R R R – C – R + RMgX ________ R – C – O Mg X _______ R – C - OH. O R R REACTIVO DE GRIGNARD A UNA CETONA EJEMPLO: CH3 H2O CH3CH2CCH3 + CH3MgBr ____ CH3CH2C – O- MgBr ______ CH3CH2C-OH +MgBr(OH) O CH3 CH3 CH3 2 BUTANONA 2 METIL 2 BUTANOL ALDEHIDOS Y CETONAS. RACTERIZA POR LA PRES CENCIA DE UN GRUPO – C = O 1.SE CA Desarrolla elNsiguiente mentefacto conceptual: R–C=O R –C–R H ALDEHIDO. O CETONA ALCOHOLES 2.Dibuje la estructura de los siguientes alcoholes. a. b. c. d. e. EtanoL Butanol 1,3-propanodiol 2,4-pentanodiol 1,2,3-butanotriol CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 66 PGF03-R03 f. g. h. i. j. k. l. m. n. o. p. q. 2-propanol 2-metil-2-propanol 1,4-butanodiol 1,2,3-propanotriol 1,2,4-butanotriol 2-propanol. 2-metil-2-butanol 1,2,4-pentanotriol 1,2-Ciclohexanodiol 2-propen-1-ol ciclobutanol 2-Iodo-3-heptin-1-ol r. 2-butenol 5. Completar las siguientes reacciones : a) 1,2 Pentanodiol + 2HBr b) 2- hexanol KMnO4 c) 1- butanol + ácido pentanoico d) 2-pentanol+ HBr e) 1- hexanol K2Cr2O7 f) 3- octanol KMnO4 g) 1- butanol + ácido hexanoico h) 1- heptanol K2Cr2O7 i) 1,2 Pentanodiol + 2HBr j) 2- pentanol + HCl k) + CH3MgBr s. 4. Escriba la estructura o el nombre según corresponda para los siguientes compuestos. Comprueba sus resultados en la sección de respuestas al final del capítulo. a) 4-cloro-3-isopropil-1-pentanol b) 2-metil-4-etil-4-heptanol c) 4-isobutil-4-n-propil-3-octanol d) Alcohol terbutílico e) 4-bromo-2-sec-butil-1-butanol f) g) CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 67 PGF03-R03 h) i) j) ALDEHÍDOS Y CETONAS L os aldehídos son compuestos de fórmula general RCHO; las cetonas son compuestos de fórmula general RR'CO. Los grupos R pueden ser alifáticos o aromáticos. Los aldehídos y las cetonas se caracterizan por poseer el grupo carbonilo: CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 68 PGF03-R03 ALDEHÍDOS Nomenclatura La nomenclatura sistemática de los aldehídos es obtenida del alcano correspondiente reemplazando la terminación -o por la terminación -al. Cuando el grupo CHO es sustituyente se utiliza el prefijo formil-.También se utiliza el prefijo formil- cuando hay tres o más funciones aldehídos sobre el mismo compuesto. En esos casos se puede utilizar otro sistema de nomenclatura que consiste en dar el nombre de carbaldehído a los grupos CHO (los carbonos de esos CHO no se numeran, se considera que no forman parte de la cadena). Este último sistema es el idóneo para compuestos con grupos CHO unidos directamente a ciclos. Nomenclatura de Aldehídos El sistema de nomenclatura corriente consiste en emplear el nombre del alcano correspondiente terminado en -al. Cuando el grupo CHO es sustituyente se utiliza el prefijo formil-. También se utiliza el prefijo formil- cuando hay tres o más funciones aldehídos sobre el mismo compuesto .En esos casos se puede utilizar otro sistema de nomenclatura que consiste en dar el nombre de carbaldehído a los grupos CHO (los carbonos de esos CHO no se numeran, se considera que no forman parte de la cadena).Este último sistema es el idóneo para compuestos con grupos CHO unidos directamente a ciclos. CETONAS Para nombrar los cetonas tenemos dos alternativas: 1. El nombre del hidrocarburo del que procede terminado en -ona .Como sustituyente debe emplearse el prefijo oxo-. 2. Citar los dos radicales que están unidos al grupo carbonilo por orden alfabético y a continuación la palabra cetona. Propiedades físicas Los compuestos carbonílicos presentan puntos de ebullición más bajos que los alcoholes de su mismo peso molecular.No hay grandes diferencias entre los puntos de ebullición de aldehídos y cetonas de igual peso molecular. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 69 PGF03-R03 Los compuestos carbonílicos de cadena corta son solubles en agua y a medida que aumenta la longitud de la cadena disminuye la solubilidad. Síntesis Ozonólisis de alquenos Tratamiento con KMnO4 en caliente de alquenos.Este método sólo es válido para la preparación de cetonas. Hidratación de alquinos Hidroboración-oxidación de alquinos Acilación de Friedel-Crafts del Benceno Oxidación de alcoholes Reacciones La reacciones de los aldehídos y cetonas son esencialmente : Oxidación Reducción Hidruro Hidrogenación Reducción de Clemmensen Reacción de Wolff-Kishner CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 70 PGF03-R03 1. Desarrolla el siguiente mentefactos conceptuales y sustente según indique el profesor CETONAS ALDEHIDOS 2. Dibuje la estructura de los siguientes compuestos. a. Etanal b. Butanal c. Propanodial d. 5-etil-2,6-heptadienal e. 3-etil-2-metilhexanal f. Benzaldehido g. 2-propenal h. 3-fenil-2-propenal i. 2-butinodial j. 4-fenil-2-pentinal k. 2-metil-3-pentanona l. 3-pentanona m. 4-metil-2-pentanona n. Butanona CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 71 PGF03-R03 o. p. q. r. s. 1,4-heptadien-3-ona 2,4,7-octanotriona 1-hepten-5-in-3-ona 4-metil-2-ciclohexenona 2-propanona. 2-metilbutanal 3. Escriba el nombre de los siguientes compuestos. f. CHO-CH2-CHO g. CHO-CH=CH-CH2-CH(-CH2-CH3)-CH=CH2 h. CHO-CH(CH3)-CH(CH3-CH2)-CH2-CH2-CH3 i. C6H5-CHO j. CHO-CH=CH2 k. CHO-CH=CH(C6H5) l. CHO-C≡C-CHO m. CHO-C≡C-CH(C6H5)-CH3 n. CH3-CH(CH3)-CO-CH2-CH3 o. CH3-CH2-CO-CH2-CH3 p. CH3-CH(CH3)-CH2-CO-CH3 q. CH3-CH2-CO-CH3 r. CH2=CH-CO-CH=CH-CH2-CH3 s CH3-CO-CH2-CO-CH2-CH2-CO-CH3 t. CH2=CH-CO-CH2-C≡C-CH3 4. Completar las siguientes reacciones. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 72 PGF03-R03 e) (CH3)2 C = O + AlH4 -----> f) CH3 - CH2 - CHO + H2CrO4 -----> g) Ar - CHO + -OH -----> LAS AMINAS Las aminas son compuestos químicos orgánicos que se consideran como derivados del amoniaco y resultan de la sustitución de los hidrógenos de la molécula por los radicales alquilo. Según se sustituyan uno, dos o tres hidrógenos, las aminas serán primarios, secundarios o terciarios, respectivamente. Amoniaco Amina primaria Amina secundaria Amina terciaria O también Las aminas son simples cuando los grupos alquilo son iguales y mixtas si estos son diferentes Las aminas son compuestos muy polares. Las aminas primarias y secundarias pueden formar puentes de hidrógeno. Las aminas terciarias puras no pueden formar puentes de hidrógeno, sin embargo pueden aceptar puentes de hidrógeno con moléculas que tengan enlaces O-H o N-H. Como el nitrógeno es menos electronegativo que el oxígeno, el enlace N-H es menos polar que el enlace O-H. Por lo tanto, las aminas forman puentes de hidrógeno más débiles que los alcoholes de pesos moleculares semejantes. Las aminas primarias y secundarias tienen puntos de ebullición menores que los de los alcoholes, pero mayores que los de los éteres de peso molecular semejante. Las aminas terciarias, sin puentes de hidrógeno, tienen puntos de ebullición más bajos que las aminas primarias y secundarias de pesos moleculares semejantes. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 73 PGF03-R03 Ejemplos de aminas Los aminoácidos contienen un grupo amino y un grupo carboxilo enlazado al mismo átomo de carbono. Los aminoácidos se enlazan entre sí a través de estos dos grupos dando un enlace amida formando las proteínas. En un extremo queda un grupo amino Terminal. Como consecuencia de los procesos de degradación, las proteínas se descomponen dando distintas aminas. Por ejemplo, la 1,5-pentanodiamina (cadaverina), el escatol (un compuesto heterocíclico), la 1,4-butanodiamina (putrescina), etcétera. Estructura de la morfina Los alcaloides son compuestos complejos que se encuentran en las plantas y contienen grupos amina. Algunos ejemplos son la morfina, la nicotina, etc. Algunas aminas son biológicamente importantes. La adrenalina, la noradrenalina, la mescalina, etc., son compuestos similares llamados β-fenilTambién están las aminas heterocíclicas, compuestos con elevada actividad mutagénica generados durante el procesado térmico de alimentos proteicos. Nomenclatura de las Aminas Las aminas se clasifican de acuerdo con el número de átomos de hidrógeno del amoniaco que se sustituyen por grupos orgánicos, los que tienen un solo grupo se llaman aminas primarias, los que tienen dos se llaman aminas secundarias y terciarias. Cuando se usan los prefijos di, tri, se indica si es una amina secundaria y terciaria, respectivamente, con grupos o radicales iguales. Cuando se trata de grupos diferentes a estos se nombran empezando por los más pequeños y terminando con el mayor al que se le agrega la terminación amina. Algunas veces se indica el prefijo amino indicando la posición, más el nombre del hidrocarburo. Las aminas comprenden algunos de los compuestos biológicos más importantes que se conocen. Ellas funcionan en los organismos vivos como biorreguladores, neurotransmisores, en mecanismos de defensa y en muchas otras funcionesmás. Debido a su alto grado de actividad biológica muchas aminas se emplean como medicamentos. A continuación, se muestran las estructuras y los usos de algunas aminas biológicamente activas. Cadaverina La cadaverina (o 1,5-diaminopentano; o pentametilenodiamina pentano-1,5-diamina; o C5H14N2) es una amina biogénica que se obtiene por la descomposición del aminoácido lisina. Se encuentra principalmente en la materia orgánica muerta, y es responsable en parte del fuerte olor a descompuesto.La formación de la cadaverina se esquematiza de la siguiente manera:(NH2)- (CH2)4-CH (COOH)-NH2 (Lisina) => NH2-(CH2)5-NH2 (Cadaverina) Putrescina Putrescina Nombre químico 1,4-diaminobutano Otros nombres tetrametilenodiamina CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 74 PGF03-R03 butano-1,4-diamina Fórmula química C4H12N2 Masa molecular 88.15 g/mol Número CAS [110-60-1] Densidad 0.877 g/cm3 Punto de fusión 27 °C Punto de ebullición 158-160 °C SMILES C(N)CCCN La Putrescina es un compuesto químico orgánico NH2(CH2)4NH2 (1,4-diaminobutano o butanodiamina) que se crea al pudrirse la carne, dándole además su olor característico. Está relacionada con la cadaverina; ambos se forman por la descomposición de los aminoácidos en organismos vivos y muertos. La putrescina es producida en pequeñas cantidades por las células vivas gracias a la acción de la ornitina-descarboxilasa. Las poliaminas, de las que la putrescina es uno de los ejemplos más simples, parecen ser factores de crecimiento necesarios para la división celular. Otros compuestos químicos que se caracterizan por su mal olor son el metanotiol y el ácido butírico. Ejemplos: CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 75 PGF03-R03 La adrenalina y la noradrenalina son dos hormonas secretadas en la médula de la glándula adrenal y liberadas en el torrente sanguíneo cuando un animal se siente en peligro. La adrenalina causa un aumento de la presión arterial y de las palpitaciones, lo que prepara al animal para la lucha. La noradrenalina también causa un incremento de la presión arterial y está implicada en la transmisión de los impulsos nerviosos. La dopamina y la serotonina son neurotransmisores que se encuentran en el cerebro. Los niveles anormales de dopamina se asocian con muchos desórdenes pisquiátricos, incluyendo la enfermedad de Parkinson. La esquizofrenia se debe a la presencia de niveles anormales de serotonina en el cerebro. La acetilcolina es una molécula pequeña e iónica y por tanto altamente soluble en agua. Las moléculas de acetilcolina son liberadas por la membrana presináptica en grupos de 104 moléculas, difundiéndose en la región de contacto entre las prolongaciones nerviosas de dos neuronas adyacentes y dando lugar a la transmisión del impulso nervioso de una célula nerviosa a otra. Los alcaloides son un grupo importante de aminas biológicamente activas, que son biosintetizadas por algunas plantas para protegerse de insectos y otros animales depredadores. A continuación, se indican las estructuras de algunos alcaloides representativos. Aunque en medicina se utilizan algunos alcaloides, principalmente como analgésicos, todos son tóxicos y causan la muerte si se ingieren en grandes cantidades. El filósofo griego Sócrates fue envenenado con coniina (cicuta). Los casos benignos de intoxicación por alcaloides pueden producir alucinaciones o efectos psicológicos que se asemejan a la tranquilidad o a la euforia. El alcaloide histrionicotoxina se encuentra en la piel de unas ranas que habitan en la selva amazónica colombiana. La histrionicotoxina provoca la muerte por parálisis de los músculos respiratorios CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 76 PGF03-R03 1. Desarrolla y explica de forma oral el siguiente mentefacto conceptual AMINAS 2. ¿Qué diferencia existe entre aminas y amidas? 3. ¿Qué importancia biológica presentan las aminas? 4. En que difiere la estructura de la adrenalina y noradrenalina. 5. Dibuje la estructura de las siguientes aminas. a) 1,2-propildiamina. b) 1,2,3-triaminobenceno. 6. Ordene las siguientes aminas de acuerdo a su temperatura de ebullición. a) etilamina b) dimetilamina c) dietilamina d) n-propilamina e) isopropilamina 7. Escriba el nombre IUPAC de las siguientes aminas. CH2 - NH2 | a) CH2 - NH2 CH2 - NH2 | CH2 | b) CH2 - NH2 CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 77 PGF03-R03 8. Complete el siguiente cuadro: AMINA ESTRUCTURA CARACTERISTICA CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 78 PGF03-R03 LAS AMIDAS Fórmula general para las amidas Una amida es un compuesto orgánico cuyo grupo funcional es del tipo RCONR'R'', siendo CO un carbonilo, N un átomo de nitrógeno, y R, R' y R'' radicales orgánicos o átomos de hidrógeno: Se puede considerar como un derivado de un ácido carboxílico por sustitución del grupo —OH del ácido por un grupo —NH2, —NHR o —NRR' (llamado grupo amino). Formalmente también se pueden considerar derivados del amoníaco, de una amina primaria o de una amina secundaria por sustitución de un hidrógeno por un radical ácido, dando lugar a una amida primaria, secundaria o terciaria, respectivamente. Concretamente se pueden sintetizar a partir de un ácido carboxílico y una amina: Todas las amidas, excepto la primera de la serie, son sólidas a temperatura ambiente y sus puntos de ebullición son elevados, más altos que los de los ácidos correspondientes Presentan excelentes propiedades disolventes y son bases muy débiles. Uno de los principales métodos de obtención de estos compuestos consiste en hacer reaccionar el amoníaco (o aminas primarias o secundarias) con ésteres. Las amidas son comunes en la naturaleza, y una de las más conocidas es la urea, una diamida que no contiene hidrocarburos. Las proteínas y los péptidos están formados por amidas. Un ejemplo de poliamida de cadena larga es el nailon. Las amidas también se utilizan mucho en la industria farmacéutica. NOMENCLATURA DE AMIDAS: Las amidas se nombran como derivados de ácidos carboxílicos sustituyendo la terminación oico del ácido por -amida. SÍNTESIS DE AMIDAS CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 79 PGF03-R03 a) Las amidas se pueden obtener por reacción de aminas con haluros de alcanoílo y anhídridos. El cloruro de etanoílo reacciona con dos equivalentes de metilamina para formar etanamida. El segundo equivalente de amina se emplea para recoger el ácido clorhídrido y favorecer los equilibrios. El anhídrido etanoico reacciona con amoniaco formando etanamina y ácido etanoico Las lactamas son amidas cíclicas obtenidas por condensación, con pérdida de agua, de una molécula que contiene grupo ácido y amino. El ácido 4-(aminometil)butanoico [1] condensa bajo calefacción para formar N-metilpirrolidin2-ona [2], un disolvente aprótico polar. Las imidas son compuestos que contienen dos grupos acilo unidos a un nitrógeno mediante enlaces simples. Son muy conocidas la Succinimida y la Ftalimida Las amidas se hidrolizan en medios ácidos, bajo calefacción, formando aminas y ácidos carboxílicos. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 80 PGF03-R03 La etanamida [1] se hidroliza en medio sulfúrico para formar el ácido etanoico [2]. Las amidas se transforman en aminas y ácidos carboxílicos por tratamiento con sosa acuosa bajo calefacción. (Hidrólisis básica de amidas) La etanamida [1] se hidroliza en presencia de sosa acuosa, para formar etanoato de sodio [2]. Reducción de Amidas a Aminas El hidruro de litio y aluminio reduce las amidas a aminas. 1. consulta 10 aplicaciones de las amidas a nivel industrial 2. desarrolla el siguiente mentefacto conceptual y sustenta de forma oral, según indique el profesor: AMIDAS 2. Dibuja la estructura de las siguientes amidas a) Metanamida b) Butanamida c) N,N-Dimetiletanamida d) Benzamida e) Propanodiamida i) Butanodiamida l) Etanodiamida CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 81 PGF03-R03 ÉTERES Los éteres son compuestos con la formula general R-O-R, Ar-O-R o Ar-O-Ar. Presentan el grupo funcional -O-. Nomenclatura Para nombrar los éteres tenemos dos alternativas: 1. Considerar el grupo alcoxi como un sustituyente (siendo R el radical más sencillo). 2. Citar los dos radicales que están unidos al O por orden alfabético y a continuación la palabra éter. Un caso particular de éteres son los epóxidos, cuyo esquema es el siguiente: Para nombrarlos se utiliza el prefijo epoxi- seguido del nombre del hidrocarburo correspondiente, e indicando los carbonos a los que está unido el O, con dos localizadores lo más bajos posibles, en caso de que sea necesario CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 82 PGF03-R03 Propiedades Debido a que el ángulo de enlace C-O-C es diferente de 180º, los momentos dipolares de los dos enlaces C-O no se anulan; en otras palabras, los éteres presentan un pequeño momento dipolar. Este pequeño momento dipolar neto no afecta en gran medida sus propiedades físicas, como el punto de ebullición que es comparable a los de los alcanos de pesos moleculares comparables. Los éteres no pueden formar enlaces mediante puentes de hidrógeno, lo que hace que estos compuestos tengan puntos de ebullición más bajos que los alcoholes de mismo peso molecular. Los éteres de cadena corta son solubles en agua. A medida que aumenta la longitud de la cadena diminuye la solubilidad. Los éteres son muy poco reactivos, a excepción de los epóxidos, por lo que se utilizan como disolventes. Los éteres alifáticos inferiores se convierten lentamente en peróxidos al contacto con el aire. Aunque están presentes en concentraciones bajas, estos peróxidos son muy peligrosos por su capacidad de producir explosiones violentas durante las destilaciones que normalmente siguen a las extracciones con éter. Dicha presencia se puede detectar por la formación de una coloración roja al agitar el éter con una solución acuosa de sulfato ferroso - amónico y tío cianato de potasio; el peróxido oxida el ión ferroso a férrico, reaccionando éste con el tío cianato para dar el color rojo sangre característico del ión complejo. La manera más fácil de eliminar los peróxidos de los éteres es destilarlo con ácido sulfúrico concentrado (el cual oxida a los peróxidos). Síntesis Los éteres son preparados para ser empleados como solventes. El más importante es el dietil éter. Los éteres se preparan por reacción de los alcoholes correspondientes con ácido sulfúrico. Al deshidratarse las dos moléculas de alcohol se debe de controlar las condiciones de reacción para evitar que la deshidratación llegue hasta el alqueno. De esta manera se preparan éteres simétricos. Síntesis de Williamson La síntesis de Williamson implica la sustitución nucleofílica de un ión alcóxido o fenóxido por un Ion halogenuro. En general, no es recomendable emplear halogenuros de arilo, debido a su poca reactividad hacia la sustitución. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 83 PGF03-R03 Reacciones L L os éteres no son reactivos a excepción de los epóxidos. La unión éter es muy estable en relación con las bases, los agentes oxidantes y los reductores. Los éteres sólo dan un tipo de reacción, la escisión por ácidos: as reacciones de los epóxidos pasan por la apertura del ciclo. Generando un alcohol primario si es catalizada por ácidos o un alcohol secundario si es catalizada por bases. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 84 PGF03-R03 1. desarrolla el siguiente mentefacto conceptual sobre ésteres ETERES 2. Escriba el nombre que corresponda a las siguientes estructuras. Señale la cadena principal y su numeración. a) b) c) d) e) F) CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 85 PGF03-R03 g) h) i) k) L) m) o) p) ÁCIDOS CARBOXÍLICOS Y DERIVADOS Los ácidos carboxílicos están caracterizados por contener el grupo carboxilo: y presentan la fórmula general RCOOH. Generalmente son ácidos débiles en solución acuosa. Nomenclatura de Ácidos carboxílicos. Cuando el grupo carboxilo es la función principal se antepone la palabra ácido al nombre del alcano correspondiente, cambiando la terminación - ano por -oico. La posición de un sustituyente se indica de la manera usual. Se debe apreciar que el carbono carbonílico siempre es considerado como C - 1. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 86 PGF03-R03 Cuando en un compuesto hay tres o más grupos COOH y en caso de ácidos cíclicos se utiliza el sufijo -carboxílico. Cuando el grupo COOH se considera como sustituyente se utiliza el prefijo carboxi- . Sales de ácidos carboxílicos: Se elimina la palabra ácido y se sustituye la terminación -ico del ácido por la terminación -ato. En caso de que se haya utilizado el sufijo -carboxílico para nombrar el ácido se sustituye, se reemplaza por -carboxilato; a continuación el nombre del metal correspondiente. Propiedades de los ácidos carboxílicos Trátese de un grupo alifático o aromático, saturado o no, sustituído o no, las propiedades del grupo carboxilo son esencialmente las mismas. Los ácidos carboxílicos son compuestos polares, y al igual que los alcoholes pueden formar puentes de hidrógeno entre sí y con otros tipos de moléculas. Los compuestos carboxílicos que tengan enlaces O - H ó N - H (pueden formar enlaces mediante puentes de H) tendrán un punto de ebullición más elevado que aquellos que no posean esos enlaces. Los ácidos carboxílicos se comportan de manera similar a los alcoholes en cuanto a sus solubilidades: los primeros son miscibles con agua, el ácido de cinco carbonos es parcialmente soluble y los superiores son virtualmente insolubles. El ácido benzóico, el más simple de los aromáticos, contiene demasiados átomos de carbono como para tener una solubilidad apreciable en agua. Los ácidos carboxílicos son solubles en solventes orgánicos menos polares, como éter, alcohol, benceno, etc. Los ácidos carboxílicos poseen puntos de ebullición superiores a los de los alcoholes respectivos debido a que un par de moléculas del ácido carboxílico se mantienen unidas no por un puente de hidrógeno, sino por dos: CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 87 PGF03-R03 La principal característica de los ácidos carboxílicos, como su propio nombre indica, es la acidez. Por lo que forman sales con gran facilidad. Al igual que todas las sales son sólidos cristalinos no volátiles, constituidos por iones positivos y negativos. Las sales de los metales alcalinos de los ácidos carboxílicos son solubles en agua, pero no en disolventes no polares; la mayoría de las sales de los metales pesados son insolubles en agua. Los olores de los ácidos alifáticos inferiores progresan desde los fuerte e irritantes del fórmico y el acético, hasta los abiertamente desagradables del butírico, valeriánico y capróico. Los superiores tienen muy poco olor debido a sus bajas volatilidades. Síntesis de ácidos carboxílicos La oxidación es el método más directo. Algunos ácidos alifáticos inferiores se hacen con los alcoholes disponibles, y los ácidos aromáticos sustituidos, con toluenos sustituidos. Oxidación de alcoholes primarios Oxidación de alquilbencenos CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 88 PGF03-R03 Carbonatación de reactivos de Grignard Posee la ventaja de alargar la cadena de átomos de carbono, por lo que se amplía el intervalo de materiales disponibles. Hidrólisis de nitrilos Los nitrilos alifáticos se preparan por tratamiento de halogenuros de alquilo primarios con cianuro de sodio en un disolvente que disuelva ambos reactivos. En dimetilsulfóxido, la reacción se realiza a temperatura ambiente con rapidez y exotérmicamente. Luego se hidroliza el nitrilo resultante, hirviendo con ácido o con un álcali acuoso para generar el ácido. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 89 PGF03-R03 En la serie alifática, tanto los reactivos de Grignard como los nitrilos se preparan con halogenuros, los cuales son preparados a partir de alcoholes, reduciendo las síntesis por reactivos de Grignard y de nitrilos a la preparación de ácidos partiendo de alcoholes que tienen un átomo de carbono menos. Reacciones Los ácidos carboxílicos deben en gran medida su reactividad al grupo carbonilo. Veremos que la mayor parte de las reacciones involucra al grupo hidroxilo, -OH, aunque estas reacciones sólo son posibles con la presencia de su complemento el grupo carboxilo, C=O. El -OH de un ácido puede ser reemplazado por grupos X (formando halogenuros de ácido), OR' (formación de ésteres), o NH2 (formación de amidas). Estas sustancias se denominan derivados funcionales de ácidos y todas poseen el grupo acilo: Los derivados funcionales se convierten con facilidad en el ácido por simple hidrólisis, y a menudo también se interconvierten. Formación de sales Halogenación alfa de ácidos alifáticos La parte hidrocarbonada de un ácido alifático puede sufrir halogenación con radicales libres característica de los alcanos. Sin embargo, en presencia de una pequeña cantidad de fósforo, la halogenación se realiza exclusivamente en la posición alfa. Esta se llama reacción de Hell - Volhard - Zelinsky. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 90 PGF03-R03 Reducción Uno de los pocos agentes reductores capaces de reducir directamente un ácido a un alcohol es el hidruro de litio y aluminio, LiAlH4. ELERCITACIÓN 1. Desarrolla el siguiente mentefacto conceptual y sustenta según indique tu profesor: ACIDOS CARBOXILICOS 2. Dibuje la estructura de los siguientes ácidos carboxílicos. a) ácido 2-metilpropanoico. b) ácido 2-etilbutanoico CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 91 PGF03-R03 3. Ordene los siguientes ácidos carboxílicos de acuerdo a su temperatura de ebullición. a) ácido propiónico b) ácido acético c) ácido valérico d) ácido isobutírico e) ácido butírico 4. Indique el nombre IUPAC de los siguientes ácidos carboxílicos. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 92 PGF03-R03 5. Mostrar con que reactivos se puede sintetizar al ácido benzoico por oxidación de un alcohol primario, un aldehído, una metil cetona y un alquil benceno. ÉSTERES Los ácidos carboxílicos se convierten directamente a un éster al calentarlo con un alcohol en presencia de ácido mineral, por lo general ácido sulfúrico concentrado. La reversibilidad de la reacción es un inconveniente en la preparación directa de un éster a partir de un ácido; se prefiere prepararlo por la vía del cloruro de ácido. Oxidación La oxidación del alcohol implica la pérdida de hidrógenos a (los hidrógenos que acompañan al átomo de carbono que soporta el grupo funcional -OH). CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 93 PGF03-R03 Primario Se emplea Py (Piridina), para detener la oxidación en el aldehído y el conjunto C5H5NH+CrO3Cl- se denomina reactivo de Jones. Secundario Terciario Probablemente se deba a la ausencia de hidrógenos a. 1. Desarrolla el siguiente mentefacto conceptual y sustenta según indique el profesor: CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 94 PGF03-R03 ESTERES 2. Escriba las fórmulas de los siguientes compuestos: a) Etanoato de metilo. b) Hexanoato de propilo. c) Acetato de pentilo. d) Acetato de isopropilo. 3. ¿Cuál de los siguientes elementos es un éster?: 4.Asigne el nombre a los siguientes esteres: CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 95 PGF03-R03 NITRILOS NOMENCLATURA Si el grupo característico -CN forma parte de la cadena principal y es grupo principal se utiliza el sufijo -nitrilo. Si es grupo principal pero no forma parte de la cadena principal se utiliza el sufijo -carbo nitrilo. Si se considera como sustituyente se utiliza el prefijo ciano-. En la nomenclatura rádico - funcional se consideran derivados del ácido cianhídrico (HCN) denominándose como cianuros de alquilo. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 96 PROPIEDADES El hecho de que HCN sea un ácido muy débil, indica que el ión cianuro es una base fuerte, por lo que este ión fuertemente básico puede separa un ión hidrógeno; ocurriendo una eliminación o una sustitución. La eliminación es la reacción predominante con halogenuros terciarios produciendo alquenos. Incluso con halogenuros secundarios el rendimiento del producto de la sustitución es malo. Síntesis Los nitrilos alifáticos se preparan al hacer reaccionar halogenuros de alquilo primarios con cianuro de sodio en un disolvente adecuado como el dimetilsulfóxido. Reacciones Hidrólisis: sea en medio ácido o básico tenemos que: Reducción La reducción de nitrilos genera una amina primaria aumentando la longitud de la cadena carbonada en un átomo. PGF03-R03 EJERCITACIÓN 1. desarrolla el siguiente mentefacto conceptual y sustenta según indique tu profesor 2. Establecer el nombre a los siguientes compuestos: CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 98 PGF03-R03 3. Escribe las fórmulas estructurales de los siguientes nitrilos a) Metanonitrilo b) Benzonitrilo c) Ciclohexanocarbonitrilo d) Propanodinitrilo j) 2-Metilpentanonitrilo PREGUNTAS TIPO ICFES. O O || || CH3-C-CH2-CH2-CH-O-CH2 | CH3 1. De acuerdo con su estructura molecular, este compuesto se caracteriza por presentar propiedades químicas de A. un éster y un aldehído B. una cetona y un éster C. un aldehído y un éster D. una cetona y un éter Responde las preguntas 2 y 3 de acuerdo con la siguiente información La siguiente ecuación representa la hidrólisis de ésteres 2. A partir de la hidrólisis de un éster de fórmula molecular C6H12O2, se obtiene un ácido R y un alcohol M . Cuando se oxida el alcohol M, se forma un ácido idéntico al ácido R. De acuerdo con esto, es válido suponer que el nombre del éster es A. propanoato de isopropilo B. butanoato de etilo C. propanoato de n-propilo D. etanoato de n-butilo 3. La estructura de la sustancia M es CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 99 PGF03-R03 Responde las preguntas 4 y 5 de acuerdo con la siguiente información En la planta de producción de una compañía se obtiene una mezcla de los siguientes compuestos: Etanol, Acetaldehído y Acido acético. 4. Si por una falla en el sistema de destilación, la máxima temperatura de la torre de destilación es 50°C es válido afirmar que A. no se puede obtener puro ningún compuesto B. sólo se puede obtener puro Etanol C. se pueden obtener puros el Etanol y el Acetaldehído D. sólo se puede obtener puro Acetaldehído 5. Si sólo se desea obtener Acido Acético en el proceso de producción, la mezcla debe ser tratada con A. una base fuerte y calor B. calor C. un oxidante fuerte y calor D. una base fuerte y un oxidante fuerte 6. La siguiente es la representación de la molécula de la adrenalina De acuerdo con ésta, se puede establecer que las funciones orgánicas presentes en la Adrenalina son CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 100 PGF03-R03 A. fenol, alcohol y amina B. alqueno, alcano, alcohol y amida C. cicloalcano, alqueno y amida D. fenol, alcohol, amina y éster Responde las preguntas 7 y 8 de acuerdo con la siguiente información 7. Los ácidos carboxílicos se disuelven en soluciones acuosas de NaOH formando sales. La reacción producida se representa en la siguiente ecuación general Al calentar una sal de sodio con una mezcla de CaO y NaOH se forma un hidrocarburo y Na2CO3, como se representa en la siguiente ecuación Una sal orgánica se calienta en presencia de NaOH y CaO formando etano y Na2CO3. De acuerdo con esta información, la sal se deriva del ácido 8. Al mezclar una sal de sodio con HCl se produce el ácido orgánico del cual se deriva la sal y NaCl. De acuerdo con esta información, los productos de la reacción de HCl con acetato de sodio (CH3 - COONa) son NaCl y CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 101 PGF03-R03 Contesta las preguntas 9 y 10 de acuerdo con la siguiente ecuación química 9. Si el compuesto R es un compuesto saturado, es posible que su estructura se represente como 10. Si se reemplaza el compuesto P por un compuesto J para llevar a cabo la reacción con el hidrógeno, la fórmula molecular del nuevo compuesto R obtenido es C5H8O2. De acuerdo con esto, es válido afirmar que J tiene A. 4 átomos de carbono B. 6 átomos de hidrógeno C. 6 átomos de carbono D. 5 átomos de hidrógeno Contesta las preguntas 11 a 12 de acuerdo con la siguiente información En los alcoholes, con excepción del metanol, se pueden efectuar reacciones de eliminación de agua (deshidratación), para obtener alquenos; tales reacciones requieren calentamiento y un agente deshidratante. La siguiente reacción general, Explica el proceso: CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 102 PGF03-R03 Los alcoholes terciarios se deshidratan más fácilmente que los secundarios y éstos a su vez más fácilmente que los primarios. Se realiza la deshidratación de varios alcoholes indicados en la siguiente tabla: 11. Si las condiciones son las adecuadas para la deshidratación y las reacciones se efectúan simultáneamente y por separado, es válido afirmar que el orden en el que se van agotando los alcoholes es A. 1, 2, 3 B. 1, 3, 2 C. 2, 3, 1 D. 3, 2, 1 12.Los alquenos que se producen en el proceso anterior respectivamente son A. 2-metil-propeno; propeno; eteno B. eteno; propeno; 2-metil-propeno C. propeno; eteno; 2-metil-propeno D. eteno; 2-metil-propeno; propeno 13. Cuando se halógena un alqueno, se rompe el doble enlace, produciéndose de esta manera la adición del halógeno. Si los alquenos obtenidos en el paso anterior se hacen reaccionar con bromo, la reacción general que explica el proceso es Contesta las preguntas 14 y 15 de acuerdo con la siguiente información CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 103 PGF03-R03 En la siguiente tabla se describe la reacción de oxidación para tres diferentes tipos de compuestos orgánicos: 14. La reacción que representa en forma general la oxidación de una cetona es 15. Si se oxida la sustancia X se produce el siguiente compuesto Es probable que el compuesto X sea A. Butanol B. Pentanol C. 2-Metil - 2 - butanol D. 2 – Butanol K2Cr2O7 16. En la reacción CH3 CH2 CH2 OH H2SO4 se produce: A. Una cetona B. Un aldehído C. Un éter D. Un éster CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 104 PGF03-R03 UNIDAD IV COMPUESTOS BIOLÓGICOS Propósito: Reconocer las propiedades físicas y químicas de los diferentes compuestos biológicos. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 105 PGF03-R03 ¿CÓMO SE DESARROLLA LA BIOQUÍMICA? En el cuerpo humano también suceden cambios químicos. Platón en su obra el Timeo y Aristóteles, en el libro cuarto Meteorología, tratan de aspectos que hoy corresponden a la fisiología, la química y la física. Para los alquimistas, los fenómenos del microcosmos –el cuerpo humano- , reflejaban los incidentes del macrocosmos en el mundo externo. Paracelso se imaginó a un ser inteligente –el Arqueos-, que no consideraba funciones como la digestión. En la búsqueda permanente de los mecanismos químicos que explicaran las funciones del cuerpo, los iatroquímicos posteriores reemplazaron el Arqueos por reacciones químicas, tales como la neutralización de ácidos y bases. La idea del elixir, el fermento que transformaba los metales bajos en oro tuvo su contrapartida en la concepción de los fermentos que ocurrían en las reacciones vitales. Las ideas sobre los mecanismos quimiofisiológicos permanecieron vagas y desorganizadas hasta mediados de 1570. Los químicos medievales y los de los comienzos de la edad moderna fueron, en su mayoría, médicos; Van Helmont, por ejemplo, realizó descubrimientos prácticos de naturaleza bioquímica. No existía mucha correlación entre las diferentes investigaciones que estaban realizando; además, eran esporádicas y superficiales. Al final del siglo XVIII, cuando la química se sistematizó, se hicieron mayores descubrimientos bioquímicos fundamentales por ejemplo Prietsley, Ingenhousz y Senebier investigaron sobre la actividad fotosintética de las plantas verdes. Sobre la respiración anima, se destacan los estudios de Lavoisier, Laplace y Séguin. En el siglo XIX se trabajó poco en la química de los procesos biológicos. La mayoría de los aportes de esta época fueron incidentes en la química general ya que era el eje central. El principal aporte fue la demostración de que los compuestos orgánicos naturales respondían a las mismas leyes que las sustancias inorgánicas. A mediados del siglo hay una mediación entre unos pocos químicos con investigadores biológicos. A finales de siglo se empiezan a juntar las piezas para tener una imagen unificada de las transformaciones químicas en el seno de las células y de la importancia de estas transformaciones para el organismo en general. La mayor parte de la bioquímica es contemporánea y sus avances han tenido lugar a partir de 1920. La bioquímica disponía de los principios básicos sobre los que aún prosigue su desarrollo: la naturaleza química de los constituyentes del cuerpo se conocían bastante bien; los requisitos nutricionales .y los mecanismos enzimáticos y hormonales que regían los procesos metabólicos se sabían menos que existían. En estos últimos años el ritmo de los descubrimientos en la bioquímica han sido muy rápidos. Uno de los grandes aportes que se han dado en la comprensión de la base molecular de la vida; ésta ha abierto nuevos campos investigación: la estructura del ADN, la combinación de genes, los mecanismos de control metabólico y el estudio del transporte a través de membranas biológicas, entre otras. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 106 PGF03-R03 EL INTERÉS DE LA BIOQUÍMICA Al comparar los estudios realizados en épocas anteriores con los realizados actualmente, pareciera como si el objeto de estudio de la bioquímica estudia la vida desde el punto de vista molecular. La bioquímica es el estudio de la base molecular de la vida. Las razones de este estudio son: Comprender las bases químicas de los procesos de la biología. Relacionar las vías moleculares con los principios comunes que son la base de las diferentes expresiones de la vida. Determinar los diferentes grados de aplicación de la bioquímica en áreas como la medicina, la farmacia, la agricultura, como por ejemplo, los mecanismos moleculares de muchas enfermedades. Resolver problemas que hoy día son un desafío para la biología y la medicina, por ejemplo; ¿cuál es la causa del cáncer?, ¿cuál es la base molecular de la esquizofrenia?, ¿cómo se controla el crecimiento celular?. Por las anteriores razones es importante y nos debe interesar el estudio de la bioquímica, pues ella nos explica como estamos constituidos, que tiene que ver la química en el funcionamiento de nuestro organismo. 1. 2. 3. 4. ¿Cuál crees que es la importancia del estudio de la bioquímica? ¿Cuáles son las moléculas que se involucran en el estudio de la bioquímica? ¿Cómo te imaginas la medicina sin el avance de la bioquímica? Desarrolla un mentefacto conceptual para bioquímica y sustenta según indique el profesor. PROTEÍNAS Son las moléculas más diversas, complejas y de mayor tamaño presentes en la célula. Contienen carbono, hidrógeno, oxígeno, nitrógeno y usualmente azufre. En algunas proteínas pueden encontrarse unidos diferentes tipos de sustancias químicas llamadas grupos prostéticos, estos incluyen carbohidratos, lípidos, grupos fosfato, el grupo hemo que contiene hierro e iones metálicos tales como el cobre y el zinc. Las proteínas tienen formas tridimensionales que son necesarias para su función específica. Entre las funciones más importantes de las proteínas se consideran: CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 107 PGF03-R03 Su papel como catalizadores orgánicos (enzimas) de casi todas las reacciones de los sistemas biológicos. Como hormonas transmitiendo información entre células. Su participación en el transporte y almacenamiento de otras moléculas pequeñas, por ejemplo el transporte de oxígeno por la hemoglobina. En el caso de los anticuerpos proporcionan defensa contra infecciones. Sirven como componentes estructurales en las células y tejidos. Ser el último recurso para la obtención de energía cuando el organismo carece de otras reservas tales como lípidos y carbohidratos. Para entender esta variedad de funciones se debe estudiar la estructura de las proteínas y examinar las propiedades de los componentes y las características de los enlaces que ellos establecen para formarlas. Las proteínas son polímeros constituidos por monómeros denominados aminoácidos proteicos o naturales, los cuales son Cada uno de ellos posee un grupo amino -NH2 y un grupo carboxilo -COOH unidos al mismo átomo de carbono alfa, se diferencian entre sí por el tamaño de sus cadenas laterales. Los aminoácidos se agrupan en cuatro categorías según las propiedades de sus cadenas laterales: No polares Poseen cadenas laterales hidrofóbicas que no interactúan con el agua por lo tanto, se localizan al interior de la molécula de proteína de la cual hacen parte. Esta ubicación les impide quedar en contacto con el agua. Son ejemplos de estos aminoácidos no polares la glicina (el más sencillo), la alanina, valina, leucina, isoleucina con cadenas carbonadas simples. El primero frecuentemente aparece constituyendo los dobleces angulares en la secuencia lineal de aminoácidos para lograr la conformación tridimensional de la proteína. Además hacen parte de este grupo la prolina con cadena cíclica de tres átomos de carbono unidos al nitrógeno del grupo amino y al carbono alfa del grupo carboxilo, esta estructura le permite en la cadena peptídica la formación de "torsiones curvas", la cisteína y la metionina con átomos de azufre en sus cadenas laterales. La cisteína es menos hidrofóbica que la metionina por poseer un grupo sulfidrilo (SH) el cual juega un papel importante en el plegamiento correcto de las proteínas ya que facilita la formación de los denominados puentes disulfuro. Otros dos aminoácidos no polares son la fenilalanina y el triptófano con cadenas laterales anilladas. Polares Son aminoácidos con cadenas laterales no cargadas pero polares o hidrofílicas. Estos son la serina, treonina, tirosina, asparagina y glutamina los cuales tienen grupos amida polares (O=C-NH2). Debido a sus cadenas polares estos aminoácidos pueden formar puentes de hidrógeno con el agua y por su naturaleza hidrofílica tienden a ubicarse en la región externa de la molécula de la proteína que estén constituyendo. Básicos Son aminoácidos con cadenas laterales que poseen grupos básicos cargados, carácter que los hace muy hidrofílicos Entre ellos se tienen la lisina, arginina e histidina siendo los dos primeros los más básicos debido a que sus cadenas laterales siempre están cargadas positivamente. La histidina puede estar sin carga o tener carga positiva a pH fisiológico, así que frecuentemente juega un papel muy activo en las reacciones enzimáticas participando en el intercambio de iones hidrógeno. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 108 PGF03-R03 Ácidos tienen cadenas laterales ácidas que terminan en grupos carboxilos como el ácido aspártico y el ácido glutámico. Estos aminoácidos están cargados negativamente en la célula y por lo tanto siempre se hace referencia a ellos como aspartato o glutamato. Son muy hidrofílicos y se localizan en la superficie de las proteínas. Formación de péptidos Los diferentes aminoácidos se polimerizan en el interior de las células para constituir péptidos y proteínas de acuerdo con la información genética, razón por la cual la polimerización se realiza con la participación de enzimas específicas y requiere del concurso del ARN y de los ribosomas para llevarse a cabo. Este proceso se inicia con una reacción de condensación entre el grupo carboxilo del primer aminoácido con el grupo amino del segundo para formar un enlace peptídico o amido con la eliminación de una molécula de agua. El compuesto resultante es un dipéptido, El cual puede formar un segundo enlace peptídico entre su grupo carboxilo Terminal y el grupo amino de un tercer aminoácido dando lugar a una molécula de agua y originando un tripéptido como se observa en la siguiente figura: De esta manera se añaden nuevos aminoácidos siguiendo la secuencia predeterminada por la información genética dando lugar a un oligopéptido (menos de 10 aminoácidos), a un polipéptido (hasta 40 aminoácidos) o una proteína con más de 50 aminoácidos. La molécula proteica puede estar constituida por uno o más polipéptidos plegados en una conformación tridimensional específica. La proteína responsable del transporte de oxígeno en los vertebrados y algunos invertebrados es la hemoglobina, la cual posee en su estructura cuatro cadenas peptídicas que se plegaron de manera independiente y que al unirse dan a la molécula las propiedades específicas para cumplir su función. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 109 PGF03-R03 CLASIFICACIÓN DE LAS PROTEÍNAS Según su composición las proteínas se clasifican en: Proteínas simples u Holoproteínas: Las cuales están formadas exclusivamente o predominantemente por aminoácidos. Proteínas conjugadas: Poseen un componente de proporción significativa no aminoacídico que recibe el nombre de grupo prostético. Según la naturaleza de este grupo consideramos: Glicoproteínas: Se caracterizan por poseer en su estructura azúcares. Se pueden citar como ejemplo: las inmunoglobulinas, algunas proteínas de membrana, el colágeno y otras proteínas de tejidos conectivos (glucosaminoglicanos). a. Lipoproteínas: Proteínas conjugadas con lípidos que se encuentran en las membranas celulares. b. Nucleoproteínas: Se presentan unidas a un ácido nucleico, como en los cromosomas, ribosomas y en los virus. c. Metaloproteínas: Contienen en su molécula uno o más iones metálicos que no constituyen un grupo hem. Por ejemplo algunas enzimas. Hemoproteínas o Cromoproteínas: Proteínas que tienen en su estructura un grupo hem De acuerdo con su morfología y solubilidad: Proteínas fibrosas: Son insolubles en agua, presentan formas moleculares alargadas, con un número variado de cadenas polipeptídicas que constituyen fibras resistentes, con cierto grado de elasticidad, fragilidad o ductilidad. 40. Funcionan como proteínas estructurales o de soporte. Las más comunes son: Elastina, Colágeno, Queratina, Fibrina, etc. Proteínas Globulares: Tienden a ser más solubles en agua, debido a que su superficie es polar. Sin embargo, pueden presentar mayor solubilidad en otros solventes como soluciones salinas, ácidos o bases diluidas o alcohol. . Su estructura es compacta con formas casi esféricas. La mayoría de las proteínas conocidas son globulares, dentro de las que se consideran todas las enzimas, las proteínas del plasma y las presentes en las membranas celulares. A su vez las proteínas globulares se pueden clasificar de acuerdo con su solubilidad: Albúminas: Proteínas fácilmente solubles en agua, que coagulan con el calor y precipitan con las soluciones salinas saturadas. Por ejemplo la Lactoalbúmina, albúmina del suero, la ovoalbúmina (presente en la clara del huevo). Globulinas: Escasamente solubles en agua pura, pero solubles en soluciones salinas diluidas como cloruro de sodio, entre ellas se encuentran las seroglobulinas (sangre), ovoglobulina, inmunoglobulinas, etc. Glutelinas: Solubles en ácidos y bases diluidos, insolubles en solventes neutros. Ejemplo: La Glutenina del trigo. Prolaminas: Solubles en alcohol del 70 al 80%, insolubles en agua, alcohol absoluto y otros solventes neutros, como la Zeína del maíz y la Gliadina del trigo. De acuerdo con su función biológica: CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 110 PGF03-R03 Proteínas estructurales: Forman parte de células y tejidos a los que confieren apoyo estructural.50. Dentro de estas podemos citar, el colágeno y la elastina presentes en el tejido conectivo de los vertebrados.51. La queratina de la piel, pelo y uñas y la espectirna presente en la membrana de los eritrocitos. Proteínas de transporte: Como su nombre lo indica, transportan sustancias como el oxígeno en el caso de la hemoglobina y la mioglobina, ácidos grasos en el caso de la albúmina de la sangre, o las que realizan un transporte transmembrana en ambos sentidos. Proteínas de defensa: Protegen al organismo contra posibles ataques de agentes extraños, entre las que se consideran los anticuerpos (inmunoglobulinas), las proteínas denominadas interferones cuya función es inhibir la proliferación de virus en células infectadas e inducir resistencia a la infección viral en otras células, el fibrinógeno de la sangre importante en el proceso de coagulación. Proteínas hormonales: Se sintetizan en un tipo particular de células pero su acción la ejercen en otro tipo. Ejemplo, la insulina. Proteínas como factores de crecimiento: Su función consiste en estimular la velocidad de crecimiento y la división celular. Como ejemplo se puede citar la hormona de crecimiento y el factor de crecimiento derivado de plaquetas. Proteínas catalíticas o enzimas: Permiten aumentar la velocidad de las reacciones metabólicas. Dentro de las células son variadas y se encuentran en cantidad considerable para satisfacer adecuadamente sus necesidades. Entre otras se consideran las enzimas proteolíticas cuya función es la degradación de otras proteínas, lipasas, amilasas, fosfatasas, etc. Proteínas contráctiles: Son proteínas capaces de modificar su forma, dando la posibilidad a las células o tejidos que estén constituyendo de desplazarse, contraerse, relajerse razón por la cual se encuentran implicadas en los diferentes mecanismos de motilidad. Las proteínas más conocidas de este grupo son la actina y la miosina. Proteínas receptoras: Proteínas encargadas de combinarse con una sustancia específica. Si se encuentran en la membrana plasmática, son las encargadas de captar las señales externas o simplemente de inspeccionar el medio. Si se encuentran en las membranas de los organelos, permiten su interacción. Sin embargo, no son proteínas exclusivas de membrana ya que algunas se encuentran en el citoplasma. El ejemplo más típico de éstas son los receptores de las hormonas esteroides. Casi todos los neurotransmisores, la mayoría de las hormonas y muchos medicamentos funcionan gracias a la presencia de estas proteínas. Proteínas de transferencia de electrones: Son proteínas integrales de membrana, comunes en las mitocondrias y cloroplastos cuya función se basa en el transporte de electrones desde un donador inicial hasta un aceptor final con liberación y aprovechamiento CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 111 PGF03-R03 de energía. Como ejemplo se citan a los Citocromos que hacen parte de la cadena respiratoria. ESTRUCTURA DE LAS PROTEÍNAS En la estructura de las proteínas se pueden considerar cuatro niveles de organización: primario, secundario, terciario y cuaternario. Cada uno de los cuales resaltan un aspecto diferente y depende de distintos tipos de interacciones. Mientras la estructura primaria es simplemente la secuencia lineal de aminoácidos de una cadena polipeptídica las demás establecen su organización tridimensional de péptidos o conjunto de ellos. Estructura primaria: se considera como estructura primaria a la secuencia lineal específica (sin ramificaciones) de aminoácidos de una cadena polipeptídica la cual es el resultado de la traducción de la información genética contenida en la secuencia de nucleótidos del ADN. La importancia desde el punto de vista químico de la estructura primaria, radica en la secuencia de los grupos laterales de los aminoácidos (cadenas laterales, R) dado que es el componente variable de la molécula que proporciona la identidad a la cadena. Por otra parte, el significado biológico de esta secuencia se basa en el control que ella ejerce en la organización de los niveles de complejidad superiores de la estructura proteica ya que esta permitirá en última instancia la determinación de su actividad biológica, es decir, la secuencia de aminoácidos tiene la información necesaria para que la molécula adopte una conformación tridimensional adecuada. Es tan importante esta secuencia que el cambio en solo un aminoácido como resultado de una mutación, puede ser trágico para la vida de un organismo. El grado de tolerancia a los cambios depende del grado de alteración de la geometría que presente la estructura proteica, así como del comportamiento químico que tiene la cadena lateral del aminoácido sustituido (polar, no polar, básico o ácido). Cabe resaltar que todas las proteínas sin importar su nivel de organización se originan de una estructura primaria que posteriormente adopta una conformación tridimensional específica. No obstante, una proteína que permanece con su estructura primaria inmodificable pero funcional es la insulina. Estructura secundaria Consiste en el enrollamiento de la cadena peptídica sobre su propio eje para formar una hélice o alguna otra estructura tridimensional específica. La estructura secundaria más común es la a-hélice (alfa), la cual se caracteriza por formar una estructura geométrica en espiral muy uniforme. La hélice se mantiene mediante puentes de hidrógeno entre el hidrógeno del grupo amino del enlace peptídico de un aminoácido y el grupo carboxilo del enlace peptídico de otro. Dentro de este grupo se pueden mencionar proteínas como el colágeno, la queratina, elastina CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 112 PGF03-R03 Otro tipo común de estructura secundaria es la hoja ß plegada, que se caracteriza por presentarse de forma aplanada y extendida, Además posee un máximo de enlaces de hidrógeno entre los enlaces peptídicos. Esta estructura consta de varias cadenas peptídicas que permanecen enfrentadas y se mantienen juntas con enlaces de hidrógeno en un arreglo a manera de zig-zag. La estructura laminar formada le confiere flexibilidad más no elasticidad. Debido a que toda cadena polipeptídica tiene un extremo C-terminal en una dirección y un extremo N- Terminal en la otra, dos cadenas enlazadas con hidrógeno y una al lado de la otra pueden correr en la misma dirección, o en dirección opuesta.80. Un ejemplo de estas proteínas es la fibroína de la seda. Paralelo Antiparalelo Estructura terciaria Es raro para una proteína entera permanecer con la estructura de a-hélice u hoja ß-plegada. La mayoría de ellas adquieren formas tridimensionales complejas denominadas estructuras terciarias, debido a que mientras la secundaria trata fundamentalmente de la conformación de los aminoácidos adyacentes de la cadena polipeptídica, la estructura terciaria describe la conformación definitiva y específica de la proteína. Durante el enrollamiento de la cadena peptídica, para dar origen a la estructura terciaria, los puentes de hidrógeno y las interacciones iónicas e hidrofóbicas entre una parte de la cadena y otra, son las fuerzas que mantienen los pliegues en posición espacial correcta. Por otra parte, los puentes disulfuro (S-S-) que se forman entre los aminoácidos de cisteína pueden acercar partes que se hayan distantes en una proteína, de hecho algunos sitios activos de enzimas están constituidos por ellos. Además, en la proteína también se forman algunos otros enlaces covalentes para mantener su estructura terciaria que por lo general es globular. Con respecto a la estructura terciaria de cadenas polipeptídicas largas, cabe destacar la presencia de regiones compactas semiindependientes denominadas dominios, Que se caracterizan por poseer una geometría casi esférica específica con un interior hidrofóbico y un exterior polar. 88. El carácter independiente del dominio es evidente cuando al separarlo de la cadena, su estructura primaria es capaz de plegarse sobre sí misma para adoptar la conformación nativa. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 113 PGF03-R03 Una proteína puede presentar más de un dominio, a menudo interconectados por un segmento polipeptídico carente de estructura secundaria regular y alternativamente estar separados por una hendidura o una región menos densa en la estructura terciaria de la proteína. Los diferentes dominios de una proteína pueden gozar de movimiento relativo que está asociado con una función. Así por ejemplo, en la enzima hexoquinasa, el sitio activo de unión del sustrato glucosa está en una hendidura entre dos dominios, cuando la glucosa se une a la hendidura, los dominios colindantes se cierran sobre el sustrato, atrapándolo para la fosforilación. Estructura cuaternaria Como se mencionó anteriormente muchas proteínas tienen dos o más cadenas plegadas de polipéptidos (subunidades) para formar su estructura terciaria. En la estructura cuaternaria se consideran moléculas proteicas superiores a los 50 mil daltons en donde las subunidades constitutivas pueden ser idénticas o diferentes y se asocian para formar dímeros, trímeros y tetrámeros. En algunos casos las cadenas aisladas son inactivas, pero en otros pueden cumplir la misma función que el complejo, aunque con diferente cinética. El ejemplo más conocido es la hemoglobina en donde las interacciones hidrofóbicas, los enlaces de hidrógeno y los enlaces iónicos ayudan a mantener las cuatro subunidades juntas para formar una molécula funcional, así cada subunidad de hemoglobina se pliega de manera similar a la estructura terciaria de mioglobina. Factores que afectan la estabilidad estructural en las proteínas Hasta el momento se cree que la estructura primaria de una proteína induce a establecer las estructuras secundaria, terciaria y cuaternaria ya que el ADN no sólo determinaría la estructura primaria sino también los niveles superiores de estructura. Sin embargo, la actividad biológica de la proteína depende en gran medida de su estructura terciaria específica mantenida por los enlaces mencionados anteriormente, de tal manera que cuando una proteína se somete a: calor, determinadas sustancias químicas, cambios bruscos de pH, etc. Su estructura terciaria se desorganiza y las cadenas peptídicas adquieren una conformación al azar que induce a la pérdida de su actividad biológica especialmente cuando actúa como enzima. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 114 PGF03-R03 Las temperaturas elevadas, rompen muy fácilmente los puentes débiles de hidrógeno y las interacciones hidrofóbicas a causa del aumento en la energía cinética de las moléculas. La alteración del pH puede cambiar el patrón de ionización de los grupos carboxilo y amino en las cadenas laterales de los aminoácidos desorganizando el patrón de atracciones y repulsiones iónicas que contribuyen a la estructura terciaria normal. La pérdida de la estructura terciaria se denomina desnaturalización, y siempre se acompaña de la alteración de las funciones biológicas normales de las proteínas. La desnaturalización se puede originar por calor o concentraciones altas de sustancias polares y solventes no polares tales como la urea que rompe los puentes de hidrógeno que mantienen la estructura de la proteína. Generalmente la desnaturalización es irreversible, particularmente si muchas proteínas desnaturalizadas interactúan en eventos no específicos al azar, como se presenta en los cuerpos de inclusión característicos de algunas enfermedades neurodegenerativas. Sin embargo, en algunos casos la desnaturalización es reversible, y una vez las condiciones del ambiente vuelvan a su estado normal, la proteína puede adquirir su forma activa. En este caso se habla de renaturalización. EJERCITACIÓN 1. Desarrolla el siguiente mentefacto conceptual y sustenta según indique el profesor: PROTEINAS CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 115 PGF03-R03 2. Responder las siguientes preguntas a) ¿Qué grupos funcionales contienen los aminoácidos? b) ¿Qué tipo de carga tiene el grupo variable de los aminoácidos? c) ¿qué es una proteína? d) ¿Dónde se lleva a cabo la síntesis de proteínas? e) ¿qué tipo de proteínas existen? Explique las características de cada una. f) ¿Qué es un polipéptido? g) ¿Qué es un aminoácido esencial? h) ¿A qué se debe que las moléculas de proteínas adopten la estructura secundaria? i) ¿Cuál es la importancia biológica de las proteínas? j) ¿Qué criterios podemos considerar para clasificar a las proteínas? 3. Diferencie entre aminoácidos básicos y ácidos. De 2 ejemplos de cada tipo. 4. Construye una dieta balanceada que debemos ingerir de acuerdo con nuestro peso y altura. 5. Clasifique los siguientes aminoácidos de acuerdo a su grupo funcional: 6. Dibuje la estructura primaria y secundaria de las proteínas. 7. Explique en que consiste la estructura terciaria y cuaternaria de las proteínas. HIDRATOS DE CARBONO. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 116 PGF03-R03 Hidratos de carbono, grupo de compuestos, también llamados glúcidos, que contienen hidrógeno y oxígeno, en la misma proporción que el agua, y carbono. La fórmula de la mayoría de estos compuestos se puede expresar como C m (H2O)n. Sin embargo, estructuralmente estos compuestos no pueden considerarse como carbono hidratado, como la fórmula parece indicar. Los hidratos de carbono son los compuestos orgánicos más abundantes en la naturaleza. Las plantas verdes y las bacterias los producen en el proceso conocido como fotosíntesis, Durante el cual absorben el dióxido de carbono del aire y por acción de la energía solar producen hidratos de carbono y otros productos químicos necesarios para que los organismos sobrevivan y crezcan. Entre los hidratos de carbono se encuentran el azúcar, el almidón, la dextrina, la celulosa y el glucógeno, Sustancias que constituyen una parte importante de la dieta de los humanos y de muchos animales. Los más sencillos son los azúcares simples o monosacáridos, Que contienen un grupo aldehído o cetona; El más importante es la glucosa. Dos moléculas de monosacáridos unidas por un átomo de oxígeno, con la eliminación de una molécula de agua, producen un disacárido, siendo los más importantes la sacarosa, la lactosa y la maltosa. Los polisacáridos son enormes moléculas formadas por uno o varios tipos de unidades de monosacáridos —unas 10 en el glucógeno, 25 en el almidón y de 100 a 200 en la celulosa. En los organismos vivos, los hidratos de carbono sirven tanto para las funciones estructurales esenciales como para almacenar energía. En las plantas, la celulosa y la hemicelulosa son los principales elementos estructurales. En los animales invertebrados, el polisacárido quitina es el principal componente del dermatoesqueleto de los artrópodos. En los animales vertebrados, las capas celulares de los tejidos conectivos contienen hidratos de carbono. Para almacenar la energía, las plantas usan almidón y los animales el glucógeno; cuando se necesita la energía, las enzimas descomponen los hidratos de carbono. Los hidratos de carbono se utilizan para fabricar tejidos, películas fotográficas, plásticos y otros productos. La celulosa se puede convertir en rayón de viscosa y productos de papel. El nitrato de celulosa (nitrocelulosa) se utiliza en películas de cine, cemento, pólvora de algodón, celuloide y tipos similares de plásticos. El almidón y la pectina, un agente cuajante, se usan en la preparación de alimentos para el hombre y el ganado. La goma arábiga se usa en medicamentos demulcentes. El agar, un componente de algunos laxantes, se utiliza como agente espesador en los alimentos y como medio para el cultivo bacteriano; también en la preparación de materiales adhesivos, de encolado y emulsiones. La hemicelulosa se emplea para modificar el papel durante su fabricación. Los dextranos son polisacáridos utilizados en medicina como expansores de volumen del plasma sanguíneo para contrarrestar las conmociones agudas. Otro hidrato de carbono, el sulfato de heparina, es un anticoagulante de la sangre. ESTRUCTURA DE LOS CARBOHIDRATOS Proyecciones de Fischer; para representar las fórmulas de los diferentes azúcares se emplean unas representaciones que se conocen como proyecciones de Fischer y se debe a Emil Fischer, quien, en 1891, sugirió un método de representación basado en la proyección CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 117 PGF03-R03 de un átomo de carbono tetraédrico sobre una superficie plana. Con esta clase de proyección, un átomo de carbono tetraédrico se representa por dos líneas cruzadas. Por convención, las líneas horizontales representan enlaces que salen de la página hacia el observador y las líneas verticales representan enlaces que se proyectan hacia atrás de la página. Observemos la proyección de Fischer en el caso del gliceral-dehído: Estructura de Fischer Sin embargo, para evitar confusiones se acostumbra emplear la estructura de Fischer semiestructural, escribiendo la cadena de átomos de carbono en forma vertical y los sustituyentes orientados hacia la derecha o hacia la izquierda. La estructura cíclica de los monosacáridos: Si regresamos al capítulo de los aldehídos y las cetonas, recordaremos que los gruposcarbonilo (C=O) de estas sustancias químicas son capaces de reaccionar con los grupos (OH-) de los alcoholes para formar hemia-cetales. Recordaremos, también, que los carbohidratos son, por definición, sustancias que químicamente corresponden a polihidroxialdehidos o polihidroxicetonas. Lo cual deja en claro que dentro de una misma molécula coexisten grupos carbonilo y grupos hidroxilo; Por lo tanto, la formación de un hemiacetal es posible y mucho fácil que cuando la reacción se produce intermolecular-mente. En el caso de los azúcares esta reacción conduce a la formación de hemiaceta-les cíclicos de cinco o seis átomos de carbono. Por ejemplo, en el caso de la glucosa, reacciona el grupo carbonilo de C1 con el grupo OH de C5, dando un anillo de C5. En la fructosa, por su parte, reacciona el carbonilo ubicado en C2 con el hidoxilo de C5. Veamos lo que ocurre con la glucosa, la fructosa y la galactosa. Proyecciones de Haworth Se llaman así en honor al químico ingles Sir. Walter N. Haworth. Esta proyección se representa el hemiacetal cíclico de cinco o seis carbonos como un pentágono o hexágono plano, Ubicado perpendicularmente al plano del papel. Los grupos unidos a los carbonos del anillo quedan por encima o por debajo del plano del anillo. Convencionalmente, los grupos OH que en la proyección de Fisher se ubican a la derecha del carbono.En la proyección de Haworth se dibujan hacia abajo, y los grupos que se ubican en la proyección de Fisher hacia la izquierda, en la proyección de Haworth se dibujan hacia arriba. El nuevo centro asimétrico que se genera al formar la estructura cíclica se llama carbono anomerico y los diasteroisomeros que se obtienen reciben el nombre e anómeros. Los cuales reciben denominaciones que dependen de la posición del grupo OH del carbono anómerico. Se designa como alfa al isomero cuyo OH se proyecte hacia abajo y beta al isomero cuyo OH se proyecte hacia arriba. Según la estructura o proyección de Haworth. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 118 PGF03-R03 Proyecciones de fisher. Los disacáridos La combinación de dos moléculas de monosacáridos con la eliminación de una molécula de agua origina un disacárido. La unión se realiza siempre entre el grupo aldehído de uno de los azucares y el grupo hidroxilo o ce tónico del otro, cuyo enlace recibe el nombre de enlace glicosidico. Así, por ejemplo, la sacarosa, llamada comúnmente azúcar de caña o de mesa, consta de una molécula de glucosa unida a otra de fructuosa, de tal modo que la unión se realiza entre el OH y el C1 del alfa glucosa con el OH del C2 de la beta fructuosa: Esto suele confirmarse ante la incapacidad de la sacarosa para reaccionar con los reactivos de Feling y de tollens, como sí lo hace la glucosa y la fructuosa, en forma individual. La lactosa o azúcar de la leche está formada por la molécula de glucosa y una molécula de galactosa. La unión entre los dos azucares se realiza entre el OH de C1 de la beta galactosa y el OH de C4 de la alfa glucosa, Lo que suele confirmarse mediante la reacción positiva del azúcar con los reactivos de Fehling y Tollens, Lo cual indica que posee un grupo aldehído libre capaz de reaccionar con estos reactivos. Otro disacárido importante es la maltosa.Se forma durante la germinación de los cereales y se puede obtener como producto de la hidrólisis del almidón de la malta; es llamado también azúcar de malta. Se forma por la unión de dos moléculas de alfa glucosa (unión 1,4), de tal suerte que este disacárido también reacciona con los reactivos de Fehling y Toillens, puesto que tiene un grupo OH aldehído libre. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 119 PGF03-R03 Los polisacáridos Son azúcares constituidos por un número elevado de moléculas de monosacáridos que presentan un peso molecular elevado, y se diferencian de los monosacáridos en algunas de sus propiedades. Por ejemplo, no tienen sabor dulce, por lo general son insolubles en agua y debido a su gran tamaño molecular, cuando se disuelven forman soluciones coloidales. Existen polisacáridos formados por pentosas o hexosas y algunos son de constitución mixta. Debido a que su tamaño es muy grande, su peso molecular sólo se conoce en forma aproximada. Entre los polisacáridos más importantes podemos mencionar el almidón, el glucógeno, la heparina, la quitina, el agar, la pectina y la celulosa. Estructura del almidon con enlaces 1,4 alfa CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 120 PGF03-R03 Desde el punto de vista alimenticio es el polisacárido más importante. Está constituido por moléculas de glucosa y representa la forma de almacenamiento de azúcares en las plantas. Consta de dos tipos de polisacári-dos: la amilosa (15 - 20%) y la amilopectina (80 - 85%). La primera está compuesta de cadenas de glucosa formadas por uniones alfa 1,4, mientras que la segunda corresponde a un polímero ramificado de glucosa con enlaces alfa 1, 4 y alfa 1,6; es insoluble en agua y toma un color azul con la solución de yodo. 1. Desarrolla el siguiente mentefacto conceptual y sustenta según indique el profesor CARBOHIDRATOS. 2. ¿Cómo se clasifican los carbohidratos? 3. Consulta la estructura, función e importancia de: a) el colágeno b) la elastina c) la hemoglobina d) la actina e) la miosina 4. Responde las siguientes preguntas: a) ¿Qué caracteriza a las moléculas de los carbohidratos? b) ¿Qué caracteriza a los monosacáridos, disacáridos, polisacáridos? c) Dar ejemplos y función de monosacáridos, disacáridos, polisacáridos. 5. 6. 7. 8. ¿Cuál es la importancia de la glucosa a nivel organísmico? ¿Qué tipo de monosacáridos existen? Mencione ejemplos. ¿Qué es un disacárido? Realice la estructura de dos de ellos. Clasifique cada proyección de Fischer de los siguientes carbohidratos como: a) aldosa o cetosa b) azúcar D o L c) tetrosa, pentosa o hexosa CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 121 PGF03-R03 LÍPIDOS Los lípidos son un grupo amplio y heterogéneo de compuestos insolubles en agua, pero solubles en solventes orgánicos no polares como el éter, el cloroformo o el benceno. En su estructura contienen carbono, hidrógeno y oxígeno, pero este último en menor proporción respecto de los carbohidratos. Son reservas energéticas y se utilizan como combustibles biológicos importantes, ya que pueden suministrar cerca de 9300 calorías por gramo, comparada con 4100 calorías de azúcares y proteínas. Forman cubiertas aislantes en la superficie de plantas y de animales Para evitar infecciones y mantener el equilibrio hídrico en ellos. Sirven como componentes estructurales de las membranas biológicas en donde contribuyen a la formación de compartimentos con respuestas bioquímicas específicas. Constituyen sistemas aislantes contra choques térmicos, eléctricos y químicos a nivel de la hipodermis o en cubiertas de órganos internos. Otros pueden ser hormonas que participan en el control de procesos metabólicos. Además sirven como precursores de otros compuestos complejos como lipoproteínas, glicoproteínas, vitaminas liposolubles etc. Los lípidos se clasifican en tres grupos principales: Lípidos Simples que incluyen grasas verdaderas saturadas (sólidas), aceites insaturados (líquidos) y ceras, los cuales tienen estructura similar compuesta por carbono, hidrógeno y oxígeno. Estructura de los lípidos simples El patrón más común de la estructura de las grasas verdaderas es una molécula de glicerol unida a cadenas de ácidos grasos. Los ácidos grasos son cadenas hidrocarbonadas apolares largas no ramificadas, con un grupo carboxilo en un extremo y el glicerol o glicerina es un polialcohol de tres átomos de carbono que puede unir sus tres grupos hidroxilo (-OH) mediante enlaces éster con los grupos carboxilo (-COOH) de una, dos o tres moléculas de ácidos grasos para dar lugar a monoglicéridos, diglicéridos o triglicéridos respectivamente. Generalmente los ácidos grasos sintetizados por las células poseen un número par de átomos de CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 122 PGF03-R03 carbono y su longitud varía de 14 a 24 carbonos. En su cadena pueden estar presentes o ausentes dobles enlaces. Estas características son importantes en las propiedades fisicoquímicas de la molécula de grasa, de tal manera que aquellas conformadas por ácidos grasos saturados, como las que se encuentran en la hipodermis de mamíferos, son sólidas a temperatura ambiente.Mientras que las grasas con ácidos grasos insaturados, como los aceites vegetales son líquidos a la misma temperaturas sin embargo, un aceite se puede convertir en grasa saturada rompiendo los dobles enlaces entre los carbonos, reemplazándolos con enlaces simples, y añadiendo hidrógenos. Este es un "aceite hidrogenado" como los que se encuentran en las margarinas. Las grasas son moléculas insolubles en agua, pero solubles en solventes no polares almacenan en las células en forma de gotas de lípido anhídro por lo que son almacenes de energía muy concentrada, en los animales el principal tejido de reserva es el adiposo, en las células denominadas adipositos. Mientras que en vegetales como maíz, sorgo, girasol, maní de los cuales se extrae industrialmente aceite, se encuentra intracelularmente en plastidios para tal fin como son los oleoplastos. Ceras Son similares a las grasas y a los aceites excepto en que los ácidos grasos que las conforman se ligan a cadenas largas de alcoholes en lugar de unirse al glicerol. Son sólidas e insolubles en agua. Las ceras forman una cubierta impermeable sobre las hojas, frutos y tallos de plantas terrestres para impedir la pérdida de agua por excesiva evapotranspiración. Algunas estructuras coberturas de los animales como son las plumas, pelos, piel poseen ceras con función impermeabilizante y lubricante.En casos excepcionales como en las abejas son empleadas para construir sus colmenas. Esta cera de abejas está constituida principalmente por ésteres de ácido palmítico y alcoholes de 26-34 átomos de carbono. Lípidos complejos: comprenden los fosfolípidos o fosfoglicéridos, de estructura similar a las grasas pero además contienen fósforo y nitrógeno; Los esfingolípidos (ceramidas, esfingomielinas, cerebrósidos y gangliósidos). A los cerebrosidos y gangliósidos también se les conoce como glicolípidos. Estructura de los lípidos complejos Fosfolípidos Son diglicéridos semejantes a un aceite excepto en que uno de los ácidos grasos se reemplaza por un residuo de ácido fosfórico y a menudo este último se une a una molécula polar pequeña ionizable tal como la colina, serina, inositol, o etanolamina. De esta manera el fosfolípido adquiere una característica anfipática, es decir su molécula presenta una "cabeza" (de glicerol y base orgánica) polar o cargada (hidrosoluble) unida a una "cola" no polar (hidrofóbica) de ácidos grasos, condición que le facilita hacer parte estructural de las membranas celulares como bicapa lipídica y cumplir en ellas una función selectiva en el transporte puesto que al entrar en contacto con el agua adquieren cierta configuración y los extremos hidrosolubles se orientan hacia el exterior mientras los extremos hidrofóbicos se orientan en sentido opuesto. Esfingolípidos Son los lípidos estructurales de membrana menos abundantes, derivados de la esfingosina, un amino alcohol de cadena larga hidrocarbonada el cual esterifica con diferentes grupos. Si el grupo amino de la esfingosina se une a un ácido graso y establece un enlace amido, esta molécula es una ceramida. La función de las ceramidas consiste en reforzar la cohesión de las células de la capa córnea de la epidermis, Limitando la pérdida de péptidos hidrosolubles y minimizan las alteraciones producidas por los rayos UV tanto en la piel como en el pelo. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 123 PGF03-R03 Si la esfingosina esterifica, el alcohol Terminal con fosforilcolina, la molécula resultante es una esfingomielina, fosfolípido de esfingosina presente en las membranas celulares. Si el grupo eterificado es un carbohidrato la molécula es un glicolípido, que puede llamarse cerebrósido si el carbohidrato es un azúcar simple y si es un oligosacárido se llama gangliósido. Puesto que los esfingolípidos tienen dos cadenas largas de hidrocarburos (hidrofóbicas) en un extremo y una región hidrofílica en el otro son también moléculas anfipáticas y muy similares a los fosfoglicéridos o fosfolípidos razón por la cual se ajustan de manera adecuada en la bicapa lipídica de las membranas. Lípidos derivados incluyen los lípidos que no se clasifican en los anteriores grupos como la familia de los esteroides, carotenoides, las prostaglandinas y las vitaminas liposolubles. LOS TRIGLICERIDOS. Las grasas animales y los aceites, considerados los lípidos más abundantes en la naturaleza, Corresponden químicamente al triéstres de glicerol y ácidos carboxílicos de cadena larga. 48. Las grasas y los aceites también se denominan triglicéridos. La hidrólisis de un triglicérido en medio alcalino y su posterior acidificación conduce a la formación de glicerol y tres moléculas de ácido graso. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 124 PGF03-R03 Los ácidos grasos e conocen más de 500 ácidos grasos (AG) diferentes, Obtenidos a partir de diversas células y tejidos. Por lo general, son ácidos orgánicos lineales que pueden ser saturados e insaturados. Los ácidos grasos saturados, hasta el ácido cáprico (CIO), son líquidos a temperatura ambiente. Los ácidos grasos insaturados son componentes característicos de los aceites. Para indicar el número de átomos de carbono del ácido y el número de dobles enlaces (C=C) en la cadena de hidrocarburo se emplean dos números separados por dos puntos (:). Así, por ejemplo, el ácido linoleico (C17H29COOH) en su cadena de 18 carbonos que contiene dos enlaces dobles, se indica como 18:2. A continuación se presentan algunas características de los ácidos grasos más abundantes en las plantas y animales, y una tabla que contiene la nomenclatura y la estructura de algunos ácidos. S Los ácidos grasos que se encuentran en la naturaleza tienen casi siempre un número par de átomos de carbono en sus moléculas. Implícitamente, se consideran derivados del ácido etanoico o acético. Los tres ácidos grasos más abundantes en la naturaleza son el ácido palmítico (16:0), el esteárico (18:0) y el ácido oleico (18:1). La mayoría de los ácidos grasos insaturados predominan como isómero cis. Los ácidos grasos no saturados tienen puntos de fusión más bajos que los ácidos grasos saturados. A mayor grado de instauración, menor punto de fusión. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 125 PGF03-R03 LOS FOSFOLÍPIDOS Esta clase de compuestos se encuentran en todas las células animales y vegetales.66. Están constituidos por glicerol, ácidos grasos, ácido fosfórico y un compuesto que contiene nitrógeno. Químicamente, son esteres del ácido fosfatídico con colina, etanolamina, serina o inositol. Dentro de este grupo están las lecitinas, las cuales son esteres del ácido fosfatídico, y la colina.Las lecitinas se encuentran en la yema del huevo, en el tejido nervioso y en el cerebro. Desde el punto de vista fisiológico, las lecitinas son importantes en el transporte de las grasas de un tejido a otro. Además, son componentes esenciales del protoplasma de todas las células del cuerpo. La lecitina se obtiene, industrialmente, de la soja. Dentro de este mismo grupo se encuentran las cefalinas. 74. Estas sustancias se encuentran en el cerebro, y están involucradas en los procesos de coagulación de la sangre; por esta razón son esenciales para el organismo. Los Esteroides Los esteroides constituyen un grupo de lípidos de naturaleza animal y vegetal, los cuales se pueden considerar como derivados de los alcoholes cíclicos de peso molecular elevado, y se encuentran en todas las células vivas. Su estructura química tiene como base un sistema de cuatro anillos, llamado núcleo de ciclopentanoperhidrofenantreno. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 126 PGF03-R03 Esta estructura es una parte integral de la molécula del colesterol. El colesterol (C27H46O) es el esteroide más corriente. Es un sólido seroso, insoluble en agua, de color blanco, que se encuentra en el plasma sanguíneo y en todos los tejidos animales, y forma parte del metabolismo humano de dos maneras: En primer lugar, es un componente esencial de las membranas biológicas. Un cuerpo adulto saludable contiene aproximadamente 140 g de colesterol, de los cuales 120 g están relacionados con las membranas. Así, por ejemplo, el sistema nervioso central y periférico contiene aproximadamente 10% (14 g) de colesterol. En segundo lugar, el colesterol es el compuesto a partir del cual se sintetizan las hormonas sexuales, Las hormonas adrenocorticoides, la vitamina D y los ácidos biliares. El colesterol contiene ocho centros quirales y, por lo tanto, contiene un número muy grande de esteroisómeros y enantiómeros potenciales. El colesterol es insoluble en el plasma sanguíneo, pero puede transportarse en él formando un complejo soluble entre el colesterol y las lipoproteínas. Las lipoproteínas de baja densidad (LDL) lo transportan desde el sitio donde se sintetiza, en el hígado, hasta los diferentes tejidos y células del cuerpo donde se emplea posteriormente. Cuando el colesterol se une a las LDL o colesterol malo, se puede acumular en los vasos sanguíneos, y formar depósitos que causan la arteriosclerosis. En cambio, las lipoproteínas de alta densidad (HDL) o colesterol bueno transportan el exceso de colesterol, y el que no es utilizado por las células es regresado al hígado para su transformación en ácidos biliares y su posterior eliminación a través de las heces. 1. Desarrolla el siguiente mentefacto conceptual y sustenta según indique el profesor. LIPÌDOS 2. Responde las siguientes preguntas a) ¿Cuál es la diferencia entre los carbohidratos y los lípidos? b) ¿Qué caracteriza la molécula de ácidos grasos y por qué es anfipática? c) ¿Que caracteriza los lípidos saponificables y dar ejemplos. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 127 PGF03-R03 d) e) f) g) h) ¿Cuáles son las moléculas base de los acilglicéridos? ¿Cuál es la diferencia entre triglicéridos saturados e insaturados? ¿Qué tipo de triglicérido están presentes en las grasas y cuáles en los aceites? ¿Cuál es la característica del monoalcohol precursor de las ceras? Explicar la función biológica desde el punto de vista químico de las ceras? O el porqué de su función biológica i) ¿Qué moléculas forman la ceramida? j) Dar ejemplos de esfingolípidos y dónde se encuentran? k) ¿Cuál es la molécula básica de los terpenos? El isopreno l) ¿Qué cualidad hace a los isoprenoides pigmentos fotosintetizadores? m) ¿A qué tipo de lípido pertenecen las vitaminas A;E y K? Isoprenoides o terpenos, por qué?. n) ¿Cuál es la molécula básica de los esteroides? o) ¿Qué grupo funcional tiene el esterano para ser un esterol? p) ¿En qué estructura celular puedes encontrar colesterol? q) ¿Cuál es la molécula precursora de las hormonas sexuales? r) ¿Cuál es la molécula precursora de las prostaglandinas? s) ¿Por qué las prostaglandinas pertenecen a los lípidos? Preguntas de selección múltiple con única respuesta - (tipo I) Las preguntas de este tipo constan de un enunciado y de cuatro posibilidades de respuesta, entre las cuales usted debe escoger la que considere correcta. La siguiente tabla muestra los valores de densidad de tres sustancias. 1. En cuatro recipientes se colocan volúmenes diferentes de cada líquido como se muestra en el dibujo. De acuerdo con lo ilustrado es válido afirmar que A. el recipiente IV es el que contiene menor masa. B. los recipientes II y IV contienen igual masa. C. el recipiente III es el que contiene mayor masa. D. el recipiente III contiene mayor masa que el recipiente I. 2. La siguiente tabla indica la temperatura de ebullición de algunos compuestos orgánicos. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 128 PGF03-R03 Del cuadro anterior es válido afirmar que A. el punto de ebullición sólo depende del número de carbonos. B. a mayor número de ramificaciones menor es el punto de ebullición. C. el punto de ebullición de los isómeros de un alcano es el mismo. D. a mayor número de ramificaciones mayor es el punto de ebullición. 3. A 20°C, un recipiente contiene un gas seco X. En el siguiente dibujo se muestra el Volumen del gas a diferentes presiones. La gráfica que mejor describe la variación del volumen cuando cambia la presión es Responda las preguntas 4 y 5 de acuerdo con la siguiente información La tabla muestra las temperaturas de ebullición de cuatro sustancias líquidas a 1 atmósfera de presión. 4. De acuerdo con la información de la tabla, es correcto afirmar que a 25ºC el líquido con mayor presión de vapor es el A. agua. B. éter etílico. C. metanol. D. benceno. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 129 PGF03-R03 5. De acuerdo con la información de la tabla, es correcto afirmar que a 70ºC, las sustancias que permanecen en estado líquido son A. metanol y agua. B. benceno y éter etílico. C. benceno y agua. D. metanol y éter etílico. 6. En la etiqueta de un frasco de vinagre aparece la información: «solución de ácido Acético al 4% en peso». El 4% en peso indica que el frasco contiene A. 4 g de ácido acético en 96 g de solución. B. 100 g de soluto y 4 g de ácido acético. C. 100 g de solvente y 4 g de ácido acético. D. 4 g de ácido acético en 100 g de solución. 7. En la siguiente tabla se muestran algunas propiedades físicas de los compuetos U, V y W. A 25ºC y 1 atm de presión, se mezclan en un recipiente abierto los compuestos U, V y W. Si estos compuestos son insolubles y no reaccionan entre sí, es muy probable que al aumentar la temperatura hasta 280ºC, el recipiente contenga A. los compuestos U y V en estado líquido y el compuesto W en estado sólido. B. el compuesto V en estado líquido y el compuesto W en estado sólido. C. el compuesto U en estado líquido, el compuesto W en estado sólido y los productos De la descomposición de V. D. el compuesto W en estado sólido y los productos de la descomposición de V. Responde las preguntas 8 a 10 de acuerdo con la siguiente información En la siguiente gráfica se muestra la relación entre [H+] y pH para varias sustancias. 8. Se requiere neutralizar una solución de NaOH, para ello podría emplearse A. amoníaco. B. agua. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 130 PGF03-R03 C. leche de magnesia. D. jugo gástrico. 9. Si el NaOH 1 M (hidróxido de sodio) es una base fuerte y el agua una sustancia neutra, es probable que la leche agria sea A. una base débil. B. una base fuerte. C. un ácido débil. D. un ácido fuerte. 10. Un tanque contiene agua cuyo pH es 7. Sobre este tanque cae una cantidad de lluvia ácida que hace variar el pH. De acuerdo con lo anterior, el pH de la solución resultante A. aumenta, porque aumenta [H+]. B. aumenta, porque disminuye [H+]. C. disminuye, porque aumenta [H+]. D. disminuye, porque disminuye [H+]. 11. La siguiente tabla muestra la cantidad de sustancia contenida en tres recipientes. Cada recipiente tiene un volumen de 22,4 litros y se encuentran a una temperatura de 0ºC. De acuerdo con la información de la tabla, es correcto afirmar que el número de moléculas contenidas en el recipiente 3 es A. el doble del número de moléculas que las contenidas en los recipientes 1 y 2. B. la mitad del número de moléculas que las contenidas en los recipientes 1 y 2. C. igual al número de moléculas contenidas en los recipientes 1 y 2. D. la suma del número de moléculas contenidas en los recipientes 1 y 12. Se tienen 1000 ml de una solución 0,5 M de KOH con pH = 13,7. Si a esta solución se le adiciona 1 mol de KOH es muy probable que A. permanezca constante la concentración de la solución. B. aumente la concentración de iones [OH-]. C. permanezca constante el pH de la solución. D. aumente la concentración de iones [H+]. 13. El compuesto 2-metíl-1-propino no puede existir, desde el punto de vista químico debido a que A. la cadena de carbonos presenta insaturaciones B. el compuesto contiene un radical C. el carbono es tetravalente D. el compuesto es saturado 14. La siguiente ecuación química representa la condensación aldólica de 2 moléculas de un aldehído. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 131 PGF03-R03 Un científico se propone sintetizar el siguiente compuesto por medio de Condensaciones aldólicas sucesivas, utilizando un único aldehído y NaOH como catalizador Contesta las preguntas 15 y 16 teniendo en cuenta la siguiente información 15. De acuerdo con lo anterior, el compuesto M es A. 2,2 - dimetil - 1 - buteno B. 1 - penteno C. 3 - metil - 1 - buteno D. 2 - metil - 1 – buteno 16. La metiletilcetona reacciona con el reactivo de Grignard (CH 3 - Mg - Cl) produciendo un alcohol terciario y Mg (OH) Cl. De acuerdo con lo anterior la estructura más probable del alcohol es 17. A 25ºC y a 1 atmósfera de presión, se quema metano en presencia de oxígeno para producir dióxido de carbono y agua, tal como se indica en la siguiente ecuación CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 132 PGF03-R03 A. B. C. D. Con esta información, es válido afirmar que la reacción es exotérmica, porque la masa de los productos es mayor que la masa de los reactivos energía potencial de los productos es menor que la energía potencial de los reactivos masa de los reactivos es igual a la masa de los productos energía potencial de los reactivos es menor que la energía potencial de los productos Contesta las preguntas 18 y 19 de acuerdo con la siguiente gráfica 18. 1036,5 g de una solución acuosa 1m de ácido clorhídrico se mezclan con 1040g de una solución acuosa de hidróxido de sodio 1m a 0ºC. Se produce una reacción entre las sustancias como se describe en la siguiente ecuación 19.De acuerdo con esta información, al finalizar la reacción se obtienen A. un compuesto y un elemento químico que forman una solución B. dos compuestos que forman una solución C. un compuesto y un elemento químico que forman una mezcla heterogénea D. dos compuestos que forman una mezcla heterogénea 20. Para preparar una solución acuosa saturada de cloruro de sodio (NaCl) a 20ºC es Necesario disolver A. 36 g de NaCl al 50% de pureza en 100 g de agua B. 10 g de NaCl al 25% de pureza en 100 g de agua C. 144 g de NaCl al 50% de pureza en 200 g de agua D. 60 g de NaCl al 25% de pureza en 200 g de agua Conteste las preguntas 21 y 22 de acuerdo con la siguiente información La siguiente ecuación química representa la reacción de neutralización de una solución de ácido sulfúrico con una solución de hidróxido de sodio CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 133 PGF03-R03 21. Si 100 ml de una solución de H2SO4 de concentración 0,1M se diluye a 1L, es válido afirmar, que para neutralizar la solución diluida se necesitan 2L de una solución de NaOH de concentración A. 0,005M B. 0,1M C. 0,05M D. 0,01M 22. Para obtener Na2SO4 sólido a partir de una solución acuosa de H2SO4 es necesario A. neutralizar la solución de H2SO4 y destilar B. evaporar la solución de H2SO4 C. neutralizar la solución de H2SO4 y evaporar D. destilar la solución de H2SO4 Contesta las preguntas 23 y 24 de acuerdo con la siguiente información La primera energía de ionización es la mínima cantidad de energía que se requiere para remover el electrón atraído con menor fuerza a un átomo gaseoso para formar un ion con carga 1+. La afinidad electrónica es la cantidad de energía absorbida por un átomo neutro gaseoso al adquirir un electrón para formar un ión con carga 123. De acuerdo con esta información, es válido afirmar que la energía de ionización necesaria para remover un segundo electrón y formar un ión con carga 2+ es A. mayor que la primera energía de ionización, debido a que la fuerza de atracción que ejerce el núcleo sobre el segundo elec trón es mayor B. mayor que la primera energía de ionización, debido a que el segundo electrón se encuentra en un nivel de mayor energía C. menor que la primera energía de ionización, debido a que el tamaño del ión es menor que el tamaño del átomo D. menor que la primera energía de ionización, debido a que la fuerza de atracción que ejerce el núcleo sobre el segundo electrón es menor 24. La forma correcta de representar la formación de los iones M-(g) y R+(g) es 25. Se mezcla 1 litro de una solución acuosa 2M de KI con 1 litro de solución acuosa 4M de Pb(NO3)2, los cuales reaccionan como se describe en la siguiente ecuación CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 134 PGF03-R03 De acuerdo con lo anterior, es válido afirmar que después de que ocurre la reacción quedan en solución A. 3 moles de Pb2+ y 3 moles de NO3 B. 2 moles de K+ y 2 moles de NO3 C. 1 mol de Pb2+ y 2 moles de NO3 D. 3 moles de Pb2+ y 6 moles de NO26. Teniendo en cuenta la disociación de los siguientes compuestos en agua es probable que la concentración de iones H+ en cuando a la solución se adiciona A. CH3COOH B. CH3COONa C. NaCl D. HNO3 27. 119. A 50ºC y 1 atmósfera de presión, un cilindro de volumen variable contiene oxígeno. La gráfica representa el cambio en el volumen del cilindro en función de la temperatura para dos etapas de un proceso Si durante el proceso el número de moles del gas permanece constante, la presión del oxígeno en la etapa 1 A. aumenta y en la etapa 2 disminuye B. disminuye y en la etapa 2 permanece constante C. permanece constante y en la etapa 2 aumenta D. permanece constante y en la etapa 2 disminuye Conteste las preguntas 28 y 29 de acuerdo con la siguiente situación El volumen máximo del recipiente mostrado en la figura es de tres (3) litros y se alcanza una vez la tapa se desplaza hasta los topes. Cuando el volumen es menor, la tapa ejerce una presión constante sobre el oxígeno contenido en el recipiente. El oxígeno se comporta como gas ideal. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 135 PGF03-R03 28. Es válido afirmar que cuando el oxígeno ocupa 1,5 litros, la temperatura en el recipiente es de aproximadamente A. 600 K B. 300 K C. 450 K D. 150 K 29. Teniendo en cuenta que el máximo volumen se alcanza cuando la temperatura en el recipiente es de 900 K, la gráfica que representa la presión en función de la temperatura en el recipiente es CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 136 PGF03-R03 GUIA DE LABORATORIO ACTIVIDAD EXPERIMENTAL N° 1 Formar grupos de cuatro estudiantes para organizar las siguientes actividades: Actividad 1: En una probeta colocar 40 ml de agua, después introduzca la pipeta dentro de la probeta y mida 10 ml, 2 ml, 5 ml, 3 ml, y 1 ml, este último ml dejarlo caer gota a gota. ¿Cuántas gotas salieron del ml?. Ahora tomar el picnómetro llenarlo de agua registrar su medición, verter el contenido en una probeta a un beaker. Registrar su medición. ¿Cuál de los tres implementos es más exacto? ¿Sustentar por qué?. Graficar lo observado. Actividad 2: Con ayuda del asesor o auxiliar de laboratorio armar el montaje de la bureta. Cerrar la llave de la bureta utilizando el embudo, colocar agua hasta su nivel cero. Dejar caer gota a gota en el beaker 1 ml. ¿Cuántas gotas salieron?. Repetir el procedimiento varias veces. Graficar. Cambiar la bureta por el embudo de separación. Actividad 3: Aprendamos a manejar el mechero. Con el trípode, malla de asbesto y beaker realizar un montaje para calentar agua, registrar varias veces su temperatura 30 C, 35 C, 40 C, 43 C, y 45 C. Graficar lo observado. Actividad 4: Tomar un balanza. Identificar sus partes graficar. Equilibrar la balanza. Registrar los pesos de: un borrador, lápiz, lapicero, anillo, regla, cuaderno, calculadora y un arete. Después coloque un objeto que registre los siguientes pesos o aproximados; 4.5 g, 8.9 g, 15.6 g,0.8 g, 0.2 g. Actividad 5: Presentar informe con las gráficas realizadas durante la experiencia. Preparar evaluación por grupo. Propiedades de los compuestos orgánicos Propósito: Identificar compuestos orgánicos de acuerdo a lo expuesto en la parte teórica. Analizar los compuestos orgánicos en sus propiedades físicas. Fundamento teórico De acuerdo con el número de átomos de carbono el hidrocarburo recibe un nombre determinado. Las propiedades físicas de los compuestos orgánicos dependen tanto del número y de la clase de átomos de la molécula como su estructura. Los alcanos son compuestos neutros, de densidad menor que la unidad. Para analizar puntos de ebullición se realizan gráficos ilustrativos. Los alcanos son casi completamente insolubles en agua. La solubilidad ene agua disminuye al aumentar el peso molecular del alcano. La baja solubilidad en el agua se debe a la baja polaridad del enlace carbono-hidrogeno. Pero los alcanos son solubles en disolventes orgánicos. PROCEDIMIENTO 1. Tomar como referencia para esta actividad cinco sustancias orgánicas cualquiera,(naftaleno, glucosa, ácido pícrico, ácido tartárico y urea.). Elabore un cuadro de propiedades, así: CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 137 PGF03-R03 Formula condensada Peso molecular Estado natural Color Olor Solubilidad en agua Solubilidad en solvente orgánico Para los dos últimos puntos proceder de la siguiente manera: Tomar un poco de la muestra con una espátula y adicionar al recipiente que contenga el solvente, agitar y observar el resultado, repetir el procedimiento con cada una de las muestras. Graficar lo observado. 2. Tomar una pequeña cantidad de sacarosa(azúcar de caña), mezclarla con una pequeña cantidad de óxido de cobre; llevarlas a un tubo de ensayo con desprendimiento lateral, taparlo herméticamente, calentar suavemente y recoger los vapores desprendidos en otro tubo que contenga agua de cal. Elaborar una gráfica del proceso. Determinar el cambio ocurrido en el tubo que tiene la mezcla. ¿Qué papel desempeña el óxido de cobre?. ¿Qué sucede en el tubo que contiene el agua de cal?. Si considera haber presenciado alguna reacción escribir la ecuación correspondiente. ¿Cómo titularía esta actividad?. 3. Utilizando un tubo capilar, depositar dentro de él una muestra de 1 cm de urea o naftaleno; sujetar el capilar a un termómetro, bien sea con un hilo de caucho o un alambre fino. Registrar inicialmente la temperatura en el termómetro, introducir el complejo a un balón de KJELDAHL que contenga aceite mineral o glicerina, colocar el montaje sobre un soporte universal y calentar suavemente; observar el preciso momento en donde el sólido comienza a cambiar de estado; registrar la temperatura, siga observando hasta cuando todo el sólido se licue y observe nuevamente la temperatura. Elaborar una gráfica del montaje completo. ¿Qué se pretende con esta actividad? ¿Por qué se utiliza glicerina o aceite mineral en lugar del agua? ¿Cuál es la temperatura registrada en el momento del cambio de estado? ¿Qué nombre le daría a esta actividad? 4. En un beaker pequeño colocar unos ml de etanol, metanol o cualquier sustancia orgánica líquida, tomar la temperatura del líquido; someter el recipiente a un baño de agua María observar detenidamente el proceso y registrar la temperatura en el momento que comienza a hervir. Diseñar una gráfica del montaje de la experiencia. Describir el proceso ocurrido en el cambio de la sustancia. ¿Cómo se titularía esta actividad y por qué? CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 138 PGF03-R03 ACTIVIDAD EXPERIMENTAL N° 2 HIDROCARBUROS AROMÁTICOS Propósito: Identificar estructura y propiedades de los hidrocarburos aromáticos pero sobretodo desarrollar habilidades para elaborar e interpretar situaciones. FUNDAMENTO TEORICO Según El escritor romano Plinio, las mujeres romanas se perfumaban con tal exageración que su proximidad en la calle se conocía a cierta distancia por el aroma que emanaban sus vestidos y cabellos. También los hombres se perfumaban en abundancia, sobre todo con bálsamo y canela. Estos perfumes que aún hoy se utilizan en todo el mundo, ocupan un lugar preferencial en la industria química, en la que se les conoce como compuestos aromáticos. Los compuestos aromáticos son hidrocarburos que se caracterizan por ser cíclicos e insaturados. El compuesto que los representa a todos es el Benceno y todos los que tengan un comportamiento similar a él. PROCEDIMIENTO 1. Tomar un balón marcarlo como A y agregar agua hasta la mitad de su capacidad. 2. Marcar otro balón como B y colocar otra porción de agua similar con la materia prima que se va a tratar(seleccione entre: canela, hojas de eucalipto, rosas, etc.) 3. Prepare un montaje para destilación, con los balones marcados; con ayuda del asistente de laboratorio o el docente. 4. Destilar calentando el balón A 5. Recoger el destilado en un erlenmeyer. 6. Envasar la esencia obtenida en recipientes de vidrio ámbar, bien cerrados. 7. Realizar graficas de la experiencia en el cuaderno de notas del laboratorio. 8. Responder las siguientes preguntas: ¿Qué componentes tiene la materia prima tratada? ¿Qué utilidad le encuentra a estas esencias? ¿Qué propiedades físicas y químicas tienen las sustancias aromáticas? Escribir un texto relacionado con los hidrocarburos aromáticos. Cree un concepto sobre: ¿Qué significa el nombre compuesto aromático? ACTIVIDAD EXPERIMENTAL N° 3 LOS HIDROCARBUROS Propósito: preparar experimentalmente un ALCANO a partir del acetato de sodio. Preparar experimentalmente un ALQUENO por deshidratación de alcohol. Preparar experimentalmente un ALQUINO a partir del carburo de calcio. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 139 PGF03-R03 Determinar conclusiones sobre el trabajo realizado con lo anteriormente expuesto. Determinar un concepto teórico válido para recopilar en síntesis el proceso químico anterior. FUNDAMENTO TEORICO Uno de los conceptos mas importantes en la química orgánica, es el grupo funcional, pues proporciona la base para separarlos en clases o familias de rasgos característicos. Por ejemplo, todos los hidrocarburos que contienen un doble enlace carbono a carbono, además de los enlaces simples carbono a carbono, poseen una serie similar de propiedades diferentes de las que son características de los ALCANOS. Igualmente, todos los compuestos que contienen un triple enlace carbono a carbono tienen un grupo de propiedades únicas. Ambos enlaces carbono a carbono, doble y triple enlace, son grupos funcionales. Existen varias formas de obtener los compuestos orgánicos, en síntesis de laboratorio, como reacciones de tipo de adición, o por sustitución. Procedimiento 1 OBTENCIÓN DEL METANO Inicialmente se arma un aparato apoyado en un soporte que contenga: Un mechero, un tubo de ensayo grande, un tubo de ensayo mediano, dos tapones horadados para los tubos, mangueras de uniones, beaker grande de 1000 ml. Después de tener el aparato armado y con la ayuda del profesor, proceder de la siguiente manera: Pulverizar conjuntamente en un mortero 3 g de acetato de sodio, 1.5 g de hidróxido de sodio y 1.5 g de óxido de calcio( escribir la fórmula de cada uno). Llevar la mezcla al tubo de ensayo grande, caliente suavemente hasta efervecer. Introducir previamente el tubo de ensayo mediano invertido con agua adentro del beaker que también contiene agua. Dejar escapar los primeros vapores que se desprenden del calentamiento y luego recoger los siguientes en el tubo de ensayo. Si la cantidad de gas desprendido es suficiente puede recogerlo con otro tubo de ensayo y tenerlos tapados. Tomar una astilla en ignición e introducir en uno de los tubos sosteniéndolo boca abajo. Procurar ser minucioso y observar detenidamente el contacto y analice. Responder estos cuestionamientos: 1. 2. 3. 4. 5. Desarrollar la reacción que se produce. Determinar el papel de la cal sodada(mezcla) Qué característica presenta el gas obtenido. Qué propiedades presenta el gas al ser puesto en contacto con la astilla en ignición. Realizar gráfica del procedimiento. Procedimiento 2 OBTENCIÓN DE ETENO Armar nuevamente el aparato apoyado en los siguientes implementos: CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 140 PGF03-R03 Dos soportes con sus pinzas, dos tubos de ensayo grande, dos tubos medianos, dos tapones horadados, mangueras y uniones, un beaker de 1000 ml, un mechero. Después de tener el aparato armado y con la ayuda del auxiliar de laboratorio o del docente, proceder en la siguiente marcha: Preparar una solución acuosa de hidróxido de sodio al 10% p/v y verter 10 ml al tubo vertical del aparato. En el tubo generador (inclinado) tome 5 ml de ácido sulfúrico concentrado y luego unas piedras pequeñas para sincronizar la ebullición. Caliente rápidamente y deje que se escapen los primeros vapores para recoger luego en los tubos sobre agua como se hizo en el procedimiento Después de recoger los vapores dejar en contacto el gas desprendido con una solución sencilla de permanganato de potasio. A los tubos que contienen el gas aplicar la prueba de la astilla conforme lo hicimos en la actividad 1. Actividad: responde estos cuestionamientos: 1. 2. 3. 4. 5. 6. 7. 8. Desarrollar de manera escrita la reacción producida .Determinar el papel del ácido sulfúrico. .Determinar el papel de la solución de hidróxido de sodio. Determinar las características del gas obtenido(color, olor, etc.) Qué le sucede al tubo que contiene la solución de permanganato de potasio. Qué explicación tiene para el comportamiento anterior. De acuerdo a lo sucedido en el tubo generador; cómo puede clasificarse la reacción? Realizar gráfica del procedimiento. Procedimiento 3 OBTENCIÓN DE ETINO Arme un aparato apoyado en los siguientes instrumentos de laboratorio. Un balón pequeño con desprendimiento lateral, un soporte universal con su pinza, un tapón horadado, una manguera con su Terminal de vidrio terminada en una punta fina, un embudo separación. Luego seguir las siguientes instrucciones: de Colocar en el balón un poco de carburo de calcio. Deje caer lentamente desde el embudo gota a gota de agua (con precaución) Acerque a la punta de la manguera una cerilla encendida. Actividad Responder los siguientes cuestionamientos: 1. Desarrolle la reacción producida en forma escrita. 2. A qué se debe la acción sucedida en la punta de la manguera. 3. Qué características tiene el gas que se produce conjuntamente con el gas. 4. Cómo se llama el gas desprendido. 5. Consultar otras propiedades del gas. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 141 PGF03-R03 ACTIVIDAD EXPERIMENTAL N° 4 LOS ALCOHOLES Propósito: observar el comportamiento de los alcoholes frente a los agentes oxidantes. FUNDAMENTO TEORICO Tanto Los alcoholes como los fenoles y los éteres son compuestos que presentan un enlace sencillo carbono a oxígeno. Los alcoholes son compuestos alifáticos que presentan uno o más grupos funcionales (-OH); los fenoles son compuestos aromáticos que contienen uno o más grupos hidroxilo unidos a un núcleo aromático. Los éteres se caracterizan por presentar un oxigeno unido a dos átomos de carbono. Estos compuestos pueden considerarse como productos de sustitución del agua: los alcoholes, y los fenoles son derivados monosustituidos, mientras que los éteres son derivados disustituidos. AGUA: ALCOHOLES: FENOLES: ETERES: H-O-H R-OH Ar-OH R-O-R¨ Los alcoholes pueden ser primarios, secundarios y terciarios; También se puede decir que son monoles, dioles y trioles.. Procedimiento 1. OXIDACIÓN DE LOS ALCOHOLES 1. En una gradilla marcar tres tubos de ensayo del 1 al 3; agregar las siguientes cantidades de sustancias: TUBO 1: 2 ml de agua + 2 ml de ácido sulfúrico concentrado. TUBO 2: 2 ml de agua + 2 ml de Hidróxido de sodio 6 M. TUBO 3: 2 ml de agua + 2 ml de Permanganato de potasio 0.01 M. 2. A cada tubo adicionar 2 ml de etanol, agitar suavemente y observar. 3. Los tres tubos representan medios diferentes, determinar en cuál medio la reacción es positiva. 4. Graficar el procedimiento observado. 5. Responder los cuestionamientos. ¿Qué es un agente oxidante? ¿Cómo clasifica los tres medios donde se realizan las pruebas? Explique las reacciones para cada tubo y consulte en el caso que lo requiera. Procedimiento 2 Oxidación de alcoholes primarios, secundarios y terciarios CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 142 PGF03-R03 1. En una gradilla numere tres tubos de ensayo del 1 al 3; a cada uno agregar 2 ml de solución de dicromato de potasio al 1 % p/v y tres gotas de ácido sulfúrico, agitar fuertemente. Adicionar a cada tubo alcohol así: TUBO 1: 0.5 ml de alcohol etílico. TUBO 2: 0.5 ml de alcohol sec-butílico. TUBO 3: 0.5 ml de alcohol ter-butílico. 2.Calentar a baño María los tres tubos y observar. Notar el olor en los productos obtenidos. 3.Registrar los datos obtenidos y graficar el montaje realizado y los cambios. 4.Responder a las siguientes preguntas de acuerdo a lo realizado: ¿Para qué tipo de alcohol la prueba es positiva?. ¿Por qué?. ¿Cómo se manifiesta esta prueba?. Procedimiento 3 Accion de la prueba de lucas en alcoholes. 1. En una gradilla marcar tres tubos de ensayo del 1 al 3; agregar a cada uno 2 ml de reactivo de Lucas, proceder de la siguiente manera: TUBO 1: 5 gotas de alcohol etílico y agitar. TUBO 2: 5 gotas de alcohol sec-butílico y agitar. TUBO 3: 5 gotas de alcohol ter-butílico y agitar. 2. Dejar reposar los tres tubos por un espacio largo(enfrié) y observar. 3.Graficar el montaje realizado y los cambios vistos. 4.De acuerdo a lo trabajado responder: ¿Con cuál alcohol responde positivamente la prueba de Lucas.? ¿Cómo se manifiesta la prueba?, describir. ¿Cómo relaciona el tiempo en las tres pruebas? Anotar la formula estructural para cada alcohol. Utilice la bibliografía si es necesario. ¿En qué consiste el reactivo de Lucas?. Consultar las fórmulas de los siguientes alcoholes. -Alcohol etílico. -Alcohol metílico. -Alcohol iso-propílico. -Glicol. -Glicerina. Con ayuda de la bibliografía o del medio electrónico consultar las principales fuentes de estos alcoholes y las reacciones básicas de ellos. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 143 PGF03-R03 BIBLIOGRAFÍA DOMÍNGUEZ, Jorge. Experimentos de química orgánica. FERNÁNDEZ, Myriam S. Spin Química 11. Voluntad. GUTIERREZ, Riveros Lilia. Química 11 .Educar Editores. HENAO, J de J. Química orgánica tomo II LONGMAN, L. Química 2 manual. RIVEROS, Lilia. Química 2. INVESTIGUEMOS 11. Química voluntad. SCHEM, Study. Manual de laboratorio.susaeta. PEÑA, Gomes. Yadira.Química 2 Santillana. CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 144 PGF03-R03 WEBGRAFIA www.laboratorioencasa.com.co www.multired.com/ciencia/pedalseg/intro www.chemicool.com www.multired.com/ciencia/pedalseg/intro http://www.infonegocio.com/csanvima/alumnos/organica/ejerciciosalc.htm#pp http://genesis.uag.mx/edmedia/material/quimicaII/eteresalcoho.cfm http://www.galeon.hispavista.com/scienceducation/ejerciciosqo1.htm www.chemicool.com http://www.pdf-search-engine.com/guia-ejercicios-quimica-pdf.html http://www.quimicaweb.net/grupo_trabajo_fyq3/tema4/index4.htm http://docencia.izt.uam.mx/cuhp/QuimOrgIII/T_3Aldehidos.pdf CIENCIAS NATURALES Y EDUCACION AMBIENTAL - Química 11 145


![resumen PRIMER DIA [Modo de compatibilidad]](http://s2.studylib.es/store/data/005786270_1-64b7003e0453af23a01b5a7ce6ff1139-300x300.png)