SOLUCIONARIO DEL LIBRO DE QUÍMICA DE 2 DE
Anuncio
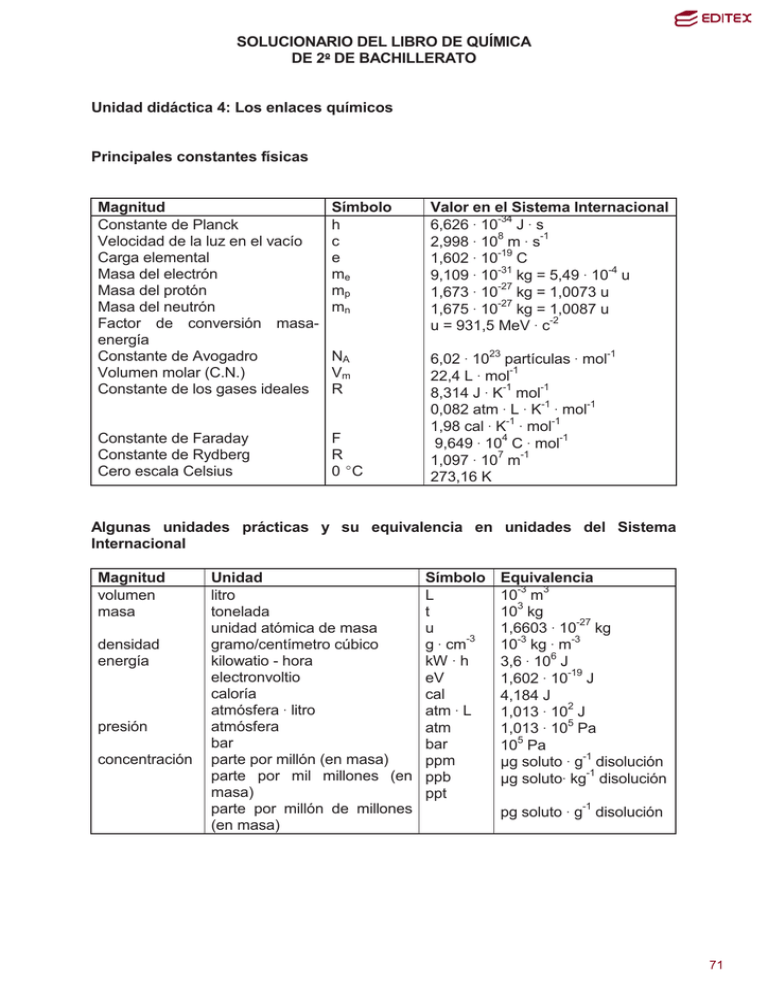
SOLUCIONARIO DEL LIBRO DE QUÍMICA DE 2 DE BACHILLERATO Unidad didáctica 4: Los enlaces químicos Principales constantes físicas Magnitud Constante de Planck Velocidad de la luz en el vacío Carga elemental Masa del electrón Masa del protón Masa del neutrón Factor de conversión masaenergía Constante de Avogadro Volumen molar (C.N.) Constante de los gases ideales Símbolo h c e me mp mn Valor en el Sistema Internacional 6,626 $ 10-34 J $ s 8 -1 2,998 $ 10 m $ s 1,602 $ 10-19 C -31 -4 9,109 $ 10 kg = 5,49 $ 10 u 1,673 $ 10-27 kg = 1,0073 u 1,675 $ 10-27 kg = 1,0087 u u = 931,5 MeV $ c-2 NA Vm R Constante de Faraday Constante de Rydberg Cero escala Celsius F R 0 (C 6,02 $ 1023 partículas $ mol-1 22,4 L $ mol-1 8,314 J $ K-1 mol-1 0,082 atm $ L $ K-1 $ mol-1 1,98 cal $ K-1 $ mol-1 9,649 $ 104 C $ mol-1 1,097 $ 107 m-1 273,16 K Algunas unidades prácticas y su equivalencia en unidades del Sistema Internacional Magnitud volumen masa densidad energía presión concentración Unidad litro tonelada unidad atómica de masa gramo/centímetro cúbico kilowatio - hora electronvoltio caloría atmósfera $ litro atmósfera bar parte por millón (en masa) parte por mil millones (en masa) parte por millón de millones (en masa) Símbolo L t u g $ cm-3 kW $ h eV cal atm $ L atm bar ppm ppb ppt Equivalencia 10-3 m3 103 kg 1,6603 $ 10-27 kg 10-3 kg $ m-3 3,6 $ 106 J 1,602 $ 10-19 J 4,184 J 2 1,013 $ 10 J 1,013 $ 105 Pa 105 Pa ȝg soluto $ g-1 disolución ȝg soluto$ kg-1 disolución pg soluto $ g-1 disolución 1 71 Z 89 13 51 18 33 85 16 56 4 83 5 35 48 20 6 58 55 30 40 17 27 29 36 24 21 50 38 9 15 87 31 32 72 2 1 26 49 77 57 Elementos químicos más utilizados y sus masas atómicas en u Símbolo Nombre masa Z Símbolo Nombre masa Ac Actinio 227 3 Li Litio 6,491 Al Aluminio 26,98 12 Mg Magnesio 24,31 Sb Antimonio 121,8 25 Mn Manganeso 54,94 Ar Argón 39,95 80 Hg Mercurio 200,6 As Arsénico 74,92 42 Mo Molibdeno 95,94 At Astato 210 60 Nd Neodimio 144,2 S Azufre 32,07 10 Ne Neón 20,18 Ba Bario 137,3 28 Ni Níquel 58,69 Be Berilio 9,012 7 N Nitrógeno 14,01 Bi Bismuto 209,0 102 No Nobelio 253 B Boro 10,81 79 Au Oro 197,0 Br Bromo 79,90 76 Os Osmio 190,2 Cd Cadmio 112,4 8 O Oxígeno 16,00 Ca Calcio 40,08 46 Pd Paladio 106,4 C Carbono 12,01 47 Ag Plata 107,9 Ce Cerio 140,1 78 Pt Platino 195,1 Cs Cesio 132,9 82 Pb Plomo 207,2 Zn Cinc 65,39 94 Pu Plutonio 242 Zr Circonio 91,22 84 Po Polonio 210 Cl Cloro 35,45 19 K Potasio 39,10 Co Cobalto 58,93 59 Pr Praseodimio 140,9 Cu Cobre 63,55 91 Pa Protoactinio 231 Kr Criptón 83,80 88 Ra Radio 226 Cr Cromo 52,00 86 Rn Radón 222 Sc Escandio 44,96 45 Rh Rodio 102,9 Sn Estaño 118,7 37 Rb Rubidio 85,47 Sr Estroncio 87,62 34 Se Selenio 78,96 F Flúor 19,00 14 Si Silicio 28,09 P Fósforo 30,97 11 Na Sodio 22,99 Fr Francio 223 81 Tl Talio 204,4 Ga Galio 69,72 43 Tc Tecnecio 99 Ge Germanio 72,59 52 Te Telurio 127,6 Hf Hafnio 178,5 22 Ti Titanio 47,88 He Helio 4,003 90 Th Torio 232,0 H Hidrógeno 1,008 74 W Volframio 183,9 Fe Hierro 55,85 92 U Uranio 238 In Indio 114,8 23 V Vanadio 50,94 Ir Iridio 192,2 54 Xe Xenón 131,3 La Lantano 138,9 53 I Yodo 126,9 2 72 Cuestiones iniciales 1. Explica por qué conduce la electricidad: a) Una disolución acuosa de KCl. b) La sal fundida CaCl2. c) El metal plata. a) Una disolución acuosa de KCl porque en disolución existen libres los iones de K+ y Cl b) La sal fundida CaCl2 porque en estado fundido existen libres los iones Ca 2+ - y Cl c) Un metal como la plata por las características del enlace metálico. 2. Por qué los elementos químicos típicamente metálicos, como el cobre o el níquel, pueden cambiar fácilmente su forma al golpearlos con un martillo sin que se rompan. Por las propiedades que manifiesta el enlace metálico, a diferencia de los sólidos iónicos que se rompen fácilmente y no se moldean como los metales. 3. Por qué en los lagos muy profundos el agua casi nunca se hiela, mientras que los poco profundos se congela fácilmente. La existencia de enlaces por puentes de hidrógeno hace que el agua tenga su máxima densidad a 4 (C y, por tanto, se deposita a esa temperatura en el fondo del lago en forma de agua líquida. Si el lago es profundo, sólo se hiela la capa superficial que aísla el resto, quedando el fondo sin solidificarse, y esto hace posible que siga existiendo la vida durante las épocas invernales bajo la capa de hielo. Actividades finales 1. Escribe el diagrama de Lewis de la molécula de Cl2CO y determina cuál es su geometría empleando la teoría de la repulsión de pares de electrones. Indica si puede formar enlaces por puentes de hidrógeno. El diagrama de Lewis es el siguiente: ·· ·· :Cl:C::O: ·· ·· :Cl: ·· La forma esperada de la molécula de Cl2CO, de acuerdo con la teoría de la repulsión de pares de electrones, es triangular: O || C » \ Cl Cl 3 73 El triángulo es isósceles, ya que presenta dos enlaces iguales C-Cl y uno diferente el doble enlace C=O. Esta molécula no puede formar enlaces por puentes de hidrógeno, pues carece de átomos de hidrógeno. 2. Indica cuál es la geometría del tricloruro de nitrógeno y justifica su diferencia con la forma geométrica del tricloruro de boro. El diagrama de Lewis del tricloruro de nitrógeno es: ·· ·· ·· :Cl:N:Cl: ·· ·· :Cl: ·· Mientras que el diagrama de Lewis del tricloruro de boro es: ·· ·· :Cl:B:Cl: ·· ·· :Cl: ·· La diferencia es que el N tiene un par de electrones no enlazantes y el boro no, por ello la molécula de tricloruro de nitrógeno tiene una disposición tetraédrica y el tricloruro de boro es plano triangular. En el tricloruro de nitrógeno, el par d electrones no enlazantes se dirige hacia el vértice de un supuesto tetraedro, por lo que la geometría de la molécula de NCl3 es la de una pirámide de base triangular. 3. Explica el tipo de enlace que se puede formar entre los elementos químicos A y B, si sus números atómicos son respectivamente 9 y 20 y cuál es la fórmula del compuesto químico resultante. A con Z = 9 tiene la configuración electrónica 1s2 2s2 2p5, y es el primer halógeno, el F. B con Z = 20 tiene la configuración electrónica 1s2 2s2 2p6 3s2 3p6 4s2 y es el tercer alcalinotérreo, el Ca. El enlace entre A y B es iónico. A captura un electrón para formar A- y B pierde dos electrones para originar B2+. Por tanto, la fórmula empírica del compuesto químico resultante es BA2, o mucho mejor CaF2. 4. Ordena de mayor a menor energía reticular los siguientes compuestos iónicos: BaS, NaCl, NaI, BaO. Justifica la respuesta. La energía reticular depende de la intensidad de las fuerzas con que están unidos los 4 74 iones en la red cristalina iónica. Puesto que las uniones son de tipo electrostático, regidas por la ley de Coulomb, se puede afirmar que alta carga y pequeño tamaño originan uniones muy intensas y, por tanto, altos valores de la energía reticular. De los cuatro compuestos iónicos dados se pueden diferenciar dos parejas: por un lado, NaCl y NaI, donde todos los iones tienen carga unidad y, por otro, BaO y BaS, en los que la carga eléctrica es dos. Luego estos dos últimos compuestos tendrán mayor energía reticular que NaCl y NaI. Puesto que el O es más pequeño que el S y en la otra pareja de compuestos iónicos, el Cl es más pequeño que el I, el orden es el siguiente: BaO > BaS > NaCl > NaI 5. A partir de los datos que se dan del yoduro de potasio, calcula la afinidad electrónica del yodo a través del ciclo de Born-Haber. Datos: Energía de formación del KI (s) = - 327 kJ/mol; Energía de sublimación del K (s) = 90 kJ/mol; Energía de sublimación del I2 (s) = 62 kJ/mol; Energía de disociación del I2 (g) = 149 kJ/mol; Energía de ionización del K (g) = 418 kJ/mol; Energía reticular del KI (s) = - 633 kJ/mol. Mediante el ciclo de Born-Haber ocurre: Sublimación: K (s) → K (g); Sublimación: ½ I 2 (s) → ½ I2 (g); + Ionización: K (g) → K (g) + e ; Disociación: I2 (g) → I (g); Ionización: I (g) + e- → I- (g); + Asociación: K (g) + I (g) → KI (s); Es del K = 90 kJ/mol Es del I2 = ½ mol · 62 kJ/mol EI = 418 kJ/mol ½ · E d = ½ mol · 149 kJ/mol ¿AE? Er = - 633 kJ/mol Considerando dichos procesos como ecuaciones, la suma algebraica de todas ellas origina: K (s) + I2 (s) → KI (s); Ef = - 327 kJ/mol donde: Ef = Es del K + ½ Es del I2 + EI + Ed + AE + Er Despejando AE resulta: AE = Ef – [Es del K + ½ Es del I2 + EI + Ed + Er] Por tanto: AE = - 327 kJ – [ 90 kJ + ½ · 62 kJ + 418 kJ + ½ · 149 kJ + ( - 633 kJ)] = - 307,5 kJ 6. Calcula la energía de formación del cloruro de magnesio a partir de los siguientes datos: Energía reticular del MgCl2 (s) = - 2524 kJ/mol; Energía de sublimación del Mg (s) = 147,7 kJ/mol; Energía de disociación del Cl2 (g) = 244 kJ/mol; Energía total de ionización del Mg a Mg2+ (g) = 2188,4 kJ/mol; Afinidad electrónica del Cl (g) = - 348,6 kJ/mol. Mediante el ciclo de Born-Haber ocurre: Sublimación: Mg (s) → Mg (g); 2+ Ionización: Mg (g) → Mg (g) + 2 e ; Disociación: Cl2 (g) → 2 Cl (g); Es = 147,7 kJ/mol EI = 2188,4 kJ/mol Ed = 244 kJ/mol 5 75 - - Ionización: 2 Cl (g) + 2 e → 2 Cl (g); Asociación: Mg2+ (g) + 2 Cl- (g) → MgCl2 (s); 2 · AE = 2 mol · ( - 348,6 kJ/mol) Er = - 2524 kJ/mol Considerando dichos procesos como ecuaciones, la suma algebraica de todas ellas origina: Mg (s) + Cl2 (s) → MgCl2 (s); ¿Ef? donde: Ef = Es + EI + Ed + 2 · AE + Er Por tanto: Ef = 147,7 kJ + 2188,4 kJ + 244 kJ + 2 · (-348,6 kJ) + (- 2524 kJ) = - 641,1 Kj 7. Halla la energía reticular del óxido de magnesio a partir de los siguientes datos: Energía de formación del MgO (s) = - 605 kJ/mol; Energía de sublimación del Mg (s) = 147,7 kJ/mol; Energía de disociación del O2 (g) = 494 kJ/mol; Energía total de ionización del Mg a Mg2+ (g) = 2188,4 kJ/mol; Afinidad electrónica del O a O2- (g) = 737 kJ/mol. Mediante el ciclo de Born-Haber ocurre: Sublimación: Ionización: Disociación: Ionización: Asociación: Mg (s) → Mg (g); Mg (g) → Mg2+ (g) + 2 e-; ½ O 2 (g) → O (g); 2O (g) + 2 e → O (g); 2+ 2Mg (g) + O (g) → MgO (s); Es = 147,7 kJ/mol EI = 2188,4 kJ/mol ½ · E d = ½ · 494 kJ/mol AE = 737 kJ/mol) ¿Er? Considerando dichos procesos como ecuaciones, la suma algebraica de todas ellas origina: Mg (s) + ½ O 2 (s) → MgO (s); Ef = - 605 kJ/mol donde: Ef = Es + EI + ½ · E d + AE + Er Por tanto: Er = Ef – [Es + EI + Ed + AE] Por tanto: Er = - 605 kJ – [147,7 kJ + 2188,4 kJ + ½ · 494 kJ + 737 kJ] = - 3925,1 kJ 8. Supongamos que los sólidos cristalinos siguientes, en cada uno de los grupos, cristalizan en el mismo tipo de red: 1) NaF, KF, LiF. 2) NaF; NaCl, NaBr. Indica razonando la respuesta: a) El compuesto químico con mayor energía reticular de cada grupo. b) El compuesto químico con menor temperatura de fusión de cada grupo. a) Considerando que la energía reticular depende de la carga y del tamaño de los iones, teniendo en cuenta que en los dos grupos el factor de carga es igual para todos los compuestos iónicos, el factor que va a decidir es el tamaño de los iones. Es decir, aquel compuesto con los cationes y aniones con tamaños más parecidos tendrá el mayor valor de la energía reticular (red más compacta), ya que al estar más próximos, la atracción entre ellos (de tipo electrostático) será más intensa. 6 76 En el grupo 1) los tres compuestos tienen en común el pequeño anión F-. Por tanto será el LIF el compuesto con mayor energía reticular, ya que el Li+ es el catión más pequeño. Análogamente en el grupo 2) existe un ión común a los tres; en este caso es el catión Na+. Y como el anión más próximo a él es el F-, el NaF es el compuesto iónico con mayor energía reticular. b) El compuesto iónico de menor temperatura de fusión será en cada grupo aquel que tenga el valor más bajo de la energía reticular. Teniendo en cuenta el razonamiento seguido en el apartado anterior, será el KF el del primer grupo y el NaBr el del segundo grupo. 9. Explica la constitución del ión carbonato, sabiendo que tiene una forma plana triangular. El átomo de C tiene 4 electrones de valencia y el O 6, de forma que los distintos enlaces covalentes del ión CO32- son: :O: ¨¨ C _ :O: :O: _ ·· ·· Y la forma es plana triangular, porque es la más estable para dicha disposición. 10. Las temperaturas de fusión de: a) Aluminio. b) Diamante. c) Agua. d) Nitrógeno son: -196 °C, 0 °C, 650 °C y 3550 °C, aun que no en ese orden. Asigna razonadamente a cada sustancia: a), b), c) y d) una temperatura de fusión, justificándola con el tipo de enlace y/o fuerza intermolecular que está presente en cada una de ellas. La temperatura de fusión está directamente relacionada con la mayor o menor intensidad de las fuerzas que mantienen unidas a las entidades elementales de una sustancia. Estas fuerzas son: - Aluminio: enlace metálico entre los átomos de aluminio. - Diamante: enlace covalente entre los átomos de carbono del sólido covalente reticular que forman. - Agua: enlaces por puentes de hidrógeno entre las moléculas de H2O. - Nitrógeno: fuerzas intermoleculares de Van der Waals de dispersión entre las moléculas de N2. La intensidad de estos cuatro tipos de fuerzas decrece en el orden: Enlace covalente en el sólido reticular > enlace metálico > enlace por puentes de hidrógeno > fuerzas de Van der Waals. 7 77 Por tanto, las temperaturas de fusión seguirán el mismo orden, es decir: 3550 °C del diamante > 650 °C del aluminio > 0 °C del agua > -196 °C del nitrógeno. 11. Dados los elementos químicos X, Y y Z, cuyos números atómicos son 19, 17 y 12, respectivamente, indica que tipo de enlace se forma cuando se unen X e Y, y cuando se unen entre sí átomos de Z. X con Z = 19 tiene la configuración electrónica 1s2 2s2 2p6 3s2 3p6 4s1, y es el tercer alcalino, el K. Y con Z = 17 tiene la configuración electrónica 1s2 2s2 2p6 3s2 3p5, y es el segundo halógeno, el Cl. 2 2 6 2 Z con Z = 12 tiene la configuración electrónica 1s 2s 2p 3s , y es el segundo alcalinotérreo, el Mg. Cuando se une un elemento muy electropositivo, como es X, con otro muy electronegativo, como es Y, el enlace es de tipo iónico. En el caso de Z, un metal, el enlace es de tipo metálico. 12. Las moléculas del CS2 y del HCN son lineales. Escribe sus diagramas de Lewis y justifica la polaridad de dichas moléculas. ·· ·· S::C::S ·· ·· y ·· H:C N En el CS2 hay dos momentos dipolares, ya que los enlaces carbono-azufre están polarizados hacia el S, más electronegativo. Sin embargo debido a la geometría lineal de la molécula se anulan y el resultado es un momento dipolar de la molécula igual a cero (molécula apolar). En el HCN, el enlace carbono-hidrogeno está polarizado hacia el carbono y el enlace carbono-nitrógeno hacia el nitrógeno. En este caso los dos momentos dipolares se suman o refuerzan y el resultado es una molécula polar. 13. Los siguientes enunciados son falsos: indica la razón de ello y reescríbelos correctamente: a) Para los siguientes cationes, el orden de tamaño del radio 3+ + 2+ iónico es: Al > Na > Mg . b) El azufre, el oxígeno y el selenio poseen covalencia 2, 4 y 6. a) Los tres iones son isoeléctronicos, tienen 10 electrones. Sin embargo, la carga positiva del núcleo aumenta está en el orden Na < Mg < Al. En consecuencia, la nube electrónica se contrae progresivamente disminuyendo la corteza electrónica y, por tanto, el radio iónico. Luego el orden correcto del radio iónico es: Na+ > Mg2+ > Al3+. 2 2 b) La covalencia del oxígeno es sólo 2, pues su configuración electrónica es 1s 2s 2 1 1 2px 2py 2pz y posee dos electrones desapareados con los que puede formar enlaces covalentes. 8 78 El azufre y el selenio sí que pueden tener covalencia 4 y 6, ya que disponen de orbitales d vacíos en el mismo nivel energético, el de n = 3 para el S y el de n = 4 para el Se. 2 Así, por ejemplo, para el S, como su configuración electrónica externa es: 3s 3px2 1 1 3py 3pz resulta que puede ocurrir las siguientes promociones: 2 1 1 1 Covalencia 4: 3s 3px1 3py1 3pz1 3d . 1 1 1 1 Covalencia 6: 3s 3px 3py 3pz 3d 3d . 14. Justifica por qué entre las moléculas de metanol, de fórmula CH3-OH se produce enlaces por puentes de hidrógeno mientras que no existe este tipo de enlace entre las moléculas de metanal de fórmula HCHO. El enlace por puentes de hidrógeno se da entre un átomo de F, O o N, que esté unido a un átomo de hidrógeno de una molécula, con un átomo de hidrógeno de una molécula vecina. O // La fórmula semidesarrollada del metanal es: H C \ H Y esta molécula no cumple con lo expuesto anteriormente: el átomo de O de la molécula no está unido directamente a un átomo de H. En resumen, el metanal carece de hidrógenos aptos para enlaces por puentes de hidrógeno. En el metanol sí se pueden dar enlaces por puentes de hidrógeno, pues es: CH3-O-H, y, por tanto, el átomo de O de una molécula pude unirse con el átomo de H del grupo hidroxilo de otra molécula vecina. 15. Describe la geometría de la molécula de trifluoruro de nitrógeno y en el estudio comparado de dicha molécula con la del agua, ¿cuál de los dos tiene mayor temperatura de ebullición y qué ángulo cabe esperar que será más abierto el H-OH o el F-N-F? ·· El diagrama de Lewis del agua es: H:O:H y el del trifluoruro de nitrógeno: ·· ·· ·· ·· :F:N:F: ·· ·· :F: ·· La molécula de H2O es angular y la de NF3 es piramidal El agua forma enlaces por puentes de hidrógeno y el trifluoruro de nitrógeno no, luego el agua tiene mayor temperatura de ebullición. La forma piramidal del NF3 tiene ligeramente un ángulo de enlace mayor que la angular del agua con dos pares de electrones no enlazantes. 9 79 16. Explica la formación de la molécula de trióxido de azufre, sabiendo que es plana triangular y admitiendo que por las medidas de las longitudes de los enlaces no todos los enlaces azufre-oxígeno son dobles enlaces. La configuración electrónica externa del azufre es: 3s2 3px2 3py1 3pz1. Esto indica que el azufre debería formar solamente compuestos en los que su covalencia fuese 2, con los números de oxidación - 2 o + 2, pero el azufre en el SO3 tiene el número de oxidación + 6. Este hecho se puede justificar teniendo en cuenta que en el azufre, por pertenecer al tercer período, puede existir un tránsito de electrones de valencia del último período a los orbitales 3d vacíos, ya que la diferencia de energía entre los orbitales 3s, 3p y 3d es pequeña. 3s 3p 3d Covalencia 6 La molécula de SO3 se puede explicar por la formación de 3 dobles enlaces azufreoxígeno y su geometría es triangular plana por ser la disposición resultante la más estable posible. .. :O: ·· :: ·· O :: S :: O : ·· ·· o bien: Diagrama de Lewis O O=S O Geometría Ahora bien, dicha molécula también puede explicarse mediante el uso de enlaces covalentes coordinados y en virtud de las medidas de las longitudes de los enlaces azufre-oxígeno, admitir que dicha molécula es en realidad: O ¸ O=S º O donde el azufre aporta dos electrones para formar un doble enlace con un átomo de oxígeno y con cada uno de los otros dos átomos de oxígeno aporta el par de electrones de enlace y formar así con estos átomos de oxígeno dos enlaces covalentes coordinados. Como el azufre aporta 6 electrones de enlace, su número de oxidación en el SO3 es + 6. 17. ¿Por qué el átomo de carbono tiene una covalencia igual a 4, aunque sólo dispone de dos electrones desapareados en su configuración electrónica externa? La configuración electrónica externa del carbono es: 2s2 2px1 2py1 y lo lógico es admitir que el carbono tenga covalencia 2 y su número de oxidación fuese sólo + 2, pero a 10 80 excepción del monóxido de carbono, de fórmula CO, el carbono forma compuestos químicos con covalencia igual a 4. La covalencia 4 se puede explicar, admitiendo que como la energía de los orbitales 2s y 2p es similar, puede ocurrir el salto de un electrón del orbital 2s al 2p y obtener una disposición con 4 electrones desapareados, lo que permite la formación de cuatro enlaces covalentes, como en el caso de metano, de fórmula CH4, y tener, según los casos, números de oxidación + 4 y - 4, dependiendo de la electronegatividad del átomo con que se una el carbono. 2s 2p Otra cuestión es que por la forma de los enlaces que forman el carbono en los distintos compuestos haya que introducir el concepto de hibridación. Así en el CH4 los cuatro enlaces son iguales, y ello se debe a que los orbitales atómicos 2s y 2p originan 4 orbitales idénticos sp3, de forma que en este caso lo que se obtiene es: sp3 18. Puede la molécula de dióxido de carbono presentar el fenómeno de resonancia, sabiendo que la distancia carbono-oxígeno en el CO2 es 0,115 nm, mientras que la distancia de un doble enlace C = O es 0,122 nm? El diagrama de Lewis de la molécula de CO2 es: ·· ·· :O::C::O: Sabemos, además, que dicha molécula es lineal con la forma: O = C = O. Pero si tenemos en cuenta que la distancia carbono-oxígeno en el CO2 tiene un valor inferior al doble enlace C=O, resulta que hay que admitir la existencia de otras formas resonantes, de forma que la molécula de dióxido de carbono se puede representar mediante: O=C=O Q - O - C ≡ O+ + O ≡ C - O- Q En el híbrido de resonancia no contribuyen por igual las tres formas resonantes. Además, la longitud del enlace carbono-oxígeno está más cerca del doble enlace que del triple, por lo que la primera forma resonante tiene una contribución mucho mayor que la de las dos formas iónicas, y se suele representar generalmente a la molécula de CO2 mediante la forma: O = C = O. 19. ¿Por qué en el etano de fórmula CH3-CH3, la longitud del enlace carbonocarbono es 0,154 nm, en el eteno, de fórmula CH2=CH2, es 0,134 nm y en el etino, de fórmula CH≡ ≡CH, es 0,126 nm? El acortamiento del enlace carbono-carbono de C-C a C=C y C≡C es por efecto de los enlaces ʌ entre los orbitales p de ambos carbonos en los enlaces doble y triple, que hace que a mayor solapamiento lateral menor sea la longitud del enlace carbono11 81 carbono: C-C es un enlace ı, mientras que en C=C hay un enlace ı y otro ʌ y en C≡C un ı y dos ʌ. 20. Escribe y explica el diagrama de Lewis de la molécula de tricloruro de nitrógeno. El átomo de nitrógeno tiene 5 electrones de valencia y el cloro siete, por lo que la molécula de NCl3 tiene: 5 + (3 $ 7) = 26 electrones de valencia y la estructura correcta de la molécula de NCl3 debe exhibir todos estos electrones de valencia. Analizando el número total de electrones de valencia, los átomos de la molécula de NCl3 sólo pueden estar unidos por enlaces sencillos, ya que cada átomo de cloro no puede realizar más que un enlace con el átomo de nitrógeno: Cl-N-Cl Cl Esta estructura esquemática emplea 3 $ 2 = 6 electrones de valencia, por lo que quedan 26 - 6 = 20 electrones para completar los octetos. Cada átomo de cloro requiere sólo ya 6 electrones para completar su octeto y el átomo de nitrógeno necesita dos electrones para lo mismo. Por tanto, el número total de electrones no enlazantes necesarios es: (3 $ 6) + 2 = 20. De esta forma, el diagrama de Lewis del tricloruro de nitrógeno es el siguiente, que cumple la regla del octeto: $$ $$ $$ : Cl : N : Cl : $$ $$ $$ : Cl : $$ 21. Determina para cada uno de los enlaces de la molécula de formaldehído, HCHO, el tipo de enlace y los orbitales atómicos que se solapan para formar cada enlace, sabiendo que dicha molécula tiene una geometría plana con un ángulo de enlace H-C-H de 125( (. El formaldehído es un compuesto químico que responde a la siguiente estructura: H C=O H La geometría plana de la molécula del formaldehído, con un ángulo de enlace H-C-H 2 de 125( indica que el átomo de carbono debe tener una hibridación sp . El que el ángulo de enlace H-C-H no sea exactamente 120( se debe a la gran electronegatividad del átomo de oxígeno que retiene los electrones del enlace C=O relativamente cercanos y hace que los electrones de los enlaces C-H se separen un 12 82 poco, abriéndose así el ángulo de enlace H-C-H. 2 El átomo de carbono dispone de un orbital p y de tres orbitales atómicos híbridos sp y forma: 2 - Con los orbitales 1s de cada átomo de hidrógeno enlaces ı C-H: sp del C - 1s del H. - El enlace C=O consta de un enlace ı y de un enlace ʌ. El enlace ı está formado por 2 un solapamiento frontal del orbital sp restante del C con uno de los orbitales 2p del O, por ejemplo el 2px. El enlace ʌ está formado por el solapamiento lateral del orbital atómico restante 2p del C con un orbital 2p del O. Ya que los orbitales p deben ser paralelos para poder formar enlaces ʌ, las direcciones de los dos orbitales antedichos deben ser las mismas y al mismo tiempo diferentes de las direcciones de los orbitales que forman el enlace ı C-O, por lo que podemos decir que el enlace ʌ se forma a partir de un orbital 2pz del C y de un orbital 2pz del O. 22. Sabiendo que la electronegatividad en la escala de Pauling del flúor es 4,0 y la del hidrógeno 2,1, calcula el porcentaje de carácter iónico del enlace del hidruro de flúor a partir de los siguientes datos: Momento dipolar del HF = 2,00 D y longitud del enlace H - F = 0,092 nm. La diferencia de electronegatividades entre el flúor y el hidrógeno es: 4,0 - 2,1 = 1,9. Como esta diferencia de electronegatividades es próxima a 1,7, resulta que el enlace entre ambos elementos tiene aproximadamente el 50 % de carácter iónico. Sabemos también que el valor numérico de la magnitud del momento dipolar está expresada por la ecuación: ȝ = q $ d Para calcular este valor supuesto el compuesto químico como iónico puro se supone que el par de electrones del enlace está totalmente desplazado hacia el halógeno: + -19 H F y la carga q es la carga del electrón e igual a 1,6$10 C. En cuanto a la distancia d, si consideramos al enlace como iónico puro, entonces la longitud de enlace se asocia con la distancia internuclear de equilibrio entre los dos + supuestos iones H y F . Luego: ȝiónico puro = 1,6$ 10-19 C $ 0,092 $ 10-9 m = 1,472$ 10-29 C $ m. 1 D = 3,3 $ 10-30 C $ m, entonces: µ iónico puro = 1,472 ·10 -29 C · m = 4,46 D . m 3,3 ·10 -30 C · D Por tanto: % iónico = µ observado 2,00 D ·100 = · 100 = 44,84 % 4,46 D µ i nico puro Valor próximo al previsto por Pauling 23. Qué clases de fuerzas hay que vencer para disolver NaCl y fundir Ag? Qué 13 83 diferencia hay en la conductividad eléctrica de ambas sustancias? En el caso del NaCl son fuerzas electrostáticas de Coulomb. El disolvente que se utilice debe romper el orden del cristal, debiendo vencer la energía reticular del mismo para poderlo disolver. Para fundir la plata hay que superar las fuerzas de unión de los átomos de plata dentro de la red metálica. Aunque la red es fácilmente deformable, se requiere de una gran cantidad de energía para producir su rotura en la fusión. El cloruro de sodio es sólo conductor de la electricidad fundido o disuelto, mientras que la plata es conductora de la electricidad en estado sólido y también una vez fundida en estado líquido. 24. ¿Por qué el yodo puede tener las covalencias 3, 5 y 7, mientras que el flúor no? El F tiene la configuración electrónica 1s2 2s2 2p5 y tiene covalencia 1 por tener un electrón desapareado, pues resulta que es: 1s2 2s2 2px2 2py2 2pz1 y no puede presentar otras covalencias superiores por no tener orbitales d próximos a los que promocionar electrones. En cambio el yodo tiene la siguiente configuración electrónica externa: 5s2 5p5 y tiene los orbitales 5 d vacíos y puede ocurrir: 5s ↑↓ ↑↓ ↑ 5p ↑↓ ↑ ↑ ↑ ↑ ↑ 5d ↑ ↑ ↑ ↑ ↑ ↑ Covalencia ↑ ↑ 3 5 7 ↑ 25. Considera los enlaces C-X entre el carbono y cada uno de los demás elementos químicos de su mismo período y comenta cuáles son polares y por qué. La polaridad de un enlace es debida a la distinta electronegatividad que presentan los átomos que se van a unir; cuanto mayor sea esta diferencia de electronegatividad mayor será la polaridad y, por tanto, mayor será el carácter iónico del enlace formado. El carbono se encuentra en el segundo período formado por: Li Be B C N O F Xe Puesto que todos estos elementos químicos tienen distinta electronegatividad, que aumenta hacia la derecha, todos los enlaces que forma el C, salvo con el Ne que no se combina, son polares. Esta polaridad es tanto mayor a medida que el C se va uniendo a átomos de los extremos de la Tabla Periódica, siendo los enlaces que presentan más polaridad C-F y C-Li, aunque en el primer caso el par de electrones de enlace está desplazado hacia el F y en el segundo hacia el C. 26. Explica la forma de la molécula de benceno, de fórmula C6H6, que es un anillo plano cíclica hexagonal con tres dobles enlaces carbono-carbono 14 84 alternados. El benceno es un compuesto químico caracterizado por el fenómeno de la resonancia. Se trata de un hidrocarburo cíclico, cuya molécula es plana hexagonal, con tres dobles enlaces carbono-carbono, donde cada átomo de carbono está unido a otros dos átomos de carbono y otro de hidrógeno, con ángulos de enlace de 120(. En principio, dicha molécula se puede explicar afirmando que los átomos de carbono poseen hibridación sp2. Cada átomo de carbono tiene cuatro electrones de valencia, de los cuales tres están en sus tres orbitales híbridos sp2 y el último en un orbital 2pz perpendicular al plano de la molécula. Los electrones de los orbitales híbridos sp2 de cada átomo de carbono se gastan en las tres uniones sigma idénticas del plano hexagonal con ángulos de enlace de 120(. Los seis electrones 2pz restantes se utilizan en la formación de tres uniones pi, con lo que la molécula de benceno es un anillo hexagonal con tres dobles enlaces alternados o conjugados. Pero esta explicación es incompleta, pues hay otras formas de enlazarse los electrones 2pz y para representar la forma de la molécula de benceno existen las siguientes posibles estructuras, que se diferencian entre sí, en cómo se originan los tres enlaces pi: En el benceno, las longitudes de enlace carbono-carbono son todas iguales entre sí y tienen un valor intermedio entre la de un enlace sencillo C-C y uno doble C=C. Ello lleva a afirmar que la estructura real del benceno no es ninguna de las anteriores y en la verdadera estructura contribuyen todas ellas, de forma que, cada átomo de carbono participa por igual del enlace pi. Esto indica que no existen tres enlaces pi localizados 15 85 en átomos concretos de carbono, sino que hay una forma resonante con una especie de gran enlace ʌ deslocalizado entre todos los átomos de carbono del anillo bencénico. 27. ¿Cuál puede ser la forma geométrica del anión ICl4- utilizando la teoría de la repulsión de pares de electrones de la capa de valencia? Se dispone de 7 electrones de valencia del I y 4 · 7 = 28 electrones en el cloro + 1 electrón para adquirir la carga eléctrica -1 , luego en total se necesitan 36 electrones de valencia. Para unir los cuatro cloros con el yodo central se gastan 8 · 4 = 32 electrones de valencia, luego quedan 4 electrones como pares de electrones no enlazantes en el yodo, es decir se necesita expandir la capa de valencia del átomo de I para acomodar los electrones necesarios en el diagrama de Lewis (no se cumple la regla del octeto). Por tanto, el diagrama de Lewis de dicho anión es: $$ :Cl: $$ $$ :Cl: ·· _ :I: ·· ·· :Cl: :Cl: $$ ·· La geometría de todo el conjunto es octaédrica con los dos pares de electrones no enlazantes del I en los dos vértices del octaedro, y en el plano central los cuatro átomos del cloro con el I central formando un conjunto plano-cuadrado. Con los dos pares de electrones no enlazantes en los dos vértices del octaedro se minimizan las repulsiones entre dichos pares d electrones. 28. Si al silicio se le dopa con pequeñas cantidades de: a) Azufre. b) Boro. c) 16 86 Arsénico. d) Galio. e) Plomo. Qué tipo de semiconductor n o p se forma. Los semiconductores n se dopan con impurezas con electrones extra dadores, por lo tanto son el azufre, arsénico y plomo Los semiconductores p se dopan con impurezas que sean aceptores de electrones, por lo tanto son el boro y el galio 29. ¿Cuál de las siguientes moléculas es polar?: a) Cl2. b) ICl. c) BF3. d) NO. e) SO2. Son polares: ICl, NO y SO2. El ICl y el NO son moléculas diatómicas con una diferencia de electronegatividades entre los dos átomos enlazados. El SO2 es una molécula angular con una diferencia de electronegatividad entre lo átomos de S y O. Son no polares: Cl2 y BF3. El Cl2 es una molécula diatómica con átomos idénticos, por consiguiente no hay diferencia de electronegatividad entre sus átomos. Para el BF3 por ser una molécula simétrica plana, los momentos dipolares de los enlaces B-F se cancelan entre sí. 30. El óxido de dinitrógeno (óxido nitroso o gas hilarante) se utiliza a veces como anestésico. Escribe la forma de dicha molécula, sabiendo que su forma es lineal y que los enlaces formados no se corresponden exactamente con las longitudes de enlace de un enlace sencillo, doble o triple entre los tres átomos enlazados. Del enunciado se deduce que la molécula de N2O presenta el fenómeno de resonancia, pudiendo presentar las siguientes estructuras resonantes: ·· ·· ·· ·· ·· ·· :N≡N-O: ↔ :N=N=O: ↔ :N-N≡O: ↔ :N=O=N: ·· ·· 31. El gas cianógeno, de fórrmula C2N2, es venenoso y es utilizado como fumigante y propulsor de cohetes. Escribe el diagrama de Lewis del mismo. Se parte de la base N-C-C-N y el diagrama resultante es: :N≡C-C≡N: 32. ¿Cuál es la estructura de Lewis del cloruro de nitrosilo, de fórmula NOCl? El diagrama de Lewis es: ·· ·· ·· :O=N-Cl: ·· INVESTIGA 17 87





