cuadro comparativo modelos atómicos
Anuncio
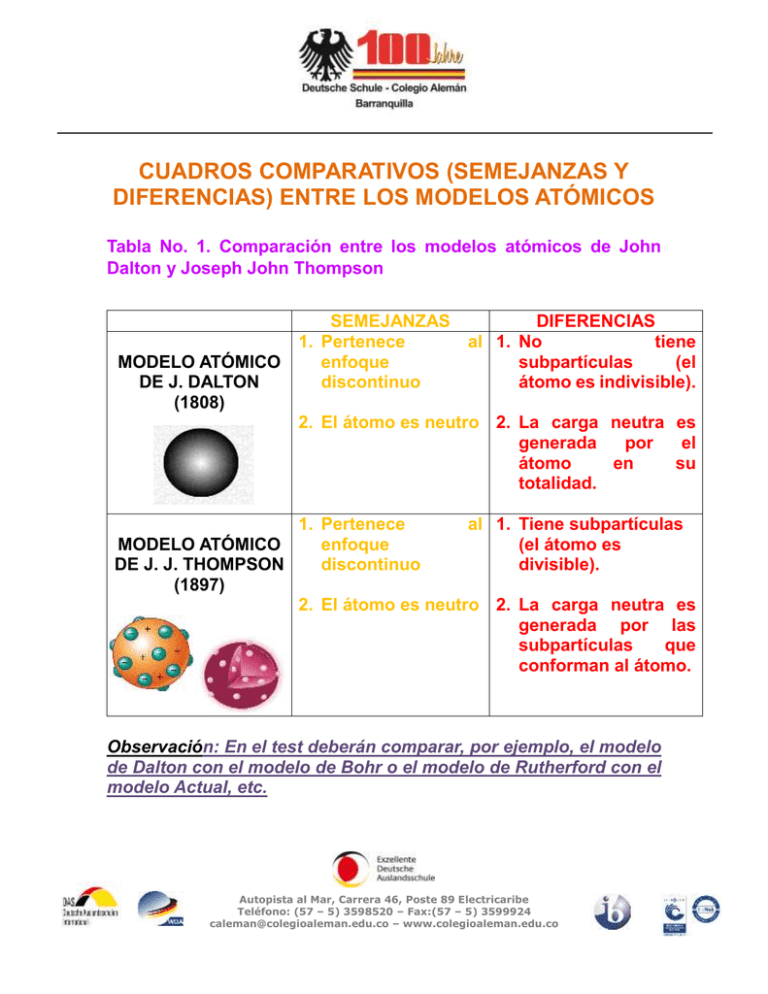
CUADROS COMPARATIVOS (SEMEJANZAS Y DIFERENCIAS) ENTRE LOS MODELOS ATÓMICOS Tabla No. 1. Comparación entre los modelos atómicos de John Dalton y Joseph John Thompson MODELO ATÓMICO DE J. DALTON (1808) SEMEJANZAS 1. Pertenece enfoque discontinuo DIFERENCIAS al 1. No tiene subpartículas (el átomo es indivisible). 2. El átomo es neutro 2. La carga neutra es generada por el átomo en su totalidad. 1. Pertenece al 1. Tiene subpartículas MODELO ATÓMICO enfoque (el átomo es DE J. J. THOMPSON discontinuo divisible). (1897) 2. El átomo es neutro 2. La carga neutra es generada por las subpartículas que conforman al átomo. Observación: En el test deberán comparar, por ejemplo, el modelo de Dalton con el modelo de Bohr o el modelo de Rutherford con el modelo Actual, etc. Autopista al Mar, Carrera 46, Poste 89 Electricaribe Teléfono: (57 – 5) 3598520 – Fax:(57 – 5) 3599924 caleman@colegioaleman.edu.co – www.colegioaleman.edu.co Tabla No. 2. Comparación entre los modelos atómicos de Joseph John Thompson y Ernest Rutherford 1. MODELO ATÓMICO DE J. J. THOMPSON (1897) 2. 3. 4. SEMEJANZAS DIFERENCIAS Pertenece al enfoque 1. Los electrones son discontinuo estáticos (están El átomo es neutro quietos inmóviles Tiene subpartículas (el en el núcleo). átomo es divisible). 2. Las subpartículas Los electrones tienen están juntas (en un carga negativa mismo lugar). mientras que los protones tienen carga positiva MODELO ATÓMICO DE E. RUTHERFORD (1911-1913) Ídem. 1. Los electrones son dinámicos (están en movimiento). 2. Los electrones están en la corteza o periferia (en órbitas) y los protones están en el núcleo del átomo. Autopista al Mar, Carrera 46, Poste 89 Electricaribe Teléfono: (57 – 5) 3598520 – Fax:(57 – 5) 3599924 caleman@colegioaleman.edu.co – www.colegioaleman.edu.co Tabla No. 3. Comparación entre los modelos atómicos de Ernest Rutherford y Niels Bohr. 1. MODELO ATÓMICO DE E. RUTHERFORD (1911-1913) 2. 3. 4. 5. 6. MODELO ATÓMICO DE N. BOHR (1913-1916) SEMEJANZAS DIFERENCIAS Pertenece al enfoque 1. Todos los electrones discontinuo. de un átomo tienen la El átomo es neutro. misma cantidad de Tiene subpartículas (el energía. átomo es divisible). 2. Las órbitas están Los electrones tienen todas a la misma carga negativa distancia del núcleo. mientras que los protones tienen carga positiva Los electrones son dinámicos (están en movimiento). Los electrones están en la corteza o periferia y los protones están en el núcleo del átomo. 1. No todos los electrones de un átomo tienen la misma cantidad de energía. Los que están más cerca del núcleo Ídem. tienen menos energía. 2. Las órbitas no están a la misma distancia del núcleo. Autopista al Mar, Carrera 46, Poste 89 Electricaribe Teléfono: (57 – 5) 3598520 – Fax:(57 – 5) 3599924 caleman@colegioaleman.edu.co – www.colegioaleman.edu.co Tabla No. 4. Comparación entre los modelos Bohr y Modelo Actual. SEMEJANZAS MODELO ATÓMICO 1. No todos los DE N. BOHR electrones de un átomo (1913-1916) tienen la misma cantidad de energía. Los que están más cerca del núcleo tienen menos energía. 2. Los orbitales no están a la misma distancia del núcleo y los electrones que están en ellos tienen diferentes energías. 3. Todas las demás semejanzas de los cuadros anteriores 4. MODELO ATÓMICO ACTUAL (DESPUÉS DE 1916) Ídem. atómicos de Niels DIFERENCIAS 1. Los electrones están ubicados en órbitas (líneas imaginarias específicas por dónde se mueven los electrones). 2. Los electrones se mueven de manera no ondulatoria. 1. Los electrones están ubicados en orbitales (son regiones del espacio con mayor probabilidad de encontrar un electrón). 2. Los electrones se mueven de manera ondulatoria (como olas en el mar). Autopista al Mar, Carrera 46, Poste 89 Electricaribe Teléfono: (57 – 5) 3598520 – Fax:(57 – 5) 3599924 caleman@colegioaleman.edu.co – www.colegioaleman.edu.co ALGUNAS GENERALIDADES SOBRE LOS MODELOS ATÓMICOS Año Científico Descubrimientos experimentales Durante el s.XVIII y principios del XIX algunos científicos habían investigado distintos aspectos de las reacciones químicas, obteniendo las llamadas leyes clásicas de la Química. 1808 Modelo atómico La imagen del átomo expuesta por Dalton en su teoría atómica, para explicar estas leyes, es la de minúsculas partículas esféricas, indivisibles e inmutables, iguales entre sí en cada elemento químico. John Dalton Demostró que dentro de los átomos hay unas partículas diminutas, con carga eléctrica negativa, a las que se llamó electrones. 1897 De este descubrimiento dedujo que el átomo debía de ser una esfera de materia cargada positivamente, en cuyo interior estaban incrustados los electrones. (Modelo atómico de Thomson.) J.J. Thomson 1911 Demostró que los átomos no eran macizos, como se creía, sino que están vacíos en su mayor parte y en su centro hay un diminuto núcleo. Dedujo que el átomo debía estar formado por una corteza con los electrones girando alrededor de un núcleo central cargado positivamente. (Modelo atómico de Rutherford.) Espectros atómicos discontinuos originados por la radiación emitida por los átomos excitados de los elementos en estado gaseoso. Propuso un nuevo modelo atómico, según el cual los electrones giran alrededor del núcleo en unos niveles bien definidos. (Modelo atómico de Bohr.) E. Rutherford 1913 Niels Bohr Bibliografía: 'Modelo atómico de Arnold Sommerfeld' 1916-1924 http://es.wikipedia.org/wiki/Modelo_at%C3%B3mico_de_Sommerfeld Modelo atómico de Schrödinger (1924-1928) http://es.wikipedia.org/wiki/Modelo_at%C3%B3mico_de_Schr%C3%B6dinger http://concurso.cnice.mec.es/cnice2005/93_iniciacion_interactiva_materia/curso/materiales/atomo/modelos.htm Por Humberto Vargas Bolaño Autopista al Mar, Carrera 46, Poste 89 Electricaribe Teléfono: (57 – 5) 3598520 – Fax:(57 – 5) 3599924 caleman@colegioaleman.edu.co – www.colegioaleman.edu.co



