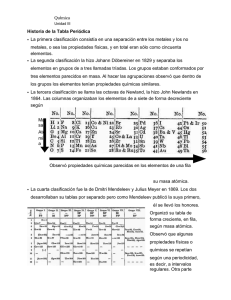
Documento 767358
Anuncio
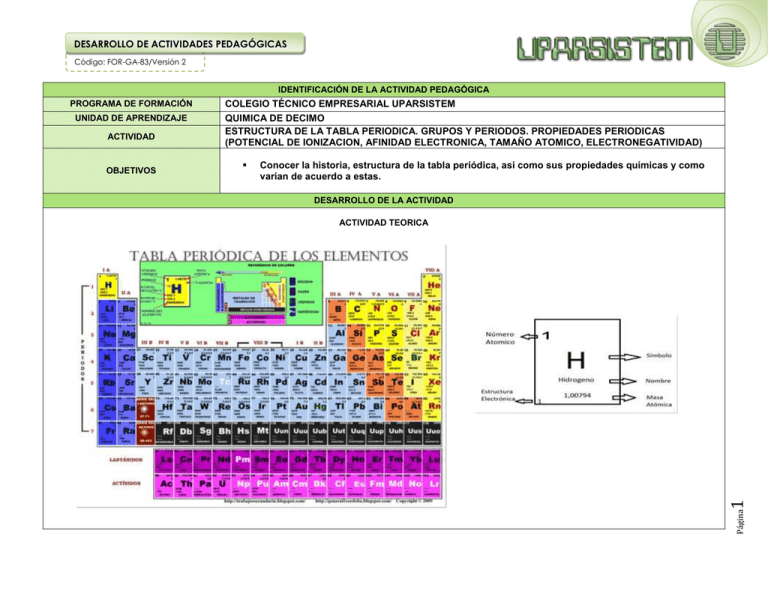
DESARROLLO DE ACTIVIDADES PEDAGÓGICAS Código: FOR-GA-83/Versión 2 IDENTIFICACIÓN DE LA ACTIVIDAD PEDAGÓGICA ACTIVIDAD OBJETIVOS Conocer la historia, estructura de la tabla periódica, así como sus propiedades químicas y como varían de acuerdo a estas. DESARROLLO DE LA ACTIVIDAD ACTIVIDAD TEORICA 1 UNIDAD DE APRENDIZAJE COLEGIO TÉCNICO EMPRESARIAL UPARSISTEM QUIMICA DE DECIMO ESTRUCTURA DE LA TABLA PERIODICA. GRUPOS Y PERIODOS. PROPIEDADES PERIODICAS (POTENCIAL DE IONIZACION, AFINIDAD ELECTRONICA, TAMAÑO ATOMICO, ELECTRONEGATIVIDAD) Página PROGRAMA DE FORMACIÓN DESARROLLO DE ACTIVIDADES PEDAGÓGICAS Código: FOR-GA-83/Versión 2 Durante el siglo XIX, los químicos comenzaron a clasificar a los elementos conocidos de acuerdo a sus similitudes de sus propiedades físicas y químicas. El final de aquellos estudios es la Tabla Periódica Moderna Johann Dobereiner En 1829, clasificó algunos elementos en grupos de tres, que denominó Los elementos de cada triada tenían propiedades químicas similares, así como propiedades físicas crecientes. Ejemplos: Cl, Br, I Ca, Sr, Ba triadas. John Newlands En 1863 propuso que los elementos se ordenaran en “octavas”, ya que observó, tras ordenar los elementos según el aumento de la masa atómica, que ciertas propiedades se repetían cada ocho elementos. Lo que llamó “Ley de las octavas”. Dmitri Mendeleev En 1869 publicó una Tabla de los elementos organizada según la masa atómica de los mismos. Lothar Meyer Al mismo tiempo que Mendeleeiev, Meyer publicó su propia Tabla Periódica con los elementos ordenados de menor a mayor masa atómica. Henry Moseley Página 2 En 1913, mediante estudios de rayos X, determinó la carga nuclear (número atómico) de los elementos. Reagrupó los elementos en orden creciente de número atómico. DESARROLLO DE ACTIVIDADES PEDAGÓGICAS Código: FOR-GA-83/Versión 2 ORGANIZACIÓN DE LOS ELEMENTOS En la naturaleza existen 90 elementos químicos y una gran variedad de compuestos que se forman a partir de las múltiples combinaciones de los elementos. Además de los elementos que existen en la naturaleza, los científicos han creado otros elementos de manera artificial en el laboratorio. En la actualidad se conocen 118 elementos químicos. La organización de los elementos químicos dio lugar al nacimiento de la tabla o sistema periódico de los elementos Una tabla en la que los elementos aparecen ordenados según sus propiedades. Los elementos situados en la misma columna tienen propiedades parecidas. ESTRUCTURA DE LA TABLA PERIODICA La tabla periódica esta organizada en GRUPOS y PERIODOS. Las COLUMNAS representan las FAMILIAS o GRUPOS formados por elementos con propiedades químicas similares. Se denotan con números romanos e indican el número de electrones de valencia. Las FILAS representan el PERIODO con números del 1 al 17. Indican los niveles de energía que posee el átomo. Página 3 En cuanto al carácter metálico y por sus características se dividen: metales, no metales y metaloides y anfóteros. DESARROLLO DE ACTIVIDADES PEDAGÓGICAS Página 4 Código: FOR-GA-83/Versión 2 DESARROLLO DE ACTIVIDADES PEDAGÓGICAS Página 5 Código: FOR-GA-83/Versión 2 DESARROLLO DE ACTIVIDADES PEDAGÓGICAS Código: FOR-GA-83/Versión 2 GRUPO A ELEMENTOS REPRESENTATIVOS Conformado por las columnas I hasta VIII A Grupo I Metales alcalino • Grupo II a Metales alcalino-térreos • Grupo III a Familia del Boro • Grupo IV a Familia del Carbono • Grupo V a Familia del Nitrógeno • Grupo VI a Familia del Azufre, del Oxigeno o Anfígenos. • Grupo VII a Halógenos • Grupo VIII Gases nobles o inertes Página • 6 Cada grupo de elementos forma una familia y los representativos tienen nombre específico. DESARROLLO DE ACTIVIDADES PEDAGÓGICAS Página 7 Código: FOR-GA-83/Versión 2 DESARROLLO DE ACTIVIDADES PEDAGÓGICAS Página 8 Código: FOR-GA-83/Versión 2 DESARROLLO DE ACTIVIDADES PEDAGÓGICAS Página 9 Código: FOR-GA-83/Versión 2 DESARROLLO DE ACTIVIDADES PEDAGÓGICAS Código: FOR-GA-83/Versión 2 PROPIEDADES PERIODICAS Las propiedades físicas y químicas varían a lo largo de los periodos. Por ello reciben el nombre de propiedades periódicas. 1. Tamaño atómico 2. Electronegatividad 3. Potencial de ionización 4. Afinidad electrónica Página 10 TAMAÑO ATÓMICO El tamaño real de un átomo no se ha podido cuantificar pero si pero si se han establecido tamaños relativos, midiendo la distancia entre los núcleos de una molécula utilizando rayos X. El tamaño relativo de los átomos aumenta cuando se incrementa el número de niveles de energía ocupados, por lo tanto en LOS GRUPOS AUMENTA DE ARRIBA HACIA ABAJO y EN LOS PERIODOS DE DERECHA A IZQUIERDA de la tabla periódica aumenta. DESARROLLO DE ACTIVIDADES PEDAGÓGICAS Código: FOR-GA-83/Versión 2 ELECTRONEGATIVIDAD Esta propiedad es la más importante en la química, porque determina los enlaces y las propiedades de la molécula. Esta propiedad es la más importante en la química, porque determina los enlaces y las propiedades de la molécula. Tendencia que presenta un átomo a atraer electrones de otro cuando forma parte de un compuesto (Es la atracción que un átomo ejerce sobre los electrones comprometidos en el enlace). Si un átomo atrae fuertemente electrones, se dice que es altamente electronegativo, por el contrario, si no atrae fuertemente electrones el átomo es poco electronegativo. Cabe destacar, que cuando un átomo pierde fácilmente sus electrones, este es denominado “electropositivo” En los grupos varia de abajo hacia arriba (aumenta) y en los periodos contraria al tamaño atómico, de izquierda a derecha (aumenta). En los grupos varia de abajo hacia arriba (aumenta) y en los periodos contraria al tamaño atómico, de izquierda a derecha (aumenta). Los elementos más electronegativos son: Flúor (F) 4.0 Oxigeno (O) 3.5 Bromo (Br) 2.8 Yodo (I), Azufre (S) y 2.5 Carbono (C) 11 3.0 Página Cloro (Cl) y Nitrógeno (N) DESARROLLO DE ACTIVIDADES PEDAGÓGICAS Código: FOR-GA-83/Versión 2 POTENCIAL DE IONIZACION La energía de ionización es la energía mínima necesaria para que un átomo gaseoso en su estado fundamental o de menor energía, separe un electrón de este átomo gaseoso y así obtenga un ión positivo gaseoso en su estado fundamental. Las energías de ionización de los elementos de un periodo aumentan al incrementarse el número atómico. Cabe destacar que las energías de ionización de los gases nobles (grupo 8A) son mayores que todas las demás, debido a que la mayoría de los gases nobles son químicamente inertes en virtud de sus elevadas energías de ionización. Los elementos del grupo 1A (los metales alcalinos) tienen las menores energías de ionización. Cada uno de estos elementos tiene un electrón en la última capa, el cual es energéticamente fácil de quitar (a partir de ahí, es posible diferenciar entre energía de ionización 1, 2 y 3), por ello los elementos de este grupo forman cationes (iones positivos). Dentro de un grupo, la energía o potencial de ionización disminuye a medida que aumenta el número atómico, es decir de arriba abajo. Esto se debe a que en elementos más grandes la fuerza con la que están unidos los electrones es mayor que en átomos más pequeños, y para sacar un electrón se requiere más energía. AFINIDAD ELECTRONICA Página La afinidad electrónica no presenta un aumento o disminución de forma ordenada dentro de la tabla periódica, más bien de forma desordenada, a pesar de que presenta algunos patrones como por ejemplo que los no metales poseen afinidades electrónicas más bajas que los metales. 12 Es la energía liberada cuando un átomo neutro en el estado gaseoso captura un electrón para formar un ion negativo (anión). DESARROLLO DE ACTIVIDADES PEDAGÓGICAS Código: FOR-GA-83/Versión 2 Las dos últimas propiedades varían exactamente igual a la electronegatividad. ACTIVIDADES Análisis y discusión sobre temas preestablecidos Conceptualización, generalización y/o definición Exploración de conocimientos previos RECURSOS Y EQUIPOS REQUERIDOS TABLERO ACRILICO, MARCADORES, BORRADOR, VIDEO BEAM. CALCULADORA CIENTIFICA. BIBLIOGRAFIA http://www.monografias.com/trabajos12/labtabla/labtabla.shtml https://www5.uva.es/guia_docente/uploads/2011/472/45938/1/Documento5.pdf Página 13 http://www.educarchile.cl/ech/pro/app/detalle?ID=136396