fisica 2 teoria segunda unidad (17121)
Anuncio

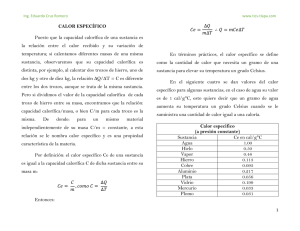
Física II Tema: Calor especifico de las sustancias Fecha:____ /____/15 3°Unidad CALOR ESPECÍFICO DE LAS SUSTANCIAS CAPACIDAD CALORIFICA A partir de experimentos se ha observado que al suministrar la misma cantidad de calor a dos sustancias diferentes el aumento de temperatura no es el mismo. Por consiguiente, para conocer el aumento de temperatura que tiene una sustancia cuando recibe calor emplearemos su CAPACIDAD CALORIFICA, que se define como la relación existente entre la cantidad de calor ΔQ que recibe y su correspondiente elevación de temperatura ΔT ∆𝑸 𝑪= ∆𝑻 El calor puede estar expresado en calorías, Kcal, joules, o BTU y la temperatura en °C, K , las unidades de la capacidad calorífica pueden ser en cal/°C, Kcal/°C, J/°C, J/K, o BTU/°F CALOR ESPECIFICO O CAPACIDAD CALORIFICA ESPECÍFICA. Puesto que la capacidad calorífica de una sustancia es la relación entre el calor recibido y su variación de temperatura, si calentamos diferentes masas de una misma sustancia observamos que su capacidad calorífica es distinta. Ejemplo: Al calentar dos trozos de hierro, uno de 2 kg y otro de 10 kg, la relación ΔQ/ΔT= C es diferente entre los dos trozos, aunque se trate de la misma sustancia. Pero si dividimos el valor de la capacidad calorífica de cada trozo de hierro entre su masa, encontraremos que la relación capacidad calorífica / masa, o bien C/m para cada trozo es la mima. Conclusión: Para un mismo material independientemente de su masa C/m = constante. A esta relación se le nombra calor específico y es una propiedad característica de la materia Por definición: el calor especifico Ce de una sustancia es igual a la capacidad calorífica C de dicha sustancia entre su masa m: 𝑪𝒆 = 𝑪 ∆𝑸 ∆𝑸 , 𝒄𝒐𝒎𝒐 𝑪 = 𝒆𝒏𝒕𝒐𝒏𝒄𝒆𝒔 𝑪𝒆 = ∴ ∆𝑸 = 𝒎𝑪𝒆∆𝑻 𝒎 ∆𝑻 𝒎∆𝑻 Calor especifico (Ce): se define como la cantidad de calor que necesita un grao de sustancia para elevar su temperatura un grado centígrado. Su unidades pueden ser cal/g°C como J/kg°C ΔQ= Cantidad de calor su unidad es (cal) calorías m= masa (g) gramo ΔT= Tf – T0 (las temperaturas tienen que estar en °C) EL CALOR Y LAS TRANSFORMACIONES DEL ESTADO FISICO Las transformaciones que se presentan en el estado físico de la materia como consecuencia del calor son: Fusión: La fusión se presenta cuando una sustancia pasa de solido a líquido., y se debe que cuando a un sólido se le suministra calor, la energía cinética de sus moléculas s e incrementa, es decir, aumenta su temperatura. Al aumentar la energía cinética de las moléculas, disminuye la fuerza de cohesión entre éstas y el sólido cambia de estado a líquido. Solidificación. Las solidificación es el cambio de estado de una sustancia al pasar de liquido a sólido. Cuando un líquido se solidifica, desprende una cantidad de calor igual ala absorbida para fundirse. Vaporización: La vaporización es el cambio de estado de agregación de una sustancia al pasar de líquido a gaseoso. Puede producirse por evaporación, que se presenta cuando un líquido se transforma en vapor sin necesidad de que el líquido alcance la temperatura de ebullición, y se efectúa sólo en la superficie del líquido. Sublimación. La sublimación es el cambio de estado en el que un sólido pasa a gaseoso sin pasar por el estado líquido o viceversa. Ejemplos de sustancias que presentan este cambio de estado son, entre otras el yodo, dióxido de carbono. El calor absorbido o desprendido por un cuerpo es proporcional a su variación de temperatura y a su masa. Cuando un cuerpo físico caliente se pone en contacto con uno frío, existe un desequilibrio térmico y, por tanto, se producirá una transferencia de calor del cuerpo caliente al frío hasta que igualan su temperatura. Ley de intercambio de calor que dice: en cualquier intercambio de calor efectuado, el calor cedido o perdido es igual al absorbido o ganado Calor latente: Cuando una sustancia se funde o se evapora absorbe cierta cantidad de calor llamada calor latente 1.-¿Qué cantidad de calor se debe aplicar a una barra de plata de 12 kg ara que eleve su temperatura de 22 °C a 90°C? CeAg= 0.056 cal/g°C 2.-Seiscientos gramos de hierro se encuentran a una temperatura de 20°C¿Cuál será su temperatura final si se suministran 8000 calorías? CeFe]= 0.113 cal/g°C