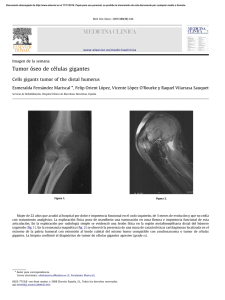
utilizacion de bcl-2 para la fabricacion de medicamentos
Anuncio

k OFICINA ESPAÑOLA DE PATENTES Y MARCAS 19 k 2 160 124 kInt. Cl. : A01K 43/04, A61K 31/70 11 Número de publicación: 7 51 ESPAÑA A61K 49/00, C12N 5/00 C12N 5/02, C12N 5/06 C12N 5/10, C12N 15/00 C12N 15/06, C12N 15/12 C12Q 1/00 k TRADUCCION DE PATENTE EUROPEA 12 kNúmero de solicitud europea: 94919263.7 kFecha de presentación: 26.05.1994 kNúmero de publicación de la solicitud: 0 751 709 kFecha de publicación de la solicitud: 08.01.1997 T3 86 86 87 87 k 54 Tı́tulo: Utilización de Bcl-2 para la fabricación de medicamentos para el tratamiento terapéutico y la prevención de enfermedades. k 73 Titular/es: LA JOLLA CANCER RESEARCH k 72 Inventor/es: Reed, John C. k 74 Agente: Curell Suñol, Marcelino 30 Prioridad: 26.05.1993 US 66556 FOUNDATION 10901 North Torrey Pines Road La Jolla, CA 92037, US 45 Fecha de la publicación de la mención BOPI: ES 2 160 124 T3 01.11.2001 45 Fecha de la publicación del folleto de patente: 01.11.2001 Aviso: k k k En el plazo de nueve meses a contar desde la fecha de publicación en el Boletı́n europeo de patentes, de la mención de concesión de la patente europea, cualquier persona podrá oponerse ante la Oficina Europea de Patentes a la patente concedida. La oposición deberá formularse por escrito y estar motivada; sólo se considerará como formulada una vez que se haya realizado el pago de la tasa de oposición (art. 99.1 del Convenio sobre concesión de Patentes Europeas). Venta de fascı́culos: Oficina Española de Patentes y Marcas. C/Panamá, 1 – 28036 Madrid ES 2 160 124 T3 DESCRIPCION Utilización de Bcl-2 para la fabricación de medicamentos para el tratamiento terapéutico y la prevención de enfermedades. 5 10 15 20 25 30 35 40 45 50 55 60 Antecedentes de la invención Apoptosis es el término utilizado para describir un tipo de muerte celular que tiene lugar en muchos tejidos como un proceso fisiológico normal. También denominado “muerte celular programada”, esta forma de defunción celular implica la activación en las células de un programa genético incorporado para el suicidio celular por el cual las células esencialmente se autodigieren. Los restos de estas células muertas se eliminan entonces casi sin dejar rastro mediante células fagocı́ticas vecinas, sin dar lugar a inflamación o cicatrizaciones. La apoptosis, pues, contrasta marcadamente con la muerte celular causada por ejemplo, por la falta de oxı́geno en el marco del infarto miocárdico o de la apoplejı́a, en los que las células pierden sus suministros energéticos, se fragmentan y derraman su contenido en el medio extracelular. Además de los procesos fisiológicos normales en los que las células se renuevan en el interior del organismo, la apoptosis puede ser inducida a producirse mediante estı́mulos celulares, hormonales y otros, para eliminar células no deseadas del organismo. Por ejemplo, la muerte de células tumorales y de células infectadas por virus mediante las células T citolı́ticas del sistema inmunitario, tiene lugar mediante apoptosis, después del reconocimiento de la diana. La apoptosis ocurre también mediante la pérdida de la estimulación hormonal en los tejidos reproductores femeninos con cada ciclo menstrual en ausencia de un embarazo exitoso. Además, numerosos estudios han mostrado que la apoptosis explica la muerte celular en una amplia variedad de áreas clı́nicamente importantes. Por ejemplo, esencialmente todos los fármacos quimioterapéuticos que se utilizan habitualmente en el tratamiento del cáncer, ası́ como la irradiación con rayos x en muchos casos, matan finalmente a las células malignas activando vı́as intracelulares que conducen a la apoptosis. En contraste con el efecto de la apoptosis en los fenómenos celulares normales, cuando está regulada de forma anómala la muerte de las células mediante aquélla puede conducir a diversas enfermedades y condiciones patológicas. Por ejemplo, la muerte de neuronas que tiene lugar en enfermedades tales como la demencia de Alzheimer y la enfermedad de Parkinson, muestra muchas caracterı́sticas que la identifican como apoptosis. Las enfermedades autoinmunes, en las que las células inmunitarias atacan de forma inapropiada los tejidos normales, son debidas, en parte, a un fallo en la ocurrencia de la apoptosis. Además, la muerte celular causada por la infección vı́rica puede tener lugar en muchos casos mediante la apoptosis, incluyendo la muerte de las células T causada por el Virus de la Inmunodeficiencia Humana (HIV) que causa el SIDA. En contraste con la inducción de la apoptosis causada por algunos virus, otros inhiben este proceso mediante la expresión de productos génicos que bloquean a aquélla. El virus del herpes simple constituye un ejemplo especı́fico de esta inhibición en la que la prevención de la apoptosis es necesaria para su infección vı́rica “latente” o persistente caracterı́stica. Utilizando quimioterapia convencional, se han realizado esfuerzos para tratar muchas de las enfermedades que conducen a una muerte celular apoptótica inapropiada, pero hasta la fecha sólo se han producido pequeños progresos respecto a un tratamiento efectivo. Además, se han ensayado también otras estrategias no convencionales en potenciaciones inducidas especı́ficas. Por ejemplo, la enfermedad de Parkinson se ha tratado en el hombre utilizando trasplantes de tejido neural fetal. En modelos animales de las enfermedades de Parkinson y Alzheimer se ha llevado a cabo el amplio ensayo de tales trasplantes de tejidos neurales, ası́ como el de fibroblastos manipulados mediante técnicas de ingenierı́a genética. En el último caso, los fibroblastos se modificaron para secretar factores neurotróficos tales como el factor del crecimiento nervioso (NGF) o neurotransmisores tales como los precursores de la dopamina para prolongar la supervivencia de las células neurales del receptor. La dificultad general de estos tratamientos es que sólo un pequeño número de células trasplantadas sobreviven inicialmente después del trasplante, o en el caso de fibroblastos manipulados genéticamente, muchas de las células que sobreviven inicialmente, no lo hacen in vivo a largo plazo. Tal como se ha mencionado anteriormente, la quimioterapia cancerosa actúa a través de diversas dianas intracelulares que culminan en la activación de la vı́a apoptósica. El cáncer constituye la segunda causa que provoca la muerte en los Estados Unidos. Uno de cada 3 americanos desarrollará alguna forma de esta enfermedad durante su vida, la mayorı́a morirá como consecuencia directa de sus tumores malignos, a causa principalmente de la inadecuación de los medicamentos quimioterapeúticos habitualmente disponibles o de la resistencia espontánea de las células malignas a tales tratamientos. Aunque muchos detalles de los tumores malignos no se entienden completamente, se han investigado 2 ES 2 160 124 T3 5 10 15 20 25 30 35 en gran parte los fundamentos de diversos cánceres. Por ejemplo, se sabe ahora que la expresión no regulada de muchos genes causa la transformación cancerosa. Estos genes se han denominado genéricamente oncogenes a causa de su capacidad de transformación cuando se expresan anormalmente. Ejemplos tı́picos de tales oncogenes incluyen proteı́nquinasas tales como Src, Herb-2 (NEU) y BCR/ABL, GTPasas tales como Ki-RAS, Ha-RAS y N-RAS, y factores de transcripción tales como Fos, Jun y Myc. Se ha documentado que estos y otros oncogenes constituyen una causa importante en el fenotipo maligno de cánceres tales como (neuroblastoma N-myc), linfoma de Burkitt (c-myc), carcinoma colorectal (Ki-RAS), leucemia mielogénica crónica (BCR/ABL), cáncer mamario (Herb-2/NEU), y cáncer de pulmón (L-myc). Se han realizado intentos para hacer diana en varios de estos oncogenes con objeto de proporcionar un tratamiento terapéutico adecuado para el cáncer. Sin embargo, a causa de los problemas anteriormente mencionados respecto a la quimioterapia, tales intentos han demostrado demasiado a menudo producir un beneficio marginal. En contraste con los oncogenes cuya expresión no regulada o anormal da lugar a una proliferación aumentada, existe al menos un “oncogen” cuya sobreexpresión da lugar a una supervivencia celular prolongada. Este oncogén se denomina Bcl-2 y se descubrió originalmente a causa de su activación inapropiada en linfomas, cánceres de los nódulos linfáticos, donde contribuye a la expansión celular neoplásica. Se ha demostrado que existen altos niveles de la proteı́na BCl-2 en aproximadamente 50.000 nuevos casos de linfomas y leucemias cada año sólo en los Estados Unidos, en esencialmente todos los casos de cáncer prostático resistente a los medicamentos (150.000 casos por año en USA), en el 80 % de los carcinomas nasofarı́ngeos, en el 70 % aproximadamente de los cánceres mamarios (aproximadamente 100.000 casos anuales en los Estados Unidos) y en todos los casos de carcinoma colorectal examinados hasta la fecha (110.000 nuevos casos por año en USA). Desde su descubrimiento inicial, se ha mostrado que Bcl-2 se expresa también normalmente en muchos tejidos del organismo, donde posee la función fisiológica de mantener la supervivencia de las células de larga duración. Entre los tipos de células cuya supervivencia regula Bcl-2 están los linfocitos de la “memoria” que se generan durante las inmunizaciones, muchos tipos de neuronas en el cerebro y particularmente en los nervios periféricos que controlan las funciones musculares y orgánicas, células de la médula ósea, células de la piel y las células troncales que dan lugar a las células absorbentes que tapizan el tracto gastrointestinal. A partir de las consideraciones anteriormente mencionadas, resulta claro que para muchas de las enfermedades que afectan a la especie humana, no han existido avances importantes hacia un tratamiento efectivo en los últimos 10 a 15 años. Sin embargo, siendo tan diversos como lo son estas enfermedades y sus tratamientos, se ha desarrollado un mecanismo común mediante el cual manifiestan sus caracterı́sticas o la quimioterapia se ha vuelto ineficaz. Este mecanismo común es la inducción o la inhibición de la muerte celular programada. 40 Ası́, existe una necesidad de controlar el proceso de apoptosis con objeto de tratar genéricamente un amplio conjunto de enfermedades y de condiciones patológicas y de poder asimismo aumentar los tratamientos clı́nicos que utilicen medicamentos fácilmente disponibles. La presente invención cumple esta necesidad y proporciona también ventajas relacionadas. 45 Sumario de la invención 50 La invención proporciona la utilización de un compuesto capaz de aumentar la actividad de Bcl-2 en las células con objeto de preparar un medicamento para tratar una enfermedad o condición patológica que dé lugar a la muerte celular apoptósica. La utilización incluye el aumento de la actividad de Bcl-2 en las células afectadas por la enfermedad o la condición patológica. De este modo, la invención proporciona medicamentos que pueden utilizarse para aumentar la actividad de Bcl-2 en una célula afectada por una enfermedad o patologı́a que conduce a la muerte celular apoptósica. Las enfermedades o condiciones patológicas que dan lugar a la muerte celular apoptósica pueden incluir, por ejemplo, enfermedades neurodegenerativas, cáncer y células infectadas por virus. 55 60 También se proporciona la utilización de una población celular que ha aumentado las actividades de Bcl-2 con objeto de preparar un medicamento para prolongar la supervivencia in vivo de células transplantadas para el tratamiento de una enfermedad o condición patológica. La utilización incluye el aumento de la actividad de Bcl-2 en una población de células y el trasplante de la población con la actividad de Bcl-2 aumentada, a un individuo. Ası́, la invención proporciona medicamentos que pueden utilizarse para aumentar la actividad de Bcl-2 en una célula, que pueden trasplantarse a un individuo. Las enfermedades o condiciones patológicas pueden incluir, por ejemplo, enfermedades neurodegenerativas, 3 ES 2 160 124 T3 5 cáncer y células infectadas por virus. Se proporciona la utilización de una molécula de ácido nucleico que codifique Bcl-2β para disminuir la actividad de Bcl-2 con objeto de preparar un medicamento para potenciar la sensibilidad de las células malignas o de las infectadas por los virus a la terapia, que incluye la disminución de la actividad de Bcl-2 en las células malignas o infectadas por los virus. De este modo, la invención proporciona también medicamentos que pueden utilizarse para disminuir la actividad de Bcl-2 en una célula maligna o infectada por el virus con objeto de potenciar la sensibilidad de la célula a una terapia. La invención asimismo proporciona métodos para identificar compuestos que alteren la muerte celular apoptósica y potencien la producción de anticuerpos monoclonales, que se dan a conocer en la presente memoria, ası́ como utilizando ratones transgénicos que expresen Bcl-2 como el transgén. 10 Descripción breve de los dibujos Figura 1. Vectores retrovı́ricos recombinantes Bcl-2 construidos utilizando técnicas estándar del ADN recombinante. 15 20 25 30 A. Las secuencias del ADN humano clonado que codifican la proteı́na Bcl-2 de longitud total (“bcl2α”) o una forma de Bcl-2 inhibitoria más corta (“bcl-2β”) se insertaron en el único sitio XhoI en pBC140 en ambas orientaciones, hacia adelante e inversa (AS; antisentido). La expresión de Bcl-2 es gobernada por un promotor/potenciador del citomegalovirus (CMV; segmentos negros). La expresión del gen de la neomicina fosfotransferasa (Neor ) es gobernada por la repetición terminal larga (LTR; segmentos blancos) más a la izquierda del virus Moloney y que se utiliza como un marcador seleccionable dominante que utiliza el antibiótico G418. Se indican los sitios de restricción seleccionados. B. Se clonó un cADN Bcl-2 humano que codifica la proteı́na Bcl-2 de longitud total en un único sitio BamHI en pZip-NEO. Se indican los sitios de restricción seleccionados: X, XhoI; Xb, XbaI; B, BamHI. Expresión de Bcl-2 gobernada por la LTR más a la izquierda del virus Moloney. La expresión del gen de resistencia a la neomicina es mediada mediante un evento de corte y empalme (que no se muestra). Figura 2. Bcl-2 y una proteı́na Bcl-2 mutante (59 Pro→Ser) permiten a las células de mamı́fero desarrollarse hasta conseguir altas densidades celulares. A. Viabilidad celular determinada mediante exclusión del azul de tripán (media +/- desviación estándar de 3 determinaciones). WT., Bcl-2 tipo salvaje; P59S, Bcl-2 mutante; Neo, control. 35 40 45 50 B. Sı́ntesis de ADN determinada mediante contaje de centelleo lı́quido de las células marcadas mediante pulsos durante 8 horas con timidina 3 H tritiada. Kcpm = kilocontajes/min (media +/- desviación estándar de 3 determinaciones). Figura 3. Bcl-2 bloquea la progenie de células cancerosas prostáticas, AT-3, induciéndose la muerte mediante infección por el virus Sindbis. La viabilidad celular determinada mediante exclusión del azul de tripan (media +/- desviación estándar de 3 determinaciones). pZIP-BCL2 o pZIP-NEO se describen en la Figura 1.B. Células de control AT-3-NEO (cı́rculos); células AT-3-BCL2 (cuadrados). Células infectadas por virus (sı́mbolos macizos); células cultivas en ausencia de virus (sı́mbolos abiertos) Figura 4. Protección de las células PC12 de la muerte inducida por glutamato mediante Bcl-2. Viabilidad celular determinada mediante el ensayo de reducción del colorante MTT (media +/- desviación estándar de 3 determinaciones). Figura 5. Homólogos de supervivencia prolongada Bcl-2 de las células 32D-3 cultivadas en ausencia de Il-3 en varios tiempos. Viabilidad celular determinada mediante exclusión del azul de tripán (media +/- desviación estándar de 3 determinaciones). A. Proteı́nas Bcl-2 humanas (HU) y de pollo (CH) prolongan la supervivencia celular. (NEO= control; no Bcl-2). 55 B. Bcl-2 humana y el homólogo Bcl-2 del virus Epstein Barr, BHRF-1, prolongan la supervivencia celular (HYG= control; higromicina B). 60 Figura 6. Bcl-2 actúa de modo sinérgico con Raf-1 para prolongar la supervivencia celular bajo condiciones de carencia del factor de crecimiento. Proteı́na Bcl-2, sola (cı́rculos abiertos); proteı́na Raf-1 activada, sola (cuadrados); proteı́nas Bcl-2 + Raf-1 (cı́rculos cerrados); sin proteı́na Bcl-2 o sin proteı́na Raf-1 (triángulos). 4 ES 2 160 124 T3 A. Viabilidad celular determinada mediante exclusión del azul de tripán (media +/- desviación estándar de 3 determinaciones). 5 B. Sı́ntesis del ADN determinada mediante incorporación de timidina tritiada. Los datos se normalizaron dividiendo los resultados obtenidos para las células cultivadas en ausencia de interleuquina-2 (Il-3) por los valores obtenidos para las células cultivadas en presencia de Il-3 (media +/- desviación estándar de 3 determinaciones). 10 C. Contenido relativo de ADN de células viables teñidas con propidio-yoduro- determinado mediante citometrı́a de flujo. Las células se hicieron crecer durante 3 dı́as en presencia (cuadros a y c) o ausencia (cuadros b y d) de Il-3. Células 32D-BCL2 (cuadros a y b); células 32D-BCL2/RAF (cuadros c y d). (FL = intensidad de fluorescencia). 15 Figura 7. Una forma dominante-negativa de la proteı́na Bcl-2, Bcl-2β, acelera la muerte celular. Viabilidad celular determinada mediante exclusión del azul de tripán. Los datos se normalizaron respecto a las células de control (NEO) (media +/- desviación estándar de 4 determinaciones). 20 25 30 Figura 8. Transferencia Western de extractos de células Sf9. Los carriles 1-3 contienen 5,0, 1,0 ó 0,2 µg, respectivamente, de proteı́nas de las células infectadas con baculovirus Bcl-2 recombinantes; el carril 4, 100 µg de proteı́nas de la progenie celular del linfoma de células B humanas que contiene la translocación t (14;18); el carril 5, 10 µg de proteı́nas de células infectadas con baculovirus Lck recombinantes (control negativo); el carril 6, 10 µg de proteı́nas de células no infectadas. Figura 9. Ensayo sin células para evaluar la función Bcl-2. A. Núcleos incubados en extractos acelulares que contenı́an lisados de células Sf9 de insectos preparados a partir de las células Sf9 control (cuadros superiores) o que expresan Bcl-2 (cuadros inferiores). Núcleos visualizados utilizando tinción Hoechst 33258 del ADN; BSA marcado con tetrametilrodamina conjugado a un péptido sintético que corresponde a la señal de localización nuclear del antı́geno T SV40 (TRITC-HSA-NLS); microscopio de contraste de fase (Contraste de fase). B. Cuantificación de núcleos intactos y competentes para el transporte incubados durante 120 ó 160 minutos en presencia o ausencia de Bcl-2. 35 Figura 10. La proteı́na Bcl-2 es directamente responsable de la supresión de la fragmentación nuclear en los ensayos de apoptosis libres de células. 40 Figura 11 demuestra que la expresión de la proteı́na Bcl-2 en una célula neuronal protege a ésta de la muerte celular inducida por el virus Herpes. Se infectaron células neuronales PC12 con un control (NEO) o con un retrovirus que contenı́a bcl-2. Se expusieron las células infectadas establemente al Virus-1 del herpes simple (HSV-1), determinándose el número relativo de células supervivientes a distintos tiempos después de la exposición al HSV-1. Los sı́mbolos macizos indican supervivencia en ausencia de la infección HSV-1; los sı́mbolos abiertos indican supervivencia en presencia de la infección por HSV-1. 45 50 La Figura 12 demuestra que las células PC12 neuronales y las células B50 expresaron la proteı́na Bcl-2 después de la transfección de las células con un vector de expresión bcl-2 (BCL-2). Las células de control se transfectaron con un vector que contenı́a sólo el gen de la neomicina (NEO). Se indica la proteı́na Bcl-2 de 26 kilodaltons (kDa) (p26-Bcl-2), ası́ como lo es la proteı́na F1 -β-ATPasa de 50 kDa de la membrana mitocondrial (p50 F1 β), la cual, en algunos experimentos se utilizó para confirmar que cantidades iguales de proteı́na se cargaron sobre el gel y se transfirieron a los filtros de nitrocelulosa. También se muestra la migración de la proteı́na Bcl-2 expresada en las células de Scott (Scott), que son células de linfoma que contienen una translocación t (14;18), y en las células 697-BCL-2 (697 B), que son una progenie celular leucémica infectada con el virus ZIP-BCL-2. 55 La Figura 13 muestra el porcentaje de supervivencia de las células de control (sı́mbolos cerrados) o de las células PC12 neuronales (sı́mbolos abiertos) que expresan Bcl-2, de las células IMR-5 y B50 después de la incubación durante 24 horas, en presencia de diversas concentraciones de glutamato. Se indica el nivel de significación de los resultados. 60 5 ES 2 160 124 T3 Descripción detallada de la invención 5 10 15 20 25 30 35 40 45 50 55 60 La presente invención se refiere a la utilización general y efectiva de compuestos para la fabricación de medicamentos, con objeto de aumentar el tratamiento de enfermedades y de condiciones patológicas. La utilización es aplicable al tratamiento del cáncer, alteraciones neurodegenerativas, infecciones vı́ricas, enfermedades autoinmunes ası́ como a la modificación de tejidos y células transplantados. Los tejidos y células modificados pueden emplearse, por ejemplo, para preparar un medicamento con objeto de tratar las alteraciones neurológicas, ası́ como las enfermedades causadas por insuficiencias hormonales y proteicas tales como la diabetes (insulina) y la hemofilia (factores de coagulación). Los usos que se describen en la presente memoria permiten también el desarrollo de nuevos medicamentos para el tratamiento y prevención de enfermedades y condiciones patológicas. Además, los procedimientos de la presente invención pueden aplicarse posteriormente para la producción de reactivos de investigación superior y diagnóstico y a composiciones para utilizar en todas las disciplinas, esencialmente, de las ciencias básicas y aplicadas. La invención proporciona, por ejemplo, medicamentos que pueden utilizarse para aumentar la actividad de Bcl-2 en una célula afectada por una enfermedad o patologı́a que dé lugar a la muerte celular apoptósica, y medicamentos que pueden utilizarse para disminuir la actividad de Bcl-2 en una célula maligna infectada por un virus con objeto de potenciar la sensibilidad de la célula a una terapia. La invención obtiene ventajas de la capacidad de Bcl-2 para evitar el proceso de la muerte celular programada conocido como apoptosis. El acertar en un mecanismo fisiológico común a muchas enfermedades distintas es eficiente y efectivo respecto al coste, porque no resulta necesario el desarrollo especializado de distintos medicamentos para cada una de las enfermedades especı́ficas. En lugar de eso, puede desarrollarse un pequeño número de compuestos terapéuticos o métodos de tratamiento con objeto de tratar esencialmente todas las enfermedades que manifiesten su condición patológica mediante la regulación alterada de la apoptosis. En muchos casos, tales compuestos pueden ser ácidos nucleicos recombinantes cuya administración se realiza mediante terapia génica. De este modo, reactivos que promueven o perjudican la aoptosis se utilizan en la fabricación de los medicamentos de la invención para retardar la muerte celular apoptósica inducida por la enfermedad o potenciar selectivamente la muerte celular tumoral mediante medicamentos quimioterapéuticos convencionales, ası́ como proteger a las células normales no neoplásicas de la toxicidad de estos medicamentos. En una forma de realización, se utiliza la tecnologı́a de transferencia génica o “terapia génica” para crear moléculas de ADN recombinante Bcl-2 y vectores vı́ricos para promover la supervivencia in vivo de células afectadas por una enfermedad o condición patológica que dé lugar a una muerte celular apoptósica. Las moléculas ADN recombinantes Bcl-2 y los vectores vı́ricos se utilizan también para modificar genéticamente a las células antes del trasplante para prolongar su tiempo de supervivencia in vivo y, cuando se puede aplicar, para corregir simultáneamente las deficiencias proteicas. La utilización de Bcl-2 para inmortalizar o prolongar la tasa de supervivencia de las células en las que se ha hecho diana, es ventajoso, porque no bloquea la diferenciación celular y no es esencialmente tumorigénico cuando se expresa en células primarias o establecidas comparadas con otros oncogenes. Ejemplos especı́ficos de tales terapias incluyen la producción de virus recombinantes que dirigen la expresión de Bcl-2, para tipos especı́ficos de neuronas y la administración de tales virus a pacientes que padecen enfermedades de Alzheimer o Parkinson mediante inyección directa en el cerebro o en el lı́quido cefalorraquı́deo; el implante intracraneal de células precursoras neuronales fetales que expresan Bcl-2 para el tratamiento de la enfermedad de Parkinson; la expansión de la masa de las células humanas que expresan Bcl-2 in vitro para prolongar su supervivencia in vivo después de trasplante y la utilización de los vectores recombinantes para dirigir la expresión de Bcl-2 a tipos celulares especı́ficos para prevenir la muerte celular inducida por las infecciones vı́ricas. Las células que expresan Bcl-2 para utilizar en los trasplantes pueden modificarse genéticamente, por ejemplo, para secretar varias hormonas y péptidos tales como factores neurotróficos en el ámbito del daño de la médula espinal, dopamina para el tratamiento de la enfermedad de Parkinson, encefalinas para el control del dolor en pacientes cancerosos terminales, factores de coagulación para pacientes con hemofilia y células de los islotes que produzcan insulina para pacientes con diabetes. En otra forma de realización, se utiliza la tecnologı́a de transferencia del gen Bcl-2 para “inmortalizar” células B humanas que produzcan anticuerpos y potencien por tanto el desarrollo de anticuerpos monoclonales humanos. La función de promover la supervivencia de Bcl-2 se utiliza también para generar ratones transgénicos Bcl-2 con objeto de aislar células B para la producción potenciada de anticuerpos monoclonales. Tales anticuerpos monoclonales son útiles con propósitos diagnósticos y terapéuticos. En todavı́a otra forma de realización, se describe un sistema acelular que reproduce fidedignamente las caracterı́sticas de la muerte celular apoptósica. El sistema es útil para el rastreo de compuestos que alteran el proceso apoptósico. Pueden utilizarse compuestos seleccionados, que promueven o inhiben la 6 ES 2 160 124 T3 apoptosis, para la fabricación de medicamentos con objeto de tratar terapéuticamente diversas enfermedades, incluyendo las neurodegenerativas, el cáncer y las células infectadas por virus. 5 10 15 20 25 El gen Bcl-2 se descubrió en primer lugar a causa de su implicación en los linfomas en el hombre. Ahora se ha demostrado que este gen prolonga la supervivencia celular en cultivos cuando se expresa a altos niveles, en distintos tipos celulares tales como linfocitos, células hemopoyéticas, fibroblastos y neuronas. Bcl-2 es una proteı́na de 26 kilodaltons (kDa) que es única entre los genes celulares. Contiene un fragmento de 17 aminoácidos hidrofóbicos cerca de su extremo carboxi que causa su inserción posttraduccional en las membranas intracelulares. Los estudios de transferencia genética han demostrado que Bcl-2 promueve la supervivencia celular mediante bloqueo de su muerte celular programada o apoptosis. La apoptosis puede ponerse en marcha activamente en las células, por ejemplo, mediante exposición a los rayos X, sustancias citotóxicas, radicales libres y calor, o puede no enmascararse eliminando los factores de crecimiento peptı́dicos crı́ticos, hormonas esteroideas, linfoquinas o neurotrofinas que suprimen constantemente la muerte celular programada en varios tejidos. Muchos de estos procesos constituyen los eventos terminales implicados en numerosas enfermedades o los eventos finales mediante los cuales los tratamientos terapéuticos llevan a cabo sus resultados. Ası́, el hacer blanco especı́ficamente en la apoptosis y alterarla, proporcionará un tratamiento general para un amplio conjunto de enfermedades y condiciones patológicas. Debe tenerse en cuenta, sin embargo, que existen vı́as independientes de Bcl-2 para la apoptosis. De este modo, las nuevas utilizaciones para Bcl-2 de las que se informa en la presente memoria, constituyen previamente circunstancias indocumentadas bajo las que la transferencia del gen Bcl-2 revela por primera vez ejercer protección contra la muerte celular programada. Bcl-2 se expresa normalmente en diversos tipos de células, pero particularmente en aquéllos que exhiben una vida larga tal como algunos tipos de neuronas, linfocitos “memoria” de duración prolongada o células que poseen potencial proliferativo de autorenovación, tales como las células basales epiteliales y las células progenitoras hemopoyéticas en la médula ósea. Es probable que Bcl-2 represente el prototipo de una familia entera de genes estructuralmente similares que son expresados de forma histoespecı́fica y contribuyen a la regulación de la vida celular. 30 35 40 45 50 55 60 Tal como se utiliza en la presente memoria, el término “apoptosis” o “muerte celular apoptósica” se refiere al proceso fisiológico que se conoce como muerte celular programada. La apoptosis es distinta a otras formas de muerte celular que tienen lugar, por ejemplo, como resultado de isquemia o necrosis, porque la apoptosis constituye una forma activa de muerte celular que requiere ATP y que necesita tı́picamente nuevo ARN y sı́ntesis proteica. Una identificación caracterı́stica de la apoptosis es la activación de endonucleasas endógenas que fragmentan inicialmente el ADN genómico en sus sitios más accesibles, es decir, entre los nucleosomas, produciendo una escala de bandas de ADN que representan múltiples enteros de la distancia internucleosómica. Esta degradación del ADN tiene lugar temprano en el proceso apoptósico, antes de la pérdida de la integridad de la membrana plasmática. Las células apoptósicas también poseen un tamaño encogido y el proceso no se acompaña habitualmente de inflamación, pues no existe derrame del contenido citoplásmico en el espacio extracelular. Con la apoptosis, una gran parte del contenido celular se autodigiere. La lisis celular in vivo nunca tiene lugar, a causa de que las células apoptósicas son fagocitadas habitualmente por los macrófagos y células relacionadas antes de la pérdida de la permeabilidad de la membrana plasmática. En consecuencia, no existe reacción inflamatoria o formación subsiguiente de cicatrices. Otras caracterı́sticas morfológicas de las células apoptósicas incluyen fragmentación nuclear, desarrollo de cuerpos vesiculares, “cuerpos apoptósicos” y burbujas de la membrana plasmática, todos en el marco de mitocondrias y lisosomas intactos. Ejemplos especı́ficos de muerte apoptósica de la célula como un suceso programado natural incluyen, por ejemplo, la pérdida de neuronas excesivas durante el desarrollo fetal y la destrucción de células T potencialmente auroreactivas durante la educación tı́mica. Tal como se utiliza en la presente memoria, el término “Bcl-2” se refiere a la proteı́na descubierta originalmente debido a su activación inapropiada en los linfomas. La Bcl-2 controla el desarrollo celular normal y la diferenciación, promoviendo la supervivencia celular. Posee un peso molecular de 26 kDa aproximadamente, determinado mediante SDS-PAGE, y se caracteriza por un tramo hidrofóbico de 17 aminoácidos aproximadamente cerca de su extremo carboxilo que funciona en la unión de la membrana intracelular. Bcl-2 posee sustancialmente la misma secuencia aminoácida que la que se muestra en SEC. ID. NO:2 y es codificada por una secuencia nucleótida sustancialmente similar a la que se muestra como SEC. ID. NO:1. La definición de “Bcl-2” tiene el propósito de incluir otros elementos de la familia Bcl-2 tales como las proteı́nas que se encontró exhibı́an las caracterı́sticas funcionales u homologı́as secuenciales an7 ES 2 160 124 T3 teriormente mencionadas. Tales elementos incluyen, por ejemplo, homólogos de Bcl-2 clonados a partir de organismos inferiores tales como ratas, ratones, pollos, mariposas y gusanos. 5 10 15 20 25 30 35 40 45 50 55 60 Un ejemplo especı́fico de un elemento de la familia Bcl-2 es la proteı́na codificada por el gen BHRF-1 en el virus Epstein Barr. El gen BHRF-1, que muestra una identidad secuencial del 22 % aproximadamente y una similitud secuencial del 47 % con Bcl-2, es funcionalmente equivalente a Bcl-2 en la promoción de la supervivencia celular (véase, por ejemplo la Fig. 5). Se entiende que pueden efectuarse modificaciones limitadas de la proteı́na sin destruir la función biológica de Bcl-2, y que puede necesitarse con objeto de llevar a cabo la actividad sólo una parte de la estructura primaria entera. Por ejemplo en la definición Bcl-2 se incluyen modificaciones menores de la proteı́na o de la secuencia nucleótida de Bcl-2 que no destruyan su actividad. Además, fragmentos de Bcl-2 que conservan al menos una función de la proteı́na entera, se incluyen en la definición. Se entiende que diversas modificaciones de la secuencia aminoácida primaria o nucleótida pueden dar lugar a proteı́nas que poseen una función sustancialmente equivalente o potenciada en comparación con las secuencias que se dan a conocer como SEC.ID. NOs: 1 y 2. Estas modificaciones pueden ser deliberadas, como las mutagénesis sitio especı́ficas, o accidentales, como mediante mutación en huéspedes que son productores de Bcl-2. Todas estas modificaciones se incluyen mientras la función biológica de Bcl-2 se conserva. Además, varias moléculas, tales como otras proteı́nas, hidratos de carbono o lı́pidos, pueden unirse a Bcl-2. Tales modificaciones se incluyen en la definición de Bcl-2. La invención proporciona la utilización de células que tienen aumentada la actividad Bcl-2 para tratar una enfermedad o condición patológicas que dan lugar a la muerte celular apoptósica. La utilización incluye el aumento de la actividad de Bcl-2 en las células afectadas por la enfermedad o condición patológica. Las enfermedades o condiciones patológicas pueden incluir, por ejemplo, enfermedades neurodegenerativas, cáncer y células infectadas por virus. La enfermedad de Alzheimer, la alteración neurodegenerativa más habitual, se estima que afecta a cuatro millones de americanos y representa una carga económica importante para las familias y la sociedad. Ningún tratamiento puede detener o incluso retardar la progresión de esta alteración. La proteı́na β amiloide (ABP) se ha identificado como un posible agente causal de esta enfermedad. La adición de ABP, o de fragmentos peptı́dicos especı́ficos de esta proteı́na, a neuronas cultivadas y progenies celulares neuronales, da lugar a la muerte celular. La expresión de Bcl-2 en estas células cultivadas mediante transferencia genética, puede reducir la muerte celular neuronal mediante ABP. Estos resultados indican que la apoptosis contribuye a la muerte celular neuronal en la enfermedad de Alzheimer. La enfermedad de Parkinson es una alteración neurodegenerativa progresiva y finalmente fatal, caracterizada por la pérdida de las neuronas dopaminérgicas pigmentadas de la substantia nigra. Los sı́ntomas de la enfermedad de Parkinson pueden a menudo tratarse inicialmente administrando L-DOPA, el precursor inmediato de la dopamina. Sin embargo, la eficacia reducida del tratamiento de L-DOPA ocurre a menudo, posiblemente a causa de que el metabolismo del medicamento evita el suministro efectivo al sistema nervioso central. La muerte celular programada se ha implicado también con el juego de una función importante en esta alteración neurodegenerativa, puesto que la retirada de factores neurotróficos a partir de las neuronas conduce a la muerte celular a través de un mecanismo que está de acuerdo con la apoptosis. Además, la ausencia de células inflamatorias o de la formación de cicatrices en los cerebros de pacientes con enfermedad de Parkinson, indica que la muerte de las neuronas del núcleo estriado puede tener lugar a través de la apoptosis de forma opuesta, por ejemplo, a la necrosis. Además de las alteraciones neurodegenerativas, se ha indicado que la apoptosis ha producido la muerte celular a partir de la neurotoxicidad inducida por el glutamato proveniente de condiciones tales como apoplejı́a y esclerosis lateral amiotrófica (ALS; enfermedad de “Lou Gehrig”). La toxicidad inducida por el glutamato tiene lugar cuando éste se libera de las neuronas que se están muriendo en el cerebro cuando se produce un daño agudo. El glutamato que se libera a partir de las neuronas que se están muriendo se une a su vez a receptores especı́ficos para el glutamato sobre las neuronas sanas adyacentes, desencadenando señales que provienen de una serie compleja de eventos bioquı́micos que conducen a la muerte celular apoptósica. Enfermedades y condiciones patológicas tales como las descritas anteriormente y aquéllas que se describirán seguidamente, pueden tratarse aumentando la actividad de Bcl-2 en las células afectadas por la enfermedad o condición patológica. El aumento de la actividad de Bcl-2 en estas células afectadas inhibirá la muerte apoptósica de tales células y por tanto reducirá o evitará la progresión de la enfermedad o condición patológica. 8 ES 2 160 124 T3 5 10 15 20 25 30 La actividad de Bcl-2 puede aumentarse mediante diversos medios, que incluyen, por ejemplo, el aumento de la tasa de sı́ntesis de Bcl-2 o la disminución de la tasa de degradación de Bcl-2, o la modulación de la capacidad de Bcl-2 para interactuar con otras proteı́nas que controlan el proceso de apoptosis. El aumento de la tasa de sı́ntesis de Bcl-2 dará lugar a una elevada acumulación proteica y por tanto de la actividad Bcl-2 en el interior celular. Puede lograrse una tasa de sı́ntesis elevada, por ejemplo, utilizando vectores recombinantes de expresión y tecnologı́a de transferencia génica para expresar un ácido nucleico que codifique Bcl-2. Tales procedimientos son bien conocidos en la técnica y se describen seguidamente haciendo referencia a vectores vı́ricos recombinantes. Otros vectores compatibles con la célula diana apropiada pueden cumplir idéntico objetivo y, por tanto, pueden ser sustituidos por vectores vı́ricos recombinantes en los procedimientos que se describen en la presente memoria. Por ejemplo, los adenovirus recombinantes que poseen promotores generales o histoespecı́ficos, pueden utilizarse para gobernar la expresión de cADN Bcl-2 y proporcionar constructos de expresión de Bcl-2 a diversos tipos de tejidos y células, incluyendo células no mitóticas tales como neuronas en la substantia nigra del cerebro (la región que se afecta en la enfermedad de Parkinson) (La Salle et al., Science 259:988-990 (1993), que se incorpora a la presente memoria como referencia). Alternativamente, los virus recombinantes adenoasociados pueden utilizarse con esta finalidad, con la ventaja añadida de que el virus recombinante puede integrarse establemente en la cromatina de células incluso en reposo no proliferativas tales como las neuronas de los sistemas nerviosos central y periférico (Lebkowski et al., Mol. Cell. Biol. 8:3988-3996 (1988), que se incorpora a la presente memoria como referencia). Pueden también utilizarse estrategias de suministro de ADN mediado por receptores, para proporcionar, de forma histoespecı́fica, plásmidos de expresión Bcl-2 a células, utilizando un ligando histoespecı́fico o un anticuerpo acomplejado no covalentemente con ADN mediante moléculas puente (Curiel et al., Hum. Gene Ther. 3:147-154 (1992); Wu y Wu. J. Biol. Chem. 262:4429-4432 (1987), incorporándose ambos a la presente memoria como referencia). La inyección directa de ADN (plásmidos de expresión de mamı́feros de varios tipos) o de ADN encapsulado en liposomas catiónicos pueden también utilizarse para la transferencia génica estable a células que no se dividen y que se dividen in vivo (Ulmer et al., Science 259:1745-1748 (1993), que se incorpora a la presente memoria como referencia). Además, puede utilizarse la transferencia de ADN mediante el procedimiento del bombardeo de partı́culas para transferir ADN a distintos tejidos (Williams et al., Proc. Natl. Acad.Sci.USA 88:2726-2730 (1991), que se incorpora a la presente memoria como referencia). 35 40 45 50 55 60 Además, los vectores recombinantes de expresión que codifican Bcl-2 pueden también contener ácidos nucleicos adicionales que no codifican Bcl-2 que son útiles para el tratamiento terapéutico de una enfermedad o condición patológica. Por ejemplo, los vectores que codifican Bcl-2 pueden construirse para codificar enzimas utilizados en la sı́ntesis de dopamina cuando se trata la enfermedad de Parkinson, por ejemplo, con la idea de proporcionar simultáneamente genes para la potenciación de la supervivencia celular (Bcl-2) y la función celular (dopamina-β-hidroxilasa). Otros ejemplos son Bcl-2 más secuencias de ADN recombinante preparadas para permitir la secreción del factor de crecimiento nervioso con objeto de apoyar la supervivencia de las neuronas colinérgicas que tı́picamente se han perdido en la enfermedad de Alzheimer (Rosenberg et al., Science 242:1575-1578 (1988), que se incorpora a la presente memoria como referencia), Bcl-2 más insulina para el tratamiento de la diabetes o Bcl-2 más encefalina para el tratamiento del dolor intratable. Si otros ácidos nucleicos que no codifican Bcl-2 están también contenidos en el interior de un vector, dependerá de la enfermedad y de la terapéutica requerida. Un experto en la materia podrá determinar dicho requisito. Los virus son agentes infecciosos muy especializados que han evolucionado en muchos casos para eludir los mecanismos de defensa del huésped. Tı́picamente, los virus infectan y se propagan en tipos celulares especı́ficos. La especificidad dirigida de los vectores vı́ricos utiliza esta especificidad natural, a su vez, para acertar en la diana de tipos celulares predeterminados y, por tanto, introducir un gen recombinante situado en el genoma vı́rico mediante métodos de ingenierı́a genética, en la célula infectada. El vector que va a utilizarse en los procedimientos de la invención, dependerá del tipo de celula deseado al que va dirigido. Por ejemplo, si van a tratarse enfermedades neurodegenerativas mediante el aumento de la actividad de Bcl-2 de las células neuronales afectadas por la enfermedad, entonces se podrı́a utilizar un vector especı́fico para las células de la progenie celular neuronal. Tales vectores vı́ricos incluyen, por ejemplo, los vectores basados en el virus del Herpes simple (Battleman et al., J. Neurosci. 13:941-951 (1993), que se incorpora a la presente memoria como referencia). De modo similar, si va a tratarse una enfermedad o condición patológica del sistema hematopoyético, entonces deberá utilizarse un vector vı́rico que sea especı́fico para las células sanguı́neas y sus precursores, preferentemente para el tipo especı́fico de célula 9 ES 2 160 124 T3 hematopoyética. Tales vectores vı́ricos incluyen, por ejemplo, a los vectores basados en HIV (Carroll et al., J. Cell. Biochem. 17E:241 (1993), que se incorpora a la presente memoria como referencia). 5 10 15 20 25 Además, tales vectores pueden modificarse adicionalmente con receptores especı́ficos o ligandos que modifiquen o alteren la especificidad de la diana mediante sucesos mediados por los receptores. Estos procedimientos de modificación pueden llevarse a cabo, por ejemplo, utilizando técnicas de ADN recombinante o procedimientos de quı́mica sintética. Ejemplos especı́ficos de vectores vı́ricos y de su especificidad incluyen, por ejemplo, el virus del herpes simple para las progenies celulares neuronales, el HIV para los linfocitos T, el virus de la hepatitis para las células hepáticas y el adenovirus para el pulmón y otros tejidos. En casos en los que las infecciones vı́ricas no pueden hacerse histoespecı́ficas, puede conseguirse que la expresión génica vı́rica especı́fica sea sólo para el tipo deseado de célula, mediante la utilización de promotores y potenciadores histoespecı́ficos (Dai et al., Proc. Natl. Acad. Sci USA 89:10892-10895 (1992), que se incorpora a la presente memoria como referencia). Los vectores vı́ricos utilizados habitualmente para hacer diana in vivo y para procedimientos terapéuticos son vectores retrovı́ricos o vectores basados en el ADN. Los vectores retrovı́ricos pueden ser construidos para funcionar como partı́culas infecciosas o para experimentar sólo una única ronda inicial de infección. En el primer caso, el genoma del virus se modifica de forma que conserve todos los genes necesarios, secuencias reguladoras y señales de empaquetamiento para sintetizar nuevas proteı́nas vı́ricas y ARN. Sin embargo, se destruyen las propiedades de transformación oncogénica de dichos virus. Una vez se han sintetizado las proteı́nas vı́ricas, la célula huésped empaqueta el ARN en nuevas partı́culas vı́ricas, que pueden experimentar rondas posteriores de infección. El genoma vı́rico se construye también para codificar y expresar el gen recombinante deseado. En el caso de vectores vı́ricos no infecciosos, el genoma del virus auxiliador se muta habitualmente para destruir la señal de empaquetamiento vı́rica, que es necesaria para encapsular el ARN en las partı́culas vı́ricas, pero conserva los genes estructurales necesarios para empaquetar los virus recombinantes cointroducidos que contienen un gen o genes de interés. Sin tal señal, cualquier partı́cula que se forme no contendrá un genoma y, por tanto, no puede continuar a través de rondas subsiguientes de infección. 30 35 40 45 50 55 60 Los procedimientos para construir y utilizar tales vectores vı́ricos son conocidos en la técnica y se revisan, por ejemplo, en Miller y Rosman, Biotechniques 7: 980-990 (1992), que se incorpora a la presente memoria como referencia. El tipo especı́fico de vector dependerá de la aplicación que se requiera. Los vectores actuales también son conocidos y están disponibles fácilmente en la técnica o pueden ser construidos por el experto en la materia. Los vectores vı́ricos que codifican Bcl-2 pueden administrarse de diversas formas para obtener la expresión y, por tanto, la actividad aumentada de Bcl-2 en las células afectadas por la enfermedad o condición patológica. Si se utilizan, por ejemplo, los vectores vı́ricos el procedimiento puede beneficiarse de su especificidad diana y los vectores no necesitan administrarse localmente en el sitio deseado. Siun embargo, la administración local puede proporcionar un tratamiento más rápido y más efectivo. La administración puede también realizarse mediante inyección intravenosa o subcutánea en el individuo. La inyección de los vectores vı́ricos en el lı́quido cefalorraquı́deo puede también utilizarse como un modo de administración, especialmente en el caso de enfermedades degenerativas. Después de la inyección, los vectores vı́ricos circularán hasta que reconozcan células huéspedes con la apropiada especificidad de diana para la infección. Un modo alternativo de administración de los vectores que codifican Bcl-2 puede ser localmente mediante inoculación directa en el sitio patológico o de condición patológica. La administración local es ventajosa, porque no existe efecto de dilución y, por tanto, es necesaria una dosis más pequeña para obtener la expresión de Bcl-2 en la mayorı́a de las células en las que se ha hecho diana. Además, la inoculación local puede aliviar el requerimiento necesario de dar en el blanco con otras formas de administración, ya que puede utilizarse un vector que infecte todas las células en el área inoculada. Si se desea la expresión en sólo un subconjunto de células especı́fico en el interior del área inoculada, entonces pueden utilizarse para cumplir con este objetivo los elementos promotor y de expresión que son especı́ficos para el subconjunto deseado. Tales vectores que no se dirigen a la diana pueden ser, por ejemplo, vectores vı́ricos, genomas vı́ricos, plásmidos, fagémidos y análogos. Los vehı́culos transfectores tales como liposomas, pueden utilizarse para introducir los vectores no vı́ricos anteriormente descritos anteriormente en las células receptoras en el interior del área inoculada. Tales vehı́culos de transfección son conocidos para los expertos en la materia. El ácido nucleico que codifica Bcl-2 que se utiliza en los procedimientos de la invención se conoce en la 10 ES 2 160 124 T3 5 10 15 20 25 30 35 40 45 50 55 60 técnica y se lista como SEC ID NO: 1. La secuencia nucleótida de Bcl-2 se encuentra también disponible a partir del Genbank bajo la identificación “HUMBCL2A” del locus como número de entrada M13994. La secuencia nucleótida que se describe en la presente memoria, (SEC ID NO.:1) o disponible a partir de la base de datos anterior es todo cuanto necesita un experto en la materia para obtener un cADN Bcl-2 con objeto de utilizarlo en los procedimientos que se dan a conocer. Además, gracias a que cADN Bcl-2 se ha publicado en Tsujimoto y Croce, Proc. Natl. Acad. Sci USA, 83:5214-5218 (1986), que se incorpora a la presente memoria como referencia, está también fácilmente disponible para los expertos en la materia. Utilizando la secuencia Bcl-2 descrita en la presente memoria (SEC ID NO:1), un experto en la materia puede clonar Bcl-2 utilizando procedimientos de rastreo de la genoteca convencional. Las sondas oligonucleótidas útiles para rastreo pueden sintetizarse utilizando métodos conocidos en la técnica tal como la quı́mica de la fosforamidita. Otros procedimientos tal como la reacción en cadena de la polimerasa (PCR) pueden utilizarse también para clonar rápida y eficientemente los ácidos nucleicos que codifican Bcl-2. Utilizando PCR, un segmento de ADN con una longitud de 6.000 pares de bases aproximadamente, puede amplificarse a partir de una única copia génica. Brevemente, la PCR implica la incubación de una muestra de ADN desnaturalizado con dos iniciadores oligonucleótidos que dirigen la sı́ntesis de las cadenas complementarias dependiente de la ADN polimerasa. Se llevan a cabo múltiples ciclos de sı́ntesis, en el que cada ciclo permite un doblaje aproximado de la cantidad de la secuencia diana. Cada ciclo se controla variando la temperatura que permita la desnaturalización de las cadenas del ADN, hibridizando los iniciadores y la sı́ntesis de nuevas cadenas de ADN. La utilización de una ADN polimerasa termoestable elimina la necesidad de añadir nuevos enzimas para cada ciclo y permite la amplificación completamente automatizada del ADN. Veinticinco ciclos de amplificación aumentan la cantidad de la secuencia diana en aproximadamente 106 veces. La tecnologı́a PCR constituye el objeto de las patentes de los Estados Unidos n◦ 4.683.195, n◦ 4.800.159, n◦ 4.754.065 y n◦ 4.683.202, todas las cuales se incorporan a la presente memoria como referencia. La presente invención proporciona asimismo la utilización de compuestos capaces de aumentar la actividad de Bcl-2 para la fabricación de medicamentos para tratar una enfermedad o condición patológica que de lugar a una célula apoptósica, en el que la enfermedad o la condición patológica es mediada por la infección vı́rica. Las utilizaciones que se describen anteriormente para el tratamiento de enfermedades neurológicas y condiciones patológicas pueden también aplicarse a varios otros estados tales como las células infectadas por virus. Muchas infecciones vı́ricas, tal como HIV, culminan en la muerte celular mediante la apoptosis. La apoptosis puede evitarse o retardarse expresando un ácido nucleico que codifica Bcl-2 o su equivalente funcional en las células infectadas por virus (véase, por ejemplo, la Fig. 3). Niveles elevados de Bcl-2 inhiben la muerte celular programada inducida por un vivus infectante y dan lugar a una supervivencia prolongada de las células infectadas. Los vectores vı́ricos que contienen Bcl-2 que hacen diana apropiadamente en las células infectadas, pueden utilizarse para introducir especı́ficamente y aumentar la actividad Bcl-2 en el interior de éstas. Tales vectores pueden también contener ácidos nucleicos que no codifican Bcl-2 que son útiles para tratar las células infectadas por virus. La presente invención proporciona la utilización de una población de células que poseen una actividad Bcl-2 aumentada para la preparación de un medicamento para prolongar la supervivencia in vivo de células transplantadas para el tratamiento de una enfermedad o condición patológica. La utilización incluye el aumento de la actividad de Bcl-2 en una población de células y el trasplante de éstas a un individuo. Las enfermedades o condiciones patológicas pueden incluir, por ejemplo, enfermedades neurodegenerativas, cáncer y células infectadas por virus. Puede utilizarse el trasplante de células genéticamente modificadas que secretan proteı́nas, hormonas o neurotransmisores, por ejemplo, para tratar las enfermedades anteriores, ası́ como también muchas alteraciones crónicas, metabólicas y heredadas, tal como la diabetes y la hemofilia empleando las utilizaciones descritas en la presente memoria, la supervivencia in vivo de tales células enfermas puede mejorarse mediante la transferencia del gen Bcl-2. Una ventaja de tratar células utilizando Bcl-2 es que éste no es oncogénico en la mayorı́a de las células y, por tanto, puede utilizarse para “inmortalizar” células que respondrán in vivo a los mecanismos de control del crecimiento normal. El trasplante celular se está explorando en la actualidad para el tratamiento de ciertas enfermedades, en especial la enfermedad de Parkinson. Por ejemplo, terapias potenciales en modelos animales de la enfermedad de Parkinson han incluido el trasplante de fibroblastos genéticamente modificados que 11 ES 2 160 124 T3 producen L-DOPA en la vecindad de la substantia nigra . Aunque los resultados de estos experimentos han sido alentadores, el tiempo de supervivencia de las células transplantadas es limitado y, por tanto, únicamente da lugar a una mejorı́a pequeña y temporal de la condición. 5 10 15 20 25 El trasplante de células cerebrales fetales, que contienen precursores de las neuronas dopaminérgicas, se ha examinado también como un tratamiento potencial para la enfermedad de Parkinson. En modelos animales y en pacientes con esta enfermedad, los trasplantes de células cerebrales fetales han dado lugar a la reducción temporal de las anormalidades motoras. Por tanto, parece que las neuronas dopaminérgicas fetales implantadas forman sinapsis con las neuronas del huésped circundante. Sin embargo, el trasplante de las células cerebrales fetales está otra vez limitado, debido, por ejemplo, al tiempo de supervivencia limitado de los precursores neuronales implantados. En el caso especı́fico de la enfermedad de Parkinson, la intervención mediante el aumento de la actividad de Bcl-2 puede mejorar la supervivencia in vitro e in vivo de las neuronas fetales y adultas dopaminérgicas, de sus precursores y fibroblastos secretores de dopamina, y de este modo puede proporcionar un tratamiento más efectivo de esta enfermedad. Probablemente, la supervivencia in vitro mejorada de esencialmente cualquier tipo celular que va a ser trasplantado mejorará el tratamiento de esta enfermedad. Por ejemplo, pueden utilizarse células neuronales o sus precursores para el tratamiento de otras enfermedades neurodegenerativas, como la enfermedad de Alzheimer y la muerte celular neuronal inducida por el glutamato, potenciando la supervivencia in vivo de las células utilizando Bcl-2. Ejemplos especı́ficos de tipos celulares distintos a las células neuronales incluyen hepatocitos para el tratamiento del fallo hepático, células β para el tratamiento de la diabetes insulino-dependiente y células dérmicas para el tratamiento de quemaduras. Además, la expresión de Bcl-2 puede utilizarse para potenciar la supervivencia de células trasplantadas para tratamientos cosméticos. Un ejemplo de tal propósito cosmético es para el tratamiento de la alopecia, el término médico para la calvicie. Además, los vectores vı́ricos pueden emplearse utilizando los procedimientos que dirigen la expresión de Bcl-2 a las células del folı́culo piloso o la aplicación tópica al cuero cabelludo de los vehı́culos de transferencia de Bcl-2, dando lugar a un nuevo tratamiento genético para la pérdida de pelo. 30 35 40 45 50 55 60 Las células que van a trasplantarse para el tratamiento de una enfermedad particular pueden modificarse genéticamente in vitro de forma que se aumente la actividad de Bcl-2. Tales procedimientos son conocidos en la técnica y son esencialmente los mismos que los descritos anteriormente, excepto en que la expresión de Bcl-2 se alcanza primero en el interior de las células in vitro. Los vectores que expresan Bcl-2 pueden construirse utilizando técnicas del ADN recombinante y pueden utilizar, por ejemplo, vectores vı́ricos, genomas vı́ricos, plásmidos, fagémidos y análogos (véase por ejemplo, Fig. 1). Tales vectores pueden también codificar una o más secuencias nucleótidas no Bcl-2 para facilitar la función terapéutica de las células una vez se han trasplantado. Los vectores que codifican Bcl-2 se introducen en células receptoras utilizando procedimientos de transfección conocidos para el experto en la materia. Tales procedimientos incluyen, por ejemplo, la infección utilizando vectores vı́ricos, la lipofección, electroporación, bombardeo de partı́culas y transfección. Pueden encontrarse procedimientos detallados de estos métodos en Sambrook et al., Molecular Cloning; A Laboratory Manual (Cold Spring Harbor Laboratory Press, 1989) y las referencias que se citan en la presente memoria, que se incorporan como referencia. Después de la transfección, las células que han aumentado los niveles de actividad Bcl-2 son seleccionadas para utilizar en el tratamiento de trasplante. El procedimiento de rastreo dependerá del método mediante el cual se aumenta la actividad Bcl-2. Por ejemplo, si la actividad aumentada tiene lugar mediante niveles elevados de la proteı́na Bcl-2, puede utilizarse entonces un ensayo cuantitativo que determine el nivel de proteı́na Bcl-2 acumulada. Tales ensayos incluyen, por ejemplo,el análisis de inmunotransferencia, de inmunoprecipitación y ELISA. Tales métodos son conocidos por los expertos en la técnica y pueden encontrarse en Ausubel et al., Current Protocols in Molecular Biology (John Wiley and Sons, 1989) o en Harlow et al., Antibodies: A Laboratory Manual (Cold Spring Harbor Laboratory Press, 1988), los cuales se incorporan a la presente memoria como referencia. Pueden también utilizarse ensayos funcionales como la inhibición de la degradación del ADN apoptósico o la desintegración nuclear, tal como la que se da a conocer en la presente memoria o es conocida en la técnica (véase el Ejemplo VII). De modo similar a la utilización de Bcl-2 para la supervivencia in vivo de las células trasplantadas, la expansión de células de mamı́fero cultivadas para un trasplante subsiguiente, o la expansión de células para la producción a escala industrial de proteı́nas, metabolitos u otros factores clı́nicamente útiles, pue12 ES 2 160 124 T3 5 10 15 20 25 30 den beneficiarse de la supervivencia potenciada debida a Bcl-2. Entre las limitaciones que afectan a este tipo de procedimientos, están la dependencia de muchos tipos celulares de la adherencia a una superficie sólida. Además, muchos tipos de células mueren mediante la apoptosis cuando los factores de crecimiento requeridos son escasamente suministrados o cuando productos de desecho tóxicos se acumulan en los cultivos de células que crecen a altas densidades. Tales problemas pueden superarse aumentando los niveles de Bcl-2 en el interior de las células cultivadas. Por ejemplo, los niveles aumentados de Bcl-2 pueden permitir a las células que dependen de un anclaje, sobrevivir y crecer en ausencia de la unión a una superficie sólida. La sobreexpresión de Bcl-2 puede también permitir a las células crecer a densidades más elevadas en comparación con las células que expresan niveles bajos o normales de Bcl-2. Además, una forma nueva de la proteı́na Bcl-2, Bc12/P59S, es sustancialmente más activa que la proteı́na de tipo salvaje, permitiendo un crecimiento con una densidad superior y evitando la muerte celular debida al agotamiento de los factores de supervivencia y crecimiento en el medio de cultivo tisular (Fig. 2). Todas estas propiedades de Bcl-2 pueden utilizarse para la expansión de la masa celular en el cultivo. La presente invención proporciona también la utilización de compuestos capaces de aumentar la actividad de Bcl-2 en las células con objeto de preparar un medicamento para prolongar la supervivencia in vivo de células trasplantadas, tratando una enfermedad o condición patológica mediante el aumento de la actividad de Bcl-2 de las células inmunitarias. El sistema inmune está formado por diversos tipos celulares que protegen el cuerpo de los organismos infecciosos, monitorizándolo continuamente respecto a la aparición de células anormales, tales como las cancerosas. Algunas células inmunitarias tienen la capacidad de unirse a y eliminar otros tipos celulares, particularmente las células tumorales y las células infectadas por virus. Un resultado de la respuesta de la célula asesina, además de la muerte de la célula diana, es la activación de la apoptosis en el interior de las mismas células asesinas. La función fisiológica de este suicidio autoinducido puede consistir en un mecanismo de retroalimentación negativo para controlar una respuesta inmune. Sin embargo, este mecanismo regulador de la muerte de la célula inmune evita que las respuestas inmunitarias sean de suficiente duración e intensidad como para eliminar de modo efectivo a las células malignas o infectadas por el virus. Las células inmunes especı́fico-tumorales y especı́fico-virales pueden también morir por la falta de suficientes factores de crecimiento tales como la interleuquina-2 (Il-2)in vivo. Este procedimiento puede detenerse o evitarse mediante la transferencia del gen Bcl-2. De este modo, el aumento de la supervivencia de las células inmunes debido a la expresión aumentada de Bcl-2 puede conducir a un tratamiento más efectivo del cáncer y de las enfermedades inducidas por virus. 35 40 45 50 La muerte apoptósica de las células inmunes puede inhibirse aislando estas células o sus precursores y modificándolos para expresar niveles elevados de Bcl-2. Los procedimientos para modificar estas células son esencialmente los mismos que los descritos anteriormente. El trasplante de las células que expresan Bcl-2 a un individuo del que se sospecha que tiene un cáncer o una infección vı́rica, asegurará una respuesta inmunitaria activa y más prolongada contra el estado patológico. Como una alternativa para el tratamiento extracorpóreo, la tecnologı́a de la transferencia génica histoespecı́fica y de la expresión pueden utilizarse para aumentar especı́ficamente la expresión del gen Bcl-2 en las células asesinas in vivo. Otros genes no Bcl-2 que aumentan la función de supervivencia celular de Bcl-2 o potencian la actividad asesina de las células inmunes, pueden introducirse en células en combinación con Bcl-2. Un ejemplo especı́fico de la introducción de un segundo gen que potencie la actividad efectora de las células inmunes es la coexpresión de la proteı́na Lck tirosina quinasa. Cuando se sobreexpresa constitutivamente, por ejemplo, mediante mutación del residuo regulador tirosina en la posición aminoácida 505, a una fenilalanina (Y505F), Lck confiere a las células T funciones efectoras sobre la célula que expresa Y505F en ausencia de IL-2. La abrogación del requerimiento de IL-2 es clı́nicamente ventajoso, porque pueden evitarse los efectos secundarios debidos al tratamiento con un medicamento inmunoestimulador tal como IL-2. Los ácidos nucleicos que codifican proteı́nas distintas a Lck pueden ser coexpresados para potenciar las funciones efectores de las células inmunes. Tales ácidos nucleicos incluyen, por ejemplo, Lyn, Hck, Fyn, Yes, Atk, Fgr y Blk. 55 60 Raf-1, que codifica una serina-treonina proteı́n quinasa, constituye un ejemplo de un gen no Bcl-2 que puede administrarse a la vez que Bcl-2 para potenciar la acción de éste (véase Ejemplo V y Fig. 6). La infección de células con secuencias de ADN que codifiquen una versión mutante de la quinasa Raf-1, con actividad quinasa constitutiva no inducible, actúa sinérgicamente con Bcl-2 para prolongar la supervivencia celular bloqueando la muerte celular apoptósica (véase, por ejemplo, Fig. 6A). De este modo, la co-expresión de genes no Bcl-2 para aumentar la función de Bcl-2 o potenciar otras funciones deseadas, proporciona oun medio de evitar o limitar las infecciones vı́ricas y el crecimiento celular maligno. 13 ES 2 160 124 T3 5 10 15 20 25 30 35 40 45 50 La presente invención proporciona asimismo la utilización de un compuesto capaz de disminuir la actividad de Bcl-2 en las células malignas o infectadas con un virus para preparar un medicamento que potencie la sensibilidad de estas células malignas o infectadas con virus a la terapia. La actividad disminuida puede llevarse a cabo expresando una forma alternativa de Bcl-2 capaz de formar un complejo unido con Bcl-2, en el que el Bcl-2 unido es inactivo, o con otras proteı́nas que interaccionen con Bcl-2, inhibiendo de este modo la función normal de Bcl-2. Muchos tipos de células malignas se vuelven resistentes o refractarias al tratamiento, debido a los altos niveles endógenos de Bcl-2. Estas células malignas con altos niveles de Bcl-2 incluyen cánceres prostáticos, colorectales y nasofarı́ngeos y linfomas, leucemias y neuroblastomas. De modo similar, las células infectadas por virus pueden ser intrı́nsecamente resistentes al tratamiento a causa de la expresión del Bcl-2 endógeno. En contraste con respecto a los métodos anteriormente descritos para aumentar la actividad de Bcl-2, tales enfermedades pueden tratarse de modo efectivo utilizando la estrategia opuesta, es decir, la inhibición de la actividad de Bcl-2. La supresión de la función de Bcl-2 puede utilizarse sola o en combinación con terapias convencionales para proporcionar un medio más efectivo de disminución de la resistencia de las células malignas o infectadas por virus a la muerte por los medicamentos quimioterapéuticos y la irradiación. La expresión de Bcl-2 puede inhibirse, por ejemplo, dirigiendo y/o vectores de expresión que produzcan la forma alternativa de la proteı́na Bcl-2, Bcl-2β. Cuando se expresa conjuntamente con un gen Bcl-2, Bcl-2β se une a las proteı́nas celulares con las cuales interacciona Bcl-2 normalmente y evita la función de éste probablemente mediante un mecanismo competitivo. La inhibición de una función de tipo salvaje mediante la coexpresión de una forma variante de un producto génico, se conoce en la técnica como una mutación negativa dominante (Fig. 7; véase, también, Kolch et al., Nature 349:426-428 (1991)), que se incorpora a la presente memoria como referencia. Bcl-2β surge mediante un mecanismo de corte y empalme alternativo y le falta el segmento hidrofóbico de los aminoácidos que se encuentra en la proteı́na normal Bcl-2, siendo necesaria la región hidrofóbica para la inserción membranosa de Bcl-2 y su función como bloqueador de la apoptosis. Otros ejemplos de Bcl-2 mutante son proteı́nas que se han manipulado mediante ingenierı́a genética para contener deleciones en el interior de la región de aminoácida 85-219 de la proteı́na Bcl-2 de 239 aminoácidos. En las células malignas en las que la función Bcl-2 se ha reducido de forma importante mediante la mutación negativa dominante, puede observarse la sensibilidad potenciada para matar mediante una amplia variedad de medicamentos quimioterapéuticos tales como metotrexato, Adriamicina, Ara-C y dexametaxona. Además de la inhibición de la actividad Bcl-2 para potenciar la sensibilidad de las células malignas o infectadas por los virus a la terapia, otros productos génicos no Bcl-2 implicados en la progresión del estado patológico, pueden inhibirse para aumentar la eficacia del tratamiento. Por ejemplo, altos niveles de actividad quinasa Raf-1 están asociados con la radioresistencia de los tumores. Las manipulaciones de transferencia génica que causan una disminución o aumento de la actividad quinasa Raf-1, pueden aumentar o disminuir, respectivamente, la sensibilidad de las células tumorales a la eliminación mediante medicamentos quimioterapéuticos. Además, las elevaciones en la actividad Raf-1 en presencia de actividad Bcl-2 aumentada, indican que la utilización combinada de reactivos diseñados para interferir con Raf-1 y Bcl-2 puede actuar sinérgicamente para hacer a las células tumorales más sensibles a su eliminación mediante medicamentos quimioterapeúticos convencionales e irradiación (véase el Ejemplo V). Como una alternativa a las estrategias de terapia y transferencia génica, pueden utilizarse compuestos quı́micos que alteren la actividad de Bcl-2. El mismo fundamento descrito anteriormente para el tratamiento de enfermedades o condiciones patológicas, puede aplicarse a estas aplicaciones, excepto en que los compuestos especı́ficos que alteran la actividad Bcl-2 se ponen en el lugar de los procedimientos recombinantes. Ası́, todas las terapias descritas previamente que utilizan la transferencia del gen Bcl-2 son igualmente aplicables a la utilización de los compuestos Bcl-2 especı́ficos. 55 Pueden obtenerse nuevos compuestos Bcl-2 especı́ficos, por ejemplo, mediante el diseño racional o los procedimientos de rastreo de sustancias al azar. Todo cuanto se requiere es un método para identificar con seguridad a los compuestos activos. Estos incluyen tanto los que aumentan la actividad Bcl-2 como los que la disminuyen. Ası́, la determinación de una actividad dependerá del resultado deseado. 60 La presente invención proporciona un procedimiento para identificar compuestos que alteran el proceso de apoptosis (véase Ejemplo VII). Este método incluye el tratamiento de un extracto celular apoptósico con uno o más compuestos y la selección del compuesto que altere el proceso apoptósico en el extracto 14 ES 2 160 124 T3 5 10 15 20 25 30 35 celular. De esta forma, el método permite la identificación de compuestos activos Bcl-2 especı́ficos. El método comprende un extracto acelular que reproduce fielmente el proceso apoptósico. Brevemente, cuando los extractos de huevos de Xenopus se mezclan con cromatina espermática, ésta se ensambla en un núcleo que está rodeado por una membrana nuclear. Estos núcleos acelulares experimentan degeneración espontánea con el tiempo o inducible en presencia de sustancias particulares. El proceso de degeneración nuclear indica el proceso que tiene lugar en las células que están muriendo por apoptosis. La adición de proteı́na Bcl-2 a los extractos evita la fragmentación nuclear (véase, por ejemplo, Fig. 9). Los compuestos activos Bcl-2 especı́ficos pueden identificarse sustituyendo el compuesto por Bcl-2 en el extracto acelular. Una ventaja del procedimiento del extracto acelular es que puede automatizarse monitorizando, por ejemplo, el transporte al núcleo de péptidos marcados radioactivamente o mediante fluorescencia; este proceso de transporte es evitado por la fragmentación nuclear. La presente invención proporciona también un procedimiento para potenciar la producción de anticuerpos monoclonales prolongando la supervivencia in vitro de células precursoras de hibridoma, aumentando la actividad de Bcl-2 en éstas. De modo similar a los procedimientos descritos anteriormente, Bcl-2 puede potenciar la supervivencia, por ejemplo, de células que producen anticuerpos. Tal supervivencia potenciada puede aumentar la eficiencia de la producción de anticuerpos monoclonales, permitiendo la generación de un mayor número de fusiones exitosas. Las células precursoras del hibridoma, tales como las células asociadas de fusión mielomáticas y las células B productoras de anticuerpos, pueden modificarse utilizando métodos descritos en la presente memoria para elevar la expresión de Bcl-2. Los vectores de expresión Bcl-2 pueden introducirse in vitro en las células mielomáticas utilizando los métodos que se exponen. Debido a que las células B que producen anticuerpos se aislan a partir de un animal inmunizado, el aumento de la expresión de Bcl-2 en estas células puede llevarse a cabo inmunizando animales transgénicos que expresen un transgen que codifique una Bcl-2. Las células B obtenidas del bazo de tales animales inmunizados mostrarán caracterı́sticas potenciadas de supervivencia comparados con las células B de los animales normales. Además, los hibridomas preparados utilizando células B obtenidas de ratones transgénicos que expresan un gen humano bcl-2, produjo una frecuencia más alta de clones antı́geno positivos que las células B obtenidas de ratones normales, aumentando por tanto la posibilidad de obtener una progenie celular de hidridoma que exprese un anticuerpo monoclonal deseado. De este modo, la invención proporciona también ratones transgénicos que expresan Bcl-2 como el transgen. Los linfocitos B de tales ratones son útiles para obtener una producción más eficiente de anticuerpos monoclonales. Además, la actividad aumentada de Bcl-2 puede asimismo utilizarse para inmortalizar las células B humanas para la producción de anticuerpos monoclonales humanos. Los ejemplos siguientes están destinados a ilustrar, pero no limitar, la presente invención. Ejemplo I 40 Este Ejemplo muestra que la expresión de Bcl-2 da lugar a un número aumentado de células viables 32D-3 en cultivo y permite que éstas permanezcan viables durante más tiempo que el observado normalmente para esta progenie celular. 45 Las células 32D-3 se transfectaron establemente con plásmidos de expresión que contenı́an un gen de resistencia antibiótica G418 y una secuencia ADN Bcl-2 de tipo salvaje o mutante humana. La secuencia Bcl-2 mutante codifica una proteı́na Bcl-2 variante que sustituye una serina por una prolina en la posición aminoácida 59 (BCL2/P59S). Esta sustitución aminoácida da lugar a un alto nivel de expresión constitutiva de BCL2/P59S. 50 55 60 Después de seleccionar las células respecto a la resistencia G418, las células se sembraron en placas y se determinó su viabilidad. Tal como se muestra en la Fig. 2A., el número de células viables de control (Neo) alcanzó un máximo en los dı́as 4-5 aproximadamente, disminuyendo a partir de entonces. El número de células viables que expresaron la proteı́na Bcl-2 de tipo salvaje (W.T.) alcanzó también un máximo aproximadamente en los dı́as 4-5, pero el número de células viables no disminuyó durante el tiempo examinado. Por el contrario, el número de células viables que expresaron la proteı́na Bcl-2 variante (P59S) aumentó durante 6 dı́as hasta un nivel aproximadamente dos veces mayor que las células de control y las células que expresaron la proteı́na Bcl-2 de tipo salvaje. Como se muestra en la Fig. 2B, el número de células viables se correlaciona con el nivel de sı́ntesis del ADN en las diversas poblaciones celulares. Estos resultados indican que Bcl-2 provoca un aumento en el número de células viables en cultivo y 15 ES 2 160 124 T3 permite que éstas permanezcan viables durante un tiempo superior al normal. Ejemplo II 5 10 15 Este Ejemplo muestra la efectividad de Bcl-2 en la evitación de la muerte inducida por el virus Sindbis de las células cancerosas prostáticas y la muerte inducida por el virus Herpes de las células neuronales PC12. Una progenie celular cancerosa de la próstata de rata, AT-3, se infectó con pZIP-BCL2 o pZIP-NEO (véase Fig. 1), haciéndose crecer entonces en presencia o ausencia del virus Sindbis. A distintos tiempos después de la adición de éste, las células se recuperaron y se determinó la viabilidad celular utilizando la exclusión del azul de tripan. Como se aprecia en la Fig. 3, la infección mediante el virus Sindbis dió lugar a la muerte de esencialmente la totalidad de las células AT-3 en el plazo de 3 dı́as (cı́rculos rellenos). Por el contrario, las células AT-3 que expresaron Bcl-2 se protegieron de la muerte inducida por el virus Sindbis (cuadros rellenos) y sobrevivieron como si el virus Sindbis no se encontrara (compárense controles, cı́rculos abiertos). Estos resultados muestran que la expresión de Bcl-2 protege a las células de la muerte debida a la infección vı́rica. 20 25 30 La expresión de Bcl-2 protege también a las células PC12 de la muerte después de la exposición al virus Herpes. Células PC12 se infectaron con pZIP-BCL2 o pZIP-NEO, exponiéndose entonces al Virus Herpes Simple (HSV-1). Las células se recuperaron a distintos tiempos después de exposición al HSV-1 y se determinó la viabilidad celular tal como se describió anteriormente. Como se muestra en la Figura 11, la viabilidad de las células PC12 disminuyó hasta aproximadamente el 15 % de la viabilidad de las células de control, tras 5 dı́as de exposición al HSV-1. Por el contrario, las células PC12 que expresaban Bcl-2 fueron protegidas de la meurte celular inducida por HSV-1 y crecieron esencialmente lo mismo que las células PC12 control, que expresaron Neo o Bcl-2, pero no se expusieron al HSV-1. Ejemplo III Este Ejemplo demuestra la efectividad de Bcl-2 para la inhibición de la apoptosis inducida por glutamato en las células neuronales PC12 cultivadas. 35 40 45 50 55 El glutamato se libera a partir de las neuronas que mueren en el cerebro durante la apoplejı́a y otras condiciones en que la supervivencia celular de las neuronas está comprometida, incluyendo, quizás, ALS. Las neuronas contienen receptores superficiales celulares de glutamato que parecen transducir señales escasamente caracterizadas que conducen a la muerte celular apoptósica. Estudios in vitro han mostrado que el tratamiento con glutamato puede conducir a la muerte de neuronas corticales cultivadas y células PC12. La muerte celular inducida por glutamato va acompañada de degradación del ADN internucleosómico y cambios ultraestructurales provinientes de la apoptosis. La expresión de Bcl-2 protege a las células neuronales de la muerte celular inducida por el glutamato. La progenie celular del feocromocitoma de rata, PC12, se infectó establemente con pZIP-BCL-2 ó pZIP-NEO (véase Fig. 1), tratándose entonces con 30 mM glutamato durante 24 horas. Después del tratamiento, se evaluó la viabilidad mediante el ensayo de reducción del colorante MTT tal como se describe en Tada et al., J. Immunol. Meth. 93:157-165 (1986). Como se muestra en la Fig. 4, la expresión de Bcl-2 protegió a las células PC12 de la muerte inducida por el glutamato. Además, las células neuronales PC12, las células B50 (Behl et al., Biochem. Biophys. Res. Comm. 186:944-950) (1992), que se incorpora a la presente memoria como referencia) y las células IMR-5 se infectaron con pZIP-BCL-2 o pZIP-NEO (Hanada et al., Canc. Res. 53:4978-4986 (1993); Behl et al., Biochem. Biophys. Res. Comm. 197:949-956 (1993), incorporándose todas estas referencias bibliográficas a la presente memoria como referencia). Las células PC12 y las células B50 se examinaron respecto a la expresión de Bcl-2 mediante inmunotransferencia. Brevemente, los lisados celulares se prepararon a partir de las células y se normalizaron respecto al contenido proteico total anterior a la evaluación de los niveles relativos de la proteı́na Bcl-2. Se produjo antisuero anti-Bcl-2 de conejo contra un péptido sintético que correspondı́a a los residuos aminoácidos 41-54 de la proteı́na Bcl-2 humana. (Reed et al., Canc. Res. 51: 6529-6538 (1991), que se incorpora a la presente memoria como referencia). 60 25 ó 50 µg de proteı́na/carril se fracionaron mediante electroforesis en gel de poliacrilamida-dodecil sulfato sódico (SDS-PAGE) en un gel al 12 %, transfiriéndose entonces a filtros de nitrocelulosa utili16 ES 2 160 124 T3 5 10 zando procedimientos estándar (véase, por ejemplo, Harlow y Lane, supra, 1988). Se detectó la proteı́na Bcl-2 humana utilizando el antisuero anti-Bcl-2 y un reactivo avidina-biotina con peroxidasa de rábano y diaminobenzidina tal como se describe por Krajewski et al., Cancer Res. 53:4701-4714 (1993), que se incorpora a la presente memoria como referencia). En algunos experimentos, la cantidad de proteı́na de la membrana interna mitocondrial, p50-F1 -b-ATPasa, se determinó para confirmar que cantidades iguales de proteı́na se cargaron sobre el gel (véase Tanaka et al., J. Biol. Chem. 268:10920-10926 (1991), que se incorpora a la presente memoria como referencia). Tal como se muestra en la Figura 12, la proteı́na Bcl-2 se expresó en las células PC12 ó B50 infectadas con pZIP-BCL-2 (“BCL-2”), pero no con pZIP-NEO (“NEO”). La comparación de la expresión Bcl-2 en las células PC12 infectadas y las células B50 fue comparable a la expresión de Bcl-2 en las células Scott, que son células de linfoma que contienen una traslocación t (14; 18), y en las células 697-BCL-2, que constituyen una progenie celular leucémica infectada con el virus ZIP-BCL-2 (Miyashita y Reed, Blood 81:151-157 (1993),que se incorpora a la presente memoria como referencia). 15 20 25 30 35 40 45 50 Células PC12 infectadas con pZIP-BCL-2 ó pZIP-NEO, las células B50 o las células IMR-5 se expusieron a diversas concentraciones de glutamato. Se cultivaron cinco mil células en 100 µl de medio en placas de 96 pocillos. Al dı́a siguiente, se añadió glutamato a 100 µl de medio. Las células se incubaron 24 horas más, recuperándose entonces y determinándose la viabilidad celular utilizando el ensayo MTT. Tal como se muestra en la Figura 13, las reducciones dependientes de la concentración en números relativos de células viables, tuvieron lugar en cada una de las tres progenies celulares neuronales distintas. Al contrario que en las células de control, las células que expresaban Bcl-2 fueron significativamente más resistentes a la muerte por el glutamato. El porcentaje de células viables puede compararse también recuperando las células a partir de los cultivos utilizando pancreatina al 20 %, volviéndolas a suspender en un medio que contiene yoduro de propidio y determinando el porcentaje de células viables mediante microscopı́a de fluorescencia o mediante clasificación de células activadas por fluorescencia. Una muestra de células se fija y embebe para análisis mediante microscopı́a electrónica con el fin de determinar si tienen lugar cambios ultraestructurales que indiquen si tiene lugar la apoptosis. La fragmentación del ADN se evalúa mediante ensayos cualitativos de electroforesis en gel y mediante procedimientos bioquı́micos cuantitativos. Un ensayo de fragmentación cualitativa del ADN se lleva a cabo utilizando el ensayo de electroforesis en gel descrito en Sorenson et al., J. Natl. Canc. Inst. 82: 749 (1990). Además, se llevan a cabo ensayos de fragmentación cuantitativa del ADN. Brevemente, se hicieron crecer las células durante 12-24 horas en un medio que contenı́a 1 µCi/ml de timidina tritiada para radiomarcar metabólicamente el ADN celular. Las células se lavaron tres veces y 1 x 106 aproximadamente se devolvieron a su medio de cultivo habitual. Las células se incubaron en presencia de varias concentraciones de glutamato (0-50 mM). De cuatro a 24 horas después, las células se sedimentaron mediante centrı́fuga y el sobrenadante del cultivo se recuperó para determinar la concentración de timidina tritiada mediante contaje de centello lı́quido (fracción 1). Las células se volvieron a suspender en 5 mM Tris (pH 7,4), 10 mM EDTA, Triton X100 al 0,5 % y se centrifugaron a 13.000 x g durante 30 minutos. Se determinó la radioactividad en el sobrenadante resultante (fracción 2), que contiene un ADN (fragmentado) de peso molecular bajo, y el sedimento, que contiene ADN intacto de peso molecular alto (fracción 3). El porcentaje de fragmentación del ADN se calcula sumando los contajes por minuto (cmps) de radioactividad en las fracciones 1 y 2, y dividiendo por los cpms totales de radioactividad en la totalidad de las tres fracciones. El principio de la degradación del ADN genómico en fragmentos de longitud oligonucleosómica se retrasó en las células PC12 infectadas con pZIP-BCL-2 y en las células B50. Estos resultados están de acuerdo con un papel para Bcl-2 en la inhibición de la muerte apoptósica de la célula en las células neuronales. Ejemplo IV 55 Este Ejemplo demuestra la similitud de la acción de los homólogos vı́ricos y aviarios de la Bcl-2 humana. 60 Las células 32D-3 se trasfectaron establemente con plásmidos de expresión que contenı́an un gen de la higromicina (HYG) o un gen de la resistencia antibiótica (NEO) G418 y cADN que codifica la proteı́na Bcl-2 humana, la proteı́na Bcl-2 del pollo o la proteı́na BHRF-1 del Virus Epstein Barr (homólogo vı́rico de Bcl-2). La producción de las proteı́nas deseadas o del mARN correspondiente se comprobó mediante inmunotransferencia o ensayos de transferencia Northern. Después de la transfección, las células se cul17 ES 2 160 124 T3 tivaron sin factor de crecimiento durante distintos tiempos y se determinó el número de células viables. 5 Tal como se muestra en la Fig. 5A, la homóloga Bcl-2 del pollo fue casi tan efectiva como la Bcl-2 humana en la prolongación de la viabilidad celular en el cultivo. Se observaron resultados similares para la proteı́na vı́rica BHRF-1, que aumentó también la viabilidad celular en ausencia de los factores de crecimiento (Fig. 5B). Los estudios de proliferación celular demostraron que el aumento en la viabilidad no fue, de hecho, debido al crecimiento celular. Ejemplo V 10 Este Ejemplo demuestra que las proteı́nas no-Bcl-2 implicadas en la supervivencia celular actúan sinérgicamente para prolongar la prolongación de las células 32D-3 in vitro. 15 20 25 30 35 Las células 32D-3 se transfectaron establemente con plásmidos de expresión que producı́an la proteı́na Bcl-2, proteı́na Raf-1 activada, o ambas, cultivándose entonces bajo condiciones de carencia del factor de crecimiento que causa la apoptosis. A distintos tiempos después de la eliminación del factor de crecimiento del medio, las células se recuperaron y se determinó la viabilidad. Tal como se muestra en la Fig. 6A, la expresión de Raf-1 solo no tuvo efecto sobre la supervivencia celular, mientras que la expresión solo de Bcl-2, tuvo un efecto modesto. De forma importante, la expresión de ambas proteı́nas Bcl-2 y Raf-1 juntas dió lugar a la prolongación sinérgica de la supervivencia celular. De modo significativo, no se observó diferencia en el nivel de sı́ntesis de ADN de las diversas poblaciones de células (Fig. 6 B) lo cual indica que el efecto combinado de Bcl-2 y Raf-1 representa una supervivencia celular potenciada y no, por ejemplo, una capacidad para proliferar en ausencia de los factores de crecimiento. Se utilizó citometrı́a de flujo para confirmar que las células privadas de los factores de crecimiento no proliferaban. Se hicieron crecer las células durante 3 dı́as en presencia o ausencia de II-3. Después de la incubación, las células se tiñeron con yoduro de propidio y se determinó el contenido relativo de ADN de las células. Tal como se muestra en la Fig. 6C, las células que expresaban BCL2 y las células que expresaban BCL2/RAF que crecı́an en presencia del factor de crecimiento (cuadros a y c), exhibı́an patrones de intensidad de fluorescencia similares a los de las distintas progenies celulares que crecieron en ausencia de II-2 (cuadros b y d). La reducción en el número de células con un contenido más alto de ADN, está de acuerdo con el número mayor de células no cı́clicas en fase G0 /en fase G1 que se encontraban en las células que crecieron en ausencia de II-3 (cuadros b y d). Ejemplo VI 40 45 Este Ejemplo ilustra la efectividad de una forma negativa dominante de la proteı́na Bcl-2 para acelerar la muerte de las células 32D-3. Las células 32D-3 se infectaron establemente con vectores retrovı́ricos que contenı́an un gen que conferı́a la resistencia a la neomicina, solo o en combinación con una secuencia de ADN que codificaba una forma de 22 kDa de la proteı́na Bcl-2, la Bcl-2β (Fig. 1A). Después de la infección, las células se cultivaron durante un dı́a sin factores de crecimiento y se determinó el número de células viables. Tal como se muestra en la Fig. 7, la expresión de la proteı́na Bcl-2β negativa dominante dió lugar a una muerte celular significativa. Ejemplo VII 50 Este Ejemplo muestra que la Bcl-2 inhibe la degradación apoptósica de los núcleos en un sistema acelular. 55 60 Se desarrolló un ensayo acelular para evaluar la función de Bcl-2, para rastrear rápidamente compuestos en cuanto a su capacidad para inhibir o potenciar la función de la proteı́na Bcl-2. El ensayo utiliza núcleos autoensamblados in vitro generados mediante la mezcla de extractos celulares derivados de los huevos de Xenopus laevis con la cromatina espermática aislada. Los núcleos se ensamblaron normalmente pero, después de alrededor de 2 horas empezaron a desintegrarse. Los núcleos aparecı́an contraı́dos y tenı́an idéntica apariencia que los aislados que se habı́an tratado brevemente con una endonucleasa. Este fenómeno parece que representa la apoptosis. Alternativamente, los núcleos hepatocı́ticos aislados pueden ser sustituidos por cromatina espermática y mezclarse con los extractos de los huevos, dando lugar al mismo fenómeno. 18 ES 2 160 124 T3 5 10 Para ensayar el efecto de la proteı́na Bcl-2 sobre los núcleos, se prepararon lisados a partir de células Sf9 de insectos infectadas con baculovirus recombinantes que codifican Bcl-2 o una proteı́na irrelevante tal como la β-galactosidasa (β-gal) o la Lck quinasa (véase Reed et al., Anal. Biochem. 205:70-76 (1992)). Para confirmar que Bcl-2 se expresaba en los lisados celulares de los insectos, las células Sf9 de éstos se infectaron con baculovirus Bcl-2 recombinantes o vectores de baculovirus Lck recombinantes. Las células infectadas se incubaron durante tres dı́as para permitir la expresión de los productos génicos, obteniéndose entonces los lisados y fraccionándose mediante electroforesis SDS-PAGE. Después de la electroforesis, las proteı́nas se transfirieron a membrana y se sondearon con un antisuero producido contra un péptido sintético correspondiente a parte de la secuencia aminoácida predicha de la Bcl-2 humana. Tal como se muestra en la Fig. 8, la proteı́na Bcl-2 se expresó en las células Sf9 infectadas con el vector de baculovirus Bcl-2 (carriles 1 y 2) pero no en las células no infectadas (carril 6) o en las células infectadas con un baculovirus que expresaba la Lck quinasa (carril 5). La proteı́na Bcl-2 significó el 5-10 % aproximadamente de la proteı́na total extractada. 15 20 25 30 35 Los lisados de las células Sf9 se añadieron a una dilución de 1:90 a los extractos de Xenopus o a una concentración proteica final de 10 µg/ml (véase Newmeyer y Wilson, Meth. Cell Biol. 36:607-634 (1991); que se incorpora a la presente memoria como referencia). En los extractos que recibieron el lisado Sf9 de control, la condensación de la cromatina empezó después de aproximadamente 2 horas (Fig. 9A, cuadros superiores, y Fig. 9B). Se formaron cuerpos muy condensados, redondos, que se teñı́an brillantemente con el colorante ADN 33258 de Hoechst y se apreció una contracción general de los núcleos y trozos flotantes de cromatina condensada en el extracto circundante (que no se muestran). Después de aproximadamente otros 40 minutos de incubación, los núcleos se habı́an desintegrado completamente (Fig. 9B) y una estructura filamentosa fluorescente Hoechst generalmente dispersa permanecı́a a lo largo con muchos agregados de cromatina esféricos pequeños o de forma irregular (que no se muestran). Por el contrario, cuando se añadió el lisado que contenı́a Bcl-2, los núcleos se protegieron de este tipo de degradación (Fig. 9A, cuadros inferiores, y Fig. 9B). Una proporción considerable de los núcleos permanecieron intactos y fueron completamente funcionales en el transporte nuclear del sustrato fluorescente, el BSA marcado con tetrametilrodamina conjugado a un péptido sintético correspondiente a la señal de localización nuclear del antı́geno T SV40 (TRITC-HSA-NLS). Debe señalarse que en la Fig. 9A, los cuadros superiores contienen dos núcleos, sólo uno de los cuales está intacto y acumula el sustrato fluorescente de transporte. Los cuadros inferiores (Bcl-2 presente) muestran un núcleo intacto tı́pico, que ha acumulado el sustrato de transporte y ha crecido considerablemente, adquiriendo una nueva membrana mediante fusión de las vesı́culas de la membrana nuclear con ésta. El ADN (Fig. 9A, cuadro izquierdo) se concentra en una parte del núcleo del extracto tratado con Bcl-2. Esta localización del ADN corresponde aproximadamente con la forma alargada original del cuerpo cromatı́nico del esperma y posee un “plumaje” normal, es decir, está descondensado, con apariencia tı́pica de la morfologı́a de los núcleos del esperma ensamblados en los extractos estándar de los huevos no apoptósicos de Xenopus. 40 45 La cuantificación de los núcleos intactos, competentes en el transporte, observados en un experimento tı́pico, reveló que, tras 2 horas de incubación, el 50 % aproximadamente de los núcleos en los extractos tratados con Bcl-2 estaban intactos (en extractos no apoptósicos estándar, el porcentaje de núcleos intactos puede ser del orden del 50-90 %), mientras que sólo el 8-10 % de los núcleos de control estaban intactos, medido por la competencia del transporte (Fig. 9B). Tal como se consideró anteriormente, en los extractos de control no se conservaron núcleos intactos 40 minutos más tarde. Sin embargo, el 42 % de los núcleos en los extractos que contenı́an Bcl-2 permanecieron intactos y competentes en el transporte, tras dos horas y 40 minutos de incubación. De este modo, los lisados que contienen Bcl-2 confieren a los núcleos en estos extractos una protección de la degradación. 50 55 60 Con objeto de mostrar que la supresión de la fragmentación nuclear se debió a la presencia de la proteı́na Bcl-2, se llevaron a cabo reacciones de inmunoprecipitación. Dos distintos lisados celulares de insectos se preincubaron con anticuerpos anti-Bcl-2-especı́ficos, o con anticuerpos irrelevantes antes de añadirlos al ensayo de apoptosis acelular de Xenopus. Tal como se muestra en la Fig. 10, los lisados incubados con los anticuerpos anti-Bcl-2 perdieron la capacidad de suprimir la degradación nuclear, mientras que la incubación con anticuerpos irrelevantes no tuvo efecto en la capacidad de los lisados para suprimir la degradación. La disminución de la proteı́na Bcl-2 después de inmunoprecipitación de los lisados con el anticuerpo anti-Bcl-2, se confirmó mediante análisis de transferencia Western (no se muestra). Resultados adicionales indican que la acción de Bcl-2 no está mediada mediante cambios en la eficiencia de la importación nuclear. La medición de la actividad de importación nuclear en estas mismas muestras mostró que la adición de lisado que contenı́a Bcl-2 dió lugar a cambios no intensos en la cantidad 19 ES 2 160 124 T3 de sustrato de transporte fluorescente importado por el núcleo en una hora. 5 Como resultado de la exposición de que la lisis nuclear en el sistema acelular es mediada por una vı́a que puede bloquearse por Bcl-2, el sistema puede utilizarse para examinar compuestos generados, por ejemplo, mediante diseño racional o sı́ntesis al azar, en cuanto a la capacidad de alterar la apoptosis. Los compuestos que exhiben la actividad deseada, pueden ser seleccionados y utilizados para tratar varias enfermedades y condiciones patológicas. Ejemplo VIII 10 15 20 25 Este Ejemplo muestra que los vectores de expresión de Bcl-2 pueden utilizarse para prolongar la supervivencia in vivo de los fibroblastos manipulados mediante ingenierı́a genética que secretan L-DOPA cuando se trasplantan a cerebros lesionados. Una estrategia similar puede utilizarse cuando se trasplantan mioblastos genéticamente modificados, células neuroendocrinas u otros tipos celulares. Además, los vectores no necesitan inyectarse directamente, sino que pueden incorporarse en “cápsulas” biocompatibles que pueden implantarse en la región deseada del cerebro. La transferencia del gen Bcl-2 se utiliza para prolongar la supervivencia de fibroblastos implantados intracranealmente que se manipulan mediante ingenierı́a genética para secretar L-DOPA. Una progenie fibroblástica inmortal de rata (208F) o fibroblastos primarios dérmicos de rata infectados establemente con retrovirus recombinantes que codifican tirosina hidroxilasa, se ha(n) injertado en el cuerpo estriado denervado de cerebros murinos. Estas células trasplantadas reducen los sı́ntomas de comportamiento durante 2 y 10 semanas, respectivamente. La pérdida de un efecto terapéutico después de algunas semanas para las células 208F fue resultado de la pérdida de las células trasplantadas supervivientes. En este modelo animal de la enfermedad de Parkinson, el éxito de la estrategia terapéutica se ha visto obstaculizado por el fallo de los fibroblastos trasplantados para sobrevivir a largo plazo en los cerebros de los animales. La expresión de Bcl-2 puede superar este problema y prolongar la supervivencia intracraneana de fibroblastos manipulados mediante ingenierı́a genética cuando se trasplantaron al cuerpo estriado de los cerebros. 30 Para generar fibroblastos que coexpresen Bcl-2 y tiroxina hidroxilasa (TH), los retrovirus Bcl-2 se utilizan para infectar fibroblastos establecidos y primarios de rata que se infectaron anteriormente de modo estable con virus que expresan TH. Las células positivas Bcl-2/TH son seleccionadas e introducidas estereotácticamente en los cerebros de los individuos que presentan la enfermedad de Parkinson. 35 40 Los procedimientos para llevar a cabo estas inyecciones en los pacientes humanos se describen, por ejemplo, en Freed et al., New Engl. J. Med. 327: 1549-1555 (1992) y Freed et al., Arch. Neurol. 47: 505-512 (1990). Brevemente, antes de la operación, se visualizan los núcleos caudado y putamen mediante tomografı́a axial computerizada. La implantación se lleva a cabo mediante una craniectomı́a elı́ptica (3,5 por 1,5 cm) con el paciente despierto y sedado y bajo anestesia local. La cabeza del paciente se dispone en un bastidor estereotáctico y la tomografı́a axial computerizada se utiliza para determinar las coordenadas para la inyección. Se llevan a cabo de seis a nueve pasadas de la aguja en cada lado del cerebro y 1,5-3 µl de la suspensión celular se depositan a lo largo de trayectorias de 10 mm en el núcleo putamen, caudado o en ambos, cuando la aguja se retira lentamente. 45 50 55 60 Un modelo animal que puede utilizarse para ensayar la eficacia u optimizar el procedimiento es la utilización de ratas, que han experimentado lesiones con 6-hidroxidopamina de sus neuronas estriatales. Por ejemplo, la vida in vivo de fibroblastos que expresen Bcl-2 trasplantados a los cerebros de tales ratas, se compara con la de fibroblastos infectados con virus de control. De esta forma, puede determinarse el número apropiado de células necesarias para una progenie celular particular que exprese Bcl-2. Se pueden realizar experimentos utilizando el modelo de la rata. En este caso, el implante se lleva a cabo disponiendo la cabeza del animal anestesiado en un bastidor estereotáctico e inyectando 10 µl de suspensión celular en dos sitios en el núcleo estriado utilizando las coordinadas AP = 0,3 mm; ML = 2,0 mm; DV = 4,5 mm, y AP = 1,5 mm; ML = 2,0 mm, DV = 4,5 mm, tal como se describe en Paxinos y Watson, The Rat Brain in Stereotaxic Coordinates (Academic Press, 1982). En cada sitio, se depositan 2,5 µl de células, elevándose entonces la jeringuilla 1 mm y administrándose otros 2,5 µl a una velocidad de 1 µl/minuto. La jeringuilla se deja in situ durante otros 2 minutos para permitir la difusión de las células, tal como se describe en Fisher et al., Neuron 6:371-380 (1991), que se incorpora a la presente memoria como referencia. El vector retrovı́rico utilizado para infectar establemente fibroblastos TH positivos expresa tanto un 20 ES 2 160 124 T3 5 10 15 20 25 30 35 40 cADN Bcl-2 como el gen lacZ de E.coli. LacZ codifica la β-gal, que es monitorizado fácilmente mediante ensayos colorimétricos. Las caracterı́sticas destacadas de este vector incluyen la repetición terminal larga más a la izquierda (5’-LTR) del virus Moloney del sarcoma, seguido por el gen Bcl-2, un sitio interno de iniciación ribosómica, lacZ y una LTR 3’ del virus Moloney de la leucemia. Este constructo retrovı́rico da lugar a tı́tulos significativamente más altos de producción vı́rica que el vector popular pBAG (véase Austin y Cepko, Development 110:713-732 (1990), que se incorpora a la presente memoria como referencia). Para producir los vectores vı́ricos, el plásmido anteriormente descrito se transfectará mediante precipitación estándar de fosfato cálcico a PE501, una progenie celular ecotrófica de empaquetamiento que muestra una más baja incidencia de eventos de recombinación espontánea que las células Psi-2 más habitualmente utilizadas. Tal como se utiliza en la presente memoria, el término “ecotrófico” significa que el vector vı́rico posee un margen limitado de huéspedes, es decir, infecta sólo células de roedores, en oposición al término “anfotrófico” que se refiere a un virus que infecta células de todas las especies. El virus producido transitoriamente se utiliza para infectar establemente la progenie celular anfitrófica PA317 mediante el procedimiento de Miller et al., Som. Cell. Mol. Gen. 12: 175-182 (1986), que se incorpora a la presente memoria como referencia. Después de dos pasadas en cultivo para permitir la integración vı́rica, las células infectadas establemente se enriquecen mediante tres rondas de clasificación de células activadas mediante fluorescencia (FACS) utilizando un sustrato β-gal fluorescente que puede utilizarse con células viables, Nolan et al., Proc. Natl. Acad. Sci. USA 85:2603-2607 (1988), que se incorpora a la presente memoria como referencia. Las células clasificadas se siembran a baja densidad en los cultivos o se siembran con una dilución limitada en placas de microtitulación. Los clones individuales se recuperan al azar, se propagan en cultivo y se rastrean inicialmente respecto a la expresión vı́rica basada en los niveles relativos de producción de la proteı́na Bcl-2, determinada mediante ensayo de inmunotransferencia utilizando anticuerpos especı́ficos para la proteı́na Bcl-2 humana. Los sobrenadantes de los cultivos derivados de los clones prometedores se titulan mediante infección de células NIH3T3 y se marcan los centros de células azules en cultivos monocapa. Este procedimiento de rastreo utiliza un protocolo que implica la fijación de las células in situ y la tinción con sustratos colorimétricos para β-gal, Lim y Chae, Biotechniques 7:576-579 (1989), que se incorpora a la presente memoria como referencia. Los clones que exhiben la producción vı́rica más alta se analizan entonces mediante transferencia de ADN para comprobar la integridad de los provirus integrados y ensayados respecto a los virus auxiliadores contaminantes mediante métodos estándar (véase, por ejemplo, Mann et al., Cell 33:153-159 (1983), que se incorpora a la presente memoria como referencia). Para obtener los fibroblastos Bcl-2/TH positivos, el vector Bcl-2/β-gal generado anteriormente se infecta establemente en fibroblastos de roedores TH positivos. Las células infectadas se enriquecen mediante citometrı́a de flujo y se injertan en los cerebros de ratas lesionadas mediante la 6-hidroxidopamina. El tratamiento se monitoriza mediante evaluación semanal respecto a sı́ntomas, tales como rotaciones inducidas por apomorfina o anfetamina. Los animales se sacrifican a distintos tiempos para determinar los números relativos de células supervivientes mediante análisis histoquı́mico de cortes tisulares teñidos de azul, utilizando sustratos colorimétricos apropiados de β-gal. 45 50 55 Una estrategia alternativa a la de selección anteriormente descrita dependiente de β-gal, con objeto de optimizar los procedimientos de trasplante, es utilizar otros vectores retrovı́ricos en lugar del vector Bcl-2/β-gal. Estos otros vectores contienen, por ejemplo, un marcador apropiado tal como un gen de resistencia a la higromicina, Gäken et al., Biotechniques 13:32-33 (1992), que se incorpora a la presente memoria como referencia. De este modo, se introduce cADN Bcl-2 en fibroblastos G418 resistentes que expresan TH, seleccionándose las células infectadas establemente en cuanto al crecimiento en higromicina. En el caso de que no se disponga de un gen marcador colorimétrico, se evalúa la presencia de fibroblastos que produzcan la proteı́na Bcl-2, mediante medios inmunohistoquı́micos utilizando anticuerpos anti-Bcl2, que son especı́ficos para la forma exógena de la proteı́na y útiles para la inmunotinción de los tejidos embebidos en parafina y fijados en el reactivo de Bouin o en formalina. Ejemplo IX 60 Este Ejemplo muestra la utilización de vectores de expresión de Bcl-2 para prolongar la supervivencia in vivo de neuronas dopaminérgicas fetales trasplantadas. La transferencia del gen Bcl-2 se utiliza para prolongar la supervivencia in vitro de neuronas do21 ES 2 160 124 T3 5 10 paminérgicas recuperadas de tejidos neurales fetales. Los precursores neuronales inmortalizados que expresan TH se construyeron utilizando un retrovirus v-myc como el oncogén inmortalizante. Se utilizaron células fetales procedentes de la región del pliegue mesencefálico de embriones de rata de 13 dı́as, a causa de que se cree que las células neuronales que pueblan la substantia nigra y subsiguientemente inervaron el núcleo estriado, migran a través de esta área entre los dı́as 12 a 14 aproximadamente de la gestación, Marchlard y Poirier, Neuroscience 9:373-381 (1983), que se incorpora a la presente memoria como referencia. Las células se infectaron con un virus v-myc y se cultivaron. A los 12 dı́as después de la infección, la totalidad de las células de control no infectadas habı́an muerto, mientras que la mitad aproximadamente de las células expuestas al virus v-myc habı́an sobrevivido. Después de selección en G418, las células se clonaron y se propagaron en cultivo por lo menos mediante 20 pasadas durante 6 meses. Se seleccionaron 3 clones al azar para caracterización detallada y uno de ellos, denominado MF13/H11, se encontró que contenı́a TH. 15 20 25 30 35 40 45 Como se muestra mediante estudios inmunohistoquı́micos, las células MF13/H11 expresaron antı́genos celulares neuronales tı́picos tales como las proteı́nas neurofilamentosas de 150 kDa y de 200 kDa, una proteı́na de adhesión neuronal especı́fica, contactina, y un marcador de la cresta neural, el gangliósido GD2. Las células no expresaron a los marcadores GFAP de los astrocitos y de las células gliales y al proteoglicano NG2. Las células continuaron dividiéndose en condiciones de alta densidad cuando se les proporcionó suero, pero cuando éste se retiró, las células se atrofiaron y murieron. MF13/H11 es el primer clon precursor neuronal dopaminérgico inmortalizado que se ha descrito hasta la fecha. Aunque se ha informado de algunos éxitos utilizando v-myc o versiones sensibles a la temperatura del antı́geno T grande de SV40 para la inmortalización de las células precursoras neuronales y la subsiguiente diferenciación de estas células in vivo, los clones inmortalizados que conservan la capacidad para diferenciarse constituyen la excepción más que la regla. Las células MF13/H11 anteriormente descritas que expresan TH, por ejemplo, exhiben una pequeña capacidad para diferenciarse in vitro cuando se estimulan con ácido retinoico y otros potentes inductores farmacológicos de diferenciación celular neuronal. A diferencia de v-myc sin embargo, Bcl-2 posee la capacidad para inmortalizar células sin afectar a su capacidad para proliferar y diferenciarse. Para prolongar la supervivencia in vitro de las células neuronales fetales, se utiliza el mismo procedimiento descrito anteriormente para la inmortalización de estas células con v-myc, excepto en que se utiliza en su lugar Bcl-2. Se utilizan tanto una progenie celular ecotrófica (PE501) como una progenie celular anfotrófica (PA317) para asegurar que se eviten cualesquiera preferencias. Brevemente, se llevan a cabo las infecciones cultivando las células precursoras neuronales fetales durante 1-2 dı́as en placas de cultivo tisular revestidas con poli-L-lisina o poli-L-ornitina. Tales condiciones eliminan las células gliales y favorecen la unión de las células precursoras neuronales. Se recuperan sobrenadantes que contienen tı́tulos elevados de virus (> 106 unidades formadoras de colonias /ml), a partir de cultivos recién preparados de células PA317 o PE501 y se añaden a los cultivos celulares fetales durante 3 a 4 horas con 10 a 20 µg/ml de polibreno o durante 16-24 horas con 4 µg/ml de polibreno. El medio que contiene los virus se elimina entonces y las células fetales se cultivan durante 1 a 2 dı́as más, antes de añadir el agente de selección apropiado (G418, higromicina o puromicina, dependiendo de si en el retrovirus bcl-2 recombinante, se incluyó, respectivamente, el gen neomicin fosfotransferasa, el gen higromicin fosfotransferasa, o el gen de resistencia a la puromicina). El cultivo continuado en el medio que contiene estos antibióticos puede durar tan poco como un dı́a o varios meses, dependiendo de los objetivos del experimento. 50 55 En algunos casos, no se lleva a cabo selección con antibióticos. Aquı́, la selección de las células infectadas Bcl-2 se realiza esencialmente utilizando las funciones promotoras de supervivencia de Bcl-2. Sólo los cultivos infectados con virus Bcl-2 contendrán células viables proliferativas, ya que las células mesencefálicas no infectadas fenecen tı́picamente en el plazo de dos semanas. Alternativamente, pueden utilizarse la actividad β-gal, ARN Bcl-2 o el análisis proteico, para rastrear las células precursoras neuronales que expresan Bcl-2. Los transformantes estables Bcl-2 se dividen y se trasplantan esencialmente tal como se describe anteriormente para los fibroblastos. 60 22 ES 2 160 124 T3 Ejemplo X Este Ejemplo describe la producción de ratones transgénicos que expresan Bcl-2. 5 10 15 20 25 30 El constructo de ADN utilizado para la producción de ratones transgénicos Bcl-2 se construyó de la siguiente manera. Un fragmento de 4,3 kb (λ1032-5/SH) que contenı́a una parte de la región no traducida 3’ del Bcl-2 humano, el punto de fractura de translocación (14;18), el segmento génico de la región que une la cadena pesada y la región potenciadora IGH, se extirpó del clon λ1032-5 del fago λ (Tsujimoto et al., Science 229:1390-1393 (1985), que se incorpora a la presente memoria como referencia) mediante digestión con SstI e HindIII. El extremo de la secuencia extirpada se hizo romo utilizando ADN polimerasa (fragmento Klenow) y T4 polimerasa y se subclonó en el sitio HincII de pSKII (Stratagene, La Jolla, CA). Un fragmento de 6,9 kb (p18-21H/BH) que contenı́a dos promotores y los primeros dos exones y una parte del segundo intrón de Bcl-2, se extirpó de p18-21H mediante Hind III y digestión parcial BamHI, y se subclonó en el plásmido anterior, pSKII/Eµ , Tsujimoto et al., Proc. Natl. Acad. Sci. USA 84: 1329-1331 (1987), que se incorpora a la presente memoria como referencia. Finalmente, un fragmento HindIII de 4,4 kb (p18-4/H) que contiene una parte del segundo intrón, tercer exón, región no traducida 3’ y sitio de poliadenilación de Bcl-2, se aisló de p18-4 y se subclonó en el sitio HindIII localizado entre los fragmentos 5’ Bcl-2 y Eµ descritos anteriormente. Para realizar la microinyección, se aisló un fragmento de ADN de 13 kb del plásmido final mediante digestión BssHII, se purificó en gel y se dializó contra el tampón TE modificado (10 mM Tris-HCl, pH 7,5, 0,1 mM EDTA). Los ratones transgénicos se produjeron inyectando 250-500 copias aproximadamente del constructo anterior en el pronúcleo masculino de los huevos fertilizados F1 (SWR/J x SJL/J) mediante procedimientos estándar conocidos en la técnica. La integración del transgén se rastreó inicialmente mediante análisis PCR de lisados de la cola utilizando iniciadores especı́ficos para la región principal del punto de fractura t (14;18). Se confirmaron resultados mediante análisis de transferencia ADN del ADN hepático aislado de la progenie F1 de cada progenie transgénica. Todos los retrocruzamientos se realizaron con ratones SWR/J. Se midieron niveles relativos de la proteı́na Bcl-2 mediante un ensayo de inmunoprecipitación/inmunotransferencia en dos etapas que utiliza anticuerpos especı́ficos para la proteı́na Bcl-2 humana, tal como se describe en Reed et al., supra, (1991). Ejemplo XI 35 40 45 50 55 60 Este Ejemplo demuestra que los linfocitos B obtenidos a partir de los ratones B6 transgénicos bcl-2 que expresan la proteı́na Bcl-2 humana, formaron hibridomas con una frecuencia significativamente más alta de clones positivos que cuando se compararon con los hibridomas formados utilizando linfocitos B obtenidos de los ratones de tipo salvaje. Los ratones B6 transgénicos que expresan un minigen bcl-2 bajo el control del potenciador de la cadena pesada inmunoglobulı́nica, se generaron tal como se describió anteriormente (Siegel et al., Proc. Natl. Acad. Sci., USA 89: 7003-7007 (1992); Katsumata et al., Proc. Natl. Acad. Sci., USA 89:11376-11380 (1992), cada uno de los cuales se incorpora a la presente memoria como referencia). Altos niveles de proteı́na Bcl-2 humana se expresan en los linfocitos B de estos ratones transgénicos y, asociada con el alto nivel de expresión de Bcl-2 en estas células, está la supervivencia prolongada de las células B después de estimulación antigénica. Los ratones B6 Bcl-2 transgénicos y los ratones B6 no transgénicos de un nacimiento múltiple, o los ratones Balb/c, se inmunizaron mediante inyección intraperitoneal con 100 µg de β-galactosidasa (β-gal) bacteriana en alumbre en los dı́as 1 y 14. Tres dı́as antes de la recogida de los bazos (habitualmente dos semanas después aproximadamente de la segunda inyección inmunizante), los ratones se revacunaron con 100 µg de β-gal en PBS. Las células del bazo se sembraron a 2 x 105 células/pocillo en placas de 96 pocillos y se fusionaron en una relación de 4:1 con células de mieloma P3/NSI-Ag4-1 (ATCC TIB 18) utilizando polietilenglicol, seleccionándose los hibridomas en medio que contenı́a HAT (Harlow y Lane, supra, 1988). Los hibridomas positivos se identificaron mediante ELISA utilizando β-gal adsorbido a placas de plástico. Se identificaron anticuerpos monoclonales positivos de rata que se unieron a los inmovilizados, utilizando un anticuerpo anti-rata de cabra conjugado con peroxidasa de rábano (Cappel / Worthington). Tal como se muestra en la Tabla, las células B obtenidas a partir de los ratones B6 transgénicos que expresan la Bcl-2 humana, produjeron por célula alrededor de 3-4x hibridomas positivos, tantos como las células B obtenidas a partir de la descendencia normal de los ratones transgénicos o de los ratones Balb/c normales. Además, el análisis de los isotipos inmunoglobulı́nicos expresados mediante los hibridomas, 23 ES 2 160 124 T3 reveló que la mayorı́a eran isotipos IgG, indicando que en los linfocitos B que expresan Bcl-2 tiene lugar un cambio de tipos. Estos resultados demuestran que los linfocitos B de los ratones transgénicos que expresan un gen bcl-2 humano, son útiles para obtener un número aumentado de hibridomas positivos. TABLA 5 Producción de hibridomas EXPT Inmunizados Célula rata Transgénicos Bcl-2 # pocillos sembrados % βgal+ % IgG 1 + + + Balb/c B6 B6 + - 384 1056 288 14 40 14 100 100 100 2 + + - B6 B6 B6 B6 + + - 576 96 276 144 70 19 16 2 89 44 30 0 10 15 20 25 Aunque la presente invención se ha descrito haciendo referencia a las formas de realización dadas a conocer, se entenderá que pueden realizarse varias modificaciones sin apartarse del espı́ritu de la invención. De acuerdo con ello, la invención está limitada únicamente por las siguientes reivindicaciones. 30 35 40 45 50 55 60 24 ES 2 160 124 T3 REIVINDICACIONES 5 1. Utilización de una población celular con actividad Bcl-2 aumentada para preparar un medicamento con objeto de prolongar la supervivencia in vivo de células trasplantadas para el tratamiento de una enfermedad o condición patológica. 2. Utilización según la reivindicación 1, en la que dicha población celular son neuronas o sus células precursoras, células β de los islotes pancreáticos, mioblastos, fibroblastos o células inmunes. 10 3. Utilización según las reivindicaciones 1 ó 2, en la que el medicamento es para el tratamiento de una enfermedad neurodegenerativa. 4. Utilización según las reivindicaciones 1 ó 2, en la que el medicamento es para el tratamiento de un cáncer o de una enfermedad vı́rica. 15 20 25 5. Utilización según las reivindicaciones 1 ó 4, en la que dicha población de células exhibe una actividad alterada de una proteı́na no Bcl-2 comparada con una célula afectada por la enfermedad o condición patológica. 6. Utilización de un compuesto capaz de aumentar la actividad de Bcl-2 en las células para la preparación de un medicamento con objeto de tratar una enfermedad o condición patológica que de lugar a la muerte celular apoptósica, afectada por la enfermedad o condición patológica. 7. Utilización de un compuesto capaz de aumentar la actividad de Bcl-2 en las células para la preparación de un medicamento con objeto de tratar una enfermedad neurodegenerativa tal como la demencia de Alzheimer, la enfermedad de Parkinson o una lesión neuronal inducida por el glutamato. 8. Utilización según la reivindicación 7, en la que dicha enfermedad neurodegenerativa es mediada por una proteı́na β-amiloide o sus fragmentos. 30 9. Utilización según la reivindicación 7, en la que dicha actividad de Bcl-2 aumenta en las células afectadas por la enfermedad neurodegenerativa, elevando los niveles de Bcl-2. 35 10. Utilización de una molécula de ácido nucleico que codifica Bcl-2β para disminuir la actividad de Bcl-2, con objeto de preparar un medicamento para potenciar la sensibilidad de las células malignas a la terapia, en la que dicha Bcl-2β constituye una forma más corta de Bcl-2, a la que le falta una región hidrofóbica suficiente para la unión de la membrana. 40 11. Procedimiento distinto del método de tratamiento del organismo animal o humano para potenciar la producción de anticuerpos monoclonales, que comprende la prolongación de la supervivencia in vitro o in vivo de las células precursoras del hibridoma de células B, aumentando la actividad de Bcl-2 en dichas células. 45 12. Procedimiento según la reivindicación 11, en el que dichas células precursoras del hibridoma de células B son células B de rata, en el que dichas células B son producidas inmunizando una rata transgénica que expresa Bcl-2 como el transgen con un antı́geno predeterminado y aislando las células B a partir del bazo o de otros órganos linfoides de dicha rata transgénica inmunizada. 50 13. Procedimiento para prolongar la supervivencia in vitro de células tumorales explantadas primarias, de forma que puedan modificarse genéticamente de manera más eficiente para secretar linfoquinas o producir otras proteı́nas que potencien la inducción de una respuesta inmune para las células, al ser irradiadas y retrotrasplantadas al paciente con cáncer, aumentando la actividad de Bcl-2 en dichas células tumorales explantadas. 55 14. Procedimiento para potenciar el crecimiento in vitro y la supervivencia de células eucarióticas para aumentar la producción de células para trasplante, aumentando la actividad de Bcl-2 en dichas células eucarióticas. 60 15. Utilización de un compuesto capaz de disminuir la actividad de Bcl-2 y de un compuesto capaz de disminuir la actividad de Raf-1 para la preparación de un medicamento con objeto de potenciar la sensibilidad de las células malignas a la terapia. 16. Procedimiento para potenciar la producción de anticuerpos monoclonales, que comprende: 25 ES 2 160 124 T3 a) la obtención de células precursoras del hibridoma a partir de un animal no humano transgénico que exprese un transgen que codifique un polipéptido, en la que la expresión de dicho polipéptido prolonga la supervivencia de dichas células precursoras del hibridoma aumentando la actividad de Bcl-2, y 5 b) la preparación de un hibridoma a partir de dichas células precursoras del hibridoma que expresan dicho gen no Bcl-2, potenciando de este modo la producción de anticuerpos monoclonales a partir de dicho hibridoma. 10 17. Procedimiento según la reivindicación 16, en el que dicho polipéptido se selecciona a partir del grupo formado por la Bcl-2 humana, un homólogo de especie de Bcl-2 y BHRF-1. 18. Procedimiento según la reivindicación 17, en el que dicho polipéptido se selecciona a partir del grupo formado por la Bcl-2 humana, la Bcl-2 del pollo y BHRF-1. 15 19. Procedimiento según la reivindicación 17, en el que dicho Bcl-2 es Bcl-2/P59S. 20. Procedimiento según cualquiera de las reivindicaciones 16 a 19, en el que el animal transgénico no humano es una rata. 20 25 30 35 40 45 50 55 60 NOTA INFORMATIVA: Conforme a la reserva del art. 167.2 del Convenio de Patentes Europeas (CPE) y a la Disposición Transitoria del RD 2424/1986, de 10 de octubre, relativo a la aplicación del Convenio de Patente Europea, las patentes europeas que designen a España y solicitadas antes del 7-10-1992, no producirán ningún efecto en España en la medida en que confieran protección a productos quı́micos y farmacéuticos como tales. Esta información no prejuzga que la patente esté o no incluı́da en la mencionada reserva. 26 ES 2 160 124 T3 27 ES 2 160 124 T3 28 ES 2 160 124 T3 29 ES 2 160 124 T3 30 ES 2 160 124 T3 31 ES 2 160 124 T3 32 ES 2 160 124 T3 33 ES 2 160 124 T3 34 ES 2 160 124 T3 35 ES 2 160 124 T3 36 ES 2 160 124 T3 37 ES 2 160 124 T3 38 ES 2 160 124 T3 39 ES 2 160 124 T3 40 ES 2 160 124 T3 41 ES 2 160 124 T3 42 ES 2 160 124 T3 43 ES 2 160 124 T3 44