area02-res037
Anuncio

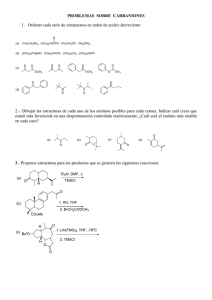
Verano de Investigación Científica y Tecnológica del Pacifico Nuevo Vallarta, Nayarit Agosto 2014 REACCION DE EPIMERIZACION TETRAHIDROPIRIMIDIN-4-ONA. DEL (±)-1-BENZOIL-3,5,6-TRIMETIL- Guadalupe Toribio Arenas. Instituto Tecnológico de Acapulco, lupik_hatter222@hotmail.com Asesor Dr. Jaime Escalante Garcia. Centro de Investigaciones Quimicas, (UAEM) jaime@ciq.uaem.mx Planteamiento del problema: Desarrollar una metodología que permita obtener la configuración cis del compuesto (±)-1-benzoil-3,5,6-trimetil-tetrahidropirimidin-4-ona, ya que anteriormente solo se obtuvo el estereoisómero de configuración trans en mayor proporción. Por lo tanto, se busca encontrar las condiciones óptimas de reacción para obtener su estereoisómero. Para esto es necesario emplear una base mas pequeña como al amiduro de litio de la diisopropilamina (LDA) en THF. La reacción de epimerizacion se debe llevar cabo en una temperatura diferente a la temperatura de alquilación ya que esto es factor importante para que el rendimiento de la reacción sea adecuado. Otro factor que podría ser modificado es el tiempo en el que transcurre la reacción ya que podría afectar la proporción de los productos cis vs trans. Metodología: Para la optimización de la reacción de alquilación, se partió de 1 g del heterociclo (±)-1-benzoil-3,6-dimetil-tetrahidropirimidin-4-ona, la cual se colocó en un matraz redondo provisto de agitación magnética, en una atmósfera de N2 con 40 mL del disolvente THF, a una temperatura de -78 oC y a continuación se le agregaron 2.1 mL de LDA (1 eq.); se dejó transcurrir 30 minutos a esta temperatura y posteriormente se agregó 0.26 mL de yodometano (1 eq.). La mezcla de reacción se dejó por una hora y finalmente se agregaron 2 mL de agua. Mediante la cromatografía en columna se logró purificar y obtener el estereoisómero trans-(±)1-benzoil-3,5,6-trimetiltetrahidropirimidin-4-ona, el cual posteriormente se sometió a una reacción de epimerización usando el mismo disolvente de THF y la temperatura de -78 oC. Se agregaron 0.94 mL de LDA (1 eq) por 30 min. Se colocó la mezcla de reacción a 0 oC para mejorar el resultado de la reacción y así poder obtener el esteroisómero cis. La separación de cromatografía en columna permitió obtener la configuración cis, la cual fue confirmada por RMN 200 MHz 1H y 13C. Verano de Investigación Científica y Tecnológica del Pacifico Nuevo Vallarta, Nayarit Agosto 2014 Conclusiones: Se obtuvieron los dos estereoisómeros precursores de los ácidos cis- y trans-3amino-2-metilbutanoicos. Se lograron separar mediante la cromatografía en columna y se identificaron mediante RMN 200 MHz 1H. Se pudo observar que el tiempo y la temperatura juegan un papel importante para así poder obtener mejores resultados, por ejemplo al incrementar la temperatura nos permitió que ocurriera la reacción de desprotonación y formar el enolato, por lo que el ataque del protón al enolato se realizó por la cara menos impedida estéricamente de la molécula y se obtuvo el estereoisómero cis de la (±)-1-benzoil-3,5,6trimetiltetrahidropirimidin-4-ona. Mediante la hidrólisis del ciclo se obtuvo el isómero cis del β-aminoácido α,β-disustituido. Debido a que el rendimiento de la reacción fue bajo (1.2 %) no es un método factible para realizar este tipo de epimerización.