Continuación y bibliografía
Anuncio
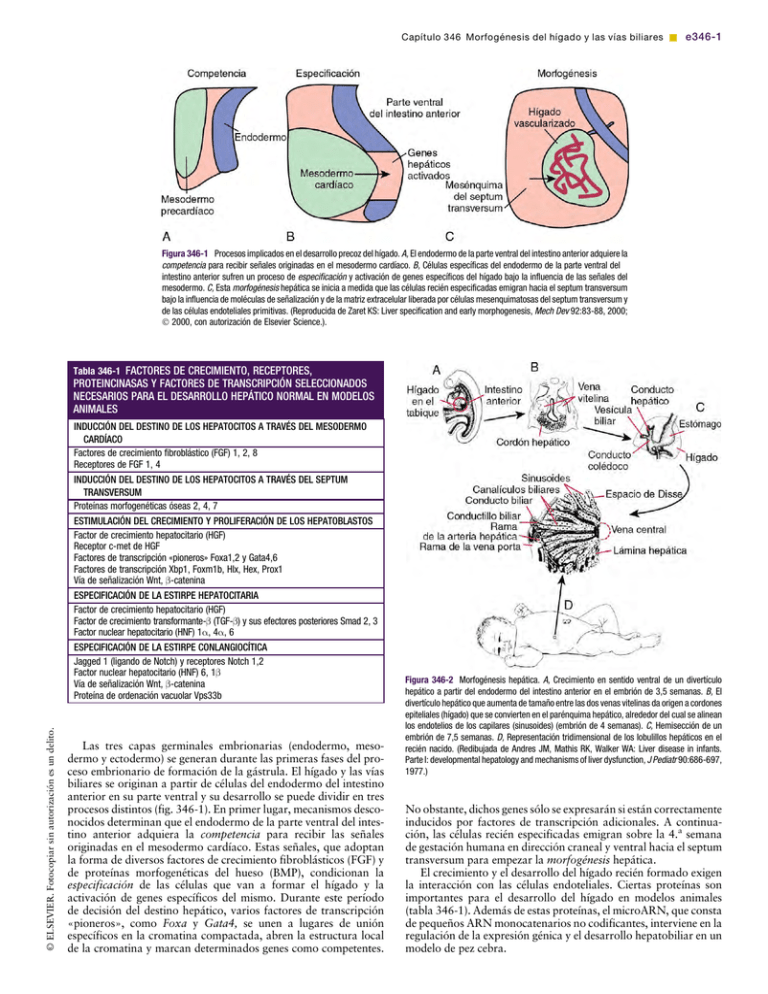
Capítulo 346 Morfogénesis del hígado y las vías biliares & e346-1 [(Figura_1)TD$IG] Figura 346-1 Procesos implicados en el desarrollo precoz del hígado. A, El endodermo de la parte ventral del intestino anterior adquiere la competencia para recibir señales originadas en el mesodermo cardíaco. B, Células específicas del endodermo de la parte ventral del intestino anterior sufren un proceso de especificación y activación de genes específicos del hígado bajo la influencia de las señales del mesodermo. C, Esta morfogénesis hepática se inicia a medida que las células recién especificadas emigran hacia el septum transversum bajo la influencia de moléculas de señalización y de la matriz extracelular liberada por células mesenquimatosas del septum transversum y de las células endoteliales primitivas. (Reproducida de Zaret KS: Liver specification and early morphogenesis, Mech Dev 92:83-88, 2000; Ó 2000, con autorización de Elsevier Science.). [(Figura_2)TD$IG] Tabla 346-1 FACTORES DE CRECIMIENTO, RECEPTORES, PROTEINCINASAS Y FACTORES DE TRANSCRIPCIÓN SELECCIONADOS NECESARIOS PARA EL DESARROLLO HEPÁTICO NORMAL EN MODELOS ANIMALES © ELSEVIER. Fotocopiar sin autorización es un delito. INDUCCIÓN DEL DESTINO DE LOS HEPATOCITOS A TRAVÉS DEL MESODERMO CARDÍACO Factores de crecimiento fibroblástico (FGF) 1, 2, 8 Receptores de FGF 1, 4 INDUCCIÓN DEL DESTINO DE LOS HEPATOCITOS A TRAVÉS DEL SEPTUM TRANSVERSUM Proteínas morfogenéticas óseas 2, 4, 7 ESTIMULACIÓN DEL CRECIMIENTO Y PROLIFERACIÓN DE LOS HEPATOBLASTOS Factor de crecimiento hepatocitario (HGF) Receptor c-met de HGF Factores de transcripción «pioneros» Foxa1,2 y Gata4,6 Factores de transcripción Xbp1, Foxm1b, Hlx, Hex, Prox1 Vía de señalización Wnt, b-catenina ESPECIFICACIÓN DE LA ESTIRPE HEPATOCITARIA Factor de crecimiento hepatocitario (HGF) Factor de crecimiento transformante-b (TGF-b) y sus efectores posteriores Smad 2, 3 Factor nuclear hepatocitario (HNF) 1a, 4a, 6 ESPECIFICACIÓN DE LA ESTIRPE CONLANGIOCÍTICA Jagged 1 (ligando de Notch) y receptores Notch 1,2 Factor nuclear hepatocitario (HNF) 6, 1b Vía de señalización Wnt, b-catenina Proteína de ordenación vacuolar Vps33b Las tres capas germinales embrionarias (endodermo, mesodermo y ectodermo) se generan durante las primeras fases del proceso embrionario de formación de la gástrula. El hígado y las vías biliares se originan a partir de células del endodermo del intestino anterior en su parte ventral y su desarrollo se puede dividir en tres procesos distintos (fig. 346-1). En primer lugar, mecanismos desconocidos determinan que el endodermo de la parte ventral del intestino anterior adquiera la competencia para recibir las señales originadas en el mesodermo cardíaco. Estas señales, que adoptan la forma de diversos factores de crecimiento fibroblásticos (FGF) y de proteínas morfogenéticas del hueso (BMP), condicionan la especificación de las células que van a formar el hígado y la activación de genes específicos del mismo. Durante este período de decisión del destino hepático, varios factores de transcripción «pioneros», como Foxa y Gata4, se unen a lugares de unión específicos en la cromatina compactada, abren la estructura local de la cromatina y marcan determinados genes como competentes. Figura 346-2 Morfogénesis hepática. A, Crecimiento en sentido ventral de un divertículo hepático a partir del endodermo del intestino anterior en el embrión de 3,5 semanas. B, El divertículo hepático que aumenta de tamaño entre las dos venas vitelinas da origen a cordones epiteliales (hígado) que se convierten en el parénquima hepático, alrededor del cual se alinean los endotelios de los capilares (sinusoides) (embrión de 4 semanas). C, Hemisección de un embrión de 7,5 semanas. D, Representación tridimensional de los lobulillos hepáticos en el recién nacido. (Redibujada de Andres JM, Mathis RK, Walker WA: Liver disease in infants. Parte I: developmental hepatology and mechanisms of liver dysfunction, J Pediatr 90:686-697, 1977.) No obstante, dichos genes sólo se expresarán si están correctamente inducidos por factores de transcripción adicionales. A continuación, las células recién especificadas emigran sobre la 4.a semana de gestación humana en dirección craneal y ventral hacia el septum transversum para empezar la morfogénesis hepática. El crecimiento y el desarrollo del hígado recién formado exigen la interacción con las células endoteliales. Ciertas proteínas son importantes para el desarrollo del hígado en modelos animales (tabla 346-1). Además de estas proteínas, el microARN, que consta de pequeños ARN monocatenarios no codificantes, interviene en la regulación de la expresión génica y el desarrollo hepatobiliar en un modelo de pez cebra. e346-2 & Parte XVIII Sistema digestivo En el seno del mesenterio ventral la proliferación de las células emigradas forma cordones hepáticos anastomosados, y la red de hepatocitos primitivos, sinusoides y mesénquima de los tabiques forma la arquitectura básica del lobulillo hepático (fig. 346-2). La porción craneal sólida del divertículo hepático (pars hepatis) acaba formando el parénquima hepático y los conductos biliares intrahepáticos. Los lobulillos hepáticos se pueden identificar ya en la 6.a semana de gestación humana. Las estructuras del canalículo biliar, que incluyen microvellosidades y complejos de unión, son lugares especializados de la membrana del hepatocito que aparecen en fases muy tempranas de la gestación, de manera que hacia la 6.a-7.a semana ya se pueden identificar grandes canalículos rodeados de varios hepatocitos. Los hepatocitos y las células de los conductos biliares (colangiocitos) se originan tanto a partir de los hepatoblastos como de precursores comunes. La señalización por la vía de Notch, que está alterada en el síndrome de Alagille, potencia la diferenciación del hepatoblasto para formar el epitelio biliar, mientras que el factor de crecimiento hepatocitario (HGF) antagoniza la diferenciación. El desarrollo de los conductos biliares intrahepáticos está determinado por el patrón de desarrollo y la ramificación de la vena porta. Alrededor de la 8.a semana de gestación, los hepatoblastos primitivos adyacentes al mesénquima que rodea las ramas de la vena porta forman un manguito cilíndrico, comenzando en el hilio hepático, denominado placa ductal. A partir de las 12 semanas de gestación se produce una «remodelación» de la placa ductal, de modo que algunos de sus segmentos experimentan una dilatación tubular y una desaparición gradual del tejido epitelial excesivo. La ramificación del árbol biliar continúa durante toda la vida fetal y en el momento del nacimiento las ramas más periféricas de las venas portales aún están rodeadas de placas ductales; se requieren otras 4 semanas para que den lugar a los conductos portales definitivos. La falta de remodelación de la placa ductal da lugar a la persistencia de configuraciones primitivas de dicha placa, anomalía denominada malformación de la placa ductal. Esta lesión histopatológica se ha observado en biopsias hepáticas de diversas afecciones hepáticas, como la fibrosis hepática congénita, la enfermedad de Caroli y la atresia biliar. La porción caudal (pars cystica) del divertículo hepático origina la vesícula biliar, el conducto cístico y el colédoco. Las porciones distales de los conductos hepáticos derecho e izquierdo se forman a partir de los conductos extrahepáticos, mientras que las porciones proximales se desarrollan a partir de las primeras placas ductales intrahepáticas. Los conductos biliares intrahepáticos y el árbol biliar intrahepático en desarrollo mantienen la continuidad luminal y la permeabilidad desde el principio de la organogénesis (v. fig. 346-2C). El flujo hepático fetal de sangre deriva de la arteria hepática y de las venas porta y umbilical, que forman el seno portal. El flujo de sangre venosa portal se dirige principalmente hacia el lóbulo hepático derecho, mientras que el flujo umbilical lo hace hacia el izquierdo. El conducto venoso deriva la sangre desde las venas porta y umbilical hasta la vena hepática, evitando que atraviese la red de sinusoides. Después del nacimiento, el conducto venoso se cierra cuando empieza la ingesta oral. La saturación de oxígeno es menor en la sangre venosa portal que en la umbilical, de forma que la oxigenación del lóbulo hepático derecho es menor que la del lado izquierdo y su actividad hematopoyética es mayor. El transporte y las actividades metabólicas del hígado se ven facilitados por la organización estructural de los cordones de hepatocitos, que forman hileras separadas por sinusoides que convergen hacia las tributarias de la vena hepática (la vena central), localizada en el centro del lobulillo (v. fig. 346-2D). Así quedan establecidas las vías y el patrón del flujo de entrada y salida de sustancias del hígado. Además del aporte arterial de la circulación sistémica, el hígado recibe un aporte de sangre venosa desde la vía digestiva a través del sistema porta. Los productos del sistema hepatobiliar se liberan por dos vías distintas: a través de la vena hepática y a través de la vía biliar que los devuelve al intestino. El hígado secreta proteínas plasmáticas y otros elementos del plasma. Los nutrientes absorbidos y circulantes llegan al hígado a través de la vena porta o la arteria hepática, atraviesan los sinusoides y después pasan a la circulación sistémica a través de la vena central. Los componentes de la bilis se transportan a través de una serie de conductos de calibre cada vez mayor, que empiezan en los canalículos biliares para seguir por los conductos biliares y culminar en el colédoco. La secreción de bilis se detecta hacia la semana 12 de gestación. Los principales componentes de la bilis cambian según el estadio del desarrollo. Cerca del nacimiento, la cantidad de colesterol y fosfolípidos es relativamente pequeña; las bajas concentraciones de ácidos biliares, la ausencia de ácidos biliares secundarios derivados de la acción bacteriana y la existencia de ácidos biliares poco frecuentes reflejan la baja velocidad de flujo biliar y la inmadurez de las vías sintéticas de los ácidos biliares. El hígado alcanza un tamaño máximo relativo en la 9.a semana de gestación y representa un 10% del peso del feto. En las primeras fases del desarrollo el hígado es un órgano hematopoyético principal. En la 7.a semana, el número de células hematopoyéticas supera al de hepatocitos funcionales en el primordio hepático. Estos hepatocitos inmaduros son más pequeños que los maduros (alrededor de 20 mm frente a 30-35 mm) y contienen menos glucógeno. En el niño a término la masa hepatocitaria se incrementa hasta dominar el órgano, a medida que aumentan el tamaño de los hepatocitos y el contenido de glucógeno. La hematopoyesis ha desaparecido casi por completo del hígado al 2. mes de vida posnatal en niños nacidos a término. Dado que la densidad de hepatocitos aumenta al hacerlo la edad gestacional, se produce una disminución relativa del volumen de la red sinusoidal. El hígado representa un 5% del peso corporal al nacer y sólo un 2% en el adulto. En el recién nacido sano varios procesos metabólicos son inmaduros, en parte por la persistencia de un patrón fetal en la actividad de varios procesos enzimáticos. Muchas de las funciones hepáticas del feto las realiza el hígado de la madre, que le aporta nutrientes y actúa como vía de eliminación de los productos finales del metabolismo y las toxinas. El metabolismo del hígado fetal se dedica sobre todo a la producción de proteínas requeridas para el crecimiento. Cerca del momento del nacimiento, las principales funciones son producir y almacenar nutrientes esenciales, excretar bilis y establecer los procesos de eliminación. La adaptación extrauterina exige la síntesis de enzimas nuevas. La modulación de estos procesos [(Figura_3)TD$IG] Figura 346-3 Esquema de la ultraestructura y los orgánulos de los hepatocitos. (Redibujada de Sherlock S: Hepatic cell structure. En Sherlock S, editor: Diseases of the liver and biliary system, 6.a ed., Oxford, 1981, Blackwell Scientific, pág. 10, con autorización de Blackwell Scientific.) Capítulo 346 Morfogénesis del hígado y las vías biliares & e346-3 depende del aporte de sustratos y de hormonas por parte de la placenta y, en el período posnatal, de los aportes dietéticos y hormonales. ULTRAESTRUCTURA DEL HÍGADO Los hepatocitos tienen varias características ultraestructurales que reflejan su función biológica (fig. 346-3). Los hepatocitos, como otras células epiteliales, muestran polarización, lo que significa que su estructura y su función están orientadas en una dirección. Uno de los resultados de esta polaridad es que las distintas regiones de la membrana plasmática del hepatocito tienen funciones especializadas. En la superficie sinusoidal se produce el transporte bidireccional, y a este nivel tiene lugar la entrada de los materiales que alcanzan el hígado a través de la vena porta y la salida del hepatocito de los compuestos secretados por el hígado. Las membranas canaliculares de los hepatocitos adyacentes forman los canalículos biliares, que están conectados por uniones estrechas, que impiden la reentrada al sinusoide de los compuestos secretados. Dentro del hepatocito, las actividades metabólicas y sintéticas se hallan contenidas en el interior de numerosos orgánulos celulares. La oxidación y el metabolismo de diversos tipos de sustratos, la oxidación de los ácidos grasos, los procesos fundamentales de la gluconeogénesis y el almacenamiento y la liberación de la energía se producen en las abundantes mitocondrias. En el retículo endoplásmico (RE), que es una red continua de túbulos y cisternas de superficie lisa o rugosa, se producen diversos procesos, como la síntesis de proteínas y triglicéridos y el metabolismo de los fármacos. La baja actividad fetal de las enzimas ligadas al RE explica la relativa ineficacia del metabolismo xenobiótico (de los fármacos). En el aparato de Golgi se empaquetan las proteínas y es posible que también participe en la secreción de bilis. Los peroxisomas de los hepatocitos son orgánulos citoplasmáticos rodeados por una membrana única que contienen enzimas, como las oxidasas y catalasas y las enzimas que intervienen en el metabolismo de los lípidos y los ácidos biliares. Los lisosomas contienen numerosas hidrolasas que participan en la digestión intracelular. El citoesqueleto del hepatocito está constituido por actina y otros filamentos, y se distribuye por toda la célula, aunque se concentra sobre todo cerca de la membrana plasmática. Los microfilamentos y los microtúbulos intervienen en la endocitosis mediada por receptor, en la secreción biliar y en el mantenimiento de la arquitectura y la motilidad del hepatocito. FUNCIONES METABÓLICAS DEL HÍGADO © ELSEVIER. Fotocopiar sin autorización es un delito. Metabolismo de los hidratos de carbono El hígado regula la glucemia sérica de forma estrecha mediante varios procesos, como el almacenamiento del exceso de hidratos de carbono en forma de glucógeno, un polímero de glucosa que se hidroliza con rapidez a ésta durante el ayuno. Los hepatocitos mantienen la glucemia sérica produciendo glucosa libre mediante glucogenólisis o gluconeogénesis. Inmediatamente después del nacimiento el lactante depende de la glucogenólisis hepática. En el hígado fetal existe actividad gluconeogénica a bajo nivel y aumenta con rapidez tras el nacimiento. La síntesis de glucógeno fetal empieza hacia la 9.a semana de gestación, pero los depósitos de glucógeno aumentan con más rapidez al final del embarazo, momento en el que el hígado contiene unas reservas de glucógeno 2-3 veces mayores que en el hígado adulto. La mayor parte de este glucógeno almacenado se utiliza durante el período posnatal inmediato. La reacumulación de glucógeno empieza a las 2 semanas de vida posnatal y los depósitos de glucógeno alcanzan los niveles adultos hacia la 3.a semana de vida en los recién nacidos a término sanos. Las fluctuaciones de la glucemia en los niños prematuros se deben en parte a que la regulación eficiente de la síntesis, el almacenamiento y la degradación del glucógeno sólo se desarrolla al final del embarazo. Los hidratos de carbono de la dieta, como la galactosa, se convierten en glucosa, pero en las primeras fases de la vida se depende mucho de la gluconeogénesis, sobre todo si las reservas de glucógeno son limitadas. Metabolismo de las proteínas En la fase de crecimiento fetal rápido, la velocidad de síntesis de las poliaminas con importancia fisiológica viene determinada por unas descarboxilasas específicas, cuya actividad es mayor que en el hígado maduro. La velocidad de la síntesis de albúmina y de proteínas de secreción en el hígado en desarrollo es paralela a los cambios cuantitativos en el retículo endoplásmico. El feto humano empieza a sintetizar albúmina hacia la 7.a-8.a semana de desarrollo y su producción aumenta en proporción inversa a la de a-fetoproteína, que es la proteína fetal predominante. Hacia el 3.er-4. mes de gestación el hígado fetal produce fibrinógeno, transferrina y lipoproteínas de baja densidad. A partir de este período el plasma fetal contendrá ya todas las principales clases de proteínas, pero sus concentraciones serán mucho menores que las observadas en los adultos. Los patrones posnatales de síntesis de proteínas varían con la clase de proteína. Todas las clases de lipoproteínas aumentan de forma abrupta 1 semana después del nacimiento y alcanzan niveles que se modifican muy poco hasta la pubertad. Las concentraciones de albúmina son bajas en el recién nacido (unos 2,5 g/dl) y alcanzan valores de adulto tras varios meses (alrededor de 3,5 g/dl). Los niveles de ceruloplasmina y de los factores del complemento aumentan muy despacio hasta alcanzar los valores del adulto a lo largo del primer año de vida. Por el contrario, los niveles de transferrina en el momento del parto son similares a los del adulto, disminuyen durante 3-5 meses y vuelven a elevarse hasta llegar a sus valores definitivos. Los bajos niveles de actividad de las proteínas específicas tienen importancia en la nutrición de los lactantes; así, un nivel bajo de actividad de la cistationina g-liasa (cistationasa) altera la vía de trans-sulfuración que permite convertir la metionina de la dieta en cisteína. Por tanto, esta última ha de aportarse en la dieta. También puede haber necesidades dietéticas similares de otros aminoácidos azufrados, como la taurina. Metabolismo de los lípidos La oxidación de los ácidos grasos es una fuente fundamental de energía en las primeras fases de la vida que complementa a la glucogenólisis y la gluconeogénesis. Los recién nacidos muestran una intolerancia relativa al ayuno prolongado, en parte por su limitada capacidad de cetogénesis hepática. En los primeros días de vida se produce una maduración rápida de la capacidad hepática para oxidar ácidos grasos. La leche es la principal fuente de calorías en las primeras fases de la vida; esta dieta rica en grasa y baja en hidratos de carbono requiere una gluconeogénesis activa para mantener la glucemia. Cuando el aporte de glucosa es limitado, la producción de cuerpos cetónicos a partir de los ácidos grasos endógenos puede aportar energía para la gluconeogénesis hepática y también es un combustible alternativo para el metabolismo del cerebro. Cuando se produce un exceso de hidratos de carbono el hígado produce triglicéridos. Los procesos metabólicos en los que participan los lípidos y las lipoproteínas son predominantemente hepáticos, de forma que la inmadurez o una enfermedad hepática altera las concentraciones de lípidos y lipoproteínas. Biotransformación Los recién nacidos tienen una menor capacidad para metabolizar y desintoxicar determinados fármacos por la falta de desarrollo de su componente microsómico hepático, lugar en el que se producen las reacciones oxidativas, reductoras, hidrolíticas y de conjugación necesarias para estas biotransformaciones. Los principales componentes del sistema de las monooxigenasas, como el citocromo P450 (CYP), citocromo-c reductasa y la forma reducida de la nicotinamida-adenina dinucleótido fosfato (NADPH), están presentes en cantidades bajas en las preparaciones microsómicas de origen fetal. En los recién nacidos a término se detecta un bajo nivel de actividad de uridindifosfato (UDP) glucuronosiltransferasa hepática y de las enzimas que participan en la oxidación de los hidrocarburos aromáticos policíclicos. Las diferencias de la farmacocinética dependientes de la edad varían entre los distintos compuestos. La semivida del paracetamol e346-4 & Parte XVIII Sistema digestivo en un recién nacido es parecida a la del adulto, mientras que la teofilina tiene una semivida de unas 100 horas en un prematuro comparadas con 5-6 horas en un adulto. Estas diferencias en el metabolismo y otros factores, como la unión a las proteínas plasmáticas y el aclaramiento renal, requieren el uso de posologías adecuadas de cada fármaco para maximizar la eficacia y evitar su toxicidad. Ejemplos muy extremos de la susceptibilidad del recién nacido a la toxicidad de los fármacos son las respuestas al cloranfenicol (síndrome del «niño gris») o al alcohol benzoílo y sus metabolitos, en las que influyen la ineficacia de la glucuronidación y la conjugación con glicina, respectivamente. Las bajas concentraciones de antioxidantes (vitamina E, superóxido dismutasa, glutatión peroxidasa) en el hígado fetal y del recién nacido aumentan también la susceptibilidad a los efectos perniciosos de la toxicidad del oxígeno y las lesiones oxidativas por peroxidación lipídica. Las enzimas microsómicas hepáticas también catalizan las reacciones de conjugación (que convierten los fármacos o los metabolitos en formas hidrosolubles que se pueden eliminar a través de la bilis). Los recién nacidos tienen una actividad baja de la UDP glucuronosiltransferasa, que convierte la bilirrubina no conjugada en un conjugado con glucurónido fácil de eliminar y es la enzima que limita la velocidad de la excreción de bilirrubina. La actividad transferasa madura con rapidez tras el nacimiento, con independencia de la edad gestacional, lo que indica que los factores que condicionan el desarrollo posnatal de la actividad de esta enzima dependen más del parto que de la edad. La actividad de los microsomas se puede estimular administrando fenobarbital, rifampicina u otros inductores del citocromo P450. También existen fármacos, como la cimetidina, que pueden inhibir la actividad P450 microsómica. Función excretora hepática La función excretora hepática y el flujo de bilis se relacionan de forma estrecha con la excreción y recirculación enterohepática de los ácidos biliares. Éstos son el principal producto de la degradación del colesterol y se incorporan a micelas mixtas junto con colesterol y fosfolípidos. Estas micelas actúan como un vehículo eficaz para la solubilización y absorción intestinal de los compuestos lipófilos, como las grasas de la dieta o las vitaminas liposolubles. La secreción de ácidos biliares por los hepatocitos es el principal determinante del flujo de bilis en el animal adulto. Por tanto, la madurez de los procesos metabólicos de los ácidos biliares afecta a toda la función excretora hepática, incluida la excreción biliar de los compuestos exógenos y endógenos. El hígado humano sintetiza dos ácidos biliares fundamentales, los ácidos cólico y quenodesoxicólico. Antes de su excreción se conjugan con la glicina y la taurina. En respuesta a una comida, la contracción de la vesícula biliar hace llegar los ácidos biliares al intestino para ayudar en la digestión y absorción de las grasas. Tras participar en la digestión de las grasas, los propios ácidos biliares se reabsorben en el íleon terminal mediante procesos de transporte activo específico, para después regresar al hígado a través de la sangre de la vena porta. En el hígado son captados por los hepatocitos y excretados de nuevo en la bilis. Esta circulación enterohepática afecta en el adulto al 9095% de la reserva de ácidos biliares circulantes. Los que no se reabsorben a nivel del íleon llegan al colon, donde la flora bacteriana produce mediante procesos de deshidroxilación y desconjugación los ácidos biliares secundarios (desoxicolato y litocolato). En el adulto, la composición de la bilis refleja la excreción de los ácidos biliares primarios y secundarios, que se reabsorben en la parte distal del intestino. Las concentraciones intraluminales de ácidos biliares son bajas en los recién nacidos y aumentan con rapidez después de nacer. La expansión de la reserva de ácidos biliares es esencial porque son necesarios para estimular el flujo biliar y absorber lípidos, que son un componente principal de la dieta neonatal. Los receptores nucleares, como el receptor farnesoide X (FXR), controlan la homeostasis intrahepática de ácidos biliares mediante varios mecanismos, como la regulación de la expresión de los genes que codifican 2 proteínas clave, la colesterol 7a-hidroxilasa (CYP7A1) y la bomba exportadora de sales biliares (BSEP). Estas proteínas son Tabla 346-2 CAUSAS DE LOS TRASTORNOS DEL METABOLISMO DE LOS ÁCIDOS BILIARES Y DE LA CIRCULACIÓN ENTEROHEPÁTICA DEFECTOS DE LA SÍNTESIS/TRANSPORTE DE ÁCIDOS BILIARES Errores congénitos de la síntesis de ácidos biliares: deficiencia de reductasa, deficiencia de isomerasa Colestasis intrahepática familiar progresiva (CIFP1, 2, 3) Colestasis intrahepática (hepatitis neonatal) Defectos adquiridos de la síntesis de ácidos biliares secundarios a una hepatopatía grave TRASTORNOS DE LA LLEGADA DE LOS ÁCIDOS BILIARES AL INTESTINO Enfermedad celíaca (contracción perezosa de la vesícula biliar) Obstrucción de los conductos biliares extrahepáticos (p. ej., atresia biliar, colelitiasis) PÉRDIDA DE LA CIRCULACIÓN ENTEROHEPÁTICA DE LOS ÁCIDOS BILIARES Fístulas biliares externas Fibrosis quística Síndrome de sobrecrecimiento bacteriano del intestino delgado (con precipitación de ácidos biliares, aumento de la absorción yeyunal y «cortocircuitos») Captación inducida por fármacos de los ácidos biliares en la luz intestinal (p. ej., colestiramina) MALABSORCIÓN DE LOS ÁCIDOS BILIARES Malabsorción primaria de los ácidos biliares (ausencia o ineficacia del transporte activo a nivel ileal) Malabsorción secundaria de ácidos biliares Enfermedad o resección ileal Fibrosis quística CAPTACIÓN DEFECTUOSA O ALTERACIONES DEL METABOLISMO INTRACELULAR Enfermedad parenquimatosa (hepatitis aguda, cirrosis) Regurgitación de las células Derivación portosistémica Colestasis esenciales para la síntesis y secreción de sales biliares, respectivamente. La expresión neonatal de estos receptores nucleares varía dependiendo del modelo animal estudiado y en el ser humano se desconoce en su mayor parte. Debido a la reabsorción ileal ineficaz de ácidos biliares y a una baja velocidad de aclaramiento hepático de los ácidos biliares de la sangre portal, existe un incremento de su concentración sérica en recién nacidos sanos, a menudo alcanzando valores que en un adulto serían indicativos de hepatopatía. En lactantes de bajo peso al nacer y en lactantes a término después de situaciones de estrés perinatal, como hipoxia o infección, pueden observarse fases transitorias de «colestasis fisiológica» y «esteatorrea fisiológica», aunque son infrecuentes en recién nacidos a término sanos. Muchos de los procesos relacionados con la inmadurez del recién nacido en la morfogénesis y función del hígado tal y como se ha descrito con anterioridad están implicados en la mayor susceptibilidad de los lactantes a la hepatopatía asociada con la nutrición parenteral. La menor reserva de sales biliares, la depleción de glutatión hepático y el defecto de sulfatación contribuyen a la producción de ácidos biliares litocólicos tóxicos y de colestasis, mientras que las deficiencias de aminoácidos esenciales, incluida la taurina y cisteína, pueden causar esteatosis hepática en estos lactantes. Pasado el período neonatal, los trastornos del metabolismo de los ácidos biliares pueden causar distintos efectos sobre la función hepatobiliar e intestinal (tabla 346-2). BIBLIOGRAFÍA Bates MD, Balistreri WF: The gastrointestinal tract: development of the human digestive system. In Fanaroff AA, Martin RJ, editors: Neonatal-perinatal medicine: diseases of the fetus and infant, ed 7, St Louis, 2002, Mosby, pp 1255-1263. Beath SV: Hepatic function and physiology in the newborn, Semin Neonatol 8:337-346, 2003. Desmet VJ: Congenital diseases of intrahepatic bile ducts: variations on the theme ‘‘ductal plate malformation, Hepatology 16:1069-1083, 1992. Capítulo 346 Morfogénesis del hígado y las vías biliares & e346-5 © ELSEVIER. Fotocopiar sin autorización es un delito. Hofmann A: Bile acids: trying to understand their chemistry and biology with the hope of helping patients, Hepatology 49:1403-1418, 2009. Lemaigre F, Zaret KS: Liver development update: new embryo models, cell lineage control, and morphogenesis, Curr Opin Genet Dev 14:582-590, 2004. Meier PJ, Stieger B: Molecular mechanisms of bile formation, News Physiol Sci 15:89-93, 2000. Roskams T, Desmet V: Embryology of extra- and intrahepatic bile ducts, the ductal plate, Anat Rec 291:628-635, 2008. Rudolph AM: Hepatic and ductus venosus blood flows during fetal life, Hepatology 3:254-258, 1983. Wuestefeld T, Zaret K: Liver development: from endoderm to hepatocyte. In Suchy FJ, Sokol RJ, Balistreri WF, editors: Liver disease in children, ed 3, New York, 2007, Cambridge University Press, pp 3-13. Zaret KS: Regulatory phases of early liver development: paradigms of organogenesis, Nat Rev Genet 3:499-512, 2002.