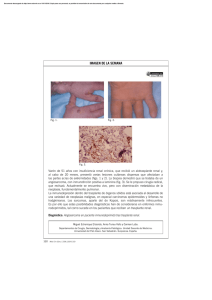
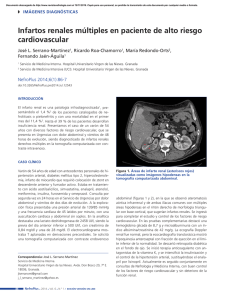
Descargar PDF completo
Anuncio

S O C I E DA D E S PA Ñ O L A D E N E F R O L O G Í A nefro N e f r o P l u s 2 016 - Vo l u m e n 8 - N ú m e r o 1 Pl s Es una colaboración S.E.N.-FRIAT ■ REVISIÓN MONOGRÁFICA • Trasplante renal de donantes en asistolia ■ REVISIÓN CORTA • Síndrome de encefalopatía posterior reversible y enfermedad renal crónica. A propósito de siete casos clínicos y revisión de la bibliografía ■ RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA ■ CASO CLÍNICO CERRADO • Síndrome tóxico en un paciente trasplantado renal: sin cartas para el descarte ■ CASOS CLÍNICOS • Síndrome hepatorrenal tras trasplante de células hematopoyéticas: una entidad poco frecuente • Infección por parvovirus B19 asociado a glomerulonefritis en un paciente inmunocompetente. Terapia exitosa con inmunoglobulinas y corticoides • Enfermedad linfoproliferativa postrasplante renal no asociada a virus de Epstein-Barr • Fallo renal causado por hipertensión maligna acelerada • ¿Son seguros los contrastes de gadolinio en pacientes con enfermedad renal crónica y hepatopatía asociada? • Trastornos electrolíticos graves asociados a tratamiento crónico con omeprazol ■ RECURSOS WEB DESTACADOS • Renal Fellow Network Edición para la Formación Médica Continuada en Nefrología e Hipertensión Arterial de la Revista Nefrología Ve r s i ó n o r i g i n a l í n t e g r a e n w w w. r e v i s t a n e f r o l o g i a . c o m INSTITUCIÓN SIN ÁNIMO DE LUCRO QUE TRABAJA PARA MEJORAR LA CALIDAD DE VIDA Y DE FUTURO DEL PACIENTE RENAL ASISTENCIA MÉDICA 14 CENTROS DE DIÁLISIS 20 MÉDICOS 166 ENFERMEROS Y AUXILIARES INVESTIGACIÓN NEFROLÓGICA 20 UNIDADES ASOCIADAS (I.R.S.I.N.) PREMIOS DE INVESTIGACIÓN APOYO PERSONAL PSICÓLOGOS TRABAJADORES SOCIALES INTEGRACIÓN LABORAL Centros de Diálisis de la Fundación Renal OFICINAS CENTRALES c/José Abascal 42,1ºIzq 28003 Madrid Tel. 914 487 100 www.friat.es CENTRO ESPECIAL DE EMPLEO (LAVANDERÍA) c/ Amistad 14. Local 28025 Madrid Tel. 913 693 328 COMUNIDAD DE CASTILLA Y LEON COMUNIDAD DE GALICIA COMUNIDAD DE MADRID LOS OLMOS c/ Dr. Velasco 27 40003 Segovia Tel. 921 460 012 OS CARBALLOS Avda de Ramón Nieto 126 Bajo Interior 36205 Vigo (Pontevedra) Tel. 986 265 712 FUNDACIÓN JIMENEZ DíAZ Avda. Reyes Católicos 2 Unidad de Diálisis. 3ª Pta. 28040 Madrid Tel. 915 449 086 EL CASTAÑAR c/ Arco del Monte 3 37700 Béjar (Salamanca) Tel. 923 408 064 SANTA MARíA c/ Ramón Puga 56 32005 Orense Tel. 988 240 808 SANTA ENGRACIA c/ Fuencarral 74, Esc 2. Bajo 28004 Madrid Tel. 915 329 732 LAS ENCINAS c/ Escuelas 4-6 37500 Ciudad Rodrigo (Salamanca) Tel. 923 498 046 BARCO DE VALDEORRAS c/ Conde de Fenosa 50 32300 Barco de Valdeorras (Orense) Tel. 988 339 065 LOS LLANOS c/ Río Segura 5 28935 Móstoles (Madrid) Tel. 916 474 477 LOS PINOS c/ Angustias 37 47400 Medina del Campo (Valladolid) Tel. 983 811 750 OS SALGUEIROS Carretera de Laza s/n 32600 Verín (Orense) Tel. 988 599 047 HOSPITAL DE VILLALBA Ctra. Alpedrete a Moralzarzal, Km 41, 28400 Collado Villalba HOSPITAL (Madrid) INFANTA ELENA Tel. 910 90 81 02 Avd. Reyes Católicos, 21 Dpto. 27 . 28340 Valdemoro (Madrid) Tel: 918 762 571 www.friat.es www.facebook.com/friat.es HOSPITAL REY JUAN CARLOS c/Gladiolo s/n. 28933 Móstoles (Madrid) Tel : 916 171 617 LOS LAUROS c/ Joaquín Turina 2 Bis 28222 Majadahonda (Madrid) Tel. 916 028 888 LOS LAUROS c/ Joaquín Turina 2 Bis 28222 Majadahonda (Madrid) Tel. 916 028 888 NEFRODIET Aplicación para ayudar a los enfermos renales a alimentarse mejor Disponible en: www.friat.es www.facebook.com/friat.es ◗◗ SUMARIO REVISIÓN MONOGRÁFICA 1 • Trasplante renal de donantes en asistolia Isabel Pérez Flores, Ana I. Sánchez Fructuoso REVISIÓN CORTA •Síndrome de encefalopatía posterior reversible y enfermedad renal crónica. A propósito de siete casos clínicos y revisión de la bibliografía Lourdes Carolina Vázquez Jiménez, Maria Isabel Troya Saborido, Ioana Elena Bancu, Josep Bonet Sol 7 RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA •Efectos de la empagliflozina sobre los episodios cardiovasculares y la mortalidad en adultos con diabetes mellitus tipo 2 Zinman B, Wanner C, Lachin JM, Fitchett D, Bluhmki E, Hantel S, et al; EMPA-REG Outcome investigators. Empagliflozin, cardio-vascular outcomes and mortality in Type 2 Diabetes. N Engl J Med 2015;373:2117-28. Análisis crítico: Alberto Martínez-Castelao, José Luis Górriz Teruel, Eva Solá Izquierdo 15 •Efecto de la finerenona sobre la albuminuria en pacientes con nefropatía diabética. ¿Grandes esperanzas en tiempos difíciles? Bakris GL, Agarwal R, Chan JC, Cooper ME, Gansevoort RT, Haller H, et al; for the Mineralocorticoid Receptor Antagonist Tolerability Study-Diabetic Nephropathy (ARTS-DN) Study Group. Effect of finerenone on albuminuria in patients with diabetic nephropathy: a randomized clinical trial. JAMA 2015;314:884-94. Análisis crítico: Beatriz Fernández-Fernández, Alberto Ortiz Arduán 20 •ESTUDIO CAPTAIN. Efectos de suspender o continuar tratamiento con bloqueantes del sistema renina-angiotensina en pacientes con insuficiencia renal crónica que van a ser sometidos a cateterismo cardíaco: resultados del uso de IECA/ARA2 y nefropatía inducida por contraste en pacientes sometidos a cateterismo cardíaco Bainey KR, Rahim S, Etherington K, Rokoss ML, Natarajan MK, Velianou JL, et al. Effects of withdrawing vs continuing renin-angiotensin blockers on incidence of acute kidney injury in patients with renal insufficiency undergoing cardiac catheterization: Results from the Angiotensin Converting Enzyme Inhibitor/Angiotensin Receptor Blocker and Contrast Induced Nephropathy in Patients Receiving Cardiac Catheterization (CAPTAIN) trial. Am Heart J 2015;170:110-6. Análisis crítico: Esther Rubio González, José María Portolés Pérez 26 •La terapia multidiana en el tratamiento de inducción de la nefritis lúpica, ¿incrementa la probabilidad de alcanzar una remisión? Liu Z, Zhang H, Liu Z, Xing C, Fu P, Ni Z, et al. Multitarget therapy for induction treatment of lupus nephritis. A randomized trial. Ann Intern Med 2015;162:18-26. Análisis crítico: Mª Adoración Martín-Gómez, Miguel Ángel Frutos Sanz 29 •Efecto del tratamiento con cinacalcet en los niveles de factor de crecimiento fibroblástico-23 en pacientes en hemodiálisis. ¿Modifica los niveles? ¿Influye en la tasa de morbimortalidad cardiovascular de este grupo de pacientes? Moe SM, Chertow GM, Parfrey PS, Kubo Y, Block GA, Correa-Rotter R, et al. Cinacalcet, Fibroblast Growth Factor-23, and Cardiovascular Disease in Hemodialysis. The Evaluation of Cinacalcet HCl Therapy to Lower Cardiovascular Events (EVOLVE) Trial. Circulation 2015;132:27-39. Análisis crítico: Raquel Ojeda 33 •¿Cuál es el efecto del citrato férrico sobre el control de la hiperfosforemia y los parámetros ferrocinéticos en los pacientes en diálisis? Lewis JB, Sika M, Koury MJ, Chuang P, Schulman G, Smith MT, et al. Ferric citrate controls phosphorus and delivers iron in patients on dialysis. J Am Soc Nephrol 2015;26:493-503. Análisis crítico: David Arroyo, Joan Valls 37 •¿La colocación del catéter peritoneal por el nefrólogo influye en la tasa de utilización de la diálisis peritoneal? Perl J, Pierratos A, Kandasamy G, McCormick BB, Quinn RR, Jain AK, et al. Peritoneal dialysis catheter implantation by nephrologists is associated with higher rates of peritoneal dialysis utilization: a population-based study. Nephrol Dial Transplant 2015;30:301-9. Análisis crítico: Emilio Sánchez Álvarez 41 •¿Mejora la icodextrina la resistencia a la insulina en los pacientes no diabéticos en diálisis peritoneal automática? De Moraes TP, Andreoli MC, Canziani ME, da Silva DR, Caramori JC, Ponce D, et al. Icodextrin reduces insulin resistence in non-diabetic patients undergoing automated peritoneal dialysis: results of a randomized controlled trial (STARCH). Nephrol Dial Transplant 2015;30:1905-11. Análisis crítico: Ana Rodríguez-Carmona, Miguel Pérez Fontán 44 •La propensión a calcificación sérica es un determinante fuerte e independiente de mortalidad cardíaca y por todas las causas en pacientes trasplantados renales Dahle DO, Åsberg A, Hartmann A, Holdaas H, Bachtler M, Jenssen TG, et al. Serum calcification propensity is a strong an Independent determinant of cardiac and all-cause mortality in kidney transplant recipients. Am J Transplant 2016;16:204-12. Análisis crítico: Minerva Rodríguez García, Pablo Román García 47 •¿Es seguro interrumpir la inmunosupresión durante el tratamiento con quimioterapia en los pacientes trasplantados renales con un síndrome linfoproliferativo postrasplante? Taylor E, Jones M, Hourigan MJ, Johnson DW, Gill DS, Isbel N, et al. Cessation of immunosuppression during chemotherapy for post-transplant lymphoproliferative disorders in renal transplant patients. Nephrol Dial Transplant 2015;30:1774-9. Análisis crítico: Frederic Cofan 51 55 •¿Cuál es la mejor presión sistólica en el paciente no diabético de alto riesgo cardiovascular? The SPRINT Research Group. A randomized trial of intensive versus standard blood-pressure control. N Engl J Med 2015;373:2103-16. Análisis crítico: J. Bonet Sol, M. Troya Saborido 59 •¿El preacondicionamiento isquémico disminuye el fracaso renal en pacientes sometidos a cirugía cardíaca? Zarbock A, Schmidt C, Van Aken H, Wempe C, Martens S, Zahn PK, et al. Effect of remote ischemic preconditioning on kidney injury among high-risk patients undergoing cardiac surgery: a randomized clinical trial. JAMA 2015;313:2133-41. Análisis crítico: Raúl García-Castro, Roberto Alcázar-Arroyo CASO CLÍNICO CERRADO 63 •Síndrome tóxico en un paciente trasplantado renal: sin cartas para el descarte María Quero Ramos, Laura Martínez Valenzuela, Ángela Casas Parra, Anna Manonelles Montero, August Vidal Bel, Oriol Bestard Matamoros, Edoardo Melilli, Xavier Fulladosa Oliveras, Josep Maria Cruzado Garrit CASOS CLÍNICOS 68 •Síndrome hepatorrenal tras trasplante de células hematopoyéticas: una entidad poco frecuente Pilar Fraile Gómez, Lourdes Vázquez, Alexandra Lizarazo, Óscar Segurado Tostón, Félix López Cadenas, Luis García Martín, Pedro García-Cosmes •Infección por parvovirus B19 asociado a glomerulonefritis en un paciente inmunocompetente. Terapia exitosa con inmunoglobulinas y corticoides Florentina Rosique López, Inmaculada López Jiménez, Rocío Alcaraz Martínez, Encarnación Mateo Bosch, Raquel Rodado Martínez, Marisol Alegría Fernández, Rosa Muñoz Muñoz, Adoración Martínez Losa, Eduardo López Guillén, Luisa Jimeno García 74 78 •Enfermedad linfoproliferativa postrasplante renal no asociada a virus de Epstein-Barr Ángela Casas Parra, Catherine Zulberti, Harvey Andrés Florez, Melani Pestaña, Oriol Puig, Fina Climent, Montse Cortés, Manuel Rubio Rivas, Josep Maria Cruzado, Edoardo Melilli 82 •Fallo renal causado por hipertensión maligna acelerada Gonzalo Martínez-Fernández, Agustín Ortega-Cerrato, Eva Oliver-Galera, Teresa Nam-Cha, Lourdes de la Vara-Iniesta, Carmen Gómez-Roldán, Juan Pérez-Martínez •¿Son seguros los contrastes de gadolinio en pacientes con enfermedad renal crónica y hepatopatía asociada? Miguel Seras, Elena Arnal, María del Carmen González-Vela, Manuel Arias 85 89 •Trastornos electrolíticos graves asociados a tratamiento crónico con omeprazol Amir Shabaka, Fernando Tornero, Samuel del Castillo-García, Raúl Rodríguez, Sara Romero-Pérez, Beatriz Gil-Casares, Raquel de Gracia-Núñez, José A. Herrero RECURSOS WEB DESTACADOS 94 •Renal Fellow Network http://renalfellow.blogspot.com.es/ Rafael Santamaría ◗◗ REVISIÓN MONOGRÁFICA Trasplante renal de donantes en asistolia Isabel Pérez Flores, Ana I. Sánchez Fructuoso Servicio de Nefrología, Hospital Clínico San Carlos, Madrid NefroPlus 2016;8(1):1-6 RESUMEN La donación en asistolia (DA) es una adicional fuente de órganos para trasplante que puede contribuir a acortar el tiempo y el número de pacientes en lista de espera. La existencia de una mayor proporción de disfunción primaria del injerto (DPI) y función renal retardada (FRR) en comparación con los riñones procedentes de donantes en muerte encefálica (DME), ha hecho que algunos grupos hayan sido más reticentes a implementar el procedimiento. Sin embargo, su difusión se ha ido ampliando al observar que la presencia de FRR no influye en la supervivencia del injerto a largo plazo, existiendo incluso mejores resultados, en la mayoría de las series, con los riñones de DA que con los obtenidos de DME con criterios expandidos. Otro hecho que ha disipado las dudas sobre el uso de este tipo de donantes ha sido el hallazgo de que el trasplante renal de DA reduce la mortalidad de los receptores, frente a permanecer en diálisis en lista de espera de un riñón procedente de DME. La vigilancia estrecha del procedimiento con el fin de evitar lesiones irreversibles derivadas del proceso de isquemia caliente, inherente a este tipo de donación, y una adecuada selección de donante y receptor pueden ayudar a garantizar unos buenos resultados. El esfuerzo por mejorar dichos resultados y la calidad de los riñones procedentes de DA se basan en la capacidad de identificar factores de riesgo y la creación de guías de consenso de adecuada práctica clínica. Palabras clave: Donation after cardiac death. Donation after circulatory death. Kidney transplantation. Non-heart beating donation. INCIDENCIA RESULTADOS La donación en asistolia (DA) se ha incrementado de forma exponencial en los últimos años, particularmente en Europa, con España a la cabeza en el caso de la DA tipo II de Maastricht o donantes no controlados (DANC). En Holanda y Reino Unido, los riñones de DA suponen casi la mitad de los trasplantes realizados (NHSBT, 2014), siendo la mayoría DA tipo III o controlados (DAC), según la clasificación de Maastricht (tabla 1); en España, la DA supone el 10 % de los trasplantes realizados en los últimos años, siendo esta cifra aún mayor en determinadas regiones (40 % en la Comunidad de Madrid) (www. ont.es/infesp/Memorias/Memoria en asistolia.pdf). Esto se debe a la obtención de buenos resultados y gracias al apoyo y promoción por parte de distintas sociedades científicas y organizaciones nacionales e internacionales como la Organización Nacional de Trasplantes y la Organización Mundial de la Salud. Como se ha descrito en distintas series de la literatura médica, los trasplantes de DA presentan una mayor incidencia de función renal retardada (FRR) y disfunción primaria del injerto (DPI) que aquellos procedentes de donantes en muerte encefálica (DME). En el caso de DA, la incidencia de FRR oscila entre el 20-80 %, mientras que para los DME esta no suele ser superior al 30 %. Sin embargo, no existen diferencias estadísticamente significativas en la supervivencia del injerto a corto y largo plazo entre ambos grupos. La FRR en los trasplantes de DME se ha relacionado con una mayor incidencia de rechazo y peores resultados a largo plazo en cuanto a función renal y supervivencia del injerto y del paciente, pero estos resultados no se confirman en el caso de la DA. Los trasplantes de DA que presentan una FRR tienen una supervivencia similar, tanto a corto como a largo plazo, a aquellos con función renal inmediata1-9. Correspondencia: Ana I. Sánchez Fructuoso Servicio de Nefrología, Hospital Clínico San Carlos. Avda. Profesor Martín Lagos s/n. 28040, Madrid. sanchezfructuoso@gmail.com A pesar de una probabilidad dos veces mayor de pérdida del injerto en los tres primeros meses postrasplante en el caso de riñones de DA, Snoeijs et al demostraron que un trasplante renal de DA con criterios estándar aporta ventajas en cuanto a supervivencia con respecto a permanecer en diálisis en espera de un riñón de DME. La mortalidad se reduce en un 56 % después del trasplante renal de DA, lo que supone un incremento de la supervivencia de 2,4 meses en los primeros 4 años. Por extrapolación de las curvas de supervivencia, la expectativa de NefroPlus 2016 Vol. 8 N.° 1 1 n n n ◗◗ REVISIÓN MONOGRÁFICA Tabla 1. Clasificación de Maastricht. Modificación de Madrid 2011 Donación no controlada Donación controlada Tipo I Fallecido a la llegada Incluye víctimas de una muerte súbita que acontece fuera del hospital, sin maniobras de RCP Tipo II Reanimación infructuosa Incluye aquellos que sufren una PCR y reciben RCP no exitosa IIa. Extrahospitalaria IIb. Intrahospitalaria Tipo III A la espera del paro cardíaco Incluye pacientes a los que se les aplica LTSV Tipo IV Paro cardíaco en muerte encefálica Incluye pacientes que sufren una PCR no esperada durante el procedimiento de donación en muerte encefálica LTSV: limitación del tratamiento de soporte vital; PCR: parada cardiorrespiratoria; RCP: reanimación cardiopulmonar. vida de los pacientes que reciben un riñón de DA se incrementa aún más a largo plazo10. La viabilidad de los riñones procedentes de DANC, que indefectiblemente están expuestos a un tiempo de isquemia caliente (TIC) más prolongado, depende de un manejo mucho más cuidadoso de donante y receptor. No obstante, los resultados son muy similares a los de DAC, con una mayor incidencia de FRR en el caso de la DANC como único rasgo diferencial en algunas series, como la publicada por nuestro grupo1,8. En 2011, autores de la Universidad de Maastricht hicieron un estudio comparativo entre los trasplantes renales de DAC y los procedentes de DANC, demostrando que no existían diferencias significativas en los resultados a largo plazo. Hoogland et al objetivaron que el filtrado glomerular estimado a un año y su declinar posterior anual era similar en ambos grupos, no existiendo tampoco diferencias en la incidencia de FRR y DPI y en la supervivencia de injerto y paciente a 10 años11. Sin embargo, aunque una selección más estricta del órgano puede reducir el porcentaje de DPI y/o riñones con función renal subóptima, ello también puede conllevar mayor riesgo de que se descarten riñones viables y dificultar así el acceso al trasplante de pacientes en lista de espera y, por tanto, no conseguir reducir la mortalidad que ello conlleva. FACTORES PREDICTORES DE SUPERVIVENCIA En un intento de mejorar los resultados a corto y largo plazo, uno de los principales objetivos de los distintos equipos que se dedican a este tipo de trasplantes es la búsqueda y detección de posibles factores de riesgo. Sin embargo, aunque se han publicado numerosos artículos en la literatura médica, el nivel de evidencia no es muy elevado, porque la mayoría de los estudios son retrospectivos, de forma que solo podremos realizar recomendaciones. En líneas generales, los principales factores de riesgo que influyen en alguna medida en los resultados del trasplante renal de DA están relacionados con las características del donante, el proceso de la donación y los antecedentes y manejo del receptor (tabla 2). 2 NefroPlus 2016 Vol. 8 N.° 1 n n n Edad del donante En una de las series más amplias publicadas, los DA mayores de 60 años tienen un riesgo superior al doble de fallo del injerto en comparación con los donantes de 40 años o más jóvenes12. Esto podría deberse a una menor reserva funcional junto a un mayor grado de isquemia por la suma de factores arterioescleróticos a los relacionados con el proceso de isquemia caliente. Sin embargo, un estudio comparativo reciente demuestra que la supervivencia de los riñones de DA mayores de 60 años es equivalente a la de los de DME para el mismo grupo de edad13. También los donantes pediátricos o menores de 10 años parecen tener un riesgo incrementado de DPI, debido a un mayor porcentaje de trombosis por el menor calibre de los vasos, que puede verse Tabla 2. Factores pronósticos de los trasplantes renales de donantes en asistolia Derivados del donante –– Edad –– Índice de masa corporal –– Antecedentes personales (hipertensión arterial, diabetes mellitus, causa del fallecimiento) Derivados del proceso de donación –– Tiempo de isquemia fría –– Tiempo de isquemia caliente –– Técnica de perfusión (cirugía rápida, perfusión regional mediante ECMO) –– Método de preservación ex vivo (MPP, PEF) Derivados del receptor –– Edad –– Retrasplantes –– Manejo de hemodinámica y diagnóstico –– Terapia inmunosupresora ECMO: oxigenación por membrana extracorpórea; MPP: máquina de perfusión pulsátil; PEF: preservación estática en frío. ◗◗ REVISIÓN MONOGRÁFICA aún más comprometido por el edema provocado por la isquemia reperfusión14. En la línea de estos resultados, nuestro grupo utiliza DA con un rango de edad comprendido entre 16 y 60 años. Obesidad del donante Otro parámetro del donante que puede influir es el índice de masa corporal (IMC). El riesgo de FRR y/o DPI puede incrementarse hasta casi el doble a partir de IMC > 45 kg/m2 15, mientras que para IMC superiores a 30 kg/m2, los datos no son tan concluyentes y varían según las series16,17. Comorbilidad del donante También existe disparidad de resultados con respecto a la existencia de diabetes, hipertensión y causa cardiovascular del fallecimiento del donante, pero parece probable que estos parámetros puedan influir en alguna medida, al igual que ocurre con los DME15,16. Con respecto al procedimiento de la donación, también se han estudiado varios factores que pueden influir en los resultados, como son los tiempos de isquemia, las técnicas de obtención del órgano y los métodos de preservación ex vivo. Tiempo de isquemia fría La existencia de un tiempo de isquemia fría (TIF) prolongado se ha relacionado con peor función renal y menor supervivencia del injerto en casos de DA. Con TIF > 12 horas se han objetivado reducciones en el filtrado glomerular estimado (FGE) al tercer mes postrasplante, que llegan a ser hasta de casi –5 ml/min para TIF > 24 horas. Un TIF inferior a 12 horas tiene una fuerte correlación positiva con una mejor supervivencia del injerto12. Estos hallazgos no son tan evidentes en los trasplantes renales de DME, por lo que parece que existe una mayor susceptibilidad a la isquemia fría en el caso de riñones procedentes de DA13. Por ello, conseguir acortar los TIF podría ser uno de los pocos factores modificables a la hora de realizar un trasplante renal de DA. Deberíamos acortar los tiempos de prueba cruzada y traslado de órganos, valorando incluso la posibilidad de trasplantar sin tipaje HLA para los receptores de un primer trasplante. Tiempo de isquemia caliente Con respecto a los TIC, los resultados son más controvertidos. La mayoría de las series no muestran diferencias estadísticamente significativas en la supervivencia de los injertos procedentes de DA según los TIC. Sin embargo, algunos autores afirman que en la DAC, TIC superiores a 30-40 minutos sí pueden influir negativamente en la supervivencia del injerto a corto y largo plazo, máxime si se asocia a otros factores de riesgo18. En el caso de la DANC en nuestro país, TIC hasta 120-150 minutos se consideran válidos, sin repercusión en los resultados8. Técnica de perfusión La técnica de perfusión del órgano más usada en la DANC, previa a la extracción, es la perfusión regional extracorpórea en normotermia o hipotermia, con obtención de buenos resultados en ambos casos19,20. Para ello, se canulan la arteria y la vena femorales y se conecta al sistema de circulación extracorpórea, que lleva un oxigenador de membrana y un intercambiador de temperatura (ECMO). A través de la arteria femoral contralateral se coloca un balón de Fogarty para la interrupción de flujo por encima del nivel de la arteria mesentérica superior. En el caso de la DAC se pueden utilizar tres técnicas: cirugía rápida con canulación directa de la aorta, perfusión in situ o perfusión regional extracorpórea mediante ECMO. Hasta ahora, la mayoría de los equipos de trasplante que realizan DAC se decantaban por la cirugía rápida, con menores costes e infraestructura. Sin embargo, estudios recientes parecen demostrar que, con el uso de la ECMO en la DAC, se puede incrementar el porcentaje de órganos válidos para trasplante por cada donante21. Incluso se plantea la posibilidad de que un período de perfusión de los órganos abdominales, previo a la extracción, podría revertir en parte los efectos perjudiciales de la isquemia caliente y favorecer su recuperación funcional tras el trasplante, aunque aún no existen estudios concluyentes en este sentido. Para intentar mejorar la perfusión de los órganos, existe consenso sobre la necesidad de administrar heparina sódica durante el procedimiento de DA. Sin embargo, se está evaluando si existen beneficios añadidos con la adición de estreptocinasa, sobre la base de estudios experimentales en animales que demostraron mejoría de la perfusión de la microcirculación renal22. Aunque un estudio aleatorizado en humanos demostró hace unos años que tratar con estreptocinasa mejora los parámetros de perfusión renales de la máquina de perfusión pulsátil23, estudios recientes sobre los perfiles de coagulación que presentan los DANC demuestran la existencia de un estado de hiperfibrinólisis, lo que no apoyaría el uso de fibrinolíticos24. Método de preservación ex vivo Otro tema muy debatido es el método de preservación de los riñones procedentes de DA durante el período de isquemia fría. Estudios comparativos en la bibliografía, que incluyen ensayos controlados aleatorizados, analizan el uso de la máquina de perfusión pulsátil (MPP) hipotérmica frente al almacenamiento estático en frío, con resultados contradictorios25,26. Mientras que en uno se identifica una reducción en la incidencia y duración de la FRR, en el otro no se demuestran beneficios de la MPP sobre la FRR. En una serie americana muy amplia de DA, se objetiva una mejoría en la supervivencia del injerto a 3 meses (no así a largo plazo) solo en el caso de uso de MPP en donantes mayores de 50 años27. Recientemente, un metaanálisis concluye que la MPP puede reducir la incidencia de FRR, pero no mejora la incidencia de DPI y rechazo agudo, ni la función renal a largo plazo; la supervivencia de paciente e injerto es similar entre los dos métodos de preservación28. Con respecto a la información que la MPP puede aportar sobre la hemodinámica renal y la concentración de biomarcadores en el líquido de perfusión, tampoco existen datos definitivos. Algunos estudios muestran que las resistencias vasculares intrarrenaNefroPlus 2016 Vol. 8 N.° 1 3 n n n ◗◗ REVISIÓN MONOGRÁFICA les son un factor de riesgo independiente de DPI, FRR y supervivencia al año. Sin embargo, el valor predictivo de las mismas es bajo, por lo que no se pueden utilizar como parámetro único para desechar un riñón de un DA29,30. Algo similar ocurre con los biomarcadores del líquido de perfusión, de forma que la capacidad de estos para predecir la viabilidad de los riñones de DA es muy pobre y la presencia de concentraciones elevadas de distintos biomarcadores no debe llevar a desechar riñones31. Edad del receptor El impacto que las características de los receptores como la edad tiene en la función renal y la supervivencia del injerto tampoco está muy claro. Únicamente existen evidencias de que el trasplante renal de DA en niños se ha asociado a un riesgo superior al doble de DPI y a una alta incidencia de FRR32. con un pequeño número de pacientes, y prácticamente no existen ensayos clínicos aleatorizados34-36. En la actualidad se puede afirmar que todos los centros que realizan trasplantes de DCP utilizan terapia de inducción para intentar minimizar los efectos perjudiciales de los ICN. Si el paciente es de bajo riesgo inmunológico, la decisión de utilizar basiliximab o timoglobulina/ATG es controvertida. No hay ningún estudio en la literatura médica que demuestre mayor eficacia de uno sobre otro, pero en nuestra experiencia37 existen datos a favor del uso de timoglobulina frente a basiliximab. Actualmente está en marcha un ensayo aleatorizado para comparar ambos tratamientos en receptores renales de DA. El uso de timoglobulina tiene la ventaja añadida de poder retirar precozmente los esteroides (al quinto día postoperatorio), sin un riesgo mayor de rechazo agudo ni de pérdida del injerto38, y además parece tener un efecto protector frente a la lesión por isquemia-reperfusión39. Retrasplantes También existe mucha controversia sobre la influencia de recibir un segundo o tercer trasplante renal de un DA en la supervivencia del injerto. Algunos autores afirman que dicha supervivencia es menor que en el caso de retrasplantes de DME, pero la explicación no está muy clara y ellos mismos argumentan que estas diferencias pueden deberse más bien a una menor compatibilidad HLA12. La utilización de imTOR u otros inmunosupresores no nefrotóxicos, como belatacept en lugar de ICN, puede ser una alternativa muy interesante que se debe tener en cuenta, tanto de inicio como a los 2-3 meses postrasplante. Son necesarios estudios comparativos entre tacrolimus e imTOR de novo, ambos con introducción retardada e inducción con timoglobulina, para poder afirmar cuál de ellos es el tratamiento más idóneo para estos pacientes. Manejo del receptor CONCLUSIÓN Lo que sí parece influir claramente en los resultados es el manejo del receptor en el postrasplante inmediato. Controlar la situación hemodinámica del receptor manteniéndole bien hidratado y evitando diálisis con balance negativo en los primeros días puede ser beneficioso. En un estudio retrospectivo se observó que los receptores de DA con presión venosa central baja e hipotensos en período perioperatorio tenían un riesgo incrementado de DPI33. También es importante la monitorización periódica del injerto mediante pruebas de imagen y la realización de biopsias repetidas hasta que recupere la función, para poder descartar la presencia de rechazo agudo, que de otra forma podría pasar desapercibido al no estar funcionante. Otro punto fundamental es evitar el uso de fármacos nefrotóxicos, como antiinflamatorios no esteroideos e inhibidores de la calcineurina (ICN), que pueden favorecer o contribuir a la isquemia de un injerto especialmente susceptible. El trasplante renal de DA es una buena alternativa para intentar reducir las listas de espera y mejorar la supervivencia de los pacientes renales. La identificación de los principales factores de riesgo que tienen mayor impacto en los resultados debe ser nuestro principal objetivo. Son necesarias guías de consenso sobre actuación y manejo de este tipo de trasplantes para poder optimizar los resultados. CRITERIOS CON LOS QUE SE HA REALIZADO LA REVISIÓN Se ha realizado una búsqueda bibliográfica en PubMed utilizando como criterios de búsqueda las palabras clave mencionadas. La búsqueda se limitó a los idiomas castellano e inglés y se realizó en artículos originales y de revisión, publicados a partir del año 2000, seleccionando aquellos con series más largas y que contaban con mayor rigor científico. Conflictos de interés Por tanto, parece evidente que en este tipo de trasplantes hay que intentar minimizar o retrasar la introducción de los ICN. En este sentido, se han publicado algunos estudios, aunque 4 NefroPlus 2016 Vol. 8 N.° 1 n n n Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo. ◗◗ REVISIÓN MONOGRÁFICA Conceptos clave 1. El trasplante renal de DA se asocia con un mayor riesgo de DPI y FRR. Sin embargo, la presencia de FRR no tiene implicaciones pronósticas, con resultados a largo plazo similares a los procedentes de DME. 2. La DAC y la DANC tienen resultados equivalentes en cuanto a supervivencia a largo plazo de paciente e injerto, aunque los trasplantes renales de DANC tienen una incidencia algo más elevada de FRR. 3. Recibir un trasplante renal de DA supone un incremento en la supervivencia frente a permanecer en lista de espera de un DME. 4. Los riñones de DA tienen una especial susceptibilidad a la isquemia fría prolongada, por lo que se debe intentar acortar los tiempos de prueba cruzada. 5. El mejor método de perfusión de los riñones procedentes de DANC es la perfusión regional mediante ECMO, siendo también una excelente alternativa para los DAC. 6. No se han demostrado diferencias significativas en los resultados de los trasplantes renales procedentes de DA entre la preservación renal mediante MPP y el almacenamiento estático en frío. 7. Mantener una situación hemodinámica estable y un adecuado manejo de fluidos en el postrasplante inmediato puede influir en los resultados. No utilizar riñones de DA como primera elección en caso de pacientes con hipotensión crónica. 8. Evitar el uso de fármacos nefrotóxicos y minimizar y/o retrasar los ICN puede ayudar a mejorar los resultados. REFERENCIAS BIBLIOGRÁFICAS 1. Sánchez-Fructuoso AI, Prats D, Torrente J, Pérez-Contín MJ, Fernández C, Álvarez J, et al. Renal transplantation from non-heart beating donors: a promising alternative to enlarge the donor pool. J Am Soc Nephrol 2000;11:350-8. **Primera serie amplia que describe los resultados del trasplante renal de DANC. 2. Weber M, Dindo D, Demartines N, Ambühl PM, Clavien PA. Kidney transplantation from donors without a heartbeat. N Engl J Med 2002;347:248-55. 3. Brook NR, White SA, Waller JR, Veitch PS, Nicholson ML. Nonheart-beating donor kidneys with delayed graft function have superior graft survival compared with conventional heart-beating donor kidneys that develop delayed graft function. Am J Transplant 2003;3:614-8. **Estudio comparativo que muestra que los trasplantes de DAC con FRR tienen mejor supervivencia que los de DME que desarrollan FRR. 4. Cooper JT, Chin LT, Krieger NR, Fernandez LA, Foley DP, Becker YT, et al. Donation after cardiac death: the university of Wisconsin experience with renal transplantation. Am J Transplant 2004;4:1490-4. 5. Kauffman HM, Rosendale JD, Taranto SE, McBride MA, Marks WH. Non-heart-beating donors (then) and donation after cardiac death (now). Transplantation Rev 2007;21:237-48. 6. Barlow AD, Metcalfe MS, Johari Y, Elwell R, Veitch PS, Nicholson ML. Case-matched comparison of long-term results of non-heart beating and heart-beating donor renal transplants. Br J Surg 2009;96:685-91. 7. Kootstra G, Van Heurn E. Nonheart-beating donation of kidneys for transplantation. Nat Clin Pract Nephrol 2007;3:154-64. 8. Sánchez-Fructuoso AI, Marques M, Prats D, Conesa J, Calvo N, Pérez-Contín MJ, et al. Victims of cardiac arrest occurring outside the hospital: a source of transplantable kidneys. Ann Intern Med 2006;145:157-64. ***Estudio que demuestra que la FRR no influye en los resultados de los trasplantes de DANC. Confirma que existen mejores resultados con la DANC que con los DME > 60 años. 9. Summers DM, Watson CJ, Pettigrew GJ, Johnson RJ, Collett D, Neuberger JM, et al. Kidney donation after circulatory death (DCD): state of the art. Kidney Int 2015;18:1-9. 10. Snoeijs MG, Schaubel DE, Hené R, Hoitsma AJ, Idu MM, Ijzermans JN, et al. Kidney from donors after cardiac death provide survival benefit. J Am Soc Nephrol 2010;21:1015-21. ***Estudio de supervivencia que analiza las ventajas de recibir un trasplante renal de DA frente a seguir en lista a la espera de un DME. 11. Hoogland ER, Snoeijs MG, Winkens B, Christaans MH, van Heurn LW. Kidney transplantation from donors after cardiac death: uncontrolled versus controlled donation. Am J Transplant 2011;11: 1427-34. **Estudio comparativo de grupo holandés de resultados de DAC frente a DANC. 12. Summers DM, Johnson RJ, Allen J, Fuggle SV, Collett D, Watson CJ, et al. Analysis of factors that affect outcome after transplantation of kidneys donated after cardiac death in the UK: a cohort study. Lancet 2010;376:1303-11. ***Demuestra que la edad del donante y el tiempo de isquemia fría son los principales parámetros que influyen en la supervivencia de los trasplantes renales de DA. NefroPlus 2016 Vol. 8 N.° 1 5 n n n ◗◗ REVISIÓN MONOGRÁFICA 13. Summers DM, Johnson RJ, Hudson A, Collett D, Watson CJ, Bradley JA. Effect of donor age and cold storage time on outcome in recipients of kidneys donated after circulatory death in the UK: a cohort study. Lancet 2013;381:727-34. ***Serie europea muy amplia que demuestra que los riñones de DA presentan una menor intolerancia a la isquemia fría que los de DME, con mayor impacto en su supervivencia. 14. De Vries EE, Hoogland PE, Wind J, Snoeijs MG, van Heurn EL. Transplantation of kidneys from paediatric DCD donors: a comparison with DBD donors. Nephrol Dial Transplant 2013;28:220-6. *Confirma mayor riesgo de DPI en los receptores infantiles que reciben un riñón de DA. 15. Ortiz J, Gregg A, Wen X, Karipineni F, Kayler LK. Impact of donor obesity and donation after cardiac death on outcomes after kidney transplantation. Clin Transplant 2012;26:E284-292. 16. Locke JE, Segev DL, Warren DS, Dominici F, Simpkins CE, Montgomery RA. Outcomes of kidneys from donors after cardiac death: implications for allocation and preservation. Am J Transplant 2007; 7:1797-807. **Serie americana que analiza los factores de riesgo de DPI y FRR. 17. Ledinh H, Weekers L, Bonvoisin C, Krzesinski JM, Monard J, de Roover A, et al. Results of kidney transplantation from controlled donors after cardio-circulatory death: a single center experience. Transplant Int 2012;25:201-9. 18. Andrews PA, Compton F, Koffman CG, Bewick M, Chang RW. Prediction of outcome in non-heart-beating kidney transplantation. Transplant Proc 2001;33:1121-4. 19. Valero R, Cabrer C, Oppenheimer F, Trias E, Sánchez-Ibáñez J, De Cabo FM, et al. Normothermic recirculation reduces primary graft dysfunction of kidneys obtained from non-heart-beating donors. Transpl Int 2000;13:303-10. 20. Sánchez-Fructuoso AI, de Miguel Marques M, Prats D, Barrientos A. Non-heart-beating donors: experience from the Hospital Clínico of Madrid. J Nephrol 2003;16:387-92. 21. Oniscu GC, Randle LV, Muiesan P, Butler AJ, Currie IS, Perera MT, et al. In situ normothermic regional perfusion for controlled donation after circulatory death. The United Kingdom experience. Am J Transplant 2014;14:2846-54. ***Grupo que demuestra que aplicar las técnicas de perfusión de los DANC a los DAC puede incrementar el porcentaje de órganos válidos para trasplante e incluso contrarrestar la lesión por isquemia-­ reperfusión. 22. Yamauchi J, Schramm R, Richter S, Vollmar B, Menger MD, Minor T. Improvement of microvascular graft equilibration and preservation in non-heart-beating donors by warm preflush with streptokinase. Transplantation 2003;75:449-53. 23. Gok MA, Shenton BK, Buckley PE, Peaston R, Cornell C, Soomro N, et al. How to improve the quality of kidneys from non-heart-beating donors: a randomised controlled trial of thrombolysis in non-heartbeating donors. Transplantation 2003;76:1714-9. 24. Vendrell M, Hessheimer AJ, Ruiz A, de Sousa E, Paredes D, Rodríguez C, et al. Coagulation profiles of unexpected DCDD donors do not indicate a role for exogenous fibrinolysis. Am J Transplant 2015;15:764-71. **Demuestran la existencia de un estado de hiperfibrinólisis en los DANC. 25. Jochmans I, Moers C, Smits JM, Leuvenink HG, Treckmann J, Paul A, et al. Machine perfusion versus cold storage for the preservation of kidneys donated after cardiac death: a multicenter, randomized, controlled trial. Ann Surg 2010;252:756-64. 6 NefroPlus 2016 Vol. 8 N.° 1 n n n 26. Watson CJ, Wells AC, Roberts RJ, Akoh JA, Friend PJ, Akyol M, et al. Cold machine perfusion versus static cold storage of kidneys donated after cardiac death: a UK multicenter randomized controlled trial. Am J Transplant 2010;10:1991-9. 27. Cantafio AW, Dick AA, Halldorson JB, Bakthavatsalam R, Reyes JD, Perkins JD. Risk stratification of kidneys from donation after cardiac death donors and the utility of machine perfusion. Clin Transplant 2011;25:E530-40. **Serie amplia que detecta que la MPP puede ser útil en los DA mayores. 28. O’Callaghan JM, Morgan RD, Knight SR, Morris PJ. Systematic review and meta-analysis of hypothermic machine perfusion versus static cold storage of kidney allografts on transplant outcomes. Br J Surg 2013;100:991-1001. ***Metaanálisis que describe la ausencia de diferencias en cuanto a DPI y supervivencia entre la MPP y la preservación estática en frío. 29. De Vries EE, Hoogland ER, Winkens B, Snoeijs MG, van Heurn LW. Renovascular resistance of machine-perfused DCD kidneys is associated with primary nonfunction. Am J Transplant 2011;11:2685-91. 30. Jochmans I, Moers C, Smits JM, Leuvenink HG, Treckmann J, Paul A, et al. The prognostic value of renal resistance during hypothermic machine perfusion of deceased donor kidneys. Am J Transplant 2011;11:2214-20. **Describe el bajo valor pronóstico de los índices de resistencia de la MPP y su ausencia de utilidad como marcador único de viabilidad. 31. Hoogland ER, de Vries EE, Christiaans MH, Winkens B, Snoeijs MG, van Heurn LW. The value of machine perfusion biomarker concentration in DCD kidney transplantations. Transplantation 2013;95:603-10. 32. Van Arendonk KJ, James NT, Locke JE, Montgomery RA, Colombani PM, Segev DL. Late graft loss among pediatric recipients of DCD kidneys. Clin J Am Soc Nephrol 2011;6:2705-11. 33. Snoeijs MG, Wiermans B, Christiaans MH, van Hooff JP, Timmerman BE, Schurink GW, et al. Recipient hemodynamics during nonheart-beating donor kidney transplantation are major predictors of primary nonfunction. Am J Transplant 2007;7:1158-66. **Describe la importancia de la situación hemodinámica del receptor en los resultados del trasplante renal de DA. 34. Ushigome H, Okamoto M, Kadotani Y, Nakamura K, Akioka K, Ohmori Y, et al. Immunosuppression in cadaveric renal transplant recipients from non-heart-beating donors in a single center. Transplant Proc 2002;34:1681-2. 35. Wilson CH, Brook NR, Gok MA, Asher JF, Nicholson ML, Talbot D. Randomized clinical trial of daclizumab induction and delayed introduction of tacrolimus for recipients of non-heart-beating kidney transplants. Br J Surg 2005;92:681-7. 36. Sánchez-Fructuoso AI, Marques M, Conesa J, Ridao N, Rodríguez A, Blanco J, et al. Use of different immunosuppressive strategies in recipients of kidney from nonheart-beating donors. Transpl Int 2005;18:596-603. 37. Pérez-Flores I, Sánchez-Fructuoso A, Florit E, Calvo N, Barrientos A. Thymoglobulin versus basiliximab as induction treatment in kidney transplantation from donors after cardiac death. Am J Transplant 2011;11(Supl 2):252. 38. Chudzinski RE, Khwaja K, Teune P, Miller J, Tang H, Pavlakis M, et al. Successful DCD kidney transplantation using early corticosteroid withdrawal. Am J Transplant 2010;10:115-23. 39. Aiello S, Cassis P, Mister M, Solini S, Rocchetta F, Abbate M, et al. Rabbit anti-rat thymocyte immunoglobulin preserves renal function during ischemia/reperfusion injury in rat kidney transplantation. Transplant Int 2011;24:829-38. ◗◗ REVISIÓN CORTA Síndrome de encefalopatía posterior reversible y enfermedad renal crónica. A propósito de siete casos clínicos y revisión de la bibliografía Lourdes Carolina Vázquez Jiménez, Maria Isabel Troya Saborido, Ioana Elena Bancu, Josep Bonet Sol Servicio de Nefrología. Hospital Universitari Germans Trias i Pujol. Badalona, Barcelona NefroPlus 2016;8(1):7-13 RESUMEN La encefalopatía posterior reversible es un síndrome clínico que se presenta como complicación neurológica de varios procesos médicos; se asocia frecuentemente a fallo renal. Se evaluaron siete casos clínicos que presentaron síndrome de encefalopatía posterior reversible (SEPR) como diagnóstico, y cuyo seguimiento realizó el Servicio de Nefrología. Se obtuvieron los datos de síntomas clínicos, como cefalea, hipertensión arterial, convulsiones, función renal y datos de neuroimagen, entre otros, del sistema informático SAP, y se valoraron la evolución y la reversibilidad de las lesiones en 7 pacientes con SEPR que presentaron deterioro de la función renal. Como prueba diagnóstica de imagen inicial se realizó una resonancia magnética nuclear cerebral (RMNC) en cuatro pacientes y una tomografía computarizada craneal en tres. En todos los casos se realizó una RMNC de control que mostró resolución significativa de las lesiones. El promedio de tiempo de recuperación fue de 14 a 21 días. Esta serie de casos reporta que un reconocimiento temprano y una sospecha clínica acertada de esta rara entidad llevan a una buena evolución si se realiza una intervención oportuna y precoz. Palabras clave: Convulsiones. Encefalopatía hipertensiva. Enfermedad renal crónica. Hipertensión arterial. INTRODUCCIÓN La encefalopatía posterior reversible (SEPR) es un síndrome clínico y radiológico descrito por primera vez en 19961, y hasta el momento se han publicado pocas series de casos. El SEPR es una variante de la encefalopatía hipertensiva2, con la diferencia de que el primero puede ir acompañado de presión arterial (PA) dentro del rango de la normalidad. Se han asociado a su desarrollo3-5 algunas alteraciones clínico-biológicas como hipertensión arterial (HTA), enfermedades renales y autoinmunes, así como medicamentos inmunosupresores La fisiopatología exacta del SEPR sigue siendo especulativa. Algunos investigadores postulan que la disfunción de la autorregulación del flujo sanguíneo cerebral a partir de la hipertensión causa una lesión endotelial con posterior edema vasogénico6, mientras que otros hablan de la vasoconstricción secundaria a la evolución Correspondencia: Lourdes Carolina Vázquez Jiménez Servicio de Nefrología. Hospital Universitari Germans Trias i Pujol. Carretera de Canyet, s/n. 08916, Badalona, Barcelona. nefrología.py@outlook.com; carolina.vazquezj@hotmail.com de la hipertensión y la compensación de autorregulación que conduce a la reducción de la perfusión cerebral, isquemia y posterior edema vasogénico. Se han reportado casos de SEPR en pacientes normotensos2,7. La disfunción renal también puede predisponer al edema vasogénico debido a la uremia crónica o por sobrecarga de líquidos por estados clínicos de hiperhidratación, que se considera que contribuyen a la aparición de edema subcortical7-9. La sospecha clínica, las pruebas de laboratorio y el uso de una adecuada prueba de imagen ayudan a establecer un diagnóstico de certeza. El diagnóstico se realiza generalmente con los siguientes síntomas: cefalea, alteraciones visuales y convulsiones junto con la presencia de una imagen radiológica compatible habitualmente con edema a nivel de la sustancia blanca detectado en la resonancia magnética nuclear cerebral (RMNC). Este edema generalmente se localiza a nivel parietooccipital posterior y bilateral en los hemisferios cerebrales. En las series descritas en la bibliografía no se ha encontrado una correlación entre la clínica y los hallazgos radiológicos10. El SEPR tiene algunas incongruencias, como que a pesar de denominarse posterior, las lesiones radiográficas no solo se limitan a la sustancia blanca parietooccipital, ya que a menudo afectan a la corteza, los lóbulos frontales, los ganglios basales y NefroPlus 2016 Vol. 8 N.° 1 7 n n n ◗◗ REVISIÓN CORTA el tronco cerebral11,12. Además, aunque se considera una entidad reversible, se han descrito casos de irreversibilidad, por lo que es importante el diagnóstico y el inicio de tratamiento precoz, dado que puede presentar complicaciones como hemorragia intracraneal y/o accidente vascular isquémico13,14. Presentamos siete casos de SEPR recopilados entre los años 2001 y 2012 en el Servicio de Nefrología de nuestro centro con el objetivo de sensibilizar y favorecer el reconocimiento de esta entidad clínica, así como su tratamiento. CASO 1 Paciente mujer de 28 años de edad, con antecedentes de enfermedad renal crónica secundaria a glomerulonefritis membranoproliferativa tipo I en programa de diálisis peritoneal, HTA controlada con betabloqueantes y mieloma múltiple, por lo que se inició tratamiento con bortezomib y dexametasona. alteraciones. El electroencefalograma resultó normal. Se realizó una TC craneal, sin evidencia de lesiones agudas. La RMNC mostró una extensa afectación de la sustancia blanca subcortical de la convexidad cerebral, temporal y occipital posterior, sugestiva de SEPR (figura 1 superior). Se inició tratamiento con amlodipino, betabloqueantes y doxazosina por vía oral para conseguir controlar la PA. Para las crisis epilépticas se inició la administración de fenitoína. Además, precisó del inicio de sesiones de hemodiálisis por hiperhidratación y deterioro de la función renal. La RMNC de control a los dos meses mostró resolución completa de las lesiones de la sustancia blanca supratentoriales bihemisféricas visualizadas en el estudio previo, confirmando la sospecha clínica de SEPR (figura 1 inferior). CASO 3 La paciente, a los 9 días de haber iniciado el tratamiento con bortezomib, presentó una crisis tónico-clónica generalizada acompañada de cifras tensionales de 180/120 mmHg, sin cefalea previa ni fiebre. No se pudo realizar RMNC inicial por problemas logísticos, si bien en la tomografía computarizada (TC) craneal se objetivaron lesiones de bajo coeficiente de atenuación en la sustancia blanca parietooccipital izquierda de morfología digitiforme, compatibles con SEPR. Inicialmente fue tratada con urapidil e hidralazina, sin haber conseguido con ello control de la PA, por lo que fue necesario iniciar tratamiento con bomba de infusión continua (BIC) de labetalol, asociada a hidralazina, amlodipino y doxazosina por vía oral. El control de las convulsiones se consiguió con BIC de clonazepam y fenitoína. La RMNC realizada dos meses después de este evento informó de hiperintensidad periventricular leve difundida y mal definida, de predominio en el entorno de los cuernos occipitales de los ventrículos laterales, en probable relación con cambios residuales de SEPR. Paciente varón de 64 años, con antecedentes de neoplasia de vejiga tratada a los 59 años y mielodisplasia de bajo grado. Sin antecedentes de enfermedad renal previa ni HTA conocida. Sin tratamiento médico en el momento de la consulta. Debutó con un cuadro clínico de cefalea, desorientación progresiva con desconexión del medio, crisis tónico-clónica generalizada acompañada de fiebre de hasta 39 ºC y crisis hipertensiva con PA de 200/120 mmHg. En la analítica presentaba deterioro de la función renal, con valores de creatinina de 3,6 mg/dl. En el estudio inmunológico solo destacaban anticuerpos antinucleares positivos (1/320) y biopsia renal compatible con microangiopatía trombótica. Se realizó una RMNC, con visualización de alteración de señal en FLAIR en los territorios frontal, de la arteria cerebral media bilateral, en el área capsuloganglionar izquierda, ambos lóbulos occipitales, cuerpo calloso, protuberancia y ambos hemisferios cerebelosos, alteración de la difusión en la porción superior del cerebelo y ambos pedúnculos cerebelosos, compatible con SEPR. CASO 2 Paciente mujer de 23 años de edad, sin historia de HTA, con antecedentes de lupus eritematoso sistémico y nefritis lúpica clase IV, que había presentado varios brotes durante su seguimiento clínico, por lo que recibió tratamiento con micofenolato mofetilo y rituximab, precisando de inicio de ciclos de ciclofosfamida intravenosa por un nuevo brote de la nefritis lúpica. A las 24 horas de administración de la tercera dosis de ciclofosfamida intravenosa, presentó náuseas, vómitos, disminución del nivel de consciencia y una crisis tónico-clónica generalizada. Al examen físico destacaba nistagmo horizontal e hiperreflexia de las cuatro extremidades, PA de 150/102 mmHg y fiebre de 38 ºC. En la analítica destacaba leucocitosis de 16.800 con 85 % de neutrófilos, creatinina de 4,1 mg/dl y urea de 172 mg/dl. El examen del líquido cefalorraquídeo no mostró 8 NefroPlus 2016 Vol. 8 N.° 1 n n n Fue necesaria, para el control de la tensión, la administración de BIC de nitroglicerina y labetalol, además de amlodipino e hidralazina vía oral. La RMNC de control realizada dos semanas después informó de la resolución significativa de las alteraciones en la sustancia blanca cerebral, cerebelosa y tronco compatibles con SEPR en vías de resolución. CASO 4 Paciente varón de 16 años con antecedentes de lupus erite­matoso sistémico y enfermedad renal crónica secundaria a nefritis lúpica clase IV, en tratamiento habitual con hidroxicloroquina sulfato y prednisona, con función renal con creatinina de 1,9 mg/dl (MDRD-4S 47 ml/min/1,73 m2), sin antecedentes de HTA. ◗◗ REVISIÓN CORTA Figura 1. Superior: En las secuencias T2 y FLAIR se identifica una hiperintensidad cortical y subcortical periférica, de predominio en la convexidad frontal y parietal bilateral, pero también en los lóbulos frontales (de predominio izquierdo), temporal posterior izquierdo, polo occipital posterior derecho, así como en la sustancia blanca profunda (esplenio de cuerpo calloso). Ninguna de las lesiones presenta restricción de la difusión. Inferior: Resolución completa de las múltiples lesiones hiperintensas en FLAIR y secuencia potenciada en T2. No se observan lesiones en el parénquima cerebral, cerebeloso ni en el tronco encefálico. En la secuencia de difusión no se aprecian alteraciones de restricción de difusión. Ingresó por síndrome nefrótico clínico y deterioro progresivo de la función renal, por lo que se inició tratamiento con bolos de ciclofosfamida; dos semanas después, coincidiendo con una transfusión de hematíes por anemización, presentó una crisis tónico-clónica generalizada de 2 minutos de duración, sin relajación de esfínteres, con cefalea acompañante y febrícula, con cifras de PA de 160/100 mmHg. En la analítica destacaba deterioro de la función renal, con creatinina de 5,1 mg/dl y acidosis metabólica. Se realizó una TC craneal, que informó de la presencia de múltiples pequeñas hipoatenuaciones córtico-subcorticales temporales posteriores bilaterales, frontal derecha córtico-subcortical y frontal izquierda parasagital sin efecto masa significativo. El fondo de ojo no presentaba evidencia de edema papilar y la punción lumbar mostraba evidencia de líquido cefalorraquídeo claro con bioquímica no compatible con infección y cultivo negativo. El electroencefalograma fue normal. Se realizó una RMNC, que evidenció la presencia de múltiples lesiones, predominantemente de la sustancia blanca subcortical, yuxtacortical y algunas con afectación cortical de localización globalmente simétrica en ambos hemisferios cerebrales y cerebelosas sin restricción de la difusión, compatibles con fenómenos de desmielinización tipo SEPR (figura 2 superior). Se suspendió el tratamiento con los bolos de ciclofosfamida y el paciente inició sesiones de hemodiálisis. Para el control de las crisis tónico-clónicas precisó de BIC de ácido valproico, levetiracetam oral y midazolam de rescate. El control de la PA se consiguió con BIC de labetalol. La RMNC de control a los 2 meses denotó la práctica resolución de las lesiones cerebrales (figura 2 inferior). CASO 5 Mujer de 64 años con antecedentes de hepatopatía crónica con virus de hepatitis C (VHC) positivo en tratamiento con ribavirina e interferón hasta enero de 2013, y posteriormente con carga vírica indetectable y sin antecedentes de alteración de la función renal. A los pocos días de finalizar el tratamiento del VHC consultó por cefalea intensa y cuadro confusional agudo con PA de 213/100 mmHg, con frecuencia cardíaca dentro del rango de la normalidad y sin fiebre. En la exploración física llamaba la atención la presencia de lesiones purpúricas en las extremidades inferiores e hiporreflexia generalizada. En la analítica destacaba pancitopenia, creatinina de 1,95 mg/dl, cociente proteína/creaNefroPlus 2016 Vol. 8 N.° 1 9 n n n ◗◗ REVISIÓN CORTA Figura 2. Superior: Presencia de múltiples lesiones que afectan a la sustancia blanca subcortical y yuxtacortical y cierta afectación cortical. Se localizan en ambos hemisferios cerebrales, de forma globalmente simétrica, aunque hay áreas de mayor afectación unilateral. Hay lesiones bilaterales y simétricas en ambos hemisferios cerebelosos y a nivel temporobasal, aunque de predominio derecho; también hay afectación parietooccipital bilateral y frontal de predominio derecho, y hay lesiones bilaterales y simétricas en ambas caras mediales de los lóbulos parietales. Se observa una pequeña alteración focal de la señal a nivel profundo localizada en el margen posterior protuberancial a la altura del pedúnculo cerebeloso superior. Inferior: Práctica resolución de las sutiles lesiones hiperintensas córtico-subcorticales bihemisféricas bilaterales supratentoriales. tinina en orina (Cro) de 1.160 mg/g, > 100 hematíes por campo en el sedimento (80-90 % de hematíes dismórficos) y crioglobulinas positivas e hipocomplementemia (C3 y C4). La RMNC de control tras 2 meses mostró marcada disminución de las áreas de hiperintensidad FLAIR/T2 en la sustancia blanca bilateral, reforzando el diagnóstico de SEPR. Se realizó una biopsia renal, que evidenció glomerulonefritis crioglobulinémica asociada al VHC. CASO 6 Por el cuadro neurológico de la paciente se realizaron una punción lumbar, que resultó no patológica, y una TC que informó de hipoatenuaciones parietooccipitales bilaterales y focales. Una semana después se completó el estudio con una RMNC, en la que destacaba un área hiperintensa en la región subcortical frontal izquierda, que no presentó restricción de la difusión compatible con SEPR. Para el control de la PA se precisó urapidil intravenoso y posteriormente se pudo pasar a amlodipino, doxazosina, hidralazina, furosemida, espironolactona y bisoprolol. No precisó de técnica renal sustitutiva. 10 NefroPlus 2016 Vol. 8 N.° 1 n n n Paciente varón de 66 años, VHC positivo que recibió tratamiento con interferón pegilado, HTA en tratamiento con alfabloqueantes y bloqueantes de los canales del calcio y enfermedad renal crónica por nefropatía IgA en programa de hemodiálisis. Acudió a urgencias por un cuadro de dolor abdominal que se inició durante la sesión de hemodiálisis habitual asociado a náuseas, sin otra sintomatología acompañante. A su llegada se encontraba hipertenso, con PA sistólica superior a 200 mmHg. En la analítica destacaban 15.000 leucocitos con neutrofilia, elevación de amilasas y lipasas, alani- ◗◗ REVISIÓN CORTA na-aminotransferasa de 796 UI/l, bilirrubina de 1,6 mg/dl e ionograma correcto. Se realizó una TC abdominal, que resultó compatible con pancreatitis aguda grado D sin signos radiológicos de necrosis parenquimatosa. Se pautó tratamiento analgésico. Asimismo, se continuó con las sesiones de hemodiálisis para ajuste del peso seco. Por otra parte, fue necesario mantener tratamiento antihipertensivo con antagonistas del calcio, doxazosina y betabloqueantes para controlar la PA. CASO 7 Durante su estancia en urgencias presentó dos episodios de crisis tónico-clónica generalizada sin signos de focalidad clara, pero con agitación posterior importante, que requirió la administración de benzodiacepinas y posteriormente de fenitoína intravenosa. Se realizó una TC craneal urgente, que informó de un área de hipodensidad occipital bilateral con disminución de los surcos a ese nivel, orientada como probable SEPR, que se confirmó mediante RMNC realizada 15 días después de este evento. Dicha resonancia magnética informó de afectación a nivel de la sustancia blanca yuxtasubcortical biparietooccipital, sin restricción de la difusión ni efecto masa, compatible con SEPR en fase de resolución. Se realizó un electroencefalograma, que resultó normal. Mujer de 52 años, con antecedentes de asma, enfermedad renal crónica de etiología no filiada, con cifras de creatinina habituales de 2,5 mg/dl y cuadro de infecciones urinarias de repetición. Presentó convulsiones tónico-clónicas generalizadas y disminución del nivel de consciencia. Asimismo, presentó cefalea y ­mutismo en los días previos al ingreso. A su llegada a nuestro centro la paciente estaba con PA de 110/60 mmHg, sin fiebre y con una exploración física sin nada que destacar. La analítica denotó deterioro de la función renal con creatinina de 17 mg/dl, urea 251 mg/dl e hiperpotasemia de 7,3 mmol/l. La ecografía renovesical mostró signos de pielonefritis obstructiva. Tabla 1. Características clínicas en siete pacientes con síndrome de encefalopatía posterior reversible Diagnóstico Tratamiento Edad Sexo Clínica PA más elevada (mmHg) 1 MM/HTA/ERC secundaria a GMN MP tipo (DP) I Bortezomib/ DXM 28 M CONV/CHTA 180/120 Diálisis peritoneal 2 LES, NL (III/IV) CTX 23 M CONV, SXF, náuseas, vómitos 150/102 4,1 mg/dl Inicio HD 3 NEO vejiga, mielodisplasia de bajo grado Ninguno 64 V CONV, CEF, SXF, CHTA 200/120 3,6 mg/dl 4 LES/ERC (NL IV/V con reacción extracapilar) CTX 16 V CONV, CEF, SXF 160/100 5,1 mg/dl Inicio HD 5 HVHC Ribavirina e IFN 64 M CEF/CCA/CHTA 213/100 1,95 mg/dl 6 VHC, enol, HTA/ERC secundaria a nefropatía IgA (HD) IFN 66 V CONV, CHTA, náuseas 200/110 HD 7 ERC de etiología no filiada/infecciones urinarias de repetición Ninguno 52 M CONV, CEF, DNC 110/60 17 mg/dl Inicio HD Caso n.º Niveles de creatinina CCA: cuadro confusional agudo; CEF: cefalea; CHTA: crisis hipertensiva; CONV: convulsiones; CTX: ciclofosfamida; DNC: disminución del nivel de consciencia; DP: diálisis peritoneal; DXM: dexametasona; ERC: enfermedad renal crónica; GMN MP: glomerulonefritis membranoproliferativa; HD: hemodiálisis; HTA: hipertensión arterial; HVHC: hepatitis por virus de hepatitis C; IFN: interferón; LES: lupus eritematoso sistémico; M: mujer; MM: mieloma múltiple; NEO: neoplasia; NL: nefritis lúpica; PA: presión arterial; SXF: síndrome febril; V: varón; VHC: virus de la hepatitis C. NefroPlus 2016 Vol. 8 N.° 1 11 n n n ◗◗ REVISIÓN CORTA Se realizó una TC craneal, que no demostró imágenes patológicas. Tras una semana, se realizó una RMNC que informó de afectación de la sustancia blanca de ambos hemisferios, que podría corresponder a edema vasogénico secundario a SEPR. Para el control de las convulsiones se requirió inicio de valproato, y se precisó de intubación orotraqueal. Además, fue necesario comenzar sesiones de hemodiálisis por anuria y deterioro de la función renal. La RMNC realizada al cabo de un mes mostró la resolución casi completa de las lesiones. DISCUSIÓN Y CONCLUSIÓN Hemos identificado siete episodios de SEPR, tres varones y cuatro mujeres, con edades de entre 16 y 64 años. Entre los antecedentes patológicos se describieron lupus eritematoso sistémico (2/7), HTA (2/7), glomerulonefritis membranoproliferativa (1/7), mieloma múltiple (1/7), hepatitis crónica por VHC (2/7) y enfermedad renal previa (5/7), uno de ellos en diálisis peritoneal y otro en hemodiálisis. Con respecto a los tratamientos inmunosupresores, dos estaban en tratamiento con ciclofosfamida, uno con bortezomib, dos con interferón y uno de ellos con ribavirina. Los signos presentes en todos los pacientes de nuestro estudio fueron: deterioro de la función renal en todos, elevación de la PA en seis de ellos, crisis tónico-clónicas en seis, cefalea en cuatro casos y fiebre en tres pacientes (tabla 1). Como prueba diagnóstica de imagen inicial se realizó una RMNC en cuatro pacientes y TC craneal en tres. En estos últimos tres no se pudo realizar RMNC inicial, a pesar de la sospecha clínica, por problemas logísticos. Como prueba complementaria se realizó punción lumbar en cuatro casos y electroencefalograma en tres, resultando todos ellos no patológicos. Seis de los pacientes recibieron inicialmente al menos cuatro fármacos para el control de la TA, entre ellos betabloqueantes, antagonistas de los canales del calcio, alfabloqueantes y nitratos. Cinco pacientes precisaron de técnica renal sustitutiva y tres de ellos, inicio de hemodiálisis. Para las crisis convulsivas se utilizó fenitoína, clonazepam, valproato y levetiracetam. Ninguno de los pacientes ha presentado recurrencia de las crisis convulsivas. En todos los casos, posteriormente al episodio, se realizó una RMNC que mostró la resolución significativa de las lesiones, incluso en aquellos en los que solo se contaba inicialmente con imágenes de TC compatibles con SEPR. Todos los pacientes mostraron una mejoría clínica y radiológica documentada. La sospecha clínica favoreció el diagnóstico precoz de los casos presentados. El SEPR es un síndrome diagnosticado cada vez con más frecuencia debido a las técnicas de neuroimagen. Tabla 2. Revisión de la bibliografía. Series de casos de síndrome de encefalopatía posterior reversible de los años 1996 a 2013 Año Autor Pacientes Comorbilidades Síntomas 1996 Hinchey et al 15 Crisis HTA secundaria a nefritis aguda, EC, SHR, LES, TI y TR de hígado CEF, alteración del estado mental, FR 2006 Magnano 17 LES CONV, CEF, AV 2008 Lee et al 36 HTA, ER, NEO, TR CONV (87 %), ENC (92 %), CEF (53 %), AV (39 %) 2010 Fugate et al 113 HTA, EC, EAI, CT, SRIS, disfunción múltiple CONV (74 %), ENC (28 %), CEF (26 %), AV (20 %) 2011 Ni et al 24 HTA, EC, ER, LES, TI, arteritis de Takayasu, síndrome de Sheehan CONV, ENC, CEF, AV, parálisis 2013 Chen et al 15 HTA, ER, TI, agentes antineoplásicos CONV, ENC, CEF, AV 2013 Yoon et al 16 HTA, EC, EAI, CT, NEO, SRIS, HSA CONV, ENC, CEF, AV 2013 Hammerstrom 19 HTA, ER, TI, TR CONV, AEM, AV AEM: alteración del estado mental; CEF: cefalea; CONV: convulsiones; CT: citotóxicos; EAI: enfermedades autoinmunes; EC: eclampsia; ENC: encefalopatía; ER: enfermedad renal; FR: fracaso renal; HSA: hemorragia subaracnoidea; HTA: hipertensión arterial; LES: lupus eritematoso sistémico; NEO: neoplasia; SHR: síndrome hepatorrenal; SRIS: síndrome de respuesta inflamatoria sistémica; TI: terapia inmunosupresora; TR: trasplante. 12 NefroPlus 2016 Vol. 8 N.° 1 n n n ◗◗ REVISIÓN CORTA En las series de SEPR presentadas en la literatura desde 1996 a 2013 los artículos de MEDLINE más relevantes, en cuanto al número de pacientes reclutados, han sido realizados mayoritariamente por los servicios de neurología y radiología. En estos, las manifestaciones clínicas presentadas con más frecuencia son cefalea, alteraciones del nivel de consciencia, trastornos visuales y convulsiones. En la mayor parte de las series se ven afectadas más mujeres que varones. Se presenta en todas las edades. Las comorbilidades son variadas. Se relaciona con varias condiciones médicas como encefalopatía hipertensiva, enfermedad renal aguda o crónica, púrpura trombótica trombocitopénica, síndrome hemolítico urémico, eclampsia, vasculitis, lupus eritematoso sistémico, crioglobulinemia, terapia inmunosupresora e inmunomoduladora, fármacos quimioterápicos, porfiria, trastornos electrolíticos, transfusiones de sangre y exposición a contraste, entre otras3-5,16-18 (tabla 2). literatura médica se han descrito casos de SEPR en pacientes con cifras de PA dentro del rango de la normalidad. En todos los casos fue necesaria una prueba de imagen adecuada para el diagnóstico, además de clínica compatible. El promedio de tiempo de recuperación de la clínica fue bastante variable, entre 14 y 21 días. La mayoría de los pacientes tenían hipertensión previa, si bien en los casos presentados uno era normotenso. También en la Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este ar­tículo. Los trastornos hipertensivos, la enfermedad renal y las terapias inmunosupresoras son factores de riesgo para presentar SEPR. Además, son situaciones frecuentes para un nefrólogo, por lo que consideramos esencial tener en cuenta esta entidad y establecer un alto grado de sospecha clínica, de cara a evitar casos de irreversibilidad, instaurando un tratamiento oportuno y ­precoz. Conflictos de interés REFERENCIAS BIBLIOGRÁFICAS 1. Hinchey J, Chaves C, Appignani B, Breen J, Pao L, Wang A, et al. A reversible posterior leukoencephalopathy syndrome. N Engl J Med. 1996;334:494-500. 2. Antunes NL, Small TN, George D, Boulad F, Lis E. Posterior leukoencephalopathy syndrome may not be reversible. Pediatr Neurol. 1999;20:241-3. 3. Lee VH, Wijdicks EF, Manno EM, Rabinstein AA. Clinical spectrum of reversible posterior leukoencephalopathy syndrome. Arch Neurol. 2008;65:205-10. 4. Mirza A. Posterior reversible encephalopathy syndrome: a variant of hypertensive encephalopathy. J Clin Neurosci. 2006;13:590-5. 5. Kur JK, Esdaile JM. Posterior reversible encephalopathy syndrome: an underrecognized manifestation of systemic lupus erythematosus. J Rheumatol. 2006;33:2178-83. 6. Strandgaard S, Olesen J, Skinhoj E, Lassen NA. Autoregulation of brain circulation in severe arterial hypertension. Br Med J. 1973;1: 507-10. 7. Byrom F. The pathogenesis of hypertensive encephalopathy and its relation to the malignant phase of hypertension. Lancet. 1954;2: 201-11. 8. Schwartz RB, Mulkern RV, Gudbjartsson H, Jolesz F. Diffusion weighted MR imaging in hypertensive encephalopathy: clues o pathogenesis. AJNR Am J Neuroradiol. 1998;19:859-62. 9. Caminero AB. Syndrome de encefalopatía posterior reversible. Neurologia. 2005;20:327-31. 10. Fugate JE, Claassen DO, Cloft HJ, Kallmes DF, Kozak OS, Rabinstein AA. Posterior reversible encephalopathy syndrome: associated clinical and radiological findings. Mayo Clin Proc. 2010;85:427-32. 11. Lee VH, Wijdicks EF, Manno EM, Rabinstein AA. Clinical spectrum of reversible posterior leukoencephalopathy syndrome. Arch Neurol. 2008;65:205-10. 12. Bartynski WS, Boardman JF. Distinct imaging patterns and lesion distribution in posterior reversible encephalopathy syndrome. AJNR Am J Neuroradiol. 2007;28:1320-7. 13. Singhal AB, Caviness VS, Begleiter AF, Mark EJ, Rordorf G, Koroshetz WJ. Cerebral vasoconstriction and stroke after use of serotonergic drugs. Neurology. 2002;58:130-3. 14. Williams TL, Lukovits TG, Harris BT, Harker Rhodes C. A fatal case of postpartum cerebral angiopathy with literature review. Arch Gynecol Obstet. 2007;275:67-77. 15. Striano P, Striano S, Tortora F, De Robertis E, Palumbo D, Elefante A, et al. Clinical spectrum of reversible and critical care management of posterior reversible encephalopathy syndrome. Med Sci Monit. 2005;11:CR:549-53. 16. Chen TH, Lin WC, Tseng YH, Tseng CM, Chang TT, Lin TJ. Posterior reversible encephalopathy syndrome in children: case series and systematic review. J Child Neurol. 2013;28:1378-86. 17. Yoon SD, Cho BM, Oh SM, Park SH, Jang IB, Lee JY. Clinical and ­ radiological spectrum of posterior reversible encephalopathy syndrome. J Cerebrovasc Endovasc Neurosurg. 2013;15: 206-13. 18. Ni J, Zhou LX, Hao HL, Liu Q, Yao M, Li ML, et al. The clinical and radiological spectrum of posterior reversible encephalopathy syndrome: a retrospective series of 24 patients. J Neuroimaging. 2011;21:219-24. NefroPlus 2016 Vol. 8 N.° 1 13 n n n RESÚMENES ESTRUCTURADOS, EVALUADOS Y COMENTADOS DE LITERATURA NEFROLÓGICA: CONCEPTO Y OBJETIVOS Los RESÚMENES ESTRUCTURADOS son resúmenes de artículos originales publicados en la literatura médica nefrológica, evaluados siguiendo criterios de lectura crítica de MBE, y que son estructurados para darles un formato sencillo y útil para su interpretación por el clínico y que, a su vez, sea homologable y permita la comparación de varios trabajos del mismo tema. Finalmente –en base a este proceso–, los trabajos son comentados por los revisores, desde el punto de vista clínico y metodológico. El objetivo principal de la publicación de estos resúmenes es facilitar al nefrólogo información acerca de novedades científicas en los distintos campos de la especialidad mediante la selección de artículos con relevancia para la práctica clínica. Como hemos comentado, esta información ha sido previamente ponderada, para que el lector pueda entender fácilmente las fortalezas y debilidades del trabajo y, por tanto, tener una opinión de éste, con independencia de las opiniones personales de los revisores. Por otra parte, desde esta Sección queremos colaborar en el desarrollo del espíritu analítico y crítico que existe en nuestra Sociedad, facilitando apoyo metodológico y el aprendizaje de técnicas de lectura crítica. Por esto, los temas irán acompañados de comentarios metodológicos y clínicos. El proceso para la elaboración de los resúmenes sigue los siguientes pasos: 1. Detección de los artículos que se publican sobre causas, evolución, diagnóstico, prevención, tratamiento, calidad de vida o análisis económico en el campo de la Nefrología, mediante unos criterios preestablecidos. 2. Los artículos seleccionados se situarán en la Web de Nefrología (www.revistanefrologia.com) indicando el nombre de los revisores encargados de su revisión. 3. Realización de resúmenes estructurados que describan la pregunta que sustenta la hipótesis del trabajo y, siguiendo criterios de análisis sistemático de lectura crítica, sus objetivos, métodos, resultados y conclusiones. 4. Comentario de estos artículos por los revisores, valorando su importancia clínica y rigor metodológico para sustentar los resultados y conclusiones. 5. Finalmente, la colección de resúmenes quedará recogida en la red y clasificada por temas que serán publicados, periódicamente, en números de NefroPlus CRITERIOS PARA LA SELECCIÓN DE ARTÍCULOS PARA RESUMIR: 1. GENERALES: artículos publicados en inglés o en español en alguna de las revistas seleccionadas a condición de que aborden materias importantes para la práctica clínica en Nefrología. 2. PREVENCIÓN O TRATAMIENTO, MEJORA DE LA CALIDAD: reparto aleatorio de los participantes a las intervenciones. Variables de resultado o desenlace de importancia clínica conocida o probable. 3. DIAGNÓSTICO: inclusión de un espectro amplio de participantes, de modo que algunos, pero no todos, tengan el trastorno o alteración objeto del estudio. Los participantes reciben la prueba diagnóstica prueba y la prueba diagnóstica definitiva, definidas ambas con claridad. 4. PRONÓSTICO: se estudia una cohorte de sujetos desde el inicio de presentar el trastorno o alteración definida, y sin haber presentado el desenlace o resultado objeto del estudio. 5. CAUSALIDAD: observaciones acerca de la relación entre exposición y desenlaces clínicos. 6. ECONOMÍA DE LOS PROGRAMAS O INTERVENCIONES DE ASISTENCIA SANITARIA: la pregunta económica debe comparar distintas alternativas de acción en pacientes reales o hipotéticos. Las distintas alternativas que se comparan deben compararse tanto por los desenlaces o resultados clínicos que producen (efectividad) como por los recursos que consumen (coste). 7. GUÍAS DE PRÁCTICA CLÍNICA: guías desarrolladas por el análisis crítico y jerarquización de datos de investigación clínica publicados y que se ocupen del tratamiento, diagnóstico, pronóstico o etiología. 8. REVISIONES SISTEMÁTICAS: definición clara de la pregunta clínica que se estudia, con descripción de la estrategia de búsqueda de la evidencia científica, de las fuentes de búsqueda y de los criterios de inclusión y exclusión de los trabajos analizados. QUEREMOS QUE ESTA INICIATIVA SEA DE TODA LA SOCIEDAD ESPAÑOLA DE NEFROLOGÍA Los interesados en formar parte de los grupos de trabajo que participarán en la selección, análisis, crítica y difusión de trabajos publicados en alguna de las subespecialidades nefrológicas, escribidnos1 indicando nombre, Servicio o Unidad de trabajo y área principal de interés (Nefrología clínica, hemodiálisis, CAPD, trasplante renal, fracaso renal agudo, hipertensión, nefropediatría, etc.). revistanefrologia@senefro.org 14 NefroPlus 2016 Vol. 8 N.° 1 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA Efectos de la empagliflozina sobre los episodios cardiovasculares y la mortalidad en adultos con diabetes mellitus tipo 2 Zinman B, Wanner C, Lachin JM, Fitchett D, Bluhmki E, Hantel S, et al; EMPA-REG Outcome investigators. Empagliflozin, cardio-vascular outcomes and mortality in Type 2 Diabetes. N Engl J Med 2015;373:2117-28. Análisis crítico: Alberto Martínez-Castelao1, José Luis Górriz Teruel2, Eva Solá Izquierdo3 1 Servicio de Nefrología. Hospital Universitario de Bellvitge. L’Hospitalet de Llobregat. Barcelona GEENDIAB. REDinREN. Instituto de Salud Carlos III 2 Servicio de Nefrología. Hospital Universitario Dr. Peset. Valencia GEENDIAB. REDinREN. Instituto de Salud Carlos III 3 Servicio de Endocrinología. Hospital Universitario Dr. Peset. Valencia NefroPlus 2016;8(1):15-19 ■■ Tipo de diseño y seguimiento Ensayo clínico multicéntrico, doble ciego, controlado con placebo realizado desde septiembre de 2010 hasta abril de 2013, con seguimiento de 3,1 años. Evaluación de los pacientes en las semanas 0, 12, 28, 40, 52, 66, 80, 94, 108, 122, 136, 150, 164, 178, 192 y 206. ■■ Asignación Aleatorización generada por ordenador en proporción 1:1:1, estratificada por nivel de glucohemoglobina (HbA1c) al cribado, índice de masa corporal (IMC) en la aleatorización, filtrado glomerular estimado (FGe) en el cribado y región geográfica. ■■ Enmascaramiento Doble ciego. N ■■ Ámbito Pacientes reclutados en 590 centros de 42 países. ■■ Pacientes Criterios de inclusión Pacientes con diabetes mellitus tipo 2 (DM-2), adultos > 18 años, IMC ≤ 45 kg/m2, FGe por MDRD > 30 ml/min/1,73 m2, enfermedad cardiovascular (CV) establecida. Criterios de exclusión Recibir agentes hipoglucemiantes en las 12 semanas previas a la aleatorización, HbA1c < 7 % o > 9 % en las 12 semanas previas a la aleatorización o HbA1c < 7 % o > 10 % a la aleatorización. Los habituales respecto a cifras de tensión arterial, infecciones, neoplasias, etc. ■■ Intervenciones Después de un período placebo abierto de 2 semanas, 7.028 pacientes fueron aleatorizados como sigue: –– Grupo empagliflozina 10 mg (n = 2.345): recibieron 1 comp./día por vía oral. –– Grupo empagliflozina 25 mg (n = 2.342): recibieron 1 comp./día por vía oral. –– Grupo placebo (GP) (n = 2.333): 1 comp./día por vía oral. Se permitió el ajuste de la dosis de agentes hipoglucemiantes previos al período de cribado, a partir de la semana 12 de tratamiento, a criterio del investigador. La dislipidemia y la hipertensión arterial se trataron según los mejores estándares de tratamiento locales. ■■ Variables de resultado Variable principal Combinado de muerte de causa CV, infarto de miocardio no mortal, accidente cerebrovascular no mortal. Variable secundaria Compuesto de la variable principal más hospitalización por angina inestable o insuficiencia cardíaca. Tamaño muestral Se realizó cribado en 11.531 pacientes con DM-2, de los cuales se aleatorizaron y trataron 7.020 en el análisis primario. Completaron el estudio el 97 %, el 25,4 % discontinuaron prematuramente el estudio y el estatus vital final se obtuvo en el 99,2 % de los pacientes. ■■ Estadística La hipótesis primaria fue la no inferioridad de la empagliflozina en el objetivo primario para el grupo combinado (las dos dosis de 10 y 25 mg/día) frente al placebo, con margen de riesgo relativo (RR) de 1,3. Se utilizó NefroPlus 2016 Vol. 8 N.° 1 15 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA una estrategia de jerarquización en cuatro escalones: no inferioridad en el objetivo primario, no inferioridad en el objetivo secundario, superioridad en el objetivo primario y superioridad en el objetivo secundario. Se consideró significación estadística un valor de p ≤ 0,0498 en el análisis final. Se consideró un margen de no inferioridad en el objetivo primario de 1,3 en el nivel de p = 0,0249, requiriéndose al menos 691 episodios para probar un poder del 90 %, asumiendo un RR de 1,0. Para la no inferioridad se consideró un intervalo de confianza (IC) del 95,02 % < 1,3. Se aplicaron los modelos de riesgos proporcionales de Cox para grupos, edad, sexo, IMC basal, HbA1c, FGe basal y distribución geográfica. La estimación de incidencias acumulativas se corrigió como riesgo competitivo para muerte, excepto la muerte de cualquier causa, en cuyo caso se aplicó la estimación de Kaplan-Meier. Las incidencias acumulativas se interrumpen en el mes 48, calculando el número de pacientes necesarios para prevenir una muerte sobre la base de distribución exponencial. Los datos de pacientes que no presentaron episodios CV fueron censurados en el último día conocido libre del evento. Los análisis secundarios incluyen la comparación de los grupos 10 mg/día frente a placebo y 25 mg/día frente a placebo. Se analizaron cambios en la HbA1c, peso, cintura abdominal, presión arterial sistólica (PAS) y diastólica (PAD), frecuencia cardíaca, colesterol HDL, colesterol LDL y ácido úrico mediante medidas repetidas utilizando un modelo mixto. ■■ Promoción y conflicto de intereses Estudio diseñado y financiado por Boëhringer-Ingelheim, que proporcionó la medicación, recolección de datos y revisión del trabajo. El laboratorio Eli-Lilly aportó financiación. La decisión sobre la publicación final recayó en el investigador principal y los miembros académicos del comité directivo. Varios autores manifestaron ser consultores de ambos laboratorios y haber recibido apoyo económico. ■■ RESULTADOS PRINCIPALES (tabla 1) Análisis basal de los grupos Los grupos están bien equilibrados en cuanto a número de pacientes, pero no se muestran las características basales por separado. En el análisis conjunto para empagliflozina sí se muestran bien equilibrados en cuanto a edad –menor o mayor de 65 años–, distribución por sexos, raza, HbA1c < 8,5 o > 8,5 %, IMC, PAS y PAD, FGe por grupos –> 90 ml/min/1,73 m2, 90 a 60 o < 60–, episodios CV previos, tratamiento con insulina, sulfonilureas, estatinas o ezetimiba, inhibidores del SRAA, betabloqueantes o diuréticos. La duración media del tratamiento fue de 2,6 años y el tiempo medio de observación de 3,1 años, similar en ambos grupos de empagliflozina frente a placebo. Variable principal Mostró una disminución significativa de episodios en el análisis conjunto de empagliflozina (490 en 4.687 pacientes, 10,5 %) frente a placebo (282 en 2.333, 12,1 %), RR 0,86, p < 0,001 para no inferioridad y p = 0,04 para superioridad. Cuando se analizaron los dos grupos de 10 y 25 mg por separado, no existieron diferencias significativas, siendo la RR de 0,85 para el grupo tratado con 10 mg/día y de 0,86 para el grupo de 25 mg/día. Variable secundaria El objetivo secundario ocurrió en 599 de 4.687 pacientes (12,8 %) en el grupo conjunto de empagliflozina y en 333 de 2.333 pacientes (14,3 %), RR 0,62, p < 0,001 en el GP. La empagliflozina redujo significativamente la mortalidad CV (RR 0,62; p < 0,001), la mortalidad de cualquier causa (RR 0,68; p < 0,001), así como la hospitalización por insuficiencia cardíaca (RR 0,65; p < 0,002). Se reportó una incidencia de IM de 4,8 % en los grupos de empagliflozina frente al 5,4 % en el GP, y de accidente vascular cerebral de 3,5 % en empagliflozina y 3 % en el GP. Control glucémico A las 12 semanas postaleatorización, el descenso de la HbA1c fue de –0,54 % en el grupo de 10 mg/día, y de –0,60 en el de 25 mg/día. A la semana 94ª, el descenso fue de –0,42 % y –0,47 %, respectivamente. En la semana 206ª –observación final–, el descenso fue de –0,26 y –0,36, respectivamente. El estudio perseguía igualar el control glucémico en ambos brazos para poder valorar el efecto del tratamiento sobre el objetivo primario sin la confusión del control glucémico. Factores de riesgo cardiovascular En los pacientes tratados con empagliflozina se observaron ligeros descensos de peso, circunferencia abdominal, PAS y PAD, así como mayor necesidad de recibir tratamiento hipoglucemiante adicional y anticoagulante en el GP. 16 NefroPlus 2016 Vol. 8 N.° 1 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA Tabla 1. Objetivos primario y secundario del estudio Placebo (n = 2.333) Resultados N.º (%) Objetivo primario (muerte cardiovascular, infarto de miocardio no mortal e ictus no mortal) 282 (2,1) Tasa/1.000 pacientes-año 43,9 Cociente de riesgo (hazard ratio) (IC del 95 %) Empagliflozina (n = 4.687) N.º (%) 490 (10,5) p Tasa/1.000 pacientes-año 37,4 0,86 (0,74-0,99) No inferioridad < 0,001 Superioridad Objetivo secundario (muerte cardiovascular, infarto de miocardio no mortal, ictus no mortal u hospitalización por angina inestable) 0,04 333 (14,3) 52,5 599 (12,8) 46,4 0,89 (0,78-1,01) No inferioridad < 0,001 Superioridad 0,08 Muerte por cualquier causa 194 (8,3) 28,6 269 (5,7) 19,4 0,68 (0,57-0,82) < 0,001 Muerte cardiovascular 137 (5,9) 20,2 172 (3,7) 12,4 0,62 (0,49-0,77) < 0,001 Hospitalización por insuficiencia cardíaca 95 (4,1) 14,5 126 (2,7) 9,4 0,65 (0,50-0,85) 0,002 Hospitalización por insuficiencia cardíaca o muerte cardiovascular (excluyendo ictus mortal) 198 (8,5) 30,1 265 (5,7) 19,7 0,66 (0,55-0,79) < 0,001 No existieron diferencias significativas en la incidencia de infarto de miocardio mortal y no mortal, infarto de miocardio silente, hospitalización por angina inestable, revascularización coronaria, ictus mortal y no mortal ni accidente isquémico transitorio. IC: intervalo de confianza. Seguridad y efectos adversos La proporción de efectos adversos, graves o que llevaran a la discontinuación del tratamiento, fue similar en los tres grupos. Existió un incremento en el porcentaje de infecciones genitales en el grupo combinado de empagliflozina (6,4 %) respecto al GP (1,8 %), no así en los episodios de infecciones del tracto urinario (18 % en empagliflozina, 18,1 % en GP). No se detectaron diferencias en cuanto a episodios de hipoglucemia, insuficiencia renal aguda, episodios de cetoacidosis, fracturas óseas o depleción de volumen en los tres grupos. Datos de laboratorio No se detectaron cambios electrolíticos relevantes y sí elevación mayor del hematocrito 4,8 ± 5,5 % en el grupo de 10 mg/día, 5 ± 5,3 % en el de 25 mg/día y 4,7 ± 0,9 en el GP. ■■ CONCLUSIONES DE LOS AUTORES Los pacientes con DM-2 y elevado riesgo CV que recibieron tratamiento con empagliflozina, en comparación con placebo, tuvieron menor incidencia de episodios de un objetivo compuesto por muerte de causa CV o de cualquier causa, cuando se añadió el fármaco en estudio a los cuidados estándares en este tipo de pacientes. NefroPlus 2016 Vol. 8 N.° 1 17 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA ■■ COMENTARIOS DE LOS REVISORES Se trata de un ensayo clínico aleatorizado, doble ciego, controlado con placebo, con tamaño muestral muy amplio y grupos de población homogéneos. Los pacientes del estudio tenían riesgo CV incrementado por criterio de inclusión y presentaron una media de HbA1c de 8,2 %, siendo la HbA1c media al final del estudio de 8,16 % en el grupo de placebo y 7,81 % en el grupo tratado. El riesgo CV del paciente con DM-2 sigue siendo elevado, a pesar de los avances en el diagnóstico más precoz, tanto de la enfermedad diabética como de las complicaciones de la DM en esta población, y muchos pacientes mueren por causa CV1,2. El armamentario de que disponemos para lograr un adecuado control glucémico en la DM es cada vez mayor, siendo los grupos farmacológicos muy numerosos y con innovaciones terapéuticas importantes en los últimos años3. Recientemente se han introducido los inhibidores del cotransportador renal sodio-glucosa tipo 24-6. Los fármacos de este grupo hasta ahora disponibles son la canagliflozina, la dapagliflozina y la empagliflozina. Todos ellos han mostrado en diversos estudios su eficacia en el control glucémico, con importantes descensos de la HbA1c, tanto solos como asociados a otros hipoglucemiantes, incluida la insulina. La novedad de introducir la inhibición en la reabsorción tubular de glucosa es muy atractiva en el manejo terapéutico de la DM, por la implicación del riñón en el metabolismo glucémico. Los estudios realizados hasta la actualidad han incluido enfermos con DM-2 y enfermedad renal con filtrado glomerular (FG) estimado hasta 30 ml/min/1,73 m2. El efecto de estos fármacos disminuye a medida que lo hace el FG, y especialmente por debajo de esa cifra, el enfermo no se beneficiará del efecto hipoglucemiante, por razón del propio mecanismo de acción de estos fármacos. En dichos estadios la reabsorción tubular está muy deteriorada y no podrán actuar. Por ello, su utilidad terapéutica en el caso de la enfermedad renal crónica es limitada, y según ficha técnica, no debe iniciarse con FG < 60 ml/min/1,73 m2. En el caso de la empagliflozina y la canagliflozina, el tratamiento puede mantenerse si el FG desciende progresivamente, ajustándose la dosis. Deberá suspenderse con FG < 45 ml/min/1,73 m2. Respecto a los efectos adversos, habrá que estar atentos a los que se produzcan a largo plazo, ya que se han reportado incrementos en las infecciones genitales –ligadas al aumento de la glucosuria–, y un posible incremento en la incidencia de tumores vesicales, probablemente también en relación con el mismo efecto. La principal novedad del presente estudio es que muestra beneficio del uso de empagliflozina en eventos CV, hasta ahora no evidenciado con ningún otro tratamiento hipoglucemiante. Estudios recientes con saxagliptina, alogliptina, insulina glargina o sitagliptina no han mostrado diferencias en el número de episodios CV entre dichos fármacos y el grupo placebo. La reducción de eventos CV aparece en el estudio EMPA-REG-OUTCOME de forma muy precoz a los 3 meses de tratamiento. Este hallazgo precoz indica que no está relacionado con el control glucémico, la presión arterial ni la arterioesclerosis. Probablemente se trate de un efecto natriurético y hemodinámico del fármaco5,6, que también explicaría su acción favorable sobre la insuficiencia cardíaca. No obstante, dado que solo un 10 % de los pacientes presentaban insuficiencia cardíaca, este dato por sí solo no parece explicar la magnitud del beneficio observado. En el estudio Emphasis-HF, eplerenona frente a placebo en la insuficiencia cardíaca sistólica leve7, las curvas también se separaron de forma precoz, como en el presente estudio. Ello pudiera sugerir la implicación de mecanismos natriuréticos y sus consecuencias hemodinámicas en el beneficio sobre la mortalidad y riesgo de insuficiencia cardíaca. Curiosamente, los pacientes tratados con empagliflozina no desarrollaron incremento de la frecuencia cardíaca, a pesar del efecto de depleción de volumen. Ello deja una puerta abierta a una posible actuación sobre el sistema nervioso simpático y sus efectos sobre la función cardíaca sistólica y diastólica. Igualmente llamativo resulta el distinto comportamiento de la empagliflozina sobre los diferentes eventos CV que integran el objetivo primario. La reducción de muerte CV fue muy relevante (hazard ratio 0,62; p < 0,001), mientras que el efecto s­ obre infarto no mortal y accidente CV no mortal fue neutro, hechos que requerirán un estudio detenido en posteriores aná­li­sis. Este es el primer estudio que aporta beneficio CV de un fármaco antidiabético en pacientes con DM y enfermedad CV previa, lo que quizá tenga consecuencias en las diferentes guías de DM respecto a la elección del tratamiento antidiabético en este perfil de pacientes con DM y enfermedad CV previa. ■■ CONCLUSIONES DE LOS REVISORES Coincidentes con las de los autores. 18 NefroPlus 2016 Vol. 8 N.° 1 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA ■■ CLASIFICACIÓN Tema: Diabetes mellitus y riesgo CV Subtema: Nefrología clínica Tipo de artículo: Tratamiento Palabras clave: Diabetes mellitus. Empagliflozina. Inhibidores del cotransportador renal de glucosa. Riesgo cardiovascular NIVEL DE EVIDENCIA: Alto GRADO DE RECOMENDACIÓN: Fuerte (GRADE [www.gradeworkinggroup.org] divide la calidad de la evidencia en cuatro grupos: alta, moderada, baja y muy baja, y divide el grado de recomendación en dos grupos: fuerte y débil.) REFERENCIAS BIBLIOGRÁFICAS 1. Emerging Risk Factors Collaboration, Sarwar N, Gao P, Seshasai SR, Gobin R, Kaptoge S, et al. Diabetes mellitus, fasting blood glucose concentration and risk of vascular disease: a collaborative meta-analysis of 102 prospective Studies. Lancet 2010;375:2215-22. 2. Hayward RA, Reaven PD, Wiitala WL, Bahn GD, Reda DJ, Ge L, et al; VADT Investigators. Follow-up of glycemic control and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2015;372:2197-206. 3. Górriz JL, Nieto J, Navarro-González JF, Molina P, Martínez-Castelao A, Pallardó LM. Nephroprotection by hypoglycemic agents: do we have supporting data? J Clin Med 2015;4:1865-89. 4. Barnett AH, Mithal A, Manassie J, Jones R, Rattunde H, Woerle HJ, et al; EMPA-REG RENAL trial investigators. Efficacy and safety of e­ mpagliflozin added to existing antidiabetes treatment in patients with type 2 diabetes and chronic kidney disease: a randomized doubled-blind, ­placebo-controlled trial. Lancet Diabetes Endocrinol 2014;2:369-84. 5. Cherney DZ, Perkins BA, Soleymanlou N, Maione M, Lai V, Lee A, et al. Renal hemodynamic effect of sodium-glucose cotransporter 2 inhibition in patients with type 1 diabetes mellitus. Circulation 2014;129:587-97. 6. Inzucchi SE, Zinman B, Wanner C, Ferrari R, Fitchett D, Hantel S, et al. SLGT-2 inhibitors and cardiovascular risk: proposed pathways and review of ongoing outcome trials. Diab Vasc Dis Res 2015;12:90-100. 7. Zannad F, McMurray JJ, Krum H, van Veldhuisen DJ, Swedberg K, Shi H, et al; EMPHASIS-HF Study Group. Eplerenone in patients with systolic heart failure and mild symptoms. N Engl J Med 2011;364:11-21. NefroPlus 2016 Vol. 8 N.° 1 19 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA Efecto de la finerenona sobre la albuminuria en pacientes con nefropatía diabética. ¿Grandes esperanzas en tiempos difíciles? Bakris GL, Agarwal R, Chan JC, Cooper ME, Gansevoort RT, Haller H, et al; for the Mineralocorticoid Receptor Antagonist Tolerability Study-Diabetic Nephropathy (ARTS-DN) Study Group. Effect of finerenone on albuminuria in patients with diabetic nephropathy: a randomized clinical trial. JAMA 2015;314:884-94. Análisis crítico: Beatriz Fernández-Fernández, Alberto Ortiz Arduán Servicio de Nefrología. Hospital Universitario Fundación Jiménez Díaz. Madrid NefroPlus 2016;8(1):20-25 ■■ Objetivos e importancia del ensayo Los antagonistas de los receptores mineralocorticoides (ARM), añadidos a un inhibidor del sistema renina-angiotensina (iSRA), incrementan la reducción de proteinuria en pacientes con enfermedad renal crónica, pero son infrautilizados por riesgo de deteriorar la función renal, provocar hiperpotasemia y por el desconocimiento sobre los efectos a largo plazo sobre la función renal en pacientes con enfermedad renal crónica (ERC)1-3. El nuevo antagonista no esteroideo de receptor mineralocorticoide (ANERM), la finerenona (BAY948862), muestra una selectividad para el receptor mineralocorticoide mayor que la espironolactona y una afinidad superior a la eplerenona en estudios preclínicos3. En el ensayo clínico ARTS (Mineralocorticoid Receptor Antagonist Tolerability Study)4, la finerenona en dosis de 2,5 a 10 mg/día redujo la albuminuria en pacientes con ERC y fallo renal, con una menor incidencia de hiperpotasemia que la espironolactona. Con esta premisa se diseña ARTS-Diabetic Nephropathy (ARTS-DN), cuyo objetivo primario es evaluar la seguridad y eficacia de 7,5, 10, 15 y 20 mg orales al día de finerenona, durante 90 días, en pacientes con diabetes mellitus tipo 2 y albuminuria > 30 mg/g en tratamiento con iSRA (inhibidores de la enzima de conversión de la angiotensina [IECA] o antagonistas de los receptores de la angiotensina 2 [ARA2])3. La variable principal de valoración (primary end-point) medida fue la ratio de albuminuria-creatinina (UACR) tras 90 días de tratamiento comparado con la medida basal. Los objetivos de seguridad fueron cambios en el potasio sérico desde la situación basal y filtrado glomerular estimado. ■■ Tipo de diseño y seguimiento Ensayo clínico multicéntrico, aleatorizado, doble ciego, grupos paralelos, fase 2B diseñado para comparar el 20 NefroPlus 2016 Vol. 8 N.° 1 n n n efecto de la finerenona en dosis desde 1,25 a 20 mg una vez al día con placebo, añadido al tratamiento con iSRA (clinicaltrials.gov: NCT1874431). Ensayo realizado en 148 centros, desde junio de 2013 hasta febrero de 2014, completando el estudio en agosto de 2014. De 1.501 pacientes cribados, 823 fueron aleatorizados y 821 recibieron finerenona. Los pacientes elegibles se aleatorizaron en proporciones iguales, recibiendo finerenona 1,25 a 10 mg/día o placebo combinado con iSRA durante 90 días. Los pacientes que recibieron finerenona en dosis de 15 y 20 mg al día se añadieron según la recomendación de un comité de monitorización de datos independiente tras evaluar los datos de seguridad del estudio. La aleatorización se adaptó para alcanzar grupos proporcionalmente equilibrados, con unos 75 pacientes en cada grupo de tratamiento para el análisis completo (intención a tratar modificado). Se presupuso un máximo de 90 pacientes por grupo para aumentar los datos totales de seguridad en pacientes con albuminuria “muy elevada” (figura 1). La aleatorización se estratificó en función de la región y la magnitud de la albuminuria (elevada si UACR 30-300 mg/g o muy elevada si ≥ 300 mg/g). ■■ Pacientes Criterios de inclusión Diabetes mellitus tipo 2, albuminuria (ratio de albuminuria-creatinina ≥ 30 mg/g), filtrado glomerular estimado (FGe) > 30 ml/min/1,73 m2 (CKD-EPI), tratamiento con iSRA, potasio sérico ≤ 4,8 mmol/l ( cribado), si FGe (CKD-EPI) 30-45 ml/min/1,73m² tras tratamiento con diuréticos ahorradores de potasio en visita de cribado sin precisar ajustes desde 4 semanas antes. Criterios de exclusión Recibir eplerenona, espironolactona, inhibidor de la renina o diurético ahorrador de potasio que no se pudiera discontinuar en el período de preinclusión o de tratamiento. RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA 1.501 pacientes evaluados 687 pacientes excluidos 635 no cumplieron criterios de inclusión 37 declinaron participar 823 pacientes aleatorizados Placebo (96p) 4 DI: ✓ 3 EA ✓ 1 VP 1,25 mg F (96p) 6 DI: ✓ 5 EA ✓ 1 VP 2,5 mg F (92p) 5 DI: ✓ 4 EA ✓ 1 VP 5 mg F (100p) 1 pérdida 9 DI: ✓ 6 EA ✓ 1 VP ✓ 1 DMd ✓ 1 RC 7,5 mg F (97p) 6 DI: ✓ 5 EA ✓ 1 VP 10 mg F (98p) 8 DI: ✓ 2 EA ✓ 3 VP ✓ 1 DS ✓ 1 RC ✓ 1 NA 15 mg F (125p) 11 DI: ✓ 8 EA ✓ 2 VP ✓ 1 RC 20 mg F (119p) 7 DI: ✓ 2 EA ✓ 1 VP ✓ 2 RC ✓ 1 NA ✓ 1 Dificultad 90 p 90 p 87 p 90 p 91 p 90 p 114 p 112 p 94 AC 94 AS 81 APP 96 AC 96 AS 81 APP 92 AC 92 AS 79 APP 98 AC 100 AS 83 APP 96 AC 97 AS 80 APP 96 AC 98 AS 83 APP 123 AC 125 AS 99 APP 117 AC 119 AS 101 APP Figura 1. AC: conjunto de análisis completo; APP: conjunto de análisis por protocolo; AS: conjunto de análisis de seguridad; DI: descontinuación en la intervención; DS: decisión del sponsor; EA: eventos adversos; DMd: decisión médica; NA: no adhesión; RC: retirada de consentimiento informado; VP: violación de protocolo. ■■ Intervenciones Los participantes se asignaron aleatoriamente a finerenona, una dosis diaria, o placebo durante 90 días de la siguiente manera: –– Grupos de tratamiento: 1,25 mg/día, n = 96; 2,5 mg/día, n = 92; 5 mg/día, n = 100; 7,5 mg/día, n = 97; 10 mg/día, n = 98; 15 mg/día, n = 125, y 25 mg/día, n = 119. –– Grupo placebo (n = 94). ■■ Estadística El análisis de seguridad incluyó todos los pacientes aleatorizados que habían tomado al menos una dosis del fármaco del estudio y que tenían datos tras el tratamiento (figura 1). El conjunto de análisis completo consideró a todos los pacientes incluidos en el análisis de seguridad que tenían valores basales y al menos un valor posbasal de UACR. El análisis por protocolo se definió como todos los pacientes en el conjunto de análisis completo que tuvieron un valor válido de UACR en el día 90 sin desviación mayor del protocolo. Los datos de seguridad se evaluaron en el conjunto de análisis de seguridad. Todos los análisis se realizaron utilizando el tratamiento actual de cada paciente. El estudio tuvo potencia estadística para demostrar un efecto dependiente de la dosis de la variable principal de valoración (end-point) primaria. Se supuso para placebo una ratio de UACR entre la visita 5 y la visita basal de 0,91-0,95, mientras la disminución esperada del UACR con el incremento de la dosis de finerenona se esperaba en una ratio de 0,64 a 0,46 para 15 mg de finerenona. El tamaño muestral de 75 pacientes en cada grupo de tratamiento válidos para el análisis completo proveería un poder de al menos el 83 % para demostrar un efecto dependiente de la dosis de la variable primaria para 7 grupos de tratamiento (dosis hasta 15 mg/día) usando el contraste lineal L7’ = (4,714; 3,714; 2,714; 0,716; –1,286; –3,286; –7,286) con un nivel de significación de 0,05 (1 cola), suponiendo una desviación estándar común de 1,25 en la escala logarítmica y un contraste real del UACR transformado logarítmico de al menos 3,937. Se esperaba que el poder aumentara en el caso del grupo 8 de tratamiento (dosis de 20 mg/día). Así, teniendo en cuenta que se habían añadido dosis de 15 mg y 20 mg/día de finerenona, se requerían en total 600 pacientes. Asumiendo un fallo de cribado de hasta un 50 %, se adscribieron unos 1.500 pacientes en el ensayo clínico NefroPlus 2016 Vol. 8 N.° 1 21 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA ARTS-DN, 823 se aleatorizaron entre los grupos de tratamiento (estimando una tasa de abandono del 10 %). Se planeó aumentar el tamaño muestral si menos del 35 % de los pacientes aleatorizados se diagnosticaran de “albuminuria muy elevada”; por ello, realmente se aleatorizaron más de 670 pacientes. El logaritmo de la UACR se asumió como normalmente distribuido, por lo que el efecto del tratamiento que observaba el cambio en la UACR se evaluó en términos de la relación con la situación basal. Para el análisis primario, la dosis de dependencia se evaluó adecuándose un modelo de análisis de covarianza a la relación entre el logaritmo de UACR en el día 90 y el basal, incluyendo los factores de grupo de tratamiento, región y tipo de albuminuria y el logaritmo de UACR basal como covariable anidada dentro del tipo de albuminuria y prueba de contraste lineal preespecificado en 1 cola de nivel de significación de 0,05. Se realizaron comparaciones subsiguientes con pares jerárquicos con placebo. Mediante el método de última observación realizada (last observation carried forward o LOCF), el valor más alto de UACR de la medida de discontinuación prematura y la medida de seguimiento se utilizaron para atribuirlos a los valores perdidos en el día 90. Los análisis de sensibilidad por el método LOCF se realizaron para la variable de eficacia primaria repitiendo el análisis primario para otros métodos de atribución, incluyendo un análisis de casos observados (solo pacientes con valores de UACR disponibles en el día 90), un enfoque LOCF en el tratamiento (incluyendo datos previos a la visita de retirada prematura), un análisis de observación basal prospectivo (atribuyendo el valor basal para los datos perdidos), un valor medio atribuible (imputando el valor de la variable principal de eficacia por el valor medio de los mínimos cuadrados del análisis de eficacia primaria), una atribución al azar (imputando el valor de la variable primaria de eficacia por un número aleatorio desde una distribución normal con mínimos cuadrados, media y varianza de la estadística descriptiva) y una imputación múltiple post hoc. Se calculó un análisis del modelo de covarianza para la ratio del logaritmo de UACR en el día 90 con los mismos factores que para el análisis primario más factores para la interacción entre el grupo de tratamiento y la región y entre el grupo de tratamiento y el tipo de albuminuria. Como análisis post hoc se calcularon en todos los grupos de tratamiento los coeficientes de correlación de Pearson entre la ratio de UACR en el día 90 y la basal, el cambio en la tensión arterial sistólica desde el basal al día 90 y el cambio en FGe desde el basal al día 90. Un análisis post hoc examinó la proporción de pacientes con una disminución UACR ≥ 30 %, ≥ 40 % y ≥ 50 % del valor basal en cada visita. Los pacientes con ERC estadio 3 también se analizaron para evaluar cambios en el potasio sérico y la FGe. Además, se realizó análisis post hoc de iSRA basal y las dosis de IECA y ARA2 se categorizaron. ■■ RESULTADOS PRINCIPALES De 1.501 pacientes seleccionados, 823 pacientes se aleatorizaron y 764 pacientes completaron el tratamiento (93 %) (figura 1). La edad media fue de 64,2 años y el 78 % de los pacientes eran varones. Basalmente, 301 pacientes (36,7 %) de los tratados tenían albuminuria muy elevada (UACR > 300 mg/g) y 328 (40 %) tenían FGe ≤ 60 ml/min/1,73 m². Un 45 % de los pacientes recibían IECA y un 25 % recibían iSRA por debajo (2,6 %) o en la dosis mínima recomendada (24,8 %), según las recomendaciones de las guías KDOQI5. Variable principal de studio (primary end-point) El análisis de covarianza demostró una relación entre las dosis estudiadas y la UACR, variable principal de estudio. La media de las ratios de UACR corregidas para placebo en el día 90 frente a la basal de finerenona a las dosis de 7,5, 10, 15 y 20 mg/día fue 0,79 (intervalo de confianza [IC] del 90 % 0,68-0,91; p = 0,0004); 0,76 (IC 90 % 0,65-0,88; p = 0,001); 0,67 (IC 90 % 0,68-0,91; p = 0,004) y 0,62 (IC 90 % 0,54-0,72; p < 0,001), respectivamente. La menor ratio se observó en el día 60 y aumentó discretamente el día 90 en el grupo tratado con 10 mg. Los resultados del análisis post hoc mediante imputación múltiple no se diferenciaron de los del método LOCF. Variable secundaria de estudio (secondary end-point) La variable secundaria preespecificada de ratio de UACR corregida con placebo basalmente frente a 30, 60 y 90 días descendió para los grupos de 7,5, 15 y 20 mg/día. La ratio inferior se observó en el día 60 y aumentó discretamente el día 90 para el resto de los grupos. A pesar de que el test exploratorio de interacción entre la región o magnitud de la albuminuria al cribado y grupo de tratamiento según cambios en la UACR no indicó interacción, hubo un menor efecto de tratamiento en el grupo de albuminuria “muy elevada” en comparación con el de albuminuria “elevada”. 22 NefroPlus 2016 Vol. 8 N.° 1 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA Se observó un descenso de UACR de al menos el 50 % desde el basal al día 90 en el 13,6 % de los pacientes en el grupo de placebo y en 17,2 %, 17,2 %, 33,6 % y 40,2 % en los grupos de finerenona de 7,5, 10, 15 y 20 mg/día. Variables de eficacia y seguridad Filtrado glomerular estimado (FGe). Los valores fueron −1,8 (IC 95 % −4,4-0,8) ml/min/1,73m²; −2,6 (IC 95 % −5,1 a −0,04) ml/min/1,73 m²; −2,2 (IC 95 % −4,6-0,2) ml/min/1,73 m² y −2,4 (IC 95 % −4,9-0,0) ml/min/1,73 m2 en finerenona 7,5, 10, 15 y 20 mg/día, respectivamente. Los cambios producidos en el grupo de finerenona fueron reversibles tras 30 días de completarse el tratamiento en la evaluación del seguimiento (día 120). La incidencia de descenso de FGe > 40 % tras el basal fue similar en el grupo de placebo y el de finerenona 1,25, 7,5, 10, 15 y 20 mg/día, no observándose ningún caso en el grupo de 2,5 y 5 mg/día. No hubo descensos del FGe superiores al 57 %. Eventos adversos No hubo diferencias significativas en la incidencia global de eventos adversos y eventos adversos serios entre los grupos de finerenona y placebo; tampoco las hubo entre las distintas dosis de finerenona, ocurriendo eventos adversos serios en el 1,5 % de los pacientes que recibieron finerenona. De los 821 pacientes en tratamiento, solo 12 (1,5 %) tuvieron incrementos en el potasio sérico por encima de 5,6 mmol/l, lo que llevó a una discontinuación del fármaco. La incidencia global para los grupos de 7,5 a 20 mg/día (grupos en los que se observó cambio significativo de la UACR) fue de 1,8 %. En un análisis post hoc en pacientes con enfermedad renal estadio 3 al inicio, la incidencia de potasio sérico ≥ 5,6 mmol/l fue 2,7 %, 5,4 %, 4,1 % y 6,3 % en los grupos con finerenona 1,25, 7,5, 15 y 20 mg/día, respectivamente, sin casos en el grupo placebo, ni en los grupos de 2,5, 5 y 10 mg/día. No hubo casos de niveles de potasio sérico > 6 mmol/l. Con respecto a la tensión arterial, la diferencia en las medias de mínimos cuadrados corregidos por placebo en la tensión arterial sistólica desde el basal al día 90 en los grupos con finerenona 7,5, 10, 15 y 20 mg/día fue de –2,8 (IC 95 % –6,5 a –0,8) mmHg; 0,1 (IC 95 % –3,5 a –3,8) mmHg; –5,1 (IC 95 % –8,5 a –1,7) mmHg y –4,7 (IC 95 % –8,2 a –1,3) mmHg, respectivamente. El análisis post hoc mostró correlación transversal no significativa entre todos los grupos de tratamiento entre el UACR y el cambio en la tensión arterial sistólica o cambio en el FGe desde el basal al día 90 de tratamiento. ■■ COMENTARIOS DE LOS AUTORES. DISCUSIÓN Análisis retrospectivos realizados en diversos ensayos clínicos demuestran una relación entre la cuantía de la reducción de la albuminuria y la progresión de la nefropatía diabética y la reducción de los eventos cardiovasculares3,6,7. Añadir antagonistas esteroideos de receptores mineralocorticoides (AERM) al tratamiento convencional con iSRA reduce la albuminuria, pero existe déficit de estudios prospectivos que evalúen los efectos a largo plazo de los ARM en la progresión de la ERC secundaria a nefropatía diabética, por el riesgo de hiperpotasemia y deterioro de la función renal2,8,9. El ensayo ARTS-DN evalúa los efectos de la finerenona combinada con iSRA en la nefropatía diabética, evaluando las dosis óptimas3. Al inicio del estudio todos los pacientes recibían iSRA. La finerenona redujo significativamente, entre el 21 % y el 38 % en los grupos de tratamiento de 7,5 a 20 mg al día3, el UACR a los 90 días de tratamiento (dosis dependiente). Existen datos contradictorios con respecto al incremento de incidencia de hiperpotasemia en pacientes con nefropatía diabética que recibían AERM e iSRA comparados con iSRA solos, con datos que indican incremento de los niveles de potasio sérico con espironolactona8,9, mientras que otros estudios muestran reducción media de UACR con baja incidencia de hiperpotasemia con eplerenona10. En la nefropatía diabética avanzada, VA NEPHRON-D y ALTITUDE mostraron que la combinación de dos iSRA, aunque redujeran la albuminuria, causaban hiperpotasemia y disminución de la función renal11,12. En el ensayo ARTS-DN, el 1,8 % de los pacientes tratados con dosis de 7,5 a 20 mg/día tuvieron hiperpotasemia, mientras que no la hubo en ningún paciente con placebo. De los tres casos de hiperpotasemia > 6 mmol/l, dos ocurrieron con dosis de 1,25 mg de finerenona y uno con dosis de 15 mg. La falta de descenso significativo de FGe puede favorecer la menor incidencia de hiperpotasemia; además, se excluyeron pacientes con valores de potasio > 4,8 mmol/l en el cribado1,3. NefroPlus 2016 Vol. 8 N.° 1 23 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA La reducción significativa de UACR en los pacientes que recibieron finerenona, combinado con un perfil de seguridad similar a los que recibían placebo, lleva a los autores a proponer estudios de mayor duración, con evaluación del impacto sobre el FGe. Hubo una pobre reducción de la tensión arterial en la dosis más elevada de finerenona tanto en el ARTS4 como en el ARTS-DN3. Otros estudios han mostrado descensos de la tensión arterial tras 3 meses con AERM2. Este efecto en la tensión arterial podría estar relacionado con la capacidad de los ARM para cruzar la barrera hematoencefálica, actuando como ARM centrales13, lo que no ocurriría con la finerenona, que no se ha encontrado en el cerebro de modelos animales en estudios experimentales14. Aunque se trata de un estudio multicéntrico aleatorizado, con amplio número de pacientes y pocas pérdidas, es un estudio de dosis, por lo que carece de grupo control activo, como limitación principal. El 60 % de los pacientes tenía FGe > 60 ml/min/1,73 m², lo que implica una limitación, por menor riesgo de hiperpotasemia. Además, la albuminuria no es válida como marcador subrogado para eventos renales como tiempo hasta la llegada a diálisis. El estudio tiene una duración corta y no permite la valoración de los efectos a largo plazo de la finerenona en la progresión de la ERC o la evaluación de los efectos antifibróticos y antiinflamatorios. Los autores concluyen que entre los pacientes con nefropatía diabética, añadir finerenona al tratamiento con IECA o ARA2 produce una mejoría de la UACR en comparación con el placebo. Se necesitarán más ensayos que comparen la finerenona con otras medicaciones. ■■ COMENTARIOS DE LOS REVISORES Los antagonistas de los receptores mineralocorticoides añadidos a iSRA han demostrado previamente descender la mortalidad en pacientes con fallo cardíaco14,15. Es bien sabido que el bloqueo dual del sistema renina-angiotensina disminuye la albuminuria tanto en pacientes con nefropatía diabética como en aquellos con otras enfermedades renales16,17, pero el efecto a largo plazo no se conoce, y existe riesgo de hiperpotasemia en pacientes diabéticos bajo tratamiento con espironolactona y eplerenona. La finerenona es un antagonista no esteroideo del receptor mineralocorticoide altamente selectivo, con una distribución distinta en los órganos. En las ratas, la finerenona disminuye el daño estructural y funcional con menos alteraciones electrolíticas que la eplerenona18; ya en el ensayo ARTS, los pacientes con fallo cardíaco disminuyeron tanto la albuminuria como el BNP, con menos aumento de potasio4,19. Por tanto, el ensayo ARTS-DN corrobora el hallazgo de su predecesor, descendiendo la albuminuria, tanto en niveles altos como muy altos de excreción de albúmina urinaria, con un buen perfil de seguridad, pocos efectos adversos y buena tolerancia del fármaco. Dentro del análisis estadístico del ensayo se ha añadido un procedimiento de imputación múltiple, que ha demostrado ser la mejor opción para solventar el problema de los datos perdidos. El problema de estos métodos es que son poco robustos, con selección de las variables de análisis muy rígida, y no siempre resuelven la estructura de los datos cuando existen variables de confusión. De hecho, aunque los datos perdidos son frecuentes en la investigación clínica, estos métodos pueden inducir sesgo en el análisis de datos, disminuyendo el poder del estudio, aunque en este caso los autores se aseguran un poder adecuado; habría que realizar mayores estudios para asegurar conclusiones certeras20. Con respecto al riesgo de hiperpotasemia, no parece que en este caso se trate de un efecto dependiente de la dosis, como suele ocurrir en los AERM, sino que el riesgo se mantiene bajo tanto en dosis bajas como en las más elevadas. No obstante, el riesgo de hiperpotasemia es superior en diabéticos y en pacientes con baja tasa de filtrado glomerular, por lo que el uso de AERM no está permitido en la enfermedad renal crónica avanzada21. En este caso, basalmente alrededor del 40 % de los pacientes tenían FGe < 60 ml/min/1,73 m2, restringiéndose además los niveles basales de potasio sérico, que debían ser < 4,8 mmol/l. El estudio tiene una duración corta, y es complejo predecir el componente multifactorial de la hiperpotasemia, que puede no solo estar relacionado con la disminución de las pérdidas renales, sino también con la disposición transcelular y la homeostasis extrarrenal de potasio19,22. Por tanto, aunque el estudio post hoc en pacientes con deterioro de la función renal no mostró empeoramiento de la función renal ni aumento de la hiperpotasemia, se necesita un mayor tiempo de seguimiento para determinar la aparición de efectos secundarios graves en población con ERC avanzada. 24 NefroPlus 2016 Vol. 8 N.° 1 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA ■■ CONCLUSIONES DE LOS REVISORES La finerenona ha mostrado ser segura y eficaz en pacientes con nefropatía diabética en tratamiento con iSRA, consiguiendo descensos significativos de la albuminuria sin incrementar sustancialmente los niveles de potasio sérico ni deteriorar la función renal. Son necesarios estudios prospectivos y aleatorizados de larga duración para confirmar si la eficacia y seguridad se mantienen a largo plazo y también para evaluar un posible efecto sobre la progresión de la ERC. REFERENCIAS BIBLIOGRÁFICAS 1. Lazich I, Bakris GL. Prediction and management of hyperkalemia across the spectrum of chronic kidney disease. Semin Nephrol 2014;34:333-9. 2. Bolignano D, Palmer SC, Navaneethan SD, Strippoli GF. Aldosterone antagonists for preventing the progression of chronic kidney disease. Cochrane Database Syst Rev 2014;4:CD007004. 3. Bakris GL, Agarwal R, Chan JC, Cooper ME, Gansevoort RT, Haller H, et al; Mineralocorticoid Receptor Antagonist Tolerability Study–Diabetic Nephropathy (ARTS-DN) Study Group. Effect of Finerenone on Albuminuria in Patients With Diabetic Nephropathy: A Randomized Clinical Trial. JAMA 2015;314:884-94. 4. Pitt B, Kober L, Ponikowski P, Gheorghiade M, Filippatos G, Krum H, et al. Safety and tolerability of the novel non-steroidal mineralocorticoid receptor antagonist BAY 94-8862 in patients with chronic heart failure and mild or moderate chronic kidney disease: a randomized, double-blind trial. Eur Heart J 2013;34:2453-63. 5. KDOQI. KDOQI Clinical Practice Guidelines and Clinical Practice Recommendations for Diabetes and Chronic Kidney Disease. Am J Kidney Dis 2007;49(2 Supl 2):S12-154. 6. De Zeeuw D, Remuzzi G, Parving HH, Keane WF, Zhang Z, Shahinfar S, et al. Albuminuria, a therapeutic target for cardiovascular protection in type 2 diabetic patients with nephropathy. Circulation 2004;110:921-7. 7. Holtkamp FA, de Zeeuw D, de Graeff PA, Laverman GD, Berl T, Remuzzi G, et al. Albuminuria and blood pressure, independent targets for cardioprotective therapy in patients with diabetes and nephropathy: a post hoc analysis of the combined RENAAL and IDNT trials. Eur Heart J 2011;32:1493-9. 8. Mavrakanas TA, Gariani K, Martin PY. Mineralocorticoid receptor blockade in addition to angiotensin converting enzyme inhibitor or angiotensin II receptor blocker treatment: an emerging paradigm in diabetic nephropathy: a systematic review. Eur J Intern Med 2014;25:173-6. 9. Mehdi UF, Adams-Huet B, Raskin P, Vega GL, Toto RD. Addition of angiotensin receptor blockade or mineralocorticoid antagonism to maximal angiotensin-converting enzyme inhibition in diabetic nephropathy. J Am Soc Nephrol 2009;20:2641-50. 10. Epstein M, Williams GH, Weinberger M, Lewin A, Krause S, Mukherjee R, et al. Selective aldosterone blockade with eplerenone reduces albuminuria in patients with type 2 diabetes. Clin J Am Soc Nephrol 2006;1:940-51. 11. Parving HH, Brenner BM, McMurray JJ, de Zeeuw D, Haffner SM, Solomon SD, et al; ALTITUDE Investigators. Cardiorenal end points in a trial of aliskiren for type 2 diabetes. N Engl J Med 2012;367:2204-13. 12. Fried LF, Emanuele N, Zhang JH, Brophy M, Conner TA, Duckworth W, et al; VA NEPHRON-D Investigators. Combined angiotensin inhibition for the treatment of diabetic nephropathy. N Engl J Med 2013;369:1892-903. 13. Gómez-Sánchez EP, Gómez-Sánchez CE. Central regulation of blood pressure by the mineralocorticoid receptor. Mol Cell Endocrinol 2012;350:289-98. 14. Pitt B, Zannad F, Remme WJ, Cody R, Castaigne A, Perez A, et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators. N Engl J Med 1999;341:709-17. 15. Delyani JA. Mineralocorticoid receptor antagonists: the evolution of utility and pharmacology. Kidney Int 2000;57:1408-11. 16. Ando K, Ohtsu H, Uchida S, Kaname S, Arakawa Y, Fujita T; EVALUATE Study Group. Anti-albuminuric effect of the aldosterone blocker eplerenone in non-diabetic hypertensive patients with albuminuria: a double-blind, randomised, placebo-controlled trial. Lancet Diabetes Endocrinol 2014;2:944-53. 17. Rossing K, Schjoedt KJ, Smidt UM, Boomsma F, Parving HH. Beneficial effects of adding spironolactone to recommended antihypertensive treatment in diabetic nephropathy: a randomized, double-masked, cross-over study. Diabetes Care 2005;28:2106-12. 18. Kolkhof P, Delbeck M, Kretschmer A, Steinke W, Hartmann E, Bärfacker L, et al. Finerenone, a novel selective nonsteroidal mineralocorticoid receptor antagonist protects from rat cardiorenal injury. J Cardiovasc Pharmacol 2014;64:69-78. 19. Esteras R, Pérez-Gómez MV, Rodríguez-Osorio L, Ortiz A, Fernández-Fernández B. Combination use of medicines from two classes of renin-­ angiotensin system blocking agents: risk of hyperkalemia, hypotension, and impaired renal function. Ther Adv Drug Saf 2015;6:166-76. 20. Newgard CD, Lewis RJ. Missing Data: How to best account for what is not known. JAMA 2015;314:940-1. 21. Makani H, Bangalore S, Desouza KA, Shah A, Messerli FH. Efficacy and safety of dual blockade of the renin-angiotensin system: meta-analysis of randomised trials. BMJ 2013;346:f360. 22. Preston RA, Afshartous D, Garg D, Medrano S, Alonso AB, Rodríguez R. Mechanisms of impaired potassium handling with dual renin-angiotensin-aldosterone blockade in chronic kidney disease. Hypertension 2009;53:754-60. NefroPlus 2016 Vol. 8 N.° 1 25 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA ESTUDIO CAPTAIN. Efectos de suspender o continuar tratamiento con bloqueantes del sistema renina-angiotensina en pacientes con insuficiencia renal crónica que van a ser sometidos a cateterismo cardíaco: resultados del uso de IECA/ARA2 y nefropatía inducida por contraste en pacientes sometidos a cateterismo cardíaco Bainey KR, Rahim S, Etherington K, Rokoss ML, Natarajan MK, Velianou JL, et al. Effects of withdrawing vs continuing renin-angiotensin blockers on incidence of acute kidney injury in patients with renal insufficiency undergoing cardiac catheterization: Results from the Angiotensin Converting Enzyme Inhibitor/Angiotensin Receptor Blocker and Contrast Induced Nephropathy in Patients Receiving Cardiac Catheterization (CAPTAIN) trial. Am Heart J 2015;170:110-6. Análisis crítico: Esther Rubio González, José María Portolés Pérez Unidad de Nefrología. Hospital Universitario Puerta de Hierro Majadahonda. Madrid NefroPlus 2016;8(1):26-28 ■■ Objetivo Determinar si mantener el tratamiento con inhibidores del sistema renina-angiotensina (ISRAA) antes de la realización de un cateterismo cardíaco reduce la incidencia de fracaso renal agudo (FRA) por nefropatía por contraste en pacientes con enfermedad renal crónica. ■■ Tipo de diseño y seguimiento Estudio piloto prospectivo, aleatorizado de grupos paralelos, realizado en un único centro. Período del estudio: desde julio de 2006 hasta marzo de 2012. Registrado en clinicaltrials.gov:NCT0031252. ■■ Asignación Aleatorizado en proporción 1:1. Método de aleatorización: sistema informático central. ■■ Pacientes Criterios de inclusión –– Pacientes que acudían al Hamilton General Hospital para realizarse un cateterismo cardíaco diagnóstico o terapéutico y que estaban siendo tratados con inhibidores de la enzima de conversión de la angiotensina (IECA) o antagonistas de los receptores de la angiotensina 2 (ARA2) al menos 24 horas antes de su inclusión. –– Evidencia de enfermedad renal crónica definida esta por el valor documentado de creatinina sérica > 1,7 mg/dl 3 meses antes y/o creatinina sérica > 1,5 mg/dl al menos una semana antes. Criterios de exclusión –– Se excluyeron los pacientes con trasplante renal o enfermedad renal crónica estadios 4 y 5 o en diálisis. 26 NefroPlus 2016 Vol. 8 N.° 1 n n n –– Realización urgente del cateterismo que no permitiera tiempo suficiente para la suspensión del fármaco. –– Pacientes con edema agudo de pulmón. ■■ Intervenciones Los 208 pacientes incluidos se aleatorizaron en dos grupos: –– Grupo de mantenimiento IECA/ARA2 para mantener el tratamiento (IECA/ARA2) de forma continua: n = 102. –– Grupo de suspensión de tratamiento (IECA/ARA2) al menos 24 horas antes del procedimiento y reintroducido a las 96 horas postratamiento: n = 106. Ambos grupos recibieron premedicación con suero salino (3 ml/kg/h una hora antes de la exposición al contraste y 1 ml/kg/h durante las 6 horas posteriores). Todos recibieron n-acetilcisteína 600 mg dos veces al día por vía oral antes y después del procedimiento. Con todos ellos se contactó telefónicamente 24 horas antes del cateterismo para suspender tratamientos con antiinflamatorios no esteroideos y/o metformina si la estaban tomando. Asimismo, se les recordó la indicación de continuar o discontinuar con ISRAA y de tomar la n-acetilcisteína. ■■ Variables de resultado Variable principal Incidencia de FRA inducido por contraste yodado, ­definido como elevación de las cifras de creatinina ≥ 0,5 mg/dl sobre la basal y/o elevación relativa de creatinina ≥ 25 % del basal en cualquier momento entre las 48 y 96 horas postexposición. Variable secundaria RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA Elevación bruta en las cifras de creatinina en ambos grupos tras el procedimiento respecto a su valor basal. Aparición de eventos tras el procedimiento Muerte, infarto de miocardio, ictus, insuficiencia cardíaca congestiva, reingreso hospitalario o necesidad de diálisis en las 72 horas tras el procedimiento. ■■ Tamaño muestral El estudio alcanza un tamaño muestral estimado de 200 pacientes en asignación 1:1, para encontrar una diferencia del 50 % de reducción del riesgo relativo de FRA por contraste, con una potencia estadística del 80 % y un error tipo 1 bilateral del 5 %. ■■ Análisis estadístico Muestra estimada de 200 pacientes para demostrar un 50 % de reducción del riesgo relativo de FRA inducido por contraste. Análisis por intención de tratar en población definida como todo paciente aleatorizado sobre el que se realizan dos mediciones de la variable principal. La tasa de eventos en ambos grupos se comparó utilizando x2 o test exacto de Fisher. ■■ Promoción y conflicto de intereses Se declaró ausencia de soporte financiero o de conflicto de intereses por parte de los autores. ■■ RESULTADOS Análisis de los grupos Los 208 pacientes estudiados completaron el período de estudio. No existían diferencias estadísticamente significativas en cuanto a edad y sexo, historia de diabetes, hipertensión, alteración hepática o fracción de eyección. En cuanto a los fármacos asociados, no existían tampoco diferencias en la toma de diuréticos, estatinas, betabloqueantes o antiagregantes plaquetarios. Sí parece haber mayores requerimientos de insulina en los pacientes diabéticos del grupo que no suspendió el fármaco. No había diferencias en cuanto a las cifras de creatinina en ambos grupos antes del procedimiento. Ambos grupos recibieron volúmenes similares de contraste y no hubo diferencias en cuanto a la técnica realizada ni las cifras de tensión arterial durante la misma (tabla 1). Tabla 1 Variable Mantiene tratamiento Suspende tratamiento p Principal: aparición de FRA 18,4 % 10,9 % 0,16 Secundaria: elevación media de creatinina 0,3 ± 0,5 mg/dl 0,1 ± 0,3 mg/dl 0,03 Clínica: 72 horas de seguimiento 3,9 % eventos: –– 1 fallecido –– 1 ictus –– 3 reingresos causa cardiovascular 0% Ninguno 0,05 Seguridad: ICC o HTA (TAS > 160 mmHg o TA > 95 mmHg) 19,6 % 10,4 % 0,06 Elevación de creatinina según subgrupos por riesgo Mehnran Moderado-alto (6-10) 0,3 ± 0,4 mg/dl 0,1 ± 0,2 mg/dl 0,01 Alto (> 10) 0,4 ± 0,7 mg/dl 0,2 ± 0,2 mg/dl 0,02 FRA: fracaso renal agudo; HTA: hipertensión arterial; TA: tensión arterial; TAS: tensión arterial sistólica. Análisis por subgrupos En las características basales de los pacientes no se encontraron diferencias entre el riesgo de presentar nefropatía por contraste utilizando el score de Mehnran. Sin embargo, en pacientes con un riesgo moderado-alto (6-10), la elevación de las cifras de creatinina era superior en el grupo que continuó tratamiento frente al grupo que lo suspendió (p = 0,01). Estos resultados son similares al seleccionar pacientes con un riesgo alto de desarrollar nefropatía por contraste según ese mismo score (> 10). Estos resultados son extrapolables cuando utilizan fórmulas de estimación del filtrado glomerular (Cockcroft-Gault o MDRD). NefroPlus 2016 Vol. 8 N.° 1 27 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA ■■ CONCLUSIONES DE LOS AUTORES En los pacientes con enfermedad renal crónica moderada que van a ser sometidos a un cateterismo cardíaco, suspender el tratamiento con IECA/ARA2 no se relaciona con una reducción de la incidencia de FRA en comparación con mantener dicho tratamiento. Sin embargo, suspender los IECA/ARA2 produce una elevación significativamente menor de las cifras de creatinina después del cateterismo. Esta intervención tan barata se debe considerar en la preparación del paciente antes de este procedimiento. ■■ COMENTARIOS DE LOS REVISORES La incidencia de FRA inducido por contraste (NIC) es muy variable según la población de referencia y los factores de riesgo del paciente. En la población general se ha descrito una incidencia del 0,6-2,3 %, que puede alcanzar el 6,1-8,5 % en pacientes con insuficiencia renal. En pacientes a los que se les realiza un procedimiento de intervencionismo coronario percutáneo de carácter urgente por un síndrome coronario agudo, la incidencia alcanza el 12 %. En pacientes hospitalizados, con comorbilidad y alto riesgo, puede alcanzar el 38 % según las series. El FRA secundario a NIC suele ser reversible, con un pico de creatinina sérica en torno al segundo o cuarto día, que recupera habitualmente los valores normales en menos de 2 o 3 semanas; sería interesante saber cómo se comportó la función renal en los pacientes que se incluyeron en el estudio y volvieron a su tratamiento habitual pasado un mes. Los factores implicados en el desarrollo de IRA tras un procedimiento de revascularización coronaria percutánea incluyen no solo la nefrotoxicidad del contraste, sino factores hemodinámicos, toxicidad de otros fármacos o ateroembolias. Llama la atención que en el grupo que continúa tratamiento hay mayor número de eventos cardiovasculares posprocedimiento (aunque sin significación estadística), mayor incidencia de ICC y elevación de las cifras de presión arterial, por lo que la elevación de las cifras de creatinina podría estar en relación con otros factores diferentes a la exposición al contraste y/o el uso de ISRAA. Suspender los fármacos ISRAA en pacientes con IRC condiciona cambios hemodinámicos intraglomerulares que mejoran las cifras de creatinina por aumento del filtrado glomerular independientemente de otros factores. Por este motivo, es difícil saber si ese menor descenso de las cifras de creatinina en los pacientes que suspenden la medicación hubiera sido igual hubieran recibido o no contraste. En un artículo realizado en enfermos con insuficiencia renal crónica avanzada, Ahmed et al objetivaron que la retirada de los fármacos ISRAA se asoció a una mejoría relevante y persistente de la función renal, con un aumento del filtrado glomerular superior al 25 % en el 61,5 % de los casos estudiados. ■■ CONCLUSIONES DE LOS REVISORES El estudio no consigue demostrar que la suspensión de fármacos ISRAA previa a la realización de un cateterismo cardíaco disminuya la incidencia de FRA por NIC. El menor deterioro de creatinina que se asocia a la suspensión de estos fármacos tiene una relevancia clínica muy relativa. Por ello, no se debe recomendar la retirada sistemática de ISRAA antes del cateterismo coronario. Sin embargo, teniendo los objetivos secundarios alcanzados (menor incidencia de ICC y niveles de creatinina) podría considerarse la suspensión de ISRAA, sobre todo en pacientes de alto riesgo renal, en cuyo caso no se deberían volver a introducir hasta el restablecimiento de su función renal previa. Son necesarios estudios de más potencia y seguimiento clínico más detallado para establecer una recomendación firme de suspender temporalmente los ISRAA antes de cada procedimiento. 28 NefroPlus 2016 Vol. 8 N.° 1 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA La terapia multidiana en el tratamiento de inducción de la nefritis lúpica, ¿incrementa la probabilidad de alcanzar una remisión? Liu Z, Zhang H, Liu Z, Xing C, Fu P, Ni Z, et al. Multitarget therapy for induction treatment of lupus nephritis. A randomized trial. Ann Intern Med 2015;162:18-26. Análisis crítico: Mª Adoración Martín-Gómez1, Miguel Ángel Frutos Sanz2 1 Unidad de Nefrología. Hospital de Poniente. El Ejido 2 Servicio de Nefrología. Hospital Regional Universitario de Málaga. Málaga NefroPlus 2016;8(1):29-32 ■■ Objetivo Valorar la eficacia y seguridad de una triple terapia multidiana con micofenolato de mofetilo (MMF), tacrolimus (TAC) y corticoides comparado con pulsos de ciclofosfamida intravenosa (CFiv) y corticoides en tratamiento de inducción para pacientes con nefritis lúpica (NL). ■■ Tipo de diseño y seguimiento Ensayo clínico multicéntrico. Prospectivo, aleatorizado, abierto. Registrado en clinicaltrials.gov: NCT008766166. Seguimiento de 24 semanas. Evaluación de los pacientes basal, semanas 2, 4 y cada 4 semanas hasta la semana 24. ■■ Asignación Aleatorización 1:1 estratificada por centros mediante software. Los investigadores de cada centro recibieron sobres numerados con el tratamiento asignado que se abrían a medida que el paciente iba firmando el consentimiento informado. ■■ Pacientes Criterios de inclusión Adultos de 18-65 años, ambos sexos, seguidos en 26 centros renales en China. Todos con biopsia renal y NL III, IV y/o V (ISN/RPS 2003) realizada hasta 6 meses antes de la aleatorización y con proteinuria al menos de 1,5 g/día. Criterios de exclusión Creatinina sérica > 3 mg/dl, índice de cronicidad biopsia > 3, tratamiento previo con MF, CF, TAC, ciclosporina o elevadas dosis de 6-metilprednisolona, plasmaféresis, inmunoglobulina intravenosa o tratamiento sustitutivo renal en los 3 meses previos. Hepatopatía o infección activa, entre otros. ■■ Intervenciones Se distribuyeron aleatoriamente 368 pacientes. Ambos grupos recibieron pulsoterapia con 6-metilprednisolona (6-MP) 500 mg/día durante 3 días consecutivos se- guidos de prednisona oral a dosis de 0,6 mg/kg/día durante las siguientes 4 semanas; se realizó la reducción posterior hasta alcanzar dosis de mantenimiento de 10 mg/día. Tras las 3 dosis de 6-MP, se dividieron los grupos y el brazo multidiana recibió 0,5 g/12 h de MMF + 2 mg/12 h de TAC (posteriormente según los niveles) y el brazo de CFiv, 0,75 g/m2 i.v. Las dosis posteriores se ajustaron entre 0,5-1 g/m2 cada 4 semanas durante 6 meses. ■■ Tratamiento de los resultados Fueron analizados por el Comité de Resultados Clínicos, enmascarados para el régimen de tratamiento. Variable de resultado principal Incidencia de remisión completa (RC) a los 6 meses del inicio del tratamiento, definida como proteinuria de 0,4 g/día o menor; sedimento inactivo, albúmina ≥ 3,5 g/dl y creatinina sérica normal. Variables de resultado secundarias –– Incidencia de respuesta global (RG) (suma de remisión completa y remisión parcial, definida esta última como reducción del 50 % de la proteinuria, proteinuria < 3,5 g/día, albúmina > 3 g/dl, y creatinina sérica normal o con incremento menor del 25 % de la creatinina basal). –– Tiempo hasta alcanzar la RG. –– Incidencia de RC y RG según las diferentes clases de NL. –– Intensidad de cambio de proteinuria, creatinina, albúmina, filtrado glomerular, SLEDAI, C3, C4, anti­ DNA. –– Tasa de reacciones adversas (RAM). ■■ Estadística Estudio de no superioridad del tratamiento multidiana frente a CFiv. Partiendo, según lo publicado, de una incidencia del 20 % de RC con CF a los 6 meses, se asume un aumento de un 15 % en esta incidencia con la terapia multidiana con un valor para alfa del 0,05 y una potencia del 80 %, necesitando una muestra de 362 pacientes que se alcanzó (181 por grupo). Análisis NefroPlus 2016 Vol. 8 N.° 1 29 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA por intención de tratar en todo paciente aleatorizado que hubiera recibido, al menos, una dosis de la medicación en estudio. Se analizaron las variables categóricas con el test de Fisher y las continuas con el test t de Student o los tests de Wilcoxon (rango de signos y suma de rangos), si la distribución fue sesgada. Mediante curvas de supervivencia de Kaplan-Meier se estimó la probabilidad acumulada de RC y de RG, así como la mediana de tiempo de RG; las diferencias entre los grupos se contrastaron con el test de log- rank. Se utilizó el método de imputación múltiple para valores no disponibles y el modelo de fragilidad para ajuste por centro. ■■ Promoción Financiado por el Programa Nacional de Investigación Básica de China y el National Key Technology R&D Program, pero no participaron en el diseño, colección, manejo, análisis ni interpretación de datos o resultados. Tampoco en la elaboración ni revisión del manuscrito. ■■ RESULTADOS PRINCIPALES Completaron las 24 semanas del estudio 155 pacientes de cada grupo, siendo la mediana de seguimiento de 12 y 6,6 meses respectivamente para multidiana y CF. Los niveles de TAC observados fueron de 5,50 ng/ml de media, con una dosis media de 3,60 mg/día, la dosis de MMF diaria fue de 1 g/día y la de CFiv, de 1,11 g/mes. La dosis de prednisona no varió entre grupos. Características basales de los grupos Siendo los grupos homogéneos, la media de edad al diagnóstico fue de 32 años, 91 % mujeres. Forma de presentación: proteinuria 2,58 g/dl (2,34-5,44), albúmina 2,56 g/dl (21-31), creatinina sérica 0,80 mg/dl (0,64-1,05), eGFR < 60 ml/min/1,73 m2 en el 21 % (solo 2,5 % < 30 ml/min/1,73 m2), HTA 30 %, hemoglobina media 10,2 ± 18,11 g/dl, DNA positivo 61%, C3 media 44 mg/dl (3463), C4 9 (5-14), SLEDAI 15 (12-18), clase III 19 %, clase IV 41 %, clase V 19 %, clase III + V 7 %, clase IV + V 27%. IA 7 (4-10), IC 1 (0-2). Variable principal Un mayor número de pacientes del grupo multidiana alcanzó RC (45,9 % frente a 25,6 %) a las 24 semanas. Esta diferencia de 20,3 puntos (intervalo de confianza [IC] 10 frente a 30,6), fue estadísticamente significativa (p < 0,001). La probabilidad acumulada de alcanzar RC resultó superior en el grupo multidiana (45,8 % [IC 38,5-53,8 %]) que en el de CFiv (26,8 [20,6-34,4 %]); hazard ratio (HR) 2,03 [IC 1,39-2,97], p < 0,001. Variables secundarias –– Eficacia: la incidencia de RC según clases de NL también fue más favorable para la multidiana, así como la incidencia de RG (figura 1), el tiempo en alcanzarla (83,5 % frente a 63 %; p < 0,001; 9 frente a 13 semanas, diferencia –4 semanas, IC –7,9 a –2,1, respectivamente), y en SLEDAI y el C3 (p < 0,001, p = 0,022). La creatinina sérica se mantuvo estable y sin diferencias entre grupos a lo largo del seguimiento. Probabilidad de RG 1,00 MT P < 0,001 0,80 0,60 CFiv 0,40 0,20 0,00 0 4 8 12 16 20 24 Semanas Figura 1. Probabilidad de alcanzar respuesta global (RG) en pacientes tratados con multiterapia (MT) frente a ciclofosfamida intravenosa (CFiv). 30 NefroPlus 2016 Vol. 8 N.° 1 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA –– Seguridad: no se objetivaron diferencias entre grupos ni en RAM globales ni en graves (50, 3% multidiana frente a 52,5 % CF en el global, y 7,2 % frente a 2,8 % en los graves, respectivamente). Más pacientes, aunque sin diferencias significativas, se retiraron del estudio por RAM en el grupo multidiana (5,5 % frente a 1,7 %; p = 0,086). No hubo ninguna muerte. Hubo menor sintomatología gastrointestinal y leucopenia, y más temblor en el multidiana (4 % frente a 20 %, p < 0,001; 0,6 % frente a 6,6 %, p = 0,003; 4,4 % frente a 0,6 %, p = 0,037). ■■ CONCLUSIONES DE LOS AUTORES La terapia multidiana con MMF y TAC a dosis bajas es superior en eficacia a CFiv para alcanzar inducción de remisión con similitud de efectos adversos. ■■ COMENTARIOS DE LOS REVISORES Desde hace 30 años se han venido ensayando diferentes estrategias terapéuticas para mejorar los resultados, tanto en eficacia como en seguridad. El MMF ha demostrado en diferentes estudios de calidad no ser inferior a la CF en eficacia ni en seguridad. Aunque los estudios suelen utilizar diferentes variables de resultado, la máxima incidencia en inducir RC a los 6 meses del inicio de la terapia está en 22,5 % para MMF1 frente a 8 % para CF2. En el trabajo analizado, es llamativa la cifra alcanzada de RC y, además, temprana, importancia que radica en lo ya objetivado con anterioridad sobre la influencia de la precocidad de respuesta en la supervivencia renal a largo plazo3,4. En el estudio ALMS, un 22 % de los 62 pacientes asiáticos en el brazo de MMF se retiraron del estudio por efectos secundarios, frente al 5 % de los 60 pacientes asiáticos del brazo de CF, lo que refleja una peor tolerancia a MMF que a CF en esta raza, quizás por la elevada dosis de MMF usada (2-3 g/día). Es por ello razonable la estrategia de administrar un mayor número de fármacos a menores dosis cada uno, pauta ya definida con éxito y establecida en los protocolos de inmunosupresión actuales para los trasplantes de órganos. El TAC en monoterapia ha demostrado eficacia en la inducción de remisión al compararlo con CF en NL de novo5,6 y en NL resistentes7, aunque con cierto grado de nefrotoxicidad en un estudio6. También combinado con el MMF en NL IV + V para la misma variable de RC a 6 meses (50 % multidiana frente al 5 % CF; p < 0,05)8. Metodológicamente, el estudio analizado alcanza el nivel 3/5 de la escala de Jadad. Se trata de un ensayo clínico en fase IV con un buen número de pacientes, analizado por intención de tratar, describiéndose los datos perdidos y confirmados los resultados con análisis de sensibilidad. Aunque abierto, los resultados que se consideran son analíticos y objetivos, por lo que el sesgo de clasificación no sería tan importante como en las valoraciones subjetivas. Puede atribuírsele una limitación por ser multicéntrico; sin embargo, todos los pacientes proceden de centros renales, por lo que mejora la homogeneidad de la muestra el que sea una misma especialidad la que realiza el tratamiento. Las biopsias fueron analizadas por dos nefropatólogos de forma independiente, lo que aumenta la calidad del estudio en cuanto al uso de los IA, IC, clase, aunque no se han usado para factores pronósticos de respuesta9. Se analizó la adherencia terapéutica (niveles de fármaco), que resultó elevada, aunque ya excluyen a los pacientes con algún dato de incumplimiento terapéutico previo. Esto es importante, dada la diferente vía de administración de ambos grupos y la posibilidad de incumplimiento de la vía oral. Supone un gran número de pacientes, mitad primeros episodios, mitad brotes, pero todos ellos NL “moderadas” (proteinuria máxima 5,44 g/dl, IC bajo y solo 2,5% de los pacientes con aclaramiento < 30 ml/min/1,73 m2), por lo que habríamos de tener precaución a la hora de extrapolar con NL con aclaramiento de creatinina < 30 ml/min/1,73 m2 en las que, además, el TAC estaría relativamente contraindicado. ■■ CONCLUSIONES DE LOS REVISORES Añadir TAC a la monoterapia con MMF y esteroides parece mejorar y acelerar la remisión completa en fase de inducción con baja incidencia de RAM. La conclusión coincide con la de los autores, pero con dos salvedades de extrapolación: –– A aquellas NL poco frecuentes que se presentan con deterioro importante del filtrado glomerular, por escasa representación en este estudio y por contraindicación relativa de TAC como nefrotóxico en situación de insuficiencia renal grave. –– A otras razas como la negra que ha demostrado mayor severidad y mejor tolerancia a MMF que la asiática. –– No se han recogido evoluciones más allá de los 6 meses (fase de mantenimiento). Se incide también en analizar los factores que pueden impedir un buen cumplimiento terapéutico para decidir una terapia intravenosa frente a la oral. NefroPlus 2016 Vol. 8 N.° 1 31 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA ■■ CLASIFICACIÓN Tema: Nefritis lúpica Subtema: Nefrología clínica Palabras clave: Ciclofosfamida. Micofenolato. Multitarget/Doble terapia/Multidiana. Nefritis lúpica. Tacrolimus NIVEL DE EVIDENCIA: 1+/Alto (SIGN/GRADE) GRADO DE RECOMENDACIÓN: A-B /Fuerte (SIGN/GRADE) ■■ NOTAS METODOLÓGICAS –– Se usa imputación múltiple como análisis de sensibilidad para resolver el problema de los datos faltantes, generando valores posibles para los valores perdidos. En general, su utilidad es la de ver si los resultados finales siguen siendo los mismos que en el análisis inicial; si es el caso, se refuerza la seguridad de los resultados obtenidos en el análisis inicial. –– Los modelos de fragilidad son modelos de regresión de efectos aleatorios utilizados en los análisis de supervivencia multivariados para modelar el riesgo en poblaciones heterogéneas o divididas en subgrupos poblacionales (como pueden ser las de diferentes centros, al ser el estudio multicéntrico). El concepto de fragilidad viene adecuado a que ciertos subgrupos de la muestra pueden presentar mayor fragilidad para sufrir un evento o efecto adverso que otros subgrupos (en el estudio que nos concierne, puede ser que los pacientes de un centro tengan mayor predisposición a presentar un evento o efecto adverso que los de otro centro por características de zona, culturales, protocolos intracentro, etc.). REFERENCIAS BIBLIOGRÁFICAS 1. Ginzler EM, Dooley MA, Aranow CA, Kim MY, Buyon J, Merrill JT, et al. Mycophenolate mofetil or intravenous cyclophosphamide for lupus nephritis. N Engl J Med 2005;353:2219-28. 2. Appel GB, Contreras G, Dooley MA, Ginzler EM, Isenberg DA, Jayne D, et al. Aspreva Lupus Management Study Group. Mycophenolate mofetil versus cyclophosphamide for induction treatment of lupus nephritis. J Am Soc Nephrol 2009;20:1103-12. 3. Houssiau FA, Vasconcelos C, D’Cruz D, Sebastiani GD, de Ramón Garrido E, Danieli MG, et al. Early response to immunosuppressive therapy predicts good renal outcome in lupus nephritis lessons from long-term follow up of patients in the Euro-Lupus Nephritis Trial. Arthritis Rheum 2004;50:3934-40. 4. Hanaoka H, Kaneko Y, Kuwana M, Takeuchi T. Early achievement of complete renal response predicts good long-term renal outcome and low systemic damage in newly diagnosed lupus nephritis class III or IV. Mod Rheumatol 2015;25:714-8. 5. Wang S, Li X, Qu L, Wang R, Chen Y, Li Q, et al. Tacrolimus versus cyclophosphamide as treatment for diffuse proliferative or membranous lupus nephritis: a non-randomized prospective cohort study. Lupus 2012;21:1025-35. 6. Zavada J, Pesickova SS, Rysava R, Olejarova M, Horak P, Hrneir Z, et al. Cyclosporine A or intravenous cyclophosphamide for lupus nephritis: the Cyclofa-Lune study. Lupus 2010;19:1281-9. 7. Lee YH, Lee H-S, Choi SJ, Ji JD, Song DD. Efficacy and safety of tacrolimus therapy for lupus nephritis: a systematic review of clinical trials. Lupus 2011;20:636-40. 8. Bao H, Liu ZH, Xie HL, Hu WX, Zhang HT, Li LS. Successful treatment of class V -IV lupus nephritis with multitarget therapy. J Am Soc Nephrol 2008;19:2001-10. 9. The American Collegue of Rheumatology response criteria for proliferative and membranous renal disease in systemic lupus erythematosus clinical trials. Renal Disease subcommittee of the American Collegue of Rheumatology Ad Hoc Committee on Systemic Lupus Erythematosus Response Criteria. Arthritis Rheum 2006;54:421-32. 32 NefroPlus 2016 Vol. 8 N.° 1 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA Efecto del tratamiento con cinacalcet en los niveles de factor de crecimiento fibroblástico-23 en pacientes en hemodiálisis. ¿Modifica los niveles? ¿Influye en la tasa de morbimortalidad cardiovascular de este grupo de pacientes? Moe SM, Chertow GM, Parfrey PS, Kubo Y, Block GA, Correa-Rotter R, et al. Cinacalcet, Fibroblast Growth Factor-23, and Cardiovascular Disease in Hemodialysis. The Evaluation of Cinacalcet HCl Therapy to Lower Cardiovascular Events (EVOLVE) Trial. Circulation 2015;132:27-39. Análisis crítico: Raquel Ojeda Servicio de Nefrología. Hospital Clínic. Barcelona NefroPlus 2016;8(1):33-36 ■■ Objetivo Determinar, con los datos del estudio EVOLVE, si el tratamiento con cinacalcet se relaciona con cambios en los niveles de factor de crecimiento fibroblástico-23 (FGF23) en pacientes en hemodiálisis, y si estos cambios modifican la morbimortalidad cardiovascular en ellos. ■■ Tipo de diseño y seguimiento Se trata de un análisis secundario del estudio EVOLVE. Este fue un ensayo clínico multicéntrico, prospectivo, doble ciego, controlado con placebo, en el que 3.883 pacientes con hiperparatiroidismo secundario en hemodiálisis fueron aleatorizados 1:1 para recibir cinacalcet o placebo, junto con las terapias convencionales para el trastorno óseo-mineral de estos pacientes, incluyendo quelantes del fósforo, vitamina D, o ambos. Este estudio fue diseñado para determinar la eficacia del cinacalcet en comparación con el placebo en pacientes en hemodiálisis y terapia tradicional para hiperparatiroidismo secundario; el end-point primario compuesto fue la mortalidad de cualquier causa y tiempo de aparición de un primer evento cardiovascular no mortal (infarto agudo de miocardio, hospitalización por angina inestable, insuficiencia cardíaca o enfermedad vascular periférica, incluyendo revascularización de la extremidad inferior y amputación no traumática). El estudio fue realizado en 500 centros de 22 países. Los pacientes fueron seguidos durante 64 meses. En este análisis post hoc del estudio principal, los objetivos fueron evaluar si las concentraciones séricas basales de FGF-23 y los cambios en las concentraciones de FGF-23 en el grupo de pacientes tratados con cinacalcet se asociaron con muerte y eventos cardiovasculares mayores. ■■ Pacientes En el estudio EVOLVE se incluyeron 3.883 pacientes en hemodiálisis con hiperparatiroidismo secundario. Los criterios de inclusión del estudio fueron tener una edad ≥ 18 años, pacientes estables en hemodiálisis (como mínimo llevar 3 meses), tener cifras de hormona paratiroidea intacta (PTHi) > 300 pg/ml y un producto calcio-fósforo > 45 mg2/dl2 (siendo siempre el calcio > 8,4 mg/dl), diabéticos tipo 2 y pacientes que firmaran el consentimiento informado. En cuanto a los criterios de exclusión, se excluyeron del estudio los pacientes con patología inestable (a juicio del investigador), con antecedentes de paratiroidectomía y/o que el investigador pensara que el paciente la podía necesitar en los 6 meses después de realizar la aleatorización; aquellos pacientes con una enfermedad que limitara su calidad de la vida, los que hubiesen recibido tratamiento con cinacalcet en los 3 meses de la aleatorización, haber sufrido una hospitalización dentro de las 12 semanas de la aleatorización por un infarto agudo de miocardio, una angina inestable, un episodio de insuficiencia cardíaca, por enfermedad vascular periférica, por isquemia y/o derrame cerebral, por cuadro de crisis convulsivas, o aquellos pacientes con trasplante renal de donante vivo previsto durante el período que durase el estudio. También se excluyeron los pacientes que estuviesen participando en otro/s ensayo/s clínico/s. ■■ Evaluaciones o intervenciones De los 3.883 pacientes del estudio EVOLVE, se tenían datos de FGF-23 al inicio en 2.985, y en 2.602 se tenían datos al inicio y a la semana 20. Este análisis se realizó solo en los pacientes con datos basales de ­FGF-23 y a las 20 semanas, lo que supone un 77 % de la cohorte original del estudio. Para valorar los cambios en los niveles plasmáticos de FGF-23, se evaluó a los pacientes que tenían datos de FGF-23 basales y en la semana 20, y se consideró un descenso significativo de niveles de FGF-23 cuando era superior al 30 %. También se analizaron los pacientes en los que el descenso era > 50 %. Estos análisis se llevaron a cabo NefroPlus 2016 Vol. 8 N.° 1 33 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA comparando ambos grupos de tratamiento, los que recibieron cinacalcet con el grupo placebo. ■■ Variable de resultado Determinar si el descenso de FGF-23 era mayor en los pacientes del grupo tratado con cinacalcet, y valorar si este descenso se asociaba o no con una menor morbimortalidad. Asimismo, analizaron si el descenso de FGF-23 estaba o no relacionado con cambios en los niveles de PTH, calcio y fósforo. ■■ Tamaño muestral Se compararon los niveles de FGF-23 en 2.602 pacientes, de los que tenían datos al inicio y en la semana 20 de seguimiento. Para llevar a cabo este trabajo, se compararon los resultados entre ambos grupos de tratamiento. ■■ Estadística Se trata de un análisis post hoc de los datos del estudio EVOLVE cuyo objetivo era valorar si los cambios en los niveles de FGF-23 al inicio y a las 20 semanas del estudio se modificaban por igual en los pacientes tratados con cinacalcet y en el grupo placebo, y determinar si los cambios en los niveles de FGF-23 se asociaban con muerte de cualquier causa y con eventos cardiovasculares mayores. Para valorar la asociación entre niveles basales de FGF23 y la reducción de estos en los pacientes tratados con cinacalcet, llevaron a cabo una regresión de Cox que fue estratificada por países y por el estatus de diabético sí/no. Posteriormente, compararon los niveles a la semana 20 de estudio entre ambos grupos con un test de Wilcoxon con suma de rangos. Para determinar el efecto de los cambios de FGF-23 desde el inicio a la semana 20 en los diferentes grupos utilizaron un análisis de regresión de Cox. Para establecer la correlación entre niveles de FGF-23 y los niveles de PTH, calcio corregido y fosfato, aplicaron el coeficiente de correlación de Pearson. Los investigadores eligieron la reducción > 30 % sobre niveles basales, siguiendo lo elegido para cifras de PTH como descenso significativo desde un punto de vista clínico. Compararon la proporción de pacientes que alcanzaron este descenso en ambos grupos con el test de x2. En los pacientes que recibieron cinacalcet también analizaron aquellos que alcanzaron un descenso > 50 %. Por último, categorizaron a los pacientes según los niveles de PTH, calcio corregido y fósforo, según los niveles recomendados por las guías K/DOQI, en la semana 20, y determinaron el porcentaje de cambio en los niveles de FGF-23 en los pacientes que cumplían lo establecido por las guías. ■■ Promoción y conflicto de intereses El estudio EVOLVE fue financiado por el laboratorio Amgen, quien proporcionó la medicación. Un comité ejecutivo académico fue el encargado de recoger todos los datos del estudio y supervisar los análisis y resultados obtenidos, así como de revisar todos los manuscritos para su publicación, incluido este. ■■ RESULTADOS PRINCIPALES Niveles basales de FGF-23 y mortalidad Los autores analizan las diferencias entre el grupo basal del trabajo original, el grupo de pacientes con valores basales de FGF-23 y los que tienen niveles a la semana 20, observando diferencias menores; los grupos son muy homogéneos. Tras ajustar por las características basales, objetivaron que mayores niveles de FGF-23 se asocian a un mayor riesgo de alcanzar el end-point primario del estudio, tener un evento cardiovascular no fatal o morir. El tratamiento con cinacalcet se asocia a mayor descenso de niveles de FGF-23 Partiendo ambos grupos de tratamiento de niveles de FGF-23 similares (cinacalcet 5.555 pg/ml frente a placebo 5.600 pg/ml; p = 0,86), en los tratados con cinacalcet se objetiva un descenso significativo respecto al grupo placebo (cinacalcet 2.255 pg/ml frente a placebo 5.580 pg/ml; p < 0,001) a las 20 semanas. Cuando analizaron el porcentaje de pacientes en los que la reducción de FGF-23 era > 30 %, también encontraron diferencias significativas (cinacalcet 64 % frente a placebo 28 %; p < 0,001) a las 20 semanas. Lo mismo pasó cuando analizaron los que alcanzaron un descenso > 50 % (cinacalcet 50 % frente a placebo 15 %; p < 0,001). El descenso de FGF-23 se mantuvo independientemente de que los pacientes estuviesen o no recibiendo tratamiento con vitamina D. El cambio de FGF-23 se correlacionaba directamente con el porcentaje de cambio en PTH, calcio corregido y fósforo. Cuando analizaron la asociación de FGF-23 con cifras de PTH, calcio y fósforo según recomiendan las guías K/DOQI, evidenciaron que la reducción de FGF-23 era mayor cuando estos tres parámetros estaban dentro de los valores recomendados. 34 NefroPlus 2016 Vol. 8 N.° 1 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA El descenso de FGF-23 se asocia con disminución de la morbimortalidad cardiovascular En los pacientes del grupo tratados con cinacalcet, el descenso ≥ 30 % en la semana 20, respecto a los niveles basales de FGF-23, se asoció con una reducción del end-point primario compuesto de descenso de muerte cardiovascular, muerte súbita cardíaca y fallo cardíaco. El descenso de los niveles de FGF-23 no se relacionó significativamente con mortalidad de cualquier causa, mortalidad de causa aterosclerótica, fracturas ni paratiroidectomías. En el grupo de pacientes que recibieron placebo, el descenso ≥ 30 % en la semana 20 con respecto a los niveles basales de FGF-23 no se asoció con una menor tasa de eventos cardiovasculares en comparación con los pacientes en los que el descenso fue < 30 %. ■■ CONCLUSIONES DE LOS AUTORES En pacientes con hiperparatiroidismo secundario, el tratamiento con cinacalcet se asocia con un mayor descenso de los niveles de FGF23, en comparación con los pacientes tratados con placebo con/sin tratamiento convencional del hiperparatiroidismo secundario, y esto lo relacionan con la menor aparición de eventos cardiovasculares, descrita previamente en los resultados del estudio EVOLVE. ■■ COMENTARIOS DE LOS REVISORES El análisis post hoc del estudio EVOLVE para valorar el efecto del tratamiento con cinacalcet sobre los niveles de FGF-23 obtiene resultados prometedores en relación con la asociación del descenso de estos niveles, con una disminución de la morbimortalidad cardiovascular. A la vista de los resultados obtenidos, el mayor descenso de FGF-23 en los pacientes tratados con cinacalcet sumado a los datos ampliamente conocidos del efecto del fármaco para reducir las cifras de PTH y mejorar el control del producto calcio x fósforo, tenemos más datos para afirmar que los pacientes en hemodiálisis con hiperparatiroidismo secundario se benefician del tratamiento con cinacalcet. Lo que este análisis no puede aclarar es cuál es el mecanismo por el que el fármaco desciende los niveles. Lo que sí comentan los autores, a la vista de que el descenso de FGF-23 se relaciona en estos pacientes con un descenso del riesgo de fallo cardíaco y de muerte súbita de origen cardíaco, es que, dado que FGF-23 es una hormona cardiotropa que ha demostrado producir daño directo sobre el cardiomiocito, produciéndole hipertrofia, el importante descenso de los niveles de FGF-23 tras el tratamiento con cinacalcet podría ser el causante de la disminución del este daño directo sobre las células del miocardio; esta es una de las explicaciones de por qué el importante descenso de FGF-23 tras tratar a los pacientes con cinacalcet puede ser per se causante de la disminución de la morbimortalidad de origen cardiovascular. Otra posible explicación es la asociación de niveles elevados de FGF-23 con disfunción endotelial, como se ha publicado en trabajos recientes, y que su descenso disminuya a su vez de forma relevante este daño endotelial. Aunque los datos obtenidos son prometedores, hay que tener en cuenta las limitaciones que tiene el trabajo. En primer lugar, que es un análisis post hoc de otro estudio. En cuanto al análisis de los datos, es importante reflejar que el momento en el que se analizan los niveles, la semana 20, es elegido por los autores (y así lo reflejan en el trabajo) por ser un momento en el que el número de pacientes es elevado. Otro sesgo es la elección del porcentaje de descenso considerado como significativo, el del 30 %, que lo eligen por similitud con la PTH (así lo explican en el trabajo los autores, y es cierto que no hay trabajos previos que hablen de otras cifras). ■■ CONCLUSIONES DE LOS REVISORES Los resultados de este análisis post hoc del estudio EVOLVE en el que se analiza el efecto del tratamiento con cinacalcet sobre la morbimortalidad cardiovascular en pacientes estables en hemodiálisis son alentadores. Parece que el tratamiento del hiperparatiroidismo secundario con cinacalcet abre una nueva posibilidad terapéutica para reducir la elevada tasa de morbimortalidad cardiovascular en estos pacientes, pero aún quedan muchos interrogantes con respecto a la utilización de este fármaco con el fin de descender los niveles de FGF-23. Son necesarios estudios en los que se aclaren los mecanismos por los que el cinacalcet disminuye los niveles de FGF-23 para poder establecer una correcta indicación terapéutica enfocada al descenso de esta hormona. Aunque faltan estos trabajos que nos aclaren cómo el fármaco desciende los niveles de FGF-23, los resultados de este análisis del estudio EVOLVE nos ayudan a tomar la decisión de tratar con cinacalcet a pacientes en hemodiálisis con hiperparatiroidismo secundario, tanto por su efecto sobre el control de esta patología como por su posible efecto beneficioso sobre la morbimortalidad cardiovascular en este grupo de pacientes, mediante el descenso de los niveles de FGF-23. ■■ CLASIFICACIÓN Tema: Morbimortalidad cardiovascular Subtema: Hemodiálisis NefroPlus 2016 Vol. 8 N.° 1 35 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA Tipo de artículo: Tratamiento Palabras clave: Factor de crecimiento fibroblástico-23. Hemodiálisis. Morbimortalidad cardiovascular NIVEL DE EVIDENCIA: Alto GRADO DE RECOMENDACIÓN: Fuerte (GRADE [www.gradeworkinggroup.org] divide la calidad de la evidencia en cuatro grupos: alta, moderada, baja y muy baja; y clasifica el grado de recomendación en dos grupos: fuerte y débil). REFERENCIAS BIBLIOGRÁFICAS 1. Chertow GM, Block GA, Correa-Rotter R, Drüeke TB, Floege J, Goodman WG, et al; EVOLVE Trial Investigators. Effect of cinacalcet on cardiovascular disease in patients undergoing dialysis. N Engl J Med 2012;367:2482-94. 2. Chertow GM, Block GA, Correa-Rotter R, Drueke TB, Floege J, Goodman WG, et al. A randomized trial of cinacalcet in patients on hemodialysis with secondary hyperparathyroidism. N Engl J Med 2012;367:2482-94. 3. Isakova T, Xie H, Yang W, Xie D, Anderson AH, Scialla J, et al; Chronic Renal Insufficiency Cohort (CRIC) Study Group. Fibroblast growth factor 23 and risks of mortality and end-stage renal disease in patients with chronic kidney disease. JAMA 2011;305:2432-9. 4. Faul C, Amaral AP, Oskouei B, Hu MC, Sloan A, Isakova T, et al. FGF23 induces left ventricular hypertrophy. J Clin Invest 2011;121:4393-408. 5. Gutiérrez OM, Januzzi JL, Isakova T, Laliberte K, Smith K, Collerone G, et al. Fibroblast growth factor 23 and left ventricular hypertrophy in chronic kidney disease. Circulation 2009;119:2545-52. 36 NefroPlus 2016 Vol. 8 N.° 1 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA ¿Cuál es el efecto del citrato férrico sobre el control de la hiperfosforemia y los parámetros ferrocinéticos en los pacientes en diálisis? Lewis JB, Sika M, Koury MJ, Chuang P, Schulman G, Smith MT, et al. Ferric citrate controls phosphorus and delivers iron in patients on dialysis. J Am Soc Nephrol 2015;26:493-503. Análisis crítico: David Arroyo1, Joan Valls2 1 Servicio de Nefrología. Hospital Universitari Arnau de Vilanova. Lleida 2 Unidad de Bioestadística y Epidemiología. Institut de Rercerca Biomèdica de Lleida (IRBLleida). Lleida NefroPlus 2016;8(1):37-40 ■■ Tipo de estudio y seguimiento Ensayo clínico multicéntrico, abierto, secuencial, aleatorizado en dos fases: primera comparada con control activo (52 semanas); segunda, realeatorización de los pacientes tratados con fármaco para comparar con placebo (4 semanas). ■■ Asignación Primera fase Aleatorización en razón 2:1 a fármaco o control activo. Asignación vía web por bloques permutados, estratificada para centros de inclusión. Segunda fase Realeatorización en razón 1:1 a continuar fármaco o placebo. ■■ Enmascaramiento Estudio abierto. N ■■ Ámbito Participaron 60 centros de Estados Unidos e Israel entre diciembre de 2010 y noviembre de 2012. ■■ Pacientes Criterios de inclusión Pacientes adultos en programa de hemodiálisis tres veces por semana o en programa de diálisis peritoneal desde al menos 3 meses antes; recibiendo entre 3 y 18 dosis de algún quelante de fósforo; ferritina sérica < 1.000 ng/ml; índice de saturación de transferrina (IST) < 50 %; y fosfato sérico ≥ 2,5 y ≤ 8 mg/dl. Criterios de exclusión Paratiroidectomía en los 6 meses previos; requerimiento absoluto de hierro o vitamina C por vía oral; intolerancia a acetato cálcico o sevelamero. ■■ Intervenciones Primera fase De los 1.072 pacientes evaluados, 441 fueron aleatorizados: –– Grupo de tratamiento (GT, n = 292): citrato férrico 210 mg, titulando según protocolo. –– Grupo de control activo (GCA, n = 149): uso libre de acetato cálcico 667 mg y/o carbonato de sevelamero 800 mg. Segunda fase De los 292 pacientes evaluados, 192 terminaron las 54 semanas y fueron aleatorizados: –– Grupo de tratamiento (GT, n = 96): citrato férrico 210 mg, titulando según protocolo. –– Grupo placebo (GP, n = 96): placebo, no se especifica el número de dosis. ■■ Variables de resultados Variable principal Variación de fosfato sérico tras 4 semanas de GT frente a GP. Variables secundarias Variación en ferritina sérica e IST, y variación de dosis acumuladas de hierro intravenoso y agentes estimulantes de la eritropoyesis (AEE) tras 54 semanas de GT frente a GCA. ■■ Tamaño muestral Estimado en 350 individuos para la primera fase, y 163 individuos para la segunda (suponiendo una tasa de abandono del 30 %), para una diferencia de fosfato sérico de 1,2 mg/dl estimando una desviación típica de 2 mg/dl en ambos grupos, con una potencia estadística del 95 % y error bilateral tipo I del 5 %. NefroPlus 2016 Vol. 8 N.° 1 37 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA ■■ Estadística Se utilizó análisis de covarianza (ANCOVA) con modelos de efecto mixto longitudinal comparando las variaciones séricas con el nivel basal para cambios en los niveles de fosfato, ferritina e IST, tanto de forma aislada como ajustada para sexo, ferritina y hemoglobina. Se utilizó el test de suma de rangos de Wilcoxon para comparar las dosis acumulativas de hierro intravenoso y AEE, y para confirmar los resultados de los ANCOVA. Los valores perdidos fueron imputados. Los análisis estadísticos se realizaron con el programa SAS. ■■ Ética y registro Todos los pacientes firmaron consentimiento informado. El estudio fue aprobado por un comité central y en cada centro participante, y fue registrado en clinicaltrials.gov: NCT01191255. ■■ Promoción y conflicto de intereses Estudio financiado por Keryx Biopharmaceuticals, Inc., y con una beca del Patient Protection and Affordable Care Act 2010. Todos los autores reconocen haber recibido apoyo económico de algún tipo de Keryx Biopharmaceuticals, Inc. ■■ RESULTADOS PRINCIPALES Análisis basal de los grupos En la primera fase, grupos homogéneos con predominio de varones (60 %) y una edad media de 55 años. Algo más de la mitad (55 %) de raza negra y el 15 % latinos. La distribución de la etiología de la enfermedad renal es la habitual, con predominio de nefropatía diabética (40 %) y vascular (30 %). Tratamiento con AEE en el 80 % y con hierro intravenoso en el 60 % de pacientes. En la segunda fase, había una mayor tasa de varones en el GT (73 % frente a 49 %), sin cambios en cuanto a edad, raza o etiología entre grupos o comparando con la primera fase. Menor tasa de pacientes en tratamiento con AEE o hierro intravenoso (65 % y 20 %), sin diferencias entre los dos grupos. Valores de laboratorio Basalmente presentaban una hiperfosforemia marcada (P = 7,3 mg/dl), con calcio 9 mg/dl y hormona paratiroidea intacta (PTHi) 500 pg/ml. Parámetros de anemia bien controlados, con hemoglobina 11,5 g/dl, IST 29 % y ferritina algo elevada (570 ng/ml). En la segunda fase, hiperfosforemia e hiperparatiroidismo mejor controlados con fósforo medio de 5,2 mg/dl, calcio 9,2 mg/dl y PTHi 350 pg/ml. Anemia igualmente bien controlada, aunque la hemoglobina fue mayor en el GT (11,4 g/dl frente a 10,9 g/dl). El IST no presentó cambios (36 %), pero la ferritina era marcadamente más elevada, especialmente en el GC (ferritina, 932 ng/ml frente a 858 ng/ml). Variable principal Tras 4 semanas, se observa una marcada diferencia estadísticamente significativa en el control de la fosforemia, con una diferencia media en los valores séricos de –2,18 mg/dl entre el GT y el GP. Esta diferencia se mantiene igual tras ajustar por las variables con distribución heterogénea entre grupos (sexo, hemoglobina y ferritina). Variables secundarias Tras 52 semanas, se observan diferencias estadísticamente significativas en todas las variables secundarias entre el GT y el GCA. Así, se objetiva un aumento medio de la ferritinemia de 282 ng/ml y un aumento del IST del 9,5 %. Estas diferencias aparecen desde la semana 12 de tratamiento. Asimismo, hay una disminución en la dosis de hierro intravenoso de 12,5 mg/semana y en la dosis de AEE de 1.190 UI/semana. Por otro lado, no hay diferencias en los valores séricos de fósforo, calcio o iPTH. Efectos adversos No hubo muertes atribuidas al tratamiento. El porcentaje global de efectos adversos (EA) fue similar en ambos grupos (92 %), pero en referencia a los EA graves, la tasa fue mayor en el GCA que en el GT (51 % frente a 42 %). Esta diferencia era debida tanto a EA graves gastrointestinales (13 % frente a 8%), como infecciosos (20 % frente a 15%) y cardíacos (13 % frente a 9%). Sin embargo, en el GT hubo mayor tasa de EA no graves gastrointestinales (49 % frente a 37 %) y de discontinuación del estudio por EA (21 % frente a 15 %). 38 NefroPlus 2016 Vol. 8 N.° 1 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA Tabla 1. Evolución de los niveles de las variables objetivo de la primera fase Variable Grupo Fosfato (mg/dl) Ferritina (ng/ml) IST (%) Basal Fin de estudio p valor entre grupos Citrato férrico 7,41 ± 0,10 5,36 ± 0,10 0,95 Control activo 7,56 ± 0,14 5,38 ± 0,13 Citrato férrico 593 ± 18 899 ± 31 Control activo 609 ± 26 628 ± 31 Citrato férrico 31,3 ± 0,7 39,3 ± 1,1 Control activo 30,9 ± 1,0 29,7 ± 1,0 < 0,001 < 0,001 Tabla 2. Evolución de los niveles de fósforo sérico en la segunda fase Variable Grupo Basal Fin de estudio Fosfato (mg/dl) Citrato férrico 5,12 ± 0,12 4,86 ± 0,13 Placebo 5,44 ± 0,15 7,21 ± 0,19 p valor entre grupos < 0,001 ■■ CONCLUSIONES DE LOS AUTORES El citrato férrico es un quelante oral del fósforo eficaz y seguro, que produce un aumento de los depósitos de hierro y una disminución de la dosis necesaria de hierro intravenoso y AEE para mantener la hemoglobina. ■■ COMENTARIOS DE LOS REVISORES El control de los niveles de fósforo es uno de los retos principales de los pacientes con enfermedad renal avanzada o en diálisis. Existe evidencia suficiente en la literatura médica de la asociación entre hiperfosfatemia y mortalidad, así como de algunos mecanismos patogénicos a través de los que genera calcificación vascular. La asociación entre administración de quelantes de fósforo y aumento de la supervivencia está menos clara, y parece depender del tipo de quelante, y su composición o contenido en calcio. Tras la desaparición en nuestro entorno del hidróxido de aluminio, actualmente los quelantes de fósforo se reducen a tres grupos: cálcicos (carbonato y acetato cálcico), no cálcicos (sevelamero y lantano) y uno mixto (carbonato magnésico/acetato cálcico). Recientemente se han desarrollado los quelantes basados en hierro, ya en ensayos en fase 3. Estos incluyen el citrato férrico, que tiene un efecto directo sobre los parámetros ferrocinéticos, y el oxihidróxido sucroférrico, cuyo componente de hierro apenas se absorbe. El citrato férrico parece una buena opción quelante en aquellos pacientes que requieran tratamiento asociado de la ferropenia, o al menos, aquellos en los que el hierro no esté contraindicado. Este estudio confirma una eficacia quelante similar a la de los tratamientos actuales habituales, con una tolerabilidad que parece similar. El efecto sobre los depósitos de hierro es significativo, y en algunos pacientes permite reducir el tratamiento con hierro intravenoso y AEE. Hay que destacar que el estudio está realizado en población norteamericana e israelí, con la mitad de los pacientes de raza negra, lo que puede dificultar su generalización a la población europea. Además, son exclusivamente datos de población en hemodiálisis, que por el momento no se pueden trasladar a pacientes en diálisis peritoneal o con enfermedad renal en prediálisis. ■■ CONCLUSIONES DE LOS REVISORES El citrato férrico parece un quelante del fósforo seguro y eficaz para el control de la hiperfosforemia en pacientes en hemodiálisis, que aumenta los depósitos y la disponibilidad de hierro. NefroPlus 2016 Vol. 8 N.° 1 39 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA ■■ CLASIFICACIÓN Tema: Hiperfosforemia Subtema: Alteraciones del metabolismo óseo mineral Tipo de artículo: Tratamiento Palabras clave: Anemia. Ferropenia. Hemodiálisis. Hiperfosforemia. Quelantes de fósforo NIVEL DE EVIDENCIA: Alto GRADO DE RECOMENDACIÓN: Fuerte (GRADE [www.gradeworkinggroup.org] divide la calidad de la evidencia en cuatro grupos: alta, moderada, baja y muy baja; y divide el grado de recomendación en dos grupos: fuerte y débil.) ■■ NOTAS METODOLÓGICAS Análisis de la covarianza (ANCOVA): valoración de múltiples mediciones del mismo parámetro Cuando se desea evaluar las diferencias observadas en una variable cuantitativa en dos o más grupos de pacientes, el análisis de la varianza (ANOVA) resulta un método adecuado para evaluar el efecto o asociación de la exposición (grupo) sobre el efecto (variable respuesta). El análisis de la covarianza (ANCOVA) consiste en la generalización del ANOVA cuando, además, se desea tener en cuenta o ajustar por factores que pueden potencialmente afectar al efecto, sin incluirlas como variable explicativa o experimental, sino como variables de control. En el caso concreto de las medidas repetidas o datos longitudinales, el valor basal puede ser considerado por sí mismo como una variable de ajuste y, por este motivo, se suele utilizar el ANCOVA en esta situación particular. La idea fundamental es que, al igual que en los modelos lineales mixtos, se desea tener en cuenta que cada paciente puede tener un efecto aleatorio. Además, el interés se centra en evaluar la variación respecto de la situación inicial, lo cual permite afrontar una heterogeneidad elevada en los valores basales de la variable respuesta que podría afectar en una mayor variabilidad de las estimaciones. De esta forma, el uso de un método ANCOVA en los diseños con medidas repetidas o longitudinales permite tener en cuenta la variabilidad interpaciente (­between-patient variability), centrándose en las diferencias atribuibles a la exposición evaluada en el contexto intrapaciente (­within-patient variability). En este contexto, el método ANCOVA resulta análogo a tratar con las diferencias pareadas cuando se observa una misma variable en dos momentos diferentes en la misma muestra de pacientes, pero generalizando esto a más de dos momentos o situaciones. Los autores del artículo analizado utilizan el método ANCOVA para evaluar el efecto del citrato férrico en el resultado principal (control del fósforo sérico) y en los secundarios (ferritina, IST y dosis de AEE y hierro intravenoso) en un ensayo clínico aleatorizado con dos grupos (tratados con citrato férrico frente a controles), ajustando por los valores basales de las variables resultado y teniendo en cuenta el efecto a lo largo de las diferentes mediciones para cada paciente. REFERENCIAS BIBLIOGRÁFICAS 1. Armitage P, Berry G. Statistical methods in medical Research. Oxford: Wiley-Blackwell; 2001. 40 NefroPlus 2016 Vol. 8 N.° 1 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA ¿La colocación del catéter peritoneal por el nefrólogo influye en la tasa de utilización de la diálisis peritoneal? Perl J, Pierratos A, Kandasamy G, McCormick BB, Quinn RR, Jain AK, et al. Peritoneal dialysis catheter implantation by nephrologists is associated with higher rates of peritoneal dialysis utilization: a population-based study. Nephrol Dial Transplant 2015;30:301-9 Análisis crítico: Emilio Sánchez Álvarez Servicio de Nefrología. Hospital Central de Asturias. NefroPlus 2016;8(1):41-43 ■■ Objetivo Analizar qué factores influyen en que un catéter de diálisis peritoneal (DP) no llegue a utilizarse como acceso peritoneal para diálisis, centrándose especialmente en el método de implantación de este. ■■ Tipo de diseño Estudio retrospectivo, poblacional de cohortes. ■■ Ámbito Provincia de Ontario, Canadá. ■■ Pacientes a todos los pacientes de Ontario a los que Sese lesidentificó colocó un catéter de DP entre el 1 de abril de 2002 y el 31 de marzo de 2010. Para asegurarse los objetivos del estudio, se excluyó a los pacientes que no habían tenido contacto con un nefrólogo durante el año previo a la inserción del catéter, que ya habían estado en DP, trasplantados renales o con una inserción previa de catéter en los 5 años anteriores, pacientes que estuvieran más de un año en un programa de hemodiálisis crónica, pacientes con el diagnóstico de ascitis o paracentesis evacuadoras en el año anterior al registro, pacientes que recibieran quimioterapia o radioterapia el año anterior a la inserción del catéter o aquellos que estuvieran recibiendo cuidados paliativos en los 6 meses anteriores. ■■ Fuentes de datos Se usaron distintas bases de datos que recogen datos epidemiológicos, clínicos, procesos, hospitalizaciones y el acceso a los programas de diálisis y trasplante. ■■ Intervención Colocación de un catéter de DP. ■■ Resultados analizados Se tuvieron en cuenta datos relacionados con la inserción del catéter de DP. Se identificaron cuatro procedimientos para la colocación del catéter en función de la técnica y del profesional que la realizó: inserción percutánea por un nefrólogo, inserción percutánea por un radiólogo intervencionista, inserción por laparoscopia o finalmente mediante cirugía abierta. En relación con los profesionales implicados, se valoraron la especialidad quirúrgica, la experiencia profesional (medida como los años transcurridos desde su graduación y el número de catéteres colocados el año anterior). Por último, se registró el centro sanitario en el que se realizó la intervención (se incluyeron 26 centros). ■■ Variables El objetivo principal fue analizar el tiempo hasta el primer uso del catéter como acceso peritoneal para la técnica de DP. Se analizaron también los eventos trasplante renal y muerte y la necesidad de hemodiálisis. El período de seguimiento concluyó el 31 de marzo de 2011, para que todos los pacientes incluidos en el estudio tuvieran al menos un año de seguimiento ■■ Ética El estudio fue aprobado por el Research Ethics Board del Sunnybrook Health Sciences Centre en Toronto. NefroPlus 2016 Vol. 8 N.° 1 41 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA ■■ RESULTADOS PRINCIPALES Se incluyeron en el estudio 3.886 pacientes a los que se les había colocado un catéter de DP. Características de los pacientes La edad media fue superior en el grupo de pacientes a los que un radiólogo les implantó el catéter. Por el contrario, los nefrólogos insertaron los catéteres a la población más joven. A los pacientes con cirugía abdominal previa se les implantó el catéter más frecuentemente mediante laparoscopia. En los pacientes con poliquistosis renal el catéter fue implantado con menos frecuencia por un radiólogo. Las técnicas laparoscópica y radiológica se usan más en los últimos años de evaluación; la colocación de catéteres por nefrólogos permaneció estable a lo largo del período de observación. Procedimientos En todos los centros analizados había cirujanos que insertaban los catéteres y en 19 de ellos (73 %) trabajaban nefrólogos. La técnica laparoscópica era realizada en la mayoría de los casos por cirujanos generales (76 %), seguidos por urólogos (12 %) y cirujanos vasculares (10 %). En cuanto a la implantación mediante cirugía abierta, los urólogos eran los profesionales más frecuentemente implicados (49 %), seguidos de cirujanos generales (36 %) y cirujanos vasculares (8 %). El grupo de radiólogos implicados en la inserción de catéteres de DP con más frecuencia se había graduado menos de 10 años antes del procedimiento. Por el contrario, el grupo de nefrólogos que colocaron catéteres tenía la mayor frecuencia de profesionales con más de 30 años de experiencia. Probabilidad de usar el catéter para la técnica de diálisis peritoneal El 83 % de los pacientes a los que se colocó un catéter iniciaron DP. El grupo de pacientes a los que un nefrólogo les implantó el catéter con más frecuencia iniciaron DP y en menos tiempo. Otros factores asociados a un menor uso de la técnica fueron la edad más avanzada, la condición de diabético, el haber estado previamente en hemodiálisis o haberse sometido a una cirugía abdominal previa a la inserción del catéter. El trasplante renal y el fallecimiento del paciente fueron causas infrecuentes de que no se comenzara la DP. La mayor proporción de pacientes que no usaron el catéter de DP fue por la realización de hemodiálisis, que fue más frecuente en el grupo de pacientes a los que un nefrólogo insertó el catéter. ■■ CONCLUSIONES DE LOS AUTORES Un alto porcentaje de los pacientes a los que se les coloca un catéter de DP (83 %) comienza esta técnica de tratamiento renal sustitutivo. Los mejores resultados se obtienen cuando el catéter es implantado por un nefrólogo (mayor tasa de inicio de DP y menor tiempo hasta el inicio). ■■ COMENTARIOS DEL REVISOR La implantación del catéter de DP es un momento clave en la vida del paciente urémico. Los problemas relacionados con el mal funcionamiento del catéter son frecuentes en los primeros meses postimplantación y condicionan con frecuencia que el paciente demore el inicio de la DP o que tenga que ser transferido a hemodiálisis1,2. Por ello, resulta de gran interés analizar qué factores pueden influir en la disfunción del catéter. Los nefrólogos fueron responsables de la inserción del catéter de PD desde los primeros tiempos de la técnica. Sin embargo, ha habido una disminución progresiva en el interés de los nefrólogos en la realización de este procedimiento. Algunas de las razones de esta observación son la falta de formación en la técnica de implantación del catéter en los programas de formación de la especialidad, el inadecuado reembolso por el procedimiento para los clínicos y la falta de tiempo para estos menesteres por los nefrólogos en general. En consecuencia, la inserción del catéter PD se ha convertido en un procedimiento realizado de forma rutinaria principalmente por los cirujanos de todo el mundo3. Sin embargo, en los últimos años parece que hay una nueva corriente que alienta la implicación de los nefrólogos en el proceso de colocación del catéter. También se ha unido al grupo de posibles profesionales que colocan catéteres de DP los radiólogos intervencionistas, con unos buenos resultados4. En el presente estudio se analiza un factor clave: la técnica de implantación y quién realiza el procedimiento. A pesar de que cabría esperar que la técnica laparoscópica (capaz de visualizar la cavidad peritoneal, resolver adherencias o recortar el omento) tuviera un 42 NefroPlus 2016 Vol. 8 N.° 1 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA mayor éxito en la colocación de los catéteres, según este estudio, son los nefrólogos, con la implantación percutánea del catéter, los que consiguen una mayor tasa de pacientes que inician el programa de DP y, además, en un menor tiempo. Algunos de los factores a los que se achaca este resultado son la implicación directa del profesional que coloca el catéter en el devenir del paciente y, sobre todo, que la implantación se realiza en el momento adecuado. Todo ello puede redundar en un incremento en las tasas de utilización de la DP como modalidad de tratamiento renal sustitutivo5. Las fortalezas de este estudio residen en que es un estudio poblacional, con un amplio tamaño muestral y con una procedencia multicéntrica de los datos. Por el contrario, tiene una serie de limitaciones, como son datos relativos a causas de no inicio de la DP (relacionadas con el propio funcionamiento del catéter, infecciones, el proceso educativo), la función renal en el momento de la implantación o factores sociales o psicosociales que podrían condicionar un retraso o no iniciar la DP. Como siempre, se necesita más información que pueda instruirnos sobre cuándo es el mejor momento para colocar el catéter y cómo definir claramente el proceso de colocación y los pasos que se han de seguir a continuación para reducir ese 17 % de pacientes a los que se les coloca un catéter de DP y finalmente no inician esa técnica dialítica. ■■ CONCLUSIONES DEL REVISOR El presente trabajo, con una amplia base de datos, pone en valor el papel del nefrólogo en el procedimiento de colocación de los catéteres de DP. No solo obtiene una alta tasa de catéteres normofuncionantes, sino que parece que los pone en el momento adecuado. Sería muy interesante analizar qué estrategias se pueden implementar para favorecer que cada vez más nefrólogos sean los responsables de la colocación de los catéteres de DP. REFERENCIAS BIBLIOGRÁFICAS 1. Kolesnyk I, Dekker FW, Boeschoten EW, Krediet RT. Time-dependent reasons for peritoneal dialysis technique failure and mortality. Perit Dial Int 2010;30:170-7. 2. Descoeudres B, Koller MT, Garzoni D, Wolff T, Steiger J, Schaub S, et al. Contribution of early failure to outcome on peritoneal dialysis. Perit Dial Int 2008;28:259-67. 3. De Moraes TP, Campos RP, de Alcántara MT, Chula D, Vieira MA, Riella MC, et al; Investigators of BRAZPD. Similar outcomes of catheters implanted by nephrologists and surgeons: analysis of the Brazilian peritoneal dialysis multicentric study. Semin Dial 2012;25:565-8. 4. Voss D, Hawkins S, Poole G, Marshall M. Radiological versus surgical implantation of first catheter for peritoneal dialysis: a randomized non-inferiority trial. Nephrol Dial Transplant 2012;27:4196-204. 5. Goh BL, Ganeshadeva YM, Chew SE, Dalimi MS. Does peritoneal dialysis catheter insertion by interventional nephrologists enhance peritoneal dialysis penetration? Semin Dial 2008;21:561-6. NefroPlus 2016 Vol. 8 N.° 1 43 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA ¿Mejora la icodextrina la resistencia a la insulina en los pacientes no diabéticos en diálisis peritoneal automática? De Moraes TP, Andreoli MC, Canziani ME, da Silva DR, Caramori JC, Ponce D, et al. Icodextrin reduces insulin resistence in non-diabetic patients undergoing automated peritoneal dialysis: results of a randomized controlled trial (STARCH). Nephrol Dial Transplant 2015;30:1905-11 Análisis crítico: Ana Rodríguez-Carmona, Miguel Pérez Fontán Servicio de Nefrología. Complejo Hospitalario Universitario. A Coruña NefroPlus 2016;8(1):44-46 ■■ Tipo de diseño Ensayo clínico aleatorizado, multicéntrico, abierto y con ramas paralelas, realizado entre octubre de 2009 y febrero de 2013, con seguimiento de 3 meses. ■■ Diseño del ensayo Aleatorización 1:1 al grupo de intervención (icodextrina) o al grupo control (glucosa) desde un centro de coordinación del estudio y mediante un programa específico. ■■ Ámbito Centros de diálisis peritoneal brasileños de siete distritos de las regiones noreste, sudeste y sur del país, coordinados por la Universidad Pontificia Católica de Paraná. ■■ Pacientes Criterios de inclusión Pacientes adultos no diabéticos tratados con diálisis peritoneal automática durante al menos 90 días y con un test de equilibrio peritoneal reciente que mostraran un transporte peritoneal, expresado como D/P de creatinina a 240’, superior a 0,50. Criterios de exclusión Negativa a participar en el estudio, índice de Charlson superior a 7, esperanza de vida inferior a un año, serología para virus de la inmunodeficiencia humana positiva, peritonitis en el mes previo, hospitalización de causa cardiovascular, metabólica o infecciosa en el mes anterior, neoplasia activa, embarazo, alergia al maíz o KT/V inferior a 1,7. ■■ Cálculo del tamaño muestral Estimado en 60 pacientes en cada brazo del estudio, calculando una tasa de abandono del 30 %. Necesario para poder detectar una reducción del índice HOMA del 25 % con una potencia estadística superior al 80 % y para un 5 % de nivel de significación bilateral. El comité coordinador programó un análisis intermedio para cuando se hubiera completado un reclutamiento del 50 % de lo programado, con el fin de analizar los resultados y disminuir riesgos innecesarios a los pacientes. 44 NefroPlus 2016 Vol. 8 N.° 1 n n n ■■ Intervenciones De 64 pacientes escrutados se distribuyó a 60 aleatoriamente: –– Grupo de intervención: 33 pacientes tratados con 2 litros de icodextrina en el intercambio diurno. –– Grupo control: 27 pacientes tratados con 2 litros de glucosa al 2,5 %. La prescripción nocturna (volumen y concentración de glucosa) fue ajustada por los clínicos encargados de los pacientes para obtener ultrafiltración y adecuación correctas. Las extracciones sanguíneas se hicieron tras 10 horas de ayuno y los análisis se realizaron en un laboratorio centralizado. ■■ Variables de seguimiento Variable principal Variación del índice HOMA entre la situación basal y tras 3 meses de seguimiento. Variables secundarias Glucemia en ayunas, insulina, hemoglobina glucosilada, cambios en el índice de masa corporal y carga de glucosa diaria. Todas las variables se estimaron en situación basal, a los 45 y a los 90 días de seguimiento. ■■ Estadística Los resultados se expresan como frecuencias para variables categóricas, medias con desviación estándar para variables de distribución normal y como mediana para las variables que no tienen distribución normal. Las diferencias entre los grupos se analizaron me­diante x2 para variables categóricas, t de Student para variables continuas de distribución normal y Mann-­Withney para las de distribución no normal. Se empleó el análisis de covarianza utilizando los datos basales como covariable, los grupos como factor fijo y el valor obtenido a los 40 días como variable dependiente. ■■ Promoción y conflicto de intereses Estudio promovido y financiado por Baxter. El promotor no intervino en la interpretación de los resultados ni en la preparación del artículo. Varios autores de la publicación reconocen haber sido consultores y haber recibido apoyo económico de Baxter. RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA ■■ RESULTADOS PRINCIPALES Análisis basal Los grupos basales eran homogéneos, sin diferencias en edad, proporción de mujeres, tensión arterial, índice de Charlson e índice de masa corporal. Proporción similar de pacientes en diferentes estratos de transporte peritoneal e idéntica carga de glucosa diaria. Los pacientes del grupo de intervención llevaban más años en diálisis. Variable principal El estudio fue suspendido tras el análisis intermedio, al objetivarse un resultado claramente favorable para la variable principal en el grupo de tratamiento con icodextrina. Tras ajuste a los niveles de HOMA previos a la intervención, los niveles del grupo con icodextrina eran de 1,49 frente a 1,89 del grupo control a los 3 meses. La variación del índice HOMA es significativa para los pacientes con icodextrina (niveles decrecientes) con respecto a los pacientes tratados con glucosa. Variables secundarias La glucosa en ayunas no mostró diferencia entre los grupos, ni al inicio ni durante el estudio. La insulinemia, ajustada para los niveles previos a la intervención, fue superior en el grupo control (7,89 mmol/l) que en el grupo con icodextrina (6,32 mmol/l), aunque ya se observaba una diferencia en el patrón basal entre los grupos de estudio y control. La hemoglobina glucosilada mostró valores similares entre los grupos, tanto antes de la intervención como después. La ultrafiltración fue superior en el grupo que utilizaba icodextrina, tanto en el intercambio largo como en el total de 24 horas, frente al grupo control (320 ml frente a –80 ml y 800 ml frente a 586 ml, respectivamente). Efectos adversos Hubo 25 efectos adversos: 10 en el grupo control y 15 en el grupo de intervención. De ellos, 6 fueron considerados graves: 4 en el grupo control y 2 en el de intervención. Hubo un fallecimiento de causa cardiovascular en el grupo control. ■■ CONCLUSIONES DE LOS AUTORES En pacientes no diabéticos tratados con diálisis peritoneal automática, la utilización de la icodextrina durante el intercambio de larga permanencia mejora la resistencia a la insulina medida a través del índice HOMA, debido a una disminución de exposición a la glucosa. Si esta mejoría de la resistencia a la insulina puede dar lugar a mejoría en el pronóstico o incluso en la mortalidad de estos pacientes, debe comprobarse en futuros estudios. ■■ COMENTARIOS DE LOS REVISORES La insuficiencia renal crónica asocia trastornos metabólicos, entre los que se encuentra la resistencia a la insulina, que se ha relacionado con una mayor morbilidad y mortalidad cardiovascular. Además, la diálisis peritoneal utiliza glucosa como agente osmótico y la continua absorción de esta puede empeorar dicha resistencia, producir hiperglucemia o diabetes de novo. Estudios realizados en diabéticos (como el ensayo IMPENDIA) han puesto en evidencia que el buen control metabólico, medido por hemoglobina glucosilada, ofrece ventajas metabólicas a los pacientes tratados con diálisis peritoneal. El presente estudio compara el control metabólico de pacientes en diálisis peritoneal automática según utilicen glucosa al 2,27 % o icodextrina en el intercambio de larga duración. No se encontraron diferencias en la hemoglobina glucosilada, pero sí en el índice HOMA, con diferencias significativas a los 90 días de seguimiento. Principales limitaciones observadas: –– Desequilibrio importante en cuanto a la permanencia previa en diálisis peritoneal entre los grupos de estudio, lo que sugiere una aleatorización defectuosa. –– Tasas inusualmente altas de abandono del estudio en los dos grupos, sobre todo para un estudio con un seguimiento de 3 meses, para las que los autores no dan una explicación. NefroPlus 2016 Vol. 8 N.° 1 45 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA –– El índice HOMA no está validado como estimador metabólico en este contexto (no diabéticos en diálisis peritoneal), por lo que el significado de las diferencias observadas es incierto. –– La extracción de las muestras se realizó entre 1 y 3 horas tras finalizar la sesión nocturna. Sin embargo, no existen validaciones previas de que sea el intervalo de tiempo adecuado para hacerlo. Los pacientes con glucosa diurna secretan insulina de manera secundaria a la absorción de glucosa, y no lo harán los que realizan el cambio con icodextrina. ■■ CONCLUSIONES DE LOS REVISORES Estudio multicéntrico y aleatorizado que muestra una aparente reducción a corto plazo del índice HOMA en pacientes no diabéticos en diálisis peritoneal automática cuando se usa icodextrina en lugar de glucosa como agente osmótico para el cambio diurno. Problemas metodológicos menores (posibles anomalías en la aleatorización, tasa de abandonos inusualmente alta) y, sobre todo, variable resultado de significado incierto en el contexto analizado. ■■ CLASIFICACIÓN Tema: Resistencia a la insulina Subtema: Icodextrina en diálisis peritoneal automática Tipo de artículo: Ensayo clínico aleatorizado, multicéntrico, abierto y paralelo Palabras clave: Diálisis peritoneal. Icodextrina. No diabéticos. Resistencia a la insulina NIVEL DE EVIDENCIA: Moderado GRADO DE RECOMENDACIÓN: Débil REFERENCIAS BIBLIOGRÁFICAS 1. Shinohara K, Shoji T, Emoto M, Tahara H, Koyama H, Ishimura E, et al. Insulin resistance as an independent predictor of cardiovascular mortality in patients with end-stage renal disease. J Am Soc Nephrol 2002;13:1894-900. 2. Fortes PC, de Moraes TP, Mendes JG, Stinghen AE, Ribeiro SC, Pecoits-Filho R. Insulin resistance and glucose homeostasis in peritoneal dialysis. Perit Dial Int 2009;29(Supl 2):S145-8. 3. Sánchez-Villanueva R, Estrada P, del Peso G, Grande C, Díez JJ, Iglesias P, et al. Repeated analysis of estimated insulin resistance using the HOMAIR index in nondiabetic patients on peritoneal dialysis and its relationship with cardiovascular disease and mortality. Nefrologia ­ 2013;33:85-92. 4. Li PK, Culleton BF, Ariza A, Do JY, Johnson DW, Sanabria M, et al. Randomized, controlled trial of glucose-sparing peritoneal dialysis in diabetic patients. J Am Soc Nephrol 2013;24:1889-900. 46 NefroPlus 2016 Vol. 8 N.° 1 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA La propensión a calcificación sérica es un determinante fuerte e independiente de mortalidad cardíaca y por todas las causas en pacientes trasplantados renales Dahle DO, Åsberg A, Hartmann A, Holdaas H, Bachtler M, Jenssen TG, et al. Serum calcification propensity is a strong an Independent determinant of cardiac and all-cause mortality in kidney transplant recipients. Am J Transplant 2016;16:204-12. Análisis crítico: Minerva Rodríguez García1, Pablo Román García2 1 Servicio de Nefrología. Hospital Universitario Central. Asturias 2 Servicio de Metabolismo Óseo y Mineral. Hospital Universitario Central. Asturias NefroPlus 2016;8(1):47-50 ■■ Objetivo Examinar la asociación entre el marcador de propensión de calcificación (tiempo de transformación [T50] de partículas de calciproteína primarias a secundarias1) y la mortalidad en una gran cohorte de trasplantados renales incidentes noruegos2, con el fin de analizar la mortalidad cardíaca y determinar la asociación con la progresión de la rigidez aórtica en un período corto de tiempo. ■■ Tipo de diseño El estudio es un estudio observacional de asociación de un marcador de propensión de calcificación con variables clínicas y end-points. Dichos end-points son mortalidad total y cardiovascular (infarto, fallo cardíaco y muerte súbita) y progresión de velocidad de pulso. ■■ Pacientes y seguimiento Criterios de inclusión Se incluyeron en este estudio pacientes trasplantados renales o renal-pancreáticos (a partir de aquí nos referiremos a ellos como trasplantados renales, incluyendo ambos grupos) que fueron examinados durante los períodos 2000-2003 (primer período) y 2009-2012 (segundo período). Se incluyeron en este estudio los pacientes que se sometieron a trasplante entre el 30 de diciembre de 1999 y el 21 de octubre de 2003 (primer período) y entre los años 2009 y 2012 (segundo período). ■■ Ámbito Pacientes reclutados en Noruega. Realización de 250300 trasplantes anuales, todos en Oslo. ■■ Metodología Las características clínicas y la propensión a la calcificación (T50) se midieron en 1.435 pacientes, 10 semanas después del trasplante renal durante el 2000-2003 (primer período) y durante 2009-2012 (segundo perío- do). Los pacientes del primer período se incluyeron para análisis de los efectos a largo plazo del T50. A 589 pacientes del segundo período (2009-2012) se les medía la velocidad de la onda de pulso aórtica a las 10 semanas del trasplante y al año. El período del 2004 al 2008 se excluyó por tener ya suficiente tamaño muestral. ■■ Evaluaciones Terapia inmunosupresora El tratamiento estándar inmunosupresor consistió en terapia de inducción con basiliximab y metilprednisolona seguido por terapia de mantenimiento con prednisolona, micofenolato y ciclosporina o tacrolimus. En el primer período, la ciclosporina fue el anticalcineurínico de elección. Del 2009 al 2012 el tacrolimus fue el preferido para pacientes de menos de 50 años y la ciclosporina en pacientes mayores y con índice de masa corporal ≥ 28 o con intolerancia a la glucosa. Desde el 2009 se redujeron las dosis de esteroides y desde el 2012 se prefirió el tacrolimus. Los inhibidores de mTOR se administraron a un número pequeño de pacientes. Medidas bioquímicas Se realizaron de forma centralizada. La tendencia a la calcificación se analizó en sangre de biobanco. Determinación de la tendencia a la calcificación Se determinó usando un método de reciente desarrollo que evalúa la propensión de sufrir calcificación sérica. El suero de los pacientes se “supersatura” con calcio y fosforo y se mide su resistencia a la calcificación, mediada por la fetuina A, esencial para la formación de calciproteínas3. Técnicamente, se usan técnicas ópticas de nefelometría (turbidimetría) para medir el tiempo (T50) de transformación in vitro del 50 % de las partículas de calciproteína (no saturadas con hidroxiapatita) a secundarias (supersaturadas). Por lo tanto, un T50 acelerado indica una capacidad sérica disminuida para NefroPlus 2016 Vol. 8 N.° 1 47 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA resistir la calcificación y una mayor propensión a la calcificación. Medidas vasculares Se midió de forma secuencial la onda de pulso en la carótida y en la arteria femoral contralateral al trasplante. La progresión de la rigidez de la onda de pulso se definió como aceleración de más de 1 m/s al año de seguimiento. Se midió a la semana 10 y después de un año en 589 pacientes de la segunda fase. Datos de mortalidad Se recogieron del Registro Renal Noruego. ■■ Estadística Las variables se representaron en relación con los cuartiles de T50. La asociación entre cuartiles de T50 y mortalidad se visualizaron con gráficas de Kaplan-Meier y analizado mediante log-rank test. La asociación independiente entre cuartiles de T50 y mortalidad se analizó con regresiones de Cox ajustadas. Las correlaciones de T50 con parámetros clínicos, de modo cross-sectional, se evaluaron con modelos de regresión lineal multivariable con selección de covariables de modo stepwise. ■■ RESULTADOS –– De los 1.886 pacientes trasplantados renales seleccionados inicialmente, 1.435 entraron a participar en el estudio. –– El T50 presentó una distribución normal. –– Los datos clínicos que correlacionaban de forma independiente con el T50 fueron: fosfato, albúmina, dosis de prednisolona ≥ 12,5 mg, donante cadáver, diabetes, altos niveles de inhibidores de calcineurina, primer trasplante, rechazo y primer período (años 2000-2003). –– Cuando se comparó a pacientes con inhibidores de la calcineurina (96,4 %) con pacientes con inhibidores de m-TOR (27 pacientes, 1,9 %), estos últimos tenían un mayor T50. –– Durante una mediana de seguimiento de 5,1 años (3,5-11,6 años), 283 pacientes fallecieron, 70 de ellos por causa cardíaca. Los cuartiles más bajos de T50 sérico se asociaron fuertemente con incremento de todas las causas de mortalidad y mortalidad cardíaca. –– El T50 se evaluó en un modelo que contenía marcadores pronósticos validados previamente como marcadores de mortalidad; la fuerza relativa de los predictores se muestra en la figura 1. –– Durante el segundo período (2009-2012), 725 pacientes tenían valores de la velocidad de la onda de pulso aórtica en la medida basal (a las 10 semanas después del trasplante) y 589 de estos pacientes tenían al año medidas repetidas de la velocidad de la onda de pulso aórtica. Durante el primer año después del trasplante no hubo cambios significativos en la media de la onda de pulso aórtica, aunque 156 pacientes (26,4 %) tenían un incremento en la onda de pulso mayor de 1 m/s. Los niveles de T50 no se asociaron con la medida de la onda de pulso o con la progresión. Mortalidad global Hazard ratio 0,5 1 2 Mortalidad CV Hazard ratio 4 0,5 0.5 1 2 4 Edad, por cada 20 años Fumadores vs nunca fumadores Diabetes T50 % por cada 100 min menos Enfermedad coronaria Tiempo en TRS, cada 2 años Creatinina, por cada 45 umol/l Exfumador vs nunca fumador Figura 1. Factores de riesgo de mortalidad. Modelo mutivariable de Cox basado en factores de riesgo 10 semanas despues del trasplante renal. Los hazard ratios corresponden al cambio de rango intercuartílico en predictores continuos y la presencia frente a la ausencia de predictores categóricos. El riesgo de muerte estaba igualmente aumentado por un descenso del rango intercuartílico en T50 y la presencia de enfermedad coronaria y diabetes. TRS: terapia renal sustitutiva; T50: mitad del tiempo máximo de transformación de la propensión a la calcificación del suero. 48 NefroPlus 2016 Vol. 8 N.° 1 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA ■■ CONCLUSIONES DE LOS AUTORES Se demuestra que en una gran muestra examinada de pacientes trasplantados renales, el incremento de la propensión de calcificación sérica (T50 reducida) es un predictor fuerte e independiente de mortalidad. Comparado con el cuartil más alto de T50, el cuartil más bajo se asocia con el doble riesgo de mortalidad por todas las causas, conduciendo a un incremento de 4 a 5 veces en el riesgo de mortalidad cardíaca. Sin embargo, no se encontró asociación entre la propensión a la calcificación y la progresión a corto plazo en rigidez aórtica, determinada como progresión de la velocidad de la onda de pulso aórtica en un año. Consecuentemente, indica que la propensión a la calcificación está estrechamente relacionada con un incremento de la mortalidad cardíaca en trasplante renal, pero ese efecto no está mediado primariamente por un incremento detectable en la rigidez aórtica en un año de estudio. Limitaciones del estudio Es un diseño observacional con las consecuentes limitaciones. Merece la pena destacar que carece de pruebas de imagen de calcificaciones vasculares, lo que dificulta extraer conclusiones directas, y que la tasa de muerte súbita es muy alta y es la mayor causa de mortalidad cardiovascular. También cabe mencionar la falta de marcadores inflamatorios, ya que las partículas de calciproteína secundarias son proinflamatorias y su aclaramiento se relaciona con la actividad macrofágica. Este incremento en la inflamación puede estar desempeñando un papel en la mortalidad no reflejado en los datos de rigidez. ■■ COMENTARIOS DE LOS REVISORES La calcificación vascular se asocia a morbimortalidad cardiovascular en los pacientes con enfermedad renal crónica y en pacientes trasplantados renales. El estudio mostrado es un estudio observacional de una muestra amplia de trasplantados renales en dos períodos diferentes de estudio. Se demuestra la relación entre la propensión a la calcificación sérica y la mortalidad cardíaca y por todas las causas, aunque no se ha conseguido demostrar la relación entre la propensión a la calcificación vascular y el aumento de la rigidez aórtica. Ya los autores muestran que existe un aumento de velocidad en la onda de pulso aórtica en el 26,4 % de los pacientes, y aunque esa relación no es significativa, probablemente con un tiempo mayor de seguimiento se podría demostrar esta relación. Son muy interesantes los datos que se muestran sobre una menor propensión de calcificación sérica en los pacientes tratados con inhibidores mTOR frente a pacientes tratados con anticalcineurínicos, aunque el número pequeño de pacientes con dicho tratamiento dificulta la posibilidad de sacar más conclusiones. Debido a la facilidad de la prueba, su reproducibilidad y que es un reflejo de funcionalidad de la cascada de calcificación, podría ser útil la realización de estas mediciones en la práctica clínica en el futuro si se confirmaran con estudios prospectivos o ensayos clínicos los resultados obtenidos en este estudio. Además, el disponer de pruebas de imagen y poder estudiar la progresión de la calcificación en este sentido podría añadir información adicional importante. ■■ CONCLUSIONES DE LOS REVISORES Se trata de un estudio observacional en pacientes trasplantados renales que aplica la realización de medidas de propensión a la calcificación y obtiene resultados relacionados con la mortalidad, tanto cardíaca como por todas las causas. Representa una novedad tecnológica por la aplicación de la medida del T50, que se puede considerar una medida semifuncional. Sin embargo, el haber tenido el control de la velocidad de la onda de pulso aórtico solo a un año y no disponer de técnicas de imagen ha limitado los resultados en el ámbito cardiovascular. Es un estudio interesante, con una fuerte asociación estadística, una cohorte amplia, métodos estadísticos adecuados y que apunta a que la determinación del T50 puede tener aplicaciones clínicas futuras. ■■ CLASIFICACIÓN Tema: Calcificación vascular Subtema: Nefrología clínica Tipo de artículo: Original Palabras clave: Calcificación vascular. Calciproteínas. Rigidez arterial. Trasplante renal NefroPlus 2016 Vol. 8 N.° 1 49 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA NIVEL DE EVIDENCIA: Una mayor propensión a calcificación sérica se asoció estrechamente con una mayor mortalidad. Sin embargo, no se encontró asociación con la rigidez arterial. GRADO DE RECOMENDACIÓN: Media-alta REFERENCIAS BIBLIOGRÁFICAS 1. Kuro-o, M. Calciprotein particle (CPP): a true culprit of phosphorus woes? Nefrologia 2014;34:1-4. 2. Reisaeter AV, Foss A, Hartmann A, Leivestad T, Midtvedt K. The kidney transplantation program in Norway since 2000. Clin Transpl. 2011:111-8. 3. Herrmann M, Schafer C, Heiss A, Graber S, Kinkeldey A, Buscher A, et al. Clearance of fetuin-A: containing calciprotein particles is mediated by scavenger receptor-A. Circ Res 2012;111:575-84. 50 NefroPlus 2016 Vol. 8 N.° 1 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA ¿Es seguro interrumpir la inmunosupresión durante el tratamiento con quimioterapia en los pacientes trasplantados renales con un síndrome linfoproliferativo postrasplante? Taylor E, Jones M, Hourigan MJ, Johnson DW, Gill DS, Isbel N, et al. Cessation of immunosuppression during chemotherapy for post-transplant lymphoproliferative disorders in renal transplant patients. Nephrol Dial Transplant 2015;30:1774-9. Análisis crítico: Frederic Cofan Servicio de Nefrología y Trasplante Renal. Hospital Clínic. Barcelona NefroPlus 2016;8(1):51-54 ■■ Objetivo Evaluar si la retirada de la inmunosupresión durante el tratamiento con quimioterapia y su reintroducción posterior a dosis bajas en los pacientes trasplantados renales con un síndrome linfoproliferativo postrasplante (PTLD, post-transplant lymphoproliferative disorders) se asocia a riesgo de provocar disfunción renal. ■■ Tipo de diseño Estudio observacional comparativo de cohortes retrospectivo controlado no aleatorizado. ■■ Ámbito Hospital Universitario Princesa Alexandra de Queensland, Australia. ■■ Pacientes Criterios de inclusión Pacientes trasplantados renales afectos de un síndrome linfoproliferativo postrasplante renal. Criterios de exclusión Muerte del paciente antes de iniciar el tratamiento, datos insuficientes, protocolo de retirada de la inmunosupresión inadecuado, rechazo agudo o crónico en el momento del diagnóstico del PTLD, no aplicación de quimioterapia CHOP-like, ausencia de paciente control adecuado. ■■ Intervenciones A los pacientes del grupo de estudio (pacientes trasplantados renales con PTLD en ausencia de criterios de exclusión) se les retiró la inmunosupresión durante el tratamiento con quimioterapia y se reintrodujo 6 semanas después a dosis bajas (< 50 % de la dosis del inhibidor de la calcineurina previa a la quimioterapia, supresión del fármaco coadyuvante [micofenolato o azatioprina] y prednisona < 10 mg/día). El grupo de estudio se comparó con un grupo control (función renal, duración del trasplante, edad, sexo y año de trasplante). ■■ Variables de resultado Variable principal Deterioro de la función renal definida por el incremento del 25 % de los niveles de creatinina sérica durante un período > 3 meses. Variables secundarias Pérdida del injerto renal con reinicio de diálisis, retrasplante, recaída del PTLD, supervivencia del paciente. ■■ Tamaño muestral No existe un cálculo del tamaño muestral. Se analizan retrospectivamente dos cohortes de pacientes. El grupo de estudio inicialmente consistió en 49 pacientes, que se redujo a 24 al aplicar los criterios de exclusión. No se especifica el tamaño muestral necesario para detectar diferencias entre los dos grupos. Por cada caso se estableció una media de 1 a 4 controles. ■■ Análisis estadístico El análisis del tiempo hasta el evento, el riesgo de pérdida del injerto y de muerte se realizó mediante estudio multivariante de análisis de regresión de Cox y análisis de riesgos competitivos. ■■ Ética y registro Estudio aprobado por el Human Research and Ethics Commitee del Hospital Princesa Alexandra. ■■ Promoción y conflicto de intereses Los autores declaran no tener conflicto de interés. Los resultados de este estudio no han sido presentados previamente excepto en formato abstract. NefroPlus 2016 Vol. 8 N.° 1 51 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA ■■ RESULTADOS PRINCIPALES Análisis basal de los grupos Se analizó una cohorte de 24 pacientes trasplantados renales con síndrome linfoproliferativo postrasplante renal entre 1994 y 2010 en ausencia de los criterios de exclusión y se compararon con una cohorte de 83 pacientes trasplantados renales sin PTLD controlados por edad, sexo, función renal y duración del trasplante. El grupo control fue ciego para la variable de evolución. La mediana de seguimiento de los casos fue de 11,9 años. Tabla 1. Características basales principales de los dos grupos Casos PTLD (n = 24) Control (n = 83) p Edad media en el trasplante (años) 32 (17-54) 33 (16-56) 0,6 Edad media al inicio del estudio (años) 44 (18-66) 44 (17-67) 0,9 9 (0,4-23) 9 (0,2-22) 0,5 1992 (1971-2003) 2000 (1970-2010) Duración del trasplante (años) Año de trasplante Creatinina al inicio de estudio (umol/l) Varones Donante vivo < 0,001 120 (85-270) 120 (81-373) 0,8 18 (75 %) 63 (76 %) 0,9 4 (17 %) 26 (31 %) 0,2 Los dos grupos fueron comparables en cuanto a edad, sexo, duración del trasplante y función renal. Los casos fueron trasplantados significativamente antes que los controles. Variable principal En total, 11 casos presentaron durante el seguimiento un deterioro > 25 % de la creatinina sérica en un período de 43 meses en comparación con 16 controles en un período de 31 meses. El tiempo en presentar un deterioro de la función renal no fue significativamente diferente entre los dos grupos, tanto en el análisis de riesgos competitivos (hazard ratio [HR] 1,8; intervalo de confianza [IC] de 95 % 0,89-3,6; p = 0,1) como en el análisis multivariante de regresión de Cox (HR 1,19; IC 95 % 0,44-3,23; p = 0,73). La prevalencia de deterioro de la función renal a los 5 años no fue diferente entre el grupo de PTLD (35 %) frente al grupo control (20 %) (p = 0,1). Variables secundarias No se observaron diferencias en el riesgo de pérdida del injerto con reinicio de diálisis entre los dos grupos, tanto en el análisis de Cox (HR 3,0; IC 95 % 0,57-16,0; p = 0,19) como en el método de riesgos competitivos (HR 2,5; IC 95 % 0,47-13,0; p = 0,28). La supervivencia del paciente a los 5 años fue inferior en los casos (70 %) en comparación con los controles (94 %) (p = 0,01). ■■ CONCLUSIONES DE LOS AUTORES La retirada de la inmunosupresión durante la quimioterapia para PTLD en pacientes trasplantados renales es segura. La reducción posterior de la inmunosupresión no se asocia con un mayor riesgo de presentar disfunción renal a medio o largo plazo. ■■ COMENTARIOS DE LOS REVISORES El síndrome linfoproliferativo postrasplante renal es una complicación grave relacionada con la inmunosupresión crónica del paciente trasplantado renal. La frecuencia es variable, pero actualmente se acepta que está en torno al 1 % (1-3 %) de los pacientes trasplantados renales. La patogénesis se ha relacionado con la proliferación de células B infectadas por el virus de Epstein-Barr (VEB). 52 NefroPlus 2016 Vol. 8 N.° 1 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA Los factores de riesgo más importantes son la intensidad de la inmunosupresión, el seroestatus del VEB y la duración del trasplante. La presentación clínica es muy variable: síndrome constitucional (fiebre, pérdida de peso), poliadenopatías, compresión de estructuras adyacentes o afectación orgánica (sistema nervioso central, pulmón, tracto gastrointestinal, hígado o el propio injerto renal). Existen diferentes formas histológicas según el grado de monoclonalidad celular. El tratamiento de las formas malignas requiere quimioterapia intensiva asociada a rituximab. El manejo de la inmunosupresión del trasplante renal en el paciente que recibe un tratamiento de quimioterapia siempre ha sido muy controvertido y se ha estudiado poco. Desde el punto de vista clínico, es habitual la reducción drástica de la inmunosupresión, o incluso su retirada en el período de administración de la quimioterapia. El autor demuestra que esta práctica no se asocia a disfunción renal. El mecanismo se debe al efecto inmunosupresor de los propios fármacos quimioterápicos (incluido el rituximab) y la severa leucopenia/linfopenia asociada, que hacen altamente improbable la aparición de un rechazo durante la interrupción de la inmunosupresión. Un aspecto diferente es la reintroducción de la inmunosupresión una vez finalizada la quimioterapia. Es difícil buscar el equilibrio en cada paciente entre el riesgo de presentar un rechazo por escasa inmunosupresión y el riesgo de recidiva del PTLD. No existe una guía clínica clara sobre la dosis o el tipo de inmunosupresor que hay que reintroducir. El autor propone la reintroducción con una reducción del 50 % de la dosis del inhibidor de la calcineurina (ciclosporina o tacrolimus) y la supresión del fármaco coadyuvante (micofenolato o azatioprina). No observa diferencias significativas en el riesgo de disfunción renal a medio-largo plazo ni en el riesgo de pérdida del injerto con necesidad de reiniciar diálisis. La supervivencia del grupo de pacientes con PTLD es lógicamente menor en comparación con el grupo control sano. En trasplante renal existe poca información. Además, los datos publicados suelen englobar otros trasplantes de órgano sólido y existen pacientes con formas de expresión del PTLD muy diferentes. En ocasiones, la reducción de la inmunosupresión es la forma única de tratar el PTLD, al tratarse de formas benignas con hiperplasia policlonal. Por tanto, es difícil comparar los resultados de este trabajo con la bibliografía1,2. No obstante, en un estudio reciente sobre 104 pacientes que desarrollaron un PTLD después de un trasplante renal o renopancreático, el análisis multivariante demostró que la retirada del inhibidor de la calcineurina fue el factor de riesgo más importante de pérdida del injerto (HR 3,07; IC 95 % 1,04-9,09; p = 0,04) y muerte (HR 4,00; IC 95 % 1,77-9,04; p < 0,001)3. El autor en este trabajo analiza un subgrupo relativamente homogéneo de pacientes con PTLD que requieren tratamiento con quimioterapia CHOP-like. El objetivo del estudio es adecuado y concreto. El método estadístico utilizado es robusto (análisis de regresión de Cox y modelo de riesgos competitivos). Se comparó con un grupo control bien seleccionado según edad, sexo, función renal y duración del trasplante. No obstante, la limitación principal del estudio es la muestra reducida (24 casos) que aumenta el error estadístico y el carácter retrospectivo del estudio. Se hace necesaria la realización de estudios prospectivos bien controlados que evalúen diferentes opciones de reintroducción de la inmunosupresión incluyendo los inhibidores de mTOR. ■■ CONCLUSIONES DE LOS REVISORES En pacientes trasplantados renales con PTLD, la retirada de la inmunosupresión durante la administración de quimioterapia es un procedimiento seguro a corto plazo. La reintroducción reducida de la inmunosupresión (mitad de dosis de ciclosporina/tacrolimus y la supresión de micofenolato/azatioprina) no tiene un impacto negativo a medio o largo plazo sobre la función real. El tamaño de la muestra y el diseño retrospectivo son insuficientes para analizar adecuadamente la repercusión real sobre la función del injerto renal o el riesgo de rechazo. ■■ CLASIFICACIÓN Tema: Síndrome linfoproliferativo postrasplante renal Subtema: Retirada de la inmunosupresión Tipo de artículo: Tratamiento. Pronóstico Palabras clave: Inmunosupresión. Síndrome linfoproliferativo postrasplante renal (PTLD, post-transplant lymphoproliferative disorder). Trasplante renal NIVEL DE EVIDENCIA: Moderado GRADO DE RECOMENDACIÓN: Débil (GRADE [www.gradeworkinggroup.org] divide la calidad de la evidencia en cuatro grupos: alta, moderada, baja y muy baja, y divide el grado de recomendación en dos grupos: fuerte y débil). NefroPlus 2016 Vol. 8 N.° 1 53 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA REFERENCIAS BIBLIOGRÁFICAS 1. Reshef R, Vardhanabhuti S, Luskin MR, Heitjan DF, Hadjiliadis D, Goral S, et al. Reduction of immunosuppression as initial therapy for posttransplantation lymphoproliferative disorder. Am J Transplant 2011;11:336-47. 2. Parker A, Bowles K, Bradley JA, Emery V, Featherstone C, Gupte G, et al; Haemato-oncology Task Force of the British Committee for Standards in Haematology and British Transplantation Society. Management of post-transplant lymphoproliferative disorder in adult solid organ transplant recipients - BCSH and BTS Guidelines. Br J Haematol 2010;149:693-705. 3. Rabot N, Büchler M, Foucher Y, Moreau A, Debiais C, Machet MC, et al. CNI withdrawal for post-transplant lymphoproliferative disorders in kidney transplant is an independent risk factor for graft failure and mortality. Transpl Int 2014;27:956-65. 54 NefroPlus 2016 Vol. 8 N.° 1 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA ¿Cuál es la mejor presión sistólica en el paciente no diabético de alto riesgo cardiovascular? The SPRINT Research Group. A randomized trial of intensive versus standard blood-pressure control. N Engl J Med 2015;373:2103-16. Análisis crítico: J. Bonet Sol, M. Troya Saborido Servicio de Nefrología y Trasplante Renal. Unidad de Hipertensión Arterial. Hospital Universitario Germans Trias i Pujol. Badalona, Barcelona NefroPlus 2016;8(1):55-58 ■■ Tipo de diseño y seguimiento Ensayo clínico multicéntrico aleatorizado, controlado y abierto. El estudio fue finalizado antes del plazo previsto a los 3,26 años de seguimiento porque el grupo de tratamiento intensivo de la presión sistólica presentaba menos acontecimientos cardiovasculares y muerte de todas las causas. ■■ Asignación Estudio aleatorizado, controlado y abierto. ■■ Enmascaramiento Ninguno. N ■■ Ámbito Pacientes reclutados en 102 consultas clínicas, coordinadas por 5 centros clínicos en Estados Unidos, incluyendo Puerto Rico. ■■ Pacientes Fueron valorados 14.692 pacientes no diabéticos, de edad superior a 50 años, presión sistólica entre 130 y 180 mmHg, riesgo cardiovascular alto según los criterios de Framingham y/o enfermedad renal crónica con filtrado estimado entre 20 a 60 ml por minuto y superficie corporal 1,73 m2. Finalmente, en el estudio se incluyeron 9.361. Fueron excluidos los pacientes con edad inferior a 50 años, diabéticos, con ictus previo, difícil control de la presión arterial y pacientes con poliquistosis. ■■ Intervenciones Los pacientes elegidos se asignaron a dos grupos según el objetivo que se deseaba alcanzar de presión sistólica. Grupo con presión sistólica inferior de 140 mmHg (tratamiento estándar) frente a inferior a 120 mmHg (tratamiento intensivo). La estratificación de la aleatorización en la consulta clínica la realizó un asignador externo. ■■ Variables de resultado Variable principal Los criterios principales de valoración fueron determinar qué presión arterial sistólica de los grupos aleatorizados presentaba mayor disminución de eventos cardiovasculares como infarto de miocardio, síndrome coronario agudo, ictus, insuficiencia cardíaca o muerte de origen cardiovascular. Variables secundarias Los criterios secundarios de valoración eran los mismos que los principales más muerte de cualquier causa. ■■ Tamaño muestral Con un reclutamiento de 9.250 participantes, se estimó que el estudio tenía un poder de detección del 88,7 % para detectar un 20 % de efecto sobre la variable principal, asumiendo una tasa de eventos del 2,2 % en el grupo de tratamiento estándar. ■■ Promoción El estudio ha sido esponsorizado por el National Heart, Lung and Blood Institute (NHLBI). Los laboratorios TAKEDA donaron azilsartán (ARA-II) y azilsartán con clortalidona a los pacientes a los cuales los clínicos creyeron oportuno administrárselo para el control de su presión sistólica, aunque el fármaco hipotensor más utilizado fueron los diuréticos. NefroPlus 2016 Vol. 8 N.° 1 55 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA ■■ RESULTADOS Tabla 1 Tratamiento intensivo Resultado Nº de pacientes Tratamiento estándar % por año Nº de pacientes Cociente de riesgo (IC del 95 %) Valor p % por año Todos los participantes (N = 4.678) (N = 4.683) Variable primaria 243 (5,2) 1,65 319 (6,8) 2,19 0,75 (0,64-0,89) < 0,001 Insuficiencia cardíaca 62 (1,3) 0,41 100 (2,1) 0,67 0,62 (0,45-0,84) 0,002 Muerte por causas cardiovasculares 37 (0,8) 0,25 65 (1,4) 0,43 0,57 (0,38-0,85) 0,005 Muerte por cualquier causa 155 (3,3) 1,03 210 (4,5) 1,40 0,73 (0,60-0,90) 0,003 Variable primaria o muerte 332 (7,1) 2,25 423 (9,0) 2,90 0,78 (0,67-0,90) < 0,001 Participantes sin ERC al inicio del estudio (N = 3.332) ≥ 30 % de reducción em filtrado glomerular estimado < 60 ml/min/1,73 m2 127 (3,8) 0,35 3,49 (2,44-5,10) < 0,001 Variables secundarias (N = 3.345) 1,21 37 (1,1) Tabla 2. Eventos adversos graves y eventos clínicos monitorizados Nº de pacientes (%) Tratamiento intensivo Tratamiento estándar Cociente de riesgo Valor p (N = 4.678) (N = 4.683) 1.793 (38,3) 1.736 (37,1) 1,04 0,25 Hipotensión 110 (2,4) 66 (1,4) 1,67 0,001 Síncope 107 (2,3) 80 (1,7) 1,33 0,05 Anomalías electrolitos 144 (3,1) 107 (2,3) 1,35 0,02 Deterioro renal agudo o insuficiencia renal aguda 193 (4,1) 117(2,5) 1,66 < 0,001 Hipotensión 158 (3,4) 93 (2,0) 1,70 < 0,001 Síncope 163 (3,5) 113 (2,4) 1,44 0,003 Anomalías electrolitos 177 (3,8) 129 (2,8) 1,38 0,006 Deterioro renal agudo o insuficiencia renal aguda 204 (4,4) 120 (2,6) 1,71 < 0,001 Variable Eventos adversos graves Condiciones de interés Eventos adversos graves solo Visita a emergencias o evento adverso grave 56 NefroPlus 2016 Vol. 8 N.° 1 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA ■■ CONCLUSIONES DE LOS AUTORES La presión sistólica inferior a 120 mmHg comparada con inferior a 140 mmHg en pacientes de alto riesgo cardiovascular pero sin diabetes presenta una menor tasa de acontecimientos cardiovasculares mortales y no mortales, así como de muerte de cualquier causa. ■■ COMENTARIOS DE LOS REVISORES Breves comentarios metodológicos sobre el estudio SPRINT: –– Excluye del estudio a pacientes de difícil control de la presión arterial, ictus previo y diabetes. –– Un 9,5 % del total de la muestra nunca recibe tratamiento hipotensor. –– El número de hipotensores recibidos oscila entre 1,8 en tratamiento estándar y 2,8 en tratamiento intensivo. El hipotensor más utilizado en el estudio fueron los diuréticos, y entre ellos la clortalidona. –– Casi el 30 % de los pacientes del estudio tenían 75 o más años y un 31 % eran de raza negra. –– La mayoría de los pacientes presentaban sobrepeso, el 51 % tomaban ácido acetilsalicílico, el 44 % estatinas y el 13 % eran fumadores activos. –– La n de pacientes reclutados para el estudio está ajustada para la valoración de la variable principal compuesta, y con los resultados obtenidos se observa que se deben tratar intensamente su presión sistólica 61 pacientes para observar una mejoría de eventos cardiovasculares y 91 cuando se analiza la causa de la muerte. –– La presión sistólica en el grupo de tratamiento intensivo fue de 121,4/68,7 mmHg y en el estándar de 136,2/76,3 mmHg, partiendo en ambos grupos de una basal de 138,7/78 mmHg –– El grupo de tratamiento intensivo tuvo más eventos adversos que el grupo de tratamiento estándar. Las consecuencias clínicas del estudio vuelven a incidir sobre cuál debe ser la mejor presión sistólica en el ser humano después de que estudios como ACCORD, publicado en 2010, en pacientes diabéticos no encontraran diferencias significativas sobre las mismas variables cardiovasculares y muerte en los pacientes con tratamiento intensivo; ello tuvo una repercusión notable posterior, ya que las guías europeas, y sobre todo la norteamericana, aconsejaron cifras de presión arterial sistólica normales hasta 150 mmHg en pacientes mayores de 60 años. Por ello, los resultados del estudio SPRINT, al descender el riesgo relativo un 43 % la causa de muerte de origen cardiovascular en el grupo de tratamiento intensivo, y que fue evidente a partir de los 2 años de seguimiento del estudio, sustentan una mayor toma de decisiones de tratamiento farmacológico basado en el riesgo relativo de muerte y enfermedad cardiovascular del paciente. ■■ CONCLUSIONES DE LOS REVISORES El estudio SPRINT replantea de nuevo al clínico hasta dónde deben descender las cifras de presión arterial y cuál es la mejor cifra de presión arterial sistólica para disminuir los eventos cardiovasculares y la muerte en sus pacientes, después de unos años en que las guías clínicas del tratamiento de la hipertensión arterial habían adoptado unas cifras de control más laxas. Por su rápida aplicabilidad clínica e intervencionismo terapéutico agresivo, es seguro que tendrá un gran impacto su implantación, pero aconsejamos al clínico individualizar el tratamiento intensivo valorando las ventajas e inconvenientes que conlleva este tratamiento. ■■ CLASIFICACIÓN Tema: Hipertensión arterial Subtema: Nefrología clínica Tipo de artículo: Tratamiento Palabras clave: Acontecimientos cardiovasculares. Muerte. Presión arterial sistólica NIVEL DE EVIDENCIA: Alto GRADO DE RECOMENDACIÓN: Alto (Levels of evidence CEBM. Universidad de Oxford: http://www.cebm.net/levels_of_evidence.asp) ■■ NOTAS METODOLÓGICAS En el estudio SPRINT, entre el grupo de tratamiento intensivo y el estándar hubo una diferencia de 14,8 mmHg respecto a la presión sistólica a partir del primer año de seguimiento, aunque la cifra media de la sistólica era 121,4 mmHg, discretamente por encima NefroPlus 2016 Vol. 8 N.° 1 57 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA de 120. El importante descenso de la mortalidad del estudio se debe a que un descenso de 2 mmHg de la presión arterial sistólica se acompaña de un descenso entre el 7-10 % de la mortalidad cardiovascular, hecho ya conocido desde hace años en pacientes hipertensos. No hubo diferencias significativas entre los dos grupos al estudiar caídas como evento adverso, aunque sí con respecto a las hipotensiones y síncope, hecho remarcable debido a que un 28 % de la población del estudio tenía 75 o más años. Para finalizar, cabe destacar que queda pendiente de publicar de este estudio una parte muy importante, según nuestra opinión, que es conocer los resultados con respecto a qué repercusión tienen los objetivos de presión sistólica sobre la demencia, los cambios de la función cognitiva y la isquemia cerebral de pequeño vaso. ■■ NOTAS CLÍNICAS Desde comienzos del siglo xxi ha tomado especial relevancia el debate de cuál debe ser el mejor componente de control de la presión arterial, siendo la hipertensión sistólica en adultos de mediana edad y ancianos a la que se le ha asignado un especial protagonismo en varios estudios, ya que es la más frecuente en las sociedades desarrolladas por el envejecimiento progresivo de estas y porque la hipertensión sistólica está muy relacionada con la aparición de nuevos eventos cardiovasculares y muerte. Pero en 2010, con la publicación del estudio ACCORD, hubo un cambio del paradigma que apuntaba que era preferible mantener baja la presión arterial sistólica, ya que en pacientes diabéticos el tratamiento intensivo no evidenció mejoría de los eventos cardiovasculares y muerte; ello tuvo una implicación clínica importante, ya que las nuevas guías europeas y americanas del tratamiento de la hipertensión aconsejaban no tratar hasta presiones sistólicas superiores a 150 mmHg en pacientes mayores de 60 años. Por ello, el estudio SPRINT seguro tendrá una implicación clínica importante en el sentido inverso, ya que aconseja el tratamiento intensivo de la presión arterial sistólica en el paciente de alto riesgo cardiovascular no diabético, aunque para el clínico en el día a día de su actuación ello puede suponer un mayor esfuerzo debido a que será más importante que nunca individualizar la actitud terapéutica a tomar, ya que el tratamiento intensivo se acompaña de un mayor número de efectos secundarios, sobre todo en hipotensión, síncope, trastornos hidroelectrolíticos y pequeños deterioros de la función renal. REFERENCIAS BIBLIOGRÁFICAS 1. The SPRINT Research Group. A randomized trial of intensive versus standard blood-pressure control. N Engl J Med 2015;373:2103-16. 2. Diao D, Wright, Cundiff DK, Gueyffier F. Pharmacotherapy for mild hypertension Cochrane Database Syst Rev 2012;8:CD006742. 3. Franklin SS, Jacobs MJ, Wong ND, L’Italien GJ, Lapuerta P. Predominance of isolated systolic hypertension among middle-aged and elderly US hypertensives: analysis based National Health and Nutrition Examination Survey (NHANES) III. Hypertension 2001;37:869-74. 4. Prospective Studies Collaboration. Age-specific relevance of usual blood pressure to vascular mortality: A meta-analysis of individual data for one million adults in 61 prospective studies. Lancet 2002;360:1903-13. 5. Beckett NS, Peters R, Fletcher AE, Staessen JA, Liu L, Dumitrascu D, et al. Treatment of hypertension in patients 80 years of age or older. N Engl J Med 2008;358:1887-9. 6. ACCORD Study Group, Cushman WC, Evans GW, Byington RP, Goff DC Jr, Grimm RH Jr, et al. Effects of intensive blood-pressure control in type 2 diabetes mellitus. N Engl J Med 2010;362:1575-85. 7. Ettehad D, Emdin CA, Kiran A, Anderson SG, Callender T, Emberson J, et al. Blood pressure lowering for prevention of cardiovascular disease and death: a systematic review and meta-analysis. Lancet 2016;387:957-67. 58 NefroPlus 2016 Vol. 8 N.° 1 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA ¿El preacondicionamiento isquémico disminuye el fracaso renal en pacientes sometidos a cirugía cardíaca? Zarbock A, Schmidt C, Van Aken H, Wempe C, Martens S, Zahn PK, et al. Effect of remote ischemic preconditioning on kidney injury among high-risk patients undergoing cardiac surgery: a randomized clinical trial. JAMA 2015;313:2133-41. Análisis crítico: Raúl García-Castro, Roberto Alcázar-Arroyo Servicio de Nefrología. Hospital Universitario Infanta Leonor. Madrid NefroPlus 2016;8(1):59-62 ■■ Tipo de diseño y seguimiento Ensayo clínico controlado, prospectivo, aleatorizado, multicéntrico, estratificado y doble ciego. ■■ Asignación Aleatorizada mediante secuencia de números generados por ordenador. ■■ Enmascaramiento Doble ciego, controlado con grupo control. N ■■ Ámbito Hospitales Universitarios de Münster, Tübingen, Freiburg y Bochum (Alemania). ■■ Pacientes Criterios de inclusión Pacientes de alto riesgo para fracaso renal agudo, sometidos a cirugía cardíaca con el uso de bypass cardiopulmonar con un score de Cleveland de 6 o más. Criterios de exclusión Infarto de miocardio hasta 7 días antes de la cirugía, edad menor de 18 años, cirugía cardíaca fuera de bomba, fallo renal agudo previo, trasplante renal, enfermedad renal crónica con filtrado glomerular renal < 30 ml/min, embarazo, enfermedad vascular periférica que afecta a los miembros superiores, síndrome hepatorrenal y tratamiento con sulfonidamida o nicorandil. ■■ Intervenciones Diseño de grupo de intervención y grupo control. Tras la asignación de los pacientes a cada grupo, y una vez inducida la anestesia, antes de la incisión quirúrgica en la piel, se procede al preacondicionamiento isquémico mediante manguito de presión en uno de los dos brazos del paciente. En el grupo de intervención (GI) se realizan tres ciclos de 5 minutos cada uno, con inflado de manguito de presión hasta 200 mmHg (o al menos 50 mmHg por encima de la presión arterial sistólica), seguido de 5 minutos de reperfusión con el manguito desinflado. En el grupo control (GC) se realiza el preacondicionamiento isquémico mediante tres ciclos de pseudoisquemia de 5 minutos cada uno, con inflado de manguito de presión hasta 20 mmHg seguido de 5 minutos con manguito desinflado. ■■ Variables de resultado Variable principal Incidencia de fracaso renal agudo en las 72 horas siguientes tras la cirugía, definido según los criterios de las guías Kidney Disease: Improving Global Outcomes (KDIGO). Variables secundarias Gravedad del fracaso renal agudo en las 72 horas tras la cirugía, mortalidad a los 30 días por todas las causas, necesidad de terapia renal sustitutiva durante el ingreso, duración de soporte ventilatorio (ventilación mecánica), tiempo de estancia en la Unidad de Cuidados Intensivos, tiempo de estancia hospitalaria, fallecimiento durante el ingreso, concentración de diversos biomarcadores urinarios NGAL [TIMP-2 x IGFBP7] en las primeras 24 horas tras la cirugía e infarto de miocardio (infarto agudo de miocardio) y accidente cerebrovascular durante el ingreso. ■■ Tamaño muestral Suponiendo una incidencia esperada de fracaso renal agudo en el grupo control del 50 % y con una potencia del 80 %, el tamaño de la muestra requerido que se calculó fue de 117 pacientes por grupo de tratamiento, para un total de 234. ■■ Análisis estadístico Análisis estadístico por intención de tratar. Se comparan las medias de las variables principales entre los dos grupos, estableciéndose la significación estadística en p < 0,05. Se ha estimado el riesgo relativo y el riesgo absoluto, con un intervalo de confianza del 95 %, y se ha realizado análisis multivariante con diversos factores que puedan contribuir al desarrollo de fracaso renal agudo. NefroPlus 2016 Vol. 8 N.° 1 59 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA ■■ Ética y registro Protocolo aprobado por el comité de ética e investigación de cada uno de los centros participantes en el estudio, de acuerdo con los principios de la declaración de Helsinki. Todos los pacientes dieron su consentimiento informado por escrito. Registrado en el German Clinical Trials Registry con el número DRKS00005333. clínica y biomédica, sin relación alguna con la industria farmacéutica, y sin poder de decisión sobre ninguna de las partes del estudio. El diseño, desarrollo y resultados del estudio, así como su publicación, han sido controlados exclusivamente por los investigadores. Dos de los autores afirman haber recibido estipendios y retribuciones por charlas por parte de Astute Medical, Inc., empresa comercializadora de NephroCheck® Test y Astute 140 Meter®, para la determinación de biomarcadores urinarios TIMP-2 e IGFBP-7, y uno de ellos ha presentado una solicitud de patente sobre el uso de biomarcadores junto con el preacondicionamiento mediante inducción de isquemia distal. ■■ Promoción y conflicto de intereses El estudio ha sido financiado mediante una beca independiente de la German Research Foundation, organización sin ánimo de lucro dedicada a la investigación ■■ RESULTADOS PRINCIPALES De los 790 pacientes preseleccionados para el estudio, fueron reclutados 240 pacientes y aleatorizados para recibir preacondicionamiento isquémico (n = 120) o simulacro de preacondicionamiento isquémico (n = 120), excluyendo al resto de pacientes por no tratarse de pacientes de alto riesgo según el score Cleveland. Análisis basal de los grupos Los dos grupos presentaron características clínicas de base similares, con un número parecido de pacientes con baja fracción de eyección del ventrículo izquierdo. La edad media era superior a 70 años en ambos grupos, con una clasificación en su mayoría grado III de la New York Heart Association (NYHA), siendo la creatinina sérica preoperatoria de 1,1-1,2 ± 0,4 mg/dl. Variables principal y secundarias Tabla 1 GC (n = 120) GI (n = 120) RAR (IC 95%) p NNT 63 (52,5) 45 (37,5) 15% (2,56-27,44 %) 0,02 7 Estadio AKIN-1 32 (26,7) 30 (25) Estadio AKIN-2 14 (11,7) 8 (6,7) Estadio AKIN-3 17 (14,2) 7 (5,8) TRS (%) 19 (15,8) 7 (5,8) 10% (2,25-17,75 %) 0,01 10 VM (horas)* 15 (12-21) 14 (11-21) 1 (–1,54 a 4) 0,16 Estancia UCI (días)* 4 (2-7) 3 (2-5) 1 (0-2) 0,04 Estancia hospitalaria (días)* 13 (10-19) 12 (9-19) 1 (–2 a 2,5) 0,45 Mortalidad 30 días (%) 5 (4,2) 7 (5,8) 1,67 (0-7,18) 0,77 IAM (%) 5 (4,2) 6 (5,0) 0,83 (0-6,12) 0,76 ACV (%) 3 (2,5) 2 (1,7) 0,83 (0-4,45) 0,65 Variable principal n (%) FRA en 72 h Clasificación AKIN Variables secundarias n (%) *Media (rango IC). ACV: accidente cerebrovascular; GC: grupo control; GI: grupo de intervención; IAM: infarto de miocardio; NNT: número necesario a tratar; RAR: reducción absoluta de riesgo; TRS: tratamiento renal sustitutivo; VM: ventilación mecánica. 60 NefroPlus 2016 Vol. 8 N.° 1 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA Si bien la determinación de los biomarcadores urinarios (TIMP-2 x IGFBP-7) en el momento inicial previo a la cirugía no difería entre los grupos, se ha detectado una concentración significativamente mayor en el grupo control (0,97 ng/ml2) 4 y 12 horas tras el bypass cardiopulmonar, en comparación con el grupo de intervención (0,36 ng/ml2), con una p < 0,001. El preacondicionamiento isquémico aumentaba la concentración urinaria de TIMP-2 x IGFBP-7 inmediatamente después de la maniobra y antes del inicio del bypass cardiopulmonar en comparación con el grupo control, siendo aquellos con un valor igual o superior a 0,5 ng/ml2 los que presentaban una menor incidencia de fracaso renal agudo con respecto a los demás (riesgo relativo [RR] 67 %; p < 0,01). Los pacientes con valor superior a 0,5 ng/ml2 a las 4 horas tras el bypass cardiopulmonar tenían una mayor incidencia de fracaso renal agudo (RR 299 %; p < 0,01). ■■ CONCLUSIONES DE LOS AUTORES En pacientes de alto riesgo sometidos a cirugía cardíaca, el preacondicionamiento mediante isquemia distal en comparación con la no intervención reduce de forma significativa la incidencia de fracaso renal agudo y el uso de terapia renal sustitutiva. ■■ COMENTARIOS DE LOS REVISORES Este estudio presenta una nueva estrategia en la minimización del daño renal en pacientes sometidos a cirugía cardíaca con bypass cardiopulmonar, y su importancia radica en que se trata de pacientes de alto riesgo previo a la cirugía, en los que se reduce de forma significativa la incidencia de fracaso renal agudo mediante la aplicación de este tratamiento, así como la necesidad de terapia renal sustitutiva. No obstante, cabe reseñar: –– Aunque se trata de un estudio multicéntrico, su potencia estadística no es suficiente para asegurar sin género de duda la hipótesis planteada por los autores. El uso sistemático en la práctica clínica diaria de esta técnica requeriría de más estudios con mayor número de pacientes que confirmen estos resultados. –– Los resultados del estudio se aplican exclusivamente a pacientes de alto riesgo, por lo que no son extrapolables a todos los pacientes que requieran cirugía cardíaca. –– No hubo diferencias en la mortalidad entre los grupos. –– Por otra parte, el uso de los biomarcadores urinarios que proponen no está generalizado y no está disponible en la mayoría de los centros de forma urgente, lo que limita los resultados del estudio al ámbito experimental, al menos por el momento. –– Habría que valorar cómo medir el grado de isquemia inducido en los pacientes, y elaborar un protocolo individualizado en cada caso según las características de cada uno. ■■ CONCLUSIONES DE LOS REVISORES Este estudio abre una nueva línea de investigación en la prevención del fracaso renal agudo en pacientes de alto riesgo sometidos a cirugía cardíaca mediante el uso de un tratamiento sencillo y en apariencia inocuo para el paciente, de bajo coste y con elevada tasa de respuesta. Asimismo, destaca la importancia del uso de biomarcadores para la estratificación del riesgo de estos pacientes. Sin embargo, conviene tratar los resultados con precaución, puesto que no son extrapolables a todos los pacientes que precisan cirugía cardíaca. Se precisa de más estudios y más amplios que confirmen estos resultados antes de generalizar esta técnica. ■■ CLASIFICACIÓN Tema: Fracaso renal agudo Subtema: Prevención Tipo de artículo: Tratamiento Palabras clave: Cirugía cardíaca. Fracaso renal agudo. Preacondicionamiento isquémico NIVEL DE EVIDENCIA: Moderado GRADO DE RECOMENDACIÓN: Fuerte (GRADE [www.gradeworkinggroup.org] divide la calidad de la evidencia en cuatro grupos: alta, moderada, baja y muy baja; y clasifica el grado de recomendación en dos grupos: fuerte y débil) NefroPlus 2016 Vol. 8 N.° 1 61 n n n RESÚMENES ESTRUCTURADOS, COMENTADOS Y EVALUADOS DE LA LITERATURA NEFROLÓGICA ■■ NOTA CLÍNICA ¿Un nuevo horizonte en la prevención del fracaso renal agudo en pacientes sometidos a cirugía cardíaca? El fracaso renal agudo es una complicación relativamente frecuente y grave en pacientes sometidos a cirugía mayor. Actualmente no existe una estrategia eficaz y reconocida disponible que minimice la incidencia de esta complicación. En este contexto surge la técnica de preacondicionamiento isquémico, que se basa en las teóricas respuestas adaptativas renales estimuladas mediante la inducción, inmediatamente antes de la cirugía cardíaca, de breves períodos de isquemia y reperfusión aplicada en tejidos distales1. Varios ensayos clínicos y diseños experimentales han demostrado la utilidad de este tratamiento en la protección frente al daño orgánico, incluido el fracaso renal agudo, a través de mecanismos no bien conocidos2, si bien se piensa que determinados mediadores liberados durante el preacondicionamiento isquémico podrían inducir el reposo del ciclo celular de las células del túbulo renal y protegerlas así de la isquemia prolongada secundaria a la cirugía. El preacondicionamiento isquémico mediante isquemia transitoria del brazo seguido por reperfusión es una opción de tratamiento muy atractiva por su sencillez y bajo coste. Sin embargo, su utilidad clínica es un tema controvertido. Así, dos amplios ensayos clínicos recientes no han mostrado superioridad de esta técnica en pacientes sometidos a cirugía cardíaca3,4. La diferencia entre estos estudios y el que se analiza en este resumen estructurado es que este último preselecciona a pacientes con alto riesgo de desarrollar fracaso renal agudo mediante una escala previamente validada. Se hacen necesarios, por tanto, más estudios por otros grupos que confirmen la hipótesis de la utilidad del preacondicionamiento en población de alto riesgo de fracaso renal agudo, y que profundicen en los mecanismos fisiopatológicos que subyacen a este hipotético efecto renoprotector. REFERENCIAS BIBLIOGRÁFICAS 1. Zarbock A, Kellum JA. Remote ischemic preconditioning and protection of the kidney: a novel therapeutic option. Crit Care Med. 2016;44: 607-16. 2. Yoon YE, Choi KH, Kim SY, Cho YI, Lee KS, Kim KH, et al. Renoprotective mechanism of remote ischemic preconditioning based on transcriptomic analysis in a porcine renal ischemia reperfusión injury model. PLoS One 2015;10:e0141099. 3. Hausenloy DJ, Candilio L, Evans R, Ariti C, Jenkins DP, Kolvekar S, et al. Remote Ischemic Preconditioning and Outcomes of Cardiac Surgery. N Engl J Med 2015;373:1408-17. 4. Meybohm P, Bein B, Brosteanu O, Cremer J, Gruenewald M, Stoppe C, et al. A multicenter trial of remote ischemic preconditioning for heart surgery. N Engl J Med 2015;373:1397-407. 62 NefroPlus 2016 Vol. 8 N.° 1 n n n ◗◗ CASO CLÍNICO CERRADO Síndrome tóxico en un paciente trasplantado renal: sin cartas para el descarte María Quero Ramos1, Laura Martínez Valenzuela1, Ángela Casas Parra1, Anna Manonelles Montero1, August Vidal Bel2, Oriol Bestard Matamoros1, Edoardo Melilli1, Xavier Fulladosa Oliveras1, Josep Maria Cruzado Garrit1 1 Servicio de Nefrología. Unidad de Trasplante Renal. Hospital Universitari de Bellvitge. L’Hospitalet de Llobregat. Barcelona 2 Servicio de Anatomía Patológica. Hospital Universitari de Bellvitge. L’Hospitalet de Llobregat. Barcelona NefroPlus 2016;8(1):63-67 El caso fue presentado en la Web de Nefrología (www.revistanefrologia.com), y durante 15 días se realizaron distintos comentarios, todos ellos de gran interés, a los que puede accederse en la Web de Nefrología, en el apartado correspondiente al número 1, volumen 8, 2016 de NefroPlus. RESUMEN Varón de 56 años, hipertenso, con enfermedad renal crónica no filiada que requirió tratamiento renal sustitutivo con diálisis peritoneal y transferencia a hemodiálisis un año después por peritonitis por Staphylococcus aureus. Receptor de trasplante renal en enero de 2013 de donante de criterios expandidos, compartiendo dos identidades. Recibió inducción con basiliximab, tacrolimus, micofenolato mofetilo y esteroides. Serologías del donante negativas excepto citomegalovirus (CMV), siendo las del receptor CMV y virus de Epstein-Barr (VEB) positivas. En el postrasplante presentó desprendimiento de placa de ateroma de la arteria ilíaca, comprometiendo el flujo vascular con creatinina nadir 240 umol/l. Al mes presentó infección por CMV, que recidivó tras la suspensión del tratamiento con valganciclovir, por lo que se convirtió desde micofenolato mofetilo a iMtor (sirolimus); viremias sucesivas negativas. En consulta mostraba deterioro de la función renal hasta cifras de 350 umol/l, filtrado glomerular de 19 ml/min, con niveles correctos, proteinuria de 1 g/día y sedimento negativo. Rechazó someterse a biopsia renal. Ingresa el 23 de enero de 2014 por un cuadro clínico de 10 días de evolución de astenia, hiporexia y pérdida de peso. Destacaba fiebre (38 ºC) con diaforesis y sin focalidad infecciosa. Tensión arterial de 110/70 mmHg sin taquicardia. Explicaba consumo, durante el último mes, de productos de herboristería y homeopatía. En la analítica destacaba: creatinina 497 umol/l, hipoalbuminemia (25 g/l), anemia microcítica, plaquetopenia leve, linfopenia y monocitosis (29,4 %), con acidosis metabólica, patrón urinario funcional sin aumento de proteinuria y niveles de tacrolimus y sirolimus elevados (11 y 9 µg/l, respectivamente). Ante el síndrome tóxico grave, se solicitó una PET-TC, en la que destacaban imagen pulmonar en vidrio deslustrado y adenopatías milimétricas mediastínicas, hiliares y retroperitoneales, con débil captación. No presentaba otras captaciones patológicas. Se solicitó reacción en cadena de la polimerasa (PCR) para virus influenza A y B, CMV, quantiferón para tuberculosis, serología para Leishmania, virus hepatotropos, virus del herpes simple, VH6, VEB, lúes y toxoplasma, y Brucella, siendo todas negativas. Se realizó broncoscopia, sin apreciar lesiones endobronquiales. Se realizó lavado broncoalveolar (BAL). Correspondencia: María Quero Ramos Servicio de Nefrología. Unidad de Trasplante Renal. Hospital Universitari de Bellvitge. C/ Feixa Llarga, s/n. 08907 L’Hospitalet de Llobregat, Barcelona. maria.quero@bellvitgehospital.cat NefroPlus 2016 Vol. 8 N.° 1 63 n n n ◗◗ CASO CLÍNICO CERRADO Evolucionó con persistencia de fiebre, diarreas, empeoramiento del síndrome tóxico, edema generalizado, ascitis y empeoramiento de la función renal, requiriendo inicio de hemodiálisis. Se repitió la PCR para CMV, que fue negativa, y se realizó una colonoscopia con biopsias, aunque sin hallazgos patológicos. El estudio de líquido ascítico fue compatible con trasudado con cultivo negativo. En el seguimiento analítico había progresión de la plaquetopenia (10.000), pancitopenia y aumento de índices inflamatorios (PCR, velocidad de sedimentación globular y ferritina) y patrón de colestasis. Dada la mala evolución, se decidió retirar el sirolimus. Ante la ausencia de adenopatías significativas, se realizó una biopsia de médula ósea, que objetivó médula hiperplásica sin evidencia de neoplasia ni hematofagocitosis. Se inició tratamiento antibiótico empírico para tuberculosis y antifúngico, y posteriormente se recibieron los resultados del BAL: Aspergillus, tuberculosis y Pneumocystis negativos. Se retiró el tacrolimus y se dejó el corticoide. No se observó mejoría clínica y por empeoramiento del patrón de colestasis y transaminitis se realizó una TC abdominal: hepatoesplenomegalia, ascitis y vesícula biliar distendida. No se observaron otros hallazgos patológicos. Se descartó obstrucción biliar por colangiorresonancia. Finalmente, se realizó una biopsia hepática transyugular (9.000 plaquetas), que no mostró hallazgos sugestivos de proceso neoplásico/linfomatoso ni proceso vírico. Se descartó la presencia de metales tóxicos en sangre periférica. Evolucionó hacia fracaso multiorgánico, falleciendo tras 45 días de ingreso. Se realizó el diagnostico post mortem. INTRODUCCIÓN CASO CLÍNICO En el postrasplante tardío las complicaciones más frecuentes en el contexto de síndrome tóxico y febril son las infecciones y los procesos neoplásicos. Se trata de un varón de 56 años, hipertenso, con enfermedad renal crónica no filiada que requirió inicio de tratamiento renal sustitutivo (febrero de 2011) con diálisis peritoneal y transferencia a hemodiálisis un año después por peritonitis por Staphylococcus aureus. En cuanto a las infecciones se refiere, la aparición de infecciones graves por gérmenes oportunistas (Cryptococcus neoformans, Listeria, Aspergillus, Pneumocistis carinii, Nocardia, tuberculosis y monocytogenes) son más frecuentes en pacientes que han estado sobreinmunodeprimidos; por ejemplo, pacientes que han recibido tratamiento por episodios de rechazo agudo, y por lo tanto se suelen presentar en los primeros meses postrasplante. La tuberculosis presenta una incidencia de 36 a 74 veces mayor en pacientes inmunodeprimidos y debe tenerse en cuenta en el diagnóstico diferencial de fiebre de origen desconocido en los pacientes receptores de órganos, sobre todo después del primer año del trasplante1. Con respecto al desarrollo de neoplasias, es notorio que los pacientes trasplantados presentan un riesgo de 2 a 5 veces superior que la población general, siendo las más frecuentes los procesos linfoproliferativos (1-20 %), los cánceres cutáneos no melanomas, cáncer de vejiga, testículo y renal2,3. Determinadas neoplasias guardan estrecha relación con infecciones víricas como es el caso del VEB con procesos linfoproliferativos, sobre todo en los casos de síndrome linfoproliferativo postrasplante durante el primer año postrasplante4, virus del herpes humano 8 (VHH-8) con el sarcoma de Kaposi, síndrome de Castleman y linfoma de cavidades, y el virus del papiloma humano con las neoplasias de pene, vulva y cuello uterino. Presentamos el caso de un paciente trasplantado renal de un año de evolución que ingresó en nuestro servicio por presentar síndrome tóxico y fiebre sin focalidad infecciosa asociada. 64 NefroPlus 2016 Vol. 8 N.° 1 n n n Fue receptor de un primer trasplante renal en enero de 2013 de donante de criterios expandidos de bajo riesgo inmunológico con PRA 0 % y aloanticuerpos de fase sólida clase 1 y 2 negativos, compartiendo dos identidades con el donante (1 DR y 1 B), por lo que recibió inducción con basiliximab, tacrolimus, micofenolato mofetilo y esteroides. Serologías de virus de la inmunodeficiencia humana, lúes y hepatitis B y C de donante y receptor negativas con CMV y VEB positivos. En el postrasplante inmediato presentó desprendimiento de placa de ateroma de la arteria ilíaca según el informe quirúrgico, destacando empeoramiento de la perfusión renal y ausencia de pulso arterial, por lo que se deshizo la anastomosis arterial y se objetivó una placa de ateroma parcialmente despegada, realizando fijación de la placa y colocación de parche de dacrón, con reanastomosis posterior sin incidencias. El Doppler de control mostró perfusión homogénea del injerto, condicionando compromiso del flujo vascular, quedando con disfunción importante: creatinina 270 µmol/l con filtrado glomerular según CKD EPI de 21 ml/min. Al mes postrasplante presentó infección por CMV, que recidivó tras la suspensión del tratamiento con valganciclovir, por lo que se convirtió de micofenolato mofetilo a iMtor (sirolimus), destacando posteriormente viremias sucesivas negativas. Niveles posconversión de tacrolimus de 6,8 µg/l y sirolimus 5,3 µg/l. En el seguimiento en consultas mostraba deterioro de la función renal hasta cifras de 350 µmol/l, que le condicionaba un filtrado glomerular de 19 ml/min, proteinuria de 1 g/día y ◗◗ CASO CLÍNICO CERRADO sedimento negativo. El paciente rechazó someterse a biopsia renal en el seguimiento en consultas. Ingresó el 23 de enero de 2014 por un cuadro clínico de 10 días de evolución de astenia, hiporexia y pérdida de peso. Destacaba fiebre (38 ºC) con diaforesis y sin focalidad infecciosa. Tendencia a hipotensión arterial, con valores de 110/70 mmHg sin taquicardia. Explicaba consumo, durante el último mes, de productos de herboristería y homeopatía. En la analítica destacaba: creatinina 497 µmol/l, hipoalbuminemia (25 g/l), anemia microcítica, plaquetopenia leve, linfopenia y monocitosis (29,4 %), con acidosis metabólica, patrón urinario funcional sin aumento de la proteinuria y niveles de tacrolimus y sirolimus elevados (11 y 9 µg/l, respectivamente). Ante el síndrome tóxico grave, se solicitó una PET-TC (figura 1), que destacaba una imagen pulmonar en vidrio deslustrado y adenopatías milimétricas mediastínicas, hiliares y retroperitoneales, con débil captación. No presentaba otras captaciones patológicas. Se solicitó PCR para virus influenza A y B, CMV, quantiferón para tuberculosis, serología para Leishmania, virus hepatotropos, virus del herpes simple, VH6, VEB, lúes, toxoplasma y Brucella, siendo todas negativas. Se realizó una broncoscopia, que no objetivó lesiones endobronquiales, y se realizó un BAL. tico compatible con trasudado (glucosa 6,1 mmol/l, proteínas 11 g/l, 500 células [18 % polimorfonucleares, 45 % histiocitos y 37 % linfocitos]) con cultivo negativo. En el seguimiento analítico había progresión de la plaquetopenia (10.000), pancitopenia, elevación de reactantes de fase aguda (PCR, velocidad de sedimentación globular y ferritina) y patrón de colestasis. Dada la mala evolución, se decidió retirar progresivamente los inmunosupresores manteniendo únicamente monoterapia con corticoides. Ante la ausencia de adenopatías significativas y la sospecha clínica de enfermedad hematológica, se realizó una biopsia de médula ósea objetivando médula hiperplásica sin evidencia de neoplasia ni hematofagocitosis. Se inició tratamiento antibiótico empírico para tuberculosis y antifúngico, obteniendo posteriormente los resultados del BAL: Aspergillus, tuberculosis y Pneumocystis negativos. No se observó mejoría clínica y ante el empeoramiento del patrón de colestasis y transaminitis se realizó una TC abdominal, destacando hepatoesplenomegalia, ascitis y vesícula biliar distendida, sin otros hallazgos patológicos. Se descartó obstrucción biliar por colangiorresonancia. Evolucionó con persistencia de fiebre, diarreas, empeoramiento del síndrome tóxico, anasarca, ascitis y empeoramiento de la función renal, requiriendo inicio de hemodiálisis. Se repitió la PCR para CMV, que fue negativa, y se realizó una colonoscopia con biopsias, sin hallazgos patológicos. Estudio de líquido ascí- Figura 2. Visión macroscópica del hígado que muestra el carácter parcheado de las lesiones. Figura 1. PET-TC: imagen pulmonar en vidrio deslustrado y adenopatías milimétricas mediastínicas, hiliares y retroperitoneales, con débil captación. Sin otras captaciones patológicas. Figura 3. Tinción con hematoxilina-eosina de un ganglio 630. Células fusiformes características del sarcoma de Kaposi. NefroPlus 2016 Vol. 8 N.° 1 65 n n n ◗◗ CASO CLÍNICO CERRADO Finalmente, se realizó biopsia hepática transyugular (9.000 plaquetas), que no mostró hallazgos sugestivos de proceso neoplásico/linfomatoso ni proceso vírico. Se descartó la presencia de metales tóxicos en sangre periférica. Evolucionó hacia fracaso multiorgánico, falleciendo tras 45 días de ingreso. Se realizó el diagnóstico post mortem de síndrome hemofagocítico asociado a sarcoma de Kaposi ganglionar y linfoma primario de cavidades con afectación parcheada a nivel ganglionar, esplénico, hepático, pulmonar, adrenal, tiroideo y renal. Destacaba obstrucción de la vía biliar condicionada por adenopatías pericoledocales. DISCUSIÓN El VHH-8 se asociaba con el sarcoma de Kaposi, enfermedad de Castleman y el linfoma de cavidades. El linfoma primario de cavidades es un linfoma célula B no ­Hodgkin poco frecuente. Se describió por primera vez en 1989 y a pesar de que su patogénesis no es del todo conocida, se considera que la infección por el VHH-8 juega un papel importante en esta enfermedad. Clínicamente, se caracteriza por la presencia de derrame linfomatoso en cavidades serosas: pleural, pericárdica o peritoneal. Para establecer el diagnóstico es importante la realización del inmunofenotipo de las células neoplásicas linfoides, siendo característico de este linfoma las células no T, no B, CD138+ y LANA-1+. Por lo que a la evolución y al tratamiento se refiere, los pacientes presentan evolución tórpida, con mortalidad del 100 % de los casos descritos durante los primeros 6 meses tras el diagnóstico, a pesar de recibir tratamiento específico (quimioterapia CHOP) y de la modificación de inhibidores de la calcineurina por rapamicina (se han descrito efectos antitumorales de los iMtor en líneas murinas)9. El síndrome hemofagocítico es una enfermedad sistémica inflamatoria fulminante que puede ser primaria (enfermedad genética) o secundaria (adquirida) en el contexto de enfermedades hematológicas, neoplásicas o en el contexto de infecciones víricas (VEB, VIH, VHH-8)10. Se caracteriza por la infiltración histiocítica del sistema retículo endotelial, que produce destrucción de los elementos formes de la sangre11. La evidencia de la infección por VHH-8 de las células tumorales se caracteriza por elevados niveles de ADN de VHH-8 e inmunotinción positiva para LANA-1 (antígeno nuclear de latencia asociado). El VHH-8 se asocia raramente al síndrome hemofagocítico, siendo esta relación más frecuente en pacientes inmunodeprimidos12. Se han descrito muy pocos casos en la literatura médica de linfoma primario de cavidades en pacientes trasplantados, presentando todos ellos anticuerpos anti-VHH-85-7. En pacientes con síndrome hemofagocítico adquirido, como en el caso que presentamos, el tratamiento del linfoma es el tratamiento de elección para tratar el síndrome hemofagocítico. En los pacientes trasplantados originarios de países con seroprevalencia media alta para el VHH-8, el riesgo de sarcoma de Kaposi depende principalmente de la reactivación del virus más que de la transmisión de infección primaria a través del órgano, y se considera que el proceso es el mismo en el linfoma primario de cavidades8. En nuestro caso, a pesar de las múltiples pruebas diagnósticas para intentar filiar la causa del síndrome tóxico, esto fue únicamente posible post mortem. En el material histológico obtenido a través de las biopsias hepáticas, de colon y de médula ósea, no fue posible identificar las características histológicas típicas del linfoma de cavidades ni del sarcoma de Kaposi, pro- Figura 4. Inmunohistoquímica positiva para virus del herpes humano 8 200 de un ganglio. En la parte superior se objetiva el linfoma de cavidades y en la inferior, el sarcoma de Kaposi. Figura 5. Tinción con hematoxilina/eosina de ganglio 400. Hemofagocitos. 66 NefroPlus 2016 Vol. 8 N.° 1 n n n ◗◗ CASO CLÍNICO CERRADO bablemente por la naturaleza “focal” o “parcheada” de las lesiones. Cabe destacar la ausencia de lesiones cutáneas típicas del sarcoma de Kaposi. Analizando el caso a posteriori, el estudio anatomopatológico del líquido ascítico hubiera podido detectar la presencia de células linfomatosas típicas del linfoma de cavidades, y la determinación del VHH-8 en sangre periférica hubiera podido orientarnos en el diagnóstico ante mortem. CONCLUSIONES El linfoma de cavidades, el sarcoma de Kaposi y el síndrome hemofagocítico son entidades de mal pronóstico que pueden asociarse a VHH-8. Según nuestra revisión bibliográfica, el caso que describimos es el primero con presencia de las tres enfermedades en un paciente portador de trasplante renal. Conflictos de interés Por este motivo, consideramos añadir la determinación de VHH-8 en el estudio de síndrome tóxico en el paciente trasplantado renal de forma sistemática. Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo. REFERENCIAS BIBLIOGRÁFICAS 1. Tabarsi P, Farshidpour M, Marjani M, Baghaei P, Yousefzadeh A, Najafizadeh K, et al. Mycobacterial infection and the impact of rifabutin treatment in organ transplant recipients: a single-center study. Saudi J Kidney Dis Transpl 2015;26:6-11. 2. Vajdic CM, McDonald SP, McCredie MR, van Leeuwen MT, Stewart JH, Law M, et al. Cancer incidence before and after kidney transplantation. JAMA 2006;296:2823-31. 3. Morscio J, Dierickx D, Tousseyn T. Molecular pathogenesis of B-cell posttransplant lymphoproliferative disorder: what do we know so far? Clin Dev Immunol 2013;150835. 4. Petrara MR, Giunco S, Serraino D, Dolcetti R, De Rossi A. Post-transplant lymphoproliferative disorders: From epidemiology to pathogenesis-driven treatment. Cancer Letters 2015;369:37-44. 5. Shi Y, Hou Y, Hu Q, Su J, Zeng H, Tan Y. A rare case of HHV-8 possitive/HIV-negative/EBV-negative primary effusion lymphoma in a renal transplant recipient. Cytopathology 2012;23:137-9. 6. Boulanger E, Afonso PV, Yahiaoui Y, Adle-Biassette H, Gabarre J, Agbalika F. Human herpesvirus-8 (HHV-8)-associated primary effusion lymphoma in two renal transplant recipients receiving rapamycin. Am J Transplant 2008;8:707-10. 7. Melo NC, Sales MM, Santana AN, Costalonga EC, Pedreira AB, Ianhez LE. Pleural primary effusion lymphoma in a renal transplant recipient. Am J Transplant 2008;8:906-7. 8. Parravicini C, Olsen SJ, Capra M, Poli F, Sirchia G, Gao SJ, et al. Risk of Kaposi’s sarcoma associated herpes virus transmission from donor allografts among Italian posttransplant Kaposi’s sarcoma patients. Blood 1997;90:2826-9. 9. Sin SH, Roy D, Wang L, Staudt MR, Fakhari FD, Patel DD, et al. Rapamycin is efficacious against primary effusion lymphoma (PEL) cell lines in vivo by inhibiting autocrine signaling. Blood 2007;109:2165-73. 10. Shah NN, Harrison N, Stonecypher M, Frank D, Amorosa V, Svoboda J. Extracavitary primary effusion lymphoma initially presenting with hemophagocytic lymphohistocytosis. Clin Lymphoma Myeloma Leuk 2014;14:e157-60. 11. Pastore RD, Chadburn A, Kripas C, Schattner EJ. Novel association of haemophagocytic syndrome with Kaposi’s sarcoma-associated herpesvirus-related primary effusion lymphoma. Br J Haematol 2000;111:1112-5. 12. Kim B, Jeon YK, Kim CW. Kaposi sarcoma herpes virus-associated hemophagocytic syndrome complicated by multicentric Castleman disease and Kaposi sarcoma in a HIV-negative immunocompetent patient: an autopsy case. J Korean Med Sci 2009;24:970-4. NefroPlus 2016 Vol. 8 N.° 1 67 n n n ◗◗ CASOS CLÍNICOS Síndrome hepatorrenal tras trasplante de células hematopoyéticas: una entidad poco frecuente Pilar Fraile Gómez1, Lourdes Vázquez2, Alexandra Lizarazo1, Óscar Segurado Tostón1, Félix López Cadenas2, Luis García Martín2, Pedro García-Cosmes1 1 Servicio de Nefrología. Hospital Universitario de Salamanca. Salamanca 2 Servicio de Hematología. Hospital Universitario de Salamanca. Salamanca NefroPlus 2016;8(1):68-73 RESUMEN El trasplante de células hematopoyéticas es el tratamiento de elección de numerosas enfermedades hematológicas, malignas y no malignas. La insuficiencia renal aguda es una complicación frecuente del trasplante de células hematopoyéticas, que empeora el pronóstico de estos pacientes. La etiología de la insuficiencia renal aguda tras el trasplante de células hematopoyéticas difiere según el momento de aparición y en numerosas ocasiones su origen es multifactorial. El síndrome de obstrucción sinusoidal hepático es una causa de insuficiencia renal aguda, que cursa como síndrome hepatorrenal, casi exclusiva de los pacientes con trasplante de médula ósea. En las formas graves, su pronóstico es fatal. Presentamos un caso de síndrome de obstrucción sinusoidal hepático con insuficiencia renal aguda secundaria por síndrome hepatorrenal y evolución favorable, gracias al diagnóstico e instauración de tratamiento precoz con defibrotide y terlipresina. Palabras clave: Defibrotide. Enfermedad venooclusiva hepática. Insuficiencia renal aguda. Síndrome hepatorrenal. Síndrome de obstrucción sinusoidal hepático. Terlipresina. Trasplante de células hematopoyéticas. INTRODUCCIÓN El trasplante de células hematopoyéticas es el tratamiento de elección de una gran variedad de enfermedades hematológicas malignas y no malignas. La insuficiencia renal aguda (IRA) es una complicación frecuente tras el trasplante de células hematopoyéticas que ocurre en los tres primeros meses postrasplante y que incrementa el riesgo de mortalidad e insuficiencia renal crónica futura. La etiología de la IRA1 tras el trasplante de células hematopoyéticas es diferente según el momento de aparición: precozmente puede ser secundaria a síndrome de lisis tumoral o a toxicidad asociada a la infusión medular que habitualmente ocurre en los primeros 5 días tras el trasplante. El síndrome hepatorrenal secundario al síndrome de obstrucción sinusoidal (SOS) hepático aparece dentro del primer mes postrasplante2. La IRA que se presenta transcurrido el primer mes postrasplante suele ser secundaria a enfermedad injerto contra huésped (EICH), aguda o crónica, o a toxicidad por inhibidores de la calcineurina. Otras causas no específicas de IRA que pueden surgir en cualquier momento del postrasplante son sepsis, hipotensión, depleción de volumen, nefrotoxicidad medicamentosa y uropatía obstructiva. En muchas ocasiones, la IRA es multifactorial y tiene un curso clínico complicado. El SOS hepático, llamado previamente enfermedad venooclusiva hepática, es una de las complicaciones más graves del trasplante alogénico y autólogo de células hematopoyéticas3. En las formas graves, con afectación multiorgánica, la mortalidad supera el 80 %. Por ello, es importante llevar a cabo la prevención del mismo en los pacientes de alto riesgo, establecer unos criterios diagnósticos homogéneos e instaurar un tratamiento precoz4. Presentamos el caso de una paciente con SOS hepático grave con IRA secundaria por síndrome hepatorrenal, tratado de forma exitosa con defibrotide y terlipresina. CASO CLÍNICO Correspondencia: Pilar Fraile Gómez Servicio de Nefrología. Hospital Universitario de Salamanca. Paseo de San Vicente, 58-182. 37007 Salamanca. pilarfg@usal.es 68 NefroPlus 2016 Vol. 8 N.° 1 n n n Presentamos el caso de una mujer de 29 años, alérgica a la penicilina, diagnosticada en 1999 de linfoma de Hodgkin tipo celularidad mixta estadio IV-B. Se trató con 6 ciclos de adriamicina, bleomicina, vinblastina, dacarbacina (ABVD) e irradiación nodal total (20 Gy), con irradiación pulmonar hasta 16 Gy. Dos ◗◗ CASOS CLÍNICOS años después (2001) presentó recidiva axilar, tratada con quimioterapia de segunda línea con cuatro ciclos de etopósido, citarabina, cisplatino, metilprednisolona (ESHAP) y trasplante autólogo de células hematopoyéticas (2002). Tras el trasplante recibió radioterapia (36 Gy) en regiones paraaórticas. En marzo de 2005, se objetivó una lesión esplénica de 3 cm y pélvica, que se trató con radioterapia (36 Gy). En febrero de 2014, la paciente presentó una nueva recidiva con adenopatías en el tronco celiaco, laterocervicales y supraclaviculares izquierdas, subcarinales, paraesofágicas y en el mediastino anterior, que se trataron inicialmente con bendamustina, con remisión completa tras cuatro ciclos. Ingresó en el Servicio de Hematología del Hospital Universitario de Salamanca en octubre de 2014 para la realización de trasplante alogénico haploidéntico en cuarta remisión completa. Se escogió como mejor donante, según el estudio de compatibilidad HLA y genotipo KIR, al padre5,6. El donante y la receptora presentaban incompatibilidad de grupo sanguíneo. Los datos del donante y la receptora aparecen reflejados en la tabla 1. La paciente recibió acondicionamiento con fludarabina, busulfán y ciclofosfamida, y prevención de la EICH con micofenolato mofetilo y tacrolimus. También se utilizó ácido ursodexosicólico. Se empleó como antibioticoterapia de primera línea aztreonam (día +2 a día +36), dada la alergia de la paciente a la penicilina, y a pesar de no existir infección bacteriana documentada fue necesario emplear teicoplanina (día +1 a día +11), vancomicina (día +12 a día +17) y amikacina (día +2 a día +17) por síndrome febril. Tampoco se constató la existencia de infección fúngica, pero se utilizó profilaxis con trimetoprima/sulfametoxazol (día –5 a día –2), posaconazol (día +1 a día +6) sustituido por micafungina (día +6 a día +10) y posteriormente por anidulafungina (día +10 hasta día +14) por sospecha de toxicidad hepática. La prevención de infecciones víricas se realizó con aciclovir. Durante el ingreso la paciente no recibió tratamiento hormonal sustitutivo. El día +13, la paciente había ganado 3 kg respecto al día previo, refería hepatomegalia dolorosa, y tanto las cifras de presión arterial como la diuresis habían disminuido. En la auscultación pulmonar se ponía de manifiesto hipoventilación desde los campos medios junto con crepitantes bibasales, y en la exploración abdominal se apreciaba aumento del perímetro abdominal (6 cm) y hepatomegalia dolorosa de tres traveses de dedo. En la analítica destacaba la alteración del perfil hepático, con elevación de la bilirrubina, la urea y la creatinina (tabla 2). Ante la sospecha inicial de IRA de origen nefrotóxico en una paciente con bajo volumen efectivo circulante, se realizó ajuste posológico, se pautaron expansores del plasma, se forzó la diuresis y se solicitaron una radiografía de tórax y una ecografía renal urgentes (figura 1) que mostraron derrame pleural, ascitis en cuantía discreta, hígado aumentado de tamaño con signos de hepatopatía difusa, inversión del flujo portal y aumento de calibre de la arteria hepática. Tabla 1. Principales datos del donante y la receptora Donante Receptor Sexo Varón Mujer Edad 57 29 Peso 63 Grupo sanguíneo A Negativo 0 Positivo HLA A03 A29, B44 B51, C16 C16, DRB07 DRB13 A03 A32, B35 B51, C04 C16, DRB04, DRB13 Serología VHA / VHC / VIH Positivo / Negativo / Negativo Negativo / Negativo / Negativo Serología VHB Ag HBs/ Ac HBs/Ac HBc Negativo / Negativo / Negativo Negativo / Negativo / Negativo Serología CMV IgG/IgM Negativo / Negativo Positivo / Negativo Serología VHS Ig G / Ig M Negativo / Negativo Positivo / Negativo Serología VVZ Ig G / Ig M Negativo / Negativo Positivo / Negativo Serología VEB Ig G / Ig M Negativo / Negativo Positivo / Negativo VRDL Negativo Negativo Toxoplasma Ig G / Ig M Positivo / Negativo Positivo / Negativo NefroPlus 2016 Vol. 8 N.° 1 69 n n n ◗◗ CASOS CLÍNICOS Tabla 2. Principales datos analíticos y exploraciones complementarias realizadas en el momento del diagnóstico Urea 127 mg/dl Glucosa 125 mg/dl pH venoso 7.46 Creatinina 2,80 mg/dl Urato 8,2 mg/dl pCO2 29 mmHg Sodio 139 mmol/l BT 4,93 mg/dl HCO3 20,6 mmol/l Potasio 4,6 mmol/l BD 4,63 mg/dl Lactato 1,9 mmol/l Cloro 101 mmol/l AST 272 U/l Hemoglobina 8,8 g/dl Calcio 9,7 mg/dl ALT 129 U/l Hematocrito 24,9 % FA 143 U/l Leucocitos 10/ml Fósforo Proteínas 4,8 g/dl PCR 27,13 mg/dl Neutrófilos 0 Albúmina 2,3 g/dl Ión amonio 25 mmol/l Plaquetas 15.000/ml Niveles FK 7,2 ng/ml Factor VIII 155 % TP 36 % Niveles amikacina 13,40 mg/ml FvW (actividad) 150,1 % TTPA 47,1 seg Niveles vancomicina 22,93 mg/ml Factor VII 49 % Fibrinógeno 638 mg/dl Radiografía de tórax Derrame pleural bilateral Plasminógeno funcional 88 UI Ecografía renal Inversión del flujo portal y aumento del calibre de arteria hepática, ascitis en cuantía discreta. Derrame pleural derecho En ese momento, el diagnóstico diferencial se estableció con la EICH aguda, que se excluyó al no existir manifestaciones clínicas a otros niveles, con el síndrome de Budd-Chiari, que se descartó al no existir datos ecográficos sugestivos de trombosis de las venas suprahepáticas, y con la nefro/hepatotoxicidad medicamentosa, no presente en ese momento por tener la paciente niveles de medicación dentro del rango terapéutico (tabla 2). Se diagnosticó de SOS hepático con IRA secundaria por síndrome hepatorrenal de acuerdo con los criterios clínicos de Baltimore7 apoyados por los hallazgos ecográficos. En las 24 horas siguientes, tras cesar la clínica hemorrágica, se inició tratamiento con defibrotide, que se mantuvo durante 19 días (día +32) hasta que los signos/síntomas de la enfermedad desaparecieron. El síndrome hepatorrenal se trató con restricción hídrica, expansores del plasma (12 concentrados de hematíes y albúmina), diuréticos (espironolactona y furosemida) y terlipresina. A las 48 horas del diagnóstico, la paciente asoció taquipnea intensa e incremento en las necesidades de oxigenoterapia, que obligó a realizar paracentesis para disminuir la presión intraabdominal. Durante el ingreso, la paciente también recibió transfusión de 40 unidades de plaquetas. La evolución clínica y analítica (figuras 2 y 3) de la paciente fue buena, siendo dada de alta el día +36 con normalización de la función renal y hepática. El control ecográfico posterior (día +28) objetivó flujo portal alternante centrípeto-centrífugo, con normalización del flujo en control ecográfico realizado tras el alta (día +90). La reevaluación de la paciente y la enfermedad hematológica, 70 NefroPlus 2016 Vol. 8 N.° 1 n n n Figura 1. Ecografía renal de la paciente en el momento del diagnóstico del SOS hepático. Destaca la inversión del flujo portal y aumento de calibre de la arteria hepática. mediante PET-TC, el día +90 reflejó que la paciente estaba en remisión completa. DISCUSIÓN Los pacientes con trasplante de células hematopoyéticas tienen mayor riesgo de presentar IRA e insuficiencia renal crónica. La ◗◗ CASOS CLÍNICOS Trasplante alogénico 10 Inicio síntomas Cr (mg/dl) BT (mg/dl) Defibrotide Terlipresina Paracentesis 9 8 7 6 5 4 3 2 1 +5 +1 D ía 2 +1 4 D ía +1 6 D ía +1 D ía 8 + D 20 ía + D 22 ía +2 4 D ía +2 D ía 6 +2 8 D ía + D 30 ía + D 32 ía +3 4 D ía +3 D ía 6 + D 44 ía +5 1 D ía +6 2 D ía +7 6 D ía +9 0 ía D ía D D ía –5 0 Figura 2. Evolución de la Cr (mg/dl) y de la BT (mg/dl) desde la realización del trasplante alogénico. AST (U/l) Trasplante alogénico Inicio síntomas 800 Paracentesis ALT (U/l) Defibrotide Terlipresina 700 600 500 400 300 200 100 +5 ía +1 D ía 2 +1 4 D ía +1 6 D ía + D 18 ía + D 20 ía + D 22 ía +2 4 D ía +2 D ía 6 +2 8 D ía + D 30 ía + D 32 ía +3 4 D ía +3 D ía 6 + D 44 ía +5 1 D ía +6 2 D ía +7 6 D ía +9 0 D ía D D ía –5 0 Figura 3. Evolución de AST (U/l) y ALT (U/l) desde el ingreso de la paciente para la realización del trasplante alogénico. incidencia de IRA varía en la literatura médica según la definición utilizada. El riesgo de IRA es mayor en trasplantes alogénicos (3070 %) que autólogos (12-24 %) y en trasplantes mieloablativos que en no mieloablativos. Los pacientes con IRA tienen un riesgo aumentado de muerte en los 6 meses que siguen al trasplante, y su supervivencia es 20 % menos en los 1-5 años siguientes respecto a los pacientes sin IRA1,2. La etiología de la IRA es diversa según el momento de aparición y en muchas ocasiones de origen multifactorial. Algunas de las causas son exclusivas de los pacientes con trasplante de médula ósea, como son la toxicidad medular tras la transfusión o el SOS hepático3,4. El SOS hepático es el término utilizado para describir el síndrome clínico que cursa con ganancia de peso, hepatomegalia e ictericia tras un trasplante de células hematopoyéticas3; es una de las complicaciones más relevantes que aparecen en el postrasplante inmediato4. Sin embargo, también puede ser secundario al empleo de quimioterapia, ingestión de alcaloides, altas dosis de radiación o trasplante hepático8. Su incidencia es del 10-15 % después del trasplante alogénico cuando se utilizan regímenes de acondicionamiento mieloablativos, e inferior al 5 % usando regímenes de acondicionamiento de intensidad reducida o tras trasplante autólogo. Afortunadamente, en la mayoría de los paNefroPlus 2016 Vol. 8 N.° 1 71 n n n ◗◗ CASOS CLÍNICOS cientes (75-80 %) se resuelve en 2-3 semanas. Sin embargo, en las formas graves la mortalidad supera el 80 %9,10. Son factores de riesgo de SOS hepático: edad inferior a 7 años, género femenino (probablemente por el empleo previo de progesterona), mala situación basal, recaída de la enfermedad, enfermedad hepática preexistente, irradiación hepática previa, capacidad de difusión pulmonar alterada, serología para citomegalovirus positiva, infección por hepatitis C, sobrecarga de hierro, administración previa de gemtuzumab, y factores relacionados con el trasplante como trasplante de células hematopoyéticas previo, trasplante alogénico frente a autólogo, incompatibilidades HLA5,6, dosis de irradiación que excedan 13-15,75 Gy (sobre todo en dosis única), regímenes de acondicionamiento11 que incorporen determinados alcaloides tóxicos y fármacos como citarabina, mitomicina, azatioprina o busulfán, sobre todo si se asocia con ciclofosfamida, prevención de la EICH que incluya sirolimus, y administración de diferentes medicaciones durante el trasplante como ketoconazol, metotrexato, anticalcineurínicos, anfotericina B, vancomicina o aciclovir. En nuestro caso, la paciente era candidata a un segundo trasplante, y a pesar de prescribirse un régimen de acondicionamiento de intensidad reducida, tenía numerosos factores de riesgo de SOS hepático: mujer, tres recaídas de la enfermedad con trasplante previo de células hematopoyéticas, irradiación previa con altas dosis, trasplante alogénico con incompatibilidades HLA5,6, régimen de acondicionamiento que incluía ciclofosfamida y busulfán11, y tratamiento posterior con tacrolimus, vancomicina y aciclovir. Independientemente de la causa, el SOS hepático aparece como consecuencia del daño endotelial7,8. Las células endoteliales sinusoidales y los hepatocitos de la zona 3 de los acinos resultan dañados por metabolitos tóxicos generados por el régimen de acondicionamiento, así como por las citocinas, quimiocinas y heparanasas liberadas por los tejidos dañados. En las células endoteliales dañadas aparecen orificios. Los glóbulos rojos, leucocitos y restos celulares pasan a través de los mismos y se acumulan en el espacio de Dissé, lo que provoca el estrechamiento progresivo de la luz de las vénulas, la reducción en el flujo de salida venoso sinusoidal, la hipertensión portal postsinusoidal y el síndrome hepatorrenal. Paralelo a las lesiones, existe un estado procoagulante con incremento del factor de von Willebrand, factor VIII, fibrinógeno, complejo trombina-antitrombina, trombomodulina y descenso en los niveles de proteína C, antitrombina y factor VII; estas alteraciones en la coagulación son una consecuencia del daño endotelial y probablemente desempeñen un papel secundario en la patogenia del SOS hepático, independientemente de su contribución a la oclusión sinusoidal. Todas estas alteraciones de la coagulación estaban presentes en nuestro caso. El SOS hepático se presenta dentro de las primeras 3 semanas tras el trasplante. Suele cursar con ganancia de peso inexplicada, seguida de alteración en la función hepática, hepatomegalia dolorosa y ascitis. Aproximadamente la mitad desarrollan IRA y un cuarto requieren hemodiálisis. Finalmente, una minoría desarrollarán fallo multiorgánico, encefalopatía hepática y muerte. En los casos graves, existe elevación del tiempo de pro72 NefroPlus 2016 Vol. 8 N.° 1 n n n trombina. La trombocitopenia refractaria a la transfusión de plaquetas es común y puede preceder a otros síntomas. Un porcentaje de pacientes desarrolla confusión, sangrado e insuficiencia cardíaca4,9. La IRA tiene las características del síndrome hepatorrenal12,13. El diagnóstico de SOS es clínico, y habitualmente no es preciso ni posible realizar biopsia renal o hepática, dada la trombopenia y los trastornos de la coagulación. La medición del gradiente de presión venosa hepática a través de la vena yugular es el método diagnóstico más preciso para confirmar y evaluar la gravedad del SOS hepático. La ecografía puede ayudar a la hora de realizar el diagnóstico diferencial; pone de manifiesto la existencia de hepatomegalia, ascitis y atenuación o inversión del flujo venoso hepático. En nuestro caso, la ecografía contribuyó al diagnóstico de forma significativa. Para diagnosticar el SOS hepático se recurre a los criterios de Seatle14 (dos o más de los siguientes eventos en los 20 días postrasplante: bilirrubina > 2 mg/dl, hepatomegalia o dolor en el hipocondrio derecho, ganancia de peso por retención de líquidos > 2 % del peso basal) o de Baltimore7 (bilirrubina > 2 mg/dl dentro de los 21 días posteriores al trasplante más al menos dos de los siguientes criterios: hepatomegalia, ascitis, ganancia de peso > 5 % respecto al peso pretrasplante). La aproximación clínica a la gravedad del SOS hepático se establece de acuerdo con las siguientes variables: bilirrubina total (leve < 5 mg/dl, moderada 5,1-8 mg/dl, grave > 8 mg/dl), AST (leve < 3 x normal, moderada 3-8 x normal, grave > 8 x normal), ganancia de peso (leve < 2 %, moderada 2-5 %, grave > 5 %), creatinina sérica (leve normal, moderada < 2 x normal, grave > 2 x normal), y tiempo de instauración (leve 6-7 días, moderado 4-5 días, grave 2-3 días)3,7,8. En nuestro caso, la paciente cumplía tanto los criterios clínicos de Seatle14 como de Baltimore7, y presentaba un SOS hepático grave. El diagnóstico diferencial debe realizarse con el síndrome de Budd-Chiari, la EICH aguda, las infecciones hepáticas y la toxicidad medicamentosa3,10. La prevención del SOS hepático es preferible al tratamiento. Deben minimizarse los factores de riesgo modificables, evitar el empleo de medicación hepatotóxica y utilizar medidas farmacológicas preventivas como ácido ursodesoxicólico. El tratamiento del SOS hepático depende de la gravedad15. El tratamiento de soporte es fundamental, prestando especial atención al balance de líquidos y sodio, el mantenimiento del volumen intravascular y la perfusión renal. Los diuréticos pueden reducir la retención de agua y sal en pacientes con exceso de volumen extracelular1,2. La terlipresina es el vasoconstrictor más utilizado en los pacientes con síndrome hepatorrenal tipo 1, donde sola o junto con albúmina, reduce la mortalidad de forma significativa12. Otras medidas adicionales, como paracentesis o toracocentesis, deben aplicarse con precaución para evitar la reducción del flujo renal. Cuando la sobrecarga de volumen y la insuficiencia renal no puedan ser controladas médicamente se recurrirá a hemodiálisis/ hemofiltración16. Para los pacientes con formas graves se recomienda el empleo de defibrotide (6,25 mg/kg i.v./6 h)17. Su mecanismo de acción no es bien conocido, pero ha demostrado efectos antiinflamatorios, antitrombóticos y antiapoptóticos sobre ◗◗ CASOS CLÍNICOS las células del endotelio. Incrementa los niveles de prostaglandinas I2, E2, prostaciclinas, y tPA que aumenta la fibrinólisis. Debido a su modesto efecto anticoagulante, es relativamente seguro en situación de trombopenia18. La administración de defibrotide debe iniciarse precozmente, ya que un retraso en las primeras 48 horas tras el diagnóstico reduce la tasa de remisión completa, y debe mantenerse hasta que los signos/síntomas de la enfermedad desaparezcan o un mínimo de 21 días. En Europa solo está aprobado su uso desde octubre de 2013 para el tratamiento y no prevención de las formas graves de SOS hepático19. No obstante, las guías clínicas de la Sociedad Británica de Sangre y Trasplante de Médula Ósea20 sugieren su empleo preventivo en adultos y en niños con trasplante alogénico de células hematopoyéticas y factores de riesgo20. En nuestro caso, deberían haberse minimizado los numerosos factores de riesgo modificables de SOS hepático que presentaba la paciente, con el objeto de reducir las posibilidades de aparición del mismo. No obstante, sí se empleó ácido ursodexosicólico como medida preventiva. Tanto la instauración precoz de medi- das de soporte, como la utilización de albúmina y terlipresina para el tratamiento del síndrome hepatorrenal y el inicio en las primeras 24 horas tras el diagnóstico del tratamiento con defibrotide, influyeron en el pronóstico de la paciente y en su curación. En resumen, la IRA es una complicación frecuente en el postrasplante de células hematopoyéticas. Su etiología difiere según el momento de aparición y en muchas ocasiones su origen es multifactorial. Los nefrólogos deben estar familiarizados, especialmente con aquellas etiologías “casi” exclusivas de los pacientes con trasplante de médula ósea, como el SOS hepático. Debemos tener en cuenta que el síndrome hepatorrenal no es una entidad exclusiva de los pacientes cirróticos, sino que puede ser secundario al SOS hepático, entidad cuya gravedad requiere un diagnóstico e inicio de tratamiento precoz con defibrotide. Conflictos de interés Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo. REFERENCIAS BIBLIOGRÁFICAS 1. Parikh CR, McSweeney PA, Koruar D, Ecder T, Merouani A, Taylor J, et al. Renal dysfunction in allogeneic hematopoietic cell transplantation. Kidney Int 2002;62:566-73. 2. Sawinski D. The kidney effects of hematopoietic stem cell transplantation. Adv Chronic Kidney Dis 2014;21:96-105. 3. Arnaout K, Patel N, Jain M, El-Amm J, Amro F, Tabbara IA. Complications of allogeneic hematopoietic stem cell transplantation. Cancer Invest 2014;32:349-62. 4. Borrego FJ, Viedma G, Pérez del Barrio P, Gil JM, De Santis-Scoccia C, Ramírez Huerta JM, et al. Insuficiencia renal aguda secundaria a enfermedad veno-oclusiva hepática en un paciente con trasplante de médula ósea. Nefrologia 2003;23:350-4. 5. Handgretinger R. Haploidentical transplantation: the search for the best donor. Blood 2014;124:827-8. 6. Wang Y, Chang YJ, Xu LP, Liu KY, Liu DH, Zhang XH, et al. Who is the best donor for a related HLA haplotype-mismatched transplant? Blood 2014;124:843-50. 7. Jones RJ, Lee KS, Beschorner WE, Vogel VG, Grochow LB, Braine HG, et al. Venoocclusive disease of the liver following bone marrow transplantation. Transplantation 1987;44:778-83. 8. Takamura H, Nakanuma S, Hayashi H, Tajima H, Kakinoki K, Kitahara M, et al. Severe veno-occlusive disease/sinusoidal obstruction syndrome after deceased-donor and living-donor liver transplantation. Transplant Proc 2014;46:3523-35. 9. Rubbia-Brandt L. Sinusoidal obstruction syndrome. Clin Liver Dis 2010;14:651-68. 10. Norvell JP. Liver disease after hematopoietic cell transplantation in adults. Transplant Rev 2015;29:8-15. 11. Nagler A, Labopin M, Berger R, Bunjes D, Campos A, Socié G, et al. Allogeneic hematopoietic SCT for adults AML using i.v. BU in the conditioning regimen: outcomes and risk factors for the occurrence of hepatic sinusoidal obstructive syndrome. Bone Marrow Transplant 2014;49:628-33. 12. Møller S, Krag A, Bendtsen F. Kidney injury in cirrhosis: pathophysiological and therapeutic aspects of hepatorenal syndromes. Liver Int 2014;34:1153-63. 13. Fabrizi F, Aghemo A, Messa P. Hepatorenal syndrome and novel advances in its management. Kidney Blood Press Res 2013;37:588601. 14. McDonald GB, Sharma P, Matthews DE, Shulman HM, Thomas ED. Venocclusive disease of the liver after bone marrow transplantation: diagnosis, incidence, and predisposing factors. Hepatology 1984;4:116-22. 15. Carreras E. How I manage sinusoidal obstruction syndrome after haematopoietic cell transplantation. Br J Haematol 2015;168:481-91. 16. Chao N. How I treat sinusoidal obstruction syndrome. Blood 2014;123:4023-6. 17. Keating GM. Defibrotide: a review of its use in severe hepatic veno-occlusive disease following haematopoietic stem cell transplantation. Clin Drug Investig 2014;34:895-904. 18. Richardson PG, Ho VT, Giralt S, Arai S, Mineishi S, Cutler C, et al. Safety and efficacy of defibrotide for the treatment of severe hepatic veno-occlusive disease. Ther Adv Hematol 2012;3:253-65. 19. Park M, Park HJ, Eom HS, Kwon YJ, Park JA, Lim YJ, et al. Safety and effects of prophylactic defibrotide for sinusoidal obstruction syndrome in hematopoietic stem cell transplantation. Ann Transplant 2013;18:36-42. 20. Dignan FL, Wynn RF, Hadzic N, Karani J, Quaglia A, Pagliuca A, et al; Haemato-oncology Task Force of British Committee for Standards in Haematology; British Society for Blood and Marrow Transplantation. BCSH/BSBMT guideline: diagnosis and management of veno-occlusive disease (sinusoidal obstruction syndrome) following haematopoietic stem cell transplantation. Br J Haematol 2013;163:444-57. NefroPlus 2016 Vol. 8 N.° 1 73 n n n ◗◗ CASOS CLÍNICOS Infección por parvovirus B19 asociado a glomerulonefritis en un paciente inmunocompetente. Terapia exitosa con inmunoglobulinas y corticoides Florentina Rosique López1, Inmaculada López Jiménez1, Rocío Alcaraz Martínez2, Encarnación Mateo Bosch1, Raquel Rodado Martínez1, Marisol Alegría Fernández1, Rosa Muñoz Muñoz1, Adoración Martínez Losa1, Eduardo López Guillén1, Luisa Jimeno García1 1 Servicio de Nefrología. Hospital Clínico Universitario Virgen de la Arrixaca. El Palmar, Murcia 2 Servicio de Medicina Interna. Hospital Morales Meseguer. Murcia NefroPlus 2016;8(1):74-77 RESUMEN Las infecciones víricas por hepatitis B, hepatitis C, virus de la inmunodeficiencia humana (VIH) y virus BK están relacionadas con enfermedades glomerulares; sin embargo, la asociación parvovirus B19 y riñón no está aún bien documentada. Se presenta el caso de un paciente inmunocompetente con fracaso renal agudo oligoanúrico en el contexto de síndrome nefrótico/nefrítico e infección aguda por parvovirus B19 (serología positiva para IgM) y diagnóstico por biopsia renal de enfermedad por cambios mínimos frente a glomerulonefritis segmentaria y focal incipiente, con reacción en cadena de la polimerasa (PCR) positiva para parvovirus B19 en tejido renal, que tras tratamiento con inmunoglobulinas y esteroides mejora de manera progresiva, presentando el paciente función renal normal en la actualidad. Creemos que en todos los pacientes con síndrome nefrótico/nefrítico se debería realizar serología para este microorganismo y en caso de infección aguda instaurar tratamiento con inmunoglobulinas y corticoides. Palabras clave: Corticoides. Glomerulonefritis. Inmunoglobulinas. Parvovirus B19. Síndrome nefrótico/nefrítico. INTRODUCCIÓN El parvovirus B19 puede producir muchas manifestaciones clínicas, incluyendo eritema infeccioso (quinta enfermedad), crisis aplásicas en pacientes con anemia hemolítica crónica, hidropesía fetal en mujeres embarazadas, artropatía aguda o crónica, aunque la mayoría de las infecciones por este microorganismo son asintomáticas. Sin embargo, su asociación con enfermedades renales no se conoce bien actualmente1. Se ha documentado su relación con enfermedades glomerulares, vasculitis y ne- Correspondencia: Florentina Rosique López Servicio de Nefrología. Hospital Clínico Universitario Virgen de la Arrixaca. Ctra. Madrid-Cartagena, s/n. 30120 El Palmar, Murcia. flori.rosique@gmail.com 74 NefroPlus 2016 Vol. 8 N.° 1 n n n fritis tubulointersticial aguda2-16. Se presenta el caso de un paciente inmunocompetente diagnosticado de infección por parvovirus B19 asociado a glomerulonefritis por cambios mínimos frente a hialinosis segmentaria y focal que tras tratamiento con inmunoglobulinas y corticoides mejora progresivamente, con función renal normal en la actualidad. CASO CLÍNICO Paciente de 73 años con antecedentes de hipertensión arterial, dislipemia, ictus isquémico hace más de 20 años sin secuelas, alergia a la penicilina y función renal previa normal dos años antes del ingreso. Acude a urgencias por un cuadro clínico de 4 días de evolución de mal estado general, astenia, edemas en la cara, las manos y los miembros inferiores y disminución de la diuresis, asociado todo ello a un cuadro respiratorio de vías altas y un cuadro digestivo con aumento del número de deposiciones de consistencia semisólida y molestias abdominales difusas. ◗◗ CASOS CLÍNICOS En la exploración física destacaba tensión arterial de 160/80 mmHg, soplo cardíaco sistólico II/VI aórtico y edema en cara, piernas y manos con fóvea. En la analítica al ingreso se objetivaba creatinina 3,06 mg/dl, urea 201 mg/dl, creatina-cinasa 529 UI/l, colesterol 342 mg/dl, hemoglobina 12 g/dl, proteínas totales 6,3 g/dl (sin medir albúmina); 4 días después, presentaba unos valores de albúmina de 2,3 g/dl y proteínas totales de 4,4 g/dl. Factor reumatoide < 10 UI/ml, antiestreptolisina < 20 UI/ml, proteína C reactiva 1,8 mg/dl. Sistemático de orina: albúmina 500 mg/dl, 671 leucocitos/campo, 98 hematíes/campo, 2 cilindros hialinos-granulosos. La orina de 24 horas no se pudo cuantificar por oligoanuria desde el ingreso. Proteinograma con patrón inflamatorio. Inmunología: C3 119 mg/dl, C4 31 mg/dl, IgG algo disminuida 726 mg/dl, IgA 225 mg/dl, IgM 78 mg/dl. Inmunoelectroforesis en suero sin picos monoclonales en la región gamma, cadenas libres kappa 4,5 mg/l, cadenas libres lambda 4 mg/l, cociente kappa/lambda 1,13, autoanticuerpos no órgano específicos (ANOES) negativos, ANCA negativos, ENA negativo, anticuerpos anticardiolipinas IgM 1 U-MPL/ml, anticuerpos anticardiolipinas IgG 1 U-GPL/ml, anticuerpos antimembrana basal 0 UI/ml, crioglobulinas negativo, Bence-Jones negativo. IEF en orina: no se detectan paraproteínas. Estudio serológico de virus de hepatitis C y B, VIH y sífilis negativo. En las pruebas complementarias realizadas, los resultados de los estudios ecográfico abdominal y ecocardiográfico fueron normales. Desde el ingreso el paciente se encontraba en oligoanuria, por lo que decidimos iniciar 3 bolos de metilprednisolona de 1 g/ día, para continuar con 1 mg/kg/día, ante la sospecha de insuficiencia renal aguda. Al segundo día iniciamos hemodiálisis ante la persistencia del fracaso renal. Se realizó biopsia renal a los 4 días del ingreso, con el resultado de nefritis tubulointersticial aguda focal de intensidad moderada. Se objetivaban 8 glomérulos, 2 de los cuales mostraban esclerosis global, áreas focales de edema intersticial con presencia de un infiltrado de intensidad moderada, constituido predominantemente por linfocitos, entre los cuales se identificaba presencia de células plasmáticas, y en menor número, polinucleares y eosinófilos. No se observaban alteraciones a nivel glomerular ni vascular. Inmunofluorescencia directa negativa para IgA, IgG, IgM, C1q, cadenas ligeras kappa y lambda. Ante los hallazgos de la biopsia se mantuvo tratamiento con prednisona, en pauta descendente, sin mostrar mejoría alguna. Ante la persistencia del fracaso renal agudo, se amplió el estudio para descartar enfermedades infecciosas que pudiesen cursar con nefritis tubulointersticial aguda y/o síndrome nefrítico. El diagnóstico histológico de nefritis tubulointersticial aguda focal y moderada no concordaba con el cuadro clínico que presentaba el paciente. Se solicitó estudio serológico: para leptospirosis, Chlamydia, Brucella y Listeria, que fueron negativos, anticuerpos IgG positivos para citomegalovirus, anticuerpos IgG para herpes simple positivos, anticuerpos IgG VCA para virus de Epstein-Barr positivos, parvovirus B19 con IgM positivo. Se realizó PCR en sangre para parvovirus, que fue negativa, y PCR en tejido renal, que se confirmó positiva. Ante la persistencia del fracaso renal agudo después de 4 semanas de tratamiento con hemodiálisis se decidió realizar una segunda biopsia renal, sospechando una evolución a glomerulonefritis colapsante. El diagnóstico histológico fue entonces de enfermedad por cambios mínimos frente a hialinosis segmentaria y focal incipiente, necrosis tubular aguda focal y nefritis tubulointersticial focal leve. Se objetivaron 12 glomérulos, 2 de los cuales presentaban esclerosis global. El resto no mostraba alteraciones morfológicas significativas, salvo la presencia de un área parahiliar en un glomérulo con tendencia nodular Pas positiva sugestiva de corresponder a lesión incipiente de hialinosis segmentaria y focal. El resto del parénquima presentaba algunas áreas focales de infiltración inflamatoria intersticial por células linfoplasmocitarias con presencia ocasional de eosinófilos, áreas de edema intersticial y alteraciones inespecíficas del epitelio tubular con carácter focal que pueden ser compatibles con necrosis tubular aguda focal e inmunofluorescencia directa discretamente positiva para IgM con depósitos mesangiales difusos y negativa para IgA, IgG, C3 y fibrinógeno. Después de 4 semanas en oligoanuria el paciente comenzó a recuperar la diuresis de manera progresiva, hasta 1.200 cc/día, pudiendo suspender la diálisis. Se mantuvo tratamiento con prednisona. En este momento se objetivó una albúmina sérica de 1,7 g/dl y proteinuria/24 horas de 15 g/día; sistemático de orina: 36 hematíes/campo, 16 leucos/campo, 1 cilindro, albúmina 500 mg/dl e hipertensión arterial controlada con medicación. La función renal mejoró hasta unos valores de creatinina de 3,36 mg/dl. De manera paralela, llamaba la atención que el paciente presentaba durante el ingreso importante anemización normocítica-normocrómica sin respuesta reticulocitaria, resistente a la eritropoyetina, precisando transfusiones. Se pensó en afectación de la médula ósea por parvovirus B19, de modo que se realizó una punción esternal que mostró médula ósea normal, pero PCR positiva para parvovirus B19 en tejido de médula ósea. Después de 2 semanas sin precisar hemodiálisis, volvió a empeorar la función renal, manteniendo diuresis de alrededor de 1.000 cc, en tratamiento con diuréticos y expansores de volumen. Se comenzó nuevamente hemodiálisis con ultrafiltración, perdiendo de nuevo la diuresis. Se repitió la serología para vigilar la seroconversión, y se confirmó que la IgM persistía positiva y la IgG se positivizó. Ante esta evolución tórpida se decidió tratar el parvovirus B19 con inmunoglobulinas intravenosas con alto porcentaje de anticuerpos antiparvovirus a dosis de 200 mg/kg/día durante 3 días y el síndrome nefrótico/nefrítico por enfermedad por cambios mínimos frente a glomerulonefritis por hialinosis segmentaria y focal con prednisona a dosis de 1 mg/kg/día. Con este tratamiento el paciente comenzó a mejorar de manera progresiva, con recuperación de la diuresis, pudiendo suspender la diálisis a los 2 meses del inicio de esta, con normalización de la creatinina a los 5 meses del ingreso, consiguiendo la remisión completa del síndrome nefrótico a los 21 meses (figura 1). NefroPlus 2016 Vol. 8 N.° 1 75 n n n 18 18 16 16 14 14 12 12 10 10 8 8 6 6 4 4 2 2 0 0 Hemodiálisis No hemodiálisis Hemodiálisis No hemodiálisis Tratamiento con inmunoglobulina (3 días) Proteinuria (g/24h) Creatinina (mg/dl) ◗◗ CASOS CLÍNICOS Hemodiálisis – 0-4 semanas – 6-8 semanas No hemodiálisis – 4-6 semanas – 8-64 semanas Tratamiento con corticoides – 0-80 semanas Tratamiento con inmunoglobulina (IGS) – 6 semanas (tres días) Tiempo (semanas) Creatinina (mg/dl) Proteinuria/24 horas Figura 1. Evolución de función renal y proteinuria. DISCUSIÓN Las enfermedades glomerulares han estado implicadas en muchas infecciones víricas, incluyendo hepatitis B y C, VIH y virus BK. Sin embargo, la asociación con el parvovirus B19 no es aún bien conocida17. El parvovirus B19 se ha asociado a glomerulonefritis proliferativa focal, glomeruloesclerosis focal y segmentaria, glomerulopatía colapsante, glomerulonefritis proliferativa mesangial difusa, glomerulonefritis endocapilar con depósitos de inmunocomplejos y enfermedad por cambios mínimos1-10. También se han documentado casos esporádicos de vasculitis y nefritis tubulointersticial aguda con evidencia serológica de infección aguda por parvovirus B1911-16. En nuestro paciente, la PCR para parvovirus B19 fue positiva en tejido renal; en cuanto al mecanismo exacto de cómo produce la infección por parvovirus B19 glomerulonefritis no es conocido. Parece ser que la detección del ADN in situ por hibridación del parvovirus B19 dentro de las células del glomérulo sugiere posible efecto vírico directo9. En nuestro caso, se diagnosticó en la primera biopsia de nefritis tubulointersticial moderada, por lo que tratamos al paciente inicialmente con dosis de corticoides de 1 mg/kg/día. Sin embargo, ante la persistencia del fracaso renal agudo y la clínica compatible con síndrome nefrítico, pensamos que la nefritis tubulointersticial podía ser un hallazgo vinculado al proceso, pero no causa del cuadro clínico del paciente, y decidimos estudiar otras causas de síndrome nefrítico, pidiendo toda la batería de probables microorganismos implicados en este cuadro, con la confirmación de infección aguda por parvovirus B19. La realización de una segunda biopsia mostró enfermedad por cambios mínimos frente a hialinosis segmentaria y focal incipiente. Supuestamente, ya tendría estos cambios mínimos en la primera biopsia, ya que esta no produce alteraciones morfológicas. Parece que hubo una mejoría inicial con los corticoides, continuando con dosis decrecien76 NefroPlus 2016 Vol. 8 N.° 1 n n n tes, pero posteriormente el paciente comenzó a empeorar; entonces se decidió un tratamiento mixto, esto es, volver a subir la dosis de corticoides y tratar la infección con inmunoglobulinas, presentando el paciente una evolución excelente. También presentó anemización normocítica-normocrómica, resistente al tratamiento con eritropoyetina que precisó transfusiones, siendo detectada la PCR de parvovirus en la médula ósea. Decidimos instaurar tratamiento con inmunoglobulinas ya que, revisando la literatura médica, en un estudio retrospectivo se evaluó la eficacia de este tratamiento en 10 pacientes con aplasia pura de células rojas con infección por parvovirus B19, de los cuales 9 estaban inmunocomprometidos, resolviéndose la anemia en 9 de los 10 pacientes, con una media de remisión de 80 días; el único paciente que no experimentó mejoría fue debido a que presentaba un síndrome mielodisplásico18. También se ha descrito que en 3 pacientes con vasculitis e infección por parvovirus B19, el tratamiento con corticoides y ciclofosfamida no controló la vasculitis; sin embargo, el tratamiento con inmunoglobulinas condujo a una rápida mejoría de las manifestaciones sistémicas de la vasculitis, así como remisión a largo plazo y control de la infección por parvovirus B1914. Nosotros concluimos que en pacientes con síndrome nefrótico/ nefrítico sería necesario realizar serología de parvovirus para descartar infección aguda por este microorganismo. En nuestro caso, el tratamiento con inmunoglobulinas con alto porcentaje de anticuerpos-antiparvovirus junto con corticoides pudo ser efectivo para el control de la enfermedad. Lo que nos planteamos, y podría ser motivo de próximos estudios, es la implicación que el virus tiene en algunas enfermedades glomerulares, cuando la PCR es detectada en tejido renal pero sin infección aguda en ese momento. Conflictos de interés Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo. ◗◗ CASOS CLÍNICOS REFERENCIAS BIBLIOGRÁFICAS 1. Parikh CR, McSweeney PA, Koruar D, Ecder T, Merouani A, Taylor J, et al. Renal dysfunction in allogeneic hematopoietic cell transplantation. Kidney Int 2002;62:566-73. 2. Sawinski D. The kidney effects of hematopoietic stem cell transplantation. Adv Chronic Kidney Dis 2014;21:96-105. 3. Arnaout K, Patel N, Jain M, El-Amm J, Amro F, Tabbara IA. Complications of allogeneic hematopoietic stem cell transplantation. Cancer Invest 2014;32:349-62. 4. Borrego FJ, Viedma G, Pérez del Barrio P, Gil JM, De Santis-Scoccia C, Ramírez Huerta JM, et al. Insuficiencia renal aguda secundaria a enfermedad veno-oclusiva hepática en un paciente con trasplante de médula ósea. Nefrologia 2003;23:350-4. 5. Handgretinger R. Haploidentical transplantation: the search for the best donor. Blood 2014;124:827-8. 6. Wang Y, Chang YJ, Xu LP, Liu KY, Liu DH, Zhang XH, et al. Who is the best donor for a related HLA haplotype-mismatched transplant? Blood 2014;124:843-50. 7. Jones RJ, Lee KS, Beschorner WE, Vogel VG, Grochow LB, Braine HG, et al. Venoocclusive disease of the liver following bone marrow transplantation. Transplantation 1987;44:778-83. 8. Takamura H, Nakanuma S, Hayashi H, Tajima H, Kakinoki K, Kitahara M, et al. Severe veno-occlusive disease/sinusoidal obstruction syndrome after deceased-donor and living-donor liver transplantation. Transplant Proc 2014;46:3523-35. 9. Rubbia-Brandt L. Sinusoidal obstruction syndrome. Clin Liver Dis 2010;14:651-68. 10. Norvell JP. Liver disease after hematopoietic cell transplantation in adults. Transplant Rev 2015;29:8-15. 11. Nagler A, Labopin M, Berger R, Bunjes D, Campos A, Socié G, et al. Allogeneic hematopoietic SCT for adults AML using i.v. BU in the conditioning regimen: outcomes and risk factors for the occurrence of hepatic sinusoidal obstructive syndrome. Bone Marrow Transplant 2014;49:628-33. 12. Møller S, Krag A, Bendtsen F. Kidney injury in cirrhosis: pathophysiological and therapeutic aspects of hepatorenal syndromes. Liver Int 2014;34:1153-63. 13. Fabrizi F, Aghemo A, Messa P. Hepatorenal syndrome and novel advances in its management. Kidney Blood Press Res 2013;37:588601. 14. McDonald GB, Sharma P, Matthews DE, Shulman HM, Thomas ED. Venocclusive disease of the liver after bone marrow transplantation: diagnosis, incidence, and predisposing factors. Hepatology 1984;4:116-22. 15. Carreras E. How I manage sinusoidal obstruction syndrome after haematopoietic cell transplantation. Br J Haematol 2015;168:48191. 16. Chao N. How I treat sinusoidal obstruction syndrome. Blood 2014;123:4023-6. 17. Keating GM. Defibrotide: a review of its use in severe hepatic veno-occlusive disease following haematopoietic stem cell transplantation. Clin Drug Investig 2014;34:895-904. 18. Richardson PG, Ho VT, Giralt S, Arai S, Mineishi S, Cutler C, et al. Safety and efficacy of defibrotide for the treatment of severe hepatic veno-occlusive disease. Ther Adv Hematol 2012;3:25365. 19. Park M, Park HJ, Eom HS, Kwon YJ, Park JA, Lim YJ, et al. Safety and effects of prophylactic defibrotide for sinusoidal obstruction syndrome in hematopoietic stem cell transplantation. Ann Transplant 2013;18:36-42. 20. Dignan FL, Wynn RF, Hadzic N, Karani J, Quaglia A, Pagliuca A, et al; Haemato-oncology Task Force of British Committee for Standards in Haematology; British Society for Blood and Marrow Transplantation. BCSH/BSBMT guideline: diagnosis and management of veno-occlusive disease (sinusoidal obstruction syndrome) following haematopoietic stem cell transplantation. Br J Haematol 2013;163:444-57. NefroPlus 2016 Vol. 8 N.° 1 77 n n n ◗◗ CASOS CLÍNICOS Enfermedad linfoproliferativa postrasplante renal no asociada a virus de Epstein-Barr Ángela Casas Parra1, Catherine Zulberti1, Harvey Andrés Florez2, Melani Pestaña3, Oriol Puig4, Fina Climent2, Montse Cortés4, Manuel Rubio Rivas3, Josep Maria Cruzado1, Edoardo Melilli1 1 Servicio de Nefrología. Hospital Universitario de Bellvitge. L’Hospitalet de Llobregat, Barcelona 2 Servicio de Anatomía Patológica. Hospital Universitario de Bellvitge. L’Hospitalet de Llobregat, Barcelona 3 Servicio de Medicina Interna. Hospital Universitario de Bellvitge. L’Hospitalet de Llobregat, Barcelona 4 Servicio de Medicina Nuclear. Hospital Universitario de Bellvitge. L’Hospitalet de Llobregat, Barcelona NefroPlus 2016;8(1):78-81 RESUMEN El virus del herpes humano-8 (VHH-8), también conocido comúnmente como “virus asociado a sarcoma de Kaposi”, es un ADN virus perteneciente a la subfamilia de los virus herpes-gamma, y es el único miembro de los Rhadinovirus con la capacidad de infectar al ser humano. La relación de este patógeno en el desarrollo de enfermedades en pacientes inmunosuprimidos es ya bien reconocida, y con respecto al grupo de los trasplantados, se ha asociado a patologías de tipo tanto neoplásico como no neoplásico. Dentro del grupo de las neoplásicas encontramos el sarcoma de Kaposi, la enfermedad de Castleman multicéntrica (ECD), el linfoma primario de cavidades y el linfoma plasmablástico; y en el grupo de patologías no neoplásicas el síndrome hemofagocítico, citopenias y fallo agudo de médula ósea. Describimos el caso de un paciente trasplantado renal desde hace 20 años que consulta por síndrome febril, adenopatías generalizadas y fracaso renal agudo, al que se le diagnostica un síndrome linfoproliferativo postrasplante. Discutimos la importancia de sospechar como agente etiológico en neoplasias postrasplante al VHH-8, mencionamos las diferentes neoplasias asociadas a este virus, las distintas técnicas diagnósticas, tratamiento y manejo de la inmunosupresión. Palabras clave: Enfermedad de Castlemann. Enfermedad linfoproliferativa postrasplante. Sarcoma de Kaposi. CASO CLÍNICO Varón de 65 años de edad, con patología nefrológica que debuta con hipertensión maligna a los 26 años de edad, biopsia renal realizada en 1975 que evidencia nefroangioesclerosis maligna. El paciente inicia terapia renal sustitutiva en hemodiálisis en 1985, y recibe un primer trasplante renal de donante cadáver en 1989. Compartiendo 1 HLA-DR con el donante, se realiza inducción con anticuerpo monoclonal anti-CD3 (OKT3), ciclosporina y prednisona, con adecuada evolución sin rechazo agudo ni otras complicaciones. Creatinina al alta de 85 µmol/l. En 2001 se cambia la ciclosporina a tacrolimus por hipertrofia Correspondencia: Ángela Casas Parra Servicio de Nefrología. Hospital Universitario de Bellvitge. C/ Feixa Llarga, s/n. 08907 L’Hospitalet de Llobregat, Barcelona. angelita_2121@hotmail.com; angela.casas@bellvitgehospital.cat 78 NefroPlus 2016 Vol. 8 N.° 1 n n n gingival. Desde entonces, el paciente sigue en biterapia con tacrolimus retard 5 mg/24 h (niveles medios: 6-8 µg/l) y prednisona 5 mg/24 h. Última creatinina 120 µmol/l, filtrado glomerular 53 ml/min, sin proteinuria ni microhematuria. En febrero de 2013, el paciente consulta a urgencias de atención primaria por clínica de disfagia alta y fiebre de predominio vespertino. Se orienta como faringoamigdalitis aguda y recibe tratamiento con amoxicilina-ácido clavulánico durante 2 semanas, aunque sin presentar mejoría. Por tanto, reconsulta a nuestro centro, donde se constata que continúa con fiebre vespertina, anorexia y disfagia alta persistente; además, se objetiva oliguria y edema de las extremidades inferiores con aumento de 3 kg de peso en la última semana. No presenta disnea. A la exploración física destaca tendencia a la hipotensión, febrícula, edemas pretibiales con fóvea grado III. A nivel bucofaríngeo, se objetiva hipertrofia amigdalar tipo IV, sin exudados. Presenta adenopatías generalizadas cervicales e inguinales. La ◗◗ CASOS CLÍNICOS exploración abdominal es normal, sin masas palpables ni visceromegalias. La analítica realizada al ingreso se describe en la tabla 1. Se objetiva un empeoramiento de la función renal con creatinina 222 μmol/l, urea 19,5 μmol/l e hipoalbuminemia grave (20 g/l). Hemograma sin leucocitosis ni leucopenia. El ionograma en orina denota un patrón funcional. En el sedimento urinario no se observan microhematuria, leucocituria ni proteinuria (0,04 g/ día). Se realizan pruebas microbiológicas, hemocultivos y urocultivo, que dan resultado negativo. El coprocultivo evidencia flora mixta intestinal. Asimismo, se realizan pruebas de cultivo Tabla 1. Parámetros analíticos al ingreso Creatinina (μmol/l) 222 (0-106) Urea (μmol/l) 19,2 (3,6-8,6) Sodio (mmol/l) 127 (135-147) Potasio (mmol/l) 3,7 (3,83-5,1) Cloro (mmol/l) 93 (102-109) Glucosa (mmol/l) 8,7 (4,1-6,9) Proteínas totales en plasma (g/l) 57 (60-80) Albúmina en plasma (g/l) 20 (35-52) Hemoglobina (g/l) 123 (126-166) Leucocitos 7.200 x 109/l (3,9-10) N 62 %, L 13 %, M 20 % Plaquetas 157.000 x 109/l (135-333) ALT/AST (ukat/l) 0,54/0,32 ALT (0-0,73) AST (0-0,54) Iones en orina muestra inicial urgencias: Sodio/Potasio/Cloro (mmol/d) 27/10/10 Iones en orina de 24 horas. Volumen: 1.000 ml Sodio/Potasio/Cloro (mmol/d) 12/21/80 Sodio (40-220) Potasio (25-125) Cloro (110-250) Proteinuria en 24 horas (g/d) 0,04 (0-0,15) Proteína C reactiva (mg/l) 65,5 (0-5) ALT: alanina-aminotransferasa; AST: aspartatoaminotransferasa; L: linfocitos; M: monocitos; N: neutrófilos. para Clostridium difficile (negativo); toxina (negativo); b2microglobulina, que resulta elevada –10,6 mg/l (N 0-2,2), y lactato deshidrogenasa normal con 1,6 μkat/l (N 0-3,4). Se realiza una ecografía para la valoración del trasplante renal, la cual muestra injerto renal en la fosa ilíaca derecha, de morfología normal, con grosor cortical conservado y correctamente diferenciado del seno, sin ectasia de vías excretoras y con ausencia de colecciones o de líquido perirrenal. Finalmente, se realiza diagnóstico de fracaso renal agudo de origen prerrenal secundario a tercer espacio (volumen efectivo intravascular disminuido) por anasarca en el contexto de desnutrición proteica. Se instaura tratamiento con sueroterapia, reposición de seroalbúmina y suplementos nutricionales. Por la presencia de síndrome tóxico y adenopatías generalizadas, y con la sospecha diagnóstica de síndrome linfoproliferativo, se decide solicitar como prueba diagnóstica una PET/TC con 18F-FDG (figura 1). La PET/TC con 18F-FDG muestra imágenes de cuerpo entero que identifican múltiples adenopatías discretamente hipermetabólicas laterocervicales (la de mayor tamaño de 23 mm y SUVmáx 5,5 g/ml), axilares (18 mm, SUVmáx 4 g/ml) (figura 1, flechas 1 y 2), cadenas ilíacas externas e inguinales (16 mm, SUVmáx 3 g/ml). Se observa también un marcado engrosamiento hipermetabólico amigdalar bilateral y simétrico (figura 1, flecha 3) y aumento difuso de la captación de la FDG a nivel esplénico (sin alteraciones Figura 1. Flechas 1 y 2: Adenopatías hipermetabólicas laterocervicales y axilares, respectivamente. Flecha 3: Engrosamiento amigdalar hipermetabólico. Flecha 4: Hipermetabolismo difuso esplénico. NefroPlus 2016 Vol. 8 N.° 1 79 n n n ◗◗ CASOS CLÍNICOS morfológicas) con respecto a la captación hepática (figura 1, flecha 4). A estos hallazgos se asocia un discreto derrame pleural bilateral sin captación patológica que condiciona un colapso pasivo de lóbulos inferiores sin clara evidencia de lesiones pleurales o pulmonares. El tamaño amigdalar, las numerosas adenopatías de características discretamente hipermetabólicas y el aumento difuso de la captación esplénica plantean el diagnóstico diferencial entre un proceso inflamatorio-reactivo/infeccioso-sistémico (infecciones por herpes virus, virus de Epstein-Barr [VEB], citomegalovirus, virus de la inmunodeficiencia humana, micobacterias, enfermedades granulomatosas, entre otras) frente a un proceso linfoproliferativo. Ante dichos hallazgos se solicitan pruebas dirigidas a la identificación de virus del herpes, VEB, citomegalovirus, virus de la inmunodeficiencia humana, micobacterias y antígenos tumorales. Entre ellas destacamos VEB IgG: 25,1 UI/ml, IgM negativo. Reacción en cadena de la polimerasa (PCR) para VEB: 4.974 copias. El resto de pruebas fueron negativas. Se realiza biopsia ganglionar cervical derecha y amidgalectomía por parte del servicio de otorrinolaringología (figura 2). El informe de la anatomía patológica describe un ganglio cervical derecho de 3 x 1,8 cm y amígdalas de 3 x 2 cm, sin alteraciones macroscópicas significativas. En el estudio histopatológico el ganglio cervical y las amígdalas muestran una arquitectura conservada, observándose en el ganglio, a nivel capsular y subcapsular, una proliferación de células fusiformes atípicas, formando estructuras vasculares (figura 2A). El estudio inmunohistoquímico es positivo para marcadores vasculares (CD31) y para el VHH-8 (figura 2B). Con estos hallazgos, se establece el diagnóstico de sarcoma de Kaposi. Además, los centros germi- A B C D Figura 2. A) Imagen histológica con tinción de hematoxilinaeosina de una proliferación vascular atípica x10. B) Marcador inmunohistoquímico para HHV-8 x20. C) Imagen histológica con tinción de hematoxilina-eosina donde se observa un centro germinal x20. D) Marcador inmunohistoquímico para IgM x20. 80 NefroPlus 2016 Vol. 8 N.° 1 n n n nales tienen un aspecto depletivo (figura 2C), y en la zona del manto destacan células aisladas de aspecto blástico, que inmunohistoquímicamente son positivas para IgM (figura 2D), lambda y VHH-8. Estos hallazgos son compatibles con una enfermedad de Castleman multicéntrica. El estudio molecular (IgH FR3) es compatible con un patrón policlonal. Ante los hallazgos histológicos se realiza PCR de VHH-8 en sangre periférica, que resulta positiva (test cualitativo). Frente a dicho diagnóstico se decide conversión con iMtor (sirolimus con un nivel entre 8 y 10 μg/l) y, posteriormente, tras una revisión de la bibliografía, se opta por añadir tratamiento con anticuerpo monoclonal anti-CD-20 (rituximab 375 mg/m2/semanal, 4 dosis en total). Tras el tratamiento instaurado el paciente evoluciona favorablemente, mejoran el síndrome febril y tóxico, y desaparecen las adenopatías a la palpación y en las imágenes. Al alta el paciente presenta recuperación completa de la función renal (creatinina 90 µmol/l) y normalización de la hipoalbuminemia (albúmina 35 g/l). Tras casi 2 años de seguimiento (20 meses) el paciente se mantiene en remisión completa, con carga vírica VHH-8 y PET-TC negativas. DISCUSIÓN El virus del herpes humano tipo 8 es un virus herpes gamma que infecta linfocitos y células epiteliales/endoteliales. La relación de este patógeno en el desarrollo de enfermedades en pacientes inmunosuprimidos es ya bien conocida, con amplia bibliografía en casos de pacientes VIH1; en lo que respecta al grupo de los trasplantados, se han planteado una serie de mecanismos de transmisión según se halle en una zona endémica o no2. La adquisición de una nueva infección puede proceder del donante, de la reactivación de una infección latente, o bien ser secundaria a una infección primaria después de un contacto sexual o no sexual (transfusión). En cuanto a la patogénesis del VHH-8, se sabe que tanto la expresión latente del gen como la lítica están presentes en el desarrollo de todas las enfermedades del tipo neoplásico, pero se ha visto que la expresión lítica del gen es más común en la ECD, menos en el sarcoma de Kaposi e infrecuente en el linfoma primario de cavidades3. La interleucina 6 tiene un papel central en la fisiopatología de la ECD, ya que el VHH-8 contiene en su ADN un homólogo de la interleucina 6 que explica la mayoría de las manifestaciones clínicas sistémicas de la enfermedad4. En cuanto al diagnóstico de la infección por VHH-8 y de las neoplasias relacionadas en pacientes postrasplantados, se utilizan varios métodos diagnósticos como la serología, el análisis inmunohistoquímico, la histología, la hibridación in situ y la PCR, ya que algunos métodos son limitados en infecciones agudas y otros tienen sensibilidad y/o especificidad relativas, siendo para algunos autores la histopatología el modelo de referencia. El conocimiento del efecto de este virus sobre la apoptosis, la progresión del ciclo celular, la angiogénesis, la producción de ◗◗ CASOS CLÍNICOS citocinas y la proliferación de células B ha sido muy útil en cuanto al desarrollo de dianas de tratamientos eficaces y efectivos contra dicho patógeno. En el tratamiento contra la infección y patologías subsecuentes por VHH-8 encontramos diferentes líneas: reducción de los inmunosupresores5, cambio del régimen de inmunosupresión, quimioterapia6, antivirales7 y tratamiento con anticuerpos monoclonales8,9. Actualmente, lo que se encuentra en mayor discusión es la técnica de detección y prevención, ya que el factor endémico del virus tiene una gran relevancia. En zonas no endémicas (< 20 %), el screening a todos los donantes y receptores puede llegar a tener una relación coste-beneficio no viable según en qué grupo poblacional nos encontremos. Independientemente de la detección pretrasplante de la carga vírica del VHH-8, no cabe ninguna duda de la importancia de la monitorización de la carga vírica VHH-8 en pacientes ya diagnosticados de patología tumoral relacionada (sea sarcoma de Kaposi o ECD o linfoma primario de cavidades) con el fin de confirmar la respuesta al tratamiento a través de la negativización de la viremia10. Como método alternativo y más preciso señalamos la monitorización inmunológica con el uso de la técnica de Elispot-T contra distintos antígenos del VHH-8. Con esta técnica se ha demostrado cómo el aumento de las clonas de células T específicas contra los antígenos del VVH-8, que se obtiene a través de la disminu- ción de la inmunosupresión, produce una remisión de la enfermedad11. Nuestro paciente presentaba dos de las neoplasias relacionadas con VHH-8, esto es, el sarcoma de Kaposi y la ECD. En la literatura médica, la presencia contemporánea de estas dos enfermedades en el trasplante renal solo se ha descrito en otro caso. El caso descrito, a diferencia del nuestro, ha tenido mala evolución, ya que ha sido diagnosticado post mortem de sarcoma de Kaposi pulmonar, mientras que la ECD sí se había detectado pre mortem12. El diagnóstico rápido de la enfermedad gracias a un enfoque multidisciplinar y a la reducción de la inmunosupresión a través de la conversión a iMtor ha sido la clave de la evolución favorable de nuestro paciente. Debido al elevado riesgo de recaída y al mal pronóstico relacionado con la ECD, en nuestra opinión es conveniente añadir también rituximab. La remisión completa casi a los dos años en nuestro caso, tratado con la administración combinada de iMtor más rituximab, respalda nuestra actitud terapéutica, aunque se debería confirmar con una casuística más amplia de casos. Conflictos de interés Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo. REFERENCIAS BIBLIOGRÁFICAS 1. Oksenhendler E. HIV-associated multicentric Castleman disease. Curr Opin HIV AIDS 2009;4:16-21. 2. Ariza-Heredia EJ, Razonable RR. Human herpes virus 8 in solid organ transplantation. Transplantation 2011;92:837-44. 3. Katano H, Sato Y, Kurata T, Mori S, Sata T. Expression and localization of human herpesvirus 8-encoded proteins in primary effusion lymphoma, Kaposi’s sarcoma, and multicentric Castleman’s disease. Virology 2000;269:335-44. 4. Van Rhee F, Stone K, Szmania S, Barlogie B, Singh Z. Castleman disease in the 21st century: an update on diagnosis, assessment, and therapy. Clin Adv Hematol Oncol 2010;8:486-98. 5. Riva G, Luppi M, Barozzi P, Forghieri F, Potenza L. How I treat HHV8/KSHV related disease in post trasplant patients. Blood 2012;120:4150-9. 6. Uldrick TS, Polizzotto MN, Aleman K, Wyvill KM, Marshall V, Whitby D, et al. Rituximab plus liposomal doxorubicin in HIV-infected patients with KSHV-associated multicentric Castleman disease. Blood 2014;124:3544-52. 7. Mandel C, Silberstein M, Hennessy O. Case report: fatal pulmonary Kaposi’s sarcoma and Castleman’s disease in a renal transplant recipient. Br J Radiol 1993;66:264-5. 8. Gantt S, Casper C. Human herpesvirus 8-associated neoplasms: the roles of viral replication and antiviral treatment. Curr Opin Infect Dis 2011;24:295-301. 9. Nicoli P, Familiari U, Bosa M, Allice T, Mete F, Morotti A, et al. HHV8-positive, HIV-negative multicentric Castleman’s disease: early and sustained complete remission with rituximab therapy without reactivation of Kaposi sarcoma. Int J Hematol 2009;90:392-6. 10. Nagao A, Nakazawa S, Hanabusa H. Short-term efficacy of the IL6 receptor antibody tocilizumab in patients with HIV-associated multicentric Castleman disease: report of two cases. J Hematol Oncol 2014;7:10. 11. Diéval C, Bonnet F, Mauclère S, Masquelier B, Bentaberry F, Cazeau A, et al. Multicentric Castleman disease: Use of HHV8 viral load monitoring and positron emission tomography during follow-up. Leuk Lymphoma 2007;48:1881-3. 12. Barozzi P, Bonini C, Potenza L, Masetti M, Cappelli G, Gruarin P, et al. Changes in the immune responses against human herpesvirus-8 in the disease course of posttransplant Kaposi sarcoma. Transplantation 2008;86:738-44. NefroPlus 2016 Vol. 8 N.° 1 81 n n n ◗◗ CASOS CLÍNICOS Fallo renal causado por hipertensión maligna acelerada Gonzalo Martínez-Fernández1, Agustín Ortega-Cerrato1, Eva Oliver-Galera2, Teresa Nam-Cha3, Lourdes de la Vara-Iniesta1, Carmen Gómez-Roldán1, Juan Pérez-Martínez1 1 Servicio de Nefrología. Complejo Hospitalario Universitario. Albacete 2 Servicio de Medicina Interna. Complejo Hospitalario Universitario. Albacete 3 Servicio de Anatomía Patológica. Complejo Hospitalario Universitario. Albacete NefroPlus 2016;8(1):82-84 RESUMEN La hipertensión maligna acelerada es una entidad caracterizada por cifras de tensión arterial elevadas, retinopatía hipertensiva grave y afectación de órgano diana, siendo el más frecuentemente afectado el riñón (50 % de los casos). El caso clínico que describimos debutó como un fallo renal agudo y muestra todas las peculiaridades clínicas de esta entidad patológica. Para su diagnóstico fue preciso la realización de una biopsia renal, donde se observó la presencia del dato anatomopatológico definitorio: focos de necrosis fibrinoide arteriolar. Pese al tratamiento adecuado, con control de las cifras de tensión arterial, la insuficiencia renal fue irreversible, algo que ocurre en el 20 % de los casos, siendo preciso el inicio de tratamiento renal sustitutivo. Palabras clave: Fallo renal agudo. Hipertensión maligna acelerada. Necrosis fribrinoide. Retinopatía hipertensiva. INTRODUCCIÓN La hipertensión maligna acelerada es una patología caracterizada por cifras elevadas de presión arterial (PA), signos de retinopatía hipertensiva grave (grados III o IV) y, desde el punto de vista anatomopatológico, daño arteriolar con focos de necrosis fibrinoide. Suele ser frecuente la aparición de complicaciones asociadas a lesión de órgano diana, como accidente cerebrovascular, cardiopatía isquémica, fallo renal agudo/subagudo o microangiopatía trombótica. Presentamos a continuación el caso de una mujer con hipertensión arterial maligna acelerada y fallo renal agudo secundario. CASO CLÍNICO Mujer de 41 años que acude a urgencias refiriendo un cuadro clínico de disnea de esfuerzo y cefalea holocraneal resistente al tratamiento analgésico de 3 semanas de evolución, junto con astenia y sensación de pérdida de visión bilateral durante los Correspondencia: Gonzalo Martínez-Fernández Servicio de Nefrología. Complejo Hospitalario Universitario de Albacete. C/ Seminario, 4. 02006 Albacete. gonzalomfer@hotmail.com 82 NefroPlus 2016 Vol. 8 N.° 1 n n n últimos 7 días. Como antecedentes personales destacaban tomas aisladas de PA elevada, sin haber recibido nunca tratamiento médico y ovariectomía izquierda por torsión crónica con diagnóstico de teratoma maduro quístico. Sin antecedentes previos de nefropatía. Como antecedentes familiares, cabe destacar que su madre presentaba hipertensión arterial, con buen control farmacológico. En la exploración física, su PA era de 190/110 mmHg, que no mejoró pese al tratamiento con los antihipertensivos empleados en urgencias (dos tomas de 25 mg de captopril y 20 mg intravenosos de furosemida). No presentaba soplos carotídeos, abdominales ni a otro nivel; la auscultación cardiopulmonar era normal, sin observarse ningún dato patológico a otro nivel. Como pruebas complementarias, se solicitó una analítica sérica, que mostró los siguientes valores: creatinina 4,3 mg/dl, urea 102 mg/dl, potasio 2,7 mmol/l, lactato deshidrogenasa 1.847 UI/l, hemoglobina 10,8 mg/dl, hematocrito 29,4 % y plaquetas 107.000/μl, y en orina se observaban 20-50 hematíes/campo junto con proteinuria de 150 mg/dl. Ante la sospecha diagnóstica, se realiza fondo de ojo que mostraba “signos de retinopatía hipertensiva grave con exudados algodonosos, alguna hemorragia en ambos ojos y edema de papila (grado IV de Keith-Wagener)”. Se decide su ingreso en Nefrología. Una vez ingresada con sospecha de hipertensión maligna acelerada, con la intención tanto de filiar la etiología del cuadro ◗◗ CASOS CLÍNICOS clínico como de valorar su repercusión sistémica, se solicitan una ecografía renal (“riñones de tamaño normal, con mala diferenciación corticomedular, sin dilatación de vías”), una angiorresonancia magnética con gadolinio (“riñón izquierdo de 11,1 cm, riñón derecho de 10,5 cm. La arteria renal derecha presenta a 1 cm de su salida una discreta disminución de calibre de un 37 % no significativa. La arteria renal izquierda también presenta una discreta disminución de 1 cm, de un 27 %, que tampoco es significativa), una tomografía computarizada craneal (“sin lesiones significativas”) y un ecocardiograma (“ventrículo izquierdo con hipertrofia grave, sin alteraciones de contractilidad segmentaria y con fracción de eyección del 78 %. Disfunción diastólica con retraso de la relajación. Sin lesiones valvulares”). En el estudio analítico se confirmaban unos valores elevados de lactato deshidrogenasa (1.752 UI/l), observándose haptoglobina de 0 y presencia de 1-2 esquistocitos/campo. Se completó el estudio analítico sérico con autoinmunidad (ANA, ANCA, ENA, anti-DNA y anti-MBG), complemento, inmunoglobulinas, hormonas tiroideas y proteinograma, que resultaron normales y/o negativos, y en estudio urinario, proteinuria de 24 horas (1,8 g/24 h), así como catecolaminas y/o ácido vanilmandélico (valores inferiores a 110 μg/24 h y 7 mg/24 h horas, respectivamente). Para obtener el diagnóstico definitivo, se procedió a la realización de una biopsia renal percutánea (en ese momento, la paciente presentaba PA parcialmente controlada de 155/85 mmHg) que mostró, según el informe de anatomía patológica: “Cilindro renal en el que se identifican 29 glomérulos, 6 de ellos esclerosados. Algunos glomérulos muestran engrosamiento de la matriz mesangial con aumento de la celularidad, y en la mayoría de estos glomérulos las lesiones son segmentarias. Las arterias de gran calibre muestran engrosamiento fibroso de la íntima. En las arterias de mediano calibre y arteriolas se observa una luz vascular disminuida con engrosamiento de la íntima y presencia de imágenes “en capa de cebolla” en la pared vascular (figura 1). Existen, a su vez, algunos focos de necrosis fibrinoide en la pared de dichas arteriolas (figura 2). En resumen, biopsia compatible con nefropatía hipertensiva maligna. Desde el punto de vista terapéutico, se comenzó tratamiento antihipertensivo, inicialmente con inhibidores de la enzima de conversión de la angiotensina (enalapril) y antagonistas de los receptores de la angiotensina II (valsartán) hasta alcanzarse las dosis máximas (20 mg cada 12 horas y 320 mg cada 24 horas). Se constató un irregular control de la PA, siendo preciso añadir nifedipino 30 mg cada 12 horas y carvedilol 25 mg cada 24 horas, consiguiéndose así un adecuado manejo de la hipertensión arterial. Clínicamente, se consiguió el cese precoz de la disnea y la cefalea que presentaba al ingreso, con progresiva desaparición de la astenia, así como sensación subjetiva de mejoría de la agudeza visual. Respecto a los trastornos iónicos, se normalizaron las cifras de potasio, presentando al alta un valor de potasio sérico de 3,9 mmol/l. Pese a la mejoría de las cifras de PA, no se consiguió optimizar las cifras de función renal, presentando al alta una creatinina 1 2 3 Figura 1. Proliferación intimal de pequeña arteriola renal que produce imágenes “en capa de cebolla” en diferentes tinciones. 1) Pas. 2) tricrómico de Masson. 3) Perls. 1 2 Figura 2. Focos de necrosis fibrinoide en la pared de las arteriolas renales en la tinción de tricrómico de Masson. plasmática de 4,5 mg/dl con aclaramiento de creatinina de 16,2 ml/min, por lo que se derivó a consulta prediálisis tras optar la paciente por diálisis peritoneal como futura técnica renal sustitutiva. DISCUSIÓN La hipertensión maligna acelerada se define como la aparición de cifras muy elevadas de PA, generalmente (aunque no es necesario para su diagnóstico) con PA diastólica de 120 mmHg, junto con presencia en el fondo de ojo de hemorragias, exudados (retinopatía grado III de Keith-Wagener) o papiledema (grado IV de Keith-Wagener)1. La gravedad del cuadro clínico está relacionada con la afectación vascular que puede aparecer a nivel renal, cerebral o cardiológico, además de la habitual presencia de anemia hemolítica microangiopática, pudiendo llegar a suponer riesgo de muerte para el paciente. A su vez, en el momento del diagnóstico, no es infrecuente la aparición de síntomas inespecíficos como náuseas y vómitos, mareo, sensaNefroPlus 2016 Vol. 8 N.° 1 83 n n n ◗◗ CASOS CLÍNICOS ción disneica, somnolencia, malestar general, cefalea, debilidad y entumecimiento en los miembros2. La etiología más frecuente se encuentra en relación con hipertensión arterial esencial, y oscila entre el 20 % y el 75 % de los casos según los estudios que lo valoren3. Si bien en décadas pasadas suponía una complicación para entre el 1 % y el 5 % de los hipertensos, en la actualidad su incidencia en estos pacientes es inferior al 1 % y se limita habitualmente a pacientes con mal cumplimiento terapéutico prolongado4. Entre las otras patologías que pueden generarla se encuentran el feocromocitoma, procesos sistémicos como el lupus eritematoso sistémico, la esclerosis sistémica o la panarteritis nudosa, las lesiones vasculorrenales, glomerulonefritis primarias (siendo la más frecuente la nefropatía IgA), el consumo de tóxicos (fundamentalmente cocaína) y ciertos fármacos como los anticonceptivos orales5. La asociación con estas patologías condiciona las pruebas diagnósticas que se deben realizar. Así, es necesario completar el estudio con análisis de autoinmunidad (ANA, ANCA y anti-DNA) y otras pruebas sugestivas de proceso sistémico (como complemento e inmunoglobulinas), catecolaminas en orina y ácido vanilmandélico, tóxicos en orina y pruebas de imagen para la valoración de la vasculatura renal (eco-Doppler, angio-TC o angio-RM)6. La fisiopatología que genera las cifras muy elevadas de PA, al margen de las causas primarias de hipertensión descritas anteriormente, parece involucrar al eje renina-angiotensina-aldosterona7. A su vez, la lesión de los órganos diana está relacionada con las lesiones vasculares sobre la microcirculación sistémica, que generan procesos isquémicos de mayor o menor magnitud. Esa isquemia, a nivel de la microcirculación renal, genera una sobreproducción de renina como mecanismo protector para asegurar la perfusión del riñón, con el consecuente efecto negativo sobre la PA, retroalimentando y amplificando el proceso. Hasta en el 50 % de los casos de hipertensión maligna acelerada se produce afectación renal, siendo el grado del daño renal oscilante entre el deterioro mínimo y reversible hasta la insuficiencia renal crónica terminal con necesidad de tratamiento renal sustitutivo. Esta situación, similar a la del caso que nos ocupa, ocurre en torno al 20 % de los casos de hipertensión maligna acelerada y daño renal8. Para el diagnóstico, si bien la presencia de los datos típicos de la patología (PA elevada con afectación grave del fondo de ojo) sumada al deterioro de la función renal es altamente indicativa de nefropatía hipertensiva maligna, el gold standard es la biopsia renal. En su valoración, aunque la lesión más llamativa y característica de la misma es la presencia de proliferación intimal que da lugar a las imágenes “en capa de cebolla”, la auténtica lesión definitoria de nefropatía hipertensiva maligna es la presencia de focos de necrosis fibrinoide en la pared de las arteriolas renales. En relación con el tratamiento, al margen del manejo de las complicaciones asociadas, es fundamental, como cabría esperar, el manejo estricto de la PA. Inicialmente, es necesario un manejo agresivo de las cifras de PA, intentando alcazar cifras de PA diastólicas inferiores a 100 mmHg en 2-6 horas, evitando a su vez un descenso de la presión superior al 25 %, para lo cual incluso es preciso el empleo de medicación intravenosa como labetalol, nitroprusiato o urapidilo9. Sin embargo, dada la implicación del eje renina-angiotensina-aldosterona en la fisiopatogénesis de la hipertensión maligna, los fármacos de elección son los antagonistas de los receptores de la angiotensina II y los inhibidores de la enzima de conversión de la angiotensina, independientemente del grado de afectación renal que presente el paciente. Esto no contraindica el empleo de cualquier otro fármaco hipotensor, puesto que lo fundamental es normalizar la PA del paciente. Tal es la importancia de este tratamiento, que la supervivencia de los pacientes tratados adecuadamente es del 70 % a los 5 años, siendo inferior al 10 % en aquellos pacientes con inadecuado manejo de las cifras de PA10. Conflictos de interés Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo. REFERENCIAS BIBLIOGRÁFICAS 1. Wong TY, Mitchell P. Hypertensive retinopathy. N Engl J Med 2004;351:2310-7. 2. Nzerue C, Oluwole K, Adejorin D, Paueksakon P, Fremont R, Akatue R, et al. Malignant hypertension with thrombotic microangiopathy and persistent acute kidney injury (AKI). Clin Kidney J 2014;7:1-4. 3. Morales E, González R, Gutiérrez E, Gutiérrez-Solís E. Hipertensión arterial maligna. Una visión actualizada. NefroPlus 2011;4:34-43. 4. Morales E, Ortiz M, González E. ¿Está disminuyendo la incidencia de la hipertensión arterial maligna o está cambiando su presentación clínica? Hipertensión 2003;20:25-36. 5. Soler MJ, Parrilla J, Vázquez-Gonzalez S, Orfilia A, Lloveras J. Hipertensión arterial maligna en un adulto joven. Nefrología 2004;24:81-4. 84 NefroPlus 2016 Vol. 8 N.° 1 n n n 6. Varon J, Marik PE. The diagnosis and management of hypertensive crises. Chest 2000;118:214-27. 7. Montgomery HE, Kiernan LA, Whitworth CE. Inhibition of tissue angiotensin converting enzyme activity prevents malignan hypertension in TGR(mREN2)27. J Hypertens 1998;16:635-43. 8. González R, Morales E, Segura J, Ruilope LM, Praga M. Long-term renal survival in malignant hypertension. Nephrol Dial Transplant 2010;25:3266-72. 9. Botey Puig A, Poch López de Briñas E. Hipertensión maligna. Hipertensión 2000;17:198-207. 10. Lane DA, Lip GYH, Beevers DG. Improving survival of malignant hypertension patients over 40 years. Am J Hypertens 2009;22:1199204. ◗◗ CASOS CLÍNICOS ¿Son seguros los contrastes de gadolinio en pacientes con enfermedad renal crónica y hepatopatía asociada? Miguel Seras1, Elena Arnal2, María del Carmen González-Vela3, Manuel Arias1 1 Servicio de Nefrología. Hospital Universitario Marqués de Valdecilla. Santander 2 Servicio de Dermatología. Hospital Universitario Marqués de Valdecilla. Santander 3 Servicio de Anatomía Patológica. Hospital Universitario Marqués de Valdecilla. Santander NefroPlus 2016;8(1):85-88 RESUMEN La fibrosis nefrogénica sistémica (FNS) es un proceso esclerosante multiorgánico secundario a la administración de contrastes basados en gadolinio en pacientes con enfermedad renal crónica (ERC) avanzada. Aunque raros, y generalmente asociados a otros procesos, se han descrito casos aislados de FNS en pacientes con ERC en estadio 3 y 4 (MDRD > 30 ml/ min/1,73 m2). Presentamos el caso de un varón de 54 años con ERC en estadio 3 secundaria a nefropatía IgA y hepatopatía crónica Child-A6 MELD-15 de origen etílico, que desarrolló FNS tras una única exploración radiológica con gadolinio, sin que pudieran demostrarse otros agentes causales. Además de exponer el caso, realizamos una revisión bibliográfica haciendo especial hincapié en la relación existente entre nefropatía y hepatopatía a la hora de desarrollar FNS tras exposición a gadolinio. Palabras clave: Cirrosis. Dermopatía fibrosante nefrogénica. Enfermedad renal crónica. Fibrosis nefrogénica sistémica. Hepatopatía crónica. INTRODUCCIÓN La fibrosis nefrogénica sistémica (FNS) es una entidad clínica rara que se presenta en pacientes con enfermedad renal crónica (ERC) avanzada tras la administración de contrastes basados en gadolinio (Gd) en la resonancia magnética (RM)1. Los radicales libres (Gd3+) producidos por la transmetilación y la formación de depósitos tisulares parecen la causa principal para desarrollar FNS2-5, si bien no la única, ya que se han encontrado múltiples factores coadyuvantes, entre ellos la hepatopatía crónica6. Varios estudios confirman el riesgo de padecer esta enfermedad tras el uso de los contrastes con Gd en los pacientes con un filtrado glomerular (FG) < 30 ml/min/1,73 m2 7-9. Según el grado de ERC, las guías recomiendan evitar su utilización (FG < 15 ml/ min/1,73 m2) o bien valorar el riesgo/beneficio para el paciente (FG 15-29 ml/min/1,73 m2)10-12. No obstante, las guías no acla- Correspondencia: Miguel Seras Servicio de Nefrología. Hospital Universitario Marqués de Valdecilla. Avda. Valdecilla, s/n. 39008 Santander. mserasmozas@gmail.com ran la actitud que se ha de seguir en pacientes con FG > 30 ml/ min/1,73 m2, o bien no consideran contraindicada la administración de Gd por presentar un riesgo muy bajo de desarrollar FNS, ni se considera la asociación a hepatopatía. CASO CLÍNICO Varón de 56 años con antecedentes personales de hipertensión arterial (> 10 años de evolución), hiperuricemia (artritis gotosa), hernia discal L5-S1, ERC estadio 3a de etiología no filiada (diagnosticado en 2007, con una creatinina basal de 1,5 mg/dl y MDRD 51 ml/min/1,73 m2), hepatopatía crónica de probable origen etílico (Child A 6, MELD 15), ictericia obstructiva y pancreatitis necrotizante (diagnosticado en 2010). Acude a urgencias en marzo de 2013 por un cuadro clínico de 2 meses de evolución de edemas progresivos de los miembros superiores e inferiores, así como disminución franca de la diuresis. Además, muestra disnea progresiva hasta hacerse de mínimos esfuerzos. El paciente refiere ingesta crónica de colchicina e indometacina por episodios de podagra desde hace años. A la exploración física se apreciaba tendencia a la hipertensión arterial, anasarca y signos indirectos de hepatopatía cróNefroPlus 2016 Vol. 8 N.° 1 85 n n n ◗◗ CASOS CLÍNICOS nica. Analíticamente presentaba: glucosa 125 mg/dl, creatinina 2,9 mg/dl, urea 126 mg/dl, AST 79 UI/l, ALT 74 UI/l, GGT 73 UI/l, fosfatasa alcalina 134 UI/l, bilirrubina total 0,5 mg/dl, calcio 8,6 mg/dl, fósforo 5 mg/dl, sodio 140 mEq/l, potasio 5,4 mEq/l, magnesio 1,5 mg/dl, amilasa 20 g/dl, albúmina 3,8 g/dl, plaquetas 168.000 mm3, hemoglobina 11,9 g/dl, hematocrito 33,6 % y actividad de protrombina 99%. En el elemental y sedimento urinario presentaba: proteínas, hemoglobina y 10-15 hematíes/campo. La proteinuria cuantificada de 24 horas fue de 800 mg. Las serologías para virus hepáticos (hepatitis A, B y C) y virus de la inmunodeficiencia humana fueron negativas. Por otra parte, el estudio inmunológico resultó negativo para ANCA, anti-MBG, ANA y factor reumatoide, con cifras de inmunoglobulinas y complemento en rango normal. Tras el tratamiento diurético intravenoso y la disminución de los edemas se apreció esclerosis cutánea de los cuatro miembros, así como microstomía, sospechándose un cuadro esclerodermiforme. Reinterrogado el paciente, refería tirantez de manos y pies de aproximadamente un año de evolución. Tras revisar la historia clínica, se comprobó que el paciente había sido sometido a una sola RM con gadolinio en 2010 durante su ingreso en Gastroenterología, para el estudio del cuadro colestásico previamente descrito. Se revisó también la función renal que presentaba el paciente al realizarse la RM, encontrándose en su situación basal con valores de creatinina de 1,5 mg/dl, y filtrado glomerular estimado mediante MDRD 51 ml/min/1,73 m2. La ecografía abdominal evidenció datos de hepatopatía crónica, ligera esplenomegalia y riñones de tamaño normal con mala diferenciación corticomedular. El ecocardiograma transtorácico mostró disfunción sistólica grave con alteraciones segmentarias de la contractilidad e hipertrofia del ventrículo izquierdo. Ante la sospecha de un cuadro glomerular se realizó una biopsia renal, que obtuvo ocho glomérulos, de los que tres se encontraban totalmente esclerosados. Se apreciaba proliferación mesangial segmentaria y focal con depósito PAS y plata positivo. El intersticio presentaba fibrosis submasiva con atrofia tubular importante. La inmunofluorescencia resultó positiva para IgA y C3, siendo el diagnóstico anatomopatológico de nefropatía IgA clase IV de la OMS13-15. Por último, se realizaron dos biopsias cutáneas en las que se objetivó una fibrosis dérmica difusa que se extendía al panículo adiposo (figura 1). Se observaban fibroblastos entre los haces de colágeno. Dichos fibroblastos fueron positivos mediante inmunohistoquímica para el CD34. Los hallazgos histológicos fueron sugestivos de fibrosis nefrogénica4. Al alta el paciente fue seguido en consultas de Nefrología y Dermatología. Tras un año de evolución, la función renal se mantuvo estable, con MDRD 25-30 ml/min/1,73 m2. A nivel cutáneo, la esclerosis no progresó, quedando limitada a manos, pies y labios, sin precisar tratamiento específico. 86 NefroPlus 2016 Vol. 8 N.° 1 n n n Figura 1. Biopsia cutánea. Fibrosis dérmica difusa (R). Paniculitis septal crónica (r). DISCUSIÓN Descrita en 1997 por Cowper et al16, la FNS es una entidad rara que se manifiesta como un proceso esclerosante sistémico en pacientes con ERC avanzada que han recibido contraste basado en Gd durante la realización de una RM17,18. Si bien la administración de gadolinio y la presencia de ERC parecen factores indispensables para desarrollar la enfermedad, se especula con múltiples factores coadyuvantes, como la administración de EPO y/o hierro intravenoso, tipo y dosis de contraste administrado, procesos inflamatorios, cirugía vascular, hepatopatía crónica, trasplante hepático, etc.6,19,20. La incidencia de la FNS varía según las series, pero se estima aproximadamente en 4,3 casos por 1.000 pacientes-año21. Hasta 2009 se habían descrito 315 casos, la práctica totalidad relacionados con ERC, fracaso renal agudo (FRA) y/o síndrome hepatorrenal22-26. A pesar de su baja incidencia, se trata de un cuadro multiorgánico, con una alta morbimortalidad y escasa respuesta al tratamiento5. Con toda la evidencia científica acumulada y con el objetivo de prevenir esta enfermedad, organismos como la Food & Drug Administration12, el American College of Radiology11 o la Medicine and Healthcare products Regulatory Agency (MHRA)10 han ◗◗ CASOS CLÍNICOS centrado su atención en el desarrollo de guías para el uso de contrastes basados en Gd en pacientes con ERC. Por lo general, dichas guías desaconsejan su utilización en pacientes con FG < 15 ml/min/1,73 m2 y recomiendan cautela en FG 15-30 ml/ min/1,73 m2. Puesto que los casos descritos en pacientes con FG > 30 resultan anecdóticos6, la administración de Gd se admite como segura o no contraindicada en estos supuestos. Las referencias a la asociación de hepatopatía y ERC son muy escasas. La MHRA10, por ejemplo, contraindica el uso de Gd exclusivamente en el trasplante hepático. Las guías también hacen referencia al tipo de contraste empleado, ya que parece existir una relación entre la estructura química de la molécula quelante de Gd y el riesgo de desarrollar FNS27,28. Actualmente existen nueve preparados comerciales basados en Gd, de los cuales la gadodiamida (Omniscan®, GE Healthcare) parece ser la más tóxica y por ello la que se recomienda evitar en pacientes con ERC. Cabe destacar que la evidencia al respecto es muy limitada; en primer lugar, por el tipo de estudios epidemiológicos disponibles, y en segundo lugar porque la gadodiamida es, con diferencia, el preparado comercial más empleado hasta la actualidad. Puesto que estos hallazgos y recomendaciones están provocando un cambio de tendencia en la utilización de los diferentes contrastes basados en gadolinio, es de suponer que en los próximos años aparezca evidencia más consistente en este campo. Como ya hemos comentado, hasta la fecha pocos han sido los casos descritos en pacientes con ERC/FRA y hepatopatía asociada6. La mayoría presentaban enfermedad avanzada de ambos órganos y solo existe un caso descrito con enfermedad hepática avanzada (trasplante hepático complicado) y fracaso renal moderado (síndrome hepatorrenal con FG > 30 ml/min/1,73 m2), tras administración repetida de contraste con Gd29. Por otra parte, no parece existir asociación entre el riesgo de desarrollar FNS y la etiología de la enfermedad hepática o renal. MELD 15) y una sola administración de contraste. No pudo encontrarse ninguna otra causa que justificara la aparición de FNS como administración de EPO o hierro intravenoso, inmunosupresores, reagudizaciones de sus procesos hepático y/o renal, etc. Por otra parte, llama la atención la benignidad del cuadro, que hace pensar que pudieran existir formas cutáneas limitadas, de evolución indolente y/o subclínica. Si así fuera, justificaría el escaso número de casos reportados en los que se asocian nefropatía y hepatopatía. Con todo esto, entendemos que la FNS es un complejísimo proceso del que poco sabemos y en el que quedan muchas dudas por resolver. ¿Hasta qué punto la hepatopatía crónica desempeña algún papel en la FNS? ¿Cómo es la interacción de esta con los procesos renales, ya sean crónicos o agudos? ¿Qué otros factores pueden intervenir en el desarrollo de la FNS tales como fármacos, patologías intercurrentes, tipo y dosis de contraste administrado, etc.? Lo que parece en cualquier caso indiscutible es que los contrastes basados en gadolinio y la ERC avanzada son los factores principales, y que de alguna manera los procesos hepáticos constituyen una pieza más de esta desconocida enfermedad. CONCLUSIÓN Con todo lo expuesto, podría parecer lógico contraindicar el uso de contrastes basados en Gd en pacientes con ERC en estadios precoces y hepatopatía asociada, teniendo en cuenta la gravedad de la enfermedad. Sin embargo, tal decisión estaría basada exclusivamente en casos aislados e implicaría serios problemas diagnósticos y terapéuticos en estos pacientes, habitualmente ya complejos de por sí. Aunque no haya afirmaciones categóricas a este respecto en las principales guías, parece conveniente tener siempre en cuenta el equilibrio riesgo/beneficio a la hora de indicar una exploración radiológica con Gd en un paciente de estas características. Conflictos de interés El caso descrito en nuestro centro presentó FNS con ERC estadio 3 secundaria a nefropatía IgA (FG de 51 ml/min/1,73 m2), hepatopatía crónica de origen enólico sin cirrosis (Child A 6, Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo. REFERENCIAS BIBLIOGRÁFICAS 1. Agarwal R, Brunelli SM, Williams K, Mitchell MD, Feldman HI, Umscheid CA. Gadolinium-based contrast agents and nephrogenic systemic fibrosis: a systematic review and meta-analysis. Nephrol Dial Transplant 2009;24:856-63. 2. Thakral C, Alhariri J, Abraham JL. Long-term retention of gadolinium in tissues from nephrogenic systemic fibrosis patient after multiple gadolinium-enhanced MRI scans: case report and implications. Contrast Media Mol Imaging 2007;26:199205. 3. Gibson SE, Farver CF, Prayson RA. Multiorgan involvement in nephrogenic fibrosing dermopathy: An autopsy case and review of the literature. Arch Pathol Lab Med 2006;130:209-12. 4. High WA, Ayers RA, Chandler J, Zito G, Cowper SE. Gadolinium is detectable within the tissue of patients with nephrogenic systemic fibrosis. J Am Acad Dermatol 2007;56:21-6. 5. Swaminathan S, High WA, Ranville J, Horn TD, Hiatt K, Thomas M, et al. Cardiac and vascular metal deposition with high mortality in nephrogenic systemic fibrosis. Kidney Int 2008;73:1413-8. 6. Mazhar SM, Shiehmorteza M, Kohl CA, Middleton MS, Sirlin CB. Nephrogenic systemic fibrosis in liver disease: a systematic review. J Magn Reson Imaging 2009;30:1313-22. 7. Laissy JP, Idée JM, Fernandez P, Floquet M, Vrtovsnik F, Schouman-Claeys E. Magnetic resonance imaging in acute and chronic kidney diseases: present status. Nephron 2006;103:50-7. NefroPlus 2016 Vol. 8 N.° 1 87 n n n ◗◗ CASOS CLÍNICOS 8. Perazella MA, Rodby RA. Gadolinium use in patients with kidney disease: A cause for concern. Sem Dial 2007;20:1-4. 9. Othersen JB, Maize JC, Woolson RF, Budisavljevic MN. Nephrogenic systemic fibrosis after exposure to gadolinium in patients with renal failure. Nephrol Dial Transplant 2007;22:3179-85. 10. Medicines and Health products Regulatory Agency. Disponible en: http:// www.mhra.gov.uk/. 11. Kanal E, Barkovich AJ, Bell C, Borgstede JP, Bradley WG Jr, et al. ACR guidance document on MR safe practices: 2013. J Magn Reson Imaging 2013;37:501-30. 12. Food and Drug Administration Public Health Advisory. FDA Drug Safety Communication: New warnings for using gadolinium-based contrast agents in patients with kidney dysfunction. Disponible en: http://www.fda.gov/Drugs/DrugSafety/ucm223966.htm. 13. Lai KN. Pathogenesis of IgA nephropathy. Nat Rev Nephrol 2012;8:275-83. 14. Working Group of the International IgA Nephropathy Network and the Renal Pathology Society. The Oxford classification of IgA nephropathy: pathology definitions, correlations, and reproducibility. Kidney Int 2009;76:546-56. 15. Working Group of the International IgA Nephropathy Network and the Renal Pathology Society. The Oxford classification of IgA nephropathy: rationale, clinicopathological correlations, and classification. Kidney Int 2009;76:534-45. 16. Cowper SE, Robin HS, Steinberg SM, Su LD, Gupta S, LeBoit PE. Scleromyxedema-like cutaneous diseases in renal dialysis patients. Lancet 2000;356:1000-1. 17. Grobner T. Gadolinium: a specific trigger for the development of nephrogenic fibrosing dermopathy and nephrogenic systemic fibrosis? Nephrol Dial Transplant 2006;21:1104-8. 18. Kallen AJ, Jhung MA, Cheng S, Hess T, Turabelidze G, Abramova L, et al. Gadolinium-containing magnetic resonance imaging contrast and nephrogenic systemic fibrosis: A case-control study. Am J Kid Dis 2008;51:966-75. 88 NefroPlus 2016 Vol. 8 N.° 1 n n n 19. Swaminathan S, Ahmed I, McCarthy JT, Albright RC, Pittelkow MR, Caplice NM, et al. Nephrogenic fibrosing dermopathy and highdose erythropoietin therapy. Ann Intern Med 2006;145:234-5. 20. Swaminathan S, Shah SV. New insights into nephrogenic systemic fibrosis. J Am Soc Nephrol 2007;18:2636-43. 21. Centre of Disease Control and Prevention. Nephrogenic fibrosing dermopathy associated with exposure to GBC-containing contrast agents-St. Louis, Missouri: 2002-2006. MMWR 2007;56:1. 22. Cowper SE. Nephrogenic fibrosing dermopathy [ICNSFR Website]. 2001-2009. Disponible en: http://www.icnfdr.org. 23. Marckmann P. An epidemic outbreak of nephrogenic systemic fibrosis in a Danish hospital. Eur J Radiol 2008;66:187-90. 24. Shabana WM, Cohan RH, Ellis JH, Hussain HK, Francis IR, Su LD, et al. Nephrogenic systemic fibrosis: A report of 29 cases. AJR Am J Roentgenol 2008;190:736-41. 25. Broome DR, Girguis MS, Baron PW, Cottrell AC, Kjellin I, Kirk GA. et al. Gadodiamide-associated nephrogenic systemic fibrosis: Why radiologists should be concerned. AJR Am J Roentgenol 2007;188:586-92. 26. Thomsen HS, Marckmann P, Logager VB. Nephrogenic systemic fibrosis (NSF): A late adverse reaction to some of the gadolinium based contrast agents. Cancer Imaging 2007;7:130-7. 27. Ersoy H, Rybicki FJ. Biochemical safety profiles of a gadolinium-based extracellular contrast agents and nephrogenic systemic fibrosis. J Magn Reson Imaging 2007;26:1190-7. 28. Marckmann P, Skov L, Rossen K, Goya Heaf J, Thomsen HS. Case-control study of gadodiamide related nephrogenic systemic fibrosis. Nephrol Dial Transplant 2007;22:3174-8. 29. Sadowski EA, Bennett LK, Chan MR, Wentland AL, Garrett AL, Garrett RW, et al. Nephrogenic systemic fibrosis: risk factors and incidence estimation. Radiology 2007;243:148-57. ◗◗ CASOS CLÍNICOS Trastornos electrolíticos graves asociados a tratamiento crónico con omeprazol Amir Shabaka1, Fernando Tornero1, Samuel del Castillo-García2, Raúl Rodríguez2, Sara Romero-Pérez3, Beatriz Gil-Casares3, Raquel de Gracia-Núñez3, José A. Herrero1 1 Servicio de Nefrología. Hospital Clínico San Carlos. Madrid 2 Universidad Europea de Madrid. Hospital Universitario Quirón. Madrid 3 Servicio de Nefrología. Hospital Universitario del Sureste. Madrid NefroPlus 2016;8(1):89-93 RESUMEN Los inhibidores de la bomba de protones (IBP), especialmente el omeprazol, son fármacos que se utilizan profusamente y que no suelen ejercer efectos adversos graves en los pacientes. Presentamos el caso de un varón de 67 años que presentó en otro centro un episodio de dolor torácico en relación con hipopotasemia moderada diagnosticado como secundario a tratamiento con tiazida, que fue suspendido y recibió tratamiento con suplementos orales de potasio. Fue evaluado posteriormente en nuestro centro, evidenciando una persistencia de la hipopotasemia, además de hipocalcemia grave e hipomagnesemia también grave refractaria al tratamiento con magnesio intravenoso y oral. Ante la sospecha de que el tratamiento con omeprazol estuviera perpetuando la hipomagnesemia, se suspendió este y se pautó ranitidina, tras lo cual se normalizaron los niveles de magnesio, además de los niveles de potasio y calcio, lo que permitió suspender todos los suplementos orales. La asociación de tratamiento prolongado con IBP junto con diuréticos se puede asociar a alteraciones electrolíticas graves secundarias a la hipomagnesemia grave, por lo que parece aconsejable el control periódico de las cifras séricas de magnesio en estos pacientes, y sustituir los IBP por antagonistas del receptor H2 en casos de hipomagnesemia grave. Palabras clave: Hipocalcemia. Hipomagnesemia. Hipopotasemia. Inhibidores de la bomba de protones. Omeprazol. INTRODUCCIÓN Los inhibidores de la bomba de protones (IBP) son un grupo farmacológico que se utiliza muy habitualmente tanto en la prevención como en el tratamiento de diversas patologías gástricas (úlcera péptica, erradicación de Helicobacter pylori, enfermedad por reflujo gastroesofágico, etc.)1. En los últimos años, se ha producido un incremento exponencial en su consumo, especialmente del omeprazol2. El omeprazol es un fármaco seguro que no suele presentar efectos secundarios, y si estos aparecen, no suelen suponer un riesgo para la vida del paciente1. A continuación, describimos a un paciente con alteraciones iónicas graves secundarias al tratamiento crónico con omeprazol, Correspondencia: Amir Shabaka Servicio de Nefrología. Hospital Clínico San Carlos. C/ Profesor Martín Lagos, s/n. 28040 Madrid. amirshabaka@hotmail.com complicación excepcional de la que apenas existen casos en la bibliografía3. CASO CLÍNICO Varón de 67 años de edad que consulta por hipopotasemia e hipocalcemia. Como antecedentes personales presenta hipertensión arterial en tratamiento con enalapril, amlodipino, olmesartán e hidroclorotiazida 12,5 mg/día; diabetes mellitus tipo 2 en tratamiento con insulina glargina; dislipidemia en tratamiento con atorvastatina, un accidente cerebrovascular 9 años atrás y cardiopatía isquémica revascularizada, para lo cual recibe tratamiento de prevención secundaria con ácido acetilsalicílico 100 mg al día y omeprazol 20 mg cada 24 horas desde hace 9 años. Como episodio previo a la consulta actual, presentó un ingreso en otro centro por un cuadro de dolor torácico, descartándose etiología isquémica. En este ingreso se evidencia hipopotasemia (potasio 2,8 mEq/l) e hipocalcemia (calcio 7,5 mg/dl) con función renal normal (creatinina 0,92 mg/dl y filtrado glomerular calculado por la fórmula MDRD-4 > 60 ml/min) y glucemia NefroPlus 2016 Vol. 8 N.° 1 89 n n n ◗◗ CASOS CLÍNICOS de 75 mg/dl. Tras la administración de potasio intravenoso se eleva el potasio sérico a 3,1 mEq/l, siendo diagnosticado de hipopotasemia secundaria a tratamiento diurético, y es dado de alta con suspensión de la hidroclorotiazida, manteniendo tratamiento hipotensor con enalapril y olmesartán y asociando suplementos de potasio (cloruro potásico 3.600 mg/día). Acude a consulta de nuestro centro para control evolutivo, evidenciándose en la analítica: potasio 3,3 mEq/l, calcio 6,5 mg/dl y magnesio 0,3 mg/dl. Se administra sulfato de magnesio intravenoso (1,5 g al día durante 2 días) y suplementos orales de magnesio (lactato de magnesio 3.000 mg/día), potasio (cloruro potásico 1.800 mg/día) y calcio (1.000 mg/día de calcio elemento). Se reevalúa a los 2 días al paciente en consulta, donde refiere malestar general. Se solicita entonces una nueva analítica, en la que, a pesar del tratamiento con magnesio intravenoso y suplementos orales de calcio, magnesio y potasio, se evidencian los siguientes valores: magnesio 0,5 mg/dl, calcio 6 mg/dl y potasio 3,1 mEq/l. Se administra de nuevo sulfato de magnesio intravenoso (3 g) y se incrementa la dosis de magnesio oral (lactato de magnesio 4.000 mg/día), potasio oral (cloruro de potasio 3.000 mg/día) y calcio oral (1.500 mg de calcio elemento). En revisión a los 2 días, el paciente presenta aumento de las cifras de potasio (4,3 mEq/l) y calcio (7,9 mg/dl) con persistencia de la hipomagnesemia (1,4 mg/día), por lo que se administra de nuevo sulfato de magnesio intravenoso (1,5 g). Dos días después, a pesar de mantener los suplementos de magnesio, el paciente presenta un nuevo descenso del magnesio sérico (1,2 mg/dl). Ante la sospecha de que el tratamiento con omeprazol esté perpetuando la hipomagnesemia, se suspende este y se pauta ranitidina 300 mg al día. En revisiones posteriores el paciente presenta un aumento progresivo de las cifras de magnesio hasta su normalización, así como cifras normales de potasio y calcio, permitiendo la suspensión de los aportes de suplementos de calcio, magnesio y potasio. La tabla 1 muestra la evolución temporal de los parámetros analíticos y su relación con las modificaciones terapéuticas aplicadas al caso. DISCUSIÓN El magnesio es un catión divalente que se encuentra de forma mayoritaria en el compartimento intracelular y que resulta fundamental para la homeostasis, ya que actúa como cofactor de una amplia gama de enzimas, transportadores y ácidos nucleicos, necesarios para el correcto metabolismo celular. Solo el 1 % se encuentra formando parte del líquido extracelular, con una concentración plasmática total de magnesio alrededor de 1,8 mEq/l. De esta, más de la mitad está unida a proteínas plasmáticas, por lo que la concentración de magnesio iónico libre es de unos 0,8 mEq/l4,5. Cuando se alcanzan niveles inferiores a los anteriormente descritos, se habla de hipomagnesemia. Este trastorno iónico se Tabla 1. Evolución de las alteraciones iónicas con el tratamiento administrado previo Día Previa Día 1 Día 3 Día 5 Día 7 Día 9 Día 15 Día 21 Día 28 Mg – 0,3 0,5 1,4 1,2 2 1,9 1,8 1,9 Ca 7,5 6,5 6 7,9 8,7 8,7 8,5 8,8 8,9 K 2,8 3,3 3,1 4,3 4,4 4,4 4,7 4,6 4,7 Cr 0,92 0,9 0,8 1,1 1 1 1,1 0,9 0,9 Mg i.v. – – 3 3 1,5 – – – – Mg oral – – 3.000 4.000 4.000 4.000 2.000 500 – K oral – 3.600 1.800 3.000 1.800 1.800 600 – – Ca oral – – 1.000 1.500 1.000 500 500 – – Omeprazol 20 20 20 20 20 – – – – Ranitidina – – – – – 300 300 300 300 Tratamiento Mg: magnesio (mg/dl); Ca: calcio (mg/dl); K: potasio (mEq/l); Cr: creatinina (mg/dl). Tratamiento previo a la analítica: Mg i.v.: sulfato de magnesio intravenoso (dosis total en g); Mg oral: lactato de magnesio (mg/día); K oral: cloruro potásico (mg/día); Ca oral: mg/día de calcio elemento; omeprazol: mg/día; ranitidina: mg/día. 90 NefroPlus 2016 Vol. 8 N.° 1 n n n ◗◗ CASOS CLÍNICOS puede producir por diversas causas, tal y como se resume en la tabla 2. En condiciones normales, los niveles de magnesio se mantienen estables debido a un equilibrio entre la absorción intestinal y la excreción a nivel renal. La ingesta diaria normal se sitúa en torno a 360 mg, con una absorción media del 50 %. La absorción intestinal se produce fundamentalmente en el yeyuno proximal y el íleon. Además, diariamente son secretados 40 mg de magnesio a nivel del intestino delgado, de los cuales se absorben 20 mg en el colon y el recto6. A nivel intestinal, la absorción de magnesio se produce por dos mecanismos: a través de los canales de magnesio transient receptor potential melastatin 6 y 7 (TRPM-6 y TRPM-7) mediante transporte activo, y un segundo mecanismo pasivo a través de la ruta paracelular. A nivel renal, el 80 % del magnesio plasmático se filtra por el glomérulo, y un 95 % es reabsorbido por la nefrona (60-70 % en el asa de Henle, 15-25 % en el túbulo Tabla 2. Causas de hipomagnesemia Causas digestivas Inanición Síndrome de malabsorción Pérdidas digestivas: diarrea, vómitos, fístulas entéricas Causas renales Tubulopatías genéticas: síndrome de Gitelman, síndrome de Bartter, mutaciones de Na/K ATPasa Nefropatías adquiridas: enfermedad tubulointersticial, necrosis tubular aguda, trasplante renal Expansión del líquido extracelular Hiperaldosteronismo, síndrome de secreción inadecuada de hormona antidiurética, diabetes mellitus, hipercalcemia, depleción de fosfato, acidosis metabólica, etc. Desplazamiento rápido del líquido extracelular Redistribución intracelular: Recuperación de cetoacidosis diabética, síndrome de realimentación, etc. Formación acelerada de hueso: tratamiento del déficit de vitamina D, metástasis osteoblásticas, etc. Fármacos Diuréticos de asa, tiazidas, cisplatino, foscarnet, aminoglucósidos, inhibidores de la bomba de protones Miscelánea Etanol, embarazo, pancreatitis, quemaduras proximal y 5-10 % en el túbulo distal)7. Es el túbulo distal donde podemos encontrar el receptor TRPM-6, que participa en la reabsorción de magnesio que no ha sido captado en el asa de Henle. El metabolismo iónico del calcio y del potasio se encuentra muy ligado al del magnesio. De ahí que, en la mayoría de los casos, cuando existe hipocalcemia y/o hipopotasemia es necesaria la corrección primaria del magnesio para llegar a alcanzar la normalización en las cifras de los otros dos iones. En lo que respecta al metabolismo del calcio, la hipocalcemia es un signo clásico de hipomagnesemia y se debe a alteraciones en la secreción de hormona paratiroidea, resistencia a esta hormona y déficit de vitamina D. En el caso del potasio, la hipopotasemia aparece en torno al 40-60 % de los pacientes con déficit de magnesio, y se puede explicar por dos mecanismos; bien por trastornos que causen pérdidas de ambos (diarrea, uso de diuréticos, etc.), o bien por la interacción que se produce entre estos dos iones a nivel renal. Es en el túbulo conector y el túbulo colector donde el magnesio desempeña un papel importante en la regulación de la excreción de potasio. En condiciones normales, el magnesio intracelular inhibe la excreción luminal de potasio a través de los canales ROMK (renal outer medullary potassium channel), por lo que en caso de hipomagnesemia se producirá una pérdida de potasio suprafisiológica, que además es relativamente refractaria a la suplementación sin la previa corrección del magnesio8. En el caso que se presenta, solo la hipopotasemia estaría justificada por el uso crónico que hace el paciente de hidroclorotiazida. Sin embargo, la hipomagnesemia y la hipocalcemia no revirtieron a pesar de la administración de suplementos hasta que se procedió a la suspensión de omeprazol. Por tanto, todo sugiere que la causa basal de este trastorno hidroelectrolítico múltiple puede estar mediada por el uso crónico que realiza nuestro paciente de este IBP. El mecanismo por el cual se presume que los IBP causan depleción de magnesio y calcio parece estar relacionado con la inhibición de los canales TRPM-6 y TRPM-79, ya sea por cambios en el pH intestinal que alteren las funciones del canal, o porque los pacientes sensibles sean portadores heterocigotos de mutaciones de dichos receptores10. Resulta relevante destacar que hasta ahora, este efecto aparece únicamente en aquellos casos en los que el IBP se combina con un diurético. Pudiera ser porque en el caso de ingesta de IBP solo se afectara el mecanismo de absorción intestinal y se produjera una compensación renal con una mayor reabsorción y que la misma no pudiera realizarse en caso de la toma de diuréticos. No obstante, actualmente no existe una respuesta clara al mecanismo por el cual se produce este trastorno. Evaluaciones realizadas tanto por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)11 como por la Food NefroPlus 2016 Vol. 8 N.° 1 91 n n n ◗◗ CASOS CLÍNICOS and Drug Administration (FDA)12, han demostrado que la hipomagnesemia podría ser un defecto de clase de este grupo farmacológico y recomiendan la realización de mediciones periódicas del magnesio en el caso de pacientes que hagan uso simultáneo de IBP junto a otros fármacos que incrementen aún más la depleción de magnesio (por ejemplo, diuréticos). No se han descrito efectos similares con el tratamiento crónico con anti-H2. Desde que en 2006 Epstein13 publicase los dos primeros casos de hipoparatiroidismo hipomagnesémico asociado a la toma de omeprazol, apenas se han descrito nuevos casos en los que se indiquen alteraciones electrolíticas asociadas a la toma crónica de IBP. Las escasas descripciones existentes en la literatura médica de asociación de hipomagnesemia y tratamiento crónico con omeprazol coinciden con el caso clínico descrito por nosotros, en el sentido de que aparece una hipomagnesemia grave junto a hipopotasemia e hipocalcemia asociada al tratamiento crónico con omeprazol y diuréticos a dosis bajas7,14,15. Esta no se corrige a pesar de la suspensión del diurético y el aporte de dosis elevadas de suplementos de magnesio. Únicamente la suspensión del tratamiento con el IBP permite la corrección progresiva del trastorno del metabolismo del magnesio, permitiendo la progresiva disminución, hasta su suspensión, de los suplementos de magnesio. En nuestro paciente, la suspensión del tratamiento con omeprazol condujo a la mejoría pro- gresiva de la hipomagnesemia hasta suspender el aporte de magnesio. No observamos efecto de la ranitidina sobre el metabolismo del magnesio cuando esta sustituye al omeprazol como protector gástrico. CONCLUSIONES La asociación de tratamiento prolongado con IBP junto con diuréticos se relaciona con alteraciones electrolíticas graves como la hipomagnesemia. Aunque de escasa frecuencia, la gravedad del cuadro clínico hace que deba considerarse. Por lo tanto, creemos que la presentación de este caso en el que describimos un efecto adverso infrecuente de un grupo terapéutico ampliamente usado en nuestro país, puede ayudar en la práctica clínica a la resolución de casos de trastornos electrolíticos múltiples de etiología no aclarada y que pueden ser graves, e incluso mortales, si no se diagnostican y tratan adecuadamente. En pacientes con tratamiento crónico con IBP y diuréticos parece aconsejable el control periódico de las cifras séricas de magnesio. La ausencia de efecto de los fármacos anti-H2 sobre el magnesio podría sugerir que estos fueran de elección como agentes gastroprotectores en los pacientes con tratamiento diurético en vez del omeprazol. Conflictos de interés Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo. REFERENCIAS BIBLIOGRÁFICAS 1. Esplugues JV, Flórez J. Farmacología de la secreción ácida gástrica y de la ulceración mucosa digestiva. En: Flórez J (dir.). Farmacología humana. 5ª ed. Barcelona: Masson; 2008; p. 757-84. 2. Agencia Española de Medicamentos y Productos Sanitarios [sede web]. Madrid: Ministerio de Sanidad, Servicios Sociales e Igualdad; 2014 [consultado 21 de abril de 2014]. Informe de utilización de medicamentos. Utilización de medicamentos antiulcerosos en España durante el periodo 2000-2012. Disponible en: http://aemps. es/medicamentosUsoHumano/observatorio/docs/antiulcerosos.pdf 3. Callejas Díaz A, Montero Hernández E, Gil Navarro M, Tutor-Ureta P, Yebra Bango M, Vargas Núñez JA. Omeprazol e hipomagnesemia. Rev Clin Esp 2011;211:30-3. 4. Hall J. Regulación renal del potasio, el calcio, el fosfato y el magnesio; integración de los mecanismos renales para el control del volumen sanguíneo y del volumen del líquido extracelular. En: Guyton y Hall. Tratado de fisiología médica. 12ª ed. Barcelona: Elsevier; 2011; p. 345-78. 5. Bringhurst F, Demay MB, Krane SM, Kronenberg HM. Bone and mineral metabolism in health and disease. En: Longo DL, Fauci AS, Kasper DL, Hauser SL, Jameson J, Loscalzo J. Harrison’s Principles of Internal Medicine. 18ª ed. New York: McGraw-Hill; 2012; p. 6013-26. 6. Pérez E, Santos F, Coto E. Homeostasis del magnesio, etiopatogenia, clínica y tratamiento de la hipomagnesemia. Nefrología 2009;29:518-24. 92 NefroPlus 2016 Vol. 8 N.° 1 n n n 7. Martínez C, Bellido V, Riestra M. Hipomagnesemia severa refractaria a la suplementación oral asociada al tratamiento con omeprazol. Endocrinol Nutr 2012;59:463-5. 8. Whang R, Whang DD, Ryan MP. Refractory potassium repletion. A consequence of magnesium deficiency. Arch Intern Med 1992;152:40-5. 9. Perazella MA. Proton pump inhibitors and hypomagnesemia: a rare but serious complication. Kidney Int 2013;83:553-6. 10. Rodríguez P, Rebollo I, Lainez M, Roldán E, Hernández R, Creagh R. Hipomagnesemia grave e hipoparatiroidismo secundario a omeprazol. Endocrinol Nutr 2013;60:156-7. 11. Agencia Española de Medicamentos y Productos Sanitarios [sede web]. Madrid: Ministerio de Sanidad, Servicios Sociales e Igualdad; 2011 [consultado 28 de abril de 2014]. Nota informativa de la Agencia Española del Medicamento. Riesgo de hipomagnesemia asociado a los medicamentos inhibidores de la bomba de protones (IBPs). Disponible en: http://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/seguridad/2011/docs/NI-MUH_27-2011.pdf. 12. Food and Drug Administration [sede web]. Silver Spring: U.S. Food and Drug Administration; 2011 [consultado 29 de abril de 2014]. Safety information. Proton Pump Inhibitor drugs (PPIs): Drug Safety Communication - Low Magnesium Levels Can Be Associated with Long-Term Use. Disponible en: http://www.fda.gov/safety/ medwatch/safetyinformation/safetyalertsforhumanmedicalproducts/ucm245275.htm. ◗◗ CASOS CLÍNICOS 13. Epstein M, McGrath S, Law F. Proton-pump inhibitors and hypomagnesemic hypoparathyroidism. N Eng J Med 2006;355:1834-6. 14. Gato A, Cordoba JG, Mora I. Hipomagnesemia grave secundaria a tratamiento prolongado con Omeprazol. Med Clin (Barc) 2011;136:84-9. 15. Matsuyama J, Tsuji K, Doyama H, Kim F, Takeda Y, Kito Y, et al. Hypomagnesemia associated with a proton pump inhibitor. Intern Med 2012;51:2231-4. NefroPlus 2016 Vol. 8 N.° 1 93 n n n ◗◗ RECURSOS WEB DESTACADOS Renal Fellow Network http://renalfellow.blogspot.com.es/ Rafael Santamaría Unidad de Gestión Clínica de Nefrología. Hospital Universitario Reina Sofía. Córdoba NefroPlus 2016;8(1):94 Figura 1. Página principal de la web. Web escrita por y para residentes de Nefrología que utiliza un enfoque docente original, basado en la práctica diaria. blicados, fomentando los comentarios y el intercambio de ideas en relación con el tema propuesto. La web Renal Fellow Network fue creada en 2003 para proporcionar un foro de discusión de casos interesantes nefrológicos, publicaciones científicas y otros temas de interés para nefrólogos, especialmente residentes. El objetivo de la web es presentar los últimos avances científicos y temas clínicos, utilizando para ello un estilo conciso, en ocasiones divertido, al mismo tiempo que de gran calidad docente. El blog, que está avalado por la Sociedad Americana de Nefrología y la National Kidney Foundation, ha sido considerado como “Web favorita” por la Sociedad Internacional de Nefrología, y tiene un promedio aproximado de 45.000 páginas vistas y 22.000 visitas del sitio al mes. Aproximadamente el 45 % de los lectores son residentes, el 20 % nefrólogos, el 20 % estudiantes de medicina y el 5% están involucrados en investigación a tiempo completo. Los contenidos son elaborados por nefrólogos y residentes en Nefrología, y tras ser revisados por un comité editorial son pu- Correspondencia: Rafael Santamaría UGC de Nefrología. Hospital Universitario Reina Sofía. Avda. Menéndez Pidal, s/n. 14005 Córdoba. rsantamariao@gmail.com 94 NefroPlus 2016 Vol. 8 N.° 1 n n n Premios ÍÑIGO ÁLVAREZ DE TOLEDO 27 años fomentando la Investigación en Nefrología AÑO 1989 INVESTIGACIÓN CIENTÍFICA •Dr. D. Jorge Andreu AÑO 1990 EX-AEQUO INVESTIGACIÓN CLÍNICA •Dr. D. Jesús Egido •Dr. D. Jorge Cannata AÑO 1991 INVESTIGACIÓN CLÍNICA •Dr. D. Pedro Aljama AÑO 1992 EX-AEQUO INVESTIGACIÓN CLÍNICA •Dr. D. José Miguel López-Novoa •Dr. D. Jesús Egido AÑO 1993 INVESTIGACIÓN BÁSICA •Dra. Dª. Eva González INVESTIGACIÓN CLÍNICA •Dr. D. Diego Rodríguez-Puyol AÑO 1994 INVESTIGACIÓN BÁSICA •Dr. D. José Miguel López-Novoa INVESTIGACIÓN CLÍNICA •Dr. D. Fernando Liaño AÑO 1995 EX-AEQUO INVESTIGACIÓN BÁSICA •Dr. D. Alberto Ortiz EX-AEQUO INVESTIGACIÓN BÁSICA •Dr. D. Santiago Lamas INVESTIGACIÓN CLÍNICA •Dr. D. Jorge Cannata AÑO 1996 INVESTIGACIÓN BÁSICA •Dr. D. Jesús Egido INVESTIGACIÓN CLÍNICA •Dra. Dª. Fuensanta Moreno AÑO 1997 INVESTIGACIÓN BÁSICA •Dr. D. Juan Saus EX-AEQUO INVESTIGACIÓN CLÍNICA •Dr. D. Eliécer Coto •Dr. D. José Mª Campistol AÑO 1998 INVESTIGACIÓN BÁSICA •Dr. D. Vicente Álvarez INVESTIGACIÓN CLÍNICA •Dr. D. Armando Torres AÑO 1999 INVESTIGACIÓN BÁSICA •Dr. D. Alberto Ortiz INVESTIGACIÓN CLÍNICA •Dr. D. Pedro Aljama AÑO 2000 INVESTIGACIÓN BÁSICA •Dra. Dª. Anna Meseguer INVESTIGACIÓN CLÍNICA •Dr. D. Manuel Praga AÑO 2001 INVESTIGACIÓN BÁSICA •Dr. D. Santiago Lamas INVESTIGACIÓN CLÍNICA •Dra. Dª. Katia López Revuelta ENFERMERÍA NEFROLÓGICA •Desierto AÑO 2009 INVESTIGACIÓN BÁSICA •Dra. Dª. Ana Belén Sanz Bartolomé INVESTIGACIÓN CLÍNICA •Dra. Dª. Gloria del Peso ENFERMERÍA NEFROLÓGICA •D. Jesús Lucas Martín Espejo AÑO 2002 EX-AEQUO INVESTIGACIÓN BÁSICA •Dr. D. Matías Ávilas •Dr. D. Fernando Corrales EX-AEQUO INVESTIGACIÓN CLÍNICA •Dr. D. Juan Miguel Redondo •Dr. D. Rafael Selgas ENFERMERÍA NEFROLÓGICA •Dª. Rosa Alonso AÑO 2010 INVESTIGACIÓN BÁSICA •Dra. Dª. Silvia Prieto Sánchez INVESTIGACIÓN CLÍNICA •Dr. D. Enrique Gruss •Dra. Dª. Carmen Sánchez (Accésit) ENFERMERÍA NEFROLÓGICA •Dª. Carmen Grau AÑO 2003 INVESTIGACIÓN BÁSICA •Dr. D. Manuel López Cabrera INVESTIGACIÓN CLÍNICA •Dr. D. Juan Navarro ENFERMERÍA NEFROLÓGICA •Desierto AÑO 2004 INVESTIGACIÓN BÁSICA •Dra. Dª. Marta Saura Redondo INVESTIGACIÓN CLÍNICA •Dr. D. Xavier Fulladosa Oliveras ENFERMERÍA NEFROLÓGICA •Dª. Rosario García Palacios AÑO 2005 INVESTIGACIÓN BÁSICA •Dr. Miguel Ángel Alonso Lebrero INVESTIGACIÓN CLÍNICA •Dr. D. Xose Manuel Lens Neo •Dr. D. Juan M. López Gómez (Accesit) ENFERMERÍA NEFROLÓGICA •Dª. Antonia Alfaro Cuenca AÑO 2006 INVESTIGACIÓN BÁSICA •Dr. D. Pedro Esbrit Argüelles INVESTIGACIÓN CLÍNICA •Dr. D. Víctor Lorenzo Sellares ENFERMERÍA NEFROLÓGICA •Dª. M. Pilar Peña Amaro AÑO 2007 EX-AEQUO INVESTIGACIÓN BÁSICA •Dr. D. Fernando Rodríguez Pascual •Dra. Dª. Miren Edurne Berra Ramírez INVESTIGACIÓN CLÍNICA •Dr. D. Peré Ginés •Dª. Patricia Fernández-Llama AÑO 2008 INVESTIGACIÓN BÁSICA •Dr. D. Santiago Rodríguez de Córdoba INVESTIGACIÓN CLÍNICA •Dr. D. Manuel Praga ENFERMERÍA NEFROLÓGICA •Dª. Dolores Ándreu Périz AÑO 2011 INVESTIGACIÓN BÁSICA •Dr. D. Jose M. Valdivielso INVESTIGACIÓN CLÍNICA •Dr. D. José M. Morales •Dra. Dª. Marian Goicoechea (Accésit) ENFERMERÍA NEFROLÓGICA •Dª. Francisca Martínez AÑO 2012 INVESTIGACIÓN BÁSICA •Dr. D. Enrique Pérez Payá INVESTIGACIÓN CLÍNICA •Dra. Dª. Roser Torrá •Dr. D. Domingo Hernández (Accésit) ENFERMERÍA NEFROLÓGICA •Desierto AÑO 2013 INVESTIGACIÓN BÁSICA •Dr. D. Carmelo Bernabeu Quirante INVESTIGACIÓN CLÍNICA •Dr. D. Josep M. Cruzado Garrit ENFERMERÍA NEFROLÓGICA •Dª. Ana Isabel Aguilera Florez •Dª. Mª. Arantzazu Arrausi (Accésit) AÑO 2014 INVESTIGACIÓN BÁSICA •Dra. Dª. Marta Ruiz Ortega EX-AEQUO INVESTIGACIÓN CLÍNICA •Dr. D. Francisco Maduell y equipo •Dra. Dª. Gema Fernández Juárez y equipo ENFERMERÍA NEFROLÓGICA •Dª. Pilar Rodríguez Gayán y Dª. Marta Conde Martínez AÑO 2015 INVESTIGACIÓN BÁSICA •Dr. D. Sergio de Frutos. Universidad de Alcalá de Henares. INVESTIGACIÓN CLÍNICA •Dr. D. Juan Francisco Navarro González. Hospital Nuestra Señora de la Candelaria. Santa Cruz de Tenerife. INVESTIGACIÓN EN ENFERMERÍA •Dª. Isabel Crehuet. Hospital Rio Hortega de Valladolid. PROYECTO LUIS HERNANDO PARA INVESTIGADORES JÓVENES •D. Juan Antonio Moreno Gutierrez. Fundación Jiménez Díaz. Acción Social Atención Psico-Social paciente 1 2 Acción Social FRIAT 6 5 Formación y actividades 3 Promoción del empleo-CEE 4 Proyecto de alimentación en enfermos renales Sensibilizador social y prevención ER Cooperación Internacional La Fundación Renal Iñigo Álvarez de Toledo considera la Acción Social como una parte imprescindible de la atención integral al paciente renal y como un elemento diferenciador de su modelo de actuación. Esto implica conocer muy bien a nuestros pacientes y situar a la persona en el centro de atención de todos los profesionales de la Fundación, con un enfoque de trabajo multidisciplinar. El Grupo de Apoyo al Paciente, formado por psicólogos y trabajadores sociales, es un elemento clave de este enfoque, prestando una atención personalizada a los pacientes y a su entorno familiar. Se persigue: facilitar su adaptación al tratamiento; valorar las condiwww.friat.es www.facebook.com/friat.es ciones psicosociales en las que se encuentra a lo largo de las diferentes etapas de la en fermedad; prestar asistencia especializada y favorecer su participación en actividades formativas y sociales. Despertar una actitud positiva es crucial para afrontar la enfermedad, superar sus limitaciones y disfrutar de una mejor calidad de vida. El objetivo de la inserción laboral de pacientes renales se lleva a cabo desde nuestro Centro Especial de Empleo, con actividad de lavandería industrial desde 1997, y a través de un servicio de asesoramiento laboral.