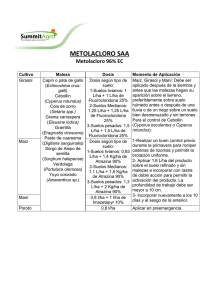
Imprima este artículo - Documento sin título
Anuncio

Rev. Int. Contam. Ambie. 29 (Número especial sobre plaguicidas) 65-84 Septiembre 2013 ATRAZINA: UN HERBICIDA POLÉMICO Anne M. HANSEN1*, Luis Gerardo TREVIÑO-QUINTANILLA2, Henri MÁRQUEZ-PACHECO1, Mariana VILLADA-CANELA3, Luis Carlos GONZÁLEZ-MÁRQUEZ4, Rosa Angélica GUILLÉN-GARCÉS2 y Arturo HERNÁNDEZ-ANTONIO5 1Instituto Mexicano de Tecnología del Agua, Paseo Cuauhnáhuac 8532, C.P. 62550, Jiutepec, Morelos, México 2Universidad Politécnica del Estado de Morelos, Boulevard Cuauhnáhuac 566, C.P. 62550, Jiutepec, Morelos, México 3Instituto de Investigaciones Oceanológicas, Universidad Autónoma de Baja California, Carretera Transpeninsular Ensenada-Tijuana No. 3917, Fraccionamiento Playitas, C.P. 22860, Ensenada, Baja California, México 4Universidad de Occidente, Av. Universidad s/n, C.P. 81048, Guasave, Sinaloa, México 5Centro del Agua para América Latina y el Caribe, Instituto Tecnológico y de Estudios Superiores de Monterrey, Ave. Eugenio Garza Sada No 2501, C.P. 64849 Monterrey, Nuevo León, México *Autora responsable: ahansen@tlaloc.imta.mx (Recibido julio 2013, aceptado agosto 2013) Palabras clave: marco legal, transporte y destino ambiental, degradación química, biodegradación, fotólisis, adsorción, atenuación natural RESUMEN La atrazina es un herbicida que se aplica en cultivos y en áreas donde se requiere controlar a la maleza. Es uno de los herbicidas más empleados a nivel mundial, presenta variable velocidad de degradación biológica y ha sido detectado en cuerpos de agua superficial y subterránea. Debido a que este herbicida se asocia con una relativamente elevada toxicidad crónica y potencial de acumularse como sustancia recalcitrante en agua superficial y subterránea, está restringido su uso en los Estados Unidos de América y ha sido prohibido en varios países de la Comunidad Europea. En México, el uso de atrazina no está regulado y es de amplia aplicación en zonas de cultivo. Dado que en cuerpos de agua superficial y subterránea se han encontrado concentraciones del herbicida que rebasan los límites para agua de consumo humano, aquí se revisa la literatura que describe los mecanismos de atenuación natural de la atrazina y los resultados obtenidos para zonas agrícolas para, de esta manera, discutir sobre la necesidad de implementar medidas sobre la regulación de su uso. En México la normatividad contempla límites para algunos plaguicidas en agua, pero no para la atrazina. No obstante, la aplicación de este herbicida en zonas agrícolas implica riesgos de contaminación debido a la posibilidad de que el herbicida y sus productos de degradación, o metabolitos, se transporten a los cuerpos de agua. Para indagar sobre la necesidad de regular el uso de la atrazina en México, en este trabajo se presentan los resultados de investigación sobre la atenuación natural de la atrazina y de muestreo en zonas agrícolas, obtenidos a través de una línea de investigación desarrollada en el Instituto Mexicano en Tecnología del Agua (IMTA) con el apoyo de estudiantes de los posgrados de Ingeniería y de Ciencias de la Tierra de la Universidad Nacional Autonoma de México (UNAM). Se revisaron las evidencias científicas para proporcionar información sobre el marco legal para el uso de la atrazina, el transporte y la atenuación natural del herbicida, los riesgos de contaminar el agua; se discute la necesidad de elaborar o modificar normas y regulaciones para restringir el uso de la atrazina y para regular sus concentraciones en el agua y de qué manera se 66 A.M. Hansen et al. pueden modificar las prácticas agrícolas actuales para proteger a los cuerpos de agua superficial y subterránea. Key words:legal framework, environmental fate and transport, chemical degradation, biodegradation, photolysis, adsorption, natural attenuation ABSTRACT The herbicide atrazine is being used for weed control in crops and also in nonagricultural areas. It is one of the most commonly used herbicides worldwide, presents variable biodegradation rates and has been detected in both surface water and groundwater systems. Because this herbicide is associated with relatively high chronic toxicity, accumulation potential and persistence in surface water and groundwater, the use of this herbicide has been restricted in the United States and prohibited in several countries of the European Community. In Mexico, the use of atrazine is not regulated and it is being widely used in agricultural areas. Since this herbicide has been detected in both surface water and groundwater and in concentrations higher than the recommended limits for drinking water, we have reviewed the mechanisms of natural attenuation of this herbicide, especially in agricultural areas, to decide upon the need for implementing regulation measures. Mexican water quality regulations provide limits for some pesticides but these do not include limits for atrazine. However, the use of atrazine in agricultural areas may represent a risk to contaminate water by transport of the herbicide or its degradation products to water bodies. To inquire about the need to regulate the use of atrazine in Mexico, this paper presents the results of natural attenuation of atrazine in Mexican agricultural areas, obtained through a research program carried out at the Mexican Institute of Water Technology (IMTA), with the support of graduate students from the Engineering and Earth Sciences Graduate Programs of the Mexican National Autonomous University (UNAM). In this paper we review the literature to provide information on the legal framework for uses of atrazine, the transport and natural attenuation mechanisms of the herbicide, the risks of contaminating water, and we discuss the necessity to restrict the use of this herbicide or to regulate concentrations in water and how farming practices should be modified to protect surface water and groundwater. INTRODUCCIÓN La atrazina es un herbicida selectivo que se aplica al suelo, que se absorbe por las raíces o las hojas de las hierbas y se aplica antes o después de que germine la maleza. Controla la aparición de malezas en cultivos, principalmente de maíz, sorgo, caña de azúcar, trigo y varios tipos de pastos, el crecimiento de malezas acuáticas en lagos y estanques, en campos de golf, en céspedes y a lo largo de carreteras o vías férreas. En el ámbito mundial, el herbicida se introdujo en 1958, pero su utilización se ha incrementado constantemente desde hace 50 años (Golla et al. 2011). El uso de la atrazina empezó en México en 1975 (SAGARPA 2007) y son diversas las empresas productoras del herbicida en el país. Gesaprim es el nombre comercial más conocido, pero existen otros productos con el mismo ingrediente activo (CICOPLAFEST 2005). De acuerdo con la Asociación Mexicana de la Industria de Plaguicidas y Fertilizantes (AMIPFAC), en 1995, el empleo de herbicidas que contienen atrazina como ingrediente activo, fue de 2012 t o 12.8 % del total de herbicidas usados en México. La importación de productos que contienen atrazina como ingrediente activo (fracción arancelaria 2933.69.09) ha aumentado de 189.35 t en 2003 a 287.8 t en 2012, provenientes de Estados Unidos de América, China, India, Israel e Italia (SIAVI 2012). Con el fin de conocer cómo se utiliza la atrazina en México, Villada-Canela (2006) realizó una encuesta en los distritos de riego (DR) del país. Aplicó aproximadamente cien cuestionarios a gerencias y módulos de los DR administrados por la Comisión 67 ATRAZINA: UN HERBICIDA POLÉMICO Nacional del Agua (CONAGUA); a Distritos de Desarrollo Rural (DDR) administrados por la Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación (SAGARPA) y a organizaciones agrícolas y de usuarios de los DR, y recibió respuesta de 60 % de ellos. Encontró que se aplicaba este herbicida en 59 % de los DR y en dosis que variaban de 0.1 a 4 kg/ha/año. Asimismo, en los DR de Chihuahua, Nuevo León, Guerrero y algunos de Sinaloa y Tamaulipas no se utilizaba este herbicida. Considerando las dosis aplicadas de atrazina en los DR y las áreas sembradas de maíz, caña de azúcar y sorgo principalmente, Villada-Canela (2006) calculó que en 2005 se aplicaban aproximadamente 1078 t/año en los DR de todo el país. La atrazina pertenece al grupo de los herbicidas triazínicos organoclorados (Fig. 1). Su nombre químico es 6-cloro-N-etil-N’-(1-metiletil)-1,3,5triazina- 2,4-diamina, y el número CAS, 1912-24-9. Cl N N H N N N H Fig. 1. Molécula de atrazina (C8H14ClN5) Entre las propiedades que determinan la movilidad de la atrazina y de sus metabolitos en el ambiente están su baja afinidad a los componentes del suelo y su elevada persistencia (Cuadro I). Asimismo, los valores de presión de vapor y la constante de la Ley de Henry reflejan su baja volatilidad. La adsorción y la mineralización son los principales procesos que influyen en la atenuación natural y el comportamiento de la atrazina en suelos (Ma y Selim 1996), siendo afectados estos procesos prin- cipalmente por el contenido de arcillas y de materia orgánica (Ben-Hur et al. 2003, Ling et al. 2005), así como por el pH (Houot et al. 2000, Tyess et al. 2006). Otros estudios han demostrado que la aplicación de fertilizantes nitrogenados inhiben la mineralización de la atrazina en suelos (Guillén-Garcés et al. 2007), mientras que González-Márquez y Hansen (2009) evaluaron el efecto de la salinidad del suelo sobre la adsorción de atrazina. La relativamente alta solubilidad en el agua y baja absorción en el suelo, así como la elevada persistencia (Graymore et al. 2001, Nödler et al. 2013) es la causa frecuente de encontrar atrazina en cuerpos de agua (Cuadro II). La exposición a la atrazina puede darse en el ambiente laboral, ya sea por vía inhalatoria o dérmica. Puede producir reacciones de irritación así como alteraciones en las funciones de algunos órganos, problemas de reproducción y alteración en los niveles de hormonas; defectos de nacimiento en seres humanos (ATSDR 2003). La atrazina se considera ligeramente tóxica para la vida acuática (Graymore et al. 2001) y es un inductor de hermafroditismo en ranas, en concentraciones tan bajas como 0.1 μg/L (Hayes et al. 2002). Asimismo, la Agencia para la Protección Ambiental de los Estados Unidos (USEPA) determinó que existe evidencia de carcinogenicidad del herbicida en animales, más no en seres humanos (USEPA 2003). Marco legal de uso de la atrazina La presencia de plaguicidas en el ambiente ha llevado a tomar acciones para reducir los efectos negativos de estas sustancias. Con respecto a esto, México ha firmado varios instrumentos internacionales que han contribuido a que se elimine el uso de algunos de los plaguicidas de mayor preocupación por su toxicidad, persistencia, potencial de bioacumulación y movilidad. Entre estos convenios destacan el Código Internacional de Conducta de la Organi- CUADRO I. PROPIEDADES DE LA ATRAZINA Parámetro Peso molecular (fw) Puntos de fusión (mp) Presión de vapor (vp) Solubilidad (SW) Vida media (por biodegradación) Constante de la Ley de Henry (KH) Logaritmo negativo de la Constante de disociación (pKa) Logaritmo del coeficiente de partición en carbono orgánico (log Koc) Logaritmo del coeficiente de partición Octanol/Agua (log Kow) Característica 215.68 g/mol 173-177ºC 3.8 × 10–5 Pa 35 mg/L en agua a 25ºC 10 días5 a 5824 días 3.04 × 10–9 atm m3/mol 1.62 a 20ºC, 1.70 a 21ºC 2.0 L/kg 2.7 Referencia Rojas et al. (2013) Kovaios et al. (2011) Rojas et al. (2013) Rojas et al. (2013) Abdelhafid et al. (2000) Montgomery (1997) Bailey et al. (1968) Rojas et al. (2013) Rojas et al. (2013) 68 A.M. Hansen et al. CUADRO II.VALORES REPORTADOS DE CONCENTRACIONES DE ATRAZINA Y DE SUS PRODUCTOS DE DEGRADACIÓN EN CUERPOS DE AGUA Cuerpo de agua Lugar Concentración Referencia (µg/L) Subterráneo Subterráneo Subterráneo Subterráneo Subterráneo Subterráneo Subterráneo Subterráneo Subterráneo Superficial Superficial Estados Unidos de América Big Springs, EUA Cuenca del río Baiyangdian, China Provincia de Vojvodina, Serbia Franja de Gaza, Oriente Próximo Kentuky, EUA Provincia de Jilin, China Estambul y Dardanelos, Turquía Zona Agrícola de Referencia, México Zona Agrícola de Referencia, México Laguna costera, Norte Adriático, Italia 0.1 – 88 2.5 – 10 0.4 – 3.29 0.198 3.5 0.14 – 0.46 0.107 0.031 – 0.041 6.23 – 21.26 4.62 – 15.01 2.4 – 8.2 Readman et al. (1993), Chapman y Stranger (1992) Ritter et al. (1996) Ye et al. (2001) Pucarević et al. (2002) Shomar et al. (2006) Golla et al. (2011) Geng et al. (2013) Nödler et al. (2013) Hernández-Antonio y Hansen (2011) Hernández-Antonio y Hansen (2011) Carafa et al. (2007) CUADRO III. RESTRICCIONES DEL USO DE ATRAZINA EN DIFERENTES PAÍSES Región País Restricción Referencia Norteamérica Estados Unidos de América Canadá México Restringido Permitido Permitido USEPA (2003) PMRA (2004) CICOPLAFEST (2005) Europa Italia, Alemania, Suecia, Austria, Prohibido Francia, Finlandia, Dinamarca Bélgica, Irlanda, Luxemburgo, Permitido Reino Unido OJEU (2004) Asia Bangladesh, Camboya, China, Indonesia, Malasia, Myanmar, Pakistán, Sri Lanka, Tailandia, Vietnam Permitido FAO (2005) Oceanía Australia Restringido NRA (2002) Permitido UNEP (2002) Permitido UNEP (2002) América Latina y Colombia, Cuba, El Salvador, El Caribe Honduras, Panamá, Puerto Rico, República Dominicana, Venezuela Antigua y Barbuda, Bahamas, Barbados, Bermuda, Belice, Costa Rica, Dominica, Granada, Guatemala, Guyana, Haití, Jamaica, Nicaragua, Saint Kitts y Nevis, Saint Lucia, San Vicente y las Granadinas, Surinam, Trinidad y Tobago zación de las Naciones Unidas para la Agricultura y la Alimentación, los planes de acción regional para el Manejo Adecuado de Sustancias Químicas de la Comisión para la Cooperación Ambiental de América del Norte (CCA 2012) y el Convenio de Estocolmo (UNEP 2001). En diversos países se han establecido restricciones del empleo de la atrazina (Cuadro III). Se observa que el uso del herbicida es restringido y prohibido en países de Europa, EUA y Australia, mientras que en México y en la mayoría de los países OJEU (2004) de América Latina y El Caribe, su aplicación está permitida sin restricción alguna. En este sentido, para proteger la calidad de agua para consumo humano, en 1993 el gobierno de EUA restringió la utilización de atrazina para control de la vegetación en zonas no agrícolas. En 1994, inició una revisión especial de los herbicidas triazínicos basada en el riesgo potencial cancerígeno debido a la exposición y consumo de alimentos y agua contaminados. En 2003, la USEPA concluye que se puede continuar ATRAZINA: UN HERBICIDA POLÉMICO utilizando atrazina, siguiendo precauciones y medidas específicas establecidas para reducir los riesgos de contaminación del agua para consumo humano. A la fecha se continúan evaluando los efectos de la atrazina en la salud humana (USEPA 2013). En Italia y Alemania se prohibió el uso de atrazina debido a que se encontraron residuos de este herbicida en cuerpos de agua, que exceden las concentraciones establecidas en la normatividad vigente de ambos países (Giupponi 2001, Tappe et al. 2002). La Unión Europea (UE) redactó la “Decisión de la Comisión del 10 de marzo de 2004” por el que se insta a todos los estados miembros a que en un corto plazo fueran retiradas las licencias de fabricación de productos fitosanitarios que contenían atrazina. Nödler et al. (2013) señalan que a pesar de esta restricción, se siguen encontrando concentraciones de atrazina en ambientes acuáticos, aunque menores al límite establecido para agua potable (European Parliament 1998). La Directiva Marco del Agua incluyó a la atrazina como una de las 33 sustancias prioritarias a monitorear en aguas europeas (European Parliament 2000). Como consecuencia de la detección de plaguicidas en agua superficial y subterránea, la Organización Mundial de Salud (WHO 2008), la Agencia para la Protección Ambiental de Estados Unidos (USEPA 2008), los países que integran la Unión Europea (OJEU 2004) así como otras naciones, han establecido límites para estos compuestos en agua para consumo humano (Cuadro IV). Estos incluyen límites para la atrazina. En los EUA se ha establecido el límite de atrazina en agua para consumo humano en 3 μg/L (USEPA 2003), mientras que la Comunidad Europea fijó el límite de 0.1 μg/L para el mismo uso del agua (European Parliament 1998) y la Organización Mundial de la Salud establece límites de 2 μg/L para atrazina y de 100 μg/L para atrazina+metabolitos (WHO 2011). En México la NOM-127-SSA-1994 (DOF 2000) define los límites de calidad y los tratamientos a que debe someterse el agua para su potabilización y entre sus parámetros considera algunos plaguicidas; por otra parte existe un proyecto de norma “Agua para uso y consumo humano: Límites máximos permisibles de la calidad del agua, control y vigilancia de los sistemas de abastecimiento” (ANEAS 2007), que estima un mayor número de plaguicidas entre ellos la atrazina que no está en la norma actual. En el cuadro IV se comparan las sustancias y los límites establecidos en la NOM-127-SSA-1994 (DOF 2000) para agua de consumo humano con los límites europeos, de los EUA, Canadá y la Organización Mundial de la Salud (OMS). 69 Se observa que las normas internacionales incluyen un mayor número de plaguicidas en comparación con la norma mexicana. Algunos países han desarrollado límites para plaguicidas en agua subterránea (Cuadro V) e incluyen a la atrazina con concentraciones entre 0.029 y 0.3 μg/L. Las concentraciones variables en las regulaciones sugieren que no existe un acuerdo ampliamente reconocido sobre los efectos adversos que causa éste y otros herbicidas y en qué concentraciones. Existen también límites para plaguicidas en suelos (Cuadro VI) y para sedimentos (Cuadro VII). Estas guías establecen límites para la atrazina y para otros plaguicidas persistentes. En México no existen guías que establecen tales límites. Readman et al. (1993) indican que la prohibición total del uso de atrazina en Italia redujo sus concentraciones en los principales ríos de este país. Años después, Nödler et al. (2013) discuten que a pesar de extender ese control en 2004 para toda la Comunidad Europea, se siguen encontrando concentraciones del herbicida y sus metabolitos en algunas de sus cuencas y costas. No obstante, dado que esos niveles se han reducido, hay evidencias del funcionamiento de las políticas de prohibición. Este escenario internacional muestra que, aún con las restricciones impuestas hace una década o más para países como Alemania e Italia, aún es factible encontrar concentraciones de atrazina en agua superficial y subterránea. Lakshminarayan et al. (1996) estimaron que los costos de la prohibición de atrazina en EUA ascienden a 240 millones de dólares, sin incluir los costos de monitoreo y de cumplimiento de las regulaciones. Prohibir a todos los herbicidas triazínicos podría mejorar la calidad del agua, pero las pérdidas en su producción costarían cerca de 740 millones de dólares. Por ello, se ha decidido restringir el uso de atrazina a aplicaciones post-emergentes, lo que tendría un efecto similar a la prohibición (Lakshminarayan et al. 1996). Para estos autores, ésta es una opción más efectiva que permite mantener las concentraciones de atrazina abajo del límite máximo permisible de 3 µg/L (USEPA 2003). Al revisar los impactos de la atrazina en los ecosistemas acuáticos, Graymore et al. (2001) concluyeron que un solo límite máximo universal para la aplicación del herbicida en cuencas hidrológicas, como sugieren varias autoridades reguladoras en Europa o en Estados Unidos, no provee una protección adecuada del ambiente acuático. En lugar de eso, argumentan que se pueden desarrollar límites más 70 A.M. Hansen et al. CUADRO IV. LÍMITES PERMISIBLES DE PLAGUICIDAS EN AGUA PARA CONSUMO HUMANO Plaguicida Alacloro Aldicarb Aldrín Atrazina Azinfos-metílico BHC (Lindano) Bendiocarb Bentazone Bromoxinil Carbaril Carbofuran Cianazina Clordano Clordecona Clorobenzeno Clorotolurón Clorpirifos Dalapón DDT y metabolitos Diazinón Dibromocloropropano Dicamba 2,4 D 2,4 DB Diclofop-metil Diclorprop Dieldrín Dimetoato Dinoseb Diquat Diurón Endosulfán Endotal Endrín Epóxido de heptacloro Fenoprop Glifosato Heptacloro Hexaclorobenceno Isoproturón Malatión MCPA Mecoprop Metolacloro Metoxicloro Metribuzin Mirex Molinato Oxamil Paraquat Paratión Pendimetalina Pentaclorofenol Forate Picloram Límites en agua para consumo humano (μg/L) CE1 EUA2 Canadá3 0.030 0.10 0.10 0.10 0.10 0.10 0.030 0.10 0.10 0.030 0.030 0.10 0.10 - 2 3 0.2 4 2 100 200 0.2 70 7 20 100 2 0.2 700 0.4 1 40 200 1 500 9 0.7 5 20 40 5 90 90 10 9 20 120 100 9 0.7 20 10 70 150 280 190 50 900 80 10 50 60 2 190 OMS4 20 10 0.03 2 2 300 7 0.6 0.2 30 30 1 1 30 90 100 0.03 6 0.6 9 9 2 10 10 20 6 20 9 - NOM-127-SSA-19945 Proyecto NOM México6 0.03 2.00 0.20 1.00 30.00 0.03 0.03 0.03 1.00 20.00 - 20 0.03 2.00 2.0 0.60 0.20 30 30 1.00 30 90 100 0.03 6.00 0.60 9.00 0.2 1.0 1.0 2.0 0.6 2.0 9.00 - 71 ATRAZINA: UN HERBICIDA POLÉMICO CUADRO IV. LÍMITES PERMISIBLES DE PLAGUICIDAS EN AGUA PARA CONSUMO HUMANO Plaguicida Límites en agua para consumo humano (μg/L) CE1 Piriproxifen Simazina 2,4,5 T 2,4,5 TP (Silvex) Terbufos Terbutilizina Toxafeno 0.10 Número de plaguicidas 14 considerados 1OJEC EUA2 4 50 3 24 Canadá3 10 1 31 OMS4 300 2 9 31 NOM-127-SSA-19945 Proyecto NOM México6 10 - 300 2.00 0.9 0.9 0.7 28 (1998) 2USEPA (2008) 3Health Canada (2012) (2008) 5DOF (2000) 6(ANEAS 2007) - = sin límite 4WHO CUADRO V.LÍMITES PERMISIBLES DE PLAGUICIDAS EN AGUA SUBTERRÁNEA CUADRO VI.LÍMITES DE PLAGUICIDAS PARA REMEDIACIÓN DE SUELOS Límite (mg/kg) Límite (mg/L) Plaguicida Alacloro Aldrín Aldrín + Dieldrín Atrazina Azinfosmetílico Carbaril Carbofuran Clordano Dieldrín DDT/DDE/DDD (total) α-HCH β-HCH γ-HCH (lindano, γ-BHC) Total HCH Endosulfán (alfa, beta, sulfato) Endrín Heptacloro Epóxido de heptacloro Maneb MCPA 1Cornelis Bélgica1 Italia2 Países Bajos3 0.03 0.2 2 0.06 0.2 2 - 0.1 0.03 0.3 0.1 0.03 0.1 0.1 0.1 0.1 - 0.000009 0.029 0.0001 0.002 0.009 0.00002 0.0001 0.000004 0.033 0.008 0.009 0.05 1.8 - 0.1 - 0.0002 0.00004 0.000005 0.000005 0.00005 0.02 y Van Gestel (2007) 2Musumeci (2007) 3MHSPE (2000) Italia2 Plaguicida Países Bajos1 Alacloro Aldrín Atrazina Carbaril Carbofuran Clordano DDT/DDE/DDD Dieldrín Endrín Endofurán α-HCH β-HCH γ-HCH (lindano, γ-BHC) Heptacloro Heptacloro epóxido Hidrochinon Maneb 0.06 0.2 0.03 0.02 0.03 10 0.5 0.04 0.01 3.0 9.0 0.05 1MHSPE (2000) (2007) 2Musumeci 0.7 0.0007 50 2.0 Residencial/Uso Industrial/ público Uso comercial 10 10 10 10 10 10 10 10 10 10 1000 100 1000 100 100 100 2000 100 500 500 - - 72 A.M. Hansen et al. CUADRO VII. LÍMITES PERMISIBLES DE PLAGUICIDAS EN SEDIMENTOS Plaguicida Aldrín Atrazina Carbaril Carbofuran Clordano DDD DDE DDT DDT/DDE/DDD (total) Dieldrín Endosulfán Endosulfán alfa Endosulfán beta Endrín a-HCH b-HCH g-HCH (lindano, g-BHC) Heptacloro Heptacloro epóxido Mirex Toxáfeno Límite (mg/kg) EUA1 Canadá2 Países Bajos3 40 4.5 3.54 1.42 - 4.5/2.26 3.54/1.22 1.42/2.07 1.19/1.19 0.06 0.2 0.03 0.02 0.03 - 6.98 2.85 2.67 0.94 2.85/0.71 2.67/2.67 0.94/0.32 10 0.5 0.01 0.01 0.01 0.04 3.0 9.0 0.05 10 0.6 800 - 0.6/0.6 0.1/0.1 0.7 0.0002 - 1Buchman (1999) (2002) 3MHSPE (2000) 2CCME flexibles para la aplicación de atrazina de acuerdo con los riesgos potenciales de contaminación del agua superficial y subterránea y en función de la fragilidad de los ecosistemas acuáticos particulares. Mecanismos de atenuación natural de la atrazina Los procesos de adsorción y degradación de la atrazina, son los principales mecanismos de atenuación natural que controlan la migración de este herbicida en agua y suelo. La adsorción de atrazina depende de la textura y la composición del suelo, el pH y la cantidad aplicada del herbicida (Hang y Roberto 2002). Gonzáles-Márquez y Hansen (2009) evaluaron el efecto de los parámetros del suelo en la atenuación natural de atrazina, encontrando que cuando es mayor el contenido de materia orgánica, más elevada es la adsorción de atrazina. La atrazina adsorbida está menos disponible para participar en otros procesos disipativos como son la biodegradación y el transporte hacia cuerpos de agua subterránea y superficial. Wang y Keller (2009) estudiaron la adsorción de atrazina en diferentes fracciones de tamaño de suelo, encontrando que la adsorción es más eficiente en la fracción arcillosa que en los limos y las arenas. Estos autores atribuyeron lo anterior a la mayor área de superficie debido a la estructura microporosa de las arcillas, que sirven como adsorbente de la atrazina y de la materia orgánica, que a su vez tiene gran capacidad de fijar este herbicida. La influencia del pH sobre la adsorción de atrazina en sustancias húmicas fue estudiada por Wang et al. (2011), quienes encontraron que estas sustancias presentan alto potencial de adsorción de atrazina a bajo pH, disminuyendo aquel con el aumento del pH. La atrazina es una base débil que se protona a pH ≤ 4, lo que favorece la adsorción en sustancias húmicas a través de interacciones iónicas (Ahmad y Rahman 2009). Por su lado, González-Márquez (2010) reporta que el incremento en la salinidad inhibe la adsorción de atrazina a sustancias húmicas, debido a cambios en la estructura y en la composición de la materia orgánica, producto de la formación de complejos de sustancias húmicas con sales de calcio y sodio. La degradación de la atrazina se lleva a cabo mediante reacciones tanto biológicas como químicas. La degradación biológica ocurre a través de la actividad de microorganismos y es considerada como el principal proceso por el cual se transforma este herbicida (Steinheimer 1993, Monard et al. 2011). Durante la biodegradación, los microorganismos utilizan atrazina como fuente de energía y de nutrientes. Sin embargo, la presencia de otras fuentes de nutrientes puede inhibir la degradación de este herbicida. La presencia de carbono y de nitrógeno mineral en el suelo limitan la biodegradación de la atrazina, ya que los microorganismos utilizan preferentemente esas fuentes de carbono y de nitrógeno, que están más disponibles para su metabolismo, en lugar de emplear la molécula de atrazina como fuente de nutrientes (Guillén-Garcés et al. 2007, Abigail et al. 2012). Diferentes autores han evaluado la biodegradación de atrazina en suelos agrícolas. González-Márquez (2005) reporta una vida media de 120 días para la atrazina en una muestra de suelo del Distrito de Riego 063 (DR 063) en Guasave, Sinaloa; Guillén-Garcés et al. (2007) encuentran vidas medias en suelos superficiales que van de 0.99 a más de 35 días en suelos de Cárdenas, Tabasco y DR 063, mientras que González-Márquez y Hansen (2009) describen vidas medias entre 2.0 a 5.8 años en perfiles de suelo del DR 063. Estas diferencias en las vidas medias se explicaron por la presencia de fertilizantes nitrogenados (Guillén-Garcés et al. 2007) y de sales (González-Márquez y Hansen 2009), que inhiben la degradación de la atrazina. ATRAZINA: UN HERBICIDA POLÉMICO En estudios realizados en campos agrícolas de Georgia, California y Minnesota, EUA, se obtuvieron vidas medias de atrazina de 13, 58 y 261 días, respectivamente; las diferencias entre estas vidas medias reportadas se atribuyen a la variación de temperatura entre los estudios, concluyendo que la atrazina es más persistente en clima frío, dada la menor actividad microbiana en esos climas (USEPA 2006). Sin embargo, habría también que considerar otros factores como la fertilización, la salinidad de los suelos y el grado de adaptación de los consorcios microbianos a la degradación del herbicida. La degradación química se lleva a cabo mediante hidrolisis y fotólisis, encontrándose atrazina en forma disuelta o adsorbida en las superficies sólidas del suelo (Honeycutt y Schabacker 1994). La hidrólisis conduce comúnmente a la obtención de compuestos hidroxilados como hidroxiatrazina, desetilhidroxiatrazina y desisopropilhidroxiatrazina (Monard et al. 2011). La hidroxiatrazina es el principal producto de la degradación química y se adsorbe más fuertemente al suelo que la atrazina (Ma y Selim 1996). Se considera que los tres metabolitos no son fitotóxicos, por tanto se estima que la hidrólisis de atrazina es un proceso que disminuye el riesgo de contaminar los cuerpos de agua por este herbicida (Aker y Muir 1978, Pichon et al. 1995). La atrazina puede hidrolizarse con bastante rapidez en medios ácidos o alcalinos, pero es muy resistente a la hidrólisis en medios neutros (pH=7) (FAO 2000). En medio neutro a temperatura de 25º C, se calcula que la hidrólisis de atrazina ocurre en 1800 años. Sin embargo, a pH ácidos o básicos, se hidroliza por completo en tiempos mucho más cortos. En FAO (2000) se reporta la hidrólisis de atrazina a pH 4 de 244 días sin aditivos y de 1.73 días en presencia de ácido húmico. La degradación fotolítica de atrazina se produce por radiación electromagnética ultravioleta, visible o infrarroja y puede ocurrir tanto en la superficie del suelo como en agua y de manera directa o indirecta (Larson y Berenbaum 1998, Dabrowska et al. 2004). Durante la degradación fotolítica directa, la energía de la luz es absorbida directamente por la molécula del herbicida, mientras que en la degradación fotolítica indirecta, la energía de la luz es absorbida y transmitida al herbicida por fotosensibilizadores como los nitratos, nitritos, compuestos férricos, sólidos suspendidos y ácidos húmicos, que aceleran la fotodegradación (Burrows et al. 2002). Prosen y Zupancic-Krajl (2005) estudiaron la fotodegradación de atrazina, demostrando que el aumento en concentración de ácidos húmicos incrementa la velocidad de fotodegradación del herbicida. Asimismo, Hashem y 73 Wolfram (2004) encontraron mayor degradación de atrazina en agua de río que en agua destilada, debido a la presencia de sólidos suspendidos en el agua de río, que actúan como fotosensibilizadores. Hernández-Antonio (2013) estudió la fotomineralización de atrazina y la formación de metabolitos de atrazina en solución con sales de CaCl2 y de NaCl, con y sin la presencia de sólidos suspendidos y con ácidos húmicos. Este autor encontró que la mineralización de la atrazina en ausencia de sólidos suspendidos no presenta diferencia de degradación con el incremento de sales en la solución. Sin embargo, el aumento de ácidos húmicos y de sólidos suspendidos en la solución elevan la mineralización de la atrazina, siendo mayor en presencia de ácidos húmicos que con sólidos suspendidos. Con base en estos resultados Hernández-Antonio (2013) concluye que la salinidad no afecta directamente la mineralización de la atrazina, pero sí desempeña un papel importante en la conformación de los sólidos y de su capacidad de adsorción de atrazina, cambiando la concentración de atrazina en la fase disuelta y, por tanto, la absorción directa de energía solar, que la fotodegrada. Microorganismos degradadores de la atrazina y vías metabólicas Recientemente han sido reportados microorganismos que degradan atrazina (Govantes et al. 2009, Krutz et al. 2010, Udiković-Kolić et al. 2012). Los primeros microorganismos aislados en la década de los 90 y que utilizaban atrazina, degradaban parcialmente el herbicida mediante desalquilaciones y desaminaciones que liberan las cadenas laterales, sin deshalogenar o romper el anillo s-triazina (Behki et al. 1993, Mulbry 1994, Shao y Behki 1995). Desde 1994 han sido aisladas y caracterizadas bacterias capaces de mineralizar atrazina (Yanze-Kontchou y Gschwind 1994), es decir, convertirla en compuestos inorgánicos. La atrazina es utilizada preferentemente por los microorganismos como fuente de nitrógeno debido al estado totalmente oxidado de los carbonos del anillo s-triazina (Mandelbaum et al. 1995, Struthers et al. 1998), las cadenas laterales N-alquilo pueden también utilizarse como fuente de carbono (Shapir et al. 2007). La vía para mineralizar la atrazina involucra dos etapas. En la primera, se genera ácido cianúrico mediante la remoción del cloruro y de las cadenas laterales N-alquilo a través de vías hidrolíticas y oxidantes hidrolíticas, cuyas enzimas frecuentemente tienen una amplia especificidad de sustrato, lo que permite la utilización de varias s-triazinas (Shapir et al. 2007). En la segunda etapa, el ácido cianúrico es cortado por hidrolisis consecutiva, produciendo 74 A.M. Hansen et al. biuret, alofanato, amonio y dióxido de carbono por un conjunto de enzimas con un rango limitado de sustratos. Esta diferencia de especificidad a nivel de sustrato puede explicarse por la diferencia de las enzimas (que han evolucionado recientemente) involucradas en la conversión de atrazina a ácido cianúrico; las enzimas que mineralizan el ácido cianúrico han existido desde hace mucho tiempo, ya que los estudios que mimetizan las condiciones químicas de la tierra antigua han generado amidas cíclicas tales como el ácido cianúrico (Fig. 2) (Cheng et al. 2005, Govantes et al. 2009, Gao et al. 2010, Seffernick et al. 2012). Las vías oxidantes hidrolíticas involucran la N-desalquilación oxidante, desclorinación hidrolítica o desaminación de la atrazina. Por catabolismo se entiende el conjunto de procesos metabólicos que transforman grandes moléculas orgánicas en moléculas pequeñas, liberándose energía. Los genes del catabolismo de la atrazina se han encontrado en microorganismos aislados de cuatro phyla (Actinobacteria, Proteobacteria, Firmicutes y Bacteroideles) de los seis continentes (Krutz et al. 2010). La mayoría de los microorganismos aislados contienen los genes degradadores de atrazina en plásmidos auto transmisibles, que son moléculas circulares de ADN extracromosómico que se replican independientemente del ADN cromosómico (Martinez et al. 2001, Devers et al. 2007), permitiendo así su distribución en diversos phyla, mediante su transferencia horizontal (Devers et al. 2005, Sorensen et al. 2005, Devers et al. 2007, Vaishampayan et al. 2007, Ghosh et al. 2008). La alta conservación de los genes degradadores de atrazina es consistente con un origen único y reciente de esta capacidad degradativa y su subsecuente dispersión global (Devers et al. 2007, Scott et al. 2009, Krutz et al. 2010), mediante transporte en polvo y depositación atmosférica en otra región del mundo (Prospero et al. 2005, Yamaguchi et al. 2012). La cepa de Pseudomonas sp. ADP (Mandelbaum et al. 1995) es el organismo modelo de la utilización de la atrazina como fuente de nitrógeno a través de una vía hidrolítica, contenida en el plásmido catabólico pADP-1 (Martinez et al. 2001). Los genes involucrados en la mineralización están localizados en dos regiones del plásmido: los genes para la conversión de atrazina a ácido cianúrico se encuentran en una región inestable del ADN que puede perderse si el microorganismo crece en medios libres de atrazina. En cambio, los genes involucrados en el corte del ácido cianúrico están agrupados en una región estable del ADN (Wackett et al. 2002). Un estudio para determinar el potencial genético de la degradación de atrazina por bacterias del suelo, permitió caracterizar varias combinaciones moleculares de los genes degradadores de atrazina. Lo que sugiere flexibilidad en la organización de estos genes para lograr la dispersión y utilización de la atrazina por microorganismos en los suelos que han sido tratados con este herbicida (Devers et al. 2007). Normalmente los microorganismos contienen los genes de degradación en elementos que pueden compartir o transferir entre ellos. En este caso y ya que existen varios genes para la conversión de atrazina a ácido cianúrico, los genes pueden combinarse dando lugar a diferentes arreglos moleculares que permiten la utilización de la atrazina como fuente de nutrientes. La utilización de atrazina por microorganismos es regulada por la disponibilidad de nutrientes (GarcíaGonzález et al. 2003); la expresión de los genes de degradación de la atrazina es inducida por el ácido cianúrico y reprimida por la fuente preferencial de nitrógeno. El producto del gen atzR es un regulador transcripcional de la familia LysR, requerido para el control mediado por nitrógeno y ácido cianúrico. El ácido cianúrico interactúa con el gen atzR, alterando su conformación para activar la trascripción de los genes de degradación de atrazina (Porrúa et al. 2007). En cuanto al transporte celular de atrazina, recientemente se reportaron los genes atzSTUVW del plásmido pADP-1, que codifican para una porina, o proteína de membrana, y los componentes de un probable transportador tipo ABC (Platero et al. 2012). Estos autores sugieren que, aun cuando la síntesis de las enzimas para convertir atrazina a ácido cianúrico es constitutiva, la asimilación de atrazina es fuertemente regulada por la disponibilidad de nitrógeno, explicando la existencia de un sistema de transporte de atrazina que podría estar codificado por el operón atzRSTUVW. Migración de la atrazina en el agua y el suelo La migración de la atrazina en el agua y el suelo es un proceso complejo. Se ha identificado que la adsorción a los diferentes componentes del suelo y la degradación, tanto química, biológica como fotolítica de la atrazina, así como el movimiento del agua en el suelo (Fig. 3), son los principales procesos que controlan el destino final de este herbicida (BesseHoggan et al. 2009). La conductividad hidráulica y la capacidad de retención de agua en el suelo influyen en la migración de la atrazina (Müller et al. 2012). La conductividad hidráulica depende de la textura del suelo. Mientras que en suelos arenosos la infiltración del agua es más rápida, en suelos arcillosos la infiltración ocurre lentamente, lo que influye en la velocidad de transporte 75 ATRAZINA: UN HERBICIDA POLÉMICO VÍA HIDROLÍTICA VÍA OXIDATIVA-HIDROLÍTICA Cl Cl N N OH N Atrazina NH NH N AM AM NH HO N OH Ácido cianúrico DEAM Cl CAH N N NH Desetilatrazina N N N N Cl OH N N N NH2 AC VÍA DEL ÁCIDO CIANÚRICO N NH N N NH2 Desisopropilatrazina NH NH2 TC Hidroxiatrazina N NH2 Desisopropildesetilatrazina NH2 NH2 OH TH N N HAEA N NH NH2 DIHA OH N HO N N BH OH N NH2 2-Cloro-4-hidroxi-6amino-1,3,5-triazina OH N N HAEA N N NH OH EAA IAIA OH N OH NH2 NH O N N 2,4-Dihidroxi-6-(N-etil)amino-1,3,5-triazina O NH2 Alofanato OH N NH N-Isopropilammelida O NH Biuret Cl Desisopropilhidroxiatrazina OH O N OH 2,4-Dihidroxi-6-amino1,3,5-triazina 2NH3 + 2CO2 N IAIA N OH Ácido cianúrico Fig. 2. Vías de mineralización de la atrazina. Izquierda. Pasos enzimáticos que catalizan la conversión de atrazina al intermediario común ácido cianúrico. Derecha: vía de degradación del ácido cianúrico. Enzimas que participan en las vías: AC, atrazina clorohidrolasa (AtzA, TrzN); HAEA, hidroxiatrazina etilaminohidrolasa (AtzB); IAIA, N-isopropilammelida isopropilamidohidrolasa (AtzC, TrzC); AM, atrazina monooxigenasa (ThcB, AtrA); TC, s-triazina clorohidrolasa (TrzA); DEAM, desetilatrazina monooxigenasa; DIHA, desisopropilhidroxilatrazina amidohidrolasa; EAA, N-etilammelida amidohidrolasa, TH, s-triazina hidrolasa (TriA); CAH, ácido cianúrico hidrolasa (AtzD, TrzD); BH, biuret hidrolasa (AtzE); AH, alofanato hidrolasa (AtzF, TrzF). Adaptado de http://umbbd.ethz.ch/atr/atr_map.html, Govantes et al. 2009, Gao et al. 2010 de la atrazina al agua subterránea (Stewart y Loague 2004). Este transporte de atrazina y de sus metabilitos en el suelo, ocurre tanto por la infiltración lenta a través de la matriz del suelo, como por el transporte más rápido a través de macroporos y grietas en el suelo (Ma y Selim 1996). De esta manera, se pueden formar flujos preferenciales, que representan movimientos irregulares y rápidos de agua y solutos a través del 76 Volatilización A.M. Hansen et al. Es co Adsorción Desorción Biodegradación Degradación química NH2 N N N OH nt ía Rutas preferenciales Lixiviación H2 N rre Fig. 3. Procesos que afectan la migración de atrazina suelo, favoreciendo el transporte de atrazina hacia el agua subterránea. Hang et al. (2010) demostraron que el transporte de atrazina puede ser independiente de sus propiedades adsorbentes, debido a que los flujos preferenciales disminuyen el tiempo de interacción entre el herbicida y los componentes del suelo. La materia orgánica del suelo puede estar presente tanto en forma sólida como disuelta en el agua del suelo. La materia orgánica incrementa la capacidad de adsorción del suelo, afectando así la migración de atrazina e inhibiendo la movilidad del herbicida (Wan-ting et al. 2005, González-Márquez y Hansen 2009). Por otro lado, la formación de complejos de atrazina con materia orgánica disuelta inhibe la adsorción del herbicida al suelo, aumentando así su migración al agua subterránea (Ben-Hur et al. 2003). Las variaciones en la cantidad y en el tipo de sales presentes en agua y suelo influyen en la atenuación natural de la atrazina ya que intervienen en el crecimiento de microorganismos degradadores del herbicida (Udikovic et al. 2003) y alteran la capacidad de adsorción del suelo (Lin et al. 2008, Jiang et al. 2009, González-Márquez 2010). GonzálezMárquez y Hansen (2009), estudiaron la relación entre la adsorción y la degradación de atrazina con parámetros de suelos agrícolas del noroeste de México, encontrando correlaciones negativas entre la degradación de atrazina y la salinidad; mientras que Mao y Ren (2010) reportaron que el incremento en la concentración de CaCl2, en la solución del suelo, favorece la adsorción de atrazina en suelos agrícolas. Resultados similares, respecto al incremento de la adsorción con el aumento de la salinidad, han sido descritos por González-Márquez (2010) para suelos mexicanos, pero tal efecto solamente se presentó con el incremento de la concentración de una sal sódica monovalente y no con una sal cálcica polivalente. González-Márquez (2010) también encontró que el incremento en la salinidad inhibe la adsorción de la atrazina a la materia orgánica, debido a cambios en la estructura y en la composición de esta última, producto de la interacción con sales mono y polivalentes. Por lo que el efecto de los tipos y de las concentraciones de sales en la adsorción de atrazina en suelos y/o componentes específicos del mismo no se puede generalizar, ya que las interacciones o mecanismos de adsorción son complejos y dependen tanto de las propiedades de la atrazina como del medio adsorbente. El contenido de agua en el suelo, así como los ciclos de secado y rehidratación, influyen en la adsorción de la atrazina al causar cambios en la estructura de la materia orgánica, manifestados principalmente por el cambio en las estructuras, tanto lineales como enrollada, de los compuestos húmicos (Hosse y Wilkinson 2001). Esta modificación de la estructura puede causar incremento en la capacidad de adsorción del suelo (Rutherford y Chiou 1992). Shelton et al. (1995) reportan que el secado y la rehidratación del suelo incrementan la adsorción de la atrazina y disminuyen su desorción, mientras que Koskinen y Rochette (1996) indican que la desorción de la atrazina en suelos no saturados aumenta con el incremento del contenido de agua ATRAZINA: UN HERBICIDA POLÉMICO en el suelo. Por lo que la capacidad de retención de agua y los ciclos de secado y rehidratación de suelos, pueden afectar la migración de la atrazina en el perfil de suelo. Los microrganismos en suelos donde se aplica atrazina desarrollan la capacidad de utilizar el herbicida como fuente de carbono o de nitrógeno, dependiendo de qué tan adaptados estén para utilizar el herbicida como nutriente. Se ha demostrado que la presencia de atrazina modifica la población microbiana que se encuentra en los suelos (Ross et al. 2006). La aplicación frecuente permite la adaptación de los microorganismos para usar atrazina como fuente de nutrientes, disminuyendo así la persistencia del compuesto (Mahía y Díaz-Raviña 2007). Por otro lado, la degradación biológica de la atrazina depende de las propiedades del suelo, las dosis de herbicida que se aplican y de la frecuencia de aplicación (Moreno et al. 2007). Los suelos con baja actividad microbiana o estériles pueden ocasionar que la concentración del herbicida se mantenga invariable por un tiempo mayor, en comparación con suelos donde la flora microbiana es abundante (Alvey y Crowley 1996), aumentado así el riesgo de transporte del herbicida a los cuerpos de agua. Existen diversos estudios sobre el efecto de factores climáticos, tales como la precipitación pluvial y la temperatura, sobre la dinámica de la atrazina en el ambiente; en ellos se ha determinado la influencia de esos factores sobre la migración de atrazina en los diversos sistemas ambientales. Se ha demostrado que después de la aplicación de la atrazina en suelos los eventos de lluvia favorecen el transporte del herbicida por escurrimiento, mientras que las lluvias continuas causan la infiltración y los consecuentes procesos de adsorción y degradación (Correia et al. 2007). Guillén-Garcés (2001) realizó una simulación con el programa PESTAN (USEPA 2012) para evaluar los efectos de la lluvia sobre la migración de atrazina en un suelo tipo Vertisol procedente del campo experimental perteneciente al Colegio de Postgraduados, ubicado en el “Trapecio” Cárdenas, Tabasco, donde la profundidad del manto freático no es mayor a 110 cm y la conductividad hidráulica es de 5 × 10–6 m/s, encontrando que en eventos de lluvia moderada (entre 2 y 15 mm/h) se favorecen los procesos de infiltración del herbicida hacia los mantos freáticos, en concentraciones superiores al límite máximo permisible establecido por la Organización Mundial de Salud (OMS) de 0.002 mg/L. Por otro lado, con lluvias débiles (menores de 2 mm/h), la biodegradación tiene mayor influencia sobre la disipación de atrazina y en estas condiciones una 77 mayor cantidad de atrazina se degrada antes de llegar al manto freático, alcanzando concentraciones inferiores al límite establecido por la OMS. González-Pradas et al. (2000) investigaron el efecto de la temperatura sobre la adsorción de atrazina en minerales arcillosos, encontrando que disminuye con el aumento de temperatura entre 15 y 35º C. Comportamientos similares fueron observados por Ureña-Amate et al. (2004) y Kovaios et al. (2006) para la adsorción de atrazina en kerolita y en sílica gel, con el incremento de temperatura entre 10 y 40 ºC. Las prácticas agrícolas también influyen sobre la migración de atrazina. En este sentido, se recomienda cero o mínima labranza, favoreciendo así la acción del herbicida sobre la maleza (Ruiz-Nájera 2001). Esta práctica favorece la oxidación lenta de la materia orgánica en el suelo (Mahdi y Xinhua 2005), favoreciendo la adsorción de atrazina (Montoya et al. 2006) y, por tanto, su retención en el suelo. Por el contrario, la labranza convencional agota la materia orgánica, disminuyendo la cantidad de microorganismos degradadores del herbicida y afectando así la biodegradación (De Villiers et al. 2002). Asimismo, al agotarse el contenido de materia orgánica, la atrazina se disuelve más en el agua de poro, aumentando el riesgo de migración del herbicida hacia los cuerpos de agua (Ben-Hur et al. 2003). La movilidad de atrazina en el suelo depende de la textura, del contenido de materia orgánica, del drenaje del suelo y de la cantidad de agua aplicada ya sea por lluvia o riego. Suelos arcillosos con alto contenido de materia orgánica tienden a retener a la atrazina en la superficie del suelo y su presencia en el agua drenada es limitada (Hang et al. 2010), mientras que en suelos arenosos, la atrazina tiende a infiltrarse y transportarse con el agua drenada (Montoya et al. 2006). Las lluvias abundantes y la aplicación de riegos excesivos, aumenta el riesgo de migración del herbicida hacia cuerpos de agua por procesos de escurrimiento e infiltración (Mobaser et al. 2012). Para disminuir el riesgo de contaminar a los cuerpos de agua se han establecido recomendaciones para el riego en zonas donde se aplica atrazina. La USEPA (2006) recomienda evitar la aplicación de atrazina a través de los sistemas de riego, a menos que la aplicación se realice con base en un programa de riego donde se asegure que sólo se humedece hasta la zona de la raíz y sin sobrepasar la capacidad de campo del suelo. También la fertilización de los suelos aumenta la migración de la atrazina debido a que la presencia, tanto de carbono como de nitrógeno, limitan su bio- 78 A.M. Hansen et al. degradación ya que los microorganismos del suelo utilizan los fertilizantes como fuentes de carbono y nitrógeno más disponibles en lugar de emplear los contenidos en la molécula de atrazina (Strong et al. 2000, Guillén-Garcés et al. 2007). Por otro lado, la aplicación de abono aumenta la cantidad de materia orgánica en la superficie del suelo, favoreciendo la adsorción de la atrazina y limitando la biodegradación, la lixiviación y la escorrentía del herbicida, por lo que permanece durante mayor tiempo en el suelo (Ben-Hur et al. 2003). Para elevar la eficiencia herbicida de la atrazina, ésta se emplea con otros compuestos como el acetoclor y la simazina en los cultivos de maíz, con ametrina en cultivos de caña de azúcar y con terbutrina en cultivos de sorgo (Ware 2000). El acetoclor es un herbicida alcalino y la atrazina es ácida, lo que provoca que cuando son aplicados simultáneamente, el acetoclor se adsorbe más que la atrazina en la materia orgánica y los minerales cargados negativamente. Esta adsorción preferencial del acetoclor causa el aumento en la migración de la atrazina al agua subterránea (Hiller et al. 2008). Por otro lado, Shaner y Henry (2007) y Shaner et al. (2010) reportan que la aplicación de atrazina junto con ametrina, terbutina y simazina, que también son herbicidas triazínicos que compiten con los mismos sitios de adsorción en el suelo. Estos herbicidas también causan mayor adaptación de los microorganismos y, por tanto, más degradación de la atrazina, disminuyendo así el efecto residual en los suelos. La atrazina se caracteriza por ser un compuesto móvil y con frecuencia se ha detectado en cuerpos de agua superficial y subterránea (Farré et al. 2007). Su migración hacia el agua subterránea depende de varios factores tales como las propiedades del suelo, la intensidad de la precipitación, los procesos de difusión, adsorción y la profundidad del manto freático, entre otros. A mayores profundidades del manto freático la biodegradación de la atrazina es afectada por mayor variedad de microorganismos, que cambian con la profundidad del perfil del suelo debido a los procesos biológicos que varían entre aerobios y anaerobios (Hang y Nassetta 2003). También cambia la capacidad de adsorción de la atrazina en el perfil de suelo ya que disminuye la concentración de materia orgánica conforme aumenta la profundidad del suelo, disminuyendo así la capacidad de adsorción de la atrazina y aumentando su estabilidad (Li et al. 2007). Por ello, se recomienda no mezclar, preparar o aplicar atrazina a menos de 15 m de los pozos para la extracción de agua potable o para riego (USEPA 2006). Consideraciones finales La revisión de la literatura científica sobre la atrazina puede ser útil para sugerir el mejoramiento de las prácticas agrícolas, así como para instar a establecer regulaciones sobre el empleo y los límites máximos permisibles de atrazina y de otros plaguicidas de amplia aplicación en países donde las evidencias de su uso, migración ambiental e impactos aun no son concluyentes. Por ello, la prohibición o restricción de estas sustancias en otras regiones puede constituir un llamado de alerta para países como México, que aún no cuenta con regulaciones o suficientes pruebas de los riesgos y posibles efectos dañinos de la utilización de atrazina y de otros plaguicidas. El promover la implementación de políticas públicas sobre el control del uso de atrazina muestra varios caminos. Por un lado, si se toma en cuenta que México suele asumir las tendencias reguladoras de otros países de Europa y Norteamérica o bien, de organizaciones internacionales como la Organización Mundial de Salud, se pueden considerar los límites ya establecidos así como las propuestas existentes de modificación de prácticas agrícolas. Por el otro, con esta revisión es evidente que aún se requiere realizar monitoreos de atrazina en cuerpos de agua y estudios sobre su atenuación natural en sedimentos y suelos de zonas agrícolas de nuestro país. También son necesarios estudios adecuados sobre toxicidad, estimaciones de riesgo y de costobeneficio, con el fin de conocer el impacto de la prohibición o de la restricción de la atrazina, así como el reemplazo por otros herbicidas menos tóxicos y similarmente efectivos. AGRADECIMIENTOS Se agradece el apoyo económico de las becas de posgrado otorgadas por el Consejo Nacional de Ciencia y Tecnología (CONACyT) a RAGC, LCGM, MVC, HMP y AHA. Al Dr. Manfred van Afferden por su participación y asesoría en esta línea de investigación. Los trabajos se realizaron con financiamiento de la Comisión Nacional del Agua (CONAGUA) a través de los convenios SGOGDTT-IMTA-99-044, SGO-GDTT-IMTA-2000, SGIH-OCFS-CHS-07-TT-214-RF-CC y SGIHOCFS-CHS-08-TT-307-RF-CC, de la Secretaría de Medio Ambiente y Recursos Naturales (SEMARNAT) y CONACYT a través del convenio SEMARNAT-2002-C01-0275 y con proyectos internos del IMTA TH-0709.1 y TH-0803.1. ATRAZINA: UN HERBICIDA POLÉMICO REFERENCIAS Abdelhafid A., Houot S. y Barriuso E. (2000). How increasing availabilities of carbon and nitrogen affect atrazine behaviour in soils. Biol Fertil Soils. 30, 333-340. Abigail M.E.A., Lakshmi V. y Das N. (2012). Biodegradation of atrazine by Cryptococcus laurentii isolated from contaminated agricultural soil. J. Microbiol. Biotech. Res. 2, 450-457. Ahmad R. y Rahman A. (2009). Sorption characteristics of atrazine and imazethapyr in soils of New Zealand: Importance of independently determined sorption data. J. Agric. Food Chem. 57, 10866-10875. Aker B. y Muir D.C. (1978). The disappearance and movement of three triazine herbicides and several of their degradation products in soils under field conditions. Weed Research. 18, 111-120. Alvey S. y Crowley D.E. (1996). Survival and activity of an atrazine-mineralizing bacterial consortium in rhizosphere soil. Environ. Sci. Technol. 30, 1596-1603. ANEAS (2007). Agua para uso y consumo humano. Límites máximos permisibles de la calidad del agua, control y vigilancia de los sistemas de abastecimiento (PROYECTO de Norma Oficial Mexicana NOMXXXX). Asociación Nacional de Empresas de Agua y Saneamiento [en línea]. http://www.aneas.com.mx/ contenido/nom.pdf. (Último acceso mayo 29, 2013). ATSDR (2003). Reseña Toxicológica de la Atrazina. Agencia para Sustancias Toxicas y Registro de Enfermedades. Departamento de Salud y Servicios Humanos de los EUA. Bailey G., White J. y Rothberg T. (1968). Adsorption of organics herbicides by montomorillionite. Soil Sci. Soc. Am. Pro. 32, 222-234. Behki R., Topp E., Dick W. y Germon P. (1993). Metabolism of the herbicide atrazine by Rhodococcus strains. Appl. Environ. Microbiol. 59, 1955-1959. Ben-Hur M., Letey J., Farmer W.J., Williams C.F. y Nelson S.D. (2003). Soluble and solid organic matter effects on atrazine adsorption in cultivated soils. Soil Sci. Soc. Am. J. 67, 1140-1146. Besse-Hoggan P., Alekseeva T., Sancelme M., Delort A.M. y Forano C. (2009). Atrazine biodegradation modulated by clays and clay/humic acid complexes. Environ. Pollut. 10, 2837-2844. Buchman M.F. (1999). NOAA SQRT Screening Quick Reference Tables, NOAA Hazmat Report 99-1, Seattle WA, Coastal Protection and Restoration Division, National Oceanic and Atmospheric Administration, 12 p. Burrows H.D., Canle L.M., Santaballa J.A. y Steeken S. (2002). Reaction pathways and mechanisms of photodegradation of pesticides. J. Photochem. Photobiol. B. 67, 71-108. 79 Carafa R., Wollgast J., Canuti E., Ligthart J., Dueri S., Hanke G., Eisenreich S.J., Viaroli P. y Zaldívar J.M. (2007). Seasonal variations of selected herbicides and related metabolites in water, sediment, seaweed and clams in the Sacca di Goro coastal lagoon (Northern Adriatic). Chemosphere 69, 1625-1637. CCA (2012). Foro de la Comisión para la Cooperación Ambiental sobre manejo de las sustancias químicas, mayo 15-16, 2012, San Antonio, Texas. Comisión para la Cooperación Ambiental. Montreal, 51 p. [en línea]. http://www.cec.org/Storage/142/16813_CEC_ Chemicals_Management_Forum_Meeting_Summary_sp.pdf. (Último acceso julio 18, 2013). CCME (2002). Sediment Quality Guidelines for the Protection of Aquatic Life. Canadian Council of Ministres of the Environment. Winnipeg, MB. 7 p. Chapman R.N.y Stranger J.W. (1992). Horticultural pesticide residues in water: a review of potential for water contamination by pesticides used in the vegetable industry in Victoria. Melbourne, Australia. Department of Food and Agriculture, 137. Cheng G., Shapir N., Sadowsky M.J. y Wackett L.P. (2005). Allophanate hydrolase, not urease, functions in bacterial cyanuric acid metabolism. Appl Environ Microbiol. 71, 4437-4445. CICOPLAFEST (2005). Catálogo Oficial de Plaguicidas. Comisión Intersecretarial para el Control del Proceso y Uso de Plaguicidas, Fertilizantes y Sustancias Tóxicas. México, D.F. 483 p. Cornelis C. y Van Gestel G. (2007). Order of the Brussels Capital Government concerning the values for soil and groundwater pollution above which a risk investigation has to be undertaken. En: Derivation methods of soil screening values in Europe. A review and evaluation of national procedures towards harmonization. Annex 3-Contry reports, EUR 22805-EN (C. Carlon, Ed.). European Commission, Joint Research Centre, Ispra, pp 249-264. Correia F.V., Macrae A., Guilherme L.R.G. y Langenbach T. (2007) Atrazine sorption and fate in a Ultisol from humid tropical Brazil. Chemosphere 67, 847-854. Dabrowska D., Kot-Wasik A. y Namieśnik J. (2004). The importance of degradation in the fate of selected organic compounds in the environment. Part II. Photodegradation and biodegradation. Pol. J. Environ. Stud. 13, 617-626. De Villiers M.C., Pretorius D.J., Barnard R.O., Van Zyl A.J. y Le Clus C.F. (2002 ). Land degradation assessment in dryland areas: South Africa. Paper for Land Degradation Assessment in Dryland Project (FAO), ARC-Institute for Soil, Climate and Water, South Africa National Department of Agriculture, Bothaville, Sudáfrica. 11p. 80 A.M. Hansen et al. Devers M., El Azhari N, Kolic N-U. y Martin-Laurent F. (2007). Detectionand organization o fatrazine-degrading genetic potential of seventeen bacterial isolates belonging to divergent taxa indicate a recent common origin of their catabolic functions. FEMS Microbiol. Lett. 273, 78-86. Devers M,. Henry S., Hartmann A. y Martin-Laurent F. (2005). Horizontal gene transfer of atrazine-degrading genes (atz) from Agrobacterium tumefaciens st96-4 pADP1:TN5 to bacteria of maize cultivated soil. Pest Manag Sci. 61, 870-880. DOF (2000). Salud ambiental. Agua para uso y consumo humano. Límites permisibles de calidad y tratamientos a que debe someterse el agua para su potabilización. Secretaría de Salud. Diario Oficial de la Federación. México, D.F. pp. 1-21. European Parliament (1998). Council Directive 98/83/EC of 3 November 1998 on the quality of water intended for human consumption. Official Journal of the European Communities, L 330/32. European Parliament (2000). Directive 2000/60/EC of the European Parliament and of the Council of 23 October 2000 establishing a framework for Community action in the field of water policy. Official Journal of the European Communities, L 327/1. FAO (2000). Evaluación de la contaminación del suelo. Manual de referencia. Food and Agriculture Organization of the United Nations. Roma, Italia. [en línea]. http://www.fao.org/docrep/005/x2570s/X2570S09. htm. (Último acceso abril 23, 2013). FAO (2005). Proceedings of the Asia regional workshop on the implementation, monitoring and observance of the international code of conduct on the distribution and use of pesticides. Food and Agriculture Organization. Bangkok, Tailandia. 249 p. Farré M., Martínez E., Ramón J., Navarro A., Radjenovic J., Mauriz E., Lechuga L., Marco M. y Barceló D. (2007). Part per trillion determination of atrazine in natural water samples by a surface plasmon resonance immunosensor. Anal Bioanal Chem. 388, 207–214. Gao J., Ellis L.B.M. y Wackett L.P. (2010). The University of Minnesota Biocatalysis/Biodegradation Database: improving public access. Nucleic Acids Res. 38, D488-D491. García-González V., Govantes F., Shaw LJ, Burns R. G. y Santero E. (2003). Nitrogen control of atrazine utilization in Pseudomonas sp. strain ADP. Appl. Environ. Microbiol. 69, 6987-6993. Geng Y., Ma J., Jia R., Xue L., Tao C., LI C., Ma X. y Lin Y. (2013). Impact of long-term atrazine use on groundwater Safety in Jilin Province, China. J. of Integr. Agr. 12, 305-313. Ghosh D., Roy K., Williamson K.E., White D.C., Wommack K.E., Sublette K.L. y Radosevich M. (2008). Prevalence of lysogeny among soil bacteria and presence of 16s rRNA and trzN genes in viral community DNA. Appl. Environ. Microbiol. 74, 495-502. Giupponi C. (2001). The substitution of hazardous molecules in production process: the atrazine case study in Italian agriculture. FEEM Working Paper No. 35.2001. Golla V., Nelms J., Taylor R. y Mishra S. (2011). Pesticide concentrations in drinking water from farm homes: Variation between community water supply and wellwater. J. Environ. Sci. Eng. 5, 955-961. González-Márquez L.C. (2005). Migración de herbicidas (atrazina y 2,4-D) en suelo del distrito de riego 063, Guasave, Sinaloa. Tesis de Maestría. Universidad Nacional Autónoma de México, Morelos México, 120 p. González-Márquez L.C. (2010). Efecto de la salinidad en la adsorción y mineralización de atrazina en suelos. Tesis de Doctorado. Universidad Nacional Autónoma de México, Morelos México, 97 p. González-Márquez L.C. y Hansen A.M. (2009). Adsorción y mineralización de atrazina y relación con parámetros de suelo del DR 063 Guasave, Sinaloa. Rev. Mex. Cienc. Geol. 26, 587-599. González-Pradas E., Villafranca-Sánchez M., Del ReyBueno F., Ureña-Amate M.D. y Fernández-Pérez M. (2000). Removal of paraquat and atrazine from water by montmorillonite-(Ce or Zr) phosphate cross-linked compounds. Pest. Manag. Sci. 6, 565-570. Govantes F., Porrúa O., García-González V. y Santero E. (2009). Atrazine biodegradation in the lab and in the field: enzymatic activities and gene regulation. Microbiol. Biotechnol. 2, 178-185. Graymore M., Stagnitti F. y Allinson G. (2001) Impacts of atrazine in aquatic ecosystems. Env. Int. 26, 483-495. Guillén-Garcés R.A. (2001). Influencia de la biodegradación en la migración de herbicidas (2,4 D y atrazina) en suelos tropicales. Tesis de Maestría. Universidad Nacional Autónoma de México, Morelos México, 73 p. Guillén-Garcés R.A., Hansen A.M. y Afferden van M. (2007). Mineralization of atrazine in agricultural soil: Inhibition by nitrogen. Environ. Toxicol. Chem. 26, 844-850. Hang S., Andriulo A., Sasal C., Nassetta M., y Portela S. (2010). Integral study of atrazine behavior in field lysimeters in Argentinean humid pampas soils. Chilean J. Agric. Res. 70, 104-112. Hand S. y Nasseta M. (2003). Evolución de la degradación de atrazina en dos perfiles de suelo de la provincia de Córdoba. Revista de Investigaciones Agropecuarias. 32, 57-69. [en línea]. http://www.redalyc.org/ pdf/864/86432106.pdf (Último acceso julio 19, 2013). ATRAZINA: UN HERBICIDA POLÉMICO Hang S. y Roberto S. (2002). Adsorción de atrazina y su relación con las características sedimentológicas y el desarrollo del perfil de dos suelos de la provincia de Córdoba. Revista de investigaciones agropecuarias. 31, 73-87. Hashem F.H.H. y Wolfram H.P.T. (2004). Photodegradation of atrazine. In water. [en línea]. http://www. envirotech-online.com/articles/water-wastewater/9/ hashem_f.h.hafez_and_wolfram_h.p.thiemann/ photodegradation_of_atrazine_in_water_-_ hashem_f.h.hafez_and_wolfram_h.p.thiemann/889/. (Último acceso mayo 08, 2013). Hayes T.B., Collins A., Lee M., Mendoza M., Noriega N., Stuart A. y Vonk A. (2002). Hermaphroditic, demasculinized frogs after exposure to the herbicide atrazine at low ecologically relevant doses. PNAS 99, 5476-5480. Health Canada (2012). Guidelines for Canadian Drinking Water Quality. Ottawa, Ontario. 22 p. Hernandez-Antonio A. (2013). Modelo conceptual de contaminación de aguas superficiales por uso de atrazina en zonas agrícolas. Tesis de Doctorado. Universidad Nacional Autónoma de México, Morelos México, 78 p. Hernández-Antonio A. y Hansen A. M. (2011). Uso de plaguicidas en dos zonas agrícolas de México y evaluación de la contaminación de agua y sedimentos. Rev. Int. Contam. Ambie. 27, 115-127. Hiller E., Krascsenits Z. y Cernasky S. (2008). Sorption of acetochlor, atrazine, 2,4-D, chlorotoluron, MCPA, and trifluralin in six soils from Slovakia. Bull. Environ. Contam. Toxicol. 80, 412–416. Honeycutt R.C y Schabacker D.J. (1994). Mechanisms of pesticide movement into ground water. Lewis Publishers. Boca Ratón, Florida. 208 p. Hosse M. y Wilkinson K.J. (2001). Determination of electrophoretic mobilities and hydrodynamic radii of three humic substances as a function of pH and ionic strength. Environ. Sci. Technol. 21, 4301-4306. Houot S., Topp E., Abdellah Y., Soulas G. (2000). Dependence of accelerated degradation of atrazine on soil pH in French and Canadian soils. Soil Biol. Biochem. 32, 615-625. Jiang Z., Li J., Peng X., Ma Y., Wang R. y Zhang Y. (2009). Study on the growth and degradation characteristics of atrazine degradation strain named J2. Conference Environ. Sci. Info. Appl. Tech. 1, 681-684. Koskinen W. y Rochette E. (1996). Atrazine sorption– desorption in field-moist soils. Int. J. Environ. Anal. Chem. 65, 223–230. Kovaios I.D., Paraskeva C.A., Koutsoukos P.G. y Payatakes A. (2006). Adsorption of atrazine on soils: model study. J. Colloid Interface Sci. 299, 88-94. 81 Kovaios I.D., Paraskeva C.A., Koutsoukos P.G. (2011). Adsorption of atrazine from aqueous electrolyte solutions on humic acid and silica. J. Colloid Interf. Sci. 356, 277-285. Krutz L.J., Shaner D.L., Weaver M.A., Webb R.M.T., Zablotowicz R.M., Reddy K.N., Huanga Y. y Thomsona S.J. (2010). Agronomic and environmental implications of enhanced s-triazine degradation. Pest Manag Sci. 66, 461-481. Lakshminarayan P.G., Bouzaher A. y Shogren J.F. (1996). Atrazine and water quality: An evaluation of alternative policy options, Environ. Manag. 48, 111-126 Larson R.A., y Berenbaum M.R. (1998). Environmental phototoxicity: solar ultraviolet radiation affects the toxicity of natural and man-made chemicals. Environ. Sci. Technol. 22, 354-360. Li Q., Luo Y., Song J. y Wu L. (2007). Risk assessment of atrazine polluted farmland and drinking water: a case study. Bull. Environ. Contam. Toxicol. 78, 187-190. Lin T., Wen Y., Jiang L., Li J., Yang, S. y Zhou Q. (2008). Study of atrazine degradation in subsurface flow constructed wetland under different salinity. Chemosphere 72, 122-128. Ling W.T., Wang H.Z., Xu J.M. y Gao Y.Z. (2005) Sorption of dissolved organic matter and its effects on the atrazine sorption on soils. J. Env. Sci. 17, 478-48. Ma L. y Selim H.M. (1996). Atrazine retention and transport in soils. Rev. Env. Cont. Tox. 145, 129-73. Mahdi M.A. y Xinhua Y. (2005). Tillage and crop residue effects on soil carbon and carbon dioxide emission in corn-soybean rotations. J. Environ. Qual. 34, 437-445. Mahía J. y Díaz-Raviña M. (2007). Atrazine degradation and residues distribution in two acid soils from temperate humid zone. J. Environ. Qual. 36, 826-831. Mandelbaum R.T., Wackett L.P. y Allan D.L. (1995). Isolation and characterization of a Pseudomonas sp. that mineralizes the s-triazine herbicide atrazine. Appl. Environ. Microbiol. 61, 1451-1457. Mao M. y Ren L. (2010). Effects of Ionic Strength and Temperature on Adsorption of Atrazine, Deethylatrazine and Deisopropyatrazine in an Alkaline Sandy Loam. 19th World Congress of Soil Science, Soil Solutions for a Changing World. Brisbane, Australia 1 al 6 de agosto, 2010 [en línea]. http://www.iuss. org/19th%20WCSS/Symposium/pdf/0308.pdf. (Último acceso marzo 10, 2013). Martínez B., Tomkins J., Wackett L.P., Wing R. y Sadowsky M.J. (2001). Complete nucleotide sequence and organization of the atrazine catabolic plasmid pADP-1 from Pseudomonas sp. strain ADP. J Bacteriol. 183, 5684-5697. 82 A.M. Hansen et al. MHSPE (2000). Dutch Target and Intervention Values. Ministry of Housing, Spatial Planning and Environment. The Hague, Países Bajos. 51 p. Mobaser J.A., Moazed H., Behfar A., Nasab S.B. y Khorasgani Z.N. (2012). Atrazine transport and distribution in field soils and comparison of the predictions made by leaching estimation and chemistry model-pesticide (LEACHP) model. Scientific Research and Essays 7, 3348-3356. Monard C., Vandenkoornhuyse P., Le Bot B. y Binet F. (2011). Relationship between bacterial diversity and function under biotic control: the soil pesticide degraders as a case study. The ISME Journal 5, 1048-1056. Montgomery J.H. (1997). Agrochemicals. 2a. ed.. Lewis Publishers, Boca Ratón, NY. 643 p. Montoya J., Costa J., Liedi R., Bedmar F. y Daniel P. (2006). Effects of soil and tillage practice on atrazine transport through intact soil cores. Geoderma 137, 161-173. Moreno J., Aliaga A., Navarro S., Hernández T. y García C. (2007). Effects of atrazine on microbial activity in semiarid soil. Appli. Soil Ecol. 35, 120-127. Mulbry W.W. (1994). Purification and characterization of an inducible s-triazine hydrolase from Rhodococcus corallines NRRL B-15444R. Appl Environ Microbiol. 60, 613-618. Müller k., Duwig C., Prado B., Siebe C., Hidalgo C. y Etchevers J. (2012). Impact of long-term wastewater irrigation on sorption and transport of atrazine in Mexican agricultural soils. J. Environ. Sci. Health Part B 47, 30-41. Musumeci L. (2007). Limit values for groundwater, surface and subsurface soil according to land use. En: Derivation methods of soil screening values in Europe. A review and evaluation of national procedures towards harmonization. Annex 3-Country reports, EUR 22805-EN (C. Carlon, Ed.). European Commission, Joint Research Centre, Ispra, pp. 249-264. Nödler K., Licha T. y Voutsa D. (2013). Twenty years later – atrazine concentrations in selected coastal waters of the Mediterranean and the Baltic Sea. Mar. Pollut. Bull. 70, 112-118. NRA (2002). Final report review of atrazine. NRA Chemical Review Program. National Registration Authority for Agricultural and Veterinary Chemicals. Canberra, Australia. 57 p. OJEC (1998). Council Directive 98/83/EC on the quality of water intended for human consumption. Official Journal of the European Communities. Bruselas, BE. 28 p. OJEU (2004). Commission decision concerning the noninclusion of atrazine in Annex I to Council Directive 91/414/EEC and the withdrawal of authorisations for plant protection products containing this active substance. Official Journal of the European Union. Bruselas, BE. 3 pp. Pichon V., Cher L., Guenw S. y Hennson M.C. (1995). Comparison of sorbents for the solid–phase extraction of the highly polar degradation products of atrazine. J. Chromatogr.-A. 711, 257-267. Platero A.I., García-Jaramillo M., Santero E. y Govantes F. (2012). Transcriptional organization and regulatory Elements of a Pseudomonas sp. Strain ADP Operon Encoding a LysR-Type Regulator and a Putative Solute Transport System. J. Bacteriol. 194, 6560-6573. PMRA (2004). Re-evaluation Decision Document (Atrazine). Pest Management Regulatory Agency. Ottawa, Ontario. 18 pp. Porrúa O., García-Jaramillo M., Santero E. y Govantes F. (2007). The LysR type regulator AtzR binding site: DNA sequences involved in activation, repression and cyanuric acid-dependent repositioning. Mol. Microbiol. 66, 410-427. Prosen H. y Zupancic-Krajl L. (2005). Evaluation of photolysis and hydrolysis of atrazine and its first degradation products in the presence of humic acids. Environ. Pollut. 133, 517-529. Prospero J.M., Blades E., Mathison G. y Naidu R. (2005). Interhemispheric transport of viable fungi and bacteria from Africa to the Caribbean with soil dust. Aerobiologia 21, 1-9. Pucarević M., Šovljanski R., Lazić S. y Marjanović N. (2002). Atrazine in groundwater of Vojvodina Province, Water Res. 36, 5120-5126. Readman J.W., Albanis T.A., Barceló D., Galassi S., Tronczynski J. y Gabrielides G.P. (1993). Herbicide contamination of Mediterranean estuarine waters: results from a MED POL pilot survey. Mar. Pollut. Bull. 26, 613-619. Ritter W.F., Chirnside A.E.M. y Scarborough R.W. (1996). Movement and degradation of triazines, alachlor, and metolachlor in sandy soils. J. Env. Sci. Health. Part-A, 31, 2699-2721. Rojas R., Morillo J., Usero J., Delgado-Moreno L. y Gan J. (2013). Enhancing soil sorption capacity of an agricultural soil by addition of three different organic wastes. Sci. Total Environ. 32, 614-623. Ross M., Goberna M., Moreno J.L., Hernández T., García C. e Insam H. (2006). Molecular and physiological bacterial diversity of a semiarid soil contaminated with different levels of formulated atrazine. Appl. Soil Ecol. 34, 93-102. Ruiz-Nájera R. (2001). Efecto del abono verde sobre la degradación de atrazina en un suelo agrícola no esterilizado y esterilizado. Tesis de Doctorado, Universidad de Colima. Tecoman, Colima, México [en línea]. http:// digeset.ucol.mx/tesis_posgrado/Pdf/Ramiro%20Elea- ATRAZINA: UN HERBICIDA POLÉMICO zar%20Ruiz%20Najera.pdf. (Último acceso febrero 28, 2013). Rutherford D.W. y Chiou C.T. (1992). Effect of water saturation in soil organic-matter on the partition of organic-compounds. Environ. Sci. Technol. 26, 965-970. SAGARPA (2007). Anteproyecto de Modificación de la Norma Oficial Mexicana NOM-032-FITO-1995. Por la que se establecen los requisitos y especificaciones fitosanitarios para la realización de estudios de efectividad biológica de plaguicidas agrícolas y su dictamen técnico. Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación. [en línea]. http://www.cofemermir.gob.mx/mir/uploadtests/10046.59.59.1.NOM-%20 032-FITO-1995%20(MODIF.).doc. (Último acceso mayo 13, 2013). Scott C., Jackson C.J., Coppin C.W., Mourant R.G. Hilton M.E., Sutherland T.D. Russell R.J. y Oakeshott JG. (2009). Catalytic improvement and evolution of atrazine chlorohydrolase. Appl Environ Microbiol. 75, 2184-2191. Seffernick J.L., Erickson J.S., Cameron S.M., Cho S., Dodge A.G., Richman J.E., Sadowsky M.J. y Wackett L.P. (2012). Defining sequence space and reaction products within the cyanuric acid hydrolase (AtzD)/ barbiturase protein family. J. Bacteriol. 194, 4579-88. Shaner D. y Henry W. (2007). Field history and dissipation of atrazine and metolachlor in Colorado. J. Environ. Qual. 36, 128-134. Shaner D.L., Krutz L.J., Henry W.B., Hanson B.D., Poteet M.D. y Rainbolt C.R. (2010). Sugarcane soils exhibit enhanced atrazine degradation and cross adaptation to other triazines. Am. Soc. Sugar Cane Tech. 30, 1-11. Shao Z.Q. y Behki R. (1995). Cloning of the genes for degradation of the herbicides EPTC (S-ethyl dipropylthiocarbamate) and atrazine from Rhodococcus sp. strain TE1. Appl. Environ. Microbiol. 61, 2061-2065. Shapir N., Mongodin E.F., Sadowsky M.J., Daugherty S.C., Nelson K.E. y Wackett L.P. (2007). Evolution of catabolic pathways: genomic insights into microbial s-triazine metabolism. J Bacteriol. 189, 674-682. Shelton D.R., Sadeghi A.M., Karns J.S. y Hapeman C.K. (1995). Effect of wetting and drying of soil on sorption and biodegradation of atrazine. Weed Sci. 43, 298-305. Shomar B.H., Muller G. y Yahya A. (2006). Occurrence of pesticides in groundwater and topsoil of the Gaza Strip. Water, Air and Soil Poll. 171, 237-251. SIAVI (2012). Secretaría de Economía. México. (Sistema de Información Arancelaria Vía Internet). [en línea]. http://www.siavi.economia.gob.mx/. (Último acceso mayo 15, 2013). 83 Sorensen S.J., Bailey M., Hansen L.H., Kroer N. y Wuertz S. (2005). Studying plasmid horizontal transfer in situ: a critical review. Nature 3, 700-710. Steinheimer T.R. (1993). HPLC determination of atrazine and principal degradates in agricultural soils and associated surface and ground water. J. Agric. Food. Chem. 41, 588-595. Stewart I. y Loague K. (2004). Assessing ground water vulnerability with the type transfer function model in the San Joaquin Valley, California. Environ. Qual. 33, 1487-98. Strong L., McTavish H., Sadowsky M. y Wackett L. (2000). Field-scale remediation of atrazine-contaminated soil using recombinant Escherichia coli expressing atrazine chlorohydrolase. Environ. Microbiol. 2, 91-98. Struthers J.K., Jayachandran K. y Moorman T.B. (1998). Biodegradation of atrazine by Agrobacterium radiobacter J14a and use of this strain in bioremediation of contaminated soil. Appl. Environ. Microbiol. 64, 3368-3375. Tappe W., Groeneweg J. y Jantsch B. (2002). Diffuse atrazine pollution in German aquifers. Biodegradation 13, 3-10. Tyess D.L., Shea P.J. y Parkhurst A.M. (2006). Mineralization potential of atrazine and degradation intermediates from clustered characteristics in inoculated soils. Soil Sediment Contam. 15, 87-102. Udikovic N., Hrsak D., Mendas, G. y Filipcic D. (2003). Enrichment and characterization of atrazine degrading bacterial communities. Food Technol. Biotechnol. 41, 211-217. Udiković-Kolić N., Scott C. y Martin-Laurent F. 2012. Evolution of atrazine-degrading capabilities in the environment. Appl. Microbiol. Biotechnol. 96, 1175-89. UNEP (2001). Convenio de Estocolmo sobre contaminantes orgánicos persistentes. United Nations Environment Programme [en línea]. http://chm.pops.int. (Último acceso mayo 12, 2013). UNEP (2002). Central America and the Caribbean Regional Report, Regionally Based Assessment of Persistent Toxic Substances. United Nations Environment Programme. Ginebra, Suiza. 133 p. Ureña-Amate M.D., Socías-Viciana M., González-Pradas E. y Saifi M. (2004). Effects of ionic strength and temperature on adsorption of atrazine by a heat treated kerolite. Chemosphere 59, 69-74. USEPA (2003). Interim Reregistration Eligibility Decision for Atrazine. United States Environmental Protection Agency. Washington, D.C. 285 p. USEPA (2006). Decision Documents for Atrazine. Office of Prevention, Pesticides and Toxic Substances. United States Environmental Protection Agency. [en 84 A.M. Hansen et al. línea]. http://www.epa.gov/oppsrrd1/REDs/atrazine_ combined_docs.pdf. (Último acceso febrero 28, 2013) USEPA (2008). List of Drinking Water Contaminants & MCLs. United States Environmental Protection Agency. Washington, D.C. 15 pp. USEPA (2012). PESTAN (Pesticide Analytical Model). United States Environmental Protection Agency [en línea]. http://www.epa.gov/ada/csmos/models/pestan. html) (Último acceso julio 18, 2013). USEPA (2013). Basic Information about Atrazine in Drinking Water. United States Environmental Protection Agency. [en línea]. http://water.epa.gov/drink/ contaminants/basicinformation/atrazine.cfm. (Último acceso marzo 7, 2013). Vaishampayan P.A., Kanekar P.P. y Dhakephalkar P.K. (2007). Isolation and characterization of Arthrobacter sp. strain MCM B-436, an atrazine degrading bacterium, from rhizospheric soil. Internat. Biodet. Biodeg. 60, 273-278. Villada-Canela M. (2006). Estimación del riesgo de contaminar mantos freáticos por infiltración de herbicida atrazina en distritos de riego en México. Tesis de Maestría. Universidad Nacional Autónoma de México, Morelos, México. 128 p. Wackett L.P., Sadowsky M.J., Martinez B. y Shapir N. (2002). Biodegradation of atrazine and related striazine compounds: from enzymes to field studies. Appl. Microbiol. Biotechnol. 58, 39-45. Wang P. y Keller A.A. (2009). Sorption and desorption of atrazine and diuron onto water dispersible soil primary size fractions. Water Res. 43, 1448-1456. Wang X., Guo X., Yang Y., Tao S. y Xing B. (2011). Sorption mechanisms of phenanthrene, lindane, and atrazine with various humic acid fractions from a single soil sample. Environ. Sci. Technol. 45, 2124-2130. Wan-ting L. Hai-zhen W., Jian-mmg X. y Yan-Zheng G. (2005). Sorption of dissolved soils organic matter and its effects on the atrazine sorption on soil. Environ. Sci. 17, 478-48. Ware G. (2000). The pesticides book. 5a ed., Thomson Publications. Fresno, California, EUA, pp.123-145. WHO (2008). Guidelines for drinking-water quality. 3a ed. World Health Organization. Ginebra, Zuiza. 515 p. WHO (2011). Guidelines for drinking-water quality. 4a ed. World Health Organization. Ginebra, Suiza. Yamaguchi N., Ichijo T., Sakotani A., Baba T. y Nasu M. (2012). Global dispersion of bacterial cells on Asian dust. Sci. Rep. 2,525. doi: 10.1038/srep00525. Yanze-Kontchou C. y Gschwind N. (1994). Mineralization of the herbicide atrazine as a carbon source by a Pseudomonas strain. Appl. Environ. Microbiol. 60, 4297-302. Ye C.M., Gong A.J., Wang X.J., Zheng H.H. y Lei Z.F. (2001). Distribution of atrazine in a crop-soil- groundwater system at Baiyangdian Lake area in China. J. Environ. Sci-China 13, 148-152.