Fisicoquímica - Benemérita Universidad Autónoma de Puebla
Anuncio

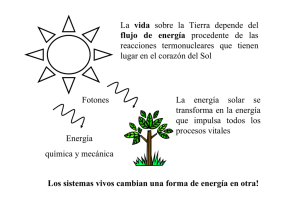
BENEMÉRITA UNIVERSIDAD AUTÓNOMA DE PUEBLA FACULTAD DE CIENCIAS QUÍMICAS LICENCIATURA: FARMACIA ÁREA ESPECÍFICA DE: FÍSICOQUÍMICA NOMBRE DE LA ASIGNATURA: FÍSICO-QUÍMICA I. (Termodinámica Química, Equilibrio Químico, Termodinámica de Soluciones. CÓDIGO: QUI-225 FECHA DE ELABORACIÓN: SEPTIEMBRE 2000 NIVEL EN EL MAPA CURRICULAR: BÁSICO TIPO DE ASIGNATURA: CIENCIA BÁSICA PROFESORES QUE PARTICIPARON EN SU ELABORACIÓN: ¾ Dra.Amparo O. Sánchez Sandoval ¾ Quím. Jaime González Carmona ¾ Quím. Pedro Soto Estrada ¾ Dr. Ramón Gudiño Fernández ¾ Dr. Roberto Portillo Reyes ¾ Quím. Andrés Camacho Iyáñez ¾ Quím. Eugenio López Gaspar HORAS DE TEORIA: 5 ¾ Quím. Carlos K. Noda y Domínguez ¾ L. en C. Héctor Mendoza Hernández ¾ Dr. Juan Carlos Ramírez García ¾ M. en C. Hilda Lima Lima ¾ Dr. Gelasio Aguilar Armenta ¾ Dr. Henoc Flores Segura HORAS PRÁCTICA: 2 CRÉDITOS: 12 PRE-REQUISITOS: Sin requisitos RECOMENDACIONES: Se recomienda que los alumnos tengan conocimientos previos de Física molecular, dinámica de partículas, electricidad, álgebra, cálculo diferencial e integral y química general. PRESENTACION GENERAL DEL PROGRAMA La clasificación de las ciencias se basa en la clasificación del movimiento de la materia, sus relaciones mutuas y diferencias. Por lo que, para señalar los límites entre la Fisicoquímica de la Física y la Química, es necesario estudiar la relación y diferencia entre las formas químicas y físicas del movimiento. Para la forma química del movimiento, es decir, para un proceso químico, es característica la variación del número y posición de los átomos en las moléculas de las sustancias reaccionantes. Entre muchas formas físicas del movimiento (Campo electromagnético, física de los núcleos atómicos, etc. ), la forma del movimiento intramolecular tiene una vinculación muy íntima con los procesos químicos (oscilación molecular, excitación electrónica y la ionización). El proceso químico más sencillo, la reacción elemental de disociación térmica, tiene lugar al crecer la intensidad (Amplitud y energía) de las oscilaciones en la molécula, especialmente, las oscilaciones de los núcleos a lo largo del enlace de valencia entre los mismos. El enlace de cierta magnitud crítica de la energía de oscilación, lleva a la ruptura de este enlace y a la disociación de la molécula en dos partes. Reacciones más complejas con la participación de varias moléculas (por lo general dos), se pueden considerar como la unión de dos moléculas en el choque de las mismas, en un complejo poco resistente y de corta vida (llamado complejo activado) y la desintegración, que sobreviene, de este complejo en moléculas nuevas, ya que este complejo resulta inestable, por enlaces determinados, cuando hay oscilaciones interiores. Así, la reacción química elemental resulta un punto particular, crítico del movimiento oscilatorio de la molécula. Este último, de por sí, no puede ser considerado movimiento químico, sin embargo, éste es fundamental para los procesos químicos primarios. Para transformaciones químicas de masas considerables de sustancias, es decir, de un conjunto de moléculas, son necesarios choques entre las moléculas e intercambio de energía entre las mismas. Así, el proceso químico real está íntimamente ligado al movimiento caótico de las moléculas de los sistemas macroscópicos, el cual frecuentemente se llama movimiento térmico. De manera particular, para este curso, sobre la base de las leyes de la termodinámica general, se expresan las leyes del equilibrio químico y la teoría de los equilibrios de fase, la cual, se llama regla de las fases. La termoquímica es una parte de la termodinámica química, en la cual se estudian los efectos térmicos de las reacciones químicas. La teoría de las disoluciones tiene como fin el esclarecimiento y predicción de las propiedades de las disoluciones, en función de las propiedades de las sustancias que forman la disolución. OBJETIVOS GENERALES DEL CURSO Desarrollar una explicación teórica de las leyes de la Termodinámica y hacer deducciones de ellas, conduciendo a un avance de la materia en concordancia con el método científico. Conocer las Leyes de la Termodinámica y sus aplicaciones en el Área químico– biológica. Conocer los límites de las teorías desarrolladas en la Termodinámica. Desarrollar la capacidad de resolución de problemas. Estudiar el paso de energía de un cuerpo a otro y de una forma a otra y su relación con los procesos biológicos. Estudiar los efectos energéticos de los procesos físicos y químicos que tienen lugar en condiciones diversas. Medir los cambios energéticos relacionados con las reacciones químicas determinando la extensión a la cual se verifican, así como el estudio de los efectos de los cambios en los factores involucrados en las reacciones. Estudiar las transformaciones químicas y fisicoquímicas de los procesos en los cuales la estructura o composición química varía. Establecer los conceptos por los cuales se estudia el equilibrio químico, con aplicaciones en la química, farmacia y biología. Construir e interpretar diagramas de equilibrio líquido - vapor saturado. CONTENIDO Y ESQUEMA DEL CURSO CAPÍTULO I. INTRODUCCIÓN TEMAS I-1. Definiciones (termodinámica, sistema, etapa, alrededores, equilibrio, etc.). I-2. Funciones fundamentales y sus unidades (longitud, volumen, fuerza, presión, energía, etc). I-3. Propiedades intensivas y extensivas (clasificación de las propiedades anteriores). I-4. Diagramas de fase de una sustancia pura (diagramas de PT y PV). I-5. Reglas de las fases. OBJETIVO DE LA UNIDAD: Establecer el lenguaje termodinámico que permita al estudiante simplificar su estudio y aplicación en los procesos naturales ligados a procesos químicos, farmacéuticos y biológicos CAPÍTULO II. PRIMER PRINCIPIO DE LA TERMODINÁMICA TEMAS: II-1. Energía Interna, calor, trabajo y temperatura (Ley Cero). II-2. Funciones de Estado y de trayectoria (clasificación de las funciones anteriores). II-3. Estado termodinámico (equilibrio termodinámico). II-4. Reversibilidad termodinámica. II-5. Trabajo de expansión - compresión. II-6.Trabajo para procesos isobáricos, isotérmicos, isocóricos y adiabáticos. II-7. Limitaciones de la termodinámica. II-8. Primer Principio de la Termodinámica. II-9. Primer principio para sistemas cerrados. II-10. Definición de Entalpía. II-11. Capacidad calorífica a volumen y presión constante. II-12. Procesos a volumen constante ( U = QV). II-13. Procesos a presión constante ( H = QP). II-14. Transferencia de calor que solo provoca cambio en la temperatura. II-15. Variación de la Entalpía en un cambio de fase (Calor latente). II-16. Aplicación del primer principio a gases ideales y sistemas sencillos. OBJETIVOS DE LA UNIDAD: ¾ Formular la primera ley de la termodinámica en palabras y mediante símbolos. ¾ Explicar a la magnitud, energía interna, como una función característica de la primera ley. ¾ Definir la capacidad calorífica de un sistema, establecer y justificar las definiciones de capacidad calorífica a presión y volumen constantes. CAPÍTULO III. TERMOQUÍMICA TEMAS: III-1. Calor de reacción (Ley de la conservación de masa, energía). III-2. Calor de formación. III-3. Calor de combustión. III-6. Determinación del calor de reacción a 25° C. III-7. Relación entre U y H para una reacción. III-8. Energía de enlace. III-9. Calor de reacción en función de la temperatura (determinación de calores de reacciones a temperaturas diferentes de 25° C). OBJETIVOS DE LA UNIDAD: ¾ Definir reacciones endotérmicas y exotérmicas. ¾ Establecer, deducir y usar la Ley de Hess. ¾ Definir las entalpías de combustión, hidrogenación, sublimación, vaporización, fusión, disolución y solvatación y su aplicación en los procesos químicos, farmacéuticos y biológicos. CAPÍTULO IV. SEGUNDO PRINCIPIO DE LA TERMODINÁMICA TEMAS: IV-1. Procesos espontáneos y no espontáneos. IV-2. Segundo Principio de la Termodinámica (Postulados). IV-3. Máquinas térmicas y Ciclo de Carnot. IV-4. Entropía. IV-5. Cambios de entropía en un gas ideal. IV-6. Cambios de entropía en los cambios de fase. IV-7. Cálculos de entropía para procesos irreversibles. IV-8. Interpretación molecular de la entropía (carácter estadístico). IV-9. Entropía y vida. IV-10. Postulado de Planck (tercera ley de la termodinámica). OBJETIVOS DE LA UNIDAD: ¾ Establecer el criterio para la dirección de cambio espontáneo y la segunda ley de la termodinámica. ¾ Definir el cambio de entropía para un sistema de referencia y utilizarla para deducir la expresión del cambio de entropía en cualquier sistema. ¾ Establecer y utilizar una expresión para el cambio de entropía del medio ambiente. ¾ Explicar que la entropía es una función característica para procesos químicos. farmacéuticos y biológicos. CAPÍTULO V. APLICACIONES DEL SEGUNDO PRINCIPIO DE LA TERMODINÁMICA TEMAS: V-1. Entropía y equilibrio. V-2. Energía Libre de Helmholtz. V-3. Energía Libre de Gibbs (Potencial Isobárico). V-4. ∆F y ∆G como criterios de equilibrio y espontaneidad. V-5. Relaciones termodinámicas de un sistema de equilibrio. V-6. Dependencia de la Energía Libre de Gibbs con la temperatura. OBJETIVO DE LA UNIDAD: ¾ Definir las funciones de Helmholtz y de Gibbs y utilizarlas para explicar los criterios de espontaneidad, así como su aplicación en Farmacia y Biología. CAPÍTULO VI. EQUILIBRIO QUÍMICO TEMAS: VI-1. Relaciones termodinámicas para sistemas con composición variable. VI-2. Potencial químico. VI-3. Condiciones generales del equilibrio químico. VI-4. Potencial isobárico de una reacción. VI-5. Equilibrio químico para reacciones que involucran gases ideales. VI-6. Ley de acción de las masas. VI-7. Constante de equilibrio en función de la temperatura. VI-8. Ley del desplazamiento del equilibrio. VI-9. Equilibrio para disoluciones ideales. VI-10. Equilibrio para sistemas no ideales (fugacidad y actividad). VI-11. Desarrollar la ecuación de Henderson- Hasselbalch OBJETIVO DE LA UNIDAD: ¾ Estudiar los conceptos relacionados con el equilibrio químico y sus aplicaciones en las reacciones químicas y explicar las relaciones que guarda el equilibro químico con los procesos químico – biológicos. CAPÍTULO VII. DISOLUCIONES DE NO ELECTROLITOS TEMAS: VII-1. Definición. VII-2. Acción recíproca intermolecular de las disoluciones y teorías de las disoluciones. VII-3. Concepto de disolución ideal (Leyes de Raoult y Henry). VII-4. Desviaciones de la idealidad. VII-5. Potenciales químicos de los componentes de una disolución ideal y diluida ideal. VII-6. Diagramas de equilibrio Líquido - Vapor en disoluciones binarias. Primera y Segunda Leyes de Konovalov. Destilación fraccionada y mezclas azeotrópicas. VII-7. Propiedades coligativas. Ø Determinación de masas moleculares. Ø La ósmosis y la presión osmótica en biología y farmacia. VII-8. Efecto de Donan OBJETIVOS DE LA UNIDAD: ¾ Establecer las Leyes de Raoult y Henry. ¾ Explicar las desviaciones que presenta las disoluciones reales, así como las leyes y aplicaciones de los equilibrio líquido – vapor saturado. ¾ Explicar el término de propiedades coligativas y dar ejemplos de ellas. METODOLOGÍA: Los métodos fundamentales de la Fisicoquímica, naturalmente, son los métodos de la Física y de la Química. Esto es, ante todo, el método experimental, la investigación de la dependencia entre las propiedades de las sustancias y las condiciones externas y el estudio experimental de las leyes del desarrollo de las reacciones con el tiempo y las leyes del equilibrio químico. La interpretación teórica del material experimental y la creación de un sistema armonioso de los conocimientos de las propiedades y de las leyes de las reacciones químicas se basa en los siguientes métodos: El método mecanocuántico, es la base del estudio de la estructura y propiedades de los átomos y moléculas aislados, compuesta de un conjunto de moléculas aisladas, así como de su acción recíproca. El método de la mecánica estadística es el que da la posibilidad de calcular las propiedades de una sustancia, compuesta de un conjunto de moléculas (propiedades “macroscópicas”), en función de los datos sobre las propiedades de moléculas individuales. El método termodinámico permite relacionar cuantitativamente las distintas propiedades de una sustancia (propiedades “macroscópicas”) y calcular algunas de estas propiedades sobre la base de magnitudes experimentales de otras propiedades. El método de la Cinética Química es la evolución en el tiempo de los sistemas que reaccionan químicamente; es decir, la medida e interpretación de las velocidades de reacción. La información que se obtiene establece una base cuantitativa por la que se fundamentan todas las teorías sobre reactividad química, por lo que la cinética química constituye un instrumento para la búsqueda de nuevos conocimientos sobre el comportamiento molecular, es esencial en la investigación y desarrollo de nuevos procesos. El método de los fenómenos de superficie estudia la regulación de estos fenómenos e interacciones en la naturaleza, así como para controlarlos en la técnica. Las investigaciones fisicoquímicas contemporáneas en cualquier rama concreta se caracterizan por la aplicación de métodos experimentales y teóricos variados, para el estudio de las diferentes propiedades de las sustancias y el esclarecimiento de su relación con la estructura de las moléculas. Con todo esto se alcanza el fin fundamental: el esclarecimiento de la dependencia de la dirección, velocidad y límites del desarrollo de las transformaciones químicas con respecto a las condiciones exteriores y a la estructura de las sustancias, que participan en las reacciones químicas. La resolución de problemas permite al estudiante explicar de manera explicita los conceptos que se dan en cada capítulo, por lo que su resolución se hará en tres sesiones de prácticas de laboratorio, esto nos obliga a ser más responsables en su aplicación. Se utilizarán diversas estrategias para abordar los temas, presentación de clase por el maestro haciendo participar a los alumnos con preguntas relacionadas con el tema, se resolverán problemas en clase, donde los alumnos apliquen los conocimientos adquiridos, se dejarán tareas que serán discutidas en clase, lectura y discusión de artículos relacionados con el tema. INSTRUMENTACIÓN DIDÁCTICA A UTILIZAR: Proyectores de Acetatos Computadoras Cañón de video Pizarrón Material bibliográfico y multimedia Uso de laboratorio CRITERIOS DE EVALUACIÓN: Se realizarán tres exámenes parciales (además se tomará en cuenta tareas, participación, asistencia, exposiciones, etc.) Se considerará la calificación de laboratorio el cual se evaluará considerando asistencias (100%), puntualidad, calificación de reportes, tareas, seminarios, etc. Se tomará cada una de la siguiente manera: 75% de la calificación de teoría y 25 % de la calificación de laboratorio. BIBLIOGRAFÍA BÁSICA: 1. -YA. Guerasimov; Curso de Química Física, Edit. Mir, Moscú, (1971). 2. -Ira N. Levin; Fisicoquímica; 4ª. Ed., Edit. McGraw-Hill, (1996). 3. -P. Sanz Pedrero; Fisicoquímica para Farmacia y Biología; Edit. Masson-Salvat, (1992). 4. -Atkins; Fisicoquímica; 5a. Ed., Edit. W.H. Freeman, New York, (1994). BIBLIOGRAFÍA COMPLEMENTARIA: 1. -F. Daniels, R.A. Alberty ; Tr. A Eroles Gómez; Fisicoquimica; Edit. CECSA, México, (1985). 2. -Gilbert W. Castellan; Fisicoquímica; Edit. Adisson-Wesley Longman, (1998). 3. -J. G. Morris, Fisicoquímica para biólogos: conceptos básicos para las facultades de medicina, farmacia y biología, 2ª. Ed., Edit. Reverté, Barcelona, (1982)