EL AGUA:
Anuncio
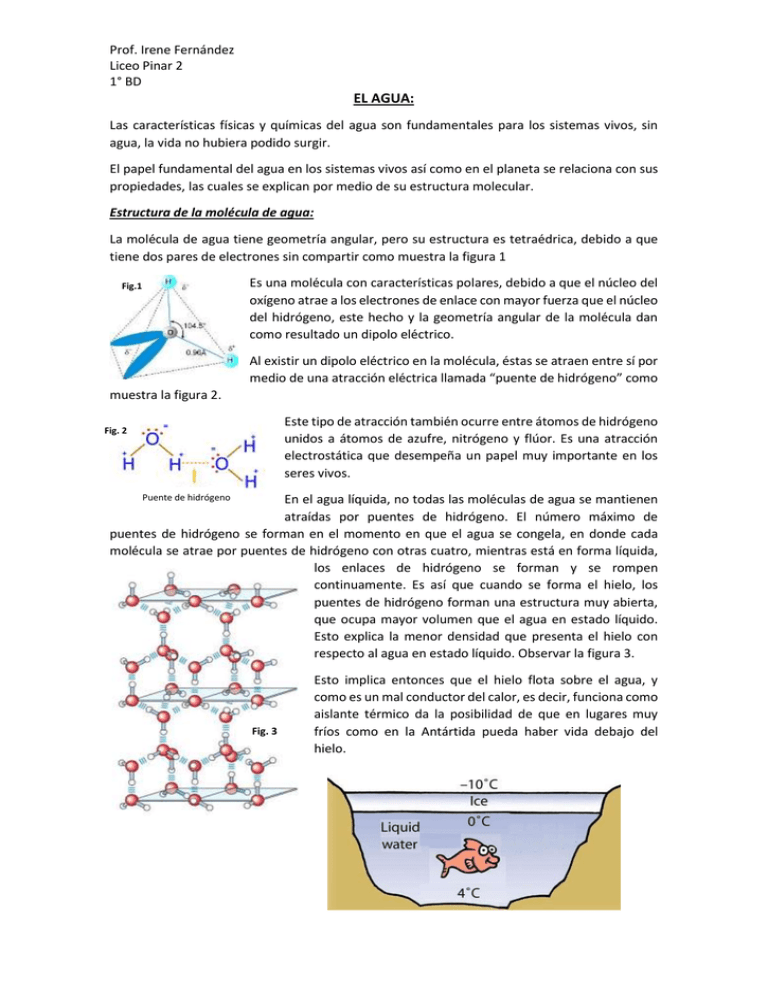
Prof. Irene Fernández Liceo Pinar 2 1° BD EL AGUA: Las características físicas y químicas del agua son fundamentales para los sistemas vivos, sin agua, la vida no hubiera podido surgir. El papel fundamental del agua en los sistemas vivos así como en el planeta se relaciona con sus propiedades, las cuales se explican por medio de su estructura molecular. Estructura de la molécula de agua: La molécula de agua tiene geometría angular, pero su estructura es tetraédrica, debido a que tiene dos pares de electrones sin compartir como muestra la figura 1 Es una molécula con características polares, debido a que el núcleo del oxígeno atrae a los electrones de enlace con mayor fuerza que el núcleo del hidrógeno, este hecho y la geometría angular de la molécula dan como resultado un dipolo eléctrico. Fig.1 Al existir un dipolo eléctrico en la molécula, éstas se atraen entre sí por medio de una atracción eléctrica llamada “puente de hidrógeno” como muestra la figura 2. Este tipo de atracción también ocurre entre átomos de hidrógeno unidos a átomos de azufre, nitrógeno y flúor. Es una atracción electrostática que desempeña un papel muy importante en los seres vivos. Fig. 2 Puente de hidrógeno En el agua líquida, no todas las moléculas de agua se mantienen atraídas por puentes de hidrógeno. El número máximo de puentes de hidrógeno se forman en el momento en que el agua se congela, en donde cada molécula se atrae por puentes de hidrógeno con otras cuatro, mientras está en forma líquida, los enlaces de hidrógeno se forman y se rompen continuamente. Es así que cuando se forma el hielo, los puentes de hidrógeno forman una estructura muy abierta, que ocupa mayor volumen que el agua en estado líquido. Esto explica la menor densidad que presenta el hielo con respecto al agua en estado líquido. Observar la figura 3. Fig. 3 Esto implica entonces que el hielo flota sobre el agua, y como es un mal conductor del calor, es decir, funciona como aislante térmico da la posibilidad de que en lugares muy fríos como en la Antártida pueda haber vida debajo del hielo. Prof. Irene Fernández Liceo Pinar 2 1° BD Propiedades del agua relacionadas con su estructura: 1. Propiedades térmicas: El agua tiene una elevada capacidad calorífica, esto significa que tiene la capacidad de absorber grandes cantidades de calor y aumentar poco su temperatura, por lo tanto, es un excelente refrigerante. El punto de ebullición del agua es elevado, comparado con los compuestos que tienen fórmula similar a ella. 2. Elevada tensión superficial: Se denomina tensión superficial de un líquido a la cantidad de energía necesaria para aumentar su superficie por unidad de área. Esto implica que un líquido tiene una resistencia para aumentar su superficie. La elevada tensión superficial del agua permite, por ejemplo que los mosquitos puedan caminar sobre su superficie, y es por lo cual, cuando nos zambullimos en ella, debemos vencer su superficie con las manos en forma de cuña. 3. Propiedades disolventes: El agua se considera un solvente universal, es decir, disuelve sustancias polares y iónicas. Las sustancias polares, como por ejemplo el alcohol y el azúcar se disuelven por formación de puentes de hidrógeno. Prof. Irene Fernández Liceo Pinar 2 1° BD Fig.5 Fig4 En la figura 4 se observa cómo la sal (compuesto iónico) se disuelve en agua. Claramente se observa que el agua vence las fuerzas de atracción entre los iones que forman el cristal de sal, rodeando a los cationes y aniones de forma diferente, se dice entonces que estos iones están solvatados, y a el conjunto de moléculas de agua que rodea a cada ion se llama esfera de solvatación. En la figura 5 se observa cómo se disuelve un sólido molecular en el agua. Las moléculas de este sólido tienen carácter polar y además cuentan en su estructura con grupos OH. Ejercicios: 1. Explica por qué el hielo flota sobre el agua. 2. El punto de ebullición normal del agua es 100°C, este valor es muy elevado comparado con los puntos de ebullición de los compuestos formados por hidrógeno y un elemento del grupo 16. Explica por qué ocurre esto. 3. ¿Qué diferencia observas entre la esfera de solvatación del catión y del anión en la figura 4?




