Resumen ASOVAC2012-Hidroboración
Anuncio

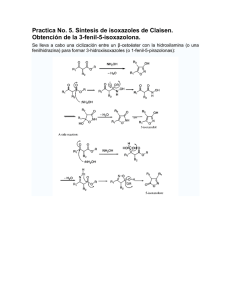
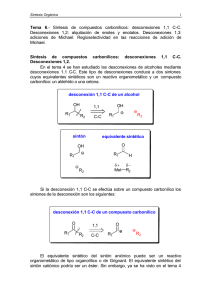
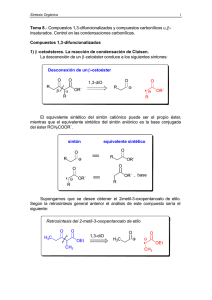
Reacciones de Hidroboración/Oxidación en androstanos como intermediarios para la modificación estructural de esteroides Neacato P., Alvarado R., Cabrera G. Centro de Química Orgánica. Lab. de Productos Naturales, Escuela de Química, Facultad de Ciencias, UCV. Introducción Aunque muchos compuestos esteroidales del tipo androstano han sido ampliamente investigados, nuestro interés se debe a que trabajos en conjunto entre el Laboratorio de Productos Naturales de la Facultad de Ciencias (UCV) y el Instituto de Biomedicina de Facultad de Medicina (UCV) sobre el uso de androstanos como antivirales, in vitro, específicamente contra el dengue hemos encontrado resultados interesantes1. En tal sentido, se ha planteado realizar transformaciones sobre el anillo B de la Dehidroepiandrosterona con el propósito de estudiar el comportamiento de los productos generados por dichas modificaciones como agentes antivirales. Objetivo Llevar a cabo reacciones de hidroboración/oxidación en ∆5 de la Dehidroepiandrosterona. Metodología La secuencia de síntesis se inició con la protección del grupo hidroxilo (acetilación), seguido por la cetalización del carbonilo de la Dehidroepiandrosterona. En el próximo paso se llevó a cabo la hidroboración/oxidación para formar el alcohol correspondiente2. Para la hidroboración3, el diborano se generó a partir de un goteo lento de iodo en metanol al borohidruro de sodio con agitación constante. El diborano generado, arrastrado por una corriente de CO2, se hizo reaccionar con el esteroide protegido el cual estaba disuelto en THF, el diborano excedente se atrapó en una trampa de H2O2. La reacción se llevó a cabo durante un periodo de dos horas. Transcurrido el tiempo de reacción se dejó reposar el alquilborano durante una hora adicional. Posteriormente, se adicionó una solución de peróxido de hidrógeno 30% gota a gota y una solución de NaOH 5% con agitación durante una hora para completar la oxidación del compuesto. Resultados La esterificación del grupo oxidrilo se llevó a cabo con un buen rendimiento (93%). Sin embargo, no fue así para la protección del grupo carbonilo, el rendimiento de la cetalización cayó a un 40%. Esto se debe, básicamente, al impedimento estérico que genera la presencia del Me-18 angular. En el caso de la hidroboración/oxidación, esta se llevó a cabo en una corriente de CO2. La reacción fue regioespecífica, se hidroxilo C-6, con un rendimiento del 45% O CH O CH 3 CH3 CH 3 CH3 3 Anhídrido Acético O Py O CH 3 CH3 OEt OEt CH3 O H C 1.- (CH3CO)2O/py 3 HO 2.- EtOH/H+ HO MeCOO CH CH 3 O 3 O 1.- B2H6/THF 2.- H2O2/NaOH CH 3 CH 3 CH3 OH O H C 3 CH3 OEt OEt O CH3 HO MeCOO OH Conclusión La introducción de un grupo hidroxilo en el C-6 en un androstano, activa no sólo esta posición sino que además posibilita una serie de modificaciones en el anillo B. Entre las cuales podríamos mencionar: formación del carbonilo por oxidación, expansión del anillo generando lactamas o lactonas, o la formación de un sistema α,β-conjugado. Referencia 1.- Rodríguez-Ortega M., Paredes A., Cabrera G. Efecto del colesterol y sus derivados en la replicación del virus dengue 2. LVI Convención Anual de ASOVAC, Cumaná, 2006. 2.- Neacato, P. Síntesis de derivados de androstanos como posibles agentes antivirales. Trabajo Especial de Grado, Facultad de Ciencias, UCV (2007). 3.- Dollé F., Hetru C., and Luu B. 1991. A new route to precursors of ecdysteroids using a region- and stereoselective hydroboration, Tetrahedron, 47(34): 7059-7066.