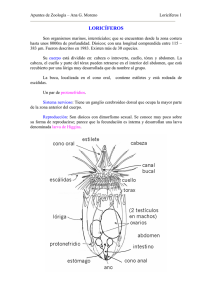
MARCAS METALICAS - Pontificia Universidad Javeriana
Anuncio

CICLO DE VIDA DE LA MARIPOSA DE “MARCAS METALICAS”: Mesosemia mevania (LEPIDOPTERA: RIODINIDAE) EN EL PARQUE ECOLOGICO PIEDRAS BLANCAS, COLOMBIA ANA MARÍA VÉLEZ ARANGO PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS CARRERA DE BIOLOGÍA Bogotá D.C. Noviembre de 2005 CICLO DE VIDA DE LA MARIPOSA DE “MARCAS METALICAS”: Mesosemia mevania (LEPIDOPTERA: RIODINIDAE) EN EL PARQUE ECOLOGICO PIEDRAS BLANCAS, COLOMBIA ANA MARÍA VÉLEZ ARANGO TRABAJO DE GRADO Presentado como requisito parcial Para optar por el título de BIOLOGO Patricia Duque Vélez DIRECTOR PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS CARRERA DE BIOLOGÍA Bogotá D.C. Noviembre de 2005 NOTA DE ADVERTENCIA Artículo 23 de la Resolución Nº 13 de Julio de 1946 “La Universidad no se hace responsable por los conceptos emitidos por sus alumnos en sus trabajos de tesis. Solo velará por que no se publique nada contrario al dogma y a la moral católica y por que las tesis no contengan ataques personales contra persona alguna, antes bien se vea en ella el anhelo de buscar la verdad y la justicia”. Bogotá 23 de enero de 2005 Señores PONTIFICIA UNIVERSIDAD JAVERIANA Bogotá Estimados señores: Yo Ana María Vélez Arango identificada con C.C. No 52 928 506 de Bogotá, autor del trabajo de grado titulado “Ciclo de vida de la mariposa de “marcas metálicas” Mesosemia mevania (Lepidoptera: Riodinidae) en el Parque Ecológico Piedras Blancas, Colombia”, presentado como requisito para optar al título de Biólogo en el año 2006; autorizo a la Pontificia Universidad Javeriana a: a) Reproducir el trabajo en medio digital o electrónico con el fin de ofrecerlo para consulta en la Biblioteca General. Si b) Poner a disposición para la consulta con fines académicos, en la página web de la Facultad, de la Biblioteca General y en redes de información con las cuales tenga convenio la Universidad Javeriana. Si c) Enviar en formato impreso o digital, en caso de que sea seleccionado para participar en concursos de trabajos de grado. Si d) Distribuir ejemplares de la obra, para la consulta entre las entidades educativas con las que la facultad tenga convenio de intercambio de información, para que este sea consultado en las bibliotecas y centros de documentación de las respectivas entidades. Si e) Todos los usos, que tengan finalidad académica. Si Los derechos morales sobre el trabajo son de los autores de conformidad con lo establecido en el artículo 30 de la Ley 23 de 1982 y el artículo 11 de la Decisión Andina 351 de 1993, los cuales son irrenunciables, imprescriptibles, inembargables e inalienables. Atendiendo a lo anterior, siempre que se consulte la obra, mediante cita bibliográfica se debe dar crédito al trabajo y a su autor. Este documento se firma, sin perjuicio de los acuerdos que el autor pacte con la Unidad Académica referentes al uso de la obra o a los derechos de propiedad industrial que puedan surgir de la actividad académica. _______________________ Ana María Vélez Arango C.C. 52 928506 de Bogotá CICLO DE VIDA DE LA MARIPOSA DE “MARCAS METALICAS”: Mesosemia mevania (LEPIDOPTERA: RIODINIDAE) EN EL PARQUE ECOLOGICO PIEDRAS BLANCAS, COLOMBIA ANA MARÍA VÉLEZ ARANGO APROBADO __________________________ ___________________________ Patricia Duque Vélez, Museo Fabio Gómez Delgado, Profesor Entomológico Piedras Blancas Director Departamento de Biología Pontificia Universidad Javeriana Asesor ___________________________ Edison Valencia Bayer Crop Science Jurado ___________________________ Edison Valencia Profesor Facultad de Agronomía Universidad Nacional de Colombia Jurado CICLO DE VIDA DE LA MARIPOSA DE “MARCAS METALICAS”: Mesosemia mevania (LEPIDOPTERA: RIODINIDAE) EN EL PARQUE ECOLOGICO PIEDRAS BLANCAS, COLOMBIA ANA MARÍA VÉLEZ ARANGO APROBADO __________________________ ___________________________ Ángela Umaña, MPhil. Cecilia Espíndola, Bióloga Decana Académica Directora de Carrera AUTOR Apellidos Vélez Arango Nombres Ana María DIRECTOR Apellidos Duque Vélez Nombre Patricia ASESOR Apellidos Gómez Delgado Nombre Fabio TRABAJO DE GRADO PARA OPTAR POR EL TÍTULO DE: Biólogo TÍTULO COMPLETO DEL TRABAJO: “Ciclo de vida de la “mariposa de marcas metálicas” Mesosemia mevania (Lepidoptera: Riodinidae) en el Parque Ecológico Piedras Blancas, Colombia”. FACULTAD: Ciencias PROGRAMA: Carrera NOMBRE DEL PROGRAMA: Biología CIUDAD: Bogotá AÑO DE PRESENTACIÓN DEL TRABAJO: 2006 NÚMERO DE PÁGINAS: 70 TIPO DE ILUSTRACIONES: - Ilustraciones - Tablas y gráficos - Fotografías DESCRIPTORES O PALABRAS CLAVE: ciclo de vida, Mesosemia mevania, planta hospedera, Notopleura macrophylla, Riodinidae. RESUMEN DEL CONTENIDO: Se describe el ciclo de vida de Mesosemia mevania a partir de 132 huevos colectados en campo sobre Notopleura macrophylla (Rubiaceae), entre el 5 de abril y el 24 de mayo de 2005 en el Parque Ecológico Piedras Blancas, Antioquia, Colombia. Para cada estadío se tomaron datos de duración y longitud, para los adultos se observó el dimorfismo sexual, la proporción de sexos y se midió la envergadura alar. Adicionalmente, se realizó una tabla de superviviencia para determinar la mortalidad de cada estadío. Para determinar el modo de distribución de la planta hospedera se realizó un índice de dispersión. Se encontró una duración promedio del ciclo de vida de 77.4 días. La mayor mortalidad la presentaron las larvas del primer estadío, seguido de los huevos. Se observó una postura con diez huevos parasitada por avispas Scelionidae. El índice de dispersión de la planta hospedera mostró una distribución agrupada. TABLA DE CONTENIDO 1. Introducción 1 2. Marco teórico y revisión de literatura 3 2.1. Antecedentes 3 2.2. Familia Riodinidae 6 2.3. Ciclo de vida 9 2.4. Planta hospedera 3. Formulación del problema y justificación 14 16 3.1. Formulación del problema 16 3.2. Pregunta de investigación 16 3.3. Justificación 16 4. Objetivos 18 5. Materiales y métodos 19 5.1. Área de estudio 19 5.2. Diseño de la investigación 19 5.2.1. Población de estudio y muestra 5.3. Métodos 20 20 5.3.1. Ciclo de vida 20 5.3.2. Planta hospedera 23 5.4. Recolección de la información 23 5.5. Análisis de la información 24 6. Resultados y discusión 6.1. Ciclo de vida 27 27 6.1.1. Descripción morfológica de cada estadio 30 6.1.2. Observaciones biológicas 43 6.1.3. Enemigos naturales 46 6.2. Tabla de vida 46 6.3. Planta hospedera 49 7. Conclusiones 50 8. Recomendaciones 51 9. Referencias 52 Índice de Tablas Tabla 1. Planilla para la toma de datos del ciclo de vida de cada 24 individuo Tabla 2. Tabla de supervivencia 25 Tabla 3. Duración de cada uno de los estadios de M. mevania 28 Tabla 4. Promedio y desviación estándar de la longitud inicial, 28 longitud final y ancho de la cápsula cefálica para cada uno de los estadios de M. mevania Tabla 5. Tabla de supervivencia de M. mevania 47 Índice de Figuras Figura 1. a. Huevo. b. Larva I. c. Larva II. d. Larva III. e. Larva IV. 31 f. Larva V. g. Prepupa. h. Pupa. i. Macho adulto vista dorsal. j. Macho adulto vista ventral. Figura 2. a. Huevo. b. Larva III. c. Pupa. d. Macho adulto 32 Figura 3. Curva de supervivencia de M. mevania 48 RESUMEN Se describe el ciclo de vida de Mesosemia mevania a partir de 132 huevos colectados en campo sobre Notopleura macrophylla (Rubiaceae), entre el 5 de abril y el 24 de mayo de 2005 en el Parque Ecológico Piedras Blancas, Antioquia, Colombia. Para cada estadío se tomaron datos de duración y longitud, para los adultos se observó el dimorfismo sexual, la proporción de sexos y se midió la envergadura alar. Adicionalmente, se realizó una tabla de superviviencia para determinar la mortalidad de cada estadío. Para determinar el modo de distribución de la planta hospedera se realizó un índice de dispersión. Se encontró una duración promedio del ciclo de vida de 77.4 días. La mayor mortalidad la presentaron las larvas del primer estadío, seguido de los huevos. Se observó una postura con diez huevos parasitada por avispas Scelionidae. El índice de dispersión de la planta hospedera mostró una distribución agrupada. PALABRAS CLAVES: ciclo de vida, Mesosemia mevania, planta hospedera, Notopleura macrophylla, Riodinidae ABSTRACT The life cycle of Mesosemia mevania is described starting form eggs collected in field on Notopleura macrophylla (Rubiaceae). For each stage we took duration and longitude, additionally we achieved a life table to determine the mortality of each stage. To determine the distribution of the host plants accomplished a dispersion index. The final average duration of the cycle was 77.3 days. The greater mortality was in the caterpillar of the first instar, followed by eggs. One posture was parasitized by wasps of the family Scelionidae. The host plant shows a cluster distribution. KEY WORDS: host plant, life cycle, Mesosemia mevania, Notopleura macrophylla, Riodinidae 1. INTRODUCCIÓN El género Mesosemia (Hübner 1819), uno de los más frecuentemente observados de la familia Riodinidae, comprende alrededor de 100 especies encontradas desde México a través de América Central y Suramérica, con una gran concentración de especies en el Amazonas. Son frecuentemente observadas en el bosque por su forma particular de desplazarse con pequeños saltos sobre las hojas. Son mariposas de tamaño pequeño, reconocidas por la forma de sus alas algo cuadradas, y la presencia de ocelos que contienen pequeñas manchas oculares en las alas anteriores. Una de las especies comúnmente vistas en nuestro medio, en el sotobosque es Mesosemia mevania (Hewitson 1857) la cual se distribuye en Venezuela, Ecuador, Perú y en el occidente de Colombia se encuentra en las tres cordilleras, en la costa Pacifica, valle de los ríos Cauca y Magdalena, desde los 100 hasta y 2400 msnm. En el Valle del Cauca se han encontrado como sus plantas hospederas a las Rubiaceae Psychotria poeppigina, P. macrophilla y Palycurea angustifolia. A pesar de que Mesosemia es uno de los géneros más diversos entre los Riodinidae, es uno de los menos conocidos en cuanto a su biología y estados inmaduros. Hasta la fecha no se conoce una descripción detallada del ciclo de vida de sus especies y puntualmente para Mesosemia mevania no se han descrito incluso sus estados inmaduros, por esta razón esta investigación pretende describir los estados larvales, el ciclo de vida y plantas hospederas de Mesosemia mevania en el Parque Ecológico Piedras Blancas. 1 Adicionalmente, esta investigación es un aporte para los proyectos sobre cría de mariposas nativas que se están adelantando en el Parque Ecológico Piedras Blancas, donde se proyecta construir un mariposario con fines educativos y recreativos. 2 2. MARCO TEÓRICO Y REVISIÓN DE LITERATURA 2.1. Antecedentes La mayoría de estudios de ciclos de vida realizados en Lepidoptera han sido sobre polillas ya que son plagas importantes en plantas de interés económico, en cuanto a especies de mariposas diurnas se han realizado estudios de ciclos de vida en Papua Nueva Guinea para los Nymphalidae Eliminas agondas glaucopsis (Merret 1993), Tanaeris artemis staudingeri, T. catops westwoodi y T. myops wahnesi (- 1996), en Australia para Sabera fuliginosa (Hesperiidae) (Müller & Wood 1999). En Malasia para Papilionidae Trogonoptera brookiana albescens (Goh 1994). En Norte América los Nymphalidae Anthanassa texana seminole (Watts & Habeck 1991) y Phyciodes phaon (Genc et al. 2003). En el Neotrópico en Trinidad los Nymphalidae Morpho peleides insularis (Urich & Emmel 1991a), Dynastor macrosiris (Urich & Emmel 1991b); en Republica Dominicana para Nymphalidae Anetia briarea (Browser et al 1992); en Puerto Rico los Pieridae Dismorphia spio (Torres Bauzá 1991a), Eurema portoricensis (Torres-Bauzá 1991b) y Eurema leuce antillarum (Torres Bauzá 1999); en México Anetia thirza thirza (Nymphalidae) (Llorente-Bousquets et al. 1993); en Costa Rica para los Nymphalidae Manataria maculata (Murillo & Nishida 2003) y Caligo atreus (Calvo 1999), y Pieridae Dismorphia virgo (Young 1972). En Suramérica en Brasil para los Nymphalidae Eunica bechina (Freitas & Oliveira 1992), Anaea ryphea (Caldas 1994) y Dryas iulia alcionea (Paim et al. 2004). En Panamá para Pieridae Dismorphia amphiona beroe (Aiello 1980). En Perú para Nymphalidae Oleria onega agarista, Oleria onega ssp. (Gallusser 2002), 3 Específicamente para Colombia se han realizado el ciclo de vida para las siguientes especies, de Nymphalidae Haetera piera (Constantino 1993), Morpho amathonte (Constantino 1997b), M. macrophtalmus y M. peleides telamon (Constantino & Corredor 2004), Heliconius cydno celinde (Prieto et al. 1999), Colobura annulata y Colobura dirce (Willmott et al. 2001); Siproeta epaphus, Anartia amathea, Colobura dirce, Ithomia alienassa, Actinote ecuatoriana, Heliconius erato y Danaus plexippus megalippe (Gil & Posada 2002); en Papilionidae Battus polydamas, Parides iphidamas, P. anchises, P. lycimens, P. lysander (Fagua & Ruiz 1996), B. chalceus ingenuus, Heraclides anchiciades, P. childrenae latifasciata, P. eurimedes emilius y P. panares erythrus (Prieto et al. 1999) y Heraclides anchisiades anchisiades (Gómez-S & Fagua 2002). En cuanto a la familia Riodinidae en 1987 Harvey reportó información de las plantas alimenticias y/o de la morfología de los estadios inmaduros conocidos para 100 especies de Riodinidos, lo que constituye el 8-9% de la diversidad total de la familia. Luego De Vries (1997) y Janzen y Hallwachs (2002) reportan información de 170-180 especies, sin embargo, esto solo representa el 13-15% de la familia. Entre los estudios realizados se encuentra: Aricoris hubrichi por Bruch 1926, Menander felsina por Callaghan 1977, Thisbe irinea por DeVries 1988, 1991, Juditha caucana por Hall y Harvey 2001 (Citados en Hall et al. 2004), Anatole rossi por Ross 1964 y Calydna sturnula por Hall et al. (2004). Sobre otras especies como Nymphidium lisimon attenuatum, Phaenochitonia sagaris satnius y Metacharis ptolomaeus se han realizado notas sobre su biología sin ser descritos todos sus estadios (Callaghan 1988). Ross 1964 realizó una descripción de la larva con breves observaciones de su ecología y etología; además se muestra la asociación de las larvas con hormigas de la especie Camponotus abdominales Fabr. (Formicinae). Se 4 partió de 21 huevos encontrados en hojas nuevas de Croton repens Schlecht. (Euphorbiaceae). Hall et al. (2004) describió a Calydna sturnula a partir del segundo instar. La planta fue Schoepfia schereberi (Olecaceae). En este estudio de los 219 individuos colectados entre orugas y pupas, solo seis fueron parasitados por avispas Apanteles y Hipomicrogaster (Braconidae), Chalcidae y por moscas Tachinidae. Callaghan (1988) describió el tercer instar (posiblemente) de Nymphidium lisimon attenuatum como larvas solitarias que se alimentan en hojas separadas, característica de otras especies mirmecófilas. En campo siempre se encontró asociada con hormigas, sin embargo algunas larvas estaban parasitadas por avispas Trichogrammatidae, lo que sugiere que las hormigas no defienden agresivamente a las larvas. En el laboratorio la larva se alimentó por la noche. Encontró como planta hospedera a Inga sp. En el mismo trabajo Callaghan (1998) describió huevos, larvas de primer, segundo y tercer instar de Phaenochitonia safaris satnius. Observó que las larvas de segundo y tercer instar tejen con seda la superficie de las hojas hasta plegarlas y así se ocultan en su interior para protegerse de la depredación, además permanecen unidas mientras se alimentan. Dos o tres días antes de la muda la larva cesa de alimentarse hasta un día después de esta. No se encontró evidencia de órganos mirmecófilos o cualquier patrón de comportamiento que pudiera sugerir su asociación con hormigas. Planta hospedera Melastomataceae. Callaghan (1998) describió los huevos y el primer instar de Metacharis ptolomaeus, la hembra ovopositó un huevo en la base del pecíolo de 5 Lacistema (Flacurtiaceae). No se encontraron especies de hormigas asociadas. Considerando todas las especies de Mesosemia muy pocas han sido criadas, De Vries et al. (1992) registran las plantas hospederas, tipo de postura y comportamiento de las larvas a partir de observaciones en campo de las siguientes especies: M. asa con Psychotria macrophylla como planta hospedera, huevos individuales y larvas solitarias; M. carissima con P. luxurians como planta hospedera y larvas solitarias; M. nr. tenebricosa y M. nr. ephyne con posturas individuales y larvas solitarias alimentándose de una Rubiaceae; M. telegone, larvas solitarias que se alimentan de Psichotria sp., Aphelandra sp. y Palicourea guianensis; finalmente M. nr. judicialis con posturas individuales y larvas solitarias sobre sus plantas hospederas Faramea sp. y Faramea eurycarpa. 2.2. Familia Riodinidae La familia Riodinidae es un grupo de mariposas de tamaño pequeño de gran variedad de formas, con colores metalizados y brillantes. Son conocidas popularmente como mariposas de marcas metálicas “metalmarks” o “revoloteadoras” por el hábito de volar constantemente y posarse con las alas abiertas ocultándose en el envés de las hojas, por lo que pasan desapercibidas (Vélez & Salazar 1991; Minno & Emmel 1993; GarcíaRobledo et al. 2002; Valencia et al. 2005). Se conocen unas 1308 especies para toda la región Neotropical y unas 630 para Colombia, distribuidas en todos los pisos térmicos. Las zonas cálidas del bosque húmedo y muy húmedo tropical como la Amazonia, la costa del Pacífico y el Magdalena Medio son las más ricas en diversidad. Esta familia tiene altos niveles de endemismo que alcanzan el 37% en la costa del 6 Pacífico, 30% en el Putumayo y el pie de monte oriental de la cordillera Oriental y 27% en el Magdalena Medio (García-Robledo et al. 2002; Valencia et al. 2005). Es una de las familias menos conocida del Neotrópico, biológicamente es la menos estudiada (D´Abrera 1984; De Vries 1997; Stehr 1987; Vélez & Salazar 1991; De Vries et al. 1992), como anteriormente se consideraba subfamilia de Lycaenidae, la biología y evolución ha sido típicamente inferida de lo conocido para los licaenidos (De Vries et al. 1992). Los huevos son esféricos, fuertemente achatados en su base y en su ápice, con poros muy elaborados (Valencia et al. 2005). Las larvas de Riodinidae son reconocidas por la presencia de más de dos setas mandibulares y por la ubicación ventral del espiráculo en A1 (Stehr 1987), las larvas son achatadas y alargadas con setas y mechones de pelos dorsales y laterales, usualmente son solitarias (Stehr 1987; García-Robledo et al. 2002; Valencia et al. 2005). Al igual que los Lycaenidae, algunas larvas son mirmecofilas, es decir, tienen simbiosis con hormigas (De Vries 1997). Las pupas de color verde, amarillo o café, con puntos negros y en algunos géneros con pequeños proyecciones o espículas laterales; empupan generalmente sobre las hojas de manera horizontal e individual como si estuviesen posadas sobre las hojas como estrategia para camuflarse, o en grupos en la base de los troncos de los árboles (Valencia et al. 2005). Las mariposas del género Mesosemia (Hübner 1819), tribu Mesosemiini (Bates 1859), son reconocidas por la forma algo cuadrada de sus alas, con manchas en forma de ojo que generalmente contiene de una a tres pupilas en la celda del ala posterior, en algunos casos los ocelos son obsoletos pero la pupila permanece. Muestran una tendencia a un fuerte dimorfismo sexual, 7 con unas pocas excepciones. En este género no se observan larvas mirmecófilas (De Vries 1997). Las mariposas de este género son componentes importantes en la riqueza de especies de mariposas desde las más bajas elevaciones hasta sitios de elevaciones medias. Es uno de los géneros frecuentemente observados de riodinidos. Aunque las especies de Mesosemia son comunes, en muchos del Neotrópico no se han encontrado especies de este genero, solo después de muchos años de trabajo se han reportado especies extremadamente raras (De Vries 1997). La cantidad de material sin determinar en museos y la confusión respecto a la identificación de los sexos refleja una verdadera necesidad de revisión de este género. Muchas especies, subespecies y formas no tienen grado de certeza, por esta razón se pueden encontrar más especies de Mesosemia de las que se reconocen actualmente (De Vries 1997). La mayoría de las plantas hospederas registradas para Mesosemia son de la familia Rubiaceae, géneros Psychotria, Faramea, Guettarda, Palicourea, Cephalanthus, y Cephaelis (De Vries et al. 1992, De Vries 1997). Solo se encuentra un registro de la familia Acanthaceae género Aphelandra (De Vries et al 1992). Para este genero, las orugas tienden a ser uniformemente verdes, cubiertas por setas rígidas esparcidas y de longitud media. Cuando son vistas desde arriba muestran unos lóbulos laterales pronunciados en todos los segmentos, todos los instares son suficientemente crípticos hasta ser casi invisibles. Los estadios tempranos pueden alimentarse constantemente, sin embargo los estadios avanzados se alimentan exclusivamente en la noche. La forma total 8 de la pupa se asemeja a las del género Leucochimona siendo las de Mesosemia más grandes (De Vries 1997). Mesosemia mevania (Hewitson 1857) se encuentra distribuida en Venezuela, Ecuador, Perú y el occidente de Colombia. En este último está presente en las tres cordilleras, en la Costa Pacífica, valle geográfico de los ríos Cauca y Magdalena, entre los 100 – 2400 m.s.n.m. Presenta una longitud del ala anterior de 24-26 mm (García-Robledo et al. 2002; Valencia et al. 2005). Los machos presentan la banda blanca de las alas anteriores más angosta que en las hembras. Las plantas hospederas son: Psychotria poeppigiana, P. macrophylla y Palicourea angustifolia (Rubiaceae) en el Valle del Cauca. En cuanto a su comportamiento vuela al interior del bosque en sitios sombreados (Valencia et al. 2005). En el Parque Ecológico Piedras Blancas esta especie se encuentra en sitios sombríos de riachuelos y quebradas, con mayor actividad entre las ocho y las tres de la tarde, comúnmente observada libando en las flores de las copas de los árboles con otras mariposas (Ramírez 1992). 2.3. Ciclo de vida El ciclo de vida de una mariposa tiene cuatro estadíos diferentes: huevo, larva, con cinco instares, pupa o crisálida y estado adulto o imago. Generalmente, la duración completa del ciclo de vida de los estados inmaduros (huevo, larva, pupa) de una mariposa diurna se encuentra entre 30 y 120 días, dependiendo de la especie y las condiciones ambientales (Constantino 1997a; Valencia et al. 2005). 9 Huevo El ciclo de vida de una mariposa se inicia cuando las hembras seleccionan una planta hospedera para poner sus huevos, la identificación inicial es visual probablemente basada en el color y forma de la hoja, una vez sobre la hoja la mariposa corrobora la identificación por percepción química con quimiorreceptores ubicados en los tarsos o en la proboscide (Vaidya 1969; Constantino 1996; Fagua et al. 1998; García-Robledo et al. 2002; Gómez-S & Fagua 2002). La oviposición puede estar influenciada por las condiciones ambientales, la mayoría de las mariposas son inactivas cuando se presentan días nublados, con viento o con lluvia. Las hembras no pueden compensar la tasa de reducción de oviposición debido al tamaño, la edad y temperatura pero pueden compensar por condiciones ambientales desfavorables (nubes, viento o lluvias) aumentando la tasa de oviposición durante períodos favorables (Stamp 1980). El sitio de oviposición dentro de la planta también puede ser característico para la especie, los huevos pueden ser puestos en la superficie inferior de la hoja, en los ápices, o incluso en los zarcillos de las enredaderas (Constantino 1996; Fagua et al. 1998; García-Robledo et al. 2002; Gómez-S & Fagua 2002). La oviposición determina la probabilidad que la oruga alcance suficiente recurso alimenticio para su desarrollo, en muchas ocasiones la hembra de una especie puede aceptar sustratos subóptimos para la oviposición cuando el óptimo es raro o no se encuentra (Chew 1997). El huevo es el estado más vulnerable de la mariposa, una buena localización asegura una mayor supervivencia de la futuras orugas disminuyendo las oportunidades de que 10 sean atacadas por parásitos o por sus depredadores, y la posibilidad de que la futura oruga encuentre el alimento que necesita (Chew 1977; Vélez & Salazar 1991). Probablemente el color conspicuo de los huevos y su posición, puede inhibir la ovoposición de nuevas posturas en la misma planta, contribuyendo así a una mejor distribución del recurso o impidiendo la pérdida de orugas por canibalismo o agresión (Stamp 1980; Fagua & Ruiz 1996). Las mariposas pueden depositar sus huevos individuales o agrupados, en los Riodinidae se observa una tendencia de posturas individuales o en grupos pequeños, tanto para las hembras como para los huevos se presentan ventajas al ser depositados individualmente. Para las hembras se encuentra que utilizan menos tiempo depositándolos, evitan depredadores, parasitoides y competencia entre herbívoros, pueden usar diferentes plantas hospederas y diferentes especies de plantas hospederas dentro de un hábitat. Mientras que para los huevos se evitan de una manera más efectiva parasitoides y predadores, especialmente si la detección de la distancia por parasitoides y predadores es pequeña; los huevos individuales son usualmente crípticos (blancos, amarillos o verdes) localizados en la parte inferior de las hojas de las plantas hospederas (Stamp 1980). Larva La fase larval es la etapa de nutrición y crecimiento del ciclo de vida de la mariposa, durante esta fase la actividad de la oruga se limita a alimentarse y crecer; a lo largo de su crecimiento, la larva transforma grandes cantidades de follaje en tejido y reservas alimenticias que usará durante las fases de pupa y adulto (García-Robledo et al. 2002). 11 Todo el cuerpo de la oruga se encuentra protegido por el exosqueleto, una envoltura de quitina que le confiere dureza, por esta razón la oruga debe mudarlo varias veces durante su desarrollo. El período comprendido entre cada muda es conocido como instar o estadio de desarrollo, por lo general la oruga presenta cinco estadios, pero el número puede variar de cuatro a siete dependiendo de la especie. Al final del último estadio la oruga deja de comer, disminuye su actividad y se prepara para pupar, este estado se conoce como prepupa (García-Robledo et al. 2002). Se encuentra que dependiendo del tipo de postura las larvas pueden ser solitarias o gregarias. El comportamiento gregario se puede interrumpir durante el tercero y cuarto instar, y en contraste encontrar larvas alimentándose individualmente o en grupos pequeños; el comportamiento gregario presenta ventajas como el incremento del comportamiento termoregulatorio, tasa de crecimiento, eficiencia en el forrajeo y defensa contra enemigos naturales (Stamp 1980; Zalucki et al. 2002). Por otro lado las larvas solitarias también presentan ventajas como una menor exposición a parásitos y predadores, y no existe competencia al momento de buscar un sitio para formar la pupa (Stamp 1980). Pupa o crisálida Al inicio la pupa se une fuertemente a un punto fijo por medio de unos ganchos llamados cremaster, internamente se lleva a cabo la metamorfosis, una reorganización drástica de tejidos que finaliza con la formación del adulto, la actividad externa de esta fase se reduce a unos mínimos movimientos abdominales. Al completarse la metamorfosis la zona ventral de la pupa se abre permitiendo que emerja el adulto (García-Robledo et al. 2002). 12 Las crisálidas se han adaptado plenamente a su entorno adquiriendo coloraciones crípticas y formas extrañas, las que se fijan a las cortezas y ramas secas tienen una coloración parda o grasosa lo que les permite pasar casi desapercibidas (Vélez & Salazar 1991). Adulto Cuando el adulto emerge de la pupa ya tiene el tamaño normal y no sigue creciendo; éste es el estado en el cual las mariposas vuelan se aparean y colocan huevos. Los adultos se alimentan de fluidos, néctar, exudados azucarados o fermentos de frutas (García-Robledo et al. 2002; Gómez-S & Fagua 2002; Valencia et al. 2005). Enemigos naturales Las mariposas están en constante riesgo a causa de diversos factores que influyen en su probabilidad de sobrevivencia, Gil y Posada (2002) encontraron para varias especies de mariposas diurnas de la zona cafetera, que los enemigos naturales más abundantes fueron los parasitoides seguidos por los entomopatógenos y el grupo menos abundante fue el de los depredadores. Los huevos y orugas jóvenes están sujetos a una extensiva presión por parte de artrópodos parasitoides (Chalcidae, Trichogrammatidae y Scelionidae, entre otros), otras familias pertenecientes a Hymenoptera, Diptera, Orthoptera, Heteroptera y Aranea (Ctenidae y Lycosidae) son enemigos naturales de orugas o pupas (DeVries 1997). Las larvas también pueden estar afectadas incluso por hongos patógenos, Gil y Posada (2002) encontraron las especies: Beauveria bassiana (Bals.) Vuill, Paecilomyces, Metarhizium anisopliae (Match.) Sorokin y Verticillium atacando larvas y pupas de varias especies de Lepidoptera; las bacterias y los virus son otro grupo de patógenos frecuentes especialmente bajo condiciones de 13 laboratorio; la presencia de estos organismos se puede dar por la manipulación inadecuada del material o por colocar en un espacio reducido varios individuos, en este estudio las larvas y las pupas fueron los estados más susceptibles (Gil & Posada 2002). Por su parte los adultos son depredados por invertebrados como arañas, mántidos, hormigas, odonatos, entre otros, y vertebrados como aves reptiles y mamíferos (De Vries 1987). 2.4. Planta hospedera Los herbívoros generalistas o polífagos se alimentan de diversas especies de plantas pertenecientes a especies poco relacionadas taxonómicamente, los especialistas monófagos consumen una planta específica y de olífagos especies estrechamente relacionadas (DeVries 1987; Fagua & Ruiz 1996; Fagua et al. 1998). La preferencia de un herbívoro por una planta está definida por las sustancias químicas de éstas, una sustancia tóxica para un herbívoro puede ser alimento para otro (DeVries 1987; Fagua & Ruiz 1996; Fagua et al. 1998; García-Robledo et al. 2002). Las plantas contienen nutrientes básicos (agua, nitrógeno, potasio, etc.), metabolitos primarios (azúcares, grasas, aminoácidos proteicos, etc.), y metabolitos secundarios (alcaloides, glucosinolatos, terpenoides, etc.). Las zonas jóvenes de crecimiento de las plantas generalmente presentan una mayor proporción de nitrógeno, fósforo, azufre, potasio y azúcares, y menor cantidad de celulosa, por lo que son preferidas por los herbívoros. La reducción en la calidad de la hoja disminuye la supervivencia de herbívoros, indirectamente por el incremento de su período de exposición a enemigos naturales (depredadores, parásitos y enfermedades), la exposición a enemigos naturales pueden favorecer adaptaciones hacia un rápido desarrollo del herbívoro (Scriber & Feeny 1979; Loader & Damman 1991; Fagua & Ruiz 1996; Fagua et al. 1998; Gómez-S & Fagua 2002). Por otro 14 lado los herbívoros también son dependientes de las características fenológicas de sus hospederos y sus ciclos de vida deben estar sincronizados con las épocas de floración, fructificación o producción del follaje (Fagua & Ruiz 1996; Forister 2005). Las orugas de lepidópteros tienen la necesidad de consumir tejidos blandos, especialmente en sus primeros estadios, la mayoría prefieren hojas con alto contenido de agua. El rechazo por parte de la oruga puede ser determinante para su supervivencia, especialmente en los primeros estadios, ya que la probabilidad de alcanzar un hospedero apropiado antes de morir por inanición o ser atacadas por depredadores es menor para orugas de tamaño pequeño (Fagua & Ruiz 1996; Zalucki et al. 2002). 15 3. FORMULACIÓN DEL PROBLEMA Y JUSTIFICACIÓN 3.1. Formulación del problema El género Mesosemia presenta un gran número de especies, sin embargo sus estados inmaduros son quizás los menos conocidos de toda la familia Riodinidae. Hasta la fecha para Mesosemia mevania no se ha realizado ningún estudio detallado de su ciclo de vida. Por esta razón es importante hacer una descripción e ilustración detallada de los estadios inmaduros de esta especie. Además, será un aporte para los proyectos sobre cría de mariposas nativas que están adelantando en el Parque Ecológico Piedras Blancas donde se proyecta construir un mariposario con fines educativos y recreativos. 3.2. Pregunta de investigación ¿Cuál es el tiempo de duración, longitud de cada estadio y sobreviviencia de M. mevania del Parque Ecológico Piedras Blancas, Antioquia, Colombia? ¿Cómo es la distribución de la planta hospedera de M. mevania? 3.2. Justificación de la Investigación Actualmente, la historia natural y descripción de los estados inmaduros de las mariposas de la familia Riodinidae son poco conocidos, para las especies de esta familia, en Colombia, no existe ningún estudio detallado. Del género Mesosemia específicamente ningún ciclo de vida ha sido descrito hasta la fecha, por esta razón realizar el seguimiento, descripción e ilustración detallada de M. mevania es la forma más adecuada de aportar conocimiento sobre la historia natural y ecología no solo de la especie, sino también de la 16 familia. Se utiliza M. mevania porque es la especie de riodinido más observada en el Parque Ecológico Piedras Blancas. En el Parque Ecológico Piedras Blancas se han realizado pocos ciclos de vida de las mariposas de la zona, esta investigación aporta al proyecto sobre cría de mariposas del Parque, el cual viene adelantando CONFENALCO Antioquia, con miras a construir un mariposario con fines educativos y recreativos. 17 4. OBJETIVOS Objetivo general Describir el ciclo de vida de Mesosemia mevania (Lepidoptera: Riodinidae) en el Parque Ecológico Piedras Blancas, Antioquia. Objetivos Específicos 1. Determinar el tiempo de duración, longitud y la probabilidad de superviviencia de cada uno de los estados de desarrollo (desde huevo hasta pupa) de M. mevania en condiciones de laboratorio. 2. Establecer las características fenotípicas de cada uno de los estadios de M. mevania. 3. Identificar la principal planta hospedera de los estados inmaduros de M. mevania del Parque Ecológico Piedras Blancas, Antioquia. 4. Determinar los patrones de dispersión de la planta hospedera en los parches de bosque del Parque Ecológico Piedras Blancas. 18 5. MATERIALES Y MÉTODOS 5.1. Área de estudio El Parque Ecológico Piedras Blancas se encuentra localizado al oriente del Municipio de Medellín, en los municipios de Guarne y Medellín, en las coordenadas 6º 8' 20'' N 75º 30' 20'' W. Se encuentra entre los 2300 y 2400 msnm, tiene una temperatura y una precipitación promedio de 15°C y 1965 mm (IDEAM 2003). La estación de lluvias tiene un régimen bimodal: abril, mayo y octubre, noviembre. El período de sequía es entre enero y marzo. De acuerdo con el sistema de Holdridge (1987) el parque corresponde a una zona de vida de bosque húmedo montano bajo (bh-MB), cerca de la línea de transición con el bosque muy húmedo montano bajo (bmh- MB). El Parque comprende una extensión de 2877 ha, de las cuales 1400 se encuentran cubiertas por vegetación natural, donde sobresalen pequeños fragmentos de bosque secundario en diversas etapas sucesionales y bosques naturales donde predomina el roble Querqus humboldtii. Además, existen 1100 ha en plantaciones forestales de diversas especies de pino, ciprés y eucalipto. En menor medida se encuentran pequeñas extensiones dedicadas a la ganadería y a la agricultura. 5.2. Diseño de la Investigación Factor de diseño: Tiempo y crecimiento de cada estadio. Variable respuesta: tiempo de cada estadio y tamaño de los individuos en cada estadio. 19 Unidad de respuesta: número de días de duración y longitud (mm). Unidad de muestreo: huevos de M. mevania de 43 posturas. 5.2.1. Población de estudio y muestra Población de estudio: población de M. mevania (Lepidoptera: Riodinidae) de los bosques naturales en estadio sucesional secundario del Parque Ecológico Piedras Blancas, Antioquia. Muestra: 132 individuos de Mesosemia mevania pertenecientes a 43 posturas. 5.3. Métodos 5.3.1. Ciclo de vida Se realizaron salidas de campo dos días por semana desde el 5 de abril hasta el 24 de mayo de 2005, en dos parches de bosque secundario del Parque Ecológico Piedras Blancas, en los que se buscaron estados inmaduros de Mesosemia mevania en individuos de Rubiaceae donde se habían observado anteriormente posturas y larvas de la especie. Además, se realizaron observaciones y anotaciones en campo del comportamiento de los adultos. Del material colectado se anotó la fecha y sitio de colecta, las plantas se numeraron, para cada una se tomaron datos de ubicación en el bosque, altura y especie, si se encontraban varias posturas o larvas en una misma planta las hojas se enumeraban y se asumía que eran posturas diferentes; para las posturas y larvas se anotó: estado de desarrollo, ubicación de los 20 huevos en la planta y número de individuos encontrados por postura y por planta. Las posturas y orugas encontradas fueron llevadas al laboratorio del Museo Entomológico Piedras Blancas, allí se depositaron individualmente en recipientes de plástico con tapa. Se les adicionó hojas frescas de la planta hospedera y en el fondo papel absorbente humedecido para evitar la deshidratación de estas y facilitar la limpieza del excremento de las larvas. Los ensayos de cría se realizaron a temperatura y humedad ambiente, diariamente se registró temperatura y humedad relativa mínima, máxima y promedio en las horas de la mañana. Diariamente se observaron los huevos para registrar la fecha de eclosión y número de orugas emergidas. Igualmente, las larvas fueron revisadas cada día para registrar mudas, patrones de coloración, comportamiento, mortalidad y presencia de parasitoides (Tabla 1). El cambio de estadio se identificó por la presencia de exuvias, las cápsulas cefálicas resultantes se fijaron en solución Kahles y se conservaron en alcohol al 80%. Se partió de 132 huevos pertenecientes a 43 posturas, para cada individuo se registró la duración de cada estadio, longitud inicial, longitud final y ancho de la cápsula cefálica para todas las larvas desde estadio uno a estadio cinco, y ancho de la pupa; para determinar la mortalidad por estadio se construyo una tabla y curva de superviviencia con todos los individuos que fueron pasando de un estadio a otros. A cada individuo en sus diferentes estadios se le tomaron las siguientes mediciones con papel milimetrado al estereoscopio: o Huevos: altura y diámetro. 21 o Larvas: longitud mínima (al momento de nacer o de mudar), longitud máxima (días antes de la muda) y ancho de la cápsula cefálica (de las pieles de las larvas). o Pupas: longitud y ancho. o Adultos: envergadura alar (longitud desde el punto de inserción del ala hasta el ápice del ala anterior). Se registró la duración de tiempo en cada estadio, es importante aclarar que como no se observaron hembras ovopositando la duración de los huevos se tomo a partir de los huevos colectados en campo. Para algunas posturas se puede calcular el tiempo de ovoposición con un margen de error entre uno y dos días porque estas plantas se revisaron diariamente. También se registró el sexo de cada adulto y se observaron las diferencias morfológicas entre estos. Se realizó una descripción detallada de cada uno de los estadios, usando la terminología de Stehr (1987), se tuvo especial cuidado en anotar los cambios de color ya que una vez fijada la larva pierde su color original. Se hizo registro fotográfico de todos los estadios y una ilustración del huevo, larva III, pupa y el adulto. Se fijaron cinco larvas de cada estadio, cada larva se sumergió en agua caliente, luego en solución Kahles (Borror et al. 1989), después de una semana se trasladaron a alcohol al 80% (Holloway, Bradley & Carter 1992). Se realizó todo el proceso de curaduria y montaje para cinco machos y cinco hembras adultos. Estas muestras de larvas y adultos se depositaron en el Museo Entomológico Piedras Blancas (MEPB) y el Laboratorio de Entomología de la Universidad de Antioquia. 22 5.3.2. Planta hospedera Para determinar el patrón de dispersión de las plantas hospederas se seleccionaron al azar seis transectos de 100x2 m en cada uno de los dos parches de bosque donde se hizo el muestreo de huevos y larvas. Cada transecto se subdividió en cien cuadrantes de 1x2 m, en cada uno se registró la cantidad de plantas hospederas. La planta hospedera fue identificada y depositada en el Herbario Universidad de Antioquia HUA # 147845. 5.4. Recolección de la información Para el registro de datos del ciclo de vida se utilizó una planilla (Tabla 1) para cada individuo, en la cual se marcó una equis si el individuo seguía en el mismo estadio o se registró la medida de la larva si había cambiado de estadio o estaba próxima a hacerlo, para los adultos se anotó la envergadura alar. En las observaciones se escribieron datos de la presencia de exuvia si se presentaba una muda, si los individuos estaban parasitados, morían, o cualquier otro dato importante. 23 Tabla 1. Planilla para la toma de datos del ciclo de vida de cada individuo. MEPB Ciclo de vida de____________ Familia______________ Estadio colectado_______ Planta hospedera _______________ Planta Nº ________ Individuo Nº ____ Hoja Nº ____ Sitio colecta _____________ Colector ________________ Fecha ____________ Tarro Fecha H LI LII LIII LIV LV PP A Observaciones H: huevo; LI: larva uno; LII: larva dos; LIII: larva tres; LIV: larva cuatro; LV: larva cinco; PP: prepupa; P: pupa; A: adulto 5.5. Análisis de la información Para el ciclo de vida de M. mevania se realizó una tabla de supervivencia de cohortes (Tabla 2) siguiendo la metodología de Begon, Harper y Townsend (1999) para determinar la mortalidad en cada uno de los estadios por: ax: número observado de individuos en cada fase. lx: número estandarizado de individuos. Se calcula convirtiendo cada valor observado en lo que se esperaría, se inicia la tabla con un valor fijo, en este caso 1,000. La utilidad de este parámetro consiste en que puede ser comparado entre curvas de superviviencia para especies, años o localidades diferentes. dx: proporción de la cohorte original que muere durante cada fase. Este valor es la diferencia entre lx y lx + 1. qx: tasa de mortalidad. Se calcula dividiendo los valores dx y lx de cada fase. 24 kx: fuerza de mortalidad. Este valor es definido como log10 ax – log10 ax+1, refleja la intensidad o tasa de mortalidad de una edad a otra. Tabla 2. Tabla de supervivencia. Estadio Huevo Larva I Larva II Larva III Larva IV Larva V Prepupa Pupa Adulto Tabla de supervivencia de Mesosemia mevania ax lx dx qx kx A partir de 132 individuos pertenecientes a 43 posturas, con los datos de cada individuo de duración (período de días entre muda y muda), longitud inicial (desde huevo hasta pupa), longitud final (desde larva uno a larva cinco), ancho de la cápsula cefálica y envergadura alar de los adultos se calculó el valor medio, mínimo y máximo, además se realizó el promedio y la desviación estándar. A partir de los adultos emergidos se realizó la relación de sexos. Para observar las diferencias entre posturas de duración, longitud inicial, longitud final y ancho de la cápsula cefálica para cada estadio, se realizaron ANOVA o prueba de Kruskalll-Wallis, dependiendo de la normalidad de los datos (Pérez 2001). Para la planta hospedera a partir de los datos obtenidos de los transectos se halló el índice de dispersión (ID) para cada uno de los cuadrantes: 25 ID = [varianza (n – 1)] / promedio donde n = el número de cuadrantes usados. Debido a que ID tiene una distribución estadística parecida a la de Chi – cuadrado (χ2), entonces se comparó el valor de ID con el de χ2; si el valor de ID tiene un valor que no se aleje mucho de χ2 significa que los individuos de la población están distribuidos al azar, si ID es menor que χ2 los individuos están distribuidos regularmente y si tiene un valor mayor están agrupados (Harms 1996). 26 6. RESULTADOS Y DISCUSIÓN 6.1. Ciclo de vida Los huevos y larvas de Mesosemia mevania se colectaron en abril y mayo, también se observaron posturas en campo en el mes de agosto. Entre el 5 de abril y el 9 de julio, fechas durante las cuales se realizó el ensayo de cría, se registró una temperatura promedio de 16.7º C y una humedad relativa de 76.7. El fotoperíodo fue de 12:12 horas luz oscuridad. La Tabla 3 muestra el tiempo de duración promedio y la desviación estándar de cada estadío, estos resultados son el producto del análisis del total de individuos independiente de la postura M. mevania requiere alrededor de 77.4 días (n = 58), desde huevo hasta la emergencia del adulto. El estadio más largo es el de pupa con 28.4 días promedio y el más corto prepupa con 3.5 días. De los instar larvales el más largo fue larva uno con 7.3 días promedio y el más corto larva cinco con 4 días. En algunos estadios como larva dos el tiempo que requirieron los individuos para pasar al próximo instar fue muy variable (desviación estándar 1.97), unos tardaron solo cuatro días, mientras que otros diez, algo similar ocurrió en larva uno (Tabla 3), probablemente la falta o mala calidad del alimento obliga a algunos individuos a mudar más rápido (Harcourt 1966; Scriber & Feeny 1979) o pueden ser unos rangos de variación normal en la especie. 27 Tabla 3. Duración de cada uno de los estadios de M. mevania. Estadio Huevo (n = 17) Larva I (n = 64) Larva II (n = 59) Larva III (n = 58) Larva IV (n = 58) Larva V (n = 58) Prepupa (n = 58) Pupa (n = 58) Total Días de duración de cada estadio Mínimo Máximo Promedio Desv. Estándar 16 18 17.0 0.79 5 12 7.3* 1.90 4 10 7.2* 1.97 3 9 5.8* 1.41 3 7 4.2* 0.87 2 7 4.0* 1.67 1 6 3.5 1.13 25 32 28.4 1.75 77.4 *diferencias estadísticamente significativas ANOVA o Kruskall-Wallis p<0.05 cuando se comparan las posturas. El incremento de longitud entre un estadio y otro fue en promedio 4.3 mm, el mayor incremento (5.3 mm) se da en el paso de larva tres que mide 11.2, a larva cuatro que alcanza 16.5 mm; el mayor aumento del ancho de la cápsula cefálica también se observa entre estos dos estadios (Tabla 4). Tabla 4. Promedio (P) y desviación estándar (D.E.) de la longitud inicial, longitud final y ancho de la cápsula cefálica para cada uno de los estadios de M. mevania. Estadio Huevo Larva I Larva II Larva III Larva IV Larva V Prepupa Pupa Longitud Inicial P 0.6 2.2* 4.9* 8.9* 13.2* 19.2 19.5 19.0* D. E. 0.1 0.4 1.5 2.0 2.0 2.5 1.3 0.8 Longitud Final P D. E. 3.6* 6.7* 11.2 16.5* 20.7 0.6 1.5 1.5 2.3 1.6 Ancho cápsula cefálica P D. E. 0.5 0.8 1.1 1.4 3.0 0.1 0.2 0.2 0.5 0.2 *diferencias estadísticamente significativas ANOVA o Kruskall-Wallis p<0.05 cuando se comparan las posturas. 28 Al realizar el ANOVA o la prueba de Kruskall-Wallis según la normalidad de los datos para cada uno de los estadios para observar las diferencia entre posturas se encuentran, para la duración diferencias significativas en larva uno (p = 0.0008), dos (p = 0.003), tres (p = 0.03), cuatro (p = 0.046) y cinco (p = 0.02), por el contrario en todas las posturas fue muy similar el tiempo que duraron como pupas y prepupas. Para la longitud de los huevos no se observan diferencias significativas entre la posturas, para la longitud inicial de larva uno (p = 0.0001), dos (p = 0.006), tres (p = 0.006), cuatro (p = 0.004) y pupa (p = 0.017) existen diferencias significativas, mientras que para larva cinco y prepupa no; por otro lado las longitudes finales de larva uno (p = 0.007), dos (p = 0.02) y cuatro (p = 0.01) presentaron diferencias, mientras que para larva tres y cinco no. La diferencias entre posturas para la duración y longitudes pudo estar ocasionada por las diferentes fechas de colecta de las posturas, por factores climáticos, calidad del alimento y genética de los individuos. No se presentaron diferencias significativas entre posturas para el ancho de la cápsula cefálica en los cinco instares. Estas diferencias tanto de duración como de tamaño de la larva se debieron posiblemente a diferencias en la calidad de las hojas como el contenido de agua y nitrógeno; Feeny y Scriber (1979) indican que mientras las tasa de crecimiento, la eficiencia de utilización del nitrogeno, y la tasa de acumulación de nitrógeno disminuyen, la duración para los dos últimos instares larvales aumenta. Otro aspecto como el contenido de nutrientes de la hoja puede afectar el crecimiento de las larvas (Scriber & Feeny 1979; Fagua et al. 1998; Gómez-S & Fagua 2002), pero no es fácil determinar cuales aspectos o combinación de aspectos juegan el papel predominante (Scriber & Feeny 1979). 29 6.1.1. Descripción morfológica de cada estadio Huevo El huevo tiene forma redondeada con 0.6 mm de longitud y 0.8 mm de diámetro (n = 132) (Tabla 4), esta longitud es similar a la encontrada por Ross (1964) para Anatole rossi (longitud: 0.4-0.5 mm, diámetro 0.6-0.7 mm, n = 21) y por Callaghan (1988) para Phaenochitona sagaris satnius (longitud: 0.4 mm, diámetro: 0.8 mm, n = 5). Mientras que muestra valores menores para lo registrado por Callaghan (1988) para Metacharis ptolomaeus (longitud: 0.2 mm, diámetro: 0.5, n = 1) y por lo estimado por García-Barros (2000) para Mesosemia sp. El huevo es achatado ligeramente en la parte superior y con la base completamente aplanada, por donde se adhiere al sustrato. El micropilo se localiza en la parte central superior, es poco profundo; la superficie del huevo es rugosa, es una red de pequeñas crestas formando patrones hexagonales con una pequeña profusión de cada intersección, con vellosidades en toda la superficie visible (Figura 1a y 2a). Los huevos de posturas agrupadas se encuentran adheridos entre sí por fibras de seda, solo ocho posturas correspondieron huevos individuales. La forma del huevo es similar, a lo descrito para Anatole rossi (Ross 1964), Phaenochitona sagaris satnius y Metacharis ptolomaeus (Callaghan 1988). Al principio el huevo es amarillo y gradualmente se va aclarando hasta volverse blanco días antes de la eclosión. La larva eclosiona por el micropilo, se tarda en promedio 17 días (16-18 días, n = 17) (Tabla 3), un valor mayor comparado con A. rossi (Ross 1964) que duro 8-9 días, P. sagaris satnius 30 31 32 con 12 días de duración y Metacharis ptolomaeus con 11 (Callaghan 1988). Primer estadio La larva mide en promedio 2.2 mm de longitud al comenzar el estadio (2.93.1 mm, n = 103) y al finalizar 3.6 mm (2.5-5 mm, n = 64) (Tabla 4). Comparando con A. rossi con 1.4-1.5 mm (n = 15) (Ross 1964), P. sagaris satnius con 1.7 mm (n = 5) y Metacharis ptolomaeus con 1 mm (n = 1) (Callaghan 1988) Mesosemia mevania presenta una longitud inicial mayor. Mientras que para la longitud final un valor similar al de A. rossi (2.5-2.6 mm, n = 15) (Ross 1964). El cuerpo es aplanado, partiendo desde el epicranio hasta la placa anal es de color amarillo hialino, incluyendo patas y propatas. Dorsalmente desde el mesotórax hasta el último segmento abdominal, se observa una banda de color verde esmeralda que contrasta con el cuerpo la cual se va oscureciendo con el tiempo. Todos los segmentos poseen chalazas con setas negras en la parte dorsal a cada lado de la línea media, el protórax presenta cinco chalazas a cada lado, el metatórax dos a cada lado, el mesotórax y todos los abdominales presentan una a cada lado; lateralmente presenta setas blancas hialinas largas incluyendo la parte superior de las propatas. Los espiráculos son blancos circulares, no presenta en los segmentos torácicos dos y tres, el espiráculo del protórax presenta una disposición más ventral que los espiráculos de los segmentos abdominales, desde el primer segmento abdominal se observa una línea espiracular blanca (Figura 1b). 33 La cápsula cefálica mide en promedio 0.5 mm de ancho (0.3-0.8 mm, n = 26) (Tabla 4), es redondeada y de color amarillo hialino, con setas hialinas cortas y largas, seis ocelos negros circulares a cada lado y mandíbulas de color café claro. El ancho de la cápsula cefálica es similar al encontrado para A. rossi (0.32-0.33 mm, n = 15) (Ross 1964) y P. sagaris satnius (0.3 mm, n = 5) (Callaghan 1988), mientras que para Metacharis ptolomaeus se encuentra un valor menor (0.13 mm, n = 1) (Callaghan 1988). Para Mesosemia mevania el mayor rango encontrado para puede ser ocasionado por el mayor número de individuos medidos. En promedio la duración de este estadio es 7.3 días (5-12 días, n = 64) (Tabla 3). Para A. rossi Ross (1964) encontró una duración de 4-5 días (n = 15) y para P. sagaris satnius Callaghan (1988) registra 9 días de duración. Lo anterior muestra que la duración del primer instar de M. mevania se encuentra dentro del rango de algunas de las especies de la familia Riodinidae. Segundo estadio Al inicio de este estadio la larva mide alrededor de 4.9 mm de longitud (2.9-9 mm, n = 62), al finalizar 6.7 mm (4.2-12 mm, n = 59) (Tabla 4). Tanto la longitud inicial de A. rossi (2.6-2.7 mm, n = 13) (Ross 1964) como la de P. sagaris satnius (2.5 mm, n = 4) (Callaghan 1988) presentan valores similares a los encontrados para M. mevania, mientras que el rango de la longitud final de A. rossi (4.0-4.4 mm, n = 13) (Ross 1964) es menor. La forma, la coloración, la disposición de setas blancas, chalazas con setas negras y espiráculos son muy similares a la del primer estadio. Presenta 34 setas blancas en la parte lateral del cuerpo y en la parte superior de las propatas, espiráculos blancos circulares sobre los que se observan pequeñas sedas blancas hialinas y línea espiracular blanca desde el primer segmento abdominal. Se diferencia del estadio anterior en que dorsalmente la línea verde esmeralda es más pronunciada, las setas negras de las chalazas son más oscuras y gruesas, el protórax presenta diez chalazas a cada lado, desde el mesotórax hasta el décimo segmento abdominal se observan tres chalazas a cada lado por segmento (Figura 1c). Cápsula cefálica con un ancho promedio de 0.8 mm (0.4-1.1 mm, n = 27) (Tabla 4), similar a la del primer estadio, ligeramente más opaca y con la mandíbula más oscura. En este estadio el cuerpo es un poco más robusto por lo que el epicranio se observa más pequeño. Los valores del ancho de la cápsula cefálica en comparación con A. rossi (0.52-0.53 mm, n = 13) (Ross 1964) y P. sagaris satnius (0.4 mm, n = 4) (Callaghan 1988), se encuentran dentro del rango encontrado para Mesosemia mevania, siendo este mas amplio que el de las otras especies posiblemente por la mayor cantidad de especimenes medidos. En promedio la duración de este estadio es de 7.2 días (4-10 días, n = 59) (Tabla 3). Para A. rossi se observa una duración de 4-5 días (n = 13) (Ross 1964) y para P. sagaris satnius de 8 días (Callaghan 1988), al igual que con la cápsula cefálica estos valores se encuentran dentro del rango encontrado para Mesosemia mevania, pero el rango para esta especie es mas amplio. 35 Tercer estadio La larva mide en promedio 8.9 mm de longitud al principio del estadio (5-13 mm, n = 59), al finalizar 11.2 mm (7.4-15 mm, n = 58) (Tabla 4), presenta valores similares a los registrados para A. rossi con una longitud inicial de 5.1-5.4 mm (n = 12) y una longitud final de 7.0-7.9 (n = 12) (Ross 1964), y valores mayores que los de P. sagaris satnius con una longitud inicial de 3.5 mm (n = 4) ( Callaghan 1988). Igual que los anteriores estadios el cuerpo es aplanado. Dorsalmente desde el protórax hasta la placa anal es de color café verdoso, se observan tres líneas paralelas de color verde claro desde el mesotórax hasta el último segmento abdominal, la línea central es más delgada que las laterales; las chalazas de esta parte del cuerpo presenta la misma coloración de las líneas. La parte lateral del cuerpo incluyendo patas y propatas presenta una coloración verde hialina tornándose cada vez más claro hacia la parte ventral. El primer segmento torácico presenta una prolongación que cubre la parte superior de la cápsula cefálica. No presenta línea espiracular, los espiráculos son blancos circulares, alrededor presentan algunas setas negras cortas (Figura 1d y 2b). Tanto dorsal como lateralmente presenta chalazas primarias y secundarias con setas negras, las primarias más cortas que en los estadios anteriores. En cuanto a la disposición de las chalazas primarias el protórax dorsal y lateralmente presenta quince a cada lado y el último segmento abdominal doce a cada lado. Dorsalmente el mesotórax presenta dos chalazas a cada lado, desde el metatórax hasta el séptimo segmento abdominal tres a cada lado y el noveno no presenta. Lateralmente desde el mesotórax hasta el 36 séptimo segmento abdominal se presenta una chalaza por segmento a cada lado y en el noveno dos a cada lado; en la parte superior de las propatas y de las patas del mesotórax y metatórax se observa una chalaza a cada lado y muchas setas blancas hialinas (Figura 1d y 2b). La cápsula cefálica de 1.1 mm (0.8-1.9 mm, n = 45) (Tabla 4) sigue siendo redondeada y su coloración cambia a verde, presentado setas hialinas cortas, mandíbula de color café más oscuro que los estadios anteriores (Figura 1d). En este estadio la larva es más robusta que en el estadio anterior por lo que el epicranio se observa cada vez más pequeño. Los valores del ancho de la cápsula cefálica para A. rossi (0.77-0.78 mm, n = 12) (Ross 1964), como para P. sagaris satnius (0.6 mm , n = 4) (Callaghan 1988) son menores a los encontrados para Mesosemia mevania. En promedio la duración de este estadio es de 5.8 días (3-9 días, n = 59) (Tabla 3), comparado con A. rossi que presenta una duración de 5-6 días (n = 12) de este estadio (Ross 1964), se puede decir que M. mevania presenta un rango similar pero mas amplio. Cuarto estadio Al iniciar este estadio la larva mide en promedio 13.2 mm (8.5-17 mm, n = 58), al finalizar 16.5 mm (11.5-20 mm, n = 58) (Tabla 4). Para A. rossi Ross (1964) encontró una longitud inicial de 7.9-9.4 mm (n = 9) y una longitud final de 10.1-11.0 (n = 9), lo que muestra un rango mas amplio para los dos datos en M. mevania, esto puede estar ocasionado por la diferencia en la cantidad de individuos medidos. 37 Cuerpo aplanado, desde el protórax hasta la placa anal es de color verde esmeralda, las patas son verde claro hialino y las propatas verde claro. Dorsalmente desde el mesotórax hasta el último segmento abdominal presenta las mismas tres líneas verde claro del tercer estadio, la del medio aun más delgada que en el estadio anterior. Al igual que el estadio anterior no presenta línea espiracular, los espiráculos son negros circulares con borde blanco. La prolongación del protórax es más grande que en el estadio anterior, cubre más la cápsula cefálica (Figura 1e). Al igual que en el estadio anterior presenta chalazas primarias y secundarias con setas negras, las primarias más largas que en larva tres. Tanto dorsal como lateralmente el protórax presenta 24 chalazas a cada lado y el último segmento abdominal 12 a cada lado; dorsalmente el mesotórax y primer segmento abdominal presentan tres chalazas a cada lado, en el metatórax y a partir del segundo segmento abdominal hasta el séptimo tienen cuatro chalazas a cada lado, el octavo dos a cada lado y el noveno no presenta. Lateralmente presenta la misma disposición y cantidad de chalazas que el estadio anterior; se diferencia en que la parte superior de las patas y propatas del mesotórax, metatórax y los primeros ocho segmentos abdominales, se observan cinco chalazas a cada lado rodeadas por setas blancas hialinas (Figura 1e). La cápsula cefálica es ovalada, de color verde hialino, con setas blancas hialinas cortas, mandíbula de color café y ancho promedio de 1.4 mm (1-2.2 mm, n = 9) (Tabla 4). Larva más robusta que en el anterior estadio. Para A. rossi se registra un valor del ancho de la cápsula cefálica entre 1.10-1.16 mm (n = 9) (Ross 1988) r al encontrado para M. mevania. 38 En cuanto a la duración promedio de este estadio, para M. mevania se encontró un valor de 4.2 días (3-7 días, n = 58) (Tabla 3), mientras que para A. rossi Ross (1964) encontró una duración mayor de 8-9 días (n = 9). Quinto estadio Al inicio del estadio la larva mide en promedio 19.2 mm de longitud (12-24 mm, n = 58), al finalizar 20.7 mm (17-25 mm, n = 58) (Tabla 4). Para A. rossi Ross (1964) encontró una longitud inicial de 12.0-13.4 mm (n = 8) y una longitud final de 14.9-16.6 mm (n = 8), por otro lado Hall et al. (2004) registran para Calydna sturnula una longitud total de 15.7 mm; valores menores a los encontrados para M. mevania. Presenta un cuerpo aplanado, dorsalmente es de color café verdoso que se va degradando lateralmente hasta llegar a verde claro en las patas y propatas; las tres líneas dorsales del anterior estadio presentan la misma disposición pero son más marcadas y la línea central cambia a una coloración verde claro, esta desaparece en el centro de cada segmento y es remplazada por cuatro puntos del mismo color, dos a cada lado, las líneas laterales también desaparecen en el centro de cada segmento pero no presentan puntos. Lateralmente hasta la base proximal de las propatas se observan puntos de un verde más claro que el de las líneas superiores. No presenta línea espiracular, los espiráculos son iguales a los del estadio anterior (Figura 1f). En este estadio también se observan chalazas primarias y secundarias con setas negras. En cuanto a las chalazas primarias tanto dorsal como lateralmente el protórax presenta 20 chalazas a cada lado y el último 39 segmento abdominal nueve a cada lado; las chalazas dorsales y laterales desde el mesotórax hasta el noveno segmento abdominal presentan la misma disposición y cantidad que el estadio anterior. La cápsula cefálica es igual a la del anterior estadio, más pequeña por el cuerpo más robusto, presenta un ancho promedio de 3 mm (2.1-3.5 mm, n = 58) (Tabla 4), comparado con A. rossi quien presenta valores de 1.93-2.10 mm (n =8) (Ross 1964), el valor son mayor. La larva es muy activa y se alimenta constantemente. La duración promedio de este estadio es de 4 días (2-7 días, n = 58) (Tabla 3), para A. rossi se presentan valores de duración mucho más altos entre 23-25 días (n = 8) (Ross 1964). Según la descripción de Stehr (1987) para las larvas de la familia Riodinidae se observa que las larvas maduras de M. mevania presentan las características descritas para la familia. Prepupa Presenta una duración promedio de 3.5 días (1-6 días, n = 58) (Tabla 3) la larva deja de comer y gradualmente la coloración de la larva se torna café oscuro, la línea dorsal del cuerpo y las propatas cambia a amarillo fuerte, mientras que las líneas paralelas a la línea media central y los puntos se mantienen de color verde esmeralda. Durante este estadio se desarrolla una base de seda sobre algún sustrato, que puede ser la hoja de la planta hospedera, el papel absorbente o la superficie del vaso por el cremaster. Una 40 vez adherida la larva perdió tamaño y las estructuras empezaron a cambiar (Figura 1g). La longitud promedio de este estadio es de 19.5 mm (17-23 mm, n = 58) (Tabla 3). Pupa La pupa mide en promedio 19 mm de longitud (17-21 mm, n = 58) por 5.9 mm de ancho (4-7 mm, n = 58) (Tabla 4), valores mayores a los encontrados para A. rossi con una longitud de 14.0-16.3 mm (n = 12) y una ancho de 4.85.9 mm (n = 12) (Ross 1964) y C. sturnula una con una longitud de 9.4 mm y un ancho de 4.0 mm (Hall et al. 2004). En los tres primeros días la pupa se oscurece, en la parte caudal presenta sedas blancas en toda la superficie pero en mayor densidad hacia la parte cefálica. Se observan ocho segmentos abdominales (Figura 1h y 2c). Solo se observan movimientos cuando es molestada. Un día antes de la emergencia la pupa se oscurece más, empezando por la parte cefálica. El imago emerge a los 28.4 días en promedio (25-32 días, n = 56) (Tabla 3). La pupa esta unida al sustrato por el cremaster y sostenida verticalmente por un cinto de seda que cruza dorsalmente por el abdomen, la zona cefálica se encuentra dirigida hacia abajo. La pupa de esta especie morfológicamente es muy diferente a la descrita para otras especies de riodinidos como A. rossi (Ross 1964) y C. sturnula (Hall et al. 2004) 41 Adulto El adulto presenta una coloración negra con azul oscuro tornasolado, en las alas anteriores presenta una un ocelo negro y una banda blanca (Figura 1i, 1j y 2d), más ancha en las hembras que coincide con las descripciones de Valencia, Gil y Constantino en el 2005 para esta especie. De las 58 pupas emergieron 56 adultos, solo dos machos y una hembra eran deformes (con las alas arrugadas), los dos restantes murieron tratando de emerger; no se observó ninguna tendencia para emerger primero machos o hembras. Se midió la envergadura alar de 73 individuos, para las hembras se encuentra un rango de 20-27 mm y para los machos de 20-26 mm lo que muestra muy poca diferencia entre los dos sexos; se observa entonces un rango más amplio de 20-27 mm que el indicado por Valencia, Gil y Constantino en el 2005 de 24-26 mm, y es un valor menor al encontrado por García-Barros en el 2000 para el género Mesosemia de 20.0 mm. Se encontró una proporción de sexos de 1:1, de 76 entre individuos tomados desde huevo y otros desde larva que emergieron 39 machos y 37 hembras, una proporción de sexos de este tipo indica un papel para machos y hembras de igual importancia, los machos protegen recursos seleccionados, esta proporción maximiza la diponibilidad de machos y maximiza la heterogeneidad genética, la cual aumenta la supervivencia de la población (Schowalter 2000). 42 6.1.2. Observaciones biológicas Se estudio un total de 43 posturas de las cuales 40 estaban agrupadas desde dos hasta diez huevos. En general se hallaron tres individuos por postura (Moda=3), solo tres posturas era huevos individuales, en contraste De Vries et al. (1992) registran para seis especies de Mesosemia y para la tribu Mesosemiini huevos individuales, esto sería un nuevo aporte para la tribu. De las 43 posturas 39 se encontraron en el borde del envés de la hoja, dos posturas en la parte central del envés de la hoja, cerca de la nervadura, una en el borde del haz de la hoja y otra en el tallo de la planta. Generalmente se encontró una postura por planta, solo en cuatro ocasiones se hallaron dos posturas en hojas diferentes de una misma planta, y en dos posturas en una misma hoja. En todas las posturas observadas el comportamiento de eclosión fue muy similar, todos los huevos de una misma postura tienden a eclosionar simultáneamente, con algunas excepciones: en tres posturas, hubo una diferencia de un día en el tiempo de eclosión de algunos huevos y en una postura de tres huevos uno eclosionó cuatro días después. Para las posturas encontradas en diferentes hojas de una misma planta la diferencia en el tiempo de eclosión entre posturas fue de dos días, posiblemente podrían fue la misma hembra que repartió sus posturas en una misma hoja. Finalmente para las dos posturas en una misma hoja la diferencia en el tiempo de eclosión fue de nueve días probablemente son de diferentes hembras, debido a que este es el único caso de dos posturas por hoja se puede concluir que la presencia de una postura en una planta por lo general inhibe una nueva ovoposición, de tal manera que las dos posturas por planta puede ser el resultado de escasez de plantas que obligaron a las hembras a aceptar 43 sustratos subóptimos para la ovoposición como lo indican Chew (1997) y Stamp (1980). La larva básicamente es solitaria, en algunos casos semi-gregaria, tolera otros instar, durante los primeros estadios se pueden encontrar desde dos hasta cinco individuos en diferentes partes de la hoja, en los estadios cuatro y cinco, solo se encontraron dos individuos por hoja. Por lo contrario De Vries et al. (1992) registran para seis especies de Mesosemia y en general para la tribu Mesosemiini larvas solitarias, en ningún momento semi-gregarias, al igual que para los huevos sería un nuevo registro para la tribu. Tal vez la característica mas interesante del comportamiento de la larva de M. mevania es su apariencia críptica, tanto en morfología (coloración y forma), como en comportamiento (posición de descanso sobre la planta hospedera), una apariencia críptica se encuentra acompañada de un comportamiento solitario, quizás por esta razón las larvas de esta especie sean básicamente solitarias, este comportamiento se encuentra descrito en Stehr (1987) y De Vries (1997) para las larvas de esta la familia Riodinidae. El color amarillo de los huevos, las larvas aplanadas y verdes en todos los instar, y el parecido de la pupa a una hoja seca o excremento de pájaro, los hacen lo suficientemente crípticos para pasar desapercibidos. Posiblemente esto reduce el ataque de predadores y parásitos; el estadio menos críptico es el huevo, de 43 posturas solo una se encontró parasitada, mientras que las larvas y pupas colectadas en campo no se encontró ninguna parasitada. Se observó que en todos los estadios las larvas se alimentan tanto en el día como en la noche, pero los estadios avanzados se alimentan principalmente en la noche, esto confirma lo dicho por De Vries en 1997 para el género 44 Mesosemia. En los primeros instares se alimenta de diferentes partes de la hoja, principalmente de la parte media, dejándola agujereada, mientras que en los estadios cuatro y cinco, se alimenta vorazmente de los bordes y presenta cortos períodos de reposo; cuando las larvas se dejaban sobre plantas, consumían todas las hojas y si no encontraban más alimento se observaban alimentándose del tallo. En los primeros estadios las larvas prefieren permanecer y alimentarse en el envés de la hoja esto, mientras que las larvas cuatro y cinco en el haz, posiblemente para pasar más desapercibidas por su similitud con el color de esta parte de la hoja. En todos los estadios la larva se adhiere con hilos a la superficie. Antes de la muda la larva deja de alimentarse, elabora una base de hilos de seda de donde se fija a la superficie por la parte caudal del cuerpo. Mientras muda la larva se encoge, la cabeza se desprende de la cápsula quitinosa y rompe por la franja hialina, por lo que se observa por un lado la cápsula y por el otro los restos del cuerpo. En el cuarto estadio se encontraron pocas cápsulas, posiblemente la larva comía parte de la exuvia. En el cuarto y quinto estadio cuando se manipulaba reiterativamente la larva, en algunas ocasiones emitía una secreción verde, probablemente repelente de artrópodos predadores como lo indican los estudios de Eisner & Meinwald (1965) y Damman (1986) para la familia Papilionidae. Antes de la formación de la pupa, la larva se oscurece y deja de comer, empieza a elaborar una base de hilos con la que se adhiere centralmente al sustrato, con la cabeza hacia abajo. Al formarse la pupa se detecta la exuvia con la cápsula cefálica adherida a ella y el cuerpo ha reducido su tamaño. Cuando el imago está listo para emerger, la pupa se abre lateralmente por las suturas cefálicas y sale el adulto, se agarra de la piel de la pupa con la cabeza hacia arriba y empieza a extender sus alas. Cuando ya ha expandido 45 totalmente las alas, el adulto excreta un líquido rojo, llamado el meconium, que es producto de los desechos metabólicos del estado pupal. Los adultos se encuentran usualmente volando en el sotobosque a menos de 2 m de altura, o en los claros hasta los 5 m, pasando de una planta a otra donde se posan con las alas abiertas sobre las hojas y pasan inadvertidas, confirmando lo observado por (Vélez & Salazar 1991; Minno & Emmel 1993; García-Robledo et al. 2002; Valencia et al. 2005). 6.1.3. Enemigos naturales No se observó la predación de huevos, larvas, pupas y adultos en campo. En cuanto a los parásitos se encontró el 4.6% de las posturas parasitadas, es decir de 43 posturas se encontraron dos parasitadas, el color de estos huevos es gris oscuro; en una de las posturas se observó que emergieron avispas de la familia Scelionidae, entre 29 y 31 días desde el día de su oscurecimiento. Este porcentaje de parasitismo tan bajo puede estar explicado porque esta especie posiblemente parasita otros hospederos diferentes (Linares & Estrada 1998). 6.2. Tabla de vida Para realizar la tabla de supervivencia de M. mevania se partió de 132 individuos en estadio de huevo a los cuales se les hizo el seguimiento de su ciclo de vida hasta que emergieron como adultos. Del total de individuos 56 (42%) alcanzaron el estado adulto. La mortalidad más alta ocurrió en las larvas del primer instar 34%, seguido de los huevos 17%, luego larva dos 8% 46 y larva tres 2%, para las prepupas y larvas de cuarto y quinto instar no se observó mortalidad (Tabla 5, Figura 3). Tabla 5. Tabla de supervivencia de Mesosemia mevania. Estadio Huevo Larva I Larva II Larva III Larva IV Larva V Prepupa Pupa Adulto Tabla de supervivencia de Mesosemia mevania ax lx dx qx 132 1.000 0.17 0.17 109 0.83 0.35 0.42 64 0.48 0.03 0.08 59 0.45 0.01 0.02 58 0.44 0.00 0.00 58 0.44 0.00 0.00 58 0.44 0.00 0.00 58 0.44 0.02 0.03 56 0.42 kx 0.019 0.032 0.031 0.031 0.030 0.030 0.030 0.031 ax: número observado al inicio de cada fase. lx: proporción de la cohorte original que sobrevive al inicio de la fase. dx: proporción de la cohorte original que muere durante cada fase. qx: tasa de mortalidad. kx: fuerza de mortalidad. La curva de supervivencia para M. mevania según Begon et al. (1999), Ricklefs & Millar (2000), Schowalter (2000), es de tipo III (cóncava), muestra una tendencia a una alta mortalidad en los estadios de huevo, larva uno y larva dos, esta se reduce una vez se superan estos estadios y resulta en una superviviencia casi constante (Figura 3). Sin embargo estos tasas de mortalidad de los primeros estadios es muy baja si se compara con los registros de Zalucki et al. (2002), para 80 especies de mariposas donde el 41% de los individuos muere en estadio de huevo y 54% en larva uno. 47 Curva de superviviencia de Mesosemia mevania 1,000 0,800 0,600 lx 0,400 0,200 Ad ul to pa Pu a V up Pr ep La rv a IV rv a III La II a rv La rv a I La a rv La H ue vo 0,000 Estadio Figura 3. Curva de superviviencia de Mesosemia mevania. La principal causa de mortalidad de los huevos no se pudo de terminar, solo un 4,6% de las posturas presento mortalidad por parasitoides; la mortalidad de las larvas de primer estadio se presentó principalmente en los primeros momentos de la eclosión, algunas larvas se extraviaron porque tal vez al morir se desecaban rápidamente y por su tamaño no se alcanzaban a observar, esto coincide con las observaciones de Zalucki et al. (2002). Probablemente la principal causa de mortalidad se dio por inanición ya sea porque las larvas no podían adherirse a la planta hospedera, o no encontraban en la hoja una parte adecuada para alimentarse (Zalucki et al. 2002). La muerte de las larvas cuando se trasladaban con pincel de una hoja a otra en los primeros días después de la eclosión confirma lo anterior. Sin embargo, como lo indican Zalucki et al. (2002), es difícil determinar la causa de la muerte incluso con observaciones intensas, según estos autores en la mayoría de los estudios las causas de mortalidad identificadas es por predadores basado en 41 estudios, por causas desconocidas para 18, por desaparición de las larvas para 14, por condiciones climáticas 12, y por el error al establecer la relación con el hospedero para 28 estudios. La 48 mortalidad encontrada en larva dos y tres pudo estar ocasionada porque el alimento no tenía los requerimientos necesarios, posiblemente por hojas deshidratadas, o por la presencia de hongos, bacterias o virus. 6.2. Planta hospedera La planta hospedera fue determinada como Notopleura macrophylla (Ruiz & Pav.) C. M. Taylor (Rubiaceae). Hasta hace poco algunas especies de esta género, incluyendo esta, se consideraban como Psychotria (Mendoza, Ramírez & Jiménez 2004). Este trabajo confirma registros anteriores de esta especie como hospedera de los estados inmaduros de M. mevania (GarcíaRobledo et. al. 2002; Valencia et al. 2005) la registran como Psychotria macrophylla. Al realizar el índice de dispersión (ID) indicado por Harms 1996 para cada uno de los cuadrantes se encontró que estos valores eran significativamente mayores que los de χ2 lo que indica que Notopleura macrophylla presenta una distribución agrupada en los dos parches de bosque en los cuales se encontraron huevos. La planta se observó en sotobosque de bosques nativos secundarios, nunca en plantaciones de ciprés o pino, en lugares muy sombreados y húmedos, más abundantes cerca de cuerpos de agua; esto confirma lo indicado por Mendoza y Ramírez (2000) para el género Psychotria quienes indican que los individuos de esta especie crecen generalmente en lugares sombreados en interior de bosque maduro y secundario. Algunas especies, como esta, se encuentran en lugares muy húmedos al lado de quebradas, por esta razón se encuentran agrupadas. 49 7. CONCLUSIONES o El ciclo de vida de M. mevania en el Parque Ecológico Piedras Blancas requiere entre 59 y 101 días para alcanzar el estado adulto, partiendo desde huevo. o Los huevos y las pupas son los estadios que más tiempo toman en su desarrollo, 17 y 20 días respectivamente, las larvas solo necesitan entre 4 y 7 días para pasar al próximo instar, esto muestra diferencias en el tiempo de duración entre los estados inmaduros del ciclo de vida. o Comparado con otras especies de mariposas la sobrevivencia de M. mevania en condiciones de laboratorio es alta. o La mayor mortalidad 35%, ocurrió en larva uno, probablemente por inanición; una vez las larvas alcanzaron el tercer estadio el porcentaje de supervivencia es del 96%. o La longitud de las larvas variaron desde 2.2 mm en su primer estadio hasta 20.7 mm para el quinto y la cápsula cefálica desde 0.5 mm en larva uno hasta 3 mm en larva cinco. El mayor incremento de longitud y del ancho de la cápsula cefálica se da en el paso de larva tres a larva cuatro. o Los estados inmaduros (huevo, larva y pupa) de M. mevania son crípticos. o Se identificó a Scelionidae (Hymenoptera) como parasitoide de M. mevania en estadio de huevos. o Las larvas de M. mevania son semi-gregarias y colocan huevos en pequeños grupos lo cual es un nuevo aporte para la tribu Mesosemiini. o La planta hospedera de M. mevania, N. macrophylla presenta un patrón de dispersión agrupado. 50 8. RECOMENDACIONES o Para enriquecer el conocimiento de la biología de M. mevania y complementar la información sobre su ciclo de vida, es necesario realizar investigaciones principalmente en el campo, que permitan conocer la longevidad de los adultos, su comportamiento de oviposición y cortejo, determinar las épocas de cría, y los principales controladores de las poblaciones en condiciones naturales. o Además, explorar si existen hospederos alternos para la especie y hacer estudios de herbivoría. o Para determinar la factibilidad de cría en cautiverio, es necesario adecuar un espacio que permita la reproducción de los adultos y así lograr un seguimiento de la especie durante varias generaciones. o Se recomienda realizar ANOVAS dentro de las posturas para observar las diferencias entre individuos en cuanto a duración, longitud inicial, longitud final y ancho de la cápsula cefálica. 51 9. REFERENCIAS AIELLO A. 1980. Life history of Dismorphia amphiona beroe (Lepidoptera: Pieridae: Dismophinae) in Panama. Psyche 87(3-4): 171-173. BEGON M., HARPER J. L. & C. R. TOWNSEND. 1999. Ecología: Individuos, Poblaciones y Comunidades. Ediciones Omega S.A. Barcelona. p. 158 – 162. BORROR D. J., TRIPLEHORN C. A. & N. F. JOHNSON. 1989. An Introduction to the Study of Insects. Sixth Edition. Thomson Learning. U.S.A. 875 p. BROWSER L. P., IVIE M. A., FINK L. S., WATTS J. R. & R. A. MORANZ. 1992. Life history of Anetia briarea and its bearing on the evolutionary relationships of the Danainae (Lepidoptera: Nymphalidae). Tropical Lepidoptera 3(2): 64-73. CALDAS A. 1994. Biology of Anaea ryphea (Nymphalidae) in Campinas, Brazil. J. Lep. Soc. 48(3): 248-257. CALLAGHAN C. J. 1988. Notes on the biology of three Riodininae species: Nymphidium lisimon attenuatum, Phaenochitonia sagaris satnius, y Metacharis ptolomaeus (Lycaenidae: Riodinidae). J. Res. Lepid. 27(2): 109114. 52 CALVO R. 1999. Éxito reproductivo de Caligo atreus (Lepidoptera: Nymphalidae) en condiciones de cultivo. Rev Biol Trop 47(3):539-544. CHEW F.S. 1977. Coevolution of Pierid butterflies and their cruciferous foodplants. II. The distribution of eggs on potencial foodplants. Evolution 31: 568-579. CONSTANTINO L.M. 1993. Notes of Haetera from Colombia, with descriptions of the immature stages of Haetera piera (Lepidoptera: Nymphalidae: Satyrinae). Tropical Lepidoptera 4(1): 13-15. CONSTANTINO L. M. 1996. Ciclos de vida y plantas hospederas de lepidópteros diurnos con potencial económico en condiciones de colinas bajas del Chocó biogeográfico. Investigación y manejo de fauna para la construcción de sistemas sostenibles. CIPAV, Cali, Valle. p. 75-86. CONSTANTINO L. M. 1997a. Conocimiento de los ciclos de vida y plantas hospederas de lepidópteros diurnos de Colombia como estrategia para el manejo, uso y conservación de poblaciones silvestres. En: Aconteceres Entomológicos. GEUN (Grupo de Entomología Universidad Nacional de Colombia), SOCOLEN (Sociedad Colombiana de Entomología Comité Antioquia). p. 57-89. CONSTANTINO L. M. 1997b. Natural history, immature stages and host plants of Morpho amathonte from western Colombia Nymphalidae: Morphinae). Tropical Lepidoptera 8(2): 75-80. 53 (Lepidoptera: CONSTANTINO L. M. & G. CORREDOR. 1997. The biology, and morphology of the early stages of Morpho macrophthalmus and Morpho peleides telamon (Nymphalidae: Morphinae) from western Colombia. Boletín Científico Museo Historia Natural Universidad de Caldas. 201-208. DAMMAN H. 1986. The osmaterial gland on the swallowtail butterfly Eurytides marcellus as a defence against natural enemies. Ecol. Ent. 11.261263. D´ABRERA B. 1984. Butterflies of South America. Hill House. Australia. 256 p. DE VRIES P. J. 1997. The butterflies of Costa Rica and their natural history. Princeton University Press, New Jersey. 327 p. DE VRIES P. J., CHACON I. A. & D. MURRAY. 1992. Toward a better understanding of host use and biodiversity in riodinids butterflies (Lepidoptera). J. Res. Lepid. 31(1-2): 103-126. EISNER T. & Y. C. MEINWALD. 1965. Defensive secretions of a caterpillar (Papilio). Science, N.Y. 150: 1733-1735. FAGUA G. & N. RUÍZ. 1996. Relaciones de herbivoría entre papiliónidas (Lepidoptera) y especies de Aristolochia (Aristolochiaceae). En: Insectos de Colombia, Estudios Escogidos. Andrade-C M. G., Amat-García G. & F. Fernández. Academia Colombiana de ciencias exactas, físicas y naturales, 54 Colección Jorge Álvarez Lleras No. 10, Coedición con el Centro Editorial Javeriano. p. 473-541. FAGUA G., RUIZ N., GONZÁLEZ F. & M. G. ANDRADE-C.1998. Calidad del hospedero en el ciclo de desarrollo de Battus polydamas (Lepidoptera: Troidini). Revista Colombiana de Entomología. 24(3-4): 131-140. FORISTER M. L. 2005. Influence of Host Plant Phenology on Mitoura nelsoni (Lepidoptera: Lycaenidae). Ann. Entomol. Soc. Am. 98(3): 295-301. FREITAS A. V. L. & P. S. OLIVEIRA. 1992. Biology and behavior of the neotropical butterfly Eunica bechina (Nymphalidae) with special reference to larval defense against ant predation. J. Res. Lepid. 31(1-2): 1-11. GALLUSSER S. A. 2002. Biology, Behavior and Taxonomy of two Oleria onega subspecies (Ithomiinae, Nymphalidae, Lepidoptera) in north-eastern Peru. Docteur ès Science. Université de Neuchâtel. Faculté des Sciences. Institut de Zoologie. Laboratoire d´Ecolgie Animale et Entomologie. Neuchâtel – Switzerland. 112 p. GARCÍA-BARROS E. 2000. Body size, egg size and their interspecific relationships with ecological and life history traits in butterflies (Lepidoptera: Papilionoidea, Hesperioidea). Biol. J. Linn. Soc. 70: 251-284. GARCÍA-ROBLEDO C., CONSTANTINO L. M., HEREDIA M. D. & G. KATTAN. 2002. Mariposas comunes de la Cordillera Central de Colombia. Wildlife Conservation Society – Programa de Colombia. 130 p. 55 GENC H., NATION J. L. & T. C. EMMEL. 2003. Life history of Phyciodes phaon (Lepidoptera: Nymphalidae). Florida Entomologist 86(4): 445-449. GIL Z. N. & F. J. POSADA. 2002. La cría de mariposas en cautiverio: una alternativa para el estudio de la biodiversidad en la zona cafetera colombiana. Revista Colombiana de Entomología 28(1): 61-68. GOH D. 1994. Life history of Trogonoptera brookiana albescens in Malaysia (Lepidoptera: Papilionidae). Tropical Lepidoptera 5(1): 1-5. GÓMEZ-S M. R. & G. FAGUA. 2002. Ciclo de desarrollo y hospederos de Heraclidas anchisiades (Lepidoptera: Papilionidae). Un modelo exploratorio para evaluar la sostenibilidad de la cría de mariposas ornamentales en la Comunidad Indígena de Peña Roja. Revista Colombiana de Entomología 28(1): 69-81. HALL J. P. W., HARVEY D. J. & D. H. JANZEN. 2004. Life history of Calydna sturnula with a review of larval and pupal balloon setae in the Riodinidae (Lepidoptera). Ann. Entomol. Soc. Am. 97(2): 310-321. HARCOURT D. G. 1966. Major Factors in Survival of the Immature Stages of Pieris rapae (L.). Can. Ent. 98: 653 – 662. HARMS K. 1996. ¿Cómo se miden los patrones de dispersión? p. 70 – 74 en: Gilbert G.S. & M. Mejía. Manual para las Investigaciones de Biología de 56 Campo. Instituto Smithsonian de Investigaciones Tropicales. Vicerrectoría de Investigación y Postgrado Universidad de Panamá. Panamá. HOLDRIDGE L.R. 1987. Ecología: basada en zonas de vida. Instituto Interamericano de Cooperación para la Agricultura. Costa Rica. HOLLOWAY J. D., BRADLEY J. D. & D. J. CARTER. 1992. IIE Guides to Insects importance to man. 1. Lepidoptera. International Institute of Entomology (An Institute of CAB International). The Natural Museum. Wallington – UK. 261 p. IDEAM. 2003. Informe de precipitación anual 1986 – 1992 Estación El Vivero. Instituto de Hidrología, Meteorología y Estudios Ambientales IDEAM, Medellín. LINARES PORTO M. & C. ESTRADA M. 1998. Predadores y parasitoides como reguladores de la densidad poblacional de mariposas del género Heliconius (Lep; Nymphalidae) en bosques con diferente grado de perturbación. Fundación para la promoción de la investigación y la tecnología. Universidad de los Andes. Santafe de Bogotá. 64 p. LOADER C. & H. DAMMAN. 1991. Nitrogen content food plants and vulnerability of Pieris rapae to natural enemies. Ecology 72(5): 1586-1590. LLORENTE-BOUSQUETS J., POZO-DE LA TIJERA C. & A. LUIS MARTÍNEZ. 1993. Anetia thirza (Lepidoptera: Nymphalidae) su ciclo de vida y distribución. Publ. Esp. Mus Zool. 7: 63-87. 57 MENDOZA H. & B. RAMÍREZ. 2000. Plantas con flores de la Planada. Guía Ilustrada de familias y géneros. Fundación FES Social. Instituto Humboldt Colombia. WWF. p. 133. MENDOZA H., RAMÍREZ B. R. & L. C. JIMÉNEZ. 2004. Rubiaceae de Colombia, Guía ilustrada de géneros. Instituto de Investigación de Recursos Biológicos Alexander Von Humboldt. Bogotá, Colombia. 351 p. MERRET P. J. 1993. Life history of Elymnias agondas glaucopis (Nymphalidae: Satyrinae), a pest of oil palm in Papua New Guinea. J. Lep. Soc.: 47(3): 229-235. MINNO M. C. & T. C. EMMEL. 1993. Butterflies of the Florida Keys. Scientific Publishers. Florida. 168 p. MURILLO L. R. & K. NISHIDA. 2003. Life history of Manataria maculata (Lepidoptera: Satyrinae) from Costa Rica. Rev. Biol. Trop 51(2): 463-470. MÜLLER C. J. & G. A. WOOD. 1999. The life history of Sabera fuliginosa fuliginosa (Miskin) (Lepidoptera: Hesperiidae) and additional hostplants for the member of the genus in the Northern Queensland. Australian Entomologist 26(4): 111-114. PAIM A. C., KAMINSKI L. A. & G. R. P. MOREIRA. 2004. Morfologia externa dos estágios imaturos de heliconíneos neotropicais: IV. Dryas iulias alcionea (Lepidoptera, Nymphalidae, Heliconiinae). Iheringia, Sér. Zool. 94(2). 58 PÉREZ C. 2001. Estadística Práctica con Statgraphics. Prentice Hall. España. 691 p. PRIETO A. V., CONSTANTINO L. M. & P. CHACÓN DE ULLOA. 1999. Estudios sobre cría de seis especies de mariposas (Lepidoptera: Rhopalocera) del bajo Anchicayá (Valle) y contribución al conocimiento de su historia natural. Revista Colombiana de Entomología 25(1-2): 23-32. RAMÍREZ D. A. 1992. Mariposas de Piedras Blancas (Antioquia), Distribución y abundancia. Seminario de grado presentado como requisito parcial para otorgar al título de Tecnólogo Forestal. Universidad Nacional, Seccional Medellín. Facultad de Ciencias Agropecuarias. 178 p. RICKLEFS R. E. & G. L. MILLER. 2000. Ecology. Fourth Edition. W. H. Freeman and Company. New York. 822 p. ROSS G. N. 1964. Life History Studies on Mexican Butterflies. II. Early stages of Anatole Rossi a new myrmecophilus metalmark. J. Res. Lep 3(2): 81-94. TORRES BAUZÁ J. A. 1991a. Dismorphia spio (Godart) en Puerto Rico (Lepidoptera: Pieridae: Dismorpiinae). Caribbean Journal of Science 27(1-2): 35-45. TORRES BAUZÁ J. A. 1991b. Biología de Eurema portoricensis (Dewitz) (Lepidoptera: Pieridae). Carib. J. Sci. 27(3-4): 124-129. 59 TORRES BAUZÁ J. A. 1999. Ciclo de vida de Eurema leuce antillarum Hall (Lepidoptera: Pieridae) en Puerto Rico. Caribbean Journal of Science 35(34): 195-200. SCHOWALTER T. D. 2000. Insect Ecology, An Ecosystem Approach. Academic Press. United States of America. 483 p. SCRIBER J. M. & P. FEENY. 1979. Growth of herbivorous caterpillars in relation of feeding specialization and the growth form of their food plants. Ecology 60(4): 829-850. STAMP N. E. 1980. Egg deposition patterns in butterflies: why do some species cluster their eggs rather than deposit them singly. The American Naturalist 115(3): 367-380. STEHR F. W. 1987. Order Lepidoptera, pp. 288-305. En: Immature Insects. Kendall / Hunt Publishing Company. United States of America. 784 p. URICH F. C. & EMMEL T. C. 1991a. Life histories of neotropical butterflies from Trinidad: 3. Morpho peleides insularis (Lepidoptera: Nymphalidae: Morphinae). Tropical Lepidoptera 2(2): 137-139. URICH F. C. & EMMEL T. C. 1991b. Life histories of neotropical butterflies from Trinidad: 4. Dynastor macrosiris (Lepidoptera: Brassolinae). Tropical Lepidoptera 2(2): 141-144. 60 Nymphalidae: VAIDYA V. G. 1969. Investigations on the role of visual stimuli in the egglaying and resting behavior of Papilio demoleus L. (Papilionidae, Lepidoptera). Anim. Behav. 17: 350-355. VALENCIA C. A., GIL Z. N. & L. M. CONSTANTINO. 2005. Mariposas Diurnas de la Zona Cafetera Central Colombiana. Cenicafé. Chinchiná (Colombia). 244p. VÉLEZ J. & J. SALAZAR. 1991. Mariposas de Colombia. Villegas Editores. Bogotá. 167 p. WATTS J. R. & D. H. HABECK. 1991. Immature stages of Anthanassa texana seminole (Lepidoptera: Nymphalidae). Tropical Lepidoptera 2(2): 103-106. WILLMOTT K. R., CONSTANTINO L. M. & J. P .W. HALL. 2001. A review of Colobura (Lepidoptera: Nymphalidae) with Comments on Larval and Adult Ecology and Descriptions of a Sibling Species. Annals of the Entomological Society of America 94(2): 185-196. YOUNG A. 1972. Notes on the Life Cycle and Natural History of Dismorphia virgo (Lepidoptera: Pieridae: Dismorphinae) in Costa Rica. Psyche 79(3): 165-178. ZALUCKI M. P., CLARKE A. R. & S. B. MALCOM. 2002. Ecology and Behavior of First Instar Larval Lepidoptera. Annu. Rev. Entomol. 47: 361-393. 61 -. 1996. Life histories of three Taenaris species (Nymphalidae: Amathusiinae) in Papua New Guinea. J. Lep. Soc. 50(3): 261-268. 62