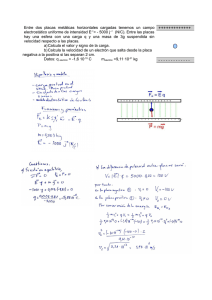
Biolixiviación de plata por Sphingomonas sp. a partir de radiografía
Anuncio

siler in UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS ―Biolixiviación de plata por Sphingomonas sp. a partir de radiografías y tarjetas de circuito impreso provenientes de teclados de computadora‖ TESIS Que para acreditar la Experiencia educativa: Experiencia Recepcional Programa Educativo: Ingeniería Química P r e s e n t a: ―Janeth Alducin Ruiz‖ Director: Dra. Rosalba Argumedo Delira Xalapa, Ver., Abril 2015 Esta tesis fue financiada por 55874 AGRADECIMIENTOS Agradezco a Dios, al creador de todas las cosas que me ha permitido llegar hasta este punto de mi vida y ver terminado uno de mis sueños. A mis padres que aparte de darme la vida, han sabido guiarme y aconsejarme para culminar cada objetivo. A pesar de la situación siempre he contado con su apoyo; nunca me han limitado, al contrario han estado allí para lograr uno a uno y sin ellos esto no se hubiera cumplido. También a mi novio por formar parte este trayecto, brindándome su paciencia, cariño y amor incondicional que fueron de gran apoyo, gracias. De igual forma la Dr. Rosalba Argumedo que como directora de esta tesis confió en mí, me dedicó parte de su tiempo, sabiduría y paciencia. Ha sido un privilegio contar con su guía y ayuda. Como último pero no menos importante a los amigos que de una manera u otra estuvieron presentes, Brenda, Erika, Mónica, Esther, Gaby, Analy, Jennifer, Odaia, Itxma, Deisy, Itzel, Yesica, Ariana y Annai. Biolixiviación de plata por Sphingomonas sp. a partir de radiografías y tarjetas de circuito impreso provenientes de teclados de computadora Janeth Alducin Ruiz Universidad Veracruzana, 2015 RESUMEN Los grandes avances tecnológicos han propiciado mejores condiciones de vida, pero poco se ha advertido del impacto negativo que se causa al ser humano, al medio ambiente y a los recursos naturales del planeta, debido a que aún somos incapaces de eliminar y tratar adecuadamente la basura tecnológica. Dentro de esta basura tecnológica se encuentran los residuos médicos y electrónicos. Es importante mencionar que algunos de estos residuos contienen metales valiosos como la plata, metal de gran importancia industrial y comercial. De los residuos médicos con mayor contenido de plata se encuentran las radiografías (RR). Mientras que los residuos electrónicos con mayor cantidad de plata se encuentran las tarjetas de circuito impreso de teclados de computadoras (RPCITC). Para la recuperación de plata a partir de RR y RPCITC se han empleado procesamientos hidrometalúrgicos y pirometalúrgicos, sin embargo, dichos procesamientos presentan desventajas energéticas y ambientales. Considerando lo anterior, la presente investigación se dio a la tarea de evaluar la capacidad de biolixiviación de plata que tiene la bacteria Sphingomonas sp. ante RR y RPCITC. Para llevar a cabo este objetivo se realizaron las siguientes etapas: 1) Desmantelamiento y raspado de RR y RPCITC, 2) Evaluación del crecimiento de la bacteria Sphingomonas sp. en diferentes cantidades de RR y RPCITC, 3) Biolixiviación de plata por Sphingomonas sp. a partir de RR y RPCITC y 4) Escalamiento de la biolixiviacion de plata con RR Y RPCITC. Los resultados obtenidos muestran que la biomasa seca de la bacteria es incrementada en la mayoría de los tratamientos con RR y RPCITC en comparación con sus respectivos controles, a los 15 y 30 días de incubación. En lo referente al pH se observa que Sphingomonas sp. al interactuar con los RR y RPCITC es capaz de disminuir el pH del medio de cultivo, casi igual al pH de los controles bióticos donde solo se encuentra la bacteria. Con respecto a la cantidad de plata biolixiviada se observó que incrementa al aumentar las inoculaciones y el tiempo de incubación, obteniendo un máximo de recuperación del 4.1% para RR y 2.4% para los RPCITC con los tratamientos inoculados tres veces e incubados por 30 días. Mientras que en el biorreactor, se obtuvo una biolixiviación del 40.1% para RR y 5.1% para RPCITC. Estos resultados deslumbran otra alternativa para recuperar plata a partir de estos residuos con la ayuda de la bacteria Sphingomonas sp. incrementando su potencial para biolixiviar plata al emplear otras condiciones de cultivo como las utilizadas en él biorreactor. Palabras clave: Plata, biolixiviación, bacteria, radiografías, residuos electrónicos ÍNDICE GENERAL Pág. ÍNDICE DE FIGURAS iv ÍNDICE DE TABLAS v 1. INTRODUCCIÓN 1 2. ANTECEDENTES 2 2.1. 2 Definición de residuos médicos y electrónicos 2.1.1. Residuo médico 2 2.1.2. Residuo electrónico 3 2.1.3. Radiografía o placa radiográfica 3 2.1.4. Placa de circuito impreso (PCI) de teclados de computadora 4 2.2. Uso de las placas radiográficas en la industria medica 5 2.3. Destino y manejo de las placas radiográficas en el 7 mundo y México 2.4. Destino y manejo de los teclados de computadoras en el mundo y México 8 2.5. Toxicidad e impacto ambiental de los residuos de placas radiográficas y PCI de teclados de computadoras 9 2.6. Alternativas para la recuperación de metales a partir residuos de placas radiográficas y PCI de teclados de computadoras 10 2.6.1. Procesamiento hidrometalúrgicas y pirometalúrgicas 11 2.6.2. Electroquímicos 11 2.6.3. Biológicos 12 2.7. Ventajas y desventajas del empleo de técnicas biológicas para la recuperación de metales a partir de residuos de placas radiográficas y PCI de teclados de computadora 13 2.8. Historia de la plata 13 i 2.9. Propiedades fisicoquímicas de la plata y algunas 15 aplicaciones 2.10. Importancia de obtener plata a partir de los residuos 16 de placas radiográficas y de las PCI de los teclados de computadoras 3. PLANTEAMIENTO DEL PROBLEMA 17 4. JUSTIFICACIÓN 18 5. OBJETIVOS 19 5.1. Objetivo general 19 5.2. Objetivos particulares 19 6. HIPÓTESIS 20 7. MARCO TEÓRICO 21 7.1. pH 21 7.2. Género Sphingomonas 21 7.3. Fases de crecimiento microbiano 22 7.4. Bioproceso 23 7.5. Enzima 23 7.6. Escala de McFarland 24 7.7. Biorreactor 24 7.8. Espectrometría de emisión óptica por plasma 24 acoplado inductivamente (ICP-OES) 7.9. Metal 25 7.10. Reacciones de óxido reducción 26 7.11. Métodos de lixiviación 26 8. MATERIALES Y MÉTODOS 28 8.1. 28 Evaluación del crecimiento de Sphingomonas sp. en diferentes cantidades de RR y RPCITC 8.1.1. Materiales biológicos 28 8.1.2. Desmantelamiento de los teclados de computadoras 28 8.1.3. Raspado de las placas de radiografías y de las PCI 28 ii de los teclados de computadora 8.1.4. Crecimiento de Sphingomonas sp. en diferentes cantidades de RR y RPCITC 29 8.2. 30 Biolixiviación de plata por Sphingomonas sp. a partir de RR y RPCITC 8.2.1. Biolixiviación de plata con una inoculación 30 8.2.2. Determinación de pH 30 8.2.3. Determinación de biomasa 31 8.2.4. Biolixiviación de plata 31 8.2.5. Biolixiviación de plata con doble inoculación 31 8.2.6. Biolixiviación de plata con triple inoculación 31 8.3. 31 Escalamiento de la biolixiviacion de plata con RR Y RPCITC 8.4. Análisis estadístico 32 9. RESULTADOS 33 9.1. Crecimiento bacteriano en diferentes cantidades de RR y RPCITC 33 9.2. Biolixiviación de plata por Sphingomonas sp. a partir de RR y RPCITC 33 9.3. Escalamiento de la biolixiviación de plata con RR Y RPCITC 38 10. DISCUSIÓN 41 10.1. Crecimiento bacteriano en diferentes cantidades de RR y RPCITC 41 10.2. Biolixiviación de plata por Sphingomonas sp. a partir de RR y RPCITC 41 11. CONCLUSIONES 43 12. RECOMENDACIONES 44 13. LITERATURA CITADA 45 iii ÍNDICE DE FIGURAS Pág. Figura 1. Partes de una placa radiográfica. a) gelatina, b) emulsión 3 de halogenuros de plata y c) base de poliéster. Figura 2. Placas radiográficas empleadas en diversos ámbitos. 4 Figura 3. PCI de teclado de 5 computadora compuesta por las películas de polipropileno flexibles (Whitchurch et al., 2009). Figura 4. Curva de crecimiento de los microorganismos a) fase de 23 lactancia b) fase logarítmica c) fase estacionaria d) fase de muerte (Hernández et al., 2003). Figura 5. Descripción general de la técnica de Espectrometría de 25 Emisión Óptica por Plasma Acoplado Inductivamente (ICP). Figura 6. Polvo obtenido de los residuos radiográficos y electrónicos 29 a) placa radiográfica y b) PCI de teclados de computadoras. Figura 7. Biomasa seca de Sphingomonas sp. con y sin residuos 33 radiográficos a temperatura ambiente (17 a 22 °C). a) 15 días de incubación y b) 30 días de incubación (Medias ± error estándar, n=3). Figura 8. Biomasa seca de Sphingomonas sp. con y sin residuos de 34 placas de circuito impreso de teclados de computadoras a temperatura ambiente (17 a 22 °C). a) 15 días de incubación y b) 30 días de incubación (Medias ± error estándar, n=3). Figura 9. pH del medio de cultivo de los tratamientos con 35 Sphingomonas sp. (biótico), residuos radiográficos (abiótico) y Sphingomonas sp. + RR a temperatura ambiente (17 a 22 °C). a) 15 días de incubación y b) 30 días de incubación (Medias ± error estándar, n=3). Figura 10. pH del medio de cultivo de los tratamientos con 36 Sphingomonas sp. (biótico), residuos de placas de circuito impreso iv de teclados de computadoras (abiótico) y Sphingomonas sp. + RPCITC a temperatura ambiente (17 a 22 °C). a) 15 días de incubación y b) 30 días de incubación (Medias ± error estándar, n=3). Figura 11. Plata biolixiviada de los residuos radiográficos por 37 Sphingomonas sp. a temperatura ambiente (17 a 22 °C). Medias ± error estándar, n=3. Figura 12. Plata biolixiviada de los residuos de PCI por 37 Sphingomonas sp. a temperatura ambiente (17 a 22 °C). Medias ± error estándar, n=3. Figura 13. Biomasa seca de Sphingomonas sp. producida en un 38 biorreactor a temperatura ambiente (17 a 22 °C). a) RR y b) RPCITC (Medias ± error estándar, n=3). Figura 14. pH del medio de cultivo del biorreactor donde se creció 39 Sphingomonas sp. a temperatura ambiente (17 a 22 °C). a) tratamientos con RR y b) material RPCITC (Medias ± error estándar, n=3). Figura 15 Plata biolixiviada en un biorreactor por Sphingomonas sp 40 ante RR y RPCITC (Medias ± error estándar, n=3). ÍNDICE DE TABLAS Pág. Tabla 1. Eventos históricos que permitieron la utilización de las 6 radiografías en el ámbito médico (Haus y Cullinan, 1989). Tabla 2. Comportamiento del pH en el medio de cultivo cuando se 35 expone a Shingomonas sp a RR y RPCITC. v 1. INTRODUCCIÓN Los grandes avances tecnológicos han propiciado mejores condiciones de vida en la sociedad actual, pero poco se ha advertido del impacto negativo que se causa al ser humano, al medio ambiente y a los recursos naturales del planeta, debido a que aún somos incapaces de eliminar y tratar adecuadamente a la basura tecnológica. Dentro de esta basura tecnológica se encuentran los residuos electrónicos y médicos. Los residuos electrónicos están constituidos por una gran variedad de equipos eléctricos y electrónicos obsoletos, mientras que los residuos médicos generalmente constan de papel, cartones, sangre o fluidos corporales, agujas, objetos punzocortantes, placas radiográficas, sustancias químicas tóxicas, etc. Es importante mencionar que algunos de estos residuos contienen metales valiosos como la plata, metal de gran importancia industrial y comercial. De los residuos con mayor contenido de plata se encuentran las placas de circuito impreso de los teclados de computadora (PCI, residuo electrónico) y las placas radiográficas (PR, residuo medico). Para la recuperación de plata a partir de estos residuos se han empleado procesamientos hidrometalúrgicos y pirometalúrgicos, los cuales, presentan desventajas energéticas y ambientales. Considerando lo anterior, se están buscando otras alternativas de menor impacto ambiental y energético que puedan recuperar plata a partir de estos residuos de una forma sustentable, evitando la obtención de este metal por la minería clásica que afecta a ecosistemas completos. Por lo que la presente investigación se dio a la tarea de evaluar la capacidad para lixiviar plata, mediante Sphingomonas sp. a partir de residuos de PCI y residuos radiográficos. La información obtenida se describe con mayor detalle en la presente tesis. 1 2. ANTECEDENTES Las PCI de teclados de computadora y las placas radiográficas que han concluido su vida útil se convierten en residuos electrónicos y médicos respectivamente. A continuación se darán algunas definiciones para entender mejor el tema. 2.1. Definición de residuos médicos y electrónicos 2.1.1. Residuo médico Los residuos médicos se generan principalmente en clínicas, hospitales, laboratorios diagnóstico y de investigación, bancos de sangre, clínicas dentales, clínicas de atención materno-infantil, hospitales veterinarios, centros de autopsia, asilos y morgues (Marinković et al., 2008). También incluyen desechos de los programas de vacunación, misiones de asistencia médica y desechos producidos cuando se cuida a un enfermo en casa (Singh y Prakash, 2007). Los residuos médicos se pueden clasificar en dos tipos: Residuos generales, los cuales no están regulados y se definen como residuos no peligrosos, es decir que no requieren de un manejo especial, tratamiento y disposición, como cartón, papel, cajas etc. (Taghipoura y Mosaferi, 2009). Residuos especiales, incluyen materiales que se consideran potencialmente riesgosos para la salud, que requieren especial manejo, tratamiento y disposición, tales como residuos químicos, residuos infecciosos y los residuos radiactivos, dentro de esta clasificación se encuentran las placas radiográficas (Prüss et al., 1999; Junco-Díaz et al., 2003). Otra forma de definir a los residuos hospitalarios es como a todo tipo de residuo de origen biológico o no biológico obtenido en un establecimiento médico, los cuales ya no tienen una posterior utilización (Rutala y Mayhall, 1992). 2 2.1.2. Residuo electrónico Se considera a los aparatos eléctricos y electrónicos que han concluido su tiempo de vida útil, volviéndose obsoletos, dentro de los cuales encontramos: computadoras, televisores, teléfonos celulares, teclados de computadoras, equipos de sonido y video, juguetes, herramientas, etc. (Mohan y Bhamawat, 2008; Nnorom y Osibanjo, 2009). También se define como cualquier aparato al que se le suministre energía eléctrica y termine su vida útil convirtiéndose en obsoleto (Widmer et al., 2005). 2.1.3. Radiografía o placa radiográfica La placa radiográfica consta de una base sobre la que se adhiere por las dos caras una emulsión (FujiFilm, 1990). La base es una hoja de poliéster de color azul con estructura rígida (Figura 1) y con un espesor de entre 0.2 y 0.1 mm, mientras que la emulsión está constituida por un 95% de AgBr y un 5% Agl (cristales planos y triangulares de aproximadamente 0.001mm) (Kodak, 1980). Cada emulsión está unida a la base mediante una capa de un material adhesivo, que impide su desprendimiento y ambas capas de la emulsión estas protegidas de las agresiones externas mediante una capa protectora de gelatina pura (FábregasMaury et al., 2002). Figura 1. Partes de una placa radiográfica. a) gelatina, b) emulsión de halogenuros de plata y c) base de poliéster. 3 Se utiliza la plata ya que es sensible a luz y esta se encuentra entre 1.5 a 2 % en cada una de las radiografías, estas placas son empleadas en el ámbito de investigación, industrial y médico (Figura 2) (Hamblin, 1962; Howell, 1996). Es importante mencionar que en la actualidad se toman aproximadamente 2 mil millones de radiografías en todo el mundo por cada año, en donde están incluidas mamografías, tomografías computarizadas, radiografías de tórax y dentales, etc. (Khunprasert et al., 2008). Figura. 2. Placas radiográficas empleadas en diversos ámbitos. 2.1.4. Placa de circuito impreso (PCI) de teclados de computadora La PCI de teclado se compone de dos películas de polipropileno flexible (Figura 3), en la que se imprimen los patrones conductivos en relación opuesta con una barrera de policarbonato (espaciador entre las dos películas), la barrera de policarbonato consta de varios orificios, los cuales se encuentran en las posiciones correspondientes a los puntos de contacto en las respectivas películas de polipropileno (Whitchurch et al., 2009). El patrón conductor se imprime con tinta eléctricamente funcional, en este caso la tinta está pigmentada con plata (Gan et al., 2009; Yang et al., 2010). Las películas flexibles se encuentran por debajo de las teclas del teclado. 4 Figura 3. PCI de teclado de computadora compuesta por las películas de polipropileno flexibles (Whitchurch et al., 2009). 2.2. Uso de las placas radiográficas en la industria medica Las radiografías han estado presentes desde la antigüedad a pesar de que los rayos X fueron descubiertos por Roentgen en el año de 1895. No obstante, hay una serie de eventos históricos que dieron lugar a la creación de las placas radiográficas actuales (Tabla 1), las cuales han sido de gran importancia para la industria médica al poder proporcionar un diagnóstico y ser una herramienta terapéutica (Robb, 1982; Haus y Cullinan, 1989). Las radiografías proporcionan imágenes del interior de nuestro cuerpo que hace muchos años no era posible y hoy es un gran logro, se puede realizar una radiografía en cualquier parte de cuerpo, un ejemplo de ello son las mastografías, tomografías, radiografías dentales y de todo el sistema óseo (Banerjee et al., 2012). Las mamografías o también llamadas mastografías, son representaciones planas de las glándulas mamarias por medio de placas radiográficas, las cuales son obtenidas gracias a los rayos X, este diagnóstico permite detectar lesiones no palpables a menos de 0.5 cm (Brandan y Villaseñor-Navarro, 2006). Las placas radiográficas también son utilizadas en las tomografías computarizadas por rayos X, las cuales se basan en la obtención de una imagen de cualquier parte del cuerpo, incluso de órganos (Ramírez-Giraldo et al., 2008). 5 Tabla1. Eventos históricos que permitieron la utilización de las radiografías en el ámbito médico (Haus y Cullinan, 1989). Año 1826 1839 1839 Persona/Compañía Joseph Nicephore Niepce Louis J.M. Doguerre Williams F. Talbot 1839 1851 1871 John Herschel Frederick Scott Archer Richard L. Maddox 1879 George Eastman 1895 1895 1896 William Conrad Roentgen William Conrad Roentgen Carl Schieusner 1896 1896 Kodak Thomas A. Edison 1896 Michael Pupin 1896 May Levy 1913 1916 Kodak Patterson Screen company 1918 1921 Kodak Patterson Screen company 1923 Kodak 1933 1934 1936 1942 1956 DuPont Patterson Screen company Ansco Pako Kodak 1960 1965 DuPont Kodak 1971 Kodak 1972 1977 1983 3M 3M Kodak Evento Primera fotografía permanente con cámara Descubrimiento de un material fotosensible Descubrimiento del método fotográfico negativopositivo Se acuña la palabra fotografía Descubrimiento del proceso colodión húmedo Descubrimiento de las placas secas al gelatinobromuro de plata Se inventa la máquina para el revestimiento por emulsión de las placas Se descubren los rayos X Se toma la primera radiografía medica Se fabrican las primeras placas de vidrio para las radiografías Introduce el primer papel para rayos X Se recomienda el tungstato de calcio para pantallas de fluoroscopia El primero en utilizar pantallas fluorescentes en combinación con placas fotográficas de vidrio. Hizo uso de las radiografías utilizando una película cubierta con doble emulsión entre dos pantallas fluorescentes intensificadas Introduce una película a base de nitrato de celulosa Producen pantallas intensificadoras fluorescentes con características mejoradas Introducen películas con doble emulsión Introducen pantallas fluorescentes con una capa protectora para su limpieza Introducen películas seguras a base de acetato de celulosa Introducen películas para rayos X teñidas de azul Introducen pantallas Patterson Par Speed Introducen películas de exposición directa a rayos X Introducen un procesador automático de películas Introducen un proceso de revelado de películas radiográficas con sistema de transporte por rodillos Hace la primera película a base de poliéster Introduce un proceso rápido de revelado (90 s) de películas Introducen pantallas que emiten en el ultravioleta para reducir el cruce luz en doble curvatura Introducen pantallas de tierras raras Introducen películas de bajo cruce Introduce la emulsión para películas radiográficas con grano tabular de haluros de plata 6 Esta técnica se basa en cuatro puntos: 1) mejorar la velocidad, 2) aumentar la resolución, 3) perfeccionar la calidad de la imagen y 4) minimizar la dosis de radiación hacia el ser vivo (Ramírez-Giraldo et al., 2008). Mientras que las radiografías dentales son una herramienta útil y necesaria en el diagnóstico y tratamiento de las enfermedades bucodentales como la caries, enfermedades periodontales y las patologías orales, sin embargo, las dosis de radiación en las radiografías dentales son bajas, ya que la exposición a la radiación debe minimizarse siempre que sea posible (ADACSA, 2006). 2.3. Destino y manejo de las placas radiográficas en el mundo y México Es importante mencionar que la información sobre el destino y manejo de los residuos radiográficos es escasa, sin embargo, se reporta que en Tailandia se recolecta una gran cantidad de placas radiográficas en hospitales (después de ser conservadas de 5 a 10 años para los registros), cada año se venden a distribuidores; los cuales se encargan de recuperar la plata por medio de electrolisis y lixiviación ácida principalmente. No obstante, el sistema de gestión de residuos radiográficos en este país presenta algunos inconvenientes: 1) hay demasiados distribuidores y procesadores de residuos radiográficos en Tailandia, sin embargo, no está claro a donde van todos los residuos radiográficos y quienes llevan a cabo su manejo, 2) algunos procesadores no oficiales de los residuos de plata, no se preocupan sobre si el tratamiento es verde, lo cual representa riesgos graves para los seres humanos, especialmente para los trabajadores y el medio ambiente, 3) existen pocos sistemas documentados sobre la gestión de los residuos radiográficos, lo que complica su control y monitoreo, 4) los residuos radiográficos están bajo el control de muchas autoridades, las cuales han establecido diferentes medidas para hacer frente a este tipo de residuos, sin embargo, las instituciones reguladoras de cada sección carecen de cooperación, lo que conduce a una brecha a nivel normativo y 5) el único procesador oficial de residuos radiográficos importa todos estos residuos de otros países para tratar de 7 recuperar la plata, lo que ha provocado que incremente el transporte de estos residuos desde otros países hacia Tailandia para su tratamiento final, lo cual involucra que toda la contaminación que se genere después del tratamiento de dichos residuos permanezca en esta nación (Khunprasert et al., 2008). Por otro lado, es evidente que en México también se tienen algunos de los problemas que presenta Tailandia, pues la mayoría de la población mexicana desconoce cuál es el destino final de estos residuos y sus implicaciones ambientales. Considerando lo anterior la investigadora Gretchen Lapidus Lavine de la Universidad Autónoma Metropolitana (UAM) ha llevado a cabo un proceso económico y sustentable para recuperar plata a partir de las placas radiográficas, y con esta técnica la investigadora pretende crear un centro de acopio de placas radiográficas, las cuales son residuos de los centros médicos (Lapidus-Lavine, 2011). 2.4. Destino y manejo de los teclados de computadoras en el mundo y México La mayor producción de residuos electrónicos (teclados de computadora) se encuentra en Estados Unidos, Canadá, Australia, Europa, Japón y Corea, sin embargo, a pesar de que existen acuerdos y convenios sobre la transferencia fronteriza de Residuos de Equipos Eléctricos y Electrónicos (REEE), estos países prefieren mandar sus residuos electrónicos a países subdesarrollos como Ghana, China, India y Pakistán para su tratamiento final (Ni y Zeng, 2009). Pero en estos países la recuperación de los materiales valiosos presentes en estos residuos es bajo condiciones infrahumanas y afectando gravemente al medio ambiente, así como a las personas que se encuentran cerca de estos lugares o en contacto directo con estos residuos debido a sus actividades laborales (Sepúlveda et al., 2010; Terazono et al., 2006). Por otro lado, en México existe poca información sobre la situación de los residuos electrónicos y la gran mayoría de los 2,443 municipios mexicanos no cuentan con 8 la infraestructura legal, medios económicos y medios humanos para hacer frente a los residuos sólidos urbanos de este tipo (UNEP, 2009). No obstante, está en proceso la aplicación de la reforma de la Ley General para la Prevención y Gestión Integral de los Residuos en materia de residuos electrónicos (Pérez-AlonsoGonzález et al., 2011). Adicionalmente la empresa mexicana Recicla Electrónicos México (REMSA) se ha dado a la tarea de hacer centros de acopio en casi todos los estados de la república, con el fin de fomentar el reciclaje de este tipo de residuos y aprovechar sus materiales valiosos para darles otro uso (REMSA, 2014). 2.5. Toxicidad e impacto ambiental de los residuos de placas radiográficas y PCI de teclados de computadoras La eliminación de la basura tecnológica de una forma no apropiada, ha provocado la contaminación del aire, suelo y cuerpos de agua, debido a que estos residuos contienen más de 1000 sustancias, muchas de las cuales son tóxicas (Huang et al., 2009). Por otro lado, es importante mencionar que el principal constituyente metálico de los residuos de placas radiográficas como de los residuos de las PCI de teclados de computadora es la plata (Chancerel et al., 2009). La plata es un metal pesado que se encuentra en una variedad de formas en el ambiente, por lo que es importante saber cómo se encuentra químicamente, para evitar que reaccione con otras sustancias y provoque la contaminación de ecosistemas terrestres y acuáticos (Purcell y Peters, 1998). Para el ser humano estar en contacto con la plata en sus formas solubles causa enfermedades, como la argiria que produce coloraciones entre gris-azulado en la piel o en los ojos (argiosis) (Gulbranson et al., 2000). También puede producir daños tóxicos en algunos órganos como hígado y riñones, en vías respiratorias y en el tracto intestinal (Drake y Hazelwoo|d, 2005). 9 Aunque la plata no se considera tan toxica para la salud del ser humano, debido a que no provoca mutaciones o cáncer (Hollinger, 1996). Pero, se considera altamente tóxica para las plantas acuáticas e invertebrados si se encuentra en una concentración de 50 µg de Ag L-1 en agua potable y 10 µg de aire total Ag m-3 (Eisler, 1996). 2.6. Alternativas para la recuperación de metales a partir residuos de placas radiográficas y PCI de teclados de computadoras En la actualidad para la recuperación de metales a partir de residuos electrónicos y médicos las técnicas más utilizadas son las hidrometalúrgicas y pirometalúrgicas. 2.6.1. Procesamiento hidrometalúrgico y pirometalúrgico El proceso hidrometalurgico consiste en la extracción de metales por medio de soluciones acuosas y orgánicas, se utiliza una gran variedad de reactivos como ácido nítrico, agua regia, ácido clorhídrico, ácido sulfúrico, cloruro férrico, etc. (Gramatyka et al., 2007). Para recuperar a los metales de interés es común que se realicen 3 etapas: 1) lixiviación, 2) concentración de la solución y 3) purificación y obtención de los metales (Silva et al., 2005). En la segunda etapa la solución se expone a procesos de separación como sedimentación, precipitación, filtración intercambio iónico, y extracción con disolventes (Ruiz et al., 2007). Mientras que en la tercera etapa se utilizan procesos de precipitación, intercambio iónico y electrolisis para obtener al metal de interés (Jha et al., 2001). Algunos de los ejemplos donde se utiliza este procesamiento para la obtención de Ag a partir de las placas radiográficas es el estudio de Moreno-García (1986) quien sumerge a las radiografías en soluciones de cianuro, cloruro férrico y ácido nítrico obteniendo una recuperación del 99% de Ag. También se ha reportado la recuperación de plata (97%) a partir de radiografías utilizando ácido oxálico al 1% 10 y a una temperatura de 97 °C, logrando separar eficientemente la plata del poliéster (Syed et al., 2002). Otra técnica reportada para la recuperación de plata a partir de las placas radiográficas es la utilización de peróxido de hidrógeno en un pH de 5.5, obteniendo una recuperación del 91.5% (Mahdizadeh et al., 2014). Por otro lado, dentro de los procesamientos pirometalúrgicos se encuentra el tostado, fundición, conversión y refinación (Havlik et al., 2010; Ojeda et al., 2009). Generalmente esta técnica es menos eficiente que el proceso hidrometalúrgico con una recuperación menor del 95%, además utiliza temperaturas mayores a 950 °C para destruir el poliéster de las placas radiográficas (Masebinu y Muzenda, 2014). Un ejemplo de este procesamiento es el uso de incineradores para recuperar la plata proveniente de las películas fotográficas, este equipo tiene la capacidad de incinerar 4500 lb h-1 de este material con una eficiencia de recuperación del 99% (Ewell y Piper, 1970). Finalmente, cabe mencionar que ambos procesamientos presentan desventajas energéticas y ambientales, como la generación de gases tóxicos en el caso de los procesos pirometalúrgicos y grandes cantidades de efluentes corrosivos y lodos para los procesos hidrometalurgicos (Zhouxiang et al., 2008). 2.6.2. Electroquímicos Los sistemas electroquímicos deben contener dos electrodos separados por un electrolito, los cuales son conectados a través de un conductor electrónico externo, donde los iones fluyen a través del electrolito desde un electrodo al otro, y el circuito se completa por los electrones que fluyen a través del conductor externo (Newman y Thomas-Alyea, 2004). Este tipo de sistemas también se ha utilizado para recuperar plata a partir de las placas radiográficas, tal es el caso de Ramírez et al. (2011) quienes reportan una recuperación del 99.8%, con un bajo consumo de energía (0.387 KWh kg-1) y alta eficiencia de corriente. 11 2.6.3. Biológicos Los procesos bilógicos son técnicas donde se utilizan microorganismos, es decir hay una interacción entre el microorganismo y el metal, lo que permite su recuperación y por consiguiente la reutilización del metal (Brierley, 2008). En lo referente al uso de microorganismos y sus enzimas para recuperar plata a partir de las placas radiográficas se encuentra el trabajo Choudhary (2013) quien utiliza una proteasa alcalina producida por el hongo Aspergillus versicolor P/F/107, (aislado de una granja de aves de corral) para hidrolizar las capas de emulsión de las radiografías, la enzima se mantuvo en contacto con las placas radiográficas a 50 C y pH=9, obteniendo una recuperación de 0.135 g de plata con un rendimiento del 0.335%. Mientras que Masui et al. (2004), reportan que la hidrolisis de las capas de emulsión de las radiografías es mucho más rápida empleando una enzima mutante termo estabilizada obtenida de la proteasa alcalina de Bacillus sp. B21-2 que con proteasas alcalinas convencionales en un reactor de tanque agitado y pH=10.5. Otro ejemplo interesante es la utilización del extracto enzimático proveniente de Bacillus subtilis ATCC6633 para remover la plata de las placas radiográficas, teniendo como condiciones un pH=8 y una temperatura de 50 °C, recuperando 0.4013 g plata con una pureza del 99.16% (Nakiboğlu et al., 2001). También se ha reportado la utilización de la proteasa alcalina proveniente de Conidiobolus coronatus, la cual se ha puesto en contacto con las radiografías y es capaz de extraer toda la emulsión dejando libre el poliéster a 40 °C y pH=10 (Shankar et al., 2010). De igual forma la proteasa alcalina proveniente del hongo Purpureocillium lilacinum LPS # 876 logro remover las capas de emulsión de las radiografías y liberar partículas de plata dentro de 6 min a 60 °C y pH=9.0 (Cavello et al., 2013). Cabe mencionar que son escasos los estudios fisicoquímicos, electroquímicos y biológicos sobre la recuperación de plata a partir de las placas de circuito impreso provenientes de los teclados de computadoras por lo cual no son mencionados en el presente escrito. 12 2.7. Ventajas y desventajas del empleo de técnicas biológicas para la recuperación de metales a partir de residuos de placas radiográficas y PCI de teclados de computadoras En lo referente a los tratamientos biológicos para la recuperación de metales estos poseen más cosas positivas que los tratamientos hidrometalúrgicos y pirometalurgicos, que son más costosos y que generan grandes cantidades de contaminantes (Jadhav y Hocheng, 2012). Algunas ventajas y desventajas se mencionaran a continuación. Ventajas: La recuperación de metales es menos costosa que con los métodos tradicionales. Son procesos biotecnológicos amigables con el medio ambiente al generar residuos menos peligrosos que con los procesamientos fisicoquímicos. Requieren un gasto energético mínimo. Los microorganismos empleados en los procesos de recuperación son aislados del medio ambiente. Desventajas: Son procesos lentos No se cuenta con una eficiencia del 100% para obtener al metal. En la mayoría de los procesos no se obtiene directamente al metal. Se requieren cuidados constantes para evitar las contaminaciones (Pant et al., 2012; Rodríguez et al., 2001). 2.8. Historia de la plata El país número uno en producción de plata es México (con un 20% de la producción mundial), seguido de los Estados Unidos, Canadá, Perú y Chile (Morones-Ramírez, 2010). 13 La plata es conocida como ―metal de acuñación‖ gracias a su uso antiguo, por lo cual es uno de los primeros metales conocidos por el hombre; su nombre se deriva del latín argentum y del griego upyog, argos (brillante o blanco), la cantidad de plata que se encuentra en la corteza terrestre es de 0.08 mgL-1 (Greenwood y Earnshaw, 1997). Se cree que las primeras extracciones de plata se dieron en las minas de Asia Menor y el uso más antiguo que se ha documentado por una civilización ocurrió en el año de 3500 a. C., en donde Menes, el primer faraón del imperio egipcio, escribió el Código de Menes donde señalaba que el valor de dos partes y media de plata correspondían a una parte de oro (Gale y Stos-Gale, 1981). Mientras que en Mesopotamia alrededor del año 3000 a. C., la plata se consideró como un material llamativo y valioso, y se tomó como base para compararlo con cualquier otro artefacto que se quisiera cambiar, posteriormente se fabricaron arillos de plata que se convirtieron en la moneda de ese tiempo (Pringle, 1998). Los romanos saquearon las minas de su vasto imperio que llegaba hasta lo que es ahora España y Portugal, llegando a perfeccionar las técnicas para trabajar la plata, que condujo al uso de este metal en la fabricación de utensilios y contenedores, para uso de la realeza, y en la construcción de complejos patrones y figuras que decoraban diversos ornamentos (Lucas, 1928). Entre tanto, en la época prehispánica la plata era extraída principalmente de las minas de Taxco Zumpango en Guerrero, México, y se fundía en pequeños hornos utilizando crisoles de arcilla, posteriormente se martillaba para producir laminas que se labraban con la finalidad de elaborar objetos para los santuarios dedicados a los dioses de los antiguos mexicanos (Coll-Hurtado et al., 2002). Por otro lado, el nitrato de plata se convirtió en la edad media en algo esencial para la medicina, al utilizarse en heridas crónicas, quemadura y úlceras, además de emplearse como un método alternativo para la cauterización del hierro (Silver et al., 2006). 14 2.9. Propiedades fisicoquímicas de la plata y algunas aplicaciones La plata metálica nativa es prácticamente pura, pero se produce en muy pequeñas cantidades, generalmente en forma cristalina, como agujas, filamentos y redes arborescentes, aunque también se ha encontrado (raramente) en pepitas y placas delgadas; los principales minerales de plata son el sulfuro de plata, solo o asociado con los sulfuros de antimonio o arsénico, y el cloruro de plata (Lucas, 1928). La plata es un metal sólido, blanco, brillante, muy dúctil y maleable el cual tiene una variedad de propiedades que la hacen deseable para la industria, gracias a estas características en muchas ocasiones se han hecho aleaciones con cobre y oro para fortalecer y facilitar el trabajo; es el mejor conductor de la electricidad y de calor que se puede conocer, pero no se utiliza con frecuencia por su alto costo (Vogel, 1969). La plata es uno de los metales más abundante y menos costoso de los metales preciosos (oro, plata, paladio y platino) (Morones-Ramírez, 2010). Se encuentra en el grupo IB de la tabla periódica, su número atómico es 47, trabaja con valencia 1+, con masa atómica de 107.83 g mol-1, peso específico de 10.5 N m-1 y sus electrones están arreglados en el siguiente orden en cada órbita: 2, 8, 18, 18, 1, es invulnerable al fuego, aire y agua; el ácido nítrico la disuelve formando el nitrato de plata (Delfin-Figueroa, 1966). Día con día el número de aplicaciones de plata va en acenso no solo en el ámbito médico sino también en nuestra vida cotidiana (Franke, 2007). La plata tiene una gran variedad de utilidades, una de ella es como agente antimicrobiano, reconocido durante muchos años para inhibir las infecciones y en el cuidado de quemaduras, heridas y úlceras (Leaper, 2006 ; Alexander, 2009). Además de una variedad de productos de supermercado como filtros de agua, lavadores de frutas y verduras y ungüentos, asimismo en la fabricación de soldaduras, dispositivos eléctricos-electrónicos, utensilios y en la joyería (Renner et al., 2001; Silver, 2003). 15 2.10. Importancia de obtener plata a partir de los residuos de placas radiográficas y de las PCI de los teclados de computadoras En los últimos años se ha incrementado la demanda de plata, debido a sus ya conocidos usos y a sus nuevas aplicaciones en forma de nanopartículas (eléctrica, química, médica, etc.), por lo que se debe buscar la manera de extraer a este metal de una forma sustentable (Jain et al., 2009). La plata es extraída convencionalmente por procesos mineros, los cuales involucran la remoción de grandes cantidades de suelo que contaminan y agreden a los ecosistemas presentes en los lugares donde se realizan las actividades mineras (Fleming, 1992). Considerando lo anterior varios países han buscado la forma de obtener metales de una manera sustentable, sugiriendo la extracción de estos metales a partir de fuentes secundarias como lo son los residuos de otras industrias, no obstante, otra problemática que tiene la recuperación de metales a partir de fuentes secundarias es que también generan sustancias contaminantes, por lo cual la búsqueda de técnicas biológicas, para obtener metales a partir de fuentes secundarias se considera de gran importancia (Tuncuk et al., 2012). Por otra parte, una ventaja que tiene la obtención de plata a partir de los residuos de las placas radiográficas (12 kg t-1) y de las PCI de los teclados de computadoras (0.7 kg t-1) es que contienen generalmente más plata que los minerales (1.3-2.4 kg t-1) donde se extrae este metal, adicionalmente se pueden obtener con mayor pureza (Purcell y Peters, 1998; Abdel-Aal y Farghaly, 2007). 16 3. PLANTAMIENTO DEL PROBLEMA El progreso tecnológico han causado que los teclados que acompañan a las computadoras de escritorio se vuelvan obsoletos en poco tiempo, mientras que las placas radiográficas al cumplir su función ya no tengan otro uso, y al no contar con una legislación vigente al respecto, terminan en los basureros como cualquier residuo sólido afectando al ambiente y a la salud humana. Debido a que las PCl provenientes de los teclados de computadora y las radiografías contienen plata, un metal pesado que puede ocasionar cambios estéticos y daños tóxicos en algunos órganos de los seres humanos (hígado, riñones, vías respiratorias y en el tracto intestinal). Además de bioacumularse en los seres vivos que se encuentren expuestos a altas concentraciones de este metal, afectando su metabolismo. 17 4. JUSTIFICACIÓN Tomando en cuenta que la plata se encuentra en muy pocas cantidades en la corteza terrestre, y la forma de extraerla daña a ecosistemas enteros, estas razones han hecho que la plata se vuelva un metal valioso y con un alto costo en el mercado por sus diversas aplicaciones. Por lo cual, es de vital importancia que en México se busquen fuentes secundarias como lo son las PCl de los teclados de computadora obsoletos y las placas radiográficas usadas, para su obtención. Esta alternativa, tiene la ventaja de ser sustentable y evitaría la afectación de los ecosistemas por el uso de los procesos mineros tradicionales. Adicionalmente la utilización de microorganismos para su recuperación evitaría la generación de sustancias altamente contaminantes y reduciría los gastos energéticos. Considerando lo anterior, la presente investigación se justifica al crear información relevante e innovadora sobre la recuperación de plata a partir de PCl y placas radiográficas empleando Sphingomonas sp., de la cual no existen muchos reportes. Adicionalmente esta información será básica para posteriormente escalar dicho procedimiento. 18 5. OBJETIVOS 5.1. Objetivo general Determinar la capacidad de Sphingomonas sp. para recuperar plata a partir de Residuos de Radiografías (RR) y Residuos de Placas de Circuito Impreso de Teclados de Computadoras (RPCITC). 5.2. • Objetivos particulares Conocer el crecimiento de la bacteria Sphingomonas sp. en diferentes cantidades de RR y RPCITC. • Evaluar la biolixiviación de plata a partir RR y RPCITC por Sphingomonas sp. • Realizar el escalamiento de la biolixiviación de plata a partir de RR y RPTCITC por Sphingomonas sp. en un pequeño biorreactor. 19 6. HIPÓTESIS La cantidad de RR y RPCiTC en el medio de cultivo, el número de inoculaciones, la agitación (oxígeno disuelto) y el tiempo de incubación serán factores decisivos para incrementar la biolixiviación de plata de Sphingomonas sp. 20 7. MARCO TEÓRICO 7.1. pH El pH es el logaritmo negativo de la concentración de iones hidronio H3O+, para saber si una solución es ácida o básica depende de la cantidad de iones hidronio H+ que contenga esta. La escala de pH tiene como neutro al valor de pH=7, si el pH es mayor que este es básico y si es menor será ácido (Atkins y Jones, 2007). 7.2. Género Sphingomonas El género Sphingomonas pertenece a la familia Sphingomonadaceae, fue descrito por Yabuuchi y Cols en 1990 y registrado por Takeuchi y Colsi en 1993, las bacterias que pertenecen a este género son bacilos no esporulados, gram negativos que tienen un único flagelo polar cuando son móviles, además son aerobios estrictos, quimioorganotróficos, producen catalasa y sus colonias generalmente son de amarillas a blancas marrón (Winn et al., 2008). Del género se conocen más de 20 especies, y de acuerdo a sus características filogenéticas, quimiotaxonómicas y fenotípicas se subdividieron en tres nuevos géneros: Sphingobium, Novosphingobium y Sphingopyxis (Takeuchi et al., 2001). Estas bacterias se encuentran distribuidas en el suelo, el agua y en los sedimentos, se sabe que tienen la capacidad de degradar hidrocarburos poliaromáticos y precipitar uranio (Fredrickson et al., 1995; Nilgiriwala et al., 2008). Por otro lado, dentro de este género bacteriano Sphingomonas paucimorbilis es un patógeno humano, ya que causa infecciones hospitalarias y provoca endoftalmitis (inflamación de los tejidos intramusculares) considerada de las más devastadoras enfermedades (Martínez y Ovalle, 2013; Mauri-Garrido et al., 2014). 21 7.3. Fases de crecimiento microbiano Está representada por una curva, la cual expresa el comportamiento del microorganismo a través del tiempo y las fases de crecimiento son: Fase de latencia: coincide con el periodo de adaptación a las condiciones de cultivo y ambientales, se presenta enseguida de la inoculación y su duración depende del estado fisiológico de la célula inoculada, durante este periodo no existe aumento en el número de células. Fase logarítmica o exponencial: las células se multiplican a su máxima velocidad, la velocidad de crecimiento durante este periodo es constante, esta fase se termina cuando ocurre unas de estas tres situaciones: 1) los nutrientes se agotan, 2) las condiciones ambientales se modifican y 3) cuando la célula produce metabolitos. Fase estacionaria: la velocidad de crecimiento (reproducción) del microorganismo es igual a la velocidad de muerte y se llega a un equilibrio celular. Fase de muerte: inicia cuando los nutrientes que están en el medio de cultivo no son suficientes para que el microorganismo se reproduzcan, por lo que las células mueren (Figura 4) (Hernández et al., 2003; Madigan et al., 2006). 22 Figura 4. Curva de crecimiento de los microorganismos a) fase de lactancia b) fase logarítmica c) fase estacionaria d) fase de muerte (Hernández et al., 2003). 7.4. Bioproceso Un bioproceso involucra los procesos mediante los cuales determinados sustratos (nutrientes) son transformados por acción biológica (microorganismos, células, tejidos y enzimas) en productos como biomasa, antibióticos, hormonas, fermentos, vacunas, ácidos orgánicos, amino ácidos, biocombustibles, etc., y servicios tales como biorremediación, biolixiviación y tratamiento de efluentes (Duque, 2010; Liu, 2013). 7.5. Enzima Las enzimas son proteínas especializadas en la catálisis de las reacciones químicas que tienen lugar en la célula, son muy eficaces como catalizadores y son altamente específicas, ya que cada una de ellas induce la transformación de un sólo tipo de sustrato, la vida no es posible sin ellas (McGilvery, 1977). Desde el punto de vista químico, son proteínas globulares, algunas de ellas con estructura cuaternaria, para cumplir su función requieren conservar su estructura nativa, en particular se destaca una región conocida como sitio activo, que es responsable de catalizar la reacción (Lehninger et al., 2004). 23 7.6. Escala de McFarland Se utiliza principalmente para visualizar aproximadamente la concentración de células en una suspensión, está representada por la concentración especifica de UFC (unidades formadoras de colonias) mL-1 de una escala que va de 5 a a10, y está diseñada para determinar la concentración bacteriana. Los estándares son realizados al mezclar soluciones de cloruro de bario ( 1%) con ácido sulfúrico (1%) en volúmenes específicos, dichas soluciones deben ser almacenadas en un recipiente sellado a una temperatura de 20-25 °C, en la oscuridad. Esta técnica tiene la ventaja de que los estándares no necesitan tiempo o equipos de incubación para estimar el número de bacterias. Mientras que las desventajas son la subjetividad en la determinación de la turbidez. Para medir la cantidad de colonias también se puede utilizar el espectrómetro para estimar la turbidez directamente (Sutton, 2011). 7.7 Biorreactor Los biorreactores son recipientes que contienen sustratos, nutrientes y células libres, en un ambiente controlado, de tal forma que se produzcan uno o más productos, el objetivo del diseño de biorreactores es pasar de los biorreactores de laboratorio a la producción a gran escala de un producto determinado de una forma económica y fiable (Moreno-Grau y Bayo-Bernal, 1996). 7.8 Espectrometría de emisión óptica por plasma acoplado inductivamente (ICP-OES) En esta técnica, la mayoría de las muestras se introducen como líquidos y un sistema de nebulización forma un aerosol que es transportado por argón a la antorcha del plasma, acoplado inductivamente por radio frecuencia (Blades y Horlick, 1981). En el plasma, debido a las altas temperaturas (6000 °K) generadas, los analitos son atomizados e ionizados, es decir las partículas de los analitos son disociadas en átomos libres, generándose los espectros de emisión atómica que 24 presentan líneas características (Hou y jones, 2000). Los espectros son dispersados por una red de difracción y el detector sensible a la luz se encarga de medir las intensidades de las líneas (Figura 5). La información es procesada por el sistema informático y los datos cuantitativos se obtienen relacionando la intensidad de emisión con la concentración en una curva de calibración (Scott et al., 1974). Figura.5. Descripción general de la técnica de Espectrometría de Emisión Óptica por Plasma Acoplado Inductivamente (ICP). 7.9 Metal Elementos químicos que presentan buena conductividad térmica y eléctrica, resistencia relativamente alta, gran rigidez y buena resistencia a los choques eléctricos. Tienen utilidad especial en aplicaciones estructurales, adicionalmente los metales se mezclan para mejorar determinadas propiedades (Askeland, 1998). 25 7.10 Reacciones de óxido reducción En una reacción de óxido-reducción, se presenta una semireacción en donde existe una pérdida de electrones (reducción), y una semireacción donde ocurre una ganancia de electrones (oxidación) (Chang y College, 2002). Por otro lado, desde el punto de vista histórico el término oxidación toma su nombre de los procesos en que una sustancia gana oxígeno, se dice que la especie química que toma oxigeno se ha oxidado y la que lo ha perdido se ha reducido., sin lugar a dudas el O2 es el agente más común pues se adiciona fácilmente a otro elemento o compuesto para formar el óxido correspondiente (Garritz y Chamizo, 1998). 7.11 Métodos de lixiviación Se encuentra una variedad de métodos en el que los microorganismos extraen metales, dentro de los cuales se encuentran la biolixiviación de minerales y de materiales sólidos. Biolixiviación de minerales, descrita principalmente para las bacterias del género Thiobacillus: 1. Biolixiviación microbiana indirecta: no se lleva a cabo un contacto entre la bacteria y la superficie del mineral, y la oxidación se da por medio de reacciones enzimáticas. 2. Biolixiviación microbiana directa: en este mecanismo la bacteria oxida directamente al mineral por acción química, al producir un metabolito lixiviante, como ácidos orgánicos que disminuyen el pH (Bosecker, 1997). Biolixiviación de materiales sólidos: Una diversidad de microorganismos (hongos y bacterias) bajo condiciones ambientales adecuadas, se han dado a la tarea de poder solubilizar y obtener metales de materiales sólidos ricos en metales, esto se realiza gracias a la 26 formación de ácidos orgánicos, agentes complejantes o enzimas; en la actualidad esta técnica se utiliza para obtener metales preciosos de residuos sólidos industriales y cenizas (Krebs et al., 1997). 27 8 MATERIALES Y MÉTODOS 8.1 Evaluación del crecimiento de la Sphingomonas sp. en diferentes cantidades de RR y RPCITC 8.1.1 Material biológico Sphingomonas sp. se aisló de suelo de los alrededores del relleno sanitario el Tronconal, Xalapa-Veracruz, México (con residuos de pilas, computadoras y placas de circuito impreso). Dicha bacteria ha sido caracterizada morfológicamente, microscópicamente, bioquímicamente, molecularmente y con perfiles lipídicos (Monroy-Martínez, 2015). 8.1.2 Desmantelamiento de los teclados de computadoras El desmantelamiento de los teclados de computadora se realizó empleando una variedad de desarmadores, ya que los teclados de computadoras obsoletos tienen alrededor de 20 tornillos de diferentes tamaños, posteriormente se obtuvo la placa de circuito impreso (PCI) que se encuentra dentro. 8.1.3 Raspado de las placas de radiografías y de las PCI de los teclados de computadora Las PCI de los teclados de computadora y las placas radiográficas se rasparon con una navaja de afeitar para remover la película de plata en el caso de las PCI y la gelatina de plata en el caso de las radiografías hasta que se obtuvo un polvo fino en ambos casos (Figura 6). 28 Figura 6. Polvo obtenido de los residuos radiográficos y electrónicos a) placa radiográfica y b) PCI de teclados de computadoras. 8.1.4 Crecimiento de Sphingomonas sp. en diferentes cantidades de RR y RPCITC Sphingomonas sp. se cultivó en cajas Petri con agar nutritivo (Bioxon®) a 28 °C por 4 días. Transcurrido este tiempo se realizó una suspensión bacteriana con una concentración de 107 UFC mL-1, utilizando la escala de Mcfarland. Posteriormente a tubos de plástico con capacidad de 50 mL se les agregaron 25 mL de medio mineral estéril (g L-1): 1.5 (NH4)2SO4; 0.5 Na2SO4; 0.25 MgCl2; 0.25 CaCl2 y 20 glucosa; pH 5.6. Luego se adicionaron 0.1 y 0.01g de polvo de radiografías y de PCI respectivamente. Posteriormente se le agregaron 3 mL de la suspensión bacteriana. Finalmente se dejaron incubar a temperatura ambiente (17 a 22 °C) y 500 rpm durante 30 días. Se utilizó un control abiótico (sin bacteria) y un control biótico (sin material). Concluido el tiempo de incubación se determinó el crecimiento de Sphingomonas sp. Es importante mencionar que Sphingomonas sp. es de lento crecimiento, por lo cual se utilizaron tiempos de incubación largos (15 y 30 días). 29 8.2 Biolixiviación de plata por Sphingomonas sp. a partir de RR y RPCITC De acuerdo a lo realizado por Yang et al. (2009), quienes evaluaron el efecto de diferentes inoculaciones de Acidithiobacillus ferrooxidans en la biolixiviación de Cu a partir de PCI. El presente estudio realizó una metodología en la cual se pudiera evaluar el efecto de las inoculaciones de Sphinghomonas sp., en la biolixiviación de Ag a partir de RR y RPCITC. 8.2.1 Biolixiviación de plata con una inoculación Sphingomonas sp. se cultivó en cajas Petri con agar nutritivo (Bioxon®) a 28 °C por 4 días. Transcurrido este tiempo se realizó una suspensión bacteriana con una concentración de 107 UFC mL-1. Posteriormente a tubos de plástico con capacidad de 50 mL se les agregaron 25 mL de medio mineral (g L -1): 1.5 (NH4)2SO4; 0.5 Na2SO4; 0.25 MgCl2; 0.25 CaCl2 y 20 glucosa; pH=5.6. Luego se adicionaron 0.01 g de polvo de las radiografías a cada tubo. Después se le agregaron 3 mL de la suspensión bacteriana. Finalmente se dejaron incubar a temperatura ambiente (17 a 22 °C) y 500 rpm durante 15 y 30 días respectivamente. Se utilizó un control abiótico (sin bacteria) y un control biótico (sin material), todos los tratamientos contaron con tres replicas. Concluido los tiempos de incubación se filtraron y se centrifugaron los tratamientos de acuerdo a Ilyas et al. (2007). Es importante mencionar que el papel filtro empleado (Whatman No. 4) permite el paso de la bacteria, por lo cual se centrifugo a 3000 rpm por 10 min para recuperar el paquete bacteriano. 8.2.2. Determinación de pH Después de filtrar y centrifugar al sobrenadante obtenido se le midió el pH con un medidor de pH (Hanna®, Mod. HI98129), previamente calibrado con el buffer de pH=4 (Hanna®, HI 7004). 30 8.2.3. Determinación de biomasa El paquete bacteriano obtenido de la centrifugación, se secó en una estufa a una temperatura de 30 °C durante 168 h, hasta llegar a peso constante. Finalmente se procedió a pesar cada muestra para obtener su peso seco. 8.2.4. Biolixiviación de plata Al sobrenadante que se le midió el pH, se acidifico con 1 mL de HNO3 concentrado, posteriormente se analizó en un espectrómetro de emisión óptica ICP (Varian ® Mod. 725-ES) para cuantificar el contenido de Ag biolixiviada. 8.2.5. Biolixiviación de plata con doble inoculación De igual forma se empleó la metodología antes descrita para los tratamientos con dos inoculaciones, con la variante de que los tratamientos que se dejaron incubando por 15 días, se inocularon una segunda vez al cuarto día de incubación, mientras que los tratamientos que se incubaron por 30 días, se incubaron por segunda vez al décimo día de incubación. 8.2.6. Biolixiviación de plata con triple inoculación También para estos tratamientos se utilizó la metodología antes descrita, solo que los tratamientos que se dejaron incubando por 15 días, se inocularon una segunda vez al cuarto día de incubación y una tercera vez al octavo día de incubación. Mientras que los tratamientos que se incubaron por 30 días, se incubaron por segunda vez al décimo día de incubación y una tercera vez al veintavo día de incubación. 8.3. Escalamiento de la biolixiviacion de plata con RR Y RPCITC Sphingomonas sp. se cultivó en cajas Petri con agar nutritivo (Bioxon®) a 28 °C por 4 días. Transcurrido este tiempo se realizó una suspensión bacteriana a una concentración de 107 UFC mL-1. Posteriormente a recipientes de plástico con 31 capacidad de 3000 mL se les agregaron 1000 mL de medio mineral (g L -1): 1.5 (NH4)2SO4; 0.5 Na2SO4; 0.25 MgCl2; 0.25 CaCl2 y 20 glucosa; pH 5.6. Luego se adicionaron 0.13 g de polvo de las radiografías y 1 g de polvo de PCI a cada recipiente. Después se le agregaron 120 mL de la suspensión bacteriana a cada respectivo recipiente. Finalmente se dejaron incubar a temperatura ambiente (17 a 22 °C) y 1000 rpm durante 15 días. Se utilizó un control abiótico (sin bacteria) y un control biótico (sin material), todos los tratamientos contaron con dos replicas. Al terminar los tiempos de incubación se determinó el pH, la biomasa seca total y la cantidad de Ag biolixiviada utilizando un espectrómetro de emisión óptica ICPOES (Varian ® Mod. 725-ES). 8.4. Análisis estadístico Para los experimentos de biolixiviación donde se determina el efecto de la incubación y las inoculaciones se empleó un diseño experimental completamente al azar utilizando un factorial 2x3x2 (2 residuos, 3 inoculaciones y 2 tiempos de incubación). Mientras que para el escalamiento se empleó un factorial 2x1(2 residuos, 1 microorganismo). Cada tratamiento tuvo tres repeticiones. Los datos obtenidos fueron analizados mediante análisis de varianza y la prueba de comparación de medias (Tukey, α=0.05) con el programa estadístico SAS. 32 9. RESULTADOS 9.1. Crecimiento bacteriano en diferentes cantidades de RR y RPCITC Los ensayos realizados para conocer la cantidad apropiada de RR y RPCITC, que no afectara el crecimiento de Sphingomonas sp., muestran que 0.1 g de RR no permiten el crecimiento de la bacteria, debido a que no se observó la turbidez característica del crecimiento bacteriano. Mientras que con 0.01 g de RR, si se observó el crecimiento de la bacteria. En el caso de los RPCITC, 0.1 g no provocó ningún efecto negativo en el desarrollo de la bacteria. 9.2. Biolixiviación de plata por Sphingomonas sp. a partir de RR y RPCITC La biomasa seca de Sphingomonas sp. no muestra diferencias significativas (P≤0.001) entre los tratamientos con RR, RPCITC y los controles, encontrando que la biomasa es incrementada en los tratamientos con residuos radiográficos en comparación con sus respectivos controles, a los 15 días de incubación (Figura 7). Figura 7. Biomasa seca de Sphingomonas sp. con y sin residuos radiográficos a temperatura ambiente (17 a 22 °C). a) 15 días de incubación y b) 30 días de incubación (Medias ± error estándar, n=3). 33 Mientras que a los 30 días de incubación se puede observar el mismo comportamiento, pero se obtuvo mayor cantidad de biomasa en la primera inoculación (0.23 g), sin embargo en la tercera inoculación el control de dicho tratamiento presentó mayor biomasa seca. Entretanto, en los tratamientos con residuos de PCI de teclados el comportamiento es similar al descrito con los residuos de radiografías, a diferencia de que la mayor cantidad de biomasa seca se produjo en los tratamientos con residuos electrónicos en la tercera inoculación al ser incubados por 15 días (0.33 g) y en los controles al ser incubados por 30 días (Figura 8). Figura 8. Biomasa seca de Sphingomonas sp. con y sin residuos de placas de circuito impreso de teclados de computadoras a temperatura ambiente (17 a 22 °C). a) 15 días de incubación y b) 30 días de incubación (Medias ± error estándar, n=3). En lo referente al pH se encontraron diferencias significativas (P≤0.001) entre los tratamientos con RR, RPCITC, controles abióticos y controles bióticos. Además se observa que Sphingomonas sp. al interactuar con los residuos radiográficos es capaz de disminuir el pH del medio de cultivo, casi similar al pH de los controles bióticos donde solo se encuentra la bacteria, ya que los controles abióticos (donde se encuentra el RR con medio de cultivo) presentan un pH más alto (5.2), a los 15 y 30 días de incubación (Figura 9). La bacteria sigue disminuyendo el pH, 34 encontrando que con tres inoculaciones el pH del control es casi igual al de los tratamientos con radiografías (Tabla 2). Tabla 2. Comportamiento del pH en el medio de cultivo cuando se expone a Shingomonas sp. a RR y RPCITC. pH Una inoculación Tratamiento Control biótico Control abiótico Dos inoculaciones Tratamiento Control biótico Control abiótico Tres inoculaciones Tratamiento Control biótico Control abiótico RR (15 días) RR (30 días) RPCITC (15 días) RPCITC (30 días) 4.5 4.3 5.2 4.0 3.6 5.1 4.7 4.3 5.8 4.5 4.2 5.9 4.4 4.3 5.2 4.5 3.8 5.2 4.7 4.5 5.7 4.8 4.0 5.9 4.5 4.3 5.2 4.4 3.6 5.2 4.7 4.6 5.6 3.7 3.7 5.9 Figura 9. pH del medio de cultivo de los tratamientos con Sphingomonas sp. (biótico), residuos radiográficos (abiótico) y Sphingomonas sp. + RR a temperatura ambiente (17 a 22 °C). a) 15 días de incubación y b) 30 días de incubación (Medias ± error estándar, n=3). 35 Por otro lado, para los residuos de teclados de computadoras, observamos un comportamiento similar al observado en los residuos radiográficos a los 15 y 30 días de incubación. También la bacteria sigue acidificando a los tratamientos con RPCITC (Figura 10). Figura 10. pH del medio de cultivo de los tratamientos con Sphingomonas sp. (biótico), residuos de placas de circuito impreso de teclados de computadoras (abiótico) y Sphingomonas sp. + RPCITC a temperatura ambiente (17 a 22 °C). a) 15 días de incubación y b) 30 días de incubación (Medias ± error estándar, n=3). En lo referente a la cantidad de plata biolixiviada por Sphingomonas sp., se observaron diferencias significativas (P≤0.001) entre los tratamientos con una, dos y tres inoculaciones, encontrando que al incrementar el número de incubaciones se incrementa la cantidad de plata biolixiviada, obteniendo una biolixiviación máxima de 2.48% a los 15 días de incubación y 4.13% a los 30 días (Figura 11). 36 Figura 11. Plata biolixiviada de los residuos radiográficos por Sphingomonas sp. a temperatura ambiente (17 a 22 °C). Medias ± error estándar, n=3. Figura 12. Plata biolixiviada de los residuos de PCI por Sphingomonas sp. a temperatura ambiente (17 a 22 °C). Medias ± error estándar, n=3. 37 Mientras que para los residuos de PCI se observó que la biolixiviacion de plata llevada a cabo por Sphingomonas sp. tiene un comportamiento semejante al encontrado con residuos radiográficos, pero la biolixiviación es menor puesto que se obtiene una biolixiviación del 0.78% y 2.35% para los 15 y 30 días de incubación respectivamente (Figura 12). 9.3. Escalamiento de la biolixiviación de plata con RR Y RPCITC. La biomasa seca de Sphingomonas sp. producida en un biorreactor muestra diferencias significativas (P≤0.001) entre los tratamientos con RR, RPCITC y sus respectivos controles, encontrando una mayor producción de biomasa en los tratamientos con residuos radiográficos (2.19 g) y RPCITC (1.10 g) respectivamente (Figura 13). Figura 13. Biomasa seca de Sphingomonas sp. producida en un biorreactor a temperatura ambiente (17 a 22 °C). a) RR y b) RPCITC (Medias ± error estándar, n=3). Por otra parte, el pH de los biorreactores donde se creció a la bacteria Sphingomonas sp presentan diferencias significativas (P≤0.001) entre los tratamientos con RR, RPCITC, controles abióticos y controles bióticos. Se observa que el pH de los tratamientos abióticos con RR aumenta ligeramente el pH inicial 38 (5.6) por presencia del residuo (5.9), puesto que el pH del control biótico (3.8) y de los tratamientos inoculados con la bacteria en presencia de RR (4.9) presentan un pH menor. Entretanto para los RPCITC el pH del medio de cultivo en los biorreactores se ve disminuido al pH inicial por acción del residuo (control abiótico) y de la bacteria (control biótico). Cabe mencionar que la bacteria en presencia de los RPCITC provoca que el pH del medio de cultivo disminuya más (3.7) en estos tratamientos (Figura 14). Figura 14. pH del medio de cultivo del biorreactor donde se creció Sphingomonas sp. a temperatura ambiente (17 a 22 °C). a) tratamientos con RR y b) material RPCITC (Medias ± error estándar, n=3). Es importante aclarar que se empleó una agitación más elevada (mayor cantidad de oxígeno disuelto en el medio de cultivo de los biorreactores), lo cual logro que la biolixiviación de plata se incrementará considerablemente en los residuos radiográficos (40.1%) y un poco en los RPCITC (5.1%), dichos resultados se observan mejor en la Figura 15. 39 Figura 15. Plata biolixiviada en un biorreactor por la bacteria Sphingomonas sp. ante RR y RPCITC (Medias ± error estándar, n=3). 40 10. DISCUSIÓN 10.1. Crecimiento bacteriano en diferentes cantidades de RR y RPCITC Considerando que la toxicidad de cualquier sustancia química está en función de su dosis, frase acuñada por el químico suizo Paracelsus (1493-1541) que hasta nuestros días se considera como un axioma de la toxicología moderna (Deichmann et al., 1986; Stirling, 2006). Podemos inferir que en el caso del RR y RPCITC este axioma se cumple para Sphingomonas sp.. Sin embargo, es claro que los componentes de los RR (AgBr y AgI) son más tóxicos para la bacteria probada que los presentes en los RPCITC, lo cual puede estar relacionado con el efecto tóxico que presentan los halógenos para bacterias como Escherichia coli (Stoimenov et al., 2002), 10.2. Biolixiviación de plata por Sphingomonas sp. a partir de RR y RPCITC El crecimiento bacteriano medido directamente por la biomasa seca de Sphingomonas sp. ante los residuos de radiografías y electrónicos ha sido difícil de comparar por la escasa información existente sobre este tema. No obstante, se ha reportado que la biomasa de Sphingomonas sp. DX-T3-03 se ve disminuida al incrementar la dosis de metales como Cd, Pb, Hg y Ni, en un medio de cultivo rico en nutrientes (Xie et al., 2010). Sin embargo, en este estudio se observa que la biomasa se incrementa en los tratamientos con RR y RPCITC, posiblemente a que el medio mineral utilizado solo contiene metales como Mg, Na, K, y Ca, y como fuente de carbono glucosa, lo cual obliga a la bacteria a utilizar a los metales presentes en los residuos. Además de que la concentración de plata contenida en la cantidad de residuos empleados no provoco un efecto tóxico a la bacteria que le impidiera disminuir su crecimiento. Con respecto al pH se ha reportado que algunas especies que pertenecen al género Sphingomonas son capaces de alcalinizar su entorno o acidificarlo dependiendo de las condiciones en las que se encuentren (Hashidoko, 2005). 41 Cuando estas bacterias se encuentran en presencia de metales son capaces de producir ácidos orgánicos, tal es el caso de Sphingomonas pituitosa que produce ácido oxálico, ácido cítrico y ácido málico ante dosis crecientes de aluminio (Panhwar et al., 2014). Dicha información nos hace inferir que en el caso de los tratamientos con RR y RPCITC y sus respectivos controles se estén produciendo estos ácidos orgánicos. Es importante mencionar que la metodología de biolixiviación empleada para la recuperación de plata a partir de RR y RPCITC no ha sido reportada, lo cual hace valiosa a esta información al ser una aportación científica, dicha razón hace difícil comparar estos resultados. Sin embargo, para el caso de RR se ha informado que la recuperación de plata empleando a la enzima proteasa alcalina proveniente de diversos microorganismos es una biotecnología prometedora. Tal es el caso de la proteasa alcalina obtenida de Bacillus subtilis ATCC6633 que es capaz de recuperar 0.4013 g de plata con una pureza del 99%, mientras tanto la proteasa alcalina proveniente del hongo Aspergillus versicolor puede recuperar 0.135 g de plata con un rendimiento del 0.33% (Nakiboğlu et al., 2001; Choudhary, 2013). La biolixiviación de plata llevada a cabo por Sphingomonas sp. con respecto a la proteasa alcalina producida por Bacillus y Aspergillus, es aceptable en el caso del biorreactor, ya que se tiene una recuperación de plata del 40.1%, sin emplear una temperatura de 50 °C, lo cual potencializa su utilización en un futuro al hacer más eficiente la recuperación de plata a partir de RR por esta técnica. 42 11. CONCLUSIONES En primera instancia los objetivos planteados se cumplieron es su totalidad, y podemos concluir que: 1) la bacteria Sphingomonas sp. es capaz de lixiviar plata dependiendo de las condiciones de cultivo y del residuo empleado, 2) la biolixiviación de plata se llevó a cabo en medios ácidos, acondicionados por la presencia de la bacteria, 3) al aumentar el número de inoculaciones de la bacteria Sphingomonas sp. se incrementa la biolixiviación de plata, 4) entre mayor sea el tiempo de incubación mayor es la biolixiviación del metal, 5) la velocidad de agitación directamente relacionado con el oxígeno disuelto en el medio de cultivo, es un factor importante para incrementar la biolixiviación de plata a partir de los RR y 6) mejorar algunas condiciones de cultivo podría incrementar las capacidades de la bacteria Sphingomonas sp. y potencializar su lixiviación de plata. 43 12. RECOMENDACIONES A continuación se mostraran algunas recomendaciones que se deberían considerar: Evitar la contaminación de los medios de cultivo donde se crezca a la bacteria Sphingomonas sp. Inocular los medios de cultivo con la bacteria Sphingomonas sp. fresca no mayor a 7 días de su crecimiento en cajas Petri. El material raspado de los RR y RPCITC es recomendable que sean del menor tamaño posible y sin plástico para que el microorganismo entre en mayor contacto con este material. No poner mucha cantidad de RR y RPCITC para no inhibir el crecimiento de la bacteria Sphingomonas sp., realizar un ensayo de tolerancia previo. Tener en cuenta la temperatura, ya que entre más baja sea más lento es el crecimiento de bacteria Sphingomonas sp. Buscar recipientes que resistan a la esterilización además que su composición no influya en el crecimiento del microorganismo. 44 13. LITERATURA CITADA Abdel-Aal, E.A., Farghaly, F.E. (2007). Preparation of silver powders in micron size from used photographic films via leaching–cementation technique. Powder Technology. 178: 51-55. Alexander, J.W., (2009). History of the medical use of silver. Surgical Infections.10: 289-292. American Dental Association Council on Scientific Affairs (ADACSA). (2006). The use of dental radiographs: update and recommendations. The Journal of the American Dental Association.137: 1304-1312. Askeland, D.R. (1999). Ciencia e ingeniería de los materiales, tercera edición, International Thomson Editores, pp. 778. Atkins, P.W., Jones, L.L. (2007). Principios de química los caminos del descubrimiento, tercera edición. Editorial Médica Panamericana, Argentina, pp. 736. Banerjee, A.K., Beckmann, E., Busch, U., Buzzi, A., Thomas, A. (2012). Historia de la radiología. Sociedad Europea de Radiología, Austria, pp. 90. Blades, M.W., Horlick, G. (1981). Interference from easily ionizable element matrices in inductively coupled plasma emission spectrometry—a spatial study. Spectrochimica Acta Part B: Atomic Spectroscopy. 36: 881-900. Bosecker, K. (1997). Bioleaching metal solubilization by microorganisms. FEMS Microbiology Reviews. 20: 591-604. Brandan, M.E., Villaseñor-Navarro, Y. (2006). Detección del cáncer de mama: estado de la mamografía de México. Cancerología. 1: 147-162. Brierley, C. (2008). How will biomining be applied in future?. Transactions of Nonferrous Metals Society of China. 18: 1302-1310. Cavello, I.A., Hours, R.A, Cavalitto, S.F. (2013). Enzymatic hydrolysis of gelatin layers of x-ray films and release of silver particles using keratinolytic serine Proteases from Purpureocillium lilacinum LPS # 876. Journal of Microbiology and Biotechnology. 23: 1133-1139. 45 Chancerel, P., Meskers, C.E.M., Hagelüken, C., Rotter, V.S. (2009). Assessment of precious metal flows during preprocessing of waste electrical and electronic equipment. Journal of Industrial Ecology. 13: 791-810. Chang, R., College, W. (2002). Química, séptima edición, McGraw-Hill, Colombia, pp. 1000. Choudhary, V. (2013). Recovery of silver from used X-ray films by Aspergillus versicolor protease. Journal of Academia and Industrial Research. 2: 39-41. Coll-Hurtado, A., Sánchez-Salazar, M.T., Morales, J. (2002). La minería en México, Primera edición, Instituto de Geografía, UNAM, México, pp. 119. Deichmann, W.B., Henschler, D., Holmstedt, B., Keil, G., 1986. What is there that is not poison? A study of the third defense by Paracelsus. Arch Toxicol. 58, 207-213. Delfin-Figueroa, M. (1966). Química general elemental, Editorial Porrúa, S.A., México, pp. 427. Drake, P.L., Hazelwood, K.J. (2005). Exposure-related health effects of silver and silver compounds: A review. Annals of Occupational Hygiene. 49: 575-585. Duque, J.P. (2010). Biotecnología panorámica de un sector, Editorial Netbiblo, España, pp.107. Eisler, R. (1996). Silver hazards to fish wildlife and invertebrate: a synoptic review. National Biological Service Biological Report. 32: 1-36. Ewell, T.W., Piper, J. (1970). Design of new silver-recovery incinerator. Eastman Kodak Company. New York, pp. 234. Fábregas-Maury, J., Estrany-Coda, F., Pujol, R.O. (2002). Recuperación de la plata de las radiografías. Técnica Industrial. 245: 32-37. Fleming, C.A. (1992). Hydrometallurgy of precious metals recovery. Hydrometallurgy. 30: 127-162. Franke, S. (2007). Microbiology of the toxic noble metal silver. In: Nies, D.H., Silver S. (Eds). Molecular microbiology of heavy metals, Springer-Verlag, Berlin Heidelberg, pp. 343-352. 46 Fredrickson, J.K., Balkwill, D.L., Drake, G.R., Romine, M.F., Ringelberg, D.B., White, D.C. (1995). Aromatic-degrading Sphingomonas Isolates from the deep subsurface. Applied and Environmental Microbiology. 61: 1917-1922. FujiFilm. (1990). Fuji Film Technical Handbook: The fundamentals of industrial radiography. Fujifilm Corporation. Tokyo, pp. 32. Gale, N.H., Stos-Gale, Z.A. (1981). Ancient egyptian silver. The Journal of Egyptian Archaeology. 67: 103-115. Gan, W., Zhang, H., Huang, B., Zhang, J., Zhou, H. (2009). Research on electronic property of low-temperature curing silver-based paste. Electronic Components and Materials. 2: 1-4. Garritz, A. Chamizo, J.A. (1998). Química, Pearson Prentice Hall, México, pp. 885. Gramatyka, P., Nowosielski, R., Sakiewicz, P. (2007). Recycling of waste electrical and electronic equipment. Journal of Achievements in Materials and Manufacturing Engineering. 20: 535-538. Greenwood, N.N., Earnshaw, A. (1997). Chemistry of the elements, Butterworth Heinemann, Grant Britain, pp. 1305. Gulbranson, S.H., Hud, J.A., Hansen, R.C. (2000). Argyria following the use of dietary supplements containing colloidal silver protein. Cutis. 66: 373-376. Hamblin, W.K. (1962). X-ray radiography in the study of structures in homogeneous sediments. Journal of Sedimentary Petrology. 32: 201-210. Hashidoko, Y. (2005) Ecochemical studies of interrelationships between epiphytic bacteria and host plants via secondary metabolites. Bioscience, Biotechnology and Biochemical. 69: 1427-1441. Haus, A.G., Cullinan, J.E. (1989). Screen film processing systems for medical radiography: a historical review. RadioGraphics. 9: 1203-1224. Havlik, T., Orac, D., Petranikova, M., Miskufovo, A., Kukurugya, F., Takacova, Z. (2010). Leaching of copper and tin from used printed circuit boards after thermal treatment. Journal of Hazardous Materials. 183: 866-873. Hernández, A., Alfaro, I., Arrieta, R. (2003). Microbiología industrial, Editorial EUNED, México, pp. 266. 47 Hollinger, M.A. (1996). Toxicological aspects of topical silver pharmaceuticals. Critical Reviews in Toxicology. 26: 255-260. Hou, X., Jones, B.T. (2000). Inductively coupled plasma/optical emission spectrometry. In: Meyers, R.A. (Ed.), Encyclopedia of Analytical Chemistry, John Wiley & Sons Ltd., Chichester, pp. 16. Howell, J.D. (1996). Technology in the hospital: transforming patient care in the early twentieth century. Johns Hopkins University Press, pp. 341. Huang, K., Guo, J., Xu Z. (2009). Recycling of waste printed circuit boards: a review of current technologies and treatment status in China. Journal of Hazardous Materials. 164: 399-408. Ilyas, S., Anwar, M.A., Niazi, S.B., Ghauri, M.A. (2007). Bioleaching of metals from electronic scrap by moderately thermophilic acidophilic bacteria. Hydrometallurgy. 88: 180-188. Jadhav, U.U., Hocheng, H. (2012). A review of recovery of metals from industrial waste. Journal of Achievements in Materials and Manufacturing Engineering. 54: 159-167. Jain, D., Daima, H.K., Kachhwaka, S., Kothari, S.L. (2009). Synthesis of plantmediated silver nanoparticles using papaya fluit extract and evaluation of their antimicrobial activities. Digest Journal of Nanomaterials and Biostructures. 4: 557-563. Jha, M.K., Kumar, V., Singh, R.J. (2001). Review of hydrometallurgical recovery of zinc from industrial wastes. Resources Conservation and Recycling. 33: 122. Junco-Díaz, R.A., Martínez-Hernández, G., Luna-Martínez, M.V. (2003). Seguridad ocupacional en el manejo de los desechos peligrosos en instituciones de salud. Revista Cubana de Higiene y Epidemiologia. 41. Khunprasert, P., Grisdanurak, N., Thaveesri, J., Danutra, V., Puttitavorn, W. (2008). Radiographic film waste management in Thailand and cleaner technology for silver leaching. Journal of Cleaner Production. 16: 28-36. Kodak. (1980). Radiography in Modern Industry. Eastman Kodak Company. New York, pp. 212. 48 Krebs, W., Brombacher, C., Bosshard, P.P., Bachofen, R., Brandl, H. (1997). Microbial recovery of metal from solids. FEMS Microbiology Reviews. 20: 605-617. Lapidus-Lavine, G. (2011). UAM crea método para extraer plata de radiografías. Consultado en http://noticias.universia.net.mx/ciencia-nn- t/noticia/2011/12/13/897382/uam-crea-metodo-extraer-plataradiografias.html Leaper, D.J. (2006). Silver dressing: their role in wound management. International Wound Journal. 3: 283-294. Lehninger AL, Nelson DL, Cox MM. 2004. Lehninger’s Principles of Biochemistry, 4th ed., W.H. Freeman, USA, pp. 1119. Liu, S. (2013). Bioprocess engineering, kinetics, biosystems, sustainability, and reactor design. Elsevier, Spain, pp. 990. Lucas, A., 1928. Silver in ancient times. The Journal of Egyptian Archaeology. 14: 313-319. Madigan, M.T., Martinko, J.M., Parker, J. (2006). Brock Biología de los microorganismos. 10ª ed., Pearson Pretince Hall, Madrid, pp. 986. Mahdizadeh, F., Eskandarian, M., Zabarjadi, J., Ehsani, A., Afshar, A. (2014). Silver recovery from radiographic film processing effluents by hydrogen peroxide: modeling and optimization using response surface methodology. Korean Journal of Chemical Engineering. 31: 74-80. Marinković, N., Vitale, K., Holcer, N.J., Džakula, A., Pavić, T. (2008). Management of hazardous medical waste in Croatia. Waste Management. 28: 10491056. Martínez, M.A., Ovalle, A. (2013). Sphingomonas paucimobilis. Revista Chilena de Infectologia. 30: 49-50. Masebinu, S.O., Muzenda, E. (2014). Review of silver recovery techniques from radiographic effluent and X-ray film waste. Proceedings of the World Congress on Engineering and Computer Science. 2: 1-5. 49 Masui, A., Yasuda, M., Fujiwara,N., Ishikawa, H. (2004). Enzymatic hydrolysis of gelatin layers on used lith film using termostable alkaline protease for recovery of silver and PET film. Biotechnology Progress. 20: 1267-1269. Mauri-Garrido, O., Borges-Mendoza, E.B., Ramos-López, C.M., Valle-Rodriguez, L., Escobar-Román, L.R. (2014). Edoftalmitis poscirugia de catarata por Sphingomonas paucimobilis. Revista Cubana de Oftalmología. 27: 1-4. McGilvery, R.W. (1977) Conceptos bioquímicos, Editorial Reverté, SA., España, pp. 569. Mohan, D., Bhamawat, P.M.K. (2008). E-waste management-global scenerio: a review. Journal of Environmental Research and Development. 2: 817-823. Monroy-Martinez, A.A. (2015). Caracterización de Sphingomonas sp. y la influencia de la presencia de plata en su perfil de ácidos grasos. Tesis de Licenciatura. Universidad Veracruzana. Moreno-Garcia, R. (1986). The recovery of silver from photographic film: a study of the leaching reaction with cyanide solution for industrial use. Hydrometallurgy. 16: 395-400. Moreno-Grau, S., Bayo-Bernal, J. (1996). Diseño de biorreactores y enzimatologia, Universidad de Murcia, Servicio de Publicaciones, España, pp. 241. Morones-Ramírez, R. (2010). Historia de la plata: su impacto en las antiguas civilizaciones y la sociedad moderna. Revista Digital Universitaria. 11: 3xx9xx. Nakiboğlu, N., Toscali, D., Yasa, I. (2001). Silver recovery from waste photograohic films by an enzymatic method. Turkish Journal of Chemistry. 25: 349-353. Newman, J., Thomas-Alyea, K.E. (2004). Electrochemical systems, third edition, John Wiley & Sons, Inc Publication, New Jersey, pp. 635. Ni, H.G., Zeng, E.Y. (2009). Law enforcement and global collaboration are the keys to containing e-waste tsunami in China. Environmental Science and Technology. 43: 3391-3994. Nilgiriwala, K.S., Alahari, A., Rao, A.S., Apte, K.S. (2008). Cloning and overexpression of alkaline phosphatase phoK from Sphingomonas sp. 50 strain BSAR-1 for bioprecipitation of uranium from alkaline solutions. Applied and Environmental Microbiology. 74: 5516-5523. Nnorom, I.C., Osibanjo, O. (2009). Toxicity characterization of waste mobile phone plastics. Journal of Hazardous Materials. 161: 183-188. Ojeda, M.W., Perino, E., Ruiz, M.C. (2009). Gold extraction by chlorination using a pyrometallurgy process. Minerals Engineering. 22: 409-411. Panhwar, Q.A., Naher, U.A., Jusop, S., Othman, R., Latif, M.A., Ismail, M.R. (2014).Biochemical and molecular characterization of potential phosphatesolubilizing bacteria in acid sulfate soils and their beneficial effects on rice growth. Plos One. 9: e97241 Pant, D., Joshi, D., Upreti, M.K., Rovindra, K. Kotnala, R.K. (2012). Chemical and biological extraction of metals present in e-waste: a hybrid technology. Waste Management. 32: 979-990. Pérez-Alonso-González, R., Carabias-Icaza, A., Ríos-Vázquez A.P. (2011). Dictamen de la Comisión de Medio Ambiente y Recursos Naturales de la Cámara de Diputados al Proyecto de Decreto que reforma diversas disposiciones de la Ley General para la Prevención y Gestión Integral de Residuos, en materia de residuos electrónicos. Gaceta Parlamentaria. 3406-III: 1-144. Pringle, H. (1998). When money arose in the ancient of Mesopotamia it profoundly and permanently changed civilization. Discover. 19: 1-6. Prüss, A., Giroult, E., Rushbrook, P. (1999). Safe management of waste from healthcare activities, Editorial World Health Organization (WHO), Genova, pp. 226. Purcell, T.W., Peters, J.J. (1998). Sources of silver in the environment. Environmental Toxicology and Chemistry. 17: 539-546. Ramírez, P.A., Reyes, V.E., Veloz, M.A. (2011). Silver recovery from radiographic films using an electrochemical reactor. International Journal of Electrochemical Science. 6: 6151-6164. 51 Ramírez-Giraldo, J.C., Arboleda-Clavijo, C., McCollough, H.C. (2008). Tomografía computarizada por rayos X: Fundamentos y actualidad. Revista Ingeniería Biomédica. 2: 54-72. Renner, H., Schlamp, G., Zimmermann, K., Weise, W., Tews, P., Dermann, K., Knödler, A., Schröder, K.-H., Kempf, B., Lüschow, H. M., Drieselmann, R., Peter, C., Schiele, R. (2001). Silver, silver compounds, and silver alloys. Ullmann's Encyclopedia of Industrial Chemistry. VCH, Weinheim, Germany, pp. 295. Residuo Electrónico México (REMSA). (2014). Consultado en http://reciclaelectronicos.com/ Robb, R.A. (1982). X-ray computed tomography: an engineering synthesis of multiscientific principles. Critical Reviews in Biomedical Engineering. 7: 265-333. Rodríguez, Y., Blázquez, M.L., Ballester, A., González, F., Muñoz, J.A. (2001). La biolixiviación al comienzo del siglo XXi. Revista de Metalurgia. 37: 655-672. Ruiz, O., Clemente, C., Alonso, M., Alguacil, F.J. (2007). Recycling of an electric arc furnace flue dust to obtain high grade ZnO. Journal of Hazardous Materials. 141: 33-36. Rutala, W.A., Mayhall, C.G. (1992). Medical waste. Infection Control. 12: 38-48. Scott, R.H., Fassel, V.A., Kniseley, R.N., Nixon D.E. (1974). Inductively coupled plasma-optical emission analytical spectrometry. Analytical Chemistry. 46: 75-80. Sepúlveda, A., Schluep, M., Renaud, F.G., Streicher, M., Kuehr, R. Hagelüken, C., Gerecke, A.C. (2010). A review of the environmental fate and effects of hazardous substances released from electrical and electronic equipments during recycling: examples from China and India. Environmental Impact Assessment Review. 30: 28-41. Shankar, S., More, S.V., Seeta-Laxman, R. (2010). Recovery of silver from waste X-ray film by alkaline protease from Conidiobolus coronatus. Kathmandu University Journal of Science, Engineering and Technology. 6: 60-69. 52 Silva, J.E., Piva, A.P., Soares, D.,Labrincha, A., Castro, F. (2005). Solvent extraction applied to the recovery of heavy metals from galvanic sludge. Journal of Hazardous Materials. B120: 113-118. Silver, S. (2003). Bacterial silver resistance: molecular biology and uses and misuses of silver compounds. FEMS Microbiology Reviews. 27: 341-353. Silver, S., Phung, L.T., Silver G. (2006). Silver as biocides in burn and wound dressings and bacterial resistance to silver compounds. Journal of Industrial Microbiology and Biotechnology. 33: 627-634. Singh, S., Prakash, V. (2007). Toxic environmental releases from medical waste incineration: a review. Environmental Monitoring and Assessment. 132: 6781. Stirling, D.A., 2006. History of toxicology and allied sciences: A bibliographic review and guide to suggested readings. International Journal of Toxicology. 25: 261-268. Stoimenov, P.K., Klinger, R.L, Marchin, G.L., Klabunde, K.J. (2002). Metal oxide nanoparticles as bactericidal agents. Langmuir. 18: 6679-6686. Sutton, S. (2011). Measurement of microbial cells by optical density. Journal of Validation Technology. 17: 46-49. Syed, S., Suresha, S., Sharma, L.M., Syed, A.A. (2002). Clean technology for the recovery of silver from processed radiographic films. Hydrometallurgy. 63: 277-280. Taghipoura, H., Mosaferi, M. (2009). Characterization of medical waste from hospitals in Tabriz, Iran. Science of the Total Environment. 407: 1527-1535. Takeuchi, M., Hamana, K., Hiraishi, A. (2001). Proposal of the genus Sphingomonas sensu stricto and three new genera, Sphingobium, Novosphingobium and Sphingopyxis, on the basis of phylogenetic and chemotaxonomic analyses. International Journal of Systematic and Evolutionary Microbiology. 51: 1405-1417. Terazono, A., Murakami, S., Inanc, N.A.B., Moriguchi, Y., Kojima, S.S.M., Yoshida, A., Li, J., Wong, J.Y.M.H., Jain, A., Peralta, I.K.G.L., Mungcharoen, C.L.T., 53 Williams, E. (2006). Current status and research on E-waste issues in Asia. Journal of Material Cycles and Waste Management. 8:1-12. Tuncuk, A., Stazi, V., Akcil, A., Yazici, E.Y., Deveci, H. (2012). Aqueous metal recovery techniques from e-scrap: Hydrometallurgy in recycling. Minerals Engineering. 25: 28-37. United Nations Environment Programme (UNEP). (2009). Sustainable Innovation and Technology Transfer Industrial Sector Studies: Recycling from e-waste to resources. 1-120. Vogel, A.I. (1969). Química analítica cualitativa. Editorial Kapelusz, Argentina, pp. 835. Whitchurch, B.W., Vaillancourt, D., Corrao, J.P., Chen, W., Huang, J. (2009). Submersible keyboard. Patente US2009/0262492A1. Widmer, R., Oswald-Krapf, H., Sinha-Khetriwal, D., Schnellmann, M., Böni, H. (2005). Global perspectives on e-waste. Environmental Impact Assessment Review. 25: 436-458. Winn, W.C., Allen, S.D., Janda, W.M., Koneman, E.W., Procop, G.W., Schrenckenberger, P.C., Woods, G.L. (2008). Diagnostico microbiológico texto y atlas en color, sexta edición, Editorial Médica Panamericana, Argentina, pp. 1691. Xie, X., Fu, J., Wang, H., Liu, J. 2010. Heavy metal resistance by two bacteria strains isolated from a copper mine tailing in China. African Journal of Biotechnology. 9: 4056-4066. Yang, T., Xu, Z., Wen, J., Yang, L. (2009). Factors influencing bioleaching copper from waste printed circuit boards by Acidithiobacillus ferrooxidans. Hydrometallurgy. 97: 29-32. Yang, Y., He, W., Wang, S., Chen, Y., Hu, K. (2010). Preparation of epoxy-silver composite conductive silver paste. Electronic Components and Materials. 5: 1-2. Zhouxiang, H., Jianying, W., Ma, Z., Jifan, H. (2008). A method to recover silver from waste X-ray films with spent fixing bath. Hydrometallugy. 92: 148-151. 54