RADIO Y ENERGIA DE UN é PARA EL ATOMO DE HIDROGENO
Anuncio

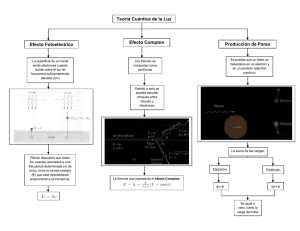
2º BACHILLERATO-Química Departamento de Física y Química Algunas demostraciones de Química INDICE 1. Teoría cinética de los gases ............................................................ 2 2. El espectro del átomo de hidrógeno- Ecuación de Rydberg ....................... 4 3. Modelo de Bohr. Radio y energia de un é para el atomo de hidrogeno .......... 5 4. El efecto Fotoeléctrico .................................................................. 6 5. El efecto Compton ....................................................................... 7 6. El espectro electromagnetico .......................................................... 8 7. Energía reticular. Ciclo de Born-Haber ............................................... 9 8. Determinación de la realción e/m del electrón .................................... 10 9. Experimento de Millikan ............................................................... 12 10. Resolución de la ecuación de Schrödinger en una dimensión .................... 13 11. Modelo Estándar de la física de partículas .......................................... 14 © Jesús Millán 17 de abril de 2015 “Exige mucho de ti mismo y espera poco de los demás. Así te ahorraras disgustos”. (Confucio) 1/16 2º BACHILLERATO-Química 1. Departamento de Física y Química TEORÍA CINÉTICA DE LOS GASES Se trata de deducir la ley de los gases ideales ( PV clásica. Se parte de ciertos postulados: nRT ) a partir de las leyes de la mecánica 1. Los gases están formados por un gran número de moléculas en continuo movimiento, chocando entre sí y con las paredes del recipiente que las contiene, siendo los choques perfectamente elásticos. 2. La presión es debida a los choques de las moléculas contra las paredes del recipiente. 3. El volumen de las moléculas es despreciable frente al volumen del recipiente que las contiene. Se encuentran a grandes distancias unas de otras y no existen fuerzas de interacción entre ellas. Estudiaremos la variación de la cantidad de movimiento invertida en los choques de las moléculas con las paredes del recipiente. A partir de esta variación de movimiento la fuerza que ocasionan y después la presión ejercida por esta fuerza sobre las paredes. p mv p F P t F S Supongamos N moléculas de masa m encerradas en un cubo de arista l. Fijémonos en una sola molécula que se dirige perpendicularmente a una de las caras con velocidad v. Inicialmente se ha de cumplir la conservación de la cantidad de movimiento: p1 m( v) p2 mv mv p 2m v y prescindiendo del carácter vectorial p 2mv La molécula saldrá desplazada en sentido contrario y volverá a chocar con la misma cara al 2l cabo de un tiempo t . v Ahora determinamos la fuerza ejercida por una sola molécula sobre la pared como la variación de la cantidad de movimiento por unidad de tiempo y posteriormente la presión. F p t 2m v 2l / v m v2 l y P F S m v2 l3 m v2 V (V es el volumen del cubo, del volumen que contiene el gas). El movimiento de las moléculas es aleatorio y se puede tratar estadísticamente y N/3 de moléculas se moverán en el eje x, las mismas en el eje y, y las mismas en el eje z. Y la 2/16 2º BACHILLERATO-Química Departamento de Física y Química presión sobre cada cara será: N m v2 3 V P (1) Donde v 2 es la velocidad cuadrática media de las moléculas. La media geométrica de las velocidades al cuadrado, para evitar el cambio de signo de la velocidad. Ahora vamos a poner esta expresión en función de variables macroscópicas como el número 1 m v2 . de moles n, N n N A , y la energía cinética media de las moléculas ec 2 2 P V n N A ec 3 pero la energía cinética de las moléculas es solamente función de la temperatura ec KT . PV n NA 2 KT 3 que podemos poner de la forma PV nRT En este caso R es la constante de los gases ideales. R = 0,082 atm·l/K·mol = 8,3145 J/K·mol = 1,99 cal/K·mol A partir de la expresión (1), para un solo mol y sustituyendo PV=RT podemos obtener la velocidad cuadrática media de las moléculas en función de su masa molécula: 3RT NA N v2 m v2 RT m v2 y la velocidad sería: M 3 3 Esta expresión representa la ley de Gram., que dice que la velocidad de difusión de un gas es inversamente proporcional a la raíz cuadrada de su masa molecular. PV Esta velocidad justificaría la ausencia de atmósfera de gases ligeros en la Tierra y de cualquier gas en la Luna. A menor masa molecular mayor velocidad de difusión, de modo que el gasa escapará de la atracción terrestre cuando supere un cuarto la velocidad de escape del planeta. También, igualmente, a partir de la misma expresión (1), si se sustituye PV=RT se comprueba que la energía cinética es únicamente función de la temperatura. PV N m v2 3 RT 2 NA 1 m v2 3 2 y la energía cinética: Ec 3/16 3 RT 2N A f (T ) 2º BACHILLERATO-Química 2. Departamento de Física y Química EL ESPECTRO DEL ÁTOMO DE HIDRÓGENO- ECUACIÓN DE RYDBERG Un espectro atómico consta de una serie de rayas que indican las frecuencias a las que el átomo emite o absorbe luz (espectros de emisión o absorción). Los espectros atómicos se conocieron antes de existir un modelo atómico satisfactorio. Desde un punto de vista empírico, los espectroscopistas descubrieron ciertas regularidades en las líneas de las rayas espectrales. El espectro más sencillo es el del átomo de hidrógeno.1 Serie de Paschen Serie de Balmer 3 Serie de Lyman 2 Serie de Brackett Serie de Pfund 4 5 1 Serie Lyman Balmer Paschen Brackett Pfunn Frecuencia UV lejano Visible y UV próximo IR muy próximo IR próximo IR ordinario n1 1 2 3 4 5 Todas las rayas espectrales del átomo de hidrógeno vienen determinadas por la ecuación de Rydberg: 1 R 1 n12 1 n22 siendo n2 n1 R: constante de Rydberg = 109677,6 cm-1 n1: número entero igual a 1 (fundamental), 2, 3, 4,…que corresponden con las series de Lyman, Balmer, Parchen, Brackett y Pfund. n2: número entero, siempre mayor que n1, y que corresponderá con la primera, segunda, tercera… línea de cada serie. Si n1 = 1 y n2 = , corresponde con la longitud de onda y la frecuencia de la energía de ionización del electrón del átomo de hidrógeno. 1 Balmer era un profesor de matemáticas que, en su tiempo libre, estaba obsesionado con fórmulas para los números. Una vez se jactó de que dados cuatro números cualesquiera podía encontrar la fórmula que los relacionase. Afortunadamente para la física, alguien le dio las 2 ( 364, 4 ) n ( en nm) . La longitudes de onda de las cuatro primeras líneas del espectro del hidrógeno. La fórmula que obtuvo fue: 2 (n 4) fórmula funcionaba con misteriosa precisión y permaneció como una curiosidad inexplicable hasta que Niels Bohr la vio. 4/16 2º BACHILLERATO-Química 3. Departamento de Física y Química MODELO DE BOHR. RADIO Y ENERGIA DE UN É PARA EL ATOMO DE HIDROGENO 1. Según el primer postulado, el é gira en una órbita estacionaria y la fuerza de atracción electrostática es igual a la fuerza centrípeta.1 2 2 Ze e mv Ze = 2 (1) v= (2) r r mr 2. El segundo postulado nos dice que solo serán posibles aquellas órbitas en las que se cumple que el momento angular es un múltiplo entero de h/2π. mv r = n 2 h 2 (3) r= h 2 mZe 4 2 n 2 (4) y el radio está cuantizado, no puede tomar cualquier valor, dependerá de n. La ecuación (3) se desprende del hecho de que el é se comporta como una onda estacionaria dentro de cada órbita: h mv 2 r n = Principio de dualidad onda corpúsculo Condición de onda estacionaria 3. El tercer postulado nos dice que cuando un é pasa de una órbita superior a otra inferior (ambas permitidas), se emite energía electromagnética, un cuanto de luz: E 2 - E1 = h f (5) La energía del electrón será la suma de la energía potencial y la energía cinética. 2 Ep= Eé = E p + Ec r Ze Ze dr = 2 r r 2 1 2 1 Ze2 = mv = Ec 2 2 r Sustituyendo el valor de r (4), en (6) tenemos: Eé = - 2 2 1 Ze2 Ze 1 Ze + =r 2 r 2 r Eé = - 1 Z 2 e4 m4 2 2 h 2 1 n 2 Que nos indica que también la energía está cuantizada y depende de n2 si n = 1 => E1 E2 - E1 = h f => rayas de los espectros si n = 2 => E2 1 En estas expresiones no aparece la k de la ley de Coulomb, esto es debido a que en el sistema electrostático k=1. 5/16 (7) (6) 2º BACHILLERATO-Química 4. Departamento de Física y Química EL EFECTO FOTOELÉCTRICO Si en una ampolla en la que se ha hecho el vacío se coloca un cátodo C metálico y frente a él un ánodo A, en cuanto el primero se ilumina con luz ultravioleta (UV) se inicia una corriente cuyo sentido corresponde al de emisión de electrones por el cátodo. La velocidad con que son emitidos dichos electrones también puede calcularse invirtiendo la polaridad del ánodo y el cátodo para que ningún electrón llegue a A. 1 2 m v max 2 e V0 donde V0 es el potencial de detención Luz hf C A I A mA V Leyes experimentales: 1. El efecto fotoeléctrico es instantáneo, aparece y desaparece con la radiación, sin retraso. 2. El número de fotoelectrones, la intensidad de corriente, es proporcional a la radiación recibida. 3. La velocidad de emisión v, no depende de la intensidad luminosa incidente ni de su polarización, pero si de su frecuencia f. 4. Para cada metal existe una frecuencia umbral f0 de la radiación luminosa, por debajo de la cual no se presenta efecto fotoeléctrico. Interpretación teórica (debida a Einstein 1903 y que le supuso el premio Nobel): - La luz está compuesta de cuantos o fotones cuya energía es E = h f, siendo f la constante de Planck. - Según la hipótesis de Einstein, cuando un fotón choca con un electrón, le cede completamente su energía y desaparece, de este modo el electrón consigue la energía suficiente para escapar de la red del metal venciendo la barrera de potencial. h f 1 2 m vmax 2 1 2 m vmax 2 h( f e 0 que también puede ponerse f0 ) Justificando así la existencia de una frecuencia umbral f0 mínima por debajo de la cual no puede haber emisión fotoeléctrica. 6/16 2º BACHILLERATO-Química 5. Departamento de Física y Química EL EFECTO COMPTON Es un choque entre un fotón y un electrón, pero en este caso no desaparece el fotón como sucedía en el efecto fotoeléctrico, sino que cede parte de su energía al electrón y se convierte en un fotón de menor energía o frecuencia, y sale dispersado en una dirección distinta a la incidente, mientras que el electrón, a su vez, adquiere una cierta energía cinética. Se trata de un choque perfectamente elástico entre un fotón y un electrón. Se aplica el principio de conservación de la energía y del momento lineal entre el fotón y el electrón como si fueran partículas. Hay que considerar la masa relativista del electrón ya que a menudo alcanza velocidades próximas a la de la luz. E hf mec2 Ee hf' E pe 'c Ee ' ' 2 p pe y me c 2 2 2 pe2'c 2 h f mec 2 h f ' me2c 4 pe ' p p ' pe2' p p' p p' y multiplicando por c2se tiene: pe2'c 2 Se sustituye ahora pc pe2'c 2 hf 2 hf ' 2 p ' pe ' (5.1) p2 p 2c 2 p 2' 2 p p ' cos p 2 'c 2 2 p p 'c 2 cos hf y 2 hf hf ' cos (5.2) Igualando ahora las expresiones (5.1) y (5.2) y operando 2 me2c 4 hf 2hfme c 2 2hf ' me c 2 2 hf hf ' (1 cos ) hf me c 2 h f ' 2 hf ' 2 2 hf hf ' cos Dividiendo ahora ambos miembros por 2hff ' mec , queda lo siguiente: c f' c f h (1 cos ) me c Salvo para =0, siempre ' ' h (1 cos ) me c y f' f , es decir h f ' h f . El efecto Compton tiene lugar preferentemente para radiaciones muy energética, de cuanto h f elevado, por ejemplo con rayos X El efecto Compton y el efecto fotoeléctrico son manifestaciones típicamente corpusculares de la luz. 7/16 2º BACHILLERATO-Química 6. Departamento de Física y Química EL ESPECTRO ELECTROMAGNETICO LONGITUD DE FRECUENCIA f en Hz ONDA en m -15 23 10 10 ESPECTRO ELECTROMAGNETICO Rayos Rayos X 10-10 1018 10-7 10-6 1015 1014 10-3 1011 10-1 109 101 107 102 106 105 103 Radiación Ultravioleta Luz Visible Radiación Infrarroja Microondas UHF VHF Ondas de Radio Onda corta Onda media Onda larga 8/16 2º BACHILLERATO-Química 7. Departamento de Física y Química ENERGÍA RETICULAR. CICLO DE BORN-HABER Una interesante aplicación de la ley de Hess la constituye la determinación experimental de la energía reticular de un cristal iónico, ER. Su medida directa es imposible, ya que dicha energía es la diferencia entre la del cristal y la de sus iones suficientemente separados entre sí para que no interaccionen, es decir, a presiones en estado gaseoso ideal (a presiones muy bajas), y este estado no es realizable en el laboratorio. Sin embargo podemos imaginar un ciclo, que recibe el nombre de Born-Haber y que, aplicado, por ejemplo al NaCl, es: Hof = -410,61 Na(s) + HS(Na) =108,6 Na(g) ½ Cl2(g) NaCl(s) ½ HD(Cl2) = 121,26 U Cl-(g) Cl(g) + Na+(g) HAE del Cl = -361,57 HI del Na = 495,75 Donde los símbolos representan: Hof = Hentalpía de formación standard del NaCl(s) HS = Calor de sublimación del Na ½ HD = Calor de disociación del Cl2(g) HAE = Afinidad electrónica del Cl HI = Energía de ionización del Na Al ser un ciclo cerrado H = 0 y, si lo recorremos en el sentido de las flechas tenemos: U= Hof - HS - ½ HD - HAE - HI Los tres primeros términos pueden determinarse de modo experimental fácilmente. Más difíciles de medir son la afinidad electrónica y el potencial de ionización. A pesar de todo el ciclo de Born-Haber es el único método para determinar la energía reticular de un cristal. Ej.: Calcula la energía reticular del NaCl con los datos numéricos indicados en el esquema del ciclo de Born-Haber (todos ellos expresados en kJ·mol-1) U= Hof - HS - ½ HD - HAE - HI U = -410,61 - 108,6 - 121,26 + 361,57 - 495,75 = - 774,75 kJ·mol-1 Dibuja el ciclo de Born-Haber para el CaCl2 y determina su energía reticular (busca los datos necesarios). 9/16 2º BACHILLERATO-Química 8. Departamento de Física y Química DETERMINACIÓN DE LA REALCIÓN E/M DEL ELECTRÓN En el Cavendish Laboratory de Cambridge, Sir J. J. Thomson midió en 1897 la relación entre la carga y la masa del electrón. Para ello utilizo un aparato que consistía en un tubo de vidrio en el que se hacía un vacío elevado, disponiendo en su interior de varios electrodos metálicos: - C = cátodo de donde parten los electrones. - A, A' = ánodos con orificio, mantenidos a un potencial positivo elevado, que aceleran y forman un haz de electrones. - P, P' = láminas desviadoras separadas una distancia conocida, que originan una diferencia de potencial y, en consecuencia, un campo eléctrico conocido, E, que se supone uniforme entre las armaduras. - S = placa fluorescente donde se impresiona el impacto del electrón. Del cátodo C parten los electrones; la mayor parte golpean en A, pero algunos atraviesan el orificio. El número de electrones se reduce al pasar por el electrodo A', quedando un pequeño haz de electrones que es el que es desviado por los campos E y B durante la distancia a. Desviación producida por el campo eléctrico E. Inicialmente el electrón entra en un campo eléctrico, que le proporciona una aceleración y le desvía verticalmente. Cuando sale de él, el electrón ya sin aceleración seguirá con velocidad y dirección constante e igual a tg . eE a ma yE e E m y 1 e x E 2 m v2 1 e a2 E 2 m v2 v L tg 1 e E t2 2m y( x tg 1 e a2 E a) 2 m v2 e a y'( x a ) E m v2 1 e a2 E 2 m v2 L e a E 2 m v Donde las únicas incógnitas son e/m. 10/16 eEa a m v2 2 L yE E x vt 2 y a L 2º BACHILLERATO-Química Departamento de Física y Química Desviación debida al campo magnético B. Colocando un campo magnético perpendicular al campo eléctrico se producirá una desviación en el electrón que viene determinada por la Ley de Lorentz y que es opuesta al campo eléctrico. El electrón describe en este caso una trayectoria circular hasta que sale del campo magnético, y luego continúa conservando la dirección y la velocidad. v2 m R evB R a2 tg R2 yM R R 2 a2 R y y a2 R R 1 2R 2 yM y R 1 2 a R2 R 1 a 2R 2 a2 2R a2 2R L tg L y a R a2 R2 a v mv eB L a R a L R a 2 yM y sustituyendo el valor del radio: Determinación de la relación eBa L mv a 2 e 1 . m Para un determinado valor del campo eléctrico E, se puede ajustar el campo magnético B, para que ambas desviaciones sean iguales, de este modo yE = yM2. eEa a m v2 2 eBa L mv L a 2 E v B ó v E B Si conocemos el valor de yE3, y sustituimos el valor de la velocidad del electrón calculado se obtiene la relación e/m. e m yE v 2 Ea 1 L a 2 yE v 2 EaL yE E B2 a L 1 J.J. Thomson (1856-1970) midió la relación e/m para el electrón, y se le concedido el premio Nobel por demostrar que el electrón es una partícula. Su hijo, G.P. Thomson, consiguió el mismo galardón por demostrar que el electrón es una onda. 2 Cuando yE=yM, podemos considerar que la fuerza eléctrica es igual a la magnética y eE=evB obteniéndose el mismo resultado (aunque las fuerzas nunca pueden anularse porque no tienen la misma dirección). 3 Lo determinó experimentalmente sin más que anular el campo magnético B. 11/16 2º BACHILLERATO-Química 9. Departamento de Física y Química EXPERIMENTO DE MILLIKAN El experimento de la gota de aceite (Millikan - 1909) El físico estadounidense Robert A. Millikan efectuó la primera medición directa y concluyente de la carga eléctrica de un electrón. Usando un atomizador de perfume desparramó pequeñas gotas de aceite dentro de una cámara transparente. En las partes superior e inferior había placas metálicas unidas a una batería, siendo una positiva y la otra negativa. Cuando el espacio entre las placas metálicas era ionizado por radiación (por ejemplo, rayos X), electrones del aire se pegaban a las gotitas de aceite, adquiriendo éstas una carga negativa. Como cada gotita adquiría una leve carga de electricidad a medida que viajaba a través del aire, la velocidad de su movimiento podía ser controlada alterando el voltaje entre las placas. En ausencia de campo eléctrico, la gota de aceite que cae bajo la acción de la gravedad y adquiere velocidad constante debido a que la fuerza de la gravedad iguala la fuerza de rozamiento (ley de Stockes). P FR mg 6 vR 2 R2 g v Des 4 9 3 R g 6 vR 3 Cuando se conecta el campo eléctrico la gota de aceite asciende debido a la fuerza que ejerce el campo eléctrico, y éste se puede regular para que ascienda con velocidad constante. El balance de fuerzas en este caso sería el siguiente: Fe P FR qE mg v Asc 6 qE 6 mg R vR Se conoce todo menos la carga, pero midiendo las velocidades de descenso y ascenso se puede determinar. Millikan encontró que, si permitía a los rayos X pasar a través del aparato mientras observaba la gota, la carga de esta podía aumentar o disminuir, y la velocidad de subida también variaba en función de esa carga extra. Al caer la velocidad no variaba pues la masa de los electrones añadidos es despreciable comparada con la masa total de la gota. Millikan y otros observadores repitieron sus experiencias y encontraron que la carga de la gota nunca era menor que un valor mínimo (1,6·10-19 C) y siempre obtenían algún valor múltiplo entero de dicho valor. 12/16 2º BACHILLERATO-Química Departamento de Física y Química 10. RESOLUCIÓN DE LA ECUACIÓN DE SCHRÖDINGER EN UNA DIMENSIÓN La mecánica cuántica tiene como punto de partida la hipótesis de la dualidad onda corpúsculo de De Broglie (1924), y el principio de incertidumbre de Heisemberg (1927), aparte naturalmente de la hipótesis cuántica ce Planck (1900). El primer postulado de la esta mecánica establece que el estado de un electrón viene determinado por una función de onda, , llamada función de estado. Y en el tercer postulado se nos dice que para determinar la energía de un electrón es preciso aplicar el operador (hamiltoniano) y resolver la ecuación: 2m (E V ) 0 o también H E de otra forma: 2 2 2 2m 2 2 x2 2 y2 (V z2 E) 0 (1) Y que son las expresiones de la conocida ecuación de Schrödinger. Poco o nada nos dicen de cómo se ha llegado a esta conclusión. Pretendo demostraros que la función de una onda estacionaria satisface esta expresión. 1. Partimos del principio de dualidad onda-corpúsculo, toda partícula lleva asociada una onda: h h h (2) y si p k mv p 2 Ecuación que relaciona una magnitud corpuscular con otra ondulatoria. 2. Determinación de la energía mecánica del electrón: 1 2 p2 Ec mv 2 2m Y considerando que el electrón tiene energía potencial por su posición respecto del núcleo, p2 entonces su energía mecánica total sería E Ec V y en consecuencia: E V (3) 2m Sustituyendo en la ecuación (3) la expresión (2) del momento lineal: 2 k 2 2m( E V ) (4) La relación entre la energía cinética y el momento lineal es: 2 ( x, t ) 1 2 ( x, t ) (5) x2 v2 t2 y que una de sus soluciones lo representan las ondas armónicas: ( x, t ) A sen ( t k x) , que ya conoces y puedes comprobar derivando esta expresión. 2 2 ( x, t ) ( x, t ) 2 m( E V ) 2 m( E V ) 2 2 k k pero de (4) y entonces 2 2 2 x x 2 que ligeramente reorganizada queda: 3. La ecuación diferencial de una onda clásica es: 2 2m 2 x2 V Compárala con la expresión (1) para tres dimensiones. 13/16 E 2º BACHILLERATO-Química Departamento de Física y Química 11. MODELO ESTÁNDAR DE LA FÍSICA DE PARTÍCULAS El modelo estándar de la física de partículas es una teoría que describe las relaciones entre las interacciones fundamentales conocidas y las partículas elementales que componen toda la materia. Es una teoría cuántica de campos desarrollada entre 1970 y 1973 que es consistente con la mecánica cuántica y la relatividad especial. Hasta la fecha, casi todas las pruebas experimentales de las tres fuerzas descritas por el modelo estándar están de acuerdo con sus predicciones. Sin embargo, el modelo estándar no alcanza a ser una teoría completa de las interacciones fundamentales debido a que no incluye la gravedad, la cuarta interacción fundamental conocida, y debido también al elevado número de constantes que implica y que no se derivan de los primeros principios. Actualmente la Física y la materia se entiende mejor en términos de interacciones de partículas fundamentales. El modelo estándar agrupa dos teorías importantes -el modelo electrodébil y la cromodinámica cuántica-. Para facilitar la descripción, el modelo estándar se puede dividir en tres partes que son las partículas de materia, las partículas mediadoras de las fuerzas, y el bosón de Higgs. Partículas de materia. Los fermiones Según el modelo estándar la materia conocida está formada por partículas con espín 1/2. En el modelo estándar todas las partículas de materia son fermiones y siguen el principio de exclusión de Pauli. Aparte de sus antipartículas asociadas, el modelo estándar explica un total de doce tipos de partículas de materia. Seis de éstos son los quarks (up, down, strange, charm, top y bottom), y los otros seis son leptones (electrón, muón, tau, y sus neutrinos correspondientes). Partículas fundamentales del Modelo Estándar Leptones Quarks Familias Nombre Símbolo Nombre Símbolo 1a electrón neutrino e 2a muón neutrino µ 3a e up u e down d µ charm c µ strange s top t bottom b tau neutrino Las partículas de la materia tienen cargas que las hacen sensibles a alguna de las fuerzas fundamentales. • Cada quark puede llevar tres cargas de color -roja, verde o azul-, permitiéndoles participar en interacciones fuertes. • Los quarks tipo up (up, top o charm) llevan una carga eléctrica de +2/3, y los tipo down (down, strange y bottom) llevan una carga eléctrica de -1/3, y participan en interacciones electromagnéticas. • Los leptones no llevan ninguna carga de color y no participan en interacciones fuertes. 14/16 2º BACHILLERATO-Química Departamento de Física y Química • Los leptones tipo down (el electrón, el muon, y el lepton tau) llevan una carga eléctrica de -1, permitiéndoles participar en interacciones electromagnéticas. • Los leptones tipo up (los neutrinos) no tienen carga eléctrica, y no participan en interacciones electromagnéticas. • Los quarks y los leptones llevan varias cargas de sabor, incluyendo el isospin débil, permitiendo a todas ellas interaccionar recíprocamente vía la interacción nuclear débil. Partículas mediadoras de fuerzas. Los bosones Las fuerzas en la física son la forma en que las partículas interaccionan recíprocamente y se influencian mutuamente. El modelo estándar explica tales fuerzas como el resultado del intercambio de otras partículas por parte de las partículas de materia, conocidas como partículas mediadoras de la fuerza. Cuando se intercambia una partícula mediadora de la fuerza, a nivel macroscópico el efecto es equivalente a una fuerza que afecta a las dos, y se dice que la partícula ha mediado (es decir, ha sido el agente de) esa fuerza. Se cree que las partículas mediadoras de fuerza son la razón por la que existen las fuerzas y las interacciones entre las partículas observadas en el laboratorio y en el universo. Las partículas mediadoras de fuerza descritas por el modelo estándar también tienen spin (al igual que las partículas de materia), pero en su caso, el valor del spin es 1, significando que todas las partículas mediadoras de fuerza son bosones. Consecuentemente, no siguen el principio de exclusión de Pauli. Los diversos tipos de partículas mediadoras de fuerza son descritas a continuación. • Los fotones median la fuerza electromagnética entre las partículas eléctricamente cargadas. El fotón no tiene masa y está descrito por la teoría de la electrodinámica cuántica. • Los bosones de gauge W+, W–, y Z0 median las interacciones nucleares débiles entre las partículas de diversos sabores (todos los quarks y leptones). Son masivos y los W tienen carga eléctrica de +1 y -1 participando en interacciones electromagnéticas. El bosón Z0 es eléctricamente. Estos tres bosones gauge junto con los fotones se agrupan juntos y medían colectivamente las interacciones electrodébiles. • Los ocho gluones median las interacciones nucleares fuertes entre las partículas cargadas con color (los quarks). Los gluones no tienen masa. El gluon tiene una carga efectiva de color, pueden interactuar entre sí mismos. Los gluones y sus interacciones se describen mediante la teoría de la cromodinámica cuántica. Interacciones descritas por el Modelo Estándar junto y bosones asociados. Interacción Grupo gauge Bosón Electromagnética U(1) fotón Débil SU(2) Fuerte SU(3) Símbolo Fuerza relativa γ ± αem = 1/137 0 bosones intermedios W , Z gluones (8 tipos) g αweak = 1,02 · 10-5 αs(MZ) = 0,121 Bosón de Higgs La partícula de Higgs es una partícula elemental escalar masiva hipotética predicha por el modelo estándar, y la única partícula fundamental predicha por ese modelo que no se ha observado completamente hasta ahora. Esto es en parte porque requiere una cantidad excepcionalmente grande de energía para crearla y observarla bajo circunstancias de laboratorio. No tiene ningún spin intrínseco, y (como las partículas mediadoras de fuerza) se clasifica así como bosón. 15/16 2º BACHILLERATO-Química Departamento de Física y Química El bosón de Higgs desempeña un papel único en el modelo estándar, y un papel dominante en explicar los orígenes de la masa de otras partículas elementales, particularmente la diferencia entre el fotón sin masa y los bosones pesados W y Z. Las masas de las partículas elementales, y las diferencias entre el electromagnetismo (causada por el fotón) y la fuerza débil (causada por los bosones W y Z), son críticas en muchos aspectos de la estructura de la materia microscópica (y por lo tanto macroscópica); así, si se demuestra que existe, el bosón de Higgs tiene un efecto enorme en el mundo alrededor nuestro. Hasta la fecha de (2010), ningún experimento ha detectado directamente la existencia del bosón de Higgs, pero hay una cierta evidencia indirecta de él. Se espera que el colisionador de hadrones del CERN traiga la evidencia experimental que confirme su existencia. Insuficiencias del Modelo Estándar Aún no hay indicios experimentales de la existencia del bosón de Higgs, aunque se espera que pueda ser detectado por el Gran Colisionador de Hadrones (LHC) cuando éste sea reparado después de un primer intento fallido y entre en pleno funcionamiento en 2010. Incluso cuando el Modelo Estándar ha tenido gran éxito en explicar los resultados experimentales, tiene ciertos defectos importantes: El problema del número de constantes físicas fundamentales. El modelo contiene 19 parámetros libres, tales como las masas de las partículas, que deben ser determinados experimentalmente (además de 10 para las masas de los neutrinos). Esos parámetros no pueden ser calculados independientemente. Gravedad cuántica. El modelo no describe la fuerza gravitatoria, ni los candidatos actuales para construir una teoría cuántica de la gravedad, se asemejan al modelo estándar. Antimateria. Dentro de él, la materia y la antimateria son simétricas. La preponderancia de la materia en el universo podría ser explicada diciendo que el universo comenzó con otras condiciones iniciales, pero la mayoría de los físicos piensan que esta explicación no es elegante. Existen alternativas al Modelo Estándar que intentan dar respuesta a estas "deficiencias", como por ejemplo la teoría de cuerdas. 16/16