Avances en el PAT - Revista Médica Veterinaria
Anuncio

Más:
Volumen 11, Número 2
Dentro de la Guia
para CoA del IPEC
Avances en el PAT
para la manufactura
de fármacos parenterales
Sección Especial
Formas
Farmacéuticas
Sólidas y Excipientes
INVESTIGACIÓN ARBITRADA
Mejoras en el análisis de productos inhalados
Granulado de espuma: Una nueva técnica para la granulación
húmeda continua utilizando un extrusor de doble tornillo
NANOPARTÍCULAS:
Apuntando a las terapias
cáncer
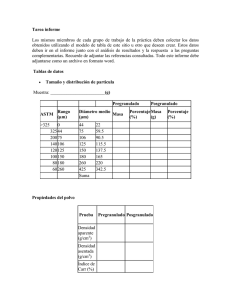
Portada Mayo-Junio 2013.indd 1
RESOLUCIÓN DE PROBLEMAS:
Tableteado y herramental
30/05/13 10:29
Un socio estratégico en aplicaciones de sistemas globales
e innovadores para optimizar los procesos de manufactura,
enfocado y con amplia experiencia
en las industrias
biotecnológicas, farmacéuticas, alimentos y bebidas.
Equipos de pruebas de integridad
|Bioreactores| Contenedores de
b i o p ro c e s o – te c n o l o g í a S i n g l e - U s e |
Fermentadores | Sistemas cross-flow
| Filtros de membrana 0.2 micras |
Prefiltros–filtros desde 50 micras
hasta 0.45 micras | Filtros para retención
de virus | Sistemas de Mezclado Single-Use
| Filtro para aire/gas | housingde acero
inoxidable | Sistemas de transferencia
Aséptica | Filtros de cromatografía por
membrana | Equipos para la determinación
de análisis en proceso | sistemas de filtración
Upstreamand donwstream.
turning science into solutions
Sartorius de México S.A. de C.V.
Cto. Circunvalación Pte. No. 149
Ciudad Satélite, Naucalpan
Estado de México 53100
Tel: +52-55-5562-1102
Fax: +52-55-5562-2942
sartorius@sartomex.com.mx
adentro es más seguro
modelo 628
Nosotros arriesgamos el cuello para que usted no tenga que hacerlo.
En Weiler Engineering, nuestro personal está dedicado al diseño y construcción de nuestras empacadoras
ASEP-TECH®. ¿El resultado? Los sistemas de envasado aséptico de líquidos más eficientes de la industria,
con tecnología de vanguardia que reduce en gran medida el elemento humano.
Qué más esperaria del sistema de envasado aséptico de líquidos más avanzado del mundo?
Nuestras máquinas de Soplado/Llenado/Sellado integran moldeado por soplado, llenado estéril y sellado hermético en una operación
ininterrumpida—un proceso de producción sin contacto humano que garantiza que los productos parenterales, soluciones oftálmicas,
fármacos respiratorios y otros medicamentos líquidos de su compañía puedan llegar al mercado de la manera más rentable posible—
en todas las ocasiones.
©2013 Weiler Engineering, Inc.
Por más de 40 años, hemos determinado el estándar industrial para el desarrollo del procesamiento estéril con un compromiso continuo
por la calidad e innovación por tecnología aséptica. Trabajaremos con su compañía para desarrollar una estrategia a medida para cada uno
de sus productos.
Para ver los sistemas
ASEP-TECH® en acción,
visite www.asep-tech.com/ptes
Soluciones protectoras mediante
envasado innovador
Marque en la tarjeta de servicio al lector el No. 9
14004-75 WEIL PharmTech ES_May2013.indd 1
PT MAYO / JUNIO.indd 1
3/28/13 3:50 PM
27/05/13 16:31
MAYO / JUNIO 2013 VOLUMEN 11, NÚMERO 2
En la Portada
Pharmaceutical Technology en Español, proporciona información importante, confiable, y
oportuna sobre todos los aspectos relacionados con Desarrollo e Investigación Aplicada;
y con las Tecnologías de Proceso, Fabricación, Formulación, y Empaque para la Industria
Farmacéutica Convencional y la de Biotecnología.
Primera plana
11 PAT
para la manufactura
de fármacos parenterales
Aplicar la calidad por diseño y la tecnología analítica de proceso
facilita la comprensión del proceso y el control de varias operaciones
en la liofilización.
Illustración por Dan Ward
Imágenes: JurgaR/Getty Images
Aspectos
Investigación Arbitrada
POSTURA OFICIAL
DESARROLLO DE FÁRMACOS INHALADOS
5 GMPs del desarrollo inicial para ESTABILI-
54 Mejora del análisis de productos inhalados
DAD: Perspectiva de la industria (Parte IV)
Bruce Acken, Mark Alasandro, Stephen Colgan, Paul
Curry, Frank Diana, Q. Chan Li, Z. Jane Li, Tony Mazzeo,
Andy Rignall, Z. Jessica Tan, Robert Timpano
Los representantes del Consorcio IQ exploran y definen esquemas y prácticas comunes de la industria para
la aplicación de las GMPs en el desarrollo inicial.
Los autores aportan métodos para obtener mejores
relaciones in vitro-in vivo.
66 Granulado con espuma
Los autores revisan los desarrollos en ganulación húmeda utilizando un extrusor de doble tornillo.
RESOLUCIÓN DE PROBLEMAS
48 Resolución de los problemas del
tableteado y los herramentales
NOVEDADES Y ANÁLISIS
La adopción de un proceso de siete pasos para el mantenimiento y el almacenamiento mejora la calidad del tableteado.
EDITORIAL INVITADA
50 Esterilización con dióxido de nitrógeno
La esterilización a temperatura ambiente utilizando gas de
dióxido de nitrógeno beneficia a los fármacos parenterales.
SÍNTESIS Y MANUFACTURA DE APIs
53 Ofreciendo un punto de vista farmacéutico
de los medios sociales
Porqué los medios sociales presentan retos y oportunidades únicas para las compañías farmacéuticas.
SOLUCIONES ESTADÍSTICAS
51 Logrando la estereoselectividad en la síntesis
63 Cálculo del resultado reportable de los datos
Los investigadores utilizan catalizadores inorgánicos como una
alternativa a los biocatalizadores en la conversión selectiva de
azúcares para producir bloques de construcción quirales.
Dos métodos para evaluar los resultados del reanálisis
después de los resultados fuera de especificaciones.
asimétrica
del reanálisis
FARMACÉUTICOS
60 Nanopartículas: facilitación de la entrega de
fármacos dirigidos en la terapia para el cáncer
Ingeniería de nanopartículas con propiedades óptimas para el
uso en las terapias del cáncer.
2
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 2
MAYO / JUNIO 2013
27/05/13 16:31
CONTENIDO
Especial
REGULACIÓN Y CUMPLIMIENTO
Formas Farmacéuticas
Sólidas y Excipientes
DENTRO DE LA USP
ESTRATEGIAS DE SOLUBILIZACIÓN
26 Polímeros avanzados para
la mejora de la solubilidad
14 Modernización de los estándares USP
La Convención de la Farmacopea de EEUU continúa haciendo de la modernización de los estándares la máxima prioridad en el 2013.
SOLUCIONES INTERNAS
Mesa redonda con Bend Research, Dow Wolff Cellulosics y Evonik
16 El error humano detrás del error humano
RECUBRIMIENTO DE TABLETAS Y GRANULACIÓN EN SECO
Debe llevarse a cabo una profunda investigación de todas las posibles causas de desviaciones.
31 Mejora continua en el recubrimiento
de tabletas y la granulación en seco
RESOLUCIÓN DE PROBLEMAS DEL CMC
Martin Hack y Dejan Djuric
18 Contaminantes por cozrrosión y sistemas
TABLETEADO
Problemas asociados con la contaminación
por corrosión en sistemas de agua.
de agua
39 Lucha contra problemas comunes
en el tableteado y el herramental
Entrevista con I Holland
CALIDAD POR DISEÑO
20 Medición de la distribución del
tamaño de partícula de los APIs
Se obtiene un mapa visual que puede usarse para estimar el tamaño de partícula del API visualmente.
35 Calidad por diseño en excipientes
Entrevista con Colorcon
VIGILANCIA REGULATORIA EN EEUU
DIVIDIDO DE TABLETAS
17 La innovación en vacunas aporta nuevos productos y procesos
43 Preocupaciones e innovaciones en
El desarrollo de vacunas se está beneficiando de los avances en manufactura y del soporte para la salud global.
Mesa redonda con Freeman Technology, AccuBreak Pharmaceuticals y Medelpharm
DENTRO DEL IPEC
el dividido y ranurado de tabletas
22 Alineándose con la guía para CoA del IPEC
Pharmaceutical Technology
es selectivamente extraida o indexada en:
Biological Sciences Database (Cambridge Scientific Abstracts)
Biotechnology and Bioengineering Database (Cambridge
Scientific Abstracts)
Business and Management Practices (RDSI)
Chemical Abstracts (CAS)
Current Packaging Abstracts
DECHEMA
Derwent Biotechnology Abstracts (Derwent Information, Ltd.)
Excerpta Medica (Elsevier)
International Pharmaceutical Abstracts (ASHP)
Science Citation Index (Thomson)
Pharmaceutical Technology está orgullosa de ser miembro
asociado de DCAT, IPEC y PDA.
Los presidentes anteriores del comité de calificación de excipientes del IPEC-Américas destacan los cambios a la guía del IPEC
sobre los certificados de análisis para excipientes a granel.
Secciones
69 ¿Qué hay de nuevo?
69 Calendario de eventos
71 Directorio Clasificado
72 Directorio de anunciantes
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 3
MAYO / JUNIO 2013
3
27/05/13 16:31
James P. Agalloco
President,
Agalloco & Associates
R. Gary Hollenbeck, PhD
Chief Scientific Officer,
UPM Pharmaceuticals
Larry L. Augsburger, PhD
Professor, Department of
Pharmaceutics,
University of Maryland
Ruey-ching (Richard) Hwang,
PhD
Senior Director,
Pharmaceutical Sciences,
Pfizer Global R&D
David H. Bergstrom, PhD
COO, NovaDel Pharma Inc.
Phil Borman
QbD Lead & Data Management &
Analysis Manager
GlaxoSmithKline
Mansoor A. Khan, PhD
Director, FDA/CDER/DPQR
Russell E. Madsen
President, The Williamsburg
Group, LLC
Rory Budihandojo
Director, Quality Systems Audit,
Boehringer-Ingelheim Shanghai
Pharmaceuticals Co. (China)
Heidi M. Mansour, PhD
Assistant Professor,
College of Pharmacy,
University of Kentucky
Todd L. Cecil
Vice-President
Compendial Science
United States Pharmacopeia
Jim Miller
President,
PharmSource Information
Services Bio/Pharmaceutical
Outsourcing Report
Metin Çelik, PhD
President,
Pharmaceutical Technologies
International (PTI)
Zak T. Chowhan, PhD
Consultant, Pharmaceutical
Development
Suggy S. Chrai, PhD
President and CEO,
Chrai Associates, Inc.
Roger Dabbah, PhD
Principal Consultant,
Tri-Intersect Solutions
Tim Freeman
Managing Director,
FreemanTechnology
Sanjay Garg, PhD
Professor,
Pharmaceutical Sciences,
University of South Australia
Moheb M. Nasr, PhD
Vice-President, CMC Regulatory
Strategy, Global Regulatory
Affairs,
GlaxoSmithKline
Garnet E. Peck, PhD
Professor Emeritus of Industrial
Pharmacy, Purdue University
James Polli, PhD
Professor,
School of Pharmacy,
University of Maryland
Wendy Saffell-Clemmer
Director, Research, BioPharma
Solutions
Gurvinder Singh Rekhi, PhD
Director,
Research and Development,
Elan Drug Delivery Inc.
Susan J. Schniepp
Pharmaceutical Consultant,
Schniepp & Associates, LLC
Colin Minchom, PhD
Vice President Particle Design
Hovione
David R. Schoneker
Director of Global Regulatory
Affairs, Colorcon
Christine Moore, PhD
Deputy Director for Science and
Policy, Office of New Drug Quality
Assessment, CDER, FDA
Eric B. Sheinin, PhD
President,
Sheinin and Associates
R. Christian Moreton, PhD
Vice-President, Pharmaceutical
Sciences, Finnbrit Consulting
Fernando J. Muzzio, PhD
Director, NSF Engineering
Research Center on Structured
Organic Particulate Systems,
Dept. of Chemical and
Biochemical Engineering,
Rutgers University
Charles A. Signorino, PhD
CEO, Emerson Resources, Inc.
Aloka Srinivasan
Principal Consultant,
PAREXEL International
Heinz Sucker, PhD
Professor Emeritus,
Pharmaceutical Institute,
University of Bern
Scott Sutton, PhD
Microbiology Network
Lynn D. Torbeck
Statistician, PharmStat Consulting
Pharmaceutical Technology en Español, V.11 No. 2 Mayo-Junio de 2013. Publicación
bimestral editada por Revistas para la Industria, S.A. de C.V. Editor responsable: Ma. Antonieta Guerrero Paz. No. de Certificado de Reserva de Derechos al Uso Exclusivo otorgado por el Instituto Nacional del Derecho al Autor No. 04-2011-010610533100-102. No. de Certificado de Licitud de Título
y Contenido otorgado por la Secretaría de Gobernación No. 15794. Domicilio de la Publicación: Av.
Insurgentes Sur 605, Desp. 404-D, Col. Nápoles, C.P. 03810, Deleg. Benito Juárez, México, D.F.
Impreso en: Polymasters de México, S.A. de C.V. - Calle Dos No. 123-C, Col. Granjas San Antonio
C.P. 09070, México, D. F. Distribuida por: Revistas para la Industria, S.A. de C.V. - Av. Insurgentes Sur
605, Desp. 404-D, Col. Nápoles, C.P. 03810, Deleg. Benito Juárez, México, D.F.
Toda la información y conceptos que aquí aparecen son responsabilidad exclusiva de cada uno
de los autores y firmas comerciales.
Esta prohibida y será castigada la reproducción total o parcial de cualquiera de los materiales
que aquí aparecen.
4
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 4
MAYO / JUNIO 2013
27/05/13 16:31
Postura Oficial: GMPs en Fase Inicial
GMPs en el Desarrollo Inicial para Estabilidad
Perspectiva de la Industria (Parte IV)
Bruce Acken, Mark Alasandro, Stephen Colgan, Paul Curry, Frank Diana, Q. Chan Li, Z. Jane Li, Tony Mazzeo, Andy
Rignall, Z. Jessica Tan, Robert Timpano
Los autores, parte del Consorcio
Internacional sobre Innovación y
Calidad en Desarrollo Farmacéutico (IQ
Consortium), exploran y definen enfoques
y prácticas comunes de la industria
cuando aplican las GMPs en el desarrollo
inicial. Un grupo de trabajo del consorcio
tiene como objetivo desarrollar una serie
de recomendaciones que puedan ayudar
a la industria a identificar oportunidades
para mejorar el tiempo de entrega para
el primer estudio en humanos y reducir
los costos de desarrollo, manteniendo
mientras tanto los estándares de calidad
requeridos y garantizando la seguridad
del paciente. Este artículo es el cuarto de
la serie y se enfoca en la estabilidad.
Bruce Acken está en Ciencias Analíticas en Merck & Co. Inc. (Summit,
NJ); Mark Alasandro está en Análisis Farmacéutico y Microbiología en
Allergan (Irvine, CA); Stephen Colgan está en Pfizer Investigación y
Desarrollo Global (Groton CT); Paul Curry está en NCE IyD Analítico en
Abbott Laboratories (Abbott Park, IL); Frank Diana está en Desarrollo
Farmacéutico en Endo Pharmaceuticals (Chadds Ford, PA); Q. Chan
Li está en Desarrollo Analítico US y Z. Jane Li está en Desarrollo
Farmacéutico, ambas en Boehringer Ingelheim Pharmaceuticals
(Ridgefield, CT); Tony Mazzeo* está en Desarrollo Analítico y Bioanalítico
en Bristol-Myers Squibb Company (New Brunswick, NJ); Andy Rignall
está en Ciencia Analítica en AstraZeneca IyD (Macclesfield, RU); Z.
Jessica Tan está en Analítica IyD en Amgen (Thousand Oaks, CA); y
Robert Timpano está en Pfizer IyD Global (Groton, CT).
*A quien debe dirigirse toda la correspondencia
E
l Consorcio Internacional sobre Innovación y Calidad
en Desarrollo Farmacéutico (IQ) formado en 2010,
es una asociación de más de 25 compañías farmacéuticas y de biotecnología con la misión de promover
estándares y regulaciones basados en la ciencia y científicamente llevados para productos medicinales en todo el mundo.
En una edición pasada del Pharmaceutical Technology, se publicó un artículo que describía las IQs de las Buenas Prácticas
de Fabricación (GMPs) en el grupo de trabajo de Desarrollo
Inicial (1). Este grupo de trabajo (WG) está concentrado en el
desarrollo de enfoques recomendados para la aplicación de las
GMPs en varias áreas de actividad del desarrollo CMC en la
Fase Inicial (p.ej., Fase 1 a Fase 2a). Una premisa clave de las
GMPs en el WG de Desarrollo Inicial es que los documentos
guía existentes de GMPs para el desarrollo inicial son vagos y
que sería valiosa una mejor claridad con opciones para cumplir
las expectativas GMP. Aunque no se aboga por una guía más
prescriptiva, en este artículo se comparten las mejores prácticas para promover la innovación en el desarrollo de productos
farmacéuticos mejorando los tiempos de ciclo, y manteniendo
mientras tanto la calidad apropiada del producto y garantizando
la seguridad del paciente.
Una consecuencia de la ausencia de claridad que rodea a la
guía de las GMP en fase inicial ha sido la variada interpretación
y aplicación de la guía de GMP existente dentro de diferentes
compañías y cuerpos regulatorios de acuerdo a su propia cultura y tolerancia al riesgo. Los debates internos con frecuencia
resultan en interpretaciones conservadoras de “uno se ajusta a
todo” que se apoyan en las guías de la Conferencia Internacional de Armonización (ICH) que son relevantes para el desarrollo de productos comerciales y no distingue diferencias en
las prácticas entre el desarrollo inicial y el desarrollo en etapa
final (es decir, Fase 2b y más allá). Por lo tanto, un conductor
clave del WG de IQ ha sido definir colectivamente las prácticas
mínimas aceptables dentro de la industria con respecto a las
expectativas de GMP en el desarrollo inicial, que permitan una
flexibilidad agregada y que sean consistentes con la guía y los
estatutos existentes (2, 3).
Según se describió en el artículo introductorio de esta serie,
los esfuerzos del WG en GMPs en el Desarrollo Inicial han
estado concentrados en las siguientes cuatro áreas de actividades de Química, Manufactura y Controles (CMC): Validación de Métodos Analíticos, Especificaciones, Manufactura del
Producto Farmacéutico y Estabilidad (1). El alcance inicial de
estos esfuerzos ha estado limitado al desarrollo de pequeñas
moléculas, el cual soporta los estudios clínicos de Primero en
Humanos (FIH) hasta la Fase 2a (prueba de concepto).
Dentro de esta revista se han publicado una serie de artículos que describen un enfoque recomendado para la aplicación
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 5
MAYO / JUNIO 2013
5
27/05/13 16:31
Postura Oficial: GMPs en Fase Inicial
de las GMPs en cada una de estas áreas. En las ediciones pasadas, se proporcionaron enfoques para la Validación de Métodos
Analíticos, Manufactura y Especificaciones para soportar los
sometimientos a las autoridades de salud (4, 5).
En este artículo, Parte IV, se discuten las necesidades de la
estabilidad. Durante el desarrollo inicial de fármacos, pueden
generarse datos de estabilidad para respaldar la manufactura
y el almacenamiento de productos clínicos que cumplan las
expectativas regulatorias para los sometimientos de Nuevos
Fármacos en Investigación (IND), Dossier de Productos Medicinales en Investigación (IMPD) o Solicitud de Estudio Clínico
(CTA) y ayudar a comprender el producto y el proceso. Los autores ilustran algunas de las mejores prácticas para estabilidad
que respalden los estudios clínicos en fase inicial en este artículo; sin embargo, algunas compañías pueden elegir hacer más,
o posiblemente menos, a su discreción y con las justificaciones
apropiadas basadas en la ciencia y en el riesgo, adecuadas para
las fases y propósitos del desarrollo. Los sistemas de calidad
GMP (p.ej., calificación de la cámara, procedimientos normalizados de operación) usados para soportar dichos estudios no
son el enfoque de este artículo.
Estudios de estabilidad para soportar el
desarrollo en la fase inicial
Al inicio en el desarrollo, las organizaciones de investigación
farmacéutica desarrollan productos con un enfoque primario
en la seguridad del paciente. Se generan datos en condiciones
de almacenamiento apropiadas para demostrar o soportar la
estabilidad de la sustancia farmacéutica y producto para asegurar la calidad del producto a través del período del estudio
clínico. Se dispone de documentos guía para indicar el tipo de
información necesaria para respaldar los estudios clínicos (3,
6-8). Aunque las guías de estabilidad del ICH describen los datos de estabilidad necesarios para respaldar las condiciones de
almacenamiento y la vida de anaquel para los sometimientos
comerciales, estas guías no son aplicables para las etapas iniciales del desarrollo cuando se conoce menos acerca de las nuevas sustancias y productos (9). Sin embargo, debe haber datos
apropiados para soportar el almacenamiento de los productos
que se están proponiendo para el uso clínico.
Si un producto está destinado para uso humano, aplican los
conceptos de las cGMPs. Para estabilidad, esta aplicación con
frecuencia resulta en un plan o protocolo escrito para el estudio
de estabilidad, métodos de prueba que se ajustan al propósito, documentación rastreable y confiable, y PNOs apropiados.
La mayoría de los compuestos en desarrollo inicial terminan
siendo suspendidos, por problemas de seguridad y/o eficacia
y/o por viabilidad comercial inadecuada. Por lo tanto, asegurar
eficientemente la calidad de los productos que se están usando
en los primeros estudios clínicos en humanos es un desafío que
enfrenta cada organización de investigación farmacéutica involucrada en los primeros estudios. Los desafíos comunes que
se enfrentan en el respaldo de la estabilidad de la sustancia farmacéutica (también conocida como API) y del producto farmacéutico se discuten aquí. Los autores ofrecen algunos enfoques
basados en el riesgo para recolectar datos para moléculas pequeñas, formas farmacéuticas orales sólidas usadas en estudios
clínicos Fase 1 y Fase 2a, en la esperanza de guiar a las compa6
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 6
ñías y a las autoridades de salud hacia estrategias armonizadas
y mejores prácticas.
En la fase inicial del desarrollo, los requerimientos CMC
incluyen la generación de los datos de estabilidad apropiados
en condiciones de almacenamiento adecuadas para respaldar
el sometimiento del IND (ó IMPD/CTA) y el uso del material
clínico hasta el final del estudio clínico. Estos objetivos científicos y regulatorios para la estabilidad deben cumplirse minimizando al mismo tiempo los gastos de operación que no agregan
ningún valor. Varios factores desde una perspectiva de negocio,
regulatoria y científica necesitan tomarse en cuenta cuando se
diseñan estudios de estabilidad en fase inicial:
• La tolerancia al riesgo de la organización patrocinadora y
su enfoque a la mitigación científica de los riesgos.
• La estabilidad inherente de la sustancia farmacéutica o
producto y el conocimiento previo del producto, del proceso y de la estabilidad.
• El ambiente regulatorio en los países en donde se realizará
el estudio clínico. Por ejemplo, algunos países pueden solicitar datos de estabilidad de múltiples lotes o de los lotes
clínicos reales o pueden no aceptar la extrapolación para
justificar asignaciones de fecha de uso.
• El uso futuro proyectado del producto. Los equipos de
desarrollo pueden tener alguna idea de la probabilidad
de que el proyecto avance a la Fase 2b. Si se espera que
un producto sea usado durante muchos meses o múltiples
años a través de varias fases de desarrollo, entonces puede
ser necesaria una propuesta de extensión de la fecha de
uso basada en datos adicionales a largo plazo y el aporte
adicional del conocimiento que se ha colectado. (3). Esta
información puede influir el alcance del estudio inicial de
estabilidad en forma de puntos de tiempo adicionales, condiciones adicionales y/o pruebas adicionales.
Considerando estos factores, la industria debe trabajar para
equilibrar las expectativas percibidas de los reguladores en los
países donde se realizarán estudios clínicos utilizando un enfoque basado en la ciencia y en el riesgo para generar y proveer
datos de estabilidad en los sometimientos regulatorios.
Alcance
En este artículo se discuten recomendaciones con respecto a la
generación de datos de estabilidad para la sustancia farmacéutica y formas farmacéuticas orales sólidas usadas para Fase 1
y Fase 2a (fases iniciales del desarrollo). Este artículo presenta
un marco de trabajo y principios orientadores para este fin. Los
ejemplos presentados no pretenden ser una guía de “como hacer”, sino más bien ilustraciones de los principios que se están
discutiendo. Otros diseños y condiciones del estudio también
pueden ser posibles con la justificación apropiada.
Los esfuerzos de desarrollo del producto para los suministros clínico iniciales con frecuencia son simples formulaciones con limitada historia de desarrollo. Los productos orales
iniciales de pequeña molécula pueden colocarse en una de
dos categorías: productos basados en la sustancia farmacéutica (DS) y productos formulados. Los productos basados en la
DS incluyen el uso de la DS tal cual (p.ej., polvo en un frasco
[PIB], polvo en cápsula [PIC], o DS enviado a granel a los sitios clínicos para el mezclado en el sitio. Estos productos casi
MAYO / JUNIO 2013
27/05/13 16:31
siempre tienen las mismas características de estabilidad que la
DS a granel, y los datos de estabilidad de la DS pueden ser
usados para respaldar la fecha de uso del producto. Los productos formulados pueden ser polvos formulados con excipientes,
cápsulas llenas con granulado formulado, o es una formulación
en tableta. Estas formulaciones llevan más esfuerzo y normalmente son usadas debido a una necesidad clínica específica, un
defecto del producto basado en la DS, o un deseo de utilizar la
misma formulación en los estudios Fases 1 y 2. En la mayoría
de los casos, serán formulaciones bastante simples que se supone tendrán un corto ciclo de vida. Si el producto avanza más
en el desarrollo, necesitarán desarrollarse formulaciones más
elegantes. No incluidas en este artículo están las formulaciones
que son preparadas extemporáneamente en el sitio clínico. Estas formulaciones son consumidas rápidamente y no se justifican estudios de estabilidad a largo plazo.
En las siguientes secciones, se discuten las consideraciones
de estabilidad de la DS y del producto farmacéutico (DP) para
el desarrollo inicial.
Estabilidad de la sustancia farmacéutica
Lotes representativos de la sustancia farmacéutica. Un
lote representativo de la DS o del DP, es aquel que se espera
que tenga estabilidad similar a la de los lotes usados en la producción clínica, basada en una evaluación fundamentada en la
ciencia y el riesgo, de los atributos que se espera que influyan
en la estabilidad, y en el conocimiento obtenido durante el desarrollo. Frecuentemente se fabrican primero lotes de DS no
GMP o GLP (buenas prácticas de laboratorio) y se colocan en
estabilidad para soportar una variedad de actividades de desarrollo del producto. Estos lotes con frecuencia son representativos de lotes GMP desde una perspectiva de la estabilidad y
pueden usarse para establecer un período de reanálisis inicial
para la DS y soportar un sometimiento clínico. Los datos de
estabilidad incluidos en la sección del CMC son limitados en
esta etapa del desarrollo (5). El lote de DS utilizado para la
manufactura del suministro clínico Fase 1 puede colocarse en
estabilidad concurrente con los estudios clínicos, si se justifica
el estudio adicional.
En el desarrollo inicial, es común que el proceso de manufactura sea mejorado como parte normal del desarrollo. Conforme evoluciona el proceso de la DS, es necesaria una evaluación para determinar si el lote inicial puesto en estabilidad es
todavía representativo del proceso mejorado. Los autores defienden un enfoque basado en la ciencia y el riesgo para decidir
si los estudios de estabilidad en los nuevos lotes del proceso
están justificados. Los principios básicos se discuten más adelante y pueden encontrarse más detalles de dicho enfoque en la
Ref. 10 y sus citas (10).
El primer paso es determinar cuáles de los atributos de la
DS tienen un efecto en la estabilidad. Este paso puede ser completado a través de evaluaciones de riesgo basadas en papel,
conocimiento previo, o a través de un desafío de estabilidad a
corto plazo a la par (según se discute en la siguiente sección)
que compare el nuevo lote con el lote inicial. Si el proceso
modificado impacta uno o más de estos atributos de calidad
relacionados con la estabilidad, el nuevo lote debe colocarse
en estabilidad. Si el proceso modificado no resulta en un cam-
bio de un atributo de calidad relacionado con la estabilidad, el
nuevo lote no necesita colocarse en estabilidad. Existen ciertos
cambios que casi siempre requieren un nuevo estudio. No puede asumirse que diferentes formas polimórficas, contra-iones, o
formas solvatadas de un compuesto tengan los mismos índices
de degradación o las mismas vías de degradación. Por lo tanto,
estos cambios casi siempre requerirán nuevos datos de estabilidad (11).
Los cambios típicos encontrados en el desarrollo inicial incluyen cambios en la vía de la síntesis (incluyendo un cambio
en el orden de los pasos formadores de enlaces), escala del lote,
equipo o sitio de manufactura, reactivos, origen de los materiales, solventes usados y pasos de cristalización. En la mayoría
de los casos, estos cambios no resultarán en cambios de la estabilidad de la DS. Una idea falsa común es que los cambios
del perfil de impurezas afectarán adversamente la estabilidad.
La mayoría de las impurezas de la DS, particularmente las impurezas orgánicas, son esencialmente inertes y no tienen efecto
sobre la estabilidad de la DS. Algunas impurezas, tales como
los metales catalíticos, las impurezas inorgánicas ácidas o básicas, o cantidades significativas de aguas residuales o solventes, pueden afectar la estabilidad, y si el nuevo proceso cambia
el nivel de estas impurezas, puede justificarse una estabilidad
adicional. Los cambios en el empaque del material a granel a
un empaque menos protector pueden requerir datos de estabilidad para soportar el cambio. Similarmente, el cambio a un
empaque más protector con el fin de extender el período de
reanálisis, más allá de lo que el estudio del lote representativo
original podría soportar, puede requerir datos adicionales en el
nuevo empaque.
Los atributos físicos que pueden impactar la estabilidad incluyen tamaño de partícula/área de superficie, el grado de cristalinidad/amorficidad, forma polimórfica, forma hidratada, y
contenido de humedad. Si un nuevo proceso cambia cualquiera
de estos atributos, se recomienda una evaluación de riesgo para
determinar si se justifica la estabilidad adicional. En algunos
casos, los datos de estabilidad acelerada o con estrés de corto
plazo pueden ayudar a decidir si estos atributos son de hecho
atributos de calidad relacionados con la estabilidad. Los conceptos detallados en los dos párrafos anteriores intentan diferenciar cambios mayores y menores y pueden resultar en diferentes estrategias de estabilidad para soportar estos cambios.
Una evaluación de riesgo puede ayudar a determinar si el
lote actual es suficientemente representativo. Alternativamente,
los datos adicionales pueden ser necesarios cuando el lote no
es representativo o cuando existe duda sustancial después de
la evaluación.
Colecta de los datos de estabilidad de la sustancia farmacéutica. Aunque las prácticas de análisis de estabilidad y
la cantidad de datos colectados varían de compañía a compañía, se discuten aquí tres enfoques comúnmente usados. Uno
es que un lote inicial de DS representativo sea colocado bajo
tiempo real y condiciones aceleradas (p.ej., 25°C/60% HR y
40°C/75% HR) y los resultados de estabilidad para unos cuantos puntos de tiempo (p.ej., 1-6 meses) se generen para soportar
un período inicial de reanálisis (p.ej., 12 meses o más). Si es necesario, el estudio de estabilidad puede continuar para extender
el período de reanálisis o el material GMP simplemente puede
ser reanalizado, según sea necesario, como parte de un prograPharmaceutical Technology en Español
PT MAYO / JUNIO.indd 7
MAYO / JUNIO 2013
7
27/05/13 16:31
Postura Oficial: GMPs en Fase Inicial
ma de reanálisis comúnmente usado para los componentes de
la manufactura.
Las pruebas analíticas seleccionadas para los estudios de
estabilidad deberán cubrir los atributos de calidad relacionados
con la estabilidad. Típicamente, estas pruebas incluirían impurezas y descripción y pueden incluir el ensayo. La pureza quiral, la forma polimórfica (p.ej., rayos X) y el contenido de agua
deben ser analizados, según convenga. Puede no ser necesario
realizar todas las pruebas en cada punto de tiempo dependiendo
del propósito de la prueba.
Un segundo enfoque es usar condiciones de alto estrés
con un tiempo corto, como el modelo de alta temperatura y
alta humedad (HT/HH), Por ejemplo, la DS es almacenada a
70°C/75% HR en contenedores abiertos y cerrados, mientras
se monitorea la estabilidad química y física hasta tres semanas.
Los resultados de la estabilidad química se utilizan para extrapolar el período de reanálisis inicial de la DS hasta 18 meses
más o menos, si se justifica. La extrapolación se basa en el principio de la clásica relación de Arrhenius entre la temperatura
y la tasa de reacción (degradación), asumiendo una reacción
de orden pseudo-cero. Es una predicción simple y rápida de
la estabilidad de la DS (12). Este enfoque es más aplicable
para la DS que se considera que tiene buena estabilidad física
y química demostrada durante el descubrimiento del fármaco.
Se ha ganado la aceptación de este enfoque en un número de
sometimientos.
Un tercer enfoque es el uso de estudios de estrés en diversas
condiciones acopladas con el modelo, como el Programa de
Evaluación de Estabilidad Acelerada (ASAP) (13). El ASAP
combina un protocolo de envejecimiento acelerado con una
ecuación de Arrhenius corregida para humedad para proveer
una predicción temprana para la DS y un período de uso de la
DS. Este programa involucra análisis estadístico para modelos
El conocimiento adquirido de estos
estudios puede usarse para: soportar condiciones de almacenamiento
y asignaciones del período inicial de
reanálisis; diseñar futuros estudios de
estabilidad; evaluar el impacto de las
excursiones de temperatura; y seleccionar el empaque.
más complejos de cinética de orden no simple de degradación
en la DS y el DP, y produce predicciones más rápidas y confiables de estabilidad química. Para la DS o DP con desafíos de
estabilidad química potencial, este enfoque puede ser muy útil
para definir la condición de almacenamiento apropiado y utilizar el período dentro de un tiempo relativamente corto que permita el avance de los programas de desarrollo inicial. Lo que es
más importante, el ASAP tiene potencial para un alcance más
amplio de evaluación de la estabilidad para desarrollar la estrategia de control de estabilidad del DP, como es la predicción de
8
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 8
MAYO / JUNIO 2013
estabilidad a largo plazo y los requerimientos de empaque en
la implementación de la QbD para comercialización. El ASAP
ha sido utilizado por las compañías como parte de los sometimientos regulatorios en múltiples países y ha proporcionado
la base para la justificación de la formulación, del empaque y
del contenido de humedad. Existe un diálogo continuo entre la
industria y las agencias regulatorias acerca de estas nuevas formas para la industria de cumplir sus obligaciones con respecto
al aseguramiento de la aceptabilidad de los productos al final de
sus vidas de anaquel.
El conocimiento adquirido de estos estudios puede entonces ser utilizado para: soportar las condiciones de almacenamiento y las asignaciones del período de reanálisis inicial; el
diseño de futuros estudios de estabilidad; evaluar el impacto de
las excursiones de temperatura; y seleccionar el empaque. Los
resultados también pueden ser usados para establecer el período de uso inicial para los productos basados en la DS (p.ej., PIB
ó PIC). Los esquemas acelerados o de estrés pueden ahorrar
tiempo para llegar a un primer estimado de la estabilidad del
material.
El período de reanálisis derivado de estos tipos de estudios
acelerados o con estrés puede ser verificado posteriormente
colocando el primer lote clínico en estudios de estabilidad en
tiempo real bajo condiciones aceleradas y de largo plazo del
ICH. Las extensiones futuras del período de reanálisis/uso pueden basarse en los datos en tiempo real.
Asignación de la fecha de reanálisis. Los datos de estabilidad de la sustancia farmacéutica que se adecúan con la
etapa de desarrollo, pueden ser generados para soportar el uso
de la DS para la manufactura de suministros clínicos a través
de un sistema que utilice las fechas de reanálisis. Cuando es
necesario un período de reanálisis más prolongado, las extensiones son más comúnmente manejadas ya sea a través de un
programa de estabilidad o a través de un programa de reanálisis
específico para el lote. En los sometimientos se puede describir
cómo se extenderá el período de reanálisis en el futuro. Si se
utilizan los datos de estabilidad del segundo (HT/HH) o del
tercer enfoque (ASAP), se extrapola un período de reanálisis
a partir de la ecuación de Arrhenius o de la ecuación de Arrhenius corregida para la humedad (12). El análisis de estabilidad
también se usa para soportar el período de uso de productos
simples basados en la DS.
Diseño de estudios de estabilidad del
producto farmacéutico para el desarrollo inicial
Selección del lote para estudios de estabilidad. Según se
señaló antes, los suministros clínicos de la etapa inicial con frecuencia son simples formulaciones orales o polvos en frascos
o polvos en cápsulas. Los estudios de estabilidad en esta etapa
inicial necesitan respaldar el uso del producto en los estudios
clínicos y facilitar más desarrollo. A menos que se requiera una
formulación específica para los estudios en fase inicial (p.ej.,
debido a escasa solubilidad, pobre biodisponibilidad, la necesidad de formulaciones de una vez al día, o la necesidad de
una formulación estéril inyectable), se emplea típicamente una
simple forma farmacéutica sólida oral. Para la DS en cápsula
o frasco, la estabilidad de la DS soportará el desarrollo en fase
inicial, sin embargo, el suministro clínico puede ser colocado
en estabilidad (p.ej., muestras de retención) y analizado, si es
27/05/13 16:31
necesario. El estudio continúa hasta el término del estudio clínico y podría también ser monitoreado en puntos de tiempo
posteriores para incrementar el conocimiento del producto, si
así conviene.
Para productos formulados como dosis sólidas orales, pueden llevarse a cabo los estudios de preformulación y desarrollo
del proceso para definir la formulación inicial. Estos estudios
también proveerán información inicial de estabilidad sobre la
DS y su compatibilidad con los excipientes, humedad, condiciones del proceso, y así sucesivamente. En esta etapa, puede
fabricarse un lote de desarrollo (no GMP) y ponerse en estabilidad. Si este lote es representativo del suministro clínico (misma
o cercana composición, proceso y empaque) puede soportar el
sometimiento como IND/IMPD y la fecha de uso inicial para
el producto. Si se requiere más de una potencia, puede usarse
un diseño de estabilidad agrupado. Los cambios en el producto
farmacéutico clínico necesitan ser evaluados y los lotes adicionales ser puestos en estabilidad, conforme sea necesario.
Utilizando las mismas herramientas y procesos de pensamiento
que se mencionaron en la porción de la DS de este artículo, el
primer paso es determinar qué atributos del DP tienen un efecto
sobre la estabilidad. Si el nuevo DP cambia uno o más de los
atributos de calidad relacionados con la estabilidad, el nuevo
lote deberá ser colocado en estabilidad. La identificación de
estos atributos de calidad relacionados con la estabilidad puede facilitarse a través de evaluaciones de riesgo en papel, el
conocimiento previo o a través de desafíos de la estabilidad a
corto plazo. Los cambios que podrían impactar la estabilidad
del producto incluyen cambios mayores en la DS (p.ej., forma
sólida), cambios en la formulación (p.ej., relación de fármaco
a excipiente, diferentes excipientes), cambios significativos al
proceso (p.ej., compresión directa a granulación húmeda), y
cambios en el empaque (p.ej., materiales de contacto, blíster
contra frasco, cambio en tamaño/espacio vacío). Los cambios
que improbablemente afecten la estabilidad para formas farmacéuticas orales simples incluyen cambios en la escala, el equipo
y el sitio de manufactura.
Vale la pena subrayar el punto de que los
datos de estabilidad incluidos primero en
los sometimientos regulatorios son con
frecuencia justo el inicio de un programa.
Requisitos mínimos para que un estudio de estabilidad soporte los sometimientos iniciales
Número de lotes. Típicamente, los lotes son limitados en el
desarrollo inicial. Como estos estudios clínicos son pequeños,
seguido existe la necesidad de producir sólo un lote. Los materiales clínicos que se espera que sean usados sólo en las Fases 1
y 2a, los autores piensan que los datos a largo plazo colectados
en el lote clínico o en un lote representativo del lote clínico
pueden ser suficientes para asegurar la estabilidad del producto
clínico en la primera fase del desarrollo. Para productos esta-
bles, los lotes adicionales de la misma formulación no necesitan colocarse en estabilidad.
Duración del estudio y puntos de tiempo. Los estudios
deben generar datos que den la certeza de que los suministros
clínicos conservan su calidad dentro de límites aceptables al
menos a través del uso de los suministros en la clínica. Como
los estudios clínicos en la primera etapa pueden ser relativamente cortos, los datos de estabilidad sólo necesitan soportar
períodos de uso breves. Sin embargo, en muchos casos, se tienen en reserva muestras extra para extender los estudios durante más tiempo como asunto de practicidad; por ejemplo, si los
suministros son necesarios para mayor duración que los planes
iniciales debido a retrasos en el programa clínico.
Como se señaló, la guía Q1A del ICH sobre análisis de estabilidad incluye recomendaciones para estudios de estabilidad
para requerimientos de solicitud de comercialización aunque
estos no pretenden respaldar los estudios clínicos iniciales. No
obstante, muchos de los lineamientos del ICH son útiles, tales
como las condiciones de almacenamiento y el espaciado de los
puntos de tiempo. El espaciado de los puntos de tiempo debe
estar diseñado para capturar la tendencia general de la estabilidad, señalando que puede ser deseable tener unos pocos puntos
de tiempo iniciales durante los estudios de selección o estudios
de estabilidad más formales para establecer una fecha de uso
para el momento del sometimiento.
Para el DP, la formulación en la fase inicial habitualmente
no será usada en los estudios clínicos posteriores. Como tal,
tiene poco valor realizar el estudio de estabilidad más allá del
tiempo en la clínica.
Las pruebas analíticas seleccionadas para los estudios de
estabilidad deben cubrir los atributos de calidad que pueden
cambiar con el tiempo. Típicamente, estas pruebas incluirían
ensayo, impurezas (es decir, productos de degradación), liberación del fármaco (p.ej., desintegración o disolución) y descripción. Si la conversión quiral ha demostrado ser un problema en
la DS, entonces ésta debe ser monitoreada en el DP. Puede no
ser necesario realizar todas las pruebas en cada punto de tiempo
dependiendo del propósito de la prueba.
Los datos de los estudios de estrés HT/HH pueden ser útiles
en la evaluación del impacto para las excursiones de temperatura y para diseñar estudios eficientes a largo plazo. Otro enfoque son los estudios de estrés acoplados con el modelo, como
el ASAP que se discutió anteriormente. El ASAP en algunos
casos puede dar un buen estimado del período de uso en un
tiempo más corto que el enfoque tradicional de estabilidad a
largo plazo. La fecha de uso derivada de la extrapolación del
estrés puede ser verificada posteriormente colocando el primer
lote clínico en estudios de estabilidad en tiempo real bajo las
condiciones aceleradas y a largo plazo del ICH.
Estrategia para asignar la fecha de uso y extensiones
de la fecha de uso. La extrapolación de los períodos de uso
es una práctica comúnmente aceptada y casi una necesidad en
términos de obtener un producto clínico empacado, etiquetado,
liberado y embarcado a los sitios clínicos con algo de tiempo se
uso sobrante para el almacenamiento en los sitios clínicos. Ha
habido mucho debate sobre cómo debe usarse la extrapolación
del conocimiento existente de la estabilidad para establecer los
períodos de uso de los suministros clínicos. Según se discutió
al principio de este artículo, muchos factores determinarán la
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 9
MAYO / JUNIO 2013
9
27/05/13 16:31
Postura Oficial: GMPs en Fase Inicial
cantidad de extrapolación que es defendible. Las autoridades
de salud pueden estar reluctantes a aceptar extrapolaciones de
más de 12 meses después de los datos de estabilidad a largo
plazo existentes, pero es posible justificar más o menos la extrapolación con base en fundamentos científicos (ver la sección
de colecta de datos de estabilidad de la DS). Un enfoque de ‘un
tamaño se adapta a todos’ es difícil de lograr en términos de
un número exacto de extrapolaciones permitidas, pero se recomienda un enfoque basado en la ciencia y el manejo del riesgo.
Con suficiente conocimiento de la estabilidad de la DS y
del producto farmacéutico y una formulación clínica estable,
el riesgo para la calidad del material es bajo cuando se permiten extensiones del período de reanálisis/uso 12 meses más allá
de los datos de estabilidad en tiempo real disponibles. Esto,
no obstante, no sería apropiado para un producto farmacéutico
inestable o uno para el cual existe conocimiento insuficiente de
la estabilidad. Este enfoque basado en el riesgo se basa en tres
principios:
1.) Los atributos de estabilidad que limitan la vida de anaquel están determinados de los estudios de desarrollo
iniciales y de las condiciones apropiadas de empaque y
almacenamiento seleccionadas.
2.) Las asignaciones de fecha de uso son monitoreadas y
confirmadas a través de estudios tradicionales (tiempo real
y acelerados) y acciones apropiadas tomadas cuando se
requiere.
3.) Las compañías tienen procedimientos internos que describen procesos para establecer y extender las fechas de
uso iniciales. Los procedimientos internos para actualizar
las asignaciones de la fecha de uso normalmente involucran la coordinación del reetiquetado clínico y en algunos
casos de los sometimientos del CMC.
Vale la pena subrayar el punto de que los datos de estabilidad incluidos primero en los sometimientos regulatorios son
con frecuencia justo el inicio de un programa para monitorear
la estabilidad de los suministros clínicos, y el monitoreo continuo para confirmar las demandas de almacenamiento y las
tendencias iniciales pueden ser muy útiles para productos que
continúan el desarrollo.
Los autores respaldan la siguiente recomendación de A. Kane:
Las compañías con frecuencia luchan con la estrategia para actualizar las asignaciones del período de reanálisis/uso a lo largo
del desarrollo y las consiguientes actualizaciones a los sometimientos del CMC para dossiers del tipo IND e IMPD. “Podría
decirse que la preferencia de muchos solicitantes sería actualizar
las asignaciones conforme se generaran más datos de estabilidad
sin necesidad del sometimiento de una enmienda sustancial. Para
evitar la necesidad para enmiendas sustanciales posteriores, el
IMPD debe contener la especificación propuesta y proporcionar
una explicación clara de cómo se aplica o aplicará la extrapolación para asignar el período de reanálisis/uso” (14). Es opinión
del autor que con un programa de monitoreo bien planeado, la
extrapolación con datos iniciales limitados está justificada.
Conclusiones
La demostración de estabilidad para suministros clínicos debe
ser conducida por medio del conocimiento científico adquirido
en el desarrollo así como en una evaluación basada en el ries10
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 10
MAYO / JUNIO 2013
go para orientar el uso eficiente de recursos disponibles. En el
desarrollo inicial, los esfuerzos clínicos están con frecuencia
concentrados en productos relativamente simples con ciclos de
vida cortos y la DS de la cual están hechos es con frecuencia
producida al evolucionar los procesos químicos. Los esfuerzos
para determinar la estabilidad de la DS y del producto farmacéutico deben ajustarse para esta fase del desarrollo y están
diseñados para dar la información de estabilidad más básica,
esto es, asegurar que la DS es de calidad adecuada cuando se
usa para la manufactura del producto y que el producto farmacéutico es de calidad adecuada mientras está en la clínica.
Para hacer esta evaluación, pueden usarse simples estudios de
estabilidad utilizando la guía del ICH y/o datos obtenidos en
condiciones aceleradas o de estrés. Pueden colectarse otros datos experimentales para incrementar el conocimiento científico
de la DS/DP.
Esperamos que la aportación de los enfoques para la estabilidad en fase inicial descritos aquí, junto con los enfoques en
esta serie de artículos de las otras áreas del grupo de trabajo de
GMPs en Fase Inicial de IQ, le den una plataforma para estimular las discusiones sobre estos enfoques dentro de la industria y
con las autoridades de salud de todo el mundo.
Para estimular más diálogo, este grupo de trabajo de IQ está
planeando un taller en el futuro cercano para promover un debate robusto y discusiones sobre estos esquemas. Tenemos la
esperanza de que estas discusiones proveerán una mejor alineación entre desarrollo, la vigilancia de QA y el área regulatorio
dentro de la industria farmacéutica y de manera más importante
con las autoridades de salud mundiales. El acuerdo entre la industria y las autoridades de salud con respecto a los esquemas
aceptables para los estudios de estabilidad en las fases iniciales
del desarrollo de fármacos sería claramente benéfico para los
científicos de desarrollo y permitiría un esquema más ágil y
flexible para abordar mejor el entorno dinámico típicamente
encontrado durante las fases iniciales del desarrollo clínico,
proporcionando mientras tanto controles apropiados para garantizar la seguridad del paciente.
Renuncia
Este artículo representa la opinión de los autores y no necesariamente la de sus respectivas compañías.
Referencias
1.A. Eylath et al., Pharm. Technol. 36 (6) 54–58 (2012).
2.21 CFR Part 211.166 Stability Testing.
3.CHMP, CHMP/QWP/185401/2004, Requirements to the Chemical
and Pharmaceutical Quality Documentation Concerning Investigational Medicinal Products in Clinical Trials (EMA, Mar. 31, 2006).
4.D. Chambers et al., Pharm. Technol. 36 (7) 76–84 (2012).
5.R. Creekmore et al., Pharm. Technol. 36 (8) 56–61 (2012).
6.FDA, Guidance for Industry: cGMP for Phase 1 Investigational Drugs
(Rockville, MD July 2008).
7.FDA, Guidance for Industry: Content and Format of Investiga tional
New Drug Applications (INDs) for Phase 1 Studies of Drugs, Including
Well Characterized, Therapeutic, Biotechnology Derived Products
(Rockville, MD, November 1995).
8.FDA, Guidance for Industry: INDs for Phase 2 and Phase 3
Studies Chemistry, Manufacturing, and Controls (Rockville
MD, May 2003).
“GMPs en el Desarrollo Inicial para Estabilidad
Perspectiva de la Industria (Parte IV)”
continúa en la pág. 20
27/05/13 16:31
Tecnología Analítica de Proceso
Avances en el PAT
para la manufactura
de fármacos
parenterales
Patricia Van Arnum
La aplicación de la calidad por
diseño y la tecnología analítica
deproceso facilita la comprensión
del proceso y el control de varias
operaciones en la liofilización.
C
uando la FDA anunció en
2 0 0 2 una nueva iniciativa, Buenas Prácticas de Ma
nufactura Farmacéutica Actuales (CGMPs) para el Siglo XXI,
y posteriormente publicó su reporte,
CGMPs Farmacéuticas para el Siglo
XXI - Un Enfoque Basado en el Riesgo, en 2004, empezó un esfuerzo para
aumentar la calidad del producto y modernizar la manufactura farmacéutica a
través de un enfoque basado en la ciencia y en el riesgo bajo los principios
de calidad por diseño (QbD) (1). Este
esfuerzo fue además estimulado por la
emisión de la guía sobre tecnología analítica de proceso (PAT) en 2004 para facilitar para facilitar las nuevas tecnologías que mejorarían el conocimiento del
proceso y asistirían en la identificación
y control de los puntos críticos en un
proceso (2). Estas tecnologías incluyen:
dispositivos de medición apropiados,
los cuales pueden colocarse en, dentro o
en línea; herramientas estadísticas o de
tecnología de la información; y un enfoque de sistemas científicos para el análisis de datos para controlar los procesos
y asegurar la producción de materiales
en proceso y productos finales de la calidad deseada (1-4). La liofilización es
una aplicación específica de la QbD y
del PAT en la manufactura de fármacos
parenterales, y una revisión de la literatura reciente muestra varios desarrollos
en este campo.
Evaluación de la tecnología
En la aplicación de la QbD al proceso de liofilización, la primera tarea en
definir los parámetros que tienen el
potencial de afectar el desempeño del
proceso y los atributos de calidad del
producto (5). Los puntos clave incluyen
los parámetros de operación del proceso de secado por congelamiento, los
parámetros de la formulación, el equipo
y la preparación de componentes y los
dispositivos (5). El PAT puede aplicarse
a través de sensores en varias etapas del
liofilizado, lo cual puede incluir el uso
de sensores de temperatura , análisis de
elevación de presión, mediciones de
temperatura manométrica, calorimetría,
microscopía y técnicas espectroscópicas, tales como el infrarrojo cercano
(NIR), Raman y espectroscopía de infrarrojo (6).
Evaluación de las herramientas
Un enfoque establecido para el PAT en
la liofilización es ofrecido por la tecnología del secado por congelamiento
SMART de SP Scientific, la cual es
utilizada para optimizar el ciclo de secado por congelamiento. La tecnología
SMART fue desarrollada por la Universidad de Connecticut y la Universidad
de Purdue a través del Centro para la
Investigación de los Procesos Farmacéuticos y autorizada a SP Scientific.
La tecnología se apoya en el uso de la
medición de la temperatura manométrica, la cual calcula la temperatura del
producto en la interfase de sublimación
sin tener que colocar termopares u otros
sensores de temperatura en los viales
del producto (7). La tecnología de secado por congelamiento SMART es usada
en el congelador de desarrollo Lyostar 3
de SP Scientific. La tecnología SMART
usa información, como es el número de
viales, el volumen de llenado, el peso
del llenado, el volumen de la cámara del secador por congelamiento y la
temperatura de formulación crítica para
optimizar un ciclo (8). Ésta contribuye
con varios puntos clave en liofilización:
selecciona un ciclo óptimo de congelamiento que se basa en si la formulación
es cristalina o amorfa; selecciona la
presión óptima de la cámara; determina
la temperatura objetivo del producto y
ajusta el secado del anaquel durante el
secado primario para mantener el producto en una temperatura objetivo predeterminada (8).
SP Scientific se ha asociado con la
compañía de gas industrial Praxair para
otra herramienta basada en el PAT para
liofilización, ControLyo Nucleation on
Demand Technology de Praxair, usada
para controlar la nucleación de la solución del producto en el secador por
congelamiento. Las compañías se asociaron primero en 2010, lo que le dio
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 11
MAYO / JUNIO 2013
11
27/05/13 16:31
Tecnología Analítica de Proceso
a SP los derechos globales, exclusivos
para comercializar la tecnología en liofilizadores de desarrollo. En 2012, las
compañías expandieron su colaboración para permitir a SP Scientific equipar sus secadores clínicos, piloto y de
producción con la Tecnología ControLyo y transferir la tecnología para permitir que SP adecúe las unidades piloto y
de producción existentes.
IQ Mobil Solutions, ubicada en
Holzkirchen, Alemania, ofrece sensores
inalámbricos y sin baterías (Sistema de
Interrogación de Temperatura Remota,
TEMPRIS) como una herramienta PAT
para liofilización. En un estudio reciente, el sistema TEMPRIS fue valorado
para la medición de la exactitud, la capacidad de detección exacta del punto
final, y el efecto del posicionamiento
utilizando corridas de producto con sacarosa, manitol y trehalosa (9). Los datos fueron comparados con las mediciones con termopares de calibre 36 y con
medición no invasiva de la temperatura
a partir de mediciones de temperatura
manométrica. Los resultados mostraron que los perfiles de temperatura del
TEMPRIS concuerdan con los datos de
los termopares cuando los sensores se
colocaron en el fondo, en el centro del
vial. Adicionalmente, los sensores del
TEMPRIS revelaron perfiles de temperatura confiables e indicaciones de punto final relacionadas con los datos del
termopar cuando se monitorearon los
viales en la posición del borde (9).
Los investigadores en la Universidad Ghent en Bélgica utilizaron
espectroscopía Raman y NIR como
herramientas PAT en un proceso de
secado por congelamiento (10). Para
el estudio, las sondas del Raman y del
La espectroscopía Raman proporcionó
datos acerca del estado sólido del manitol, el punto final del congelamiento
y varias condiciones físicas y químicas
(p.ej., inicio de la nucleación del hielo e
inicio de la cristalización del manitol).
La espectroscopía NIR monitoreó los
puntos clave en el secado, el punto final
de sublimación del hielo y la liberación
del agua de hidratos durante el almacenamiento (10). Un estudio posterior
examinó además el uso de los analizadores de proceso espectroscópicos en
línea (Raman, NIR y espectroscopía de
emisión de plasma) (11).
Otro estudio reciente examinó el
uso de espectroscopía de absorción con
láser de diodos sintonizable (TDLAS)
para el monitoreo del secado secundario en el liofilizado a escala de laboratorio con el propósito de dirigirse a
los contenidos de humedad intermedia
en el producto (12). Un estudio inicial
examinó el TDLAS para determinar la
temperatura promedio del producto en
el secado primario (13).
Otros enfoques
Los investigadores recientemente implementaron y evaluaron un sistema
de fibra óptica como herramienta de
monitoreo del proceso durante la liofilización. El estudio registró los perfiles
de temperatura del manitol, sacarosa y
trehalosa utilizando varios prototipos
de sensores de fibra óptica (OFSs) (14).
Los datos se compararon con los datos
obtenidos con termopares convencionales o manometría Pirani/capacitancia
con respecto al punto final del secado
primario. Los investigadores reportaron
que los datos obtenidos con el OFS en
Un estudio reciente evaluó un sistema de fibra óptica
como herramienta de monitoreo del proceso.
NIR se construyeron en la cámara del
liofilizador para permitir el monitoreo
simultáneo del proceso de una solución
de manitol al 5% (p/v). Los espectros
Raman y NIR fueron colectados continuamente durante el secado por congelamiento y se analizaron utilizando análisis de componentes principales y resolución multivariada de la curva (19).
12
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 12
contacto con el producto estuvieron en
buena concordancia con los datos obtenidos mediante los termopares o la manometría Pirani/capacitancia. Los OFSs
mostraron mayor sensibilidad, respuesta más rápida y mejor resolución en
comparación con los termopares (14).
Otro estudio examinó el uso de un sensor suave para el monitoreo en línea del
paso de secado primario de un proceso
de secado por congelamiento en viales
(15).
Referencias
1.FDA, Pharmaceutical CGMPs for the 21st
Century—Risk-Based Approach: Final Report (Rockville, MD, 2004).
2.FDA, Guidance for Industry: PAT—A
Framework for Innovative Pharmaceutical Development, Manufacturing and
Quality Assurance (Rockville, MD, 2004).
3.FDA, Progress Report on Process Analytical Technology, www.fda.gov/Drugs/
DevelopmentApprovalProcess/Manufacturing/QuestionsandAnswersonCurrentGoodManufacturingPracticescGMPforDrugs/ucm072006.htm,
accessed Feb. 13, 2013.
4.P. Van Arnum, Pharm. Technol. 36 (9),
38-40 (2012).
5.F. Jameel and W.J. Kessler, “Real-time
Monitoring and Controlling of Lyophillization Process Parameters Through
Process Analytical Technology Tools,”
in PAT Applied in Biopharmaceutical
Process Development and Manufacturing: An Enabling Tool for Quality by
Design, C. Undey et al., Eds. (CRC Press,
Taylor & France, Boca Raton, FL, 2012),
pp. 241-243.
6.R.B. Shah et al., “Scientific and Regulatory Overview of Process Analytical
Technology in BioProcesses,” in PAT
Applied in Biopharmaceutical Process
Development and Manufacturing: An
Enabling Tool for Quality by Design, C.
Undey et al., Eds. (CRC Press, Taylor &
France, Boca Raton, FL 2012), p. 5.
7.D. Sesholtz and L. Mather, “’Smart
Freeze Drying,” Innovation in Pharm.
Technol., www.biopharma.co.uk/wpcontent/uploads/2010/07/Smart_Freezedr y ing _ a r ticle _ 20 07, accessed
Feb. 13, 2013.
8.Shon, “Optimization of Primary FreezeDrying Cycle Times,” Innovation in
Pharm. Technol., www.iptonline.com/
pdf_viewarticle.asp?cat=7&article=887,
accessed Feb. 13, 2013.
9.C. Schneid and H. Giessler, AAPS PhamSciTech. 9 (3), 729-739 (2008).
10. R.M. De Beer et al., J. Pharm. Sci.
98 (9),3430-3446 (2009).
11. R.M. De Beer et al., Talanta 83 (5), 16231633 (2011).
12. S.C. Schneid et al., AAPS PharmSciTech.
12 (1), 379-387 (2011).
13. C. Schneid et al., J. Pharm. Sci. 98 (9),
3406-3418 (2009).
14. J.C. Kasper et al., Eur. J. Pharm. Biopharm.
online, DOI 10.1016/j.ejpb.2012.10.009, 15
Nov. 2012.
15. S. Bosca, A.A. Barresi and D. Fissore, Pharm. Dev. Technol., online,
DOI 10.3109/10837450.2012.757786,
Jan. 22, 2013. PT
MAYO / JUNIO 2013
27/05/13 16:31
Avances de las pruebas analíticas e instrumentación para biofarmacéuticos
También en enero del 2013, Perkin Elmer lanzó la estación de trabajo
automatizada JANUS BioTx Pro para un proceso mejorado de desarrollo
de proteínas. La estación de trabajo está diseñada para purificación de
proteínas en pequeña escala, de alto rendimiento (de µg a mg de proteínas)
y acomoda múltiples modos de cromatografía (columna, punta y lote).
Ésta también soporta herramientas de selección en placas comercialmente
disponibles y basada en columnas, tales como las placas GE PreDictor, las
columnas PhyNexus PhyTip, y las columnas Atoll. Las aplicaciones para
la estación de trabajo incluyen estudios de unión a resinas y selección de
condiciones.
En mayo del 2012, Shimazdu lanzó un Analizador de Glicanos Accurate
2 (AGA2) mejorado, el cual provee una base de datos de glicanos y la
Resonancia AXIMA de la compañía, un MALDI (desorción/ ionización de
láser asistido con matriz)-QIT (trampa de iones quadrupolo)-espectrómetro
de masas TOF (tiempo de vuelo). El AXIMA Resonancia está acoplado
a una base de datos que contiene información estructural de glicanos
generada a partir de espectros de MSn reales para seleccionar picos
precursores hasta MS4. Los espectros resultantes son interpretados para
regresar la estructura del glicano más probable. El AGA2 fue creado a
partir de glicanos biosintetizados y contiene glicanos bien definidos
y caracterizados, biológicamente relevantes. También usa esquemas
comunes de marcado con fluorescencia, incluyendo la 2-aminopiridina, el
ácido 2-aminobenzoico y la 2-aminobenzamida, y otros tipos de marcado
con fluorescencia.
En febrero de 2013, Thermo Fisher Scientific expandió su portafolio de
análisis de alto contenido con tres nuevas soluciones en biología celular:
el Lector Thermo Scientific ArrayScan XTI High Content Analysis (HCA,
la Plataforma Thermo Scientific CellInsight NXT HIgh Content Screening
(HCS), y la actualización del Thermo Scientific X1 para clientes actuales
del ArrayScan VTI. Cada uno de estos productos presenta una cámara de
gran formato, CCD (dispositivo cargado-acoplado) sensible, la suite para el
software Thermo Scientific HCS Studio, y mayores capacidades de proceso.
La cámara Thermo Scientific X1 CCD, usada para análisis de alto contenido,
ofrece mejor sensibilidad, mayor resolución y un gran campo de visión.
Thermo Fisher Scientific también introdujo la columna Thermo Scientific
Dionex GlycanPac AXH-1 HPLC, la cual está diseñada para la separación
simultánea de glicanos biológicamente importantes con base en la
carga, el tamaño y la polaridad. La columna está diseñada para separar
glicanos tanto marcados como nativos con base en la disponibilidad de las
muestras. La separación de glicanos nativos le permite a los investigadores
eliminar el paso de arcado fluorescente e incrementar el rendimiento.
En 2012, Agilent Technologies se asoció con el Centro para Ciencias
Ómicas de España en metabolómicos basados en RMN (resonancia
magnética nuclear) y espectrometría de masas y automatización para
usar en biología de sistemas integrados. El Centro para Ciencias Ómicas
(COS) fue establecido por la Universidad de Rovira i Virgili en colaboración
con el Centro Tecnológico de Nutrición y Salud de España. El COS abrió en
septiembre de 2012 y está equipado con instrumentación de Agilent. El
COS es un centro de excelencia, donde Agilent demostrará los flujos de
trabajo en biología integrados en genómica, proteómica, transcriptómica{
lipidómica y metabolómica.
En noviembre de 2012, Bruker lanzó METALJET, una fuente brillante
microfocal de rayos X para aplicaciones en biología estructural. METALJET
es una opción para los sistemas de cristalografía de proteínas D8 VENTURET
y para sistemas de Dispersión de Rayos X en Ángulo Pequeño (SAXS)
NANOSTAR. La fuente METALJET para los sistemas de biología estructural
de Bruker fue desarrollada en colaboración con Excillum AB e Incoatec
GmbH para usar en cristalografía de proteínas y aplicaciones de SAXS.
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 13
MAYO / JUNIO 2013
Chad Baker/Getty Images
Conforme las compañías
biofarmacéuticas/
farmacéuticas
incrementan su desarrollo
de fármacos basados
en biológicos, las
compañías que proveen la
instrumentación analítica
y los bienes y servicios a
laboratorios de análisis
están, a su vez, ofreciendo
herramientas mejoradas
para la caracterización
de biológicos, la
biomanufactura y el
análisis relacionado.
En diciembre de 2012, Sartorius Stedim Biotech (SSB) expandieron sus
capacidades de software para tecnología analítica de proceso asociándose
con Umetrics, un proveedor de tecnología multivariada, incluyendo el
software para el diseño de experimentos (DoE) y el análisis de datos
multivariados (MVA). Bajo el pacto, SSB asume la comercialización global y
la distribución del portafolio de Umetrics para las industrias farmacéutica y
biofarmacéutica e integrarán los programas de software de Umetrics como
productos de marca propia dentro de su propio portafolio de bioproceso
y comercializar éstos como soluciones autónomas bajo un convenio de
marca dual. Las principales áreas para estos sistemas de software son los
pasos críticos de proceso, tal como los procesos de cultivo celular o pasos
de purificación específicos. El MVA permite que los parámetros del proceso
sean sumados en trayectorias del lote, y el programa de DoE permite que
estos parámetros críticos del proceso sean identificados y cuantificados.
En enero de 2013, Waters expandió su plataforma biofarmacéutica con
UNIFI, nuevas columnas de cromatografía de líquidos de ultra-resolución
(UPLC) ACQUITY CSH130 C18 y XSelect HPLC CSH130 C18 para mapeo de
péptidos, y tres kits GlycoWorks para marcado de glicanos y preparación
de muestras. Estos productos son un avance en el análisis bioterapéutico
de rutina, particularmente para glicoproteínas que requieren análisis de
modificaciones de glicanos así como análisis estructural a nivel proteína
y a nivel péptido. La plataforma biofarmacéutica reúne la tecnología
de caracterización UPLC/espectrometría de masas (MS) con el sistema
de información científica UNIFI que fue primero desarrollado para
análisis de masa de proteínas intactas, mapeo de péptidos, y soporte
de bioseparaciones generales. La expansión soporta una mezcla de MS
con tiempo de vuelo quadrupolo (Q-TOF) e instrumentos de detección
óptica dentro de un grupo de trabajo de laboratorio en red. La aplicación
recientemente liberada Glycan expande las capacidades de la plataforma
para respaldar la asignación de rutina y el perfilado de glicanos liberados
utilizando detección con fluorescencia. La combinación de separaciones
UPLC HILIC (cromatografía de líquidos con interacción hidrofílica) de alta
resolución, los estándares de calibración y los reactivos de la compañía y
el acceso al Instituto Nacional de Irlanda para Investigación y Capacitación
en Bioprocesos (NIBRT)/base de datos de referencia de la unidad de glicano
GlycoBase 3+ UPLC de Waters permite las asignaciones, la cuantificación y
el perfilado de glicanos. Desarrollado por el grupo de trabajo del Profesor
Pauline Rudd en NIBRT, la base de datos GlycoBase 3+ es un depositario
de datos de retención cromatográfica de glicanos, expresados en unidades
de calibración de glucosa, y el cual abarca series de estructuras de glicanos
asociadas con glicoproteínas bioterapéuticas.
13
27/05/13 16:31
DENTRO DE LA USP
Anthony J. DeStefano, PhD es vicepresidente senior, capítulos generales y estándares de calidad en la Convención
REGULACIÓN Y CUMPLIMIENTO
de la Farmacopea de Estados Unidos.
Modernización de los Estándares USP
La Convención de la Farmacopea de EUA continúa teniendo como prioridad en el
2013 la modernización de los estándares.
L
a modernización de las monografías y de los capítu- rencia de Procedimientos Analíticos; <1225> Validación de
los generales estándar continuará siendo una priori- Procedimientos Compendiales; y <1226> Verificación de
dad máxima para la Convención de la Farmacopea Procedimientos Compendiales. Aunque la USP-NF especifica
de EUA (USP) en 2013. La USP también continuará que sólo los resultados obtenidos mediante métodos y prodesarrollando y modificando los capítulos generales que tie- cedimientos en el compendio se consideran concluyentes, la
nen un amplio impacto en múltiples monografías que aparecen USP-NF provee lineamientos en el Capítulo General <1225>
en todas sus publicaciones compendiales -Farmacopea de los sobre la validación de procedimientos no compendiales para
Estados Unidos y el Formulario Nacional (USP-NF), Food aquéllos que desean utilizar métodos alternativos para la evaChemical Codex, Compendio de Medicamentos, Compendio luación de conformidad. En el Capítulo General <1226>, la
de Suplementos Dietéticos, USP sobre Mezclado (galénica), USP-NF provee guías sobre la verificación -una demostración
y Compendio de Medicamentos
del usuario de que un artículo es
Herbolarios. Las prioridades de
adecuado para ser analizado por
La USP evaluará todas las
la modernización también han
métodos y procedimientos desfactorizado en la expansión de
buenas prácticas de distribución critos en el compendio. En gelas capacidades del laboratorio
neral, la USP también está evadisponibles para productos
en los sitios internacionales de
luando más estrechamente los
la USP en Brasil, China e India
enfoques estadísticos aplicados a
farmacéuticos.
así como en sus oficinas cenla validación y verificación que
trales en Rockville, Maryland. Estas capacidades mejoradas les permitiría a los fabricantes pronosticar que sus procedisoportarán los esfuerzos de desarrollo de los estándares de mientos se ajustarán a los objetivos.
referencia internos de la USP.
Buenas prácticas de distribución
Pruebas de identificación
En el área de las pruebas de identificación, la USP ha estado
recurriendo cada vez más al uso de pruebas instrumentales
como alternativas para las pruebas más viejas y menos específicas. El Comité de Expertos de Análisis Químico de la USP
le ha dado a la modernización del Capítulo General <191>
Pruebas de Identificación - General, una alta prioridad durante el ciclo 2010-2015 de la USP, particularmente debido a la
relevancia directa del capítulo general para cientos de monografías en la USP-NF, muchas de las cuales están actualmente
modernizándose por sí mismas. Mucho del trabajo del Comité
de Expertos se basará en la retroalimentación de una encuesta
a fabricantes realizada por la USP en 2011, en la cual el 92%
de quienes respondieron reportaron el uso de las pruebas tradicionales de química húmeda para la identificación. Dentro
de este grupo, el 64% también reporto el uso de métodos adicionales de análisis instrumental que son más específicos -un
indicador para la necesidad de modernizar esta prueba para la
identidad de una muestra de material.
Validación y verificación en control de calidad
Para los fabricantes, la validación y verificación de procedimientos analíticos juega papeles importantes en las actividades de control de calidad del laboratorio. La USP ha establecido un Panel de Expertos que propondrá modificaciones
a los tres Capítulos Generales de la USP: <1224> Transfe14
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 14
Otra área principal de actividad en el 2013 para los Capítulos Generales de la USP será el desarrollo de un conjunto de
capítulos generales relacionados con asuntos de la cadena de
suministro. En 2012, la USP fue anfitriona de un taller público
para fabricantes, profesionistas, reguladores y otras partes interesadas para obtener retroalimentación sobre una propuesta inicial para un capítulo general de información de la USP
titulado <1083> Integridad de la Cadena de Suministro. El
propósito del capítulo general fue proporcionar un recurso
para todas las partes, sin importar el tamaño y papel en la cadena de suministro global, para la producción, distribución, y
entrega de medicamentos a paciente4s. En un nuevo enfoque
planeado, la USP evaluará todas las buenas prácticas de distribución disponibles para productos farmacéuticos, sustancias
farmacéuticas, excipientes, suplementos dietéticos, preparaciones galénicas y otras subcategorías de artículos compendiales. Se espera que esto le permita a la USP desarrollar una
nueva estructura para las buenas prácticas de distribución que
abarcarán a los capítulos generales de información relacionados con los sistemas de gestión de la calidad, gestión del
control ambiental, importación y exportación e integridad de
la cadena de suministro.
Referencias
1.
USP, “2011 USP Identification Testing Methods Survey”
(USP, 2011). PT
MAYO / JUNIO 2013
27/05/13 16:31
Marque en la tarjeta de servicio al lector el No. 4
PT MAYO / JUNIO.indd 15
27/05/13 16:31
SOLUCIONES INTERNAS
Susan J. Schniepp es vicepresidente de calidad y asuntos
regulatorios en Allergy Laboratories Inc. y es miembro
REGULACIÓN Y CUMPLIMIENTO
del Consejo Consultor Editorial de PharmTech.
El error humano detrás del error humano
Debe realizarse una investigación minuciosa de todas las posibles causas de desviación.
L
a investigación de desviaciones es un elemento importante en el cumplimiento de las cGMP. Las investigaciones bien realizadas y documentadas son
cruciales para cualquier operación de manufactura
de una compañía. Existen numerosas clases de capacitación
y seminarios destinados a demostrar cómo conducir investigaciones apropiadas y minuciosas. Incluso con todo esto disponible, persiste un sobre uso de “error humano” atribuido
como causa raíz. Este sobre uso representa pérdida de oportunidades para reducir problemas futuros mediante la identificación de la verdadera causa raíz de una desviación. En este
punto es el error humano en el Error Humano. La pregunta
que necesita ser respondida durante la investigación inicial
en una desviación es ¿qué causó que el empleado cometiera
el error humano? El hacerse esta pregunta al principio de la
investigación lleva a una mejor identificación de la causa raíz
y a oportunidades para la mejora continua.
¿Cómo se reduce el “error humano” como causa raíz de
los problemas? Hay tres elementos clave requeridos para minimizar efectivamente el error humano como causa raíz detrás de una desviación: documentación bien escrita y concisa
(p.ej., PNOs y registros de lote), capacitación efectiva sobre
dichos procedimientos y ejecución apropiada en el desempeño de los pasos. Cuando estos elementos están en su sitio y
funcionando entonces el uso de errores humanos, como causa
raíz, deben ser pocos y alejados entre sí. Ver cada uno de estos
elementos en más detalle para asegurar que cumplen su propósito, puede ayudar a las compañías a llegar a la causa raíz
real de un problema en lugar de sólo desestimar un evento
como error humano.
Documentación
La documentación está destinada a detallar de manera concisa
y comprensible una serie recurrente de instrucciones que, si
se llevan a cabo apropiadamente y en orden, deben producir
un resultado predecible. Estas instrucciones deben estar escritas de manera clara y sucinta y con suficiente detalle, de
manera que la operación que describe pueda ser ejecutada
con éxito por individuos entrenados. Todos los documentos
asociados con una actividad necesitan ser sincronizados de
manera que la información sea consistente entre los documentos. Por ejemplo, los PNOs pueden contener instrucciones de
muestreo pero los registros de lote maestro indican cuándo
deben tomarse las muestras. Las instrucciones entre los dos
documentos no deben ser ambiguas o contradictorias. Adicionalmente, debe evitarse el texto subjetivo con palabras tales
como “inmediatamente”. En lugar de utilizar la palabra “in16
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 16
mediatamente”, las instrucciones deben definir los elementos
necesarios para la tarea a ser realizada de manera apropiada.
También es importante escribir las instrucciones para la audiencia a la que van dirigidas. En algunos casos, la fuerza
de trabajo puede estar educada en el idioma inglés, aunque
puede ser que no sea el idioma materno dominante. Evitar los
términos coloquiales o la jerga popular ayudará a asegurar
que todos los empleados comprendan las instrucciones.
Capacitación
Una vez que está establecido el contenido del documento, los
empleados que realizan la función descrita deben ser apropiadamente capacitados. La capacitación cabal de un empleado debe ser un enfoque multifase. Inicialmente, el empleado
debe leer todos los documentos relacionados que definen la
tarea y preguntar cualquier duda que pudieran tener de su
supervisor. Una vez que el capacitado ha comprendido la
documentación escrita, debe asociarse con un empleado experimentado. Muchas compañías tropiezan en este paso en
el departamento de capacitación porque con frecuencia solo
asocian al nuevo empleado con el empleado experimentado
más conveniente sin detenerse a pensar si el empleado experimentado tiene la capacidad para entrenar a otro en su área de
experiencia. Las compañías deben invertir tiempo evaluando
quiénes de su personal con experiencia tiene la habilidad y
paciencia para enseñar una actividad a una persona en capacitación. El supervisor debe también permanecer en el circuito
a través de esta fase de la capacitación para ayudar a enfatizar
la importancia de la actividad en la manufactura del producto.
El supervisor y el entrenador designado deben ambos acordar
cuando el capacitado se siente cómodo realizando una función sin supervisión constante. Cuando los empleados están
apropiadamente entrenados y comprenden la actividad que
están realizando, es menos probable que cometan un error.
Realización y ejecución
Después de que los documentos de control están establecidos y los empleados están apropiadamente capacitados, éstos necesitan monitorear su propio desempeño conforme al
estándar establecido durante el entrenamiento. El proceso
para monitorear el desempeño debe incluir el uso de métricas.
Las métricas podrían incluir el rastreo de qué tan frecuente
se escriben desviaciones para una operación particular o sobre un empleado particular. El análisis de estos datos podría
“El error humano detrás del error humano”
continúa en la pág. 25
MAYO / JUNIO 2013
27/05/13 16:31
Novedades Regulatorias
Cuando los fármacos y biológicos están en desabasto o llevan
precios altos, los médicos y otros proveedores parecen desear
comprar medicamentos de orígenes desconocidos, ignorando
la posibilidad de que esos productos pudieran estar adulterados,
falsificados o que sean inefectivos. Una respuesta de los funcionarios de la FDA es idear un método para identificar productos que cumplen los estándares de calidad. Si dicha designación
se tradujera en mayores ventas, se estimularía a los fabricantes
a invertir más en mejorar sus instalaciones de producción, particularmente las que hacen productos inyectables estériles, de
acuerdo a Janet Woodcock, directora del Centro para Evaluación e Investigación de Fármacos (CDER), y Marta Wosinska,
director del personal de economía del CDER. Escribiendo en
“Farmacología Clínica y Terapéutica”, los reguladores describen cómo los fabricantes de genéricos compiten en precio y no
en calidad, debido a que los compradores consideran a todos
los genéricos igualmente efectivos y seguros y con frecuencia
no pueden vincular los problemas de seguridad con productos
o pacientes específicos (1). De esta forma, el mercado fracasa
para recompensar la calidad del producto y estimula a los fabricantes a reducir costos minimizando la inversión en la producción de calidad. La propuesta de la FDA es proporcionarle
a los compradores y los pagadores “Métricas significativas de
calidad en la manufactura”, similares a las medidas de calidad
usadas para calificar a los restaurantes, crear tarjetas de calificación HMO, o identificar vitaminas que cumplan los criterios
de la Farmacopea de los Estados Unidos.
Más falsificaciones
A pesar de toda la publicidad y las alertas que advierten contra
la compra de medicamentos fraudulentos y no aprobados, la
FDA recientemente descubrió más versiones falsificadas del
fármaco para cáncer de Roche, Avastin (bevacizumab) circulando en el sistema de salud de EUA. El fármaco está siendo
distribuido por Medical Device King (también conocido como
Pharmacological), y las pruebas de laboratorio muestrean que
algunos lotes no tienen ningún ingrediente activo. La FDA
amonestó a los médicos a tener cuidado de medicamentos que
llevaran grandes descuentos y que parecieran “demasiado bueno para ser verdad”. Éstos son probablemente falsificados, y el
gobierno federal está metiendo a los distribuidores a la cárcel y
levantando cargos contra los médicos que compran los fármacos con conocimiento de causa.
Ayuda con mejores etiquetas
Una regla de la FDA adoptada en 2006 les pedía a los fabricantes de fármacos y biológicos que actualizaran el etiquetado de
productos nuevos y recientemente aprobados de manera que la
información para prescribir fuera más clara y más útil para los
profesionales de la salud. Desafortunadamente, sólo el 15% de
todos los fármacos y biológicos han adoptado la Regla del Etiquetado para Médicos (PLR), en gran medida debido a que sólo
aplica a terapias aprobadas después de Junio del 2001. Los fármacos genéricos obtienen un pase, por otra parte, a menos que
el innovador cambie su etiqueta, lo cual no ha ocurrido para muchos productos más antiguos en donde las marcas ya no están en
el mercado. Para alentar la mayor adopción del formato PLR, el
CDER está ofreciendo darles a los fabricantes un proyecto de
etiquetado PLR y asistencia para la conversión al nuevo formato
de etiquetado. El CDER anunció la propuesta en el Federal Re-
gister de Feb. 6 2013 y solicita comentarios sobre cómo ayudar
mejor a la industria con la conversión del etiquetado (2).
Vigilancia de seguridad en tiempo real
La FDA está desarrollando su sistema Mini-Sentinel para el
monitoreo de la seguridad y desempeño de fármacos después
de que éstos entren al mercado cambiando al Sistema Sentinel
completo previsto por la legislación 2007 de la FDA. El plan
es establecer un “sistema sostenido de vigilancia activa” que
pueda servir como un “recurso nacional” para evaluar múltiples problemas de salud, explicó Janet Woodcock, del CDER,
en el 5o. Taller Público de la Iniciativa Sentinel en enero de
2013. El Mini-Sentinel ha operado a través de un modelo de
base de datos distribuida que obtiene respuestas a preguntas
de seguridad de fármacos desde una red de sistemas de datos
de salud. Durante los cinco años pasados, el programa ha establecido operaciones centrales, métodos de investigación, y
protocolos para analizar las evaluaciones de seguridad de los
fármacos, Con la caducidad del programa mini-sentinel a finales del 2014, Woodcock prevé un consorcio más amplio, el cual
puede incluir a los fabricantes farmacéuticos que pueden tener
acceso a datos del sistema actual y de fuentes adicionales para
respaldar la calidad del producto. La investigación metodológica adicional explorará maneras de asegurar que los resultados
de las operaciones del Sentinel sean válidas y que el Sentinel
respalde “el bien público”.
Sunshine al fin
El objetivo de la largamente esperada regulación federal “Sunshine” (luz de sol), publicada en Feb. 1o. 2013, por los Centros para
Servicios de Medicare y Medicaid (CMS), es evitar la indebida
influencia de la industria sobre la prescripción y la investigación
biomédica requiriendo a los fabricantes que reporten todos los pagos y “transferencias de valor” a los médicos y hospitales de enseñanza. Promulgada como parte del Acta de Cuidado Costeable
(ACA) de 2010, el programa Sunshine tomó casi dos años para
finalizar, en gran medida porque los doctores protestaron porque
el revelado de los pagos de las compañías farmacéuticas y de dispositivos médicos sería engañoso y estaría fuera de contexto. La
regulación final establece marcos de tiempo y especifica que los
fabricantes sometan la información con el CMS sobre los pagos
para actividades de investigación, honorarios de consulta, obsequios, alimentos, costos de viaje, y honorarios de ponencias, más
la propiedad e intereses de inversión de un doctor y su familia en
un “fabricante aplicable”. El CMS le dio a los doctores unos pocos días extra para revisar y desafiar los datos de la industria antes
de publicar los datos en su sitio web, y se espera que los fabricantes eviten dichas disputas estableciendo sistemas de rastreo electrónico de “gasto agregado” que les permita compartir y confirmar los datos del pago con los receptores antes del sometimiento
al CMS. Con todos los retrasos, los fabricantes tienen ahora hasta
Marzo de 2014 para reportar los datos de pago para Agosto hasta
Diciembre 2013 y los datos no serán publicados hasta Septiembre
de 2014. Queda por ver si el “Sunshine” desalienta a los médicos
de servir como investigadores en estudios clínicos comerciales o
como consultores o asesores de los fabricantes.
Referencias
1.“Clinical Pharmacology and Therapeutics,” posted on Nature.
com (Jan. 23, 2013), www.nature.com/cpt, accessed Feb. 14, 2013.
2.Federal Register, Vol. 78, No. 25, pp. 8446-8. PT
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 17
REGULACIÓN Y CUMPLIMIENTO
Identificación de la Calidad
MAYO / JUNIO 2013
17
27/05/13 16:31
REGULACIÓN Y CUMPLIMIENTO
RESOLUCIÓN DE
PROBLEMAS DEL CMC
Larry Gatlin, PhD es consultor de
Biotecnología y Farmacéutica en
Patheon.
Contaminantes por corrosión
y sistemas de agua
Larry Gatlin discute los problemas asociados con contaminación
por corrosión en los sistemas de agua.
P.
¿Es la corrosión un contaminante
con el que necesito lidiar en mi sistema de agua? Es visiblemente seguro,
pero no hay un impacto detectable en la
calidad de mi agua.
La medición de
la tasa de corrosión
puede ayudar a
determinar cuándo
un sistema debe
limpiarse, de
manera que no se
impacte el
producto final.
R.
El sarro es una descripción de los
depósitos por corrosión encontrados en los sistemas de acero inoxidable.
El sarro puede variar de color desde un
rojo claro o naranja a un ladrillo oscuro.
Los colores púrpura oscuro o negro se
encuentran normalmente en los sistemas de vapor con colores variables debido a las temperaturas más calientes.
Con mucha frecuencia el material rojo
claro de los depósitos es principalmente
óxido de hierro hidratado. Los componentes del sarro también pueden incluir
óxido de cromo, níquel y molibdeno. La
formación de sarro es un proceso continuo en todos los sistemas de tubería
metálica, pero se exacerba por la alta
temperatura y la composición del metal.
No obstante, la alteración del color de
las tuberías de acero inoxidable 316L,
los accesorios y los recipientes debido
a la deposición de sarro no es un problema por sí mismo, cualquier contaminación del producto que provenga del
sarro es un problema. Cantidades muy
pequeñas de iones metálicos pueden
impactar significativamente la estabilidad de algunos productos.
El sarro puede ser colocado en una
de tres categorías:
• Sarro Clase I es producto de la corrosión depositado, que consiste en óxidos de hierro e hidróxidos que se originan en cualquier sitio en el sistema
y se depositan corriente abajo. La
superficie subyacente de acero inoxidable por debajo de dichos depósitos
generalmente permanece inalterada.
18
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 18
Este depósito de sarro puede generalmente limpiarse con facilidad.
• Sarro Clase II es un producto de
corrosión adherido que se origina
in-situ sobre superficies de acero
inoxidable no pasivadas o pasivadas
inapropiadamente. Por su formación,
la película protectora normalmente
pasiva sobre la superficie de acero
inoxidable se altera.
• Sarro Clase III es un producto de la
corrosión azul o negro, principalmente de óxido de fierro, llamado
comúnmente magnetita, el cual se
forma sobre las superficies en sistemas de vapor a alta temperatura. En
superficies electropulidas, el depósito de la corrosión puede ser negro
brillante, estable y adherente. En
superficies pulidas mecánicamente,
pasivadas, el depósito de la corrosión
puede ser negro polvoso y puede deshacerse.
Los cambios en la tasa de formación de sarro pueden ser resultado de
influencias de la operación del flujo,
puntos de uso, presión, oscilaciones
en la temperatura del agua, y suministro o problemas de la constitución. La
medición de la tasa de corrosión puede
ayudar a determinar cuándo un sistema
debe limpiarse de manera que el producto final no sea impactado. Los sistemas modernos de agua farmacéutica
son completamente automatizados y
varias compañías ofrecen instrumentos
en línea para medir la formación de sarro mientras se mantiene el apego al 21
CFR parte 11. Es responsabilidad de la
compañía demostrar que el sistema de
“Contaminantes por corrosión y
sistemas de agua”
continúa en la pág. 25
MAYO / JUNIO 2013
27/05/13 16:31
PT MAYO / JUNIO.indd 19
27/05/13 16:31
Elga.indd 1
¿Pureza del agua? Sólo elija tecnologías adaptadas a su ciencia y aplicación.
¿Cambios a futuro? Actualice y reconfigure conforme necesite evolucionar.
¿El reto del espacio? Adapte su solución donde usted quiera
Marque en la tarjeta de servicio al lector el No. 6
ELGA. Nuestra Innovación. Su Elección.
¿Quiere ver más? Vea el PURELAB Chorus
en acción en www.elgalabwater.com/choice
•
•
•
16/05/13 19:04
Es su laboratorio, es su presupuesto, es su ciencia, de manera que… ¿No debería tener el
control de su manera de trabajar? ELGA, líder del mercado en purificación de agua de
laboratorio, ha innovado un rango de soluciones de purificación modulares que le dan la
libertad de hacer justo eso. ¿Está listo para experimentar la libertad de elegir?
Presentando al innovador PURELAB® Chorus: innovación es ahora
su elección, un enfoque nuevo y fresco a su manera de trabajar.
En sintonía con su ciencia
REGULACIÓN Y CUMPLIMIENTO
RESOLUCIÓN DE
PROBLEMAS
Medición de la distribución del
tamaño de partícula del API
Ann Newman, PhD
es consultora principal
para Patheon
El mapeo visual puede proporcionar un estimado de la
distribución del tamaño de partícula
P.
¿Existe una manera inteligente de
medir directamente la distribución
del tamaño de partícula del fármaco/
API en una mezcla/granulado de tabletas, suponiendo que el API tiene muy
baja solubilidad acuosa y los excipientes están en un estado mezclado (ya sea
solubles o insolubles en agua)?
Se obtiene un
mapa visual que
puede ser
utilizado para
estimar visualmente
el tamaño de
partícula.
R.
Un método que he usado para
estimar/medir directamente el
tamaño de partícula de las partículas
de API en tabletas, el cual también funcionaría para mezclas y granulados,
es el mapeado. Escogiendo un único
pico para el API, puede obtenerse una
distribución visual del API. Con el fin
de obtener una distribución del tamaño de partícula, necesitarías extender
el análisis contando las dimensiones
para un número relevante de partículas.
Muchas veces, es suficiente una simple
evaluación visual para ver fácilmente
las diferencias basadas en parámetros
tales como el material de inicio o del
proceso.
El mapeo puede ser realizado utilizando una variedad de técnicas que
incluyen infrarrojo (IR), Raman, energía dispersiva por rayos x (EDX) e incluso difracción en polvos con rayos X
(XRPD). El análisis EDX, realizado en
un microscopio electrónico de barrido
(SEM), puede usarse para moléculas
de API que contienen elementos dóci-
les para el EDX (habitualmente arriba
del carbón en la tabla periódica). En mi
proyecto, el API contenía un ión cloruro
que no estaba presente en ninguno de
los excipientes. Mediante el mapeo de
la presencia del cloruro, los tamaños de
partícula del API presente en dos tabletas fueron comparados directamente y
relacionados con los datos de disolución para ayudar a explicar una velocidad de disolución más lenta. Para el
mapeo espectral, es necesario un pico
del API que no se traslape con los excipientes en la formulación. El pico del
API se utiliza entonces para mapear la
presencia del API en la muestra. Se obtiene un mapa visual que puede ser usado para estimar el tamaño de partícula
del API visualmente o puede realizarse
un paso adicional de medición del tamaño de áreas relevantes. La limitación
es el aumento del microscopio usado;
las partículas más pequeñas requerirán
mayores aumentos. La resolución de la
técnica también jugará un papel y puede
ser controlada por la fuente del instrumento y los parámetros experimentales.
La mayor resolución requerirá pasos de
análisis más pequeños y tiempos de escaneo más prolongados. Estos factores
necesitarán ser considerados cuando
preparen su experimento para determinar la cantidad de tiempo y esfuerzo
que es necesario para la información
que se desea obtener.
“GMPs en el Desarrollo Inicial para Estabilidad
Perspectiva de la Industria (Parte IV)”
continuación de la pág. 10
9. ICH, Q1A(R2) Stability Testing of New
Drug Substances and Products, Step 4
version (2003).
10. S. T. Colgan et al., “The Application of
Science and Risk Based Concepts to
Drug Substance Stability Strategies,”
Jrnl. of Pharm. Innov. (in press 2012).
11. S. R. Byrn, R. R. Pfeiffer, and J. G.
Stowell, Solid-State Chemistry of
Drugs. 2nd Edition (SSCI, Inc., West
20
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 20
Lafayette, Indiana) pp. 259–366. Also
see, ICH, Q6A, Specifications: Test
Procedures and Acceptance Criteria for
New Drug Substances and New Drug
Products: Chemical Substances, Step 4
version (1999).
12. K.C. Waterman, “Understanding and
Predicting Pharmaceutical Product
Shelf-life” in Handbook of Stability
Testing in Pharmaceutical Develop-
ment, K. Huynh-Ba, ed. (Springer Science Business Media, LLC, New York,
NY, 2009) pp. 115–135.
13. K.C. Waterman, AAPS PharmSciTech
12 (3) 932–937 (2011).
14. A. Kane, J. Williams, and L Yeo, Regulatory Rapporteur, pp. 3–8 (July/Aug
2008). PT
MAYO / JUNIO 2013
27/05/13 16:31
Marque en la tarjeta de servicio al lector el No. 7
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 21
MAYO / JUNIO 2013
21
27/05/13 16:31
REGULACIÓN Y CUMPLIMIENTO
DENTRO DEL IPEC
Juanita Garofalo
David B. Klug
David R. Schoneker
Juanita Garofalo es
gerente global de
etiquetado y acondicionado en Avantor
Performance Materials
David B. Klug es
gerente senior,
auditorías GMP en
Sanofi y Director
de IPEC-Americas
David R. Schoneker
is director, global
regulatory affairs at
Colorcon.
Alineándose con la Guía CoA del IPEC
Los directores anteriores del comité de calificación de excipientes de IPEC-Americas destacan los
cambios a la guía del IPEC de los certificados de análisis para los excipientes a granel.
H
a pasado más de una década desde que la Guía
de Certificados de Análisis para Excipientes Farmacéuticos a Granel (Guía CoA 2000) fue publicada (1). Desde entonces, han ocurrido cambios
importantes en la industria farmacéutica global y en la arena
regulatoria, los cuales han necesitado el desarrollo de la Guía
de Certificados de Análisis IPEC para Excipientes Farmacéuticos, 2013 (Guía CoA). Entre estos cambios está la formación de la Federación del IPEC en 2010, la publicación
de documentos del IPEC interrelacionados (2-12) que hacen
referencia a certificados de análisis de excipientes, el mayor
énfasis en la transparencia de la cadena de suministros (13)
para proteger la vida de los pacientes, y la disponibilidad de
las opciones definidas por el Instituto de Investigación de
Calidad de Productos (PQRI) para el análisis de excipientes
terminados (14). La guía CoA incorpora las mejores prácticas
actuales de la industria y de las fuentes regulatorias (15).
La Federación del IPEC se estableció para coordinar mejor el trabajo de IPEC-Americas, IPEC Europa, IPEC Japón e
IPEC China dirigido a cumplir los objetivos de sus compañías
miembro y de la industria como un todo. La seguridad de los
pacientes es un conductor clave de todas las guías del IPEC.
Como muchos excipientes farmacéuticos son ahora fabricados, distribuidos y usados globalmente, la Guía del CoA fue
desarrollada bilateralmente por IPEC-Americas e IPEC Europa. Adicionalmente, la Guía CoA se les proporcionará a IPEC
Japón e IPEC China para la posible adopción y publicación
en sus regiones respectivas. Como el comercio de excipientes
es internacional, la Guía CoA será un activo invaluable para
la industria mundial.
La Guía CoA fue desarrollada como un esfuerzo de colaboración por los fabricantes de excipientes, los distribuidores
y usuarios. Los miembros de los comités de Calificación de
Excipientes de IPEC-Americas y los de Calidad/Asuntos Regulatorios de IPEC Europa, fueron los que integraron el grupo
de trabajo que desarrolló la Guía CoA. Se identificaron y se
abordaron los asuntos de las compañías miembro del IPEC
en el proceso de revisión, como se: la ausencia de referen-
22
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 22
cia a métodos analíticos, las restricciones de los programas
de computadora, las circunstancias en las que el fabricante
del excipiente no necesita llevar a cabo pruebas de identificación, legibilidad, ausencia de nombre y dirección del fabricante original, transparencia de la cadena de suministro, y
uso de términos además de la fecha de caducidad o la fecha
de reevaluación recomendada. Además de las aportaciones de
las compañías miembro del IPEC, la FDA ha presentado sus
ideas sobre los CoAs en diversas conferencias y en reuniones
con IPEC-Americas y las observaciones de la FDA también
fueron abordadas durante el proceso de revisión.
Los estándares internacionales de certificación GMP de
excipientes incluyen requerimientos que son consistentes con
la Guía CoA. El estándar NSF/IPEC 363 GMP para Excipientes Farmacéuticos (actualmente en desarrollo) define el contenido mínimo requerido para el CoA. También EXCIPACT
Certificación de Estándares para Excipientes Farmacéuticos:
Buenas Prácticas de Manufactura/Buenas Prácticas de Distribución incluye varios requerimientos relacionados con al
CoA.
La Guía CoA será proporcionada a la Farmacopea de los
Estados Unidos (USP) para su consideración en la modificación del Capítulo General <1080> Excipientes Farmacéuticos
a Granel - Certificado de Análisis, el cual actualmente se basa
en la Guía CoA 2000. A las agencias regulatorias y las organizaciones de la industria tales como Sindusfarma en Brasil
y SaFyBi en Argentina también se les proporcionará la Guía
CoA como parte de un esfuerzo continuo para armonizar las
expectativas de los excipientes a nivel mundial.
Cambios importantes
La Guía CoA detalla el contenido requerido y el formato recomendado e incluye un CoA modelo a ser usado como ejemplo. Se reconoce que el programa de computadora existente
usado para generar el CoA puede plantear restricciones que
limitan la capacidad para lograr el formato recomendado. Por
esta razón, el formato del CoA modelo proporcionado en la
Guía CoA se ofrece sólo como ejemplo. No debe interpretarse
MAYO / JUNIO 2013
27/05/13 16:31
erróneamente que debe seguirse el formato recomendado.
Formato de fecha. Como la Guía CoA es de aplicación
internacional, se requiere un formato de fecha que no sea ambiguo de manera que las fechas (p.ej., reevaluación o fecha
de caducidad) sean claramente comunicadas. Un ejemplo de
un formato de fecha no ambigua ofrecido en la Guía CoA
es usar caracteres alfa para designar el mes y cuatro dígitos
para designar el año: DD MMM AAAA (p.ej., 14 JUL 2013).
Esta mejor práctica garantiza que los excipientes usados en la
manufactura de productos farmacéuticos cumplan los requerimientos de la especificación en el momento del uso y que la
confusión no lleve al uso de excipientes caducos.
Fabricante original. El fabricante original y el sitio de
manufactura deben estar identificados si son diferentes al
proveedor o a la ubicación del proveedor. Específicamente,
el nombre y la dirección deben aparecer directamente o por
referencia (es decir, utilizando un código) en el CoA.
Independientemente de si aparece o no un código en el
CoA, el usuario del excipiente es responsable de conocer el
nombre del fabricante original y la dirección del sitio de manufactura original para cada lote recibido. Cuando se utiliza
un código, el proveedor del excipiente es responsable de definir el código para el usuario del recipiente, a solicitud del
mismo. Dicha información puede requerir un acuerdo de divulgación de información confidencial (16).
Además de ser un documento legal y la base de la certificación del fabricante del excipiente de que el excipiente
continuará cumpliendo la especificación hasta la fecha de reevaluación o de caducidad, el CoA es un elemento crucial de
los controles generales de la cadena de suministro que deben
tener en sitio los fabricantes de excipientes, los distribuidores y los fabricantes de producto terminado. Para facilitar la
rastreabilidad hasta el fabricante del excipiente, la inclusión
del nombre del fabricante original y la dirección del sitio de
manufactura original o un código apropiado en el CoA fue
enfatizada en las discusiones que IPEC-Americas ha tenido
con la FDA.
Verificación de autenticidad. El usuario del excipiente
debe verificar periódicamente la autenticidad y validez del
CoA- Esto puede lograrse de manera eficiente durante una
auditoría al proveedor o de otra forma, enviando el CoA al
emisor para verificar que es auténtico. La frecuencia de dicha
verificación puede basarse en la evaluación de riesgo, la cual
toma en consideración la confiabilidad del fabricante del excipiente y de la cadena de suministro involucrada.
El CoA debe incluir el nombre y el título de la persona
que lo autorizó. Un CoA generado por computadora, donde
los controles apropiados están en orden con el fabricante del
excipiente, proporciona un grado equivalente o mejor de aseguramiento de que el CoA está apropiadamente autorizado
que un documento original firmado a mano. No hay un requerimiento legal de tener un CoA firmado a mano en la mayoría
de los países a condición de que los controles apropiados estén en el lugar para un proceso alternativo de firma generada
por computadora.
Si un distribuidor emite un CoA con su membrete, su CoA
debe ser rastreable hasta el CoA del fabricante original. También, el CoA del distribuidor debe incluir el nombre y la ubi-
cación o el código (si se usa) del fabricante original.
Opciones definidas por el PQRI para el análisis
de excipientes terminados.
La Guía CoA 2000 incluía provisiones para “frecuencia de
análisis reducido” por el fabricante del excipiente. Desde
la emisión de la Guía CoA 2000, fue publicada la Postura
Oficial Conjunta del Instituto de Investigación de Calidad de
Productos (PQRI) sobre Análisis Farmacéutico y Estrategias
de Control. Según se reportó en este documento de postura
oficial:
“En una reunión post-taller, los representantes de la FDA
establecieron que se considera que la práctica de análisis salteado no cumple con las cGMPs porque para aquellos lotes
que no son muestreados y analizados, hay una carencia de
aseguramiento de que el excipiente terminado cumpla todas
sus especificaciones. La FDA piensa que si un atributo para
una materia prima terminada tiene criterios requeridos, debe
haber alguna medición o prueba del material en cada lote para
asegurar que se cumplen los criterios” (14).
La FDA estableció en su respuesta al artículo del PQRI
y en discusiones posteriores con la industria que el análisis
en proceso puede ser utilizado en lugar del análisis del excipiente terminado para determinar el cumplimiento con un
parámetro de prueba especificado y liberar un excipiente
que cumple con las especificaciones apropiadas, siempre y
cuando el fabricante del excipiente haya identificado/documentado claramente la “medición” en proceso que se relaciona directamente con el parámetro de prueba especificado
y la prueba en proceso demuestra claramente que cada lote
de excipiente pasaría el requerimiento si se analiza. Este tipo
de aseguramiento puede obtenerse durante una auditoría del
proveedor. Sin el aseguramiento de la correlación del análisis
en proceso con un resultado de la prueba del excipiente terminado (p.ej., auditoría del proveedor), se le requiere al usuario
realizar alguna prueba que no es realizada por el fabricante
del excipiente en cada lote.
Con base en las observaciones de la FDA, un usuario ya
no debería más considerar los datos del análisis periódico
(lote salteado) por el fabricante del excipiente, como suficientes para liberar el excipiente para usarlo en un producto
farmacéutico, sin importa la cantidad de datos históricos que
puedan existir. Esta posición es un cambio de paradigma para
la industria farmacéutica. Muchas compañías utilizan los programas de análisis reducido y se apoyan en los datos del CoA
del proveedor y, en el pasado, han aceptado las declaraciones
del proveedor de que las especificaciones para una prueba
particular fueron certificadas a través del uso del análisis en
proceso o de lote salteado. Adicionalmente, de manera histórica, las farmacopeas tales como la USP han permitido que se
utilice este tipo de enfoque por parte de los fabricantes del excipiente en sus noticias generales y el ICH Q6A ha permitido
el análisis de lote salteado del producto farmacéutico y de la
sustancia farmacéutica. Sin embargo, con base en las observaciones recientes de la FDA, no les permitirán a los usuarios apoyarse en las mediciones en proceso para justificar un
parámetro de prueba especificado sin evidencia documentada
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 23
MAYO / JUNIO 2013
23
27/05/13 16:31
REGULACIÓN Y CUMPLIMIENTO
(p.ej., auditorias en sitio) para demostrar que están en función
los procedimientos apropiados para asegurar el cumplimiento. Aunque históricamente los usuarios de excipientes pueden
no haber establecido este nivel de evidencia documentada,
sino que más bien, pueden haberse apoyado simplemente en
datos “no justificados/no confirmados” en sus programas de
análisis reducido, la FDA dejó claro durante las discusiones
con el PQRI que esto se considera ahora inapropiado (14).
“De acuerdo con los representantes de la FDA, una determinación apropiada que asegure que cada lote se ajusta a las
especificaciones apropiadas podría involucrar alguna combinación de los siguientes enfoques:
1. Análisis del producto final
2. Análisis en proceso
3. Monitoreo continuo de un atributo con controles de
proceso estadísticos
4. Justificación documentada que, con base en el método de manufactura, el atributo de prueba puede no
estar presente y por lo tanto la prueba no es aplicable
(p.ej., solventes residuales)” (14).
La Guía CoA se refiere a los incisos 2-4 (arriba) como
“además del análisis del excipiente terminado” y los resultados derivados de otros que no sean el análisis del excipiente
terminado deben estar claramente indicados en el CoA. Por
ejemplo, el nombre de la prueba puede ponerse como pie de
página para indicar que el resultado se obtiene de otro análisis
que no es el del excipiente terminado.
La Guía CoA también hace referencia al ICH Q6A en
esta sección, el cual permite el análisis de lote salteado del
producto farmacéutico y de la sustancia farmacéutica. Como
se mencionó antes, la FDA tiene expectativas adicionales relacionadas con el uso de los resultados del análisis de lote
salteado del proveedor, listados en un CoA para determinar
el cumplimiento de la materia prima por parte de las compañías farmacéuticas. La FDA ha establecido que el análisis
de lote salteado por parte del fabricante de un excipiente, por
sí mismo no proporciona los datos suficientes para que los
usuarios del excipiente justifiquen el análisis reducido en la
recepción y esta ausencia de datos fue la base de las discusiones del PQRI. Sin embargo, el análisis apropiado de lote
salteado puede proporcionar la base para que el fabricante de
un excipiente certifique el cumplimiento con la especificación
porque el fabricante del excipiente tiene un conocimiento y
comprensión significativos del proceso más allá de lo que está
disponible para el usuario. Esto se permite en el capítulo de
Noticias Generales de la USP y no existe el requerimiento de
que el fabricante del excipiente analice cada lote con todas las
pruebas listadas en sus especificaciones, cuando otros controles pueden demostrar el cumplimiento continuo.
Verificación de los resultados de las pruebas y mediciones para los parámetros específicos. Antes de liberar
un excipiente para usar en la manufactura de un producto
farmacéutico terminado, es responsabilidad del usuario del
excipiente asegurar que se haya obtenido un resultado de
conformidad de la prueba para cada parámetro de la especificación ya sea mediante el muestreo y el análisis del excipien24
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 24
te terminado para cada parámetro, utilizando los resultados
calificados de las pruebas del proveedor obtenidos del CoA,
o apoyándose en “otras pruebas aparte de las del análisis del
excipiente terminado” para respaldar el cumplimiento con un
parámetro particular cuando esté calificado como se señaló
anteriormente. El CoA del excipiente debe identificar estos
resultados “aparte de los del análisis del excipiente terminado” que se están usando para la liberación del producto en su
sitio e informar a los usuarios del excipiente en consecuencia.
Antes de aceptar cualquier resultado de las pruebas del
CoA, el usuario del excipiente debe calificar al fabricante del
excipiente para asegurarse que el excipiente es fabricado y
analizado de manera consistente con las guías aplicables de
GMP para excipientes y con los requisitos del usuario del excipiente. La calificación debe incluir una auditoría en el sitio
del fabricante o proveedor del excipiente quien proporcionó
el CoA ya sea al usuario del excipiente o a un tercero calificado para verificar que los datos proporcionados en el CoA son
generados utilizando los métodos apropiados y son confiables. La reevaluación periódica también es necesaria para verificar que el fabricante del excipiente permanece calificado.
Siempre que el usuario de un excipiente se apoye en los
datos del CoA, en lugar del análisis de entrada, se sugiere que
exista un acuerdo de calidad apropiado entre el fabricante del
excipiente y el usuario del excipiente que defina claramente
las responsabilidades de cada parte. En tales casos, el fabricante del excipiente sirve, en esencia, como un laboratorio
por contrato para el usuario del excipiente.
Referencia a métodos analíticos. Es necesario que el
usuario del excipiente conozca los métodos analíticos usados por el fabricante del excipiente para analizar cada lote
cuando los datos del CoA se usan para la liberación del lote.
Las referencias a los métodos analíticos deben aparecer en el
CoA o estar vinculadas a un documento de especificaciones,
de manera que el método analítico utilizado por cada prueba
sea comunicado claramente al usuario. En el caso en que el
método analítico esté incluido en la especificación vinculada
en lugar del CoA, se le debe proporcionar al usuario del excipiente el documento de la especificación.
Análisis de identificación. La identidad 5.40 de las Noticias Generales de la USP establece “Una prueba compendial
titulada Identidad o Identificación se proporciona como un
auxiliar para verificar la identidad de los artículos que pretenden ser, p.ej., aquéllos tomados de contenedores etiquetados,
y establecer si es el artículo nombrado en la USP-NF” (17).
Adicionalmente, el 21 CFR § 211.84(d)(1) establece “Al menos debe realizarse una prueba para verificar la identidad de
cada componente de un producto farmacéutico. Se llevarán
a cabo pruebas de identidad específicas, si existen” (18). De
manera similar, para los usuarios de excipientes cuyo producto farmacéutico sea comercializado en Europa, la legislación
de EUA establece, “La identidad de un lote completo de material de inicio puede normalmente estar garantizado, sólo si
“Alineándose con la Guía CoA del IPEC”
continúa en la pág. 25
MAYO / JUNIO 2013
27/05/13 16:31
“Alineándose con la Guía CoA del IPEC”
continuación de la pág. 24
se toman muestras individuales de todos los contenedores y se
hace una prueba de identidad en cada muestra (19)”.
Ha habido confusión dentro de la industria con respecto
al reporte de pruebas de identificación en el CoA de los excipiente. La Guía CoA del IPEC aclara que este reporte no se
requiere cuando el fabricante de un excipiente tiene otros procedimientos de control en el sitio que proporcionan el aseguramiento adecuado de que su producto cumplirá la prueba de
identificación, si se realiza. Adicionalmente, el usuario debe
realizar una prueba de identificación en cada lote recibido sin
importar si el proveedor ha realizado la prueba de identificación o no.
3.
4.
5.
6.
7.
8.
9.
10.
Resumen
En resumen, se espera que la Guía CoA sea una herramienta
crucial para los fabricantes, distribuidores y usuarios de excipientes proveyendo claridad en los requerimientos regulatorios e industriales adicionales relacionados con la transparencia de la cadena de suministro, la autenticidad del CoA
y los requerimientos de análisis por nombrar unos cuantos y
proporcionando un formato sugerido que incluya toda la información necesaria.
11.
12.
13.
14.
15.
16.
Referencias
1.
2.
D. Schoneker, Changing the Supply-Chain Controls for Excipients –Part I: The IPEC-Americas Certificate of Analysis
Guide for Bulk Pharmaceutical Excipients, Pharm.Tech. (June
2000).
IPEC-Americas, Excipient Master File Guide (2004), ipecamericas.org.
17.
18.
19.
IPEC-Americas and IPEC Europe, Excipient Pedigree Position
Paper (2009), ipecamericas.org.
IPEC-Americas and IPEC Europe, Excipient Stability Program Guide (2010), ipecamericas.org.
IPEC-Americas and IPEC Europe, Good Distribution Practices Guide (2006), ipecamericas.org.
IPEC-Americas, Good Distribution Practices Audit Guide
(2011), ipecamericas.org.
IPEC-Americas, IPEC Europe, and the PQG, Good Manufacturing Practices Audit Guide (2007), ipecamericas.org.
IPEC-Americas, IPEC Europe, and the PQG, Good Manufacturing Practices Guide (2006), ipecamericas.org.
IPEC-Americas and IPEC Europe, Qualification of Excipients
for Use in Pharmaceuticals (2008), ipecamericas.org.
IPEC-Americas and IPEC Europe, Quality Agreement Guide
and Template (2009), ipecamericas.org.
IPEC-Americas, Significant Change Guide (2009), ipecamericas.org.
IPEC, International Pharmaceutical Excipient Council Glossary (2010), ipecamericas.org.
A. Falk, PhD, Pharm.Tech. 34(3) (Mar. 2010).
B. Carlin et al., Pharm. Tech. 31 (9) (Sept. 2007).
PQG PS 9100:2002 Annex C Certificates of Analysis; WHO
Technical Report Series, No. 902 & No. 908; UK Guidance on
Certificates of Analysis (from Orange Guide).
Note: It is hoped that in the future, all excipient makers and
excipient users will realize the benefits of establishing a longterm confidential disclosure agreement during the supplier
qualification process.
USP, USP 35 General Notices, 5.40 Identity
CFR 211.84(d)1
EU Legislation–Eudralex Vol 4: Good Manufacturing Practice Guidelines, Chapter 6 Quality Control, Annex 8 Sampling of Starting and Packaging Materials (2006). PT
“Contaminantes por corrosión y sistemas de agua”
continuación de la pág. 18
medición trabaja porque un método de medición exacto para
la tasa de corrosión o depósito de sarro ayudará a determinar
los límites de operación antes de que se requiera la limpieza
del sarro y la repasivación.
Históricamente, las frecuencias de retiro del sarro y repa-
sivación se determinaban subjetivamente (es decir, anualmente, bianualmente, semestralmente o cada paro programado),
pero una frecuencia basada en el nivel de comodidad de riesgo para la compañía puede ser demasiado frecuente, costándole así tiempo, recursos y dinero a la compañía.
“El error humano detrás del error humano”
continuación de la pág. 16
llevar a una documentación pobre o un entrenamiento pobre
como causa raíz en lugar de “error humano”. Además de las
métricas, el proceso debe también aportar un circuito de retroalimentación donde el empleado (viejo o nuevo) tenga una
oportunidad de identificar áreas de mejora tanto en los documentos como en la capacitación. Cuando se modifican los documentos de control, es importante recapacitar a los empleados en el cambio y asegurarse que modifiquen su conducta
para estar en línea con las nuevas instrucciones.
Asignar ocasionalmente el error humano como la causa
de una desviación es válido si un empleado simplemente cometió un error. Sin embargo, deben agotarse otras posibilidades
para la desviación antes de que el error humano sea atribuido
como la causa raíz. Utilizando la métrica apropiada, teniendo
instrucciones claras y concisas, realizando una capacitación
detallada,estableciendo mecanismos de retroalimentación en
el desempeño y utilizando las herramientas apropiadas para el
análisis de la causa raíz, puede asignarse una causa raíz más
precisa y puede alcanzarse una mejora continua del proceso. PT
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 25
MAYO / JUNIO 2013
25
27/05/13 16:31
Sección Especial: Formas Farmacéuticas Sólidas y Excipientes
Estrategias
de
Solubilización
Polímeros avanzados para mejora de
la solubilidad
Sesión de preguntas y respuestas moderada por Adeline Siew, PhD
Colin Anderson/Gettyimages
Clases químicas y propiedades fisicoquímicas
La pobre solubilidad continúa siendo un reto
mayor en el desarrollo de formulaciones. Como
el número de nuevas entidades químicas que son
escasamente solubles continúa incrementándose,
los profesionales de la formulación se enfrentan
con la importante tarea de abordar estos
problemas de solubilidad de manera que
más compuestos puedan ser traducidos en
medicamentos clínicamente útiles. Un enfoque
popular para este problema es el uso de polímeros
como excipientes solubilizantes. Pharmaceutical
Technology reunió un panel de expertos de la
industria para un foro especial de discusión de
los polímeros para solubilización y las estrategias
de formulación relacionadas para fármacos
escasamente solubles. Los participantes incluyen a
Michael Morgan, PhD, director de nueva tecnología
en Bend Research; Brian Koblinski, gerente de
marketing estratégico en Dow Wolff Cellulosics;
y Firouz Asgarzadeh, PhD, director de servicios
técnicos, Norteamérica, polímeros farmacéuticos y
servicios en Evonik Corporation.
26
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 26
PharmTech: Varios polímeros/copolímeros pueden ser usados
en el mejoramiento de la solubilización. ¿Qué identificarían
como clases químicas clave para estos excipientes y las propiedades relacionadas que contribuyen a su función como solubilizantes? ¿En qué tipos de formulación se usan?
Morgen (Bend Research): Los celulósicos, poli(vinilpirrolidona) (PVP) y sus copolímeros, acrilatos y poli(etilen
óxido) (PEO) y sus copolímeros son algunas de las clases
clave de polímeros que han sido identificados como excipientes solubilizantes para formulaciones orales. Los polímeros
para la solubilización efectiva tienden a ser amfifílicos por
naturaleza, significando que tienen sitios tanto hidrofóbicos
como hidrofílicos que les permiten interactuar favorablemente con compuestos de baja solubilidad (es decir, hidrofóbicos) y dispersarse y disolverse en ambientes acuosos como
el tracto gastrointestinal (GI). Las interacciones específicas
del polímero con sí mismo, el API y el medio acuosos puede
resultar en un rango de estructuras solubilizantes, que incluye
micelas, coloides y complejos iónicos.
Los polímeros solubilizantes se utilizan en muchos tipos
de formulaciones, dependiendo de la ruta de administración,
la dosis, las propiedades del API y los retos de entrega específicos asociados con el programa de desarrollo particular. Para
la entrega oral, las dispersiones de sólidos amorfos pueden ser
un enfoque de mejoramiento de la formulación para mejorar
la biodisponibilidad de compuestos Clase II y IV del Sistema
de Clasificación de Biofarmacéuticos (BCS). Dos procesos
comunes para hacer dichas dispersiones son el secado por aspersión y la extrusión con fundido caliente (HME). El secado
por aspersión puede ser usado para formar una partícula de
dispersión monolítica o alternativamente, la dispersión puede ser depositada sobre un soporte sólido para incrementar
el área de superficie y la velocidad de disolución. Mezclas
físicas de dos fases de polímero y API cristalino en una forma farmacéutica sólida pueden usarse para solubilizar el API.
Para los primeros estudios del alcance, las soluciones líquidas de polímero (p.ej., PEO) y el API pueden ser valiosas. En
cada caso, la selección del tipo de formulación y el proceso de
manufactura dependerán de los requerimientos del programa
específico de desarrollo del fármaco.
Koblinsky (Dow): Los polímeros con base de celulosa,
como la hipromelosa (HPMC) y el acetato de hidroxipropil
metil celulosa (HPMCAS, también conocido como acetato
succinato de hipromelosa) tienen una elevada utilidad en las
dispersiones sólidas. Su seguridad y baja reactividad del fármaco hacen de ellos un candidato ideal para la mayoría de
los fármacos. Las dispersiones secadas por aspersión (SDDs)
y el HME son las tecnologías más comunes usadas para la
MAYO / JUNIO 2013
27/05/13 16:31
Marque en la tarjeta de servicio al lector el No. 18
PT MAYO / JUNIO.indd 27
27/05/13 16:31
Sección Especial: Formas Farmacéuticas Sólidas y Excipientes
solubilización con polímeros celulósicos. Los polímeros celulósicos mantienen dispersiones estables de sólidos, inhiben la
cristalización del API y pueden promover la supersaturación
del fármaco. Las opciones en viscosidad y niveles de sustitución tanto con el HPMC como con el HPMCAS ayudan
al formulador a optimizar el desempeño en el mejoramiento
de la solubilidad así como en la capacidad de procesamiento
del material, lo cual incluye SDDs post-procesado y formulaciones de HME en formas farmacéuticas tradicionales como
tabletas y cápsulas.
Asgarzadeh (Evonik): La estructura química y las propiedades fisicoquímicas de los APIs y polímeros juegan un papel
principal en la formación de soluciones de polímero-API sólido. Los poli(met)acrilatos, los polímeros celulósicos y la PVP
son extensamente usados en el desarrollo de formulaciones
de dispersión sólida. Cada clase de polímeros contiene enlaces químicos específicos que pueden interactuar con grupos
específicos en los APIs. Las técnicas de HME, SDD y coprecipitación transforman los fármacos cristalinos escasamente
solubles en una estructura amorfa, metaestable, con un estado
de energía mayor dispersa en una matriz de polímero que se
solubiliza más fácilmente, llevando a una solubilidad acentuada. Las fuertes uniones de hidrógeno y las interacciones
iónicas entre el API amorfo y el polímero inhiben o retardan
la recristalización del API incluso con polímeros que tienen
temperaturas de transición de vidrio bajas (Tg’s), Como existe una miríada de estructuras de API con diferentes características fisicoquímicas, no hay una clase de polímeros que
pudieran considerarse mejores solubilizadores que otros. Es
esencial seleccionar los polímeros apropiados para estudios
de selección basados en una buena comprensión de las estructuras tanto del polímero como del fármaco y las posibles
interacciones que pueden tener.
Un conductor clave para la buena
estabilidad física del estado sólido
de formas amorfas es la baja
movilidad molecular.
Selección de un polímero adecuado
PharmTech. ¿Qué factores determinan el tipo de polímero farmacéutico para usar en una formulación dada para mejorar la
solubilidad? ¿Puede proporcionar un ejemplo específico para
ilustrar los puntos de decisión usados en una formulación que
implica un desafío, incluyendo cualquier dato relevante?
Morgen (Bend Research): Cuando se seleccionan polímeros solubilizantes, debe considerarse el desempaño, la
estabilidad y la capacidad de manufactura de la formulación
asociada. Las propiedades químicas y físicas del polímero solubilizante afectan al total de estos tres atributos, por lo tanto,
es con frecuencia necesario balancear las propiedades del polímero para lograr la formulación solubilizada óptima. Habitualmente, las propiedades del API y los requerimientos del
programa de desarrollo (p.ej., dosis) resultarán en un mayor
28
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 28
énfasis en uno o dos de estos tres atributos de la formulación.
Idealmente, el polímero solubilizante interactuará con el
API para sostener las elevadas concentraciones del API en el
tracto GI en una o más especies de alta actividad (p.ej., fármacos fácilmente disueltos, micelas y coloides). Para los APIs
que son particularmente propensos a precipitación en una forma de baja energía, la interacción significativa polímero/API
es especialmente importante. Para muchos APIs, se prefieren
los polímeros que tienen una interacción hidrofóbica sustancial con el API. La HPMCAS es uno de los polímeros de dispersión más ampliamente útiles para formar y sostener a las
especies de alta energía en medios acuosos con compuestos
BCS Clase II y IV.
Tanto la estabilidad química como la física de las formulaciones solubilizadas son importantes. De las dos, la
estabilidad química tiende a ser más específica del API. La
estabilidad física del estado sólido es por lo general una consideración importante para las formulaciones solubilizadas,
especialmente cuando el fármaco está en el estado amorfo.
Un conductor clave para una buena estabilidad física en estado sólido de las formas amorfas, tales como las dispersiones
poliméricas, es la movilidad molecular baja, la cual puede
alcanzarse seleccionando un polímero de dispersión que tenga una Tg alta. Un número de polímeros de solubilización
comunes, como la PVP y sus copolímeros y celulósicos, tienen alta Tg en su estado seco. El agua, sin embargo, puede
plastificar los materiales y reducir la Tg. Los polímeros con
captación de humedad baja como una función de la humedad,
como las HPMCAS, con frecuencia le imparten mejor estabilidad física a las formas farmacéuticas amorfas en el estado
sólido, bajo condiciones de almacenamiento ambiental que
los polímeros más higroscópicos. Una alta Tg es menos importante para la estabilidad física cuando el API y el polímero
son miscibles, lo cual es con frecuencia el objetivo para las
formulaciones HME.
La capacidad de manufactura es una consideración importante cuando se seleccionan polímeros solubilizantes. Para
el secado por aspersión, la alta solubilidad y la baja viscosidad en los disolventes orgánicos volátiles usados durante el
proceso son importantes. Los requisitos para el procesado
con HME son algo diferentes, requiriendo buena estabilidad
térmica, especialmente cuando se formulan fármacos con alta
temperatura de fusión (Tm). Adicionalmente, la miscibilidad
del API y del polímero es con frecuencia deseable en el proceso por HME para lograr una fase de dispersión simple.
Koblinski (Dow): La estructura química del API, así como
la tecnología usada para alcanzar mejor solubilidad impacta la
elección del polímero. La SDD y la HME son dos tecnologías
comunes usadas para crear dispersiones sólidas para mejorar
la solubilidad. Cada técnica tiene su propia serie de parámetros del polímero mejor adaptados para usar en la tecnología,
sin embargo los objetivos generales para ambos métodos son
suministrar el fármaco amorfo, inhibir la cristalización del
fármaco y maximizar la carga del fármaco en la formulación.
Las características de los polímeros mejor adaptados para
el secado por aspersión incluyen la capacidad para formar
una solución atomizable de polímero-fármaco. Los polímeros
MAYO / JUNIO 2013
27/05/13 16:31
que resultan en una viscosidad de la solución baja facilitarán
concentraciones más elevadas de fármaco y polímero en la
solución, reduciendo así el uso del solvente e incrementando
la versatilidad de la formulación.
Pueden usarse modelos de
predicción para calcular las
interacciones polímero-API que
pueden ocurrir.
Para ser adecuado para la HME, un polímero farmacéutico debe ser procesable con fusión en condiciones que no
degraden los componentes de la formulación. Los polímeros
con baja Tg así como una amplia ventana de procesado térmico se adaptan bien para la HME; sin embargo, la Tg debe ser
lo suficientemente elevada para evitar la recristalización en
condiciones de almacenamiento. El polímero también debe
tener buena inhibición de la nucleación del cristal para mantener el API en niveles supersaturados con la disolución. Debido a un contenido de polímero relativamente alto en muchas
formulaciones de HME, la seguridad del polímero durante el
procesado (es decir, ningún producto de degradación tóxico)
y en la formulación final es también crítica.
Asgarzadeh (Evonik): Los polímeros usados para la formación de dispersiones sólidas deben tener Tg’s razonablemente
altas para permitir la estabilización de la estructura amorfa
del API vía la restricción del movimiento molecular (es decir, el estado vítreo) en condiciones de almacenamiento que
generalmente están por debajo de la Tg del producto terminado. Los polímeros con menores Tg’s han demostrado formar
soluciones sólidas estables cuando se forman fuertes uniones
de hidrógeno o interacciones iónicas entre el polímero y el
activo. Las fuertes uniones del hidrógeno y las interacciones
iónicas contribuyen a la formación y estabilización de soluciones sólidas primeramente, rompiendo el entramado cristalino de fármacos altamente cristalinos, escasamente solubles,
y en segundo lugar, retrasando la recristalización ya que el
API molecularmente disperso prefiere permanecer unido al
polímero.
Otra consideración cuando se utiliza extrusión con fundido para la preparación de dispersiones sólidas es que la Tg del
polímero debe ser suficientemente baja para permitir temperaturas de procesado aceptables minimizando la degradación
del polímero y/o del fármaco. El copolímero catiónico amino
metacrilato (Eudragit E, Evonik) forma soluciones con el fármaco aniónico ibuprofeno debido a la fuerte unión del hidrógeno y a las interacciones iónicas en temperaturas de extrusión tan bajas como 60°C. Aunque las Tg’s de los extruidos
de la solución sólida de ibuprofeno/Eudragit E son tan bajas
como 10°C a 20°C, éstos permanecen amorfos y estables a
temperatura ambiente debido a la fuerte unión de hidrógeno y a las interacciones iónicas. La fusión del API durante
la extrusión con fundido no es un requerimiento pero ayuda
con la formación de la solución sólida. Las soluciones sólidas
de fármacos con puntos de fusión tan altos como 250°C a
300°C es posible cuando dichas interacciones fuertes pueden
formarse entre polímeros y el fármaco como es el caso del
azúcar y el agua (soluto/solvente) donde el azúcar no es necesario que se funda con el fin de disolverse en el agua.
Modelos de predicción
PharmTech: ¿Puede utilizarse modelos de predicción en la selección de excipientes de un polímero solubilizante? Si es así,
¿Puede explicar el modelo y las variables relacionadas usadas
en el modelo?
Morgen (Bend Research): Un rango de modelos físicos
predictivos es valioso en la selección de polímeros solubilizantes. Dichos modelos son más valiosos cuando se utilizan
en conjunto con propiedades físicas medidas del API, el polímero y/o la formulación. En particular, con frecuencia utilizamos modelos para estimar la absorción oral con base en
los parámetros clave, tales como la dosis del API, los valores
de solubilidad y supersaturación, el coeficiente de partición
del API en sales biliares y las velocidades de disolución y
precipitación del API. Varios de estos parámetros dependen
de la elección del polímero. En particular, el perfil del tiempo del nivel de supersaturación del API está con frecuencia
fuertemente influido por la elección del polímero y puede
afectar dramáticamente la absorción y la biodisponibilidad.
Estos parámetros son típicamente medidos in vitro y después
usados en modelos predictivos. Una importante advertencia
es que es notoriamente difícil pronosticar exactamente ciertos
parámetros in vitro, tales como la velocidad de precipitación
del API con base en las mediciones in vitro. Otros tipos de
modelos que algunas veces son empleados incluyen esquemas del parámetro de solubilidad para predecir interacciones
entre los APIs y los polímeros, incluyendo estimados de la
solubilidad del API en una matriz de polímeros. Aunque tales
predicciones pueden ser útiles, es algunas veces más rápido y
más exacto hacer las mediciones que hacer los cálculos.
Koblinski (Dow): Los modelos de predicción pueden ser
usados para calcular las interacciones polímero-API que
pueden ocurrir. Adicionalmente, pueden usarse herramientas
tales como los parámetros de solubilidad, para establecer la
solubilidad del API en el polímero seleccionado. Los parámetros de solubilidad de Hansen son usados con frecuencia
en este aspecto como una herramienta de selección para la
compatibilidad fármaco-polímero; sin embargo, sólo deben
ser usados como guía en conjunto con los datos de preformulación.
Asgarzadeh (Evonik): En un esquema de desarrollo de una
formulación empírica convencional, varias combinaciones
cualitativas y cuantitativas de fármaco y polímeros son fundidas, secadas por aspersión o fundidas en película a partir
de disolventes orgánicos en numerosos experimentos para
identificar formulaciones apropiadas de solución sólida/dispersión. Dichas metodologías de desarrollo empírico consumen tiempo y requieren cantidades significativas de fármacos
así como análisis costosos. Las herramientas predictivas para
identificar los disolventes para los polímeros basadas en los
parámetros de solubilidad y en las interacciones moleculares
(p.ej., uniones de hidrógeno e interacciones iónicas) han sido
usadas durante varias décadas en las industrias de pintura, polímeros y química orgánica. Estas herramientas de pronóstico
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 29
MAYO / JUNIO 2013
29
27/05/13 16:31
Sección Especial: Formas Farmacéuticas Sólidas y Excipientes
permiten una selección sistemática más rápida de formulaciones y condiciones de proceso en las primeras etapas de
desarrollo de un producto de dispersión sólida, independiente
de la tecnología de preparación usada.
Una de tales herramientas desarrolladas por Evonik es el
MemFis (Modelado de Extrusión con Fundido y Sistema de
Información de la Formulación). El modelo MemFis utiliza
teorías de contribución bien establecidas del grupo de polímeros y química orgánica para estimar los parámetros de solubilidad de Hansen de moléculas de fármacos y polímeros.
En MemFis, se consideran los cálculos de más de 50 contribuciones de grupos químicos y los efectos de las interacciones polares (es decir, momentos dipolo), así como de 40
diferentes interacciones de uniones de hidrógeno sobre los
parámetros de solubilidad. El MemFis permite la selección
de formulaciones iniciales de solución solida/dispersión y de
condiciones del proceso de extrusión con fundido sin consumo del API. Reduce el número de experimentos llevando calidad al desarrollo de la formulación en un enfoque sistemático
más que empírico que está dirigido a experimentos apropiados. Otras herramientas analíticas, tales como el mapeo Raman, la calorimetría diferencial de barrido, y la microscopía
de fuerza atómica, pueden permitir la detección temprana de
la formación de una solución sólida o de cualquier efecto de
recristalización.
Calidad por diseño
PharmTech: La calidad por diseño (QbD) es una consideración general en el desarrollo de fármacos. Con respecto al
mejoramiento de la solubilidad ¿Cuáles son los atributos de
calidad críticos y/o los parámetros de procesos críticos, importantes en la selección del excipiente?
Morgen (Bend Research): Recientemente, las compañías
farmacéuticas, los proveedores de excipientes y los CRDMOs
(organizaciones de investigación/desarrollo/ manufactura por
contrato) han lanzado iniciativas significativas para llevar los
principios de la QbD a la selección y diseño del polímero, la
formulación, y el espacio del proceso. Con respecto al polímero, los atributos de calidad críticos pueden incluir distribución del peso molecular y atributos químicos, tales como la
relación y secuencia de diferentes unidades monoméricas y/o
el número y patrón de sustitución de los grupos hidrofóbicos
en la columna vertebral del polímero. Existen casos en los
cuales las diferencias relativamente pequeñas en la química
pueden afectar significativamente el desempeño del polímero
y la formulación. En algunos casos, el perfil de impurezas del
polímero también puede ser crítico para el desempeño.
Típicamente, un número de parámetros críticos por el
lado del proceso influirá en la selección de los excipientes.
Dependiendo del proceso, los disolventes y las temperaturas
de la solución, puede ser seleccionada con base en la solubilidad del API o su compatibilidad con el disolvente, el cual
puede a su vez influir en la elección del polímero. De la misma forma, los perfiles de tiempo de proceso-temperatura pueden ser parámetros críticos del proceso, particularmente para
la elección de los excipientes de la HME, para asegurar el
adecuado mezclado para la completa dispersión y disolución
del API dentro de la matriz del polímero calentado si se desea
una solución sólida.
30
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 30
Los excipientes en una
formulación con solubilidad
acentuada no deben considerarse
como rellenos o parte de la matriz
de aglutinante.
Koblinski (Dow): La selección del excipiente correcto con
control de los atributos de calidad críticos es crucial para una
formulación robusta. Un enfoque de QbD para el desarrollo
de fármacos ayuda a que el producto farmacéutico final tenga el efecto terapéutico deseado sobre una base consistente.
En el mejoramiento de la solubilidad, los excipientes juegan
el papel de estabilizar el fármaco y mantenerlo en el estado
deseado para lograr la máxima liberación del fármaco y el
sostenimiento de la concentración. Un estudio de QbD con un
excipiente, por ejemplo HPMCAS, buscará las características
del polímero, tales como la sustitución de acetil y succinil
utilizando un estudio de diseño de experimentos para cubrir
el espacio experimental y encontrar los niveles de sustitución
acentuados para la solubilización del fármaco específico. A
través de estudios hechos en Dow, hemos encontrado que algunos fármacos, tales como la fenitoína, son muy sensibles
a cambios en los niveles de sustitución del polímero y por lo
tanto, requieren un estrecho control alrededor de los valores
acentuados para un desempeño consistente. Otros fármacos
menos sensibles pueden tolerar un rango más amplio de valores de sustitución manteniendo mientras tanto el desempeño.
Un programa de QbD, en colaboración con el fabricante del
excipiente, puede ayudar a los formuladores a desarrollar un
producto farmacéutico robusto y terapéuticamente eficiente.
Asgarzadeh (Evonik): Cuando se seleccionan excipientes
para mejoramiento de la solubilidad, las propiedades fisicoquímicas del excipiente, tales como las características morfológicas, la solubilidad acuosa/pH, el peso molecular, la estructura cristalina, la porosidad, la densidad y la viscosidad
están entre los atributos de calidad críticos (CQAs) que deben
ser evaluados. El impacto de los CQAs seleccionados basado
en la evaluación de riesgo sobre las propiedades del producto
final debe ser estudiado y bien comprendido. Los excipientes en una formulación con solubilidad mejorada ya no deben
considerarse como relleno o parte de la matriz de aglutinante
porque contribuyen al desempeño del API que de otra manera
no tiene ninguna absorción y biodisponibilidad. Los parámetros críticos del proceso (CPPs) son atributos específicos del
proceso. Para aplicaciones de mejoramiento de la solubilidad,
la extrusión con fundido y el secado por aspersión son las
tecnologías más comúnmente usadas. Los CPPs para la extrusión con fundido son la velocidad del tornillo, la temperatura
de extrusión, la velocidad de alimentación, la temperatura de
transición vítrea de la mezcla fármaco-polímero y la viscosidad del fundido. Sin embargo, para el secado por aspersión,
deben considerarse parámetros tales como velocidad de atomizado, contenido de sólidos en porciento, tamaño y escala
del secador por aspersión, tamaño de la boquilla y temperatura en la cámara de expansión. PT
MAYO / JUNIO 2013
27/05/13 16:31
Sección Especial: Formas Farmacéuticas Sólidas y Excipientes
R ecubrimiento de Tabletas
y
Granulado
en
Seco
Mejora continua en el recubrimiento de tabletas
y la granulación
Avances en diseño y operación de equipo
L.B. Bohle
Martin Hack y Dejan Djuric
La alta eficiencia en las operaciones unitarias es
un prerrequisito para lograr mejoras generales
en la manufactura de formas farmacéuticas
sólidas. Los autores examinan avances recientes
en diseño y operación de equipos en atomizado,
secado y mezclado para mejorar el proceso de
recubrimiento de tabletas.
Martin Hack* es vicepresidente y gerente general
y Dejan Djuric, PhD, es gerente de operaciones científicas,
ambos en L.B. Bohle, 700 Veterans Circle,
Oficina 100, Warminster, PA 18974, tel. 215.957.1240,
mhack@lbbohle.com
*A quien debe dirigirse la correspondencia.
E
l costo es un asunto crucial para las compañías
farmacéuticas, los fabricantes de genéricos y los
CMOs, los cuales deben estar atentos a los costos
operacionales generales del equipo así como a los
costos iniciales de capital. El proceso de alta eficiencia en la
manufactura de formas farmacéuticas sólidas es un objetivo
deseado, y los recubridores de tabletas y los granuladores han
pasado por mejoras en la tecnología para lograr la mejora
continua en estas operaciones.
Mejoras en la manufactura de formas
farmacéuticas sólidas
Para evaluar las mejoras en la manufactura de formas farmacéuticas sólidas, uno debe examinar los avances en el diseño y
la operación de equipos para el atomizado, secado y mezclado
para mejorar el proceso general de recubrimiento de tabletas.
Se describe lo más destacado de tales avances.
Recubrimiento de tabletas. Las mejoras a las tecnologías
de recubrimiento de tabletas están ayudando a los fabricantes farmacéuticos a alcanzar mayor uniformidad y reducción
de desechos. Estas mejoras se deben en su mayor parte a los
avances en el sistema de mezclado, así como en el bombo
y la configuración del flujo de aire. El recubrimiento de tabletas consiste en tres pasos principales: atomizado, secado y
mezclado. Cada paso debe estar calibrado con los otros para
optimizar el proceso completo.
Atomizado. El equipo de atomizado incluye los tipos de
boquilla, el número y tipo de pistolas y el espaciado de pistola
a pistola. Los parámetros de proceso incluyen la velocidad
del atomizado, la distancia y ángulo de la pistola al lecho de
las tabletas, la presión del aire de atomización y el patrón de
la presión del aire. Las boquillas de la pistola de atomización
son claves para el recubrimiento eficiente y las boquillas que
crean un patrón de rocío oval y un ángulo del rocío de 50° a
60° trabajan mejor. La configuración de la barra de atomización dictará la cantidad de traslape rocío-cono. Un ligero traslape de los conos de rocío de cada boquilla puede ser deseable para una cobertura consistente; sin embargo, demasiado
traslape llevará a una sobrehumectación localizada del lecho
de las tabletas. En la mayoría de los casos, la distancia pistola
a lecho irá de 6 pulg. a 10 pulg. aunque la distancia real depende de la fuerza de la presión del aire de atomización y el
patrón de la presión del aire sobre el tamaño del bombo de
recubrimiento.
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 31
MAYO / JUNIO 2013
31
27/05/13 16:31
Sección Especial: Formas Farmacéuticas Sólidas y Excipientes
Secado. El secado de la suspensión de recubrimiento tiene lugar durante la atomización y cuando se esparce sobre la
superficie de la tableta. La temperatura del aire de entrada, el
flujo y humedad del volumen del aire de entrada y el grado de
perforación del bombo controlan el secado. Estos parámetros
deben estar controlados en una manera que evita la sobrehumectación pero no causa el secado por aspersión. La manera
en que el aire se mueve a través del bombo de recubrimiento también influye el secado. La mayoría de los bombos de
recubrimiento extraen aire de la parte superior del bombo y
lo sacan por un lado. Otros colocan tanto la entrada como la
salida en la base del bombo. No importa dónde está la entrada
y la salida, el objetivo es manejar el aire de manera que se
minimice la turbulencia y el calor excesivo en la zona del atomizado. Debe alcanzarse un equilibrio entre la temperatura y
el volumen del aire de entrada y la velocidad del atomizado.
Una vez que los elementos
básicos del recubrimiento de
tabletas son entendidos,
el fabricante puede decidir
cuales características de
recubridor de tabletas se
adaptan mejor a su forma
farmacéutica sólida.
Mezclado. El mezclado es un prerrequisito para un recubrimiento homogéneo y uniforme. Idealmente, la acción del
bombo mezclará las tabletas de manera que cada una esté expuesta por igual al rocío. Hacerlo así depende de la geometría
del bombo y del uso de deflectores, espirales, barras elevadoras u otros componentes. Muchos bombos comunes tienen un
diámetro que excede su longitud. Esta relación puede crear un
lecho de tabletas demasiado profundo para un mezclado efectivo. No es poco común encontrar puntos muertos en la mitad
de estos lechos de tabletas. Tales puntos muertos pueden causar sobrehumectación y la formación de grumos o gemelos, lo
cual puede dañar las tabletas.
Para romper o evitar los grumos y las zonas muertas, algunos bombos están adaptados con un dispositivo llamado
deflector o pala. La pala está fija dentro del bombo de recubrimiento, de manera que conforme gira el bombo, las tabletas
contactan con la pala, dirigiéndolas hacia afuera. Aunque la
inserción de la pala puede mejorar el mezclado, puede incrementar el riesgo de rompimiento de tabletas. Un enfoque
alternativo es usar un bombo cuya longitud exceda a su diámetro y que incorpore deflectores helicoidales para un mezclado suave de las tabletas. El bombo más largo crea un lecho
poco profundo de tabletas que está libre de zonas muertas.
Los deflectores helicoidales superior e inferior exponen todas
las tabletas al atomizado igualmente. Esta configuración permite velocidades de atomizado más elevadas, lo cual acorta el
32
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 32
tiempo requerido para recubrir las tabletas en cada lote.
El papel del diseño del equipo de recubrimiento
en la manufactura
Una vez que los fabricantes farmacéuticos entienden los
elementos básicos del recubrimiento de tabletas, pueden determinar cuáles características del recubridor de tabletas se
adaptan mejor a su forma farmacéutica sólida. Por ejemplo,
apoyándose en un recubridor cuya longitud del bombo de
recubrimiento excede su diámetro crea un lecho de tabletas
poco profundo que promueve la exposición de las tabletas al
atomizado. También permite la instalación de más boquillas
sobre el lecho de lo que es posible en los bombos convencionales. Esta combinación mejora exponencialmente la uniformidad del recubrimiento. Sin embargo, existe un límite para
el número de boquillas que deben añadirse. Los fabricantes
deben ponderar el beneficio de agregar boquillas contra el
riesgo de sobrehumectar el lecho de tabletas. Es mejor utilizar
suficientes boquillas para cubrir el lecho evitando o minimizando al mismo tiempo el traslape.
También debe evaluarse el flujo de aire. Los recubridores
convencionales tienen flujo de aire superior-a-lateral, de manera que el aire caliente a alta velocidad pasa a través de la
zona de atomizado. Esta implementación del flujo de aire causa turbulencia y la posibilidad de secar por aspersión las gotas
del recubrimiento. Los fabricantes farmacéuticos pueden reducir estos efectos ajustando el flujo de aire, la temperatura y
la velocidad de atomizado. Esta corrección, sin embargo, puede hacer más lenta la operación de recubrimiento o incrementar la cantidad de solución de recubrimiento desperdiciada.
La mínima turbulencia de aire y las aplicaciones de recubrimiento mejoradas pueden lograrse utilizando un bombo
con una entrada y salida que se extiende en la base del bombo.
Esta mejora del diseño también permite un mejor control sobre la temperatura del lecho de tabletas. Adicionalmente, este
control da velocidades del atomizado más rápidas y reduce
los tiempos de recubrimiento en tanto como 45%.
Las compañías que utilizan ambos diseños del bombo de
recubrimiento han encontrado que los bombos con flujo de
aire superior-a-lateral son hasta 85% eficientes. Este resultado
significa que aproximadamente el 15% o más del atomizado
se deposita dentro del bombo de recubrimiento, en las pistolas
y en la barra de atomización o en el desfogue. Los diseños
que usan aire de flujo base-a-base, los cuales jalan el atomizado sobre el lecho de tabletas como un vacío, pueden alcanzar
aproximadamente el 98% de eficiencia. También acortan el
tiempo de recubrimiento general porque facilitan mayores velocidades de atomizado sin sobrehumectar el lecho de tabletas.
En aplicaciones que requieren recubrimientos gruesos de
las tabletas, el lecho de tabletas puede crecer en un tercio o
más. Esta formulación requiere un ajuste de la distancia de
pistola a lecho durante el proceso. Cuando el recubrimiento
de las tabletas involucra sustancias potentes, los fabricantes
pueden considerar la automatización del movimiento de las
boquillas, la barra de atomización, o ambos. Esta característica elimina la necesidad de abrir el bombo de recubrimiento,
incrementando así la eficiencia y seguridad.
MAYO / JUNIO 2013
27/05/13 16:31
Finalmente, los fabricantes deben notar cómo su bombo
de recubrimiento mezcla y maneja las tabletas. El mezclado homogéneo promueve la uniformidad de contenido. Los
bombos equipados con deflectores de mezclado helicoidales
mueven constantemente las tabletas hacia atrás y hacia adelante a través del bombo, eliminando así los puntos muertos.
Estudios de recubrimiento de tabletas
Los investigadores han realizado varios estudios científicos
en recubrimiento de alta eficiencia en la manufactura de formas sólidas. Estos estudios proporcionan guía para las mejoras del proceso de recubrimiento de tabletas (1-6).
Efectos del escalamiento sobre la abrasión de las tabletas
durante el recubrimiento en bombo. Un estudio del 2006 investigó la influencia del escalamiento de la producción sobre
la abrasión de las tabletas en un bombo de recubrimiento (1).
Se examinó cómo el tamaño del lote durante el escalamiento
puede afectar la abrasión y el mellado de los bordes de las
tabletas planas. Los investigadores vieron la pérdida de peso
de tabletas rastreadoras blancas mezcladas con un lote de tabletas recubiertas con azul en un bombo a escala de laboratorio y un bombo a escala piloto como función de diferentes
velocidades y tiempos de mezclado del bombo. Ellos observaron que incrementando el tamaño del lote se causaba una
reducción en la pérdida de peso debido al menor daño en los
bordes de las tabletas. Los investigadores determinaron que
un mayor número de tabletas impacta en la pared del bombo en la escala de laboratorio en comparación con lo que la
escala piloto podría explicar para este resultado. Este efecto
es contrario a la creencia común de que el incremento en el
tamaño de lote en el escalamiento lleva a una mayor abrasión
o daño a las tabletas (1).
Espectroscopía Raman como herramienta PAT en el recubrimiento con activo. El recubrimiento con activo es una
aplicación de recubrimiento pelicular en la cual el ingrediente
activo farmacéutico está incluido en la capa de recubrimiento.
Esto le representa a los fabricantes el desafío de lograr la cantidad correcta de recubrimiento y uniformidad en cada dosis.
Para asegurar la calidad de cada dosis, los fabricantes pueden
beneficiarse desarrollando tecnología analítica de proceso
(PAT) que pueda monitorear el proceso de recubrimiento y
detectar el final del ciclo de recubrimiento. En un estudio, los
investigadores realizaron experimentos de recubrimiento utilizando el fármaco diprofilina (2). Ellos utilizaron un bombo
para cubrir tabletas de placebo y tabletas conteniendo diprofilina. Durante el recubrimiento con activo, los investigadores registraron espectros Raman en línea. Estas mediciones
espectrales fueron comparadas con el aumento promedio de
peso y la cantidad de ingrediente activo recubierto en cada
punto de tiempo (2).
El modelo quimiométrico que crearon utilizando espectroscopía Raman fue probado monitoreando más tabletas
recubiertas. El grupo de investigación también estudió los
efectos de la velocidad de rotación del bombo y la distancia
de trabajo en la señal Raman y estudiaron el efecto resultante
del modelo quimiométrico. Utilizando espectroscopía Raman
como herramienta PAT, ellos pudieron determinar la cantidad
de ingrediente activo en la película cuando se aplicó sobre los
núcleos de las tabletas placebo y en tabletas que contenían el
ingrediente activo. Los investigadores también determinaron
que este método puede ser usado cuando se cambian los parámetros del proceso y las condiciones de medición dentro de
un rango restringido, haciendo de esto una herramienta PAT
apropiada (2).
Comparación de la pistola de atomizado en laboratorio y
en producción para el escalamiento. En un estudio de escalamiento, los investigadores examinaron una pistola de atomizado de laboratorio y una pistola de atomizado de producción
(3). Ellos analizaron la influencia de la presión del aire de
atomización, la distancia de la pistola de atomizado al lecho
de las tabletas, la viscosidad de la solución del polímero y la
velocidad de atomizado. Las pistolas de atomización fueron
comparadas con base en el ancho y la altura del atomizado, el
tamaño y velocidad de la gota, y la densidad del atomizado.
Los investigadores midieron la densidad del atomizado, el tamaño de la gota y la velocidad con un analizador de partículas
con fase Doppler (3). Este estudio le dio a los investigadores
información básica para los ajustes del escalamiento de las
pistolas de atomizado del laboratorio y de producción. Ambas
fueron comparables con respecto al tamaño y velocidad de la
gota, y el escalamiento del tamaño de la gota puede realizarse
mediante un ajuste de la presión del aire de atomización. El
escalamiento de la velocidad de la gota puede lograrse ajustando la pistola de atomizado a la distancia tableta-lecho. El
resultado del estudio fue que el modelo estadístico de los investigadores y las gráficas de superficie fueron herramientas
poderosas y convenientes para escalar los ajustes del atomizado si la pistola de atomizado se cambió de una pistola de
atomizado de laboratorio a un pistola de atomizado para producción (3).
Granulación seca y compactación con rodillos
La granulación seca continua es un proceso establecido en la
industria farmacéutica. Actualmente, no sólo se aplica para
materiales sensibles a la humedad y temperatura sino también
para productos de formas farmacéuticas sólidas de gran volumen. En comparación con las técnicas clásicas de granulación húmeda, no se requiere un sofisticado sistema de secado
para el proceso. Esta eliminación del sistema de secado evita
grandes inversiones para el equipo de producción y el espacio
y baja los costos de manufactura. Un beneficio adicional de
tener una operación de una unidad es su aptitud para la instalación en una operación de un piso. El granulador seco puede
ser alimentado con un solo contenedor del granel intermedio
(IBC). Para habilitar el proceso continuo, puede usarse una
tolva de alimentación de mayor potencia con un sensor de
nivel y una adecuada capacidad de retención para facilitar el
cambio de IBCs adicionales sin interrumpir el proceso.
En el lado de la descarga, puede usarse un sistema simple
de transporte neumático del flujo para transferir el granulado
resultante a un IBC receptor para el futuro mezclado y procesado. Esta reducción en el manejo de equipo puede reducir
más los costos de capital con un sistema de granulado en seco.
Adicionalmente, para rendimientos de gran volumen, el
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 33
MAYO / JUNIO 2013
33
27/05/13 16:31
Sección Especial: Formas Farmacéuticas Sólidas y Excipientes
rápido proceso de compactación con rodillos es primordial
para el procesado eficiente. Esta eficiencia permite la producción de diferentes productos y tamaños de lote de producto
con una sola máquina (4). El mercado ya ofrece varios granuladores en seco, los cuales pueden ser descritos por el arreglo
de los dos rodillos de compactación. Éstos pueden ser montados horizontalmente, verticalmente o en un plano inclinado.
Dependiendo del proveedor, los rodillos difieren en anchura, diámetro y propiedades de la superficie. Además, los
compactadores de rodillo se distinguen entre compactadores
de hueco fijo y de hueco movible, mientras que los compactadores de rodillos movibles son lo último. Sin embargo, sólo los
compactadores de rodillos movibles aseguran una porosidad
homogénea del listón a presión de compactación constante.
El paso de la granulación, en donde los listones son transferidos a gránulos finales, está por lo general integrado en el
equipo de compactación con rodillos y se lleva a cabo en uno
o dos pasos (5, 6). Con esto en mente, los fabricantes introdujeron un granulador en seco con un manejador de rodillos
electromecánico y ejes del rodillo masivos montados de manera horizontal.
Con esta máquina recientemente desarrollada, es necesario un tiempo mínimo para lograr un estado estable durante el
arranque del proceso, y el hueco paralelo está asegurado durante todo el tiempo de la producción. El control del circuito
proporcional-integral-derivativo (PID) minimiza las desviaciones del hueco durante el procesado y permite porosidades constantes del gránulo. El paso de la granulación se logra
utilizando un tamiz cónico, el cual transforma suavemente los
listones en gránulos finales incluso en rendimientos de material altos. Debido a los diferentes tamices, puede obtenerse la
distribución deseada del tamaño de partícula.
Estudio de caso del compactador con rodillos
El objetivo del siguiente estudio es mostrar y demostrar la
funcionalidad de este tipo de granulador en saco sofisticado.
Materiales y métodos. Se utilizó una mezcla de polvos
(relación 1:1) que consiste en lactosa y celulosa microcristalina para la compactación con rodillos. Para la lubricación,
se añadió 0.5% de estearato de magnesio. Los excipientes
fueron premezclados en un mezclador de caja. La mezcla homogénea fue compactada con rodillos en diferentes fuerzas
de compactación y diferentes arreglos del tamiz. Se utilizó
un rodillo maestro liso y un rodillo ranurado de 100 mm de
ancho para los ensayos de compactación. El muestreo se llevó a cabo después del arranque del proceso cuando se había
alcanzado el estado estable. Los gránulos finales fueron submuestreados manualmente y analizados por duplicado mediante tamizado mecánico.
Fuerza de compactación. Se analizó el impacto de la fuerza de compactación sobre el tamaño de partícula del gránulo
final a 2 rpm de velocidad del rodillo, 300 rpm para el tamiz
raspador de 1.5 mm, y un ancho de hueco de 2.5 mm. El proceso empezó con un control del circuito activado del PID para
el sistema de alimentación. El estado estable se alcanzó en 40
segundos con una fuerza de compactación específica constante y un ancho de hueco constante. De esta manera, pudo
34
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 34
detectarse una pérdida mínima de material debido al control
de circuito rápido.
Durante el procesado, se incrementó gradualmente la
fuerza de compactación, de manera que el siguiente nivel de
fuerza fue alcanzado rápidamente en un lapso de segundos.
Las desviaciones de la fuerza de compactación específica estuvieron por debajo de ± 0.1 kN/cm y ± 0.1 mm para el hueco,
respectivamente. Así, ambos parámetros pudieron considerarse constantes durante el proceso.
El tamaño de partícula del gránulo se incrementó con los
mayores niveles de fuerza de compactación. Después de la
granulación, a través de un tamiz raspador de 1.5 mm, la cantidad de finos (tamaño de partícula < 100 μ m) fue desde el
39% para los gránulos compactados a 5 kN/cm hasta 11%
para los gránulos preparados con una fuerza de compactación
de 15 kN/cm. La compactación con dicho nivel de fuerza alto
llevó a una cantidad más elevada de gránulos gruesos (> 2000
μm). Por lo tanto, se recomienda un tamaño de tamiz más
pequeño entre 1 mm y 1.5 mm para minimizar esta fracción
de gránulos grandes.
Ancho del hueco. El rendimiento del material durante la
compactación con rodillos puede incrementarse con un ancho
de hueco más grande. Se reporta en la literatura que un ancho
de hueco más grande con un nivel de fuerza de compactación
constante lleva a gránulos más finos (4). Este efecto no pudo
ser observado cuando se compactó la mezcla de polvos a 10
kN/cm.
A una velocidad de los rodillos de 2 rpm y una velocidad
del tamiz de 300 rpm (1.5 mm de tamiz raspador), se obtuvieron distribuciones comparables del tamaño de partícula de los
gránulos aunque el ancho del hueco se incrementó desde 1.5
mm hasta 3.5 mm. Una aplicación homogénea de la fuerza de
compactación sobre el ancho del rodillo completo pudo ser
una razón para el tamaño de gránulo similar. Por lo tanto, el
resultado del material podría ser fácilmente incrementado sin
un cambio en las propiedades del gránulo.
Disposición del tamiz. La fuerza de compactación aplicada
afecta principalmente el tamaño de partícula del gránulo. En
segundo lugar, la disposición de una unidad de granulación
integrada determina la distribución final del tamaño de partícula. Con el incremento del tamaño del tamiz, se obtienen
gránulos más secos.
Los tamices de raspado con tamaño de la malla de 1.5 mm
y 2 mm llevó a distribuciones similares del tamaño de partícula de los gránulos a una velocidad del tamiz de 300 rpm. En
comparación, el tamiz raspador de 1 mm llevó a gránulos más
finos con mayor cantidad de finos. Finalmente los tres tipos
de malla llevaron a cantidades aceptables de finos debido al
comportamiento de corte suave del tamiz raspador durante la
granulación. La elección del tamaño correcto de la malla hace
posible influir la distribución final del tamaño de partícula del
gránulo.
Una posibilidad adicional para variar la disposición del
tamiz es la alteración de la velocidad del rotor del tamiz. En
contraste con los sistemas clásicos de tamiz rotatorio, los ta“Mejora continua en el recubrimiento de tabletas y la granulación”
continúa en la pág. 42
MAYO / JUNIO 2013
27/05/13 16:31
Sección Especial: Formas Farmacéuticas Sólidas y Excipientes
Calidad
por
Diseño
Calidad por diseño en excipientes
Manejo de la variabilidad de los excipientes
Creative Crop/Getty Images
Sesión de preguntas y respuestas moderada por Patricia Van Arnum
El manejo de la variabilidad de los excipientes
es un elemento esencial en el diseño y la
manufactura robusta de productos
farmacéuticos sólidos orales y es una tarea
integral cuando se aplican los principios de la
calidad por diseño (QbD). El artículo examina
factores en la evaluación de la variabilidad
de los excipientes, los retos asociados que los
desarrolladores necesitan abordar para diseñar y
fabricar productos farmacéuticos sólidos orales y
las soluciones para dichos retos.
L
os excipientes juegan un papel crucial en una formulación y, como parte de la misma, influyen en la
calidad del producto farmacéutico final. El manejo
de la variabilidad de los excipientes es un elemento
esencial en el diseño y la manufactura de productos farmacéuticos sólidos orales y es una tarea integral en la aplicación de
los principios de la calidad por diseño (QbD). Pharmaceutical
Technology examinó el desempeño de los excipientes en la
QbD en una transmisión por Internet (webcast) (www.pharmtech.com/excipient) en 2012. Participando de dicho webcast
estuvieron Catherine Sheehan, directora de excipientes en la
Farmacopea de EUA, Ian Robertson, gerente de QbD Global
en Colorcon, Chris Moreton, vicepresidente de ciencias farmacéuticas en FinnBrit Consulting y Greg Amidon, profesor
de investigación de ciencias farmacéuticas en el Colegio de
Farmacia de la Universidad de Michigan y director del Panel
de Expertos del Desempeño de Excipientes de la USP. En este
artículo, Robertson ofrece información más profunda sobre
el manejo de la variabilidad de los excipientes en paradigma
de la QbD.
Evaluando la variabilidad de los excipientes
PharmTech: ¿Cuáles son las consideraciones clave en la evaluación de la variabilidad de los excipientes y cuáles son los
desafíos asociados que los desarrolladores necesitan abordar
para el diseño y manufactura de productos farmacéuticos sólidos orales?
Robertson (Colorcon): Es importante entender los efectos
de la variabilidad normal de los excipientes para asegurar que
los riesgos potenciales para la calidad del producto farmacéutico sean manejados efectivamente. Con un enfoque cada
vez mayor en la QbD, tanto el innovador como los desarrolladores del fármaco genérico deberán demostrar el manejo
del riesgo del excipiente en relación con los atributos de calidad críticos de los productos farmacéuticos. De esta forma,
mientras que es responsabilidad del desarrollador demostrar
el diseño y manufactura robusta de la formulación, es importante que todas las partes interesadas colaboren al principio
del ciclo de vida del producto para asegurar el éxito mutuo.
Con frecuencia, se dispone del conocimiento y las herramientas para evaluar proactivamente los efectos de la variabilidad
de los excipientes sobre la calidad del producto farmacéutico.
Desde luego, esto no sólo proporciona el suficiente desarrollo
sino que, de manera importante, da soporte a la implementación de una estrategia de control efectivo para la manufactura
comercial posterior.
De manera que uno podría preguntar ¿Por qué son variables los excipientes y cuáles son las fuentes de esta variabiPharmaceutical Technology en Español
PT MAYO / JUNIO.indd 35
MAYO / JUNIO 2013
35
27/05/13 16:31
Sección Especial: Formas Farmacéuticas Sólidas y Excipientes
lidad? Bueno, los excipientes usados dentro de los productos
farmacéuticos son diversos en términos de su química, origen,
manufactura y también control. Hablando en general, podríamos considerar dos clases de excipientes. Los descritos como
naturales o que se derivan de un origen natural y aquéllos
descritos como sintéticos o semi-sintéticos. Los excipientes
naturales o derivados naturalmente y los factores, incluyendo
el origen de la cosecha junto con las variables ambientales,
tales como el cultivo y las condiciones del proceso, pueden
todos afectar las propiedades fisicoquímicas del excipiente resultante. Incluso para excipientes sintéticos o semi-sintéticos,
las diferencias en la materia prima, tales como los componentes orgánicos e inorgánicos del aceite crudo o el gas, junto con
la variabilidad en el proceso químico, contribuirán todos a la
variabilidad general del propio excipiente.
Es crítico que los fabricantes
y vendedores de excipientes
colaboren estrechamente con el
desarrollador para reducir mejor los
riesgos de fallas en la calidad.
Para un fabricante individual de un excipiente, puede haber variabilidad de lote a lote en las propiedades fisicoquímicas. Con frecuencia, un fabricante puede hacer productos
relacionados, como los diferentes grados físicos o químicos,
o incluso abastecer a diferentes industrias. Por lo tanto, puede adoptarse diferentes campañas de manufactura, las cuales pueden llevar a la variabilidad asociada con el cambio, el
arranque o el paro de una sola línea de producción.
Ciertamente, entre los múltiples fabricantes de un excipiente, es probable que haya diferencias en las materias primas y en el proceso de producción usado, la escala de manufactura y la ubicación, todo lo cual puede contribuir a la variabilidad de las propiedades fisicoquímicas de un excipiente.
Yo creo que es también importante reconocer la variabilidad en los controles usados. Aunque se requiere que los excipientes cumplan los estándares farmacopeicos apropiados,
puede haber diferencias en las especificaciones del excipiente
de vendedor a vendedor. Esto puede incluir los rangos especificados dentro de las pruebas estándar así como la inclusión
de pruebas de propiedades fisicoquímicas no compendiales.
Junto con los parámetros especificados, es importante
también considerar tanto los parámetros no especificados
así como los parámetros no rutinarios. La variabilidad de los
parámetros no especificados o no reportados podría impactar
el desempeño del producto farmacéutico dependiendo de su
diseño o uso a que está destinado. Aunque no estén reportadas, estas propiedades pueden ser medidas por el fabricante
como parte de su estrategia de control. Adicionalmente, los
excipientes puede variar en lo que se denomina parámetros no
rutinarios (p.ej., reactantes residuales y catalizadores residuales). La variación de estos parámetros puede no ser medida
36
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 36
comúnmente por el fabricante.
Por lo tanto, en la mayoría de los casos los productos farmacéuticos robustos se desarrollan y fabrican con éxito para
manejar dicha variabilidad de los excipientes. Sin embargo, la
falla para comprender y controlar la variabilidad del excipiente ha llevado a algunos problemas de calidad serios.
La FDA, por ejemplo, se ha expresado públicamente sobre la variabilidad de los excipientes y su relación con las
recuperaciones de producto farmacéutico del mercado (recalls). Es claro que pueden fallar algunas prácticas existentes
de desarrollo y manufactura para asegurar que rutinariamente se produzcan medicamentos con los estándares de calidad
apropiados. Además, la demostración de calidad mediante el
análisis no evita que estos productos sub-estándar entren al
mercado. Obviamente, las fallas de calidad, incluyendo las
relacionadas con la variabilidad de los excipientes, pueden
tener consecuencias serias para el fabricante en términos de
daños financieros y de reputación. Finalmente, el usuario final, es decir, el paciente, se pone en riesgo.
Los productos farmacéuticos sub-estándar que llegan al
paciente pueden impactar la seguridad y la eficacia. E incluso
aquéllos que son capturados y rechazados por control de calidad o aquéllos que son recuperados del mercado pueden llevar
a la escasez del fármaco. Esto, nuevamente, tiene un impacto
en el paciente. De esta forma, con la atención del público cada
vez mayor en la industria farmacéutica y las regulaciones, es
claro que el manejo de la variabilidad de los excipientes será
un área de importancia industrial cada vez mayor.
Es crítico, por lo tanto que los fabricantes de excipientes y
los vendedores colaboren estrechamente con el desarrollador
para reducir mejor las fallas de calidad. Esto es importante
desde el inicio en el desarrollo del producto farmacéutico,
donde el conocimiento y la experiencia del excipiente pueden
soportar proactivamente un diseño robusto de la formulación
y un control eficiente de la manufactura. El no considerar la
variabilidad normal de los excipientes puede llevar al diseño
y desarrollo de formulaciones no robustas. Desafortunadamente, esto puede necesitar límites más estrechos en las especificaciones de los excipientes, la selección del lote, o incluso
la manufactura a la medida para controlar el desempeño del
producto farmacéutico terminado.
Debe reconocerse que, en algunos casos, la capacidad del
fabricante del excipiente para cumplir dichos requerimientos
puede no ser fácilmente alcanzable, si no es que inalcanzable
en lo absoluto. Esto, por lo tanto, presenta un riesgo y costo
adicional para el producto en general.
También es importante considerar la interacción de todas
las variables, incluyendo las del API (ingrediente activo o fármaco) y las del proceso de manufactura. El uso de evaluación
del riesgo es útil para identificar aquéllas variables primarias
que puedan afectar los atributos de calidad críticos del producto farmacéutico.
El uso de la QbD, por lo tanto, presenta una oportunidad para asegurar que la calidad se construye por diseño. La
colaboración temprana de todas las partes interesadas puede
asegurar mejor que los riesgos potenciales de la variabilidad
normal de los excipientes pueden ser calculados eficiente-
MAYO / JUNIO 2013
27/05/13 16:31
Marque en la tarjeta de servicio al lector el No. 18
Marque en la tarjeta de servicio al lector el No. 8
PT MAYO / JUNIO.indd 37
27/05/13 16:31
Sección Especial: Formas Farmacéuticas Sólidas y Excipientes
mente mediante nuestro conocimiento previo y las herramientas disponibles.
Enfoques
PharmTech: ¿Puede profundizar sobre ese conocimiento y las
herramientas y soluciones relacionadas?
Robertson (Colorcon): Como mencioné previamente, el
diseño de la formulación es crítico para asegurar un desempeño robusto del producto. Y para ilustrar este punto, me gustaría mucho mostrar un ejemplo de cómo la variabilidad normal
del excipiente en un polímero que controla la tasa de liberación del fármaco, la hipromelosa (METHOCELTM K15M
CR) fue determinada para la liberación de un fármaco a partir
de una matriz hidrofílica de liberación extendida. El estudio
examinó la importancia de la concentración de METHOCELTM
K15M CR con respecto al manejo de la variación de los atributos del material como tamaño de partícula, viscosidad y
porcentaje de sustituyentes hidroxipropoxilo (HP). Y los rangos estudiados fueron en los extremos y el punto central de
los límites de especificación.
Utilizando clorhidrato de propanolol como el fármaco
modelo, pudo verse que la liberación del fármaco fue más
lenta cuando se incrementaba la concentración de METHOCELTM K15M CR de 15% a 30% (p/p) y esto, por supuesto,
se podía esperar. La liberación del fármaco fue generalmente consistente a través de los extremos de la viscosidad y el
porciento de sustituyentes hidroxipropoxilo (HP) independientemente de la concentración del fármaco. Por lo tanto, la
formulación fue robusta para la variación normal de estos dos
atributos del material.
Curiosamente, sin embargo, para el tamaño de partícula
se demostró claramente que la concentración más baja de
METHOCELTM K15M CR, 15% (p/p) resultó no sólo en una
diferencia de la tasa de liberación, como se vio previamente,
sino también en variabilidad entre tabletas. Aquí, se demostró
una liberación del fármaco más rápida y más variable para
la formulación que contenía la fracción de partículas de tamaño en el límite superior de la especificación del polímero
METHOCELTM K15M CR. En la concentración de METHOCELTM K15M CR de 30%, sin embargo, esta variación no se
observó. Se demostró tal desempeño robusto de la disolución
independientemente del tamaño de partícula.
Estos ejemplos muestran que es prudente determinar si
tales atributos del material son un riesgo potencial para los
atributos de calidad del producto farmacéutico durante el desarrollo inicial de la formulación. Claramente, en esta etapa,
es generalmente más fácil ajustar la formulación y/o el pro-
ceso para manejar dichos efectos más que la implementación
de cambios durante las últimas etapas del desarrollo del producto farmacéutico.
El impacto de la variabilidad normal de los excipientes,
sin embargo puede también ser manejada de otras formas.
Ciertamente, la QbD da soporte a estrategias para desarrollar
la flexibilidad de la formulación o el espacio de diseño de la
formulación. El ajuste de la composición cuantitativa del lote
de producto farmacéutico puede justificarse para manejar la
variabilidad del atributo del excipiente entrante. Según se discute en las guías del ICH, es necesario el mejor conocimiento
de los atributos del material para desarrollar y justificar dicha
estrategia. No obstante, esto proporciona una oportunidad
tanto para el desarrollador como para el proveedor para colaborar más y asegurar que pueden ser evaluadas las propiedades fisicoquímicas necesarias del excipiente para desarrollar
dichas estrategias.
Adicionalmente, también es importante no ver las especificaciones del excipiente para ventas como el criterio de
valoración para el control de la variación del mismo. Las especificaciones de venta del excipiente y los límites de prueba
pueden, desde luego, ser variables. Por lo tanto, esto puede
ser no representativo de la capacidad de control del fabricante
del excipiente. Y yo creo que esto es un punto importante,
particularmente para la evaluación del riesgo. El mejor conocimiento aquí puede reducir el riesgo percibido de la variabilidad de la propiedad del excipiente sobre los atributos de calidad del producto farmacéutico. Y, ciertamente, los fabricantes
del excipiente pueden proporcionar el conocimiento previo
de su capacidad, por ejemplo, demostración de la capacidad
del proceso, datos de tendencia representativos del atributo
del material, o incluso estadísticas descriptivas que ilustren el
control para la estrategia individual de manufactura.
En el estudio de caso de la matriz de propanolol, otra herramienta disponible para el desarrollador es la de la muestra
del atributo del excipiente. Esta puede estar disponible para
ayudar al desarrollador en el análisis proactivo del efecto de
la variabilidad normal del excipiente sobre su formulación
particular. Sin embargo, esto puede no ser siempre útil para
estudiar todos los atributos del excipiente, particularmente si
el control del fabricante es exhaustivo y si la variabilidad lote
a lote es insignificante. No obstante, dichos esquemas pueden
ser valiosos para respaldar el diseño experimental y el posterior desarrollo del espacio de diseño. PT
METHOCEL™ es marca registrada de The Dow Chemical Company
Informes y Contrataciones:
Tel: 52 (55) 5659-8880, 5536-2100, 5543-1486
E-mail: info@pharmatechespanol.com.mx
38
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 38
MAYO / JUNIO 2013
27/05/13 16:31
Sección Especial: Formas Farmacéuticas Sólidas y Excipientes
Tableteado
Lucha contra los problemas comunes en el
tableteado y el herramental
FotografiaBasica/Getty Images
Sesión de preguntas y respuestas moderada por Adeline Siew, PhD
Este artículo proporciona un panorama
general del proyecto de investigación
antiadherente en la ciencia del
tableteado (TSAR) de I Holland, el cual está
realizando la compañía en colaboración con la
Universidad de Nottingham en el Reino Unido.
El proyecto TSAR busca comprender porque
ciertas formulaciones se adhieren a
herramental de la tableta, un problema
principal encontrado por los
fabricantes de tabletas.
L
os problemas durante la manufactura de tabletas
con frecuencia resultan en tiempos muertos del proceso y costos de operación más elevados. Algunos
de estos problemas pueden ser minimizados o eliminados con el mantenimiento y almacenamiento apropiado
del herramental de las tabletas. Pharmaceutical Technology
habló con los expertos en I Holland acerca de las causas de
los problemas comunes tales como la variación del peso de
las tabletas, la dureza o los problemas de rotura, el laminado,
y el pegosteado, así como de un proceso de siete pasos para el
cuidado del herramental.
Los representantes de I Holland también discutieron la
colaboración en la investigación de la compañía de la Escuela
de Farmacia de la Universidad de Nottingham en el Reino
Unido, la cual busca comprender por qué ciertas formulación
se adhieren al herramental de las tabletas, un problema mayor
que con frecuencia se encuentran los fabricantes de tabletas.
El objetivo de este proyecto conjunto es desarrollar una herramienta predictiva que permite la identificación de la mejor
solución de recubrimiento para los problemas de adhesión de
la formulación sin necesidad de llevar a cabo experimentos
de ensayo y error a escala completa con varios recubrimientos
anti-adherentes.
Ciencia del Tableteado
PharmTech: ¿Qué es la ciencia del tableteado?
I Holland: La ciencia del tableteado es parte de la oferta de
servicios básicos de I Holland. Esto abarca muchos aspectos
de nuestra capacidad de IyD, incluyendo el trabajo con socios
académicos y técnicos sobre proyectos de investigación científica que nos ayudan a mejorar nuestra comprensión de porqué un punzón o una matriz se comportan bien. Por ejemplo,
durante años muchos fabricantes de herramental han pulido
los punzones hasta un acabado de espejo óptimo porque saben
que esto ayuda a que el punzón se comporte más efectivamente, aunque nadie realmente comprende por qué es este el caso.
Los fabricantes de punzones y matrices son esencialmente
compañías de ingeniería y con frecuencia tienen una reluctancia a involucrarse en problemas de tableteado más amplios.
Nuestra inversión en la ciencia del tableteado ayudará a
los fabricantes de tabletas a reducir los gastos que pueden estar asociados con un desempeño pobre del herramental más
abajo de la línea, eliminando muchos problemas antes que
el punzón o la matriz golpeen la producción. Por ejemplo, la
‘adhesión’ es un problema mayor en la producción de tabletas
que estamos tratando de enfrentar a través de nuestro trabajo
con la Universidad de Nottingham con el proyecto de investigación anti-adhesión de la ciencia del tableteado (TSAR).
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 39
MAYO / JUNIO 2013
39
27/05/13 16:31
Sección Especial: Formas Farmacéuticas Sólidas y Excipientes
Esperamos entregar una herramienta predictiva que elimine
la necesidad de pasar por costosos ensayos de recubrimiento
para determinar la mejor solución de recubrimiento.
de proporcionar capacitación sobre estos asuntos y cómo resolverlos (1).
Problemas comunes en el tableteado
PharmTech: ¿Cuáles son las soluciones a estos problemas?
I Holland: Dependiendo de las causas exactas de cada uno
de los problemas previamente descritos, existen varias soluciones potenciales. Como guía, seguir un simple proceso de
siete pasos para el cuidado y mantenimiento del herramental
puede ayudar a minimizar la presencia potencial de la mayoría de los problemas del tableteado y del herramental (2). El
proceso de siete pasos es un enfoque lógicamente planeado
y profesional para el mantenimiento y almacenamiento del
herramental según se resume a continuación:
• Limpiar. Cuando el herramental se retira de la tableteadora, debe ser limpiado concienzudamente y
secado para remover cualquier residuo de aceite o
de producto, especialmente de las partes difíciles de
alcanzar como el grabado y las chavetas.
• Evaluar. Los punzones y las matrices deben ser visualmente inspeccionados con aumento en busca de
señales de daño, desgaste o corrosión y para validar
el proceso de limpieza. Esta evaluación establecerá
si el proceso de producción está corriendo bien o no,
dando así pistas de problemas con la tableteadora o
con el propio herramental y si se requiere algún mantenimiento del herramental.
• Reparar. El desgaste ligero de la superficie, la corrosión y el daño en el herramental puede ser reparado
y pulido hasta una condición utilizable. Las puntas
desgastadas pueden resultar en tabletas de pobre
calidad y definición inferior del grabado que puede
llevar a punteado y adhesión. La reparación deben
hacerla técnicos bien capacitados y experimentados
de mantenimiento para asegurar que el herramental
no excede los límites de tolerancia.
• Medir. La medición es esencial después de reparar
para asegurar que las dimensiones críticas del herramental se han mantenido dentro de una tolerancia de
trabajo aceptable. La medición debe realizarse a intervalos regulares incluso si no ha sido necesaria la
reparación, para verificar el desgaste natural durante
el proceso de compactación. La medición esencial es
la longitud de trabajo crítica del punzón ya que esto
controla el espesor, el peso y la dosis de la tableta.
• Pulir. El pulido ligero, controlada, sobre una base
frecuente, asegurará que el herramental se mantiene
con un terminado liso, ayudando así a maximizar la
vida del herramental y reduce los problemas tales
como la adhesión y el laminado.
• Lubricar. La lubricación es importante para proteger,
preservar y ayudar a una operación suave del herramental. Puede recomendarse un rango de aceites y
grasas para diferentes aplicaciones, tales como preservativos, o para propósitos de lubricación.
• Guardar. El almacenamiento y transporte del herramental debe ser específicamente diseñado para maximizar la seguridad y el manejo seguro para minimizar el daño y el deterioro.
PharmTech: ¿Cuáles son los problemas comunes encontrados
en la manufactura de tabletas?
I Holland: Hay muchos problemas comunes encontrados
en la manufactura de tabletas. Algunos de los más comunes
están listados más adelante. Cada una de estas áreas de problemas puede tener varias causas potenciales, pero a continuación se resumen breves panoramas generales de los principales problemas:
• Variación del peso de la tableta. La causa más probable de este problema es la extensa variación en las
longitudes de trabajo del punzón, que con frecuencia
se debe a punzones desgastados o adherencia/punteado que pueden causar acumulación de gránulos en la
cara del punzón y resultar en longitudes de punzón
no uniformes.
• Punteado. El punteado se refiere a cuando un gránulo comprimido se adhiere al detalle (es decir, el
grabado) en la cara del punzón. Este problema podría
deberse a un diseño inapropiado del grabado, caras
de la punta desgastadas, insuficiente fuerza de compactación o problemas de granulación tales como humedad excesiva o lubricante insuficiente.
• Adhesión. La adhesión está definida como la adherencia de los gránulos en general a la superficie de
la punta del punzón. Adicionalmente, el perfil inapropiado de la tableta puede tener un impacto en la
dureza y densidad inadecuadas de la tableta.
• Laminado. El laminado es la separación en láminas
del cuerpo o copa de la tableta y con frecuencia está
causado por el aire atrapado en el cuerpo de la tableta.
• Pobre definición de la tableta (grabado en relieve).
Este problema podría atribuirse a un pobre diseño del
grabado (es decir, demasiado pequeño o demasiado
superficial), caras del punzón desgastadas debido a
una formulación abrasiva, o excesivo pulido.
• Dureza de la tableta/problemas de rotura. Estos problemas son con frecuencia causados por longitudes
disparejas del punzón en un juego, agentes aglutinantes incorrectos en la formulación, o laminado debido
al aire atrapado.
Existen otros problemas relacionados con el herramental,
tales como:
• Problemas de manejo del herramental
• Rotura de la punta del punzón
• Desgaste de la cabeza del punzón
• Estrechez del punzón
• Desgaste del hueco de la matriz
• Desgaste de la punta por abrasión
• Corrosión
• Picoteado/impregnación de las caras de la punta del
punzón
Los fabricantes de punzones y matrices deben ser capaces
40
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 40
El proceso de siete pasos
MAYO / JUNIO 2013
27/05/13 16:31
DuraLac®.
Lactosa anhidra ahora disponible.
De Meggle.
Inmedi t
Inmediatamente
eficaz, MEGGLE también ofrece
lactosa anhidra para una amplia variedad de
aplicaciones
p
farmacéuticas. ¡Optimice
¡ p
su formulación! Los beneficios hablan por
p sí solos.
Y por DuraLac®:
– Perfectamente adecuada para la compresión
directa y formulaciones de granulación seca
– Excipiente
p
de elección para
p
formulaciones con
p
principios
p activos sensibles a la humedad
– Excelente rendimiento de dureza a baja fuerza
de compactación
– Humedad estable debido a la relativamente
baja higroscopicidad
DuraLac® de MEGGLE:
Lactosa anhidra de calidad conocida.
MEGGLE HEAD OFFICE:
www.meggle-pharma.de
service.pharma@meggle.de
Tel.: +49 [0]807 173 476
MEXALC, S.A. DE C.V.
www.mexalc.com
info@mexalc.com
Tel. (52 55) 5616 0668; 5616 1651
Marque en la tarjeta de servicio al lector el No. 17
PT MAYO / JUNIO.indd 41
27/05/13 16:31
Sección Especial: Formas Farmacéuticas Sólidas y Excipientes
Investigación anti-adhesión
PharmTech: ¿Podría decirnos más acerca del proyecto TSAR,
para el cual usted está colaborando con la Universidad de
Nottingham?
I Holland: Desde el lanzamiento de nuestro PharmaCote
en un rango de recubrimientos de punzón y matriz hace más
de cinco años, I Holland ha sido llamado cada vez más para
resolver problemas de adhesión dentro del sector farmacéutico ya que los fabricantes de tabletas se dan cuenta que estos
problemas pueden ser eliminados sin reducir el rendimiento
del producto e invertir en costosos sistemas de estearato de
magnesio. La manera tradicional de resolver un problema de
adhesión sería suministrarle al cliente con una serie de pruebas de herramientas que contienen muchos recubrimientos diferentes de punzones y matrices. Se lleva a cabo un ensayo de
compresión completa en el sitio del cliente para averiguar el
recubrimiento que más efectivamente resolvería el problema
de adhesión. Este enfoque involucra una inversión significativa para el cliente en el herramental así como en tiempo.
El objetivo del proyecto TSAR es desarrollar una herramienta predictiva que nos permita identificar cuál recubrimiento de punzón y matriz es más probable que resuelva estos
problemas de adhesión, eliminando así la necesidad de llevar
a cabo estudios de compresión a escala completa con todos
los recubrimientos anti-adherentes. El desarrollo de la herramienta predictiva no comenzará hasta que hayamos colectado
suficientes datos de interacción de muchos excipientes diferentes e ingredientes activos. Este trabajo está actualmente en
marcha ya que estamos probando varias muestras suministradas por nuestros clientes.
Nuestro objetivo es utilizar las técnicas de análisis multivariado recientemente desarrolladas, vinculadas a química
de superficie en nanoescala y técnicas de morfología tales
como microscopía de fuerza atómica (AFM), tiempo de vuelo secundario a espectroscopía de masas iónica (ToFSIMS),
espectroscopía Raman, mediciones de ángulo de contacto, espectroscopía fotoelectrónica de Rayos X (XPS), microscopía
electrónica de barrido (SEM) y perfilometría con láser. Una
vez que los datos sean colectados, utilizaremos una herramienta de análisis de componentes que nos permita agrupar
los diferentes excipientes/ingredientes activos. Sólo después
de este proceso, podremos iniciar el desarrollo de la herramienta predictiva.
Actualmente estamos a medio camino a través de dos
años de proyecto y gastamos el primer año únicamente en
colectar datos de varios productos suministrados por diferentes clientes. La pieza de equipo más utilizada a la fecha ha
sido la AFM, la cual nos permite mapear cuantitativamente,
a nivel de nanoescala, la adhesión en los punzones de tabletas recubiertos con PharmaCote utilizando partículas simples
de fármaco/excipiente. Las bajas mediciones de la fuerza de
adhesión (nN) colectadas dentro del AFM indican el nivel de
fuerzas de Van der Waals que están presentes. También estamos cambiando la humedad y la temperatura dentro del ambiente de análisis para colectar datos sobre fuerzas capilares
que estén presentes. Sólo cuando todos los ingredientes de la
formulación estén probados se esta forma analítica, moveremos la formulación a un ambiente de producción y comprimiremos las tabletas utilizando el mismo herramental recubierto
con PharmaCote.
Esta revisión en el ‘mundo real’ permite que los resultados del estudio analítico sean verificados en un ambiente de
producción y le da al cliente la seguridad de que están comprando la solución óptima para su problema específico. No se
puede enfatizar lo suficiente en cómo es único cada problema
de adhesión y puede variar significativamente de sitio a sitio,
de tableteadora a tableteadora y de producto a producto, lo
cual hace que las pruebas de compresión de laboratorio sean
vitales.
Referencias
1. Eurostandard Educational Collection 2010 Edition.
2. T. Higgins, Pharm. Tech. 37 (2) 30–31 (2013). PT
“Mejora continua en el recubrimiento de tabletas
y la granulación”
continuación de la pág. 34
mices cónicos ofrecen un alto rendimiento del material y en
bajos valores de velocidad del tamiz. Para evaluar el impacto
de la velocidad del tamiz sobre el tamaño final del gránulo, la
compactación se llevó a cabo en una fuerza de compactación
específica de 10 kN/cm, 2 rpm de velocidad del rodillo y valores cada vez mayores de velocidad del tamiz para un tamaño
de malla (es decir, tamiz raspador de 1.5 mm).
Con velocidades más altas del tamiz, la cantidad de finos se redujo. Esto puede ser explicado por el hecho de que,
con mayor velocidad del rotor, los listones necesitan menos
tiempo para pasar la malla. Ocurre menos fricción durante la
granulación y lleva a una menor cantidad de finos. Por lo tanto, la alteración de la velocidad del tamiz es otra posibilidad
para ajustar la distribución deseada del tamaño de partícula de
los gránulos finales.
Conclusión
Este estudio demuestra la funcionalidad de los nuevos com42
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 42
pactadores de rodillo. Fue posible producir precisamente
una formulación de gránulos de placebo representativa, con
desperdicio de material insignificante durante el arranque del
proceso. Adicionalmente, el estudio muestra que una disposición adecuada del tamiz ofrece la posibilidad de lograr un
tamaño de gránulo deseado alterando el tamaño de la malla y
la velocidad del tamiz.
Referencias
1.
2.
3.
4.
5.
6.
R. Mueller and P. Kleinebudde, Eur. J. Pharm. Biopharm. 64
(3), 388-92 (2006).
R. Mueller et al., Drug. Dev. Ind. Pharm. 36 (2), 234-243 (2010).
R. Mueller and P. Kleinebudde, AAPS PharmSciTech. 28 (1),
E21-31 (2007).
R.W. Miller, Pharm. Technol. 18 (3), 154-162 (1994).
P. Kleinebudde, Eur. J. Pharm. Biopharm. 58 (2), 317-326
(2004).
Y. Teng, Z. Qiu, and H. Wen, Eur. J. Pharm. Biopharm. 73 (2),
219-229 (2009). PT
MAYO / JUNIO 2013
27/05/13 16:31
Sección Especial: Formas Farmacéuticas Sólidas y Excipientes
Dividido
de
Tabletas
Preocupaciones e innovaciones en el dividido y
ranurado de tabletas
Nicholas Eveleigh/Gettyimages
Tecnologías analíticas
PharmTech habló con Tim Freeman de
Freeman Technology; David Beach, asesor
y consultor de tecnología para Accu-Break
Pharmaceuticals; y Thierry Menard, gerente
de laboratorio, y Bruno Villa, presidente,
ambos en Medelpharm, acerca de los retos e
innovaciones en el dividido y ranurado de tabletas.
PharmTech: ¿Cómo ha influido el desarrollo de nuevas tecnologías analíticas los criterios y estándares de calidad para
la uniformidad de dosis unitarias? ¿Los sistemas más precisos han llevado a una mayor focalización en el ranurado de
tabletas?
Freeman (Freeman Technology). El ranurado de tabletas
les permite a los pacientes controlar la dosificación de sus fármacos y podría potencialmente producir ahorros en el costo
para los proveedores de salud. También hace que las tabletas
grandes sean fáciles de tragar. Sin embargo, la producción
de una tableta ranurada indudablemente suma complejidad
al proceso de manufactura. Este tema salió a relucir por la
reciente guía de la FDA sobre el ranurado de tabletas, tanto
para el tableteado general y más específicamente para la manufactura de genéricos.
Aunque un aspecto clave de la división de tabletas ha estado siempre en cómo se distribuye uniformemente el ingrediente activo dentro del producto terminado, es igualmente
importante comprender cómo producir tabletas con la integridad mecánica y propiedades requeridas. Los avances en
las técnicas espectroscópicas, tales como el infrarrojo cercano
(NIR) y la espectroscopia de rotura inducida por láser (LIBS),
significa que es ahora posible analizar la uniformidad de contenido a través de la superficie de una tableta. Adicionalmente, los avances en las técnicas de caracterización de polvos
pueden apoyar en el desarrollo de procesos de manufactura
verdaderamente robustos.
La pobre uniformidad de contenido se atribuye con frecuencia a la dificultad de lograr una mezcla homogénea para
empezar, lo cual puede deberse a que el ingrediente activo
está presente en muy bajos niveles o es cohesivo y propenso
a la aglomeración. Alternativamente, si el API tiene una diferencia significativa en el tamaño de partícula o en la densidad, con los excipientes en la mezcla, puede ser posible la segregación posterior al mezclado. La caracterización dinámica
del polvo puede ayudar a optimizar el proceso de mezclado
(1) y también pronostica la probabilidad de segregación. Esto,
por lo tanto, da un conocimiento real de cómo abordar estos
problemas.
Adicionalmente, los parámetros dinámicos en combinación con el cizallamiento y las propiedades del granel, soportan una comprensión amplia de la conducta del polvo, ya sea
durante el propio proceso de mezclado o cuando se procesa
a través de la tableteadora. Estas propiedades juntas ayudan
a los fabricantes a racionalizar y controlar el desempeño del
polvo durante la descarga desde la tolva, mientras fluye a
través del alimentado y durante el llenado de la matriz. Adicionalmente, proporcionan información relacionada con las
características de compresión de la mezcla, así como a cuantificar la facilidad con la cual el aire es arrastrado y liberado,
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 43
MAYO / JUNIO 2013
43
27/05/13 16:32
Sección Especial: Formas Farmacéuticas Sólidas y Excipientes
los cuales impactan la calidad de la tableta terminada. Esta
información puede ser extremadamente valiosa en asegurar
compatibilidad entre el equipo de proceso seleccionado y las
propiedades de la muestra, una pareja que es crucial para garantizar la uniformidad de contenido en tabletas ranuradas.
PharmTech. Cuando los fabricantes están desarrollando una
tableta diseñada para ser ranurada o subdividida, ¿Qué pruebas
son necesarias para asegurar la estabilidad? ¿Cómo influye el
factor de cumplimiento del paciente en estas decisiones?
Freeman (Freeman Technology): La estabilidad genera
problemas alrededor de las propiedades mecánicas de la tableta, por ejemplo, ¿puede ser partida en dos dosis igualmente
útiles sin desmoronarse, y el producto terminado es estable a
pesar de la ranura? Una vez más, la caracterización del polvo
puede jugar un papel útil aquí en la optimización del producto
y del proceso. Por ejemplo, uno de los factores que influyen la
dureza y friabilidad de la tableta es la consistencia del llenado
de la matriz, lo cual a su vez está impactado por las características de la mezcla de polvo. Incluso si la matriz puede ser
llenada uniformemente a una velocidad de tableteado comercialmente viable, es vital que el aire arrastrado sea rápidamente liberado durante la compresión y la compactación, ya
que la retención puede ocasionar laminación y la formación
de casquillos. La retención es especialmente un problema
para las tabletas más grandes que tienen más probabilidad
de ser ranuradas. La capacidad de la mezcla para liberar aire
puede ser cuantificada utilizando parámetros tales como permeabilidad y a través de caracterización dinámica de polvos
aireados. Finalmente, la respuesta del polvo a la compresión
puede ser medida directamente vía el análisis de compresibilidad. En resumen, la amplia caracterización multifacética del
polvo soporta el desarrollo de formulaciones optimizadas y
de procesos más exactos, los cuales ambos se requieren para
producir tabletas ranuradas bien construidas, mecánicamente
estables que son fáciles de usar por los pacientes.
PharmTech: La FDA está actualmente trabajando en un
proyecto de guía para el ranurado de tabletas. Si se implemen-
La mayor atención por parte
de la FDA intensifica la
necesidad de un enfoque
riguroso para el desarrollo de
tabletas. — Tim Freeman
ta, ¿Cómo podría afectar dicha guía los enfoques analíticos
para las tabletas ranuradas, tanto en términos de nuevos desarrollos como en demandas de la industria?
Freeman (Freeman Technology): La mayor atención por
parte de la FDA en las tabletas ranuradas intensifica el requerimiento para que los fabricantes adopten un riguroso esquema de calidad por diseño (QbD) a sus procesos de desarrollo.
Los esquemas analíticos que pueden llevar a una mejor comprensión de los parámetros críticos para la calidad, tales como
la uniformidad de contenido y la estabilidad mecánica, como
se señaló antes, son, por lo tanto, probables que se vuelvan
44
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 44
Cómo está abordando la USP las dosis divididas
La Convención de la Farmacopea de EUA (USP) está examinando
el tema de la uniformidad de dosis unitarias para determinar si el
ranurado produce dosis divididas consistentes. Anthony DeStefano,
PhD, vicepresidente senior de capítulos generales y estándares de
calidad para la salud en la USP, da un panorama general del trabajo de
la USP en esta área.
PharmTech: Tenemos conocimiento de que la USP está examinando
el tema de la uniformidad de dosis unitarias para determinar si el
ranurado produce dosis divididas consistentes y como puede ser mejor
evaluada la estabilidad y la friabilidad de las tabletas divididas. ¿Cuál
es el estatus del trabajo de la USP sobre este tema? ¿Cuáles son los
objetivos clave?
DeStefano: Existe un proyecto de guía de la FDA que discute los
temas del ranurado de tabletas desde una perspectiva de calidad
por diseño, con un enfoque en lo que necesitan hacer los fabricantes
para demostrar que una tableta ranurada puede ser etiquetada como
‘funcionalmente ranurada’. La USP está interesada en desarrollar
un capítulo general que proporcione una prueba que como mínimo
definiera las especificaciones post-comercialización, tales como
requisitos de variación de peso, para demostrar que una tableta está
funcionalmente ranurada.
PharmTech: ¿Está la USP considerando armonizar su potencial nuevo
capítulo sobre este tema con los requerimientos propuestos por la
Farmacopea Europea (Farm.Eur.)?
DeStefano: La USP está analizando la posibilidad de desarrollar un
capítulo general que trate con el ranurado de las tabletas. El comité de
la USP que desarrolla este capítulo utilizó la información disponible de
la Farmacopea Europea como punto de inicio para sus deliberaciones.
PharmTech: ¿De qué desafíos está consciente la USP con respecto
al ranurado de tabletas para el desarrollo de fármacos y la industria de
manufactura?
DeStefano: La USP ha publicado un artículo de estímulo en el Foro
Farmacopeico 35 (6) (2009), el cual recibió comentarios mezclados
con preocupaciones de una amplia audiencia que incluía fabricantes,
asociaciones de profesionistas y profesionales académicos. La
prevalencia de la división de tabletas fue reconocida como un hecho
y las observaciones fueron por lo general de apoyo a los esfuerzos
de la USP para establecer estándares para las tabletas ranuradas
y la conveniencia de dividir las tabletas. Un punto en común era
que la capacidad para subdividir una tableta está implicada por la
ranura. El estándar de la Farm.Eur. sobre el ranurado de tabletas
está visto como un buen comienzo con la posibilidad de mejora. Se
expresaron inquietudes de que sin evidencia de que el fármaco esté
uniformemente distribuido a través de la tableta, el uso del peso para
evaluar la calidad de las porciones de la tableta dividida puede no ser
adecuado.
cada vez más importantes. Las propiedades que pronostican
el desempeño del mezclado y cómo se comportará la mezcla
posteriormente en la tableteadora son especialmente valiosas.
Por ejemplo, volviendo al tema del arrastrado y liberación del
aire, los polvos para proceso con baja permeabilidad a velocidades altas pueden finalmente llevar a la acumulación de aire
atrapado en el polvo en todas las etapas del tableteado, debido
a las rápidas velocidades de flujo del polvo y el reciclado. El
MAYO / JUNIO 2013
27/05/13 16:32
resultado neto es una degradación eventual en la calidad de
la tableta. Esta es sólo una de muchas ilustraciones de cómo
los datos de las propiedades del polvo pueden ayudar a los
procesadores a tomar decisiones bien pensadas acerca de cuál
equipo usar y a que índices de producción apuntar para una
manufactura eficiente de tabletas ranuradas.
Retos comunes
PharmTech: ¿Cuáles son los retos comunes involucrados en
la formulación, manufactura y análisis de tabletas ranuradas?
Medelpharm: Es desafiante para los fabricantes de fármacos identificar una fórmula robusta que cree la dureza correcta
y satisfaga los requerimientos de calidad para el dividido. Ser
capaz de seleccionar rápidamente es clave con el fin de probar
muchas fórmulas, formatos y opciones. El reto aquí es realizar pruebas rápida y eficientemente.
Dosis unitarias
PharmTech: ¿Qué tan fácil es para los fabricantes de tabletas
tradicionales asegurar que las dosis unitarias de tabletas subdivididas caen dentro de los criterios aceptados de la USP, la
Farm.Eur. y otros documentos guía?
Beach (Accu-Break): Tradicionalmente, las ranuras en las
tabletas han sido aplicadas más como una característica estética/de comercio que con la expectativa de algún propósito funcional. Con la llegada de los cambios regulatorios que
empezaron primero en Europa y ahora también propuestos
en EUA, el ranurado funcional de las tabletas ha tomado un
La precisión y la confiabilidad
son incluso más críticas que lo
habitual cuando se producen
tabletas ranuradas. —
Medelpharm
nuevo significado y ha colocado requerimientos adicionales
en los fabricantes de desean comercializar tabletas con una
ranura. El logro de los requerimientos actualmente establecidos para tabletas ranuradas funcionalmente no es un asunto
sencillo para los fabricantes de tabletas porque el diseño de la
tableta, los procesos y los análisis esperados de la forma farmacéutica terminada han todos tomado nuevas complejidades. Los datos deben ahora demostrar que la ranura resulta en
una fracción de la forma farmacéutica completa que cumple
los mismos requerimientos que la tableta intacta o sin ranura. Este requerimiento ha colocado requerimientos de análisis
adicionales en estos fabricantes que desean tener tabletas funcionalmente ranuradas. Asuntos tales como uniformidad de
contenido del segmento, friabilidad de los segmentos de la
tableta, desempeño de la disolución in vitro y estabilidad de
los segmentos de la tableta fracturada deben todos ser investigados y documentados como parte del desarrollo.
Medelpharm: La uniformidad de contenido es incluso más
crítica con una dosis que se hace más pequeña y una varianza
en el peso ya elevada debido a las tabletas divididas. Esta va-
rianza añade más presión en el escalamiento y la formulación,
requiriendo procesos más robustos.
Medelpharm, por ejemplo, hizo algunos experimentos
para un cliente con herramental de forma progresiva donde
examinamos la forma ideal (ángulo o indentación), así como
la ranuración simple o de dos lados y los beneficios de usar
una tableta con “cintura estrecha”. Produciendo pequeños lotes a velocidad de producción, fuimos capaces de pronosticar
cuáles pares superiores o inferiores de punzones y la selección de la matriz, producían las mejores tabletas para cumplir
los requerimientos regulatorios. Al mismo tiempo, probamos
la eficiencia de las matrices conformadas y de diferentes puntas de punzón para encontrar el mejor compromiso entre la
aceptación de calidad y los costos del herramental.
Sin embargo, cumplir los requisitos es difícil, ya que las
guías de calidad toman en cuenta la acción humana en la rotura de la tableta. Y, como todos sabemos, el proceso regulatorio definido para romper una tableta es rara vez seguido en
la vida cotidiana.
PharmTech: Para asegurar que las tabletas pueden ser divididas equitativamente con buena uniformidad de contenido de la dosis, ¿Qué factores necesitan tomar en cuenta los
fabricantes?
Medelpharm: Como siempre, el monitoreo y el conocimiento de los parámetros críticos clave son cruciales para la
calidad. Durante la investigación y desarrollo de la etapa de
compresión, es importante utilizar las herramientas de producción finales (punzones), usar parámetros de compresión
similares que durante la producción (p.ej., fuerzas, ciclo/velocidad de compresión y pre-compresión) y el uso de sistemas
similares de regulación del peso para controlar la homogeneidad del llenado y del peso. Diferentes fuerzas o velocidades
de compresión entre investigación y desarrollo y producción
crearán diferente dureza y densidad dentro de las tabletas, lo
cual impactará la disolución y el rompimiento.
El flujo de polvo en los sistemas de alimentación y dentro
de la tableta durante la compresión, es otro parámetro que
debería ser medido. Los simuladores de tableteadoras de producción de alta velocidad pueden monitorear estos parámetros.
División de tabletas no ranuradas
PharmTech: ¿Cuáles son los problemas o riesgos asociados con
la división de tabletas no ranuradas, especialmente si tienen
recubrimiento pelicular o tabletas de liberación modificada?
Beach (Accu-Break): La división de tabletas no ranuradas está plagada de incertidumbre, sin importar el método
de división involucrado. Las tabletas no ranuradas no están
diseñadas para ser subdivididas en dosis parciales confiables
y consistentes, y con frecuencia resultan en partes astilladas
son pérdida de masa significativa. La división de tabletas con
recubrimiento pelicular no ranuradas o de tabletas de liberación modificada, en la mayoría de los casos resultará no sólo
en una dosis del medicamento inexacta, sino podría también
tener otros efectos indeseables. En el caso de tabletas con
recubrimiento pelicular, particularmente si el recubrimiento
pelicular es funcional (p.ej., un recubrimiento entérico), el
contenido de la tableta podría hidrolizarse en el estómago,
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 45
MAYO / JUNIO 2013
45
27/05/13 16:32
Sección Especial: Formas Farmacéuticas Sólidas y Excipientes
resultando en una profunda degradación del fármaco. Similarmente con las tabletas de liberación modificada, la fractura
de la tableta intacta podría resultar en un perfil de liberación
marcadamente más rápido de los segmentos rotos y la producción de efectos colaterales indeseados debido a la absorción
demasiado rápida del contenido de la tableta. En general, las
tabletas no ranuradas, con recubrimiento pelicular deben tragarse enteras para evitar efectos no deseados.
Medelpharm: Los principales riesgos son:
• Control de la dosis del API. El riesgo de pedazos y
fragmentos disparejos con dosis variables es muy
alto en comparación con las tabletas ranuradas. Los
riesgos se miden en procesos de aseguramiento de la
calidad de acuerdo a las farmacopeas.
• Modificación de las características de liberación
temporizada. Estas características pueden, en algunos casos, destruirse totalmente cuando se rompe una
tableta.
Para reducir los riesgos y asegurar la QbD en tabletas
multicapa diseñadas especialmente para ser divididas sin
marcas de ranura, tienes que crear tabletas que sean prototipos reales de producción y navegar por el comportamiento en
el espacio de diseño completo utilizando tableteadoras robot
como el STYL’ONe.
PharmTech: ¿Qué tan diferente es el proceso de tableteado
para tabletas ranuradas en comparación con tabletas no ranuradas en términos de la tecnología y equipos involucrados,
control de calidad y protocolos de aseguramiento de calidad,
y requerimientos de análisis de estabilidad?
Medelpharm: La precisión y la confiabilidad son incluso
más críticas que lo acostumbrado cuando se producen tabletas
ranuradas. La sensibilidad a la varianza se incrementa en los
procesos de escalamiento hacia arriba, así como en la producción de tabletas. Es importante tomar nota de lo siguiente:
• Antes de la compresión, es crucial asegurar que los
procesos están en el sitio para evitar mal mezclado,
segregación y sobre-lubricación; problemas clásicos
durante el procesado.
• Durante la compresión, debe haber control más estrecho de la regulación y reglas de rechazo.
• La uniformidad de masa y el llenado son parámetros
importantes. El diferente peso o el llenado disparejo
crea diferente dureza, la cual a su vez impacta la friabilidad y la calidad de la rotura, así como el llenado
disparejo.
El diseño del herramental es, desde luego, crucialmente
importante y la simulación por computadora puede proporcionar información sobre la línea de estrés dentro de las tabletas.
Sin embargo, sólo los estudios de tabletas reales, en oposición a los modelos virtuales, en una tableteadora completamente industrial como el STYLCAM o el STYL’One pueden
proporcionar datos y resultados rápidamente. Para limitar
más el riesgo, un ‘robot de tableteado’ como un STYL’One
puede navegar por el espacio de diseño y ayudar a seleccionar
rápidamente el diseño ideal del punzón y los parámetros de
producción.
46
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 46
Enfoque de la Farm.Eur. de la división de tabletas
El capítulo 2.9.40 de la Farmacopea Europea (Farm.Eur.) es el
requerimiento vinculante para la uniformidad de dosis. Recientemente,
se ha creado un capítulo adicional, el 2.9.47, titulado “Demostración
de Uniformidad de Dosis Unitarias utilizando Tamaños de Muestra
grandes”. PharmTech habló con Susanne Keitel de la Comisión de la
Farmacopea Europea acerca del capítulo alternativo.
PharmTech: ¿Cómo se enfocan las tabletas ranuradas en la FarmEur.?
Keitel: El capítulo general, ‘Uniformidad de Dosis Unitarias’, tiene
que ver con tabletas intactas y no incluye criterios de aceptación para
tabletas ranuradas. Sin embargo, la Comisión de la Farm.Eur. decidió
incluir requisitos sobre la uniformidad de tabletas ranuradas en la sección
de ‘Producción’ de la monografía general de Tabletas hace varios años.
La sub-sección ‘Subdivisión de Tabletas’ describe cómo debe probarse la
uniformidad de las tabletas ranuradas y define los criterios de aceptación.
Estos requisitos fueron establecidos en colaboración cercana con las
autoridades de los estados miembros de la Farm.Eur.
PharmTech: La Farmacopea Europea ha creado un capítulo
alternativo adicional, el 2.9.47, ¿Puede decirnos más?
Keitel: El capítulo 2.9.40 (uniformidad de dosis unitarias) de la
Farmacopea Europea, está basado en el texto armonizado con la
Farmacopea de EUA y la Farmacopea Japonesa en el contexto del Grupo
de Discusión Farmacopeico (PDG), y esto permanecerá como el requisito
vinculante. Recientemente, sin embargo, la Comisión de la Farm.Eur.
creó un capítulo alternativo adicional 2.9.47 titulado ‘Demostración
de Uniformidad de Dosis Unitarias utilizando Tamaños de Muestra
grandes’, el cual pretende, aunque no está limitado a, la evaluación de
productos medicinales que son fabricados utilizando metodología de
tecnología analítica de proceso (PAT). El cumplimiento con el capítulo
general 2.9.40 Uniformidad de Dosis Unitarias, puede ser demostrado
utilizando los procedimientos descritos en el capítulo 2.9.47. Este nuevo
capítulo fue publicado en octubre del 2012 en el suplemento 7.7, y
entrara en vigor en abril del2013.
El capítulo les permite a los solicitantes usar la información obtenida
durante la producción de tabletas, como la proveniente del análisis en
línea por infrarrojo cercano, para evaluar la uniformidad de contenido
del lote. La información de respaldo en este nuevo capítulo y la
justificación pueden encontrarse en artículos adicionales (1, 2).
PharmTech: ¿Cómo puede reducirse el gran número de unidades
desviadas y qué guía sobre el proceso de tableteado como un todo
puede usted ofrecer a los fabricantes de tabletas ranuradas?
Keitel: La uniformidad de tabletas ranuradas depende de la
formulación de la propia tableta, incluyendo su geometría y dureza y la
geometría de la línea de rotura. Por lo tanto, necesita ponerse atención
específica a la ranuración durante el desarrollo de la formulación y del
proceso de manufactura. Este proceso es un ejemplo de la calidad por
diseño: la ranuración necesita construirse dentro de la tableta. Esto está
también reconocido por la Farm.Eur., y los reguladores de la UE ya que
la demostración de la uniformidad de medias tabletas sólo se requiere
durante el desarrollo y no como prueba de liberación de rutina.
Referencias
1.
1.
O. Holte and M.Horvat, Pharmeuropa 23.2., 286–293 (2011)
O. Holte and M. Horvat, Pharm Technol. 36 (10) 118–122 (2012).
MAYO / JUNIO 2013
27/05/13 16:32
Desafíos regulatorios
PharmTech: Con la división de tabletas ganando mayor atención de la FDA y otros reguladores, ¿Cuáles serán los desafíos
para los fabricantes de tabletas?
Beach (Accu-Break): El desafío para los fabricantes de tabletas farmacéuticas con la llegada de las nuevas regulaciones
es demostrar que sus productos cumplen o exceden los requisitos propuestos. Este desafío sólo puede ser cumplido por
el cliente que diseña la formulación y el herramental de las
tabletas para cumplir el análisis re querido de los segmentos
de la tableta dividida después del rompimiento de la misma.
Para aquéllos fabricantes deseosos de etiquetar un producto
como ‘funcionalmente ranurado’, las nuevas regulaciones requerirán más diligencia durante el desarrollo del producto, la
generación de datos apropiados para darle a los reguladores
la confianza para aprobar las tabletas ‘funcionalmente ranuradas’, y el análisis continuo mejorado después de la aprobación para demostrar que el producto ‘funcionalmente ranurado’ continúa, en la fabricación comercial, para cumplir las
especificaciones requeridas.
Casi la mitad de todos los estadounidenses de más de 55
años están tomando al menos un fármaco de prescripción, y el
25% de los mayores de 55 años están tomando cuatro o más
fármacos de prescripción. La demografía de ancianos en su
conjunto es responsable de aproximadamente el 30% de las
prescripciones emitidas en los EUA. La necesidad para la flexibilidad de las dosis, especialmente dentro de esta demografía es indiscutible. Reconocemos una paradoja en la industria
farmacéutica: aunque que la flexibilidad de la dosis es claramente importante, la mayoría de los fabricantes no están comercializando formas farmacéuticas que permitan ajustes de
dosis fácil y exactamente. La gran mayoría (estimada como
mayor del 85%) de formas farmacéuticas orales fueron comercializadas ya sea como tabletas no ranuradas o como cápsulas.
Muchas de las tabletas ranuradas restantes con frecuencia por-
Las nuevas regulaciones requerirán
más diligencia durante el desarrollo
del producto. —David Beach
tan una ranura cosmética que indica la mitad de la tableta, pero
esa ranura ha demostrado ser escasamente funcional.
La Unión Europea reconoció la necesidad del ranurado
funcional desde hace una década e implementó la Monografía
0478 de la Farmacopea Europea. En EUA, la necesidad de un
ranurado eficaz y consistente de las tabletas ha llegado recientemente a un centro de atención con la publicación de la USP
de Estándares Farmacopeicos para las Características de Subdivisión de Tabletas Ranuradas, y la guía de la FDA titulada
Guía para la Industria, Ranurado de Tabletas: Nomenclatura,
Etiquetado y Evaluación de Datos.
Nuestras tecnologías Accu-Break fueron diseñadas para
crear dosis farmacéuticas que pueden subdividirse fácilmente
a mano en dosis exactas más pequeñas. En el desarrollo de
varias tecnologías, nos enfocamos en el apego a los siguientes
parámetros para nuestras tabletas:
•
Las tabletas deben dividirse en dosis parciales exactas, incluyendo ¼ de dosis si se desea.
• Las dosis parciales deben pasar la uniformidad de
contenido.
• Las tabletas deben ser fáciles de romper por los pacientes.
• Las tabletas y las dosis parciales deben pasar la friabilidad, la disolución y las pruebas de estabilidad.
• La tableta intacta debe ser ingerible (es decir, no demasiado grande).
• El costo de la producción unitaria por tableta debe ser
comparable al de las tabletas convencionales.
• Las formulaciones de liberación controlada y el recubrimiento pelicular deben ser una opción.
Hemos desarrollado dos distintas tecnologías de tableta
multicapa, conocidas como ‘Accu-B’ y ‘Accu-T’, las cuales
ambas incorporan una capa sin fármaco estratégica que sirve
como capa de rotura dentro de las tabletas:
Con la tecnología Accu-B, la forma farmacéutica tiene dos
capas, una de las cuales no tiene fármaco. La segunda capa
contiene fármaco y está profundamente ranurada. La capa sin
fármaco proporciona varias características únicas: la primera
y principal, dada la profunda ranura en la capa del fármaco, la
capa sin fármaco forma una columna vertebral que le da a la
forma farmacéutica terminada la fuerza mecánica para soportar las operaciones de acondicionado y embarque. La segunda, la capa sin fármaco es el plano de fractura para la tableta
Accu-B. La tableta puede romperse a través de la ranura, y la
fractura ocurre en la capa sin fármaco. En comparación con
una tableta ranurada convencionalmente, el diseño de bicapa
Accu-B asegura la exactitud de la dosis parcial y elimina las
preocupaciones sobre la pérdida de masa. Las tabletas ranuradas pueden también satisfacer los requerimientos de análisis
y datos tanto para la Monografía 0478 de la Farm.Eur. como
la nueva guía de tabletas ranuradas de la FDA.
Nuestra tecnología Accu-T utiliza hasta cinco capas en
una tableta ‘más alta que ancha’, y la incorporación de capas
sin fármacos sirve a uno de dos propósitos:
Se incorpora una capa de rompimiento sin fármaco dentro
de la mitad de una tableta Accu-T y se usa para separar las
capas que contienen el fármaco. Como las capas que contienen el fármaco están físicamente localizadas en la parte de
‘arriba’ y en el ‘fondo’ de esta tableta más alta que ancha, el
rompimiento de la tableta a través de la capa media de placebo separa la dosis en mitades exactas.
La capa sin fármaco proporciona una barrera física entre
los ingredientes activos. Esta barrera permita la formulación
de activos incompatibles sin preocupaciones acerca del comezclado y los problemas resultantes de estabilidad física o
química. La tecnología utiliza maquinaria que puede producir
tabletas con hasta cinco capas comprimidas de manera que el
uso de más de una capa sin fármaco puede facilitar una “poli
píldora” con tres diferentes formulaciones conteniendo APIs.
Referencias
1.
Freeman Technology, Blending white paper, http://www.
freemantech.co.uk/en/literature-and-downloads/articles-andwhite-papers.html#white-papers PT
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 47
MAYO / JUNIO 2013
47
27/05/13 16:32
RESOLUCIÓN DE PROBLEMAS
glowimages/GETTY IMAGES
Equipo y Proceso
Resolución de problemas de
tableteo y herramental
Trevor Higgins
La adopción de un proceso de siete pasos para
el mantenimiento y el almacenamiento mejora la
calidad del tableteado.
L
os problemas en la manufactura de las tabletas y las
fallas del herramental de las
mismas son generalmente el
resultado de uno o de una combinación
de lo siguiente:
• Producto/gránulo difícil
• Diseño inapropiado de la tableta
• Preparación y operación incorrecta de la tableteadora
• Mantenimiento inadecuado de
la tableteadora
• Pobre condición del herramental de las tabletas.
La pobre condición del herramental,
en particular, puede causar muchos
problemas. Sin embargo, estos problemas pueden minimizarse o eliminarse,
adoptando un proceso simple, de siete
pasos, de cuidado del herramental. El
proceso de siete pasos es un esquema
lógico, planeado y profesional para el
mantenimiento y el almacenamiento del
herramental que ha sido adoptado por
muchas compañías alrededor del mundo como un procedimiento estándar de
operación (PNO).
El proceso de siete pasos
1. Limpiar. Cuando el herramental se
retira de la tableteadora, debe ser perfectamente limpiado y secado para eliminar cualquier aceite o residuo de producto, especialmente de áreas difíciles
de alcanzar (p.ej., ranuras y relieves).
El equipo utilizado para este proceso
Trevor Higgins
es técnico experto en I Holland, tel. 44 0 115
9726153, email@iholland.co.uk
48
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 48
podría incluir limpieza ultrasónica y
procesos de lavado automatizado. Es
esencial, sin embargo, que el proceso
no cause corrosión del material del herramental y para este fin, debe utilizarse
un inhibidor de la corrosión.
2. Evaluar. Los punzones y las matrices deben ser inspeccionados visualmente bajo aumento en busca de señales
de daño, desgaste o corrosión y validar
el proceso de limpieza. Esta evaluación
establecerá si el proceso de producción
está corriendo bien o no. La evaluación
también dará pistas para problemas con
la tableteadora o el propio herramental
e indicará si se requiere algún mantenimiento del herramental. El equipo
típico incluye lentes de alto aumento y
microscopios.
3. Reparar. El desgaste ligero de la
superficie, la corrosión y el daño en
el herramental pueden ser reparados y
pulidos hasta una condición utilizable.
Las puntas desgastadas pueden resultar
en tabletas de pobre calidad e inferior
definición del grabado, lo que puede
llevar a laminado y pegoteado. Equipo tal como el mandril motorizado y
el motor de pulido de doble extremo
se usa junto con accesorios de pulido.
La reparación debe llevarse a cabo por
técnicos de mantenimiento bien entrenados y experimentados para asegurar
que el herramental no se salga de los
límites de tolerancia. La reparación no
debe realizarse en herramental con recubrimiento ya que esto puede eliminar
el recubrimiento del punzón.
4. Medir. La medición es esencial
después de la reparación para asegurar
que se han mantenido las dimensiones
cruciales del herramental dentro de una
tolerancia de trabajo aceptable. El equipo para medir puede ir desde simples
micrómetros manuales, calibradores
vernier, y medidores de altura hasta sistemas de medición semi-automáticos,
computarizados, digitales. La medición
debe llevarse a cabo a intervalos regulares, incluso si no ha sido necesaria la
reparación, para verificar el desgaste
natural durante el proceso de compactación. La medición esencial es la longitud de trabajo crítico del punzón, ya
que éste controla el espesor, el peso y la
dosis de la tableta.
5. Pulido. Un pulido ligero, controlado, de manera frecuente, asegurará
que el herramental se mantenga con un
terminado liso, ayudando a maximizar
la vida del herramental y a reducir problemas tales como el pegoteo y el laminado. El pulido manual, para remediar,
puede ser realizado utilizando motores
de pulido con doble extremo con ruedas
para pulir de nylon y compuestos abrasivos finos. Un proceso más controlado
y consistente es el sistema de pulido por
arrastre, automatizado, el cual se apoya
menos en la habilidad y experiencia del
operador. Este también permite que se
pulan hasta 70 punzones en un ciclo de
20 minutos, proporcionando así aumento de la eficiencia. No se requiere volver
a limpiar después del pulido siempre y
cuando se use un medio y pasta para
pulido de grado alimenticio durante esta
operación.
6. Lubricar. La lubricación es importante para proteger el herramental
MAYO / JUNIO 2013
27/05/13 16:32
y ayudar a que la operación sea suave.
Puede recomendarse un rango de aceites y grasas para las diferentes aplicaciones.
7. Guardar. El almacenamiento y el
transporte del herramental deben estar
específicamente diseñados para minimizar el daño y el deterioro. Existen
diferentes maneras de guardar el herramental de las tabletas de manera segura
y confiable; esto va desde los gabinetes
para almacenamiento hasta contenedores de almacenamiento diseñados a la
medida. Cualquiera que sea el sistema
adoptado, es importante que el herramental esté separado para evitar contacto y que la condición del herramental no
se deteriore durante el almacenamiento.
La aplicación del proceso en siete
pasos tendrá un impacto directo sobre
la reducción de muchos problemas comunes de las tabletas y el herramental,
resultando así en una tableta de mejor
calidad, y puede proveer un ahorro del
costo directo para el fabricante de tabletas.
Figura 1. Típico daño a un borde
delicado de la punta del punzón
Figura 3. Típico anillado del
hueco de la matriz
Figura 2. Típico desgaste del
cabezal
Figura 4. Pegoteado (es decir, el
producto se adhiere a la cara de
la punta del punzón)
all figures are courtesy of the author.
Aplicación del proceso a los
problemas del tableteado
Pueden identificarse problemas comunes y resolverse utilizando el proceso
de siete pasos.
Daño en el borde de la punta del punzón. Los bordes de la punta del punzón
son muy delicados y el daño en la forma
de rasguños y abolladuras pueden causar rebabas y astillas de vez en cuando
(ver Figura 1). Estos defectos pueden
llevar a fallas más serias, tales como la
rotura de la punta del punzón. La experiencia nos dice que aproximadamente
el 80% del daño a los punzones y matrices es generalmente causado de manera
accidental cuando se manejan los punzones durante los procesos de producción y cuidado del herramental. El daño
puede ocurrir, por ejemplo, cuando se
carga o se descarga el herramental en
la tableteadora, durante el almacenamiento o mientras se limpia o se pule
el herramental. Adoptando los Pasos
1 (Limpiar) y 2 (Evaluar) del proceso
de siete pasos, puede identificarse este
tipo de daño y, repitiendo la evaluación
a lo largo del proceso, podemos reconocer las causas principales. Si el daño
es sólo ligero, puede ser posible usar el
Paso 3 (Reparar) para reparar el daño,
removiendo las rebabas y volviendo a
pulir los bordes de la punta hasta una
condición buena utilizable, asegurando
así una apariencia consistente de la tableta.
Desgaste del cabezal. Las áreas del
punzón que están en contacto con otras
partes de la tableteadora y que están
sujetas a fuerzas de fricción y compactación a alta velocidad son típicamente
propensas al desgaste. Un ejemplo es el
cabezal “de permanencia” plano, el cual
está en contacto con los rodillos de precompresión y compresión principal (ver
Figura 2). Debe investigarse el desgaste
prematuro. El desgaste puede atribuirse a varias causas, pero comúnmente
se debe a lo ajustado del punzón y/o
a una pobre lubricación. Nuevamente,
esto puede identificarse durante el Paso
2 (Evaluar). Cualquier desgaste ligero
puede eliminarse con un pulido de remedio mediante el Paso 3 (Reparar). El
pulido debe ser seguido de la medición
de la longitud de trabajo crítica durante
el Paso 4 (Medir) asegurando así que
los punzones están dentro de un rango
de tolerancia aceptable para un buen
peso de la tableta y control del espesor.
El desgaste del ángulo del cabezal de
la leva puede también ser el resultado
de punzones apretados o de carencia de
lubricación y este desgaste puede también ser monitoreado y reparado como
se indicó anteriormente.
“Resolución de problemas de tableteo y
herramental”
continúa en la pág. 59
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 49
MAYO / JUNIO 2013
49
27/05/13 16:32
RESOLUCIÓN DE PROBLEMAS
glowimages/GETTY IMAGES
Equipo y Proceso
Esterilización con Dióxido de Nitrógeno
Evan Goulet
La esterilización a temperatura ambiente utilizando gas de
dióxido de nitrógeno beneficia a los fármacos parenterales.
Evan Goulet, PhD,
es gerente de aplicaciones técnicas en Noxilizer,
Baltimore, MD, info@noxilizer.com.
50
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 50
de vapor saturado. Debido a esto, no es
probable que ocurra la condensación
del esterilizante, incluso en geometrías
complicadas. No se requiere el calentamiento de la cámara de esterilización de
NO2 para mantener la fase gaseosa del
esterilizante, lo cual permite que la esterilización y aireación se lleven a cabo
a temperatura ambiente. Sin embargo,
tanto el EO como el H2O2 requieren
algún grado de calentamiento, lo cual
puede resultar en la desestabilización de
productos sensibles.
Los empaques esterilizados pueden ser
manejados inmediatamente después
del ciclo (Noxilizer, Esterilizador
Industrial de Dióxido de Nitrógeno RTS
360).
No se requiere el calentamiento de la cámara de
esterilización con dióxido
de nitrógeno.
La esterilización con NO2 proporciona
una rápida y efectiva inactivación de
formas tanto vegetativas como de esporas de bacterias. Esta rápida letalidad
permite un nivel de aseguramiento de
la esterilidad de 10-6 a ser alcanzado en
un ciclo con un tiempo típico de puerta
a puerta de 60 - 120 minutos, minimizando así el tiempo que está expuesto
el producto farmacéutico a temperatura ambiente. No existe una fase de
preacondicionado y la aireación del
esterilizante residual del producto está
incluida en el tiempo de ciclo global.
El NO2 es compatible con muchas de
las opciones de empaque de barrera
estéril en el mercado, como los sobres
de Tyvek y charolas de plástico con tapas de Tyvek. Como el NO2 es un esterilizante de superficie, el gas requiere
acceso al producto, lo cual es proporcionado por el Tyvek respirable. La
esterilización con NO2 típicamente se
llevaría a cabo en el empaque primario,
y cualquier instrucción para el uso sería
incluida en el empaque secundario.
El NO2 esterilizante, aunque es un gas
tóxico, no es carcinogénico y no es inflamable, lo que lo hace atractivo como
una opción para llevar la esterilización
al piso de manufactura para los fabricantes de mayores volúmenes. La esterilización doméstica ofrece ahorros
potenciales en términos de los costos
de transporte e inventario que se arrastran, asociados con la esterilización por
contrato. La esterilización puede colocarse en línea entre las operaciones de
empacado primaria y final. Para los fabricantes cuyos volúmenes no son suficientemente grandes para justificar una
esterilización en el sitio, pero quienes
requieren esterilización a temperatura
ambiente, la esterilización con NO2 por
contrato es una opción. PT
IMAGE COURTESY OF THE AUTHOR.
E
l gas de dióxido de nitrógeno (NO2) puede darles a los
fabricantes de productos farmacéuticos parenterales con
medios de esterilización verdaderamente a temperatura ambiente de las superficies exteriores de los contenedores de
fármacos para una sola dosis que están
destinados a usarse en un campo estéril.
Otras opciones de esterilización como
el óxido de etileno (EO), el peróxido de
hidrógeno (H2O2) y la radiación, pueden
exponer a los productos farmacéuticos a
temperaturas elevadas durante tiempos
extendidos o penetrar el contenedor y
los sistemas de cierre. Ambos escenarios pueden afectar adversamente los
productos farmacéuticos o los biológicos, especialmente aquéllos que tienen
estabilidad limitada a temperaturas elevadas. El NO2 es compatible con muchos
de los materiales que son comunes a los
contenedores de fármacos parenterales
y sistemas de cierre, incluyendo vidrio,
copolímeros de olefinas cíclicas (COC),
polipropileno, hule silicón, elastómeros
termoplásticos y hules farmacéuticos.
Como esterilizante de superficie, el NO2
no penetra los contenedores o sistemas
de cierre durante el proceso de esterilización, dejando el producto farmacéutico no afectado.
El NO2 posee algunas propiedades químicas y físicas específicas que lo posicionan bien para usar como esterilizante
para productos farmacéuticos parenterales sensibles a la presión y temperatura. Como hierve a 21°C, el esterilizante
NO2 puede introducirse dentro de la cámara con mínimo o ningún vacío. La esterilización se lleva a cabo típicamente
utilizando concentraciones de NO2 que
están en el rango de 1-2% de la presión
MAYO / JUNIO 2013
27/05/13 16:32
Síntesis
y
M anufactura
de
A pis
Logrando la
Estereoselectividad en la
Síntesis Asimétrica
Patricia Van Arnum
Los investigadores utilizan catalizadores
inorgánicos como una alternativa a los
biocatalizadores, en la conversión selectiva
de azúcares para producir bloques de
construcción quiral.
L
a química quiral juega un papel significativo en el desarrollo de intermedios farmacéuticos y APIs, y como tal, los
avances en la síntesis asimétrica son de
valor para las compañías farmacéuticas.
Los investigadores de la academia y la
industria continúan desarrollando nuevas rutas para lograr la enantioselectividad deseada.
Evaluando la oportunidad
El mercado global para la tecnología
quiral, inclusive de las aplicaciones en
farmacéuticos, se espera que muestre
un crecimiento moderado durante los
próximos cinco años. El mercado global de tecnología quiral tuvo un valor
cercano a los $ 5,300 mdd en el 2011,
de acuerdo a un análisis reciente de
BCC Research. Se espera que este
Patricia Van Arnum
es editora ejecutiva de
Pharmaceutical Technology,
485 Route One South, Edif.
F, Primer Piso, Iselin, NJ
08830, tel. 732.346.3072,
pvanarnum@advanstar.com,
twitter@PharmTechVArnum
mercado aumente a una tasa de crecimiento anual compuesto (CAGR) de
6.5% desde el 2011 hasta el 2016 y se
aproximará a $7,200 mdd para finales
del período previsto. Los productos de
la síntesis quiral representaron la mayoría del mercado de tecnología quiral
en 2010, con un 80% de participación
(es decir, $ 3,900 mdd en ingresos).
Este segmento del mercado se estimó
en $4,200 mdd en 2011 y se espera
que sea de $5,700 mdd para el 2016,
una CAGR de cinco años de 6.4% de
acuerdo a BCC. El mercado del análisis
quiral fue valorado en $785.7 mdd en
2010 y creció a $839.4 mdd en 2011. Se
proyecta que este mercado alcance casi
$1,100 mdd para el 2016 una CAGR de
5.8% durante el período de cinco años,
de acuerdo a BCC.
Generando epímeros del azúcar
Una revisión de la literatura reciente
revela varios esquemas interesantes
en la química quiral. Uno de dichos
esquemas involucra la síntesis de azúcares raros, los cuales tienen potencial
en varias aplicaciones importantes que
incluyen bloques de construcción quiral
en síntesis de productos naturales. Los
métodos de producción actuales, no
obstante, utilizan procesos bioquímicos
costosos y complejos para transformar
abundantes azúcares que se encuentran
fácilmente en estos azúcares raros. Para
abordar esta limitación, los investigadores del Instituto de Tecnología de
Massachusetts (MIT) han encontrado
una manera de utilizar catalizadores
inorgánicos en lugar de enzimas para
generar epímeros de azúcar de manera
simple y robusta, de acuerdo a un comunicado de prensa del MIT el 10 de
octubre del 2012.
Típicamente, los procesos bioquímicos utilizados para generar azúcares
raros de azúcares más abundantes involucran tres clases principales de enzimas, dos de las cuales, las isomerasas y
las oxidorreductasas, son activas en un
amplio rango de sustratos simples, pero
las cuales también pueden resultar en la
formación de productos colaterales. Por
ejemplo, la xilosa isomerasa convierte
la glucosa en fructosa y simultáneamente convierte la fructosa en manosa.
Estos procesos han generado algunos
azúcares raros comercialmente disponibles, pero la compleja naturaleza de este
proceso bioquímico lo hace costoso, de
acuerdo al comunicado de MIT. La tercera clase de enzimas, las epimerasas,
son potencialmente los biocatalizadores
más útiles para la extensa producción
de azúcares raros ya que éstos ofrecen
alta especificidad para productos y son
capaces de modificar selectivamente
los azúcares en múltiples posiciones
del carbono. Al igual que todos los catalizadores biológicos, sin embargo,
las epimerasas pueden ser frágiles ya
que requieren condiciones de reacción
específicas y sólo pueden actuar sobre
azúcares previamente funcionalizados.
Los investigadores del MIT reportaron el uso de catalizadores inorgánicos
en lugar de las enzimas para generar
epímeros de azúcar, ofreciendo así una
alternativa a los biocatalizadores en la
conversión selectiva de azúcares (1). El
sistema catalítico involucra el uso de un
silicato microporoso sustituido con estaño (Sn-Beta Zeolite) combinado con
una sal de borato. Los investigadores
del MIT encontraron que el Sn-Beta
zeolite en presencia de tetraborato de
sodio catalizaba la epimerización selectiva de aldosas en medio acuoso. La
reacción procede por medio de un mecanismo de cambio de carbono 1,2, en
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 51
MAYO / JUNIO 2013
51
27/05/13 16:32
Síntesis
y
M anufactura
donde los enlaces C-C se mueven dentro de la columna vertebral de la molécula, de acuerdo al comunicado de MIT.
Otros avances en química quiral
Los investigadores del Departamento
de Química Aplicada de la Facultad de
Ciencias de la Universidad de la Ciencia de Tokio y del Centro de la Fundación Japonesa para la Investigación del
Cáncer desarrollaron un método para
la síntesis total del AMF-26, un agente
antitumor que rompe el sistema de Golgi inhibiendo la activación del factor 1
de la ADP-ribosilación (2). Una parte
clave de la síntesis fue la construcción
del precursor lineal quiral mediante la
reacción del aldol asimétrico seguido
por una reacción de Diels-Alder intramolecular estereoselectiva predictiva
asistida por computadora (2).
Los investigadores también reportaron recientemente lo que clasificaron
como la primera síntesis asimétrica organocatalítica de oxindoles 3,3-disustituidos que presenta dos heteroátomos en
la posición C3 empleando la aminación
altamente enantioselectiva de 3-ariltiooxindoles o 3-alcoxioxindoles utilizando DBAD (3). El trabajo demostró
que los 3-tiooxindoles y 3-alcoxioxindoles fueron nucleófilos reactivos para
el desarrollo de reacciones asimétricas
catalíticas (3). En otras novedades, los
investigadores describen su trabajo que
involucra una reacción de cicloadición
doble (1,3)-dipolar asimétrica catalítica. Ellos reportaron que utilizando
un catalizador de plata quiral, pueden
prepararse pirrolizidinas enantio-enriquecidas en un matraz a partir de materiales de inicio económicos, disponibles comercialmente. Los productos de
pirrolizidina contienen una variedad de
patrones de sustitución y tantos como
seis centros estereogénicos (4).
En el área de la biocatálisis, los investigadores de la Escuela de Ingeniería
Química y biomolecular, del Instituto
Georgia de Tecnología, del Instituto
Petit de Bioengienería y Biociencia y
Merck % Co., alteraron con éxito una
leucina deshidrogenasa a través de varias rondas de ingeniería de proteínas
hasta una amina deshidrogenasa enantioselectiva (5). En lugar del α-ceto ácido de tipo silvestre, la nueva amina deshidrogenasa acepta la cetona análoga,
metil isobutil cetona, la cual corresponde al intercambio del grupo carboxi por
52
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 52
de
A pis
un grupo metilo para producir (R)-1,3dimetilbutilamina quiral (5).
Otros esquemas catalíticos
En la síntesis de intermedios farmacéuticos o APIs, pueden ser útiles los amplios avances en catálisis. El grupo de
investigación del Profesor Petri Pih
ko en el Departamento de Química y
el Centro de NanoCiencias de la Universidad de Jyväskylä en la Academia
de Finlandia, resolvió recientemente
dos problemas en catálisis química, de
acuerdo a un comunicado de prensa de
diciembre 20 de 2012.
En el primer proyecto, los investigadores diseñaron un catalizador intramolecularmente asistido para la síntesis
de beta-aminoácidos. Los catalizadores
previamente publicados trabajan sólo
con cadenas laterales aromáticas en las
iminas, pero el nuevo catalizador diseñado en la Universidad de Jyväskylä
no tiene esta limitación, de acuerdo al
comunicado. El método puede ser aplicado en la síntesis de beta-aminoácidos,
los cuales son bloques de construcción
importantes. Para la comprensión del
mecanismo catalítico y el diseño del
catalizador, los investigadores colaboraron con los grupos de investigación
del Profesor Imre Pápai en la Academia Húngara de Ciencias para estudios
computacionales y el Profesor de Academia Kari Rissanen en la Universidad
de Jyväskylä para la caracterización de
los catalizadores por rayos X.
En un segundo proyecto, los investigadores identificaron un nuevo mecanismo para la reacción de adición de
Michael catalizada por aminas entre aldehídos y nitroalquenos. El nuevo modelo propuesto por los grupos de Pihko
y Pápai incluye una nueva especie, un
anillo de seis miembros, como el intermedio clave en ciclo que está protonado
en el paso determinante de la velocidad.
El trabajo es una combinación de estudios computacionales y experimentales que se complementan entre sí en
la comprensión del mecanismo de reacción. Específicamente, los investigadores utilizaron óxidos de dihidrooxazina,
los cuales son intermedios estables que
se protonan directamente, sin la intermediación de los zwitteriones, en adiciones de Michael organocatalíticas de
aldehídos y nitroalquenos. La protonación de estas especies explica el papel
del co-catalizador ácido en estas reac-
ciones y la estereoquímica observada
cuando la reacción se lleva a cabo con
α-alquilnitroalquenos (6).
El BINOL y sus derivados son clases de ligandos ampliamente usados
en síntesis asimétrica, como las reacciones de Diels-Alder, la adición de
carbonilo, y las reducciones (7). Los
investigadores de la Universidad de
Texas, en Austin, han desarrollado un
catalizador bifuncional derivado del
BINOL para producir bromolactonizaciones altamente enantioselectivas de
ácidos carboxílicos no saturados (8, 9).
Específicamente, el catalizador promovió bromolactonizaciones altamente
enantioselectivas de ácidos 4- y 5-aril4-pentenoico, pero también catalizó
las bromolactonizaciones altamente
enantioselectivas de ácidos 5-alquil4(Z)-pentenoicos. Los investigadores
afirman que estas reacciones representan las primeras bromolactonizaciones
catalíticas de ácidos olefínicos alquilsustituidos que procedieron por medio
de ciclizaciones en modo 5-exo para
dar lactonas en las cuales se forman
nuevos enlaces carbón-bromo en un
centro estereogénico con alta enantioselectividad. Los investigadores también
reportaron sobre lo que dicen que es la
primera desimetrización catalítica de un
ácido dienoico pro-quiral mediante bromolactonización enantioselectiva (8, 9).
Referencias
1.
2.
3.
4.
5.
6.
7.
8.
9.
Y. Román-Leshkov, “Sn-Beta Zeolites
with Borate Salts Catalyze the Epimerization of Carbohydrates via an Intramolecular Carbon Shift,” Nature Comnun.,
online, DOI:10.1038/ncomms2122,
Oct. 9, 2012.
I. Shiina, J. Med Chem. 56 (1), 150–159
(2013).
J. Zhou, “Organocatalytic Asymmetric
Synthesis of 3,3-Disubstituted Oxindoles
Featuring Two Heteroatoms at C3 position,” Chem. Commun., online, DOI:
10.1039/C3CC38819K, Jan. 23, 2013.
A.D. Lim, J.A. Codelli, and S.E. Reisman, “Catalytic Asymmetric Synthesis
of Highly Substituted Pyrrolizidines,”
Chem. Sci., online, DOI: 10.1039/
C2SC21617E, Nov. 13, 2012.
M.J. Abrahamson, Angew. Chem., Int. Ed.
Engl., 51 (16), 3969–3972 (2012).
G. Sahoo, Angew. Chem., Int. Ed. Engl. 51
(52), 13144–13148 (2012).
W. Sommer and D. Weibel, Aldrich
ChemFiles 8.2 (56) (2008).
D.H. Paull, J. Am. Chem. Soc., 134 (27),
11128–11131 (2012).
C. Drahl, Chem. & Eng. News 90 (28), 29
(2012). PT
MAYO / JUNIO 2013
27/05/13 16:32
JORG GREUEL/PHOTODISC/GETTY IMAGES
EDITORIAL INVITADA
Ofreciendo un punto de vista farmacéutico
de los medios socialesfarmacéutico de los
medios sociales
Aaron Davidson
Por qué los medios sociales presentan retos y oportunidades
únicas para las compañías farmacéuticas.
D
esde que Twitter se lanzó en
2006 y Facebook se volvió la
corriente principal, la mayoría de las industrias han visto
formas de conectarse con sus consumidores a través de los medios sociales.
Los fabricantes de dispositivos médicos
y farmacéuticos, sin embargo, han estado notablemente ausentes de esta tendencia. ¿Por qué es que, en 2013, tantas
compañías de ciencias de la vida evitan
los medios sociales mientras que la mayoría de las otras industrias los adoptan?
En los Estados Unidos, la respuesta
principal es la incertidumbre regulatoria. La FDA todavía no ha publicado
una guía final acerca del uso apropiado
de los medios sociales, y su limitado
proyecto de guía apenas tiene un año
de antigüedad (1). La simple naturaleza
de los medios sociales -incluyendo sus
varias y diferentes formas, su naturaleza pública, intrínsecamente interactiva
y sus elementos de anonimato- plantea
desafíos únicos para la FDA y las compañías de ciencias de la vida.
Regulación promocional
La FDA regula estrechamente la manera en que los productos farmacéuticos
pueden ser promovidos. Las compañías
deben someter todo el material promocional a la FDA y correr el riesgo de recibir cartas de la Oficina de Promoción
de Fármacos de Prescripción (OPDP)
de la FDA, si se piensa que los materiales promocionales representan engañosamente un perfil de seguridad, eficacia
o riesgo de un producto. Además, se
prohíbe a los fabricantes dar incluso inAaron Davidson
es socio en la práctica de
Life Sciences en Baker
Botts, que se enfoca
principalmente en la
defensa de los fabricantes
de farmacéuticos y
dispositivos médicos.
formación veraz acerca de los usos de
fármacos o dispositivos médicos si tales
usos no han sido aprobados por la FDA.
Sin embargo, una reciente apelación del
fallo judicial ha generado dudas acerca
de la prohibición de la FDA de las comunicaciones veraces no indicadas en
la etiqueta (2), lo que revierte una condena penal por la promoción fuera de
indicaciones por motivos constitucionales para la libertad de expresión.
La simple naturaleza
de los medios sociales
plantea desafíos únicos.
La FDA ha advertido a los fabricantes que “para que los materiales promocionales sean veraces y no engañosos,
deben contener información del riesgo
en cada parte [de los materiales] según
sea necesario para calificar cualquier reclamo hecho acerca del fármaco” (3). El
asunto del espacio es una preocupación,
por ejemplo, para cualquier compañía
que considere el Twitter ya que su límite
de 140 caracteres hace imposible proporcionar toda la información de riesgo
acerca de un producto. ¿Es suficiente dar
un vínculo a esa información cuando se
anuncie la aprobación para una nueva indicación? ¿Y qué pasa si un consumidor
o un médico ‘twitea’ en respuesta que el
fármaco también actúa bien para tratar
una condición para la cual el fármaco no
ha sido aprobado? ¿La compañía tiene
obligación de responder? Los tableros
de mensajes en línea y Facebook, incluso YouTube, aunque no están muy
limitados de espacio como el Twitter,
tienen límites prácticos que los hacen
incómodos para proporcionar “toda la
información de seguridad importante.”
Incluso si toda la información requerida
por la FDA pudiera ser proporcionada,
esta información está fechada y podría
volverse engañosa cuando se disponga
de más datos.
Guía de la FDA
La FDA celebró audiencias acerca del
uso de medios sociales por parte de los
fabricantes farmacéuticos en Noviembre del 2009. Sin embargo, tomó hasta
Diciembre del 2011 para que la agencia publicara su proyecto de guía (1).
No obstante, más que proporcionar una
dirección amplia acerca de los medios
sociales, la FDA se enfocó en un tipo
específico de solicitud que podrían recibir los fabricantes.
Probablemente llevará más de un
año antes que la FDA provea guía adicional. El Acta de Seguridad e Innovación de la FDA (FDA-SIA), promulgada el 9 de Julio de 2012, le solicita a la
Secretaría de Salud y Servicios Humanos que emita una guía que describa la
política de la FDA sobre promoción y
uso del Internet (incluyendo los medios
sociales) para Julio de 2014.
Mientras tanto, los fabricantes deben
tratar de determinar lo que es aceptable
revisando el proyecto de guía de la FDA
y las cartas emitidas por la OPDP de la
FDA. Con los riesgos de cometer una
falta de la FDA y los desafíos prácticos
creados por los medios sociales, no sería
de sorprender que las compañías de ciencias de la vida estén preocupadas para
ofrecer páginas de Twitter o Facebook
específicas para productos, canales de
YouTube o tableros de mensajes en línea.
Referencias
1.
2.
3.
FDA, Responding to Unsolicited Requests for Off-Label Information About
Prescription Drugs and Medical Devices
(Rockville, Maryland, December 2011).
United States vs. Caronia, No. 90-5006cr (2nd Cir. Dec. 3, 2012).
FDA, Letter to Cephalon, Inc., www.
fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/
EnforcementActivitiesbyFDA/WarningLettersandNoticeofViolationLetterstoPharmaceuticalCompanies/
UCM166238.pdf. PT
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 53
MAYO / JUNIO 2013
53
27/05/13 16:32
Fármacos I nhalados
Mejora del análisis de productos inhalados
Métodos para obtener mejores relaciones
in vitro-in vivo
Mark Copley
Incluso en una industria en la que todo el
desarrollo de productos es complicado por
las complejidades de la biología humana, los
productos inhalados oralmente (OIP) destacan
como singularmente exigentes. La respuesta
clínica es un problema particularmente
complejo, aunque también hay otras áreas
que representan un desafío. Tanto la técnica
del paciente como la capacidad individual
pueden tener un mayor impacto sobre la
efectividad de la entrega del fármaco y el
desarrollo es complicado por la interacción
entre el dispositivo y la formulación. El autor
discute el equipo de análisis y las técnicas de
colecta de información usadas para mejorar
la medición de la distribución aerodinámica
del tamaño de partícula y la relación entre los
datos de prueba in vitro y el comportamiento
in vivo.
L
a técnica de impacto en cascada se utiliza para medir
la distribución aerodinámica del tamaño de partícula
(APSD) de todos los productos inhalados oralmente
(OIPs). Los datos resultantes son ampliamente indicativos de la probable conducta de deposición en el tracto
respiratorio y respalda el desarrollo de una eficiencia objetivo
para la entrega del fármaco. Es ampliamente reconocido que
el impacto en cascada es incapaz de replicar completamente
la compleja aerodinámica y conductas de deposición que tienen lugar en la garganta y los pulmones. Los pulmones operan
bajo condiciones de humedad elevada y dentro de éstos la velocidad de flujo volumétrico se desacelera con cada bifurcación, estableciendo perfiles de velocidad complejos a través
de la estructura del pulmón. Los mecanismos resultantes de
la deposición de partículas, los cuales incluyen sedimentación
y difusión así como impactación, son difíciles de simular de
manera integral. La mejora de la relación entre los datos de
la prueba in vitro y la conducta in vivo, sin embargo, se está
volviendo cada vez más importante por un número de razones, incluyendo la implementación exitosa de la calidad por
diseño (QbD), la necesidad de reducir los costos del desarrollo
de OIP y el deseo de lograr bioequivalencia in vitro para los
productos genéricos.
Los pasos para modificar la impactación en cascada que
asegure mejores relaciones in vitro-in vivo (IVIVRs) van desde el uso de nuevo equipo de análisis, como el Alberta Idealized-Throat (AIT) y avanzados simuladores de la respiración,
para la adopción de técnicas más eficientes de recolección de
información, incluyendo la Medición Abreviada del Impactador (AIM).
Impactación en cascada multiplatina
Mark Copley es director de ventas en Copley Scientific, Colwick Quays
Business Park, Private Road No. 2, Colwick, Nottingham, NG4 2JY, RU,
Tel: +44 0 115 961 6229, www.copleyscientific.com
*A quien debe dirigirse la correspondencia.
Sometido: Junio 28, 2012. Aceptado: Octubre 12, 2012.
54
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 54
Los impactadores multiplatina consisten en una serie de platinas conformadas cada una de una placa de boquillas, con un
arreglo específico de las boquillas, y una superficie de colecta.
El aire cargado con la muestra es extraído hacia el impactador
a una velocidad de flujo volumétrico constante, y pasa secuencialmente a través de las platinas. Como el tamaño de la boquilla y el área total de la boquilla se reducen con el número
de platinas, las partículas son aceleradas progresivamente. En
cada platina, las partículas con suficiente inercia se liberan del
aire prevalente y se impactan sobre la superficie de colecta,
produciendo así una serie de fracciones de masa que pueden
ser analizadas para determinar cómo se distribuye el activo
MAYO / JUNIO 2013
27/05/13 16:32
con respecto al tamaño.
Figura 1: Preparación de la prueba con un impactador en cascada típico para el
La Figura 1 muestra un impactador
estudio de inhaladores de polvo seco (DPI)
en cascada farmacopeico típico preparado
para el análisis del inhalador de polvo seco
Flujómetro y adaptador
del flujómetro
(DPI) que incluye un número de accesorios
esenciales. El dispositivo está interconectado
al impactador en cascada utilizando un adapIntercambio
tador de boquilla apropiado y un puerto de
Dispositivo y
inducción. La velocidad de flujo a través del
adaptador
de boquilla
Bomba de
impactador en cascada está controlada por
Controlador
vacío
de flujo crítico
controlador de flujo crítico/flujómetro, y una
Cronómetro
bomba de vacío extrae aire a través de todo
el sistema.
P
P
Es posible extraer una conexión floja enImpactador
tre los diferentes elementos de esta disposiVálvula solenoide Válvula de
2 puertos/2 vías control de flujo
ción y el escenario de la vida real que pretende reflejar. El puerto e inducción representa
Nota: Este diagrama es una guía general para la preparación de la prueba para DPIs. Por favor,
refiérase a las monografíasde prueba individuales (p.ej., Farmacopea de los Estados Unidos y
la boca y la garganta y el impactador en casFarmacopea Europea) para instrucciones detalladas.No está dibujado a escala.
cada dimensiona a las partículas que con más
probabilidad se depositen en los pulmones.
El controlador de flujo/flujómetro asegura la aplicación de una manual, lo cual la vuelve incluso más limitante conforme auvelocidad de flujo estable y adecuadamente representativa du- menta la demanda de datos más valiosos y discriminatorios.
El alivio de la carga de los análisis es, por lo tanto, importante
rante el análisis.
para el avance continuo, especialmente en ambientes de IyD
Evaluando la práctica establecida
en los cuales los presupuestos se están recortando cada vez
La evaluación de la disposición establecida contra los re- más.
quisitos de información para el desarrollo de productos reconocidos destaca algunas de sus limitaciones. El puerto de Mejor representación de la deposición en garganta
inducción estándar de la Farmacopea de los Estados Unidos El objetivo de simular con más precisión la deposición en la
(USP)/Farmacopea Europea (Farm.Eur.) descrito en el Capí- boca y garganta concentra la atención en alternativas para el
tulo General <601> “Aerosoles, Sprays nasales, Inhaladores puerto de inducción estándar de la USP/Farm.Eur. Una de tade dosis medidas e Inhaladores de Polvos Secos” de la USP les alternativas es un molde de la garganta humana (2-5). Estas
y la sección 2.9.18 “Preparaciones para Inhalación”, de la alternativas ofrecen la ventaja de reflejar exactamente la fisioFarm.Eur., por ejemplo, está bien adaptado a la manufactura logía de una garganta. El trabajo experimental ha demostrado,
de precisión y da un desempeño confiable, consistente, pero sin embargo, diferencias significativas en la conducta de deactualmente se reconoce ampliamente que tiene una tendencia posición entre los diferentes moldes de garganta (1). Aunque
a sub-pronosticar significativamente la cantidad de dosis emi- es de esperarse que estas diferencias se den debido a la variatida capturada por el tracto respiratorio superior para algunos bilidad en la anatomía humana, complican la interpretación de
productos, con relación a los datos clínicos (1). Por lo tanto, los resultados dentro del contexto de estandarización y análisis
sin importar la conducta de deposición dentro del pulmón, el de rutina. Además, la manufactura reproducible y precisa de
puerto de inducción de la USP tiende a sobreestimar el alcance dichos moldes es compleja, lo que los hace difíciles de medir
y calificar. Debido a que los moldes tampoco son fáciles de
de la deposición en el pulmón completo.
De igual importancia es el hecho de que esta disposición manejar o de interconectar con el impactador, éstos son menos
requiere de la aplicación de una velocidad de flujo constante a que ideales desde un punto de vista práctico.
Estas limitaciones han estimulado el interés en el desarrotravés tanto del dispositivo como del impactador en cascada,
mientras que en el uso clínico, los productos inhalados están llo de soluciones que caigan entre un molde de garganta y el
sujetos a un rango de perfiles de respiración de los usuarios. puerto de inducción estándar (6). Estas soluciones incluyen el
La velocidad de flujo constante requerida por los impactado- Alberta Idealized Throat (AIT). Desarrollado por los invesres en cascada resulta en un forma de onda cuadrada, más que tigadores del Laboratorio de Investigación de Aerosoles de
en la forma de los patrones infinitamente variables, con forma Alberta (Universidad de Alberta, Canadá), el AIT tiene una
de campana amplia, de los pacientes reales. Adicionalmente, geometría interna estandarizada y altamente reproducible,
los impactadores idealmente requieren cambios de volumen pero similar a la humana que se presta a la manufactura de
múltiples para garantizar el dimensionamiento confiable y precisión. Su desempeño es independiente de la velocidad
completo del aerosol. Este requerimiento invariablemente re- de flujo y con los inhaladores de dosis medida presurizados
sulta en un volumen de prueba que es mayor que el volumen (pMDI) y los DPIs, se ha demostrado que colectan más de
de inhalación de al menos una parte de la población de pacien- la dosis emitida que el puerto de inducción de la USP (1, 7,
8). Ciertamente, la capacidad del AIT para replicar más certes a los que se destina.
Finalmente, existe la preocupación general de la produc- canamente la conducta de deposición in vivo en la garganta,
tividad. El impacto en cascado ha sido reconocido desde hace en comparación con el puerto de inducción de la USP, ha sido
mucho, como una tarea que consume tiempo, intensivamente confirmada directamente en varios estudios, algunos de los
3
2
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 55
MAYO / JUNIO 2013
55
27/05/13 16:32
Fármacos I nhalados
Tabla 1: Datos colectados resumidos para un inhalador de dosis medida presurizado
(pMDI) analizado utilizando un puerto de inducción de la Farmacopea de los Estados
Unidos (USP) y el Alberta Idealized Throat. (DE es desviación estándar, T/MP es
garganta/boquilla, µg a/ac es µg de activo/activación, MOC es colector de micro orificio,
FPD es dosis de partículas finas, FPF es fracción de partículas finas, GSD es desviación
estándar geométrica, MMAD es diámetro aerodinámico de la mediana de masas).
Puerto de Inducción USP
Alberta Idealized Throat
Platina
Media
DE
Media
DE
T/MP (μg a/ac)
54.2
1.6
66.8
5.1
1 (μg a/ac)
2.9
0.6
1.1
0.2
2 (μg a/ac)
1.8
0.1
0.7
0.1
3 (μg a/ac)
4
0.3
2.2
0.6
4 (μg a/ac)
16
1.9
12.7
2
5 (μg a/ac)
14.2
1.5
15.5
0.9
6 (μg a/ac)
38
0.6
4.3
0.5
7 (μg a/ac)
0.7
0.2
0.7
0.1
MOC (μg a/ac)
0.5
0.1
0.5
0.1
TOTAL
98
3.6
104.4
8.4
FPD (μg a/ac)
37.3
2.6
34.8
3.3
FPF (%)
38
1.4
33.4
1.3
GSD
1.9
0.2
1.6
0
MMAD (μm)
2.5
0.1
2.2
0.1
Figura 2: Para este inhalador de dosis medida presurizada, el uso del Alberta
Idealized Throat cambia la distribución del tamaño de partícula aerodinámico
medido, acumulativo, a las distribuciones de partículas más finas en relación con el
puerto de inducción estándar de la Farmacopea de los Estados Unidos (USP).
Masa acumulativa en %, basada en la masa
dimensionada por el impactador
100
80
garganta USP
garganta Alberta
60
40
20
0
1
Diámetro aerodinámico (µm)
56
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 56
10
cuales incluyen OIPs comercializados (911). Las geometrías del AIT están también
disponibles en formas para niños e infantes,
lo cual amplía su atractivo para el análisis
in vitro (12).
Estudio experimental: Evaluación del desempeño del AIT
El APSD de un pMDI (ingrediente activo:
salbutamol) fue medido en un proyecto en
colaboración con Melbourn Scientific (RU)
utilizando un impactador (Next Generation
Impactor, Copley Scientific) con el puerto
de inducción de la USP y un AIT (7). El
análisis se llevó a cabo a una velocidad de
flujo de 30 L/min, de acuerdo a la guía de
la farmacopea para MDIs, con seis mediciones replicadas realizadas en cada caso.
Todas las platinas de colecta del NGI y del
AIT estaban recubiertas con aceite de silicón aplicado en solución de n-hexano (1%
p/v), lo cual es una práctica estándar que
reduce el rebote de las partículas (es decir,
el re-arrastre de las partículas que impactan
a altas velocidades). El puerto de inducción
de la USP se dejó sin recubrir, como se hace
para el análisis de rutina.
La Tabla 1 muestra los datos de colecta promediados para cada componente
del equipo de prueba incluyendo una masa
combinada registrada para la garganta y la
boquilla del inhalador. Los valores para la
dosis de partículas finas (FPD), fracción de
partículas finas (FPF), desviación estándar
geométrica (GSD), y diámetro aerodinámico de la mediana de la masa (MMAD)
fueron determinados a partir de estos datos.
Los cálculos se basaron en el total de masa
emitida/activación y el supuesto de un límite superior de 5 micras para las FPD y FPF.
Los datos de deposición para la garganta/boquilla muestran que el AIT captura
más de la dosis, reduciendo así la masa del
fármaco que entra al impactador en cascada. Este resultado se atribuye a diferencias
en la geometría de las dos interfases, más
que a cualquier efecto de recubrimiento (7).
La Figura 2 muestra las APSDs acumuladas promediadas basadas en la cantidad
de material que sale de la boquilla/garganta. Aquí, el uso del AIT cambia la APSD a
tamaños más finos a través del rango de tamaños completo, sugiriendo así que no todos los tamaños de partícula son retenidos
igualmente con respecto al puerto de inducción estándar. En un experimento paralelo
con un DPI, se observó el mismo efecto (7).
Estos son resultados iniciales y se requiere
mayor investigación. Sin embargo, los re-
MAYO / JUNIO 2013
27/05/13 16:32
sultados subrayan el hecho de que la mejor representación de
la deposición en boca/garganta puede influir las evaluaciones
de la deposición regional en el pulmón, lo cual es una función
del tamaño de partícula, así como estimados de la deposición
completa en el pulmón. Desde una perspectiva in vitro, el uso
del AIT asegura que sólo la porción del aerosol que realmente
se depositaría en el pulmón está dimensionada por el impactador en cascada, proporcionando así datos más relevantes.
Figura 3: El análisis de inhaladores estándar de polvo seco
involucra la aplicación de un perfil de onda cuadrado, cuyas
dimensiones se derivan de la velocidad de flujo establecida.
150
Velocidad de flujo 100
(L/min)
50
Aplicación de perfiles de respiración representativos
Como los impactadores en cascada multiplatinas requieren
una velocidad de flujo de aire constante para una operación
exitosa, el problema de aplicar perfiles de respiración que
representen mejor la vida real demanda una solución en dos
etapas: desaclopar la velocidad de flujo y el volumen a través
del dispositivo, de la velocidad de flujo y el volumen a través del impactador, e identificar el perfil más adecuado para
el análisis.
La entrada de mezcla es una opción establecida para desaclopar las velocidades de flujo. Diseñada para adaptarse entre la entrada de un rango de impactadores en cascada y un
puerto de inducción USP o el AIT, permite que el impactador
en cascada sea operado bajo condiciones de estado estacionario, como un muestreador de aerosol de velocidad de flujo
constante (de la manera en que fue diseñado), mientras que al
mismo tiempo permite la aplicación de una velocidad de flujo
reducida o variable a través del inhalador. Una acción de mezclado suave asegura un mezclado efectivo, sin turbulencias, de
la composición (es decir, la funda) y de la muestra cargada en
las corrientes de aire antes de la introducción al impactador,
resultando en mínimas pérdidas internas (4, 13).
La evaluación del perfil de respiración más apropiado para
el análisis es una cuestión constante y más compleja. Para los
inhaladores con un mecanismo de entrega activo, como los
pMDIs y algunos DPIs, existe evidencia experimental que sugiere relativamente baja sensibilidad para probar la velocidad
de flujo (13, 14). El estudio del nebulizador, por otro lado, en
el cual la aerolización de la dosis se basa en la corriente de
respiración del paciente, ya se ha sometido a una modificación
significativa con la publicación de dos nuevas monografías
armonizadas: Farm.Eur. 2.9.44 y USP 1601 (15, 16). Estas
entraron en vigor en enero de 2012 y agosto de 2011, respectivamente e incluyen cuatro diferentes perfiles de respiración
para evaluar la entrega de dosis para diferentes grupos de pacientes: adultos, niños, infantes y neonatos.
Para la mayoría de los DPIs, la fuerza motriz que maneja
el dispositivo es suministrada únicamente por el paciente y,
por esta razón, se conocen ampliamente como DPIs pasivos.
El perfil de respiración seleccionado, por lo tanto, impacta el
proceso de dispersión de la dosis así como la inhalación de
las partículas resultantes. Aquí, la aplicación de perfiles de
respiración más representativos está generalmente reconocida
como importante, aunque existe considerable debate acerca de
lo que realmente se requiere.
Centrándose en los DPIs
Las monografías farmacopeicas para el análisis de los DPIs
especifican la aplicación de una velocidad de flujo que resulte
en una caída de presión de 4 kPa a través del dispositivo, lo
cual se considera ampliamente representativo de la fuerza de
inhalación de un paciente adulto. Los DPIs varían considera-
4 L en 100 L/min
4 L en 60 L/min
0
0
1
2
4
Figura 4: Disposición de prueba para el análisis del inhalador de
polvo seco que incorpora el Alberta Idealized Throat, una entrada
de mezcla y un simulador de respiración.
blemente en término de resistencia al flujo por lo que, en la
práctica, probar velocidades de flujo abarca un amplio rango
de valores, desde alrededor de 30 - 40 L/min para un dispositivo de alta resistencia hasta el límite impuesto de 100 L/min
para aquéllos con mucha menor resistencia. La velocidad de
flujo definida se aplica durante el mismo tiempo tomado para
extraer 4 L de aire a través del dispositivo si se siguen las especificaciones farmacopeicas, o 2 L si se sigue la guía de la FDA,
en la forma de un perfil de onda cuadrada (ver Figura 3).
Aunque este procedimiento es lógico como parte de una
prueba de control de calidad rutinaria, estandarizada, se ha
presentado evidencia que sugiere que el uso de una caída de
presión de 4 kPa da una velocidad de flujo que es irrealmente
alta para ciertos grupos de pacientes con función pulmonar
deteriorada. De la misma manera, también se ha cuestionado el volumen total inspirado. Sobre esta base, se han hecho
sugerencias de que deben realizarse análisis de velocidad de
flujo más bajo, posiblemente con volúmenes totales menores,
en el desarrollo de productos para uso pediátrico, por ejemplo,
o para el tratamiento de la enfermedad pulmonar obstructiva
crónica (EPOC) o asma (17).
Por el otro lado, conforme la tecnología de DPI se extiende
en la entrega de terapias sistémicas, se han propuesto también
argumentos contrarios (18). La investigación sugiere que, en
un grupo de adultos usuarios sin deterioro pulmonar, podría
lograrse una caída de presión de 8 kPa, lo cual sugiere que
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 57
3
Tiempo (s)
MAYO / JUNIO 2013
57
27/05/13 16:32
Fármacos I nhalados
Figura 5: Esquema que ilustra la Medición Abreviada del
Impactador - concepto del tracto respiratorio humano, el cual
involucra el uso de dos platinas de impactación (CPM es masa
de partículas gruesas, FPM es masa de partículas finas, EPM es
masa de partículas extra-finas, IP es producto inhalado).
>5micras
Espaciador
Mejora de la productividad utilizando el AIM
<5.0 micras
< 1.0 micra
1 micra
EPM
FPM
5 micras
Otras variaciones posibles
CPM
I.P.
Filtro
las velocidades de flujo de la prueba deben ser mucho más
elevadas si se aplica la misma maniobra de inhalación durante
el uso. Este último punto es crucial si, para la entrega sistémica, se instruye a los pacientes para que inhalen de diferente
manera para optimizar el perfil de deposición del activo, y entonces el análisis necesita reflejar esto. Igualmente importante,
más allá de estas consideraciones de la velocidad de flujo de la
prueba, existe un problema más amplio de la forma del perfil
de respiración aplicado durante el análisis.
Durante el uso del paciente, el aire es extraído a través del
DPI para fluidificar y aerosolizar la dosis, formando así una
nube de partículas, de las cuales una gran proporción es suficientemente fina para ser extraída dentro del pulmón. Los mecanismos involucrados en este proceso de aerosolización son
complejos, pero puede postularse que la aceleración del aire
a través del tapón de polvo resulta en la aplicación de fuerzas
de corte, dando así lugar a la dispersión y el vaciado del dispositivo. Si el dispositivo no se vacía, o si la fuerza aplicada
es insuficiente para dispersar la dosis a un tamaño respirable
(típicamente se considera menor de 5 micras), entonces la eficiencia de entrega del fármaco está deteriorada (18).
Este mecanismo propuesto ha llevado a sugerir que no es
sólo la velocidad de flujo aplicada durante el análisis la que es
importante, sino también la velocidad a la cual el flujo parte
del cero. En el análisis farmacopeico convencional, el aire es
efectivamente “encendido” o “apagado”, con casi una aceleración instantánea. En contraste, los datos para adultos sanos
indican que puede tomar hasta 0.5 segundos lograr un pico
del flujo inspiratorio, dando así una velocidad de aceleración
apreciablemente más lenta (18).
Estos debates han resultado en la aplicación de pulmones
58
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 58
electrónicos o artificiales y la introducción de nuevos simuladores de la respiración que permiten la exploración detallada
del impacto del perfil de respiración sobre el desempeño del
dispositivo durante el análisis de rutina (2, 19). Aplicando perfiles típicos de las poblaciones de pacientes destinados y levantando flujos de aire de una manera variable pero estrechamente definida, estos sistemas permiten a los investigadores
determinar cómo pueden ser afectados los atributos de calidad
típicos por la variabilidad de paciente a paciente en esta área.
Esta investigación es un área que continúa pero es crítica en el
desarrollo de la tecnología DPI (ver Figura 4).
En años recientes, la búsqueda de productividad mejorada en
el análisis de productos inhalados ha impulsado el interés en
el AIM (20). Un punto clave es el análisis de control de calidad (QC), aunque el esquema también es promisorio para
IyD. El AIM involucra la separación de una muestra en un
número mucho menor de fracciones que las de un impactador
en cascada multi-platinas, aportando así algunos beneficios
importantes:
• Resultados analíticos más rápidos
• Análisis menos complicados, lo que resulta en una
reducción de la probabilidad de error
• Facilidad de automatización
En IyD, la propuesta es que los requisitos para una mejor
productividad pueden cumplirse aplicando la versión humana
del tracto respiratorio (HRT) del concepto del AIM, el cual
concentra la atención en aquellas partes del APSD que son
cruciales para la evaluación del desempeño de la entrega del
fármaco (ver Figura 5). Los estudios publicados destacan el
interés industrial en este esquema (21-23). El potencial que
ofrece el AIM para reducir el error humano y mejorar la integridad de los datos también puede respaldar el desarrollo de
mejores IVIVRs que se basan en resultados más seguros.
El AIM-HRT consiste en dos platinas de impactación, un
filtro y un espaciador para modificar el comportamiento aerodinámico. Éste separa la dosis en una masa de partículas
gruesas (>5 micras), una masa de partículas finas (<5 micras)
y una masa de partículas extra-finas (<1 micra). Estas fracciones estarían típicamente asociadas con la deposición en
boca/garganta, la deposición en pulmones y, potencialmente
la pérdida vía la exhalación, respectivamente. La tecnología,
no obstante, permite que el diámetro de corte de las platinas se
varíe, según sea necesario, para producir resultados que se correlacionen más estrechamente con los datos medidos in vivo,
si los hay. Algunos estudios indican que esto puede lograrse
utilizando un diámetro de corte más cercano a las 3 micras
que a las 5 micras (24). El futuro, el AIM puede, por lo tanto,
permitir la aceleración del diseño de experimentos y los estudios de selección aunque hay un debate considerable acerca
de su aceptación.
Viendo a futuro
La prueba convencional con el impactador en cascada usado
para medir el APSD de todos los OIPs fue originalmente desarrollada con la idea del análisis de QC. Ésta cumple esta
MAYO / JUNIO 2013
27/05/13 16:32
función bien porque permite una medida altamente discriminatoria y reproducible de la calidad del producto. Sin embargo, la disposición convencional tiene inconvenientes para los
investigadores que tratan de tener acceso a una comprensión
más detallada de la tecnología de inhalación y obtener mejores
IVIVRs que el desarrollo adicional. Una cuestión es la mejor
representación de la conducta de deposición en la boca y la
garganta y otra es la aplicación de perfiles de respiración más
representativos durante el análisis, en el cual pueden tener un
impacto en la emisión de la dosis y el resultante APSD del
aerosol generado. El problema de la productividad analítica
continúa presionando en un entorno de recorte de costos más
profundo.
Los proveedores del instrumento están respondiendo positivamente a estos requerimientos introduciendo nuevos productos tales como la entrada mezclada, simuladores de respiración sofisticados, nuevas interfases tales como el AIT y
equipo de AIM que agiliza el análisis. Estos nuevos productos
potencialmente permiten avances significativos en el área del
análisis de producto inhalado dentro del entorno de IyD. En el
futuro, dichas innovaciones ofrecen la oportunidad de conformar el análisis in vitro en una herramienta más efectiva para
el rápido avance de la tecnología de inhaladores para el rango
más amplio posible de terapias de fármacos.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
Referencias
1.
2.
3.
4.
5.
Y. Zhang, K. Gilbertson, and W.H. Finlay, J. Aerosol Medicine
20 (3) 227-235 (2007).
M. Hamilton and D. Prime, “A Rapid In-vitro Dry Powder Inhaler Device Equivalence Screening Study Using the Hydraulic
Lung,” poster presentation at Drug Delivery to the Lungs
(DDL) 22 (Edinburgh, Scotland, 2011).
B. Olsson, et al., Proceedings of Respiratory Drug Delivery
2008 Conference (Phoenix, AZ, 2008), Vol 1, pp. 197-205.
B. Olsson, E. Berg, and M. Svensson, Proceedings of Respiratory Drug Delivery 2010 Conference (Orlando, FL, 2010), pp.
225–234.
M. Svensson and E. Berg, Proceedings of Respiratory Drug
Delivery 2008 Conference (Phoenix, AZ, 2008), pp. 391-394.
18.
19.
20.
21.
22.
23.
24.
Y. Zhang, T. L. Chia, and W. Finlay, Aerosol Sci. and Tech. 40
(5), 361-372 (2006).
M. Copley, J. Mitchell, and D. Solomon, Inhalation 5 (4) 12-16
(2011).
A. Watkins, T. Gerrish, and N. Childerhouse, Proceedings of
Respiratory Drug Delivery 2012 Conference (Phoenix, AZ,
2012), pp. 877-882.
B. Grgic, W.H. Finlay, and A.F.Heenan, J. Aerosol Sci. 35 (1)
21-32 (2004).
Y. Zhou, J. Sun, and Y.S. Cheng, J. Aerosol Med. and Pulmonary Drug Deliv. 24 (6) 277-284 (2011).
M. Rahmatalla, et al., J. Aerosol Med. 15 (4) 379–385 (2002).
W. Finlay, Proceedings of Respiratory Drug Delivery 2012
Conference (Phoenix, AZ, 2012), pp. 325-336.
N.C. Miller, M.J. Maniaci, S. Dwivedi, and G.W. Ward, Proceedings of Respiratory Drug Delivery Conference (Orlando,
FL, 2000), pp. 191-196.
W. Finlay and M.G. Gehmlich, Intl. J. of Pharmaceutics 210
(1-2) 83-95 (2000).
Eur. Ph., 7.3 (Supplement) Chapter 2.9.44, “Preparations for
Nebulisation: Characterisation” (EDQM, Strasbourg, France,
2012), 3803-3805.
USP 34-NF 29 First Supplement, General Chapter <1601>,
“Products for Nebulization–Characterization Tests” (US Pharmacopeial Convention, Rockville, MD, 2011), pp. 4729-4732.
D.K. Nadarassan, K.H.Assi, and
H. Chrystyn, Eur. J. Pharm. Sci. 39 (5)
348-354 (2010).
D.Harris, Pharm. Tech. Eur. 19 (9) 29-35 (2007).
P. Burnell, et al., J. Aerosol Sci. 29 (8), 1011-1025 (1998).
M. Copley, J. Mitchell, E. McAulay and D. Russell-Graham,
Inhalation 4 (1) 7-11 (2010).
J. Mitchell, et al., J. Aerosol Med. and Pulmonary Drug Deliv.
25 (4) 188-197 (2012).
G.Keegan and D.A.Lewis, Proceedings of Respiratory Drug
Delivery 2012 Conference (Phoenix, AZ, 2012), pp. 465-468.
G.Keegan and D.A.Lewis, Proceedings of Respiratory Drug
Delivery 2012 Conference (Phoenix, AZ, 2012), pp. 469-472.
S. Newman and H-K. Chan, J. Aerosol Medicine 21 (1) 1-8
(2008). PT
“Resolución de problemas de tableteo y herramental”
continuación de la pág. 49
Desgaste del calibre de la matriz. El desgaste del calibre
de la matriz o “anillado” (ver Figura 3) es otro defecto común que puede llevar a problemas tales como “laminado” de
las tabletas y problemas para la eyección de las tabletas, lo
cual resulta en producto desperdiciado y producción reducida
de tabletas. El anillado es causado por el desgaste abrasivo
y la deformación por las fuerzas continuas que actúan sobre
la cara del calibre de la matriz. Este daño se acelera cuando
se comprimen gránulos duros y abrasivos encontrados en algunas formulaciones, particularmente vitaminas y minerales.
Este desgaste puede ser identificado utilizando inspección visual durante el Paso 2 (Evaluar), aunque también se dispone
de equipo preciso para medir y monitorear este desgaste en
el Paso 4 (Medir). El monitoreo de la condición física de la
matriz puede resultar en un diagnóstico temprano antes de
que el defecto tenga una efecto negativo sobre la producción
de las tabletas.
Pegoteado y laminado. Cuando son nuevos, las superficies
de las caras del punzón de las tabletas están generalmente pulidas hasta un acabado espejo. Sin embargo, estas superficies
pueden deteriorarse durante un período de tiempo, debido a
la continua compactación de los gránulos, lo que puede llevar a defectos del tableteado tales como el “laminado” y el
“pegoteado” (ver Figura 4) provocados por la adhesión del
producto al ahora terminado rugoso. Este deterioro puede ser
identificado durante la evaluación (Paso 2. Evaluar). El producto puede limpiarse con un sistema de limpieza eficiente
(Paso 1. Limpiar) y el terminado puede mejorarse/repararse
utilizando el proceso de pulido de remedio como en el Paso 3
(Reparar). Con un frecuente pulido ligero utilizando un sistema de pulido automatizado (Paso 5. Pulir), puede mantenerse
una superficie lisa y eficiente.
Conclusión
El proceso de siete pasos es una secuencia lógica a seguir
cuando se ha usado y retirado el herramental de la tableteadora. Cada uno de los pasos puede ser realizado de manera aislada, si es necesario, y va dirigido a prolongar de alguna manera la vida del herramental, permitiendo al mismo tiempo la
planeación y el reemplazo programado del herramental. PT
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 59
MAYO / JUNIO 2013
59
27/05/13 16:32
Nanopartículas: facilitando
la administración dirigida
de fármacos en la terapia
para el cáncer
A deline Siew, PhD
PharmTech habló con Robert Langer, profesor del Instituto
de Tecnología de Massachusetts y fundador de BIND
Biosciences; Stephen Zale, vicepresidente de desarrollo en
BIND Biosciences; y Yanli Zhao, profesor asistente y miembro
de la fundación nacional de investigación en la Universidad
Tecnológica de Nanyang, Singapur, acerca de la ingeniería
de nanopartículas con propiedades óptimas para usar en las
terapias para el cáncer.
L
as nanopartículas han cambiado significativamente el panorama del tratamiento, prevención y diagnóstico de enfermedades, generando una nueva ola de
estrategias de entrega de fármacos a nanoescala. Desde mejora en solubilidad/
biodisponibilidad (1, 2) y entrega dirigida de fármacos (3, 4) hasta liberación
controlada/sostenida (5, 6) y protección
de moléculas lábiles (p.ej., proteínas,
péptidos y ADN) de la degradación enzimática (7, 8), estas estructuras pueden
ser fabricadas, controladas y manipuladas para sumir nuevas propiedades y
funciones que han abierto nuevas puertas en la arena biomédica.
Aunque las nanopartículas pueden
variar en el rango de tamaño desde 10
nm a 1000 nm, las nanomedicinas son
típicamente menores de 200 nm (9).
Las nanopartículas hechas de polímeros
naturales o sintéticos han ganado popularidad debido a su estabilidad y facilidad de modificación de la superficie.
Pueden ser construidas para alcanzar
una liberación controlada del fármaco así como la localización específica
en sitios de la enfermedad mediante la
modificación de las características del
polímero y la química de superficie.
Por ejemplo, ha sido bien establecido
60
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 60
MAYO / JUNIO 2013
que las nanopartículas se acumulan de
preferencia en el tumor y sitios inflamatorios debido al efecto mejorado de
permeabilidad y retención (EPR) de la
vasculatura (9-11). En el sitio objetivo,
las nanopartículas poliméricas biodegradables pueden actuar como un depósito local de fármacos que provee liberación continua del agente terapéutico
encapsulado.
Estas ventajas ofrecidas por las
nanopartículas para la entrega dirigida
de fármacos son resultado de su pequeño tamaño y del uso de los materiales
biodegradables. El pequeño tamaño le
permite a las nanopartículas superar las
barreras biológicas (p.ej., epitelio gastrointestinal, vasculaturas del tumor, y
endotelio de los sitios inflamatorios) y
alcanzar una captación celular mientras
que el uso de los materiales biodegradables permite la liberación sostenida del
fármaco en el sitio objetivo (9-11).
Los avances en el desarrollo de las
nanopartículas han visto que estos sistemas se han traducido en medicamentos
clínicamente útiles, particularmente en
el tratamiento del cáncer. Ejemplos de
medicamentos basados en nanopartículas aprobados por la FDA y la EMA
como terapias para el cáncer incluyen
Doxil y Myocet (formulaciones lipo-
somales de doxorubicina), DepoCyt
(citarabina liposomal), Abraxane (una
formulación unida a albúmina de paclitaxel) y Genexol-PM (una formulación
de micelas poliméricas de paclitaxel).
Nanomedicinas en
evaluación clínica
Algunas formulaciones basadas
en nanopartículas están en desarrollo
clínico como tratamientos potenciales
para el cáncer. El nanoplatino de NanoCarrier (NC-6004), el cual consiste
de cisplatino incorporado dentro de
nanopartículas micelares compuestas
de polietilen glicol (PEG) y copolímeros en bloque de ácido poliglutámico,
está pasando por la evaluación Fase
II en pacientes con cáncer pancreático
avanzado o con metastásicos (12). Los
resultados preclínicos mostraron que el
nanoplatino se acumulaba en las células
cancerosas y tenía una nefrotoxicidad y
neurotoxicidad significativamente menor (13). En un estudio Fase I realizado
en el RU, la formulación fue bien tolerada en pacientes con tumores sólidos,
proporcionando liberación sostenida y
prolongada con mínima nefrotoxicidad
y ninguna mielosupresión, ototoxicidad, emesis o neurotoxicidad significativas (14).
El CRLX101 de Cerulean consiste en el inhibidor de topoisomerasa-1,
la camptotecina, conjugada covalentemente a un copolímero de PEG-βciclodextrina que se auto-ensambla en
nanopartículas de aproximadamente 30
nm de diámetro (15). A diferencia de
las camptotecina, estas nanopartículas
tienen una larga vida media en circulación, permitiendo que se acumulen en
los tumores. Después de la captación
del CRLX101 en las células tumorales, la camptotecina activa es liberada
gradualmente de las nanopartículas,
proporcionando una concentración sostenida del fármaco en los tumores. Se
ha observado que esta concentración
sostenida de camptotecina en el sitio del
tumor resulta en la inhibición del HIF-1
alfa, un factor de transcripción inducido
por hipoxia que se sabe que regula la
supervivencia de las células cancerosas,
la metástasis y la resistencia al fármaco.
Los estudios han demostrado que las
nanopartículas de CRLX101 aumentan
la eficacia de la camptotecina facilitando la localización y retención en el tejido blanco, incrementando la deposición
intracelular del fármaco, proveyendo
un suministro sostenido de la camptotecina activa y prolongando la actividad
del fármaco en el sitio blanco (16). El
CRLX101 está en evaluación Fase II
para el tratamiento de diversos tipos de
SCIEPRO/Science Photo Library/Getty Images
SOLUCIONES EN FARMACÉUTICOS
27/05/13 16:32
tumores (15).
El NK105 de Nippon Kayaku, una
formulación de paclitaxel basada en nanopartículas incorporadas en copolímeros en bloque de PEG-poliaspartato, fue
desarrollada para aumentar la actividad
antitumoral del paclitaxel reduciendo
mientras tanto los efectos adversos tales
como neurotoxicidad, mielosupresión
y reacciones alérgicas (17). El NK105
está actualmente en desarrollo Fase III
y se están llevando a cabo estudios para
investigar si el NK105 puede mejorar
la sobrevivencia sin avance en pacientes con cáncer de mama metastásico o
recurrente.
Otros ejemplos de terapéuticos para
el cáncer, dirigidos a nivel molecular y
basados en nanopartículas que están en
desarrollo clínico incluyen el BIND014 de BIND Biosciences (Fase I), el
CALAA-01 de Calando (Fase I), el
MBP-426 de Mebiopharm (Fase I/II),
y el SGT53-01 de SynerGene (Fase I).
Pharmaceutical Technology habló
con Robert Langer, profesor del Instituto de Tecnología de Massachusetts
(MIT) y fundador de BIND Biosciences; Stephen Zale, vicepresidente de desarrollo en BIND Biosciences; y Yanli
Zhao, profesor asistente y miembro de
la fundación de investigación nacional en la Universidad Tecnológica de
Nanyang (NTU), Singapur, acerca de
la ingeniería de las nanopartículas con
propiedades óptimas para usar como terapias para el cáncer.
Construyendo en propiedades
óptimas
PharmTech: ¿Cuáles son las consideraciones clave cuando se diseñan nanopartículas para la entrega de terapéuticos para el cáncer? ¿Cómo se construyen estas nanopartículas para lograr la
entrega dirigida?
Zale (BIND Biosciences): Esta es una
cuestión complicada debido a que los
efectos de muchas características sobre
cómo se comportan las nanopartículas
en el cuerpo humano son interdependientes entre sí. Hablando ampliamente, para que las nanopartículas sean
efectivas, éstas deben poder circular en
el torrente sanguíneo, extravasarse dentro de los tejidos enfermos y liberar su
carga terapéutica a una velocidad que
proporcione altas concentraciones en el
sitio blanco.
Nosotros utilizamos partículas basadas en copolímeros de ácido poliláctico (PLA) o ácido copoliláctico/glicólico (PLGA) y PEG, y pegamos ligandos
focalizados en el extremo de la cadena
del PEG. Hemos desarrollado un proceso de manufactura de partículas que
PT MAYO / JUNIO.indd 61
encapsulan la carga del fármaco en el
núcleo del PLA/PLGA de la partícula y
orienta el PEG y el ligando focalizado
hacia la superficie de la partícula. El
PEG le da a las partículas una corona
similar al agua, que oculta a las partículas de los sistemas corporales que de
otra manera las retirarían de la corriente
sanguínea en unos pocos minutos después de la administración. Como resultado, nuestras nanopartículas muestran
vidas medias en la circulación de cerca
de 24 horas y son capaces de concentrar
los fármacos en tumores a niveles típicamente 10 veces mayores que cuando
la misma dosis se da en solución.
Langer (MIT y BIND Biosciences):
Hemos utilizado un amplio rango de
ligandos focalizados, incluyendo anticuerpos, fragmentos de anticuerpos,
aptámeros, péptidos y pequeñas moléculas. Hemos estudiado un rango de
objetivos que incluyen, por ejemplo,
objetivos tumorales bien establecidos
y clínicamente validados como el antígeno de membrana específico para
próstata (PSMA) y receptor 2 del factor de crecimiento epidérmico humano
(HER2), y han descubierto nuestros
propios blancos y ligandos en áreas tales como la enfermedad cardiovascular.
En BIND, es rápida la traducción a la
clínica y por lo tanto, el foco está sobre
los blancos validados en áreas de necesidades clínicas no cumplidas como
el cáncer, y principalmente utilizando
péptidos y ligandos de pequeña molécula para la focalización.
Existen muchos antígenos o receptores expresados por células cancerosas
o el tejido circundante que pueden ser
La focalización pasiva
con frecuencia
no es suficiente para
erradicar los efectos
colaterales de fármacos
citotóxicos. - Zhao
focalizadas por ligandos de péptidos
o pequeñas moléculas, las cuales son
inherentemente más estables y menos
complejas que los ligandos macromoleculares tales como anticuerpos y
aptámeros. Por ejemplo, mientras que
nuestros estudios iniciales empleaban
un aptámero que se dirigía al PSMA,
BIND cambió a una molécula pequeña
de unión al PSMA en el BIND-014, lo
cual les permitió moverse rápidamente
al desarrollo clínico con una partícula
dirigida simple, farmacéuticamente estable y bien caracterizada. Esta partícu-
la dirigida al PSMA puede ser fabricada
reproduciblemente a gran escala y ha
demostrado ser no tóxica en estudios en
animales.
Zhao (NTU): Las nanopartículas
tienden a agregarse como resultado de
su gran relación de superficie a volúmen en el medio biológico. Cuando se
aglomeran las nanopartículas, éstas no
sólo pierden su funcionalidad pretendida, sino que son rápidamente reconocidas y efectivamente removidas por las
células fagocíticas mononucleares en
el sistema retículoendotelial (RES) del
hígado y el bazo. Este secuestro con
frecuencia se incrementa por el recubrimiento superficial de nanopartículas
con una corona de proteínas que lleva a
la opsonización y fagocitosis mejorada
por el RES.
Una estrategia para mantener una
buena dispersión de nanopartículas cargadas con fármaco en medios biológicos es por modificaciones en la superficie con polímeros de PEG. Se sabe que
el PEG evita la adsorción de proteína
(opsonización) sobre las superficies
de la nanopartícula, mejora el tiempo
de circulación, reduce la captación no
específica del RES y facilita la acumulación preferencial en sitios del tumor
a través del efecto EPR. Sin embargo,
la focalización pasiva por sí misma, con
frecuencia no es suficiente para erradicar los efectos colaterales de fármacos
citotóxicos y desvían la terapia anticáncer alejándola de las células sanas a las
células cancerosas selectivamente focalizadas.
Para mejorar más la capacidad de focalización de nanopartículas cargadas con
fármaco, estos sistemas también deben
ser acoplados con agentes focalizadores
que pueden unirse activamente con antígenos sobre-expresados o receptores
en la superficie de las células cancerosas. Las nanopartículas cargadas con
fármaco pueden construirse para reconocer y unirse a células cancerosas a
través de interacciones ligando-receptor
y las nanopartículas enlazadas se internalizan antes de que el fármaco cargado
sea liberado dentro de las células. Finalmente, existe otra preocupación de que
estos sistemas de entrega de fármacos
deben liberar el fármaco cargado rápidamente acumulándola en los sitios del
tumor y después de haber sido captada
por las células cancerosas.
Diseño de nanopartículas para
la focalización selectiva
PharmTech: ¿Podría describir su investigación sobre nanopartículas como
sistemas de entrega dirigidos en el traPharmaceutical Technology en Español
MAYO / JUNIO 2013
61
27/05/13 16:32
SOLUCIONES EN FARMACÉUTICOS
tamiento del cáncer?
Langer (MIT y BIND Biosciences): La
idea de emplear nanopartículas dirigidas para llevar los fármacos para cáncer
al sitio de la enfermedad e incrementar
su seguridad ha estado dando vueltas
durante varias décadas, pero hasta recientemente la solución ha sido esquiva. Un obstáculo mayor ha sido la incapacidad de lograr la interacción óptima
de las características de la partícula que
confiere la dirección a las células enfermas, la evasión de los mecanismos de
depuración de partículas y la liberación
controlada de la carga del fármaco encapsulada.
A mediados de la década del 2000,
Omid Farokhzad de la Escuela de Medicina de Harvard y yo, desarrollamos
una nueva estrategia para la focalización de nanopartículas poliméricas
cargadas con el fármaco a los sitios de
la enfermedad, incluyendo las células
cancerosas y la vasculatura enferma. La
tecnología se basa en un novedoso proceso de auto-ensamblado que permite la
formación de bibliotecas de nanopartículas que consisten en cientos e incluso miles de distintas formulaciones de
nanopartículas. Desarrollamos métodos
para separar estas partículas para identificar a aquéllas con las propiedades
óptimas para la focalización al tejido
enfermo y la evasión de los tejidos que
no son el blanco. De manera importante, las partículas que desarrollamos
están compuestas de polímeros biocompatibles y biodegradables que son
usados comúnmente en otros productos
farmacéuticos tales como microesferas
biodegradables y proteínas PEGiladas.
Zale (BND Biosciences): BIND está
actualmente usando esta plataforma
para desarrollar nanopartículas focalizadas llamadas Accurins para tratar el
cáncer y otras enfermedades. La compañía se ha propuesto desarrollar Accurins para evaluación clínica. La más
avanzada de estas nanopartículas es el
BIND-014, un Accurin dirigido a un
receptor de la superficie celular expresado en todos los tipos de tumores sólidos mayores. El BIND-014 contiene el
agente quimioterapéutico docetaxel, el
cual es un fármaco revolucionario por
derecho propio, con aprobaciones en
cinco indicaciones de tumores sólidos,
incluyendo el de mama, pulmón y próstata. El BIND-014 apenas ha completado un estudio clínico Fase I y está avanzando a la Fase II. Los primeros resultados para el BIND-014 son muy prometedores. Hemos visto que el fármaco
se comporta de manera muy diferente
62
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 62
MAYO / JUNIO 2013
del docetaxel convencional, incluyendo
señales de actividad mostrada en dosis
relativamente bajas y en tumores donde
el docetaxel no se utiliza normalmente.
Zhao (NTU): Nuestras nanopartículas
de sílica meso-porosa multifuncional
para la entrega controlada y dirigida
al cáncer tienen tres componentes -el
núcleo de nanopartícula de sílica mesoporosa, la amino-β-ciclodextrina, los
polímeros de PEG funcionalizados con
una unidad de adamantano (Ad) en un
extremo y una unidad de folato (FA) en
el otro extremo (Ad-PEG-FA) (18). La
superficie de las nanopartículas de sílica
mesoporosa se funcionaliza primero con
los anillos de la amino-β-ciclodextrina
unidos por enlaces disulfuro hidrolizables, que bloquean los fármacos dentro
de los mesoporos de las nanopartículas.
Los polímeros de Ad-PEG-FA son inmovilizados sobre la superficie de la nanopartícula a través de una fuerte com-
El BIND-014 ha
completado apenas un
estudio clínico Fase I
y está avanzando a
la Fase II. -Zale
plejación de β-ciclodextrina/adamantano. Las nanopartículas multifuncionales
pueden ser atrapadas eficientemente por
las células cancerosas, ricas en receptores de folato a través de endocitosis
mediada por el receptor, donde después
liberan rápidamente el fármaco anticáncer cargado dentro de la célula cuando
se dispara por el pH ácido y el glutatión
intracelular.
Se construyen diversas funciones
sobre las nanopartículas multifuncionales para entregar fármacos de manera
óptima. Estas funciones incluyen:
• Recubrimiento PEGilado en la superficie de la nanopartícula para
mejorar la estabilidad a largo plazo
de las nanopartículas bajo condiciones fisiológicas
• Focalización activa del cáncer mediante los ligandos de folato unidos
a la superficie de la nanopartícula
• Liberación del fármaco activada
por el pH para permitir que el fármaco se libere dentro de los compartimientos intracelulares ácidos
tales como el endosoma y el lisosoma (pH 5.0-5.5)
• Superficie de la nanopartícula cargada positivamente bajo condiciones ácidas para facilitar la transferencia de las nanopartículas desde
el endosoma al citoplasma
Hidrólisis inducida por el glutatión
de los enlaces disulfuro para mejorar más la liberación del fármaco en el citoplasma de las células
cancerosas.
La construcción de estas funciones sobre las entidades individuales de
nanopartículas mejora la eficacia de la
entrega de fármacos anticáncer a las
células cancerosas, reduciendo mientras tanto los efectos citotóxicos sobre
las células sanas. Los experimentos in
vivo demuestran que las nanopartículas
de sílica mesoporosa multifuncionales,
cargadas con doxorubicina, podrían
efectivamente liberar la doxorubicina
en los sitios con tumor dando como resultado una inhibición significativa del
crecimiento tumoral.
•
Referencias
1. M. Morgen et al., Pharm. Res. 29 (2) 427440 (2012).
2. A. Siew et al., Mol. Pharm. 9 (1) 14-28
(2012).
3. C. Liu et al., Biomat. 34 (10) 2547-2564
(2013).
4. I. Altintas et al., J. Control. Rel. 165 (2)
110-118 (2013).
5. W.Y. Qian et al., Int. J. Nanomed. 7: 57815792 (2012).
6. J.H. Sung, D. Han, and J.B. Lee, Biotechnol. J. 8 (2) 215-220 (2013).
7. C.Y. Dombu and D. Betbeder, Biomat.
34 (2) 516-525 (2013).
8. S. Hauptstein and A. BernkopSchnurch, Expert. Opin. Drug Deliv. 9
(9) 1069-1081 (2012).
9. R. Singh and J.W. Lillard, Exp. Mol.
Pathol. 86 (3) 215-223 (2009).
10. A.Z. Wang, R. Langer, and O.C.
Farokhzad, Annu. Rev. Med. 63: 185-198
(2012).
11. A. Swami et al., “Nanoparticles for targeted and temporally controlled drug
delivery,” in Multifunctional Nanoparticles for Drug Delivery Applications, S.
Svenson and R.K. Prud’homme, Eds.
(Springer, US, 2012), pp. 9-29.
12. NanoCarrier, “NC-6004 Nanoplatin,”
www.nanocarrier.co.jp/en/research/
pipeline, accessed Feb. 8, 2013.
13. H. Uchino et al., Br. J. Cancer 93 (6) 678687 (2005).
14. R. Plummer et al., Br. J. Cancer 104 (4)
593-598 (2011).
15. Cerulean, “CRLX101,” http://ceruleanrx.
com, accessed Feb. 8, 2013.
16. Young et al., Curr. Bioact. Compd. 7 (1)
8-14 (2011).
17. T. Hamaguchi et al., Br. J. Cancer 92 (7)
1240-1246 (2005).
18. Zhang et al., Adv. Funct. Mat. 22 (24)
5144-5156 (2012). PT
27/05/13 16:32
PHOTODISC/GETTY IMAGES
SOLUCIONES ESTADÍSTICAS
Calculando el resultado reportable
de los datos del reanálisis
Chris Burgess
Dos métodos para evaluar datos de reanálisis
después de resultados fuera de especificaciones.
L
a importancia de Estados
Unidos vs. Barr Laboratories
(1) en el manejo de resultados fuera de especificaciones
(OOS) en el laboratorio farmacéutico
no puede ser sobreestimado. Se llevó
13 años después del juicio para que la
FDA emitiera su guía final (2) sobre la
materia en el 2006. El Grupo de Trabajo de Control de Calidad Analítico (3)
de la Aca-demia Europea de Cumplimiento (ECA) lanzó recientemente la
versión 2 de su procedi-miento estándar
de operación (SOP) sobre investigaciones de OOSA (4), el cual armoniza los
enfoques regulatorios de la FDA y Europeos.
En una columna anterior, se discutió la cuestión de la selección del tamaño de la mues-tra para el análisis y
se hicieron propuestas (5). El artículo,
sin embargo, no abordó la polémica
cuestión de cómo calcular el resultado
reportable. El reanálisis sólo se lleva a
cabo si no puede establecerse una causa raíz para el OOS. En tales casos, el
requeri-miento de la FDA es específico.
Si no se identifica ningún error del
laboratorio o de cálculo en la primera
prueba, no hay bases científicas para
invalidar los resultados OOS iniciales a
favor de pasar los resultados del reanálisis. Todos los resultados del análisis,
Chris Burgess, PhD,
es científico analítico en
Burgess Analytical
Consultancy Limited,
‘Rose Rae’, The Lendings,
Startforth, Barnard Castle,
Co Durham,DL12 9AB,
RU; Tel: +441833 637 446;
chrisburgessconsultancy.com;
wwwburgessconsultancy.com
tanto los que pasan como los sospechosos, deben ser reportados y considerados en las decisiones de liberación
del lote (2).
La palabra clave es considerados.
¿Cómo podemos tomar en cuenta todos
los resultados del análisis de manera
racional y científica según lo requiere
el 21 CFR §211.160 (b)? Existen dos
maneras bien establecidas de tomar en
consideración un resultado OOS para
llegar a un resultado reportable.
Enfoque del intervalo de
confianza estándar
Primeramente, buscaremos el aislamiento del resultado OOS utilizando
un enfoque de intervalo de confianza
estándar. Tomemos como ejemplo que
la especificación registrada para un ensayo es 95.0 a 105.0% del etiquetado
y que se obtuvo un resultado OOS de
94.7% en el laboratorio. La investigación que se realizó no pudo identificar
una causa raíz. La unidad de calidad
autorizó un protocolo de reanálisis para
seis reanálisis y los resultados en % obtenidos fueron 98.0, 97.0, 96.1, 96.5,
97.4 y 96.2. En este ejemplo, se tomó
la decisión de que seis resultados de
reanálisis que pasaran de siete llevarían
al aislamiento del resultado OOS en lugar del ejemplo del caso de Barr que era
de siete resultados de ocho.
Sin embargo, la cuestión que permanece es cómo demostrar que el resultado OOS ha sido aislado con éxito
y como calcular el resultado reportable.
Una cosa que no podemos hacer para
llegar a un resultado reportable es tomar el promedio de todos los resultados
porque:
En el contexto del análisis adicional realizado durante una investigación
OOS, promediar el(los) resultado(s) del
análisis original que ocasionó la investigación y los resultados del reanálisis
adicional o del remuestreo obtenidos
durante la investigación del OOS no es
apropiado ya que oculta la variabilidad
entre los resultados individuales (2).
Existe también una buena razón
estadística para no calcular este promedio, la cual es porque la media aritmética (el promedio) es sensible a resultados aberrantes y una inclusión del OOS
causará que el resultado reportable esté
sesgado. Un mejor enfoque sería utilizar un método estadístico para calcular
la media robusta y la desviación estándar robusta.
La idea detrás del método de aislamiento utilizando un intervalo de
confianza, es que si el intervalo de confianza de la media aritmética, calculado
con una confianza de 95% de todos los
resultados, cae por arriba del límite de
especificación más bajo (LSL), excluirlo del cálculo del resultado reportable
está justificado, aunque el resultado
OOS será registrado en el registro del
laboratorio según está requerido por la
regulación.
El límite de confianza (LC) al 95%
más bajo de la media se calcula para todos los resultados (n = 7) utilizando la
ecuación convencional:
X–
t (0.05,n–1) s
n
donde X es la media del total de los
siete valores, t(0.05, n-1) es el valor de la
distribución t para 6 grados de libertad
con el 95% de confianza y s es la desPharmaceutical Technology en Español
PT MAYO / JUNIO.indd 63
(EC .1)
MAYO / JUNIO 2013
63
27/05/13 16:32
SOLUCIONES ESTADÍSTICAS
Figura 1: Ilustración de un “aislamiento” exitoso de resultado fuera de especificación
(OOS) utili-zando el esquema del intervalo de confianza. LSL es el límite inferior de la
especificación, USL es el límite superior de la especificación.
LSL
USL
Límite inferior
de confianza
al 95 %
105
104
103
102
101
99
Reanálisis
100
98
97
96
95
94
93
92
91
90
Reanálisis
OOS inicial
Figura 2: Ilustración de un “aislamiento” fallido de resultado fuera de especificación
(OOS) utili-zando el esquema del intervalo de confianza. LSL es el límite inferior de la
especificación, USL es el límite superior de la especificación.
LSL
USL
Limite inferior
de confianza
al 95%
Reanálisis
105
104
103
102
101
Reanálisis
100
99
98
97
96
95
94
93
92
91
90
OOS inicial
al 95% de 94.9%. En este caso, el “aislamiento” fallaría (ver Figura 2).
Enfoque H15
Un enfoque estadísticamente más atinado es incluir el resultado OOS directamente utilizando un procedimiento
robusto basado en la mediana y las desviaciones a partir de él, debido a que las
medianas están menos influidas por los
valores aberrantes.
El método descrito aquí brevemente
está basado en el método H15 de Hubert (6). Este método es más difícil de
calcular que el intervalo de confianza
estándar ya que se apoya en un procedimiento iterativo. Sin embargo, se logra
fácilmente utilizando una hoja de cálculo de Excel sin la necesidad de macros.
Los detalles matemáticos se dan en Ellison, Barwick y Duguid Farrant (7) y no
se cubren aquí.
Este procedimiento estadístico robusto tiene una ventaja mayor en que
el cálculo incluye al aberrante como
parte de la serie de datos y proporciona
valores para la media robusta y la desviación estándar robusta. Este procedimiento de cálculo cumple el requerimiento de la FDA descrito al principio
porque se le da consideración activa al
resultado OOS. Adicionalmente, calcula el intervalo de confianza al 99%
más que al 95%, ya que proporciona un
mayor aseguramiento del cumplimiento
con la especificación.
Brevemente, el algoritmo usado es
el siguiente:
1. Calcular el estimado inicial de la
mediana y la desviación estándar
robusta.
0
viación estándar de la muestra calculada.
Por lo tanto para nuestro ejemplo:
t
s
IC 95% inferior = X (0.05,n–1)
n
2.45 (1.06)
= 96.76–
7
= 95.8
(EC .2)
Como este valor es mayor que el LSL
de 95.0%, el aislamiento del resultado
OOS inicial se logra.
El valor reportable es el valor medio
64
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 64
de seis resultados del reanálisis. Esta situación se muestra en la Figura 1.
Observe en la Figura 1 y, en particular, en la Figura 2, el efecto del sesgo
sobre la media causado por la inclusión
del resultado OOS original y el ensanchamiento de la distribución normal.
Existe una desventaja estadística para
este método debido a que la distancia
del resultado OOS de los valores de
reanálisis causa un punto en el cual falla el “aislamiento”. Por ejemplo, si el
resultado OOS fuera 92.7% en lugar de
94.7, entonces al repetir el cálculo se
tendría un límite inferior de confianza
1
n
1.483Mediana
2.
x *i =
Evaluar todos los puntos de datos
utilizando
x *i–1 –1.5s *i–1 if x *i < x *i–1 –1.5s *i–1
x *i–1 + 1.5s *i–1 if x *i > x *i–1 + 1.5s *i–1
de otra forma
x *i–1
Este paso reemplaza los puntos fuera
del rango con valores en los límites de con-
MAYO / JUNIO 2013
27/05/13 16:32
Figura 3: Ilustración del esquema H15 para calcular la media robusta y la desviación
estándar robusta. LSL es el límite inferior de la especificación.
LSL
X̂ 0 = 96.5
2.96ŝ 0 = 2.20
Datos iniciales
–
X = 96.56
s = 1.063
94.0
95.0
96.0
97.0
98.0
99.0
Iteración 1
94.0
95.0
96.0
97.0
98.0
99.0
–
X = 96.62
s = 0.731
Iteración 5
–
X = 96.66
s = 0.798
LSL
94.0
H15 X̂ 28 = 96.64
95.0
96.0
97.0
fianza calculados de 99% pero deja otros
valores sin cambio.
3. Actualizar el estimado para la desviación estándar con base en el estimado
actual con un factor de corrección, β,
para la distribución normal.
4. Repetir los pasos 2 y 3 para los datos actualizados hasta que los valores
para la media robusta y la desviación
estándar robusta ya no cambien, por
ejemplo, en 0.1% (es decir, el cálculo
converge).
5. Calcular el intervalo de confianza final
s donde i es el
al 99% de 2.96 β
ciclo en el cual
converge.
Es más sencillo entender el proceso gráficamente (Figura 3) que matemáticamente
y este enfoque se ilustra utilizando la misma serie de datos que el ejemplo original.
El resultado OOS inicial se muestra como
un círculo rojo y los datos del reanálisis se
muestran como círculos verdes (línea de
datos inicial). El LSL también está marcado
i
2.96
ŝ 28
= 2.54
β
98.0
99.0
Iteración28
(convergencia)
–
X = 96.64
s = 0.860
en la gráfica. La primera iteración se mueve
tanto al resultado OOS inicial como al resultado de un reanálisis para el intervalo de
confianza robusto calculado de 99% que se
muestra como puntos azules rodeados por
un círculo rojo. Observe que cinco de los
seis resultados del reanálisis no cambiaron
a lo largo de todos los cálculos iterativos.
Conforme avanzan las iteraciones, la media robusta y la desviación estándar robusta
cambian hasta que los valores convergen.
En nuestro ejemplo, tomó 28 iteraciones
para obtener la convergencia. El cambio
más grande durante las iteraciones es para
la desviación estándar robusta. El intervalo
de confianza final al 99% está dentro de la
especificación y el valor de la media robusta
para el resultado reportable (basado en los
siete puntos de datos) es 96.44.
Conclusión
Se han descrito dos enfoques establecidos
para la evaluación de los datos de reanálisis
SU PRESENCIA
EN LA REVISTA MÁS LEIDA
POR LA INDUSTRIA FARMACÉUTICA
después de un resultado OOS junto con un
método para generar un resultado reportable. Estos dos enfoques no son los únicos
y las compañías pueden seleccionar y defender sus propios enfoques estadísticos.
Cualquiera que sea el esquema que se seleccione, la selección debe ser documentada,
justificada y descrita en un PNO.
References
1.United States vs. Barr Laboratories, Inc.
Civil Action No. 92-1744, US District
Court for the District of New Jersey: 812
F. Supp. 458. 1993 US Dist. Lexis 1932;
Feb. 4, 1993, as amended Mar. 30, 1993.
2. FDA, Investigating Out-of-Specification
(OOS) Test Results for Pharmaceutical
Production (Rockville, MD, Oct. 2006).
3. European Compliance Academy (ECA)
Analytical Quality Control Working
Group website, www.gmp-compliance.
org/eca_aqc_aboutus.html, accessed Jan.
7, 2012.
4. C. Burgess and B. Renger, ECA Standard
Operating Procedure 01, Laboratory
Data Management; Out of Specification
(OOS) Results, Version 2, Aug. 2012.
5. L.D. Torbeck, Pharm. Tech. 35 (12), 28,
54 (2011).
6. M. Thompson and P.J. Lowthian, Notes
on Statistics and Data Quality for Analytical Chemists, Section 7.6; Huber’s
H15 method, Imperial College Press,
2011, ISBN-10 184816-617 & references
therein.
7. S.L.R. Ellison, V.J. Barwick, and T.J. Duguid Farrant, Practical Statistics for the
Analytical Scientist, Section 5.3; Robust
Statistics, Royal Society of Chemistry,
2009, ISBN 978-0-85404-131-2. PT
CONTRATE SU PAUTA
PUBLICITARIA
AHORA
Mayores Informes y Contrataciones:
Tel: 52 (55) 5659-8880, 5536-2100, 5543-1486
E-mail: info@pharmatechespanol.com.mx
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 65
MAYO / JUNIO 2013
65
27/05/13 16:32
Granulado
con espuma
Granulación espumosa
Una nueva técnica para la granulación húmeda continua,
utilizando un extrusor de doble tornillo
Michael R. Thompson y Paul J. Sheskey
Como resultado del cambio de filosofía hacia la manufactura
continua, se está introduciendo nuevo equipo en las plantas
de producción farmacéutica. El extrusor de doble tornillo es un
ejemplo de dicho equipo para usar en la granulación húmeda.
Los autores revisan desarrollos en granulación húmeda
utilizando un extrusor de doble tornillo; exponen los elementos
con humectación en esta máquina e introducen una nueva
técnica, la granulación espumosa, que utiliza el extrusor de
doble tornillo para satisfacer completamente las necesidades
únicas de granulación.
Michael R. Thompson* es profesor asociado en el
Departamento de Ingeniería Química en la Universidad
McMaster, Hamilton, Ontario, L8S 4L7, Canadá, Tel: 905.525.9140,
mthomps@mcmaster.ca, y Paul J. Sheskey es científico de
investigación en Larkin Laboratory, The Dow Chemical Company,
Midland, Michigan.
*A quien debe dirigirse la correspondencia
Sometido: Septiembre 6, 2012. Aceptado: Septiembre 28, 2012.
66
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 66
MAYO / JUNIO 2013
E
l extrusor de doble tornillo proporciona granulados
altamente consistentes debido a su operación continua y camino del flujo estrechamente confinado, lo
que requiere que todas las partículas experimenten
una historia de cizallamiento similar. El intenso mezclado del
extrusor de doble tornillo permite una concentración de líquidos óptima más baja para la granulación, produciendo al
mismo tiempo gránulos más densos para las formulaciones
placebo y para los fármacos con dosificación alta en comparación con un mezclador de lotes de alto cizallamiento (1, 2).
Como resultado, las operaciones de secado y molido pueden
reducirse significativamente con el uso de esta maquinaria en
la producción de formas farmacéuticas sólidas orales.
El líquido de aglutinación en la granulación húmeda tiene
una profunda influencia sobre las propiedades del gránulo del
producto (3-5) y afecta la fricción entre los polvos transportados y la pared del barril dentro del extrusor, lo cual afecta el
consumo de polvo y la temperatura de salida de los gránulos
(2, 6). Existen asuntos cruciales a ser resueltos con respecto
a la introducción de líquidos en este tipo de maquinaria para
obtener la humectación rápida y uniforme de los excipientes,
de manera que el proceso exhiba estabilidad en la operación,
los límites se lubriquen inmediatamente para reducir el desgaste del equipo y el calentamiento de los gránulos y para
obtener granulados de alta calidad.
Función del extrusor de doble tornillo
Una variante común del extrusor usado para granulación es el
extrusor de doble tornillo co-rotatorio, completamente interengranado (7). Las diferencias entre los proveedores se basan
en gran medida en el volumen interno disponible de la máquina (con frecuencia descrito por la relación del diámetro
exterior con respecto al diámetro interior de los elementos del
tornillo) así como el diámetro del tornillo, pudiendo ambos
afectar significativamente las propiedades del granulado tanto
en el tamaño del gránulo como en la porosidad intragranular
(8). La máquina es altamente modular, haciéndola una plataforma flexible para la manufactura continua de diferentes
productos durante su período de vida de servicio a la compañía. La región de inter-engranado entre los dos tornillos crea
una acción de auto-barrido que minimiza la acumulación de
material dentro de la máquina pero también proporciona un
camino complejo del flujo para mezclar y consolidar los polvos. Para la granulación húmeda, el molde final del extrusor
está generalmente abierto para colectar gránulos sin consolidación excesiva.
La granulación húmeda dentro del extrusor de doble tornillo co-rotatorio es un proceso de alimentación continua, lo
que significa que el volumen interno disponible de la máquina
nunca está completamente lleno con material durante la operación. Este modus operandi es importante para la extrusión
27/05/13 16:32
porque minimiza la acumulación de caFigura 1: Diseños de tornillo característicos usados en extrusores de doble tornillo para granulación
lor disipado en las formulaciones del fárhúmeda. Los tornillos mostrados corresponden a la literatura a que se hace referencia en este
maco transportado, ya que limita la comartículo: (a) ref. 11, (b) ref. 4, (c) ref. 6. Los polvos entran en el extremo del lado izquierdo y las
presión contra la pared del barril, desflechas indican los puntos de adición del líquido
acopla los parámetros de la velocidad de
salida y velocidad de tornillo para darle
a los formuladores más control sobre
su proceso, y permite más rápidamente
(a)
la adición corriente abajo de materiales
(sólidos, líquidos o gases) porque el sistema no está presurizado excepto para
(b)
regiones de mezclado pequeño. Las zonas de los tornillos que están privadas de
material experimentan un flujo de arras(c)
tre dominante, en la cual los polvos son
empujados corriente abajo mediante los
vuelos giratorios de los elementos tipo
transmisión. Se ha encontrado que estos
(d)
elementos del tornillo contribuyen poco
al crecimiento del gránulo (5, 9). De heBloque de amasado
Elemento de peinado o picado
cho, los diseños de tornillo que usan sólo
elementos de transmisión muestran muy pobre distribución extrusor. El problema surge debido al espacio estrechamente
del líquido aglutinante dentro de los sólidos de salida (10). Es confinado dentro del extrusor, mencionado al inicio, que da
raro, sin embargo, que un diseño de tornillo esté comprendido como resultado que el puerto de inyección del líquido esté en
completamente de elementos de transmisión o que la longitud inmediata proximidad al flujo de polvo. Este confinamiento
completa de la máquina esté siempre completamente privada. evita la atomización de la solución aglutinante en gotas miEl crecimiento significativo de los gránulos requiere la inclu- cro-dimensionadas antes de entrar en contacto con los sólidos
sión de zonas de mezclado conducidas con presión, las cuales del polvo, como se hace en las mezcladoras de alto cizallaestán necesariamente completamente llenas conforme los pol- miento. Como resultado, se sobresaturan regiones del polvo
vos son exprimidos a través de estas secciones. Los bloques mientras que otras permanecen virtualmente secas. Este prode amasado y los elementos de peine (es decir, picado) son blema fue destacado en el artículo de Shah dirigido al indusejemplos de mezcladores comúnmente usados en números trial, quien reportó una sobretensión del proceso, aunque los
moderados a lo largo de la longitud del tornillo para producir eventos de sobrecarga del motor son también comunes (11).
el crecimiento del gránulo con menor desgaste (5, 9, 11-13). Shah demostró varias estrategias relacionadas con el diseño
La Figura 1 muestra algunos diseños típicos para la granula- del tornillo y la adición secuencial de cantidades de líquido
ción. Mantener estos elementos de mezclado más cerca del más pequeñas dentro del proceso como medio para minimizar
la presencia de sobretensión. Dichos cambios incrementan en
final del extrusor reduce el desgaste (4).
La velocidad de flujo del polvo es uno de los parámetros gran medida la complejidad de operación del extrusor y no
más significativos que influyen el alcance de crecimiento del eliminan la causa raíz del problema. Alternativamente, una
gránulo, con mayores salidas que producen gránulos más nueva solución llamada granulación espumosa utiliza el comgrandes. El efecto es causado por los mayores volúmenes portamiento único de la espuma acuosa para causar la rápida
de polvo que se acumulan en frente de las zonas de mez- dispersión del líquido aglutinante sobre una gran área del polclado presurizadas conforme se incrementa la velocidad de vo durante la humectación.
flujo, produciendo mayores fuerzas compresivas axiales en
las partículas presentes. De hecho, se ha demostrado que la Granulación espumosa
dispersión del aglutinante dentro de una masa escasamente El aglutinante espumoso acuoso utilizado en la granulación
humectada puede mejorarse para la granulación si el diseño espumosa está compuesto de un alto volumen de gas disperdel tornillo y la velocidad de flujo se ajustan para proporcio- sado dentro de un líquido que contiene excipientes es pumannar fuerzas de compresión apropiadas (6). Sin embargo, la tes, formando así una estructura semirrígida, inestable. Los
influencia de la velocidad de flujo sobre el crecimiento del excipientes efectivos para la granulación farmacéutica son
gránulo no se ve con frecuencia en los extrusores más peque- especies del éter de celulosa que promueven una alta actiños o en procesos altamente privados (4). El incremento de la vidad espumante y actúan como aglutinantes en el proceso.
velocidad del tornillo tiene menos influencia en el tamaño del Muchos excipientes aprobados no iónicos, poliméricos son
gránulo, pero generalmente incrementa el número de eventos también agentes espumantes adecuados. El líquido espumoso
de picado proporcionados por las zonas de mezclado para re- puede incluir aditivos (p.ej., especies poliméricas para agluducir la ocurrencia de partículas sobredimensionadas (4, 6, 9). tinación o recubrimiento y partículas, como APIs, deslizantes
Para una velocidad de flujo fija, el incremento de la velocidad y desintegrantes) en tanto no interfieran con su preparación.
del tornillo reducirá el volumen del polvo que llena los ele- Las espumas semirrígidas exhiben característicamente burbumentos del tornillo de transmisión, lo que resulta en menor jas estrechamente empacadas o una morfología polihédrica
que depende de la fracción gas-volumen aunque se requiere
consumo de polvo por el proceso.
Entre los estudios publicados para la granulación húmeda, un mínimo de 64% (v/v) de gas para que la espuma muestre
un punto crucial que rara vez se menciona, aunque es am- algún grado de rigidez. La fracción de volumen del gas prepliamente conocido en la industria farmacéutica, es la difi- sente en la espuma se conoce con frecuencia como su calicultad de humectar uniformemente una formulación en un dad espumante (FQ). Para la granulación, FQ generalmente
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 67
MAYO / JUNIO 2013
67
27/05/13 16:32
Granulado
con espuma
Figura 2: Distribución típica del equipo para la granulación
espumosa que muestra: (1) extrusor de doble tornillo,
(2) puerto de alimentación del polvo, (3) alimentador
gravimétrico para los excipientes en polvo, (4) rellenador
lateral, (5) generador de espuma mecánico y (6) tubo de
alimentación de espuma.
Figura 3: Una vista transversal del extrusor de doble
tornillo parcialmente lleno con excipientes e polvo (en
azul) muestra las diferencias en configuración usadas
para (a) inyectar directamente líquidos contra (b)
introducir espuma aglutinante dentro del proceso de
granulación.
Puerto de inyección
(a)
Sección transversal principal del extrusor
que muestra los elementos de transmisión
(b)
Rellenador lateral
se mantiene en un rango de 75-95%. Las espumas que están
demasiado húmedas (<75% de FQ) carecen de la estabilidad
adecuada para dispersarse bien y con frecuencia simplemente
se colapsan sobre las superficies del equipo de proceso. Las
espumas muy secas (>95% de FQ) ocupan volúmenes muy
grandes de espacio (lo que complica su adición dentro del
proceso confinado); muestran viscosidades inherentes muy
altas (tanto como 105 veces la de su líquido contenido) y se
colapsan más fácilmente en presencia de cizallamiento que
las espumas más húmedas (14).
La granulación espumosa fue introducida por primera
vez por Keary y Sheskey para el mezclado con alto cizallamiento de ingredientes farmacéuticos (15). Este estudio demostró que se requería menos líquido aglutinante y que la
68
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 68
MAYO / JUNIO 2013
velocidad de adición de la espuma podía ser mucho más alta
en comparación con la atomización con rocío. Los menores
requerimientos de líquido aglutinante fueron explicados en
los estudios de penetración en lecho estático de Tan et al.,
los cuales analizaron las características de saturación de la
espuma contra la humectación por goteo con lactosa y polvos
de vidrio Ballotini (16). Estos estudios observaron que más
masa aglutinante era absorbida por estos polvos mediante la
espuma contrariamente a la adición por goteo en cualquier
momento dado, y como resultado, los núcleos de los gránulos
eran 40% más grandes. Las espumas de mayor FQ fueron absorbidas más lentamente debido al engrosamiento más lento
de la espuma y al drenado más lento de su líquido contenido en el polvo de contacto (14, 17). Se han reportado varios
estudios de granulación espumosa para mezcladores de alto
cizallamiento (17-21).
La granulación espumosa continua con un extrusor de
doble tornillo fue introducida en un estudio de caso que comparó la técnica con el método de adición de líquido convencional (6). Una metodología exitosa para medir dicha espuma
dentro de la máquina requirió que se reconociera su conducta,
similar a la de un sólido, y utilizando esquemas comúnmente
empleados para la alimentación de sólidos a granel más que
de líquidos. Una unidad auxiliar, conocida como rellenador
(stuffer) lateral en la industria de la extrusión, se encontró que
era adecuada para la alimentación de la espuma. El rellenador
lateral está fácilmente disponible comercialmente, y el arreglo
físico y el software de control de la mayoría de los extrusores
pueden ser configurados para adaptarse a él. En la Figura 2
se muestra una disposición típica de la extrusión con el rellenador lateral y el generador se espuma. El rellenador lateral
es una barrena en miniatura, de doble tornillo que se monta en
un lado del extrusor principal y transporta los materiales a una
zona especificada del proceso. Debido a la acción de arrastreflujo de los tornillos rotatorios en el alimentador lateral, la
espuma se fuerza dentro de la formulación que va pasando
dentro del extrusor principal y se colapsa parcialmente con
el contacto, mientras que la espuma sobrante forma una capa
entre el polvo y el barril del extrusor. La Figura 3 destaca las
diferencias conceptuales entre la inyección líquida y la adición de espuma desde una vista perpendicular del extrusor. El
mecanismo de humectación con espuma dentro del extrusor
está todavía en estudio. Un modelo de dos etapas propuesto
en una publicación reciente se basó en la forma en que las
espumas preparadas de líquidos de diferentes viscosidades y
teniendo diferentes FQs se colapsaban y drenaban bajo diferentes condiciones de cizallamiento, así como la manera en
que afectaban las propiedades del gránulo del extrusor (14).
Se piensa que ocurre una etapa de humectación dirigida por
la presión en el punto de entrada en donde entra la espuma al
proceso, con las espumas más rígidas que mostraban mayor
resistencia colapsando inmediatamente con el contacto con la
formulación no humectada. La espuma sobrante, no colapsada empuja el polvo a un lado para formar una capa arriba. La
subsiguiente etapa de humectación conducida por el cizallamiento parece estar gobernada por la respuesta de la espuma
al cizallamiento; las capas de espuma más rígida se colapsan
más fácilmente bajo cizallamiento mecánico para humectar
el polvo debajo, mientras que las espumas más humectadas
muestran mayor resistencia al colapso bajo cizallamiento mecánico estableciendo morfologías más estables comprendidas
por burbujas más pequeñas.
Desde un punto de vista operacional, práctico, el método
“Granulación espumosa”continúa en la pág. 70
27/05/13 16:32
CALENDARIO DE EVENTOS
Cuando usted contacte a alguno de los organizadores de éstos eventos,
por favor mencione que vio su evento en
MAYO
3–6
World Biotechnology Congress 2013. Lugar: Boston,
USA Contacto / Info: http://www.pharmtech.com/
pharmtech/Events/World-Biotechnology-Congress-2013/
Event/detail/www.worldbiotechcongress.com
8 – 10
BIOtech Japón. Lugar: Tokyo Big Sight. Contacto / Info:
biotech@reedexpo.co.jp, Teléfonos: 81-3-3349-8518,
Página Web: www.bio-t.jp/en
13 – 16
Achemasia 2013. Lugar: Beijing, PRC China National
Convention Center. Contacto / Info: wu@dechema.
de, Teléfonos: + (49) 6975 64152, Página Web: http://
achema-content.dechema.de/
14 – 15
Expoplast Toronto 2013. Lugar: Toronto Congress
Center, 650 Dixon Road M9W 1J1 Toronto, Canadá.
Contacto / Info: info@congresmtl.com, Teléfonos: + (14)
16245 5000, Página Web: www.expoplast.org
JUNIO
4–6
ALIMENTARIA MEXICO 2013. Lugar: Centro Banamex,
México DF. Página Web: www.alimentaria-mexico.com/en
14 – 16
XXI COLAMIQC. Lugar: São Paulo – SP BRASIL.
Contacto / Info: congresso@colamiqc2013.com.
br, Teléfonos: 55 1150445466, Página Web: www.
colamiqc2013.com.br
18 – 21
EXPO PACK MÉXICO 2013. Lugar: Centro de
convenciones BANAMEX, Ciudad de México.
Contacto / Info: ventas@expopack.com.mx, Teléfonos:
(52) 55 5545 4254, Fax. + 52 (55) 5545-4302, Página
Web: www.expopack.com.mx
29 – 30
ENCUENTRO CIENTÍFICO 2013 FEUM – USP. LUGAR:
México D.F. Contacto / Info: QFB César Díaz / cdiaz@
farmacopea.org.mx Teléfonos: 5207-8187 y 52076887 Ext. 2822. Fax: ext. 2828. Página Web: www.
farmacopea.org.mx
25 – 27
CCPhI China 2013. Lugar: SNIEC, Shanghai, China,
Shanghai New International Expo Centre. Contacto / Info:
cphi@ubm.com, Teléfonos: + 86 2128906666, Página
Web: www.cphi-china.com
promueva su evento aquí
contrataciones (55) 5659-8880
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 69
MAYO / JUNIO 2013
69
27/05/13 16:32
Granulado
con espuma
“Granulación espumosa”continuación de la pág. 68
Tabla 1: Diferencias entre la adición de aglutinante
espumoso y líquido en la granulación
Adición de aglutinante en
espuma
Adición de aglutinante líquido
Granulación aceptable en concentraciones de aglutinante de
6% y 11%
Granulación aceptable sólo
con concentración del aglutinante de 11%
Baja compresión axial
preferida, de otra manera,
agregación excesiva observada
Temperatura de salida del
gránulo insensible en gran medida al proceso (menos de 40°C
en todos los casos)
Temperaturas del gránulo muy
altas (llegando a tanto como
90°C en condiciones de compresión axial alta
de granulación húmeda:
• Evita sobretensión del proceso en un extrusor de doble
tornillo debido a la alta área de cobertura de la espuma
sobre el polvo durante la humectación
• Simplifica el arranque del proceso porque las velocidades de operación completa pueden alcanzarse inmediatamente, no así con la inyección de líquido, donde el flujo
del polvo debe incrementarse lentamente para evitar sobrecarga del motor
• Reduce el desgaste de la máquina, indicado por el extrusor que ya no experimenta más los fuertes ruidos de
golpes que indican la deflexión del tornillo causada por
un flujo de polvo disparejo.
Se piensa que estas observaciones están relacionadas con
el mecanismo de humectación en dos etapas previamente descrito, el cual causa que el polvo se aísle inmediatamente de la
pared del barril por una capa de espuma, al menos hasta que
está bien humectado. El polvo en este caso está constantemente saturado con el aglutinante sobre un área mucho más
grande de contacto que en la adición directa de líquido, la cual
minimiza la concentración local del aglutinante en el material poroso. La característica de lubricación de la granulación
espumosa, en la cual la capa de espuma aísla los polvos de
la pared del barril hasta que está uniformemente humectado,
es un punto importante a ser subrayado para el proceso de
extrusión. La lubricidad de los sólidos transportados afecta
tanto al consumo de polvo por la maquinaria así como a la
temperatura de salida de los gránulos (2).
Comparación de granulación húmeda con espuma y
convencional
Un estudio a velocidades de flujo en escala piloto (20-40
kg/h) comparó la adición del aglutinante espumoso y la inyección directa del líquido en la granulación (6). Se utilizó
un aglutinante de metilcelulosa (Dow, Methocel A15 PLV)
en dos concentraciones, 6% y 11% (p/p), con relación a polvo de -lactosa monohidratada. Se probaron dos tornillos para
producir diferentes características de compresión axial (que
fueron mencionadas previamente como un factor importante
para el crecimiento del gránulo dentro del extrusor) con velocidad de flujo cambiante: una con un solo par de elementos de
mezclado que producen menor compresión axial (LAC) y una
segunda con dos pares en serie para proveer una vía de flujo
más restrictiva y mayor compresión axial (HAC). En la Tabla
1 se resumen las notables diferencias entre los dos métodos
de granulación. Las propiedades del gránulo del estudio mos70
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 70
traron que se alcanzaron tamaños y porosidad intragranular
comparables por cualquiera de los métodos, siempre que se
usaran las condiciones apropiadas. El requerimiento reducido
de líquido en el proceso fue un hallazgo comparable al que
se encuentra con los mezcladores de alto cizallamiento (15).
Conclusiones
La granulación húmeda en máquinas de extrusión de doble
tornillo tiene varias ventajas clave sobre los métodos convencionales, pero para avanzar a la aceptación para la producción
GMP, sus operaciones necesitan ser mejor entendidas y necesitan resolverse los desafíos con respecto a la estabilidad del
proceso. La granulación espumosa continua es una nueva técnica robusta que resuelve los problemas de sobretensión del
proceso que están relacionados con una pobre humectación
del polvo mediante los métodos convencionales, de adición
de líquido. La alta tendencia a la dispersión de la espuma en
la granulación, contra la naturaleza de remojo inmediato de
los líquidos, produce polvos humectados más uniformemente
e incrementa la lubricidad general del proceso, lo cual beneficia el comportamiento de desgaste de la máquina y minimiza
el calentamiento disipativo del producto. Con propiedades de
la partícula comprables a las de la granulación húmeda convencional, la granulación espumosa le da a los formuladores
mayor flexibilidad en el logro de los objetivos de producción.
Referencias
1. E.I. Keleb, A. Vermeire, C. Vervaet, and J.P. Remon, Drug Dev.
Ind. Pharm. 30 (6) 679-691 (2004).
2. L. Tan, A.J. Carella, Y. Ren, and J.B. Lo, Pharm. Dev. Tech. 16 (4)
302-315 (2011).
3. E.I. Keleb, A. Vermeire, C. Vervaet, and J.P. Remon, Inter. J.
Pharm. 239 (1-2) 69-80 (2002).
4. E.I. Keleb, A. Vermeire, C. Vervaet, and J.P. Remon, Inter. J.
Pharm. 273 (1-2) 183-194 (2004). 5. D. Djuric and P.
Kleinebudde, J. Pharm. Sci. 97 (11) 4934-4942 (2008).
6. M.R. Thompson, S. Weatherley, R.N. Pukadyil, and P.J. Sheskey,
Drug Dev. Ind. Pharm. 38 (7) 771-784 (2012).
7. W. Thiele, “Twin-Screw Extrusion and Screw Design,” in Pharmaceutical Extrusion Technology, I. Ghebre-Sellassie and C. Martin, Eds. (Marcel Dekker, New York, NY, 2003), pp. 69-98.
8. D. Djuric, et al., Eur. J. Pharm. Biopharm. 71 (1) 155-160 (2009).
9. M.R. Thompson and J. Sun, J. Pharm. Sci. 99 (4) 2090-2103
(2010).
10. R.M. Dhenge, et al., Pow. Tech., DOI: 10.1016/j.powtec.2012.05.045,
May 29, 2012.
11. U. Shah, Pharm. Tech. 29 (6) 52-66 (2005).
12. B. Van Melkebeke, C. Vervaet, and J.P. Remon, Inter. J. Pharm.
356 (1-2) 224-230 (2008).
13. N.O. Lindberg, C. Tufvesson, P. Holm, and L. Olbjer, Drug Dev.
Ind. Pharm. 14 (13) 1791-1798 (1988).
14. M.R. Thompson, B. Mu, and P.J. Sheskey, Pow. Tech., 228, 339348 (2012).
15. C.M. Keary and P.J. Sheskey, Drug Dev. Ind. Pharm., 30 (8) 831845 (2004).
16. M.X.L. Tan, L.S. Wong, K.H. Lum, and K.P. Hapgood, Chem.
Eng. Sci., 64 (12) 2826-2836 (2009).
17. M.X.L. Tan and K.P. Hapgood, Pow. Tech., 218, 149-156 (2012).
18. S.L. Cantor, S. Kothari, and O.M.Y. Koo, Pow. Tech., 195, 15-24
(2009).
19. P. Sheskey, C. Keary, D. Clark, and K. Balwinski, Pharm. Tech., 31 (4)
94-108 (2007).
20. M.X.L. Tan and K.P. Hapgood, Chem. Eng. Res. Des. 89 (5) 526536 (2011).
21. M.X.L. Tan and K.P. Hapgood, Chem. Eng. Sci. 66 (21) 5204-5211
(2011). PT
MAYO / JUNIO 2013
27/05/13 16:32
Directorio Clasificado
INST. Y EQUIPO PARA INSPECCIÓN
CONTROL Y MONITOREO DE PROCESOS
MAQUINARIA DE ACONDICIONAMIENTO /
AGRUPADORAS Y ENVOLVEDORAS
MAQUINARIA DE ACONDICIONAMIENTO /
BLISTERAS Y ENCARTONADORAS
MAQUINARIA DE ACONDICIONAMIENTO /
LLENADORAS Y TAPONADORAS
MAQUINARIA DE ACONDICIONAMIENTO /
LLENADORAS Y TAPONADORAS
VARIOS / CHAT MASCOTAS
Síguenos en...
El lugar para los amantes de sus mascotas
desde
Recibe consejos e información para el cuidado de tu mascota y
Consulta a Expertos que responderán a tus principales inquietudes sobre:
• Comportamiento / Entrenamiento
• Alimentación
• Higiene
• Control de plagas
• Enfermedades / padecimientos comunes
• y más
Comparte experiencias con otros dueños de mascotas
Conoce a otras mascotas como la tuya
Encuentra pareja para tu mascota
Compra regalos para tu mascota
Encuentra, Participa y Aprende
Pharmaceutical Technology en Español
PT MAYO / JUNIO.indd 71
MAYO / JUNIO 2013
71
27/05/13 16:32
ÍNDICE DE ANUNCIANTES
Maquinaria de Acondicionamiento y embalaje
Maquinaria de Acondicionamiento / Soplado , Llenado, Sellado
Maquinaria de Acondicionamiento / Llenadoras y Taponadoras
Maquinaria de Acondicionamiento / Blisteras y Encartoinadoras
Instrumentos y Equipos Analíticos - Biotecnología
Inst. y Equipo para Inspección. Control y Monitoreo de Procesos
Ingredientes Activos/ Excipientes y Vehículos
Ingredientes Activos/ Excipientes y Vehículos
Granuladores / Molinos
Equipo de Proceso / Tableteadoras y Encapsuladras
Equipo de Proceso / Encapsuladoras de Gelatina Blanda
Construcción y Sistemas Críticos / Cuartos Ambientales
Cápsulas de Gelatina Blanda
VEOLIA WATER SYSTEMS MEXICO S.A. DE C.V.
MEGA EMPACK
PACK FEEDER -PACK & PROCESS
WEILER ENGINEERING, INC.
ROTA - PACK & PROCESS
FABRIMA - PACK0TGM - PACK & PROCESS
SARTORIUS
OPTREL - PACK & PROCESS
MEXALC, S.A. DE C.V.
COLORCON
FITZ PATRICK - PACK & PROCESS
ACG -pam - PACK & PROCESS
SKY SOFTGEL CO., LTD - PACK & PROCESS
GRUPO IDEA
CATALENT
71
15
19
27
69
1
71
71
2a de forros
71
41
37
71
3ra. Forros
71
21
4ta. Forros
18
3
4
6
15
16
9
13
12
5
10
14
8
17
2
11
7
1
facebook Mas Q Perruqueria twitter @MASQUEPERRUQUERIA
www.petfacebook.com.mx
www.eolis.com.mx y www.comsaemte.com
www.purelabflex.com / E-mail: elga.mexico@veoliawater.com
www.megaempack.com
www.packprocess.com / Email: info@packprocess.com
www.weilerengineering.com / e-mail: solutions@weilerengineering.com
www.packprocess.com / Email: info@packprocess.com
www.packprocess.com / Email: info@packprocess.com
www.sartorius.com / Email: sartorius-stedim@sartomex.com.mx
www.packprocess.com / Email: info@packprocess.com
www.mexalc.com.mx / Email: tklabe@mexalc.com
www.colorcon.com/spanish
www.packprocess.com / www.fitzmill.com
www.packprocess.com / E-mail: info@packprocess.com
www.packprocess.com / Email: info@packprocess.com
www.grupoidea.com.mx / e-mail: atencionaclientes@grupoidea.com.mx
www.catalent.com / Email: consultas@catalent.com
DIRECCIÓN WEB / CORREO ELECTRÓNICO
Materiales de Envase y Empaque
EOLIS AMERICA LATINA S.A. DE C.V.
69
NO. PARA TARJETA DE
SERVICIO AL LECTOR
Materiales y Accesorios para Laboratorio / Purificadores de Agua para Laboratorio
PETFACEBOOK
No. PÁGINA
Sistemas de Aire Acondicionado
MAS QUE PERRRUQUERIA
EMPRESA
Varios / Chat Mascotas
PRODUCTO/SERVICIO
Varios / Estética para mascotas
Cuando usted contacte a alguno de estos anunciantes, por favor mencione que vió su anuncio en
27/05/13 16:32
PT MAYO / JUNIO.indd 72
MAYO / JUNIO 2013
Pharmaceutical Technology en Español
72
Marque en la tarjeta de servicio al lector el No. 1
Portada.indd 4
16/11/12 08:29