DEMANDA QUÍMICA DE OXÍGENO DE MUESTRAS ACUOSAS (a
Anuncio

DEMANDA QUÍMICA DE OXÍGENO
DE MUESTRAS ACUOSAS
(a) MÉTODO ALTERNATIVO
(b) TRATAMIENTO
DE
LOS
RESIDUOS GENERADOS POR
EL MÉTODO TRADICIONAL DE
REFLUJO ABIERTO Y POR EL
MÉTODO ALTERNATIVO
Landy Irene Ramírez-Burgos
Ma. del Carmen Durán-Domínguez-de-Bazúa
Juan Alejandro García-Fernández
Ramón Montuy-Hernández
Miguel Oaxaca-Grande
Serie: Química Ambiental de los Residuos Peligrosos
Vol. 1
Año 2008
1
® UNAM, Facultad de Química, PIQAyQA
Programa de Ingeniería Química Ambiental y de Química Ambiental (PIQAyQA)
Facultad de Química, Universidad Nacional Autónoma de México
ISBN: 968-36-9000-9
Responsables de la publicación:
M.A.I. Landy Irene Ramírez Burgos
Dra.-Ing. María del Carmen Durán Domínguez de Bazúa
Serie: Química Ambiental de las sustancias y de los Residuos Peligrosos
Volumen 1
(Primera edición, 2001, 100 ejemplares)
(Segunda edición, 2004, 500 ejemplares)
(Tercera edición, 2008, 100 ejemplares, versión electrónica)
México, D.F. México
Correos electrónicos (e-mail): mcduran@servidor.unam.mx y landy@servidor.unam.mx
2
CONTENIDO
LISTADO DE TABLAS Y FIGURAS
RESUMEN
ABSTRACT
CAPÍTULO I.
Generalidades
I.1
Introducción
I.2
Antecedentes
I.2.1 Significado de la demanda química de oxígeno (DQO)
I.2.2. Importancia de la demanda química de oxígeno (DQO)
I.2.3 Problemática de los residuos generados con la determinación
de la DQO
I.2.4 Problemática en estudio
I.3
Estrategia
I.3.1 Objetivos generales
I.3.2 Objetivos específicos
CAPÍTULO II.
Fundamentos
II.1
Métodos para la evaluación de la DQO
II.1.1 Ensayo de oxidación al permanganato (reflujo abierto)
II.1.2 Método normalizado de oxidación al dicromato (reflujo
abierto)
II.1.3 Método normalizado de oxidación al dicromato (reflujo
cerrado titulométrico)
II.1.4 Método normalizado de oxidación al dicromato (reflujo
cerrado colorimétrico)
II.1.5 Ensayos de evaluación rápida de DQO (reflujo cerrado)
II.1.6 Métodos instrumentales
II.2
Legislación y normatividad mexicana vigente en materia de
residuos peligrosos
II.2.1 Sistema legal
II.2.2 Ley General del Equilibrio Ecológico y la Protección al
Ambiente
II.2.3 Reglamento sobre residuos peligrosos
II.2.4 Normas oficiales mexicanas sobre residuos peligrosos
II.3
Alternativas de solución para la estabilización de residuos
peligrosos
II.3.1 Minimización en la fuente
II.3.2 Recuperación y reciclaje
II.3.3 Tratamientos
II.3.3.1 Tratamientos físicos-y/o químicos
II.3.3.2 Tratamientos biológicos
II.3.3.3 Tratamientos térmicos
II.3.4 Disposición final
II.3.5 Factores importantes en la selección de tecnologías
II.4
Generalidades para plata, mercurio y cromo
II.4.1 Plata
II.4.1.1 Generalidades
II.4.1.2 Propiedades químicas
II.4.1.3 Reacciones
II.4.1.4 Usos en la industria
II.4.1.5 Toxicidad
II.4.2 Mercurio
II.4.2.1 Generalidades
II.4.2.2 Propiedades químicas
II.4.2.3 Reacciones
3
Página
6
8
9
10
10
12
12
12
14
15
15
16
16
18
18
19
19
19
19
20
20
20
20
22
23
23
25
25
26
26
27
32
33
37
39
39
39
39
40
41
41
41
42
42
43
44
CAPÍTULO III
.
CAPÍTULO IV
II.4.2.4 Usos en la industria
II.4.2.5 Toxicidad
II.4.3 Cromo
II.4.3.1 Generalidades
II.4.3.2 Propiedades químicas
II.4.3.3 Reacciones
II.4.3.4 Usos en la industria
II.4.3.5 Toxicidad
Fase experimental (metodología)
III.1
Descripción de las fuentes de aguas residuales utilizadas para el
estudio comparativo en la determinación de DQO
III.1.1 Vinazas
III.1.2 Cempasúchil
III.1.3 Nejayote
III.1.4 Materiales, equipo y reactivos
III.1.5 Descripción de metodología
III.2
Técnicas empleadas para determinar DQO
III.2.1 Método colorimétrico (reflujo cerrado)
III.2.2 Método estándar de reflujo abierto
III.3
Residuos generados por los métodos en estudio para la
determinación de DQO
III.3.1 Análisis del residuo
III.3.1.1 Toma de muestra
III.3.1.2 Caracterización del residuo
III.3.2 Análisis cualitativo
III.3.3 Análisis cuantitativo
III.3.3.1 Determinación de la concentración total para cada
metal
III.3.3.2. Determinación de la concentración para cada uno
de los metales en su respectivo estado de oxidación
III.4
Proceso físico-químico de eliminación de metales
III.4.1 Equipo
III.4.2 Material
III.4.3 Reactivos
III.4.4 Metodología
III.4.5 Descripción química del proceso
Análisis de resultados y discusión
IV.1
Evaluación de las metodologías para determinar la DQO
IV.1.1 Resultados obtenidos con las dos metodologías evaluadas
para cada una de las aguas residuales estudiadas
IV.1.2 Análisis de costos en materia de reactivos utilizados en las
determinaciones de la DQO
IV.2
Evaluación del sistema propuesto para la estabilización de los
residuos de la DQO
IV.2.1 Análisis cualitativo
IV.2.2 Análisis del residuo antes y después de aplicar el proceso
físico-químico propuesto
IV.2.2.1 Concentración inicial y final de los contaminantes
(resultados cuantitativos)
IV.2.2.2 Por ciento de eliminación de metales
IV.2.3 Comparación con la normatividad mexicana para residuos
peligrosos
IV.2.4 Disposición de los residuos generados en el proceso
físico-químico de eliminación de metales
IV.2.5 Análisis técnico-económico del proceso de tratamiento
4
45
45
46
46
47
49
50
50
51
52
52
54
55
56
56
57
57
59
62
63
63
63
64
66
66
66
68
70
70
70
71
72
74
74
74
75
78
78
79
79
80
82
84
85
CAPÍTULO V
propuesto
Conclusiones y recomendaciones
V.I
Conclusiones
V.2
Recomendaciones
Anexos
Anexo A Preparación de la curva de calibración
Anexo B Valores experimentales de DQO
Anexo C Resultados estadísticos generales obtenidos para los valores
promedio de DQO
Anexo D Condiciones analiticas para la determinación de plata, mercurio y
cromo
Anexo E Preparación de reactivos para el proceso de eliminación de
metales
Anexo F Normatividad aplicable
Bibliografía
Bibliografía consultada (sin citas en el texto)
5
88
88
89
91
92
94
114
117
127
128
151
155
LISTA DE TABLAS Y FIGURAS
Figura I.1
Figura II.1
Figura III.1
Figura III.2
Tabla I.1
Tabla III.1
Tabla III.2
Tabla III.3
Tabla III.4
Tabla III.5
Tabla III.6
Tabla III.7
Tabla III.8
Tabla IV.1
Tabla IV.2
Tabla IV.3
Tabla IV.4
Tabla IV.5
Tabla IV.6.
Tabla IV.7.
Tabla IV.8
Tabla IV.9
Tabla IV.10
Tabla IV.11
Tabla IV.12
Tabla IV.13
Tabla IV.14
Tabla IV.15
Tabla IV.16
Tabla IV.17
Tabla IV.18
Tabla IV.19
Tabla IV.20
Tabla IV.21
Tabla IV. 22
Tabla IV.23
Tabla A.1
Tabla B.1
Tabla B.2
Tabla B.3
Tabla B.4
Seguimiento en línea de una planta de tratamiento de aguas residuales
Sistema legal mexicano
Diagrama de bloques de los procesos empleados
Ejemplificación del proceso propuesto para estabilizar los residuos de la DQO
Límites máximos permisibles para Cr, Hg y Ag según la NOM-052-ECOL-93
Composición promedio de vinazas generadas en una destilería de alcohol de caña
Caracterización de aguas de ensilado y prensado
Composición promedio del nejayote
Relación entre volúmenes de muestra y de reactivo para el método colorimétrico
Generación de residuos por el método estándar de reflujo abierto
Generación de residuos: método rápido colorimétrico de reflujo cerrado
Porcentaje de reducción de residuos peligrosos para ambos métodos
Algunas características del residuo estudiado
Costo de reactivos utilizados en la determinación de la DQO
Costo de reactivos preparados para el método estándar
Costo de reactivos por prueba unitaria para el método estándar
Costo de reactivos para el método colorimétrico
Costo de reactivos por prueba unitaria por el método colorimétrico
Comparación de costos por prueba unitaria para ambos métoodos
Resultados del análisis cualitativo para cada uno de los tanques
Concentraciones inicial y final para el tanque 1
Concentraciones inicial y final para el tanque 2
Concentraciones inicial y final para el tanque 3
Concentraciones inicial y final para el tanque 4
Por ciento de eliminación para el tanque 1
Por ciento de eliminación para el tanque 2
Por ciento de eliminación para el tanque 3
Por ciento de eliminación para el tanque 4
Concentración final en el tanque 1 y su comparación con la NOM-052-ECOL1993
Concentración final en el tanque 2 y su comparación con la NOM-052-ECOL1993
Concentración final en el tanque 3 y su comparación con la NOM-052-ECOL1993
Concentración final en el tanque 4 y su comparación con la NOM-052-ECOL1993
Cantidad de AgCl y Hg2Cl2 obtenida en cada tanque
Cantidad de Cr(OH)3 y HgO obtenida en cada tanque
Costo de material
Costo de reactivos
Cantidades de solución para la elaboración de la curva de calibración
Valores experimentales triplicados de DQO obtenidos de una solución estándar de
hidrogenoftalato de potasio de concentración conocida (680mg/1000mL) por el
método colorimétrico
Valores experimentales triplicados de DQO obtenidos de una solución estándar de
hidrogenoftalato de potasio de contración conocida (680mg/1000mL) por el
método estándar
Valores experimentales triplicados de DQO obtenidos de una solución estándar de
glucosa de concentración conocida (50mg/100mL) por el método colorimétrico
Valores experimentales triplicados de DQO obtenidos de una solución estándar de
glucosa de concentración conocida (50mg/100mL) por el método estándar
6
Página
13
21
69
73
15
53
55
55
58
62
63
63
64
75
76
77
77
78
78
79
79
80
80
80
81
81
81
82
82
83
83
84
85
85
86
87
92
94
94
95
95
Tabla B.5
Tabla B.6
Tabla B.7
Tabla B.8
Tabla B.9
Tabla B.10
Tabla B.11
Tabla B.12
Tabla B.13
Tabla B.14
Tabla B.15
Tabla B.16
Tabla B.17
Tabla B.18
Tabla B.19
Tabla B.20
Tabla B.21
Tabla B.22
Tabla C.1
Tabla C.2
Tabla C.3
Tabla C.4
Tabla C.5
Tabla C.6
Tabla D.1
Tabla D.2
Tabla D.3
Resultados obtenidos de DQO en muestras triplicadas de agua de cempasúchil
analizadas por el método colorimétrico, empleando una dilución de 1mL/100mL
Resultados obtenidos de DQO en muestras triplicadas de agua de cempasúchil
analizadas por el método estándar, empleando una dilución de 1mL/100mL
Resultados obtenidos de DQO en muestras triplicadas de agua de cempasúchil
analizadas por el método colorimétrico, empleando una dilución de 1mL/500mL
Resultados obtenidos de DQO en muestras triplicadas de agua de cempasúchil
analizadas por el método estándar, empleando una dilución de 1mL/500mL
Resultados obtenidos de DQO en muestras triplicadas de agua de cempasúchil
analizadas por el método colorimétrico, empleando una dilución de 1mL/1000mL
Resultados obtenidos de DQO en muestras triplicadas de agua de cempasúchil
analizadas por el método estándar, empleando una dilución de 1mL/1000mL
Resultados obtenidos de DQO en muestras triplicadas de agua de vinazas
analizadas por el método colorimétrico, empleando una dilución de 1mL/100mL
Resultados obtenidos de DQO en muestras triplicadas de agua de vinazas
analizadas por el método estándar, empleando una dilución de 1mL/100mL
Resultados obtenidos de DQO en muestras triplicadas de agua de vinazas
analizadas por el método colorimétrico, empleando una dilución de 1mL/500mL
Resultados obtenidos de DQO en muestras triplicadas de agua de vinazas
analizadas por el método estándar, empleando una dilución de 1mL/500mL
Resultados obtenidos de DQO en muestras triplicadas de agua de vinazas
analizadas por el método colorimétrico, empleando una dilución de 1mL/1000mL
Resultados obtenidos de DQO en muestras triplicadas de agua de vinazas
analizadas por el método estándar, empleando una dilución de 1mL/1000mL
Resultados obtenidos de DQO en muestras triplicadas de agua de nejayote
analizadas por el método colorimétrico, empleando una dilución de 1mL/100mL
Resultados obtenidos de DQO en muestras triplicadas de agua de nejayote
analizadas por el método estándar, empleando una dilución de 1mL/100mL
Resultados obtenidos de DQO en muestras triplicadas de agua de nejayote
analizadas por el método colorimétrico, empleando una dilución de 1mL/500mL
Resultados obtenidos de DQO en muestras triplicadas de agua de nejayote
analizadas por el método estándar, empleando una dilución de 1mL/500mL
Resultados obtenidos de DQO en muestras triplicadas de agua de nejayote
analizadas por el método colorimétrico, empleando una dilución de 1mL/1000mL
Resultados obtenidos de DQO en muestras triplicadas de agua de nejayote
analizadas por el método estándar, empleando una dilución de 1mL/1000mL
Resultados estadísticos generales obtenidos para los valores promedio de DQO en
las soluciones estándar por los métodos analíticos estándar y colorimétrico
Resultados estadísticos generales obtenidos para los valores promedio de DQO
para la muestra de agua residual de cempasúchil a diferentes concentraciones por
los métodos analíticos estándar y colorimétrico
Resultados estadísticos generales obtenidos para los valores promedio de DQO
para la muestra de agua residual de vinazas a diferentes concentraciones por los
métodos analíticos estándar y colorimétrico
Resultados estadísticos generales obtenidos para los valores promedio de DQO
para la muestra de agua residual de nejayote a diferentes concentraciones por los
métodos analíticos estándar y colorimétrico
Intervalos de confianza obtenidos para los métodos analíticos estándar y
colorimétrico sobre las soluciones estándar a diferentes concentraciones
Intervalos de confianza obtenidos para los métodos analíticos estándar y
colorimétrico sobre las aguas residuales analizadas a diferentes concentraciones
Condiciones óptimas para el análisis de plata, mercurio y cromo mediante
espectrofotometría de absorción atómica
Lecturas para concentración de plata
Lecturas para concentración de mercurio
7
95
97
98
99
101
102
103
104
105
106
107
108
109
110
111
112
113
114
115
115
115
115
116
116
120
124
125
Tabla D.4
Lecturas para concentración de cromo
126
8
DEMANDA QUÍMICA DE OXÍGENO
(a) Método alternativo
(b) Tratamiento de los residuos generados por el método tradicional de reflujo
abierto y por el método alternativo
RESUMEN
Se presenta un método alternativo para analizar el contenido de contaminantes en aguas basado
en la prueba analítica llamada DEMANDA QUÍMICA DE OXÍGENO (DQO) empleada en el
laboratorio del Programa de Ingeniería Química Ambiental y de Química Ambiental
(PIQAyQA), pero que consume menos reactivos y genera menos residuos. También se presenta
una metodología o proceso para separar selectivamente los metales pesados del residuo líquido
procedente de la determinación de la DQO. En primer término se realizó un análisis mediante
absorción atómica y se encontró que el residuo líquido contenía los siguientes metales: Ag+,
Hg22+, Hg2+, Cr3+, Cr6+. La concentración de plata, mercurio y cromo sobrepasaba los límites
máximos permisibles establecidos en la normatividad mexicana, por lo que se le considera un
residuo líquido peligroso de acuerdo con la Norma Oficial Mexicana NOM-052-ECOL-1993.
Después se planteó un tratamiento físico-químico para separar estos metales del líquido que los
contenía ya que, sabiendo los tipos de metales presentes, su estado de oxidación, su estado físico,
el volumen, factores económicos y la legislación, es posible estabilizarlos de manera sencilla en
función de los reactivos, equipos y material existentes en el laboratorio. El proceso se basa en
tres pasos, en cada uno de los cuales se llevan a cabo reacciones específicas para cada uno de los
metales en su respectivo estado de oxidación. En el primer paso se agrega ácido clorhídrico
(HCl) precipitando la plata Ag+ como cloruro de plata (AgCl↓) y el catión mercurioso Hg22+
como cloruro mercurioso (Hg2Cl2↓). En el segundo paso se agrega sulfato ferroso amoniacal,
,
Fe(NH4)2 (SO4)2, para reducir el Cr6+ a Cr3+ y precipitarlo en un medio básico. El tercer y último
paso consiste en agregar hidróxido de sodio NaOH para precipitar el Cr3+ como hidróxido de
cromo Cr(OH)3↓ y el catión mercúrico Hg2+ como óxido de mercurio (HgO↓). La última fase de
esta investigación consistió en realizar análisis sistemáticos para determinar las cantidades de
metales que realmente se están eliminando al estabilizar los residuos. La principal ventaja de este
proceso físico-químico es que se tiene un por ciento de eliminación del 90%, recuperando los
metales que pueden ser reutilizados ó puede dárseles una disposición final adecuada. Los
residuos sólidos obtenidos en el proceso, se siguen investigando para tratar de recuperar los
metales y de esta forma poder volver a utilizarlos. El costo de este proceso es relativamente bajo,
ya que los reactivos empleados son todos de grado industrial, que son más baratos que los
reactivos de grado analítico. Además, no se requiere equipo especial ni material costoso y el área
donde se realiza el tratamiento no necesita ser ni grande ni exclusiva. El proceso físico-químico
planteado representa una metodología específica cuya estrategia puede ser una alternativa de
solución para los problemas creados por la generación de residuos líquidos peligrosos similares
en los laboratorios de docencia e investigación.
Palabras clave:DQO, residuo peligroso, tratamiento
9
CHEMICAL OXYGEN DEMAND
(a) Alternative method
(b) Treatment of residues generated by the traditional method of open reflux
and by the alternative method
ABSTRACT
An alternative method for analyzing the contents of pollutants in waters based on the analytical
test known as CHEMICAL OXYGEN DEMAND (COD) used in the laboratories of the Program
for Environmental Chemical Engineering and Chemistry but that consumes much less reagents
generating less residues was established. Also, a methodology or process was developed to
selectively separate the heavy metals present in the liquid residue produced during the COD
laboratory analysis of waters. An atomic absorption analysis showed that this liquid residue
contained Ag+, Hg22+, Hg2+, Cr3+, Cr6+. The mercury, silver and chromium concentrations were
higher than the established Mexican law limits, and thus, these liquid residues should be
considered hazardous wastes according to the Mexican Official Norm (Norma Oficial Mexicana
NOM-052-ECOL-1993). A physicochemical treatment was devised to selectively separate these
metals from the waste liquid, according to its state of oxidation, physical state, total volume,
economic factors, and normativity limits considering the availability of unexpensive reagents and
usually found equipments and materials in any teaching and/or research laboratory. The
separation process is based in three steps, where specific reactions are carried out depending
upon the metals oxidation state. In the first step, hydrochloric acid (HCl) is added to precipitate
silver Ag+ as silver chloride (AgCl↓) and mercurous cations Hg22+ as mercurous chloride
(Hg2Cl2↓). In the second step, ferrous ammonia sulfate, FAS, Fe(NH4)2 (SO4)2, is added to
,
reduce Cr6+ to Cr3+ and precipitate it in a basic milieu. The third and last step consist in adding
sodium hydroxide NaOH for precipitating Cr3+ as chromium hydroxide Cr(OH)3↓ and the
mercuric cation Hg2+ as mercuric oxide (HgO↓). The last phase of this research consisted in
systematically analyze the amounts of metals that are really eliminated during the residues
stabilization process. The main advantage of this physicochemical process is that a 90%
elimination efficiency is reached, and the metals are recovered as chlorides and oxides,
susceptible of being recycled by private companies. Further research is being carried out for this
recovery process. The costs associated to this process are relatively low, since the reagents used
are industrial grade, considerably less expensive than those of analytical grade. Besides, no
special equipment or materials are required and the areas needed in the laboratory to carry it out
are neither big nor exclusive for this purpose. The physicochemical process proposed represents a
specific methodology within the strategy adopted by our laboratories to solve the problems
created by the generation of hazardous liquid residues in both research and teaching laboratories.
Keywords: COD, hazardous waste, treatment
10
CAPÍTULO I
GENERALIDADES
I.1
INTRODUCCIÓN
En la naturaleza no se generan desperdicios puesto que los residuos de un proceso biológico se
aprovechan como insumos en otro. Sin embargo, los seres humanos desarrollan actividades y
procesos productivos ineficientes que consumen grandes cantidades de energía, agua ó materias
primas, que producen grandes cantidades de residuos ya que no son aprovechados para otros
procesos y solamente son acumulados en tiraderos o enviados a diferentes esferas del ambiente
(Cortinas-de-Nava y Gleason, 1993). Esta generación de residuos ha obligado a tomar medidas,
no sólo a nivel nacional sino también a nivel mundial. En México, es importante crear una
conciencia del problema que esto ocasiona ya que, por lo general, se observa que la mayor parte
de los residuos tienen una disposición clandestina en tiraderos municipales, barrancas, drenajes
municipales, ríos, lagos, etcétera, ocasionando un deterioro para el ambiente.
Los residuos varían según el tipo de actividades y formas de consumo que los generan. Por esta
razón, los residuos se pueden clasificar para su estudio en emisiones hacia la atmósfera, en aguas
contaminadas y residuos industriales. Estos últimos se clasifican en residuos no peligrosos y
residuos peligrosos. La Ley General de Equilibrio Ecológico y Protección al Ambiente (DOF,
1996) define a un residuo peligroso como aquel residuo, en cualquier estado físico, que por sus
características corrosivas, reactivas, explosivas, tóxicas, inflamables o biológico-infecciosas,
representen un peligro para la salud, el ambiente; o se encuentre listado en la NORMA OFICIAL
MEXICANA NOM-052-ECOL-1993.
Anteriormente, el interés de la norma jurídica se centraba en corregir los efectos de la
contaminación sobre la salud humana, sin considerar de manera integral, las causas que la
originaban; es decir, se abocaba exclusivamente a la prevención y control de la contaminación a
través de normas que se limitaban a establecer sanciones para corrección de conductas que
produjeran efectos indeseables. De esta manera no se identificaban las causas que están en la
base de la problemática ecológica y se trataba el fenómeno como un conjunto de conductas
individuales que debían ser corregidas a través de castigos.
Actualmente, en la política ambiental tienen privilegio los instrumentos de ejecución cuya
finalidad es prevenir la ocurrencia de situaciones nocivas para los ecosistemas, con base en la
consideración de que, por lo general, la eliminación del daño ambiental tiene un costo más alto
para la sociedad que su prevención e, incluso, que no siempre esa eliminación es posible.
11
Por lo anterior, se ha considerado sumamente importante contar con la información científicotécnica sobre las propiedades y efectos de los productos químicos, que permitan el
establecimiento de reglas y de mecanismos que prevengan, reduzcan o controlen sus riesgos,
concluyendo que la manera más eficaz para la reducción de dichos riesgos, es el empleo del
enfoque del ciclo de vida integral, es decir, controlarlos desde “su cuna hasta su tumba”, lo cual
implica la necesidad de una coordinación intersectorial eficaz y eficiente.
El uso sustentable de los recursos naturales, así como la optimación de los recursos naturales,
toman gran importancia día a día, en particular en épocas de crisis. El usar eficientemente los
recursos, controlar y minimizar los residuos introduce una nueva cultura de producción que, a su
vez, conduce a la reingeniería de la planta productiva.
El principio más importante que rige a una política de control y manejo de residuos debe ser el de
evitar su generación o, al menos, minimizarla. Esto obedece a las propias leyes de la naturaleza
(primera y segunda leyes de la termodinámica), por lo que esto no se puede evitar totalmente,
sino que se debe limitar su volumen a lo mínimo, someter los residuos generados a tratamiento y
seleccionar la disposición final más adecuada.
El Programa de Ingeniería Química y de Química Ambiental (PIQAyQA), de la UNAM, se
encarga de realizar diversas actividades para la solución de problemas ambientales. Una de las
más importantes la conforma la implantación de "tecnologías más limpias", en las cuales la
generación de residuos, gasto de agua y consumo de energía se minimizan.
Este trabajo se presenta como una alternativa aplicable para cualquier laboratorio, enfocada
justamente a minimizar la generación de residuos. El caso específico que se aborda aquí es el de
los residuos generados en la determinación de la demanda química de oxígeno (DQO) en
muestras líquidas.
La DQO es una prueba que se realiza en muchos laboratorios, ya que es uno de los parámetros
más usados para establecer la concentración de materia orgánica en muestras de aguas y aguas
residuales. Durante la aplicación de esta prueba se genera una cantidad importante de residuos
considerados como peligrosos por su contenido de metales (cromo hexavalente, plata y
mercurio), de acuerdo a la Norma Oficial Mexicana, NOM-052-ECOL-1993.
Por lo anterior, en esta investigación también se propone una técnica alternativa que permita la
minimización de los residuos que se generan durante la aplicación de esta prueba lo que, a su vez,
repercutirá en un ahorro de reactivos y una menor afectación al ambiente y de una metodología
para tratar los residuos generados durante la realización de esta prueba analítica, sea por el
método tradicional o por la alternativa propuesta. En la prueba se emplean reactivos que
.
contienen metales, tales como Ag+, Hg22+, Hg2+, Cr3+ y Cr6+ , que hacen que a estos residuos se
les considere como residuos peligrosos.
En la actualidad, la política nacional de residuos peligrosos, acuerda la importancia prioritaria a
la reducción de su generación y peligrosidad en la fuente; en particular, mediante la adopción de
procesos productivos más limpios.
12
Por otro lado, la segunda prioridad es su reutilización o “reúso”, reciclado y recuperación y la
última prioridad es su tratamiento y disposición final, todo ello, de manera ambientalmente
adecuada (Cortinas-de-Nava y Gleason, 1993).
Considerando las prioridades nacionales anteriores sobre residuos peligrosos, el proceso
propuesto se basa principalmente en estas dos últimas debido a que se busca una recuperación de
los metales (separación selectiva), para poderles dar un nuevo uso o “reúso” o cuando no sea
posible esta recuperación, darles un tratamiento para eliminar los metales pesados y obtener un
residuo inocuo.
Existen diferentes técnicas, procesos o métodos para tratar a un residuo peligroso y el proceso
propuesto para este trabajo es solamente una opción más y se basa en un tratamiento físicoquímico que maneja operaciones unitarias simples como son: Neutralización, precipitación,
óxido-reduccción y centrifugación.
I.2
ANTECEDENTES
I.2.1.
SIGNIFICADO DE LA DEMANDA QUÍMICA DE OXÍGENO (DQO)
La demanda química de oxígeno (DQO) es un parámetro químico, que representa una medida de
toda la materia orgánica e inorgánica presente en disolución y/o suspendida que puede ser
químicamente oxidada, por la acción de agentes oxidantes, bajo condiciones ácidas y se mide
como miligramos de “oxígeno” equivalentes a la fracción orgánica disuelta y/o suspendida por
litro de disolución (agua residual) (Anexo A).
En esta determinación la materia orgánica es oxidada a bióxido de carbono y agua:
Agente oxidante
K2Cr2O7
Materia orgánica e inorgánica
oxidable
I.2.2.
Condiciones:
Medio ácido
T = 145ºC
t=2h
Bióxido de carbono + Agua + K2Cr2O7
(remanente)
IMPORTANCIA DE LA DEMANDA QUÍMICA DE OXÍGENO (DQO)
La DQO es un parámetro importante y lo suficientemente rápido para determinar el grado de
contaminación del agua y puede ser empleada para estimar la eficiencia de una planta de
tratamiento de aguas residuales.
13
Mediante este parámetro se realiza un seguimiento monitorio y se puede dar un seguimiento en
línea de la calidad del agua residual en tratamiento, midiendo la DQOInf (a la entrada) y la
DQOEfl (a la salida).
Esto se puede ejemplificar mediante la Figura I.1.
AGUA
RESIDUAL
DQOInf
PLANTA DE
TRATAMIENTO
DQOEfl
AGUA
TRATADA
Muestreo en línea para seguimiento (monitorio) y control
Figura I.1 Seguimiento en línea de una planta de tratamiento de aguas residuales
Mediante esta evaluación monitoria en línea se puede saber si el tratamiento es el adecuado y el
por ciento de eficiencia de depuración en el agua de salida.
A continuación se da un ejemplo de esto.
Ejemplo:
Se tiene un agua residual proveniente de una fábrica X con una DQO soluble de 2,000 mg/L.
Después de pasar a través de una planta de tratamiento, se logra obtener una DQO de 90 mg/L.
Se desea saber el grado de depuración obtenido (% de remoción de materia orgánica medida
como DQO).
Datos:
DQOInf = 2,000 mg/L
DQOEfl = 90 mg/L
Para calcular el % de remoción es necesario calcular la DQOremovida, ésta se calcula de la
siguiente manera:
DQOremovida = DQOInf - DQOEfl
Sustituyendo los datos:
DQOremovida = 2,000 mg/L - 90 mg/L
DQOremovida = 1,910 mg/L
Para calcular el % de remoción se utiliza la siguiente fórmula:
14
DQOremovida
% de remoción = ---------------------- *100
DQOInf
Sustituyendo los datos obtenidos se tiene:
1,910 mg/L
% de remoción = --------------------- *100
2,000 mg/L
% de remoción = 95.5 % de materia orgánica medida como DQO
En este ejemplo se ve claramente la importancia de realizar una evaluación monitoria en línea, ya
que sabiendo la DQO a la entrada de la planta de tratamiento y la DQO a la salida de ésta, puede
saberse rápidamente el % de depuración, o sea, la eficiencia del sistema de depuración.
I.2.3.
PROBLEMÁTICA DE LOS RESIDUOS GENERADOS CON
DETERMINACIÓN DE LA DEMANDA QUÍMICA DE OXÍGENO (DQO)
LA
Para determinar la DQO, los métodos más usados, precisos y confiables son el de la oxidación
por dicromato (APHA, 1985) y el “método rápido” (Jeris, 1967). Ambos métodos utilizan los
siguientes reactivos:
• Dicromato de potasio (K2Cr2O7), agente oxidante
• Sulfato de plata (Ag2SO4), catalizador de la reacción
• Sulfato mercúrico (HgSO4), sirve para precipitar algunos iones inorgánicos como los Cl-, etc.
• Sulfato ferroso amoniacal hexahidratado Fe(NH4)2(SO4)2*6H2O, para titular el exceso de
cromo
• Ácido sulfúrico concentrado (H2SO4), medio donde se realiza la reacción
Después de realizada la determinación (DQO), se obtiene un residuo que, de acuerdo a la
NORMA OFICIAL MEXICANA NOM-052-ECOL-1993 (Anexo F), debe ser considerado como
un residuo peligroso debido a que contiene mercurio, plata y cromo en concentraciones por arriba
de lo establecido por la normatividad mexicana.
Los límites máximos permisibles que esta Norma marca para estos elementos se encuentran en la
Tabla I.1.
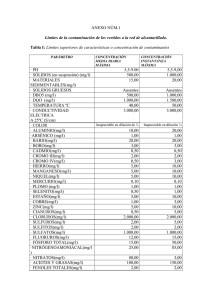
Tabla I.1 Límites máximos permisibles para cromo, mercurio y plata, según la NORMA
OFICIAL MEXICANA NOM-052-ECOL-93
15
CONSTITUYENTES
INORGÁNICOS
CONCENTRACIÓN
MÁXIMA PERMITIDA
(ppm)
5.0
0.2
5.0
CROMO HEXAVALENTE
MERCURIO
PLATA
I.2.4.
PROBLEMÁTICA EN ESTUDIO
Para auxiliar a los diferentes laboratorios de la UNAM, al sector paraestatal e industrias privadas
y a las oficinas de gobierno en la solución de sus problemas ambientales, especialmente debidos
a la generación de residuos peligrosos, en julio de 1989 se creó el Programa de Ingeniería
Química Ambiental y de Química Ambiental (PIQAyQA) (Bazúa-Durán, 1994). Para resolver
estos problemas el PIQAyQA realiza múltiples investigaciones en diversos laboratorios, que
manejan sustancias peligrosas, en pequeñas cantidades. Algunas de estas sustancias provienen de
la determinación analítica de la demanda química de oxígeno (DQO), parámetro químico que es
ampliamente utilizado en casi todos los laboratorios que hacen estudios ambientales y que, por
las características de las sustancias que se emplean (Inciso I.2.3), es considerado un residuo
peligroso y como tal se le debe manejar.
I.3
ESTRATEGIA
Para la primera parte de este trabajo se propuso la utilización de una técnica alternativa al método
estándar tradicional utilizado en el PIQAyQA y en muchos laboratorios analíticos. Para llevar a
efecto dicho estudio, se compararon dos métodos utilizados para la determinación de la demanda
química de oxígeno; el método estándar de reflujo abierto (utilizado en el PIQAyQA y en la
mayor parte de los laboratorios analíticos en México y otros países) y el método rápido microcolorimétrico de reflujo cerrado (alternativo).
Se analizaron muestras de soluciones estándar de concentración conocida para establecer las
diferencias reales existentes entre ellos. Se aplicaron pruebas de DQO por ambos métodos y se
realizó el análisis para cada prueba por triplicado.
Esta prueba se aplicó a las diferentes aguas residuales agroindustriales que se encontraban en
estudio en el PIQAyQA (cempasúchil, vinazas y nejayote) para establecer el tiempo mínimo
óptimo que permitiera la reproducibilidad de los resultados para cada agua residual. Cabe
mencionar que el análisis se realizó empleando diferentes concentraciones, para cada tipo de
agua residual.
Para la segunda parte se analizaron las características físicas del residuo generado por las
mediciones de demanda química de oxígeno; después se realizó un análisis cualitativo para
comprobar que ciertamente se tenían plata, mercurio y cromo; y, posteriormente, se realizó un
análisis cuantitativo para saber la cantidad que existía de cada uno de los metales en cada tanque.
16
Asimismo, se realizó una investigación bibliográfica detallada sobre la normatividad existente
con respecto a los residuos peligrosos, las alternativas en el manejo y la disposición final de los
residuos peligrosos y las generalidades para cada uno de los metales (propiedades físicas,
químicas, reacciones específicas, usos en la industria y toxicidad). Esta revisión bibliográfica
sirvió para sustentar el proceso planteado en este trabajo, el cual, una vez comprobado
experimentalmente se aplicó a los residuos generados en el PIQAyQA en la determinación de la
DQO.
I.3.1.
OBJETIVOS GENERALES
Los objetivos generales de esta investigación fueron:
• Realizar un estudio comparativo entre los métodos analíticos estándar de reflujo abierto y el
método rápido-colorimétrico de reflujo cerrado, utilizados para la determinación de la
demanda química de oxígeno (DQO) y, a través del análisis estadístico correspondiente,
estimar la diferencia real que existe entre ellos; medir la precisión de la estimación para, en
caso de ser adecuado, poder implementar el método colorimétrico que permita minimizar la
generación de residuos contaminantes durante la aplicación de esta prueba.
• Establecer una metodología de estabilización de los residuos generados aplicable a
laboratorios de docencia e investigación para obtener formas químicas inocuas que puedan ser
dispuestas o reutilizadas posteriormente con el mínimo costo posible y con operaciones
unitarias sencillas que no requieran de una infraestructura costosa.
I.3.2.
OBJETIVOS ESPECÍFICOS
Los objetivos específicos de esta investigación pueden dividirse en tres grandes rubros:
ECONÓMICOS
• Reducir costos de análisis y de tratamiento de los residuos generados
• Reducir costos por posibles lesiones profesionales
• Reducir costos de transportación
• Reducir costos por sanciones
AMBIENTALES
• Reducir la cantidad de los residuos generados
• Disminuir el riesgo de derrames y accidentes
• Evitar un impacto ambiental negativo
• Mantener el equilibrio ecológico de nuestro país y el planeta.
LEGISLATIVOS
•
•
Cumplir con la normatividad ambiental vigente
Evitar penalizaciones
17
En el siguiente capítulo de este libro se presentan en forma somera los fundamentos en los
que se basa la estrategia propuesta para alcanzar los objetivos planteados.
18
CAPÍTULO II
FUNDAMENTOS
II.1
MÉTODOS PARA LA EVALUACIÓN DE LA DEMANDA QUÍMICA
DE OXÍGENO (DQO)
La llamada demanda química de oxígeno (DQO) es una determinación química de la cantidad de
sustancias fuertemente oxidantes requeridas para oxidar la fracción orgánica de una muestra
susceptible al dicromato o permanganato en medio ácido y, considerando que es una reacción
equímolecular, se espera que esta cantidad sea equivalente a la materia orgánica oxidada.
Para la determinación de la DQO, existen diferentes métodos, dividiéndose principalmente en
tres categorías; Los métodos de reflujo abierto, los métodos de reflujo cerrado y los métodos
instrumentales.
El método de reflujo abierto es adecuado para una amplia gama de residuos líquidos en los que se
prefiere un gran tamaño de muestra en donde la valoración del material oxidante remanente se
efectúa por titulometría. Los métodos de reflujo cerrado son más económicos en cuanto al uso de
reactivos, la valoración se puede efectuar por titulometría del material oxidante remanente o bien
por colorimetría del ión que se produce por la reducción del componente oxidante (APHA,
1995).
Cabe mencionar que, en la valoración por colorimetría, es conveniente eliminar los sólidos
suspendidos que se presentan después del período de digestión para poder obtener resultados
reproducibles.
Los métodos instrumentales de análisis de DQO son muy rápidos y dan resultados reproducibles,
donde se requieren microvolúmenes de muestra para su análisis (Ramalho,1990).
Algunos de los métodos mencionados son los siguientes:
♦
♦
♦
♦
♦
♦
Ensayo de oxidación al permanganato (reflujo abierto).
Método normalizado de oxidación al dicromato (reflujo abierto).
Método normalizado de oxidación al dicromato (reflujo cerrado titulométrico).
Método normalizado de oxidación al dicromato (reflujo cerrado colorimétrico).
Ensayos de evaluación rápida de DQO (reflujo cerrado).
Métodos instrumentales para la determinación de DQO.
19
II.1.1.
ENSAYO DE OXIDACIÓN AL PERMANGANATO (REFLUJO ABIERTO)
Recomendado como método normalizado hasta hace relativamente poco tiempo, este ensayo ha
sido reemplazado por el de dicromato. En este ensayo se utiliza permanganato de potasio
(KmnO4) en lugar de dicromato como agente oxidante.
La muestra de agua residual se somete a ebullición con un exceso de permanganato en solución
ácida (H2SO4) durante 30 minutos. La solución de color rosa se enfría y se añade una cantidad
determinada de oxalato de amonio [(NH4)2C2O4)] con el que la solución vuelve a ser incolora. El
exceso de oxalato se valora con permanganato de potasio hasta recuperar el color rosa inicial. El
oxalato usado se calcula por diferencia y el permanganato utilizado se define con un simple
cálculo estequiométrico (Ramalho,1990).
II.1.2.
MÉTODO NORMALIZADO DE OXIDACIÓN AL DICROMATO (REFLUJO
ABIERTO)
Este método se lleva a cabo calentando en condiciones de reflujo total (abierto), una muestra de
volumen determinado con un exceso conocido de dicromato de potasio (K2Cr2O7) en presencia
de ácido sulfúrico (H2SO4), durante un período de al menos dos horas. La materia orgánica en la
muestra se oxida. Como resultado, se consume el dicromato de color amarillo que se reemplaza
por el ión crómico de color verdoso. Como catalizador se emplea sulfato de plata (Ag2SO4); la
medición se lleva a cabo por valoración titulométrica del dicromato restante con una solución
valorada de sulfato ferroso amoniacal [Fe(NH4)2(SO4)2.6H2O] (Ramalho,1990).
II.1.3.
MÉTODO NORMALIZADO DE OXIDACIÓN AL DICROMATO (REFLUJO
CERRADO TITULOMÉTRICO)
Este método presenta una modificación al método anterior en cantidades de muestras y reactivos
utilizados, se emplean volúmenes pequeños, en proporciones adecuadas para su análisis, los
cuales se someten a digestión a reflujo cerrado durante dos horas, lo cual permite una mayor
oxidación de compuestos orgánicos volátiles, debido al mayor tiempo de contacto con el agente
oxidante; donde la valoración se efectúa al igual que en el método de reflujo abierto, conservando
siempre la proporción equivalente en concentración de reactivos (APHA,1995).
II.1.4. MÉTODO NORMALIZADO DE OXIDACIÓN AL DICROMATO (REFLUJO
CERRADO COLORIMÉTRICO)
En este método, las muestras se someten a reflujo bajo las mismas condiciones que el método
anterior de reflujo cerrado por titulometría; este ensayo elimina el procedimiento de titulación, ya
que la valoración se determina por colorimetría del ión crómico que se produce, como
consecuencia de la reducción del dicromato (APHA,1995).
20
II.1.5.
ENSAYOS DE EVALUACIÓN RÁPIDA DE DQO (REFLUJO CERRADO)
Existen diferentes ensayos rápidos para la evaluación de DQO, que normalmente consisten en
digerir muestras de aguas residuales con dicromato, por períodos de tiempo inferiores a las dos
horas que son consideradas en el método normalizado. En una de estas técnicas, se procede a una
digestión de la muestra con solución K2Cr2O7-H2SO4-Ag SO4 a 165°C durante 15 minutos; la
valoración se puede efectuar al igual que en los métodos normalizados por titulometría o bien por
colorimetría del ión producido como consecuencia de la reducción del agente oxidante (Jeris,
1992).
II.1.6.
MÉTODOS INSTRUMENTALES PARA LA DETERMINACIÓN DE DQO
Los métodos instrumentales para la determinación de la DQO, son bastante rápidos (requieren de
tiempos inferiores a 5 minutos) y los resultados son reproducibles en un intervalo de ±3%,
presentando una buena correlación con los obtenidos por el método normalizado.
Algunos de estos métodos tratan micromuestras (0.02 mL) por inyección. La muestra se inyecta
al horno de combustión catalítico de platino donde son arrastradas por corrientes de CO2 seco,
que oxida los contaminantes a CO y H2O. El agua se recoge en un tubo de secado y los productos
de la reacción pasan por un segundo tratamiento catalítico. La concentración de CO se mide con
un analizador infrarrojo dispersivo integral, sensible al monóxido de carbono. La lectura
resultante se traduce directamente en DQO utilizando un gráfico calibrado.
La oxidación que tiene lugar en los métodos instrumentales es más vigorosa que la oxidación con
dicromato y, en consecuencia, sus resultados representan un nivel mucho más real de demanda de
oxígeno de los contaminantes presentes en la aguas residuales (Ramalho.1990).
II.2
LEGISLACIÓN Y NORMATIVIDAD MEXICANA VIGENTE EN
MATERIA DE RESIDUOS PELIGROSOS
II.2.1.
SISTEMA LEGAL
La base del sistema jurídico mexicano se encuentra en la Constitución Política de los Estados
Unidos Mexicanos. De esta norma fundamental (promulgada el 5 de febrero de 1917 y reformada
más de 400 veces desde entonces), derivan las normas jurídicas específicas, siguiendo una
jerarquización tal, que cada una valida y fundamenta a otra inferior y ésta, a su vez, da origen a
otra u otras (Figura II.1).
Las leyes
Colocadas en un primer nivel jerárquico en el sistema jurídico mexicano, las leyes son normas
generales y permanentes, que derivan de la Carta Magna; con la que deben guardar congruencia y
no contradecirla, contrariarla, rebasarla o modificarla. Al ser aplicables a toda persona o situación
que quede incluida dentro de lo que disponen, las leyes son generales ya que no se refieren a
21
ninguna persona o caso en particular. Los destinatarios están señalados por circunstancias
abstractas. A quien realice el supuesto, se le aplica la Ley.
Constitución
Política de los
Estados Unidos
Mexicanos
Leyes
Reglamentos
Normas oficiales
mexicanas
Figura II.1 Sistema legal mexicano
En el sistema jurídico mexicano la ley es fuente autónoma, creadora de obligaciones en aquellos
casos en que se considera un hecho material, independiente de toda voluntad del ser humano y
hace que se generen consecuencias de Derecho (Carmona, 1999).
Los reglamentos
En segundo nivel dentro de la escala jerárquica del Sistema Jurídico Mexicano están los
reglamentos. Estos comprenden las disposiciones legislativas expedidas por el Poder Ejecutivo
Federal para el desarrollo o instrumentación de las disposiciones legales. Es decir, por lo general,
el reglamento deriva de una ley a la cual complementa y amplía en sus principios.
Por otro lado, existen reglamentos que no necesariamente tienen una referencia legal directa y
que son denominados reglamentos autónomos, como es el caso de los expedidos para la
jurisdicción del Distrito Federal, en el que no existe congreso local. Los titulares de la
administración pública de las áreas reguladas son las directamente responsables de la forma y
contenido de los reglamentos correspondientes. A propuesta de éstos, el Ejecutivo promulga los
reglamentos y los decretos, mismos que pueden ser modificados mediante decreto, tanto por los
titulares de la Administración Pública como por el propio Ejecutivo.
Las normas
22
El tercer nivel de esta jerarquización está ocupado por las normas. En esencia, son resoluciones
de control ejercidas específicamente en el ámbito administrativo, al provenir de decisiones
emitidas por una o varias autoridades de la Administración Pública; en algunos casos son
producto de un estudio particular de normalización, aprobado por una autoridad reconocida
(como la anterior Secretaría de Comercio y Fomento Industrial, que ya no existe), con objeto de
evitar conflictos que pudieran surgir en casos concretos.
A partir de la entrada en vigor de la Ley Federal sobre Metrología y Normalización (LFMN) (16
de julio de 1992), se hizo necesario replantear todas las normas técnicas obligatorias (incluyendo
las ambientales y las sanitarias), publicadas previamente en nuestro país.
II.2.2.
LEY GENERAL DEL EQUILIBRIO ECOLÓGICO Y LA PROTECCIÓN AL
AMBIENTE
La Ley General del Equilibrio Ecológico y la Protección al Ambiente (LGEEPA) fue publicada
en el Diario Oficial de la Federación el 13 de diciembre de 1996, con base en los artículos 4, 25,
27 y 73 de la Constitución Política Mexicana. Esta ley es reglamentaria de las disposiciones de la
Constitución referida a la preservación y restauración del equilibrio ecológico, así como a la
protección al ambiente en el territorio nacional y a las zonas sobre las que la nación ejerce su
soberanía y jurisdicción y su objeto es el de establecer las bases para:
♦ Definir los principios de la política ecológica general y regular los instrumentos para su
aplicación
♦ Propiciar el ordenamiento ecológico y la preservación, restauración y mejoramiento del
ambiente
♦ Proteger las áreas naturales así como la flora y fauna
♦ Aprovechar racionalmente los elementos naturales
♦ Prevenir y controlar la contaminación del agua, aire y suelo
♦ Promover la concurrencia del gobierno federal con las entidades federativas y los
municipios, así como entre las diversas dependencias y la participación de la sociedad.
La LGEEPA está compuesta por 204 artículos, divididos en seis títulos:
I.
II.
III.
IV.
V.
VI.
Disposiciones generales
Biodiversidad
Aprovechamiento sustentable de los elementos naturales
Protección al ambiente
Participación social e información ambiental
Medidas de control y seguridad; y sanciones
Esta Ley define en su Título I, artículo 3, fracción XXXII a los residuos peligrosos (RP) como
"todos aquellos residuos, en cualquier estado físico, que por sus características corrosivas,
23
reactivas, explosivas, tóxicas, inflamables y/o biológico-infecciosas, representen un peligro para
el equilibrio ecológico o el ambiente".
La LGEEPA establece que la regulación de las actividades relacionadas con materiales o residuos
peligrosos es un asunto de alcance general en la nación o de interés de la Federación y faculta a
la entonces Semarnap (Secretaría del Medio Ambiente, Recursos Naturales y Pesca) y ahora
Semarnat (Secretaría del Medio Ambiente y Recursos Naturales) para que, previa opinión de
otras dependencias del Ejecutivo Federal, publique los listados correspondientes. De manera
particular y definitiva, la gestión de los residuos peligrosos está contenida en los artículos del
Capítulo VI, Título IV, denominado Protección al ambiente.
II.2.3.
REGLAMENTO SOBRE RESIDUOS PELIGROSOS
El 13 de diciembre de 1996 fue publicado, en el Diario Oficial de la Federación, el Reglamento
de la LGEEPA en Materia de Residuos Peligrosos. Este reglamento tiene por objeto regular las
actividades de generación, almacenamiento, manejo, transportación, tratamiento, incineración,
“reúso” y/o disposición final de residuos peligrosos. Para tal efecto, el Ejecutivo Federal, a través
de la anterior Semarnap (Secretaría del Medio Ambiente, Recursos Naturales y Pesca) y ahora
Semarnat (Secretaría del Medio Ambiente y Recursos Naturales), emite los listados de residuos
peligrosos y las Normas Oficiales Mexicanas que regulan el manejo de éstos así como autorizar y
supervisar la instalación, construcción, transporte, alojamiento, reutilización (“reúso”),
tratamiento, reciclaje, incineración y disposición final, etc., de ellos.
Asimismo, obliga a las empresas generadoras, transportistas, etc., a presentar periódicamente la
información que sobre estas actividades se genere, mediante la presentación de diversos
formatos. Crea igualmente, la metodología sobre las características de ciertas actividades. Por
ejemplo: la implementación de bitácoras para el manejo de los residuos, las condiciones que
deben reunir las áreas de almacenamiento, las de transporte y las de disposición final.
II.2.4.
NORMAS OFICIALES MEXICANAS SOBRE RESIDUOS PELIGROSOS
La LGEEPA previó la expedición de la Normas Técnicas Ecológicas (NTE) en las que se
establecían requisitos, especificaciones, condiciones, procedimientos, parámetros y límites
permisibles que debían de observarse en el desarrollo de actividades o uso de destino de bienes
que causaran o pudieran causar desequilibrios a los ecosistemas o al medio en general y que,
además, permitieran uniformar principios, preceptos, políticas y estrategias de conservación y
restauración de los recursos naturales. Por tal razón, para regular la gestión de los residuos
peligrosos se publicaron siete Normas Técnicas Ecológicas entre 1988 y 1989, las cuales fueron
derogadas y transformadas en Normas Oficiales Mexicanas (NOM) con la expedición de la Ley
Federal sobre Metrología y Normalización el 22 de octubre de 1993 (SEDESOL, 1993) y son las
siguientes:
NOM-052-ECOL-1993 Establece las características de los residuos peligrosos, el listado de los
mismos y los límites que hacen a un residuo peligroso por su toxicidad al ambiente.
24
NOM-053-ECOL-1993 Establece el procedimiento para llevar a cabo la prueba de extracción
para determinar los constituyentes que hacen a un residuo peligroso por su toxicidad al ambiente.
NOM-054-ECOL-1993 Establece el procedimiento para determinar la incompatibilidad entre dos
o más residuos considerados como peligrosos por la NOM-052-ECOL-93.
NOM-055-ECOL-1993 Establece los requisitos que deben reunir los sitios destinados al
confinamiento controlado de residuos peligrosos, excepto los radioactivos.
NOM-056-ECOL-1993 Establece los requisitos para el diseño y construcción de las obras
complementarias de un confinamiento controlado de residuos peligrosos.
NOM-057-ECOL-1993 Establece los requisitos que deben observarse en el diseño, construcción
y operación de celdas de un confinamiento controlado para residuos peligrosos.
NOM-058-ECOL-1993 Establece los requisitos para la operación de un confinamiento
controlado de residuos peligrosos.
NOM-083-ECOL-1996 Establece las condiciones que deben reunir los sitios destionados a la
disposición final de los residuos municipales (aclaración 7 de marzo de 97). Esta Norma Oficial
Mexicana establece las condiciones de ubicación, hidrológicas, geológicas e hidrogeológicas que
deben reunir los sitios destinados a la disposición final de los residuos sólidos municipales y es
de observancia obligatoria para aquellos que tienen la responsabilidad de la disposición final de
los residuos sólidos municipales.
NOM-087-ECOL-SSA1-2002 Protección ambiental -Salud ambiental- Residuos peligrosos
biológico-infecciosos-Clasificación y especificaciones de manejo.(DOF 7 de noviembre de
1995). La Ley General del Equilibrio Ecológico y la Protección al Ambiente, define como
residuos peligrosos a todos aquellos residuos que por sus características corrosivas, reactivas,
explosivas, tóxicas, inflamables y biológico-infecciosas, que representan un peligro para el
equilibrio ecológico o el ambiente; mismos que serán manejados en términos de la propia ley, su
Reglamento y normas oficiales mexicanas que expida la Secretaría de Medio Ambiente y
Recursos Naturales previa opinión de diversas dependencias que tengan alguna injerencia en la
materia, correspondiéndole a la citada SEMARNAT su regulación y control.
Con fecha de 7 de noviembre de 1995, se publicó en el Diario Oficial de la Federación la
Norma Oficial Mexicana NOM-087-ECOL-1995, Que establece los requisitos para la separación,
envasado, almacenamiento, recolección, transporte, tratamiento y disposición final de los
residuos peligrosos biológico-infecciosos que se generan en establecimientos que presten
servicios de atención médica. Los establecimientos de atención médica son regulados por la
Secretaría de Salud por lo que en la revisión de la norma mencionada, se incluye a los
representantes del sector.
Esta revisión consideró las características de los diferentes tipos de unidades médicas que prestan
atención a poblaciones rurales.
25
Los residuos peligrosos biológico-infecciosos se han venido manejando en términos de las
regulaciones ambientales antes señaladas, sin embargo fue necesario actualizar la NOM-087ECOL-1995, tomándose en consideración las experiencias y competencias de los sectores
involucrados en su cumplimiento, con el fin de que sus disposiciones sean operativas y adecuadas
para proteger el medio ambiente y la salud de la población en general. Esta Norma Oficial
Mexicana es de observancia obligatoria para los establecimientos que generen residuos
peligrosos biológico-infecciosos y los prestadores de servicios a terceros que tengan relación
directa con los mismos.
NOM-133-ECOL-2000 Protección ambiental -Bifenilos policlorados (BPC)-Especificaciones de
manejo (DOF, 2001). La existencia de bifenilos policlorados (BPC) es uno de los problemas
ecológicos que tiene nuestro país, ya que representan un riesgo potencial para la salud, el medio
ambiente y el equilibrio ecológico. Por ello se requiere la instrumentación de mecanismos
técnicos y jurídicos que permitan dar un manejo adecuado a los BPC y sus residuos. Esta Norma
Oficial Mexicana establece las especificaciones de protección ambiental para el manejo de
equipos, equipos eléctricos, equipos contaminados, líquidos, sólidos y residuos peligrosos que
contengan o estén contaminados con bifenilos policlorados y los plazos para su eliminación,
mediante su desincorporación, reclasificación y descontaminación. Es de observancia obligatoria
para todas las personas físicas o morales que posean los citados equipos, productos, líquidos,
sólidos y residuos peligrosos que contengan o estén contaminados con BPC, así como para las
empresas que presten servicios relacionados con el manejo de los mismos.
II.3
ALTERNATIVAS DE SOLUCIÓN PARA LA ESTABILIZACIÓN DE
RESIDUOS PELIGROSOS
Ante la imperiosa necesidad de iniciar medidas que, a corto, mediano y largo plazos, solucionen
y prevengan el impacto de los residuos peligrosos sobre el entorno ecológico, se han generado
diversas estrategias de solución (Cortinas-de-Nava y Gleason, 1993):
1.- Minimización en la fuente
2.- Recuperación y reciclaje
3.- Tratamiento
4.- Disposición final
II.3.1.
MINIMIZACIÓN EN LA FUENTE
Las medidas adoptadas para minimizar o disminuir los residuos peligrosos comprenden la
siguientes acciones:
Modificación de procesos
La innovación tecnológica ha repercutido en la creación de procesos productivos más eficientes,
capaces de economizar energía y de aprovechar mejor las materias primas, así como de disminuir
26
la generación de residuos peligrosos, reduciendo con ello los costos de manufactura. Ejemplos de
modificaciones pueden ser: pequeños cambios en los métodos de operación (temperatura,
presión), sustitución de materias primas o cambios mayores, como instalación de nuevos
procesos o nuevas maquinarias.
Sustitución de productos
Mediante esta opción se busca reemplazar productos altamente tóxicos o peligrosos por otros que
aporten sus mismos servicios y cuyo manejo a lo largo de su ciclo de vida sea más seguro y
respetuoso del ambiente. Tal es lo ocurrido al sustituir los bifenilos policlorados en los
transformadores eléctricos por otros tipos de agentes dieléctricos como ciertos aceites minerales
o por aire.
Segregación en la fuente
Consiste en prevenir la contaminación de grandes volúmenes de residuos industriales no
peligrosos con otros que sí lo sean, además del manejo y la disposición adecuada de estos
últimos. Estos métodos proporcionan beneficios importantes a las empresas, al disminuir las
cantidades de residuos peligrosos y reducir los costos de su manejo.
II.3.2.
RECUPERACIÓN Y RECICLAJE
Se trata de opciones que, en general, no requieren de inversiones por parte de los generadores de
residuos peligrosos, ya que son operaciones rentables en las que se emplean materiales de fácil
separación y purificación. Se distinguen tres tipos de opciones:
• Reciclaje en la propia planta
• Recuperación comercial fuera de la planta
• Intercambio de materiales
En el caso del intercambio de materiales, se recomienda que las empresas generadoras de
residuos peligrosos y las encargadas de su recuperación o reciclaje se instalen lo más cerca
posible unas de las otras, con el fin de facilitar las operaciones (Manahan, 2000).
II.3.3 TRATAMIENTOS
Un tratamiento es cualquier técnica, método o proceso que cambie las propiedades físicas,
químicas y/o biológicas de los residuos peligrosos para reducir su peligrosidad, recuperar
material, energía o incluso para reducir su volumen. El estudio de estos tratamientos se divide en
(Espíndola-Zepeda, 1992):
A) Tratamientos físicos y/o químicos
B) Tratamientos biológicos
27
C) Tratamientos térmicos
II.3.3.1. Tratamientos físicos y/o químicos
En este tipo de procesos se puede involucrar el uso de reacciones químicas para transformar las
corrientes residuales peligrosas en substancias menos peligrosas, así como tratamientos físicos
para facilitar su separación; puede fomentar la recuperación de los recursos de la substancias
peligrosas, por lo que puede emplearse para obtener subproductos útiles y efluentes residuales
ambientalmente aceptables (Wentz, 1989). Estos procesos son mejores para el tratamiento de
residuos que el método tradicional de disposición en un relleno sanitario o en un sitio de
disposición controlada, debido a que los costos de esta disposición se están incrementando de
manera continua y su reglamentación es cada vez más estricta. Dentro de las ventajas del
tratamiento químico como método de disposición se encuentra su relativo bajo costo, comparado
a la incineración. En algunas ocasiones, el tratamiento produce subproductos útiles y en muchas
otras implica la creación de otro residuo menos peligroso (Phifer, 1988).
Precipitación química
La precipitación química es un proceso por el cual una sustancia soluble se convierte en insoluble
ya sea por una reacción química o por cambios en la composición del solvente para disminuir la
solubilidad de la substancias en él. Los sólidos precipitados pueden separase por sedimentación
y/o filtración. Se usa comúnmente la precipitación para reducir la dureza del agua por remoción
de calcio y magnesio (Chung, 1989).
La precipitación es aplicable al tratamiento de los residuos peligrosos acuosos que contengan
constituyentes tóxicos que puedan convertirse en insolubles. Esto comprende residuos que
contienen los metales y metaloides arsénico, bario, cadmio, cromo, cobre, plomo, mercurio,
níquel, selenio, plata, talio y zinc. Otros residuos acuosos que comúnmente contienen metales y
pueden removerse por precipitación, son los residuos corrosivos y el licor de baños químicos de
metales gastados en las operaciones de acabado del acero en la industria del hierro y el acero.
En el proceso de precipitación química se adiciona un agente precipitante químico al metal
contenido en el residuo acuoso. Esto se lleva cabo en un tanque de reacción con agitación. Los
metales disueltos se convierten en insolubles por una reacción química entre los compuestos
metálicos solubles y el agente precipitante. Los sólidos suspendidos resultantes se separan por
sedimentación en un clarificador. Para mejorar la remoción de los sólidos suspendidos, se puede
realizar una floculación, con o sin un agente coagulante químico. La elección del reactivo es la
primera consideración en la precipitación de metales pesados, la segunda consideración es la
solubilidad, ya que la precipitación depende del producto de solubilidad del compuesto
indeseable (el metal que va a separarse). Debido a que la solubilidad se afecta por la temperatura,
también es un factor importante en este tipo de reacciones.
La especie química también influye en el proceso. Por ejemplo, el hierro ferroso es
considerablemente más soluble que el hierro férrico, por lo que se realiza un tratamiento con un
agente oxidante para convertir el hierro ferroso a férrico. Otro ejemplo es el cromo hexavalente
28
que es mucho más soluble que la menos peligrosa forma trivalente. Los cromatos deben
reducirse, antes de separarse, a cromo trivalente para llevar acabo una precipitación. Se debe
considerar la posibilidad de que se formen complejos cuando se tratan aguas residuales que
contengan amoníaco, fluoruros, cianuros o metales pesados (Wentz, 1989).
Existen diferentes agentes precipitantes químicos para la reacción de metales pesados de los
residuos acuosos. La precipitación de hidróxidos utilizando cal como agente precipitante es el
método más empleado; la mayoría de los metales también pueden precipitar como sulfuros y
algunos de ellos como carbonatos. Se obtienen dos corrientes de este proceso, los lodos que
contienen los sólidos precipitados y el líquido clarificado. A los lodos se les elimina el agua y los
sólidos se disponen previo proceso de estabilización. Este proceso genera un gran volumen de
lodos los cuales deben ser dispuestos. Todo proceso se opera a condiciones ambientales,
eliminando así el peligro de alta presión y temperatura con respecto a otros sistemas. En caso de
que los compuestos químicos empleados sean irritantes para la piel, por medio de esta tecnología
pueden ser fácilmente manejados en una forma segura.
Neutralización
Muchas operaciones de manufactura y proceso producen efluentes que son ácidos o alcalinos en
su naturaleza. La neutralización de una corriente residual excesivamente ácida o básica es
necesaria en una variedad de situaciones (Kiang, 1982). Esta técnica involucra coordinadamente
un ácido o una base adicionados a una corriente de residuos peligrosos para ajustar el valor de pH
a un nivel deseado, la neutralización puede requerirse antes del tratamiento del residuo para
proteger el equipo y optimizar el funcionamiento del tratamiento; el pH final deseado fluctúa
entre 6 y 9 y los productos de la reacción incluyen agua, sales y sólidos precipitados.
La neutralización se lleva a cabo más comúnmente en mezclado completo dentro de tanques
resistentes a la corrosión, lagunas y filtros de lechos con piedras calizas. Las bases más usadas
son la cal, el hidróxido de calcio, sosa cáustica e hidróxido de amonio. Los ácidos más comunes
son el sulfúrico, el clorhídrico y el nítrico.
Este proceso puede llevarse a cabo en flujo continuo o en forma intermitente (“batch” en inglés)
y es conducido por lo general en tanques en serie. La alimentación del agente neutralizante se
controla automáticamente. La remoción de los sólidos se requiere, ya sea después de la
neutralización o en un clarificador-separador, con el propósito de remover los sólidos
precipitados.
Se aplica complementariamente en diferentes puntos de un proceso. Es un tratamiento de uso
común que requiere la separación (si los hay), en un clarificador. Antes de la floculación pueden
liberarse gases tóxicos como amoníaco, ácido sulfhídrico, ácido cianhídrico, en caso de que no se
efectúe el proceso lentamente o no se prepare adecuadamente. En la industria petroquímica se
aplica a:
1.- Aguas residuales ácidas o alcalinas
2.- Sosas gastadas
29
El proceso utiliza mezcladores, clarificadores y sedimentadores. Los sistemas de neutralización
se diseñan en una o varias etapas.
Se requieren postratamientos para remover los metales y los compuestos orgánicos suspendidos o
disueltos. Si se obtiene una alta concentración de compuestos disueltos se formarán complejos
químicos que requerirán un tratamiento químico adicional como adsorción con carbón, ósmosis
inversa o intercambio iónico. En el caso de que obtengan sólidos precipitados, deben removerse
mediante clarificadores o filtros. Si se obtienen con la calidad adecuada y existe un mercado,
pueden venderse o, en su defecto, se disponen adecuadamente.
Hidrólisis
La hidrólisis como proceso químico se ha utilizado desde los primeros días de la manufactura del
jabón. La adición de un álcali para neutralizar grasas calientes en la producción del jabón aún se
utiliza. Los procesos que involucran la hidrólisis son comunes en la industria alimentaria,
papelera y petroquímica (Kiang, 1982).
La hidrólisis se puede realizar en un equipo sencillo (en tanques abiertos por lotes) o en equipos
más complicados (flujo continuo en grandes torres). El manejo de ácidos fuertes y álcalis
requiere de precauciones. Las reacciones que se llevan a cabo a presiones y temperaturas
elevadas necesitan control y un seguimiento estricto del proceso.
Como proceso de tratamiento para residuos peligrosos, la hidrólisis se puede aplicar a una amplia
variedad de formas físicas. Puede adaptarse al manejo de líquidos, gases y sólidos. Con pocas
excepciones, la hidrólisis no parece ser promisoria para la disposición de materiales inorgánicos.
Sin embargo, es de gran importancia para compuestos orgánicos aromáticos y alifáticos, tales
como ésteres, éteres, carbohidratos, ácidos sulfónicos, compuestos halogenados, fosfatos y
nitrilos.
Una desventaja potencial de la hidrólisis es la posibilidad de formación de productos de reacción
indeseables. Frecuentemente será necesario conducir una investigación preliminar (a escala de
laboratorio) de la reacción, para determinar la temperatura, presión, tiempo de reacción, agente
hidrolizante y concentración apropiadas. También deben estudiarse las rutas de reacción más
probables y la toxicidad de cualquier producto generado (Kiang, 1982).
30
Fotólisis
El proceso fotoquímico ocurre continuamente en la atmósfera y en la superficie de la tierra. Es un
proceso ambiental natural que se presenta diariamente, degradando numerosos compuestos
orgánicos en la superficie del suelo, en la atmósfera y en varios cuerpos del agua. La radiación
ultravioleta que llega a la superficie de la tierra está limitada a longitudes de onda mayores de
295nm, ya que el oxígeno atmosférico absorbe las longitudes inferiores (Willard, 1974).
El equipo fotoquímico consiste de dos componentes: Un recipiente que contiene el material a
irradiar y una fuente de luz, en ocasiones natural (sol) y en otras artificial. La mayoría de los
recipientes son de vidrio o de sílice fundido y, cuando se usa una fuente artificial de energía
luminosa, son de dos diseños básicos; aquéllos en que la fuente luminosa está sumergida en el
medio de reacción y aquéllos en que la fuente luminosa está externa al medio. Existen tres tipos
principales de lámparas de resonancia de mercurio que se emplean como fuentes de luz ya que
producen energía en la región ultravioleta. La fotólisis se emplea como método de
descomposición de ciertos herbicidas e insecticidas, debido a que el uso extenso de éstos ha
llegado a contaminar las aguas subterráneas por infiltración. La fotólisis de muchos compuestos
aromáticos conduce a una fragmentación incompleta del anillo. Algunos de los productos de la
fotólisis de plaguicidas pueden presentar problemas toxicológicos potenciales (aún cuando se
piensa que son menos tóxicos que el material original). En consecuencia, se debe contar con un
proceso de tratamiento secundario que mineralice los fotoproductos a CO2, H2O y cloro. Se
pueden utilizar organismos microbianos selectos o microorganismos genéticamente modificados
para realizar la descomposición completa de algunos fotoproductos generados por la radiación
ultravioleta.
Oxidación y reducción químicas
En los procesos electroquímicos se emplea la transferencia de electrones, mediante reacciones de
óxido-reducción. En ellas, una especie química aumenta su estado de oxidación mientras que la
otra especie lo disminuye (su estado de oxidación). Cuando un ión, átomo o molécula pierde
electrones, la sustancia se oxida y cuando gana electrones, se reduce. Cuando el Cr6+ gana
electrones y se convierte en Cr3+ el ión se reduce; cuando el Cr3+ pierde electrones y se convierte
en Cr6+ el ión se oxida. Las reacciones de óxido-reducción o “redox” tienen un papel importante
en el tratamiento de residuos que contienen trazas de metal y de residuos tóxicos inorgánicos tal
como los residuos que contienen metales, sulfuros, cianuros, cromo y también en el tratamiento
de algunos compuestos tales como fenoles y plaguicidas.
La oxidación química se usa ampliamente para tratar residuos peligrosos y no peligrosos. La
tecnología está bien establecida y representa un medio seguro de tratamiento que puede evaluarse
y controlarse fácilmente. Aún cuando la oxidación química es más apropiada para el tratamiento
de líquidos también se puede usar para suspensiones y lodos. Debido a que los agentes oxidantes
no son selectivos y representan la principal parte del costo del tratamiento, este tipo de sistemas
de tratamiento es más apropiado para residuos con un bajo contenido de compuestos orgánicos.
Los residuos orgánicos que se han tratado por oxidación química son: fenoles, aminas,
mercaptanos y clorofenoles. Sin embargo, algunos compuestos orgánicos son resistentes a la
oxidación de la mayoría de los agentes oxidantes a temperaturas y presión ambiente, por lo que
31
probablemente requieran de un incremento, en la temperatura, el uso de un catalizador o de luz
ultravioleta (Fochtman, 1989).
El tratamiento de residuos por oxidación se puede realizar por procesos continuos y
semicontinuos; ambos emplean equipo muy similar ya que involucran la mezcla de dos líquidos
acuosos, el residuo y el tratamiento químico o el contacto de una solución acuosa con gas.
Algunas reacciones son rápidas, del orden de 1 a 2 segundos y pueden llevarse a cabo en un
reactor, tal como la oxidación del bisulfito de sodio por hipoclorito de sodio. La mezcla de los
reactivos en la tubería da como resultado una reacción rápida que puede seguirse a través de
aumentos en la temperatura y el potencial de óxido-reducción. Las velocidades de reacción se
incrementan a temperaturas elevadas aún cuando se requiere de un incremento en la energía y
temperaturas superiores a los 100ºC, así como, en ocasiones, equipo de presión. Estos cambios en
el proceso deben tomarse en cuenta en los costos de operación y en el incremento del capital
(Fochtman, 1989). El problema principal de la óxido-reducción de metales, es la generación de
grandes cantidades (en términos de masa y/o de volumen) de lodos que, después de ser secados,
deberán depositarse en sitios controlados ya que, aunque los metales son relativamente inertes
cuando se convierten a hidróxidos, pueden sufrir cambios químicos por intemperismo u otros
factores externos, volviéndose peligrosos. El mercurio reducido produce menos cantidad de lodos
(Hernández, 1997).
Estabilización/Solidificación
En el manejo de residuos peligrosos, la solidificación/estabilización es un término normalmente
utilizado para designar una tecnología que emplea aditivos para reducir la movilidad de los
contaminantes, haciendo así al residuo aceptable a los requerimientos actuales de disposición en
el suelo (Buelt, 1989). La solidificación y estabilización son procesos de tratamiento designados
para mejorar el manejo de residuos y las características físicas, disminuir el área superficial a
través de la cual los contaminantes se pueden transferir o infiltrar, limitar la solubilidad o
desintoxicar los constituyentes peligrosos (Buelt, 1989).
En la solidificación, estos resultados se obtienen primordialmente por la producción de un bloque
monolítico de residuo tratado con una integridad estructural muy alta. La estabilización describe
procesos que limitan la solubilidad o desintoxican el contaminante; las características físicas
pueden o no mejorarse o modificarse.
El término fijación se usa para proponer estabilización o solidificación. La encapsulación
superficial se define como una técnica para separar el residuo con una chaqueta o membrana de
material impermeable que se coloca entre el residuo y el ambiente (Cullinane, 1986).
Estos procesos se han aplicado a una gran variedad de residuos incluyendo residuos de acabado
de metal, galvanoplastia, desecho de minas, lodos de efluentes de tratamientos, lodos, sedimentos
y suelos ácidos o que contienen metales pesados, cenizas de incineración, lodos de la producción
de alimentos y residuos de la emisiones de gas, suelos contaminados con residuos radiactivos,
residuos que contienen compuestos orgánicos y en el tratamiento de suelos contaminados con
bifenilos policlorados. Los procesos de cementación son más propicios para residuos inorgánicos,
32
especialmente aquellos que contienen cationes. Los residuos inorgánicos aniónicos y los residuos
orgánicos son más apropiados para los procesos de encapsulación orgánica (World Bank, 1989).
II.3.3.2. Tratamientos biológicos
Son muy similares a los empleados en el tratamiento de aguas residuales y se aplican a residuos
peligrosos cuya toxicidad no es letal para los microorganismos.
Desde el punto de vista del tratamiento biológico, las bacterias pueden considerarse como
diminutos reactores químicos automáticos. La degradación biológica es la conversión bacteriana
de elementos de sus formas orgánicas a sus formas inorgánicas más oxidadas. Este proceso se
conoce como mineralización (Durán-de-Bazúa, 1994a):
C-orgánico -------------------------------------> CO2
bacterias
H-orgánico -------------------------------------> H2O
bacterias
N-orgánico -------------------------------------> NO3-1
bacterias
S-orgánico --------------------------------------> SO4-2
bacterias
P-orgánico --------------------------------------> PO4-3
bacterias
Las bacterias metabolizan los contaminantes orgánicos disueltos en las aguas residuales para
suministrarse suficiente energía que les permita sintetizar moléculas complejas como las de las
proteínas y polisacáridos (carbohidratos), necesarios para construir nuevas células.
El metabolismo bacteriano tiene dos mecanismos, el catabolismo (que significa ruptura) para
obtener energía y el anabolismo (que significa construcción) para síntesis. La oxidación de
desechos se conoce como aerobia cuando se usa oxígeno molecular como el agente oxidante.
Cuando no se tiene oxígeno molecular para realizar estas reacciones de mineralización, al
proceso se le conoce como anaerobio. En éste, haciendo una abstracción muy simplista puede
decirse que la materia orgánica es degradada en varias etapas por diferentes grupos de bacterias
anaerobias,: las que convierten la materia orgánica a ácidos grasos, principalmente ácido acético
y las que convierten estos ácidos en metano (Durán-de-Bazúa, 1994a).
Estabilización bioquímica en mezclas semisólidas (“Compost”, en inglés)
33
El proceso involucra una oxidación bioquímica, que se puede efectuar mediante dos métodos: En
el suelo o en un reactor. Los productos resultantes se pueden emplear como mejoradores del
suelo. Puede aplicarse a residuos de tipo microbiológico como medios de cultivo, residuos
resultantes de cuentas bacterianas o de las pruebas de control ambiental, todos ellos previamente
esterilizados.
La biotecnología basada en el uso de microorganismos desarrollados selectivamente para
degradar sustancias tóxicas específicas se ha empleado con éxito en las siguientes industrias: de
refinación y extracción de petróleo, química, farmacéutica, textil y de pulpa de papel.
II.3.3.3. Tratamientos térmicos
Los procesos térmicos se aplican a compuestos orgánicos primarios, pero pueden procesar la
mayoría de los residuos sin importar su forma. Estos procesos pueden ser muy eficientes, pero
también de costos muy elevados (Brunner, 1991; Manahan y col., 2000; Manahan y Larsen,
1999).
Ofrece como ventajas que induce cambios permanentes en los residuos peligrosos; reduce su
volumen considerablemente y permite la recuperación de energía, ya que es posible obtener
importantes cantidades de vapor a alta presión, a partir de lo cual se puede generar calor y/o
electricidad.
En el tratamiento térmico existen dos procesos principales; éstos son: INCINERACIÓN y
PIRÓLISIS. La incineración se caracteriza por realizarse en presencia de oxígeno obteniéndose
como productos bióxido de carbono, agua y cenizas. La pirólisis se lleva a cabo en ausencia de
oxígeno y se obtienen sustancias provenientes de la ruptura térmica de las moléculas iniciales, en
ocasiones en forma de polímeros, hasta alcanzar el llamado “gas de síntesis”. Existe un proceso
patentado que combina ambos y que se denomina “Chem-Char”, por las palabras en inglés de
combustión química con carbón.
Incineración
La incineración es un método de tratamiento que consiste en la oxidación de los residuos, vía
combustión controlada.
La mayoría de los residuos peligrosos están constituidos por carbono, hidrógeno y oxígeno con
halógenos, azufre, nitrógeno y en ocasiones están presentes metales pesados. La estructura de la
molécula generalmente determina qué tan peligrosa es una sustancia para la salud humana y para
el ambiente. Si las moléculas pueden ser degradadas a bióxido de carbono, agua y sustancias
inorgánicas asociadas, su toxicidad se reduce considerablemente.
Existen los siguientes tipos de incineración:
Incineración por inyección de líquidos
34
El incinerador consiste de una cámara de combustión refractaria y una serie de atomizadores. El
combustible y los residuos deben inyectarse separadamente. La eficiencia de combustión está
limitada por las características de los atomizadores Se utiliza para residuos que pueden ser
atomizados por ejemplo, líquidos como los plaguicidas que son altamente solubles.
Incineradores de lecho fluidificado
El incinerador es una cámara de material refractario con una cámara de material inerte,
generalmente es arena, la cual se mantiene suspendida por medio de la inyección de aire. Este
dispositivo puede emplearse para residuos líquidos o sólidos con un tamaño de partícula
relativamente uniforme. Las ventajas que tienen los incineradores de lecho fluidificado son: un
excelente mezclado, requerimientos mínimos para obtener el exceso de aire y capacidad para
retener a los residuos gaseosos en el material del lecho. El precalentamiento y la inyección del
aire dentro del lecho reducen los efectos de enfriamiento y habilitan al incinerador de residuos
con valores bajos de calentamiento.
Incineración en horno rotatorio
Los elementos clave en este proceso industrial de incineración son el horno rotatorio y la cámara
secundaria de combustión, la cual asegura temperaturas mayores de 1350°C y un tiempo de
residencia apropiado para obtener una incineración completa.
Las características principales de un horno rotatorio son las siguientes:
•Cilindro rotatorio, para residuos sólidos, líquidos o pastosos
•Temperatura de 1000 a 1200°C
•Tiempo de retención en la cámara, 2 a 3 segundos
•Cámara de poscombustión, 1200°C, retención cada 4 segundos
•Recuperación de calor, generación de vapor y/o electricidad
•Enfriador de gases de combustión (“Quench”, en inglés)
•Torres de absorción de gases y purificación
•Sistema colector de cenizas
•Sistema de seguimiento para los gases con control para los gases de salida
•Depósito controlado para las cenizas
•Capacidad desde 2500 hasta 3000 toneladas por año
Ventajas de los procesos de incineración
La aplicación de la incineración reduce de manera considerable el volumen de los desechos
simplificando su manejo y evita en gran medida la demanda de áreas dedicadas a confinamientos
35
controlados (que representan grandes inversiones) y el riesgo permanente de tener almacenados
residuos tóxicos y peligrosos.
La incineración es una excelente tecnología para disponer de sustancias con alto poder calorífico
como son disolventes y polietileno, reduciendo la cantidad de combustible consumido.
Recuperación potencial de la energía calorífica que puede ser recirculada, utilizándose en otro
proceso.
Desventajas de los procesos de incineración
La inversión inicial es mucho más alta que otras tecnologías alternativas, debido al uso de
equipos de incineración de alta eficiencia debidamente instrumentados y con sistemas de
protección redundantes que garanticen la correcta operación del equipo. Es necesario instalar
equipo anticontaminate para controlar y evitar las emisiones a la atmósfera de gases
potencialmente dañinos aún en concentraciones vestigiales y cumplir con las normas establecidas
para garantizar la calidad del aire.
La operación de los incineradores requiere de personal altamente calificado, ya que es mucho
más compleja cuando se compara con otras tecnologías, porque la variabilidad de la composición
de los residuos y las severas condiciones de operación requieren de llevar a cabo una
descomposición térmica eficiente.
El equipo requiere de un mantenimiento riguroso y continuo que garantice su óptima operación.
Pirólisis
La pirólisis se ha convertido recientemente en una alternativa viable como un proceso para la
recuperación de recursos a partir de los residuos industriales peligrosos.
La pirólisis es una descomposición de materia orgánica a temperaturas elevadas sin la presencia
de oxígeno. Es un proceso endotérmico en el cual el calentamiento de los materiales orgánicos en
ausencia de oxígeno, como ya se dijo, da como resultado la ruptura de los compuestos en sus
constituyentes. Las temperaturas aplicadas en la pirólisis de una mezcla de residuos industriales
se da en intervalos comprendidos entre 500 y 900°C, obteniéndose:
1.- Fase gaseosa: Hidrógeno, metano, monóxido y dióxido de carbono.
2.- Fase líquida: Agua, alquitrán, aceite formado principalmente por benceno y otros compuestos
orgánicos.
3.- Fase sólida: cenizas, carbonatos y sílice principalmente.
Estos productos y sus concentraciones varían de acuerdo a la composición de los residuos
alimentados y a las condiciones de operación manejadas en el proceso.
Los productos obtenidos en la pirólisis pueden emplearse como combustibles, excepto el agua y
las cenizas, obteniéndose así un efecto de contaminación mínimo.
36
Otros productos como son ácido acético, metanol y otros solventes obtenidos podrían ser
revendidos.
Los productos de la pirólisis dependen del tiempo, temperatura, presión, presencia de
catalizadores y composición de la corriente de alimentación; se producirán monóxido de carbono,
dióxido de carbono y oxígeno de materiales oxigenados; amoníaco o nitrógeno de materiales
nitrogenados como proteínas y poliuretanos; el metano y el etano se incrementan cuando el
contenido de plástico aumenta en los residuos.
Las ventajas de un proceso de pirólisis radican en:
•Disposición de muchos residuos peligrosos
•Conversión de residuos industriales peligrosos en fuentes de energía
•Comercialización de productos combustibles
•Ambientalmente es un proceso seguro
Un horno rotatorio puede utilizarse para la pirólisis de residuos industriales peligrosos, mediante
un proceso continuo o intermitente. Sin embargo, antes de elegir un equipo de pirólisis deberán
efectuarse los estudios pertinentes que permitan adquirir el sistema más simple, eficiente y
limpio.
En México, aún no existen plantas de pirólisis de residuos industriales peligrosos; por lo que se
tiene únicamente la experiencia existente en otros países donde se han obtenido buenos
resultados en el tratamiento de residuos industriales. La principal desventaja en los procesos de
pirólisis radica en la necesidad de preparar la materia prima, especialmente en el caso de los
materiales sólidos, los cuales pueden ser heterogéneos pero de tamaño de partícula pequeño.
Proceso “Chem-Char”© o de combustión química con carbón
Los procesos de gasificación son inherentemente superiores a la incineración en varios aspectos
importantes para la destrucción de una variedad de residuos peligrosos. Las ventajas de la
gasificación se refieren a (1) Su naturaleza reductiva y (2) La producción de productos gaseosos
que pueden usarse como combustibles relativamente limpios ya que al quemarse de manera
eficiente estabilizan (“descomponen”) los productos residuales de la gasificación. El proceso
patentado como gasificación “ChemChar” lleva a cabo la gasificación de los residuos sobre una
matriz de carbón granular macroporoso en un flujo a co-corriente. El carbón brinda la posibilidad
de ser usado como medio de tratamiento, como fuente de combustible y como superficie activa
donde los subproductos se adhieren. El carbón usado para la gasificación “ChemChar” puede
prepararse a partir de la gasificación de carbón bituminoso u otros materiales carbonosos.
©
ChemChar Research Inc./Universidad de Missouri, Departamento de Química, Missouri, EEUUA
37
A escala piloto y prototipo se gasificaron residuos que contenían materiales peligrosos,
incluyendo compuestos organoclorados y al gasificarse sobre el carbón, los compuestos se
deshalogenaron y descompusieron y los metales pesados, los radionúclidos y el HCl se retuvieron
sobre el carbón residual. Dado que el proceso es reductivo y se lleva a cabo en una atmósfera
pobre de oxígeno, no se formaron SOx, NOx o dibenzodioxinas o dibenzofuranos clorados,
subproductos indeseables clásicos de la incineración. El mercurio elemental volátil que salía del
gasificador fue atrapado de manera eficiente en un filtro de carbón que recibía la corriente
gaseosa de salida. La gasificación “ChemChar” trabajó particularmente bien para residuos mixtos
que contenían constituyentes químicos peligrosos y materiales radioactivos (Manahan y Larsen,
1999).
II.3.4.
DISPOSICIÓN FINAL
Sin considerar la utilización de técnicas de descomposición, tratamiento, y estabilización,
siempre habrá remanentes de residuos peligrosos de algunos materiales que tienen que ponerse en
algún lugar. Un caso favorable es el de los residuos de hidrocarburos que al ser incinerados, se
obtienen como productos dióxido de carbono y agua que se descargan a la atmósfera. Pero
algunas veces incluso los remanentes de la incineración se consideran residuos peligrosos
(Manahan, 1990).
Se denomina disposición final a la acción de depositar permanentemente los residuos en sitios y
condiciones adecuadas para evitar daños al ambiente. Solo existen dos alternativas para depositar
los residuos: La disposición en tierra y la disposición en océanos (Tchobanoglous, 1993). Esta
última ha encontrado una gran oposición dados los efectos no cuantificables que podría generar.
De hecho, se ha prohibido a nivel internacional, aunque el control de esta disposición “ilegal” es
prácticamente imposible. La disposición final en tierra consiste en colocar los residuos encima o
por debajo de la superficie terrestre. En algunos casos se mezclan con el suelo; en otros, se hacen
esfuerzos para evitar el contacto con él. La disposición en tierra ha sido restringida y sólo se
permite para residuos tratados o residuos que cumplen determinadas especificaciones (Manahan,
1990).
Codisposición
La codisposición es la disposición de los residuos peligrosos con los domésticos u otros residuos
similares. El objetivo central es el de mantener la cantidad de residuos balanceada para asegurar
que los procesos de atenuación no están excedidos. Por lo tanto, es necesario el control de la
cantidad de los residuos que entren. La codisposición se considera como una opción de la
disposición segura y eficiente para muchos residuos peligrosos (Batstone, 1989).
Sin embargo, dado que algunos estudios han demostrado que, en el mediano y largo plazos puede
resultar contraproducente, en Europa, la UE ha prohibido su uso.
Aplicación en el suelo: Biolabranza/”Landfarming”
38
“Landfarming” es el término en idioma inglés con el que se conoce al método de aplicación en el
suelo, donde el sustrato orgánico de un residuo se degrada primeramente por la acción
ultravioleta del sol (fotólisis) y, posteriormente, por la acción de los microorganismos aerobios
que se encuentran en la parte superior del suelo.
Este método también se considera como una forma de disposición de residuos ya que no hay
seguridad de que se realice este tratamiento secuencial y que su eficiencia garantice la inocuidad
de los productos resultantes a los cuerpos receptores acuosos superficiales o subterráneos que
reciban sus lixiviados, provocados por la lluvia.
Este proceso se desarrolló hace más de veinte años por la industria del petróleo para el
tratamiento de sus residuos. Recientemente, se viene utilizando para el tratamiento de un gran
número de residuos industriales, inclusive de algunos clasificados como peligrosos.
En esencia, la biolabranza o “landfarming” es un proceso que consiste de la mezcla del residuo
con la parte superficial del suelo (15 a 20 cm), que normalmente se conoce como zona arable
(O´Brien, 1989) y se mueve en forma periódica para promover la acción solar y la de los
organismos que actúan una vez que las sustancias complejas han empezado a descomponerse por
la presencia de la luz ultravioleta del sol y por radicales libres oxidantes presentes.
El suelo es el reactivo/catalizador de este sistema de tratamiento y, por lo tanto, se debe estudiar
detalladamente. Los parámetros importantes a tener en cuenta son: Los componentes del residuo
que serán el factor limitante en el establecimiento de las cantidades a aplicar, el área requerida
para el tratamiento de una cantidad determinada de residuo y la recepción de fotones por unidad
de área y de radicales libres por unidad de masa de los contaminantes limitantes. El criterio de
diseño basado en el tratamiento en el suelo, obviamente, no se puede transferir de una localidad a
otra (O´Brien, 1989).
Una objeción de la aplicación en el suelo es que se requiere una gran extensión de terreno.
Además, debe caracterizarse perfectamente al suelo, al residuo y a las características
climatológicas de la zona para saber si es conveniente utilizar esta técnica; de lo contrario
representa una amenaza potencial al ambiente, tanto por la generación de lixiviados con la lluvia
como de su llegada al subsuelo sin ningún control.
Confinamientos controlados
Un confinamiento controlado es una instalación de disposición donde los residuos peligrosos se
colocan en el suelo. Algunos incluso se sepultan o se estabilizan previamente de tal manera que
no representen un peligro para la salud pública o el ambiente. Los confinamientos no son
homogéneos y generalmente se conforman de celdas, en las cuales se coloca un volumen
específico de residuos peligrosos, aislándolos de las celdas adyacentes por una barrera apropiada.
Las barreras entre celdas consisten comúnmente de una capa de suelo natural, generalmente
arcillas, las cuales restringen el movimiento lateral o descendente de los lixiviados de los
residuos peligrosos. Generalmente, el llenado se continúa por encima del nivel del terreno para
utilizar eficientemente el espacio y suministrarse un nivel para el escurrimiento de la
39
precipitación pluvial, en caso de existir. Estos escurrimientos o lixiviados deben ser tratados
(Batstone, 1989).
Los confinamientos son un método común de manejo de residuos peligrosos, tanto para los
residuos no tratados como para los residuos que han recibido tecnologías de tratamiento y
estabilización y requieren de una construcción cuidadosa, así como de un seguimiento y
mantenimiento continuos (Batstone, 1989).
Hasta el momento, México cuenta con un sólo confinamiento controlado en operación y es el de
Residuos Industriales Multiquim, S.A. de C.V. (RIMSA) en el municipio de Mina, Nuevo León.
II.3.5.
FACTORES IMPORTANTES EN LA SELECCIÓN DE TECNOLOGÍAS
Dentro de los factores importantes para definir la tecnología que debe usarse para estabilizar y
disponer de residuos peligrosos están los siguientes:
1. Tipo de residuo: Se refiere a la caracterización de los componentes del residuo por
ejemplo. lodos que contienen metales pesados, aceites contaminados, sulfato de bario
contaminado, etc.
2. Forma o estado físico del residuo: Se encuentran principalmente en estado sólido,
semisólido o líquido.
3. Cantidad: Se refiere al volumen de residuos que requieren tratamiento.
4. Economía relativa del tratamiento: Es uno de los puntos determinantes para la elección de
la(s) tecnología(s) de tratamiento. Se requiere un análisis de los costos de operación, la
infraestructura existente, costos de inversión y costos de mantenimiento, así pues, la
elección, además de tomar en cuenta las características físicoquímicas del residuo, estará
determinada por los factores de índole económica y, por supuesto, de la infraestructura
que exista, así como de los requerimientos de personal capacitado.
5. Legislación: Es indispensable que las opciones seleccionadas se encuentren acordes con
las leyes vigentes, pues solamente así, se podrá contar con un control adecuado que
realmente proteja al ambiente.
II.4
GENERALIDADES PARA PLATA, MERCURIO Y CROMO
II.4.1.
PLATA
II.4.1.1. Generalidades
La plata es un metal blanco, brillante, suave y maleable, presenta una alta conductividad eléctrica
y térmica. Químicamente es menos reactiva que el cobre, excepto frente al azufre y ácido
sulfhídrico; este último ennegrece rápidamente la superficie de la plata, por formación de sulfuro
de plata. El metal se disuelve en ácidos oxidantes, en solución de cianuro y en presencia de
oxígeno o peróxido (Burriel, 1989).
40
La plata se encuentra nativa en la naturaleza, a veces en masas hasta de 100 kg. Los minerales de
plata más importantes son: la argentita (Ag2S), la estromeyerita (Cu2S.Ag2S), y la pirargirita
(Sb2S3.3Ag2S). La clorargirita (AgCl), se encuentra en pequeñas cantidades. Los yacimientos
mayores se encuentran en México (suministra más de un tercio de la producción mundial),
Estados Unidos de América, Canadá (Ontario), Australia, Sajonia, Hungría y Siberia. El agua de
mar tiene trazas de sales de plata. Los minerales del plomo suelen contener también algo de plata.
Al beneficiar el plomo, la plata queda retenida por el plomo. La plata pura comercial suele
contener cobre y otros metales.
La plata cristaliza en octaedros regulares en el sistema cúbico de cara centrada, su peso
específico es de 10.5, hierve a 1955ºC dando entonces vapor azul monoatómico. La plata fundida
absorbe veinte veces su volumen de oxígeno, perdiéndolo de nuevo al solidificar. La plata es un
metal noble. Se llaman metales nobles a aquellos que son muy resistentes a las acciones químicas
y que no se combinan con el oxígeno a la presión ordinaria ni aún a la temperatura elevada.
II.4.1.2 Propiedades químicas
Pertenece al grupo Ib de la tabla periódica, posee una estructura cortical externa 3d10, 4s1 y
puede funcionar en sus compuestos con los grados de oxidación (I), (II), (III), en medio acuoso
sólo se encuentra como monovalente.
De los distintos estados de oxidación, el catión más estable en disolución es el Ag+, incoloro
(saturación del orbital externo 3d), por lo que las reacciones analíticas de este elemento se basan
en las características de este catión. Los estados de oxidación superiores de la plata, Ag(II) y (III)
son muy inestables como iones libres (muy ácidos y oxidantes); sin embargo, se pueden
estabilizar por formación de precipitados o complejos; las formas más conocidas son los óxidos
AgO y Ag2O3 y el complejo nitrato de Ag(II), que permite una relativa estabilidad de sus
soluciones. El óxido AgO es muy fácil de obtener y es utilizado como oxidante fuerte,
fundamentalmente en oxidaciones orgánicas.
El metal no puede ser disuelto por ácidos no oxidantes. Su mejor disolvente es el ácido nítrico.
También se disuelve en el ácido sulfúrico concentrado y caliente, lo que se aplica a la separación
de sus aleaciones con el oro, que permanece insoluble. No es atacado apreciablemente por los
hidróxidos alcalinos fundidos, propiedad que se aplica a la fabricación de crisoles de plata para
fusiones alcalinas.
El catión Ag+ es un poco más oxidante que el catión Fe3+, por lo que es fácilmente reducible; sin
embargo, su potencial se hace mucho más reductor en presencia de Cl- o de otros aniones que
precipiten o formen complejos con el catión. Los compuestos de plata más solubles en agua son
el nitrato, fluoruro y clorato. Los más insolubles son el sulfuro y los halogenuros.
II.4.1.3 Reacciones
1. Hidróxidos alcalinos fuertes
41
Originan precipitado pardo de Ag2O, insoluble en exceso de reactivo, fácilmente soluble en ácido
nítrico y en amoníaco:
2Ag+ + 2OH- --------------------> Ag2O↓ + H2O
Las soluciones amoniacales de óxido de plata suelen depositar, por reposo, cristales negros, una
vez secos, son fuertemente explosivos (plata fulminante).
2. Ácido sulfhídrico
Precipitado negro de Ag2S, insoluble en amoníaco, en sulfuros o polisulfuros alcalinos y en
soluciones no muy concentradas de cianuro potásico soluble fácilmente en ácido nítrico diluido y
caliente y con más dificultad en soluciones concentradas de cianuro potásico.
2Ag+ + H2S--------------------> Ag2S ↓ + 2H+
3Ag2S ↓ + 2NO3- + 8H+ -------------------> 6Ag+ + 2NO + 3S + 4H2O
3. Precipitación con cloruro
El ión Cl- es reactivo general del catión Ag+ en cuanto sirve para separarle de otros cationes y
también especial, porque puede servir para identificación del mismo. Forma un precipitado
blanco, cuajoso, que oscurece a la luz, insoluble en los ácidos fuertes y soluble en gran exceso de
Cl-.
Ag+ + Cl- -------------------> AgCl↓
II.4.1.4 Usos en la industria
La plata es uno de los metales más nobles y más utilizados en la industria. Los usos industriales
más importantes son: Platería y joyería, contactos y componentes eléctricos, aleaciones y
soldaduras, piezas dentales y médicas, espejos, baterías, productos químicos y fotografía
(González, 1978).
II.4.1.5 Toxicidad
La plata puede ser ingerida de diversas formas, vía consumo de organismos marinos, por
utensilios de comida y algunas piezas dentales (Hans, 1988). La plata no presenta graves
problemas de salud a nivel industrial en concentraciones por debajo de 0.10 mg/m3. Las sales de
plata son capaces de penetrar por la piel a través de los poros de las glándulas sudoríparas. Los
compuestos de plata pueden ser absorbidos por inhalación y por ingestión y se encuentra en altas
concentraciones en hígado, bazo, músculo, piel y cerebro. Los valores normales de plata en
riñones, hígado y bazo son 0.4, 0.7, 2.7 mg/kg de peso seco, respectivamente.
La vida media biológica para la plata es del orden de pocos días para animales y de 50 días
aproximadamente para humanos; es posible que depósitos en la piel también tengan una larga
vida media. La excreción de la plata es por vía gastrointestinal principalmente; la excreción
urinaria es de 10μg/día y por eliminación fecal es de 30-80μg/día; esto ha sido reportado en
personas saludables. Los compuestos de plata soluble en agua, tales como los nitratos, tienen un
42
efecto local corrosivo y pueden causar un envenenamiento mortal si es tomado por accidente.
Una dosis con propósitos terapéuticos por vía intravenosa, si sobrepasa los 50 mg, es letal.
Los hallazgos en los casos de algunas necropsias indican edema pulmonar, hemorragia y necrosis
de la médula ósea, hígado y riñón. La instilación de aproximadamente 7 g de AgNO3, dentro de
la cavidad uterina, como abortivo, ha sido reportado que en las primeras 3 horas es fatal. La
exposición por largo tiempo ya sea por inhalación o por ingestión de sales de plata coloidal
produce una enfermedad llamada argiriasis o argiria, palabras que según el diccionario de la
lengua española (árgyros, plata), que se caracteriza por una pigmentación azul-grisácea de la piel
en los sitios expuestos y en las vísceras del cuerpo por intoxicación crónica con sales de plata.
También el parénquima cerebral puede ser afectado por la argiria.
La dosis requerida para inducir la argiriasis está en el intervalo de 1 a 30 g de sales de plata
solubles. La plata metálica es menos dañina, con excepción de preparaciones de plata coloidal.
Las personas rubias son consideradas más susceptibles a contraer la argiria. Exposición repetida
en animales puede producir anemia, crecimiento cardíaco, retardo en el crecimiento y cambios
regenerativos en el hígado. No ha sido reportado un tratamiento efectivo para la argiriasis. La
terapia mediante la formación de “ligandos” se ha reportado que no es efectiva.
II.4.2 MERCURIO
II.4.2.1 Generalidades
El mercurio es conocido y usado hace más de 2,000 años. La introducción del mercurio en la
investigación científica, ocurrió en 1643 con la invención del barómetro de Torricelli, el cual usó
el mercurio para la determinación de la presión atmosférica. En 1720, Fahrenheit inventó el
termómetro de mercurio (Burriel, 1989).
El mercurio es el único metal líquido a las temperaturas ordinarias. Se solidifica a -38.87ºC y
hierve a 356.9ºC. Tiene color blanco como la plata con un ligero matiz azulado. Cuando el
mercurio se solidifica, el metal se contrae y cristaliza con el sistema romboédrico. Su alta
conductividad térmica, ocasiona que el mercurio pueda ser usado como agente refrigerante. Su
baja resistividad eléctrica, ocasiona que el mercurio pueda ser usado en contactos eléctricos. Su
alta volatilidad es incomparable con respecto a los demás metales.
El mercurio es el único elemento, junto con los gases raros, que forma vapor monoatómico a
temperatura ambiente, por lo que resulta muy contaminante.
43
II.4.2.2 Propiedades químicas
Pertenece al grupo IIb de la Tabla Periódica y su estructura cortical externa es 5d10, 6s2. A pesar
de la semejanza electrónica con los elementos de su grupo (Zn y Cd), las analogías de tipo
analítico son escasas. Funciona con los grados de oxidación (I) y (II), originando los compuestos
mercuriosos y mercúricos, respectivamente. El estado de oxidación (I) es sólo aparente, ya que en
realidad es un dímero formado por dos iones Hg(II) unidos por enlace covalente, +Hg-Hg+.
Hg(I)
El catión es incoloro, como lo son las sales solubles mercuriosas. Por sus propiedades analíticas,
el Hg22+ tiene ciertas analogías de comportamiento con Ag+ y Tl+, precipitando los tres cationes
cloruros insolubles. El catión mercurioso es un catión bastante ácido que necesita acidez libre
para existir en medio acuoso. Si la acidez no es suficiente puede precipitar sales básicas blancas o
amarillas.
El cloro ataca al metal formando Hg2Cl2 (diferencia de los hipocloritos que originan óxidos
amarillos, HgO u oxicloruro mercúrico, Hg2Cl2O pardo). Tanto el mercurio metálico como el ión
mercurioso son reductores débiles, excepto cuando actúan en presencia de agentes que forman
complejos de Hg(II). El catión mercurioso sólo es estable en medio ácido y, a pH>3.5, el catión
sufre una “dismutación” que origina HgO y Hg. En presencia de algún anión que estabilice al
catión mercurioso, como el Cl- , se impide la “dismutación”, debido a que la estabilidad del
precipitado (Hg2Cl2) es mayor que la del precipitado de HgO, siempre y cuando no se rebase un
pH>11.
Los compuestos más insolubles del Hg(I) son: Hg2Cl2 blanco que ennegrece con amoníaco, por
lo que ha recibido el nombre de calomel o calomelanos; Hg2I2, amarillo vivo; Hg2(SCN)2, blanco
sedoso. La insolubilidad y color de estas sales tienen una gran semejanza con las
correspondientes de Ag(I).
Hg(II)
Es incoloro y tiene gran tendencia a formar compuestos covalentes poco disociados, incluso con
aniones inorgánicos, como es el caso del HgCl2 o el Hg(CN)2; estas especies neutras no tienen
carácter salino, son compuestos muy poco disociados; el Hg(CN)2 deja tan baja concentración de
Hg2+ en solución que no reacciona con sus reactivos ordinarios, excepto con los sulfuros. A esta
tendencia se debe el hecho de que el Hg(II) entre a formar parte, fácilmente, en numerosas
combinaciones orgánicas.
Naturalmente, a diferencia del Hg(I), forma numerosos complejos (Burriel, 1989). Su acción
deformante sobre los aniones con los que puede formar compuestos insolubles es grande y por
esta razón son fuertemente coloreados, aunque el anión sea incoloro, (sulfuro, negro; óxido, rojo;
yoduro, rojo, etc). El catión mercúrico es un oxidante moderado en medio ácido; en medio
alcalino es menos oxidante por formarse la especie HgO. En las disoluciones acuosas de sus sales
disociadas (nitrato, perclorato) el catión Hg2+ se comporta como un catión ácido que se hidroliza
fuertemente, por lo que las citadas disoluciones necesitan acidez libre para estabilizar el catión.
44
Si la acidez disminuye, precipitan sales básicas por formación de compuestos insolubles con el
catión HgOH+, de color amarillo o rojo. El HgO, amarillo en frío y rojo en caliente, precipita a un
pH de 2.4; este óxido es prácticamente insoluble incluso a valores altos de pH.
Cuando la especie disuelta está poco disociada, como ocurre con el HgCl2, el comportamiento
ácido-base se ve modificado por la mayor estabilización del Hg2+; así el cloruro mercúrico no
precipita el óxido hasta un pH próximo a 7. Las sales m{as solubles son: nitrato, cloruro y
cianuro. Las sales más insolubles son: HgS, negro; HgI2, rojo; HgO, amarillo o rojo.
II.4.2.3 Reacciones
Hg(I)
1. Hidróxidos alcalinos fuertes
Inicialmente se forma un precipitado negro de óxido de mercurio (I)
Hg22+ + 2OH- --------------------> Hg2O↓ + H2O
Lentamente, en frío y más rápidamente si se calienta, el precipitado toma color gris de una
mezcla de mercurio elemental (negro) y óxido mercúrico (amarillo). originados en la dismutación
del óxido mercurioso:
Hg2O↓ --------------------> HgO↓ + Hg
2. Ácido sulfhídrico
Precipitado negro mezcla de mercurio metálico y de sulfuro mercúrico (II)
Hg22+ + H2S --------------------> Hg + HgS + 2H+
3. Anión cloruro
Origina precipitado blanco denso, de Hg2Cl2 (calomelanos). Diferencia de Hg2+, que no precipita.
El Hg2Cl2 se disuelve en el agua regia, o en el agua de bromo, oxidándose a Hg2+:
Hg22+ + 2Cl- --------------------> Hg2Cl2↓
Hg2Cl2↓ + Br2 --------------------> 2Hg2+ + 2Cl- + 2BrHg(II)
1.Hidróxidos alcalinos fuertes
Con pequeñas concentraciones de álcali origina sal básica, amarilla o pardo rojiza de
composición variable. Si se continúa la adición de álcali, al llegar a un pH alrededor de 2
45
precipita óxido mercúrico (II), amarillo, ligeramente soluble en exceso de álcali y fácilmente
soluble en ácidos:
Hg2+ + NO3- + OH- --------------------> HgNO3 (OH)↓
HgNO3 (OH)↓ + OH- -------------------->HgO↓ + NO3- + H2O
2. Ácido sulfhídrico
Origina precipitado negro de sulfuro mercúrico. En medio fuertemente ácido puede precipitar
diversos sulfocloruros de color blanco, amarillo y rojo, sucesivamente, antes de llegar a la forma
de sulfuro negro:
3Hg2+ + 2Cl- + H2S --------------------> Hg3Cl2S2↓ + 4H+
Hg3S2Cl2↓ + H2S --------------------> 3HgS↓ + 2H+ + 2Cl3. Yoduro de potasio
Forma un precipitado rojo de HgI2, fácilmente soluble en exceso de reactivo por formar el
complejo HgI42Hg2+ + 2I- --------------------> HgI2↓
HgI2↓ + 2I- --------------------> HgI42II.4.2.4 Usos en la industria
En amalgamas con excepción del hierro, todos los demás metales, pueden ser amalgamados con
mercurio. Amalgamas de sodio y potasio son utilizadas como agentes reductores. El mercurio se
utiliza como cátodo en celdas electrolíticas para obtención de cloro e hidróxido de sodio
(Fishman, 1970). Los cloruros, óxidos, sulfatos, acetatos y fosfatos de mercurio son buenos
catalizadores para muchas reacciones químicas.
En aparatos eléctricos donde su estabilidad, fluidez, alta gravedad específica y conductividad
eléctrica son únicas, también se utiliza en lámparas de mercurio de baja presión o fluorescentes y
de alta presión utilizados en alumbrado público. Estas lámparas son utilizadas también en
fotocopiado, proyección de películas, fotografía. El mercurio se utiliza en termómetros,
barómetros, osciloscopios, contactos, computadoras. El HgO se utiliza en pinturas y como
reactivo, el Hg2Cl2 es utilizado en lo que se conoce como calomelanos en electrodos.
II.4.2.5 Toxicidad
Los compuestos de Hg(I) son tóxicos, aunque menos que los de Hg(II). Así, el HgCl2 tiene una
elevada toxicidad, mientras que el Hg2Cl2, que se ha utilizado como purgante, no es tóxico
debido a su insolubilidad en los ácidos del aparato digestivo (Hans, 1988). Los compuestos de
Hg(II) son fuertemente tóxicos. El HgCl2, sublimado corrosivo, que se encuentra con frecuencia
en las prácticas docentes, es mucho más tóxico cuando penetra en el organismo por vía pulmonar,
lo que se debe tener muy en cuenta cuando se evapora una disolución que contiene dicha sal, ya
46
que el “HgCl" en disolución destila apreciablemente a la temperatura del baño María. La
absorción de vapores o polvos mercuriales por el cuerpo humano se conoce como nociva desde
hace bastantes siglos. Para el manejo del mercurio y sus compuestos, es necesario utilizar equipo
de protección como impermeables, guantes, lentes de protección, y respiradores con absorbentes
especiales. Estas precauciones son necesarias para prevenir la inhalación, la ingestión y absorción
del mercurio. En California, el límite tolerado es de 0.15 mg/m3.
La absorción de mercurio se realiza por la vía respiratoria, piel y vía gastrointestinal. Si hubiera
una explosión de aire que contiene 0.1 mg/m3 de mercurio esta cantidad sería excretada en 24
horas por la orina, heces, lágrimas y saliva. El organismo humano es capaz de absorber y excretar
en algunos casos, cantidades tan altas como 2 mg/día sin presentar ningún síntoma de
intoxicación.
Los compuestos fenilmercuriales son considerados mucho menos tóxicos que los derivados
alquílicos y pueden ser comparados con los compuestos mercúricos inorgánicos. La toxicidad por
inhalación de vapor de mercurio provoca carraspera, temblores, malestares abdominales y otros
síntomas acompañados con excreción en la orina, se ha demostrado también que altas
concentraciones de mercurio en el aire daña los tejidos pulmonares.
El mercurio en el cuerpo tiene alta afinidad por grupos sulfhidrilos, iones cloruro y aminas y esto
ocasiona que el mercurio inhiba la ureasa, invertasa y otras enzimas que contienen grupos SH. el
mercurio puede bloquear la vía metabólica de la glucosa. Los antídotos empleados provocan la
formación de “ligandos” del metal para que éste sea inactivado y excretado, entre estos están: Nacetilfenilcilamina, el 2,3 dimercaptopropanol (BAL) y ácido etilendiaminotetraácetico (EDTA).
II.4.3. CROMO
II.4.3.1 Generalidades
Descubierto por el químico Vauquelin en l797, le dio el nombre de “chrome”, que procede del
griego Chroma, que significa color, en atención a que todos los compuestos conocidos de cromo,
sólidos o en disolución, son coloreados. Pertenece al grupo VIa de la tabla periódica y tiene una
estructura cortical externa 3p6, 3d5, 4s1.
El cromo considerado habitualmente como "puro" es de color blanco brillante, quebradizo y tan
duro que raya el vidrio. Pero el cromo "purísimo", obtenido en condiciones especiales, libre de
impurezas, no es duro ni quebradizo, sino dúctil, por lo que la dureza y la fragilidad se considera
que son debidas a pequeñas impurezas de óxidos, carburos o nitruros (Burriel, 1989).
El cromo es extraordinariamente resistente químicamente a temperatura ordinaria. Tiene un
punto de fusión considerablemente alto (1800ºC) pero el de ebullición no es proporcionalmente
alto (2300ºC a presión atmosférica). No se oxida notablemente con el aire, algunas veces en la
presencia de humedad aparecen manchas superficiales; cuando se calienta se quema,
especialmente, a la flama de soplete de oxígeno y también cuando se calienta con clorato de
potasio o nitrato de potasio. Se disuelve en ácido clorhídrico acuoso o en ácido sulfúrico, no
tienen acción sobre el ácido nítrico concentrado o diluido ni el agua regia en frío.
47
II.4.3.2 Propiedades químicas
Los estados de oxidación más frecuentes para el cromo son : (II) (III) y (VI), originando
compuestos cromosos, crómicos y cromatos (dicromatos), respectivamente; además se conocen
compuestos de Cr(IV) y Cr(V). El sistema Cr(II)/Cro es bastante reductor, lo que condiciona que
el metal se disuelva fácilmente en ácido clorhídrico, concentrado y diluido, con desprendimiento
de hidrógeno. En ausencia de aire (atmósfera inerte) se obtiene Cr2+, y en presencia de aire, Cr3+,
o mezcla de Cr2+ y Cr3+. El ácido sulfúrico diluido ataca lentamente al cromo, con
desprendimiento de hidrógeno y formación de Cr2+ o Cr3+, según exista o no oxígeno presente. El
ácido sulfúrico concentrado y caliente disuelve fácilmente al cromo, originando Cr3+ y
desprendiendo SO2:
2Cro + 3H2SO4 + 6H+ --------------------> 2Cr3+ + 3SO2 + 6H2O
El ácido nítrico, diluido o concentrado, no ataca al cromo, al que pasiva, por formación de una
capa de óxido, con lo que se hace insoluble en los ácidos, incluso en el sulfúrico concentrado y
frío y en el agua regia. El efecto de “pasivado” hace que el metal no se ataque por el cloro seco,
vapores nitrosos, dióxido de azufre, sulfhídrico, álcalis cáusticos, etc.
El ácido perclórico concentrado ataca y disuelve al cromo y a sus aleaciones, originando Cr(VI)
(dicromato). El Cr(II), muy reductor en todo el margen de pH, es muy fácilmente oxidado a
Cr(III), incluso por el oxígeno disuelto o el ambiental, por lo que apenas tiene existencia en
medio acuoso, a no ser que se consiga estabilizar esta valencia o inhibir la oxidación. El potencial
del sistema Cr(VI)/Cr(III) depende del pH del medio. En un medio suficientemente ácido las
sales de Cr(VI), los dicromatos, son oxidantes enérgicos que oxidan cuantitativamente
(dicromatos) al Fe2+, al Sn2+, al I- y al C2H5OH, entre otros:
Cr2O72- + 6Fe2+ + 14H+ --------------------> 2Cr3+ + 6Fe3+ + 7H2O
Cr2O72- + 6I- + 14H+ --------------------> Cr3+ + 3I2 + 7H2O
A medida que el pH aumenta el Cr(VI) se hace menos oxidante por lo que la utilización de
cromatos como oxidantes en medios alcalinos es muy restringida. Los grados de oxidación
Cr(IV) y Cr(V) se forman como intermediarios (no estables) en las reacciones redox en que
interviene el sistema Cr(IV)/Cr(III). Además, se conocen algunos compuestos sólidos de Cr(IV),
como el CrO2, de importancia industrial por su ferromagnetismo y del Cr(V).
Cr(II)
Todos los compuestos cromosos son inestables al aire, en el que se oxidan rápidamente a
compuestos de Cr(III). En disolución originan al catión Cr2+, azul, muy reductor, que reduce
lentamente al hidrógeno del agua, desprendiendo hidrógeno elemental. La facilidad con la que se
oxida el Cr2+ justifica que no se encuentre prácticamente en disolución acuosa y que no sea
objeto de investigación cualitativa. Pueden ser más o menos estabilizados en medio acuoso por
formación de complejos con acetato, etilendiamina, cianuro y tiocianato. Los complejos con
48
hidracina son bastante estables pero insolubles en agua. En presencia de polialcoholes se inhibe
la oxidación atmosférica, estabilizándose las soluciones de Cr2+, con lo que se consigue
aprovechar el gran poder reductor de esta especie para efectuar valoraciones reductimétricas.
Cr(III)
Origina las sales crómicas y sus compuestos que junto, con los cromatos (grado de oxidación VI),
constituyen los compuestos de cromo más importantes desde el punto de vista analítico. Las sales
solubles en agua originan el catión Cr3+, que lógicamente no se encuentra libre sino formando
acuocomplejos simples o mixtos con los aniones existentes en la disolución. La diversidad de
estos complejos determina el color de las soluciones de cromo, que presentan tonalidades verde,
violeta y, en ocasiones, gris. En medios ácidos predomina la especie Cr3+ coexistiendo con las
formas básicas CrOH2+ y Cr(OH)2+.
A valores de pH próximos a 5 precipita el óxido hidratado que se suele formular como
Cr(OH)3.nH2O. El precipitado es bastante estable, si bien puede disolverse en medios alcalinos
para dar cromitos, siendo el CrO2-, verde, la especie predominante; posiblemente también existan
las formas Cr(OH)52- y Cr(OH)63-. Los cromitos, en general, no son muy estables y reprecipitan el
hidróxido por simple ebullición.
Cr(VI)
En este estado de oxidación el cromo presenta una relación carga/radio tan elevada que no puede
formar cationes en medio acuoso, sino aniones oxigenados como CrO42-, Cr2O72-, etc. En medios
alcalinos la especie predominante es el ión cromato, CrO42-, amarillo; a valores de pH próximos a
6; el cromato acepta protones transformándose en HCrO4- y Cr2O72-, de color rojo naranja:
CrO42- + H+ --------------------> HCrO42CrO42- + 2H+ --------------------> Cr2O72- + H2O
El equilibrio entre las especies HCrO4- y Cr2O72- está condicionado por la concentración; a
concentraciones elevadas predomina el dímero Cr2O72-; a bajas concentraciones predomina
HCrO4-. En medios más ácidos se forma el ácido crómico H2CrO4.
Los compuestos más importantes de cromo (VI) son los cromatos y los dicromatos metálicos,
todos ellos coloreados. Los cromatos más insolubles son PbCrO4, amarillo, Ag2CrO4, rojo,
Tl2CrO4, amarillo, HgCrO4, amarillo y los más solubles los Hg22+, Sr2+, Cu2+ y Fe2+. Todos ellos
son solubles en ácidos más o menos fuertes.
Los dicromatos son solubles, siendo la especie K2Cr2O7 el compuesto más importante de cromo
(VI); es rojizo en estado cristalino y se torna amarillo al pulverizarlo. Es ampliamente utilizado
como oxidante en los laboratorios y ciertas industrias.
II.4.3.3 Reacciones
49
Cr(III)
1.Hidróxidos alcalinos fuertes
Precipitado gris verdoso, o violáceo, gelatinoso, de Cr(OH)3, soluble en frío, en exceso de
reactivo, dando una solución verdosa que contiene al anión cromito CrO2-:
Cr3+ + 3OH- --------------------> Cr(OH)3↓
Cr(OH)3↓ + OH- --------------------> CrO2- + 2H2O
Si la disolución alcalina que contiene el cromito se diluye y se hierve, ocurre un proceso
hidrolítico con reprecipitación cuantitativa del hidróxido.
2. Carbonatos alcalinos
La alcalinidad proporcionada por la hidrólisis es suficiente para que precipite el hidróxido de
cromo, más estable que el carbonato:
Cr3+ + 3CO32- + 3H2O --------------------> Cr(OH)3↓ + HCO3El mismo comportamiento y, por idéntica razón, tiene el carbonato de bario, el tiosulfato de
sodio, el sulfuro de amonio y el cianuro de potasio.
3. Ácido sulfhídrico
El H2S no reacciona con el Cr3+ en medio ácido; en medio alcalino tampoco es posible la
obtención de Cr2S3 debido a que es más estable el hidróxido, Cr(OH)3. Por consiguiente, el
sulfuro de cromo sólo puede obtenerse en ausencia de agua, es decir, por vía seca.
Cr(VI)
1. Peróxido de hidrógeno
En medio ácido, el Cr(VI) reacciona con el H2O originando un pentóxido de cromo, CrO5, de
color azul intenso, que puede extraerse en éter o en alcohol amílico:
Cr2O72- + 2H+ + 4H2O2 --------------------> 2CrO5 + 5H2O
El pentóxido contiene dos grupos peroxi, por lo que también se llama peróxido de cromo.
2. Reactivos de precipitación
El CrO42- precipita sales coloreadas con muchos cationes. Tiene interés analítico y, a veces, se
utilizan con fines de identificación, el precipitado rojo de Ag2CrO4 o los amarillos de PbCrO4 y
50
BaCrO4, obtenidos con los cationes correspondientes en medio acético y solubles en ácidos
fuertes.
3. Ácido sulfhídrico
Los cromatos y dicromatos, en medio ácido, son reducidos por el SH2 a Cr3+, con precipitación
de azufre:
Cr2O72- + 3H2S + 8H+ -------------------> 2Cr3+ + 3S + 7H2O
La oxidación del H2S pude llegar incluso a sulfato, por lo que es necesaria la eliminación de
Cr(VI), por reducción. Si la acción del H2S sobre soluciones que contienen Cr(VI) se efectúa en
medio poco ácido, el Cr(III) resultante se estabiliza como Cr(OH)3.
II.4.3.4 Usos en la industria
El cromo metálico encuentra su principal uso en la industria acerera, los aceros de cromo son
característicos por su dureza y resistencia y, por lo tanto, son empleados para herramientas y
particularmente en partes de máquinas sometidas a grandes tensiones como los baleros. Otras
aleaciones como las de bronce y latón son también frecuentemente endurecidas al adherir cromo.
Una aleación Ni-Cr-Fe en alambre forma nicromo, que se usa en las resistencias de hornos
eléctricos. El cromo es el más duro de los metales usuales y es muy apropiado para la producción
de recubrimientos protectores.
El cromado electrolítico ha encontrado amplia aplicación en la industria automovilística, así
como para muchos otros objetos especialmente de cocina (electrodomésticos, baterías de cocina,
etc) (Benítez-Sánchez, 1989). Los compuestos de cromo son más ampliamente usados que el
cromo metálico. Las sales de Cr(III) y cromatos son usadas para la industria de colorantes como
mordentes. En la industria peletera sirven para la producción de piel-Cr, más durable. Se ha
encontrado aplicación en fotografía. Numerosos compuestos de cromo son empleados como
pigmentos minerales: Amarillo cromo (cromato de plomo), naranja cromo (cromato básico de
plomo), verde cromo (óxido de cromo(III)).
II.4.3.5 Toxicidad
No hay evidencia de que el cromo incluido normalmente en la dieta produzca efectos adversos en
la salud. Sin embargo, la ingestión de grandes cantidades de dicromato de potasio ha causado la
muerte. El cromo hexavalente es mucho más tóxico que el trivalente. Las exposiciones crónicas
de polvo de cromato se han correlacionado con la incidencia de cáncer pulmonar y una
administración oral de 50 ppm de cromato en la dieta se ha sido asociado con la depresión en el
crecimiento y daños en hígado y riñón en animales de experimentación (Hans, 1988).
Se toman, en general, como potencialmente carcinogénicos a los compuestos de cromo
hexavalente y se niega esta capacidad a los trivalentes. Entre los compuestos hexavalentes, se
señala a los compuestos monocromados como los principales carcinógenos. El dicromato de
potasio es el primero en número de casos por compuesto que provocan dermatitis. Se señalan
diversas actividades en las que se ha encontrado dermatitis por cromo galvanizado, impresión
51
con tintas de cromo, industria del cemento, curtiduría comercial, pintura y ensamblajes de
automóviles, molinos de madera, plantas de aviones, equipos de aire acondicionado, producción
de cromatos, cromado, fotografía y litografía, pantallas de televisión a color, industria de
construcción. También en algunos productos como: detergentes, blanqueadores, cerillos, acero
inoxidable, preparados químicos para la agricultura.
Es muy amplio el número de industrias relacionadas con la dermatitis por cromo (algunas de ellas
con producción a gran escala, lo que implica un gran número de trabajadores expuestos). Las
afecciones respiratorias son los efectos más comúnmente provocados por la inhalación de polvos
de cromatos y de gases de ácido crómico en los trabajadores.
Son muy diversas las manifestaciones clínicas descritas de afecciones respiratorias: ulceración y
perforación del tabique nasal, mucosa inflamada, irritación de la conjuntiva, rinitis crónica,
sinusitis, enfisema, traqueitis, bronquitis crónica, catarro, bronconeumonía, faringitis, asma. Se
señala que el cromo es absorbido pobremente en el tracto gastrointestinal; en la forma
hexavalente un poco más que en la trivalente; sin embargo, los trastornos gastrointestinales,
siendo menos frecuentes que los del sistema respiratorio son más dolorosos y fáciles de
identificar; el vómito y la diarrea son síntomas notables que aparecen desde que la intoxicación
por ingestión de cromo es incipiente.
El cromo en su forma hexavalente y trivalente, pueden provocar trastornos en el sistema nervioso
central. En los oídos se ha encontrado corrosión de la membrana del tímpano y úlceras en el
canal externo.
A continuación en el siguiente capítulo se presenta la metodología experimental realizada en esta
investigación.
52
CAPÍTULO III
FASE EXPERIMENTAL
(METODOLOGÍA)
III.1 DESCRIPCIÓN DE LAS FUENTES DE AGUAS RESIDUALES
UTILIZADAS PARA EL ESTUDIO COMPARATIVO EN LA
DETERMINACIÓN DE DQO
Como se mencionó en la introducción, para probar las metodologías de determinación de
contenidos de materia orgánica como demanda química de oxígeno, se emplearon las aguas
residuales que, en el lapso de desarrollo de esta investigación estaban siendo estudiadas en los
laboratorios del PIQAyQA, vinazas de un ingenio azucarero-alcoholero (Ramírez-Burgos y col.,
2000a,b), agua del procesamiento del cempasúchil para la producción de harinas para pigmentar
dietas y extraer colorantes y, finalmente, nejayote o agua de cocción de maíz, proveniente de un
molino de nixtamal. A continuación se describen brevemente los procesos de los que se derivan
esta agua residuales, sus características y la forma en que se tomaron las muestras para la
medición de sus contenidos de materia orgánica, medida como DQO.
III.1.1 VINAZAS
Éste es uno de los efluentes líquidos más contaminantes del proceso de producción de alcohol
etílico. Tiene una alta carga orgánica medida como demanda química de oxígeno (DQO) que va
aproximadamente de 70,000 a 150,000 mg/L que, comparada con los desagües domésticos (400600 mg DQO/L), da una idea del impacto ambiental que causan (Tabla III.1).
Dado que la industria azucarera es una de las principales industrias contaminantes de las cuencas
de México, los ingenios azucareros/alcoholeros han empezado a adoptar acciones tendientes a
minimizar estos efectos negativos mediante el adecuado tratamiento de sus aguas residuales, que
permitan su reutilización dentro del ingenio dado que, por otra parte, el costo del uso y
distribución del agua se irá incrementando en los próximos años (Chaux y col., 1997; Durán y
col., 1994a,b; Durán-de-Bazúa, 1994a,b; Durán-de-Bazúa y col., 1988, 1991; Klomp y col., 1995;
Zámano y col., 1991).
Para ubicar en el contexto de México a este sector industrial, en general, la industria genera 64.5
m3/s de descargas líquidas con 1.6 millones de toneladas de DBO anualmente. De este valor, sólo
el 8% (5.3 m3/s) es tratado, obteniendo una remoción de 0.32 millones de toneladas de DBO. Los
53
restantes 59.2 m3/s, que es el 92%, queda sin tratar, contribuyendo con 1.28 x 106 ton de DBO.
(CMIC, 1998).
El sector agrícola genera 337 m3/s al año de agua residual (agua de retorno agrícola), lo que
representa el 62% del total nacional. El balance de descarga de agua residual urbana, industrial y
agrícola del país es de 634 m3/s que, anualmente, representa cantidades muy importantes (CMIC,
1998):
Total
Agricultura
Sector doméstico
Industrial
100%
62%
28%
10%
634 m3/s anual
337 m3/s anual
231 m3/s anual
64.5 m3/s anual
Tabla III.1 Composición promedio de las vinazas generadas en una destilería de alcohol de caña
(Durán-de-Bazúa y col., 1988)
PARÁMETRO
o
Temperatura, C
Valor de pH
Alcalinidad, g CaCO3 /L
Turbiedad, UNT (unidades nefelométricas de turbiedad)
Sólidos totales, g/L
DBO5, mg O2/L
DQO, g O2/L
Nitrógeno total, g/L
Nitrógeno Kjeldhal, mg N/L
Nitrógeno amoniacal, mg N/L
Sulfatos, g/L
Iones potasio, g/L
Ión sodio, g/L
*Dilución de 1/100
CANTIDAD
25-35
4.2-7.0
5.8
30,000
69-90
31,500*
69-128
1.2-1.6
1,600
150
3.1-5.8
8.1
0.14
Sin duda, la industria con mayor participación relativa en vertimiento de residuos que elevan la
carga orgánica al agua es la azucarera con un 53%, le siguen la elaboración de bebidas y la
fabricación de alcohol con un 10%, la petrolera, la de la celulosa y el papel, la alimentaria, la
metálica básica y la química con un 5%, cada una, (CMIC, 1998).
Algunas de estas industrias están establecidas en zonas con baja disponibilidad de agua, lo que
resulta en una sobreexplotación de acuíferos, contaminación de los ecosistemas y altos costos de
oportunidad.
Se considera que muchas empresas podrían utilizar aguas tratadas o grises en sus servicios o
procesos, con lo que se disminuiría la presión ejercida sobre la capacidad de los acuíferos o, en su
54
caso, se podría aumentar la cobertura del servicio de agua potable a favor del consumo doméstico
(Ramírez-Burgos y col., 2000a,b).
El ahorro de agua en los ingenios azucareros es de gran importancia, debido a factores de carácter
ecológico y económico que obligan a reducir al mínimo los volúmenes de agua que la fábrica
toma de diferentes fuentes de abastecimiento y que, a su vez, debe verter al ecosistema. Desde el
punto de vista económico, es imprescindible disminuir los costos de producción, para que esta
agroindustria sea viable económicamente.
Una forma de lograrse es incrementando la eficiencia mediante un mejor aprovechamiento de los
insumos, como es el agua, durante el proceso de producción, así como tomando las medidas de
carácter técnico necesarias en todos los sistemas hidráulicos de la fábrica, para que se minimice
el consumo de agua. Lo anterior sin olvidar que la rentabilidad económica no depende sólo del
buen manejo de agua, también depende del por ciento de azúcar recuperado (Baltazar, 1993).
III.1.2 CEMPASÚCHIL
Es una flor indígena de México (su nombre viene del náhuatl y significa flor de muchos pétalos),
que contiene pigmentos altamente apreciados en la industria alimentaria, farmacéutica y avícola
(Chávez, 1995; Chávez y col., 1994; Chávez-Sánchez y col., 1995).
Para su aprovechamiento industrial se cosecha y deshidrata y las harinas producidas son
adquiridas directamente por la industria avícola o enviadas a un segundo proceso, esta vez de
extracción, para obtener los pigmentos puros y emplearlos como colorantes en la industria
alimentaria o en la industria químico farmacéutica.
Para su deshidratación, la flor es ensilada (sujeta a procesos anaerobios de descomposición, para
eliminar parte del agua intracelular, a través de la ruptura de la pared celular) y, posteriormente,
prensada mecánicamente para extraer una porción adicional de agua, antes de enviar la torta
obtenida a secadores que emplean aire caliente que por convección, la deshidrata. La torta
deshidratada es enviada a molinos para homogenizar su tamaño de partícula y composición y
envasado para su posterior venta o procesamiento.
En las dos primeras operaciones, la de ensilado y la de prensado, se generan aguas residuales con
elevadas cantidades de material en suspensión y disuelto (aproximadamente 1.4 L/s de aguas
residuales para 200 ton/d de flor), provenientes de las propias flores y con características
generales que las hacen potencialmente dañinas para el ambiente (Chávez, 1995; Chávez y col.,
1994; Chávez-Sánchez y col., 1995). En la Tabla III.2 se presenta su composición promedio.
55
Tabla III.2 Caracterización de aguas de ensilado y prensado (Anónimo, 1990, Chávez, 1995)
CALIDAD DEL EFLUENTE (mg/L)
PARÁMETROS
PRENSADO
Sólidos suspendidos totales
24,000
Sólidos suspendidos volátiles
19,700
Sólidos disueltos totales
23,400
Fosfatos
1,500
N-Amoniacal
300
N-Orgánico
830
Demanda química de oxígeno total
72,600
Demanda química de oxígeno soluble
48,300
Demanda bioquímica de oxígeno total
40,170
Demanda bioquímica de oxígeno soluble
28,900
Grasas y aceites
470
Coliformes totales (NMP/100mL)
0
Sólidos sedimentables (mL/L)
600
Valor de pH (unidades)
4.1
Caudal (L/s)
0.5
ENSILADO
3,150
2,900
36,300
1,580
270
320
92,000
51,700
56,900
29,900
480
0
0
4.1
0.9
III.1.3 NEJAYOTE
Es el agua residual de molinos de nixtamal y fábricas de harina de maíz nixtamalizado. Tiene
residuos del propio maíz, así como restos de la cal usada durante la cocción, tanto en forma
suspendida como disuelta. Esta materia orgánica e inorgánica representa una elevada carga
contaminante desde el punto de vista ambiental. Además, la temperatura y el pH de salida son
altos (de 40 a 70oC y de 12 a 14 respectivamente), en particular, en las fábricas de harina de maíz
nixtamalizado. En éstas se emplean considerables cantidades de agua (de 500 a 1500m3/d) que
cuando se arrojan al drenaje o directamente a los acuíferos y/o suelo crean problemas de
deterioro ambiental (Durán de Bazúa, 1987a,b). La Tabla III.3 presenta la composición promedio
del nejayote, donde se destaca la cantidad de materia orgánica presente medida como DQO
(Valderrama, 1989).
Tabla III.3 Composición promedio del nejayote (Valderrama, 1989)
PARÁMETRO
CONCENTRACIÓN
Nitrógeno Kjeldahl (mg/L)
291
Proteína (%N * 6.25)
1.81
Azúcares reductores totales (mg/L)
2.58
Cenizas (%)
10.20
Grasa (%)
4.50
DBO5 (mg oxígeno disuelto/L)
7,875.00
DQO (mg oxígeno disuelto/L)
21,280.00
Sólidos (mg/L)
19,490.00
56
III.1.4 MATERIALES, EQUIPOS Y REACTIVOS
Los equipos y materiales empleados, de acuerdo a sus instrucciones de uso, fueron los siguientes:
•
•
•
•
•
•
Escpectrofotómetro UV-VIS GBC 911
Horno de calentamiento para usar a 165oC (estufa de secado)
Centrífugas (micro, semimicro y macrocentrífuga)
Digestor Behr para 24 muestras simultáneas, temperatura 150oC
Tubos condensadores con juntas esmeriladas
Celdas de cuarzo (10mm) para espectrofotómetro
Los reactivos analíticos empleados fueron:
•
•
•
•
•
•
•
•
•
Dicromato de potasio (K2Cr2O7)
Ácido sulfúrico concentrado (H2SO4)
Sulfato ferroso amoniacal hexahidratado [Fe(NH4)2(SO4)2 •6H2O]
Sulfato de plata (Ag2SO4)
Sulfato de mercúrico (HgSO4)
Sulfato ferroso heptahidratado [FeSO4•7H2O]
Hidrógenoftalato de potasio (C8H5KO4)
1-10, Fenantrolina
Agua destilada (disolvente)
III.1.5 DESCRIPCIÓN DE LA METODOLOGÍA
Durante la experimentación se realizaron análisis a muestras de soluciones estándar de
concentración conocida y a muestras de aguas residuales agroindustriales (vinazas, cempasúchil
y nejayote), a diferentes concentraciones, empleando los métodos a comparar. Se realizó la
prueba de DQO soluble en todas las muestras, realizando cada análisis por triplicado.
En el desarrollo de la aplicación del método rápido por colorimetría, se presentaron algunos
problemas, como fueron la presencia de partículas suspendidas en solución de la muestra
digerida, las cuales causaban interferencia en la absorbancia de la solución colorida de la muestra
analizada, lo que se reflejaba en los resultados analíticos obtenidos, así como la inestabilidad del
complejo coloreado, lo que repercutía en la reproducibilidad de los resultados. Para eliminar la
interferencia provocada por los sólidos en suspensión, se propuso su eliminación por
centrifugación, para lo cual se realizaron pruebas a diferentes intervalos en el tiempo de
centrifugación (15, 20, 25, 30, 35, 40, 60 minutos); determinándose que el tiempo óptimo para su
eliminación fue de 30 minutos de centrifugación a 500 rpm. Para resolver el problema, en la
inestabilidad del complejo coloreado, se modificó el tiempo de digestión del método rápido
colorimétrico de 15 minutos; efectuándose pruebas a diferentes tiempos de digestión (15, 20, 25,
30, 35, 40, 60 minutos), determinando que el tiempo mínimo óptimo para la estabilidad del
complejo y la reproducibilidad de los resultados, fue de 30 minutos a 165oC. La velocidad de
reacción química aumenta al elevarse la temperatura. Un incremento de 10oC, casi siempre
57
duplica o triplica la velocidad de reacción entre las moléculas, las cuales se mueven más
rápidamente y, por consiguiente, las colisiones son más frecuentes; las moléculas no solo chocan
con más frecuencia, sino que el impacto es más considerable debido a que la velocidad es más
alta.
III.2 TÉCNICAS EMPLEADAS PARA DETERMINAR DQO
III.2.1 MÉTODO COLORIMÉTRICO (REFLUJO CERRADO)
FUNDAMENTO
El análisis colorimétrico es una técnica cuantitativa basada en la comparación de la intensidad de
un color entre una muestra problema y un estándar. Para determinar la concentración de una
muestra problema, se construyen gráficas de curvas de calibración utilizando muestras estándares
de concentración conocida. De esta forma, la absorbancia de la muestra problema se obtiene en el
espectrofotómetro y su concentración se obtendrá por la interpolación de la absorbancia en la
curva de calibración.
PREPARACIÓN DE REACTIVOS
Los reactivos usados son los siguientes:
a ) Solución de digestión 0.21N
Disolver en agua destilada 10.216g de dicromato de potasio previamente secado a 103°C
durante 2 horas, l67 mL de ácido sulfúrico concentrado y 33.3 g de sulfato de mercurio;
aforar a un litro
b ) Reactivo con ácido sulfúrico
Pesar 10.12 g de sulfato de plata y adicionar un litro de ácido sulfúrico concentrado (el
sulfato de plata tarda de 1 a 2 días en disolverse)
c ) Hidrógenoftalato de potasio patrón (HFP)
Disolver 0.680g de C8H5KO4 en agua destilada, previamente secado a 120°C durante una
hora y aforar a un litro. El HFP tiene un DQO teórico de 1.176 mgO2/mg y esta solución
tiene un DQO teórico de 800 mgO2/L (Pitwell, 1983).
PROCEDIMIENTO
1 ) Acondicionamiento de la muestra
Se centrifugan perfectamente las muestras durante 15 minutos a 3600 rpm para eliminar los
sólidos suspendidos. Posteriormente, se efectúan las diluciones correspondientes y se toma la
cantidad correcta de muestra para el análisis (Tabla III.4). En un tubo de cultivo se mezclan:
• 2 mL de muestra problema
• 1 mL de solución de digestión 0.21N
• 3 mL del reactivo ácido sulfúrico con sulfato de plata
58
Se colocan los tubos en una estufa precalentanda a 165°C y se someten a reflujo durante 30
minutos. Se enfrían las muestras, el blanco y los patrones, los cuales se preparan de manera
similar a las muestra problema, cambiando los mL de muestra problema por agua destilada.
2 ) Proceso de centrifugado
Una vez digeridas las muestras, se dejan enfriar y se centrifugan durante 30 minutos a 5000
rpm para eliminar los sólidos que interfieren en las lecturas de absorbancia en el
espectrofotómetro
3 ) Determinación de la reducción de dicromato
De las muestras centrifugadas y enfriadas, así como del blanco y los patrones, se mide la
absorbancia y se compara con la curva de calibración.
4 ) Preparación de la curva de calibración
Se preparan una serie de patrones con la solución de hidrógenoftalato de potasio con (DQO)
equivalentes que oscilen entre 20 y 800 mg O2/L completando el volumen con agua
destilada; utilizando los mismos volúmenes de reactivos, los mismos tubos y el mismo
procedimiento de digestión que para las muestras problemas. Se someten a reflujo durante 30
minutos a una temperatura de 165°C y se toman lecturas de absorbancia en el
espectrofotómetro, utilizando una técnica de barrido a una longitud de onda que oscile entre
580 y 620 nm. Una vez obtenida la curva de calibración, se efectúa el barrido
correspondiente sobre las muestras a tratar y se obtiene la concentración directamente en
ppm o mg/L de materia orgánica de las muestras analizadas.
1. Acondicionamiento de la muestra
Se centrifugan perfectamente las muestras a 3600 rpm
Se diluyen a concentraciones adecuadas de operación especialmente las muestras de alta
concentración
2. Medición de la cantidad correcta de muestra problema y reactivos
La Tabla III.4 presenta la relación correcta de muestra y reactivos que se utilizan para la
determinación de la prueba de la DQO por el método colorimétrico.
Tabla III.4. Relación entre volumen de muestra y volúmenes de reactivo para determinar DQO
por el método colorimétrico
Tubos de
digestión
Tubos de
cultivo
Muestra
problema
(mL)
Solución de
digestión (mL)
0.21 N
H2SO4/Ag2SO4
(mL)
Volumen
final
2
1
3
6
3.- Digestión de las muestras
59
Las muestras se colocan en un horno de digestión, previamente calentado a 165°C, por un
período de tiempo de 30 minutos; se utiliza un blanco sustituyendo la muestra problema con agua
destilada y se somete a las mismas condiciones, empleando la misma cantidad de reactivos que
las muestras problemas.
4.- Proceso de centrifugación
Después de la digestión, las muestras se dejan enfriar a temperatura ambiente y se centrifugan a
5000 rpm durante 30 minutos para la eliminación de los sólidos suspendidos presentes después
de la digestión.
5.- Determinación de la reducción del dicromato
La concentración de DQO se calcula mediante la reducción del dicromato por colorimetría,
utilizando un espectrofotómetro, empleando para ello, una técnica de barrido a una longitud de
onda de 580-620 nm. (ver Anexo A), donde la concentración se calcula directamente a través de
una curva de calibración previamente preparada.
6.- Preparación de la curva de calibración (solución patrón C8H5KO4)
Las muestras para la curva de calibración se tratan al igual que las muestras problemas,
sometiéndolas a digestión a 165°C, utilizando los mismos tubos y la misma cantidad de reactivos
que las muestras analizadas.
III.2.2 MÉTODO ESTÁNDAR DE REFLUJO ABIERTO
El método estándar de reflujo abierto sigue los puntos que a continuación se detallan:
1. Acondicionamiento de la muestra
2. Medición de 10 mL de la muestra problema en análisis y colocación en el tubo de digestión
3. Adición de 0.2 g de Hg2S04
4. Posterior adición de 5 mL de K2Cr2O7, 0.25N
5. Adición de 15 mL de reactivo H2SO4/Ag2SO4
6. Colocación de los tubos en el digestor e inicio de reflujo durante dos horas a 150°C
7. Enfriamiento y adición de 40 mL de agua destilada
8. Valoración del K2Cr2O7 remanente con solución valorada de sulfato ferroso amoniacal 0.1N,
empleando como indicador ferroína:
60
mg DQO/L = (a - b) * N * 8000 / mL de muestra (f)
(III-1)
9. Valoración de la solución de sufato ferroso amoniacal:
Normalidad SFA = mL de K2Cr2O7 * N /mL SFA
(III-2)
FUNDAMENTO (APHA, 1995)
El método se basa en una oxidación de la materia orgánica oxidable que se encuentra en el agua
en un medio fuertemente ácido, con una solución valorada de dicromato de potasio. El exceso de
agente oxidante después de un tiempo de reflujo de 2 horas a 150°C, se determina con una
solución valorada de sulfato ferroso amoniacal (FAS) en presencia de un complejo ferroso de
ortofenantrolina (ferroína) como indicador interno. El valor obtenido se introduce a una ecuación
cuyo desarrollo da como resultado la concentración (mg/L) de materia oxidable químicamente.
PREPARACIÓN DE REACTIVOS
a) Ácido sulfúrico con plata
Disolver 10.12 de Ag2SO4 en un litro de H2SO4 concentrado (la solución de sulfato de plata
en ácido sulfúrico concentrado tarda entre 1 y 2 días en disolverse).
b) Solución estándar de dicromato de potasio, 0.25N
Disolver 12.259g de K2Cr2O7 previamente secado a 103°C durante 2 horas en agua destilada
y diluir a 1000 mL.
c)
Solución estándar de sulfato ferroso amoniacal 0.1N (SFA o FAS, por sus siglas en
inglés)
Disolver 39.2 g de Fe(NH4)2(SO4)2.6H2O en agua destilada. Agregar 20 mL de H2SO4
concentrado y diluir a 1000 mL. Estandarizar esta solución con la solución estándar de
dicromato de potasio.
d) Solución indicadora de ferroína
Disolver 0.3712 g de 1-10 fenantrolina monohidratada junto con 0.1737 g de FeSO4.7H2O
en agua destilada y diluir a 25 mL.
e) Estandarización
Diluir 5 mL de solución estándar de dicromato de potasio en 50 mL de agua destilada,
adicionar 15 mL de H2SO4 concentrado y titular con sulfato ferroso amoniacal utilizando
0.10 a 0.15 mL (2 o 3 gotas) de ferroína como indicador.
mL de K2Cr2O7 x 0.25
61
Normalidad =
________________________________
(III-3)
mL de SFA utilizados en la titulación
PROCEDIMIENTO
1 ) Mezclado en los tubos o vasos de digestión
10 mL de solución problema
5 mL de solución de dicromato de potasio
Adicionar 0.2g de sulfato mercúrico
15 mL de solución de ácido sulfúrico-sulfato de plata
2 ) Preparación de tubos patrón o blancos
Se preparan de manera idéntica a los tubos que contienen la muestra problema, sustituyendo
los 10 mL de muestra problema por agua destilada
3 ) Digestión de las muestras
Colocar los tubos en la placa de digestión a 150°C durante 2 horas
Transcurrido el tiempo dejar enfriar a temperatura ambiente
Adicionar 40 mL de agua destilada
4 ) Valoración de las muestras
Adicionar dos gotas de ferroína como indicador
Titular con solución valorada de sulfato ferroso amoniacal (SFA o FAS, en inglés)
Tomar como punto final de la titulación el primer cambio de color manifiesto desde el azul
verdoso al marrón rojizo
5 ) Cálculos
DQO en mg de oxígeno / L = (A - B) * N * 8000 / mL de muestra
donde:
A = mL de FAS utilizados para el blanco
B = mL de FAS utilizados para la muestra
N = Normalidad de la solución titulante (FAS)
8000 = miliequivalente de oxígeno
Finalmente, a fin de tener una mejor comprensión de los resultados obtenidos, sobre todo desde
el punto de vista cuantitativo, se decidió realizar una prueba estadística más.
Aquí resulta importante mencionar que se aplicó una herramienta matemática comúnmente
utilizada en la ingeniería para la comparación de los resultados experimentales con modelos
matemáticos tal como suele ocurrir, por ejemplo, en la termodinámica química (comparación de
predicción de datos equilibrio, reglas de mezclado, utilización de ecuaciones de estado, etc.).
Al revisar la bibliografía se encontró una metodología bastante funcional y representativa
desarrollada por Bazúa y Moreno (1993). Dicha metodología consiste en general en comparar los
62
datos obtenidos, mediante funciones matemáticas y errores previamente definidos. De la
aplicación de esta metodología puede deducirse que:
• Las soluciones estándar, a las concentraciones señaladas, presentan un error estándar entre
los métodos que oscila entre 0.9 - 1.7%. lo que permite establecer que los métodos son
comparables y confiables.
• Para la aguas residuales analizadas el error estándar oscila entre 1- 2.5% para la dilución
(1/100mL).
• Se puede observar que para muestras con gran dilución (1/500mL), el error estándar oscila
entre 5 y 12% y al aumentar el factor de dilución (1/1000mL) el error aumenta su magnitud
en un intervalo de 10 - 30%.
De lo anterior se establece que los métodos son analíticamente comparables; esto se aprecia al
aplicarlos sobre soluciones estándar. Para las diferentes aguas residuales, se observa que, a
concentraciones adecuadas, los métodos presentan una variación aceptable, por lo que es
fundamental tomar en cuenta este parámetro a la hora de aplicar los métodos, de acuerdo con el
tipo de agua residual a tratar.
III.3 RESIDUOS GENERADOS POR LOS MÉTODOS EN ESTUDIO PARA
LA DETERMINACIÓN DE DQO
Las Tablas III.5 y III.6 presentan la cantidad de residuos que son generados durante la aplicación
de los métodos estándar de reflujo abierto y el método rápido colorimétrico de reflujo cerrado por
prueba unitaria en la determinación de la demanda química de oxígeno.
Tabla III.5. Generación de residuos por el método estándar de reflujo abierto en la
determinación de la demanda química de oxígeno por muestra unitaria
MUESTRA Y REACTIVOS
Muestra
H2SO4
K2Cr2O7
H2O
SFA
Cantidad total de residuos
RESIDUOS GENERADOS
10 mL
15 mL
5 mL
40 mL
7 mL
77 mL
Tabla III.6. Generación de residuos por el método rápido colorimétrico de reflujo cerrado
para la determinación de la demanda química de oxígeno por muestra unitaria
MUESTRA Y REACTIVOS
Muestra
H2SO4
Sol. de digestión
Cantidad total de residuos
RESIDUOS GENERADOS
2 mL
3 mL
1 mL
6 mL
63
La aplicación del método alternativo frente al método estándar tradicional para la determinación
de la DQO permite una reducción del volumen de residuos generados del 92% (Tabla III.7), lo
que se reflejó en un ahorro del 84% de costos en los reactivos utilizados.
Tabla III.7. Porcentaje de reducción en generación de residuos peligrosos por el
método rápido colorimétrico frente al método estándar de reflujo abierto
Método estándar
De reflujo abierto
Método colorimétrico
% de reducción
de residuos
generados
77 mL
6 mL
92
III.3.1 ANÁLISIS DEL RESIDUO
El residuo generado después de realizada la demanda química de oxígeno (DQO) por el método
tradicional, correspondiente a varias tesis de licenciatura y posgrado realizadas en los
laboratorios, se fue almacenando en tanques de polietileno de alta densidad de 200L, llegando a
tener 4 tanques totalmente llenos.
III.3.1.1 Toma de muestra
Para realizar la toma de la muestra, fue necesario emplear equipo de protección (bata de algodón,
“goggles” y guantes de látex), debido a que el residuo es sumamente ácido y una gota de éste al
entrar en contacto con la piel produciría una quemadura de primer grado. La toma de la muestra
fue realizada por medio de una pipeta volumétrica de 20mL, una propipeta y se tomó una muestra
de 100mL de cada uno de los 4 tanques. La muestra fue colocada en frascos de vidrio.
III.3.1.2 Caracterización del residuo
Para poder plantear un proceso o tratamiento de los residuos, es necesario conocer las
características de éste, por lo que se hicieron algunas determinaciones que se consideraron eran
las más importantes y que se muestran en la Tabla III.8.
Tabla III.8. Algunas características del residuo estudiado
PARÁMETROS
ESTADO FÍSICO
COLOR
TEMPERATURA (ºC)
Valor de pH (unidades)
1
Líquido
Verde
20
<1
64
TANQUE
2
Líquido
Verde
20
<1
3
Líquido
Verde
20
<1
4
Líquido
Verde
20
<1
CONDUCTIVIDAD (mV)
SÓLIDOS TOTALES (mg/L)
SÓLIDOS TOTALES VOLÁTILES (mg/L)
SÓLIDOS TOTALES FIJOS (mg/L)
414.7
395,560
389,040
6,520
420.7
390,520
383,800
6,720
411.4
316,500
310,480
6,020
417.9
392,580
385,300
7,280
De los parámetros determinados anteriormente y que se consideraron como los más importantes,
cabe destacar aquéllos que corresponden a su estado físico y pH, que marcan la pauta para
empezar a plantear un proceso específico. A continuación se da una explicación de por qué
fueron importantes.
Estado físico
Al tener un residuo en estado líquido en los 4 tanques, los metales (plata, mercurio y cromo)
deben estabilizarse por formación de precipitados o complejos separables físicamente de la
solución acuosa.
Valor de pH
Conociendo el valor de pH del residuo puede saberse en qué estado de oxidación se encuentran
los metales; por ejemplo: El catión Cr3+ en solución acuosa sólo puede existir en un medio ácido,
debido a que forma acuocomplejos simples o mixtos con los aniones existentes en la disolución y
en un medio básico no podría existir en solución acuosa, debido a que reaccionaría con los iones
OH• y formaría un precipitado muy estable como lo es el hidróxido de cromo Cr(OH)3.
III.3.2 ANÁLISIS CUALITATIVO
Mediante este análisis, lo más importante es saber si, efectivamente, se tienen en los
contenedores iones de plata, mercurio y cromo, independientemente de la concentración y del
número de oxidación del metal, ya que para saber esto, posteriormente se realiza un análisis
cuantitativo (inciso III.1.4). Para cada uno de los metales se realiza un análisis cualitativo.
Plata
Una de las reacciones más específicas para la plata, es la que se lleva a cabo con los cloruros,
debido a que forma un precipitado muy estable (Burriel, 1989):
2Ag+ + 2Cl- ---------------------> 2AgCl ↓(precipitado blanco)
(III-4)
A una muestra de 10mL, proveniente de uno de los tanques, se le agregan 2mL de ácido
clorhídrico HCl 2N, obteniéndose inmediatamente un precipitado blanco:
RESIDUO LÍQUIDO (proveniente de la DQO) + HCl --------> precipitado blanco
(III-5)
Para comprobar que efectivamente el precipitado obtenido es AgCl ↓ se procede de la manera
siguiente:
65
Al precipitado obtenido se le separa del residuo líquido por medio de una centrifugación; a este
precipitado se le agregan 2mL de hidróxido de amonio NH4OH, 2N, disolviéndose totalmente el
precipitado y obteniéndose una disolución totalmente translúcida. Esto se debe a que la plata
forma un complejo con el NH4OH y al formarse el complejo Ag(NH3)2+ la plata forma una
disolución:
Ag+ + 2NH3OH- --------------------------> Ag(NH3)2+ + 2OH-
(III-6)
Posteriormente, para romper este complejo y reprecipitar a la plata como cloruro de plata AgCl↓,
a la disolución se le agrega 1mL de ácido nítrico concentrado, HNO3, volviéndose a obtener un
precipitado blanco que indica la presencia indiscutible de plata:
Ag(NH3)2+ + Cl- + 2H+ --------------------------> AgCl ↓ + 2NH4+
(III-7)
Mercurio
Una de las reacciones más específicas para la determinación del catión Hg22+ es la formación de
cloruros y se lleva a cabo con ácido clorhídrico diluido HCl, debido a que se forma un
precipitado blanco denso (calomelanos) (Burriel, 1989):
Hg22+ + 2Cl- ---------------------------> Hg2Cl2 ↓
(III-7)
A una muestra de 10mL proveniente de uno de los tanques se le agregan 2mL de HCl 2N,
obteniéndose un precipitado blanco denso:
RESIDUO LÍQUIDO (proveniente de la DQO) + HCl -----> precipitado blanco
(III-8)
Como los cloruros también son reactivos específicos para la plata, se comprobó la existencia del
Hg2Cl2 ↓ de la siguiente manera:
Se separó por centrifugación el precipitado obtenido y se agregaron 2mL de hidróxido de amonio
NH4OH 2N produciéndose una “dismutación” y apareciendo mercurio metálico y sal amido
mercúrica blanca. El color resultante es prácticamente negro (identificación de cloruro
mercurioso Hg2Cl2 ↓):
Hg2Cl2 ↓ + 2NH3 ---------------------> Hg + HgCl(NH2) ↓ + NH4+ + Cl-+
(III-9)
A diferencia del cloruro de plata AgCl↓ que al agregarle el hidróxido de amonio NH4OH 2N el
precipitado se disuelve y, al agregarle el hidróxido de amonio, NH4OH 2N, el cloruro mercurioso
Hg2Cl2 forma un precipitado negro.
Cromo
Los iones cromatos CrO42- precipitan como sales coloreadas con muchos cationes. Para fines de
identificación se utiliza nitrato de plata AgNO3 debido a que al reaccionar con los iones cromato
produce un precipitado rojo de cromato de plata, Ag2CrO4:
H2CrO4 + 2AgNO3 ---------------------> Ag2CrO4 ↓ (rojo) + 2HNO3+
66
(III-10)
RESIDUO LÍQUIDO (proveniente de la DQO) +AgNO3 --------> precipitado rojo+ (III11)
A una muestra de 10mL de uno de los tanques se le agregaron 2mL de AgNO3, obteniéndose un
precipitado rojo, que indica la presencia de cromo.
III.3.3 ANÁLISIS CUANTITATIVO
III.3.3.1 Determinación de la concentración total para cada metal
Mediante este análisis y una vez comprobada la existencia de plata, mercurio y cromo (ver inciso
III.1.3), el paso siguiente para plantear un proceso o sistema de tratamiento para los residuos
generados después de realizar la determinación de DQO, es determinar la concentración exacta
de cada uno de los metales.
Para realizar esta determinación, es necesario trabajar en un equipo de espectrofotometría de
absorción atómica (ver condiciones de operación y trabajo en el Anexo D).
III.3.3.2. Determinación de la concentración para cada uno de los metales en su respectivo
estado de oxidación
Para realizar un proceso adecuado para el tratamiento del residuo es necesario saber el estado de
oxidación en que se encuentran cada uno de los metales, ya que con base en este conocimiento se
puede instrumentar un método de separación adecuado (p. ej., reacciones de precipitación con
algún reactivo específico). También, el hecho de conocer la concentración de cada uno de ellos es
importante, para saber evaluar la eficiencia de eliminación y/o separación de cada metal. Como
ya se mencionó anteriormente, el equipo de absorción atómica solamente indica la concentración
del metal, sin tomar en cuenta el estado de oxidación. Para subsanar esto, se empleó un método
indirecto para determinar la concentración de cada uno de los metales en su respectivo estado de
oxidación. A continuación se describe este método.
67
Plata
La plata en solución acuosa y en un medio ácido solamente puede estar presente como Ag+, por
lo que para este metal no es necesario ningún método específico.
Mercurio
El mercurio en solución acuosa y un medio ácido puede existir como catión mercurioso Hg22+
(número de oxidación 1+) y catión mercúrico Hg2+ (número de oxidación 2+). Para determinar la
concentración de cada uno de los estados de oxidación se hace lo siguiente:
1. Se toma una muestra y se lee la concentración total del metal en el equipo de absorción
atómica (Hg total)
Hg total = Hg22+ + Hg2+ ................... (III-12)
9 = ? + ?
2. Se agrega un agente precipitante para el catión mercurioso Hg22+, que en este caso fue ácido
clorhídrico HCl 2N. La reacción que se lleva a cabo es la siguiente:
Hg22+ + 2Cl- --------------------------------> Hg2Cl2 ↓
(III-13)
3. Se separa el precipitado de cloruro mercurioso Hg2Cl2 ↓ por centrifugación o por filtración
4. Se repite la medición de la muestra en el equipo de absorción atómica ya que, habiendo
eliminado el catión mercurioso Hg22+, debido a que se separó en el paso anterior (Hg2Cl2 ↓),
solamente se está determinando el catión mercúrico Hg2+, que no precipita con el HCl:
Hg22+ = Hgtotal - Hg2+
? = 9 - 9
(III-14)
5. Sabiendo la concentración de Hgtotal y de Hg2+, por diferencia se obtiene la concentración del
Hg22+
6. De esta forma se obtienen las concentraciones para el catión mercurioso Hg22+ y el catión
mercúrico Hg2+.
Cromo
El cromo en solución acuosa y en un medio ácido puede existir como Cr3+ y Cr6+. Para conocer la
concentración en cada uno de los estados de oxidación se hizo lo siguiente:
1. Se toma una muestra y se lee la concentración total del metal en el equipo de absorción
atómica (Cr total)
Cr total = Cr3+ + + Cr6+ .................... (III-15)
9 = ? + ?
68
2. Se agrega un agente precipitante para el Cr3+ que, en este caso, es hidróxido de sodio, NaOH
8N. La reacción que se lleva a cabo es la siguiente:
Cr3+ + 3OH- ----------------------------> Cr(OH)3 ↓
(III-16)
3. Se separa el precipitado de hidróxido de cromo Cr(OH)3 ↓ por centrifugación o por filtración
4. Se vuelve a leer la muestra en el equipo de absorción atómica pero sabiendo que ésta ya no
contiene el Cr3+, debido a que se separó en el paso anterior(Cr(OH)3 ↓), solamente se
determina el Cr6+ , ya que éste no precipita con el hidróxido de sodio (NaOH)
5. Por diferencia se obtiene la concentración de Cr3+ , ya que se conoce la concentración para
Crtotal y para Cr6+
Cr3+ = Crtotal - Cr6+.................... (III-17)
? = 9 - 9
6. De esta forma se obtienen las concentraciones para Cr3+ y Cr6+ en sus respectivos estados de
oxidación.
III.4 PROCESO FÍSICO-QUÍMICO DE ELIMINACIÓN DE METALES
Una vez conocidas las características físicas y químicas y la concentración de los metales en su
respectivo estado de oxidación, se procede a plantear un proceso para separar selectivamente los
metales del residuo. Se buscaron en la literatura reactivos específicos para cada metal que
tuvieran la característica de que al reaccionar formaran precipitados poco solubles en agua y que
fueran de bajo costo.
El proceso consiste en tres etapas, cada una de las cuales tiene reacciones específicas para cada
uno de los metales en su respectivo estado de oxidación.
Partiendo del análisis cuantitativo realizado con anterioridad, se tienen los siguientes metales:
Ag+, Hg22+ , Hg2+ , Cr3+ , Cr6+
1. Se adiciona ácido clorhídrico HCl, precipitando el catión Ag+ como cloruro de plata AgCl y el
catión mercurioso Hg22+ como cloruro mercurioso Hg2Cl2.
2. Se adiciona sulfato ferroso amoniacal Fe(NH4)2 (SO4)2 , para reducir el Cr6+ a Cr3+.
3. Se adiciona hidróxido de sodio NaOH para precipitar el catión mercúrico Hg2+ como óxido
mercúrico HgO y el catión Cr3+ como hidróxido de cromo Cr(OH)3.
En este proceso se emplean las operaciones de precipitación, óxido-reducción, centrifugación y
neutralización.
A continuación en la Figura III.1 se ejemplifican estas tres etapas.
69
Figura III.1 Diagrama de bloques de los procesos empleados
ADICION DE
Fe(NH4)2(SO4)2
ADICIÓN DE HCL
RESIDUO LÍQUIDO
PELIGROSO
(Ag+, Hg22+ , Hg2+ , Cr3+ , Cr6+)
ETAPA
1
CENTRIFUGACIÓN
RESIDUO
LIQUIDIO
ADICION DE
NaOH
ETAPA
2
ETAPA
3
CENTRIFUGACIÓN
SECADO
RESIDUO
SÓLIDO
(AgCl, Hg2Cl2)
RESIDUO
SÓLIDO
(HgO, Cr(OH)3)
70
NEUTRALIZACIÓN
RESIDUO
LÍQUIDO DIN
METALES
III.4.1 EQUIPO
Para realizar el proceso físico-químico de eliminación de los metales se utilizan únicamente los
siguientes equipos:
1)Potenciómetro marca ORION modelo 720A
2)Centrífuga para 6000 RPM: marca HERAEUS
III.4.2 MATERIAL
El material empleado para realizar el proceso físico-químico de eliminación de metales es el
siguiente:
•Agitador de vidrio
•Bata de algodón
•Cubeta de plástico de 10L
•Embudo de plástico
•Espátula
•Guantes de asbesto
•Guantes de látex
•Lentes (goggles)
•Matraz aforado de 100mL
•Matraz aforado de 1L
•Pipeta graduada de 10mL
•Piseta
•Propipeta
•Vaso de precipitado de vidrio de 250mL
•Vaso de precipitado de vidrio de 500mL
•Vaso de precipitado de vidrio de 1L
•Vaso de precipitado de plástico de 4L
III.4.3 REACTIVOS
Los reactivos necesarios para realizar el proceso físico-químico de eliminación son los
siguientes:
•Ácido clorhídrico 2N
•Ácido sulfúrico concentrado (grado industrial)
•Hidróxido de sodio 8N (grado industrial)
•Sulfato ferroso amoniacal (grado industrial)
La preparación de los reactivos se encuentra descrita en el Anexo E.
71
III.4.4 METODOLOGÍA
Se trataron 20L de residuo diariamente con la metodología que a continuación se describe.
1) Se utiliza equipo de protección (bata de algodón, guantes de látex y lentes de protección).
2) Se toman 4L de residuo de cualquier tanque, por medio de una bomba manual de polietileno,
con una extensión de una manguera del mismo material y éste se vierte a una cubeta de
polietileno de 10L.
3) El paso anterior se realiza 5 veces.
4) Se agregan 60mL de ácido clorhídrico HCl 2N (bajo campana de extracción) a cada una de
las 5 cubetas.
5) Se agita durante 1 minuto cada cubeta por medio de un agitador de vidrio (bajo campana de
extracción).
6) En este paso se obtiene un residuo líquido y un residuo sólido, por lo que es necesario
centrifugar el residuo a 3500 rpm, a -10ºC, durante 5 minutos.
7) El residuo líquido se coloca en una cubeta de plástico de 10L.
8) El residuo sólido se coloca en un envase de plástico exclusivo para esto.
9) Al residuo líquido obtenido en el paso 7 se le agregan 100g de sulfato ferroso amoniacal
Fe(NH4)2(SO4)2 (FAS) grado industrial a cada cubeta y se agita durante 5 minutos por
medio de un agitador de vidrio (emplear campana de extracción) .
10) Se agrega hidróxido de sodio NaOH 8N, hasta alcanzar un valor de pH = 9 (emplear
campana de extracción)
Nota 1: Para realizar el paso (10) adecuadamente deben hacerse previamente las siguientes
actividades:
A) Agregar a cada cubeta 2L de hidróxido de sodio NaOH 8N lentamente debido a
que la reacción es muy exotérmica, emplear campana de extracción
B) Dejar enfriar durante 2 horas aproximadamente en la campana ó el tiempo necesario
para que alcance una temperatura de 25ºC
C) Llevar, una vez frío, al potenciómetro para medir el pH y agregar el hidróxido de
sodio NaOH 8N necesario para llegar al valor de pH=9.5
D) Si por alguna razón el pH es mayor de 9.5, agregar ácido sulfúrico concentrado
H2SO4 hasta obtener el pH deseado
E) Durante las adiciones de hidróxido de sodio ó de ácido sulfúrico, se debe agitar
constantemente el fluido mediante un agitador de vidrio.
11) Una vez que el residuo tiene el pH deseado, se centrifuga inmediatamente debido a que si se
deja por mucho tiempo el residuo cristaliza. La centrifugación se lleva a cabo a 3500 rpm, a
-10ºC, durante 8 minutos.
12) El residuo líquido se coloca en una cubeta de 10L y se le agrega ácido sulfúrico
concentrado H2SO4 hasta un valor de pH=7 (Se necesitan aproximadamente 10mL).
13) En una charola de metal se pone un plástico grueso a la medida de ésta y se coloca el residuo
sólido.
14) En una parrilla de calentamiento a 75ºC se coloca la charola con el residuo durante 24 horas
para que éste se seque.
15) Una vez seco el residuo, se coloca en un recipiente exclusivo etiquetado y fechado.
72
III.4.5 DESCRIPCIÓN QUÍMICA DEL PROCESO
Partiendo del análisis realizado se encontraron los siguientes metales en el estado de oxidación
siguiente:
Ag+, Hg22+ , Hg2+ , Cr3+ , Cr6+
Con base en ello se siguieron los pasos que, a continuación, se describen:
1. Al residuo líquido se le agrega ácido clorhídrico HCl 2N para que precipite Ag+ y Hg22+
2Ag+ + 2Cl- ......................> 2AgCl ↓
Hg22+ + 2Cl- .....................> Hg2CL2↓
pks = 9.7
pks = 17.9
2. El paso siguiente es el de agregar sulfato ferroso amoniacal Fe(NH4)2(SO4)2 . 6H2O debido a
que es un agente reductor muy fuerte y, por lo tanto, sirve para reducir el Cr6+ a Cr3+.
Los potenciales de óxido-reducción se ejemplifican en el siguiente esquema:
Fe (III)
0.771
Fe (II)
Cr (VI)
1.330
E (V)
Cr (III)
La reacción de óxido-reducción que lo representa es la siguiente:
3Fe2+<.............................>3Fe3+ + 3eCr6+ + 3e-<..............................>Cr3+
........................................................................................
3Fe2+ + Cr6+<..............................>3Fe3+ + Cr3+
3. Una vez que el Cr(VI) se reduce a Cr(III), se le agrega hidróxido de sodio NaOH 8N para que
precipite como hidróxido de cromo Cr(OH)3 y, además, también precipite el catión mercúrico
Hg2+ como óxido mercúrico HgO. La reacción que representa este paso es la siguiente:
Cr3+ + 3OH-.........................> Cr(OH)3↓ pks = 30.2
Hg2+ + 2OH-.........................> HgO↓ + H2O pks = 25.6
La Figura III.2 ejemplifica este proceso.
En el siguiente capítulo se presentan los resultados de los análisis realizados, así como la
discusión de los mismos.
73
RESIDUO LÍQUIDO (A)
Ag+ , Hg22+ , Hg2+ , Cr3+ , Cr6+
2AgCl ↓
2Ag+ + 2ClADICIÓN DE HCl 2N
Hg2Cl2 ↓
Hg22+ + 2Cl-
RESIDUO SÓLIDO (B)
RESIDUO LÍQUIDO (C)
Hg2+ , Cr3+ , Cr6+
AgCl , Hg2Cl2
ADICIÓN DE Fe(NH4)2(SO4)2 .6H2O
PARA REDUCIR EL Cr6+ A Cr3+
RESIDUO LÍQUIDO (D)
Hg2+ , Cr3+
ADICIÓN DE NaOH 8N
RESIDUO SÓLIDO(E)
Hg2+ + 2OH- → HgO ↓ + H2O
Cr3+ + 3OH- → Cr(OH)3 ↓
RESIDUO LÍQUIDO (F)
HgO, Cr(OH)3
SIN METALES
Figura III.2. Ejemplificación del proceso propuesto para estabilizar los residuos de la DQO
74
CAPÍTULO IV
ANÁLISIS DE RESULTADOS Y DISCUSIÓN
IV.1 EVALUACIÓN DE LAS METODOLOGÍAS PARA DETERMINAR LA
DQO
IV.1.1 RESULTADOS OBTENIDOS CON LAS DOS METODOLOGÍAS EVALUADAS
PARA CADA UNA DE LAS AGUAS RESIDUALES ESTUDIADAS
Los diferentes tipos de aguas agroindustriales analizadas, como se menciona en el capítulo III,
fueron vinazas, nejayote y agua del proceso de obtención de colorante a partir del cempasúchil; a
cada una de ellas se le determinó (por triplicado) el valor de DQOs empleando los métodos en
estudio (estándar y colorimétrico).
En el Anexo B se muestran los datos tabulados (Tabla B.1- B.22) de los valores de DQOs
obtenidos de cada tipo de agua agroindustrial a diferentes diluciones, así como de las soluciones
estándar utilizadas como referencia, para los dos métodos en estudio. Además, se incluyen los
valores obtenidos al aplicar las medidas de dispersión estadística, a saber, media aritmética,
desviación estándar y coeficiente de variación.
De estos datos puede observarse lo siguiente:
1) En general, tomando como parámetro de comparación estadística la desviación estándar (σ)
•
La dispersión de los datos oscila entre 2 y 7 unidades de las variables originales de la
población, para las diluciones utilizadas (1/100, 1/500, 1/1000mL), así como para las
soluciones estándar de las concentraciones indicadas para ambos métodos.
2) Si se toma como parámetro de comparación al coeficiente de variación (C.V.) se observa lo
siguiente:
•
La dispersión de los datos para las soluciones estándar, así como para la dilución de
1/100mL de las aguas analizadas se encuentra en el intervalo de 0.2 a 1 %, en ambos
métodos.
75
•
Para la dilución de 1/500mL, existe una dispersión con un intervalo entre 1 a 6%. Este
porcentaje de dispersión se incrementa al aumentar el factor de dilución de 1/1000mL
a un intervalo de 5-20% para ambos métodos.
De los puntos 1 y 2, debe decirse que se considera al C.V., como un mejor criterio estadístico
para establecer la dispersión de los datos, dado que el coeficiente de variación expresa el
resultado en forma porcentual, es decir en términos relativos y no absolutos.
La representación gráfica para la comparación de los valores promedio generados por los
métodos en estudio de las soluciones estándar y las aguas agroindustriales analizadas se
presentan en las Gráficas B.1- B.5 del Anexo B. Un esquema estadístico general de los resultados
promedio de las réplicas se muestra en las Tablas C.1 a C.4 (Anexo C).
Con la finalidad de establecer una mejor representación y/o comprensión de los resultados
obtenidos, se decidió realizar la prueba conocida como intervalo de confianza a cada método, la
cual permite estimar un intervalo dentro del cual casi con seguridad esté el verdadero parámetro.
Los resultados obtenidos al aplicar esta herramienta estadística se muestran en las Tablas C.5 y
C.6 (Anexo C).
IV.1.2 ANÁLISIS DE COSTOS EN MATERIA DE REACTIVOS UTILIZADOS EN LAS
DETERMINACIONES DE LA DQO
La Tabla IV.1 presenta una cotización de los reactivos utilizados en la determinación de la
demanda química de oxígeno. En ella se especifica la presentación en que se encuentra en el
mercado cada uno de ellos, así como también se indica el costo por unidad.
Tabla IV.1. Costo de reactivos utilizados en la determinación de la DQO
REACTIVOS
PRESENTACIÓN
K2Cr2O7
COSTO (M.N.)
Fco. 500 g
$613.00
Hg2SO4
Fco. 125 g
$2,458.00
Fe(NH4)2(SO4)2.6H2O
Fco. 500 g
$520.00
Ag2SO4
Fco. 100 g
$1,437.00
C8H5K04
1-10 Fenantrolina
FeSO4.7H2O
Fco. 250 g
$1,204.05
Fco. 10 g
Fco. 500 g
$316.00
$136.00
H2SO4
Fco. 2.5 L
$205.00
Agua destilada
Fco: 19 L
$104.00
Con base en la cotización anteriormente mencionada, se efectuó un análisis de costos en los
reactivos que se utilizan en la determinación de la demanda química de oxígeno para ambos
métodos en estudio (estándar y colorimétrico). Se evaluaron los costos de las soluciones
preparadas también para los dos métodos. La Tabla IV.2 presenta el costo de las soluciones
76
preparadas para el método estándar, así como también la cantidad de cada reactivo utilizado para
la preparación de las soluciones. Paralelamente, se efectuó el cálculo del costo por prueba
unitaria para este método (Tabla IV.3).
Tabla IV.2. Costo de reactivos preparados utilizados en la determinación de la demanda
química de oxígeno por el método estándar
REACTIVO
CANTIDAD
H2SO4
1000 mL
$82.00
Ag2SO4
10.12 g
$145.42
Litro de ácido sulfúrico con plata
COSTO
$ 227.42
K2Cr2O7
12.25 g
$15.00
H20 (destilada)
1000 Ml
$5.47
Litro de dicromato de potasio 0.25N
$20.47
Fe(NH4)2(SO4)2.6H20
39.2 g
$40.77
H2SO4
20 mL
$1.64
H2O (destilada)
980 mL
$5.36
Litro de sulfato ferroso amoniacal 0.1N
$47.77
1-10 Fenantrolina
0.3712 g
$11.73
FeSO4.7H2O
0.1737 g
$0.047
H2O (destilada)
25 mL
$0.137
25 mL de indicador de ferroína
$11.91
77
Tabla IV.3. Costo de reactivos utilizados por prueba unitaria en la determinación de la
demanda química de oxígeno por el método estándar
REACTIVOS
CANTIDAD
COSTO
H2SO4
15 mL
$1.23
K2Cr2O7
5 mL
$0.10
HgSO4
0.2 g
$3.93
Fe(NH4)2(SO4)2.6H20
7 mL
$0.33
Ferroína
0.1 mL
$0.048
40 mL
$0.22
H20 (destilada)
Costo por prueba unitaria
$5.86
Como se mencionó anteriormente, se realizó la evaluación de los costos de las soluciones
preparadas y de las cantidades de reactivos utilizados en cada una de ellas. En las siguientes
tablas (IV.4 y IV.5) se presenta el costo de cada una de las soluciones utilizadas por el método
alternativo (colorimétrico) y el costo por prueba unitaria para dicho método, respectivamente.
Tabla IV.4. Costo de reactivos preparados utilizados en la determinación de la demanda
química de oxígeno por el método colorimétrico
REACTIVOS
CANTIDAD
COSTO
K2Cr2O7
10.216 g
$12.53
H2SO4
167 mL
$13.69
33.3 g
$655
833 mL
$4.75
HgSO4
H2O (destilada)
Litro de solución de digestión 0.21N
$685.97
H2SO4
1000 mL
$ 82.00
Ag2SO4
10.12 g
$145.43
Litro de ácido sulfúrico con plata
$227.43
78
Tabla IV.5. Costo de reactivos utilizados por prueba unitaria en la determinación de la
demanda química de oxígeno por el método colorimétrico
REACTIVOS
CANTIDAD
Sol. de digestión
1 mL
$0.70
H2S04
3 mL
$0.25
Costo por prueba unitaria
COSTO
$0.95
Finalmente se realizó una comparación de costos en cuanto al empleo de los reactivos utilizados
por cada uno de los métodos (Tabla IV.6).
Esta comparación se realizó por prueba unitaria en cada método, donde se puede apreciar que el
método propuesto como una alternativa para la reducción de residuos contaminantes peligrosos
generados para la determinación de DQO, permite un considerable ahorro económico en cuanto
al empleo de reactivos (del 84%).
Tabla IV.6. Comparación de costos por prueba unitaria en la determinación de DQO por
los métodos utilizados
Método
estándar
Método
colorimétrico
% de disminución
de costos
$5.86
$0.95
83.8
IV.2 EVALUACIÓN DEL SISTEMA PROPUESTO PARA LA ESTABILIZACIÓN DE
LOS RESIDUOS DE LA DQO
IV.2.1 ANÁLISIS CUALITATIVO
Los resultados del análisis cualitativo realizado en los residuos generados por la determinación
de la demanda química de oxígeno, según la problemática presentada en el capítulo III, se
presentan en la Tabla IV.7.
En esta tabla se puede observar que en los cuatro tanques existía plata, mercurio y cromo.
79
Tabla IV.7 Resultados del análisis cualitativo para cada uno de los tanques
TANQUE
PLATA
MERCURIO
CROMO
1
9
9
9
2
9
9
9
3
9
9
9
4
9
9
9
9= Significa que metal se encuentra presente en cada tanque
1V.2.2 ANÁLISIS DEL RESIDUO ANTES Y DESPUÉS DE APLICAR EL PROCESO
FÍSICO-QUÍMICO PROPUESTO
Este análisis se realizó para saber la concentración promedio de metales antes y después del
proceso de eliminación propuesto.
IV.2.2.1 Concentración inicial y final de los contaminantes (resultados cuantitativos)
En las Tablas IV.8 a la IV.11 se puede observar que la concentración inicial de los metales
variaba en cada uno de los tanques; sin embargo, después de aplicar el proceso de eliminación de
metales en los cuatro tanques los resultados de la concentración final para cada metal fueron
todos muy semejantes; es decir, no se presentó una diferencia significativa en el contenido de
metales del residuo tratado de cada tanque.
Esto significa que el proceso físico-químico de eliminación de metales propuesto puede ser usado
para cualquier tipo de residuo que contenga estos metales, sin importar la concentración inicial
de éstos.
Tabla IV.8 Concentraciones inicial y final para el tanque 1
CONCENTRACIÓN
Ag+
INICIAL(ppm)
1000
FINAL(ppm)
0.9
2+
Hg2+
Cr3+
Cr6+
515
53
259
0.71
0.1
16.2
0.01
0.03
Hg2
80
Tabla IV.9 Concentraciones inicial y final para el tanque 2
CONCENTRACIÓN
Ag+
Hg22+
Hg2+
Cr3+
Cr6+
INICIAL(ppm)
2
174
173
352
416
FINAL(ppm)
0.9
0.1
28.2
0.01
0.05
Tabla IV.10 Concentraciones inicial y final para el tanque 3
CONCENTRACIÓN
Ag+
INICIAL(ppm)
600
FINAL(ppm)
1.5
2+
Hg2+
Cr3+
Cr6+
256
228.9
453
39
0.1
27.1
0.01
0.07
Hg2
Tabla IV.11 Concentraciones inicial y final para el tanque 4
CONCENTRACIÓN
Ag+
Hg22+
Hg2+
Cr3+
Cr6+
INICIAL(ppm)
2
171
479
575
1
FINAL(ppm)
0.7
0.1
29.2
0.01
0.05
IV.2.2.2 Por ciento de eliminación de metales
Con base en los resultados obtenidos en las tablas presentadas en el inciso anterior se puede
calcular el por ciento de eliminación de los metales mediante la siguiente fórmula:
% DE ELIMINACIÓN
=
-
Concentración inicial Concentración final
Concentración inicial
x100
Las Tablas IV.12 a la IV.15 muestran el % de eliminación de los metales para cada uno de los
tanques. En estas tablas se puede observar que se tienen porcentajes de eliminación por arriba del
90% para casi todos los metales, por lo que el proceso de eliminación puede ser considerado
como adecuado.
81
Los valores de eliminación más bajos que se tienen son para la plata Ag+ en el tanque 2 y en el
tanque 4. Sin embargo, esto no indica que el proceso no sea el adecuado ,ya que en todos los
casos la concentración final es menor que la exigida por la norma correspondiente.
Tabla IV.12 Por ciento de eliminación para el tanque 1
METAL
Ag
% DE ELIMINACIÓN
99.91
+
Hg22+
99.98
Hg2+
69.43
3+
99.99
Cr6+
95.77
Cr
Tabla IV.13 Por ciento de eliminación para el tanque 2
METAL
Ag
% DE ELIMINACIÓN
55
+
Hg22+
99.94
Hg2+
83.69
Cr3+
99.99
6+
99.98
Cr
Tabla IV.14 Por ciento de eliminación para el tanque 3
METAL
Ag
% DE ELIMINACIÓN
99.75
+
Hg22+
99.96
Hg2+
88.16
Cr3+
99.99
6+
99.82
Cr
82
Tabla IV.15 Por ciento de eliminación para el tanque 4
METAL
Ag
% DE ELIMINACIÓN
65
+
Hg22+
99.94
Hg2+
93.90
Cr3+
99.99
Cr6+
95
Los valores encontrados y el por ciento de eliminación obtenido es de gran importancia ya de
estos valores depende que se cumplan con los limites máximos permisibles establecidos en la
normatividad ambiental vigente en materia de residuos peligrosos y de aguas residuales.
Dada la importancia que la legislación ambiental tiene hoy en día a nivel mundial, se considera
necesario mencionar a continuación el estado del arte de este tema en relación al trabajo expuesto
en este libro.
IV.2.3 COMPARACIÓN CON LA NORMATIVIDAD MEXICANA PARA RESIDUOS
PELIGROSOS
En las Tablas IV.16 a la IV.19 se compara el resultado de concentración final en el residuo con
los valores que la norma oficial mexicana NOM-052-ECOL-1993 establece como límites
máximos permisibles para plata, mercurio y cromo.
Tabla IV.16 Concentración final del líquido residual contenido en el tanque 1 y su
comparación con lo indicado en la NOM-052-ECOL-1993
METALES
Ag+
Hg22+
CONCENTRACIÓN
LÍMITE MÁXIMO
COMPARACIÓN DE LA
FINAL DEL RESIDUO PERMISIBLE (ppm)
CONCENTRACIÓN
(ppm)
NOM-052-ECOL-1993
FINAL VS. LÍMITE
MÁXIMO PERMISIBLE
NOM-052-ECOL-1993
0.9
5
√
0.1
0.2
√
Hg2+
16.2
0.2
X
Cr
3+
0.01
5
√
Cr
6+
0.03
5
√
√= Significa que cumple con los límites máximos permisibles establecidos por la norma oficial mexicana
NOM-052-ECOL-1993
X = Significa que no cumple con los límites máximos permisibles establecidos por la norma oficial mexicana
NOM-052-ECOL-1993
83
Tabla IV.17 Concentración final del líquido residual contenido en el tanque 2 y su
comparación con lo indicado en la NOM-052-ECOL-1993
METALES
Ag+
Hg22+
CONCENTRACIÓN
LÍMITE MÁXIMO
COMPARACIÓN DE LA
FINAL DEL RESIDUO PERMISIBLE (ppm)
CONCENTRACIÓN
(ppm)
NOM-052-ECOL-1993
FINAL VS. LÍMITE
MÁXIMO PERMISIBLE
NOM-052-ECOL-1993
0.9
5
√
0.1
0.2
√
Hg2+
28.2
0.2
X
Cr
3+
0.01
5
√
Cr
6+
0.05
5
√
√= Significa que cumple con los límites máximos permisibles establecidos por la norma oficial mexicana
NOM-052-ECOL-1993
X = Significa que no cumple con los límites máximos permisibles establecidos por la norma oficial mexicana
NOM-052-ECOL-1993
Tabla IV.18 Concentración final del líquido residual contenido en el tanque 3 y su
comparación con lo indicado en la NOM-052-ECOL-1993
METALES
Ag+
Hg2
2+
CONCENTRACIÓN
LÍMITE MÁXIMO
COMPARACIÓN DE LA
FINAL DEL RESIDUO PERMISIBLE (ppm)
CONCENTRACIÓN
(ppm)
NOM-052-ECOL-1993
FINAL VS. LÍMITE
MÁXIMO PERMISIBLE
NOM-052-ECOL-1993
1.5
5
√
0.1
0.2
√
Hg2+
27.1
0.2
X
Cr3+
0.01
5
√
Cr6+
0.07
5
√
√= Significa que cumple con los límites máximos permisibles establecidos por la norma oficial mexicana
NOM-052-ECOL-1993
X = Significa que no cumple con los límites máximos permisibles establecidos por la norma oficial mexicana
NOM-052-ECOL-1993
84
Tabla IV.19 Concentración final del líquido residual contenido en el tanque 4 y su
comparación con lo indicado en la NOM-052-ECOL-1993
METALES
Ag+
Hg22+
CONCENTRACIÓN
LÍMITE MÁXIMO
COMPARACIÓN DE LA
FINAL DEL RESIDUO PERMISIBLE (ppm)
CONCENTRACIÓN
(ppm)
NOM-052-ECOL-1993
FINAL VS. LÍMITE
MÁXIMO PERMISIBLE
NOM-052-ECOL-1993
0.7
5
√
0.1
0.2
√
Hg2+
29.2
0.2
X
Cr
3+
0.01
5
√
Cr
6+
0.05
5
√
√= Significa que cumple con los límites máximos permisibles establecidos por la norma oficial mexicana
NOM-052-ECOL-1993
X = Significa que no cumple con los límites máximos permisibles establecidos por la norma oficial mexicana
NOM-052-ECOL-1993
En las tablas anteriores se puede observar que en los cuatro tanques, los metales Ag+, Hg22+, Cr3+
y Cr6+ se encuentran dentro de los límites máximos permisibles establecidos por la norma oficial
mexicana NOM-052-ECOL-1993, por lo que el proceso físico-químico de eliminación de los
metales puede ser considerado como adecuado.
El catión mercúrico Hg2+ es el único de los metales que no cumple con la norma NOM-052ECOL-1993, debido a que en los cuatro tanques su valor al final sobrepasa los límites
establecidos por ésta.
Esto significa que debe buscarse otro método complementario que reduzca su concentración a 0.2
ppm que es el límite máximo permisible. Esta nueva separación se haría a partir del último
residuo líquido, F (Figura III.2).
IV.2.4 DISPOSICIÓN DE LOS RESIDUOS GENERADOS EN EL PROCESO FÍSICOQUÍMICO DE ELIMINACIÓN DE METALES
En la figura III.2 se puede observar que en el proceso físico-químico de eliminación de metales al
final se obtienen tres residuos, uno líquido, F y dos sólidos, B y E. El residuo líquido F que
contiene aún al Hg2+ (16.2 a 29.2 ppm) está siendo almacenado para seguir investigando una
metodología de separación que permita reducir su concentración final hasta 0.2 ppm, que es el
límite permitido por la normatividad mexicana.
El residuo sólido que contiene AgCl y Hg2Cl2, B, es colocado en un recipiente de polietileno,
para continuar con estudios de separación del AgCl y del Hg2Cl2, ya que estos productos por
separado tienen un valor comercial como reactivos grado industrial, dependiendo de la pureza
85
con la que se logren separar y recuperar. La cantidad total de AgCl y Hg2Cl2 que se obtiene por
tanque de 200L se muestra en la Tabla IV.20.
Tabla IV.20 Cantidad de AgCl y Hg2Cl2 obtenida en cada tanque
TANQUE
AgCl y Hg2Cl2 (g)
1
386.22
2
41.49
3
219.42
4
40.78
El segundo residuo sólido obtenido E que contiene Cr(OH)3 y HgO, es colocado en tanques de
200L y también es almacenado para continuar con el estudio de la separación del Cr(OH)3 y del
HgO para su uso en el laboratorio como reactivos grado industrial. La Tabla IV.21 muestra la
cantidad de Cr(OH)3 y HgO obtenidos:
Tabla IV.21 Cantidad de Cr(OH)3 y HgO obtenida en cada tanque
TANQUE
Cr(OH)3 y HgO (g)
1
114.32
2
341.59
3
239.6
4
331.88
En este punto es importante mencionar que los residuos sólidos obtenidos contienen a los metales
que se querían separar selectivamente, además de que al encontrarse en estado sólido los metales
están estabilizados y se les puede recuperar, separar o almacenar de una manera ambientalmente
adecuada, por lo que el proceso físico-químico de eliminación en este punto también puede
considerarse como satisfactorio.
IV.2.5 ANÁLISIS TÉCNICO-ECONÓMICO DEL PROCESO DE TRATAMIENTO
PROPUESTO
El proceso físico-químico propuesto, se llevó a cabo a nivel de laboratorio y se tenían disponible
infraestructura, reactivos, material y equipo, por lo que el aspecto técnico no fue un problema. La
viabilidad económica como tal no es posible obtenerla, debido a que para saber si un proceso es
económicamente viable, es necesario calcular una TASA INTERNA DE RETORNO (TIR) que
se obtiene de la siguiente forma:
TIR =
Ventas anuales brutas
Inversión fija de capital
Para este proceso es posible calcular la Inversión fija de capital, pero no es posible calcular las
Ventas anuales brutas, debido a que se tendría que tener un ingreso por concepto de
86
comercialización o que se utilizaran los residuos sólidos obtenidos. Sin embargo, para tener una
idea del costo de tratamiento del residuo, por medio de este proceso, se realizó una evaluación
preliminar.
Para obtener los costos del proceso se tomaron en cuenta únicamente los costos de material y
reactivos. No se consideró la adquisición de equipos, la mano de obra, los servicios, la
construcción de un local, etc., ya que éste es un primer acercamiento al problema.
El costo de reactivos y materiales para tratar cuatro tanques de 200L se encuentra desglosado en
las Tablas IV.22 y IV.23 (cotización realizada por El CRISOL S.A DE C.V. para materiales y por
DROGUERÍA COSMOPOLITA S.A. DE C.V. para reactivos).
Tabla IV.22 Costo de material
MATERIAL
Agitador
Bata
Cubeta
Embudo
Espátula
Guantes
Guantes
Lentes (“goggles”)
Matraz aforado
Matraz aforado
Pipeta graduada
Piseta
Propipeta
Vaso de precipitado
Vaso de precipitado
Vaso de precipitado
Vaso de precipitado
Total
ESPECIFICACIONES
Vidrio, altura:30cm,
Diámetro:0.5mm
Algodón 100%
Plástico, volumen:10L
Plástico, Diámetro:20cm
Mango de madera, Hoja:20cm
Asbesto
Látex
Plástico
100mL
1L
10mL
1L
Ninguna
Vidrio, 250mL
Vidrio, 500mL
Vidrio, 1L
Polipropileno, 4L
87
COSTO $ (POR UNIDAD)
9.00
180.00
7.00
105.00
25.00
80.00
15.00
112.00
142.00
224.00
35.00
51.00
72.00
23.00
32.00
58.00
231.00
1,401.00
Tabla IV.23 Costo de reactivos
REACTIVO
Ácido clorhídrico HCl
(concentrado)
Ácido sulfúrico H2SO4
(concentrado)
Hidróxido de sodio NaOH (lenteja,
grado industrial)
Sulfato ferroso amoniacal
Fe(NH4)2(SO4)2 (grado industrial)
CANTIDAD
2.5L
COSTO $
148.00
1L
85.00
150kg
2850.00
20kg
135.00
Total = $ 3218.00
Costo total = Costo de reactivos + Costo de material
Costo total = 3218.00 + 1401.00
Costo total = $ 4,619.00 M.N.
Para tratar 800L de residuo se tiene que hacer una inversión en reactivos y material de $ 4,619.00
Si el costo total se divide entre el volumen de residuo a tratar, se obtiene el costo de materiales
por litro de residuo a tratar:
Costo por litro de residuo
=
Costo total
Volumen total de residuo
Costo por litro de residuo
=
$ 4,619.00
800L
Por cada litro de residuo a tratarse se tendría un costo de $ 5.77 M.N., solamente por
materiales y reactivos.
NOTA: Podrían hacerse varias suposiciones para calcular una tasa interna de retorno, como las
de considerar el costo de su disposición controlada en Mina, Nuevo León (Bazúa-Durán,
1994). Sin embargo, se consideró que para el propósito de este trabajo no se justifica, ya
que el beneficio de realizarlo no está sustentado en datos específicos.
Con base en los resultados presentados en este capítulo, se dan las conclusiones y
recomendaciones de esta investigación en el último capítulo, que es el siguiente.
88
CAPÍTULO V
CONCLUSIONES Y RECOMENDACIONES
V.1. CONCLUSIONES
Con base en los resultados obtenidos y cumpliendo con el primer objetivo propuesto, el de
determinar si el método alternativo propuesto para la determinación de la DQO era equivalente al
método tradicional, se concluye que:
•
•
•
•
•
•
El método colorimétrico es aceptable, ya que para soluciones estándar no se presentan
diferencias estadísticamente significativas en la comparación de resultados por los
métodos estudiados.
De acuerdo con los diferentes niveles de significancia utilizados (α = 0.05, 0.01, 0.001),
se observa que los dos métodos analíticos en estudio son confiables a un nivel de
confianza del 95%, ya que la anchura del intervalo no presenta gran amplitud y el
porcentaje de variación a los demás niveles de significación es muy pequeño, para las
soluciones estándar y para la dilución de 1/100mL de las aguas analizadas. Sin embargo,
este intervalo se incrementa al aumentar el factor de dilución.
La reproducibilidad de los resultados para el método colorimétrico se logra mediante la
eliminación de las interferencias causadas por los sólidos en suspensión que se forman
después del proceso de digestión.
El control de la temperatura y el tiempo de digestión son parámetros fundamentales para
la estabilidad del complejo coloreado, pieza clave para la evaluación analítica de las
muestras de prueba.
La generación de residuos peligrosos se minimiza al disminuir el 92% de los residuos
generados por el método estándar, lo que a su vez repercute en una menor afectación al
ambiente.
Resulta ser sumamente económico, al disminuir el 84% de los costos en empleo de
reactivos.
Con base en los resultados obtenidos y cumpliendo con el segundo objetivo propuesto, el de
determinar si el método alternativo propuesto para la determinación de la DQO era equivalente al
método tradicional, se concluye que:
89
• El residuo generado después de realizar la prueba de DEMANDA QUÍMICA DE OXÍGENO
(DQO) contiene los siguientes metales: Ag+, Hg22+, Hg2+, Cr3+, Cr6+. La concentración de
estos metales sobrepasa los límites máximos permisibles, establecidos por la norma oficial
mexicana NOM-052-ECOL-1993, por lo que se considera como un residuo líquido peligroso.
• Aunque en la actualidad existen diferentes tratamientos, procesos o métodos para tratar un
residuo peligroso, el proceso físico-químico planteado es una alternativa viable de solución
para tratar los residuos generados en la prueba analítica de la DQO.
• En el proceso físico-químico de eliminación de metales, se obtuvieron eficiencias de
+
2+
3+
6+
eliminación adecuadas para Ag , Hg2 , Cr y Cr , cumpliendo con la normatividad vigente.
• El catión Hg2+ fue el único que no alcanzó la concentración establecida por la normatividad
mexicana. Sin embargo, los porcentajes de eliminación para este metal fueron, en promedio,
del 85% (con concentraciones iniciales entre 53 y 479 ppm que se redujeron a 16.2-29.2 ppm).
• El proceso físico-químico de eliminación tiene la ventaja de que maneja conceptos sencillos,
por lo que hace que este proceso sea relativamente fácil de entender y aplicar, pudiéndose usar
en algún otro laboratorio que genere un residuo igual o similar.
• El proceso físico-químico de eliminación de metales en solución propuesto puede ser usado en
.
cualquier residuo que contenga Ag+, Hg22+, Hg2+, Cr3+, Cr6+.
• Mediante el proceso físico-químico de eliminación de metales en solución se obtuvieron dos
2+
residuos sólidos, el primero que contenía Ag+, Hg2 y el segundo con Hg2+, Cr3+ y Cr6+. Los
residuos sólidos obtenidos son residuos estabilizados que están siendo almacenados, para
estudiar la recuperación de los metales y una vez separados puedan ser empleados como
reactivos grado industrial en algún otro laboratorio.
• El costo de reactivos y material es de $ 5.35/L de residuo tratado. Deberá considerarse este
costo en el costo intrínseco del análisis sumándole mano de obra, servicios, etc.
• El proceso físico-químico de eliminación de metales propuesto en este trabajo de tesis, es una
muestra de la importancia de la Química para plantear posibles soluciones problemas
ambientales específicos.
V.2. RECOMENDACIONES
Sería recomendable para la optimización del método sugerido lo siguiente:
•
•
•
Eliminar los sólidos que se presentan, mediante un incremento en la velocidad de las
revoluciones durante la centrifugación.
Estudiar la posibilidad de aplicar algún método físico-químico para solubilizar los sólidos
que se presentan después de la digestión, sin que esto afecte la determinación de esta
prueba.
Tener un estricto control en el tiempo de digestión y temperatura.
90
En lo que respecta a la metodología de tratamiento se sugiere
• Que la gente que realiza la prueba analítica de DQO, sea capacitada para aplicar el proceso de
eliminación de metales a los residuos líquidos que genere y de esta manera tener un sistema
amigable con el ambiente e integrado.
• Seguir investigando para que a partir de los residuos sólidos que se obtienen del proceso de
eliminación de metales, se logren separar y posteriormente recuperar los metales que
contienen estos residuos sólidos y se puedan volver a utilizar, ya sea en el propio laboratorio o
en otros complementarios.
• Tratar de mejorar el proceso de eliminación del catión mercúrico Hg2+, para disminuir su
concentración haciendo una reducción de Hg2+ a Hg22+, precipitándolo posteriormente con
HCl.
• Buscar alternativas menos contaminantes para determinar la cantidad de materia disuelta y
coloidal en aguas residuales y, de esta forma, disminuir el uso de la prueba de DQO.
91
ANEXOS
92
ANEXO A
PREPARACIÓN DE LA CURVA DE CALIBRACIÓN
Para elaborar la curva de calibración, se disuelven 680 mg de hidrógenoftalato de potasio
(C8H5KO4) en agua destilada previamente secado y se afora a un litro (solución estándar
madre).
Esta solución presenta una DQO teórica de 800 mgO2/L y a partir de ésta se preparan una serie
de soluciones patrón o estándar en un intervalo que oscile entre 20 - 800 mgO2/L.
La Tabla A.1 presenta los mL de solución estándar madre utilizados para la elaboración de las
soluciones estándar, requeridas para la preparación de la curva de calibración, así como también
los mL de agua destilada utilizados para llevar a un volumen de 100mL todas las muestras
preparadas.
Tabla A.1. Cantidades de solución estándar madre y agua destilada utilizadas para la elaboración
de la curva de calibración
No. de
estándar
Concentración
Teórica
1
2
3
4
5
6
7
8
9
10
0
10
50
100
200
300
400
600
700
800
C8H5KO4
(mL)
0.00
1.25
6.25
12.5
25.0
37.5
50.0
75.0
87.5
100
Agua destilada
(mL)
100.0
98.75
93.75
87.50
75.00
62.50
50.00
25.00
12.50
0.000
Estas soluciones estándar se someten a digestión, a las condiciones establecidas en el texto.
Concluido el proceso de digestión de las soluciones estándar, se dejan enfriar y posteriormente se
efectúan las lecturas de absorbancia en el espectrofotómetro uv-visible, efectuando barridos a un
intervalo de longitud de onda de 580 - 620 nm.
Se utiliza un programa de computadora (GBC ScanMaster V1.65), el cual permite realizar las
lecturas con mayor facilidad. En este programa se introducen los valores de los parámetros
requeridos para la elaboración de la curva de calibración, a partir del cual se obtienen
directamente las concentraciones de las muestras problemas en mgO2/L (Shaw, 1989).
Los datos generados para la realización de la curva de calibración son tabulados y graficados
directamente por la computadora los cuales se listan a continuación.
93
Calibración de resultados
Nombre del archivo: Curva
Ecuación de calibración: Segundo orden, forzada a pasar por el origen
Intervalo p/longitud de onda (nm): 580.0 - 620.0
Forma de medición: Áreas bajo las curvas
Estándar
1
2
3
4
5
6
7
8
9
10
Concentración
=
Barrido
stan1
stan2
stan3
stan4
stan5
stan6
stan7
stan8
stan9
stan10
-84.023abs
SD = 3.552
Conc. T.
0.000
10.000
50.000
100.00
200.00
300.00
400.00
600.00
700.00
800.00
+
1526.78ªbs
Abs. nm
-0.00037
0.00713
0.03464
0.06224
0.1292
0.1994
0.2644
0.4064
0.4718
0.5370
+
0.000
RSD = 8.250e+18
94
Conc. Exp.
-0.5717
10.887
52.788
94.699
195.838
301.151
397.844
606.616
701.655
795.597
ANEXO B
VALORES EXPERIMENTALES DE DQO
Los datos experimentales completos se presentan a continuación en las Tablas B.1 a 22.
Tabla B.1. Valores experimentales triplicados de DQO obtenidos de una solución estándar de
hidrogenoftalato de potasio de concentración conocida (680mg/1000mL) por el
método colorimétrico
Réplica
1
(mgDQO/L)
791.26
788.71
807.81
808.17
806.88
789.26
807.41
790.73
796.13
805.85
809.72
807.42
789.56
803.72
806.64
Réplica
2
(mgDQO/L)
794.19
791.54
800.07
805.72
803.28
792.72
800.52
795.22
799.54
801.59
804.73
800.06
792.46
805.86
799.07
Réplica
3
(mgDQO/L)
790.48
789.26
803.41
809.08
809.71
795.52
808.74
797.01
803.62
804.08
801.99
799.73
795.43
797.51
803.44
Valor promedio
de las réplicas
(mgDQO/L)
791.98
789.84
803.76
807.66
806.62
792.50
805.56
794.32
799.76
803.84
805.48
802.40
792.48
802.05
803.05
Desviación
estándar entre
réplicas (σ)
1.96
1.50
3.88
1.74
3.22
3.14
4.41
3.24
3.75
2.14
3.92
4.35
2.94
2.58
3.80
Coeficiente de
variación entre
réplicas (%)
0.25
0.19
0.48
0.22
0.40
0.40
0.55
0.41
0.47
0.27
0.49
0.54
0.37
0.32
0.47
Tabla B.2. Valores experimentales triplicados de DQO obtenidos de una solución estándar de
hidrogenoftalato de potasio de contración conocida (680mg/1000mL) por el método
estándar
Réplica
1
(mgDQO/L)
777.61
782.69
769.98
780.15
761.42
753.88
761.69
758.34
746.59
762.85
779.10
785.36
773.88
763.15
786.42
Réplica
2
(mgDQO/L)
783.48
782.69
774.50
780.15
771.23
763.41
772.52
767.97
755.11
762.85
785.44
785.36
786.63
772.35
786.42
Réplica
3
(mgDQO/L)
777.61
775.26
774.50
780.15
771.23
763.41
761.69
767.97
755.11
770.82
785.44
785.36
773.88
763.15
786.42
Valor promedio
de las réplicas
(mgDQO/L)
791.31
780.21
772.99
780.15
767.96
760.23
765.30
764.76
752.27
765.51
783.33
785.36
778.13
766.22
786.42
95
Desviación
estándar entre
réplicas (σ)
13.26
4.29
2.61
0
5.66
5.50
6.25
5.56
4.92
4.60
3.66
0
7.36
5.31
0
Coeficiente de
variación entre
réplicas (%)
1.68
0.55
0.34
0
0.74
0.72
0.82
0.73
0.65
0.60
0.47
0
0.95
0.69
0
Tabla B.3. Valores experimentales triplicados de DQO obtenidos de una solución estándar de
glucosa de concentración conocida (50mg/100mL) por el método colorimétrico
Réplica
1
(mgDQO/L)
525.04
532.25
525.91
523.55
521.90
525.61
524.19
515.38
521.25
518.86
517.01
530.81
532.80
531.16
527.80
518.54
516.59
531.16
520.60
533.26
Réplica
2
(mgDQO/L)
528.72
531.26
526.91
526.42
519.47
529.31
524.89
513.26
518.53
516.32
515.24
527.53
528.26
530.74
525.88
520.18
518.37
526.40
519.38
529.42
Réplica
3
(mgDQO/L)
524.15
528.69
523.15
523.38
522.43
524.07
526.33
515.87
522.61
520.36
519.42
525.01
526.17
532.13
530.29
517.05
521.41
527.90
523.00
527.13
Valor promedio de
las réplicas
(mgDQO/L)
525.97
530.73
525.32
524.45
521.27
526.33
525.14
514.84
520.80
518.51
517.22
527.78
529.08
531.34
528.00
518.59
518.79
528.49
520.99
526.60
Desviación estándar
entre
réplicas (σ)
2.42
1.84
1.95
1.71
1.58
2.69
1.09
1.39
2.08
2.04
2.10
2.91
3.39
0.71
2.21
1.57
2.44
2.43
1.84
3.11
Coeficiente de
variación entre
réplicas (%)
0.46
0.35
0.37
0.33
0.30
0.38
0.21
0.27
0.30
0.39
0.41
0.55
0.64
0.13
0.42
0.30
0.47
0.46
0.35
0.59
Tabla B.4. Valores experimentales triplicados de DQO obtenidos de una solución estándar de
glucosa de concentración conocida (50mg/100mL) por el método estándar
Réplica
1
(mgDQO/L)
526.32
531.40
517.65
521.59
505.88
515.50
519.38
515.38
515.50
517.65
513.73
527.56
523.26
529.88
515.87
527.07
523.08
526.92
519.23
515.38
Réplica
2
(mgDQO/L)
526.32
531.40
517.65
521.59
516.45
515.50
519.38
523.72
515.50
517.65
522.44
517.34
515.50
519.67
515.87
519.52
514.88
515.34
519.23
515.38
Réplica
3
(mgDQO/L)
526.32
523.87
517.65
515.50
516.45
523.72
519.38
515.38
515.50
517.65
522.44
517.34
515.50
529.88
515.87
527.07
514.88
515.34
519.23
515.38
Valor promedio de
las réplicas
(mgDQO/L)
526.32
528.89
517.65
519.56
511.17
518.24
519.38
518.16
515.50
517.65
519.54
529.75
518.09
526.48
515.87
524.55
517.61
519.2
519.23
515.38
96
Desviación estándar
entre
réplicas (σ)
0
4.35
0
3.52
7.47
4.75
0
4.82
0
0
5.03
5.90
4.48
5.89
0
4.36
4.73
6.69
0
0
Coeficiente de
variación entre
réplicas (%)
0
0.82
0
0.68
1.46
0.92
0
0.93
0
0
0.97
1.13
0.86
1.11
0
0.83
0.91
1.29
0
0
Tabla B.5. Resultados obtenidos de DQO en muestras triplicadas de agua de cempasúchil
analizadas por el método colorimétrico, empleando una dilución de 1mL/100mL
Réplica
1
(mgDQO/L)
858.83
847.29
841.78
857.60
862.96
863.79
839.24
873.74
847.86
862.77
855.10
863.20
872.36
868.35
866.06
848.55
855.39
866.22
876.39
855.41
860.08
873.53
856.90
853.56
861.71
850.62
869.17
850.92
858.90
864.88
Réplica
2
(mgDQO/L)
854.65
852.13
849.32
855.10
856.87
857.65
845.41
867.29
852.51
853.27
847.93
858.39
872.25
870.27
865.83
850.59
859.68
860.22
871.27
850.46
862.12
865.06
855.26
853.26
858.53
846.33
873.30
848.25
855.91
860.82
Réplica
3
(mgDQO/L)
859.21
849.22
845.78
852.90
858.49
860.06
840.57
871.68
845.14
857.29
848.84
861.72
867.88
866.54
871.71
852.60
861.15
858.09
868.11
858.63
857.81
870.88
858.17
862.77
856.85
853.19
867.67
845.99
861.44
859.96
Valor promedio
de las réplicas
(mgDQO/L)
857.56
849.55
845.63
855.20
859.44
860.50
841.74
871.00
848.50
857.78
850.62
861.10
870.83
868.39
867.87
850.58
858.74
861.51
871.92
854.83
860.00
869.82
856.78
856.53
859.03
850.04
870.04
848.38
858.75
861.89
97
Desviación
estándar entre
réplicas (σ)
2.53
2.44
3.77
2.35
3.15
3.10
3.20
3.30
3.72
4.77
3.90
2.46
2.56
1.87
3.33
2.02
2.99
4.21
4.18
4.11
2.16
4.33
1.46
5.40
2.47
3.46
2.91
2.47
2.77
2.63
Coeficiente de
variación entre
réplicas (%)
0.29
0.28
0.44
0.27
0.37
0.36
0.38
0.38
0.44
0.56
0.46
0.29
0.29
0.21
0.38
0.24
0.35
0.49
0.48
0.48
0.25
0.50
0.17
0.63
0.28
0.41
0.33
0.29
0.32
0.30
Tabla B.6. Resultados obtenidos de DQO en muestras triplicadas de agua de cempasúchil
analizadas por el método estándar, empleando una dilución de 1mL/100mL
Réplica
1
(mgDQO/L)
915.44
911.76
877.32
884.76
877.78
885.19
877.65
900.40
904.38
892.43
873.02
886.98
904.41
900.74
911.76
879.38
909.40
900.74
911.76
880.00
907.41
903.70
869.30
890.37
879.63
907.06
897.41
903.34
899.63
896.83
Réplica
2
(mgDQO/L)
915.44
919.85
877.32
880.16
877.78
885.19
877.65
900.40
899.47
892.43
873.02
880.30
895.24
900.74
903.21
879.38
895.67
900.74
903.29
886.33
898.78
897.52
869.30
895.47
879.63
896.96
890.17
903.34
888.66
891.69
Réplica
3
(mgDQO/L)
911.78
911.76
877.32
884.76
869.47
885.19
865.34
900.40
899.47
884.51
873.02
880.30
895.24
900.74
903.21
883.52
895.67
900.74
896.45
886.33
898.78
903.70
869.30
895.47
879.63
896.96
892.53
903.34
888.66
891.69
Valor promedio
De las réplicas
(mgDQO/L)
914.22
914.46
877.32
883.22
875.01
885.19
873.55
900.40
901.10
889.79
873.02
882.53
898.30
900.74
906.06
880.76
900.24
900.74
903.83
884.22
901.66
901.64
869.30
893.77
879.63
900.33
893.37
903.34
892.32
893.40
98
Desviación
estándar entre
réplicas (σ)
2.11
4.67
0
2.66
4.80
0
7.11
0
2.83
4.57
0
3.86
5.29
0
4.94
2.39
7.93
0
7.67
3.65
4.98
3.57
0
2.94
0
5.83
3.69
0
6.33
2.97
Coeficiente de
variación entre
réplicas (%)
0.23
0.51
0
0.30
0.55
0
0.81
0
0.31
0.51
0
0.44
0.59
O
0.54
0.27
0.88
0
0.85
0.41
0.55
0.39
0
0.33
0
0.65
0.41
0
0.71
0.33
Tabla B.7. Resultados obtenidos de DQO en muestras triplicadas de agua de cempasúchil
analizadas por el método colorimétrico, empleando una dilución de 1mL/500mL
Réplica
1
(mgDQO/L)
187.39
188.39
204.07
194.90
200.24
182.19
185.08
175.21
184.47
185.41
215.96
194.62
198.41
201.02
196.17
195.91
195.68
200.34
184.50
206.10
180.50
200.98
188.19
185.41
200.93
211.22
179.46
205.22
200.02
191.15
Réplica
2
(mgDQO/L)
190.47
186.25
198.16
189.77
195.76
185.22
186.19
181.22
179.36
181.29
196.59
189.07
191.62
193.28
190.15
189.03
192.86
195.24
185.37
197.61
187.05
193.88
190.20
186.14
197.34
200.83
182.45
192.22
198.27
188.25
Réplica
3
(mgDQO/L)
188.42
190.92
199.05
193.86
195.49
186.91
184.18
180.12
185.74
185.40
200.94
191.26
193.47
196.93
193.16
192.97
190.78
196.42
181.53
200.99
185.88
198.91
193.19
183.44
199.92
198.41
184.39
195.18
197.79
192.53
Valor promedio
De las réplicas
(mgDQO/L)
188.76
188.52
200.43
192.84
197.50
184.57
185.15
178.85
183.19
184.03
204.50
191.65
194.50
197.08
193.16
192.64
193.11
197.33
183.80
201.57
184.48
197.92
190.53
185.00
199.40
203.49
182.1
197.54
198.69
190.64
99
Desviación
estándar entre
réplicas (σ)
1.57
2.34
3.19
2.71
2.40
2.13
1.00
3.20
3.38
2.38
10.16
2.80
3.51
3.87
3.01
3.45
2.46
2.67
2.01
4.27
3.49
3.65
2.52
1.40
1.85
6.81
2.48
6.81
1.17
2.18
Coeficiente de
variación entre
réplicas (%)
0.83
1.24
1.59
1.41
1.22
1.15
0.54
1.79
1.84
1.29
4.97
1.46
1.80
1.96
1.56
1.79
1.27
1.35
1.10
2.12
1.89
1.84
1.32
0.75
0.93
3.34
1.36
3.45
0.59
1.15
Tabla B.8. Resultados obtenidos de DQO en muestras triplicadas de agua de cempasúchil
analizadas por el método estándar, empleando una dilución de 1mL/500mL
Réplica
1
(mgDQO/L)
188.89
203.70
196.30
192.60
188.89
188.89
193.31
203.31
189.60
197.03
200.74
200.74
191.24
189.87
185.87
193.16
195.22
199.26
203.19
203.19
188.89
207.17
199.20
211.16
207.17
194.44
202.38
190.48
186.51
189.60
Réplica
2
(mgDQO/L)
188.89
210.17
196.30
189.60
188.89
192.28
193.31
203.31
189.60
190.78
195.46
190.27
191.24
189.87
190.23
188.15
190.12
199.26
203.19
197.17
188.89
207.17
193.26
200.85
200.78
194.44
202.38
190.48
186.51
190.84
Réplica
3
(mgDQO/L)
180.24
203.70
190.60
192.60
188.89
192.98
188.89
196.77
189.60
190.78
195.46
190.27
191.24
185.27
185.87
193.16
190.12
199.26
195.46
197.17
188.89
200.74
185.87
200.85
195.77
194.44
195.87
185.89
186.51
199.20
Valor promedio
De las réplicas
(mgDQO/L)
186.00
205.86
194.40
191.60
188.89
191.15
191.84
201.13
189.60
192.86
197.22
193.76
191.24
188.34
187.32
191.49
191.82
199.26
200.61
199.18
188.89
205.03
192.78
204.29
201.24
194.44
200.21
188.95
186.51
193.21
100
Desviación
estándar entre
réplicas (σ)
4.99
3.74
3.29
1.73
0
1.96
2.55
3.78
0
3.61
3.05
6.04
0
2.66
2.52
2.89
2.94
0
4,46
3.48
0
3.71
6.68
5.95
5.71
0
3.76
2.65
0
5.22
Coeficiente de
Variación entre
Réplicas (%)
2.68
1.81
1.69
0.90
0
1.02
1.33
0.50
0
1.87
1.55
3.12
0
1.41
1.34
1.51
1.53
0
2.22
1.76
0
1.81
3.46
2.91
2.84
0
1.88
1.40
0
2.70
Tabla B.9. Resultados obtenidos de DQO en muestras triplicadas de agua de cempasúchil
analizadas por el método colorimétrico, empleando una dilución de 1mL/1000mL
Réplica
1
(mgDQO/L)
96.60
100.86
88.58
103.84
90.16
89.20
100.83
102.22
87.33
104.87
99.73
84.25
101.49
119.99
102.68
98.95
94.46
98.45
81.31
92.99
85.14
109.07
99.81
124.62
108.07
104.26
91.27
80.65
92.32
98.56
Réplica
2
(mgDQO/L)
95.71
99.68
90.48
100.42
88.85
90.60
90.16
95.37
85.33
100.78
97.37
84.35
100.94
111.79
96.86
96.01
95.64
97.54
86.31
90.07
85.41
100.17
98.89
122.26
100.59
98.62
90.23
82.25
90.24
98.65
Réplica
3
(mgDQO/L)
90.61
95.67
89.85
97.24
91.58
88.20
95.38
97.27
86.38
99.82
95.74
88.52
93.27
108.90
98.86
99.10
97.64
95.59
84.33
93.48
86.14
103.96
97.81
118.26
103.27
101.83
93.72
80.59
93.66
99.84
Valor promedio
de las réplicas
(mgDQO/L)
94.31
98.74
89.64
100.50
90.20
89.33
95.46
98.29
86.35
101.82
97.61
85.71
98.57
113.56
99.47
98.02
95.91
97.19
83.98
92.18
85.56
104.40
98.84
121.71
103.98
101.57
91.74
81.16
92.07
99.02
101
Desviación
estándar entre
réplicas (σ)
3.23
2.72
0.97
3.30
1.37
1.21
5.34
3.54
1.00
2.68
2.00
2.44
4.60
5.75
2.96
1.74
1.61
1.46
2.52
1.84
0.52
4.47
1.00
3.21
3.79
2.83
1.79
0.94
1.72
0.71
Coeficiente de
variación entre
réplicas (%)
3.42
2.76
1.08
3.28
1.51
1.35
5.60
3.60
1.16
2.63
2.06
2.84
4.66
5.07
2.97
1.78
1.68
1.50
3.00
2.00
0.60
4.28
1.01
2.64
3.64
2.79
1.95
1.16
1.87
0.72
Tabla B.10. Resultados obtenidos de DQO en muestras triplicadas de agua de cempasúchil
analizadas por el método estándar, empleando una dilución de 1mL/1000mL
Réplica
1
(mgDQO/L)
87.89
107.41
103.70
96.30
88.89
96.30
88.89
107.14
103.17
99.21
95.24
87.65
91.63
95.62
89.22
89.22
92.94
96.65
92.94
94.60
91.62
95.60
103.60
107.57
92.62
104.10
100.37
96.65
107.81
91.24
Réplica
2
(mgDQO/L)
91.79
107.41
103.70
96.30
88.89
96.30
97.88
93.17
91.89
99.21
95.24
92.77
82.43
95.62
99.12
89.22
101.65
89.49
92.94
94.60
103.54
89.12
103.60
94.27
105.73
91.64
91.64
106.34
98.14
104.60
Réplica
3
(mgDQO/L)
91.79
107.41
95.89
96.30
94.33
88.89
97.88
93.17
91.89
99.21
83.15
92.77
91.63
86.88
99.12
89.22
101.65
96.65
103.71
88.32
103.54
89.12
94.63
94.27
92.62
91.64
100.37
106.34
93.53
104.60
Valor promedio
de las réplicas
(mgDQO/L)
90.49
107.41
95.90
96.30
90.70
93.83
94.88
97.83
95.65
99.21
91.21
91.06
88.56
92.71
95.82
89.22
98.75
94.26
96.53
92.51
99.57
91.28
100.61
98.70
96.99
95.79
97.46
103.11
99.83
100.15
102
Desviación
estándra entre
réplicas (σ)
2.25
0
6.67
0
3.14
4.28
5.19
8.07
6.51
0
6.98
2.96
5.31
5.05
5.72
0
5.03
4.13
6.22
3.63
6.88
3.74
5.18
7.68
7.57
7.19
5.04
5.59
7.29
7.71
Coeficiente de
variación entre
réplicas (%)
2.49
0
6.95
0
3.46
4.56
5.47
8.24
6.81
0
7.65
3.25
6.00
5.44
5.97
0
5.09
4.39
6.44
3.92
6.91
4.10
5.15
7.78
7.80
7.51
5.17
5.43
13.72
7.70
Tabla B.11. Resultados obtenidos de DQO en muestras triplicadas de agua de vinazas analizadas
por el método colorimétrico, empleando una dilución de 1mL/100mL
Réplica
1
(mgDQO/L)
655.82
666.62
658.37
655.59
656.53
649.02
661.64
657.43
652.32
648.17
645.36
650.26
652.85
649.79
660.86
658.37
648.89
644.32
661.93
641.11
644.21
647.06
644.50
654.49
640.53
668.20
650.55
665.11
654.97
660.03
Réplica
2
(mgDQO/L)
660.23
659.31
655.27
658.65
661.62
653.58
665.49
662.34
659.97
653.79
641.53
654.17
659.36
656.81
667.08
663.82
651.93
652.29
658.38
647.23
650.27
653.96
651.36
657.94
646.21
663.19
653.23
659.74
650.16
661.82
Réplica
3
(mgDQO/L)
663.18
664.24
659.82
651.29
660.73
647.94
667.53
659.26
649.81
646.96
646.85
658.60
660.23
647.96
661.17
659.23
656.35
649.26
657.16
640,11
649.15
648.12
643.26
649.83
640.35
660.10
649.82
662.36
657.48
666.32
valor promedio
de las réplicas
(mgDQO/L)
659.74
663.39
657.82
655.18
659.63
650.18
664.89
659.68
654.03
649.64
647.25
654.34
657.48
651.52
663.04
660.47
652.39
648.62
659.16
642.82
647.88
649.71
646.37
654.09
642.36
663.83
651.20
662.40
654.20
662.72
103
Desviación
estándar entre
réplicas (σ)
3.7
3.73
2.32
3.70
2.72
2.99
2.99
2.48
5.29
3.64
2.11
4.17
4.03
4.67
3.51
2.93
3.75
4.02
2.48
3.85
3.22
3.72
4.36
4.07
3.33
4.09
1.80
2.69
3.72
3.24
Coeficiente de
variación entre
réplicas (%)
0.56
0.56
0.35
0.56
0.41
0.46
0.45
0.38
0.81
0.56
0.33
0.64
0.61
0.72
0.53
0.44
0.57
0.62
0.38
0.60
0.50
0.57
0.57
0.62
0.52
0.62
0.28
0.41
0.57
0.49
Tabla B.12. Resultados obtenidos de DQO en muestras triplicadas de agua de vinazas analizadas
por el método estándar, empleando una dilución de 1mL/100mL
Réplica
1
(mgDQO/L)
703.85
707.69
692.31
707.69
700.00
700.00
696.15
692.31
696.85
700.79
704.72
708.96
705.22
697.76
694.03
705.22
701.49
697.80
702.38
706.35
698.41
694.44
679.47
688.46
700.00
707.69
692.31
703.84
711.11
714.81
Réplica
2
(mgDQO/L)
699.56
701.88
692.31
698.27
700.00
695.37
704.85
692.31
689.71
700.79
696.85
708.96
697.76
704.28
700.16
705.22
693.18
690.21
702.38
699.21
706.42
694.44
685.26
688.46
694.33
700.24
700.19
694.21
705.93
708.39
Réplica
3
(mgDQO/L)
703.85
701.88
692.31
707.69
692.26
695.37
689.18
688.84
689.71
700.79
696.85
698.37
697.76
704.28
700.16
705.22
693.18
690.21
695.27
706.35
698.41
694.44
685.26
693.94
694.33
707.69
700.19
703.84
705.93
708.39
Valor promedio
de las réplicas
(mgDQO/L)
702.42
703.82
692.31
704.55
697.42
696.91
696.73
691.15
692.09
700.79
699.47
705.43
700.25
702.11
698.12
705.22
695.95
692.74
700.01
703.97
701.08
694.44
683.33
690.29
696.22
705.21
697.56
700.63
707.66
710.53
104
Desviación
estándar entre
réplicas (σ)
2.48
3.35
0
5.44
4.47
2.67
7.85
2.00
4.12
0
4.54
6.11
4.31
3.76
3.54
0
4.80
4.38
4.10
4.12
4.62
0
3.34
3.16
3.27
4.3
4.55
5.56
2.99
3.71
Coeficiente de
variación entre
réplicas (%)
0.35
0.48
0
0.77
0.64
0.38
1.13
0.29
0.59
0
0.65
0.87
0.61
0.54
0.51
0
0.68
0.63
0.59
0.59
0.66
0
0.48
0.46
0.47
0.61
0.65
0.79
0.42
0.52
Tabla B.13. Resultados obtenidos de DQO en muestras triplicadas de agua de vinazas analizadas
por el método colorimétrico, empleando una dilución de 1mL/500mL
Réplica
1
(mgDQO/L)
144.59
135.75
139.93
146.31
157.14
158.90
146.27
161.70
138.49
145.65
165.39
138.84
164.90
143.72
147.46
137.15
130.77
157.25
144.92
155.50
141.27
159.95
147.24
138.36
159.74
149.96
154.30
136.25
157.15
140.89
Réplica
2
(mgDQO/L)
148.61
140.59
143.83
150.22
152.43
161.54
152.82
166.26
146.63
151.57
159.26
142.16
165.67
149.73
152.34
143.41
138.36
161.43
151.75
162.68
148.72
163.80
153.18
143.39
164.43
155.77
161.87
140.21
160.19
148.32
Réplica
3
(mgDQO/L)
151.76
143.15
145.77
152.39
160.00
155.67
149.86
158.99
140.51
147.30
155.48
145.81
158.73
150.79
155.42
145.33
140.25
155.26
146.71
162.88
150.12
157.87
148.09
145.56
160,18
159.53
155.44
133.47
152.26
150.10
Valor promedio
de las réplicas
(mgDQO/L)
148.32
139.83
143.18
149.64
156.52
158.70
149.65
162.32
141.88
148.17
160.04
142.27
163.10
148.08
151.74
141.96
136.46
157.98
147.79
160.35
146.70
160.54
149.50
142.44
161.45
155.09
157.20
136.64
156.53
146.44
105
Desviación
estándar entre
réplicas (σ)
3.59
3.76
2.97
3.08
3.82
2.94
3.28
3.67
4.24
3.06
5.00
3.49
3.80
3.81
4.01
4.28
5.02
3.15
3.54
4.20
4.76
3.00
3.21
3.69
2.59
4.82
4.08
3.39
4.00
4.89
Coeficiente de
variación entre
réplicas (%)
2.42
2.68
2.08
2.06
2.44
1.85
2.19
2.26
2.99
2.06
3.12
2.45
2.33
2.57
2.65
3.01
3.68
1.99
2.40
2.62
3.24
1.87
2.15
2.59
1.60
3.11
2.60
2.48
2.56
3.34
Tabla B.14. Resultados obtenidos de DQO en muestras triplicadas de agua de vinazas analizadas
por el método estándar, empleando una dilución de 1mL/500mL
Réplica
1
(mgDQO/L)
154.76
150.80
150.80
154.76
156.16
153.19
155.38
151.40
147.41
147.41
143.30
159.36
163.35
150.65
150.79
146.83
142.86
146.83
156.00
152.00
148.00
159.38
147.22
150.60
143.45
162.28
154.76
150.65
163.45
143.40
Réplica
2
(mgDQO/L)
154.76
141.23
142.44
154.76
146.54
153.19
155.38
143.57
147.41
154.76
150.54
159.36
155.73
150.65
146.54
146.83
150.65
146.83
142.44
152.00
148.00
159.38
155.46
14244
155.30
153.29
154.76
163.37
154.19
155.37
Réplica
3
(mgDQO/L)
146.27
150.80
142.44
154.76
146.54
146.32
142.81
143.57
154.68
147.41
150.54
142.44
155.73
150.65
150.79
156.17
150.65
155.73
156.00
142.80
148.00
142.68
147.22
150.60
143.45
153.29
148.73
150.65
154.19
143.40
Valor promedio
de las réplicas
(mgDQO/L)
151.93
147.61
151.89
154.76
149.75
150.90
151.19
146.18
149.83
149.86
148.13
153.72
156.94
150.65
149.37
149.94
148.05
149.80
151.48
148.93
14800
153.81
149.97
147.88
147.40
156.29
152.75
154.89
157.28
147.39
106
Desviación
estándar entre
réplicas (σ)
4.90
5.53
0.95
0
5.55
3.97
7.26
4.52
4.20
4.24
4.18
9.78
5.55
0
2.45
5.39
4.50
5.14
7.83
5,31
0
9.64
4.76
4.71
6.84
5.19
3.48
7.34
5.35
6.91
Coeficiente de
variación entre
réplicas (%)
3.23
3.74
0.62
0
3.71
2.63
4.80
3.09
2.80
2.83
2.82
6.35
3.54
0
1.64
3.60
3.04
3.43
5.17
3.57
0
6.26
3.17
3.19
4.64
3.32
2.29
4.74
3.40
4.69
Tabla B.15. Resultados obtenidos de DQO en muestras triplicadas de agua de vinazas analizadas
por el método colorimétrico, empleando una dilución de 1mL/1000mL
Réplica
1
(mgDQO/L)
58.09
72.38
93.06
62.06
53.63
59.41
80.99
56.39
95.69
68.17
87.16
56.01
72.03
60.57
70.53
71.15
92.90
80.08
62.32
84.89
68.70
81.74
62.40
72.18
63.98
67.80
77.31
81.00
79.45
70.82
Réplica
2
(mgDQO/L)
64.92
75.42
88.24
67.45
60.12
64.76
75.48
63.23
85.41
73.31
80.09
55.73
67.78
58.22
67.28
75.54
83.65
77.87
56.21
77.60
66.45
78.63
59.61
68.16
57.28
65..93
70.21
90.17
82.37
68.76
Réplica
3
(mgDQO/L)
59.53
66.92
87.09
70.34
58,48
55.25
82.43
58.32
89.96
65.59
79.26
62.98
70.34
63.18
71.28
69.71
80.04
82.50
62.46
78.37
72.15
83.42
65.58
65.19
65.99
71.40
68.44
93.10
75.47
71.83
Valor promedio
de las réplicas
(mgDQO/L)
60.84
71.57
89.46
66.62
57.41
59.81
79.63
59.31
90.35
69.02
82.17
58.24
70.05
60.66
69.70
72.13
85.53
80.15
60.33
80.29
69.10
81.26
62.53
68.51
52.42
68.38
71.99
88.09
79.10
70.47
107
Desviación
estandar entre
réplicas (σ)
3.60
4.31
3.17
4.20
3.37
4.77
3.67
3.53
5.15
3.93
4,34
4.11
2.14
2.48
2.13
3.04
6.63
2.32
3.57
4.01
2.87
2.43
2.99
3.51
4.56
2.78
4.69
6.31
3.46
1.56
Coeficiente de
variación entre
réplicas (%)
5.92
6.02
3.54
6.31
5.88
7.97
4.61
5.95
5.70
5.69
5.28
7.05
3.05
4.09
3.05
4.21
7.76
2.89
5.92
4.99
4.15
2.99
4.78
5.12
7.31
4.07
6.52
7.17
4.95
2.22
Tabla B.16. Resultados obtenidos de DQO en muestras triplicadas de agua de vinazas analizadas
por el método estándar, empleando una dilución de 1mL/1000mL
Réplica
1
(mgDQO/L)
67.73
71.71
81.67
75.70
68.08
86.60
67.69
75.50
73.71
83.67
71.72
69.68
81.68
75.33
69.40
63.42
71.43
83.42
78.00
66.46
84.58
79.69
80.22
65.30
71.73
81.14
77.38
75.33
82.73
79.74
Réplica
2
(mgDQO/L)
72.48
64.18
72.36
75.70
68.08
86.60
73.17
75.50
73,71
75.19
71.72
69.68
72.17
67.12
69.40
70.23
71.43
77.18
85.41
72.32
77.29
79.69
73.37
65.30
71.73
72.33
77.38
85.44
72.78
79.74
Réplica
3
(mgDQO/L)
67.73
64.18
72.36
66.17
77.56
76.14
67.69
65.13
73.71
69.28
66.33
76.09
81.68
67.12
69.40
70.23
64.26
83.42
85.41
66.46
77.29
86.99
73.37
76.25
71.73
81.14
86.26
75.33
72.78
87.19
Valor promedio
de las réplicas
(mgDQO/L)
69.31
66.69
75.46
72.52
71.24
83.11
69.52
72.04
73.73
76.05
69.92
71.82
78.51
69.86
69.40
67.96
69.04
81.34
82.94
68.41
79.72
82.12
75.65
68.95
71,73
78.20
80.34
78.70
76.10
82.22
108
Desviación
estándar entre
réplicas (σ)
2.74
4.35
5.38
5.50
5.47
6.04
3.16
5.99
0
7.23
3.11
3.70
5.49
4.74
0
3.93
4.14
3.60
4.28
3.38
4.21
4.21
3.95
6.32
0
5.09
5.13
5.84
5.74
4.3
Coeficiente de
variación entre
réplicas (%)
3.96
6.52
7.12
7.59
7.68
7.27
4.55
8.31
0
9.51
4.45
5.15
6.99
6.79
0
5.79
6.00
4.43
5.16
4.95
5.28
5.13
5.23
9.03
0
6.50
6.38
7.42
8.21
5.23
Tabla B.17. Resultados obtenidos de DQO en muestras triplicadas de agua de nejayote analizadas
por el método colorimétrico, empleando una dilución de 1mL/100mL
Réplica
1
(mgDQO/L)
352.96
363.49
361.23
370.24
362.91
356.54
371.63
378.52
375.64
363.93
361.27
363.15
372.69
380.57
352.38
356.87
364.94
366.58
375.08
378.97
364.97
376.10
356.30
373.77
366.82
367.58
381.78
360.36
373.72
367.14
Réplica
2
(mgDQO/L)
358.87
355.00
355.78
366.47
364.73
360.06
366.57
382.46
380.24
359.71
367.84
365.61
366.72
377.52
359.52
361.98
370.82
371.84
380.47
367.83
364.85
377.57
363.51
379.50
372.43
365.76
377.67
367.73
378.02
372.88
Réplica
3
(mgDQO/L)
360.24
361.08
362.65
370.03
358.31
366.88
365.81
379.40
380.92
364.65
370.25
366.54
369.74
382.63
362.46
360.05
367.38
369.49
383.55
371.33
373.09
385.79
365.63
384.99
375.59
372.99
385.07
359.81
381.54
377.09
Valor promedio
de las réplicas
(mgDQO/L)
357.36
359.86
359.89
368.91
361.98
361.16
368.00
380.13
378.93
362.76
366.45
365,10
369.72
380.24
358.12
359.63
367.71
369.30
379.70
372.71
367.64
379.82
361.81
379.42
371.61
368.78
381.51
362.63
377.76
372.37
109
Desviación
estándar entre
réplicas (σ)
3.87
4.38
3.63
2.19
3.31
5.26
3.16
2.07
2.87
2.67
4.65
1.75
2.99
2.57
5.18
2.58
2.95
2.63
4.29
5.70
4.72
5.22
4.89
5.61
4.44
3.76
3.71
4.42
3.92
4.99
Coeficiente de
variación entre
réplicas (%)
1.08
1.22
1.01
0.57
0.91
1.46
0.86
0.54
0.76
0.74
1.27
0.48
0.81
0.68
1.45
0.72
0.80
0.71
1.13
1.53
1.28
1.37
1.35
1.48
1.19
1.02
0.97
1.22
1.04
1.34
Tabla B.18. Resultados obtenidos de DQO en muestras triplicadas de agua de nejayote analizadas
por el método estándar, empleando una dilución de 1mL/100mL
Réplica
1
(mgDQO/L)
352.06
382.02
382.02
378.28
382.02
358.27
378.00
376.10
378.97
400.03
383.94
372.33
397.65
388.14
359.63
377.95
358.27
362.20
366.14
373.38
372.17
392.16
373.24
368.43
387.32
371.25
376.63
367.14
384.27
375.67
Réplica
2
(mgDQO/L)
352.06
373.54
371.99
378.28
376.93
358.27
369.65
376.10
383.67
395.10
389.47
381.86
389.81
376.34
367.65
377.95
368.76
362.20
371.43
381.24
384.13
385.30
373.24
368.43
387.32
365.82
385.51
374.84
377.67
384.57
Réplica
3
(mgDQO/L)
352.06
373.54
282.02
378.28
376.93
366.82
369.65
388.67
383.67
395.10
383.94
372.33
389.81
388.14
359.63
377.95
368.76
372.61
371.43
381.24
372.17
392.16
373.24
374.89
374.08
365.82
385.51
367.14
384.27
375.67
Valor promedio
de las réplicas
(mgDQO/L)
352.06
376.37
378.68
378.28
378.63
361.12
372.43
380.29
382.10
396.74
385.78
375.51
392.42
384.21
362.30
377.95
365.26
365.67
369.67
378.62
376.16
389.87
373.24
370.58
382.91
367.63
382.55
369.71
382.07
378.64
110
Desviación
estándar entre
réplicas (σ)
0
4.90
5.79
0
2.94
4.94
4.82
7.26
2.71
2.85
3.19
5.50
4.53
6.81
4.63
0
6.06
6.01
3.05
4.54
6.91
3.96
0
3.74
7.64
3.14
5.13
4.45
3.81
5.14
Coeficiente de
variación entre
réplicas (%)
0
1.30
1.53
0
0.78
1.37
1.29
1.91
0.71
0.72
0.83
1.47
1.15
1.77
1.28
0
1.66
1.64
0.83
1.20
1.84
1.02
0
1.01
2.00
0.85
1.34
1.20
1.00
1.34
Tabla B.19. Resultados obtenidos de DQO en muestras triplicadas de agua de nejayote analizadas
por el método colorimétrico, empleando una dilución de 1mL/500mL
Réplica
1
(mgDQO/L)
56.04
59.70
76.59
74.91
83.03
69.44
55.26
69.58
66.56
70.99
48.97
54.71
57.77
54.72
55.25
78.02
60.55
57.98
76.28
70.60
66.79
70.75
67.63
72.21
58.57
55.42
49.54
75.22
77.72
67.06
Réplica
2
(mgDQO/L)
54.89
63.21
80.42
78.82
83.20
72.82
59.63
71.65
68.43
65.33
54.65
60.23
61.47
60.39
57.66
80.34
68.63
64.86
70.67
63.57
66.71
77.66
75.77
69.71
66.54
62.87
55.27
81.79
80.12
72.19
Réplica
3
(mgDQO/L)
61.10
66.25
74.93
81.43
79.26
72.65
61.57
72.53
72.32
67.49
56.45
62.09
58.45
64.42
62.50
74.57
72.81
69.99
68.54
60.09
72.56
68.03
66.43
74.36
67.05
63.17
55.34
83.24
75.23
73.20
Valor promedio
de las réplicas
(mgDQO/L)
57.34
63.05
77.31
78.39
81.83
72.64
58.82
71.25
69.10
67.94
53.36
59.01
59.23
59.84
58.47
77.64
67.00
64.28
71.83
64.75
68.69
72.15
69.94
72.09
64.05
60.48
53.38
80.08
77.69
70.82
111
Desviación
estándar entre
réplicas (σ)
3.30
3.28
2.82
3.28
2.22
3.11
3.23
1.51
2.94
2.86
3.90
3.84
1.97
4.87
3.69
2.90
5.80
6.03
4.00
5.35
3.35
4.96
5.08
2.33
4.76
4.39
3.33
4.27
2.45
3.29
Coeficiente de
variación entre
réplicas (%)
5.76
5.20
3.64
4.19
2.72
4.28
5.49
2.13
4.25
4.20
7.32
6.50
3.33
8.14
6.31
3.74
8.66
9.38
5.57
8.27
4.88
6.88
7.27
3.23
7.42
7.26
6.24
5.34
3.15
4.65
Tabla B.20. Resultados obtenidos de DQO en muestras triplicadas de agua de nejayote analizadas
por el método estándar, empleando una dilución de 1mL/500mL
Réplica
1
(mgDQO/L)
67.86
67.86
64.28
71.43
78.74
74.80
74.22
62.30
66.74
78.60
74.18
55.74
60.25
81.08
65.64
80.94
59.58
62.30
64.20
68.47
71.53
77.54
59.73
73.46
69.35
60.56
81.26
75.82
72.00
67.83
Réplica
2
(mgDQO/L)
59.32
72.18
64.28
71.43
84.25
74.80
74.22
73.11
72.16
78.60
83.27
67.38
68.16
73.35
65.64
80.94
68.43
69.70
72.26
74.12
71.53
69.00
66.38
61.52
77.69
68.38
72.37
83.37
72.00
75.43
Réplica
3
(mgDQO/L)
67.86
72.18
64.28
82.17
78.74
74.80
83.65
73.11
81.82
63.89
74.18
67.38
68.16
73.35
77.28
72.82
68.43
69.70
64.20
68.47
71.53
69.00
66.38
73.46
69.35
60.56
81.26
75.82
72.00
75.43
Valor promedio
de las réplicas
(mgDQO/L)
67.92
70.74
64.28
75.01
80.58
74.80
77.36
69.51
73.57
73.70
77.21
63.50
65.52
75.93
69.52
78.23
65.48
67.23
66.89
70.35
71.53
71.85
64.16
69.48
72.13
63.17
78.30
78.34
72.00
72.90
112
Desviación
estándar entre
réplicas (σ)
4.92
2.49
0
6.20
3.18
0
5.44
6.24
7.64
8.49
5.25
6.72
4.57
4.46
6.72
4.69
5.11
4.27
4.65
3.26
0
4.93
3.84
6.89
4.82
4.51
5.13
4.36
0
4.39
Coeficiente de
variación entre
réplicas (%)
7.24
3.53
0
8.27
3.95
0
7.04
8.98
10.38
11.52
6.80
10.58
6.97
5.88
9.67
6.00
7.80
6.35
6.96
4.64
0
6.86
5.98
9.92
6.68
7.15
6.56
5.56
0
6.02
Tabla B.21. Resultados obtenidos de DQO en muestras triplicadas de agua de nejayote analizadas
por el método colorimétrico, empleando una dilución de 1mL/1000mL
Réplica
1
(mgDQO/L)
41.01
30.56
33.51
28.51
52.50
36.60
26.03
45.52
47.84
45.75
27.04
44.90
27.46
26.06
52.51
27.62
45.37
42.98
27.20
46.24
48.37
33.76
55.11
26.17
36.91
53.15
28.69
41.40
30.77
46.00
Réplica
2
(mgDQO/L)
48.17
37.38
38.63
33.49
47.32
40.22
32.41
49.53
50.14
48.61
36.71
51.28
28.43
31.09
60.62
33.45
47.67
51.11
33.18
50.16
55.31
40.01
58.27
34.52
40.54
61.25
32.18
48.21
37.02
50.69
Réplica
3
(mgDQO/L)
50.23
29.19
42.54
34.28
54.50
43.48
30.06
51.43
50.67
54.29
29.38
53.18
33.40
35.44
60.55
35.28
52.19
52.07
26.14
44.71
58.32
41.99
62.24
37.33
35.83
64.37
37.35
51.88
29.28
45.11
Valor promedio
de las réplicas
(mgDQO/L)
59.68
32.38
38.23
32.09
51.44
40,10
29.50
48.83
49.55
49.55
31.04
49.79
29.76
30.86
57.89
32.12
48.41
48.72
28.84
47.04
54.00
38.59
58.54
32.67
37.76
59.59
32.74
47.16
32.36
47.27
113
Desviación
estándar entre
réplicas (σ)
15.05
4.39
4.53
3.13
3.71
3.44
3.23
3.02
1.50
4.35
5.05
4.34
3.19
4.69
4.66
4.00
3.47
4.94
3.80
2.81
5.10
4.30
3.57
5.80
2.47
5.79
4.36
5.32
4.11
3.00
Coeficiente de
variación entre
réplicas (%)
25.22
13.55
11.85
9.75
7.20
8.58
10.94
6.18
3.04
8.77
16.25
8.71
10.71
15.21
8.05
12.46
7.17
10.25
13.16
5.98
9.45
11.13
6.10
17.77
6.53
9.72
13.31
11.28
12.69
6.34
Tabla B.22. Resultados obtenidos de DQO en muestras triplicadas de agua de nejayote analizadas
por el método estándar, empleando una dilución de 1mL/1000mL
Réplica
1
(mgDQO/L)
50.18
46.60
39.43
35.84
58.44
35.43
31.25
27.24
39.06
46.63
36.44
25.83
39.06
46.88
42.97
27.20
42.80
50.43
31.46
37.10
54.37
31.12
34.63
52.45
48.72
54.29
41.18
28.65
37.99
48.27
Réplica
2
(mgDQO/L)
50.18
46.60
44.52
47.31
67.34
35.43
31.25
32.54
39.06
55.44
36.44
25.83
47.36
55.27
33.66
27.20
42.80
50.43
42.57
37.10
66.71
42.17
42.22
64.53
55.44
54.29
41.18
38.19
45.67
56.53
Réplica
3
(mgDQO/L)
62.25
54.22
31.26
47.31
58.44
43.21
42.26
32.54
39.06
46.63
28.32
36.43
39.06
46.88
33.66
33.43
42.80
39.88
31.46
43.21
66.71
31.12
34.63
64.53
48.72
54.29
57.99
38.19
45.67
48.27
Valor promedio
de las réplicas
(mgDQO/L)
54.20
49.14
38.40
43.49
61.41
38.02
34.92
30.77
39.06
49.57
33.73
29.36
41.83
49.68
36.76
29.28
42.80
46.91
35.16
39.14
62.60
34.80
37.16
60.50
50.96
54.29
46.78
35.01
43.11
51.02
114
Desviación
estándar entre
réplicas (σ)
6.97
4.40
6.69
6.62
5.14
4.49
6.36
3.06
0
5.09
4.69
6.12
4.79
4.84
5.38
3.60
0
6.09
6.41
3.53
7.12
6.38
4.38
6.97
3.88
0
9.71
5.51
4.43
4.77
Coeficiente de
variación entre
réplicas (%)
12.86
8.95
17.42
15.23
8.37
11.81
18.20
9.94
0
10.26
13.90
20.84
11.46
9.75
14.62
12.29
0
12.98
18.24
9.01
11.38
18.33
11.79
11.53
7.61
0
20.75
15.73
10.29
9.35
ANEXO C
RESULTADOS ESTADÍSTICOS GENERALES OBTENIDOS PARA LOS
VALORES PROMEDIO DE DQO
Los datos experimentales completos se presentan a continuación en las Tablas C.1 a 6.
Tabla C.1. Resultados estadísticos generales obtenidos para los valores promedio de DQO en las
soluciones estándar por los métodos analíticos estándar y colorimétrico
Muestra
Concentración (mg/mL)
Dilución (mL)
Método
Num. de datos
Valor más bajo
Valor más alto
Media
Mediana
Desv. std. poblacional
Desv. std. muestral
Coef. correlación
Cuadrado del coef. R
Varianza
Coef. de variación
Hidrógenoftalato de potasio
680/1000
1/100
Colorimétrico
Estándar
15
15
789.84
752.27
807.66
791.31
800.0867
773.3433
802.4
772.29
5.911263
10.80108
6.1187423
11.180179
0.2264979
-0.03998688
0.05130129
0.00159851
37.44
125.00
0.76
1.4
Glucosa
50/100
S.D
Colorimétrico
Estándar
20
20
514.84
511.17
531.34
529.75
524.012
519.911
525.23
518.72
4.679285
4.701607
4.8009544
4.8237515
-0.05544458
-0.1423245
0.003074101
0.02025626
23.05
23.27
0.92
0.93
Tabla C.2. Resultados estadísticos generales obtenidos para los valores promedio de DQO para la
muestra de agua residual de cempasúchil a diferentes concentraciones por los métodos
analíticos estándar y colorimétrico
Muestra
Dilución (mL)
Método
Num. de datos
Valor más bajo
Valor más alto
Media
Mediana
Desv. std. Poblacional
Desv. std. Muestral
Coef. Correlación
Cuadrado del coef. R
Varianza
Coef. de variación
1/100
Colorimétrico
Estándar
30
30
841.74
869.3
871.92
914.46
858.485
892.4487
858.745
893.585
8.017028
12.12823
8.154066
12.335547
0.2207808
0.05693448
0.04874418
0.003241535
66.49
152.17
0.95
1.4
CEMPASÚCHIL
1/500
Colorimétrico
Estándar
30
30
178.85
186.0
204.50
205.86
192.099
194.304
192.74
192.82
6.889645
5.62938
7.0074259
5.7256158
0.1975671
0.1437668
0.03903277
0.02066888
49.104
32.78
3.6
2.95
115
1/1000
Colorimétrico
Estándar
30
30
81.16
88.56
121.71
107.41
96.22967
95.87733
97.40
95.86
8.339585
4.241728
8.4821527
4.314241
0.1034758
0.2692612
0.01070723
0.07250162
71.95
18.61
8.8
4.5
Tabla C.3. Resultados estadísticos generales obtenidos para los valores promedio de DQO para la
muestra de agua residual de vinazas a diferentes concentraciones por los métodos
analíticos estándar y colorimétrico
Muestra
Dilución (mL)
Método
Num. de datos
Valor más bajo
Valor más alto
Media
Mediana
Desv. std. poblacional
Desv. std. muestral
Coef. correlación
Cuadrado del coef. R
Varianza
Coef. de variación
1/100
Colorimétrico
Estándar
30
30
642.36
683
664.89
710.53
654.8677
698.947
654.27
699.74
6.3299
5.793563
6.4381085
5.8925932
-0.2154635
0.09876914
0.04642452
0.009755342
41.45
34.72
0.98
0.84
VINAZAS
1/500
Colorimétrico
Estándar
30
30
136.46
146.18
163.1
157.28
150.6837
150.8857
149.57
149.955
7.880013
2.961893
8.0147247
3.0125277
0.07616979
0.1361927
0.005801837
0.01854844
64.24
9.08
1.15
1.99
1/1000
Colorimétrico
Estándar
30
30
52.42
66.69
90.35
83.11
71.17067
74.42
69.875
73.125
10.25218
5.11
10.427449
5.19736
0.09936079
0.4098565
0.009872567
0.1679823
108.73
27.01
14.65
6.98
Tabla C.4. Resultados estadísticos generales obtenidos para los valores promedio de DQO para la
muestra de agua residual de nejayote a diferentes concentraciones por los métodos
analíticos estándar y colorimétrico
Muestra
Dilución (mL)
Método
Num. de datos
Valor más bajo
Valor más alto
Media
Mediana
Desv. std. poblacional
Desv. std. muestral.
Coef. correlación
Cuadrado del coef. R
Varianza
Coef. de variación
1/100
Colorimétrico
Estándar
30
30
357.36
352.06
381.51
396.74
369.0337
376.2483
368.39
378.115
7.59635
9.447227
7.7262102
9.60873
0.4368052
0.08944821
0.1907988
0.008000982
59.69
92.33
2.09
2.55
NEJAYOTE
1/500
Colorimétrico
Estándar
30
30
53.36
63.17
81.83
80.58
67.415
71.373
68.315
71.69
7.886016
4.89718
8.0208297
4.9808981
0.04411035
-0.04846974
0.001945723
0.002349316
64.33
24.81
11.9
6.98
116
1/1000
Colorimétrico
Estándar
30
30
28.84
29.28
59.68
62.6
42.55
43.32867
43.57
42.315
10.13981
9.274446
10.313154
9.4329956
0.04358253
0.111588
0.001899437
0.01245188
106.36
88.98
24.24
21.77
Tabla C.5. Intervalos de confianza obtenidos para los métodos analíticos estándar y colorimétrico
sobre las soluciones estándar a diferentes concentraciones
Muestra
FHP
Glucosa
Método
Concentración
(mg/mL)
Colorimétrico 680/1000
Estándar
680/1000
Colorimétrico 50/100
Estándar
50/100
Dilución
(mL)
1/100
1/100
S.D
S.D
α = 0.05
796.70 - 803.48
767.15 - 779.54
521.77 - 526.59
517.65 - 522.17
Limites de confianza
α = 0.01
795.38 - 804.79
764.75 - 781.94
520.94 - 527.08
516.82 - 522.99
α = 0.001
793.54 - 806.63
761.39 - 785.29
519.84 - 528.18
515.72 - 524.10
Tabla C.6. Intervalos de confianza obtenidos para los métodos analíticos estándar y colorimétrico
sobre las aguas residuales analizadas a diferentes concentraciones
Muestra
Método
Colorimétrico
Cempasúchil
Estándar
Colorimétrico
Vinazas
Estándar
Colorimétrico
Nejayote
Estándar
Dilución
(mL)
1/100
1/500
1/1000
1/100
1/500
1/1000
1/100
1/500
1/1000
1/100
1/500
1/1000
1/100
1/500
1/1000
1/100
1/500
1/1000
α = 0.05
856.40 - 862.59
189.49 - 194.71
93.06 - 99.40
887.76 - 897.14
192.16 - 196.44
94.27 - 97.49
652.47 - 657.27
147.69 - 153.67
67.28 - 75.06
696.75 - 701.15
149.77 - 152.02
72.48 - 76.37
366.15 - 371.92
64.42 - 70.41
38.70 - 46.40
372.66 - 379.84
69.51 - 73.23
39.81 - 46.85
117
Limites de confianza
α = 0.01
855.32 - 863.66
188.58 - 195.62
91.96 - 100.50
886.13 - 898.76
191.42 - 197.19
93.71 - 98.05
651.63 - 658.11
146.65 - 154.71
65.92 - 76.42
695.99 - 701.91
149.37 - 152.41
71.80 - 77.04
365.14 - 372.92
63.38 - 71.45
37.36 - 47.74
371.41 - 381.09
68.87 - 73.88
38.59 - 48.07
α = 0.001
853.95 - 865.03
187.42 - 196.78
90.57 - 101.89
884.07 - 900.83
190.48 - 198.13
93.00 - 98.76
650.57 - 659.17
145.33 - 156.03
64.20 - 78.14
695.01 - 702.88
148.88 - 152.90
70.95 - 77.89
363.87 - 374.20
62.06 - 72.77
35.66 - 49.44
369.83 - 382.67
68.05 - 74.70
37.03 - 49.63
ANEXO D
CONDICIONES ANALÍTICAS PARA LA DETERMINACIÓN DE PLATA,
MERCURIO Y CROMO
La determinación de los cationes Ag, Hg y Cr, se realiza por ESPECTROSCOPÍA DE
ABSORCIÓN ATÓMICA, método que se ha venido utilizando oficialmente para la
determinación de estos tres metales.
FUNDAMENTO
La espectrofotometría de absorción atómica es una técnica que se basa en el estudio de la energía
radiante, que es emitida por los átomos. Cuando se aplica una cantidad de energía de una
intensidad apropiada a un átomo, éste la absorbe y dentro de su configuración electrónica
(entendiéndose configuración electrónica como el acomodo de los electrones ordenadamente en
cada uno de los orbitales del elemento), un electrón de su capa u orbital es promovido a una
configuración menos estable conocida como estado excitado.
Debido a que este estado es inestable, el elemento tiende a regresar a su estado basal y durante
este proceso emite energía radiante equivalente a la energía que absorbió para llegar a dicho
estado de excitación. La longitud de onda de la energía emitida está relacionada directamente con
la transición electrónica ocurrida y es propia de cada elemento.
La fuente de energía es una flama. El proceso de absorción atómica consiste en que si la luz de la
longitud de onda precisa incide en un átomo libre, en estado base, el átomo puede absorber la luz
a medida que entra en estado excitado.
Las determinaciones de la concentración de un elemento en una muestra por absorción atómica,
es la cantidad de la luz absorbida por los átomos en estudio.
ANÁLISIS CUANTITATIVO
Sobre la llama o celda de flama que posee átomos en estado fundamental o basal, se enfoca la luz
a la longitud de onda de resonancia, con una intensidad inicial denominada como I0. Debido a la
concentración de átomos en la flama se provoca una disminución en la intensidad inicial de la
luz, denominada como I, dependiendo de la concentración. El detector mide la intensidad
disminuida (I) porque es ahí donde se dirige la luz.
Para determinar la cantidad de luz absorbida se comparan I e I0. La transmitancia (T), es uno de
los términos que se utilizan para determinar la cantidad de luz absorbida y se define como la
razón de la intensidad disminuida y la intensidad inicial; es una indicación de la fracción de luz
inicial que pasa a través de la flama para incidir en el detector.
T= I/I0
(D-1)
118
El término más utilizado para definir la absorción de la luz en la espectrofotometría de absorción
atómica es “la absorbancia”. Esta intensidad presenta una relación lineal o proporcional a la
concentración del elemento a determinar en alguna muestra.
A = log I0/I
(D-2)
La ley que define esta relación es la de Lambert y Beer
A = abc
(D-3)
Donde:
A: Absorbancia
a: Coeficiente de absorción, constante características de las especies absorbentes
b: Longitud de la trayectoria de la luz interceptada por la celda de absorción
c: Concentración de la especies absorbentes en la misma celda
La ecuación establece que la absorbancia es directamente proporcional a la concentración de las
especies absorbentes según las condiciones instrumentales. En la espectrofotometría de absorción
atómica se observa el comportamiento entre la absorbancia y la concentración de algunos
elementos en una solución.
Con esta relación, se pueden preparar curvas de calibración con soluciones de concentración
conocida obteniendo una curva similar a la ilustrada en la Gráfica II.1.
ABSORBANCIA
CURVA DE CALIBRACIÓN
0.6
0
0
0.8
0.83
1
CONCENTRACIÓN
Gráfica D.1.
Esta curva de calibración sirve para poder calcular la concentración de elementos en soluciones,
con base en la absorbancia que presenten.
119
INSTRUMENTACIÓN
El espectrofotómetro de absorción atómica está formado por:
- Una fuente luminosa.
- Una celda para contener la muestra.
- Un medio para la medición de la luz específica.
La lámpara de cátodo hueco es una de las fuentes luminosas más utilizadas. El diseño de éstas es
adecuado para emitir el espectro atómico de un elemento y son independientes para cada uno.
El cátodo de la lámpara es un cilindro hueco del elemento que se va a determinar (el ánodo y es
cátodo se encuentran en un cilindro de vidrio, sellado y lleno de un gas inerte).
Los componentes que se utilizan para medir la luz específica son:
Un monocromador que dispersa las distintas longitudes de onda de la luz que es emitida por la
fuente y separa la línea del elemento en cuestión. Esta longitud de onda aislada por el
monocromador incide sobre el fotomultiplicador directamente. Este tubo produce una corriente
eléctrica que depende de la intensidad de la luz incidente, ésta es amplificada y procesada,
produciendo una señal que se mide con el atenuador. La señal se procesa para obtenerse en
unidades de concentración.
SENSIBILIDAD Y LÍMITES DE DETECCIÓN
Estos términos describen las dos características instrumentales de la calidad del equipo. La
sensibilidad (concentración característica), se define como la pendiente que se obtiene en la
calibración de absorbancia contra concentración para cada elemento. Está expresada en
microgramos por mililitro, necesaria para producir una absorción de 1% y cuyo valor es 0.0044.
La sensibilidad se calcula con la siguiente expresión:
sensibilidad = (concentración del estándar * 0.0044)/ absorbancia media
La sensibilidad del aparato sirve para saber si todas las condiciones del equipo son las óptimas y
si está cumpliendo las especificaciones establecidas.
El concepto de límite de detección involucra consideraciones de dimensión de señal, como de
ruido en la línea base para dar una indicación de la mínima concentración del elemento que se
puede determinar. El límite de detección describe la capacidad del instrumento.
CONDICIONES DEL EQUIPO
Para efectuar el análisis de los metales: plata, cromo, mercurio, mediante espectrofotometría de
absorción atómica es necesario primero encender el equipo (Espectrofotómetro de absorción
atómica Marca: VARIAN, Modelo: SPECTRAA400); después, colocar las lámparas de cátodo
120
hueco (de los metales antes mencionados) enfocándolas sobre la celda de muestreo. Una vez
realizado esto, se establecen las condiciones de operación del equipo indicadas en la tabla II.1
TABLA D.1.
CONDICIONES ÓPTIMAS PARA EL ANÁLISIS DE PLATA, MERCURIO Y CROMO
MEDIANTE ESPECTROFOTOMETRÍA DE ABSORCIÓN ATÓMICA
CONDICIONES
LONGITUD DE ONDA
(nanómetros)
FLAMA
Corriente de la lámpara (mV)
Abertura (SLIT) (nanómetros)
PLATA
328.1
MERCURIO
253.7
CROMO
357.9
aire/
acetileno
4
0.5
aire/
acetileno
4
0.5
aire/
acetileno
7
0.2
PREPARACIÓN DE LA CURVA DE CALIBRACIÓN
Es indispensable preparar una serie de soluciones patrón de concentración conocida y creciente
del elemento (metal) a analizar, de tal manera que proporcione una curva de calibración, la cual
se pueda usar para calcular la concentración del metal en las muestras problema.
Se prepararon tres curvas de calibración, correspondientes a cada uno de los metales: Ag, Hg y
Cr a partir de soluciones patrón, cuyas concentraciones para cada metal fueron de:
PLATA: 5, 10 y 15 ppm
CROMO: 5, 10, y 15 ppm
MERCURIO : 50, 100, y 200 ppm
Los resultados se muestran en las Gráficas D.2 a la D.4
121
0.7
0.6
Absorbancia
0.5
0.4
0.3
0.2
0.1
0
0
5
10
Concentración (ppm)
Gráfica D.2. Curva de calibración para PLATA
122
15
0.45
0.4
0.35
Absorbancia
0.3
0.25
0.2
0.15
0.1
0.05
0
0
50
100
Concentración (ppm)
Gráfica D.3. Curva de calibración para MERCURIO
123
200
0.9
0.8
0.7
Absorbancia
0.6
0.5
0.4
0.3
0.2
0.1
0
0
5
10
Concentración (ppm)
Gráfica D.4. Curva de calibración para CROMO
124
15
LECTURA DE LA CONCENTRACIÓN DE PLATA, MERCURIO Y CROMO
Después de realizar las curvas de calibración para cada uno de los metales, se procede a leer la
concentración de cada uno de ellos, para esto algunas muestras se tuvieron que diluir para que
entraran dentro del intervalo de la curva de calibración. Las Tablas D.1 a la D.3 muestran las
lecturas
Tabla D.2. Lecturas para concentración de plata
MUESTRA
CONC
(ppm)
0.0
5.0
10.0
15.0
2.0
%RSD
BLANCO
ESTÁNDAR 1
0.6
ESTÁNDAR 2
0.6
ESTÁNDAR 3
0.4
1.1
MUESTRA 1
(TANQUE 1)
0.1
19.5
MUESTRA 2
(TANQUE 2)
1.2
0.3
MUESTRA 3
(TANQUE 3)
0.1
14.6
MUESTRA 4
(TANQUE 4)
0.9
0.2
MUESTRA 5
(TANQUE 1)
0.9
4.4
MUESTRA 6
(TANQUE 2)
1.5
0.9
MUESTRA 7
(TANQUE 3)
0.7
1.8
MUESTRA 8
(TANQUE 4)
RSD = Desviación estándar
MEAN ABS = Absorbancia promedio
MEAN
ABS
-0.002
0.224
0.461
0.687
0.088
LECTURAS
-0.002
0.224
0.463
0.690
0.087
-0.002
0.226
0.458
0.686
0.088
-0.002
0.223
0.461
0.685
0.089
0.004
0.003
0.005
0.004
0.056
0.056
0.056
0.055
0.003
0.003
0.003
0.002
0.040
0.040
0.040
0.040
0.006
0.006
0.006
0.006
0.068
0.068
0.069
0.067
0.030
0.030
0.030
0.029
Las muestras 1, 2, 3 y 4 corresponden a la concentración al inicio (antes de aplicar el proceso de
eliminación de metales), las muestras 1 y 3 se tuvieron que diluir 1:20 (5mL en 100 mL) y
después 1:25. Las muestras 2 y 4 se tuvieron que diluir 1:20 (5mL en 100 mL).
Las muestras 5, 6, 7 y 8 corresponden a la concentración final (después de aplicar el proceso de
eliminación de metales).
124
Tabla D.3. Lecturas para concentración de mercurio
MUESTRA
CONC
(ppm)
0.0
50.0
100.0
200.0
113.9
%RSD
BLANCO
ESTÁNDAR 1
0.7
ESTÁNDAR 2
0.5
ESTÁNDAR 3
1.3
0.9
MUESTRA 1
(TANQUE 1)
69.5
1.9
MUESTRA 2
(TANQUE 2)
92.5
0.7
MUESTRA 3
(TANQUE 3)
130.1
0.5
MUESTRA 4
(TANQUE 4)
53.8
1.2
MUESTRA 5
(TANQUE 1)
173.6
0.1
MUESTRA 6
(TANQUE 2)
206.9
0.1
MUESTRA 7
(TANQUE 3)
191.8
0.8
MUESTRA 8
(TANQUE 4)
16.2
1.8
MUESTRA 9
(TANQUE 1)
28.2
0.8
MUESTRA 10
(TANQUE 2)
27.1
1.5
MUESTRA 11
(TANQUE 3)
29.2
47.4
MUESTRA 12
(TANQUE 4)
RSD = Desviación estándar
MEAN ABS = Absorbancia promedio
MEAN
ABS
-0.005
0.103
0.210
0.410
0.238
LECTURAS
-0.005
0.103
0.209
0.405
0.236
-0.005
0.103
0.210
0.411
0.239
-0.005
0.104
0.211
0.415
0.240
0.144
0.147
0.144
0.142
0.194
0.193
0.195
0.193
0.271
0.273
0.270
0.271
0.111
0.112
0.112
0.110
0.358
0.359
0.358
0.359
0.424
0.425
0.423
0.423
0.394
0.397
0.391
0.394
0.033
0.034
0.033
0.033
0.058
0.058
0.059
0.058
0.056
0.057
0.055
0.056
0.202
0.218
0.290
0.099
Las muestras 1, 2, 3 y 4 corresponden a la concentración de Hg total (antes de aplicar el proceso
de eliminación de metales), las cuatro muestras se tuvieron que diluir 1:20 (5mL en 100 mL).
Las muestras 5, 6, 7 y 8 corresponden a la concentración de Hg2+ (antes de aplicar el proceso de
eliminación de metales), la muestra 8 se tuvo que diluir 1:2.5 (20mL en 50 mL).
Las muestras 9, 10, 11 y 12 corresponden a la concentración final del residuo (después de aplicar
el proceso de eliminación de metales)
125
Tabla D.4. Lecturas para concentración de cromo
MUESTRA
CONC
(ppm)
0.0
5.0
10.0
15.0
7.82
%RSD
BLANCO
ESTÁNDAR 1
0.2
ESTÁNDAR 2
0.6
ESTÁNDAR 3
0.8
0.4
MUESTRA 1
(TANQUE 1)
4.61
0.8
MUESTRA 2
(TANQUE 2)
14.76
0.2
MUESTRA 3
(TANQUE 3)
3.46
1.3
MUESTRA 4
(TANQUE 4)
0.71
1.3
MUESTRA 5
(TANQUE 1)
3.33
1.3
MUESTRA 6
(TANQUE 2)
7.93
1.2
MUESTRA 7
(TANQUE 3)
0.67
3.0
MUESTRA 8
(TANQUE 4)
0.03
4.2
MUESTRA 9
(TANQUE 1)
0.05
5.7
MUESTRA 10
(TANQUE 2)
0.07
1.1
MUESTRA 11
(TANQUE 3)
0.05
5.7
MUESTRA 12
(TANQUE 4)
RSD = Desviación estándar
MEAN ABS = Absorbancia promedio
MEAN
ABS
-0.001
0.376
0.607
0.813
0.518
LECTURAS
-0.001
0.377
0.610
0.820
0.519
-0.001
0.375
0.603
0.809
0.516
-0.001
0.376
0.609
0.810
0.519
0.346
0.348
0.343
0.348
0.802
0.803
0.801
0.803
0.260
0.264
0.260
0.257
0.053
0.053
0.054
0.052
0.250
0.254
0.249
0.248
0.523
0.522
0.530
0.517
0.050
0.052
0.050
0.049
0.003
0.003
0.003
0.002
0.004
0.004
0.004
0.004
0.006
0.005
0.006
0.006
0.004
0.004
0.004
0.004
Las muestras 1, 2, 3 y 4 corresponden a la concentración de Cr total (antes de aplicar el proceso de
eliminación de metales), las muestras 1 y 3 se tuvieron que diluir (3mL en 100 mL), las muestras
2 y 4 se tuvieron que diluir primero 3 mL en 100 mL y después 1:5 (5mL en 25 mL).
Las muestras 5, 6, 7 y 8 corresponden a la concentración de Cr 6+ (antes de aplicar el proceso de
eliminación de metales), la muestra 6 se tuvo que diluir primero 1:25 y después 1:5, la muestra 7
se tuvo que diluir 1:5
Las muestras 9, 10, 11 y 12 corresponden a la concentración final del residuo (después de aplicar
el proceso de eliminación de metales)
126
ANEXO E
PREPARACIÓN DE REACTIVOS PARA EL PROCESO DE ELIMINACIÓN DE
METALES
Ácido clorhídrico 2N
1.- En un matraz aforado de 1L se pone agua destilada hasta arriba de la mitad
2.- Se le agregan 166.6 mL de ácido clorhídrico concentrado, lentamente, por las paredes del
matraz (bajo la campana)
3.- Se lleva hasta la marca de aforo con agua destilada
Hidróxido de sodio 8N
1.- Se pesan 320 g de hidróxido de sodio grado industrial
2.- El hidróxido de sodio se coloca en un vaso de precipitado de 1L
3.- Se le agrega agua hasta donde el vaso de precipitados marque 800 mL
4.- El vaso de precipitado con el hidróxido de sodio se ponen en una parrilla de agitación y se
agita por medio de un agitador electromagnético durante 10 minutos (bajo la campana)
Nota: Tener cuidado debido a que la reacción es sumamente exotérmica
5.- Se retira el vaso de precipitados de la parrilla de agitación con un guante de asbesto
6.- El vaso de preipitados se deja bajo la campana durante una hora para que se enfríe
7.- Con un embudo se pasa la solución de hidróxido de sodio a un matraza aforado de 1L y se
completo con agua hasta la marca del aforo
127
ANEXO F
NORMATIVIDAD APLICABLE
Norma Oficial Mexicana NOM-052-ECOL-1993
SERGIO REYES LUJÁN, Presidente del Instituto Nacional de Ecología, con fundamento en los artículos 32
fracción XXV de la Ley Orgánica de la Administración Pública Federal; 5o. fracciones VIII y XIX, 8o. Fracciones II
y VII, 36, 37, 43, 150, 160 y 171 de la Ley General del Equilibrio Ecológico y la Protección al Ambiente; 4o.
fracción I, 5o. y 6o. del Reglamento de la Ley General del Equilibrio Ecológico y la Protección al Ambiente en
Materia de Residuos Peligrosos; 38 fracción II, 40 fracciones X y XVII, 41, 43, 46, 47, 52, 62, 63 y 64 de la Ley
Federal sobre Metrología y Normalización; Primero y Segundo del Acuerdo por el que se delega en el Subsecretario
de Vivienda y Bienes Inmuebles y en el Presidente del Instituto Nacional de Ecología, la facultad de expedir las
normas oficiales mexicanas en materia de vivienda y ecología, respectivamente, y
CONSIDERANDO
Que los residuos peligrosos en cualquier estado físico por sus características corrosivas, reactivas, explosivas,
tóxicas, inflamables, venenosas, biológico infecciosas representan un peligro para el equilibrio ecológico, por lo que
es necesario definir cuales son esos residuos identificándolos y ordenándolos por giro industrial y por proceso, los
generados por fuente no específica, así como los límites que hacen a un residuo peligroso por su toxicidad al
ambiente.
Que habiéndose cumplido el procedimiento establecido en la Ley Federal sobre Metrología y Normalización para la
elaboración de proyectos de normas oficiales mexicanas, el C. Presidente del Comité Consultivo Nacional de
Normalización para la Protección Ambiental ordenó la publicación del proyecto de norma oficial mexicana NOMPA-CRP-001/93, que establece las características de los residuos peligrosos y el listado de los mismos, publicado en
el Diario Oficial de la Federación el 2 de julio de 1993, con el objeto de que los interesados presentaran sus
comentarios al citado Comité Consultivo.
Que la Comisión Nacional de Normalización determinó en sesión de fecha 1º de julio de 1993, la sustitución de la
clave NOM-PA-CRP-001/93, con que fue publicado el proyecto de la presente norma oficial mexicana, por la clave
NOM-CRP-001-ECOL/1993, que en lo subsecuente la identificará.
Que durante el plazo de noventa días naturales contados a partir de la fecha de la publicación de dicho proyecto de
norma oficial mexicana, los análisis a que se refiere el artículo 45 del citado ordenamiento jurídico, estuvieron a
disposición del público para su consulta.
Que dentro del mismo plazo, los interesados presentaron sus comentarios al proyecto de norma, los cuales fueron
analizados en el citado Comité Consultivo Nacional de Normalización, realizándose las modificaciones procedentes.
La Secretaría de Desarrollo Social, por conducto del Instituto Nacional de Ecología, publicó las respuestas a los
comentarios recibidos en la Gaceta Ecológica, Volumen V, número especial de octubre de 1993.
Que previa aprobación del Comité Consultivo Nacional de Normalización para la Protección Ambiental, en sesión
de fecha 5 de octubre de 1993, he tenido a bien expedir la siguiente
NORMA OFICIAL MEXICANA NOM-052-ECOL-1993, QUE ESTABLECE LAS CARACTERÍSTICAS DE
LOS RESIDUOS PELIGROSOS, EL LISTADO DE LOS MISMOS Y LOS LÍMITES QUE HACEN A UN
RESIDUO PELIGROSO POR SU TOXICIDAD AL AMBIENTE.
PREFACIO
En la elaboración de esta norma oficial mexicana participaron:
- SECRETARIA DE DESARROLLO SOCIAL
. Instituto Nacional de Ecología
. Procuraduría Federal de Protección al Ambiente
- SECRETARÍA DE GOBERNACIÓN
- SECRETARÍA DE ENERGÍA, MINAS E INDUSTRIA PARAESTATAL
- SECRETARÍA DE COMERCIO Y FOMENTO INDUSTRIAL
- SECRETARÍA DE AGRICULTURA Y RECURSOS HIDRÁULICOS
- SECRETARÍA DE COMUNICACIONES Y TRANSPORTES
- SECRETARÍA DE SALUD
128
. Dirección General de Salud Ambiental
- DEPARTAMENTO DEL DISTRITO FEDERAL
- GOBIERNO DEL ESTADO DE MÉXICO
. Secretaría de Ecología
- COMISIÓN FEDERAL DE ELECTRICIDAD
- PETRÓLEOS MEXICANOS
. Auditoría de Seguridad Industrial, Protección Ambiental y Ahorro de Energía
. Gerencia de Protección Ambiental y Ahorro de Energía
. Pemex-Gas y Petroquímica Básica
Gerencia de Seguridad Industrial y Protección Ambiental
- ALTOS HORNOS DE MÉXICO, S.A. DE C.V.
- ASOCIACIÓN NACIONAL DE FABRICANTES DE PINTURAS Y TINTAS
- ASOCIACIÓN MEXICANA DE LA INDUSTRIA AUTOMOTRIZ
- ASOCIACIÓN NACIONAL DE LA INDUSTRIA QUÍMICA
- BECTON DICKINSON DE MÉXICO, S.A. DE C.V.
- BUFETE QUÍMICO, S.A. DE C.V.
- CÁMARA DE LA INDUSTRIA DE TRANSFORMACIÓN DE MONTERREY
- CÁMARA MINERA DE MEXICO
- CÁMARA NACIONAL DE LA INDUSTRIA DE LA CELULOSA Y DEL PAPEL
- CÁMARA NACIONAL DE LA INDUSTRIA DE LA TRANSFORMACIÓN
- CÁMARA NACIONAL DE LA INDUSTRIA DEL HIERRO Y DEL ACERO
- CÁMARA NACIONAL DE LA INDUSTRIA FARMACÉUTICA
- CÁMARA NACIONAL DE LA INDUSTRIA HULERA
- CELANESE MEXICANA, S.A. DE C.V.
- CEMENTOS APASCO, S.A. DE C.V.
- CHEMICAL WASTE MANAGEMENT DE MÉXICO, S.A. DE C.V.
- COLEGIO NACIONAL DE INGENIEROS QUÍMICOS Y QUÍMICOS, CONIQQ
- COMERCIAL MEXICANA DE PINTURAS
- COMPAÑIA HULERA TORNEL, S.A. DE C.V.
- CONFEDERACION NACIONAL DE CÁMARAS INDUSTRIALES
- DISTRIBUIDORA KROMA, S.A. DE C.V.
- DUPONT, S.A. DE C.V.
- GENERAL MOTORS DE MÉXICO, S.A. DE C.V.
- GRUPO PRyC ASESORÍA INDUSTRIAL, S.C.
- INGENIERÍA PARA EL CONTROL DE RESIDUOS MUNICIPALES E INDUSTRIALES, S.A. DE C.V.
- INSTITUTO DE PROTECCIÓN AMBIENTAL
- INSTITUTO MEXICANO DE FIBRO INDUSTRIAS
. INSTITUTO MEXICANO DEL PETRÓLEO
- INSTITUTO POLITECNICO NACIONAL
. MAPLE CONSTRUCCIONES Y CONSULTORÍAS, S.A. DE C.V.
- MATERIALES INOXIDABLES, S.A.
- METALOIDES, S.A. DE C.V.
- MEXALIT INDUSTRIAL, S.A. DE C.V.
- PROCTER & GAMBLE DE MÉXICO, S.A. DE C.V.
- PRODUCTOS TEXACO, S.A. DE C.V.
- RESIDUOS INDUSTRALES MULTIQUIM, S.A. DE C.V.
- SERVICIO DE INGENIERÍA Y CONTROL AMBIENTAL, S.A.
- TF VICTOR
- UNIROYAL, S.A. DE C.V.
- UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO
- UNIVERSIDAD AUTÓNOMA METROPOLITANA
1. OBJETO
Esta norma oficial mexicana establece las características de los residuos peligrosos, el listado de los mismos y los
límites que hacen a un residuo peligroso por su toxicidad al ambiente.
2. CAMPO DE APLICACIÓN
129
Esta norma oficial mexicana es de observancia obligatoria en la definición y clasificación de residuos peligrosos.
3. REFERENCIAS
NOM-053-ECOL.- Que establece el procedimiento para llevar a cabo la prueba de extracción para determinar los
constituyentes que hacen a un residuo peligroso por su toxicidad al ambiente.
4. DEFINICIONES
4.1 Cretib
El código de clasificación de las características que contienen los residuos peligrosos y que significan: corrosivo,
reactivo, explosivo, tóxico, inflamable y biológico infeccioso.
4.2 Fuente no específica
Las actividades que generan residuos peligrosos y que pueden aplicarse a diferentes giros o procesos.
4.3 Proceso
El conjunto de actividades físicas o químicas relativas a la producción, obtención, acondicionamiento, envasado,
manejo, y embalado de productos intermedios o finales.
4.4 Solución acuosa
La mezcla en la cual el agua es el componente primario y constituye por lo menos el 50% en peso de la muestra.
5. CLASIFICACIÓN DE LA DESIGNACIÓN DE LOS RESIDUOS
5.1 El procedimiento a seguir por el generador de residuos para determinar si son peligrosos o no, se muestra en el
anexo 1.
5.2 Se consideran como peligrosos los residuos clasificados en las tablas 1 (anexo 2), 2 (anexo 3), 3 y 4 (anexo 4),
así como los considerados en el punto 5.5. En casos específicos y a criterio de la Secretaría de Desarrollo Social,
podrán ser exceptuados aquellos residuos que habiendo sido listados como peligrosos en las tablas 1, 2, 3 y 4 de los
mencionados anexos, puedan ser considerados como no peligrosos porque no excedan los parámetros establecidos
para ninguna de las características indicadas en el punto 5.5.
5.3 Los residuos peligrosos atendiendo a su fuente generadora, se clasifican en residuos peligrosos por giro
industrial y por procesos, así como por fuente no específica de acuerdo a las tablas 1 (anexo 2), 2 (anexo 3), 3 y 4
(anexo 4).
5.4 Para fines de identificación y control, en tanto la Secretaría no los incorpore en cualquiera de las tablas 1 (anexo
2), 2 (anexo 3) ó 3 y 4 (anexo 4), los residuos determinados en el punto 5.5 se denominarán como se indica en la
siguiente tabla:
CARACTERÍSTICAS
No. SEDESOL
Corrosividad (C)
P 01
Reactividad (R)
P 02
Explosividad (E)
P 03
Toxicidad al Ambiente (T)
El correspondiente al contaminante tóxico
Inflamabilidad (I)
según las Tablas 5, 6 y 7
Biológico Infecciosas (B)
P 04
P 05
5.5 Además de los residuos peligrosos comprendidos en las tablas 1 (anexo 2), 2 (anexo 3), 3 y 4 (anexo 4), se
considerarán peligrosos aquéllos que presenten una o más de las siguientes características: corrosividad, reactividad,
explosividad, toxicidad, inflamabilidad y/o biológico infecciosas; atendiendo a los siguientes criterios.
5.5.1 Un residuo se considera peligroso por su corrosividad cuando presenta cualquiera de las siguientes
propiedades:
5.5.1.1 En estado líquido o en solución acuosa presenta un pH sobre la escala menor o igual a 2.0, o mayor o igual a
12.5.
5.5.1.2 En estado líquido o en solución acuosa y a una temperatura de 55 °C es capaz de corroer el acero al carbón
(SAE 1020 ), a una velocidad de 6.35 milímetros o más por año.
5.5.2 Un residuo se considera peligroso por su reactividad cuando presenta cualquiera de las siguientes propiedades:
5.5.2.1 Bajo condiciones normales (25 °C y 1 atmósfera), se combina o polimeriza violentamente sin detonación.
5.5.2.2 En condiciones normales (25 °C y 1 atmósfera) cuando se pone en contacto con agua en relación (residuoagua) de 5:1, 5:3, 5:5 reacciona violentamente formando gases, vapores o humos.
5.5.2.3 Bajo condiciones normales cuando se ponen en contacto con soluciones de pH; ácido (HCl 1.0 N) y básico
(NaOH 1.0 N), en relación (residuo-solución) de 5:1, 5:3, 5:5 reacciona violentamente formando gases, vapores o
humos.
130
5.5.2.4 Posee en su constitución cianuros o sulfuros que cuando se exponen a condiciones de pH entre 2.0 y 12.5
pueden generar gases, vapores o humos tóxicos en cantidades mayores a 250 mg de HCN/kg de residuo o 500 mg de
H2S/kg de residuo.
5.5.2.5 Es capaz de producir radicales libres.
5.5.3 Un residuo se considera peligroso por su explosividad cuando presenta cualquiera de las siguientes
propiedades:
5.5.3.1 Tiene una constante de explosividad igual o mayor a la del dinitrobenceno.
5.5.3.2 Es capaz de producir una reacción o descomposición detonante o explosiva a 25°C y a 1.03 kg/cm² de
presión.
5.5.4 Un residuo se considera peligroso por su toxicidad al ambiente cuando presenta la siguiente propiedad:
5.5.4.1 Cuando se somete a la prueba de extracción para toxicidad conforme a la norma oficial mexicana
NOM 053-ECOL-1993, el lixiviado de la muestra representativa que contenga cualquiera de los constituyentes
listados en las tablas 5, 6 y 7 (anexo 5) en concentraciones mayores a los límites señalados en dichas tablas.
5.5.5 Un residuo se considera peligroso por su inflamabilidad cuando presenta cualquiera de las siguientes
propiedades:
5.5.5.1 En solución acuosa contiene más de 24% de alcohol en volumen.
5.5.5.2 Es líquido y tiene un punto de inflamación inferior a 60°C.
5.5.5.3 No es líquido pero es capaz de provocar fuego por fricción, absorción de humedad o cambios químicos
espontáneos (a 25°C y a 1.03 kg/cm2).
5.5.5.4 Se trata de gases comprimidos inflamables o agentes oxidantes que estimulan la combustión.
5.5.6 Un residuo con características biológico infecciosas se considera peligroso cuando presenta cualquiera de las
siguientes propiedades:
5.5.6.1 Cuando el residuo contiene bacterias, virus u otros microorganismos con capacidad de infección.
5.5.6.2 Cuando contiene toxinas producidas por microorganismos que causen efectos nocivos a seres vivos.
5.6 La mezcla de un residuo peligroso conforme a esta norma con un residuo no peligroso será considerada residuo
peligroso.
6. MANEJO
6.1 Los residuos que hayan sido clasificados como peligrosos y los que tengan las características de peligrosidad
conforme a esta norma oficial mexicana deberán ser manejados de acuerdo a lo previsto en el Reglamento de la Ley
General del Equilibrio Ecológico y la Protección al Ambiente en Materia de Residuos Peligrosos, las normas
oficiales mexicanas correspondientes y demás procedimientos aplicables.
7. VIGILANCIA
7.1 La Secretaría de Desarrollo Social por conducto de la Procuraduría Federal de Protección al Ambiente, es la
autoridad competente para vigilar el cumplimiento de la presente norma oficial mexicana.
8. SANCIONES
8.1 El incumplimiento a esta norma oficial mexicana será sancionado conforme a lo establecido en la Ley General
del Equilibrio Ecológico y la Protección al Ambiente, su Reglamento en Materia de Residuos Peligrosos y demás
disposiciones jurídicas aplicables.
9. BIBLIOGRAFÍA
9.1 Code of Federal Regulations, Vol. 40, Part, 260, 1991. U.S.A. (Código Federal de Regulaciones, Vol. 40, Parte
260, 1991, Estados Unidos de América).
9.2 NIOSH/OSHA, U.S. Departamento de Salud y Recursos Humanos. U.S. Departamento de Trabajo. DHHS
(NIOSH) No. 81-123, January 1981, (Guía Sanitaria para Residuos Químicos).
9.3 Registro Internacional de Tóxicos Químicos Potenciales, Génova 1982.
10. CONCORDANCIA CON NORMAS INTERNACIONALES
Esta norma oficial mexicana coincide parcialmente con el Code of Federal Regulations, Vol. 40, Part, 260, 1991.
U.S.A. (Código Federal de Regulaciones, Vol. 40, Parte 260, 1991, Estados Unidos de América).
11. VIGENCIA
11.1 La presente norma oficial mexicana entrará en vigor al día siguiente de su publicación en el Diario Oficial de la
Federación.
11.2 Se abroga el Acuerdo por el que se expidió la Norma Técnica Ecológica NTE-CRP-001/88, que establece los
criterios para la determinación de residuos peligrosos y el listado de los mismos, publicado en el Diario Oficial de la
Federación el 6 de junio de 1988.
Dada en la Ciudad de México, Distrito Federal, a los dieciocho días del mes de octubre de mil novecientos noventa y
tres.
131
ANEXO 2
TABLA 1
CLASIFICACIÓN DE RESIDUOS PELIGROSOS POR GIRO INDUSTRIAL Y PROCESO.
NO.DE GIRO INDUSTRIAL Y
CLAVE RESIDUO PELIGROSO
GIRO PROCESO.
CRETIB
1
ACABADO DE METALES Y GALVANOPLASTIA
1.1
PRODUCCION EN GENERAL
(T)
LODOS DE TRATAMIENTO DE LAS AGUAS
RESIDUALES PROVENIENTES DEL LAVADO DE
METALES PARA REMOVER SOLUCIONES
CONCENTRADAS
(T)
LODOS PROVENIENTES DE LAS OPERACIONES
DEL DESENGRASADO
(T)
SALES PRECIPITADAS DE LOS BAÑOS DE
REGENERACION DE NIQUEL
(T)
BAÑOS DE ANODIZACION DEL ALUMINIO
(T,C) SOLUCIONES GASTADAS Y RESIDUOS
PROVENIENTES DEL LATONADO
(T,C) SOLUCIONES GASTADAS Y RESIDUOS
PROVENIENTES DEL CADMIZADO
(T,C) SOLUCIONES GASTADAS Y RESIDUOS
PROVENIENTES DEL CROMADO
(T,C) SOLUCIONES GASTADAS Y RESIDUOS
PROVENIENTES DEL COBRIZADO
(T,C) SOLUCIONES GASTADAS Y RESIDUOS
PROVENIENTES DEL PLATEADO
(T,C) SOLUCIONES GASTADAS Y RESIDUOS
PROVENIENTES DEL ESTAÑADO
(T,C) SOLUCIONES GASTADAS Y RESIDUOS
PROVENIENTES DEL NIQUELADO
(T,C) SOLUCIONES GASTADAS Y RESIDUOS
PROVENIENTES DEL ZINCADO
(T,C) SOLUCIONES GASTADAS Y RESIDUOS
PROVENIENTES DEL TROPICALIZADO
(T)
SOLUCIONES GASTADAS Y RESIDUOS DE LOS
TANQUES DE ENFRIAMIENTO POR ACEITES EN
LAS OPERACIONES DE TRATAMIENTO EN
CALIENTE DE METALES
(T,C) SOLUCIONES GASTADAS Y SEDIMENTOS DE
LOS BAÑOS DE CIANURO DE LAS
OPERACIONES DE GALVANOPLASTIA
(T,C) SOLUCIONES GASTADAS DE CIANURO DE LOS
TANQUES DE LIMPIEZA CON SALES EN LAS
OPERACIONES DE TRATAMIENTO EN
CALIENTE DE METALES
(T,C) SOLUCIONES GASTADAS Y RESIDUOS
PROVENIENTES DE LOS BAÑOS DE
FOSFATIZADO
(T,C) RESIDUOS DE CATALIZADORES AGOTADOS
(T)
RESIDUOS CONTENIENDO MERCURIO DE LOS
PROCESOS ELECTROLÍTICOS
2.
2.1
BENEFICIO DE METALES
FUNDICION DE PLOMO
PRIMARIA.
(T)
(T)
LODOS Y POLVOS DEL EQUIPO DE CONTROL
DE EMISIONES DEL AFINADO
LODOS PROVENIENTES DE LA LAGUNA DE
132
NO.INE
RP1.1/01
RP1.1/02
RP1.1/03
RP1.1/04
RP1.1/05
RP1.1/06
RP1.1/07
RP1.1/08
RP1.1/09
RP1.1/10
RP1.1/11
RP1.1/12
RP1.1/13
RP1.1/14
RP1.1/15
RP1.1/16
RP1.1/17
RP1.1/18
RP1.1/19
RP2.1/01
RP2.1/02
(T)
2.2
FUNDICION DE PLOMO
SECUNDARIO.
(T)
(T)
(T)
(T)
2.3
PRODUCCION DE
ALUMINIO.
(C,T)
(C,T)
(T)
2.4
PRODUCCION PRIMARIA
DE COBRE
(T)
(T)
2.5
PRODUCCION
SECUNDARIA DE COBRE
(T)
(T)
2.6
PRODUCCION DE COQUE.
(T)
(T)
(T)
2.7
PRODUCCION DE HIERRO Y
ACERO.
(T)
(C,T)
(T)
2.8
PRODUCCION DE
ALEACIONES DE HIERRO.
(T)
(T)
(T)
(T)
2.9
PRODUCCION DE
COMPUESTOS DE NIQUEL.
(T)
(T)
2.10
PRODUCCION PRIMARIA
DE ZINC.
(T)
EVAPORACIÓN
SOLUCIÓN RESIDUAL DEL LAVADOR DE
GASES QUE PROVIENE DEL PROCESO DEL
AFINADO
LODOS Y POLVOS DEL EQUIPO DE CONTROL
DE EMISIONES DEL AFINADO
ESCORIAS PROVENIENTES DEL HORNO
LODOS PROVENIENTES DEL SISTEMA DE
TRATAMIENTO DE AGUAS RESIDUALES
LODOS PROVENIENTES DEL LAVADOR DE
GASES QUE PROVIENEN DEL PROCESO DEL
AFINADO
LODOS DE LAS SOLUCIONES DE CAL DEL
LAVADOR DE GASES EN LA FUNDICIÓN Y
REFINADO DE ALUMINIO
SOLUCIONES GASTADAS PROVENIENTES DE
LA EXTRUSIÓN
ESCORIAS PROVENIENTES DEL HORNO DE
FUNDICIÓN DE CHATARRA DE ALUMINIO.
LODOS DE LAS PURGAS DE LAS PLANTAS DE
ÁCIDO
RESIDUOS DEL PROCESO DE EXTRUSIÓN DE
TUBERÍA DE COBRE
ESCORIAS PROVENIENTES DEL HORNO
RESIDUOS DEL PROCESO DE EXTRUSIÓN DE
TUBERÍA DE COBRE
LODOS DE DESTILACIÓN CON CAL
AMONIACAL
LIXIVIADOS Y CENIZAS DEL PROCESO DE
COQUIZADO
LODOS DE ALQUITRÁN DEL TANQUE
SEDIMENTADOR
RESIDUOS DEL ACEITE GASTADO
LICOR GASTADO EN LAS OPERACIONES DE
ACERO INOXIDABLE
LODOS Y POLVOS DEL EQUIPO DE CONTROL
DE EMISIONES DE HORNOS ELÉCTRICOS
LODOS Y POLVOS DEL EQUIPO DE CONTROL
DE EMISIONES EN LA PRODUCCION DE
HIERRO-CROMO
COLAS EN LAS PLANTAS DE MANUFACTURA
DE HIERRO-NÍQUEL
ESCORIAS PROVENIENTES DEL HORNO
CASCARILLA Y/O COSTRAS METÁLICAS
ACEITOSAS DEL PROCESO DE FORJA EN
CALIENTE
LODOS DE LA MANUFACTURA DE
ALEACIONES DE NÍQUEL
RESIDUOS DE LA PRODUCCIÓN DE
CARBONILO DE NÍQUEL
LODOS DE TRATAMIENTO DE AGUAS
RESIDUALES Y/O PURGAS DE LA PLANTA DE
ÁCIDO
133
RP2.1/03
RP2.2/01
RP2.2/02
RP2.2/03
RP2.2/04
P2.3/01
RP2.3/02
RP2.3/03
RP2.4/01
RP2.4/02
RP2.5/01
RP2.5/02
RP2.6/01
RP2.6/02
RP2.6/03
RP2.7/01
RP2.7/02
RP2.7/03
RP2.8/01
RP2.8/02
RP2.8/03
RP2.8/04
RP2.9/01
RP2.9/02
RP2.10/01
(T)
(T)
3.
3.1
3.2
3.3
3.4
3.5
3.6
3.7
4.
4.1
RP2.10/02
RP2.10/03
ACEITES RESIDUALES DE LAS OPERACIONES
RP3.1/01
LODOS DEL TRATAMIENTO DE AGUAS
RESIDUALES DE LAS OPERACIONES
RP3.2/01
RESIDUOS DE PINTURA
RP3.3/01
RESIDUOS DE LA PRODUCCIÓN
RP3.4/01
RESIDUOS DE LA PRODUCCIÓN
RP3.5/01
RESIDUOS DE LA PRODUCCIÓN
RP3.6/01
RESIDUOS DE LA PRODUCCIÓN
RP3.7/01
(T)
RESIDUOS DE LOS ACABADOS
RP4.1/01
(C,T)
RESIDUOS DE LA CURTIDURÍA
RP4.2/01
COMPONENTES ELECTRÓNICOS
OPERACIONES DE
(I,T)
MAQUILA, FORMACIÓN Y
TERMOFORMACIÓN
PLÁSTICA DE
COMPONENTES
ELECTRÓNICOS
OPERACIONES DE
(T)
MAQUILA,
QUÍMICA/ELECTROQUÍMICA Y
REVESTIMIENTO DE
COMPONENTES
ELECTRÓNICOS
OPERACIONES DE
(T)
REVESTIMIENTO DE
COMPONENTES
ELECTRÓNICOS
PRODUCCIÓN DECINTAS
(T)
MAGNÉTICAS
PRODUCCIÓN DE
(T)
CIRCUITOS
ELECTRÓNICOS
PRODUCCIÓN DE
(T)
SEMICONDUCTORES
PRODUCCION DE TUBOS
(T)
ELECTRÓNICOS
4.2
CURTIDURÍA
ACABADO DE PRODUCTOS
DE CUERO
CURTIDO DE CUERO
5.
5.1
EXPLOSIVOS
PRODUCCIÓN EN GENERAL
6.
LODOS DEL ÁNODO ELECTROLÍTICO
RESIDUO DEL LIXIVIADO DE CADMIO
(R,E) LODOS DEL TRATAMIENTO DE AGUAS
RESIDUALES
(R,E) CARBON AGOTADO DEL TRATAMIENTO DE
AGUAS RESIDUALES QUE CONTIENEN
EXPLOSIVOS
(T) LODOS DEL TRATAMIENTO DE AGUAS
RESIDUALES EN LA FABRICACION,
FORMULACIÓN Y CARGA DE LOS
COMPUESTOS INICIADORES DEL PLOMO
BASE
(R,E) AGUA ROSA-ROJA DE LAS OPERACIONES DE
TNT
(R,E) RESIDUOS DE LA MANUFACTURA DE
CERILLOS Y PRODUCTOS PIROTÉCNICOS
(R,E) RESIDUOS DE LA MANUFACTURA DEL
PROPELENTE SÓLIDO
PRODUCCION DE HULE
134
RP5.1/01
RP5.1/02
RP5.1/03
RP5.1/04
RP5.1/05
RP5.1/06
6.1
HULE SINTÉTICO Y
NATURAL
(T)
(T)
7.
7.1
7.2
7.3
7.4
7.5
7.6
MATERIALES DE DESECHO PROVENIENTES
DE LA TRANSFORMACION EN LA
MANUFACTURA DE HULE NATURAL Y
SINTETICO.
RESIDUOS DE NITROBENCENO
PROVENIENTES DE LA INDUSTRIA HULERA
MATERIALES PLÁSTICOS Y RESINAS SINTÉTICAS
PRODUCCIÓN DE FIBRA DE (T,I) FONDAJES DE TANQUES DE
RAYÓN
ALMACENAMIENTO DE MONÓMEROS
(T) LODOS DEL SISTEMA DE TRATAMIENTO DE
AGUAS RESIDUALES
(T) LODOS DE LAS AGUAS RESIDUALES DE LOS
SISTEMAS DE LAVADO DE EMISIONES
ATMOSFÉRICAS
PRODUCCIÓN DE LÁTEX
(T,I) FONDAJES DE TANQUES DE
ESTIRENOBUTADIENO
ALMACENAMIENTO DE MONÓMEROS
(T) LODOS DEL SISTEMA DE TRATAMIENTO DE
AGUAS RESIDUALES
(T) LODOS DE LAS AGUAS RESIDUALES DE LOS
SISTEMAS DE LAVADO DE EMISIONES
ATMOSFÉRICAS
PRODUCCIÓN DE RESINAS
(T) FONDAJES DE TANQUES DE
ACRILONITRILO
ALMACENAMIENTO DE MONÓMEROS
BUTADIENO ESTIRENO
(T) LODOS DEL SISTEMA DE TRATAMIENTO DE
AGUAS RESIDUALES
(T,I) LODOS DE AGUAS RESIDUALES DE LOS
SISTEMAS DE LAVADO DE EMISIONES
ATMOSFÉRICAS
(T) PIGMENTOS RESIDUALES
PRODUCIÓN DE RESINAS
(T,I) FONDAJES DE TANQUES DE
DERIVADAS DEL FENOL
ALMACENAMIENTO DE MONÓMEROS
(T) LODOS DEL SITEMA DE TRATAMIENTO DE
AGUAS RESIDUALES
(T) LODOS DE LAS AGUAS RESIDUALES DE LOS
SISTEMAS DE LAVADO DE EMISIONES
ATMOSFÉRICAS
PRODUCCIÓN DE RESINAS
(T) CATALIZADOR GASTADO
POLIÉSTER
(T,I) FONDAJES DE TANQUES DE
ALMACENAMIENTO DE MONÓMEROS
(T) LODOS DEL SISTEMA DE TRATAMIENTO DE
AGUAS RESIDUALES
(T) LODOS DE LAS AGUAS RESIDUALES DE LOS
SISTEMAS DE LAVADO DE EMISIONES
ATMOSFÉRICAS
(T) PIGMENTOS RESIDUALES
PRODUCCIÓN DE RESINAS
(T,I) FONDAJES DE TANQUES DE
DE POLIURETANO
ALMACENAMIENTO DE MONÓMEROS
(T) LODOS DEL SISTEMA DE TRATAMIENTOS DE
AGUAS RESIDUALES
(T) LODOS DE LAS AGUAS RESIDUALES DE LOS
SISTEMAS DE LAVADO DE EMISIONES
ATMOSFÉRICAS
135
RP6.1/01
RP6.1/02
RP7.1/01
RP7.1/02
RP7.1/03
RP7.2/01
RP7.2/02
RP7.2/03
RP7.3/01
RP7.3/02
RP7.3/03
RP7.3/04
RP7.4/01
RP7.4/02
RP7.4/03
RP7.5/01
RP7.5/02
RP7.5/03
RP7.5/04
RP7.5/05
RP7.6/01
RP7.6/02
RP7.6/03
7.7
PRODUCCIÓN DE RESINAS
DE SILICÓN
(T,I)
(T)
(T)
7.8
PRODUCCIÓN DE RESINAS
VINILICAS
(T)
(T,I)
(T)
8.
8.1
9.
9.1
9.2
METALMECÁNICA
PRODUCCIÓN EN GENERAL
MINERÍA
EXTRACCIÓN DE
ANTIMONIO.
EXTRACCIÓN DE ÓXIDOS
DE COBRE
(T)
ACEITES GASTADOS DE CORTE Y
ENFRIAMENTO EN LAS OPERACIONES DE
TALLERES DE MAQUINADO
(T) RESIDUOS PROVENIENTES DE LAS
OPERACIONES DE BARRENADO Y
ESMERILADO
(T) SOLUCIONES DE LOS BAÑOS DE TEMPLADO
PROVENIENTES DE LAS OPERACIONES DE
ENFRIAMIENTO
(C,T) RESIDUOS DE LAS OPERACIONES DE
LIMPEZA, ALCALINA O ÁCIDA
(T,I) PINTURAS, SOLVENTES, LODOS,
LIMPIADORES Y RESIDUOS PROVENIENTES
DE LAS OPERACIONES DE RECUBRIMIENTO,
PINTANDO Y LIMPIEZA
(T) LODOS PRODUCTO DE LA REGENERACIÓN DE
ACEITES GASTADOS
(T)
(T)
(T)
(T)
9.3.
EXTRACCIÓN DE PIRITA
DE COBRE
(T)
(T)
9.4
EXTRACCIÓN DEL PLOMO
FONDAJES DE TANQUES DE
ALMACENAMIENTO DE MONÓMEROS
LODOS DEL SISTEMA DE TRATAMIENTOS DE
AGUAS RESIDUALES
LODOS DE LAS AGUAS RESIDUALES DE LOS
SISTEMAS DE LAVADO DE EMISIONES
ATMOSFÉRICAS
SOLVENTES GASTADOS
FONDAJES DE TAQUES DE
ALMACENAMIENTO DE MONÓMEROS
LODOS DEL SISTEMA DE TRATAMIENTO DE
AGUAS RESIDUALES
(T)
JALES Y COLAS PROVENIENTES DE LA
CONCENTRACION DEL MINERAL.
RESIDUOS PROVENIENTES DE LA
CONCENTRACION DEL MINERAL A TRAVES
DE LIXIVIACION POR CEMENTACION DE
FIERRO SEGUIDO POR PRECIPITACION DEL
HIERRO.
RESIDUOS PROVENIENTES DE LA
CONCENTRACIÓN DEL MINERAL POR EL
PROCESO DE LIXIVIACIÓN POR VERTIDO
SEGUIDO POR PRECIPITACIÓN DEL HIERRO
RESIDUOS PROVENIENTES DEL PROCESO DE
LIXIVIACIÓN IN SITU SEGUIDA POR
PRECIPITACIÓN DEL HIERRO
JALES DE LA CONCENTRACION DEL MINERAL
POR LAS TECNICAS DE FLOTACION Y
LIXIVIADO EN TINA.
RESIDUOS PROVENIENTES DE LA
CONCENTRACIÓN DEL MINERAL MEZCLADOS
CON ÓXIDOS DE COBRE USANDO LA TÉCNICA
DE PRECIPITACION DEL HIERRO
JALES PROVENIENTES DE LA
136
RP7.7/01
RP7.7/02
RP7.7/03
RP7.7/04
RP7.8/01
RP7.8/02
RP8.1/01
RP8.1/02
RP8.1/03
RP8.1/04
RP8.1/05
RP8.1/06
RP9.1/01
RP9.2/01
RP9.2/02
RP9.2/03
RP9.3/01
RP9.3/02
RP9.4/01
ZINC
CONCENTRACIÓN DE LOS SÓLIDOS POR
FLOTACIÓN
10.
10.1
PETROLEO Y PETROQUIMICA.
EXTRACCION DE
(R,I)
PETROLEO
10.2
REFINACION DEL
PETROLEO.
(T)
(T)
(T)
(T)
10.3
10.3.1
10.3.2
10.3.3
PETROQUIMICA.
PRODUCCION DE
ACRILONITRILO
PRODUCCION DE
BUTADIENO.
PRODUCCION DE
DERIVADOS CLORADOS.
(T)
(T)
(C,T,I)
(C,T,I)
10.3.4
PRODUCCION DE
ACETALDEHIDO.
(C,T,I)
(C,T)
10.3.5
10.3.6
10.3.7
11
11.1
PRODUCCION DE
ESTIRENOETILBENCENO.
PRODUCCION DE
PERCLOROETILENO
(T)
TRATAMIENTO PRIMARIO
DE EFLUENTES.
(T,I)
(T)
RECORTE DE PERFORACION DE POZOS
PETROLEROS EN LOS CUALES SE USEN
LODOS DE EMULSION INVERSA.
NATAS DEL SISTEMA DE FLOTACION CON
AIRE DISUELTO (FAD).
LODOS DEL SEPARADOR API Y CARCAMOS.
LODOS SIN TRATAR DE TANQUES DE
ALMACENAMIENTO QUE CONTENGAN
SUBSTANCIAS TOXICAS QUE REBASEN LOS
LIMITES PERMITIDOS POR ESTA NORMA.
LODOS DE TRATAMIENTOS BIOLOGICOS QUE
CONTENGAN METALES PESADOS O
SUBSTANCIAS TOXICAS QUE REBASEN LOS
LIMITES PERMITIDOS POR ESTA NORMA.
POLIMERO Y CATALIZADOR USADO DE LA
PURGA DE LA TORRE DE APAGADO.
RESIDUOS DE LA DESHIDROGENACION DEL
N-BUTANO.
CLORADOS INTERMEDIOS PROVENIENTES
DEL FONDO DE LA COLUMNA
REDESTILADORA DE MONOMERO DE
CLORURO DE VINILO.
CLORADOS PESADOS PROVENIENTES DE LOS
FONDOS DE LA COLUMNA DE PURIFICACION
DE DICLOROETANO.
CROTONALDEHIDO RESIDUAL DEL CORTE
LATERAL DE LA TORRE DE DESTILACION DEL
PROCESO VIA OXIGENO.
CLORACETALDEHIDO PROVENIENTE DEL
FONDO DE LA TORRE PURIFICADORA Y
TORRE LATERAL DEL PROCESO VIA AIRE.
CATALIZADOR CON OXIDOS DE FIERRO,
CROMO Y POTASIO PROVENIENTES DEL
REACTOR DE DESHIDROGENACION.
DERIVADOS HEXACLORADOS PROVENIENTES
DE LOS FONDOS DE LA COLUMNA DE
RECUPERACION DE PERCLOROETILENO.
LODOS DE LOS SEPARADORES API Y
CARCAMOS.
PINTURAS Y PRODUCTOS RELACIONADOS.
(T) RESIDUOS DE RETARDADORES DE FLAMA Y
PINTURAS DE BASE.
(T) RESIDUOS DEL SECADOR DE BARNIZ.
PRODUCCION DE
(T,C) AGENTES LIMPIADORES Y LODOS DE
MASTIQUE Y PRODUCTOS
TRATAMIENTO DE AGUAS RESIDUALES.
DERIVADOS.
(T) BOLSAS Y EMPAQUES DE MATERIA PRIMA.
(T) RESIDUOS DEL EQUIPO DE CONTROL DE LA
CONTAMINACION DEL AIRE.
137
RP10.1/01
RP10.2/01
RP10.2/02
RP10.2/03
RP10.2/04
RP10.3.1/01
RP10.3.2/01
RP10.3.3/01
RP10.3.3/02
RP10.3.4/01
RP10.3.4/02
RP10.3.5/01
RP10.3.6/01
RP10.3.7/01
RP11.1/02
RP11.1/03
RP11.1/01
RP11.1/02
RP11.1/03
11.2
PRODUCCION DE
PINTURAS.
(T,I)
AGENTES LIMPIADORES Y LODOS DEL
TRATAMIENTO DE AGUAS RESIDUALES DE
LA PRODUCCION DE PINTURAS BASE
SOLVENTE.
RESIDUOS DE MATERIAS PRIMAS EN LA
PRODUCCION DE PINTURAS ENLISTADAS EN
EL ANEXO 5.
BOLSAS Y ENVASES DE MATERIA PRIMA
ENLISTADAS EN EL ANEXO 5.
LODOS PROVENIENTES DE LA PRODUCCION.
AGENTES LIMPIADORES Y LODOS DEL
TRATAMIENTO DE AGUAS RESIDUALES DE
LA PRODUCCION DE PINTURAS BASE-AGUA.
RP11.1/01
(T)
AGUAS RESIDUALES DEL PROCESO
(INCLUYENDO SOBRENADANTES, FILTRADOS
Y AGUAS DE LAVADO)
RP12.1/01
(C,T)
AGUAS DE LAVADO DEL VENTEO DEL
REACTOR.
SOLIDOS DE LA FILTRACION, EVAPORACION
Y CENTRIFUGADO.
POLVOS RECOLECTADOS EN FILTROS DE
BOLSA Y BARRIDO DEL PISO EN LAS
OPERACIONES DE MOLIENDA Y EMBALAJE.
RESIDUOS DE LA PRODUCCION.
RP12.1/02
AGUAS RESIDUALES DEL RECTOR Y ACIDO
SULFURICO GASTADO DEL SECADOR DEL
ACIDO.
ABSORBENTES GASTADOS Y AGUAS
RESIDUALES DEL SEPARADOR DE SOLIDOS.
LODOS DEL TRATAMIENTO DE AGUAS
RESIDUALES.
AGUAS RESIDUALES Y AGUAS DE LAVADO
DE LA CLORACION DEL CICLOPENTADIENO.
SOLIDOS RETENIDOS EN LA FILTRACION DE
HEXACLOROCICLOPENTADIENO.
RESIDUOS DEL LAVADOR AL VACIO DEL
CLORADOR DE CLORDANO.
RESIDUOS DE LA PRODUCCION.
RP12.3/01
(T)
(T,I)
(T)
(T)
12.
12.1
PLAGUICIDAS.
PRODUCCION DEL ACIDO
ETILENOBISDITIOCARBAMICO Y
SUS SALES.
(T)
(T)
12.2
12.3
PRODUCCION DE
ATRACINA.
PRODUCCION DE
BROMURO DE METILO.
(T)
(C,T)
(T)
12.4
PRODUCCION DE
CLORDANO.
(T)
(T)
(T)
(T)
12.5
12.6
12.7
12.8
PRODUCCION DE
CLOROTOLUENO.
PRODUCCION DE
CREOSOTA.
PRODUCCION DE 2,4-D
(DICLOROFENOL)
PRODUCCION DE
DISULFOTON.
(T)
(T)
(T)
(T)
(T)
(T)
12.9
PRODUCCION DE FORATO.
(T)
(T)
RP11.2/02
RP11.2/03
RP11.2/04
RP11.2/05
RP12.1/03
RP12.1/04
RP12.2/01
RP12.3/02
RP12.4/01
RP12.4/02
RP12.4/03
RP12.4/04
RP12.5/01
LODOS DEL TRATAMIENTO DE AGUAS
RESIDUALES.
RESIDUOS DEL 2,6-DICLOROFENOL.
RP12.6/01
AGUAS RESIDUALES NO TRATADAS.
FONDOS DE DESTILACION EN LA
RECUPERACION DE TOLUENO.
LODOS DEL TRATAMIENTO DE AGUAS
RESIDUALES.
AGUAS RESIDUALES DEL LAVADO.
SOLIDOS DE LA FILTRACION DEL ACIDO
DIETILFOSFORO-DITIOICO.
RP12.7/02
RP12.8/01
138
RP12.7/01
RP12.8/02
RP12.9/01
RP12.9/02
(T)
12.10
12.11
12.12
12.13
PRODUCCION DE
MALATION.
PRODUCCION DE METIL
META ARSENIATO DE
SODIO Y ACIDO
CACODILICO.
PRODUCCION DE
PARATION Y METIL
PARATION.
PRODUCCION DE
TOXAFENO.
(T)
LODOS DEL TRATAMIENTO DE AGUAS
RESIDUALES.
RESIDUOS DE LA PRODUCCION.
RP12.10/01
(T)
SUBPRODUCTOS SALINOS.
RP12.11/01
(T)
RESIDUOS DE LA PRODUCCION.
RP12.12/01
(T)
LODOS DEL TRATAMIENTO DE AGUAS
RESIDUALES.
AGUAS RESIDUALES NO TRATADAS DEL
PROCESO.
RP12.13/01
(T)
13
PRESERVACION DE LA MADERA.
PRODUCCION EN
(T)
GENERAL.
(T)
14.
14.1
15.
15.1
LODOS SEDIMENTADOS DEL TRATAMIENTO
DE AGUAS EN PROCESOS QUE UTILIZAN:
CRESOTA, CLOROFENOL,
PENTACLOROFENOL Y ARSENICALES.
RESIDUOS DEL PROCESO DE CLORACION EN
LA PRODUCCION DE PRESERVATIVOS PARA
MADERA.
PRODUCCION DE BATERIAS.
PRODUCCION EN
(T)
GENERAL.
LODOS DEL TRATAMIENTO DE AGUAS
RESIDUALES EN LA PRODUCCION DE
BATERIAS DE PLOMO ACIDO.
(T) LODOS DEL TRATAMIENTO DE AGUAS
RESIDUALES EN LA PRODUCCION DE
BATERIAS DE NIQUEL-CADMIO.
(T) PRODUCTOS DE DESECHOS DE LAS BATERIAS
NIQUEL-CADMIO.
(T) PRODUCTOS DE DESECHOS DE LAS BATERIAS
ZINC-CARBONO.
(T) PRODUCTOS DE DESECHOS DE BATERIAS
ALCALINAS.
(T) BATERIAS DE DESECHOS Y RESIDUOS DE LOS
HORNOS DE LA PRODUCCION DE BATERIAS
DE MERCURIO.
(C,T) BATERIAS DE DESECHO DE LA PRODUCCION
DE BATERIA DE PLOMO ACIDO.
QUIMICO FARMACEUTICA
PRODUCCION DE
FARMOQUIMICOS
(T)
(T)
(T)
RESIDUOS DE LA PRODUCCION QUE
CONTENGAN SUBSTANCIAS TOXICAS AL
AMBIENTE.
CARBON ACTIVADO GASTADO QUE HAYA
TENIDO CONTACTO CON PRODUCTOS QUE
CONTENGAN SUBSTANCIAS TOXICAS AL
AMBIENTE.
MATERIALES FUERA DE ESPECIFICACION
QUE CONTENGAN SUBSTANCIAS TOXICAS AL
AMBIENTE.
139
RP12.9/03
RP12.13/02
RP13.1/01
RP13.1/02
RP14.1/01
RP14.1/02
RP14.1/03
RP14.1/04
RP14.1/05
RP14.1/06
RP14.1/07
RP15.1/01
RP15.1/02
RP15.1/03
15.2
ELABORACION DE
MEDICAMENTOS.
(T)
(T)
15.3
PRODUCCION DE
BIOLOGICOS.
(B)
(T)
15.4
15.5
16.
16.1
16.2
16.3
PRODUCCION DE
HEMODERIVADOS.
PRODUCCION DE
PRODUCTOS
VETERINARIOS DE
COMPUESTOS DE
ARSENICO U ORGANOARSENICALES.
QUIMICA INORGANICA.
PRODUCCION DE ACIDO
FLUORHIDRICO.
PRODUCCION DE CLORO
(PROCESO DE CELDAS DE
DIAFRAGMA USANDO
ANODOS DE GRAFITO)
PRODUCCION DE CLORO
(PROCESO DE CELDAS DE
MERCURIO)
16.5
PRODUCCION DE
PIGMENTOS DE CROMO Y
DERIVADOS.
RP15.2/02
RP15.3/01
RP15.3/02
MATERIALES FUERA DE ESPECIFICACIONES.
(T)
LODOS DEL TRATAMIENTO DE AGUAS
RESIDUALES.RP15.5/01
(T)
RESIDUOS DE DESTILACION (BREAS) DE
COMPUESTOS A BASE DE ANILINA.
RP15.5/02
(T)
LODOS DEL TRATAMIENTO DE LAS AGUAS
RESIDUALES.
RESIDUOS DE HIDROCARBUROS CLORADOS
DE LA ETAPA DE PURIFICACION.
RP16.1/01
(T)
(T)
(T)
PRODUCCION DE
FOSFORO.
RP15.2/01
(B)
(T)
16.4
RESIDUOS DE LA PRODUCCION Y
MATERIALES CADUCOS O FUERA DE
ESPECIFICACION QUE CONTENGAN
SUBSTANCIAS TOXICAS AL AMBIENTE.
CARBON ACTIVADO GASTADO QUE HAYA
TENIDO CONTACTO CON PRODUCTOS QUE
CONTENGAN SUBSTANCIAS TOXICAS AL
AMBIENTE.
RESIDUOS DE LA PRODUCCION, MATERIALES
CADUCOS Y FUERA DE ESPECIFICACION.
RESIDUOS DE PROCESOS QUE CONTENGAN
SUBSTANCIAS TOXICAS AL AMBIENTE.
(T)
(T)
(T)
(T)
(T)
(T)
(T)
RP15.4/01
RP16.2/01
LODOS DE LA PURIFICACION DE SALMUERA,
DONDE LA SALMUERA PURIFICADA
SEPARADA NO SE UTILIZA.
LODOS DEL TRATAMIENTO DE AGUAS
RESIDUALES.
CATALIZADOR AGOTADO DE CLORURO DE
MERCURIO.
LODOS DE TRATAMIENTO.
RP16.3/01
RESIDUOS DE LA PRODUCCION.
LODOS DEL TRATAMIENTO DE AGUAS
RESIDUALES DE LA PRODUCCION DE
PIGMENTOS NARANJA Y AMARILLO DE
CROMO.
LODOS DEL TRATAMIENTO DE AGUAS
RESIDUALES DE LA PRODUCCION DE
PIGMENTOS VERDES DE CROMO.
FILTRO AYUDA GASTADO (TORTAS DE
FILTROS)
LODOS DEL TRATAMIENTO DE AGUAS
RESIDUALES DE LA PRODUCCION DE
PIGMENTOS VERDES DE OXIDO DE CROMO
(ANHIDROS E HIDRATADOS).
RESIDUOS DEL HORNO DE LA PRODUCCION
RP16.4/02
RP16.5/01
140
RP16.3/02
RP16.3/03
RP16.4/01
RP16.5/02
RP16.5/03
RP16.5/04
RP16.5/05
16.6
PRODUCCION DE OTROS
PIGMENTOS
INORGANICOS.
(T)
(T)
(T)
17.
17.1
QUIMICA ORGANICA
PRODUCCION DE
ACETALDEHIDO A PARTIR
DEL ETILENO.
17.2
PRODUCCION DE
ANHIDRIDO FTALICO A
PARTIR DEL NAFTALENO.
17.3
PRODUCCION DE
ANHIDRIDO FTALICO A
PARTIR DE ORTOXILENO.
17.4
PRODUCCION DE
ANHIDRIDO MALEICO.
PRODUCCION DE ANILINA.
17.5
17.6
PRODUCCION DE
CLOROBENCENOS.
17.8
17.9
PRODUCCION DE
CLORURO DE BENCILO.
PRODUCCION DEL
CLORURO DE ETILO.
PRODUCCION DE
DIBROMURO DE ETILENO
VIA
BROMACION DEL ETENO.
17.11
17.12
PRODUCCION DEL
DICLOROETILENO.
PRODUCCION DE
DISOCIANATO DE
TOLUENO.
PRODUCCION DE
DIISOCIANATO DE
TOLUENO VIA
RP16.6/02
RP16.6/03
FONDOS DE LA ETAPA DE DESTILACION.
RP17.1/01
(T)
CORTES LATERALES EN LA ETAPA DE
DESTILACION.
PRODUCTOS TERMINALES LIGEROS DE LA
DESTILACION.
RP17.1/02
(T)
(T)
FONDOS DE LA DESTILACION.
PRODUCTOS TERMINALES LIGEROS DE LA
ETAPA DE DESTILACION.
RP17.2/02
RP17.3/01
(T)
(T)
FONDOS DE LA ETAPA DE DESTILACION.
RESIDUOS DE LA PRODUCCION.
RP17.3/02
RP17.4/01
(T)
(T)
FONDOS DE DESTILACION.
RESIDUOS DEL PROCESO DE EXTRACCION
DEL PRODUCTO.
FONDOS DE DESTILACION O DE LA COLUMNA
FRACCIONADORA.
CORRIENTES ACUOSAS DE LA ETAPA DEL
LAVADO DEL REACTOR DE PRODUCTO.
FONDOS DE LA ETAPA DE DESTILACION.
RP17.5/01
RP17.5/02
FONDOS PESADOS DE LA COLUMNA
FRACCIONADORA.
AGUAS RESIDUALES DEL LAVADOR DE
GASES DEL VENTEO DEL REACTOR.
RP17.8/01
(T)
(T)
(T)
(T)
(T)
(T)
17.10
RP16.6/01
(T)
(T)
17.7
DE PIGMENTOS VERDES DE OXIDO DE
CROMO.
LODOS DEL TRATAMIENTO DE AGUAS
RESIDUALES DE LA PRODUCCION DE
PIGMENTOS NARANJA DE MOLIBDATO.
LODOS DEL TRATAMIENTO DE AGUAS
RESIDUALES DE LA PRODUCCION DE
PIGMENTOS AMARILLOS DE ZINC.
LODOS DEL TRATAMIENTO DE AGUAS
RESIDUALES DE LA PRODUCCION DE
PIGMENTOS AZULES DE HIERRO.
ABSORBENTES SOLIDOS GASTADOS DE LA
ETAPA DE PURIFICACION DEL PRODUCTO.
(T)
FONDOS DE LA ETAPA DE PURIFICACION DEL
PRODUCTO.
(T) FONDOS PESADOS DE LA ETAPA DE
DESTILACION.
(R,T) RESIDUOS DE CENTRIFUGACION Y
DESTILACION.
(T)
CONDENSADOS ORGANICOS DE LA
COLUMNA DE RECUPERACION DE
SOLVENTES.
141
RP17.2/01
RP17.6/01
RP17.6/02
RP17.7/01
RP17.9/01
RP17.9/02
RP17.9/03
RP17.10/01
RP17.11/01
RP17.12/01
17.13
FOSGENACION DE LA
TOLUENDIAMINA.
PRODUCCION DE 1,1DIMETILHIDRACINA
(DDAH)A PARTIR DE
HIDRAZINAS DE ACIDO
CARBOXILICO.
(C,T)
FONDOS DE LA TORRE DE SEPARACION DE
PRODUCTOS.
(T,I)
17.14
17.15
17.16
17.17
17.18
17.19
17.20
PRODUCCION DE
DINITROTOLUENO VIA
NITRACION DE TOLUENO.
PRODUCCION DE
EPICLORHIDRINA
PRODUCCION DE
FENOL/ACETONA A
PARTIR DEL CUMENO.
PRODUCCION DE
FLUOROMETANOS.
PRODUCCION DE ETIL
METIL PIRIDINA
PRODUCCION DE
NITROBENCENO/ ANILINA.
PRODUCCION DE
NITROBENCENO
MEDIANTE LA NITRACION
DEL BENCENO.
CABEZAS CONDENSADAS DE LA COLUMNA
DE SEPARACION DE PRODUCTO Y GASES
CONDENSADOS DEL VENTEO DEL REACTOR.
(T) CARTUCHOS DE LOS FILTROS AGOTADOS DE
LA PURIFICACION DEL PRODUCTO.
(T) CABEZAS CONDENSADAS DE LA COLUMNA
DE SEPARACION DE INTERMEDIOS.
(C,T) AGUAS DE LAVADO DEL PRODUCTO.
(T)
(T)
(T)
(T)
(T)
(T)
(T)
17.21
17.22
PRODUCCION DE
TETRACLORURO DE
CARBONO.
PRODUCCION DE
TOLUENDIAMINA VIA
HIDROGENACION DE
DINITROTOLUENO.
(T)
PRODUCCION COMBINADA
RP17.13/04
RP17.14/01
FONDOS PESADOS DE LA COLUMNA DE
PURIFICACION.
FONDOS PESADOS (BREA) DE LA ETAPA DE
DESTILACION.
RP17.15/01
RESIDUO DE CATALIZADOR AGOTADO DE
ANTIMONIO EN SOLUCION ACUOSA.
RESIDUOS DE LAS TORRES DE LAVADO DE
GASES.
CORRIENTES COMBINADAS DE AGUAS
RESIDUALES.
FONDOS DE LA DESTILACION.
RP17.17/01
SUBPRODUCTOS Y RESIDUOS DEL REACTOR
EN LA PRODUCCION DEL NITROBENCENO.
FONDOS PESADOS O PRODUCTOS
RESIDUALES DE LA ETAPA DE DESTILACION.
RP17.16/01
RP17.18/01
17.19/01
17.20/01
17.20/02
RP17.21/01
RP17.22/01
(T)
PRODUCTOS LIQUIDOS TERMINALES
LIGEROS CONDENSADOS DE LA ETAPA DE
PURIFICACION DEL PRODUCTO.
VECINALES DE LA ETAPA DE PURIFICACION
DEL PRODUCTO.
FONDOS PESADOS DE LA ETAPA DE
PURIFICACION DEL PRODUCTO.
CATALIZADORES AGOTADOS DEL REACTOR
DE HIDROCLORACION.
RESIDUOS DEL LAVADOR DE PRODUCTO.
FONDOS DE LA ETAPA DE DESTILACION.
FONDOS PESADOS DE LA COLUMNA DE
PESADOS.
FONDOS O RESIDUOS PESADOS DE LAS
RP17.22/02
(T)
(T)
(T)
(T)
17.24
RP17.13/03
AGUA DE REACCION (SUBPRODUCTO) DE LA
COLUMNA DE SECADO.
(T)
PRODUCCION DE 1,1,1TRICLOROETANO.
RP17.13/02
(T)
(T)
17.23
RP17.13/01
(T)
142
RP17.22/03
RP17.22/04
RP17.23/01
RP17.23/02
RP17.23/03
RP17.23/04
RP17.24/01
DE TRICLOROETILENO Y
PERCLOROETILENO.
18
18.1
TEXTILES.
PRODUCCION EN
GENERAL.
TORRES.
(T)
TAMBOS Y CONTENEDORES CON RESIDUOS
DE TINTES Y COLORANTES.
(T) LODOS DEL SISTEMA DE TRATAMIENTO DE
AGUAS RESIDUALES.
(T) AGENTES MORDIENTES GASTADOS
RESIDUALES.
(C,T) RESIDUOS DE DETERGENTES, JABONES Y
AGENTES DISPERSANTES.
(C) RESIDUOS ACIDOS O ALCALINOS.
(C,T) RESIDUOS PROVENIENTES DEL BANQUEADO.
(T) RESIDUOS DE ADHESIVOS Y POLIMEROS.
(T) RESIDUOS DE AGENTES ENLAZANTES Y DE
CARBONIZACION.
ANEXO 3
TABLA 2
CLASIFICACION DE RESIDUOS POR FUENTE NO ESPECIFICA.
NO.DE
CLAVE
RESIDUO PELIGROSO
FUENTE
CRETIB
1
FUENTES DIVERSAS Y
NO ESPECIFICAS.
1.1
FUENTES NO
(T)
ENVASES Y TAMBOS VACIOS USADOS EN
ESPECIFICAS.
EL MANEJO DE MATERIALES Y RESIDUOS
PELIGROSOS.
(T)
LODOS DE DESECHO DEL TRATAMIENTO
BIOLOGICO DE AGUAS RESIDUALES QUE
CONTENGA CUALQUIER SUBSTANCIA
TOXICA AL AMBIENTE EN
CONCENTRACIONES MAYORES A LOS
LIMITES SEÑALADOS EN EL ARTICULO 5.5
DE ESTA NORMA.
(T,I)
ACEITES LUBRICANTES GASTADOS.
(T)
RESIDUOS DE BIFENILOS POLICLORADOS O
DE CUALQUIER OTRO MATERIAL QUE LOS
CONTENGA EN CONCENTRACION MAYOR
DE 50 PPM.
(T)
RESIDUOS DE EL MANEJO DE LA FIBRA DE
ASBESTO PURO, INCLUYENDO POLVO,
FIBRAS Y PRODUCTOS FACILMENTE
DESMENUZABLES CON LA PRESION DE LA
MANO (TODOS LOS RESIDUOS QUE
CONTENGAN ASBESTO EL CUAL NO ESTE
SUMERGIDO O FIJO EN UN AGLUTINANTE
NATURAL O ARTIFICAL).
(T)
TODAS LAS BOLSAS QUE HAYAN TENIDO
CONTACTO CON LA FIBRA DE ASBESTO, ASI
COMO LOS MATERIALES FILTRANTES
PROVENIENTES DE LOS EQUIPOS DE
CONTROL COMO SON: LOS FILTROS,
MANGAS, RESPIRADORES PERSONALES Y
143
RP18.1/01
RP18.1/02
RP18.1/03
RP18.1/04
RP18.1/05
RP18.1/06
RP18.1/07
RP18.1/08
NO.INE
RPNE1.1/01
RPNE1.1/02
RPNE1.1/03
RPNE1.1/04
RPNE1.1/05
RPNE1.1/06
(T)
(T)
(T)
(T,I)
(I,T)
(E,T)
OTROS; QUE NO HAYAN RECIBIDO UN
TRATAMIENTO PARA ATRAPAR LA FIBRA
EN UN AGLUTINANTE NATURAL O
ARTIFICIAL.
TODOS LOS RESIDUOS PROVENIENTES DE
LOS PROCESOS DE MANUFACTURA CUYA
MATERIA PRIMA SEA EL ASBESTO Y LA
FIBRA SE ENCUENTRE EN FORMA LIBRE,
POLVO O FACILMENTE DESMENUZABLE
CON LA PRESION DE LA MANO.
LOS SIGUIENTES SOLVENTES
HALOGENADOS GASTADOS EN
OPERACIONES DE DESENGRASADO:
TETRACLOROETILENO, TRICLOROETILENO,
CLORURO DE METILENO, 1,1,1TRICLOROETANO, TETRACLORURO DE
CARBONO,
FLUOROCARBONOS CLORADOS Y LOS
SEDIMENTOS O COLAS DE LA
RECUPERACION DE ESTOS SOLVENTES Y
MEZCLAS DE SOLVENTES GASTADOS.
LOS SIGUIENTES SOLVENTES
HALOGENADOS GASTADOS USADOS EN
OTRAS OPERACIONES QUE NO SEA EL
DESENGRASADO: TETRACLOROETILENO,
CLORURO DE METILENO,
TRICLOROETILENO, 1,1,1-TRICLOROETANO,
CLOROBENCENO, 1,1,2-TRICLORO-1,2,2TRIFLUORETANO, O-DICLOROBENCENO,
TRICLOROFLUOROMETANO Y 1,1,2TRICLOROETANO; Y LOS SEDIMENTOS O
COLAS DE LA RECUPERACION DE ESTOS
SOLVENTES Y MEZCLAS DE SOLVENTES
GASTADOS.
LOS SIGUIENTES SOLVENTES GASTADOS
NO HALOGENADOS: XILENO, ACETONA,
ACETATO DE ETILO, ETILBENCENO, ETER
ETILICO, ISOBUTIL METIL CETONA,
ALCOHOL N-BUTILICO, CICLOHEXANONA Y
METANOL: Y LOS SEDIMENTOS O COLAS DE
LA RECUPERACION DE ESTOS SOLVENTES Y
MEZCLAS DE SOLVENTES GASTADOS.
LOS SIGUIENTES SOLVENTES GASTADOS
NO HALOGENADOS: TOLUENO, ETIL METIL
CETONA, DISULFURO DE CARBONO,
ISOBUTANOL, PIRIDINA, BENCENO, 2ETOXIETANOL; 2-NITROPROPANO Y LOS
SEDIMENTOS DE LA RECUPERACION DE
ESTOS SOLVENTES Y MEZCLAS DE
SOLVENTES GASTADOS.
LOS SIGUIENTES SOLVENTES GASTADOS
NO HALOGENADOS: CRESOLES, ACIDO
CRESILICO, NITROBENCENO Y LOS
SEDIMENTOS DE LA RECUPERACION DE
ESTOS SOLVENTES Y MEZCLAS DE
144
RPNEI.1/07
RPNE1.1/08
RPNE1.1/09
RPNE1.1/10
RPNE1.1/11
RPNE1.1/12
(T)
(T)
1.2
RESIDUOS
PROVENIENTES DE
HOSPITALES,
LABORATORIOS Y
CONSULTORIOS
MEDICOS.
SOLVENTES GASTADOS.
RESIDUOS DEL TRI-TETRA-, O
PENTACLOROFENOL PROVENIENTES DE SU
PRODUCCION O DE SU USO COMO
REACTANTE, PRODUCTO INTERMEDIO O
COMPONENTE DE UNA FORMULACION.
RESIDUOS DE TETRA-PENTA-, O
HEXACLOROBENCENO PROVENIENTES DE
SU USO COMO REACTANTE, PRODUCTO
INTERMEDIO O COMPONENTE DE UNA
FORMULACION, BAJO CONDICIONES
ALCALINAS.
RPNE1.1/13
RPNE1.1/14
(B)
RESIDUOS DE SANGRE HUMANA.
RPNE1.2/01
(B)
RESIDUO DE CULTIVO Y CEPAS DE
AGENTES INFECCIOSOS.
RESIDUOS PATOLOGICOS.
RESIDUOS NO ANATOMICOS DE UNIDADES
DE PACIENTES.
RESIDUOS DE OBJETOS PUNZOCORTANTES
USADOS.
RESIDUOS INFECCIOSOS MISCELANEOS
COMO: MATERIALES DE CURACION Y
ALIMENTOS DE ENFERMOS CONTAGIOSOS.
RPNE1.2/02
(B)
(B)
(B)
(B)
RPNE1.2/03
RPNE1.2/04
RPNE1.2/05
RPNE1.2/06
ANEXO 4
TABLA 3.
CLASIFICACION DE RESIDUOS DE MATERIAS PRIMAS QUE SE CONSIDERAN PELIGROSAS EN LA
PRODUCCION DE PINTURAS.
No.DE
MATERIA PRIMA
CLAVE
RESIDUO PELIGROSO
GIRO
CRETIB
1
ACEITES MINERALES, ACIDOS, MONOMEROS Y ANHIDRIDOS.
1.1
PRODUCCION EN GENERAL.
(T)
ACEITES AROMATICOS
(T)
ACEITES NAFTENICOS
(T,I)
ACIDO ACETICO
(T,I)
ACIDO CLORHIDRICO
(I)
ACIDO FUMARICO
(I)
ACIDO ISOFTALICO
(I)
ACIDO ISONONANOICO
(T)
ACIDO OXALICO
(I)
ANHIDRIDO FTALICO
(I)
ANHIDRIDO MALEICO
(I)
ANHIDRIDO TRIMETILICO
(I)
MONOMERO DE ACRILATO DE ETILO
(T)
MONOMERO DE METACRILATO DE
ETILO
(I)
MONOMERO DE METACRILATO DE
ISOBUTILO
2
PEROXIDOS PLASTIFICANTES POLIOLES Y VARIOS
145
No.INE
RPP1.1/01
RPP1.1/02
RPP1.1/03
RPP1.1/04
RPP1.1/05
RPP1.1/06
RPP1.1/07
RPP1.1/08
RPP1.1/09
RPP1.1/10
RPP1.1/11
RPP1.1/12
RPP1.1/13
RPP1.1/14
2.1
PRODUCCION EN GENERAL
3
3.1
PIGMENTOS
PRODUCCION EN GENERAL
4
4.1
RESINAS
DISPERSIONES Y
MICRODISPERSIONES EN AGUA
SINTETICAS EN SOLUCION DE
SOLVENTES
4.2
4.3
4.4
SOLIDAS
SINTETICAS
5
5.1
SOLVENTES
PRODUCCION EN GENERAL
(T)
(T)
(T)
(I)
(I)
(I)
(I)
(T,I)
(R)
(R)
HIDROXIDO DE AMONIO
PEROXIDO DE LAURILO
FTALATO DE BUTIL BENCILO
PENTAERI TRITOL
PROPILEN GLICOL
TRIMETILOL ETANO
TRIMETILOL PROPANO
FORMALDEHIDO
PARAFORMAL DEHIDO
SILICATO DE ETILO
RPP2.1/01
RPP2.1/02
RPP2.1/03
RPP2.1/04
RPP2.1/05
RPP2.1/06
RPP2.1/07
RPP2.1/08
RPP2.1/09
RPP2.1/10
(T)
(T)
(T)
(T)
(T)
(T)
(T)
(T)
(T)
AMARILLO NAFTOL
AZUL FTALOCIANINA
AZUL VICTORIA COLORANTE
NARANJA 29-19 PIRAZOLONA
VIOLETA DE CARBAZOL
AMARILLO CROMO
ROJO MOLIBDATO
NARANJA CROMO 25
NARANJA MOLIBDATO
RPP3.1/01
RPP3.1/02
RPP3.1/03
RPP3.1/04
RPP3.1/05
RPP3.1/06
RPP3.1/07
RPP3.1/08
RPP3.1/09
(T)
RESINA DE TOLUEN DIISOCIANATO
RPP4.1/01
(I)
(T,I)
(T)
(I)
(I)
(T)
(T)
(T)
(R)
(R)
(T)
(R)
(R)
(T)
(T,I)
ALQUIDALICAS DE ACEITE LARGA
ALQUIDALICAS DE ACEITE MEDIO
EPOXICAS
FENOLICAS EN SOLUCION
FUMARICAS
HEMATOXI METIL MELAMINA
MALEICAS
POLIESTER
SILICON ALQUIDAL
SILICONES
URETANOS
NITRO-CELULOSA
POLIAMIDA
POLIESTERES
FENOLICAS MODIFICADAS Y EN
SOLUCION
RPP4.2/01
RPP4.2/02
RPP4.2/03
RPP4.2/04
RPP4.2/05
RPP4.2/06
RPP4.2/07
RPP4.2/08
RPP4.2/09
RPP4.2/10
RPP4.2/11
RPP4.3/01
RPP4.4/01
RPP4.4/02
RPP4.4/03
(I)
(I)
(I)
(I)
(I)
(I)
(I)
(I)
(I)
(I)
ACETATO DE BUTIL CARBITOL
ACETATO DE BUTIL CELLOSOLVE
ACETATO DE CARBITOL
ACETATO DE CELLOSOLVE
ACETATO DE METIL CELLOSOLVE
ACETONA
ALCOHOL DIACETONA
ALCOHOL ETILICO
ALCOHOL ISOBUTILICO
ALCOHOL POLIVINILICO
RPP5.1/01
RPP5.1/02
RPP5.1/03
RPP5.1/04
RPP5.1/05
RPP5.1/06
RPP5.1/07
RPP5.1/08
RPP5.1/09
RPP5.1/10
146
(I)
(I)
(I)
(I)
(T)
(I)
(I)
(T,I)
(T,I)
(I)
(I)
(I)
(T,I)
(T,I)
(I)
(I)
(I)
(I)
(I)
(I)
AROMINA 100
AROMINA 150
BUTANOL
CICLOHEXANONA
CLORURO DE METILENO
ETER METILICO DEL ETILEN GLICOL
ETER MONOBUTILICO DEL
DIETILENGLICOL
ETER MONOETILICO DEL
ETILENGLICOL
ETER MONOPROPILICO DEL
ETILENGLICOL
2-ETIL-HEXILALCOHOL
GAS NAFTA
GAS SOLVENTE
ISOFORONA
METIL ISOBUTILCETONA
2-NITROPROPANO
VMP NAFTA
HEPTANO
HEXANO
ISOPROPANOL
METANOL
RPP5.1/11
RPP5.1/12
RPP5.1/13
RPP5.1/14
RPP5.1/15
RPP5.1/16
RPP5.1/17
RPP5.1/18
RPP5.1/19
RPP5.1/20
RPP5.1/21
RPP5.1/22
RPP5.1/23
RPP5.1/24
RPP5.1/25
RPP5.1/26
RPP5.1/27
RPP5.1/28
RPP5.1/29
RPP5.1/30
TABLA 4
CLASIFICACION DE RESIDUOS Y BOLSAS O ENVASES DE MATERIAS PRIMAS QUE SE CONSIDERAN
PELIGROSAS EN LA PRODUCCION DE PINTURAS.
NO. DE RESIDUOS DE MATERIAS PRIMAS Y CLAVE RESIDUO PELIGROSO
No. INE
GIRO BOLSAS O ENVASES
CRETIB
1
ACIDOS,ANHIDRIDOS MONOMEROS Y PEROXIDOS
1.1
PRODUCCION GENERAL
(I)
ACIDO ACRILICO
RPE1.1/01
(I)
ACIDO AZELAICO
RPE1.1/02
(I)
ACIDO DIMETILPROPIONICO
RPE1.1/03
(I)
ACIDO ETIL 2-HEXOICO
RPE1.1/04
(I)
ACIDO PARATOLUEN SULFONICO
RPE1.1/05
(I)
ACIDO SEBASICO
RPE1.1/06
(T,I)
ACIDO SULFONICO AROMATICO
RPE1.1/07
(T)
ACIDO SULFURICO
RPE1.1/08
(I)
ACIDO TEREFTALICO
RPE1.1/09
(I)
ANHIDRIDO METACRILICO
RPE1.1/10
(I)
ANHIDRIDO SUCCINICO
RPE1.1/11
(I)
ACETATO DE VINILO
RPE1.1/12
(I)
ACRILATO DE BUTILO
RPE1.1/13
(I)
ACRILATO DE METILO
RPE1.1/14
(I)
ESTIRENO
RPE1.1/15
(I)
METACRILATO DE BUTILO
RPE1.1/16
(I)
METACRILATO DE METILO
RPE1.1/17
(T)
HIDROPEROXIDO DE CUMENO
RPE1.1/18
(T)
PEROXIDO DE AZORPE1.1/19
DISISOBUTIRONITRILO
(I,R)
PEROXIDODE BENZOILO
RPE1.1/20
(I,R)
PEROXIDO DE CICLOHEXANONA
RPE1.1/21
(T)
PEROXIDO DE DITERBUTILO
RPE1.1/22
(T,R) PEROXIDO DE METIL ETILCETONA
RPE1.1/23
147
(T,R)
(T,R)
2
2.1
SECANTES,PIGMENTOS Y VARIOS
PRODUCCION EN GENERAL
(T,I)
(T)
(T,I)
(T)
(T,I)
(T)
(T,I)
(T)
(T)
(T)
(T)
4
4.1
RPE1.1/24
RPE1.1/25
(T,I)
(T,I)
(T)
(T)
(T)
(T)
(T)
(T)
(T)
NAFTENATO DE COBALTO
NAFTENATO DE PLOMO
ALCANOATO DE COBALTO
ALCANOATO DE PLOMO
NEODECANATO DE COBALTO
NEODECANATO DE PLOMO
OCTOATO DE COBALTO
OCTOATO DE PLOMO
ALBAYALDE
AMONIACO
ANTIESPUMANTE ORGANICO
FOAMICIDE B-18
DIBUTILAMINA
DIETILENGLICOL
DIETILENTRIAMINA
TIMETIL ETIL AMINA
ETIL METIL CETOXIMA
HIDROQUINONA
HIDROXIDO DE SODIO
LITARGIRIO
MINIO
NITRITO DE SODIO
OXIDO DE MERCURIO
OXIMAS
PLOMO
SALES DE MERCURIO (BIOCIDAFUNGICIDA) POLACIDA
TRIETILAMINA
TRIETILENTE TRAAMINA
TRIFENILFOSFITO
SULFATO DE PLOMO
AMARILLO CADMIO
AMARILLO URAMINA
NARANJA BENCIDINA
ROJO CADMIO
VERDE CROMO 25
(T,I)
(T,I)
(I)
(I)
(T,R)
(Y)
(Y)
ACRILICAS EN SOLUCION
ALQUIDALICAS DE ACEITE CORTA
FENOL-FORMALDEHIDO
FORMALDEHIDO TIPO TRIACINA
ISOCIANATOS
MELAMINA FORMALDEHIDO
UREA FORMALDEHIDO
RPE3.1/01
RPE3.1/02
RPE3.1/03
RPE3.1/04
RPE3.1/05
RPE3.1/06
RPE3.1/07
ACETATO DE AMILO
RPE4.1/01
(T)
(T,I)
(T,I)
(T,I)
(T,I)
(T)
(R)
(T)
(T)
(R)
(T)
(T)
(T)
(T)
3
3.1
PEROXIDO DE TERBUTIL
PERBENZOATO
PEROXI-2-ETIL HEXANOATO
DETERBUTILO
RPE2.1/01
RPE2.1/02
RPE2.1/03
RPE2.1/04
RPE2.1/05
RPE2.1/06
RPE2.1/07
RPE2.1/08
RPE2.1/09
RPE2.1/10
RPE2.1/11
RPE2.1/12
RPE2.1/13
RPE2.1/14
RPE2.1/15
RPE2.1/16
RPE2.1/17
RPE2.1/18
RPE2.1/19
RPE2.1/20
RPE2.1/21
RPE2.1/22
RPE2.1/23
RPE2.1/24
RPE2.1/25
RPE2.1/26
RPE2.1/27
RPE2.1/28
RPE2.1/29
RPE2.1/30
RPE2.1/31
RPE2.1/32
RPE2.1/33
RPE2.1/34
RESINAS
SINTETICAS ENSOLUCION
DESOLVENTES
SOLVENTES
PRODUCCION EN GENERAL
(I)
148
(I)
(I)
(I)
(I)
(I)
(I)
(T,I)
(I)
(I)
(I)
5
6
7
8
9
10
ACETATO DE BUTILO
ACETATO DE ETILO
ACETATO DE ISOAMILO
ACETATO DE ISOPROPILO
ACETATO DE METILO
AGUARRAS
BUTIL CELLOSOLVE
CICLOHEXANO
DIETIL CETONA
ETER METILICO DEL PROPILEN
GLICOL
(I)
GASOLINA INCOLORA
(I)
METIL ETIL CETONA
(T,I)
METIL ISOAMIL CETONA
(T,I)
METIL ISOBUTIL CARBINOL
(T,I)
TOLUENO
(T,I)
XILENO
RESIDUOS DE MATERIAS PRIMAS EN LA PRODUCCION.
RESIDUOS DEL LAVADO CON SOLVENTES.
LODOS DE DESTILACION DE SOLVENTES.
RESIDUOS DEL EQUIPO ANTICONTAMINANTE.
LODOS DEL TRATAMIENTO DE AGUAS RESIDUALES.
LODOS DE LIMPIEZA DE GASES EN EQUIPO DE CONTROL.
RPE4.1/02
RPE4.1/03
RPE4.1/04
RPE4.1/05
RPE4.1/06
RPE4.1/07
RPE4.1/08
RPE4.1/09
RPE4.1/10
RPE4.1/11
RPE4.1/12
RPE4.1/13
RPE4.1/14
RPE4.1/15
RPE4.1/16
RPE4.1/17
ANEXO 5
TABLA 5
CARACTERISTICAS DEL LIXIVIADO (PECT) QUE HACEN PELIGROSO
A UN RESIDUO POR SU TOXICIDAD AL AMBIENTE
NO. DE INE
CONSTITUYENTES
CONCENTRACION MAXIMA
INORGANICOS.
PERMITIDA (mg/l)
C.1.01
ARSENICO
5.0
C.1.02
BARIO
100.00
C.1.03
CADMIO
1.0
C.1.04
CROMO HEXAVALENTE
5.0
C.1.05
NIQUEL
5.0
C.1.06
MERCURIO
0.2
C.1.07
PLATA
5.0
C.1.08
PLOMO
5.0
C.1.09
SELENIO
1.0
NO. DE INE.
C.O.01
C.O.02
C.0.03
C.O.04
C.O.05
C.0.06
C.0.07
C.0.08
C.0.09
C.O.010
C.0.011
C.0.012
TABLA 6
CONSTITUYENTES ORGANICOS
ACRILONITRILO
CLORDANO
o-CRESOL
m-CRESOL
p-CRESOL
ACIDO 2,4-DICLOROFENOXIACETICO
2,4-DINITROTOLUENO
ENDRIN
HEPTACLORO (Y SU EPOXIDO)
HEXACLOROETANO
LINDANO
METOXICLORO
149
CONCENTRACION MAXIMA
PERMITIDA (mg/l)
5.0
0.03
200.0
200.0
200.0
10.0
0.13
0.02
0.008
3.0
0.4
10.0
C.0.013
C.0.014
C.0.015
C.0.016
C.0.017
C.0.018
C.0.019
NITROBENCENO
PENTACLOROFENOL
2,3,4,6-TETRACLOROFENOL
TOXAFENO (CANFENOCLORADO
TECNICO)
2,4,5-TRICLOROFENOL
2,4,6-TRICLOROFENOL
ACIDO 2,4,5-TRICLORO
FENOXIPROPIONICO (SILVEX)
TABLA 7
CONSTITUYENTE ORGANICO VOLATIL
No. DE INE
C.V.01
C.V.02
C.V.03
C.V.04
C.V.05
C.V.06
C.V.07
C.V.08
C.V.09
C.V.010
C.V.011
C.V.012
C.V.013
C.V.014
C.V.015
C.V.016
C.V.017
C.V.018
C.V.019
C.V.020
C.V.021
C.V.022
C.V.023
C.V.024
C.V.025
BENCENO
ETER BIS (2-CLORO ETILICO)
CLOROBENCENO
CLOROFORMO
CLORURO DE METILENO
CLORURO DE VINILO
1,2-DICLOROBENCENO
1,4-DICLOROBENCENO
1.2-DICLOROETANO
1,1-DICLOROETILENO
DISULFURO DE CARBONO
FENOL
HEXACLOROBENCENO
HEXACLORO-1,3-BUTADIENO
ISOBUTANOL
ETILMETILCETONA
PIRIDINA
1,1,1,2-TETRACLOROETANO
1,1,2,2-TETRACLOROETANO
TETRACLORURO DE CARBONO
TETRACLOROETILENO
TOLUENO
1,1,1-TRICLOROETANO
1,1,2-TRICLOROETANO
TRICLOROETILENO
150
2.0
100.0
1.5
0.5
400.0
2.0
1.0
CONCENTRACION MAXIMA
PERMITIDA (mg/l)
0.5
0.05
100.0
6.0
8.6
0.2
4.3
7.5
0.5
0.7
14.4
14.4
0.13
0.5
36.0
200.0
5.0
10.0
1.3
0.5
0.7
14.4
30.0
1.2
0.5
BIBLIOGRAFÍA (texto y anexos)
APHA. 1985. Standard methods for the examination of water and wastewater. AWWA,
APHA, WPCF (American Water Works Association, American Public Health Association,
Water Pollution Control Federation), 16a. ed. Washington, D.C. EEUUA.
APHA. 1995. Standard methods for the examination of water and wastewater. AWWAAPHA-WEF (American Water Works Association, American Public Health Association,
Water Environment Federation). Franson, M.A., Ed.19a. ed. Washington, D.C. EEUUA.
Anónimo. 1990. Efluentes de deshidratadoras, reporte final. Laboratorios Bioquimex, S.A. de
C.V. México, D.F. México.
Baltazar, E. 1993. La aplicación del modelo actual en la capacitación de recursos humanos para
la industria azucarera mexicana. En memorias del Simposio Nacional "La capacitación y
desarrollo tecnológico en el campo cañero mexicano", Agosto 5-7 Xalapa, Veracruz,
México
Batstone, R. 1989. The safe disposal of hazardous waste. A World Bank Technical Paper. Vol.
II. Pp. 551-570. Washington, D.C., EEUUA.
Bazúa-Durán, C. 1994. Reutilización de residuos ácidos de cromo: Una tecnología limpia.
Tesis profesional, Ingeniería Química, Facultad de Química, UNAM. Pp. 18,19. México,
D.F., México.
Bazúa, E., Moreno, M. 1993. Equilibrio líquido-vapor ELV para mezclas, comparación de la
ecuación de estado de Miyano-Masuoka y su regla de mezclado no clásica con la ecuación
de estado de Peng-Robinson. Avances en Ingeniería Química. Pub. Departamento de
Ingeniería Química, UNAM, Cd. Universitaria, México, D.F. México.
Benítez-Sánchez, M. 1989. Estudio monográfico de dos sectores industriales que contribuyen
a la contaminación del agua con Cr VI. Tesis profesional, Ingeniería Química,. Facultad
de Química, UNAM. Pp. 28-30, México, D.F., México.
Bishop, J. 1988.. 911 UV-Visible Spectrophotometer Operation Manual. GBC Scientific
Equipment Pty. Ltd. 2a. ed., Australia.
Brunner, C. R. 1991. Handbook of incineration systems. Mc-Graw Hill. Pp. 9.4, 10.6, 12.8.
Nueva York, EEUUA.
Buelt, J. L. 1989. Standard handbook of hazardous waste treatment. Mc-Graw Hill. Pp. 8121. Nueva York, EEUUA.
Burriel, M. F. 1989. Química analítica cualitativa. Paraninfo. Pp. 418-751. Madrid, España.
Carmona, M.C. 1999. Comunicación personal. México D.F., México.
Castro-González, A., Durán-de-Bazúa, C., Enríquez-Poy, M., Pliego-Bravo, Y. 1998.
Consideraciones en un ingenio azucarero para minimizar las descargas líquidas y mejorar
las condiciones de operación de su planta de tratamiento de aguas residuales. Ingenio,
3(34):2-7 (1998).
Chaux, D., Durán-de-Bazúa, C., Cordovés, M. 1997. Towards a cleaner and more profitable
sugar industry. Pub. UNIDO. An information package on waste minimization and pollution
abatement in the cane sugar industry. Libro derivado del Informe Final de Proyecto
US/INT/91/217/15-01-2, ONUDI-GEPLACEA-UNAM. Eds. Sergio Miranda-da-Cruz y
Ralph Luken. United Nations Industrial Development Organization. Vol. 1, 82 p. y Vol. 2,
40 p. Viena, Austria.
151
Cortinas-de-Nava, C., Gleason, S. 1993. Residuos peligrosos en el mundo y en México.
Secretaría de Desarrollo Social, Instituto Nacional de Ecología. Pp. 20-86 México, D.F.,
México.
Cullinane, M. J. 1986. Handbook for stabilization, solidification of hazardous waste. USEPA,
Hazardous Waste Engineering Research Laboratory, P. 56. Cincinnati Ohio, EEUUA.
Chávez, I. 1995. Tratamiento aerobio de aguas diluídas de cempasúchil en un reactor de
biodiscos. Tesis profesional, Ingeniería Química. Instituto Tecnológico de Tapachula,
Chis., México.
Chávez-Sánchez, I., Ramírez-Burgos, L.I., Pedroza-Islas, R., Durán-de-Bazúa, C. 1995.
Tratamiento aerobio de aguas diluidas de cempasúchil en un reactor de biodiscos.
INFORME TÉCNICO DE PROYECTO CEMPA-01-95. Pub. Prog. Ing. Quím. Amb. y de
Quím. Amb. 93 pags. Facultad de Química, UNAM. México D.F. México.
Chávez, I., Pedroza-Islas, R., Ramírez-Burgos, L.I., Durán-de-Bazúa, C. 1994. VI JORNADAS
CIENTÍFICAS DEL ÁREA DE CIENCIAS QUÍMICAS. Depuración de aguas
residuales del procesamiento de cempasúchil (Tagetes erecta) en un reactor de biodiscos.
Universidad Autónoma de Chiapas, Secretaría Académica, Área de Ciencias Químicas.
Tapachula, Chis., México. Noviembre 27- 29.
Chung, N. K. 1989. Standard handbook of hazardous wastes. Mc-Graw Hill. Pp. 7.21-7.29.
Nueva York, EEUUA.
CMIC, 1998 (Cámara Mexicana de la Industria de la Construcción); Centro de Estudios del
Sector Privado por el Desarrollo Sustentable, 1era Ed., Ed. Cespedes.
DOF. 2001. Diario Oficial de la Federación., 10 de diciembre de 2001. Modificación 5 de marzo
de 2003. México, D.F., México.
DOF. 1996. Diario Oficial de la Federación. Primera sección. Órgano del Gobierno
Constitucional de los Estados Unidos Mexicanos. Secretaría de Desarrollo Social, Sedesol.
Ley General del Equilibrio Ecológico y la Protección al Ambiente. 13 de diciembre de
1996. Pp. 84-120. México, D.F., México.
Durán, C., Noyola, A., Poggi, H.M., Zedillo, L.E. 1994a. Water and energy use in sugar mills and
ethyl alcohol plants. En EFFICIENT WATER USE. ED. H. GARDUÑO-VELASCO Y
F. ARREGUÍN-CORTÉS. PUB. UNESCO-ROSTLAC. ISBN 92-9089-340-0. Pp. 361370. Montevideo, Uruguay.
Durán, C., Noyola, A., Poggi, H.M., Zedillo, L.E. 1994b. Uso del agua y la energía en ingenios
azucareros / alcoholeros. En USO EFICIENTE DEL AGUA. Ed. H. Garduño-Velasco y
F. Arreguín-Cortés. PUB. UNESCO- ROSTLAC. ISBN 92-9089-045-2. Pp. 361-370.
Montevideo, Uruguay.
Durán de Bazúa, C. 1994a. Tratamiento biológico de aguas residuales de la industria química
y de proceso. Departamento de Alimentos y Biotecnología, División de Ingeniería,
Programa de Ingeniería Química Ambiental y Química Ambiental. Facultad de Química,
UNAM., Ciudad Universitaria, México, D.F. México.
Durán-de-Bazúa, C. (Responsable Global). 1994b. Aplicaciones de la biotecnología en la
agroindustria de la caña de azúcar. Rev. IMIQ, 35(9):18-25.
Durán de Bazúa, C. 1987a. Effluents of the food industry in Mexico: Environmental impacts on
soil and water resources and possible solution using the biotechnological approach. Case
problem: The corn industry. En "BIOTECHNOLOGY APPLIED TO
ENVIRONMENTAL PROBLEMS. GLOBAL BIO-CONVERSIONS". Ed. D.L. Wise.
152
Vol. II. Chapter 2. Pp. 75-119. CRC Press Inc. ISBN 0-8493-4509-x. Boca Raton, FLA.
EEUUA.
Durán de Bazúa, C. 1987b. Recycling of Corn Processing Wastes / Reaprovechamiento de
efluentes de la industria del maíz. C. Final project report / INFORME FINAL DE
PROYECTO. 100 pags. Pub. UNAM/UNEP. ISBN 968-36-1644-5. México - Federal
Republic of Germany, UNAM - Universität Karlsruhe (TH). México, D.F. México.
Durán-de-Bazúa, C., Noyola-Robles, A., Poggi-Varaldo, H.M., Zedillo-Ponce-de-León, L.E..
1994. Paquete tecnológico para tratar vinazas de ingenios azucareros alcoholeros: sistema
anaerobio/aerobio. Rev. IMIQ, 35(8):42-47.
Durán-de-Bazúa, C., Noyola, A., Poggi-Varaldo, H.M., Zedillo, L.E. 1991. Biodegradation of
process industry wastewater. Case problem: Sugarcane industry. En "BIOLOGICAL
DEGRADATION OF WASTES". Ed. A. M. Martin. CAP. 17. Pp. 363-388. Elsevier
Science Pub. Ltd. ISBN 1-85166-635-4. Londres, Inglaterra.
Durán-de-Bazúa, C.; Medellín, P.; Noyola, A.; Poggi-Veraldo, H., Zedillo, L. E. 1988.
Caracterización de vinazas y su degradación en un sistema combinado de tres reactores
anaerobios y un reactor aerobio de biodiscos. Tecnol. Ciencia Ed. (IMIQ, Méx.), 3(2):3343.
Espíndola-Zepeda, M. 1992. Evaluación de tecnologías que emplean procesos fisicoquímicos
para el tratamiento de residuos peligrosos. Tesis profesional, Ingeniería Química.
Facultad de Química, UNAM. Pp. 59-120, México, D.F., México.
Fishman, M.J. 1970. Determination of mercury in water. J. Anal. Chem., 93:(11):50-60.
Fochtman, E. G. 1989. Standard handbook of hazardous waste treatment and disposal. McGraw Hill. Pp. 7.41-7.49. Nueva York, EEUUA.
González, H. 1976. Recuperación de plata a partir de jales. Tesis profesional, Ingeniería
Química Metalúrgica. Facultad de Química, UNAM. Pp. 32-40. México, D.F., México.
Hans, S. 1988. Handbook on toxicity of inorganic compounds. Mc-Graw Hill. Pp. 239-251.
419-437, 619-625. Nueva York, EEUUA.
Hernández, M. R. 1997. Proceso físico-químico para eliminar plata, mercurio y cromo, del
residuo generado en la determinación de la demanda química de oxígeno (DQO).
Tesis profesional, Ingeniería Química. Facultad de Química, UNAM. México. D.F.,
México
Jeris, 1992. En “Determinación de componentes orgánicos”. 5220.C. Reflujo cerrado método
titulométrico. Secc. 5-17 a 18. APHA-AWWA-WPCF. Métodos normalizados para el
análisis de aguas potables y residuales. Franson, M.A., Dir. Ed. Ediciones Díaz de
Santos, S.A. Madrid, España.
Jeris, J. S. 1967. A Rapid COD Test, Water and Wastes Engineering, VOL(4):89-91.
Kiang, Y. H. 1982. Hazardous waste processing technology. Ann Arbor Science. Pp. 486, 487,
499-501. Washington, D:C:, EEUUA.
Klomp, E., Clancy, J., Durán-de-Bazúa, C. 1995. Contaminación de aguas y uso de la energía en
la industria azucarera. Una comparación entre México y Holanda. Rev. IMIQ, 36(3):7-26.
Manahan, S. E. 2000. Environmental Chemistry. Lewis Publishers. Michigan, EEUUA.
Manahan, S. E. 1990. Hazardous waste chemistry: Toxicology and treatment. Lewis
Publishers. Pp. 351-353. Michigan, EEUUA.
Manahan, S. E., Larsen, D.W. 1999. “Chemchar” process for gasification of hazardous wastes
and mixed radioactive/hazardous wastes / Proceso “Chem char” para la gasificación de
153
residuos peligrosos y sus mezclas con residuos radioactivos. Tecnol. Ciencia Ed (IMIQ,
Méx), 14(1-2): 44-55.
Manahan, S. E., Larsen, D.W., Durán-Moreno, A., Durán-de-Bazúa, C. 2000. La gasificación
como una opción para la disposición de residuos peligrosos. Rev. IMIQ (Méx), 41(12):35-39 (2000).
O´Brien, L. 1989. Hazardous waste site remediation. Van Nostrand Reinhold. Pp. 128-135. St.
Louis, EEUUA.
Phifer, R. W. 1988. Handbook of hazardous waste management for small quantity
generators. Lewis Publishers. Pp. 134, 135. Michigan, EEUUA.
Pitwell, L.R. 1983. Standard COD. Chem. Brit., 19:907.
Prawda, J. 1984. Métodos y Modelos de Investigación de Operaciones. Vol. II. Modelos
Estocásticos. Ed, Limusa. México, D.F. México.
Ramalho, R. 1990. Tratamiento de Aguas Residuales. Ed. Reverte, S.A. España.
Ramírez-Burgos, L.I., Durán-Domínguez-de-Bazúa, M.C., Enríquez-Poy, M. 2000a. La auditoría
ambiental en los ingenios azucareros: Un ejemplo de aumento de productividad en este
sector industrial. Primera Parte. Ingenio, 5(46):5-7.
Ramírez-Burgos, L.I., Durán-Domínguez-de-Bazúa, M.C., Enríquez-Poy, M. 2000b. La auditoría
ambiental en los ingenios azucareros: Un ejemplo de aumento de productividad en este
sector industrial. Segunda Parte. Ingenio, 5(47):4-8.
SEDESOL. 1993. Secretaría de Desarrollo social, Normas oficiales mexicanas en materia de
protección ambiental. Diario Oficial de la Federación, 22 de octubre. México, D.F.,
México.
Shaw, S. 1989. GBC ScanMaster Scan Manipulation Program for 911 UV/VIS Operation
Manual. GBC Scientific Equipment Pty Ltd., Australia.
Tchobanoglous, G. 1993. Integrated solid waste management. Mc-Graw Hill. Pp. 460-464.
Nueva York, EEUUA.
Valderrama, S. B. 1989. Estudios químicos y biológicos de la biomasa microbiana generada
en un sistema aerobio de tratamiento de aguas residuales de la industria alimentaria.
Tesis profesional, QFB (Tecnología de Alimentos). Facultad de Química, UNAM. México,
D.F. México.
Wentz, C. A. 1989. Hazardous waste management. Mc-Graw Hill. Pp. 156-160, 195-197.
Nueva York, EEUUA.
Willard, H. 1974. Métodos instrumentales de análisis. Ed. CECSA. Pp. 65, 103, 132, 423.
México, D.F., México.
World Bank. 1989. The safe disposal of hazardous wastes. Batstone, J. y Wilson, D., Eds.
Estudio conjunto del Banco Mundial, Organización Mundial de la Salud y el Programa
Ambiental de las Naciones Unidas. Technical Paper No. 93. Vol. I. Pp. 19-32. Nuava York,
EEUUA.
Zámano, A.H., Zedillo-Ponce-de-León, L.E., Durán-de-Bazúa, C. 1991. Tratamiento biológico de
aguas residuales de la industria alcoholera a partir de melazas de caña de azúcar. Informe
Técnico de Trabajo VIN-01-90. UNAM-AZÚCAR-IMPA. Pub. PIQAyQA, Facultad de
Química. UNAM. 100 pags. México, D.F. México.
154
BIBLIOGRAFÍA CONSULTADA
(SIN CITAS EN EL TEXTO)
Allen, E.H. 1975. Chemical oxygen demand: Analysis of organic water in natural and
wastewaters. Washington, D.C. EEUUA.
Ayres, G. 1970. Análisis químico cuantitativo. Harla. México, D.F., México.
Batres, R. 1993. Cálculo de parámetros en una ecuación de estado cúbica para mezclas
multicomponentes. Tesis profesional, Inegiería Química, Facultad de Química, UNAM.
México, D.F. México
Box, G., Hunter, W. 1988. Estadística para investigadores, introducción al diseño de
experimentos, análisis de datos y construcción de modelos. Ed. Reverté, S.A, Barcelona,
España.
Brumblay, R.U. 1969. Análisis cualitativo. CECSA. México, D.F., México.
Camacho-Frías, E. 1991. Separación de metales pesados por cromatografía de líquidos de
alta resolución. Tesis de maestría. Facultad de Química, UNAM. México, D.F., México.
Clifford, D. 1967. Total Oxygen Demand, A New Instrumental Method. American Chemical
Society. Milland, Michigan, EEUUA.
Curtman, L.S. 1959. Análisis químico cualitativo. Manuel Marín y Cía., eds. Barcelona,
España.
Danbrine, E. 1993. Hazardous waste confirmed as safe kiln fuel. Rock Products. St. Louis,
EEUUA.
Encyclopedia of Chemical Technology. 1979. Kirk-Othmer, Eds. John Wiley & Sons Vol. 6,
Nueva York, EEUUA.
Encyclopedia of Physical Science and Technology. 1987. Meyers R. Academic Press Inc. Vol.14,
Orlando, Florida EEUUA.
Freeman, H. M. 1990. Hazardous waste minimization. Mc Graw Hill. Nueva York, EEUUA.
Garza-Vera, E. 1976. Determinación comparativa por fluorimetría, colorimetría y
gravimetría de níquel, plata, aluminio, zinc, y cobre por formación de quelatos. Tesis
profesional, Química. Facultad de Química, UNAM. México, D.F., México.
Griffin, R. D. 1990. Principles of hazardous material management. Lewis Publishers.
Michigan, EEUUA.
Huesca-Barnetche, C. 1995. El “reúso” de residuos peligrosos líquidos como combustible
alterno en hornos para la fabricación del cemento. Tesis profesional, Ingeniería
Química. Facultad de Química, UNAM. México, D.F., México.
Jackman A.P. 1991. Hazardous waste treatment technologies. Noyes Publications. Nueva
Jersey, EEUUA.
Kennedy, J., Neville, A. 1982. Estadística para ciencias e ingeniería 2a. ed. Ed. Harla, Harper y
Row Latinoamericana. México, D.F. México.
López, J. 1971. Manual de estadística para químicos. Ed. Alhambra. Madrid, España.
Reyes, R. 1989. Introducción a los residuos industriales y su disposición final. Tesis
profesional, Ingeniería Química. Facultad de Química, UNAM. México. D.F., México.
Márquez-Vargas, M. 1987. Recuperación de plata para la obtención de nitrato de plata a
partir de residuos de laboratorio. Tesis profesional, Químico Farmacéutico Biologo.
Facultad de Estudios Superiores Cuatitlán, UNAM. México, D.F., México.
155
Miyasako, K. 1992. Legislación, normalización y movimiento transfronterizo de residuos
peligrosos. Primera Reunión Anual del Programa Universitario del Medio Ambiente.
Ciudad Universitaria, México, D.F. México.
Nieves-Acosta, J.F. 1978. Los metales pesados en el mejoramiento de los terrenos. Tesis
profesional, Ingeniería Química. Facultad de Química, UNAM. México, D.F., México.
Pecsok, R.L., Shields, L.D. 1973. Métodos modernos de análisis químicos. Limusa. México,
D.F., México.
Pino, F. 1979. Técnicas experimentales de análisis cualitativo. Urmo. México, D.F., México.
Rinsbom, A. 1979. Formación de complejos en química analítica. Alhambra. Madrid, España.
Rojas-Santamaría, A.L. 1977. Caracterización de las aguas residuales del corredor industrial
Toluca-Lerma. Tesis profesional, Química. Facultad de Química, UNAM. México, D.F.,
México.
Santos-Romo. I. 1975. Análisis de mercurio metálico. Tesis profesional, Química. Facultad de
Química, UNAM. México, D.F., México.
Villalobos-Peñalosa, M. 1987. Método para análisis de cromo y su aplicación en la
caracterización de residuos sólidos industriales. Tesis profesional, Química. Facultad de
Química, UNAM. México, D.F., México.
Varian. 1989. Analytical methods flame atomic absorption spectrometry. Mulgrave. Victoria,
Australia.
Vogel, A. 1974. Química analítica cualitativa. Ed. Kapelusz. Buenos Aires, Argentina.
156