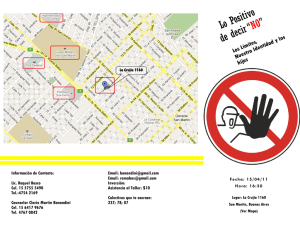
Descargar - Instituto Humboldt
Anuncio

SERIE RECURSOS HIDROBIOLÓGICOS Y PESQUEROS CONTINENTALES DE COLOMBIA IX. RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA Parte I Colombia, Venezuela, Ecuador, Perú, Brasil, Guyana, Surinam y Guayana Francesa: diversidad, bioecología, uso y conservación Carlos A. Lasso, Ricardo S. Rosa, Paula Sánchez-Duarte, Mónica A. Morales-Betancourt y Edwin Agudelo-Córdoba (Editores) © Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. 2014 Impreso en Bogotá, D. C., Colombia, enero de 2014 1.000 ejemplares. Los textos pueden ser citados total o parcialmente citando la fuente. Citación sugerida Obra completa: Lasso, C. A., R. S. Rosa, P. Sánchez-Duarte, M. A. Morales-Betancourt y E. Agudelo-Córdoba (Editores). 2013. IX. Rayas de agua dulce (Potamotrygonidae) de Suramérica. Parte I. Colombia, Venezuela, Ecuador, Perú, Brasil, Guyana, Surinam y Guayana Francesa: diversidad, bioecología, uso y conservación. Serie Editorial Recursos Hidrobiológicos y Pesqueros Continentales de Colombia. Instituto de Investigación de los Recursos Biológicos Alexander von Humboldt (IAvH). Bogotá, D. C., Colombia. 368 pp. SERIE EDITORIAL RECURSOS HIDROBIOLÓGICOS Y PESQUEROS CONTINENTALES DE COLOMBIA Instituto de Investigación de Recursos Biológicos Alexander von Humboldt (IAvH). Editor: Carlos A. Lasso Alcalá. Revisión científica: Antonio Machado-Allison y Donald Taphorn. Revisión de textos: Carlos A. Lasso, Ricardo de Souza Rosa, Paula Sánchez-Duarte, Mónica A. Morales-Betancourt y Edwin Agudelo-Córdoba. Fotos portada: Aniello Barbarino, Carlos A. Lasso y Mónica A. Morales-Betancourt. Fotos contraportada: Oliver Lucanus. Foto portada interior: Mónica A. Morales-Betancourt. Diseño y diagramación: Luisa F. Cuervo G. Impresión: JAVEGRAF – Fundación Cultural Javeriana de Artes Gráficas. Capítulos o fichas de especies: Valentim, F. C., M. C. Gross y E. Feldberg. 2013. Estatus cario-evolutivo de las rayas con énfasis en las especies de agua dulce (Potamotrygonidae). Capítulo 7.2. Pp. 297-309. En: Lasso, C. A., R. de S. Rosa, P. Sánchez-Duarte, M. A. Morales-Betancourt y E. Agudelo-Córdoba (Editores). IX. Rayas de agua dulce (Potamotrygonidae) de Suramérica. Parte I. Colombia, Venezuela, Ecuador, Perú, Brasil, Guyana, Surinam y Guayana Francesa: diversidad, bioecología, uso y conservación. Serie Editorial Recursos Hidrobiológicos y Pesqueros Continentales de Colombia. Instituto de Investigación de los Recursos Biológicos Alexander von Humboldt (IAvH). Bogotá, D. C., Colombia. Rayas de agua dulce (Potamotrygonidae) de Suramérica. Parte I. Colombia, Venezuela, Ecuador, Perú, Brasil, Guyana, Surinam y Guayana Francesa: diversidad, bioecología, uso y conservación. / Carlos A. Lasso [et. al] editores; Serie Recursos Hidrobiológicos y Pesqueros Continentales de Colombia, IX. -- Bogotá: Instituto de Investigación de Recursos Biológicos Alexander von Humboldt, 2013. 368 p.: fotog. col.; 16.5 x 25 cm. Incluye bibliografía y tablas ISBN: 978-958-8343-91-4 1. PECES 2. ICTIOLOGÍA 3. ECOLOGÍA ANIMAL 4. BIOLOGÍA ANIMAL 5. PECES DE AGUA DULCE. 6. RAYAS 7. POTAMOTRYGONIDAE. 8. AMÉRICA DEL SUR. I. Lasso, Carlos A., ed. II. S. Rosa, Ricardo, ed. III. SánchezDuarte, Paula, ed. IV. Morales-Betancourt, Mónica A., ed. V. Agudelo-Córdoba, Edwin, ed. VI. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. CDD: 597.176 Ed. 23 Número de contribución: 489 Registro en el catálogo Humboldt: 14928 Catalogación en la publicación – Biblioteca Instituto Humboldt – Nohora Alvarado Responsabilidad. Las denominaciones empleadas y la presentación del material en esta publicación no implican la expresión de opinión o juicio alguno por parte del Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Así mismo, las opiniones expresadas no representan necesariamente las decisiones o políticas del Instituto, ni la citación de nombres, estadísticas pesqueras o procesos comerciales. Todos los aportes y opiniones expresadas son de la entera responsabilidad de los autores correspondientes. M. A. Morales-B. COMITÉ CIENTÍFICO • • • • • • • • • • • • • • • • • • • • • • Anabel Rial Bouzas (Fundación La Salle de Ciencias Naturales, Venezuela) Aniello Barbarino (Instituto Nacional de Investigaciones Agropecuarias INIA, Venezuela) Antonio Machado-Allison (Universidad Central de Venezuela) Carlos Barreto-Reyes (Fundación Humedales, Colombia) Carlos A. Rodríguez Fernández (Fundación Tropenbos Colombia) Célio Magalhães (Instituto Nacional de Pesquisas da Amazonia INPA/CPBA, Brasil) Donald Taphorn (Universidad Experimental de los Llanos-Unellez, Venezuela) Edwin Agudelo-Córdoba (Instituto Amazónico de Investigaciones CientíficasSinchi, Colombia) Fernando Trujillo (Fundación Omacha, Colombia) Francisco de Paula Gutiérrez (Universidad Jorge Tadeo Lozano, Colombia) Germán Galvis Vergara (Universidad Nacional de Colombia) Hernando Ramírez-Gil (Universidad de los Llanos-Unillanos, Colombia) Hernán Ortega (Universidad Nacional Mayor de San Marcos-UNMSM, Perú) Jaime De La Ossa (Universidad de Sucre, Colombia) John Valbo Jørgensen (Departamento de Pesca y Acuicultura, FAO) Josefa C. Señaris (Instituto Venezolano de Investigaciones Científicas, Venezuela) Luz F. Jiménez-Segura (Universidad de Antioquia, Colombia) Mauricio Valderrama Barco (Fundación Humedales, Colombia) Myriam Lugo Rugeles (Universidad Nacional de Colombia) Ramiro Barriga (Instituto Politécnico de Quito, Ecuador) Ricardo Rosa (Universidad Federal de Paraiba, Brasil) Ricardo Restrepo M. (Universidad Santo Tomas de Aquino-USTA, Colombia) Rosa E. Ajiaco-Martínez (Universidad de los Llanos-Unillanos, Colombia) Acuarela: E. Canetti F. Trujillo TABLA DE CONTENIDO Presentación 9 Prólogo 11 Autores y afiliaciones 13 Agradecimientos 17 Resumen ejecutivo 19 Executive summary 25 Sumário executivo 27 Introducción 31 1. Biogeografía de las rayas de agua dulce (Potamotrygonidae) de América del Sur 39 2. Historia de la investigación de las rayas de agua dulce (Potamotrygonidae): estado actual del conocimiento 49 3. Aspectos metodológicos 63 3.1. Métodos para la captura y análisis de datos bioecológicos de las rayas de agua dulce (Potamotrygonidae) 65 3.2. Utilización de métodos no letales para el estudio de las rayas de agua dulce (Potamotrygonidae) 85 3.3. Trabajo de laboratorio para la identificación de la rayas de agua dulce (Potamotrygonidae) 97 3.4. 4. 5. Elaboración de las fichas de especies 107 Claves para la identificación de las rayas de agua dulce (Potamotrygonidae) 111 4.1. 111 Clave artificial para la identificación de los géneros de la familia Potamotrygonidae 4.2. Clave para la identificación de las especies amazónicas del género Heliotrygon 112 4.3. Clave para la identificación de las especies amazónicas del género Plesiotrygon 113 4.4. 113 Clave para la identificación de las especies del género Potamotrygon 4.5. Chave artificial de identificação para os gêneros da família Potamotrygonidae 117 4.6. Chave de identificação para as espécies amazônicas do gênero Heliotrygon 118 4.7. Chave de identificação para as espécies amazônicas do gênero Plesiotrygon 118 4.8. Chave de identificação para as espécies amazônicas do gênero Potamotrygon 119 4.9. Key to the genera of the family Potamotrygonidae 122 4.10. Key to the species of the genus Heliotrygon 123 4.11. Key to the species of the genus Plesiotrygon 123 4.12. Key to the species of the genus Potamotrygon 124 Catálogo de especies 129 Heliotrygon gomesi 131 Heliotrygon rosai 134 Paratrygon aiereba 137 Plesiotrygon iwamae 157 Plesiotrygon nana 164 6. Potamotrygon boesemani 170 Potamotrygon constellata 172 Potamotrygon dumerilii 176 Potamotrygon falkneri 181 Potamotrygon henlei 184 Potamotrygon humerosa 190 Potamotrygon leopoldi 193 Potamotrygon magdalenae 195 Potamotrygon marinae 207 Potamotrygon motoro 209 Potamotrygon orbignyi 228 Potamotrygon schroederi 247 Potamotrygon scobina 256 Potamotrygon tatianae 261 Potamotrygon tigrina 264 Potamotrygon yepezi 267 Sistemática y citogenética: estado actual, limitaciones y alcances 281 6.1. Aproximación a la filogenia molecular de la familia Potamotrygonidae en Colombia y Venezuela: aplicaciones en sistemática y conservación 283 6.2. Estatus cario-evolutivo de las rayas con énfasis en las especies de agua dulce (Potamotrygonidae) 297 7. Marco normativo y comercialización de las rayas de agua dulce (Potamotrygonidae) en el norte de América del Sur 311 8. Envenenamientos causados por rayas de agua dulce (Potamotrygonidae) en Brasil, con notas sobre países vecinos (Colombia, Venezuela y Ecuador): implicaciones en la salud pública 343 Conclusiones y recomendaciones para la conservación 363 9. Caño Verde. Reserva Natural Privada Bojonawi. Foto: M. A. Morales-Betancourt M. A. Morales-B. M. A. Morales-B. PRESENTACIÓN Hablar de las rayas de agua dulce es remontarme a mis primeros tiempos de estudiante en la Universidad Central de Venezuela. En ese momento (1984) recibí la beca de la Fundación Científica Fluvial de los Llanos, para asistir al Dr. Guillermo LópezCorcuera de la Universidad de los Andes, en lo que llamaron la “Fauna Legendaria”, una iniciativa editorial que involucraba a todos esos “bichos raros” o fauna emblemática y temida de los llanos colombovenezolanos: los caimanes, tembladores o temblones, culebras de agua o güios y por supuesto, las rayas de agua dulce. Ese fue mi primer encuentro con este increíble grupo de peces desconocido para muchos de nosotros hasta entonces, y que desde ese instante me cautivó. Recuerdo el desconocimiento total de los aspectos más básicos -para esa fecha sólo sabía de la existencia de rayas marinasy como de la mano del profesor LópezCorcuera empezamos a recorrer el país buscando rayas, hablando con los pescadores sobre el folclor alrededor de estos animales y como cada vez veía a estos peces más cercanos a nosotros los humanos, que al resto de los peces óseos. Su viviparidad aplacentada, la baja fecundidad, la inversión parental en la cría, la aparente “menstruación de las hembras”, los mitos y leyendas criollos e indígenas, y su mecanismo defensivo tras millones de años de evolución, amén del todo el tema de los envenenamientos y la salud pública, definitivamente nos envolvió. Así, nos dijimos a nosotros mismos, que algún día le daríamos a las rayas el lugar que se merecen en las Ciencias Naturales. De ahí surgió mi primer artículo científico-divulgativo de mi carrera profesional. Nuestras incursiones de aquel entonces fueron palos de ciego frente a una taxonomía muy confusa y a la ausencia de colectas disponibles para su comparación. Sin embargo, el tesón del profesor LópezCorcuera nos llevó a realizar lo que tal vez hoy verían como algo prehistórico en la sistemática molecular: las técnicas de electroforésis en geles de poliacrilamida. Esas técnicas nos permitieron en aquel entonces separar en bandas individuales las distintas proteínas de los extractos de hígado de varias especies rayas y demostrar lo que hoy en día vemos con los análisis de ADN: como la enorme variabilidad cromática se ajusta a las diferentes especies y explica en gran medida la diversidad del grupo. 9 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA PRESENTACIÓN Mucho tiempo pasó desde ese entonces y nos dedicamos a colectar rayas a lo largo y ancho de todo el país, tanto en Venezuela como en Colombia, con la seguridad de que más temprano que tarde se vería cumplido nuestro sueño. Y así fue, tras casi 30 años, gracias al Instituto Humboldt y a todos los socios y colaboradores científicos, es una realidad. Más placentero resulta aún saber, como una iniciativa que incluyó primero sólo a Colombia y a Venezuela en el 2012, fue creciendo e involucró a países vecinos como Ecuador, Perú, las Guayanas y Brasil, y que apenas terminando de escribir este IX volumen de la Serie sobre los Recursos Hidrobiológicos y Pesqueros Continentales de Colombia, ya tenemos la solicitud de otros países hermanos para una segunda parte: Argentina, Bolivia, Paraguay y Uruguay. No puedo terminar esta presentación sin antes agradecer a las autoridades institucionales respectivas, a todo el equipo editorial y en especial a todos los autores de esta obra, por haber creído en nosotros. Carlos A. Lasso Alcalá Instituto de Investigación de Recursos Biológicos Alexander von Humboldt Bogotá, Colombia 10 P. Sánchez-Duarte M. A. Morales-B. PRÓLOGO Prologar esta obra dedicada a una temática para mi tan pletórica de recuerdos gratos y entusiastas esfuerzos, no deja de llenarme de alegría. Cuando por los años sesenta en la ciudad de Santa Fe incursioné en el problema del veneno de las púas de las rayas, me hallé con que poco y nada se sabía en la Ictiología sobre esta familia de elasmobranquios. Con excepción de los historiadores coloniales del río de la Plata y algún naturalista como D’Orbigny, Müller y Henle y Garman, se creía estar ante especies de aguas salobres, lo cual no era así. De tal manera, bajo la guía del maestro Orfila y la Sociedad Internacional de Nomenclatura Zoológica, determinamos conforme a las reglas vigentes que se estaba ante la familia Potamotrygonidae y no Paratrygonidae, y que en aquella se aglutinaban las especies conocidas hasta entonces y a las que se fueron agregando nuevos géneros y especies. Nuestras investigaciones cubrieron así las grandes cuencas atlántica y caribeña suramericanas, así como la de algún gran lago de América Central. Tuve de tal manera en mis manos tipos y paratipos y conocí las colecciones de Harvard, Washington, Nueva York, París, Bruselas, Londres, La Haya y Berlín Oriental. Me hice toda suerte de amigos ictiólogos. La sorpresa empero fue grande cuando en el río Benoue, afluente del Níger, apareció una raya de agua dulce similar a Potamotrygon magdalenae. Me convertí de inmediato en el compañero de ruta en Boston de Darlington y su famosa teoría del desplazamiento de continentes. En efecto, reúnan el golfo africano con la saliente nororiental de Suramérica y verán que las bocas amazónica, orinoquense y del Magdalena, se acercan a la del Níger africano, como si alguna vez hubiera existido un gran mar de agua dulce interior y común a ambos continentes enlazados. No obstante, hoy día sabemos que dichas especies eran en realidad elementos estuarinos pertenecientes a la familia Dasyatidae, que penetraban las aguas dulces. Pero no acabaron allí las sorpresas. La guerra del Vietnam aportó otra sorpresa. En el río Mekong, pleno Laos asiático, otra raya similar de agua dulce hería con sus dardos envenados a los marines. En fin, es 1970, me hallo saliendo de la orden Jesuita y debiendo abandonar todas mis investigaciones y lo que fue peor, perdiendo mi laboratorio que para entonces tenía hasta microscopio electrónico. América Latina y sus avatares políticos son así. Me reespecialicé en medicina forense, campo en el que aún trabajo y tuve la satisfacción de ver que en Butantan aislaron el veneno 11 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA PRÓLOGO de las rayas que yo había estudiado en su acción experimentalmente. Recuerdo con afecto a Russell de Los Ángeles (USA) y a Bruce Halstead que publicó ese gran trabajo sobre animales venenosos marinos del mundo en tres gruesos tomos y que dedicó gran espacio a mis hallazgos. De ambos obtuve los fondos que me permitieron avanzar en gran parte. Lamentablemente creo que la sistemática zoológica terminara de ser una tierra de combate cuando la identificación por ADN sea una realidad accesible. Lo pensé ya en 1970. Lo sigo sosteniendo hoy cuando a diario en el campo forense trabajo en identificaciones criminales. Tal vez si viviera algunos años más y tuviera recursos podría escribir muchos más sobre las experiencias de aquellos tiempos, pero por ahora pese al tan pregonado modelo argentino debo trabajar para vivir y a Dios gracias salud hay que es lo importante. Felicito a los autores de esta magnífica obra y agradezco de corazón el afectuoso reconocimiento. Mariano N. Castex Miembro Decano Academia de Ciencias, Buenos Aires, Argentina 12 M. A. Morales-B. AUTORES Y AFILIACIONES Autoridad Nacional de Acuicultura y Pesca - AUNAP, Colombia Carlos A. Lasso classo@humboldt.org.co Adriana M. Suárez Q. adriana.suarez@aunap.gov.co Juliana Agudelo jagudelo@humboldt.org.co Escuela Politécnica Nacional, Instituto de Ciencias Biológicas, Quito, Ecuador Lina M. Ortiz-Arroyave linaortiza@gmail.com Ramiro Barriga ramiro.barriga@epn.edu.ec Fundación FUNINDES, Colombia Armando Ortega-Lara ictiologo@gmail.com Fundación La Salle de Ciencias Naturales, Museo de Historia Natural La Salle, Venezuela Oscar M. Lasso-Alcalá oscar.lasso1@fundacionlasalle.org.ve María P. Baptiste E. mpbaptiste@humboldt.org.co Mónica A. Morales-Betancourt mmorales@humboldt.org.co Paula Sánchez-Duarte psanchez@humboldt.org.co Instituto de Pesquisas Científicas e Tecnológicas do Estado do Amapá IEPA, Brasil Cecile S. Gama cecilegama@hotmail.com Instituto de Investigación de Recursos Biológicos Alexander von Humboldt, Colombia Instituto Nacional de Investigaciones Agrícolas - INIA, Venezuela Adriana Guzmán guzmadri@hotmail.com Aniello Barbarino Duque abarbarino@inia.gob.ve 13 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA AUTORES Y AFILIACIONES Instituto Nacional de Pesquisas da Amazônia – INPA, Brasil Coordinacion de Biodiversidad - Cbio Laboratorio de Genetica Animal Universidade Federal Rural de Pernambuco - UFRPE, Brasil Laboratorio de Dinámica de Poblaciones Marinas - DIMAR Eliana Feldberg feldberg@inpa.gov.br María Lúcia Goes de Araújo malugaraujo@gmail.com Francisco Carlos de Souza Valentim valentim@inpa.gov.br Universidade Estadual Paulista UNESP, Brasil Facultad de Ingeniería Pesquera Instituto Amazónico de Investigaciones Científicas SINCHI, Colombia Domingos Garrone Neto garroneneto@yahoo.com Astrid A. Acosta-Santos astridacostasantos@gmail.com Facultad de Medicina de Botucatu Cesar A. Bonilla-Castillo biocaesar@gmail.com Vidal Haddad Jr. haddadjr@fmb.unesp.br Edwin Agudelo-Córdoba eagudelo@sinchi.org.co Universidad del Amazonas, Colombia Guber A. Gómez-Hurtado gubersinchi@yahoo.es Parques Nacionales Naturales de Colombia María T. Sierra-Quintero mtsqursa@gmail.com Universidade Federal do Amazonas UFAM, Brasil Instituto de Ciencias Biológicas - ICB Departamento de Biología Laboratoria de Citogenómica Hugo H. Franco-Rojas hugofrancorojas@yahoo.es Marlon Peláez-Rodríguez mpelaez@uniamazonia.edu.co Universidad de los Andes, Bogotá, Colombia Laboratorio de Ecología Molecular de Vertebrados Acuáticos - LEMVA Departamento de Ciencias Biológicas David A. García-Villamil da.garcia25@uniandes.edu.co Maria Claudia Gross m.claudia.gross@gmail.com Susana J. Caballero Gaitán sj.caballero26@uniandes.edu.co Universidade Federal da Paraíba UFPB, Brasil Universidad Jorge Tadeo Lozano, Colombia Ricardo de Souza Rosa rsrosa@dse.ufpb.br Herly B. Ramos-Socha heraso43@gmail.com 14 M. A. Morales-B. Marcela Grijalba-Bendeck marcela.grijalba@utadeo.edu.co Universidad Mayor de San Marcos, Lima, Perú Museo de Historia Natural Universidade de São Paulo - USP Departamento de Zoología, Brasil Instituto de Biociencias João Paulo Capretz Batista da Silva jpcbs@ib.usp.br Hernán Ortega hortega.musm@gmail.com João Pedro Fontenelle jpfontenelle@ib.usp.br Universidade Paulista - UNIP, Brasil Maíra Portella Ragno mairaportella@gmail.com Getulio Rincón zazan143@terra.com.br Universidad Surcolombiana Claudia M. Rodríguez-Sierra rodriguez-sierracm@usco.edu.co Marcelo Rodrigues de Carvalho mrcarvalho@ib.usp.br Thiago Loboda loboda_bio@yahoo.com.br 15 Pesca de Paratrygon aiereba en el río Putumayo. Foto: M. A. Morales-Betancourt M. Sabaj-P. AGRADECIMIENTOS Los editores agradecen al Ministerio de Ambiente y Desarrollo Sostenible de Colombia por el apoyo que permitió la realización y la publicación de este trabajo. A la Directora del Instituto de Investigación de Recursos Biológicos Alexander von Humboldt (IAvH), Brigitte L. G. Baptiste, Johanna Galvis (Oficina Jurídica), Ricardo Carrillo (Oficina de Planeación), así como a la Junta Directiva del IAvH, por haber respaldado la elaboración de este libro en el marco del Plan Operativo Anual 2013 del Programa de Biología de la Conservación y Uso de la Biodiversidad. A los profesores Antonio Machado-Allison y Donald Taphorn por la revisión técnica del documento. A la AUNAP de Colombia por la información estadística suministrada, y en especial a nivel regional, a Luis G. Rojas (Inírida), por su colaboración. A la Directora del Instituto Amazónico de Investigaciones Científicas Sinchi, Luz M. Mantilla, y a los investigadores y funcionarios que nos apoyaron en Leticia y Puerto Leguízamo. A la Fundación Omacha, especialmente a su Director, Fernando Trujillo por su continuo apoyo en este proceso, información sobre el uso de las especies y material fotográfico. El apoyo en campo fue invaluable: Puerto Carreño (Bayker Castañeda, Esther Marín, Alejandro Sibleszi, Eugenia Escarriá); Puerto Nariño (Lorena Ortíz). También a los pescadores de Pto. Carreño (Clímaco Unda, Wilson Aya y Javier Aya). Las expediciones a la Estrella Fluvial de Inírida (2008) fueron financiadas por WWF Colombia, Corporación para el Desarrollo Sostenible del Norte y Oriente Amazónico-CDA y la Fundación La Salle de Ciencias Naturales (Museo de Historia Natural). Nuestro agradecimiento particular a Jose Saulo Usma, Cesar Meléndez y Josefa C. Señaris. En el 2012 contamos con la participación en campo de Isidro González, Delio Suárez, Wilbert D. Suárez, Gustavo López-Vargas y Eastman Uribe. Los editores agradecen a los colegas que aportaron información adicional inédita, bibliografía y fotografías: Akemi Shibuya, Alberto Fernández-Yépez, Amyra Cabrera, Anabel Rial, Arnaldo Ferrer, Admilson Torres, Ariel Trujillo, Camilo Rincón, Camm C. Swift, Carmen Montaña, Christian Cramer, Cristiano Burmester, C. Gómez, Dennis Lizarro, Donald C. Taphorn, Elkin Argumedo, Elkin Briceño, Francisco Mijares, Francisco Nieto, Germán Galvis, Geraldo M. Santos, Hugo P. Castello, Iván J. Negrete, Juan Alfredo Ximenez, Jaime Hernández, Jayson de Barros Huss, Joao P. Lima, Josefa C. Señaris, Julio Robles, Justa Fernández, Leo Nico, Lisiane Hahn, 17 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA AGRADECIMIENTOS Luz. F. Jiménez-Segura, L. F. Goncalves, Mariano Castex, María D. Escobar, Mark Sabaj-Pérez (apoyado en parte por el proyecto XINGU - NSF DEB-1257813), Madeleine I. Oetinger, Max Hidalgo, Mónica del P. Martínez, Mauricio Pinto Almeida, Natalia Ortiz, Nathan Lujan, Maurício P. Almeida, Michael Goulding, Ning Labbish Chao, Oliver Lucanus, Rafael Antelo, Ricardo M. Corrêa e Castro, Semillero Yuma Challwani - Universidad Surcolombiana, Thomas B. Thorson (q.e.p.d.), Toru Taniuchi y Tulia S. Rivas. A los curadores de las colecciones ictiológicas y museos que enviaron la información: Otto Castillo (MCNG), Francisco Villa-Navarro (UT), Francisco Provenzano (UCV), Luz F. Jiménez-Segura (UA), Francisco Bisbal (EBRG), José I. Mojica (UNAL-ICN), Claudia Medina (IAvH). Especial agradecimiento a Carlos Montaña por su asistencia en Villa de Leyva. Gracias A Eliane Canetti por haber cedido gentilmente sus obras artísticas. Aniello Barbarino agradece a los pescadores comerciales de rayas del río Apure; a los técnicos de pesca del INIA Apure por su esfuerzo en los trabajos de campo, y al Instituto Humboldt por gestionar a través de sus integrantes la posibilidad de la creación de este aporte. En memoria del investigador Rafael Aparicio, quien en su vida apoyó sin condición la investigación en el INIA Apure. Cecile de Souza Gama agradece al Gobierno del Estado de Amapá, Secretaría de Estado del Medio Ambiente, que fueron los órganos financiadores de su trabajo y a la Universidad Federal de Paraíba, donde estaba matriculada en el curso de doctorado, programa de post graduación en Ciencias Biológicas, durante la ejecución del mismo. Getulio Rincon agradece al Dr. 18 Miguel Petrere por su amistad, comentarios, correcciones y orientación en el texto original. Al Consejo Nacional de Desenvolvimiento Científico y Tecnológico-CNPq por las becas de doctorado y posdoctorado. Hernán Ortega Torres agradece a Vanessa Correa, Max Hidalgo, Thiago Loboda y Maira Ragno. Lyda Marcela Grijalba Bendeck agradece el apoyo institucional del Departamento de Ciencias Biológicas y Ambientales, Programa de Biología Marina, Facultad de Ciencias Naturales e Ingeniería de la Universidad de Bogotá Jorge Tadeo Lozano, Bogotá y Santa Marta. Marcelo Rodrigues de Carvalho agradece a la Fundación para el Apoyo a la Investigación del Estado de São Paulo (FAPESP) y el Consejo Nacional de Desarrollo Científico y Tecnológico (CNPq) por el apoyo financiero. Oscar M. Lasso-Alcalá agradece a José Luis González (Museo de Historia Natural La Salle, FLASA, Venezuela). Manuel González-Fernández (Museo de la Estación Biológica de Rancho Grande, MPPA, Maracay, Venezuela). Glenys Andrade de Pasquier (Estación Local El Lago, INIA, Maracaibo, Venezuela) y Alberto Fernández-Badillo (Instituto de Zoología Agrícola, FAGRO, UCV, Maracay, Venezuela). Ricardo S. Rosa agradece a los científicos por aporte en material, información sobre la presencia de especies y/o fotografías de rayas de agua dulce amazónicas: Camm C. Swift, Donald C. Taphorn, Fernando Marques, Geraldo M. Santos, Hugo P. Castello, Maurício P. Almeida, Michael Goulding, Ning Labbish Chao, Ricardo M. Corrêa e Castro, Toru Taniuchi y el fallecido Thomas B. Thorson. O. Lasso-Alcalá M. A. Morales-B. RESUMEN EJECUTIVO En el marco del Plan Operativo Anual (2013) del Programa de Biología de la Conservación y Uso de la Biodiversidad del Instituto de Investigación de Recursos Biológicos Alexander von Humboldt, se llevó a cabo la iniciativa “Rayas de agua dulce (Potamotrygonidae) de Suramérica. Parte I. Colombia, Venezuela, Ecuador, Perú, Brasil, Guyana, Surinam y Guayana Francesa: diversidad, bioecología, uso y conservación”, proyecto que forma parte de una línea de trabajo a largo plazo sobre los recursos hidrobiológicos y pesqueros continentales de Colombia y su relación con las cuencas transfronterizas. Para liderar este proceso editorial se contó con la participación de la Universidade Federal da Paraiba de Brasil, el Instituto Humboldt y el Instituto Amazónico de Investigaciones Científicas SINCHI de Colombia, junto a 20 organizaciones (universidades, ONG, autoridades pesqueras, entre otras) de cinco países. Este incluyó la colaboración y coautoría de 39 expertos que aportaron información al documento. Este libro surge como una respuesta a la necesidad de describir de la mano de expertos en taxonomía, sistemática, citogenética, biología, ecología acuática, biología pesquera, normativa, comercio y salud pública, lo relativo a la diversidad, bioecología, uso y conservación de las rayas de agua dulce (Potamotrygonidae) de Suramérica. En esta primera parte se consideró a Colombia, Venezuela, Ecuador, Perú, Brasil (cuenca amazónica fundamentalmente) y las Guayanas (Guyana, Surinam y Guayana Francesa). Se persigue a futuro, complementar dicho estudio con los todos países restantes del área de distribución de la familia en América del Sur (excepto Chile), complementado con datos novedosos de proyectos que ya se están adelantando. Las rayas de agua dulce son un recurso biológico, económico (pesca ornamental y consumo) y sanitario de gran trascendencia en nuestro continente. La familia Potamotrygonidae es un grupo muy complejo desde el punto de vista taxonómico y se clasifican en cuatro géneros, uno monotípico (Paratrygon Duméril 1865), otros dos con dos especies cada uno (Plesiotrygon, Rosa, Castello y Thorson 1987 y Heliotrygon Carvalho y Lovejoy 2011) y otro multiespecífico (Potamotrygon Garman 1877), con unas 20 especies reconocidas como válidas hasta el momento. Estudios en desarrollo indican que todavía hay una diversidad desconocida en el 19 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA RESUMEN EJECUTIVO grupo, con especies aun por describir de los géneros Heliotrygon, Paratrygon y Potamotrygon, en las cuencas de Brasil, Colombia, Perú y Venezuela. De manera global, se reconocen en la actualidad -sin contar las especies no descritas-, 25 especies de rayas de agua dulce: Heliotrygon (2 sp.), Paratrygon (1 sp.), Plesiotrygon (2 sp.) y Potamotrygon (20 sp.). Brasil es el país con la mayor riqueza (17 sp.), seguido de Colombia (11 sp.), Perú (10 sp.), Venezuela, Ecuador y Argentina (5 sp. c/u), Paraguay (4 sp.), Uruguay (3 sp.) y finalmente Bolivia y las Guayanas (Guyana, Surinam y Guayana Francesa), con dos especies cada uno. No obstante, es importante mencionar que todavía hay muchos vacíos espaciales en cuanto a las prospecciones ictiológicas, especialmente en países como Venezuela, Ecuador, Colombia y Bolivia. El libro incluye nueve capítulos. El primero muestra una panorámica general de la biogeografía de la familia; el segundo trata la historia de la investigación de los potamotrigónidos; el tercero hace referencia a los diferentes enfoques metodológicos para el estudio en campo (métodos de captura y métodos no letales) y laboratorio y el cuarto recoge por primera vez las claves para la identificación de los géneros y especies de la familia. El quinto capítulo está centrado en el catálogo de las 21 especies de rayas reconocidas en los ocho países 20 objeto del estudio. Estas fichas consideran toda la información disponible sobre la taxonomía de la especie (diagnosis, validez, sinonimias); distribución geográfica; talla y peso; hábitat; alimentación; aspectos reproductivos; usos (ornamental, alimento, medicinal); aspectos pesqueros; comercialización, marco normativo, estatus de conservación y amenazas. El capítulo seis recoge los avances en sistemática y citogenética de las rayas, mediante un análisis de sus alcances y limitaciones. Incluye un estudio cario-evolutivo y muestra resultados inéditos sobre la filogenia molecular de la familia en Colombia y Venezuela, con sus aplicaciones en sistemática y conservación a nivel regional. El capítulo siete analiza todo el marco normativo y de comercialización -de acuerdo a la información disponible- para Colombia, Venezuela, Ecuador, Perú y Brasil. El capítulo ocho considera los aspectos relativos a los envenenamientos y lesiones causadas por rayas, sus implicaciones sobre la salud pública, así como detalles sobre su epidemiología, aspectos clínicos, tratamientos y prevención. Finalmente, todos estos insumos, se recogen las principales conclusiones y se dan las recomendaciones para la conservación. En la tabla 1 se sintetiza toda la información disponible sobre la distribución, historia natural, uso y categoría de amenaza para las 21 especies de rayas estudiadas. Cuencas Am Am Am Or Am Países Br, Col, Pe, Ec? Br, Pe Br, Bo, Col, Ec, Pe Col, Ve Br, Col, Ec, Pe Especie Heliotrygon gomesi Heliotrygon rosai Paratrygon aiereba (Amazonas) Paratrygon aiereba (Orinoco) Plesiotrygon iwamae 113,5 ♀ 24 ♂ (Ve) 19,5 ♀ 18,4 ♂ 1570 ♀ 1140 ♂ (Ve) 165 ♀ - 520 ♂ (Col, Pe) 650 (Br) Ic - Ent - Car Ic - Car 60 (Br) 38 ♀ - 42 ♂ (Col) Ic - Ent - Car 17,4 ♂ 21,5 ♀ (Ec) 1300 (Br) 850 ♀ - 760 ♂ (Col) 900 (Ec) Hábitos alimenticios 6,2 ♀ (Col) Peso máx. (kg) 577 (Br) 597 ♀ (Col) Talla máx. AD (mm) 370 500 (Br) 430 (Ec) 500 (Col, Pe) 420 (Br) 390 (Ec) 581 (Br RN) 460 (Col) 520 (Ec) 3 a 5 (Br RN) 3 (Col) FO (huevos) Reproducción TMS ♀ (mm) 447 546 (Br RN) TMS ♂ (mm) 2 (promedio) 1 a 5 (Ec) 1a8 2 (Br - RN) 1 a 7 (Ec) FU (embriones) NE-Global NE-Global Categoría de amenaza Orn (Col) DD - Global Al (Ve), Orn DD - Global (Col), VU (2ad) Col Me (Col, Ve) Al (Br) Orn (Col, Br, DD - Global Pe) VU (2ad) Col Me (Col) Orn Orn Uso Países: Ar (Argentina), Bo (Bolivia), Br (Brasil), Col (Colombia), Ec (Ecuador), GF (Guayana Francesa), Gu (Guyana), Pa (Paraguay), Pe (Perú), Su (Surinam), Ur (Uruguay), Ve (Venezuela). Cuencas: Am (Amazonas), Ama (Amapá), Ap (Approuague), At (Atrato), Car (Caribe), Cor (Corantijn), Es (Essequibo), In (Inini), La (Lawa), Mg-Ca (Magdalena – Cauca), Mar (Maroní), Mbo (Maracaibo), Me (Mearim), Or (Orinoco), Oy (Oyapoc), Pa – Pg (Paraná – Paraguay), Pr (Parnaíba), Pl (La Plata), RN (Río Negro), Su (Surinam), Ta (Tampoc), To (Tocantins). Hábitos alimenticios: Car (carcinófago), Ent (entomófago), Ic (ictiófago), Mal (malacófago), Pol (poliquetófago). Reproducción: TMS (talla madurez sexual), FO (fecundidad ovárica), FU (fecundidad uterina). Uso: Al (alimenticio), Me (medicinal), Orn (ornamental). Categoría de amenaza: CR (En Peligro Crítico), DD (Datos Deficientes), LC (Preocupación Menor), NT (Casi Amenazada), VU (Vulnerable). Tabla 1. Resumen de la información geográfica, historia natural, uso y categoría de amenaza para las 21 especies de rayas consideradas. Para mayor detalle ver fichas de especies. R. Barriga 21 22 Am Cor Am Br, Col, Pe Su Br, Col, Ec, Pe? Br Bo, Br, Pe Br Br Br Col GF, Su Plesiotrygon nana Potamotrygon boesemani Potamotrygon constellata Potamotrygon dumerilii Potamotrygon falkneri Potamotrygon henlei Potamotrygon humerosa Potamotrygon leopoldi Potamotrygon magdalenae Potamotrygon marinae 390 In, La, Mar, Oy, Ta 1,5 ♂ 6,1 ♀ 323 ♂ 476 ♀ Car, Mag-Ca 20 332 1,9 ♂ 17 ♀ 346 ♂ 710 ♀ 4,3 278 ♀ 483 ♂ 13 (Col) 16,8 ♀ 16,2 ♂ (Ec) 550 (Col) 310 ♀ - 290 ♂ (Ec) 432 Hábitos alimenticios Ent Ent - Mal - Ic Car - Pol - Ent 12,4 ♀ (Col, Pe) 0,3 ♂ (Col) 0,3 ♂ (Br) Peso máx. (kg) 427 (Su) 523 ♀ (Col, Pe) 165 ♂ (Col) 243 ♂ - 202 ♀ (Br) Talla máx. AD (mm) 720 Am Am Am Am, PaPg, Pl Am Cuencas Países Especie 390 234 234 230 (At) 210 (At) 151 (Mg) 164 (Mg) 105 270 300 1 a 11 1a3 390 254 (Br Ama) 300 272 (Br Ama) FO (huevos) Reproducción TMS ♀ (mm) 359 (Col) 359 (Col) 320 (Ec) 310 (Ec) 377 (Su) 163 (Col, Pe) TMS ♂ (mm) 1a9 1a9 1a3 4 a 11 (Col) 3 a 10 (Ec) FU (embriones) Al, Me, Orn Orn Orn (Col, Pe) Uso NE - Global NT - Col NT - Global DD - Global NE - Global NE - Global NE-Global NE-Global DD - Global NE-Global NE-Global Categoría de amenaza RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA RESUMEN EJECUTIVO Países Col, Ve Talla máx. AD (mm) Am, Or Am, Or Br, Col, Ve Br, Col, Ec Pe Pe Col, Ve Potamotrygon schroederi Potamotrygon scobina Potamotrygon tatianae Potamotrygon tigrina Potamotrygon yepezi Mbo Am Am Or Col, Ve Am, Ap, Es, Su Or Hábitos alimenticios 1,8 ♂ 4,5 ♀ > 258 ♂ > 250 ♀ 380 ♂ 560 ♀ 6 ♂ (Br) 9 ♀ (Br) 5,6 ♂ (Col) 590 ♂ (Br) 617 ♀ (Br) 490 ♂ (Col) 362 (Pe) 10,5 ♀ - 5,6 Ent - Car - Ic ♂ (Col, Ve) 612 ♀- 524 ♂(Col, Ve) Ent Ic Car - Ic Ent - Car 5,8 ♂ (Ve) 26,5 ♀ (Ve) 490 ♂ (Ve) 770 ♀ (Ve) Ent - Car Ent - Car - Ic 3,9 ♂ (Br) 6,4 ♀ (Br) 4,2 ♂ 3,5 ♀ 20 (Br) 11♀ - 7,3 ♂ (Col, Pe) Ent - Car - Ic 16,5 ♀ 17,8 ♂ (Ec) Peso máx. (kg) 370 ♂ (Br) 460 ♀ (Br) 442 ♂ 395 ♀ 700 (Br) 518 ♀ - 427 ♂ (Br) Am, Es, Me, 625 ♀ - 520 Pa, Pr ♂ (Col, Pe) 280 ♀ - 320 ♂ (Ec) Cuencas Potamotrygon orbignyi (Orinoco) Br, Col, Potamotrygon Gu, GF, orbignyi (Amazonas Per, Su, y otras cuencas) Ve Potamotrygon motoro (Orinoco) Ar, Bo, Br, Col, Potamotrygon Ec, Gu, motoro (Amazonas) Pa, Pe, Ur, Ve Especie 440 (Br) 300 (Col) 340 (Ec) 6 a 11 (Br) FO (huevos) Reproducción TMS ♀ (mm) 118 400 141 200 370 (Col) 440 (Br RN) 395 (Ve) 420 (Br RN) 350 185 (Ve) 244 (Br) 444 (Br RN) 230 (Ve) 251 (Br) 390 (Br RN) 1a3 4 Al, Orn Orn Orn 1 a 3 (Br - RN) 2 (Col Or) 3 a 7 (Br RN) Orn Orn Al, Orn Uso Orn 2 (promedio) (Br - RN) 1 (Br - To) 1a7 15 a 25 (Br) 1 a 5 (Col) 5 a 10 (Ec) FU (embriones) 1 a 4 (Col) 1 a 2 (Col) 4 a 17 (Ve) 1 a 17 (Ve) 3 a 7 (Br RN) 1 a 5 (Br - To) 300 (Col, 225 (Col, 1a4 Ve) Ve) 390 (Br) 380 (Ec) TMS ♂ (mm) VU (B2biii) - Col DD - Global NE - Global NE - Global DD - Global VU (A4d) Col DD - Global NT - Col LC - Global NT - Col LC - Global DD - Global VU (A4d) Col DD - Global VU (A4d) Col Categoría de amenaza R. Barriga 23 Río Purus, Brasil. Foto: F. Trujillo M. A. Morales-B. EXECUTIVE SUMMARY Within the framework outlined of our Annual Operations Plan (2013) the Conservation Biology and Biodiversity Use Program of the Instituto de Investigación de los Recursos Biológicos Alexander von Humboldt, has produced a book titled: “Freshwater Stingrays (Potamotrygonidae) of South America. Part I. Colombia, Venezuela, Ecuador, Peru, Brazil, Guyana, Suriname and French Guiana: Diversity, Bioecology, Use and Conservation”, a project that is part of our long term commitment to the study of the hydrobiological resources and continental fisheries of Colombia and shared-border river watersheds. This research was led by scientists from the Universidade Federal da Paraiba de Brazil, the Instituto Humboldt and the Instituto Amazónico de Investigaciones Científicas SINCHI of Colombia, and in the editorial project contributions from 20 organizations of five countries have been included (universities, NGOs, fishery agencies, and others). This book arises from the need to have experts synthesize and concentrate our knowledge of the taxonomy, systematic, cytogenetics, biology, aquatic ecology, fishery biology, fishing regulations, commerce, public health, diversity, use and conservation of the freshwater stingrays (Potamotrygonidae) of South America. In this first part Colombia, Venezuela, Ecuador, Peru, Brazil (primarily the Amazon Basin) and the Guianas (Guyana, Suriname and French Guiana) are included. In a future volume, this study will be continued to include all the remaining countries of South America (except Chile) where freshwater stingrays occur and report new information from projects still in progress. Freshwater stingrays are a significant biological and economic (ornamental and human consumption) resource and of great concern for public health. The family Potamotrygonidae is a complex taxonomic group of four genera, one monotypic (Paratrygon Dumeril 1865), two with two species each (Plesiotrygon Rosa, Castello and Thorson 1987 and Heliotrygon Carvalho and Lovejoy, 2011) and one multispecies genus (Potamotrygon Garman 1877), that at present has about 20 nominal species. Studies underway indicate that there is still much unrecognized diversity in the group, with new species to be described in the genera Heliotrygon, Paratrygon and Potamotrygon, from Brazil, Colombia, Peru and Venezuela. 25 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA EXECUTIVE SUMMARY We currently recognize - excluding undescribed species - 25 species of freshwater stingrays: Heliotrygon (2 sp.), Paratrygon (1 sp.), Plesiotrygon (2 sp.) and Potamotrygon (20 sp.). Brazil is the country with the most species (17 sp.), followed by Colombia (11 sp.), Peru (10 sp.), Venezuela, Ecuador and Argentina (5 sp.), Paraguay (4 sp.), Uruguay (3 sp.) and finally Bolivia and the Guianas (Guyana, Suriname and French Guiana), with two species each. However, it should be noted that the freshwater fishes of many regions are still very poorly surveyed especially in Venezuela, Ecuador, Colombia and Bolivia. This book has nine chapters. The first presents the general panorama of the biogeography of the family; the second summarizes the history of potamotrygonid research; the third gives a review of the field methods (specimen capture and non-lethal) and laboratory procedures used to study stingrays. The fourth chapter puts together for the first time, keys to identify all the genera and species of the family. The fifth is a catalog of the 21 species from the eight countries covered in this study. The species accounts include information about the taxonomy of the species (diagnosis, validity, synonymy); 26 geographic distribution; size and weight; feeding habits; reproduction; uses (ornamental, food, medicinal); fishery aspects; commercialization; legal framework (fishing regulations); conservation and threat status. Chapter six gives systematic and cytogenetic progress for the study of stingrays using achievement/shortcoming analysis. It includes a karyotype evolution study and results of unpublished molecular phylogenetic studies of species from Colombia and Venezuela, and consideration of the regional implications of results for systematics and conservation. In chapter seven, fishery regulations and the commercialization process are considered, based on information available from Colombia, Venezuela, Ecuador, Peru and Brazil. Chapter eight deals stingray wounds and envenomation, implications for public health, and details on epidemiology, clinical aspects, treatment and injury prevention. Finally, based on this information, conclusions are drawn and conservation recommendations are made. Table 1 (page 21). Briefly summarizes information on distribution, natural history, use and threat category for the 21 species of rays studied. M. A. Morales-B. M. A. Morales-B. SUMÁRIO EXECUTIVO Como parte do Plano Operativo Anual (2013 ) do Programa de Biologia da Conservação e Uso da Biodiversidade do Instituto de Investigação dos Recursos Biológicos Alexander von Humboldt, desenvolveu-se a iniciativa “ Raias de água doce (Potamotrygonidae) da América do Sul . Parte I. Colômbia, Venezuela, Equador, Peru, Brasil , Guiana, Suriname e Guiana Francesa: diversidade, bioecologia, uso e conservação”, projeto que faz parte de uma linha de trabalho de longo prazo sobre os recursos hidrobiológicos e pesqueiros de águas continentais da Colômbia e sua relação com as bacias transfronteiriças. Para liderar este processo, contou-se com a participação da Universidade Federal da Paraíba no Brasil, do Instituto Humboldt e do Instituto Amazônico de Investigações Científicas SINCHI da Colômbia, para desenvolver um projeto editorial com 20 organizações (universidades, ONGs, autoridades de pesca, entre outros) em cinco países. Ele incluiu a colaboração e coautoria de 39 especialistas que forneceram informações valiosas para o documento. Este livro surge como uma resposta à necessidade de descrever, a partir de especialistas em taxonomia, sistemática, citogenética, biologia, ecologia aquática, biologia pesqueira, regulamentação, comércio e saúde pública , a diversidade, a bioecologia, uso e conservação das raias de água doce (Potamotrygonidae) da América do Sul . Nesta primeira parte consideraram-se a Colômbia, Venezuela, Equador, Peru, Brasil (bacia amazônica, principalmente) e Guianas (Guiana, Suriname e Guiana Francesa). Pretende-se no futuro, complementar o estudo com todos os países restantes da área de distribuição da família na América do Sul (exceto Chile), inserindo novos dados de projetos que estão em andamento. As raias são consideradas um recurso biológico e econômico (pesca ornamental e consumo), além de terem grande importância em questões de saúde no nosso continente. A família Potamotrygonidae é um grupo muito complexo do ponto de vista taxonômico, no qual são classificados quatro gêneros, um monotípico (Paratrygon Duméril, 1865), dois com duas espécies cada (Plesiotrygon Rosa, Castello e Thorson, 1987 e Heliotrygon Carvalho e Lovejoy, 2011) e um multiespecífico (Potamotrygon Garman, 1877), com cerca de 20 espécies reconhecidas como válidas até o momento. Estudos em andamento indicam que ainda há uma diversidade desconhecida no 27 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA SUMÁRIO EXECUTIVO grupo, com espécies ainda a serem descritas nos gêneros Heliotrygon, Potamotrygon e Paratrygon, nas bacias do Brasil, Colômbia, Peru e Venezuela. De modo geral, são reconhecidas atualmente, sem contar as formas não descritas, 25 espécies de raias de água doce: Heliotrygon (2 sp.), Paratrygon (1 sp.), Plesiotrygon (2 sp.) e Potamotrygon (20 sp.). O Brasil é o país com a maior riqueza (17 sp.), seguido pela Colômbia (11 sp.), Peru (10 sp.), Venezuela, Equador e Argentina (5 sp.) Paraguai (4 sp.) , Uruguai (3 sp.) e, finalmente, a Bolívia e as Guianas (Guiana, Suriname e Guiana Francesa), com duas espécies cada. No entanto, é importante mencionar que ainda existem muitas lacunas geográficas nas prospecções ictiológicas, especialmente em países como a Venezuela, Equador, Colômbia e Bolívia. O livro inclui nove capítulos. O primeiro traz uma visão geral da biogeografia da família, o segundo é a história da investigação dos potamotrygonídeos, o terceiro refere-se às diferentes abordagens metodológicas para o estudo de campo (armadilhas métodos e métodos não letais) e de laboratório e o quarto reúne pela primeira vez, chaves para a identificação de gêneros e espécies da família. O quinto capítulo centra-se no catálogo das 21 espécies reconhecidas de raias nos oito países pesquisados. Essas fichas consideraram 28 todas as informações disponíveis sobre a taxonomia das espécies (diagnóstico, validade, sinônimos), distribuição geográfica, altura e peso, habitat, alimentação, aspectos reprodutivos, usos (ornamental, alimentar, medicinal), aspectos pesqueiros, comercialização, marco regulatório, estado de conservação e ameaças. O capítulo seis descreve o progresso da sistemática e citogenética das raias, através de uma análise de seus alcances e limitações. Inclui um estudo cário-evolutivo e apresenta resultados inéditos sobre a filogenia molecular da família na Colômbia e Venezuela, com suas aplicações em sistemática e conservação em nível regional. O sétimo capítulo analisa todo o quadro de regulamentação pesqueira e de comércio, de acordo com a informação disponível para a Colômbia, Venezuela, Equador, Peru e Brasil. O capítulo oito considera os aspectos de envenenamentos e lesões causadas pelas raias, suas implicações na saúde pública, bem como detalhes sobre a sua epidemiologia, quadro clínico, tratamento e prevenção. Finalmente, a partir de todas estas informações, apresentam-se as principais conclusões e recomendações para a conservação. A tabela 1 (página 21) sintetiza as informações disponíveis sobre a distribuição, história natural, uso e categoria de ameaça para as 21 espécies de raias estudadas. Laguna Charapa, cerca del río Tuputini, Ecuador. Foto: R. Barriga. Ciénaga de Paredes. Puerto Wilches. Foto: N. Ortíz A. I. Shibuya INTRODUCCIÓN Carlos A. Lasso, Ricardo S. Rosa, Mónica A. Morales-Betancourt, Paula SánchezDuarte y Edwin Agudelo-Córdoba Las rayas de agua dulce se agrupan en la familia Potamotrygonidae. Son un grupo de peces muy diversificado en Suramérica y se encuentran en la mayoría de los ríos tropicales del continente, excepto en aquellos que drenan al Pacífico y en las cuencas de la costa Atlántica al sur del río Parnaíba en Brasil, hasta el Río de La Plata (Brooks et al. 1981, Rosa 1985, Rosa et al. 2010), incluyendo todos los países de América del Sur, excepto Chile. Los potamotrigónidos son muy complejos desde el punto de vista taxonómico y se clasifican en cuatro géneros, uno monotípico (Paratrygon Duméril 1865), otros dos con dos especies cada uno (Plesiotrygon, Rosa, Castello y Thorson 1987 y Heliotrygon Carvalho y Lovejoy 2011) y otro multiespecífico (Potamotrygon Garman 1877), con unas 20 especies reconocidas como válidas hasta el momento. Los estudios en marcha indican que todavía hay una diversidad desconocida en el grupo, con especies aún por describir de los géneros Heliotrygon, Paratrygon y Potamotrygon, en las cuencas de Brasil, Colombia, Perú y Venezuela (Carvalho, Lasso y Rosa, obs. pers.). Hay aún otras especies que tienen un estatus taxonómico dudoso y necesitan estudios adicionales para decidir acerca de su validez. Entre estas se mencionan las siguientes especies amazónicas: Potamotrygon garrapa (Schomburgk 1843) y Potamotrygon ocellata (Engelhardt 1912) de Brasil, y Potamotrygon humboldti (Roulin 1865) de Colombia. De manera global, se reconocen en la actualidad -sin contar las especies no descritas-, 25 especies de rayas de agua dulce: Heliotrygon (2 sp.), Paratrygon (1 sp.), Plesiotrygon (2 sp.) y Potamotrygon (20 sp.). Brasil es el país con la mayor riqueza (17 sp.), seguido de Colombia (11 sp.), Perú (10 sp.), Venezuela y Argentina (5 sp.), Ecuador y Paraguay (4 sp. c/u), Uruguay (3 sp.) y finalmente Bolivia y las Guayanas (Guyana, Surinam y Guayana Francesa), con dos especies cada uno (Tabla 1). No obstante, es importante mencionar que todavía hay muchos vacíos en cuanto a las prospecciones ictiológicas, especialmente en países como Colombia, Venezuela, Ecuador y Bolivia. 31 Heliotrygon gomesi Carvalho y Lovejoy 2011 Heliotrygon rosai Carvalho y Lovejoy 2011 Paratrygon aiereba (Müller y Henle 1841) Plesiotrygon iwamae Rosa, Castello y Thorson 1987 Plesiotrygon nana Carvalho y Ragno 2011 Potamotrygon boesemani Rosa, Carvalho y Wanderley 2008 Potamotrgon brachyura (Günther 1880) Potamotrygon constellata (Vaillant 1880) Potamotrygon dumerilii (Castelnau 1855) Potamotrygon falkneri Castex y Maciel 1963 Potamotrygon henlei (Castelnau 1855) Potamotrygon hystrix (Müller y Henle 1841) Potamotrygon humerosa Garman 1914 Especies x x x x x Colombia Venezuela x Ecuador x x x Perú x x x x x x Brasil x x x x x x x x x x x Guyana Surinam x Guayana Francesa Argentina x x x Bolivia x x x Uruguay 32 x x x Paraguay Amazonas Paraná-Paraguay, Río de La Plata Amazonas Amazonas, ParanáParaguay, Río de La Plata Amazonas Amazonas Paraná-Paraguay Corantijn Amazonas Amazonas Amazonas, Orinoco Amazonas Amazonas Cuencas Tabla 1. Lista de la especies de rayas de agua dulce (Potamotrygonidae) de América del Sur y su distribución por países y cuencas. RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA INTRODUCCIÓN Potamotrygon orbignyi (Castelnau 1855) Potamotrygon schroederi Fernández-Yépez 1957 Potamotrygon scobina Garman 1913 Potamotrygon tatianae Silva y Carvalho 2011 Potamotrygon schuehmacheri Castex 1964 Potamotrygon signata Garman 1913 Potamotrygon tigrina Carvalho, Sabaj-Pérez y Lovejoy 2011 Potamotrygon yepezi Castex y Castello 1970 Potamotrygon motoro (Müller y Henle 1841) Potamotrygon leopoldi Castex y Castello 1970 Potamotrygon magdalenae (Duméril 1865) Potamotrygon marinae Deynat 2006 Especies Tabla 1. Continuación. x x x x x x x x x x Colombia Venezuela Ecuador x x Perú x x x x Brasil x x x x x x Guyana x x Surinam x Guayana Francesa x x Argentina x x Bolivia x Uruguay x Paraguay x Maracaibo Amazonas Parnaíba Paraná Amazonas Amazonas, Orinoco Amazonas, Orinoco Magdalena, Atrato y San Jorge (Caribe) Inini, Maroní, Oyapoc, Tampoc Amazonas, Orinoco, Mearím, Paraná-Paraguay, Parnaiba, Paraguay, Essequibo Amazonas, Orinoco, Essequibo, Parnaíba Amazonas Cuencas F. Mijares 33 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA INTRODUCCIÓN Son peces cartilaginosos (Chondrichthyes) caracterizados y diferenciados de otras rayas cercanas de hábitos marinos y/o estuarinos (Dasyatidae y Urotrygonidae), por tener un proceso prepélvico extendido o alargado. El cuerpo es en forma de disco, circular u oval, deprimido y la boca está en posición ventral. Tienen cinco pares de aberturas ventrales y un par de espiráculos branquiales dorsales. Exhiben dimorfismo sexual (forma y tipo de dientes) y así como en todos los condríctios, los machos tienen órganos copuladores o “claspers” también conocidos como mixoterigios, para la fecundación interna. Tanto los machos como las hembras pueden realizar migraciones de carácter reproductivo. Generalmente están restringidas a las aguas dulces, aunque hay especies que pueden tolerar ciertos niveles de salinidad como en Brasil (delta del Amazonas) (Charvet-Almeida 2001, Almeida 2008, Almeida et al. 2009), el estuario de Lago de Maracaibo (Lasso obs. pers.) y el delta del Orinoco (Rodríguez-Guerra et al. 2008). A pesar de estar completamente adaptadas al agua dulce, también tienen una glándula rectal vestigial, que es responsable de la excreción del exceso de sales en los peces marinos cartilaginosos, lo que constituye una clara evidencia de su ascendencia u origen marino. Son por lo general de hábitos alimenticios entomófagos, comedores de invertebrados, carcinófagos en muchos casos (Potamotrygon spp) o ictiófagos (Paratrygon aiereba, Potamotrygon sppindividuos de gran talla) (ver p. e. Lasso et al. 1996, Barbarino y Lasso 2005, 2009, Moro et al. 2011, Shibuya et al. 2009, entre otros). En algunos países como Venezuela, Brasil y Colombia, son objeto de una pesquería comercial con fines alimenticios (p. e. Paratrygon Barbarino y Lasso 2005, 2009, 34 Charvet-Almeida et al. 2002) y por supuesto en la pesca de subsistencia por parte de las comunidades indígenas e incluso rurales en toda su área de distribución (Lasso 1985). Tienen una gran importancia como recurso pesquero ornamental, especialmente en Colombia, Perú y Brasil, donde son objeto de aprovechamiento y representan un aporte económico muy importante a las comunidades locales. Son vivíparos aplacentados, de estrategia “K” o de equilibrio, como sus congéneres marinos (rayas y tiburones), caracterizados por una baja fecundidad, crecimiento lento, cuido parental parcial, maduración tardía, con eventos reproductivos anuales o interanuales, a veces sincronizados con el régimen hidrométrico (Lasso 1985, CharvetAlmeida et al. 2005). Estas características las hacen ser muy vulnerables frente a los impactos antrópicos como la pesca incidental, la comercial con fines de consumo y sobre todo, la pesca ornamental. A pesar de su amplia distribución y abundancia en ciertas regiones de Suramérica, no han sido estudiadas en profundidad. Esto determina en gran medida el desconocimiento taxonómico a pesar de los últimos esfuerzos (Rosa et al. 2010, Carvalho y Lovejoy 2011) y por ende de otros aspectos bioecológicos. Según Brooks et al. (1981), parte del desconocimiento radica en los siguientes aspectos: 1) algunas de las descripciones originales son incompletas (basadas a veces en un solo ejemplar) y en ocasiones sin ilustraciones; 2) variabilidad intraespecífica en los patrones de coloración (policromatismo); 3) posible existencia de ejemplares híbridos y 4) falta de colecciones intensivas en muchas cuencas y colecciones representativas en los museos o colecciones ictiológicas. Aunado a la importancia científica de este grupo de peces por las razones expuestas F. Mijares previamente, debe considerarse su impacto en la población rural y en especial en los pescadores artesanales, comerciales, deportivos y turistas, a causa de los accidentes ocasionados por las picaduras de las rayas. Estos peces son de hábitos bentónicos y viven posados en el fondo. Presentan en la cola una o más espinas o púas aserradas de origen dérmico (aguijones), recubiertas de células que secretan veneno, que clavan como un mecanismo defensivo cuando son atacadas o pisadas accidentalmente (Castex y Loza 1964, Lasso 1985, Haddad Jr. et al. 2013). Esta situación genera un impacto muy importante sobre las comunidades locales e incluso sobre el ganado y animales domésticos, de ahí su importancia en la salud pública. Es por ello, que la correcta identificación de las rayas, constituye el primer paso para caracterizar la toxicidad de las diferentes especies y desarrollar tratamientos clínicos adecuados. Una vez alcanzado este objetivo, pueden desarrollarse proyectos de investigación multidisciplinarios con médicos, bioquímicos y administradores de la salud pública, a objeto de tratar desde el punto de vista epidemiológico y terapéutico, los envenenamientos causados por las rayas. Vemos entonces como las rayas de agua dulce tienen importancia no sólo científica, sino también económica (alimento y ornamental) y para la salud pública. Es por ello, que con esta publicación, hemos tratado de llenar estos vacíos, tal que contribuyan al conocimiento taxonómico, biológico, ecológico, pesquero, comercial, normativo y sanitario, de este importante grupo de peces en América del Sur. En esta primera entrega se ha considerado a Colombia, Venezuela, Brasil (cuenca amazónica), Ecuador, Perú y las Guayanas (Guyana, Surinam y Guayana Francesa), con toda la información disponible hasta el momento, incluyendo datos inéditos de países como Colombia y Venezuela, donde el avance ha sido importante en estos últimos diez años. Nuestra meta es a futuro, una segunda parte, donde se considere la información de los otros países hermanos del área de distribución de la familia Potamotrygonidae (Bolivia, Paraguay, Argentina, Uruguay), incluyendo las cuencas extra-amazónicas de Brasil, así como los nuevos avances en el conocimiento (historia natural, sistemática molecular y descripción de nuevas especies), que al cierre de esta edición, ya están en marcha y ofrecerán resultados innovadores. Bibliografía • • • • • Almeida, M. P. 2008. História natural das raias de água doce (Chondrichthyes: Potamotrygonidae) na ilha de Marajó (Pará-Brasil). Tesis Doctoral, Museu Paraense Emílio Goeldi, Universidade Federal do Pará, Belém. 64 pp. Almeida, M. P., R. B. Barthem, A. S. Viana y P. Charvet-Almeida. 2009. Factors affecting the distribution and abundance of freshwater stingrays (Chondrichthyes: Potamotrygonidae) at Marajó island, mouth of the Amazon River. Panamerican Journal of Aquatic Sciences 4: 1–11. Barbarino, A. y C. A. Lasso. 2005. Pesquería y aspectos biológicos de la raya manta Paratrygon aiereba (Müller y Henle 1841) (Myliobatiformes, Potamotrygonidae), en el río Apure (Venezuela). Memoria de la Fundación La Salle de Ciencias Naturales 163: 93-108. Barbarino, A. y C. A. Lasso. 2009. La pesca comercial de la raya manta Paratrygon aiereba (Müller y Henle 1841) (Myliobatiformes, Potamotrygonidae), en el río Apure (Venezuela). Acta Apuroquia 1 (1): 24-31. Brooks D. R., T. B. Thorson y M. A. Mayes. 1981. Freshwater stingrays (Potamotrygonidae) and their helminth parasites: testing hypotheses of evolution 35 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA INTRODUCCIÓN • • • • • • • 36 and coevolution. Pp 147–175. En: Funk, V. A. y D. R. Brooks (Eds.). Advances in cladistics, Proceedings of the First Meeting of the Willi Hennig Society. New York Botanical Garden, New York, USA. Carvalho, M. R. y N. R. Lovejoy. 2011. Morphology and phylogenetic relationships of a remarkable new genus and two new species of Neotropical freshwater stingrays from the Amazon basin (Chondrichthyes: Potamotrygonidae). Zootaxa 2776: 13-48. Castex, M. N. y F. Loza. 1964. Etiología de la enfermedad paratrygónica: estudio anatómico, histológico y funcional del aparato agresor de la raya fluvial americana. Revista de la Asociación Médica Argentina 78: 314– 324. Charvet-Almeida, P. 2001. Ocorrência, biologia e uso das raias de água doce na baía de Marajó (Pará, Brasil), com ênfase na biologia de Plesiotrygon iwamae (Chondrichthyes: Potamotrygonidae). Tesis Doctoral, Museu Paraense Emílio Goeldi, Universidade Federal do Pará, Belém. 213 pp. Charvet-Almeida, P., M. L. G. Araújo, R. S. Rosa y G. Rincón. 2002. Neotropical Freshwater Stingrays: diversity and conservation status. Shark News 14: 1-2. Charvet-Almeida, P., M. L. G. Araújo y M. Pinto de Almeida. 2005. Reproductive aspects of freshwater stingrays (Chondrichthyes: Potamotrygonidae) in the Brazilian Amazon Basin. Journal Northwestern Atlantic Fisheries Sciences 35: 165-171. Haddad Jr., V., J. L. C. Cardoso y D. Garrone Neto. 2013. Injuries by marine and freshwater stingrays: history, clinical aspects of the envenomations and current status of a neglected problem in Brazil. Journal of Venomous Animals and Toxins including Tropical Diseases 19: 1-11. Lasso, C. A. 1985. Las rayas de agua dulce. Natura 77: 6-9. • • • • • • Lasso, C. A., A. Rial y O. Lasso-Alcalá. 1996. Notes on the biology of the freshwater stingrays Paratrygon aiereba (Müller & Henle, 1841) and Potamotrygon orbignyi (Castelnau, 1855) (Chondrichthyes: Potamotrygonidae) in the venezuelan Llanos. Aqua, Journal of Ichthyology & Aquatic Biology 2 (3): 39-50. Moro, G.; P. Charvet y R. S. Rosa. 2011. Aspectos da alimentação da raia de água doce Potamotrygon orbignyi (Chondrichthyes: Potamotrygonidae) da bacia do rio Parnaíba, nordeste do Brasil. Revista Nordestina de Biologia 20: 47-57. Rodríguez-Guerra, J. C., C. A. Lasso y O. M. Lasso-Alcalá. 2008 (“2007”). Aportación al conocimiento de la bioecología de la raya fluvio-estuarina Potamotrygon sp. (Myliobatiformes, Potamotrygonidae) en el delta del Orinoco y golfo de Paria, Venezuela. Memoria Fundación La Salle de Ciencias Naturales 168: 93-113. Rosa, R. 1985. A systematic revision of the South American freshwater stingrays (Chondrichthyes: Potamotrygonidae). Tesis Doctoral. Williamsburg, College of William and Mary, Virginia. 523 pp. Rosa, R. S., P. Charvet-Almeida y C. C. D. Quijada. 2010. Biology of the South American potamotrygonid stingrays. Pp. 24186 En: Carrier, J. C., J. A. Musick y M. R. Heithaus (Eds.). Sharks and their relatives II: Biodiversity, adaptive physiology and conservation. Taylor & Francis Group, New York, USA. Shibuya, A., M. L. G. Araújo y J. A. S. Zuanon. 2009. Analysis of stomach contents of freshwater stingrays (Elasmobranchii, Potamotrygonidae) from the middle Negro River, Amazonas, Brazil. Pan-American Journal of Aquatic Sciences 4 (4): 466 – 475. Caño Mosco, afluente del río Bita. Foto: M. A. Morales-Betancourt Caño Cristales, PNN La Macarena. Foto: C. A. Lasso M. A. Morales-B. 1. Biogeografía de las rayas de agua dulce (Potamotrygonidae) de América del Sur Ricardo S. Rosa y Carlos A. Lasso Los estudios biogeográficos sobre las rayas de agua dulce neotropicales aún muestran un conocimiento incompleto sobre la taxonomía, distribución y filogenia del grupo, así como sobre la paleogeografía de América del Sur, lo que dificulta particularmente, la aplicación de los métodos de la biogeografía histórica. Sin embargo, algunas hipótesis preliminares acerca de la biogeografía histórica de este grupo se han propuesto y son las que se discutirán en este capítulo. Biogeografía descriptiva La distribución geográfica de la familia Potamotrygonidae se limita a la región neotropical y se extiende por varias cuencas que desembocan en el océano Atlántico, desde el río Atrato en el norte de Colombia, hasta el sur en el Río de La Plata, entre Argentina y Uruguay. Sin embargo, existe una brecha en la distribución del grupo entre las cuencas costeras desde el río Parnaíba, en el noreste de Brasil y el Río de La Plata (Rosa 1985, Rosa et al. 2010). Tampoco hay representantes de la familia en la vertiente Pacífica de la cordillera andina Occidental, y por lo tanto, de todos los países de América del Sur, la distribución de la familia sólo excluye a Chile (Rosa 1985, Rosa et al. 2010). La presencia de especies del género Potamotrygon en el río São Francisco en Brasil, de acuerdo a los registros de ejemplares capturados durante la expedición Thayer en el siglo XIX, fue considerada un error, una vez que no se han encontrado posteriormente otros ejemplares en la cuenca (Rosa 1985, Rosa et al. 2010). Considerando la división zoogeográfica de América del Sur definida con base en la fauna de peces de agua dulce de Eigenmann (1910) y modificadas por Géry (1969) y Lowe-McConnell (1975), los Potamotrygonidae están representados en las regiones de la Orinoquia, Magdalénica, Transandina, Paranense, Guyano-Amazónica y ausentes de las regiones Andina, Patagónica, Este-Brasileña y Transandina al sur de Colombia (Rosa 1985), así como también de las subdivisiones andinas Puna, Chile Central, Subantártica y Patagónica presentadas por Posadas y Ortiz-Jaureguizar (2010). La distribución geográfica de los géneros de la familia (Figura 1) es distinta, siendo 39 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA BIOGEOGRAFÍA Heliotrygon y Plesiotrygon exclusivamente amazónicos, mientras que Potamotrygon tiene la distribución más amplia, con presencia en la Amazonia, en las cuencas costeras entre el río Atrato en Colombia y el río Parnaíba en Brasil, y en la cuenca del río Paraguay-Paraná hasta casi su desembocadura en el Río de La Plata. En la cuenca alta del río Paraná, incluyendo sus afluentes Paranapanema y Tietê en Brasil, una invasión reciente de dos especies del género Potamotrygon ocurrió después de perturbaciones humanas como la construcción de embalses, especialmente el de Itaipú, que eliminó la barrera natural del Salto Sete Quedas o Guaira en el río Paraná (Haddad Jr. 2005, Toffoli 2006, Garrone Neto y Haddad Jr. 2007, Garrone Neto et al. 2007). Paratrygon está presente tanto en la Amazonia como en la Orinoquia. Estudios y observaciones recientes, confirman la presencia del género Heliotrygon en la cuenca del Orinoco en Venezuela (Ishihara y Taniuchi 1995, Carvalho y Lovejoy 2011, Lasso datos no publicados). La mayor diversidad filogenética y riqueza de especies de potamotrigónidos se encuentran en la Amazonia. Filogenia y origen evolutivo de las rayas de agua dulce A pesar de que la ascendencia marina de los potamotrigónidos es por lo general, reconocida, todavía hay mucha controversia sobre el pariente más cercano de este grupo entre las rayas marinas, y si este grupo invadió el continente de América del Sur desde las costas del Atlántico o del Pacífico (Rosa et al. 2010). Esencialmente se han postulado ancestros entre los Dasyatidae (géneros Dasyatis, Himantura y Taniura) (Miyake 1988, Nishida 1990, Dingerkus 1995, McEachran et al. 1996, Lovejoy 1996, Marques 2000) o entre los Urolophidae y Urotrygonidae (géneros Urobatis, Urolophus y 40 Urotrygon) (Brooks et al. 1981, Thorson et al. 1983, Rosa 1985, Rosa et al. 1987, Quijada 2003, Dunn et al. 2003, Carvalho et al. 2004, Rosa et al. 2010). Tampoco hay consenso sobre las relaciones internas entre los géneros de la familia y tanto Plesiotrygon como Paratrygon fueron considerados como el género basal de la familia (Rosa et al. 2010). De manera similar se ha señaldo que las espécies de Plesiotrygon podrían pertenecer al género Potamotrygon (Toffoli 2006, Toffoli et al. 2008, Carvalho y Ragno 2011). Con base en estas diferentes hipótesis filogenéticas, se han propuesto diversos escenarios biogeográficos para el origen de las rayas de agua dulce en America del Sur. Estos escenarios suelen dividirse en modelos dispersionistas o vicariantes, es decir, el ancestro marino invadiendo el continente en uno o más episodios distintos, posiblemente a partir de la costa Atlantica, o el ancestro que quedó “atrapado” o aislado en las cuencas de agua dulce después de las incursiones marinas sobre el continente, fueran estas a partir de la costa Atlantica o Pacífica (Brooks et al. 1981, Rosa 1985, Lovejoy 1997, Lovejoy et al. 1998, Carvalho et al. 2004, Rosa et al. 2010). Biogeografía histórica Brooks et al. (1981), con base en datos parasitológicos, propusieron que los potamotrigónidos están más relacionados con las rayas marinas del género Urolophus (actualmente las formas americanas són tratadas en el género Urobatis). Mediante la distribución reciente de este género e informaciones paleogeográficas, estos autores establecieron la hipótesis del origen Pacífico para los potamotrigónidos a partir de un ancestro marino que quedó “atrapado” en el mar epicontinental, tras el proceso de la orogenia de los Andes. M. A. Morales-B. Figura 1. Distribución de los géneros de la familia Potamotrygonidae. Los asteriscos (azul) representan el género Heliotrygon, cuadrados (verde) Paratrygon, triángulos (negro) Plesiotrygon y círculos (rojo) Potamotrygon. Cada símbolo puede representar más de un espécimen o localidad. 41 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA BIOGEOGRAFÍA Rosa (1985) y Rosa et al. (1987) concuerdan con la hipótesis filogenética de Brooks et al. (1981), aunque también argumentaron que la distribución reciente de Urobatis no sería un hecho decisivo para indicar un origen Pacífico, ya que que el género se encuentra también representado en el Atlántico por una especie (U. jamaicensis), no citada por Brooks y colaboradores. No obstante, la distribución conocida de Plesiotrygon podría apoyar la hipótesis del origen Pacífico a partir de la orogenia de los Andes, una vez que sus registros eran todos de la cuenca alta del río Amazonas. Lovejoy (1996), con base en datos morfológicos, propuso una hipótesis filogenética indicando al género anfiamericano Himantura -que todavía debe tratarse de un género distinto de las Himantura del Indo-Pacifico según Lovejoy (1996, 1997) y Compagno (2005)-, como el grupo hermano de los potamotrigónidos. Lovejoy (1996) planteó modelos biogeográficos alternativos a la hipótesis de Brooks et al. (1981), incluyendo transgresiones marinas sobre el continente suramericano, que ocurrieron incluso antes de la orogenia andina. Estos modelos son también vicariantes, una vez que las regresiones marinas que se sucedían a las trangresiones, podrían quebrar una distribución ancestral más amplia, dejando parte de la población en ambientes anteriormente ocupados por el mar epicontinental y que progresivamente fueron transformandose en salobres y finalmente en agua dulce. Citando a Rosa (1985), Lovejoy (1996) ponderó que la cuestión del origen Atlántico versus Pacífico no se justificaba, una vez que estos océanos estaban ampliamente conectados desde el Paleoceno superior hasta la emergencia del Istmo de Panamá en el Plioceno Inferior. 42 Lovejoy (1997) y Lovejoy et al. (1998) continuaron con las discusiones sobre los ancestros, el tiempo y el origen de los potamotrigónidos, considerando de nuevo a las Himantura anfiamericanas como el grupo hermano (ver Capítulo 6.1 para una topología presentada por estos últimos autores). Lovejoy (1997) expuso críticas a los métodos y datos de Brooks et al. (1981), que llevaron a la hipótesis del origen Pacífico de los potamotrigónidos. Con base en la información paleo-geográfica disponible -que la porción norte de la cuenca amazónica drenaba por el proto-Orinoco hacia la región donde hoy se encuentra el Lago de Maracaibo en el Caribe (Hoorn et al. 1995), este autor, planteó que el ingreso del ancestro marino en América del Sur podría haber ocurrido en el Oligoceno Tardío a finales del Mioceno Medio, cuando este drenaje estuvo activo, o incluso desde el Cretáceo Temprano a partir del Atlántico o Caribe, cuando América del Sur y África empezaron a separarse. Hoberg et al. (1998) incluyeron a los Potamotrygonidae en una hipótesis filogenética basada en parásitos gnathostomátidos. Sus resultados mostraron que la relación de grupo hermano entre las Himantura anfiamericanas y los Potamotrygonidae (sensu Lovejoy 1996) no se podía corroborar, ya que se basaba en un sólo carácter homoplásico, y por el contrario, indicaron que los Potamotrygonidae eran más afines a los géneros Urolophus y Taeniura del Océano Pacífico. Así, sus resultados no proporcionaron evidencias de un origen Atlántico de los potamotrigónidos, sino que apoyaron firmemente un origen Pacífico. Marques (2000), con base en datos moleculares y parasitológicos, volvió a confirmar a las Himantura anfiamericanas, como el M. A. Morales-B. grupo hermano de los potamotrigónidos e incluso sugirió que Potamotrygon no sería monofilético, una vez que Potamotrygon yepezi y una especie no descrita del Río Negro, tenían más afinidad filogenética con Plesiotrygon que con otras especies de Potamotrygon (ver Capítulo 6.1 para una topología presentada por estos autores). Partiendo de dos eventos paleo-geográficos (el surgimiento del Istmo de Panamá y el aislamiento del Lago de Maracaibo) para calibrar el reloj molecular, Marques (2000) calculó que la divergencia entre los potamotrigónidos y su ancestro marino ocurrió entre el Oligoceno Inferior y Mioceno Inferior (hace 19 millones de años), pero con la inclusión de un intervalo de confianza, este evento podría haber ocurrido entre 6 y 38 millones de años. En este contexto, Marques destacó la importancia de las incursiones marinas en el continente suramericano, que tuvieron lugar desde el Cretácico al Mioceno Medio (Harrington 1962, Räsänen et al. 1995, Hoorn 1996, Lundberg et al. 1998, Wesselingh 2006), y la conexión anfipanameña entre el Pacífico oriental y el Caribe, como determinantes en el proceso vicariante de esta divergencia. Carvalho et al. (2004), utilizando caracteres morfológicos de géneros fósiles y actuales de rayas para evaluar las relaciones entre los Myliobatiformes, rechazaron las afinidades previamente propuestas de las Himantura anfiamericanas y Taeniura con las rayas de agua dulce (Potamotrygonidae). Estos autores también rechazaron la diferenciación de los potamotrigónidos en el Mioceno, y en su lugar, abogaron por un origen anterior, datado por lo menos desde finales del Eoceno Temprano o incluso antes, en el Cretácico. También apoyaron el escenario biogeográfico de las transgresiones marinas, como un mecanismo para la invasión del ancestro marino en el continente suramericano, rechazando el papel de las transgresiones marinas en el Lago Pebas para el establecimiento de los ancestros marinos, dado su carácter reciente. En su lugar, afirmaron que las transgresiones del Cretácico Tardío fueran más consistentes con la edad mínima derivada de su filogenia. Con respecto a la datación temprana de la diferenciación de los potamotrigónidos, otros autores indicaron datos interesantes en esta dirección. La presencia de elementos fósiles de potamotrigónidos (dientes y tubérculos cutáneos) con edad miocénica en las cuencas del Amazonas y Paraná (Deynat y Brito 1994, Räsänen et al. 1995, Brito y Deynat 2004), señalan la presencia mucho antes de estas rayas en el continente suramericano, una vez que no hay evidencia de conexiones entre las dos cuencas en el Mioceno (Lundberg et al. 1998, Roddaz et al. 2006, Wesselingh 2006, Rosa et al. 2010). Toffoli (2006) propuso una filogenia molecular con base en dos genes mitocondriales (ATP sintetasa subunidades 6 e 8, y Citocromo c oxidasa I - COI). Él encontró que Paratrygon es el género basal y Potamotrygon el más derivado. La posición de Plesiotrygon varió de acuerdo con el método de reconstrucción, indicando todavía que este género puede ser parte de Potamotrygon, un resultado también corroborado posteriormente por Toffoli et al. (2008) (ver Capítulo 6.1 para una topología presentada por estos autores). El cladograma con máxima parsimonia para ambos genes indicó Plesiotrygon como el grupo hermano de Potamotrygon schroederi, y las dos últimas especies como el grupo hermano de una especie no descrita de Potamotrygon del Río Negro en Brasil. El 43 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA BIOGEOGRAFÍA tiempo de divergencia entre los dos clados se estimó como 7,68 (6,10 – 9,57) millones de años atrás y entre Plesiotrygon iwamae y Potamotrygon schroederi como 6,77 (5,61 – 7,93) millones de años atrás. En el escenario biogeográfico, Toffoli (2006) destacó la posible importancia del Arco Purús (cf. Lundberg et al. 1998), constituyendo una barrera geográfica que restringió la ocupación de la Amazonia oriental por los potamotrigónidos hasta dos millones de años atrás. García-Villamil (2012) estudió la sistemática molecular de los potamotrigónidos de Colombia y Venezuela, utilizando los marcadores moleculares Cyt-b, COI y ATPasa 6, y también ubicó al género Plesiotrygon dentro de Potamotrygon y la posibilidad de que Potamotrygon no fuera monofilético (ver el Capítulo 6.1 para una topología presentada por dichos autores). Finalmente, una revisión más reciente acerca de los estudios biogeográficos de peces de agua dulce de América del Sur (Ribeiro et al. 2011), tomando como ejemplo el trabajo de Carvalho et al. (2004), indicó la importancia de la inclusión de datos paleontológicos en el establecimiento de hipótesis filogenéticas y biogeográficas. En el caso específico de la invasión del continente suramericano por el ancestro de los potamotrigónidos, los autores concluyeron que esta estaría asociada más probablemente, con eventos mesozoicos, que con las transgresiones marinas y la evolución Cenozoica de los Andes. Conclusiones Los diversos estudios filogenéticos (p. e. Rosa 1985, Nishida 1990, McEachran et al. 1996, Lovejoy 1996, Marques 2000, Dunn et al. 2003, Quijada 2003, Carvalho et al. 2004, McEachran et al. 2004), confirman 44 la ascendencia marina de los Potamotrygonidae, aunque todavía permanece la incertidumbre de si el grupo más cercano estaría entre los dasyátidos o los urolófidos y urotrigónidos. Cualquiera que sea el grupo hermano, la pregunta acerca del origen Pacífico versus Atlántico no procede, conforme a lo apuntado por diversos autores (Rosa 1985, Lovejoy 1996, 1997), una vez que la conexión anfipanameña entre el Pacífico oriental y el Caribe podría proporcionar amplios intercambios de la fauna marina con distintos orígenes (Pacífico o Atlántico-Tethyana), así como una amplia distribución de la especie ancestral a lo largo de la costa norte de América del Sur. Esta conexión permaneció activa durante el largo período de tiempo geológico en el que ocurrió la diferenciación de las rayas de agua dulce en América del Sur, hasta la emergencia del Istmo de Panamá en el Plioceno Superior (3 millones de años atrás) (Albert et al. 2006, Posadas y OrtizJaureguizar 2010). También hay gran incertidumbre acerca de la datación del origen de los potamotrigónidos, ya que el intervalo señalado en la literatura va desde el Cretácico hasta el Mioceno (Lovejoy 1996, 1997, Lojejoy et al. 1998, Marques 2000, Brito y Deynat 2004, Carvalho et al. 2004). La propuesta de nuevas hipótesis biogeográficas acerca del grupo debe incorporar necesariamente una filogenia robusta, basada no solamente en datos parciales o de pocos atributos, sino en la mayor evidencia posible, incluyendo datos morfológicos y moleculares, así como una datación acuciosa de evidencias fósiles y geológicas (Carvalho et al. 2004, Rosa et al. 2010). Bibliografía • Albert, J. S., N. R. Lovejoy y W. G. R. Crampton. 2006. Miocene tectonism and M. A. Morales-B. • • • • • • • the separation of cis-and trans-Andean river basins: evidence from Neotropical fishes. Journal of South American Earth Sciences 21: 14–27. Brito, P. M. y P. P. Deynat. 2004. Freshwater stingrays from the Miocene of South America with comments on the rise of potamotrygonids (Batoidea, Myliobatiformes). Pp. 575-582. En: Arratia, G., M. V. H. Wilson y R. Cloutier (Eds.). Recent Advances in the Origin and Early Radiation of Vertebrates. Verlag Dr. Friedrich Pfeil, München, Germany. Brooks, D. R., T. B. Thorson y M. A. Mayes. 1981. Freshwater stingrays (Potamotrygonidae) and their helminth parasites: testing hypotheses of evolution and coevolution. Pp. 147–175. En: Funk, V. A. y D. R. Brooks (Eds.). Advances in cladistics, Proceedings of the First Meeting of the Willi Hennig Society. New York Botanical Garden, New York, USA. Carvalho, M. R., J. G. Maisey y L. Grande. 2004. Freshwater stingrays of the Green River Formation of Wyoming (Early Eocene), with the description of a new genus and species and an analysis of its phylogenetic relationships (Chondrichthyes: Myliobatiformes). Bulletin of the American Museum of Natural History 284: 1–136. Carvalho, M. R. y N. R. Lovejoy. 2011. Morphology and phylogenetic relationships of a remarkable new genus and two new species of Neotropical freshwater stingrays from the Amazon basin (Chondrichthyes: Potamotrygonidae). Zootaxa 2776: 13-48. Carvalho, M. R. y M. P. Ragno. 2011. An unusual, dwarf new species of Neotropical freshwater stingray, Plesiotrygon nana sp. nov., from the upper and mid Amazon basin: the second species of Plesiotrygon (Chondrichthyes: Potamotrygonidae). Papéis Avulsos de Zoologia 51: 101-138. Compagno, L. J. V. 2005. Checklist of living Chondrichthyes. Pp. 503-548. En: Hamlett, W. (Ed.). Reproductive Biology and Phylogeny of Chondrichthyes: Sharks, Batoids and Chimaeras. Science Publishers, Inc., Enfield, New Hampshire, USA. Deynat, P. y P. M. Brito. 1994. Révision des tubercules cutanés des raies • • • • • • • • (Chondrichthyes, Batoidea) du basin du Paraná, Tertiaire d’Amerique du Sud. Annales de Paleontologie 80: 237–251. Dingerkus, G. 1995. Relationships of potamotrygonin stingrays (Chondrichthyes: Batiformes: Myliobatidae). En: Oetinger, M. I. y G. D. Zorzi (Eds.). The biology of freshwater elasmobranchs, a symposium to honor Thomas B. Thorson. Journal of Aquariculture and Aquatic Sciences 7: 32–37. Dunn, K. A., J. D. McEachran y R. L. Honeycutt. 2003. Molecular phylogenies of myliobatiform fishes (Chondrichthyes: Myliobatiformes), with comments on the effects of missing data on parsimony and likelihood. Molecular Phylogenetics and Evolution 27: 259–270. Eigenmann, C. H. 1910. Catalogue of the fresh-water fishes of tropical and south temperate America. Reports of the Princeton University expeditions to Patagonia 1896-1899. Zoology. Fishes Patagonia 3 (4): 375-511. García-Villamil, D. 2012. Molecular systematics of the freshwater stingrays (Myliobatiformes: Potamotrygonidae) of the Amazon, Orinoco, Magdalena, Essequibo, Caribe and Maracaibo basins (ColombiaVenezuela): evidence from mitochondrial genes. Tesis de Maestría, Universidad de los Andes, Bogotá. 32 pp. Garrone Neto, D. y V. Haddad Jr. 2007. Ocorrência de arraias fluviais (Myliobatiformes, Potamotrygonidae) na região do baixo Paranapanema, Sudeste do Brasil. Boletim da Sociedade Brasileira de Ictiologia 88: 10-11. Garrone Neto, D., V. Haddad Jr., M. J. A. Vilela y V. S. Uieda. 2007. Registro de ocorrência de duas espécies de potamotrigonídeos na região do Alto Rio Paraná e algumas considerações sobre sua biologia. Biota Neotropica 7: 1-3. Géry, J. 1969. The freshwater fishes of South America. Pp. 828-848. En: Fittkau, E. J., J. Illies, H. Klinge, G. Shwabe y H. Sioli (Eds.). Biogeography and ecology in South America. Vol. 2., W. Junk, The Hague, Netherlands. Haddad Jr., V. 2005. Ocorrência de arraias da família Potamotrygonidae no rio Para- 45 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA BIOGEOGRAFÍA • • • • • • • • • 46 ná e relato da presença no rio Tietê: resultados preliminaries. Boletim da Sociedade Brasileira de Ictiologia 78: 3. Harrington, H. J. 1962. Paleogeographic development of South America. Bulletin of the American Association of Petroleum Geolologists 46: 1773-1814. Hoberg, E. P., D. R. Brooks, H. MolinaUreña y E. Erbe.1998. Echinocephalus janzeni n. sp. (Nematoda: Gnathostomatidae) in Himantura pacifica (Chondrichthyes: Myliobatiformes) from the Pacific coast of Costa Rica and Mexico, with historical biogeographical analysis of the genus. Journal of Parasitology 84: 571-581. Hoorn, C. 1996. Miocene deposits in the Amazonian foreland basin. Science 273: 122–123. Hoorn, C., J. Guerrero, G. A. Sarmiento y M. A. Lorente. 1995. Andean tectonics as a cause for changing drainage patterns in Miocene northern South America. Geology 23: 234-240. Hubert, N. y J. F. Renno. 2006. Historical biogeography of South American freshwater fishes. Journal of Biogeography 33: 1414–1436. Ishihara, H. y T. Taniuchi. 1990. A strange potamotrygonid ray (Chondrichthyes: Potamotrygonidae) from the Orinoco river system. En: Oetinger, M. I. y G. D. Zorzi, (Eds.). The Biology of Freshwater Elasmobranchs, a symposium to honor Thomas B. Thorson. Journal of Aquariculture and Aquatic Sciences 7: 91-97. Lovejoy, N. R. 1996. Systematics of myliobatoid elasmobranches: with emphasis on the phylogeny and historical biogeography of Neotropical freshwater stingrays (Potamotrygonidae: Rajiformes). Zoological Journal of the Linnean Society 117: 207257. Lovejoy, N. R. 1997. Stingrays, parasites, and Neotropical biogeography: a closer look at Brooks et al.’s hypotheses concerning the origin of Neotropical freshwater rays (Potamotrygonidae). Systematic Biology 46: 218-230. Lovejoy, N. R., E. Bermingham y A. P. Andrew. 1998. Marine incursion into South America. Nature 396: 421–422. • • • • • • • • • • Lowe-McConnell, R. H. 1975. Fish communities in tropical freshwaters. Their distribution, ecology and evolution. Longman, London, England. 303 pp. Lundberg, J. G., L G. Marshall, J. Guerrero, B. Horton, M. C. S. L. Malabarba y F. Wesselingh. 1998. The stage for Neotropical fish diversification: A history of tropical South American Rivers. Pp. 13– 48. En: Malabarba, L. R., R. E. Reis, R. P. Vari, Z. M. Lucena y C. A. S. Lucena (Eds.). Phylogeny and classification of Neotropical fishes. Edipucrs, Porto Alegre, Brasil. Marques, F. 2000. Evolution of Neotropical freshwater stingrays and their parasites: taking into account space and time. Tesis Doctoral, University of Toronto, Toronto. 325 pp. McEachran, J. D., K. A. Dunn y T. Miyake. 1996. Interrelationships of the batoid fishes (Chondrichthyes: Batoidea). Pp. 63-82. En: Stiassny, M. L. J., L. R. Parenti y G. D. Johnson (Eds.). Interrelationships of Fishes. Academic Press, London, England McEachran, J. D. y N. Aschliman. 2004. Phylogeny of Batoidea. Pp. 79–113. En: Carrier, J. C., J. A. Musick y M. R. Heithaus (Eds.). Biology of sharks and their relatives. CRC Press, Boca Raton, FL, EUA. Miyake, T. 1988. The systematics of the stingray genus Urotrygon with comments on the interrelationships within Urolophidae (Chondrichthyes, Myliobatiformes). Tesis Doctoral, Texas A&M University, College Station. Nishida, K. 1990. Phylogeny of the suborder Myliobatidoidei. Memoirs of the Faculty of Fisheries, Hokkaido University 37:1–108. Posadas, P. y E. Ortiz-Jaureguizar. 2010. Evolução da região andina da América do Sul. Pp. 175-188. En: Carvalho, C. J. B y E. A. B. Almeida (Eds.). Biogeografia da América do Sul Editora Roca, São Paulo, Brasil. Quijada, C. C. D. 2003. Relações filogenéticas intergenéricas de raias neotropicais de água doce (Chondrichthyes: Potamotrygonidae). Tesis de Maestría, Universidade Federal da Paraíba, João Pessoa. 84 pp. Räsänen, M. E., A. M. Linna, J. C. R. Santos y F. R. Negri. 1995. Late Miocene tidal M. A. Morales-B. • • • • • deposits in the Amazonian foreland basin. Science 269: 386–390. Ribeiro, A. C., F. C. T. Lima y N. A. Menezes. 2011. Biogeografia dos peixes de água doce da América do Sul. Pp. 261-276. En: Carvalho, C. J. B y E. A. B. Almeida (Eds.). Biogeografia da América do Sul Editora Roca, São Paulo, Brasil. Roddaz, M., S. Brusset, P. Baby y G. Hérail. 2006. Miocene tidal-influenced sedimentation to continental Pliocene sedimentation in the forebulge–backbulge depozones of the Beni–Mamore foreland Basin (northern Bolivia). Journal of South American Earth Sciences 20: 351–368. Rosa, R. S. 1985. A systematic revision of the South American freshwater stingrays (Chondrichthyes: Potamotrygonidae). Tesis Doctoral, College of William and Mary, Williamsburg, Virginia. 523 pp. Rosa, R. S., H. P. Castello y T. B. Thorson. 1987. Plesiotrygon iwamae, a new genus and species of Neotropical freshwater stingray (Chondrichthyes: Potamotrygonidae). Copeia 2: 447-458. Rosa, R. S., P. Charvet-Almeida y C. C. D. Quijada. 2010. Biology of the South American potamotrygonid stingrays. Pp. 241- • • • • 86 En: Carrier J. C., J. A. Musick y M. R. Heithaus (Eds.). Sharks and their relatives II: Biodiversity, adaptive physiology and conservation. Taylor y Francis Group, New York, USA. Thorson, T. B., D. R. Brooks y M. A. Mayes. 1983. The evolution of freshwater adaptation in stingrays. National Geographic Research Reports 15: 663–694. Toffoli, D. 2006. História evolutiva de espécies do gênero Potamotrygon Garman, 1877 (Potamotrygonidae) na Bacia Amazônica. Dissertación de Maestria, Instituto Nacional de Pesquisas da Amazônia, Universidade Federal do Amazonas, Manaus. 126 pp. Toffoli, D., T. Hrbek, M. L. G. Araújo, M. P. Almeida, P. Charvet-Almeida e I. P. Farias. 2008. A test of the utility of DNA barcoding in the radiation of the freshwater stingray genus Potamotrygon (Potamotrygonidae, Myliobatiformes). Genetics and Molecular Biology 31: 324–336. Wesselingh, F. P. 2006. Miocene long-lived Lake Pebas as a stage of mollusc radiations, with implications for landscape evolution in western Amazonia. Scripta Geologica 133: 1-17. 47 Potamotrygon orbignyi, cuenca Orinoco. Foto: M. A. Morales-Betancourt R. Rosa 2. Historia de la investigación de las rayas de agua dulce (Potamotrygonidae): estado actual del conocimiento Ricardo S. Rosa, Carlos A. Lasso, Paula Sánchez-Duarte, Ramiro Barriga y Hernán Ortega La adquisición de conocimientos sobre las rayas de agua dulce (Potamotrygonidae) empieza a partir del siglo XVI, en paralelo con la conquista de los territorios de América del Sur durante la colonización europea, proceso que continuó con las expediciones científicas realizadas entre los siglos XVIII al XX. El panorama del desarrollo histórico del grupo ha sido presentado por varios autores (Castex 1963a, b, c, 1968, Rosa 1985a, Zorzi 1995, Rosa et al. 2010). La presencia de rayas de agua dulce en los ríos del Neotrópico fue reseñada por los primeros exploradores del continente suramericano, que en varias ocasiones relataron los accidentes sufridos por los integrantes de sus expediciones. Uno de los relatos más antiguos es el del español Álvaro Núñez “Cabeza de Vaca”, quién en el siglo XVI realizó una expedición terrestre desde el sur de Brasil hasta Paraguay y reportó la presencia de rayas de agua dulce en la cuenca del río Paraná-Paraguay (Cabeza de Vaca “1999”, Rosa 2009). En el siglo XVII, Fray Cristóbal de Lisboa, durante su estancia en el Marañon describe e ilustra una raya de agua dulce bajo el nombre indígena “yabeburapeni” (Castex 1964, Rosa 2009). Su obra manuscrita: Historia de los animales y los árboles del MarañonMSS, se conserva en el Archivo Histórico Colonial de Lisboa y fue editada en Portugal (Cristovão de Lisboa “1967”). Siglo XVIII En el siglo XVIII, además de las citas de presencia de rayas en los ríos de América del Sur realizadas por diversos cronistas y viajeros, la información más detallada sobre estos animales fue proporcionada por los jesuitas Mariano Sánchez Labrador, Florián Paucke, Tomas Falkner y Martin Dobrizhoffer en la cuenca del río ParanáParaguay. También por José Gumilla en la cuenca del río Orinoco, utilizando nombres comunes (Gumilla 1791, Dobrizhoffer 1822, Castex 1968a, b). El naturalista brasileño Alexandre Rodrigues Ferreira, registró en sus manuscritos una raya de agua dulce amazónica en el estado de Pará en Brasil, bajo el nombre vernáculo “arraia-iaueira” (Ferreira 1972). 49 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA HISTORIA DE LA INVESTIGACIÓN Siglo XIX Para el siglo XIX, muchos naturalistas extranjeros que realizaron expediciones a Suramérica obtuvieron ejemplares de rayas de agua dulce de los ríos amazónicos y otras cuencas, dando paso al inicio de la taxonomía moderna del grupo y las primeras descripciones sistemáticas de las especies. El doctor François Désiré Roulin y los naturalistas Francis de Castelnau y Robert Schomburgk describieron ejemplares colectados por ellos (Roulin 1829, Schomburgk 1843, Castelnau 1855) (Figura 1), mientras que el material obtenido por Natterer, d’Orbigny y Louis Agassiz fue descrito en las monografías de Müller y Henle (1841), Duméril (1865) y Garman (1913). Los manuscritos e ilustraciones de rayas realizadas por Alfred Wallace durante su viaje al Río Negro en la Amazonia brasileña permanecieron inéditos por más de un siglo y el material biológico se perdió en el naufragio de la embarcación que lo conducía a Europa (Wallace “2002”). En el siglo XIX llegó a 15 el total de especies de rayas dulceacuícolas neotropicales descritas, todas asignadas a géneros marinos (Pastinaca, Trygon y Taeniura) de la familia Trygonidae y provenientes de diversos países (Argentina, Brasil, Colombia, Guyana, Surinam y Venezuela). Garman (1877) fue el primero en separar las rayas agua dulce de las marinas, incluyéndolas en la subdivisión Potamotrygones. El Museo de Zoología y Anatomía Comparada de la Universidad de Torino a través de Boulenger 1887 se refiere al hallazgo de nuevas especies obtenidas en las colecciones de peces realizadas por Clarence Buckley en el año de 1880 en las localidades de Sarayacu y Canelos. El mismo autor en 1898 y Figura 1. Ilustración original de Trygon strogylopterus Schomburgk 1843. Fuente: W. Jardine, Naturalist’s Library, vol. 40, plate 22. 50 M. A. Morales-B. 1899 describe nuevas especies de peces del Ecuador que fueron capturadas por el Dr. Enrico Festae. En las publicaciones citadas no se menciona el hallazgo de especies de rayas de la familia Potamotrygonidae. El conocimiento básico de la ictiofauna del noroccidente de América del Sur se encuentra publicado en Eigenmann (1922) y Eigenmann y Allen (1942), pero en estos trabajos no se reportaron especies de rayas de agua dulce en la Amazonia ecuatoriana. Siglo XX Samuel Garman, a principios del siglo XX, en una monografía dedicada a los peces cartilaginosos, revisó las especies conocidas de rayas de agua dulce neotropicales y describió seis especies nuevas agrupadas en dos géneros, Disceus y Potamotrygon (Garman 1913). En esa misma obra, Garman estableció la familia Potamotrygonidae para las rayas de agua dulce del Neotrópico. Un año antes Engelhardt (1912), describió un taxón subespecífico de raya para la desembocadura del río Amazonas (Trygon hystrix var. ocellata), especie no considerada en la monografía de Garman (1913). Exceptuando la mención de especies de Potamotrygonidae (a veces como Paratrygonidae) en varios estudios de fauna durante la primera mitad del siglo XX (p. e. Miranda-Ribeiro 1907, Eigenmann 1922, Devicenzi 1924, Fowler 1948), no hubo grandes contribuciones científicas para el grupo durante este periodo. A los trabajos mencionados, merece la pena agregar las publicaciones realizadas sobre aspectos médicos y biológicos (p. e. Vellard 1931, Jorg 1935) y una descripción de nueva especie del río Uruguay, Potamotrygon brumi (Devincenzi y Teague 1942), posteriormente sinonimizado con Potamotrygon brachyura (Günther 1880). El interés sobre Potamotrygonidae se reanudó en varios temas al final de la década de 1940, incluyendo aspectos taxonómicos y biológicos (p. e. Fernández-Yépez 1948, 1949, 1957 y Fernández-Yépez y Espinosa 1957), ecológicos (Myers 1949) y de acuariofilia (Myers 1947). La década de 1960 fue crucial para la investigación científica de la familia Potamotrygonidae, con la producción extensiva de Mariano Castex y colaboradores, en particular el Profesor Hugo Castello (Figura 2), cubriendo aspectos históricos, médicos, biológicos y la descripción taxonómica de varias especies, principalmente de la cuenca del Paraná-Paraguay (p. e. Castex 1963a, b, c, 1964a, b; ver Rosa 1985a para una revisión de la literatura y López y Ponte-Gómez 2013 para la biografía y bibliografía). En el noroeste de Suramérica, el ictiólogo Ovchinyck (1967) autor de la primera y segunda lista de peces de agua dulce del Ecuador, registró por primera vez dos especies de rayas (Potamotrygon hystrix y Potamotrygon sp.). En la tercera lista (Barriga 1991), se añaden dos especies: Paratrygon aiereba, Plesiotrygon iwamae. En la última lista de peces de agua dulce e intermareales (Barriga 2012), se incluye a Potamotrygon constellata, Potamotrygon scobina y Potamotrygon schroederi. En América del Norte, los científicos Reeve M. Bailey y Thomas B. Thorson se interesaron respectivamente, en los aspectos taxonómicos y biológicos de los Potamotrygonidae (Bayley 1969, Thorson 1983), participando también en expediciones científicas en América del Sur (Figura 3). Thorson fue un pionero en el estudio de la fisiología de la adaptación de estos animales en el agua dulce, tratando la osmorregulación (Thorson et al. 1967). A pesar de las revisiones taxonómicas parciales realizadas por Castex (1964b, 1967, 51 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA HISTORIA DE LA INVESTIGACIÓN a. b. c. d. Figura 2. a) Mariano Castex con una raya de agua dulce recien capturada en la década del 60; b) Mariano Castex en una foto reciente por Leandro Sanchez; c) Hugo Castello; d) Agustín Fernández-Yépez. Fotos: fichero personal de M. R. Carvalho (a), www.elidentikit (b); archivo estudio Castex (c); A. Fernández-Yépez (d). Castex y Castello 1969), el conocimiento sobre la diversidad sistemática del grupo permanecía confusa, con varias especies de dudosa validez taxonómica, debido a las pobres descripciones originales y en muchos casos debido a la pérdida del material tipo (Rosa 1985a). La revisión sistemática realizada por el primer autor como tesis doctoral (Rosa 1985a), aunque siga 52 siendo en gran parte desconocida, permitió establecer sinónimos mediante el examen de material tipo y descripciones disponibles, así como una lista de especies válidas y publicaciones sobre la diversidad taxonómica del grupo (Rosa 1985b, 1991, Rosa et al. 1987). Sus resultados también fueron adoptados en las listas de especies de peces para diferentes ámbitos, como el M. A. Morales-B. a. b. Figura 3. a). Reeve M. Bailey en la expedición del Museo Americano de Historia Natural en Bolivia, 1964; b) Thomas B. Thorson en Leticia, Colombia, año 1970. Fuente: fichero personal de R. S. Rosa, fotos cedidas por J. A. Ximenez (a) y M. I. Oetinger (b). checklist de especies de condrictios (p. e. Compagno 1999, 2005), un catálogo de peces neotropicales (Carvalho et al. 2003), catálogos regionales de especies de peces (p. e. Rosa y Carvalho 2007, Carvalho y Rosa 2009), además de un catálogo de tipos de peces (Séret y McEachran 1986). Como ejemplo de la confusión que ha prevalecido en este grupo taxonómico hasta la década de 1970, se puede citar el caso de Paratrygon aiereba (Müller y Henle 1841), a la cual le fueron asignados tres nombres específicos en diferentes combinaciones genéricas y ortografías, considerados como sinónimos objetivos (Trygon aiereba, Trygon strogylopterus, Disceus strongylopterus, Elipesurus strongylopterus, Ellipesurus strongylopterus, Potamotrygon strongylopterus y Disceus thayeri), además de nombres dudosos que fueron tratados como sinónimos subjetivos (Raja ajereba, Raja orbicularis y Elipesurus spinicauda). La diferencia entre Castex (1968a, 1969) y Bailey (1969), que respectivamente consideraron como válidos para esta especie los nombres Disceus thayeri Garman 1913 y Elipesurus spinicauda Schomburgk 1843, sólo fue resuelta después de un estudio detallado de las descripciones originales y tipos disponibles, determinando Paratrygon aiereba (Müller y Henle 1841), como el nombre válido (Rosa 1985a, b, 1991). A pesar de su nombre similar al 53 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA HISTORIA DE LA INVESTIGACIÓN de Raja aiereba Walbaum 1792, especie establecida para aireba de Marcgraf (1648), este último no se incluyó en la sinonimia (así como su equivalente Raja orbicularis Bloch y Schneider 1801), porque la región explorada por Marcgrave durante el dominio holandés en Brasil no registra rayas de agua dulce (Rosa 1991). Siglo XXI Al final del siglo XX y comienzo del siglo XXI, se hicieron nuevas contribuciones al estudio de las rayas de agua dulce neotropicales, incluyendo trabajos sobre historia natural, alimentación y reproducción (Lasso et al. 1996, Charvet-Almeida et al. 2005, Lonardoni et al. 2006, RodríguezGuerra et al. 2008), parasitología (Brooks y Thorson 1976, Brooks et al. 1981, Marques 2000, Marques et al. 2001), filogenia (Lovejoy 1996, Carvalho et al. 2004), biogeografía (Lovejoy 1997, Brito y Deynat 2004), morfología funcional (PântanoNeto y Souza 2002), acuarismo (Ross y Schäfer 2000), pesquerías (Barbarino y Lasso 2005, 2009) y divulgación científica (López-Corcuera 1984, Lasso 1985, Charvet-Almeida et al. 2002), entre otros enfoques. En Venezuela, el listado de peces más reciente (Lasso et al. 2004a) ya reconocía cinco especies y su distribución en la diferentes cuencas. Para Perú, en la lista más actualizada, Ortega et al. (2011) señalan ocho especies, incluidas en tres géneros. Para el caso de Colombia, ya Dahl en 1971, hacía referencia a las especies de rayas presentes en el norte de Colombia. A partir de esa fecha, en las listas de peces que se han realizado para las diferentes cuencas del país: Amazonas (Mojica et al. 2005, Bogotá-Gregory y Maldonado-Ocampo 2006, Galvis et al. 2006), Atrato (MaldonadoOcampo et al. 2006a), Catatumbo (Galvis 54 et al. 1997, Ortega-Lara et al. 2012), Guaviare, Inírida y Atabapo (Lasso et al. 2009, Miller-Hurtado et al. 2009), Magdalena (Villa-Navarro et al. 2006, Mojica et al. 2006), Orinoco (Lasso et al. 2004b), Putumayo (Ortega et al. 2006) y Tomo (Maldonado-Ocampo et al. 2006b), siempre se encuentran referidas las especies de rayas de agua dulce. También, algunos estudios sobre peces ornamentales incluyen las rayas de agua dulce, destacando su importancia en este mercado (Ramírez-Gil y Ajiaco-Martinez 2001, Ramírez-Gil et al. 2001, Sanabria 2004, Galvis et al. 2007 a,b, Ajiaco et al. 2012). En 2007, Mejía-Falla y colaboradores realizan una lista de tiburones y rayas de Colombia, con el fin de actualizar la información de este grupo de peces en el país, lista que se ha ido actualizando con nuevos reportes (Lasso et al. 2010, Muñoz-Osorio y Mejía-Falla 2013). Posteriormente, en 2009, Puentes y colaboradores publican un libro sobre el avance en el conocimiento del grupo de peces cartilaginosos en Colombia, publicación que dió paso al Plan de Acción Nacional para la conservación y manejo de tiburones, rayas y quimeras de Colombia - PAN Tiburones Colombia, publicado en 2010 (Caldas et al. 2010) y adoptado bajo el decreto No. 1124 de 2013, como el instrumento de política que establece los lineamientos para la conservación y manejo sostenible de las especies de tiburones, rayas y quimeras de Colombia. García-Villamil (2012) hizo un estudio sobre la sistemática molecular de la familia en las cuencas de Colombia y Venezuela. También se puede mencionar que en la primera versión del Libro rojo de peces dulceacuícolas de Colombia (Mojica et al. 2002) se encontraba incluida una especie de raya M. A. Morales-B. de agua dulce (Potamotrygon yepezi). En la actualización de esta publicación (Mojica et al. 2012), se evaluaron e incluyeron seis espécies: Paratrygon aiereba, Potamotrygon motoro, Potamotrygon schroederi y Potamotrygon yepezi, bajo la categoría de Vulnerable y Potamotrygon magdalenae y Potamotrygon orbignyi, bajo la categoría de Casi Amenazadas. A pesar de estos avances recientes, una mirada general sobre el estado actual de conocimiento sobre rayas de agua dulce neotropicales, indica la necesidad de estudios adicionales sobre anatomía, genética y paleontología, como apoyo a la investigación de la sistemática filogenética y biogeografía (Rosa et al. 2010). También se destaca la necesidad de adoptar medidas de conservación y ordenación frente el aumento de los impactos antropogénicos en sus ambientes, con el fin de proteger la diversidad biológica de este grupo, el único de la fauna reciente de Chondrichthyes que presenta adaptación completa y exclusiva para el agua dulce. Bibliografía • • • Ajicaco-Martínez, R. E., H. Ramírez-Gil, P. Sánchez-Duarte, C. A. Lasso y F. Trujillo. 2012. IV. Diagnóstico de la pesca ornamental en Colombia. Serie Editorial Recursos Hidrobiológicos y Pesqueros Continentales de Colombia. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Bogotá, D. C., Colombia, 152 pp. Bailey, R. M. 1969. Comment on the proposed suppression of Elipesurus spinicauda Schomburgk (Pisces) Z. N. (S.) 1825. The Bulletin of Zoological Nomenclature 25: 133134. Barbarino, A. y C. A. Lasso. 2005. Pesquería y aspectos biológicos de la raya manta Paratrygon aiereba (Müller y Henle 1841) (Myliobatiformes,Potamotrygonida e), en el río Apure (Venezuela). Memoria de la Fundación La Salle de Ciencias Naturales 163: 93-108. • • • • • • • • • Barbarino, A. y C. Lasso. 2009. La pesca comercial de la raya manta Paratrygon aiereba (Müller y Henle, 1841) (Myliobatiformes, Potamotrygonidae) en el río Apure, Venezuela. Acta Apuroquia 1 (1): 24-31. Barriga, R. 1991. Los peces de agua dulce del Ecuador. Revista Politécnica. Biología 16 (3) 7-88. Barriga R. 2012 Lista de peces de agua dulce e intertmareales del Ecuador. Revista Politécnica 30 (3): 83-119. Bogotá–Gregory, J. D. y J. A. MaldonadoOcampo. 2006a. Peces de la Amazonia, Colombia. Biota Colombiana 7 (1): 55-94. Brito, P. M. y P. P. Deynat. 2004. Freshwater stingrays from the Miocene of South America with comments on the rise of potamotrygonids (Batoidea, Myliobatiformes). Pp. 575-582. En: Arratia, G., M. V. H. Wilson y R. Cloutier (Eds.). Recent Advances in the Origin and Early Radiation of Vertebrates. Verlag Dr. Friedrich Pfeil, München, Germany. Brooks, D. R. y T. B. Thorson. 1976. Two tetraphyllidean cestodes from the freshwater stingray Potamotrygon magdalenae Duméril 1852 (Chondrichthyes: Potamotrygonidae) from Colombia. Journal of Parasitology 62: 943-947 Brooks, D. R., M. A. Mayes y T. B. Thorson. 1981. Systematic review of cestodes infecting freshwater stingrays (Chondrichthyes: Potamotrygonidae) including four new species from Venezuela. Proceedings of the Helminthological Society of Washington 48: 43-64. Cabeza de Vaca (pseud.) “1999”. Naufrágios e comentários Álvar Nunes. L&PM, Porto Alegre, Brasil. 257 pp. Caldas-Aristizábal, J. P., E. Castro-González, V. Puentes, M. Rueda, C. A. Lasso, L. O. Duarte, M. Grijalba-Bendeck, F. Gómez, A. F. Navia, P. A. Mejía-Falla, S. Bessudo, M. C. Diazgranados y L. A. Zapata-Padilla (Eds.). 2010. Plan de Acción Nacional para la conservación y manejo de tiburones, rayas y quimeras de Colombia (PAN-Tiburones Colombia). Instituto Colombiano Agropecuario, Secretaria Agricultura y Pesca San Andrés Isla, Ministerio de Ambiente, Vivienda y Desarrollo Territorial, Institu- 55 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA HISTORIA DE LA INVESTIGACIÓN • • • • • • • • • 56 to de Investigaciones Marinas y Costeras, Instituto Alexander von Humboldt, Universidad del Magdalena, Universidad Jorge Tadeo Lozano, Pontificia Universidad Javeriana, Fundación SQUALUS, Fundación Malpelo, Conservación Internacional, WWF Colombia. Editorial Produmedios, Bogotá, D.C., Colombia. 70 pp. Carvalho, M. R., N. R. Lovejoy y R. S. Rosa. 2003. Potamotrygonidae. Pp. 22-29. En: Reis, R. E., C. J. Ferraris Jr. y S. O. Kullander (Eds.). Checklist of freshwater fishes of South and Central America. Editora da Pontifícia Universidade Católica, Porto Alegre, Brasil. Carvalho, M. R., J. G. Maisey y L. Grande. 2004. Freshwater stingrays of the Green River Formation of Wyoming (Early Eocene), with the description of a new genus and species and an analysis of its phylogenetic relationships (Chondrichthyes: Myliobatiformes). Bulletin of the American Museum of Natural History 284: 1–136. Carvalho, M. R. y R. S. Rosa. 2009. Family Potamotrygonidae. Pp. 26. En: Vari, R. P., C. J. Ferraris, Jr., A. Radosavljevic y V. A. Funk (Eds.). Checklist of the freshwater fishes of the Guiana Shield. Bulletin of the Biological Society of Washington 17: 1-94. Castelnau, F. L. 1855. Animaux nouveaux ou rares recueillis pendant l’expédition dans les parties centrales de l’Amerique du Sud, de Rio de Janeiro a Lima, et de Lima au Para. Vol. 2. P. Bertrand, Paris, France. Castex, M. N. 1963a. Notas heurísticas sobre el género Potamotrygon. Museo Argentino de Ciencias Naturales Bernardino Rivadavia, Publicaciones de Extensión Cultura y Didáctica 11: 110. Castex, M. N. 1963b. La raya fluvial. Notas histórico-geográficas. Libreria y Editorial Castellvi, Santa Fé, Argentina. 119 pp. Castex, M. N. 1963c. El género Potamotrygon en el Parana medio. Anales del Museo Provincial de Ciencias Naturales “Florentino Ameghino” 2: 1-86. Castex, M. N. 1964a. Una nueva especie de raya fluvial americana: Potamotrygon schuhmacheri sp. n. Neotrópica 10: 92-94. Castex, M. N. 1964b. Estado actual de los estudios sobre la raya fluvial neotropical. • • • • • • • • • En: Cincuentenario del Museo Provincial de Ciencias Naturales “Florentino Ameghino”. Museo Provincial de Ciencias Naturales “Florentino Ameghino” 9-50 pp. Castex, M. N. (Ed.). 1968a. Sanchez Labrador, peces y aves del Paraguay natural ilustrado 1767. Compañia General Fabril Editora, Buenos Aires, Argentina. 510 pp. Castex, M. N. 1968b. Elipesurus Schomburgk 1843 (Pisces): proposed suppression under the plenary powers. Z. N.(S.) 1825. Bulletin of Zoological Nomenclature 24: 353355. Castex, M. N. 1967. Freshwater venomous rays. Pp. 167-176. En: Animal toxins. First International Symposium on Animal Toxins, Atlantic City, New Jersey. Pergamon Press, Oxford y New York, England and USA. Castex, M. N. 1969. Comment on the objections forwarded by R. M. Bailey to the proposed suppression of Elipesurus spinicauda Schomburgk (Pisces) Z. N. (S.) 1825. Bulletin of Zoological Nomenclature 26: 6869 Castex, M. N. y H. P. Castello. 1969. Nuevas sinonimias para el género monotípico Disceus Garman 1877 (Potamotrygonidae) y observaciones sistemáticas a la familia Paratrygonidae Fowler 1948 (dubit.). Acta Scientifica del Instituto Latinoamericano de Fisiologia de la Reproducción 7: 1-43. Charvet-Almeida, P., M. L. G. Araújo, R. S. Rosa, R. S. y G. Rincon. 2002. Neotropical freshwater stingrays: diversity and conservation status. Shark News 14: 1-2. Charvet-Almeida, P., M. L. G. Araújo y M. P. Almeida. 2005. Reproductive aspects of freshwater stingrays (Chondrichthyes: Potamotrygonidae) in the Brazilian Amazon Basin. Journal of Northwest Atlantic Fishery Science 35: 165-171. Compagno, L. J. V. 1999. Checklist of living elasmobranchs. Pp. 471-498. En: Hamlett W. C. (Ed.). Sharks, skates and rays, the biology of elasmobranch fishes. The John Hopkins University Press, Baltimore, USA. Compagno, L. J. V. 2005. Checklist of living Chondrichthyes. Pp. 503-548. En: Hamlett, W. (Ed.). Reproductive Biology and Phylogeny of Chondrichthyes: Sharks, Ba- M. A. Morales-B. • • • • • • • • • • • toids and Chimaeras. Science Publishers, Inc., Enfield, New Hampshire, USA. Cristovão de Lisboa, F. 1967. História dos animais e árvores do Maranhão. Estudo e notas do Dr. Jaime Walter. Arquivo Histórico Ultramarino, Lisboa, Portugal. 183 pp. Dahl, G. 1971. Los peces del norte de Colombia. Ministerio de Agricultura, Instituto de Desarrollo de los Recursos Naturales Renovables (INDERENA). Talleres Litografía Arco. Bogotá D.C., Colombia. 391 pp. Devicenzi, G. J. 1924. Peces del Uruguay. Anales del Museo Nacional de Montevideo 11 (5): 97-290. Devicenzi, G. J. y G. W. Teague. 1942. Ictiofauna del Uruguay Medio. Anales del Museo de Historia Natural de Montevideo 5: 1–103. Dobrizhoffer, M. 1822. An account of the Abipones, an equestrian people of Paraguay. Vol. 1, John Murray, London, England. 456 pp. Duméril, A. 1865. Histoire naturelle des poissons ou ichthyologie générale. Vol. 1, Elasmobranches plagiostomes et holocéphales ou chiméres. Librairie Encyclopédique de Roret, Paris, France. Eigenmann, C. H. 1922. The fishes of Western South America. Part 1, The fresh-water fishes of Northwestern South America, including Colombia, Panama, and the Pacific slopes of Ecuador and Peru, together with an appendix upon the fishes of the Rio Meta in Colombia. Memoirs of the Carnegie Museum 9 (l): 1-36. Eigenmann, C. H. y W. R. Allen. 1942. Fishes of western South America. I. The intercordilleran and Amazonian lowlands of Peru. II.- The high pampas of Peru, Bolivia, and northern Chile. With a revision of the Peruvian Gymnotidae, and of the genus Orestias: Zoologischer Anzeiger 39 (21/22): 643-648. Fernández-Yépez, A. 1948. Potamotrygon hystrix (Müller y Henle) en Venezuela. Evencias 5: 1-2. Fernández-Yépez, A. 1957. Nueva raya para la ciencia Potamotrygon schroederi, n. sp. Boletín del Museo de Ciencias Naturales 1-2: 7-11. Ferreira, A. R. 1972. Viagem filosófica pelas capitanias do Grão Pará, Rio Negro, • • • • • • • • Mato Grosso e Cuiabá. Memórias, Zoologia, Botânica. Conselho Federal de Cultura, Rio de Janeiro, Brasil. Fowler, H. W. 1948. Os peixes de água doce do Brasil. Arquivos de Zoologia do Estado de São Paulo 6: 1–204. Galvis, G., J. I. Mojica y M. Camargo. 1997. Peces del Catatumbo. ECOPETROL / OXY / SHELL-Asociación Cravo Norte. D’Vinni Edit. Ltda, Santa Fe de Bogotá, Colombia. 118 pp. Galvis, G., J. I. Mojica, S. R. Duque, C. Castellanos, P. Sánchez-Duarte, M. Arce, A. Gutiérrez, L. F. Jiménez, M. Santos, S. Vejarano, F. Arbeláez, E. Prieto y M. Leiva. 2006. Peces del medio Amazonas: Región Leticia. Conservación Internacional. Serie de Guías Tropicales de Campo 5. Bogotá, Colombia. 546 pp. Galvis, G., J. Mojica, F. Provenzano, C. A. Lasso, D. Taphorn, R. Royero, C. Castellanos, A. Gutiérrez, M. Gutierrez, Y. López, L. M. Mesa, P. Sánchez-Duarte y C. Cipamocha. 2007a. Peces de la Orinoquia Colombiana con énfasis en especies de interés ornamental. Incoder. Universidad Nacional. SINCHI. Bogotá, Colombia. Galvis, G., P. Sánchez-Duarte, L. M. Mesa, Y. López, M. Gutierrez, A. Gutiérrez, M. Leiva y C. Castellanos. 2007b. Peces de la Amazonia Colombiana con énfasis en especies de interés ornamental. Incoder. Universidad Nacional. SINCHI. Bogotá, Colombia. 425 pp. García-Villamil, D. 2012. Molecular systematic of the freshwater stingrays (Myliobatiformes: Potamotrygonidae) of the Amazon, Orinoco, Magdalena, Essequibo, Caribe and Maracaibo basins (ColombiaVenezuela): evidence from mitocondrial genes. Tesis de Maestría, Universidad de los Andes, Bogotá. 32 pp. Garman, S. 1877. On the pelvis and external sexual organs of selachiens, with special reference to the new genera Potamotrygon and Disceus. Proceedings of the Boston Society of Natural History 19: 197-215 Garman, S. 1913. The Plagiostomia (sharks, skates and rays). Memoirs of the Museum of Comparative Zoology 36: 1 - 528. 57 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA HISTORIA DE LA INVESTIGACIÓN • • • • • • • • • 58 Gumilia, J. 1791. Historia natural, civil y geográfica de las naciones situadas en las riveras del río Orinoco. 2 vols., Barcelona, España. Jorg, M. E. 1935. Ulcera cutánea gangrenosa por herida con espina caudal de pez raya. Novena Reunión de la Sociedad Argentina de Patologia Regional 3: 1599-1616. Lasso, C. A. 1985. Las rayas de agua dulce. Natura 77: 6-9. Lasso, C. A., A. B. Rial y O. Lasso-Alcalá. 1996. Notes on the biology of the freshwater stingrays Paratrygon aiereba (Müller y Henle, 1841) and Potamotrygon orbignyi (Castelnau, 1855) (Chondrichthyes: Potamotrygonidae) in the Venezuelan llanos. Aqua, Journal or Ichthyology & Aquatic Biology 2: 39-52. Lasso, C. A., D. Lew, D. Taphorn, C. DoNascimiento, O. M. Lasso-Alcalá, F. Provenzano, A. Machado-Allison. 2004a. Biodiversidad ictiológica continental de Venezuela. Parte I. Lista de especies y distribución por cuencas. Memoria de La Fundación La Salle de Ciencias Naturales 159-160: 105-195. Lasso, C. A., J. I. Mojica, J. S. Usma, J. Maldonado, C. DoNascimiento, D. Taphorn, F. Provenzano, O. Lasso-Alcalá, G. Galvis, L. Vasquez, M. Lugo, A. Machado-Allison, R. Royero, C. Suarez y A. Ortega-Lara. 2004b. Peces de La cuenca del río Orinoco. Parte I: Lista de especies y distribución por subcuencas. Biota Colombiana 5 (2): 95-158. Lasso, C. A., J. S. Usma, F. Villa, M. T. Sierra-Quintero, A. Ortega-Lara, L. M. Mesa, M. A. Patiño, O. M. Lasso-Alcalá, K. González-Oropesa, M. P. Quiceno, A. Ferrer y C. F. Suárez. 2009. Peces de la Estrella Fluvial Inírida: ríos Guaviare, Inírida, Atabapo y Orinoco, Orinoquia colombiana. Biota Colombiana 10 (1 y 2): 89 – 122. Lasso, C. A., A. Acosta-Santos y E. Agudelo. 2010. Primer registro de la raya látigo o antena Plesiotrygon iwamae Rosa, Castello y Thorson 1987 (Chondrichthyes: Potamotrygonidae) para Colombia. Biota Colombiana 11 (1 y 2): 173-175. Lonardoni, A. P., E. Goulart, E. F. Oliveira y M. Abelha. 2006. Hábitos alimentares e sobreposição trófica das raias Potamotrygon • • • • • • • • falkneri e Potamotrygon motoro (Chondrichthyes: Potamotrygonidae) na planície alagável do alto rio Paraná, Brasil. Acta Scientiarum Biological Sciences 28: 195-202. López, H. L y J. Ponte Gómez. 2013. Ictiólogos de la Argentina: Mariano Narciso Antonio José Castex. ProBiota, FCNyM, UNLP, La Plata, Argentina, Serie Técnica y Didáctica 14: 1-30. López-Corcuera, G. 1984. Fauna legendaria. Colección Fauna de los Llanos de Venezuela. Fundación Científica Fluvial de los Llanos. Editorial Andes, Caracas, Venezuela. 131 pp. Lovejoy, N. R. 1996. Systematics of myliobatoid elasmobranches: with emphasis on the phylogeny and historical biogeography of Neotropical freshwater stingrays (Potamotrygonidae: Rajiformes). Zoological Journal of the Linnean Society 117: 207-257. Lovejoy, N. R. 1997. Stingrays, parasites, and Neotropical biogeography: a closer look at Brooks et al.’s hypotheses concerning the origin of Neotropical freshwater rays (Potamotrygonidae). Systematic Biology 46: 218-230. Maldonado-Ocampo, J. A., F. A. Villa-Navarro, A. Ortega-Lara, S. Prada-Pedreros, U. Jaramillo-Villa, A. Claro, J. S. Usma, T. S. Rivas, W. Chaverra, J. F. Cuesta y J. E. Gracía-Melo. 2006a. Peces del río Atrato, zona hidrogeográfica del Caribe, Colombia. Biota Colombiana 7: 143-154. Maldonado-Ocampo, J., M. Lugo, J. D. Bogotá-Gregory, C. A. Lasso, L. Vásquez, J. S. Usma, D. Taphorn y F. Provenzano. 2006b. Peces del río Tomo, Cuenca del Orinoco, Colombia. Biota Colombiana 7: 113-127. Marcgrave, G. 1648. Historiae rerum naturalium Brasiliae. En: Historiae naturalis Brasiliae, auspicio et beneficio ilustriss,, I. Mavritii Com. Nassav illius provinciae et maris summi praefecti adornata. Piso, G and G. Marcgrave. F. H. Haack y L. Elsevier, Leiden, Netherland. Marques, F. 2000. Evolution of Neotropical freshwater stingrays and their parasites: taking into account space and time. Tesis Doctoral, University of Toronto, Toronto. 322 pp. M. A. Morales-B. • • • • • • • • • Marques, F. P. L., D. R. Brooks y C. A. Lasso. 2001. Anindobothrium n. gen. (Eucestoda: Tetraphyllidea) inhabiting marine and freshwater potamotrygonid stingrays. Journal of Parasitology 87: 666-672. Mejía-Falla, P. A., A. F. Navia, L. M. Mejía, A. Acero y E. A. Rubio. 2007. Tiburones y rayas de Colombia. Lista revisada y comentada. Boletín Investigaciones Marinas y Costeras 36: 111-149. Miller-Hurtado, H., D. C. Taphorn, J. S. Usma. 2009. Lista preliminar de los peces del río Papunahua, cuenca del río Iníridadepartamento del Vaupés, Colombia. Biota Colombiana 10 (1-2): 163-169. Miranda Ribeiro, A. 1907. Fauna brasiliense. Peixes II (Desmobranchios). Archivos do Museu Nacional do Rio de Janeiro 14: 129217. Mojica, J. I., C. Castellanos, J. S. Usma y R. Álvarez-León (Eds.). 2002. Libro rojo de peces dulceacuícolas de Colombia. Serie Libros Rojos de Especies Amenazadas de Colombia. Instituto de Ciencias Naturales, Universidad Nacional de Colombia, Ministerio del Medio Ambiente, Bogotá, Colombia. 319 pp. Mojica, J., G. Galvis, F. Arbeláez, M. Santos, S. Vejarano, E. Prieto-Piraquive, M. Arce, P. Sánchez-Duarte, C. Castellanos, A. Gutiérrez, S. Duque, J. Lobón-Cerviá, J. y C. Granado-Lorencio. 2005. Peces de la cuenca del río Amazonas en Colombia: Región de Leticia. Biota Colombiana 6 (2): 191-210. Mojica, J., G. Galvis, P. Sánchez-Duarte, C. Castellanos y F. Villa. 2006. Peces del Valle Medio del río Magdalena, Colombia. Biota Colombiana 7 (1): 23 – 38. Mojica, J. I., J. S. Usma, R. Álvarez-León y C. A. Lasso (Eds.). 2012. Libro rojo de peces dulceacuícolas de Colombia 2012. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt, Instituto de Ciencias Naturales de la Universidad Nacional de Colombia, WWF Colombia y Universidad de Manizales. Bogotá, D. C., Colombia, 319 pp. Müller, J. y F. G. J. Henle. 1841. Systematische beschreibung der Plagiostomen. Verlag von Veit, Berlin, Germany. 200 pp. • • • • • • • • • Muñoz-Osorio, L. A. y P. A. Mejía-Falla. Primer registro de la raya manzana, Paratrygon aiereba (Müller y Henle, 1841) (Batoidea: Potamotrygonidae) para el río Bita, Orinoquia, Colombia. Latin American Journal of Aquatic Research 41 (1): 189-193. Myers, G. S. 1947. The Amazon and its fishes. Part 2, The fishes. The Aquarium Journal 18 (4): 13-20. Myers, G. S. 1949. Salt tolerance of freshwater fish groups in relation to zoogeographical problems. Bijdragen Tot De Dierkunde 28: 315-322. Ortega, H., J. I. Mojica, J. C. Alonso y M. Hidalgo. 2006. Listado de los peces de la cuenca del río Putumayo en su sector colombo – peruano. Biota Colombiana 7 (1): 95 – 112. Ortega, H., M. Hidalgo, E. Correa, J. Espino, L. Chocano, G. Trevejo, V. Meza, A. M. Cortijo y R. Quispe. 2011. Lista anotada de lós peces de aguas continentales del Perú: estado actual del conocimiento, distribución, usos y aspectos de conservación. Ministerio del Ambiente, Dirección General de Diversidad Biológica – Museo de Historia Natural, UNMSM. 48 pp. Ortega-Lara, A., O. M. Lasso-Alcalá, C. A. Lasso, G. Andrade de Pasquier y J. D. Bogotá-Gregory. 2012. Peces de la subcuenca del río Catatumbo, cuenca del Lago de Maracaibo, Colombia y Venezuela. Biota Colombiana 13 (1): 71-98. Pântano-Neto, J. y A. M. Souza. 2002. Anatomia da musculatura oro-braquial associada à alimentação de duas espécies de raias de água doce (Potamotrygonidae; Elasmobranchii). Publicações avulsas do Instituto Pau Brasil de História Natural 5: 53-65. Puentes, V. A. F. Navia, P. A. Mejía-Falla, J. P. Caldas, M. C. Diazgranados y L. A. Zapata. (Eds.). 2009. Avances en el conocimiento de tiburones, rayas y quimeras de Colombia. Fundación SQUALUS, Ministerio de Ambiente Vivienda y Desarrollo Territorial, Instituto Colombiano Agropecuario, COLCIENCIAS, Conservación Internacional, WWF Colombia. 245 pp. Ramírez-Gil, H. y R. Ajiaco-Martínez. 2001. La pesca de especies de interés orna- 59 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA HISTORIA DE LA INVESTIGACIÓN • • • • • • • • 60 mental en el área de influencia de Inírida, Guainía. Pp. 139-154. En: Ramírez-Gil, H. y R. Ajiaco-Martínez. (Eds.). La pesca en la baja Orinoquia colombiana: una visión integral. Instituto Nacional de Pesca y Acuicultura, INPA. Ramírez-Gil, H., L. Carrillo-Villar, E. Lacera-Padilla y R. Ajiaco-Martínez. 2001. La pesca de especies de interés ornamental en el área de influencia de Puerto Carreño. Pp. 123-137. En: Ramírez-Gil, H. y R. AjiacoMartínez. (Eds.). La pesca en la baja Orinoquia colombiana: una visión integral. Instituto Nacional de Pesca y Acuicultura, INPA. Rodríguez-Guerra, J. C., C. A. Lasso y O. M. Lasso-Alcalá. 2008. Aportación al conocimiento de la bioecología de la raya fluvio-estuarina Potamotrygon sp. (Myliobatiformes, Potamotrygonidae) en el delta del Orinoco y golfo de Paria, Venezuela. Memoria de la Fundación La Salle de Ciencias Naturales 168: 83-104. Rosa, R. S. 1985a. A systematic revision of the South American freshwater stingrays (Chondrichthyes: Potamotrygonidae). Tesis Doctoral, College of William and Mary, Williamsburg, Virginia. 523 pp. Rosa, R. S. 1985b. Further comment on the nomenclature of the freshwater stingray Elipesurus spinicauda Schomburgk, 1843 (Chondrichthyes: Potamotrygonidae). Revista Brasileira de Zoologia 3: 27-31. Rosa, R. S. 1991. Paratrygon aiereba (Müller and Henle, 1841) the senior synonym of the freshwater stingray Disceus thayeri Garman, 1913 (Chondrichthyes: Potamotrygonidae). Revista Brasileira de Zoologia 7: 425-437. Rosa, R. S. 2009. Elasmobranchii. Pp. 203210 En: Rocha, R. M. y W. A. Boeger (Eds.). Estado da arte e perspectivas para a Zoologia no Brasil. Sociedade Brasileira de Zoologia, Ed. UFPR; Curitiba. Rosa, R. S., H. P. Castello y T. B. Thorson. 1987. Plesiotrygon iwamae, a new genus and species of Neotropical freshwater stingray (Chondrichthyes: Potamotrygonidae). Copeia 2: 447-458. Rosa, R. S. y M. R. Carvalho. 2007. Família Potamotrygonidae. Pp. 17-18. En: Buckup, • • • • • • • • • P. A., N. A. Menezes y M. S. Ghazzi (Orgs.), Catálogo das espécies de peixes de água doce do Brasil. Museu Nacional, Rio de Janeiro, Brasil. Rosa, R. S., P. Charvet-Almeida y C. C. D. Quijada. 2010. Biology of the South American potamotrygonid stingrays. Pp. 241286 En: Carrier, J. C., J. A. Musick y M. R. Heithaus (Eds.). Sharks and their relatives II: Biodiversity, adaptive physiology and conservation. Taylor y Francis Group, New York, USA. Ross R. A. y F. Schäfer. 2000. Aqualog Süsswasser Rochen: Freshwater Rays. Verlag ACS, Mörfelden-Walldorf, Germany. 192 pp. Roulin, M. 1829. Description d’une pastenague fluviatile du Meta (Pastenague de Humboldt). Annales des Sciences Naturelles 6: 104-107. Sanabria, A. I. 2004. Catálogo de las principales especies de peces ornamentales de Colombia: especies de interés comercial. En: Beltrán, I. C., P. V. Daza y M. A. Landines (Eds.). Incoder. Bogotá, D. C., Colombia (CD ROM). Schomburgk, R. H. 1843. Fishes of British Guiana, Part 2. En: Jardine, W. (Ed.). Naturalist’s Library, vol 40. W. H. Lizars, Edinburgh, Scotland. Séret, B. y J. D. McEachran. 1986. Catalogue critique des types de Poissons du Muséum national d’Histoire naturelle (Suite). Poissons Batoides (Chondricthyes, Elasmobranchii, Batoidea). Bulletin du Muséum d’Histoire Naturelle 8: 3-50. Thorson, T. B., C. M. Cowan y D. E. Watson. 1967. Potamotrygon spp: elasmobranchs with low urea content. Science 158: 375377. Thorson, T. B., J. K. Langhammer y M. I. Oetinger. 1983. Reproduction and development of the South American freshwater stingrays, Potamotryon circularis and P. motoro. Environmental Biology of Fishes 9: 3-24. Villa-Navarro, F. A., P. T. Zúñiga-Upegui, D. Castro-Roa, J. E. García-Melo. M. E. García-Melo y M. E. Herrada-Yara. 2006. Peces del alto Magdalena, cuenca del río M. A. Morales-B. • • Magdalena, Colombia. Biota Colombiana 7: 3-22. Vellard, J. 1931. Venim des raies (Taeniura) du Rio Araguaya (Brésil). Comptes Rendus de l’Académie des Sciences 192: 1279-1281. Wallace, A. R. 2002. Fishes of the Rio Negro. Museu de Zoologia Universidade de São Paulo, São Paulo, Brasil. 62 pp. • Zorzi G. D. 1995. The biology of freshwater elasmobranchs: an historical perspective. En: Oetinger, M. I. y G. D. Zorzi (Eds.). The Biology of Freshwater Elasmobranchs, a Symposium to Honor Thomas B. Thorson. Journal of Aquariculture and Aquatic Sciences 7: 10-31. Paratrygon aiereba, río Orinoco. Foto: M. A. Morales-Betancourt 61 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA ASPECTOS METODOLÓGICOS 62 P. Sánchez-Duarte 3. Aspectos metodológicos 3.1 Métodos para la captura y análisis de datos bioecológicos de las rayas de agua dulce (Potamotrygonidae) 3.2 Utilización de métodos no letales para el estudio de las rayas de agua dulce (Potamotrygonidae) 3.3 Trabajo de laboratorio para la identificación de las rayas de agua dulce (Potamotrygonidae) 3.4 Elaboración de las fichas de especies 63 Captura de Potamotrygon orbignyi, río Orinoco. Foto: C. A. Lasso M. A. Morales-B. 3.1 Métodos para la captura y análisis de datos bioecológicos de las rayas de agua dulce (Potamotrygonidae) Cecile S. Gama, Maria L. Goés de Araújo, Carlos A. Lasso, Mónica A. Morales-Betancourt, Paula Sánchez-Duarte y Adriana Guzmán Los métodos de captura y análisis de datos para las rayas de agua dulce poco difieren de los métodos utilizados tradicionalmente en el estudio de otros peces, tanto teleósteos como elasmobranquios, sean marinos o de agua dulce. La diferencia más importante viene determinada por los hábitos esencialmente bentónicos y la conformación corporal (deprimida dorsoventralmente), que limitan la cantidad y la efectividad de los métodos o artes de pesca que son realmente eficientes para su captura. En ese sentido, se tratará de dar a continuación algunos ejemplos de métodos de captura, colecta y artes de pesca, así como su efecto en los individuos. La información está basada en la experiencia en los países objeto de estudio, con sus particularidades locales, ya sea con fines de pesca comercial (alimento y ornamental) o pesca científica. Estos métodos por lo general, requieren del sacrificio de los ejemplares para análisis posteriores en laboratorio. En el Capítulo 3.2 se describen en detalle los métodos no letales. Métodos y artes de pesca o colecta Dependiendo del tipo de hábitat se emplean diferentes métodos, artes o aparejos de pesca activos o pasivos que pueden agruparse de la siguiente manera: Métodos pasivos Mallas, redes agalleras, trasmallos, chinchorros, redes de ahorque (redes de espera). Son redes mono o multifilamento de longitud, altura y tamaño del entrenudo (abertura de malla) variable (40, 60, 80 y 100 mm), que son caladas a diferentes profundidades y que permanecen en la misma posición hasta que se levantan y revisan. Capturan rayas de todas las especies y tamaños. Monofilamento. No es un método muy eficiente para la colecta de rayas pues depende de las características del ambiente. Si el fondo del cuerpo de agua es irregular y con mucha corriente, es poco probable que la porción inferior de la malla, que tiene plomos, pueda permanecer bien ajustada. Por lo tanto, al moverse las rayas van a 65 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA ASPECTOS METODOLÓGICOS pasar por los espacios dejados entre la malla y el sustrato y al contrario de los peces fusiformes, cuando las rayas se encuentran con redes de espera, difícilmente son atrapadas. Multifilamento. Sigue el mismo principio de las redes monofilamento, pero cuando las rayas se mueven buscando otro lugar, un leve contacto de la espina aserrada de la cola con la malla, será suficiente para que las espinas se enreden en los filamentos de la red. Debido a su coloración, la red puede ser más fácil de detectar visualmente por las rayas, en especial si se utiliza en ambientes de aguas claras y transparentes. Métodos activos 1) Atarrayas. Consta de una red más o menos circular con una relinga de plomos en su margen, que cuando es lanzada, se abre y luego se cierra rápidamente en el agua, quedando los peces atrapados en el copo (Lasso 2004). Requieren de un operario, investigador o pescador que la lance al agua, ya sea desde la orilla o de la embarcación. Dependiendo de las características del cuerpo de agua, la captura puede ser direccionada o al azar. Este aparejo no se debe utilizar en ambientes con fondo rocoso o con muchos troncos. Capturan rayas medianas y/o pequeñas. 2) Arrastrón, arrastre, chinchorros o redes de playa. Son redes mono o mul- tifilamento que son arrastradas a lo largo de un área, revolviendo el fondo y capturando los peces. Requiere de dos operarios, uno de los cuales permanece en la orilla con el calón o cabecero (vara), mientras que el otro se desplaza perpendicularmente a este, hacia el interior del cuerpo de agua. También puede utilizarse desde una embarcación y se emplea generalmente en 66 aguas abiertas (Lasso op. cit.). Capturan rayas de todos los tamaños y especies, especialmente aquellas que viven sobre fondos arenosos. 3) Redes de arrastre. En la pesca de gran escala, el arrastre es realizado por barcos, pero artesanalmente la red se opera de forma manual con un pescador dirigiendo cada uno de los extremos. Este método es responsable por el mayor número de accidentes entre pescadores y rayas. Hay un tamaño intermedio que corresponde a la red de arrastre camaronera muy utilizada en los estuarios o deltas y que consiste de una pequeña lancha de madera o fibra con un motor fuera de borda de unos 40 HP y una red de arrastre camaronera. Es muy eficiente para la captura de rayas en el fondo del cauce principal del río y sobre todo en zonas fangosas someras. Lo mejor de este método es que captura las rayas vivas (si los arrastres son cortos -máximo media hora- y permite devolver las rayas al agua (Lasso y Sánchez-Duarte 2011). Captura rayas de varias especies y todos los tamaños, aunque es más eficiente con rayas medianas y/o pequeñas. En la figura 1 (a – h) se muestran algunos de estos métodos de pesca. 4) Anzuelos. Línea de mano: presenta la ventaja de alcanzar profundidades mayores y ambientes inaccesibles para otros aparejos. Se recomienda número de anzuelo 5, 6 y 7. Captura rayas medianas y/o grandes de cualquier especie. Trapo: nombre regional utilizado en el norte de Brasil para anzuelos colocados atados a varas, troncos o ramas, siguiendo el mismo principio de las líneas de mano, pero se distribuyen varios anzuelos que deben ser inspeccionados después de un P. Sánchez-Duarte a. b. c. d. e. f. Figura 1. a) Pesca con redes multifilamento, Llanos de Venezuela; b) pesca nocturna, río Amazonas, Puerto Nariño, Colombia; c) redes monofilamento para la captura de Potamotrygon magdalenae; d) pesca con chinchorro (Paratrygon aiereba), Amazonia peruana; e) pesca con atarraya, río Orinoco, raudal de Atures, Venezuela; f) pesca de arrastre camaronero (delta del Orinoco). Fotos: C. A. Lasso (a), M. A. Morales-Betancourt (b, e), Grupo Yuma Challwan (c), H. Hildago (d), P. Sánchez-Duarte (f). 67 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA ASPECTOS METODOLÓGICOS g. h. Continuación figura 1. g) Pesca con atarraya multifilamento, río Amazonas, Brasil; h) pesca experimental de arrastre. Fotos: C. Gama (g) y N. L. Chao (h). cierto intervalo de tiempo. En Venezuela se conoce como “rama” y se utiliza básicamente para la pesca de Paratrygon aiereba. Espinel, espiñel o calandrio: consiste en disponer varios anzuelos espaciados en una misma línea que está extendida y posicionada en el fondo del cuerpo de agua. Es un buen método para ser utilizado en playas y ambientes con pocos obstáculos en el fondo, como rocas y troncos, dado que los anzuelos pueden quedar enredados. Captura rayas medianas a grandes, ocasionalmente más pequeñas. En la Amazonia colombiana se usa para la captura de rayas adultas de gran tamaño en su época de reproducción en julio y agosto (Paratrygon aiereba y Plesiotrygon iwamae), pero no para alimento sino como ornamentales, ya que las hembras abortan las crías las cuales son recogidas por el pescador y la madre es devuelta al río. En Venezuela pasó a ser el arte de pesca preferencial en las pesquerías de Paratrygon aiereba en sustitución del “arponeo”, que era menos eficiente y más costoso. En Perú, los “pishiñeros” o pescadores de peces ornamentales, en este 68 caso los que se dedican a la captura de las rayas cerca al río Nanay, utilizan espineles con carnada para capturar “rayas tigre” (Potamotrygon tigrina) y “rayas otorongo” (Potamotrygon motoro), etc. Utilizan un cordel largo de la orilla hacia el centro del río con carnada que puede ser peces, pollo, etc. y una pesa para estabilizar en el fondo los anzuelos ubicados en el cordel principal (Ortega com. pers.). En Brasil se utiliza el espinel de fondo para la captura comercial de rayas de agua dulce en el medio y bajo río Amazonas y río Tapajós. Son espineles de 1.000 - 1.200 m de longitud (400 anzuelos), con una distancia entre anzuelos de 1,8 m. Los espineles se hacen con hilo de nylon de 2,5 mm y anzuelos número 4. Se capturan principalmente Potamotrygon motoro, Paratrygon aiereba y Plesiotrygon iwamae. En el Río Negro, se utilizan espineles con hilo de nylon de 2,5 mm y unos 100 anzuelos de números 5, 6 y 7 (el fin de la pesca son bagres - Siluriformes). Las principales especies de rayas capturadas son P. Sánchez-Duarte Potamotrygon motoro y Paratrygon aiereba. Las líneas con anzuelos número 1, pueden estar a la deriva en el cauce principal del Río Negro, durante octubre a diciembre, para capturar grandes bagres (Siluriformes) y ocasionalmente capturan rayas mantas (Paratrygon aiereba). En la figura 2 (a – f) se ilustran algunos de estos aparejos. 5) Zagalla y arpón de cabeza desprendible. En Colombia y Venezuela la zagalla, también llamado chuzo, es de hierro y presenta dos puntas dentadas de 12 cm de longitud, unida a una vara de madera de 1,2 a 1,5 m de longitud. Tiene un lazo o soltadera al final de la vara, que sirve para ubicar la presa (Ajiaco-Martínez et al. 2012). En Brasil su uso también es común. El arpón es una vara de hierro de 8 a 12 cm de largo, que puede ser o no bifurcada. Se fija a una vara de madera de 1,2 a 2 m de largo. Al final de la vara de hierro se une una soga que se suelta cuando el arpón se fija a la presa. Se puede usar desde la orilla, una embarcación o mediante inmersiones subacuáticas con careta (Ajiaco-Martínez et al. 2012, Lasso 2004). Dependiendo del ambiente puede ser un método de captura muy selectivo y puede usarse tanto de día como de noche. Se utiliza en zonas poco profundas y de agua transparente (claras o negras). Sin embargo, en aguas turbias donde no es posible tener contacto visual el fondo, las arponeadas son realizadas de forma aleatoria y la captura de las rayas ocurre por lo general al azar. Independientemente del tipo de cuerpo de agua, también es posible acceder a los fondos que no pueden ser alcanzados con otros aparejos. Su uso es particular para la captura de Paratrygon aiereba en Venezuela (ver Barbarino y Lasso 2005, 2009 y Lasso et al. 2013 – ver ficha de la especie- este libro, para mayor detalle). En Brasil, la zagalla es utilizada comúnmente para la pesca artesanal de especies que se encuentran en zonas poco profundas (p. e. cíclidos) y es un método común utilizado en el Río Negro en la pesca negativa de rayas de agua dulce. 6) Arco y flecha. Por lo general lo usan los grupos indígenas, con fines alimenticios. El arco está fabricado de madera flexible y la fibra que lo templa puede ser natural o de nylon. La flecha mide entre 1,2 a 1,5 m de longitud y presenta tres a cinco puntas dentadas de 5 cm de longitud. La flecha presenta un lazo que sostiene el pescador para no perder la presa (Ajiaco-Martínez et al. 2012). En la figura 3 (a – f) se muestran las zagallas, arpones, arco y flecha. 7) Nasas. Aparejo utilizado en la región de Puerto Carreño e Inírida (Orinoquia colombiana) y áreas aledañas de Venezuela, también se usa en la Amazonia. Están fabricadas en hierro, de forma cónica, con 25 cm de diámetro máximo. También puede ser elaborada con una canastilla de ventilador. Ambas estructuras además de la parte metálica tienen una bolsa de anjeo (malla) donde es atrapada la raya (AjiacoMartínez et al. 2012). El pescador detecta visualmente al pez y realiza un lance colocando la nasa encima de la raya, la cual se mueve hacia la bolsa, de donde es retirada y dejada en el bote para el transporte (Ajiaco-Martínez et al. 2012). Se emplea para especies de tamaño pequeño o juveniles, en ocasiones neonatos. En el Río Negro la pesca de rayas se realiza (especialmente neonatos y juveniles), con 69 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA ASPECTOS METODOLÓGICOS a. b. c. d. e. f. Figura 2. a) Pesca con espinel (Potamotrygon sp.), Amazonia brasileña; b) pesca con espinel (Potamotrygon motoro), Amazonia ecuatoriana; c) pesca incidental con espinel (Paratrygon aiereba), Arauca, Orinoquia colombiana; d) pesca con línea y anzuelo número 1, utilizada en el Río Negro durante noviembre a febrero para la captura de grandes bagres, captura como pesca incidental a Paratrygon aiereba; e) pesca deportiva con anzuelo (Paratrygon aiereba), río Cinaruco, Orinoquia venezolana; f) espinel utilizado en el Río Negro. Fotos: C. Gamba (a), J. I. Jácome (b), F. Mijares (c), C. Montaña (e), M. L. D. Araujo (d, f). 70 P. Sánchez-Duarte a. b. c. d. e. f. Figura 3. a) Pesca con zagalla (Potamotrygon motoro), río Inírida, Colombia; b) pesca con zagalla (Potamotrygon schroederi), caño Dagua, Orinoquia colombiana; c) pesca con zagalla (Potamotrygon sp.), Mavaca, alto Orinoco, Venezuela; d) pesca con arpón (Potamotrygon orbignyi), Puerto Carreño, río Orinoco, Colombia; e) pesca con arpón de cabeza desprendible (Paratrygon aiereba), río Apure, Venezuela; f) pesca con arco y flecha (Potamotrygon motoro), río Orinoco, Bojonawi, Colombia. Fotos: M. A. Morales-Betancourt (a), C. A. Lasso (b, d, f), C. Montaña (c), A. Barbarino (e). 71 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA ASPECTOS METODOLÓGICOS un arte compuesto por red de malla y una varilla de madera flexible, de dimensiones 1,2 x 0,7 x 0,5 m. La faena de pesca se realiza por la noche con linterna o una luz de bicicleta conectada a una batería de 42 V y a remo o canalete. 8) Careta o máscara de buceo. Para inmersiones subacuáticas superficiales en ríos de aguas claras y/o negras. El pescador avista la raya y esta es capturada manualmente con un chinchorro, red de mano pequeña o nasa. Originalmente utilizada en la Orinoquia, su uso se ha extendido a la Amazonia. Se usa para todas las especies en sus fases juveniles (Figura 4 a – d). Esta forma de pesca se emplea también en el río Tapajós, para la captura de rayas (neonatos y juveniles). La faena de pesca se puede realizar durante el día o la noche, en el último caso se utiliza una linterna. Impacto de los artes y métodos de pesca De los métodos listados arriba, algunos son más agresivos para la integridad de los peces que otros, y es por ello, que dependiendo de los objetivos de cada estudio, la selección del arte debe ser pre-definida para que no haya pérdida de información, esfuerzo en la captura y maltrato a los animales. Debido a la baja tasa de crecimiento y fecundidad del grupo, los largos periodos de gestación, longevidad alta y la madurez sexual tardía, en comparación con la mayoría de los peces óseos (Camhi et al. 1998, Musick y Bonfil 2004), las rayas constituyen un grupo de especies con baja densidad poblacional, principalmente en áreas con dos o más especies simpátricas. Las rayas generalmente tienen una movilidad baja y por lo general forman poblaciones 72 locales con baja capacidad de dispersión. Probablemente son territoriales y filopátricas (Frederico et al. 2012, Rincón 2006). A estos elementos, debe sumarse la presión ejercida por la pesca artesanal, pues a pesar de no ser aprovechadas en las pesquerías, son sacrificadas frecuentemente, debido a los problemas causados por los aguijones o espinas de la cola de las rayas, a los pescadores. Es posible que la creciente degradación de hábitats y la pesca con fines ornamentales y alimenticio, también estén contribuyendo a la disminución de las poblaciones. Ante esta situación, es necesaria una regulación de los métodos de colecta para evitar mayores impactos en las poblaciones y optimizar la toma de datos. Algunos métodos permiten el registro de información para el conocimiento científico básico, es decir, aspectos ecológicos y sistemáticos esenciales de las especies, sin alterar la integridad de los individuos, con el objeto de conocerlas para su conservación. La utilización de métodos no letales para el estudio de las rayas consiste en garantizar la posibilidad de seleccionar los individuos que deben ser mantenidos vivos o sacrificados. El acompañamiento a los animales durante un largo periodo de tiempo puede ayudar a esclarecer cuestiones en torno a las tasas de crecimiento, uso del hábitat para alimentación y reproducción, periodos de actividad y otros factores individuales como lesiones y posibles recuperaciones. Para los trabajos de acompañamiento de poblaciones es imprescindible el reconocimiento individual de los ejemplares. P. Sánchez-Duarte a. b. c. d. Figura 4. Captura de rayas (Potamotrygon motoro y Potamotrygon sp.) con nasa; a) con caretéo en el río Bita (aguas claras), b) detalle de pesca de Potamotygon orbignyi en el río Bita, c) en el caño Dagua, d) en el río Atabapo (aguas negras), Orinoquia colombiana. Fotos: M. A. Morales-Betancourt. Marcas externas (“tags”) se utilizan frecuentemente dado su bajo costo y facilidad de observación en campo. Esas marcas consisten de perlas o elastómeros de color, cuyas innumerables combinaciones confieren una identidad única para cada individuo. Sin embargo, las características medio ambientales y los eventos impredecibles, pueden dañar estas marcas o incluso removerlas de los animales en cuestión, al pasar por debajo de troncos, grietas en las rocas, etc. Las marcas internas, aunque no son visibles fácilmente, se conservan más y permanecen en el cuerpo del animal por tiempo indefinido. Los microchips del tipo PIT (Passive Integrated Transponder) se pueden introducir por vía subcutánea en lugares estandarizados por el investigador para facilitar su identificación. Un lugar adecuado para la inserción y con menor probabilidad de pérdida por depredación, es en paralelo a la línea media del cuerpo, ligeramente antes de la inserción de la cola en el disco (Figura 5). Las marcas externas pueden aumentar la mortalidad de los individuos neonatos, 73 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA ASPECTOS METODOLÓGICOS a. b. Figura 5. a) Instalación de un microchip en un ejemplar de Potamotrygon cf. dumerilli, con longitud de 30,2 cm AD; b) utilización de dispositivo para detetcar la presencia del microchip. Fotos: A. Torres (a) y J. P. Lima (b). principalmente en especies pequeñas. Para especies de mayor tamaño las marcas exteriores del tipo T-Bar ofrecen resultados satisfactorios (Figura 6). Estos microchips son utilizados normalmente para la marcación de animales en estaciones piscícolas y su aplicación en rayas en el medio natural ha demostrado ser eficaz, lo que puede generar datos sobre crecimiento, desplazamiento individual y periodos reproductivos. Para mayor detalle de los métodos no letales, consultar el Capítulo 3.2. Las rayas de agua dulce son muy resistentes a la manipulación durante el muestreo y pueden permanecer por fuera del agua el tiempo suficiente para realizar registros biométricos, fotográficos, etc. y posteriormente ser devueltas al agua. Sin embargo, lo ideal es poder manipularlas en recipientes con agua. Su supervivencia después de la liberación dependerá del grado de daño que se les haya causado durante la captura. Potamotrygon schroederi es una 74 Figura 6. Individuo de Paratrygon aiereba en recuperación luego de ser anestesiado con eugenol y marcado con T-BAR. Foto: M. L. G. Araújo. especie muy sensible al manejo posterior a la captura. Para evitar la mortalidad, se recomienda dejar los ejemplares en un recipiente con agua, preferiblemente del mismo río. Dependiendo del tamaño de los individuos se pueden poner de uno a cuatro animales (hasta 30 cm AD) en un recipiente con 20 l de agua. Para la P. Sánchez-Duarte manipulación, los individuos se pueden anestesiar con eugenol (aceite de clavo de olor): 1 ml diluido en 5 ml de etanol al 70%. Después de la manipulación, se puede colocar el animal al movimiento del agua del medio y liberarlo. Con esta manipulación, la tasa de mortalidad fue del 0,3% para las especies de Río Negro. Entre los métodos que no causan daño físico a los ejemplares están la nasa, red de arrastre, atarraya, el arrastrón y el “zangarreo o chinchorreo”. Con la atarraya y el arrastrón, las rayas pueden ser rápidamente manipuladas y liberadas. En las redes de enmalle, si las rayas capturadas permanecen mucho tiempo enredadas, pueden morir o por estar indefensas volverse presas frente a otros depredadores. En algunas localidades, constituyen el método más adecuado para la captura, sin embargo, el intervalo de tiempo entre las inspecciones debe ser reducido para evitar pérdidas. Los anzuelos tienden a causar lesiones en la boca de las rayas (Figura 7), pero cuanto más corto sea el tiempo que permanecen enganchadas, mucho menor será el daño. A pesar de que las lesiones pueden parecer demasiado agresivas, la recuperación de las rayas es impresionante. Su cicatrización es muy rápida y eficiente, por lo que es posible el registro de sucesivas recapturas de un mismo individuo mediante este método (Figura 8). El anzuelo es uno de los artes de pesca que presenta la tasa de mortalidad más alta (alrededor del 80%), debido principalmente a que los animales lo engullen y se puede fijar en el esófago o en el estómago. Hay casos de rayas que tragan el anzuelo y se vuelven incapaces para seguir alimentándose. Las zagallas y arpones podrían ser utilizados como un método no letal para la captura si se clavan en los bordes del disco, 2 1 a. b. Figura 7. a) Lesión causada por el anzuelo de un espinel (flecha 1); b) después de dos meses el mismo individuo es recapturado y está totalmente recuperado de la primera lesión. La flecha 2 muestra la segunda lesión causada por la recaptura. Fotos: C. S. Gama. 75 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA ASPECTOS METODOLÓGICOS a. b. Figura 8. Ejemplar de Potamotrygon sp. colectado en dos momentos diferentes: septiembre/2011 (longitud disco = 22,2 cm); mayo/2012 (longitud disco = 24,6 cm), respectivamente, mostrando la recuperación de lesiones en el disco. La flecha señala la pérdida de la cola, probablemente resultado de la depredación. Fotos: C. S. Gama. pero preferiblemente deben ser evitadas dado que la garantía de supervivencia del ejemplar está directamente relacionada con la eficacia del operador para lograr engancharla por el disco, evitando así herir su porción anterior y los órganos internos. Si la zagalla afecta la línea lateral o el cartílago, puede no ser mortal, pero afecta el mecanismo sensorial y el cartílago no se regenera (Figura 9). En aguas claras y poco profundas el enganche por el disco es mucho más probable, pero cuando los “zagalleos y/o arponeos” se realizan al azar en el caso de aguas turbias o un poco más profundas, siempre existe la posibilidad de alcanzar al animal en aquellas partes no deseadas. Registro de datos biológicos en campo Coloración La identificación de las rayas se realiza principalmente con base en el patrón de 76 Figura 9. Marca en el disco dejada por la captura con zagalla. Foto: C. S. Gama. la coloración dorsal del disco. Para garantizar conservar ese patrón se debe evitar mantener individuos vivos en recipientes de color claro por mucho tiempo, pues la coloración dorsal tiende a perder su contraste, dificultando así el proceso de identificación del ejemplar. P. Sánchez-Duarte Toma de datos mínimos en campo Además de considerar por supuesto los datos de colecta clásicos (localidad, coordenadas, etc.), es imprescindible contar al menos con la identificación del sexo (medir el largo del clasper en machos), el ancho y largo del disco, así como el peso (Figura 10). Debe prestarse especial atención a la presencia de ectoparásitos en la región ventral del cuerpo y ser colectados inmediatamente antes de la fijación o preservación del animal completo. Si el objetivo es realizar un estudio de parásitos branquiales, hay que evitar el uso de anestésicos como eugenol. Se recomienda utilizar un anestésico intramuscular. Fijación y conservación Después de las captura se puede iniciar el proceso de fijación una vez se confirme la muerte del ejemplar. Debido a los problemas de identificación de las especies y la posibilidad de hibridar entre ellas (Achenbach y Achenbach 1976, Lasso 1985, Toffoli et al. 2008, Garrone Neto et al. 2007), es clave la toma de muestras de tejidos para la creación de un banco genético que permita comparaciones a futuro. Para ello deben conservarse las muestras en alcohol 70 o 95% en microtubos de 2 ml (Figura 11). Las rayas deben ser introducidas en un recipiente con una solución de agua y eugenol, para que se garantice que el ejemplar no esté vivo durante el proceso de fijación, dado que se trata de organismos muy resistentes que pueden permanecer por un tiempo razonable fuera del agua y continuar mostrando signos de vida. La presencia de marcas de mordeduras, “quemaduras” y lesiones, deben ser identificadas y reportadas ya que pueden indicar periodo de cópula. Los órganos internos deben ser retirados preferencialmente con el espécimen fresco, lo que permite visualizar parámetros importantes para la diagnosis, en especial los estadios de reproducción. Después de la disección, el aparato reproductor y el tracto digestivo se deben fijar en solución tampón de formaldehido al 10% con bórax (borato de sodio o tetraborato de sodio) (Charvet-Almeida et al. 2005, Almeida et al. 2010) o con carbonato de calcio, para observaciones y análisis posteriores. En los estudios de interacciones tróficas y de dieta, se recomienda recoger una muestra de músculo y congelarla para posteriores análisis de isótopos estables (Kim et al. 2011). Se recomienda atar los extremos del estómago y los intestinos para evitar la pérdida de contenido. El hígado debe pesarse para calcular el índice hepato-somático (IHS). Del aparato reproductor se debe observar y anotar el aspecto de los ovarios, recuento de los folículos vitelogénicos (para la determinación de la fecundidad ovárica) y la presencia de huevos/embriones en el útero. Los embriones no viables se registran en aproximadamente el 5% de las especies del género Potamotrygon (Araujo 1998). Estos embriones deben ser descartados del conteo total de la fecundidad uterina. Factores como hormonas y deficiencias nutricionales de la leche uterina podrían ser la causa de este fenómeno (Marcon com. pers.) (Figura 12). Si se quieren realizar análisis del aparato reproductor, se recomienda fijar tres fragmentos de las gónadas de las porciones proximal, media y distal. Realizar frotis del oviducto de las hembras, el esperma masculino y colectar muestras de tres regiones del útero para realizar análisis de las paredes uterinas (trofonemata). Como fijador se puede utilizar formol al 10% con 77 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA ASPECTOS METODOLÓGICOS a. b. c. d. Figura 10. a) Medida del largo del disco; b) ancho del disco; c) longitud del clasper; d) peso; e) peso en campo con dinamómetro digital. Fotos: A. Acosta (a, b), P. Sánchez-Duarte (c), Grupo Yuma Challwani (d), A. Torres (e). e. 78 P. Sánchez-Duarte a. b. Figura 11. a) Toma de muestra de tejido; b) individuo de Potamotrygon motoro despúes de retirado el tejido. Fotos: A. Torres (a), C. Gama (b). a. b. Figura 12. a) Masa de semen en la cloaca de una hembra de Potamotrygon orbgnyi, Río Negro; b) con una flecha roja se indica un embrión muerto en el útero, al lado los embriones con el desarrollo normal de la misma hembra; c) fijación con formol al 10%. Fotos: M. L. G. Araújo. c. 79 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA ASPECTOS METODOLÓGICOS bórax. Para fijar muestras para microscopía electrónica se utiliza glutaraldehído y fragmentos más pequeños de calcodilato (Araujo 1998). Con todo eso, no siempre la disección puede realizarse en campo, por lo que el espécimen se debe preservar bien para que el análisis pueda hacerse en el laboratorio. Para eso, los peces deben fijarse en solución de formaldehido al 10%, con ayuda de inyecciones para poder garantizar la penetración de la solución en las partes internas. En la región abdominal las inyecciones deben realizarse en abundancia con la solución tampón (Figura 12). El congelamiento de las muestras también puede ser utilizado como una estrategia para preservar los peces para su análisis posterior. Sin embargo, después del descongelamiento el pez debe ser sometido al proceso de fijación con formaldehido. Todo el material colectado debe permanecer en la solución fijadora por un periodo mínimo de siete días. Después de ese periodo el material ya se puede lavar en forma abundante con agua corriente, buscando remover el moco superficial y luego podrá ser transferido para una solución de conservación en etanol al 70%. Para estudios de edad y crecimiento se deben colectar de cada raya, un bloque de cinco a seis vértebras de la región monospondílica posterior (Branstetter y Stiles 1987). Después de la limpieza, las vértebras deben fijarse en formol al 4% durante 24 horas y ser conservadas en etanol al 70%. Debido a la concavidad de las vértebras, estas deben estar incrustadas en resina de poliéster. Posteriormente se marcan y se cortan con una sierra de disco de corte metalográfico de diamante de baja 80 velocidad. De cada vértebra se deben realizar dos a tres cortes longitudinales para obtener secciones que pasen a través del foco de la vértebra. Cada cuerpo vertebral debe ser seccionado en el plano frontal como se sugieren Cailliet et al. (1983), con un espesor de aproximadamente 0,3 mm. Las bandas de crecimiento, que consiste en anillos translúcidos (estrecho) y opacos (ancho) (Casselman 1983), deben observarse y medirse en cada sección usando un microscopio estereoscópico (Araújo 2011). Accidentes durante el trabajo de campo El trabajo de campo con rayas de agua dulce implica un nivel de riesgo para los investigadores, pues al ser un grupo de peces con un comportamiento peculiar, despierta el interés de las personas al mismo tiempo que los somete a situaciones de riesgo constante durante las faenas de muestreo (Figuras 13 a-c). El manejo de los peces debe ser realizado con mucho cuidado, dado a que las rayas poseen toxinas en la espina caudal que se combinan con un mucus producido por el epitelio y actúan juntos causando edemas, dolores, inflamación y necrosis en la región afectada (Magalhães et al. 2006). Debido a la propiedad termolábil del veneno, el dolor puede ser mitigado por la inmersión del área afectada en agua caliente, por lo que el dolor cesará poco a poco y se evitará el edema. A pesar de ello, puede ocurrir inflamación, necrosis y perdurar por un periodo medio de tres meses hasta la cicatrización de la herida (Haddad Jr. et al. 2004). En el capítulo 8 de este libro se hace un análisis más detallado de los envenenamientos por rayas. Bibliografía • Achenbach, G. M. y S. V. M. Achenbach. 1976. Notas acerca de algunas especies de P. Sánchez-Duarte • a. • • b. • • • c. Figura 13. Ejemplos de accidentes derivados de la manipulación rayas en (a y b) Brasil; c) en Colombia (Orinoquia). Fotos: C. B. Jaster (a), J. P. Lima (b), C. A. Lasso (c). • raya fluvial (Batoidei, Potamotrygonidae), que frecuentan el sistema hidrográfico del rio Paraná médio en el Departamento la Capital (Santa Fe-Argentina). Comunicaciones del Museo Provincial de Ciencias Naturales “Florentino Ameghino” 8: 1-34. Ajicaco-Martínez, R. E., H. RamírezGil, P. Sánchez-Duarte, C. A. Lasso y F. Trujillo. 2012. IV. Diagnóstico de la pesca ornamental en Colombia. Serie Editorial Recursos Hidrobiológicos y Pesqueros Continentales de Colombia. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Bogotá, D. C., Colombia, 152 pp. Almeida, M. P., P. M. O. Lins, P. CharvetAlmeida y R. B. Barthem. 2010. Diet of the freshwater stingray Potamotrygon motoro (Chondrichthyes: Potamotrygonidae) on Marajó Island (Pará, Brazil). Brazilian Journal of Biology 70 (1): 155-162. Araújo, M. L. G. 1998. Biologia reprodutiva e pesca de Potamotrygon sp. C (Chondrichthyes - Potamotrygonidae), no Médio Río Negro, Amazonas. Masters Dissertation. Manaus, Instituto Nacional de Pesquisas da Amazônia y Universidade do Amazonas. 171 pp. Barbarino, A. y C. A. Lasso. 2005. Pesquería y aspectos biológicos de la raya manta Paratrygon aiereba (Müller y Henle 1841) (Myliobatiformes, Potamotrygonidae), en el río Apure (Venezuela). Memoria de la Fundación La Salle de Ciencias Naturales 163: 93-108. Barbarino, A. y C. A. Lasso. 2009. La pesca comercial de la raya manta Paratrygon aiereba (Müller y Henle, 1841) (Myliobatiformes, Potamotrygonidae) en el río Apure, Venezuela. Acta Apuroquia 1 (1): 24-31. Branstetter, S. y R. Stiles. 1987. Age and growth of the bull shark, Carcharhinus leucas, from the northern Gulf of Mexico. Environmental Biology of Fishes 20: 169-181. Camhi, M., S. Fowler, J. Musick, A . Bräutigam y S. Fordham. 1998. Sharks and their relatives: ecology and conservation. Occasional Paper 20. IUCN Species Survival Commission, Gland, Switzerland. 39 pp. 81 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA ASPECTOS METODOLÓGICOS • • • • • • • 82 Charvet-Almeida, P., M. L. G Araújo y M. P. Almeida. 2005. Reproductive aspects of freshwater stingrays (Chondrichthyes: Potamotrygonidae) in the Brazilian Amazon Basin. Journal Northwest Atlantic Fisheries Sciences 35: 165–171. Frederico, R. G. 2012. Filogenia e conservação de Paratrygon aiereba Dumeril (Chondrichthyes: Potamotrygonidae) na região Amazônica. Dissertação de Mestrado, PPG-BTRN, Manaus, INPA/UFAM. 55 pp. Garrone Neto, D, V. Haddad Jr., M. J. A Vilela y V. S. Uieda. 2007. Registro de ocorrência de duas espécies de potamotrigonídeos na região do alto rio Paraná e algumas considerações sobre sua biologia. Biota Neotropica 7: 205-208. Haddad Jr., V., D. Garrone Neto, P. Neto, J. B. Marques y K. C. Barbaro. 2004. Freshwater stingrays: study of epidemiologic, clinic and therapeutic aspects based on 84 envenomings in humans and some enzymatic activities of the venom. Toxicon 43: 287–294. Kim, S. L., D. R. Casper, F. Galván-Magaña, R. Ochoa-Díaz, S. B. Hernández y P. L. Koch. 2011. Carbon and nitrogen discrimination factors for elasmobranch soft tissues based on a long-term controlled feeding study. Environmental Biology of Fishes 95(1): 37–52. Lasso, C. A. 1985. Las rayas de agua dulce. Natura 77: 6-9. Lasso, C. A. 2004. Los peces de la Estación Biológica El Frío y Caño Guaritico, Esta- • • • • • do Apure, Llanos del Orinoco, Venezuela. Publicaciones del Comité Español del Programa MaB y de la Red IberoMaB de la UNESCO, N° 5. 454 pp. Lasso, C. A. y P. Sánchez-Duarte. 2011. Los peces del delta del Orinoco. Diversidad, bioecología, uso y conservación. Fundación La Salle de Ciencias Naturales-Chevron S. A. Caracas. 500 pp. Magalhães, K. W., C. Lima, A. A. PiranSoares, E. E. Marques, C. A. Hiruma - Lima y M. Lopes-Ferreira. 2006. Biological and biochemical properties of the Brazilian Potamotrygon stingrays: Potamotrygon cf. scobina and Potamotrygon gr. orbignyi. Toxicon 47: 575–583. Musick, J. A. y R. Bonfil 2004. Management techniques for elasmobranch fisheries. FAO Fisheries Technical Paper No. 474. Rincon-Filho, G. 2006. Aspectos taxonômicos, alimentação e reprodução da raia de água doce Potamotrygon orbignyi (Castelnau) (Elasmobranchii: Potamotrygonidae) no rio Paraná - Tocantins. Tese de Doutorado. Universidade Estadual Paulista “Júlio De Mesquita Filho”, rio Claro. 132 pp. Toffoli, D., H. Tomas, M. L. G. Araújo, M. P. Almeida, P. Charvet-Almeida y I. P. Farias. 2008. A test of the utility of DNA barcoding in the radiation of the freshwater stingray genus Potamotrygon (Potamotrygonidae, Myliobatiformes ). Genetics and Molecular Biology 31 (1): 324-336. Pesca de raya (Potamotrygon scobina) con espinel en el caño Dagua, Orinoco. Foto: M. A. Morales-Betancourt Potamotrygon motoro, Reserva Natural Bojonawi, Orinoco. Foto: J. Robles C. A. Lasso 3.2 Utilización de métodos no letales para el estudio de las rayas de agua dulce (Potamotrygonidae) Domingos Garrone Neto El estudio de rayas de la familia Potamotrygonidae in situ es bastante difícil debido a las condiciones ambientales que imponen los ríos y las planicies inundables de la región Neotropical. Sin embargo, cuando se logra generar información de estas especies mediante observaciones directas, se puede potencializar el conocimiento sobre su modo de vida, trayendo a discusión cuestiones poco conocidas y complementando las informaciones obtenidas de forma indirecta. La aplicación de métodos no letales implica un conjunto diverso de herramientas de estudio para acceder a la información, que no requiere de la eutanasia de los animales, puesto que emplea desde estrategias de buceo a pulmón libre, hasta equipos sofisticados de telemetría, bajo la perspectiva de provocar la menor interferencia posible en el comportamiento de los animales objeto de estudio. Su uso, así como sucede con otros métodos de estudio, presenta limitaciones y depende de la comprensión de una serie de factores para que sea posible alcanzar los objetivos propuestos. Este capítulo presenta y discute métodos tradicionales y novedades tecnológicas empleadas en el estudio de rayas de agua dulce, con base en las experiencias obtenidas en diferentes regiones de Brasil, demostrando su potencial de utilización, facilidades y dificultades. Observaciones subacuáticas El uso de observaciones subacuáticas es de gran importancia para los ictiólogos marinos, pero desafortunadamente constituye un desafío para muchos investigadores en agua dulce, sobre todo en función de los problemas relacionados con el buceo en lugares de baja visibilidad, como por ejemplo, los ríos de aguas blancas. Los trabajos clásicos realizados por Sazima (1986) y posteriormente por diversos colaboradores, demostraron el potencial de los ríos brasileños para el estudio de la naturaleza, que revelaron una serie de comportamientos no descritos para peces óseos y otros organismos de agua dulce, incluyendo las rayas (p. e. Garrone Neto y Sazima 2009a, b). Básicamente, las observaciones subacuáticas pueden ser realizadas por medio 85 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA MÉTODOS NO LETALES del buceo a pulmón libre (“snorkelling”) o autónomo (“scuba”) y más recientemente, mediante cámaras y vehículos operados a control remoto (ROVs, por su sigla en inglés). Su empleo depende del entrenamiento previo, de los objetivos de la investigación, de las condiciones ambientales de las áreas de estudio y de las peculiaridades de las especies investigadas. Algunas publicaciones relacionadas especialmente con observaciones a pulmón libre están disponibles en la literatura y pueden ayudar en la planificación de estudios de ese tipo (ver Helfman 1992, Sabino 1999, Lasso et al. 2002, Nakamura et al. 2004, entre otros). El uso de observaciones subacuáticas puede ser muy útil en investigaciones relacionadas con la biología de las especies de rayas de agua dulce (por ejemplo, alimentación y reproducción), la diversidad y distribución, la actividad y el uso del hábitat, interacciones intra e interespecificas, los movimientos diarios y estacionales. El acceso a ese tipo de información puede ser realizado utilizando buceo libre o autónomo, dependiendo del grado de capacitación y de las necesidades de cada investigador. El empleo del buceo libre y/o autónomo también es indicado para la captura de ejemplares en estudios que requieren el marcaje u obtención de muestras de animales (como moco, tejido y espinas), siendo muy eficiente en la búsqueda activa de individuos de diferentes especies y tamaños, activos o no, durante el día y la noche. El buceo libre tiene poco costo operacional, pues sólo requiere del uso de traje de Figura 1. Observación de un ejemplar de Potamotrygon motoro mediante buceo a pulmón libre (“snorkelling”). Condiciones como esta pueden ofrecer valiosa información sobre el comportamiento de los potamotrigónidos en la naturaleza, sí se es precavido en minimizar o en neutralizar el “efecto del observador”. Foto: C. Burmester. 86 M. A. Morales-B. neopreno, careta, snorkel y aletas. Es interesante por la movilidad que brinda y por permitir la aproximación del investigador al objeto de estudio (Figura 1). Puede ser aplicado en diferentes ambientes, incluyendo lugares de difícil acceso, donde el transporte y el sostenimiento de equipos de buceo autónomo se convierten en factores limitantes. Sin embargo, su uso puede ser limitado cuando es necesario explorar lugares con visibilidad restringida o en profundidades mayores a cinco metros. El buceo autónomo demanda la realización de cursos de capacitación y la utilización de equipos más sofisticados, incluyendo chalecos y cilindros de aire comprimido, entre otros, lo que puede encarecer y restringir su uso. Es útil ya que permite la observación y el registro de potamotrigónidos en lugares con diferentes profundidades, sobre todo, mayores a cinco metros. Pero también, ofrece mayor riesgo que en el buceo libre por aumentar la exposición del investigador a situaciones como buceo en corriente, buceo en altitud, enredo con troncos y aparejos de pesca (como redes y espineles) y riesgos de salud asociados con la descompresión. Igualmente, el elevado número de boyas y ruidos relacionados con el uso de suplementos de aire en el buceo autónomo, puede provocar un mayor impacto en el objeto de estudio en comparación con el buceo libre, que demanda atención del investigador para prevenir errores de muestreo, debido a la interferencia del observador en el comportamiento de los animales. La observación y el registro de rayas de agua dulce mediante el buceo puede ser potencializado utilizando cuadernos de campo y equipos de filmación y fotografía subacuática. En la actualidad, la gama de productos existentes para ese fin es extensa y su uso dependerá de las condiciones técnicas y financieras de cada investigador. Las tablillas de PVC son muy útiles para la realización de anotaciones debajo del agua, sobre todo, cuando se emplean protocolos para la colecta de datos a razón de estandarizar el muestreo (Tabla 1). Las cámaras digitales anfibias o acondicionadas en burbujas, permiten una gran capacidad de registro que contribuye a la consulta e interpretación posterior de las imágenes captadas. Reglas de madera u otros instrumentos de tamaño conocido (como redes, por ejemplo), pueden ser utilizados para estimar el tamaño de los animales observados (especialmente el ancho del disco), por ejemplo lo que se realiza en estudios con especies de Myliobatiformes marinos y de agua dulce (p. e. Aguiar et al. 2009, Garrone Neto y Uieda 2012). Se destaca una modernización de ese método, acoplando dos apuntadores laser a las cámaras de video y de fotografía, aunque su uso puede ser limitado en ambientes con elevada luminosidad. Se debe tener en cuenta que la presencia del investigador y de todos los equipos utilizados para la realización de las observaciones subacuáticas puede interferir en el comportamiento de las rayas. Por eso, es necesario mantener una distancia segura con el objeto de estudio (trabajos preliminares pueden ayudar a establecer la “distancia de fuga”) y adoptar las medidas que atenúen el “efecto del observador” (Lehner 1996), como el uso de ropa de neopreno y otros aditamentos de coloración discreta (o camuflada), emplear iluminación indirecta y filtros de celofán de color rojo en las linternas (sobre todo durante el buceo nocturno, ya que ambos perturban menos las rayas que la luz amarilla/blanca o la iluminación directa), no usar flash para captar imágenes y mantener una buena 87 88 ( ) 0,5 – 2 ( ) Expuesta ( ) Expuesta ( ) Presente ( ) Presente ( ) Presente ( ) Presente ( ) Presente ( ) Presente ( ) Consolidado ( )0–2 ( ) Interespecífica ( ) Acostado Profundidad (m) Restricción Vertical Restricción Horizontal Vegetación Marginal Vegetación subacuática Arena Cascajo Piedras Corrientes Sustrato Visibilidad (m) Interacciones Actividad Observaciones ( ) Pasto Ambiente ( ) Playa Temperatura del agua (°C) LD (estimativa en cm): ( ) Bosque ( ) Enterrado ( ) Intraespecífica ( )2–5 ( ) Ecotono ( ) Ausente ( ) Ausente ( ) Ausente ( ) Ausente ( ) Ausente ( ) Ausente ( ) Protegida 1 lado ( ) Protegida ( )2–5 Superfície: ( ) Pedregal Fondo: ( ) Nadando ( ) 5 – 10 ( ) Ausente ( ) No consolidado ( ) > 15 ( ) Islote ( ) Forrajeo ( ) > 10 ( ) Protegida 3 lados ( ) 10 – 15 Nº foto(s): Horario: Tiempo (min.): ( ) Protegida 2 lados ( ) 5 – 10 Variables de uso del hábitat y actividad Sexo: Características del individuo Lugar: ( ) compressor Especie: Marcas naturales: Fecha: Tipo de buceo: ( ) libre ( ) scuba Características del buceo Tabla 1. Protocolo empleado en el estudio sobre la actividad y uso del hábitat de dos especies de rayas del género Potamotrygon Fuente: adaptado de Aguiar et al. (2009). Largo disco (LD). RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA MÉTODOS NO LETALES M. A. Morales-B. flotabilidad para evitar tocar el sustrato o levantar sedimentos con las aletas. En virtud de que muchas veces los encuentros con rayas pueden ser repentinos y por el hecho que los comportamientos raros o hechos inesperados pueden ser observados durante el buceo, es importante que el investigador esté preparado para colectar el mayor número de informaciones posibles, se familiarice con los animales, equipos y métodos de muestreo para el estudio del comportamiento de los peces, tradicionalmente utilizados en ictiología (ver Martin y Bateson 1986 y Sabino 1999). Marcación convencional Los métodos tradicionales de marcación han sido utilizados desde el siglo XIX en estudios de desplazamiento, sobrevivencia y tasas de mortalidad, densidad poblacional, edad y crecimiento de peces, a partir de capturas y recapturas. Los equipos utilizados para ese fin varían en tamaño y tipo, incluyendo básicamente marcas externas de plástico, pigmentos o mutilaciones (McFarlane et al. 1990). Las marcas externas útiles para los estudios en potamotrigónidos incluyen modelos plásticos filamentosos como las “t-bar anchor tags (tba-tags)” y “dart-tags” o redondeados y rectangulares como los discos de Petersen y las “roto-tags”. Son de fácil utilización, siendo normalmente insertadas en el dorso de los animales, próximos a la base de la cola o en las márgenes pectorales, con dardos o agujas de plástico/acero inoxidable (Figura 2). En todos estos modelos, cada marca puede exhibir un número único de identificación para cada animal. También, es posible incluir el nombre del proyecto, de la institución de investigación responsable y un número telefónico de contacto, en caso que se capturen los peces por terceros (como pescadores profesionales o deportivos). Los estudios con marcación convencional permiten entre otros, el conocimiento de las tasas de dispersión y distancias recorridas, tasas de crecimiento y mortalidad. Sin embargo, no es posible obtener informaciones sobre los movimientos diarios y el uso del hábitat, pues la marcación convencional no permite conocer el camino recorrido por los animales durante el periodo comprendido entre la captura, liberación y el momento de su recaptura. Es necesario emprender un gran esfuerzo de muestreo y marcar un elevado número de ejemplares para poder colectar información mediante estudios de captura y recaptura, toda vez que las tasas de recaptura esperadas varían de 5 a 15%, no alcanzando el porcentaje deseado en algunos casos. Como ventaja, la marcación convencional es de bajo costo operacional, siendo muy útil en lugares donde existe abundancia de especie y/o de individuos. Biotelemetría El término “biotelemetria” es utilizado para designar la medición remota, sea pasiva o activa, del comportamiento de los animales, por medio del uso de una serie de métodos y técnicas. Este conjunto de herramientas es empleado desde el inicio de la segunda mitad del siglo XX en Norteamérica y países europeos y se basa en la detección remota de una señal, emitida a través de transmisores fijados en los animales y por medio de receptores operados desde algunos metros o hasta pocos kilómetros de distancia, vía satélite o mediante dispositivos de almacenamiento de datos posicionados en el propio ambiente (Giles 1971, Cooke et al. 2004). Para las rayas de agua dulce y en función del tipo de ambiente ocupado con preferencia por estas especies (sustrato de ríos de aguas claras, blancas y negras), la 89 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA MÉTODOS NO LETALES Figura 2. Método de marcación convencional de individuos del género Potamotrygon con modelos plásticos filamentosos del tipo “espagueti/t-bar anchor tag”. Fotos: J. de Barros Huss. radiotelemetría y la telemetría acústica constituyen el principal grupo de herramientas de la biotelemetría que pueden ser utilizadas. Tanto la una como la otra ofrecen una gran diversidad de opciones, sobretodo en equipamientos y como todo método, presentan ventajas y desventajas. La radiotelemetría es muy eficaz para el monitoreo activo y pasivo de rayas en aguas continentales, por presentar facilidad en la detección de la señal en aguas someras con baja conductividad y sufrir poca perturbación por ruidos existentes en los cursos de agua, incluso en áreas con centrales hidroeléctricas. Sin embargo, es limitada cuando se requiere utilizar en aguas profundas (> 20 m) y/o con alta conductividad (p. e. agua salada o salobre), 90 sugiriéndose la telemetría acústica como alternativa en estos casos. Este otro método utiliza sistemas semejantes a los de la radiotelemetría, pero se diferencia de esta, por que los transmisores emiten señales sonoras en vez de ondas de radio y porque los receptores utilizan hidrófonos en lugar de antenas. Posee gran aplicación en aguas profundas y con alta conductividad, lo que la vuelve más ventajosa en relación a la radiotelemetría cuando se pretende estudiar el comportamiento de los potamotrigónidos en ambientes estuarinos o en ambientes fluviales con profundidad superior a 20 metros. Otra gran ventaja de la telemetría acústica es la posibilidad de monitorear pasivamente los animales con hidrófonos sumergidos, que deja a los equipos menos vulnerables a M. A. Morales-B. sabotajes y a la intemperie, frente a aquellos que son instalados por fuera del agua. Las figuras 3 y 4 ilustran algunos de los trabajos que utilizan radiotelemetría y telemetría acústica para investigar asuntos a. relacionados con la ecología espacial de especies del género Potamotrygon en Brasil. En la tabla 2 se presenta la comparación entre los equipamientos de radiotelemetría y de telemetría acústica, que ayuden b. Figura 3. Uso de la radiotelemetría para el estudio del comportamiento de Potamotrygon falkneri en el río Paraná, sureste del Brasil. (a) Ubicación de los animales. (b) Observaciones subacuáticas para evaluar los efectos de los radiotransmisores sobre el comportamiento de los individuos marcados. Fotos: L. Hahn (a), D. Garrone Neto (b). Figura 4. Aplicación de telemetría acústica en estudios sobre movimientos diarios y estacionales de potamotrigónidos. Este método permite la obtención de la ubicación aproximada de los animales, así como la evaluación de los parámetros ambientales durante el examen de los mismos, cuando se utiliza un transmisor equipado con sensores de temperatura y presión. Fotos: C. Burmester. 91 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA MÉTODOS NO LETALES Tabla 2. Comparación del desempeño entre equipamiento para telemetría acústica y radiotelemetría en diferentes condiciones de estudio. Fuente: adaptado de Koehn (2012). Características Acústica Radio Condiciones del lugar Agua con alta conductividad, salobre o salada Excelente No aplica Agua con baja conductividad, dulce Excelente Excelente Aguas profundas, superior a 20 metros Excelente Malo Agua turbulenta, con rápidos o próxima a centrales hidroeléctricas Malo Excelente Vegetación acuática densa, con bancos de macrófitas, etc. Malo Bueno Presencia de obstáculos como rocas y bancos de arena Malo Malo a razonable Agua con elevada turbidez Bueno Muy bueno Agua con presencia de algas Malo Excelente Presencia de termoclina/gradiente de temperatura Malo a razonable Bueno Especie estudiada Rápida, que se mueve mucho Malo con monitoreo móvil, Excelente bueno con estaciones fijas Migratoria de larga distancia Malo con monitoreo móvil, Excelente bueno con estaciones fijas Número de animales a ser marcados Bueno a razonable, dependiendo de la capacidad del equipo de manejar algoritmos y códigos Bueno, dependiendo del número de frecuencias y de antenas utilizadas Equipamiento Opciones de rastreo Hidrófonos en el agua, con barco o estaciones fijas Antena normalmente en el aire, a pie, en vehículo, barco o avión Estaciones automatizadas Bueno Excelente Posicionamiento en 3D Métodos existentes Difícil Relación entre el tamaño de las marcas y Bueno el tamaño de los animales 92 Bueno M. A. Morales-B. Tabla 2. Continuación. Características Vida útil de los transmisores Acústica Radio Varible, dependiendo de la tasa de emisión de señales (“burst interval”), del tamaño de la marca (cuanto mayor es la marca, mayor es la batería), entre otros Variable, dependiendo de la tasa de emisión de señales (“burst interval”), del tamaño de la marca (cuanto mayor es la marca, mayor es la batería), entre otros Transmisores dotados de sensores como presión (profundidad), temperatura y Equipamientos existentes movimiento Equipamientos existentes Transmisores con almacenamiento, memoria Equipamientos existentes Posible Direccionalidad Malo a razonable De bueno a excelente, dependiendo de la frecuencia y del tipo de antena Uso de energía por los receptores Bueno a razonable, dependiendo de la tecnología empleada Bueno a orientar la selección del investigador, de acuerdo con el desempeño del método en diferentes situaciones. La selección del método a ser empleado (acústica o radio) dependerá de los objetivos de la investigación y de las condiciones del lugar de estudio. Investigaciones preliminares para la realización de pruebas con los equipos, adecuación/selección de métodos de monitoreo (fijo y/o móvil) y la fijación de transmisores, intercambio de experiencia con investigadores y fabricantes, entre otros, son muy útiles para orientar el plan de trabajo. Además de eso, se debe tener en mente que la marcación electrónica puede afectar el comportamiento de los animales estudiados. Es por eso que se recomienda adoptar procedimientos que minimicen el estrés provocado por la captura y manipulación de las rayas, además de reglas universalmente aceptadas para estudios de biotelemetría de peces, que incluyen: • • • La utilización de la “regla general del 2%” empleada en estudios con teleósteos para la selección del tamaño de los transmisores a ser utilizados, donde el peso de las marcas electrónicas no debe exceder el 2% del peso de los animales (Winter 1996). La captura preferentemente con aparejos que no provoquen daños o mucho estrés elevado, para evitar mortalidad por infecciones o heridas graves. El mantenimiento de las rayas antes, durante y después de su manipulación, en recipientes con agua corriente, buscando minimizar el estrés de la 93 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA MÉTODOS NO LETALES • captura y acompañar la recuperación total de los animales antes de ser liberados. La fijación externa de los transmisores en la porción dorsal de la base de la cola de las rayas, en función de las limitaciones anatómicas que poseen los peces deprimidos (dorso-ventralmente), usando una anestesia local que no sea vasoconstrictora (para evitar la necrosis de las extremidades) y materiales esterilizados y biológicamente probados (para evitar infecciones y rechazos). Aunque los métodos y técnicas de biotelemetría pueden contribuir a generar informaciones bastante interesantes sobre el modo de vida de los potamotrigónidos en la naturaleza, el acceso a los equipamientos es todavía limitado en función del costo elevado y de la necesidad de un entrenamiento especifico. El éxito de las investigaciones de esa naturaleza, dependerá de la elaboración de objetivos claros y de la selección adecuada de los equipos, para que sea efectivamente posible colectar los datos pretendidos. Bibliografía • • • • 94 Aguiar, A. A., J. L. Valentin y R. S. Rosa. 2009. Habitat use by Dasyatis americana in a south-western Atlantic oceanic island. Journal of the Marine Biological Association of the United Kingdom 89: 1147-1152. Cooke, S. J., S. G. Hinch, M. Wikelski, R. D. Andrews, T. G. Wolcott y P. J. Butler. 2004. Biotelemetry: a mechanistic approach to ecology. Trends in Ecology and Evolution 19: 334-343. Garrone Neto, D. y V. S. Uieda. 2012. Activity and habitat use of two species of stingrays (Myliobatiformes: Potamotrygonidae) in the upper Paraná River basin, Southeastern Brazil. Neotropical Ichthyology 10 (1): 81-88. Garrone Neto, D. y I. Sazima. 2009a. Stirring, charging, and picking: hunting • • • • • • • • • • tactics of potamotrygonid rays in the Upper Paraná River. Neotropical Ichthyology 7 (1): 113-116. Garrone Neto, D. y I. Sazima. 2009b. The more stirring the better: cichlid fishes associate with foraging potamotrygonid rays. Neotropical Ichthyology 7 (3): 499-501. Giles Jr., R. H. 1971. Wildlife management techniques. 3rd ed. Washington: TWS. 633 pp. Helfman, G. S. 1992. Underwater methods. Pp. 349-369. En: Nielsen, L. A. y D. L. Johnson. (Eds.). Fisheries Techniques. Blacksburg: American Fisheries Society. 468 pp. Koehn, J. D. 2012. Designing studies based on acoustic and radio telemetry. Pp. 45-87. En: Adams, N. S., J. W. Beeman y J. H. Eiler. (Eds.). Telemetry techniques: a user guide for fisheries research. Maryland: American Fisheries Society. Lasso, C. A., O. M. Lasso-Alcalá y J. Meri. 2002 (“2000”). Diversidad y estructura de la comunidad de peces de un río de la Guayana venezolana: observaciones y censos subacuáticos como metodología alternativa. Memoria de la Fundación La Salle de Ciencias Naturales 154: 99-115. Lehner, P. N. 1996. Handbook of ethological methods. 2nd ed. Cambridge. Cambridge University Press. 672 pp. Martin, P. y P. Bateson. 1986. Measuring behaviour–an introductory guide. New York: Cambridge University Press. 200 pp. McFarlane, G. A., R. S. Wydoski y E. D. Prince. 1990. Historical review of the development of external tags and marks. American Fisheries Society Symposium 7: 9-29. Nakamura, K., C. A. Lasso, C. Vispo y M. Ortaz. 2004 (“2002”). Observaciones subacuáticas: una herramienta efectiva para la obtención de datos ecológicos y etológicos en comunidades ícticas continentales. Memoria de la Fundación La Salle de Ciencias Naturales 157: 83-110. Sabino, J. 1999. Comportamento de peixes em riachos: uma abordagem naturalística. Pp. 183-208. En: Caramaschi, E. P., R. Mazzoni P. y R. Peres-Neto. (Eds.). Ecologia de Peixes de Riachos. Rio de Janeiro: PPGEUFRJ. 260 pp. M. A. Morales-B. • Sazima, I. 1986. Similarities in feeding behaviour between some marine and freshwater fishes in two tropical communities. Journal of Fish Biology 29 (1): 53-65. • Winter, J. D. 1966. Advances in underwater biotelemetry. Pp. 555-590. En: Murphy, B. R. y D. W. Willis. (Eds.). Fisheries Techniques. 2nd ed. Maryland: American Fisheries Society. 732 pp. Potamotrygon tigrina, río Nanay, Perú. Foto: O. Lucanus 95 Potamotrygon orbignyi, río Orinoco. Foto: M. A. Morales-Betancourt G. Gómez 3.3 Trabajo de laboratorio para la identificación de las rayas de agua dulce (Potamotrygonidae) Carlos A. Lasso, Ricardo S. Rosa, Paula Sánchez-Duarte, Mónica A. Morales-Betancourt y Juliana Agudelo Las rayas de agua dulce constituyen un grupo de peces cuya morfología y anatomía externa no es siempre diagnóstica o no permite separar los diferentes taxa a nivel específico con facilidad, como en otros peces teleósteos. No obstante, a nivel genérico, algúnos caracteres si tienen validez y su empleo es sencillo, incluso para los no especialistas (taxónomos). Por el contrario a nivel interno (osteología), algunas medidas y conteos si son de utilidad para diferenciar las especies. Los aspectos relativos al patrón de coloración son tratados en detalle en los capítulos 4 (claves) y 5 (fichas de especies), y son de gran utilidad en la mayoría de los casos -a pesar de la variación intraespecífica- para separar las especies. A continuación de describen los diferentes métodos morfométricos y merísticos utilizados tradicionalmente en la descripción de las rayas de agua dulce. Morfometría Los métodos para medir las rayas de agua dulce neotropicales y establecer las relaciones morfométricas de interés para su descripción y dado el caso su diagnósis, siguen el protocolo establecido por Rosa (1985) en la revisión taxonómica de la familia Potamotrygonidae y que han sido utilizados posteriormente en las publicaciones derivadas de ella (Rosa et al. 1987, Rosa 1991). Estos métodos fueron adaptados de diversos trabajos anteriores que trataron la taxonomía de este grupo de rayas (Devincenzi y Teague 1942, Bigelow y Schroeder 1953, Fernández-Yépez 1957, Hubbs y Ishiyama 1968, Castex y Castello 1970, Thorson y Watson 1975, Chirichigno y McEachran 1979, Compagno y Roberts 1982), así como de los ficheros personales de Henry B. Bigelow, William C. Schroeder, Leonard J. V. Compagno, John D. McEachran y Tsutomu Miyake. Posteriormente, algunas medidas fueron modificadas y otras nuevas agregadas al protocolo, a partir de publicaciones más recientes (Silva y Goulart 2007, Rosa et al. 2008, Carvalho et al. 2004, Carvalho y Ragno 2011). Por ejemplo, el ancho postorbital del cráneo de Rosa (1985), es tratado ahora como el ancho supraorbital 97 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA TRABAJO DE LABORATORIO (Carvalho et al. 2004, Carvalho y Ragno 2011), una vez que los procesos anteriormente denominados post-orbitales pasaron a llamarse supraorbitales. Las medidas externas se toman generalmente de punto a punto, sin proyecciones, con una regla en milímetros (mm) para las estructuras más grandes de 150 mm, o con calibres tipo Vernier, en décimas de milímetro, para las estructuras más pequeñas de 150 mm. Las medidas bilaterales se toman el lado izquierdo del ejemplar. Las medidas internas en el cráneo se hacen con calibres en décimas de mm, en ejemplares disecados (esqueletos secos o transparencias de alizarina-tripsina) o en radiografías directamente. En las descripciones taxonómicas y en los estudios de variación morfométrica en rayas, las medidas externas generalmente se representan como un porcentaje del ancho del disco (% AD), mientras que las medidas proporcionales en el cráneo suelen ser representadas como un porcentaje del largo del cráneo. Las medidas más utilizadas se definen en la siguiente lista y están representadas en las figuras 1, 2 y 3. 1. Ancho de disco (AD): distancia máxima entre los bordes laterales del disco, tomada con la regla que se coloca por debajo de la superficie ventral de la raya. 2. Largo de disco (LD): máxima distancia entre la punta del hocico hasta el extremo posterior del borde izquierdo del disco, tomada de forma oblicua a la línea media, con la regla situadada por debajo de la superficie ventral de la raya. 98 3. Longitud total (LT): máxima distancia entre la punta del hocico hasta el extremo de la cola, tomada con la regla por debajo de la superficie ventral de la raya. 4. Largo interno de disco (LID): máxima distancia entre la punta del hocico hasta la axila pectoral izquierda, tomada de forma oblicua a la línea media, con la regla colocada entre la superficie ventral de la raya y la superficie dorsal de la aleta pélvica. 5. Distancia boca - escapulo - coracoides: distancia entre el margen anterior de la placa dentaria inferior, hasta el margen anterior del cartílago coracoides, tomada ventralmente en la línea media. 6.Distancia boca-cloaca: distancia entre el margen anterior de la placa dentaria inferior, hasta el margen anterior de la cloaca, tomada ventralmente en la línea media. 7. Distancia cloaca-aguijón o espina caudal: distancia tomada ventralmente entre el margen posterior de la cloaca hasta la línea que pasa sobre la base del aguijón. 8. Largo de la cola: distancia medida ventralmente entre el margen posterior de la cloaca hasta la extremidad de la cola. 9. Ancho de la cola: ancho máximo entre los bordes laterales de la cola, tomada en su base. 10. Ancho de la cola en el aguijón: distancia máxima entre los bordes laterales de la cola, tomada en la base del aguijón. 11. Altura de la cola: altura máxima de la cola, tomada verticalmente en su base. 12. Altura de la membrana de la cola: altura máxima de la membrana dorsal o pliegue situado distalmente en N. Lujan la cola (aplica a ejemplares del género Potamotrygon). 13. Longitud del aguijón o espina caudal aserrada: longitud máxima de la parte expuesta del aguijón de la cola. 14.Ancho de la aleta pélvica: ancho máximo del margen posterior de la aleta pélvica, incluyendo el margen interno del clasper en los machos. 15. Largo de la aleta pélvica: longitud máxima del margen anterior de la aleta pélvica. 16. Longitud del clasper: distancia del margen posterior de la cloaca hasta la extremidad del clasper izquierdo. 17. Distancia pre-cloacal: distancia entre la punta del hocico hasta el margen anterior de la cloaca, tomada ventralmente en la línea media. 18. Distancia pre-oral: distancia entre la punta del hocico hasta el margen anterior de la mandíbula inferior, toma en la línea media con la boca cerrada. 19. Distancia pre-nasal: distancia entre la punta del hocico hasta el margen anterior de la narina. 20. Distancia entre la primera y quinta abertura branquial: tomada entre los márgenes internos de la primera y quinta abertura branquial del lado izquierdo. 21. Distancia entre las primeras aberturas branquiales: ancho entre el primer par de aberturas branquiales, tomada entre sus márgenes internos. 22.Distancia entre las quintas aberturas branquiales: ancho entre el quinto par de aberturas branquiales, tomada entre sus márgenes internos. 23.Ancho de la boca: ancho máximo entre la comisura bucal derecha e izquierda, tomada con la boca cerrada. 24. Largo de la narina: distancia entre el margen anterior y posterior de la narina izquierda. 25. Distancia internasal o internarinal: distancia entre los márgenes anteriores de las narinas. 26. Diámetro del ojo: diámetro máximo horizontal del ojo izquierdo. 27. Largo del espiráculo: distancia entre el margen anterior y posterior del espiráculo izquierdo, tomado oblicuamente a la línea media. 28. Distancia interorbital: distancia mínima entre el borde craneano dorsal en la región orbital, tomado externamente presionándo el calibre contra la piel que recubre esta región o sobre el cráneo limpio o en radiografía. 29. Distancia interocular: distancia entre el borde medial de los ojos. 30.Distancia interespiracular: distancia entre el margen posterior de los espiráculos. 31.Distancia pre-ocular: distancia entre la punta del hocico hasta el margen anterior del ojo. 32. Ancho de la placa dentaria superior: ancho máximo de la placa dentaria superior, tomado presionándo el calibre contra sus márgenes en el interior de la boca. 33. Ancho de la placa dentaria inferior: ancho máximo de la placa dentaria inferior, tomada presionándo el calibre contra sus márgenes en el interior de la boca. 34. Largo del cráneo: distancia máxima del margen anterior de la cápsula nasal izquierda hasta el cóndilo occipital, tomado paralelamente a la línea media. 35. Ancho del cráneo: ancho máximo entre los márgenes laterales de las cápsulas nasales. 36. Ancho preorbital del cráneo: ancho máximo entre las extremidades de los procesos preorbitales del cráneo. 99 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA TRABAJO DE LABORATORIO 37. Ancho supraorbital del cráneo: ancho máximo entre las extremidades de los procesos supraorbitales del cráneo. 38. Ancho pos-orbital del cráneo: ancho máximo entre las extremidades de los procesos post-orbitales del cráneo. 39. Largo de la fontanela craneana: distancia máxima entre los márgenes anterior y posterior de la fontanela de cráneo. 40. Ancho de la fontanela craneana: ancho máximo de la fontanela craneana en su porción anterior. 41. Ancho de la mandíbula: ancho máximo entre los bordes laterales de la mandíbula inferior. Figura 1. Medidas dorsales externas. 2) Largo de disco (LD); 3) longitud total (LT); 4) largo interno de disco (LID); 9) ancho de la cola; 10) ancho de la cola en el aguijón; 13) longitud del aguijón; 26) diámetro del ojo; 27) largo del espiráculo; 29) distancia interocular; 30) distancia interespiracular. Fuente: modificado de Rosa (1985). 100 N. Lujan Figura 2. Medidas ventrales externas. 1) Ancho del disco (AD); 5) boca al escapulo-coracoides; 6) boca-cloaca; 7) cloaca-aguijón; 8) largo de la cola; 14) ancho de la aleta pélvica; 15) largo de la aleta pélvica; 16) longitud del clasper; 17 distancia pre-cloacal; 18) distancia pre-oral; 19) distancia pre-nasal; 20) distancia entra la primera y quinta abertura branquial; 21) ancho entre las primeras aberturas branquiales; 22) ancho entre las quintas aberturas branquiales; 23) ancho de la boca; 24) largo de la narina; 25) distancia internasal. Fuente: modificado de Rosa (1985). Caracteres merísticos Los métodos para el conteo fueron adaptados de diversos trabajos (Bigelow y Schroeder 1953, Hubbs y Ishiyama 1968, Stehman et al. 1978, Rosa 1985) y se dividen en estructuras esqueléticas (vertebras y radios de las aletas), estructuras derivadas de dentículos dérmicos y dientes. Los dos últimos tipos se pueden contar en ejemplares frescos o preservados, mientras que para el conteo de caracteres esqueléticos, se requiere de ejemplares disecados, diafanizados (transparentados) o con radiografías de los mismos. Las 101 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA TRABAJO DE LABORATORIO Figura 3. Medidas del cráneo. 34) largo del cráneo; 35) ancho del cráneo; 36) ancho preorbital; 37) ancho supraorbital; 38) ancho post-orbital; 39) largo de la fontanela; 40) ancho de la fontanela. Fuente: modificado de Rosa (1985). estructuras bilaterales normalmente se cuentan en el lado izquierdo del animal. Para los conteos vertebrales, la columna fue dividida arbitrariamente en una región precaudal (anterior a su intersección con el margen posterior de la barra puboisquiadiaca) y una región caudal (posterior a este mismo punto). Tal división arbitraria está justificada por la dificultad de reconocer la primera vertebra caudal en los ejemplares radiografiados. Los caracteres merísticos más utilizados se definen a continuación. 1. Vertebras precaudales: se cuentan desde la primera vertebra radiográficamente distinta en la placa sinarcual anterior, hasta el margen posterior de la barra pubo-isquiadiaca. 102 2. Vertebras caudales: se cuentan desde la primera vertebra posterior a la barra pubo-isquiadiaca, hasta la última vertebra radiográficamente distinta en la cola; cada dos centros diplospóndilos se cuentan como una vértebra. 3. Vertebras caudales hasta el aguijón o espina caudal aserrada: contadas desde la primera vertebra posterior a la barra pubo-isquiadiaca, hasta la base de aguijón de la cola (el anterior cuando hay más de uno); este recuento está incluído en el anterior. 4. Vertebras totales: corresponde a la suma de los conteos 1 y 2. 5. Vertebras diplospóndilas: total de vértebras diplospóndilas en la cola. 6. Vertebras sinarcuales: total de vértebras radiográficamente distintas en la placa sinarcual. N. Lujan 7. Radios de la aleta pélvica: número total de radios cartilaginosos en la aleta pélvica; se cuentan de manera separada para machos y hembras, dado el dimorfismo sexual. 8. Radios del propterígio: número total de radios cartilaginosos soportados en el cartílago propterígio de la aleta pectoral. 9. Radios del mesopterigio: número total de radios cartilaginosos soportados en el cartílago mesopterígio de la aleta pectoral. 10.Radios del metapterigio: número total de radios cartilaginosos soportados en el cartílago metapterígio de la aleta pectoral. 11. Total de radios pectorales: número total de radios cartilaginosos en la aleta pectoral, corresponde a la suma de los conteos 8, 9 y 10. 12.Dientes superiores: número de hileras longitudinales de dientes en la mandíbula superior (Figura 4a). 13.Dientes inferiores: número de hileras longitudinales de dientes en la mandíbula inferior (Figura 4b). 14. Dientes inferiores medianos: número de dientes descubiertos en hilera longitudinal mediana, de la mandíbula inferior (Figura 4c). 15.Espinas medio-dorsales: número total de espinas visibles a simple vista, en la línea media dorsal, contadas desde la porción distal del disco hasta la cola. Figura 4. Dientes en las rayas de agua dulce. a) Total de hileras longitudinales en la mandíbula superior; b) total de hileras longitudinales en la mandíbula inferior; c) dientes inferiores medianos. Fuente: modificado de Rosa (1985). 103 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA TRABAJO DE LABORATORIO Discusión Así como en otros grupos zoológicos, las características morfométricas y merísticas de las rayas son de gran utilidad en los estudios taxonómicos. En el caso específico de los potamotrigónidos, algunas características morfométricas y merísticas permiten la diferenciación taxonómica entre los géneros de la familia. De ellas, se pude indicar el largo de la cola, las distancias preocular y preoral y el número de radios en la aleta pectoral (Rosa 1985, 1991, Rosa et al. 1987, 2010). Para la diferenciación de las especies en un mismo género, la utilidad de características morfométricas y merísticas es más discreta, una vez que las variaciones intraspecíficas muchas veces se sobreponen a las variaciones entre especies. Sin embargo, algunas características morfométricas y merísticas han sido empleadas en la distinción de especies en los géneros Potamotrygon, Plesiotrygon y Heliotrygon, tales como el largo y ancho de la cola, largo del espiráculo, número de radios pectorales y número vértebras (Rosa et al. 2008, Carvalho y Lovejoy 2011, Carvalho y Ragno 2011, Silva y Carvalho 2011). El ancho del disco ha sido adoptado como la medida patrón para el cálculo de medidas proporcionales en la mayoría de los estudios en taxonomía de rayas (p.e. Bigelow y Schroeder 1953, Fernández-Yépez 1957, Castex y Castello 1970, Thorson y Watson 1975, Compagno y Roberts 1982, Rosa 1985). Su ventaja sobre el largo del disco y la longitud total, es que no presenta la variación bilateral del primero, ni la variación en la longitud total, debido a la rotura del extremo de la cola que ocurre en la mayoría de los ejemplares provenientes del medio natural. En el análisis morfométrico hay que tener en cuenta si los ejemplares fueron 104 medidos en fresco o después de fijados o preservados en formaldehido. Se han encontrado diferencias entre las medidas externas en un mismo individuo, debido a la contracción de los tejidos (de 1,6 hasta un 4,1% en el ancho del disco), que ocurre en ejemplares preservados (Rosa 1985). Por último, es importante mencionar que aunque la aplicación de técnicas de morfometría geométrica en rayas es aún limitada (p. e. Piorski y Nunes 2000), sus perspectivas son prometedoras, especialmente en la solución de los problemas taxonómicos donde la morfometría tradicional es ineficiente. Se espera que en un futuro próximo, el número de estudios de variación morfométrica en potamotrigónidos se amplíe, y que los mismos sean utilizados como herramientas para resolver diversos problemas taxonómicos que todavía persisten en este grupo. Bibliografía • • • • Bigelow, H. B. y W. C. Schroeder. 1953. Sawfish, guitarfish, skates and rays. Pp. 508-514. En: Tee-Van, J., C. M. Breder, A. E. Parr, W. C. Schroeder y L. P. Schultz (Eds.). Fishes of the Western North Atlantic, Part 2. Sears Foundation for Marine Research, Yale University, New Haven, USA. Carvalho, M. R., J. G. Maisey y L. Grande. 2004. Freshwater stingrays of the Green River Formation of Wyoming (Early Eocene), with the description of a new genus and species and an analysis of its phylogenetic relationships (Chondrichthyes: Myliobatiformes). Bulletin of the American Museum of Natural History 284: 1–136. Carvalho, M. R. y N. R. Lovejoy. 2011. Morphology and phylogenetic relationships of a remarkable new genus and two new species of Neotropical freshwater stingrays from the Amazon basin (Chondrichthyes: Potamotrygonidae). Zootaxa 2776: 13-48. Carvalho, M. R. y M. P. Ragno. 2011. An unusual, dwarf new species of Neotropical N. Lujan • • • • • • • • freshwater stingray, Plesiotrygon nana sp. nov., from the upper and mid Amazon basin: the second species of Plesiotrygon (Chondrichthyes: Potamotrygonidae). Papéis Avulsos de Zoologia 51: 101-138. Castex, M. N. y H. P. Castello. 1970. Potamotrygon yepezi, n. sp. (Condrichthyes, Potamotrygonidae), a new species of freshwater sting ray from Venezuelan rivers. Acta Scientifica / Instituto Latinoamericano de Fisiología y Reproducción 8: 15-39. Chirichigno, N. y J. D. McEachran. 1979. Urolophus tumbesensis, a new stingray from the coast of Peru (Batoidea: Urolophidae). Copeia 4: 709-713. Compagno, L. J. V. y T. R. Roberts. 1982. Freshwater stingrays (Dasyatidae) of Southeast Asia and New Guinea, with description of a new species of Hirnantura and reports of unidentified species. Environmental Biology of Fishes 7: 321-339. Devicenzi G. J. y G. W. Teague. 1942. Ictiofauna del Uruguay Medio. Anales del Museo de Historia Natural de Montevideo 5: 1–103. Fernández-Yépez, A. 1957. Nueva raya para la ciencia Potamotrygon schroederi, n. sp. Boletín del Museo de Ciencias Naturales 1-2: 7-11. Hubbs, C. L. y R. Ishiyama. 1968. Methods for the taxonomic study and description of skates (Rajidae). Copeia 1968: 483–491. Piorski, N. M. y J. L. S. Nunes. 2000. Dimorfismo sexual e tendência alométrica de Urotrygon microphthalmum Delsman, 1941 (Elasmobranchii, Urolophidae). Boletim do Laboratório de Hidrobiologia, São Luis 13: 67-81. Rosa, R. S. 1985. A systematic revision of the South American freshwater stingrays • • • • • • (Chondrichthyes: Potamotrygonidae). Tesis Doctoral, College of William and Mary, Williamsburg, Virginia. 523 pp. Rosa, R. S. 1991. Paratrygon aiereba (Müller & Henle, 1841) the senior synonym of the freshwater stingray Disceus thayeri Garman, 1913 (Chondrichthyes: Potamotrygonidae). Revista Brasileira de Zoologia 7: 425–437. Rosa, R. S., H. P. Castello y T. B. Thorson. 1987. Plesiotrygon iwamae, a new genus and species of Neotropical freshwater stingray (Chondrichthyes: Potamotrygonidae). Copeia 2: 447-458. Rosa R. S., M. R. Carvalho y C. A. Wanderley. 2008. Potamotrygon boesemani (Chondrichthyes: Myliobatiformes: Potamotrygonidae), a new species of neotropical freshwater stingray from Surinam. Neotropical Ichthyology 6: 1–8. Silva, A. G. C. y E. Goulart. 2007. Morfometria de raias continentais (Chondrichthyes, Potamotrygonidae) do alto rio Paraná, Brasil. Acta Scientiarum Biological Sciences 29: 413-419. Silva, J. P. C. B. y M. R. de Carvalho. 2011. A new species of Neotropical freshwater stingray of the genus Potamotrygon Garman, 1877 from the Río Madre de Díos, Peru (Chondrichthyes: Potamotrygonidae). Papéis Avulsos de Zoologia 51: 139-154. Thorson, T. B. y D. E. Watson. 1975. Reassignment of the African freshwater stingray, Potamotrygon garouaensis, to the genus Dasyatis, on physiologic and morphologic grounds. Copeia 4: 701-712. 105 Ilustración: E. Canetti R. Barriga 3.4 Elaboración de las fichas de especies Carlos A. Lasso, Mónica A. Morales-Betancourt, Paula SánchezDuarte y Juliana Agudelo Para la elaboración de las fichas de especies se partió de una revisión exhaustiva de la literatura publicada en revistas científicas, libros, boletines, resoluciones, estadísticas, así como literatura gris (informes técnicos, tesis, etc.), disponibles hasta la fecha. Esto constituyó el punto de partida para cumplir con los diferentes apartados considerados en las fichas de las especies. Los ítems o apartados en los cuales se basó la elaboración de las fichas de especies, se dividió en tres grupos: a) historia natural de la especie (distribución geográfica, talla, peso, hábitat, alimentación, reproducción y comportamiento, entre otros); b) aprovechamiento (uso, aspectos pesqueros, normativa) y aspectos sobre su conservación (amenazas y conservación). En el caso de que no hubiera información para alguno de los ítems consignados, no se incluyó ese apartado en la ficha. En la medida de lo posible la información fue discriminada por cuencas hidrográficas, en especial en aquellas que pudieran representar un complejo de especies, ya que para tener un buen manejo y conservación de las especies, es indispensable conocer su historia natural, uso y conservación en función de la región donde se distribuyen, dadas las diferencias y particularidades de las condiciones ambientales. Contenido de las fichas 1. Especie, autor y año. Descriptor (y fecha) original de la especie. 2. Fotografía. Ilustración de la especie. 3. Nombre común y/o indígena. Se emplean los nombres vernáculos de uso en cada zona, incluidos los indígenas, así como los que se encuentran en la literatura científica y en la industria de la acuariofilia. 4. Otros nombres usados y/o sinonimias. Se incluyen las principales sinonimias u otros nombres científicos usados en la literatura con el fin de poder relacionar la especie con la bibliografía histórica. 107 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FICHAS 5. Estatus de conservación. Para establecer las especies se incluyó la categoría nacional, en Colombia de acuerdo a el Libro rojo de peces dulceacuícola de Colombia (Mojica et al. 2012). La categoría global según el listado de la UICN (Versión 2013.1) (www. uicnredlist.org). 6. Caracteres distintivos. Breve rese- ña de los caracteres morfológicos, merísticos, morfométricos y de coloración, que permiten identificar la especie. 7. Distribución geográfica a. Países. Países donde se distribuye la especie. b. Cuencas hidrográficas. Se discrimina la distribución de las especies por cuencas en los diferentes países considerados. c. Subcuencas. Se incluyó la información por subcuencas y en ocasiones algunos ríos de orden menor, según las cuencas hidrográficas a las que pertenecen. d. Mapas. Para la construcción de los mapas se manejaron diferentes fuentes: ESRI 2013 basemap data, NAVTEQ DeLorme para el mapa base de Suramérica y ESRI para los ríos de Suramérica y los países limítrofes de Colombia (2009) a escala 1:500.000. La fuente de información sobre la distribución, corresponde a los registros puntuales (georeferenciados) obtenidos de las colecciones biológicas y complementada sobre todo, con datos de los investigadores (publicados o no) referentes a avistamientos. Las colecciones consultadas fueron: AMNH: American Museum of Natural History, New York, U. S. A. CAS: California Academy of Science, San Francisco, U. S. A. 108 CIACOL: Colección Ictiológica de la Amazonia Colombiana, SINCHI, Colombia. CIUA: Colección Ictiológica, Universidad de Antioquia, Colombia. CZCH: Colección Zoológica de Chocó, Colombia. CZUT-IC: Colección Zoológica de la Universidad del Tolima – Ictiología, Colombia. IAvH: Colecciones Biológicas Instituto Alexander von Humboldt, Colombia. ICN: Instituto de Ciencias Naturales, Museo de Historia Natural, Universidad Nacional de Colombia, Bogotá, Colombia. INIA: Instituto Nacional de Investigaciones Agrícolas, Venezuela. INPA: Coleçâo Ictiologia, Manaos, Brasil. IRSNB: Institut Royal des Sciences Naturelles de Belgique, Bruselas, Bélgica. FMNH: Field Museum of Natural History, USA. MBUCV: Museo de Biología, Universidad Central de Venezuela, Caracas, Venezuela. MCNG: Museo de Ciencias Naturales, Universidad Nacional Ezequiel ZamoraUnellez, Guanare, Venezuela. MCP: Museu de Ciência e Tecnologia, Pontifícia Universidade Católica do Rio Grande do Sul. MCZ: Museum of Comparative Zoology, Harvard University. MEPN: Colección Ictiológica, Instituto de Ciencias Biológicas de la Escuela Politécnica Nacional, Quito, Ecuador. MHNLS: Museo de Historia Natural La Salle, Caracas, Venezuela. MLS: Museo de La Salle, Universidad de La Salle, Bogotá, Colombia. MUSM: Colección Ictiológica del Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos, Lima, Perú. MZUSP: Museu de Zoología, Universidade de São Paulo, Brasil. ROM: Royal Ontario Museum, Canadá. UFPB: Universidade Federal da Paraíba, Brasil. M. A. Morales-B. UMMZ: University of Michigan, Museum of Zoology, USA. ZMH: Zoological Museum Hamburg, Alemania. 8. Talla y peso. Corresponde a registros de la talla y peso máximo alcanzado por los adultos (discriminado por sexos cuando se disponía de la información) y en algunos casos de los neonatos. La talla se expresa como ancho del disco (AD) y longitud del disco (LD). En algunos casos se menciona la longitud total (LT). Las medidas siguen a Rosa (1985). 9. Hábitat. Ocupación espacio-temporal de la especie en los diferentes cuerpos de agua, así como datos ecológicos de los mismos. La información proviene de bibliografía u observaciones personales de los autores. 10. Alimentación. Incluye la información de los hábitos alimenticios y alimentarios de las especies. Cuando hubo estómagos disponibles para su análisis, se calculó el índice de importancia relativa (IIR). Se indica el número de estómagos analizados (n) y entre paréntesis se especifica el número de estómagos que mostraron algún tipo de contenido. 11. Reproducción. De acuerdo a la dis- ponibilidad de información, se incluye los siguientes aspectos: época de reproducción, fecundidad (ovárica y uterina) y talla mínima de madurez sexual (discriminando cuando fue posible entre machos y hembras). La fecundidad ovárica se define como el número de óvulos viables y la uterina como el número de embriones (Charvet-Almeida et al. 2005). Se incluye también información sobre la longitud del clasper (sensu Rosa 1985) y la proporción sexual entre los neonatos y/o embriones, así como el AD de los mismos. 12. Movimientos y comportamiento. Hace referencia a los desplazamientos de los individuos entre los diferentes cuerpos de agua de acuerdo a la época climática, así como a los movimientos de acuerdo a su grado de desarrollo. 13. Uso. Se reseña el uso de las especies: alimenticio, ornamental y/o medicinal. 14. Aspectos pesqueros a. Método de captura. Se refiere al arte de pesca empleado para capturar la especie de acuerdo a su uso. b. Desembarques. Muestra los desembarcos anuales y las medias o promedios mensuales, CPUE, al igual la procedencia de los mismos. c. Comercialización y exportación (estadísticas). Muestra los datos de movilización de las especies desde regiones específicas del país o desde el país hacia el exterior. d. Normativa. Hace referencia a las medidas legales sobre el aprovechamiento de la especie en los diferentes países. 15. Amenazas. Se incluye los factores que amenazan la supervivencia de la especie como lo son el uso no sostenible (consumo alimenticio -sobrexplotación- y comercio ornamental) y la degradación ambiental. 16. Conservación. De acuerdo a la disponibilidad de la información, se mencionan los planes o medidas de conservación existentes para la especie en particular. 17. Referencia de identificación. Cita del autor (es) consultados en la identificación de la especie en particular. 109 Potamotrygon scobina, río Orinoco. Foto: M. A. Morales-Betancourt M. A. Morales-B. 4. Claves para la identificación de las rayas de agua dulce (Potamotrygonidae) Ricardo S. Rosa 4.1. Clave artificial para la identificación de los géneros de la familia Potamotrygonidae 1a. Distancia desde la boca hasta el margen anterior del disco relativamente larga, contenida 2,2 a 3,3 veces en el ancho del disco; aletas pélvicas totalmente cubiertas dorsalmente por el disco ……............................................................................................................................... 2 1b. Distancia desde la boca al margen anterior del disco relativamente corta, contenida 3,6 a 5,6 veces en el ancho del disco; aletas pélvicas por lo menos parcialmente expuestas detrás del margen posterior del disco ..........................................................................................3 2a. Disco oval, su borde anterior cóncavo, sin una prominencia anteromediana; un botón carnoso en forma de perilla presente en el margen exterior del espiráculo; aguijón o espina aserrada de la cola generalmente más grande que la longitud del espiráculo …………………… …………………............................………….........................................................…………… Paratrygon 111 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA CLAVES 2b. Sin un botón carnoso en forma de perilla en el margen exterior del espiráculo; disco casi circular, su borde anterior convexo, con una pequeña prominencia anteromediana; aguijón de la cola ausente o reducido, más corto que la longitud del espiráculo ….…………………… ………….......................................................................................................................... Heliotrygon 3a. Cola relativamente corta, su longitud es menor de dos veces el ancho del disco; pliegues membranosos presentes dorsalmente y ventralmente en la cola; ojos relativamente grandes y elevados en el perfil dorsal, su diámetro horizontal contenido menos de cuatro veces en la distancia interorbital .............................................................................................. Potamotrygon 3b. Cola relativamente larga y filiforme, su longitud es mayor de dos veces el ancho de disco; sólo un pliegue membranoso ventral en la cola; ojos muy pequeños, no sobresalientes en el perfil dorsal del disco, su diámetro horizontal contenido por lo menos 4,4 veces en la distancia interorbital ..................……………………………………………………………… Plesiotrygon 4.2 Clave para la identificación de las especies amazónicas del género Heliotrygon (aplica a ejemplares adultos y sub-adultos; no se incluyen especies cuyas descripciones no están todavía publicadas) 1a. Coloración dorsal del disco generalmente gris o marrón uniforme, sin marcas diferenciadas formando un vermiculado; distancia de la axila pectoral hasta el margen posterior de la aleta pélvica proporcionalmente corta, en promedio 1,9% del ancho del disco ………… …...…………………………………………………………………….………….……………. Heliotrygon gomesi 112 A. Barbarino 1b. Coloración dorsal del disco generalmente con fondo gris o marrón claro, con pequeñas manchas blancas o amarillo claro formando un patrón vermiculado; distancia de la axila pectoral hasta el margen posterior de la aletá pélvica proporcionalmente larga, en promedio 3,7% del ancho del disco ……………………………………………………………… Heliotrygon rosai 4.3 Clave para la identificación de las especies amazónicas del género Plesiotrygon (aplica a ejemplares adultos y sub-adultos) 1a. Coloración dorsal del disco con un fondo marrón amarillento o marrón-grisáceo y numerosas manchas irregulares blancas, ocasionalmente formando rosetas; la coloración del fondo no forma un patrón reticulado en adultos y sub-adultos; disco oval o sub-elíptico, longitud del disco 99,7-108,6% del ancho del disco -AD (promedio 103,4% AD); boca proporcionalmente grande, su ancho representa el 7,8-13,9% AD (promedio 9,5) ………………… ……….………………………………………………………………….………………….…. Plesiotrygon iwamae 1b. Coloración dorsal del disco con fondo marrón claro u oscuro, con numerosas manchas irregulares blancas o amarillo claro, formando rosetas u ocelos incompletos; la coloración oscura del fondo suele formar un patrón reticulado irregular; disco aproximadamente circular, longitud del disco 98,4-112,5% del ancho del disco -AD (promedio 104,4%); boca proporcionalmente pequeña, su ancho 6,5-8,3% AD (promedio 7,7%) ………………………… ….……………………….…………………………………………………………........…….…. Plesiotrygon nana 4.4 Clave para la identificación de las especies del género Potamotrygon (aplica a ejemplares adultos y sub-adultos; no se incluyen especies cuyas descripciones no han sido publicadas todavía de los ríos Amazonas, Negro y Tapajós en Brasil, y río Meta en Colombia y Venezuela, así como especies con estatus taxonómico dudoso de Brasil y Colombia). 1a. Coloración dorsal del disco generalmente con ocelos de colores variados, desde el blanco, amarillo y naranja hasta el rojo intenso, circundados o rodeados por un anillo negro, su diámetro más grande que el diámetro horizontal de los ojos ……….….……….….…………. 2 1b. Superficie dorsal del disco generalmente sin ocelos más grandes que el diámetro horizontal de los ojos; ocelos pequeños suelen estar presentes en la periferia del disco ……..... 5 2a. Ocelos de la superficie dorsal del disco generalmente distribuidos en un patrón regular de círculos concéntricos; ocelos generalmente circulares, raramente fusionados dos a dos, reducidos en tamaño o ausentes, su color del amarillo a naranja; cola sin ocelos; especie ampliamente distribuida: cuenca del Orinoco (Colombia-Venezuela) y Amazonas (Colombia, Brasil, Ecuador, Perú, Bolivia y Venezuela), Guyana, Surinam, Guayana Francesa, Uruguay y Argentina (cuenca del Paraná) …………….….……………….….……………. Potamotrygon motoro 113 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA CLAVES 2b. Ocelos de la superficie dorsal del disco generalmente distribuidos irregularmente sin formar un patrón de círculos concéntricos ………………….….……………….….……………….…... 3 3a. Ocelos de la superficie dorsal del disco naranja intenso a rojo, de forma irregular, ovales o fusionados dos a dos, y rodeados por anillos negros relativamente anchos; especie distribuida en la cuenca del río Corantijn en Surinam ………….….………… Potamotrygon boesemani 3b. Ocelos de la superficie dorsal del disco circulares o con formatos irregulares, alunados, a veces fusionados dos a dos, su color varía del blanco al amarillo; cola con ocelos similares a los del disco, extendidos desde su base hasta la inserción del aguijón o espina caudal aserrada ….….……………….….……………….….……………….….……………….….……………….….…. 4 4a. Ocelos de la superficie dorsal del disco distribuidos irregularmente o excepcionalmente en un patrón circular; ocelos circulares o irregulares, ocasionalmente con el centro negro; dientes relativamente grandes y anchos, con forma tetragonal o hexagonal, dispuestos en 14 a 26 filas longitudinales en la mandíbula superior; especie distribuida en la cuenca de los ríos Tocantins y Araguaia en Brasil ……………………..….….……………. Potamotrygon henlei 4b. Ocelos de la superficie dorsal del disco distribuidos irregularmente o excepcionalmente en un patrón circular; ocelos circulares o irregulares, ocasionalmente con el centro negro; dientes relativamente pequeños, con formato tetragonal, en 23 a 25 filas longitudinales en la mandíbula superior; especie distribuida en la cuenca de los ríos Xingú y Iriri en Brasil ……………………………………….….……………….….……………….….………..... Potamotrygon leopoldi 5a. Superficie dorsal del disco generalmente con un patrón de coloración reticulado oscuro delimitando formas poligonales sobre un fondo marrón ……………….….……………….….…… 6 5b. Superficie dorsal del disco sin un patrón reticulado conspicuo ………….….……………….. 7 6a. Patrón reticulado formado por líneas marrón oscuras continuas o interrumpidas, delimitando formas generalmente hexagonales sobre un fondo marrón claro; cola con bandas laterales oscuras y generalmente con una sola hilera de espinas dorsales; surcos labiales bien desarrollados y evidentes; especie ampliamente distribuida en el norte de Suramérica (Colombia, Venezuela, Brasil, Perú y las Guayanas) en las cuencas del Orinoco, Amazonas y Parnaíba ….….….….……………….….……………….….……………….….……… Potamotrygon orbignyi 6b. Patrón reticulado formado por líneas marrón difusas, contínuas o interrumpidas, delimitando formas hexagonales o circulares sobre un fondo marrón claro; superficie dorsal del disco muy áspera en cualquier talla corporal, con dentículos bien desarrollados y agudos, a veces formando tubérculos marginales; cola con espinas dorsales y laterales muy desarrolladas; surcos labiales ausentes; especie distribuida en la cuenca media y baja del Amazonas, desde el Río Negro hasta el río Pará (Brasil) …………….… Potamotrygon humerosa 7a. Superficie dorsal del disco con un patrón de coloración formado por manchas circulares, ovales o reniformes, de color blanco, amarillo o naranja sobre un fondo marrón, gris a púrpura-negro ………….….……………….….……………….….……………….….……………….….…... 8 114 A. Barbarino 7b. Superficie dorsal del disco con un patrón de coloración diferente del indicado en 7a …. ….……………….….……………….….……………….….……………….….……………….….………………... 14 8a. Manchas de la superficie dorsal del disco más pequeñas que el diámetro horizontal de los ojos ………….….……………….….……………….….……………….….……………….….………………...9 8b. Manchas de la superficie dorsal del disco más grandes que el diámetro horizontal de los ojos ……….….……………….….……………….….……………….….……………….….……………….…12 9a. Cola corta, con el aguijón posicionado más basalmente, la distancia entre el margen posterior de la cloaca y la inserción del aguijón es menor que la mitad del ancho del disco; manchas de la superficie dorsal del disco irregulares, amarillas o marrón, concentradas formando rosetas de formato irregular (aproximadamente ovales) sobre un fondo marrón oscuro; las rosetas disminuyen en tamaño hacia las márgenes del disco y se extienden en la superficie dorsal de la cola, donde quedan separadas por espacios negros en forma de silla; especie de la cuenca de los ríos Oyapock y Maroni en la Guayana Francesa y posiblemente en las cuencas de los ríos Negro y Meta en Brasil y Colombia ………… Potamotrygon marinae 9b. Cola relativamente larga, con el aguijón más distal, la distancia entre el margen posterior de la cloaca y la inserción del aguijón es más grande que la mitad del ancho del disco ………………...…....…………...…....…………...…....…………...…....…………...…....…………...…....…. 10 10a. Manchas de la superficie dorsal del disco de formato irregular o reniforme, de color marrón claro o amarillentas, generalmente unidas en un patrón vermiculado; algunas manchas amarillas más intensas y de forma más circular, circundadas por pigmento oscuro, suelen estar dispersas en la porción intermedia y periférica del disco; espinas medianas en una única hilera sobre la cola; especie de la cuenca del río Madre de Díos en Perú ………… ……...…....…………...…....…………...…....…………...…....…………...…....…… Potamotrygon tatianae 10b. Manchas de la superficie dorsal del disco circulares u ovales, generalmente sin formar un patrón vermiculado …………………...…....…………...…....…………...…....…………...…....…… 11 11a. Manchas de la superficie dorsal del disco circulares, blancas o amarillo claro, dispersas de manera difusa u ocasionalmente concentradas formando rosetas circulares sobre un fondo más oscuro o a veces en figuras irregulares separadas por un retículo oscuro; especie del canal principal del río Amazonas y Orinocoy partes bajas de los afluentes principales …………...…....…………...….........……….………………………………….………… Potamotrygon scobina 11b. Manchas de la superficie dorsal del disco circulares u ovales, amarillas o marrón claro sobre un fondo marrón oscuro, dispersas de forma difusa, ocasionalmente concentradas formando un vermiculado o desvaneciéndose en ejemplares más oscuros; especie de las cuencas del río Atrato y Magdalena-Cauca en Colombia …....................…........…........…........…. .......…........…........…........…........…........…........…........….........…....…… Potamotrygon magdalenae 12a. Porción distal de la cola sin barras oscuras alternadas con espacios más claros; cola relativamente corta, generalmente menor que el ancho del disco; espinas medianas de la 115 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA CLAVES cola dispuestas en una a tres hileras irregulares; manchas de la superficie dorsal del disco irregulares u ovales, amarillas sobre un fondo marrón, más grandes que el diámetro horizontal de los ojos y ocasionalmente unidas formado un patrón vermiculado; especie originalmente descrita de la cuenca del río Paraná, presente también en la porción superior del río Amazonas en Perú y en la subcuenca del río Madeira en Brasil y Bolivia …………………...… ....…………...…....…………...…....…………...…....…………...……..……………… Potamotrygon falkneri 12b. Porción distal de la cola con cinco o seis barras oscuras, alternadas con espacios más claros …………...….............……………………………………………………………………………………... 13 13a. Manchas de la superficie dorsal del disco circulares, ovales o reniformes, de color amarillo a naranja, formando un patrón vermiculado irregular sobre un fondo marrón claro a oscuro; especie distribuida en las partes altas de la cuenca del río Amazonas en Perú ……… ..………………………………………………..…………...…....…………...……………. Potamotrygon tigrina 13b. Manchas de la superficie dorsal del disco largas y reniformes, de color crema, amarillo o naranja, unidas formando un patrón de rosetas irregulares en forma de cerebro, sobre un fondo marrón o gris oscuro a púrpura-negro; especie distribuida en la cuenca de los ríos Negro, Meta y Orinoco, en Brasil, Colombia y Venezuela ……........…........…........…........…........ …........…........…........…........…........…........…........…........…........………… Potamotrygon schroederi 14a. Manchas negras de la superficie dorsal del disco irregulares (circulares u ovales) y con tallas variables, esparcidas, sin formar un patrón regular, sobre un fondo marrón claro a marrón-gris oscuro; estas manchas pueden estar unidas formando un vermiculado; ocasionalmente hay manchas circulares blancas o amarillas esparcidas irregularmente sobre el fondo; especie restricta a la cuenca del Lago de Maracaibo y subcuenca del río Catatumbo en Venezuela y Colombia ……………...…....…………...…....…………...…....… Potamotrygon yepezi 14b. Superficie dorsal del disco con un patrón de coloración diferente del indicado en 14a .... ………………………………………………………………………………...…....…………...…....……………… 15 15a. Superficie dorsal del disco marrón-oliváceo o gris oscuro, con pequeñas manchas blancas o amarillas formando rosetas u ocelos irregulares cerca del margen del disco; ocasionalmente con un patrón reticular de pigmento oscuro; superficie dorsal del disco y cola con tubérculos muy desarrollados; los del disco situados en el margen del mismo, región escapular y en la línea medio-dorsal posterior; especie de la cuenca del Amazonas, desde Perú, Ecuador y Colombia hasta Brasil ……………...…....………........…........…........…........…........ …........…........…........…........…........…........…........…........……...…....…….Potamotrygon constellata 15b. Superficie dorsal del disco marrón claro, con figuras casi triangulares delimitadas por pigmento oscuro, formando un patrón reticulado abierto; surcos labiales ausentes; especie de la baja cuenca del Amazonas, incluyendo la subcuenca del río Araguaia, la Isla de Marajó y la costa de Amapá en Brasil …………………...…....……........…........…........…........…........…........ …........…........…........…........…........…........…........…........……...…....……… Potamotrygon dumerilii 116 A. Barbarino 4.5 Chave artificial de identificação para os gêneros da família Potamotrygonidae 1a. Distância da boca até a margem anterior do disco relativamente longa, 2.2 a 3.3 vezes na largura disco; nadadeiras pélvicas totalmente cobertas dorsalmente pelo disco ............ 2 1b. Distância da boca até a margem anterior do disco relativamente curta, 3.6 a 5.6 vezes na largura do disco; nadadeiras pélvicas exposta pelo menos parcialmente por detrás da margem posterior do disco ..............…………...…....…………...…....…………...…....…………...…... 3 2a. Disco oval, sua margem anterior côncava, sem uma proeminência anteromediana; um botão carnoso presente na margem externa do espiráculo; espinho serrilhado da cauda geralmente maior que o comprimento do espiráculo .........…………...…....…………...…Paratrygon 2b. Disco quase circular, sua margem anterior convexa, com una pequena proeminência anteromediana; sem um botão carnoso na margem externa do espiráculo; espinho serrilhado da cauda ausente ou reduzido, mais curto que o comprimento do espiráculo ………………… …………………………...…....…………...…....………............................................................ Heliotrygon 3a. Cauda relativamente curta, seu comprimento menos de duas vezes a largura do disco; pregas membranosas presentes dorsalmente e ventralmente na cauda; olhos relativamente grandes e elevados no perfil dorsal, seu diâmetro horizontal contido menos que quatro vezes na distância interorbital.................................................................................Potamotrygon 117 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA CLAVES 3b. Cauda relativamente longa e filiforme, seu comprimento mais de duas vezes a largura do disco; apenas uma prega membranosa ventral na cauda; olhos muito pequenos, não salientes no perfil dorsal do disco, seu diâmetro horizontal contido pelo menos 4,4 vezes na distância interorbital ............................................................................................ Plesiotrygon 4.6 Chave de identificação para as espécies amazônicas do gênero Heliotrygon (aplica-se a espécimes adultos e subadultos; não estão incluídas espécies com descrição pendente). 1a. Coloração dorsal do disco geralmente cinza ou marrom uniformemente, sem marcas diferenciadas formando um vermiculado; distância da axila peitoral à margem posterior da nadadeira pélvica proporcionalmente menor, em média, 1,9% da largura do disco ………… …………………………….………………….……………..................…….………….……. Heliotrygon gomesi 1b. Coloração dorsal do disco geralmente com fundo cinza ou marrom claro, com pequenas manchas brancas ou amarelo claro formando um padrão vermiculado; distância axila peitoral à margem posterior nadadeira pélvica proporcionalmente grande, em média, 3,7% da largura do disco ………………….…………….…………….…………….…………….….. Heliotrygon rosai 4.7 Chave de identificação para as espécies amazônicas do gênero Plesiotrygon (aplica-se a espécimes adultos e subadultos). 1a. Coloração dorsal do disco com fundo marrom amarelado ou marrom-acinzentado, com numerosas manchas brancas irregulares, ocasionalmente formando rosetas; a coloração de fundo não formam um padrão reticulado em adultos e sub-adultos; disco oval ou subelíptico, comprimento disco 99,7-108,6% da largura do disco -LD (média de 103,4%); boca proporcionalmente grande, sua largura 7,8-13,9% LD (média 9,5%) …………….…………….……… …….…………….…………….…………….…………….…………….…………………... Plesiotrygon iwamae 1b. Coloração dorsal do disco com fundo marrom claro ou escuro, com inúmeras manchas brancas ou amarelo claro, formando rosetas ou ocelos incompletos; a coloração escura do fundo tipicamente pode formar um padrão reticulado irregular; disco aproximadamente circular, comprimento disco 98,4-112 ,5% da largura do disco -LD (média de 104,4%); boca proporcionalmente pequena, a sua largura 6,5-8,3% LD (média 7,7%) ………………….………… ….…………….…………….…………….…………….…………….…………….……….…... Plesiotrygon nana 118 A. Barbarino 4.8 Chave de identificação para as espécies amazônicas do gênero Potamotrygon (aplica-se a espécimes adultos e subadultos; não se incluem espécies cujas descrições não estão ainda publicadas, dos rios Amazonas, Negro e Tapajós no Brasil, rio Meta na Colômbia e rio Orinoco na Venezuela, assim como espécies com status taxonômico duvidoso do Brasil e Colômbia). 1a.Coloração dorsal do disco geralmente com ocelos de cores variadas, desde o branco, amarelo e laranja até o vermelho intenso, e circundados por um anel negro, seu diâmetro maior que o diâmetro horizontal dos olhos ………………….…………….…………….…………….………… 2 1b. Superfície dorsal do disco geralmente sem ocelos maiores que o diâmetro horizontal dos olhos; pequenos ocelos podem estar presentes na periferia do disco ………………….…… 5 2a. Ocelos da superfície dorsal do disco geralmente distribuídos em um padrão regular de círculos concêntricos; ocelos geralmente circulares, raramente fusionados dois a dois, reduzidos em tamaño e número ou mesmo ausentes, sua cor de amarelo a laranja; cauda sem ocelos; espécie amplamente distribuída, encontrada nas bacias dos rios Orinoco (Colômbia e Venezuela), Amazonas (Colômbia, Brasil, Equador, Peru, Bolívia e Venezuela), Mearim e Parnaíba (Brasil), assim como na Guiana, Suriname, Guiana Francesa, e na bacia do rio Paraná-Paraguai (Argentina, Brasil, Paraguai e Uruguai) ………………. Potamotrygon motoro 2b. Ocelos da superfície dorsal do disco geralmente distribuídos irregularmente sem formar um padrão de círculos concêntricos ……………….…………….…………….…………….……… 3 3a. Ocelos da superfície dorsal do disco laranja intenso a vermelho, de forma irregular, ovais ou fusionados dois a dois, e rodeados por anéis negros relativamente largos; espécie distribuída na bacia do rio Corantijn no Suriname …………………….Potamotrygon boesemani 3b. Ocelos da superfície dorsal do disco circulares ou com formatos irregulares, lunados, por vezes fusionados dois a dois, sua cor de branco a amarelo; caudacom ocelos similares aos do disco, desde sua base até a inserção do espinho serrilhado …………….…………….……4 4a. Ocelos da superfície dorsal do disco distribuídos irregularmente ou excepcionalmente em um padrão circular; ocelos circulares ou irregulares, ocasionalmente como centro negro; dentes relativamente grandes e largos, com formato tetragonal ou hexagonal, em 14 a 26 fileiras longitudinais na mandíbula superior; espécie distribuída na bacia dos rios Tocantins e Araguaia no Brasil …….…………….…………….…………….………... Potamotrygon henlei 4b. Ocelos da superfície dorsal do disco distribuídos irregularmente ou excepcionalmente em um padrão circular; ocelos circulares ou irregulares, ocasionalmente como centro negro; dentes relativamente pequenos, com formato tetragonal, em 23 a 25 fileiras longitudinais na mandíbula superior; espécie distribuída na bacia dos rios Xingúe Iriri no Brasil …… …………….……………….…………….……………………………...……….……..…. Potamotrygon leopoldi 119 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA CLAVES 5a.Superfície dorsal do disco geralmente com um padrão de coloração reticulado escuro delimitando formas poligonais sobre um fundo marrom ...……………….…………….…………….. 6 5b. Superfície dorsal do disco sem um padrão reticulado conspícuo …………………….……… 7 6a. Padrão reticulado formado por linhas marrom-escuras, contínuas ou interrompidas, delimitando formas geralmente hexagonais sobre um fundo marrom claro; cauda com bandas laterais escuras e geralmente com uma única fileira de espinhos dorsais; sulcos labiais bem desenvolvidos e evidentes; espécie amplamente distribuída no norte da América do Sul (Colômbia, Venezuela, Brasil, Peru e Guianas), nas bacias dos rios Orinoco, Amazonas e Parnaíba ........…………….…………….…………….…………….…………….… Potamotrygon orbignyi 6b. Padrão reticulado formado por linhas marrom difusas, contínuas ou interrompidas, delimitando formas hexagonais o circulares sobre um fundo marrom claro; superfície dorsal do disco muito áspera em qualquer tamanho corporal, com dentículos bem desenvolvidos e agudos, àsvezes formando tubérculos marginais; cauda com espinhos dorsaise laterais muito desenvolvidos; sulcos labiais ausentes; espécie da porção média e baixa da bacia do rio Amazonas, do rio Negro até o rio Pará (Brasil) ………………….…… Potamotrygon humerosa 7a. Superfície dorsal do disco com um padrão de coloração formado por manchas circulares, ovais ou reniformes, de cor branca, amárelo ou laranja sobre um fundo marrom, cinza apúrpura-negro ………………….…………….…………….…………….…………….…………….…………. 8 7b. Superfície dorsal do disco com um padrão de coloração diferente do indicado em 7a …… ……….…………….…………….…………….…………….…………….…………….…………….…………..… 14 8a. Manchas da superfície dorsal do disco menores que o diâmetro horizontal dos olhos ……………….…………….…………….…………….…………….…………….…………….…………….………..9 8b. Manchas da superfície dorsal do disco maiores que o diâmetro horizontal dos olhos …… ……….…………….…………….…………….…………….…………….…………….…………….…………….. 12 9a. Cauda curta, como espinho serrilha do posicionado mais basalmente, a distância entre a margem posterior da cloaca e a inserção do espinho serrilhado menor que a metade da largura do disco; manchas da superfície dorsal do disco irregulares, amarelas ou marrom, concentradas formando rosetas de formato irregular (aproximadamente ovais) sobre fundo marrom escuro; rosetas diminuem de tamaño em direção às margens do disco e se estén de uma superficie dorsal da cauda, onde se encontram separadas por espaços negros em forma de sela; espécie da bacia dos rios Oyapocke Maroni na Guiana Francesa e possivelmente nas bacias dos rios Negro e Meta no Brasil e Colômbia …….……Potamotrygon marinae 9b. Cauda relativamente longa, com oespinho serrilhado posicionado mais distalmente, a distância entre a margem posterior da cloaca e a inserção do espinho serrilhado maior que a metade da largura do disco .........…………….…………….…………….…………….…………….…...10 120 A. Barbarino 10a. Manchas da superfície dorsal do disco com formato irregular ou reniforme, marromclaro ou amareladas, geralmente unidas em um vermiculado; algumas manchas amarelas mis intensas e com forma mais circular, circundadas por pigmento escuro, podem estar dispersas na porção intermediaria e periférica do disco; espinhos medianas em uma única fileira sobre a cauda; espécieda bacia do rio Madre de Díos no Perú ………………….……………. …………….…………….…………….…………….………..……...........................… Potamotrygon tatianae 10b. Manchas da superfície dorsal do disco circulares ou ovais, geralmente sem formar um padrão vermiculado ……………….…………….…………….…………….…………….…………….…..… 11 11a. Manchas da superfície dorsal do disco circulares, brancas ouamarelo-claro, dispersas difusamente, ou ocasionalmente concentradas formando rosetas circulares sobre fundo mais escuro ou ainda, figuras irregulares separadas por um retículo escuro; espécie do canal principal do rio Amazonas e Orinoco e partes baixas de seus principais afluentes ……… ……….…………….…………….…………….…………….……………......…………… Potamotrygon scobina 11b. Manchas da superfície dorsal do disco circularesou ovais, amarelas ou marrom-claro sobre um fundo marrom escuro, dispersas difusamente, ocasionalmente concentradas formando um vermiculado ou desvanecendo-se em exemplares mais escuros; espécie das bacias dos ríos Atrato e Magdalena-Cauca na Colômbia ….……………Potamotrygon magdalenae 12a. Porção distal de da cauda sem barras escuras alternadas com espaços mais claros; cauda relativamente curta, geralmente menor que a largura do disco; espinhos medianos da cauda em una a três fileiras irregulares; manchas da superfície dorsal do disco irregulares ou ovais, amarelas sobre um fundo marrom, maiores que o diâmetro horizontal dos olhos, ocasionalmente unidas formando um vermiculado; espécie originalmente descrita da bacia do rio Paraná, ocorrendo também na porção superior do rio Amazonas no Peru e na subbacia do rio Madeira no Brasil e Bolívia ……………….…………….………… Potamotrygon falkneri 12b. Porção distal da cauda com cinco o seis barras escuras, alternadas com espaços mais claros ……………………….…………….…………….…………….…………….…………….…………….….. 13 13a. Manchas da superfície dorsal do disco circulares, ovais ou reniformes, de cor amarela a laranja, formando um padrão vermiculado irregular sobre um fundo marrom claro a escuro; espécie distribuída nas partes altas da bacia do rio Amazonas no Peru ……………….…… ……….…………….…………….…………….…………….…………….……………..…. Potamotrygon tigrina 13b. Manchas da superfície dorsal do disco grandes e reniformes, de cor creme, amarelo ou laranja, unidas formando um padrão de rosetas irregulares em forma de cérebro, sobre um fundo marrom ou cinza escuro a púrpura-negro; espécie distribuída nas bacias dos rios Negro, Meta e Orinoco, no Brasil, Colômbia e Venezuela …..……………..Potamotrygon schroederi 14a. Manchas negras da superfície dorsal do disco irregulares (circulares ou ovais) e com tamanhos variados, esparsas, sem formar um padrão regular, sobre um fundo marrom claro a marrom-acinzentado escuro; estas manchas podem estar unidas formando um vermiculado; ocasionalmente há manchas circulares brancas o amarelas esparsas sobre o fundo; 121 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA CLAVES espécie restrita à drenagem do Lago de Maracaibo e rio Catatumbo, na Venezuela e Colômbia ………………….…………….…………….…………….…………….……............… Potamotrygon yepezi 14b. Superfície dorsal do disco com um padrão de coloração diferente do indicado em 14a .………………………….………….…………….…………….…………….…………….………..….…………… 15 15a. Superfície dorsal do disco marrom-oliváceo ou cinza-escuro, com pequenas manchas brancas o amarelas formando rosetas ou ocelos irregulares próximo à margem do disco; ocasionalmente com um padrão reticular de pigmento escuro; superfície dorsal do disco e cauda com tubérculos muito desenvolvidos; os do disco situados próximo à margem, na região escapular e na linha médio-dorsal posterior; espécie da bacia do Amazonas, desde Peru, Equador e Colômbia até o Brasil ………………….…………….……Potamotrygon constellata 15b. Superfície dorsal do disco marrom-claro, com figuras quase triangulares delimitadas por pigmento escuro, formando um padrão reticular aberto; sulcos labiais ausentes; espécie da porção baixa do Amazonas, incluindo a sub-bacia do rio Araguaia, a ilha de Marajó e a costa do Amapá no Brasil ………………….…………….…………….………….Potamotrygon dumerilii 4.9 Key to the genera of the family Potamotrygonidae 1a. Distance from mouth to anterior margin of disc relatively long, contained 2.2 to 3.3 times in disc width; pelvic fins completely covered dorsally by the disc ……………….…………2 1b. Distance from mouth to anterior margin of disc relatively short, contained 3.6 to 5.6 times in disc width; pelvic fins at least partially exposed dorsally, behind posterior margin of disc ……………….…………….…………….…………….…………….…………….…………….………...… 3 2a. Disc oval, its anterior margin concave and without extended tip (no anteromedial process); fleshy knob on exterior margin of spiracle present; serrated spine on the tail usually longer than spiracle length ………………….…………….…………….…………….………… Paratrygon 2b. Disc almost circular, its anterior margin convex with small anteromedial process present; no fleshy knob on exterior margin of spiracle; tail without serrated spine, or spine reduced and shorter than spiracle length ................................................................. Heliotrygon 122 A. Barbarino 3a. Tail relatively short, its length less than twice width of disc; dorsal and ventral membranous folds present on tail; eyes relatively large and elevated above dorsal profile, horizontal eye diameter contained fewer than four times in interorbital distance .................................... .................................................................................................................................... Potamotrygon 3b. Tail relatively long and filamentous, its length greater than two disc widths; only ventral membranous fold present on tail; eyes very small, not projecting above dorsal profile, horizontal eye diameter contained at least 4.4 times in interorbital distance ……………… ………………………………………………………........................………………………….......... Plesiotrygon 4.10 Key to the species of the genus Heliotrygon (use this key only for adult or sub-adult individuals) 1a.Dorsal surface of disc usually uniform gray or brown, without vermiculated markings; distance from pectoral-fin axil to posterior margin of pelvic fin proportionally small, 1.9% disk width in average …………………………………………………………………… Heliotrygon gomesi 1b. Dorsal surface of disc usually with light gray or brown background coloration and small white or light yellow spots forming a vermiculated pattern; distance from pectoral-fin axil to posterior margin of pelvic fin proportionally large, 3.7% disk width in average .…………… …………………………………………………………………………………………………….. Heliotrygon rosai 4.11 Key to the species of the genus Plesiotrygon (Use this key only for adult or sub-adult individuals) 1a. Dorsal surface of disc yellowish brown or brownish-gray, with numerous irregular white spots, occasionally forming rosettes; dorsal background coloration not forming a reticulated pattern in adults and sub-adults; disc oval or sub-elliptic, disk length 99,7-108,6% of disk width – DW (103.4% in average); mouth proportionally large, mouth width 7.8-13.9% DW (9.5% in average) ...........………………………………………………………… Plesiotrygon iwamae 123 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA CLAVES 1b. Dorsal surface of disc light or dark brown or brownish-gray, with numerous white or light yellow spots, forming rosettes or incomplete ocelli;dorsal background coloration typically forming an irregular reticulated pattern; disk approximately circular, disk length 98.4-112 .5% of disk width – DW (104.4%in average); mouth proportionally small, mouth width 6.5-8.3% DW (7.7% in average) …………………………………………………Plesiotrygon nana 4.12 Key to the species of the genus Potamotrygon (use this key only for adult or sub-adult individuals. Recognized but as yet undescribed species from the Amazon, Negro and Tapajós rivers in Brazil and the Meta River in Colombia and Venezuela are not included. Taxa of dubious validity from Colombia and Brazil are also excluded) 1a. Dorsal surface of disc usually with ocelli of various colors (white, yellow, orange or bright red) that are surrounded by a black ring; diameter of ocelli greater than horizontal eye diameter ……………………………………………………………………………………………………...… 2 1b. Dorsal surface of disc usually without ocelli that are larger than the horizontal eye diameter; smaller ocelli often present near disc margins .……………………………………………… 5 2a. Ocelli of dorsal surface of disc usually distributed in a regular pattern of concentric circles; ocelli usually circular, rarely, two may fuse together, may be reducedin size and number or even absent; color of ocelli yellow or orange; tail without ocelli; a widespread species found in the Orinoco Basin (Colombia-Venezuela), Amazon Basin (Colombia, Brazil, Ecuador, Peru, Bolivia and Venezuela), Mearim and Parnaíba (Brazil), as well as in Guyana, Surinam, French Guiana,andin the Paraná-Paraguay Basin (Argentina, Brazil, Paraguay and Uruguay) …………………………………………………………………………….Potamotrygon motoro 2b. Ocelli of dorsal surface of disc usually irregularly shaped and distributed, and not forming pattern of concentric circles ………………………………………………………………………….. 3 3a. Ocelli or dorsal disc surface bright orange to red, of irregular shape, oval, or fused in pairs and surrounded by relatively wide black rings; occurs in Corantijn River Basin of Surinam ……………………………………………………………………………………. Potamotrygon boesemani 3b. Ocelliof dorsal disc surface circular or irregularly shaped, moon-shaped, sometimes fused in pairs, and with color from white to yellow; tail with ocelli present, similar to those of disc and extending from insertion of tail to base of serrated spine …................…….....… 4 4a. Ocelli on dorsal disc surface usually distributed irregularly but sometimes forming circular pattern; ocelli circularor irregular, occasionally with black center; teeth relatively large and wide, tetragonal or hexagonal in shape, arranged in 14 to 26 longitudinal rows in upper jaw; occurs in the Tocantins and Araguaia River drainages in Brazil ……………………… ………………………………………………………………………………………………… Potamotrygon henlei 124 A. Barbarino 4b. Ocelli of dorsal disc surface distributed irregularly or exceptionally in circular pattern; ocelli circular or irregular, occasionally with black centers; teeth relatively small, tetragonal in shape, arranged in 23-24 longitudinal rows in upper jaw; occurs in Xingu and Iriri River drainages in Brazil …………………………………………………………… Potamotrygon leopoldi 5a. Dorsal disc surface usually with dark reticulated pattern of polygonal shapes over brown background ………………………………………………………………………………………………...6 5b. Dorsal disc surface without conspicuous reticulated pattern ………………………………… 7 6a. Reticulated pattern formed by dark brown lines, continuous or interrupted, that outline usually hexagonal shapes over a light brown background; tail with dark lateral bands and usually with just one row of dorsal spines; labial furrows well developed and evident; species widely distributed in northern South America (Colombia, Venezuela, Brazil, Peru and the Guianas) in the Orinoco, Amazonas and Parnaíba River basins ……………………… ……………………………………………………………………………………………... Potamotrygon orbignyi 6b. Reticulate pattern formed by continuous or interrupted faint brown lines that outline hexagonal or circular shapes over a light brown background; dorsal disc surface very rough at all body sizes, with sharp, well-developed denticles that sometimes form marginal tubercles; tail with dorsal and lateral spines very well developed; labial furrows absent; species occurs in middle and lower Amazon River Basin, from Río Negro to Para River (Brazil) …… ……………………………………………………………………………………………Potamotrygon humerosa 7a. Dorsal disc surface with color pattern formed by circular, oval or kidney-shaped spots, white, yellow or orange in color, over a brown, grey or purplish-black background .……… 8 7b. Dorsal disc surface color pattern not as above in 7a ………………………………………………14 8a. Spots on dorsal disc surface smaller than horizontal eye diameter …………………………9 8b. Spots on dorsal disc surface larger than horizontal eye diameter …… ……………………12 9a. Tail short, with spine near base, distance from posterior margin of cloaca to spine insertion less than half disc width; spots on dorsal disc surface irregularly shaped, yellow or brown and concentrated to form irregular rosettes (approximately oval) over a dark brown background;rosettes smaller near disc margins and extending onto dorsal surface of tail, where they are separated by saddle shaped black marks; occurs in Oyapock and Maroni rivers in French Guiana and possibly in the Negro and Meta rivers of Brazil and Colombia ..... ..........………………………………………………………………………………………Potamotrygon marinae 9b. Tail relatively long, with the serrated spine placed distally, distance from posterior margin of cloaca to spine insertion greater than half disc width ………………………………10 10a. Spots of dorsal disc surface irregular or kidney-shaped, light brown or yellow and usually united within a vermiculated pattern; some yellow spots more intense and circular, 125 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA CLAVES outlined by dark pigment, usually distributed more in intermediateand marginal regions; spines in a single median row on dorsal surface of spine; occurs in the Madre de Díos River Drainage in Peru …..…………………………………………………………………Potamotrygon tatianae 10b. Spots of dorsal disc surface circular or oval, usually not forming a vermiculated pattern ………………………………………………………………………...........…………………………………………11 11a. Spots of dorsal disc surface circular, white or light yellow, distributed widely on disc or occasionally concentrated in circular rosettes over a darker background or sometimes forming irregular shapes separated by dark reticulation; occurs in main channel of the Amazon and Orinoco River and in the lower portion of major tributaries ………………..… ………… ……………………………………………………………………………………………..… Potamotrygon scobina 11b. Spots of dorsal disc surface circular or oval, yellow or light brown over dark brown background, usually widely distributed on disc but occasionally concentrated to form vermiculated pattern, or very faint and faded in darker individuals; occurs in the Atrato and Magdalena-Cauca River Basins in Colombia ………………………….............................................. .................................................................................................………….. Potamotrygon magdalenae 12a. Distal portion of tail without alternating dark and light bars; tail relatively short, usually less than disc width; median spines on dorsal surface of tail arranged in one to three irregular rows; spots on dorsal disc surface irregular or oval, yellow over brown background, larger than horizontal eye diameter and occasionally united to form vermiculated pattern; species originally described from the Paraná River Basin, also present in upper Amazon River in Peru, and the Madeira River drainage in Brazil and Bolivia ……………… ………………………………………………………………………….…………………… Potamotrygon falkneri 12b. Distal portion of tail with five or six dark bars alternating with lighter spaces ………13 13a. Spots of dorsal disc surface circular, oval or kidney-shaped, yellow or orange, forming irregular vermiculated pattern over light or dark brown background; occurs in upper reaches of Amazon River Basin in Peru ……………………………………………… Potamotrygon tigrina 13b. Spots of dorsal disc surface long and kidney-shaped, beige, yellow or orange, united to form pattern of irregular brain-shaped rosettes over brown, dark grey or purplish-black background; occurs in the Negro, Meta and Orinoco River systems in Brazil, Colombia and Venezuela …………………………………………………………………….……… Potamotrygon schroederi 14a. Black spots of dorsal disc surface irregular (circular or oval) and variable in size, usually not regularly distributed over disc, background color light brown to dark grayish-brown; spots sometimes united to form vermiculated pattern; occasionally with irregularly distributed circular white or yellow spots; restricted to Lake Maracaibo Basin in Venezuela and Colombia ……………………………………………………………………................… Potamotrygon yepezi 14b.Dorsal disc surface with color pattern not as described above in 14a …………………… 15 126 A. Barbarino 15a.Dorsal disc surface olivaceous-brown or dark grey with small white or yellow spots forming rosettes or ocelli near disc margins; occasionally with reticulate pattern of dark pigment; dorsal disc surface with well-developed tubercles; tubercles on disc concentrated near margins, scapular region and posterior mid-dorsal line; occurs in Amazon Basin in Peru, Ecuador, Colombia and Brasil …………………………………………Potamotrygon constellata 15b. Dorsal disc surface light brown with almost triangular figures outlined by dark pigment forming an open reticulated pattern; labial furrows absent; occurs in Amazon Basin including the Araguaia River drainage, Marajó Island and the Amapá coast in Brazil .……… …………………………………………………………………………………………….. Potamotrygon dumerilii Potamotrygon orbignyi, río Orinoco. Foto: M. A. Morales-Betancourt 127 5. Catálogo de especies Heliotrygon gomesi Potamotrygon leopoldi Heliotrygon rosai Potamotrygon magdalenae Paratrygon aiereba Potamotrygon marinae Plesiotrygon iwamae Potamotrygon motoro Plesiotrygon nana Potamotrygon orbignyi Potamotrygon boesemani Potamotrygon schroederi Potamotrygon constellata Potamotrygon scobina Potamotrygon dumerilii Potamotrygon tatianae Potamotrygon falkneri Potamotrygon tigrina Potamotrygon henlei Potamotrygon yepezi Potamotrygon humerosa Canal entre el lago el Correo y Tarapoto, en la Amazonia colombiana. Foto: F. Trujillo Heliotrygon gomesi FAMILIA POTAMOTRYGONIDAE Heliotrygon gomesi Carvalho y Lovejoy 2011 Nombre común y/o indígena Arraia (Brasil); raya china (mercado acuarófilo), raya (Colombia). Estatus de conservación espiráculos (Figura 1a), estos últimos sin procesos espiraculares en los márgenes posteriores. Coloración dorsal ceniza, beige o marrón claro uniforme, con manchas ligeramente vermiculadas. Categoría global IUCN: no evaluada. Caracteres distintivos Disco completamente circular, sin concavidad media en el margen anterior. Cola sin espinas o con una espina caudal aserrada muy reducida, mucho menor que el tamaño del espiráculo. Narinas circulares, hocico alargado (distancia pre-orbital cerca de 1/3 del ancho del disco). Ojos bien reducidos y mucho más pequeños que los Talla y peso En la Amazonia brasileña los ejemplares adultos alcanzan en promedio 400 mm AD y una longitud total de 360 a 840 mm (Tabla 1). No hay datos para el peso. En Colombia, los dos ejemplares examinados Tabla 1. Datos y relaciones morfométricas para juveniles (n=2) y adultos (n=10) de Heliotrygon gomesi de la Amazonia brasileña. Ancho del disco (AD), longitud del disco (LD). Estadio de desarrollo (proporción de sexos) Intervalo (mm) Promedio (mm) % AD AD LD AD LD AD LD Juveniles (2 H) 224 - 290 230 - 290 246,5 260 100 105,2 Adultos (5 H : 5 M) 305 - 578 320 - 624 398,7 417,6 100 104,5 Carvalho et al. 131 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE a. b. Figura 1. Heliotrygon gomesi. a) Detalle de la cabeza de una hembra de 445 mm AD; b) vista ventral, lago El Correo, Puerto Nariño, Colombia. Foto: A. Acosta-Santos. a. b. Figura 2. Heliotrygon gomesi. a) Macho de 530 mm AD y b) hembra de 597 mm AD capturados en el río Amazonas, Colombia. Fotos: A. Acosta-Santos. fueron dos hembras inmaduras de 445 y 597 mm AD (463 mm LD- 562 mm LD), con un peso de 3 y 6,2 kg, respectivamente (Figura 2). Distribución geográfica Países: Brasil, Colombia (primer registro), Perú y probablemente Ecuador. Cuenca: Amazonas. 132 Subcuencas: parte alta del río Amazonas incluyendo afluentes, probablemente se encuentra también en las secciones bajas de los principales tributarios del Amazonas, así como como en la parte más baja de este río. Su distribución es similar a la de Plesiotrygon iwamae (Carvalho y Lovejoy 2011). En Colombia sólo es conocida del río Amazonas (lago El Correo) en la localidad de Puerto Nariño (Lasso y AcostaSantos datos no publicados). Heliotrygon gomesi Heliotrygon gomesi FAMILIA POTAMOTRYGONIDAE Registros de Heliotrygon gomesi. Hábitat Fondo del cauce principal de los grandes ríos amazónicos de aguas blancas, también presente en grandes lagos de aguas negras (Amazonia colombiana). Reproducción Prácticamente sin información. Las hembras con 578 mm AD son consideradas adultas. Un macho procedente del río Nanay (Perú) de 400 mm AD tenía una longitud del clasper de 62 mm. Las dos hembras procedentes de la Amazonia colombiana (445 y 597 mm AD), eran inmaduras. Uso Ornamental. Amenazas Salvo la pesca incidental, no se conoce ninguna. Referencia de identificación Carvalho y Lovejoy (2011). Autores Marcelo R. de Carvalho, Thiago Loboda, João Paulo C. B. da Silva, João Pedro Fontenelle (Brasil), Carlos A. Lasso, Astrid Acosta-Santos y Edwin Agudelo-Córdoba (Colombia). Carvalho et al. 133 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Heliotrygon rosai Carvalho y Lovejoy 2011 Nombre común y/o indígena Raya “coly” (mercado acuarófilo); arraia (Brasil). Estatus de conservación posteriormente. Narinas circulares; hocico alargado (distancia preorbital cerca de 1/3 del ancho del disco). Ojos reducidos, no destacados y mucho menores que los espiráculos; estos últimos sin procesos espiraculares en los márgenes posteriores. Coloración dorsal compuesta de numerosas manchas vermiculares variando de blanco a crema sobre un fondo de color marrón claro o ceniza. Categoría global IUCN: no evaluada. Caracteres distintivos Disco circular, con mayor amplitud justo en la parte anterior de la cintura pectoral, sin concavidad media en el margen anterior. Cola corta, su base con una espina aserrada reducida, con una longitud más o menos equivalente al tamaño del espiráculo y sin sierras prominentes curvadas Tabla 2. Datos y relaciones morfométricas para juveniles (n=4) y adultos (n=2) de Heliotrygon rosai de la Amazonia brasileña. Ancho del disco (AD), longitud del disco (LD). Estadio de desarrollo (proporción de sexos) 134 Intervalo (mm) Promedio (mm) % AD AD LD AD LD AD LD Juveniles (2 H : 2 M) 206 - 309 215 - 315 243 255,3 100 105,3 Adultos (1 H : 1 M) 483 - 577 500 - 604 530 552 100 104,1 Heliotrygon rosai Heliotrygon rosai FAMILIA POTAMOTRYGONIDAE Talla y peso En la Amazonia brasileña, ejemplares adultos de Heliotrygon rosai alcanzan máximo 577 mm AD y un largo del disco de 604 mm (Tabla 2). No hay datos de peso. Distribución geográfica Países: Brasil y Perú. Cuencas: Amazonas. Subcuencas: parte alta, media y baja de la cuenca del río Amazonas y probablemente también en las partes más bajas de sus principales tributarios. Ha sido registrada para los ríos Purús, Nanay y la isla de Marajó. Su distribución es muy parecida a la de Plesiotrygon iwamae (Carvalho y Lovejoy 2011). Hábitat Fondo del cauce principal de los grandes ríos amazónicos de aguas blancas. Reproducción Individuos machos de la Amazonia brasileña de 247 mm AD (20 mm longitud clasper) son considerados juveniles; con 483 mm AD (60 mm longitud clasper) son preadultos y con 587 mm AD (87 mm longitud clasper), ya han alcanzado la madurez sexual. Movimientos y comportamiento Sin información, probablemente realicen desplazamientos entre el cauce principal del río y la planicie de inundación (grandes lagos). Registros de Heliotrygon rosai. Carvalho et al. 135 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Uso Ornamental. Aspectos pesqueros Especie descrita recientemente, conocida como “coly” en la auariofilia. Probablemente confundida en la estadísticas con Paratrygon aiereba (Lasso obs. pers.). Amenazas Ninguna conocida, salvo la pesca incidental. Referencia de identificación Carvalho y Lovejoy (2011). Autores Marcelo R. de Carvalho, João Paulo C. B. da Silva, Thiago Loboda, João Pedro Fontenelle, Ricardo Rosa y Carlos A. Lasso. 136 Heliotrygon rosai Paratrygon aiereba FAMILIA POTAMOTRYGONIDAE Paratrygon aiereba (Müller y Henle 1841) Orinoco Nombre común y/o indígena Raya manta, raya ceja, raya manzana (Colombia, Venezuela); arraia-maçã, manzana (Amazonia brasileña); aramaçá o aramassu (río Xingú, Brasil). Sinonimias Trygon strogylopterus Schomburgk 1843, Disceus thayeri Garman 1913. Estatus de conservación Categoría global IUCN: Datos Insuficientes (Góes de Araújo y Rincón 2009); categoría nacional: Vulnerable VU (A2ad) (Colombia) (Mojica et al. 2012). Caracteres distintivos Cuerpo discoidal y aplanado (longitud del disco contenido 1 a 1,2 veces en el ancho del disco); en forma de manzana cortada por la mitad (de ahí su nombre en acuariofilia), no Lasso et al. Amazonas tan circular como en Potamotrygon, con una concavidad anterior en su margen y sin un botón rostral. Aletas pélvicas cubiertas dorsalmente por el disco. Dorso del disco con dentículos dérmicos, más grandes y fuertes hacia los bordes anterior y posterior. En el Amazonas el número de las filas de espinas en la cola varían en función de la población, aunque por lo general hay de una a tres. Ojos pequeños y pedunculados; presenta una protuberancia carnosa en el margen externo de los espiráculos, principal diferencia con Heliotrygon. Distancia de la boca al margen anterior del disco relativamente larga, contenida 2,6 a 3,3 veces en el ancho del disco. Boca amplia, sin papilas, con 15/15 a 35/33 filas longitudinales de dientes grandes. Cola corta, filiforme (su longitud contenida 1,1 a 1,9 veces el AD), sin pliegues dorsales ni ventrales, más larga en ejemplares juveniles. 137 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Evidencias morfológicas, anatómicas y osteológicas muestran que hay al menos, dos especies dentro del género Paratrygon, una descrita para la cuenca amazónica (P. aiereba) y otra nueva para la ciencia distribuida en la cuenca del Orinoco (Lasso y Loboda, obs. pers.). Esta aseveración es reforzada y soportada por los análisis de genética molecular mostrados en este mismo libro (ver Capítulo 6.1). Subcuencas: Referencia de identificación Talla y peso Rosa (1985) y Lasso y Sánchez-Duarte (2012a). Distribución geográfica Países: Brasil, Bolivia, Colombia, Ecuador, Perú y Venezuela. Cuencas: Amazonas (Brasil, Bolivia, Colombia, Ecuador y Perú); Orinoco (Colombia y Venezuela). Amazonas (Araguaia, Branco, cauce principal del Amazonas incluyendo el delta, Marañón, Napo, Putumayo, Rio Negro o Guainía, Solimoes, Tapajós, Xingú, Yanayacu); Orinoco (Apure, Arauca, Bita, Capanaparo, Caroní, cauce principal incluyendo el delta, Caura, Cinaruco, Inírida, Meta, Tomo, Ventuari). CUENCA DEL ORINOCO Colombia. Se examinaron 11 individuos (8 H : 3 M), provenientes de los ríos Bita, Tomo y Orinoco (Puerto Carreño), incluyendo un neonato, cuatro juveniles y seis adultos, según la talla de madurez establecida para esta cuenca por Lasso et al. (1996) (hembras 37 cm AD y machos 45 cm AD) (Tabla 3). Para las hembras el mayor AD registrado fue 80 cm con un peso Registros de Paratrygon aiereba. 138 Paratrygon aiereba Paratrygon aiereba FAMILIA POTAMOTRYGONIDAE Tabla 3. Datos y relaciones morfométricas para neonatos (n=1), juveniles (n=4), y adultos (n=6), de Paratrygon aiereba de la cuenca del río Orinoco, Colombia. Ancho del disco (AD) , longitud del disco (LD). Estadio de desarrollo (proporción de sexos) Intervalo (mm) Promedio (mm) % AD AD LD AD LD AD LD Neonatos (1 H) 160 160,5 160 160,5 100 100,3 Juveniles (1 H : 3 M) 270 - 380 250 - 420 317,5 322,5 102,4 101,6 Adultos (6 H) 370 - 800 320 - 950 558,3 613,3 110,6 109,9 se registró un máximo de 157 cm AD con un peso de 88 kg, aunque una hembra más pequeña (125 cm AD) alcanzó un peso mayor, 113,5 kg, record máximo de la especie. Para los machos se observó algo parecido, se registró un ancho de disco máximo de 114 cm, correspondiente a un peso de 20 kg, aunque dos machos adultos de menor talla (94 cm y 77 cm AD), presentaron un peso superior (24 kg c/u). de 28 kg y para los machos el mayor AD registrado fue 27 cm con un peso de 6 kg, correspondiente a un juvenil. Venezuela. Lasso et al. (1996) examinaron 38 individuos (18 H : 20 M) provenientes de los Llanos de Apure (caño Guaritico, afluente del río Apure). Para las hembras se registró un intervalo de AD entre 19,6 – 78 cm, con un peso máximo de 25 kg. Para los machos el intervalo de AD estuvo entre 12,5 – 65 cm un peso máximo de 14 kg (Tabla 4). Posteriormente, Barbarino y Lasso (2005) examinaron 73 individuos (48 H : 25 M) provenientes de las pesquerías comerciales del río Apure. Para las hembras La información más reciente para la cuenca del río Apure (2009-2012) corresponde a 36 individuos (23 H : 13 M), capturados para consumo con arpón y espinel. Para los machos se registró un AD máximo de Tabla 4. Datos y relaciones morfométricas para neonatos (n=9), juveniles (n=13) y adultos (n=6) de Paratrygon aiereba de la cuenca del río Orinoco, Venezuela. Ancho del disco (AD), longitud del disco (LD). Tomado de Lasso et al. (1996). Estadio de desarrollo (proporción de sexos) Intervalo (mm) Promedio (mm) % AD AD LD AD LD AD LD Neonatos (5 H : 4 M) 125 - 239 160 - 269 207,7 236,7 100 114 Juveniles (7 H : 6 M) 250 - 369 276 - 416 304,2 340,5 100 111,9 Adultos (1 H : 5 M) 380 - 530 416 - 529 451 459 100 103,9 Lasso et al. 139 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE 80 cm, correspondiente a un peso de 20 kg y para las hembras el mayor AD registrado fue 132 cm con un peso de 104 kg (Figuras 3 a y b). Las hembras alcanzan entonces un ancho discal mayor al de los machos. En las figuras 4 (a- f) y 5 (a-f), se muestran diferentes patrones de coloración en la Orinoquia. Hábitat Colombia. Habita el cauce principal de los grandes ríos y caños en todo tipo de aguas (blancas, claras y negras) (Lasso y Sánchez-Duarte 2012a). No entra en la planicie inundable. Venezuela. Es común en aguas blancas y claras, más rara en aguas negras. En el río Apure - principal afluente del río Orinoco en la región llanera - durante el periodo de aguas altas, se captura principalmente en los fondos arenosos de las playas y en las zonas donde las aguas del río generan una corriente inversa, áreas conocidas localmente como “poyatas”. Esos espacios, según los pescadores, son lugares de alimentación y refugio para la especie. Durante la temporada del descenso de a. b. Figura 3. Relación talla (ancho discal)-peso de Paratrygon aiereba para a) machos (n=13) y b) hembras (n=23), cuenca del río Apure, Orinoquia (Venezuela). 140 Paratrygon aiereba Paratrygon aiereba FAMILIA POTAMOTRYGONIDAE a. b. c. d. e. f. Figura 4. Paratrygon aiereba. a) Hembra en el río Orinoco (Reserva Bojonawi), Colombia; b) hembra vista dorsal; c) vista ventral, río Bita, Orinoquia colombiana; d) río Apure, Venezuela; e) individuo de unos 25 cm (AD), caño Samuruco, Cravo Norte, Arauca, Colombia; f) delta del Orinoco. Fotos: C. A. Lasso (a, d), M. A. Morales-Betancourt (b, c), F. Mijares (e), O. M. Lasso-Alcalá (f). Lasso et al. 141 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE b. a. c. d. e. f. Figura 5. Paratrygon aiereba, Venezuela. a) Río Orinoco, edo. Amazonas; b) río Cinaruco; c) río Capanaparo; d) caño Guaritico, afluente del río Apure; e) macho adulto, caño Guaritico; f) macho inmaduro, río Caura, Guayana venezolana. Fotos: N. Lujan (a), C. Montaña (b), A. Barbarino (c), C. A. Lasso (d-f). 142 Paratrygon aiereba Paratrygon aiereba FAMILIA POTAMOTRYGONIDAE las aguas es frecuente observarlas en las bocas de los caños, lugares ideales para la alimentación, ya que numerosas especies de peces pequeños están migrando hacia aguas más profundas. La especie se captura con mayor frecuencia entre 30 y 180 cm de profundidad (Barbarino y Lasso 2009). Puede haber una segregación de tallas de acuerdo al tamaño del río, los individuos más grandes están en los ríos de mayor tamaño y los más pequeños en los afluentes. Alimentación Carnívora: ictiófaga-carcinófaga. Colombia. N = 11 (0). Los 11 ejemplares examinados presentaron los estómagos vacíos. Venezuela. N = 32 (31). Es una especie ictiófaga-carcinófaga (Lasso et al. 1996). Los peces representaron el 79% y 85% de la dieta (machos y hembras, respectivamente) y los camarones 28,6% y 53,8% (machos y hembras, respectivamente). Los machos consumieron una mayor diversidad de ítems alimenticios (nueve) que las hembras (cinco). Los peces incluidos en la dieta fueron Aphyocharax alburnus, Prochilodus mariae, Pimelodus blochii y Loricariichthys maculatus. Un macho de 76 cm AD ingirió un coporo (Prochilodus mariae) de 32,5 cm LT. Los camarones correspondieron a Macrobrachium amazonicum y Macrobrachium yelskii. En el estudio de Barbarino y Lasso (2005), que incluyó rayas de mayor tamaño en comparación con el trabajo anterior (Lasso et al. 1996), sólo el 20% de las rayas colectadas presentó algún contenido estomacal y no se observaron diferencias entre hembras y machos. Todos los contenidos examinados correspondieron exclusivamente a peces y se identificaron ocho especies de seis familias (Apteronotidae, Characidae, Lasso et al. Curimatidae, Doradidae, Pimelodidae y Prochilodontidae). Reproducción Colombia. Una hembra adulta (68 mm AD) observada en la confluencia del río Bita con el Orinoco, en la época seca (marzo 2009), abortó un embrión hembra de 16 cm AD y 16,5 cm LD, con 90 g (MuñozOsorio y Mejía-Falla 2013). Recientemente (diciembre 2013), una hembra de 77 cm AD y 26 kg, proveniente del río Orinoco, abortó dos embriones (macho 19 cm AD y hembra 18 cm AD) (Figura 6 a y b). Venezuela. En el estudio realizado por Lasso et al. (1996) en un afluente del río Apure, durante la época de aguas bajas y altas, se observó que los machos alcanzaban la madurez sexual a partir de los 44,7 cm AD y las hembras con 37 cm AD. Hembras mayores a 61 cm AD estaban completamente maduras y mostraban actividad reproductiva. Respecto a la fecundidad, se observó una hembra de 76 cm AD que tenía un feto macho de 12,5 cm AD y dos huevos uterinos de diferente diámetro. Otra hembra de 62 cm AD abortó dos fetos (macho y hembra) de 19,6 y 19,7 cm AD, respectivamente. En el estudio realizado en el río Apure durante la época de lluvias y aguas altas (junio – agosto), Barbarino y Lasso (2005), examinaron 73 individuos de los cuales la proporción de hembras vs. machos favoreció a las primeras en una proporción casi de 2 : 1. Todas las hembras capturadas estaban por encima de la talla de madurez sexual establecida para la especie en este río (37 cm AD). De la misma forma, para los machos todos los ejemplares capturados, salvo uno (40 cm AD), estaban por encima de la talla mínima estimada de madurez sexual (45 cm AD) (Lasso et al. 143 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE 1996). La talla mínima en la cual se registraron indicios de madurez sexual fue en una hembra de 51 cm AD capturada en el mes de julio (aguas altas), que tenía un embrión poco desarrollado. El intervalo de tallas en los que se observaron signos de madurez sexual fue 51 a 134 cm AD. Los embriones con el estadio de desarrollo más avanzado se observaron en cuatro hembras de 80 a 122 cm AD y en tres de ellas los neonatos fueron abortados in situ al momento de su captura. También se observaron embriones en estadios menos avanzados en cinco hembras de 97 a 134 cm AD, que también fueron abortados. La fecundidad (número de embriones intrauterinos) varió de 1 en una hembra de 51 cm AD, a 8 embriones en otra hembra de 97 cm AD. De las 14 hembras gestantes, siete (51 – 134 cm AD) tenían un sólo embrión; una (80 cm AD) 4 embriones; dos (81 -86 cm AD) 5 embriones; una (108 cm AD) 6 embriones; una (120 cm AD) 7 embriones y por último, la hembra de 97 cm AD con la mayor fecundidad (8 embriones) (Barbarino y Lasso 2005). En la figura 6 c y d, se muestra un embrion y dos neonatos. Uso Ornamental (Brasil, Colombia y Perú), alimenticio (Venezuela) y medicinal (aceite del hígado para tratar afecciones respiratorias como gripa y asma) en toda la Orinoquia (Colombia-Venezuela). Aspectos pesqueros Colombia Método de captura. Manualmente para fines ornamentales. Incidentalmente con anzuelo, calandrio y redes de enmalle. Comercialización y exportación. Durante los últimos cinco años se exportaron 144 216 ejemplares, distribuidos así: 2007 (3 ind.), 2008 (8 ind.), 2009 (149 ind.), 2010 (15 ind.) y 2011 (41 ind.) (Incoder 2012) (Figura 7). Hay datos de movilización de individuos desde Inírida para los años 2011 (466 ind.) y 2012 (1.494 ind.). La información de Puerto Carreño no fue suministrada. Durante el periodo antes mencionado (5 años), Colombia exportó Paratrygon aiereba a seis países: China, Hong Kong, Japón, México, Rusia y Tailandia. La mayor exportación se produjo en el 2009 hacia Tailandia con 120 ejemplares (Figura 8). Los acopiadores de Puerto Carreño, compran a los pescadores los individuos en $20.000 y los venden a los exportadores a $65.000 (valores promedio para 2009) (Mejía-Falla et al. 2010). El precio de venta en el mercado internacional para el 2012 fue de USD 127,5 (precio promedio basado en la oferta de redes electrónicas del mundo, el cual varía según ancho/longitud del disco y patrón de coloración del ejemplar). Venezuela. Desde 1996 existe una pesquería artesanal con fines de consumo en el río Apure. Se realiza entre junio y agosto (aguas altas), época en que las capturas de las especies tradicionales y de mayor valor económico (como bagres y coporos), son más escasos (Barbarino y Lasso 2005, 2009). Método de captura. Para el 2005, Barbarino y Lasso reportaban que en el 82% de los casos los ejemplares eran capturados con arpón, seguido por la “rama”, que es un anzuelo con carnada (15%) y finalmente con chinchorro playero (3%) (Figura 9). A partir del 2009 se ha incorporado la pesca con espinel (cuerda o línea de po- Paratrygon aiereba Paratrygon aiereba FAMILIA POTAMOTRYGONIDAE a. b. c. d. Figura 6. Paratrygon aiereba. a) hembra adulta 77 cm AD; b) embrión hembra 18 cm AD mostrando el saco vitelino, río Orinoco, Colombia; c) embrion hembra de 230 mm AD, río Apure, Venezuela; d) neonatos, caño Guaritico afluente del río Apure. Fotos: M. A. MoralesBetancourt (a, b) y C. A. Lasso (c, d). Lasso et al. 145 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Figura 7. Ejemplares de Paratrygon aiereba exportados desde Colombia. Periodo 20072011. Fuente: Incoder (2012). Figura 8. Principales países del mundo que importaron ejemplares de Paratrygon aiereba. Periodo 2007 – 2011. Fuente: Incoder (2012). lipropileno que varía de 50 a 80 metros de largo, donde cada 1,8 m se hacen un par de nudos y de allí se cuelga otra línea de 0,6 m de largo amarrando en su otro extremo un anzuelo N0 1 o 2). Para las faenas de pesca, al caer la noche (19:00 horas) se amarra un extremo del espinel en la orilla del río, extendiéndolo sobre sitios de fondos arenosos (desembocadu- 146 ra de pequeños cuerpos de aguas al río o caños) y el otro extremo se deja caer al río con un lastre. Como carnada se utilizan peces de la familia Loricariidae (Pterygoplichthys spp e Hypostomus spp). La relinga se recoge a las 5:00 horas. El cambio en el uso de arte de pesca, de arpón a espinel, se debe a que con el primero se debían recorrer grandes distancias, lo que implica Paratrygon aiereba Paratrygon aiereba FAMILIA POTAMOTRYGONIDAE a. b. c. d. Figura 9. Pesca de Paratrygon aiereba, río Apure, Venezuela. a) Arponero; b) captura en Arichuna; c) presentación para la venta; d) pesca con espinel. Fotos: A. Barbarino. uso de motor y mayor gasto de combustible, requiere un mayor esfuerzo físico y las capturas eras menores. tados con arpón y el 52,8% (19 ind.), que pesaron 675 kg, fueron capturados con espinel (Figura 11). Desembarques. En la figura 10 se presenta la captura de la especie, mediante el uso exclusivo del arpón durante seis años. En total se extrajeron 2.525 kg, por parte de 65 arponeros en casi 100 horas de pesca, con una CPUE promedio de 5,6 kg/arponero/hora (Barbarino y Lasso 2005). En total durante dicho periodo se capturaron unos 75 individuos (Figura 10). Comercialización y exportación. La comercialización es a nivel local. Las capturas totales para el periodo 1996 – 2002 fueron del orden de las 2,7 toneladas. Para la comercialización de la raya se desechan varias partes del cuerpo. En primer lugar el pescador corta de 2 a 5 cm del borde externo de las aletas pectorales, luego hace un corte dorsal que va desde la cola e incluye la cavidad abdominal y la cabeza. Por último se quita la piel únicamente en la parte dorsal del cuerpo, quedando los trozos listos para la comercialización. La carne que se aprovecha de cada ejemplar Adicionalmente, se cuenta con el registro de 36 ejemplares capturados entre agosto 2009 a agosto de 2012. De estos, el 47,2% (17 ind.), que pesaron 599 kg fueron colec- Lasso et al. 147 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE a. b. Figura 10. Evolución de la captura de Paratrygon aiereba, a) en número de individuos y b) en kilogramos. Periodo 1996 a 2002. Fuente: Barbarino y Lasso (2005). Figura 11. Volumen de captura (kg) de Paratrygon aiereba en el río Apure. Los datos de 2009 y 2010 corresponden a pescas realizadas con arpón y los de 2012 a pescas con espinel. No se cuenta con datos de 2011. Fuente: Barbarino y Lasso (2009, datos no publicados). 148 Paratrygon aiereba Paratrygon aiereba FAMILIA POTAMOTRYGONIDAE se encuentra entre el 57,2 al 70,3% del peso total (en promedio el 63%) y se consume sólo de forma fresca (Figura 12). El aceite extraído del hígado también se comercializa y se utiliza como remedio local para afecciones respiratorias (Barbarino y Lasso 2005). Amenazas Es un recurso ornamental de importancia creciente. La mayor amenaza en la Orinoquia es la extracción desmedida de individuos inmaduros (juveniles). Censos realizados en la Estrella Fluvial Inírida (ríos Inírida, Guaviare, Atabapo y Orinoco) (fe- brero-mayo 2011) no indican la presencia de esta especie en la región, lo cual es otro factor de preocupación. Entran a Colombia de manera ilegal vía la frontera colombovenezolana por la región de Inírida (Lasso y Sánchez-Duarte 2012a). En el río Arauca del lado colombiano, la pesca incidental causa gran daño a las poblaciones de esta especie, ya que todos los individuos que caen en artes de pesca con anzuelo (como calandrio o espinel) son sacrificadas para recuperar los anzuelos y su carne no es aprovechada (Mijares com. pers.) (Figura 13). a. b. c. d. Figura 12. Comercialización de Paratrygon aiereba en Venezuela. a) pesaje y b) corte de las aletas pectorales en el río Apure; c) presentación de la carne para la venta en el mercado de San Fernando de Apure y d) venta de aceite de hígado. Fotos: A. Barbarino. Lasso et al. 149 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE a. b. Figura 13. a) Captura accidental de raya manta y b) sacrifício del animal para extraer el anzuelo, río Cravo Norte, Arauca. Foto: F. Mijares. Conservación Oportunidades de conservación. En el Plan de Acción Nacional para la conservación y manejo de tiburones, rayas y quimeras de Colombia PAN tiburonesrayas (Caldas et al. 2010), la especie quedó establecida con un grado de prioridad de acción alto, en relación con la pesca, comercio y distribución de la misma. Medidas de conservación propuestas. En Colombia se considera necesario fortalecer el sistema de registro y seguimiento de las capturas (consumo y ornamentales) y exportaciones de rayas dulceacuícolas, que genere estadísticas confiables (Caldas et al. 2010). Regulación de la exportación mediante asignación de cuotas basadas en criterios científicos de abundancia en su medio natural. Definición de áreas prioritarias para su conservación (p. e. reservas de pesca) a través de planes de manejo conjunto con pescadores, acopiadores y exportadores. Promover la reproducción en cautiverio. Prohibir la exportación de individuos adultos como posibles parentales. Regulación conjunta de vedas y tallas con países limítrofes (Brasil, Perú, Ecuador y Venezuela). Realizar trabajos taxonómicos tradicionales (morfológicos) y avanzados (sistemática molecular), así como muestreos en campo (Lasso y Sánchez-Duarte 2012a). Autores Carlos A. Lasso, Paula Sánchez-Duarte, Aniello Barbarino, Mónica A. Morales-Betancourt, Lina Ortiz-Arroyave y Oscar M. Lasso-Alcalá. 150 Paratrygon aiereba Paratrygon aiereba FAMILIA POTAMOTRYGONIDAE CUENCA DEL AMAZONAS Talla y peso Se examinaron 40 individuos (23 H : 17 M), 28 provenientes del Amazonas colombiano (18 H : 10 M), cuatro del Amazonas ecuatoriano (3 H : 1 M) y ocho del Amazonas peruano (2 H : 6 M). De estos, 12 fueron neonatos, 16 juveniles y 12 adultos (Tabla 5). Para los machos se registró un ancho de disco máximo (AD) de 76 cm, correspondiente a un peso de 42 kg (Colombia) (Figura 14a). Para las hembras se registró un máximo de 85 cm AD con un peso de 23,6 kg, sin embargo una hembra más pequeña (71,5 cm AD) alcanzó un peso mayor (38 kg) (Colombia) (Figura 14b, Tabla 6). Brasil. Góes de Araújo y Rincón (2009) mencionan que la especie alcanza una talla máxima de 130 cm AD con un peso de 60 kg. En el Río Negro, Goés de Araújo (2011) examinó 227 individuos (119 H : 108 M). Para las hembras se registró un intervalo de AD entre 15,3 – 93 cm, con un peso máximo de 38 kg. Para los machos el intervalo de AD estuvo entre 16,4 – 67 cm con un peso máximo de 16 kg. Loboda (obs. pers.) señala que alcanza fácilmente los 100 cm de ancho de disco (AD), por encima de 30 kg. Un ejemplar capturado en el río Xingú pesó 35 kg. De 11 ejemplares adultos examinados en la cuenca amazónica se observó un AD promedio de 60 cm y 66 cm LD (Tabla 6). Ecuador. Se reporta una talla máxima de 90 cm AD, una talla promedio para machos de 30 cm AD y un peso promedio de 17,4 kg. Para hembras, 48 cm AD con un peso de 21,5 kg (Barriga obs. pers.). Hábitat Brasil. Frecuente tanto en ríos de aguas blancas, como negras y claras. Se encuentra en aguas poco profundas con una temperatura cercana a los 25 ºC, valores de pH entre 4,5 a 6,6; conductividad (μS/cm) entre 14,4 a 44,8 y sólidos totales disueltos (mg/l) entre 7,1 a 23,9. Es menos tolerante a la salinidad que otras especies de rayas como Potamotrygon scobina y Potamotrygon orbignyi (Duncan y Fernandes 2010). Habita playas arenosas del cauce principal del río y en márgenes de islas con playa arenosa (10%), cauce principal del río (15%), bancos de arena (3%) y playas (70%) (Goés de Araújo 2011). Colombia. Todo tipo de aguas (blancas, claras, rara en aguas negras). Los adultos suelen estar en la parte más profunda del Tabla 5. Datos y relaciones morfométricas para neonatos (n=12), juveniles (n=16) y adultos (n=12), de Paratrygon aiereba de la cuenca del río Amazonas (Colombia, Ecuador y Perú). Ancho del disco (AD), longitud del disco (LD). Estadio de desarrollo (proporción de sexos) Neonatos (7 H : 5 M) Juveniles (6 H : 10 M) Adultos (10 H : 2 M) Sánchez-D. et al. Intervalo (mm) Promedio (mm) AD LD AD LD 170 - 220 170 - 244 196,1 223,7 269 - 711,1 308 - 815 472,6 507,6 460 - 850 540 - 768 653,9 684 % AD AD LD 100,5 114,1 108 107,4 104,5 104,6 151 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE a. b. Figura 14. Relación talla (ancho discal)-peso de Paratrygon aiereba; a) machos (n=16); b) hembras (n=22). Cuenca del río Amazonas: Colombia, Ecuador y Perú. Tabla 6. Datos y relaciones morfométricas para adultos (n=11) de Paratrygon aiereba de la cuenca del río Amazonas (Brasil). Ancho del disco (AD), longitud del disco (LD). Estadio de desarrollo (proporción de sexos) Adultos (7 H : 4 M) 152 Intervalo (mm) AD LD 468 - 786 519 - 857 Promedio (mm) AD LD 601 660 % AD AD 100 LD 109,8 Paratrygon aiereba Paratrygon aiereba FAMILIA POTAMOTRYGONIDAE a. b. c. d. e. f. Figura 15. Paratrygon aiereba. a) Río Amazonas, Colombia; b) captura en Puerto Leguízamo, río Putumayo, Amazonas, Colombia; c) río Yaguas, Perú; d) Amazonas; e) río Parime, Amazonas, Brasil; f) río Yasuní, Amazonia ecuatoriana. Fotos: M. A. Morales-Betancourt (a, b), M. Hidalgo (c), A. Shibuya (d), M. D. Escobar (e), R. Barriga (f). Sánchez-D. et al. 153 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE cauce del río y los subadultos y juveniles en playas. Frecuente en el sector de Tarapacá, río Putumayo y río Yavarí. En el río Amazonas parece no ser tan común. Ecuador. Esta especie se encuentra tanto en el cauce principal del río como en las lagunas grandes de inundación. En el primer caso ocupa las playas arenosas y en las segundas en playas cubiertas de cieno y vegetación acuática. La profundidad de los sitios de captura no superó los 2,5 m (Barriga obs. pers.). Alimentación Almeida et al. (2005), señalan un periodo de gestación cercano a los nueve meses, con una fecundidad ovárica de 3 a 5 óvulos y fecundidad embrionaria de 2 embriones. La fertilización se lleva a cabo en la época de aguas altas, el periodo de gestación durante la época de bajada de aguas y el nacimiento ocurre en la época de subida de aguas. A partir de 56 machos estudiados, dichos autores establecen la talla mínima de madurez sexual en 60 cm AD y para 45 hembras analizadas, la talla mínima de madurez sexual propuesta fue de 72 cm AD. ca del Amazonas en Colombia. En el contenido se registró un pez (% IIR=99,9) y un insecto del orden Diptera (Chironomidae) (% IIR=0,1). En este mismo río (Río Negro), Goés de Araújo (2011), examinó 227 individuos, de los cuales la proporción de hembras vs. machos favoreció a las primeras en una proporción 1,8 : 1. Para los machos se estableció como talla mínima de madurez sexual 54,6 cm AD, que se alcanza aproximadamente a los 5,4 años de vida y para las hembras la talla mínima de madurez sexual se propuso en 58,1 cm AD, que se alcanza aproximadamente a los 5,6 años de vida. El ciclo reproductivo es estacional, por año se gestan dos embriones/ hembra y la gestación dura de cuatro a seis meses durante la época de aguas en descenso y bajas. El parto ocurre en los meses de enero-febrero (aguas bajas). El tamaño al nacer es de 15,3 cm AD para hembras y 16,4 cm AD para machos, se observó una fuerte correlación entre el tamaño de la madre y el tamaño del embrión. Reproducción Colombia, Ecuador y Perú. En el ma- Carnívora: ictiófaga-entomófaga-carcinófaga. Brasil. Góes de Araújo y Rincón (2009), reportan en la Amazonia brasileña el consumo de peces pequeños, camarones, gusanos y larvas de insectos. Shibuya et al. (2009) registran para el Río Negro como presa dominante, los peces (94,8%) y como presas raras, crustáceos e insectos acuáticos (2,6%). Entre los peces consumidos, se encuetran algunas familias típicas del fondo del río (Cetopsidae y Doradidae), así como otras que habitan en las playas arenosas (Engraulidae y Loricariidae). Colombia. N=1 (1) proveniente de la cuen- Brasil. El ciclo reproductivo está estrechamente relacionado con el ciclo hidrológico y este desencadena el inicio o influye directamente en todas las fases del ciclo reproductivo. Para el Río Negro, Charvet- 154 terial examinado para Colombia se observó una hembra madura de 46 cm AD (con tres óvulos) y una hembra inmadura de 71 cm AD. En Colombia y Ecuador la especie muestra embriones bien desarrollados en septiembre, época de bajada de aguas del Paratrygon aiereba Paratrygon aiereba FAMILIA POTAMOTRYGONIDAE río Amazonas. Para Ecuador, se reporta como talla mínima de maduración sexual 52 cm AD para hembras, con una fecundidad embrionaria entre 1 – 7 (Barriga datos no publicados). En marzo, en el río Aguárico (provincia de Orellana), se colectaron cuatro individuos inmaduros (3 H : 1 M) que todavía registraban la cicatriz del saco vitelino; con AD entre 19 a 20,5 cm y pesos entre 430 y 555 g (Figura 16). a. En la figura 17 se muestra la relación entre la longitud del clasper versus el ancho del disco para 12 ejemplares provenientes de la Amazonia colombo-ecuatoriana. Se observa la separación de los ejemplares según el estado de desarrollo: neonato, juvenil y adulto. Movimientos y comportamiento b. c. Figura 16. Vista (a) dorsal, (b) ventral y (c) detalle de la cicatriz del saco vitelino en neonatos de P. aiereba colectados en la Amazonia ecuatoriana. Colección Ictiológica del Instituto de Ciencias Biológicas de la Escuela Politécnica Nacional, Quito, Ecuador. Foto: M. A. Morales-Betancourt. Sánchez-D. et al. En el Río Negro la especie presenta movimientos diarios entre zonas de diferente profundidad, relacionadas con la alimentación (Góes de Araújo y Rincón 2009). Se ha observado el uso diferencial del hábitat durante el ciclo de vida. Así, en las zonas de playa y bancos de arena se encuentran individuos de 0 a 4 años y a partir de los 5 años los individuos se desplazan hacia el cauce principal del río donde hay una mayor profundidad, también realizan movimientos a zonas menos profundas para alimentarse (Goés de Araújo 2011). Uso Brasil. Su exportación para el comercio de peces ornamentales es ilegal. Se comercializa para consumo de carne de manera local (Góes de Araújo y Rincón 2009). Colombia. Se aprovecha como ornamental en Tarapacá, río Putumayo y río Yavarí. Se pesca con nasa de aro cuadrado y chinchorro. 155 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE J A Figura 17. Relación proporcional de la longitud del clasper vs. el ancho del disco en 13 ejemplares de Paratrygon aiereba de la Amazonia (Colombia, Ecuador y Perú). Neonatos (N), juveniles (J) y adultos (A). Amenazas Es una especie vulnerable debido a su baja fecundidad (1,2 embriones femeninos nacidos anualmente por cada hembra adulta) y una alta tasa de mortalidad natural en los primeros años de vida (Goés de Araújo 2011). Conservación Oportunidades de conservación Medidas de conservación propuestas Brasil. Se recomienda la protección del hábitat y programas de monitoreo a la pesca (Góes de Araújo y Rincón 2009). La baja resiliencia de la especie exige medidas cautelares para prohibir la pesca negativa (que consiste en eliminar las rayas presentes en las playas utilizadas para turismo) y el creciente esfuerzo de la pesca comercial en la cuenca del Río Negro (Goés de Araújo 2011). Colombia. Las mismas oportunidades y medidas de conservación tomadas y propuestas para la especie en la Orinoquia. Autores Paula Sánchez-Duarte, Carlos A. Lasso, Astrid Acosta-Santos, Mónica A. MoralesBetancourt, Edwin Agudelo-Córdoba, Cesar A. Bonilla-Castillo, Guber A. Gómez-Hurtado, Adriana Guzmán y Lina M. Ortiz-Arroyave (Colombia); Thiago Loboda, Ricardo S. Rosa, João Paulo C. B. de Silva, João Pedro Fontanelle, Marcelo R. de Carvalho (Brasil), Ramiro Barriga (Ecuador) y Hernán Ortega (Perú). 156 Paratrygon aiereba Plesiotrygon iwamae FAMILIA POTAMOTRYGONIDAE Plesiotrygon iwamae Rosa, Castello y Thorson 1987 Nombre común y/o indígen Arraia, raya látigo (Brasil, Colombia), raya antena (Colombia). Estatus de conservación Categoría global UICN: Datos Insuficientes (Charvet-Almeida et al. 2009). Caracteres distintivos Disco oval en todas las etapas del desarrollo (longitud del disco entre 98,6 – 104,5% del AD), con una protuberancia en forma de botón en la parte distal. Superficie dorsal de color gris a marrón claro en el fondo, con líneas muy delgadas y curvas de color café claro o amarillo, que forman rosetas o manchas dispersas de forma irregular (más pequeñas que la distancia interorbital). Aletas pélvicas proyectadas posteriormente mucho más allá del márgen posterior del disco (alrededor de la mitad de longitud de la aleta pélvica visible dorsalmente). Cola muy larga y filiforme (contenida más de dos veces en el ancho del disco), de color claro (ventral) y gris claro (dorsal), con una sola fila irregular de espinas y un solo pliegue carnoso ventral; termina como un látigo filiforme. Ojos Sánchez-D. et al. muy pequeños, no pedunculados, su diámetro está contenido al menos 4,4 veces en el espacio interorbital. Espiráculo romboidal (longitud media correspondiente al 6,8% AD). Promedio del ancho de la boca 10,9% del AD; ejemplares adultos con numerosas filas de dientes, que varían entre 30-60/31-64. Promedio de la distancia entre las narinas 8,7% del AD. Radios de las aletas pectorales (77 – 84). Talla y peso Brasil. Plesiotrygon iwamae alcanza grandes tamaños, más de 650 mm AD (Carvalho y Rango 2011). Colombia – Perú. Se examinaron 20 individuos (9 H : 11 M) provenientes de la Amazonia colombo-peruana, de los cuales 17 fueron juveniles y 3 adultos (Tabla 7). Para los machos se registró un ancho de disco máximo (AD) de 520 mm, correspondiente a un peso de 6 kg (Figura 18a) 157 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Tabla 7. Datos y relaciones morfométricas para juveniles (n=17) y adultos (n=3) de Plesiotrygon iwamae. Amazonia colombo-peruana. Ancho del disco (AD), longitud del disco (LD). Estadio de desarrollo (proporción de sexos) Juveniles (8 H : 9 M) Adultos (1 H : 2 M) Intervalo (mm) AD LD 125 - 269 125 - 308 420 - 520 430 - 540 Promedio (mm) AD LD 181,1 179 470 485 % AD AD LD 103,9 98,8 101,1 103,2 a. b. Figura 18. Relación talla (ancho discal)-peso de Plesiotrygon iwamae; a) machos (n=9); b) hembras (n=9). 158 Plesiotrygon iwamae Plesiotrygon iwamae FAMILIA POTAMOTRYGONIDAE y para las hembras se registró un máximo de 420 mm AD y un peso de 2,8 kg (Figura 18b). Los machos mostraron un ancho discal mayor al de las hembras. cha, Napo, Pará, Putumayo, San Miguel, Tocantins, Tiputini y Tivacuno). Ecuador. Barriga (datos no publicados) Brasil. Al parecer no es una especie abun- reporta para hembras un AD promedio de 440 mm con un peso de 19,5 kg y para machos un AD promedio de 350 mm con un peso de 18,4 kg. Distribución geográfica Países: Brasil, Colombia, Ecuador y Perú. Cuencas: Amazonas (Brasil, Colombia, Ecuador, Perú); Solimoes (Brasil). Subcuencas: Amazonas (Aguarico, Caucayá, Guepi, Imuya, Indillama, Lagartoco- Hábitat dante, aunque se encuentra ampliamente distribuida a lo largo de todo el río Amazonas (más de 5.000 km) (Charvet-Almeida et al. 2009, Carvalho y Rango 2011). Restringida al cauce principal de los grandes ríos, habita en aguas blancas y está ausente en las aguas claras como las del río Tapajos o en las aguas negras como las del Río Negro (Duncan y Fernandes 2010). Parece que es una de las especies de rayas que presenta mayor tolerancia a la salinidad (Rosa et al. 2010). Registros de Plesiotrygon iwamae. Sánchez-D. et al. 159 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Colombia. Es común en las partes más profundas del cauce principal del río Amazonas. Alimentación Ictiófaga-entomófaga-carcinófaga. N=5 (5) provenientes de la quebrada Yaricayá, afluente río Putumayo. Un ejemplar registró 5% llenado (100% Chironomidae), para los otros cuatro ejemplares colectados en la Amazonia colombo-peruana (ríos Amazonas y Putumayo), el contenido estomacal estaba altamente digerido, sin embargo se identificó el orden Diptera (% IIR=67) (cabezas de Chironomidae sin di- gerir) e individuos del orden Trichoptera (% IIR=33) (Figura 19). Rosa et al. (1987) analizaron tres muestras provenientes de la Amazonia brasileña donde se evidenció el consumo de peces del orden Siluriformes (Scoloplacidae y Trichomycteridae), otros peces, insectos y crustáceos decápodos (familia Paleomonidae). Charvet-Almeida (2001) citado por Charvet-Almeida et al. (2009), analizó 25 estómagos donde registró el consumo de camarones (Paleomonidae y otros), cangrejos (Portunidae), isópodos (Sphaeromatidae) y peces (Gobiidae). En el bajo Figura 19. Índice de importancia relativa (%IIR) de los ítems consumidos por cuatro ejemplares de Plesiotrygon iwamae colectados en la Amazonia colombo-peruana (ríos Amazonas y Putumayo). 160 Plesiotrygon iwamae Plesiotrygon iwamae FAMILIA POTAMOTRYGONIDAE Amazonas la alimentación parece concentrarse durante la marea baja, cuando la corriente es menor (Rosa et al. 2010). Reproducción Prácticamente sin información en la Amazonia colombiana y peruana. En Ecuador la talla de madurez gonadal está reportada por Barriga (datos no publicados) en 430 mm AD para hembras y 390 mm AD para machos. El número de embriones por hembra varía de uno a cinco. De acuerdo a los pescadores del río Amazonas en la frontera colombo-peruana, se reproduce entre julio y agosto, época en que son capturadas las hembras grávidas y de las cuales se aprovechan los neonatos abortados, como peces ornamentales. La única información disponible muestra la relación entre la longitud del clasper versus el ancho del disco para los diez ejemplares examinados provenientes de la Amazonia colombo-peruana (ríos Amazonas y Putu- mayo). Se ve la separación clara entre los ocho ejemplares juveniles y dos adultos, lo que indica que alcanza la madurez sexual cerca de los 500 mm AD (Figura 20). Datos de la Amazonia brasileña indican que Plesiotrygon iwamae alcanza la madurez sexual cerca de los 420 mm AD (machos) y 500 mm AD (hembras). El periodo de maduración gonadal dura de dos a tres meses, la cópula ocurre durante la época de lluvias y el nacimiento de las crías tiene lugar en el periodo de transición entre la época seca y la temporada de lluvias (con una duración aproximada de tres meses). Tiene una fecundidad baja, en promedio dos crías y probablemente uno de los periodos de gestación más largos entre las rayas de agua dulce (hasta ocho meses) (Charvet-Almeida et al. 2005, 2009, Carvalho y Rango 2011). La información disponible sobre la relación AD vs. longitud del clasper, basada en ejemplares de museo (MNRJ, MZUSP, USNM, ZMH) se muestra en la tabla 8. Figura 20. Relación proporcional de la longitud del clasper vs. el ancho del disco en 10 ejemplares de Plesiotrygon iwamae. Amazonia colombo-peruana (ríos Amazonas y Putumayo). Juveniles (J), adulto (A). Sánchez-D. et al. 161 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Tabla 8. Ancho discal (AD) y longitud del clasper para cinco ejemplares de Plesiotrygon iwamae de la Amazonia brasileña. AD (mm) 210 Longitud clasper (mm) 24 215 16 Juvenil 282 36 Juvenil 490 115 Adulto 547 118 Adulto 579 112 Adulto Estadio Juvenil Movimientos y comportamiento En el estuario del río Amazonas (región de la isla de Marajó), las hembras grávidas se desplazan río arriba durante la época de sequía, cuando los niveles de salinidad aumentan. Este movimiento parece coincidir con la temporada de nacimiento de esta especie en la zona (Charvet-Almeida et al. 2009). hembras grávidas grandes, estas abortan los embriones, que son recolectados por el pescador para su venta como ornamentales. La madre es devuelta al río viva ya que no tiene ningún valor comercial ni es consumida en la región. En Brasil se pesca con palangre y redes de deriva como alimento (Charvet-Almeida et al. 2009). Amenazas En Brasil el comercio como ornamental no está permitido y se reciben algunas denuncias al respecto (Ramos 2009). Esta especie también se utiliza con fines de consumo en algunas regiones de la Amazonia brasileña, pero no se encuentra entre las especies objetivo. También se captura como pesca incidental en palangres y redes de deriva. Teniendo en cuenta que no es una especie muy abundante, su baja fecundidad y su ciclo reproductivo largo, preocupa cualquier tipo de pesquería dirigida a esta especie (Charvet-Almeida et al. 2009). Conservación Uso Su presencia en Colombia no fue confirmada sino hasta el año 2010 (Lasso et al. 2010), por lo que no se tuvo en cuenta en el PAN tiburones-rayas (ver Caldas et al. 2010). Aspectos pesqueros En la figura 21 se muestran algunas ilustraciones de la espécie en la Amazonia colombiana. Se captura principalmente con fines ornamentales en estadio juvenil (Gutiérrez 2007) y como alimento en estadio adulto. Método de captura. Manualmente con fines ornamentales. En Colombia se pesca con espinel o calandrio de julio a agosto, época reproductiva. Cuando se capturan 162 Referencia de identificación Carvalho y Rango (2011), Lasso et al. (2010). Plesiotrygon iwamae Plesiotrygon iwamae FAMILIA POTAMOTRYGONIDAE a. b. c. d. e. f. Figura 21. Plesiotrygon iwamae, Colombia. a) Macho adulto, río Amazonas; b) hembra adulta, río Amazonas; c) detalle del clasper, río Amazonas; d) hembra adulta, río Putumayo; e) vista dorsal de un macho juvenil (186 mm AD), río Amazonas; f) vista ventral de un macho juvenil (186 mm AD), río Amazonas. Fotos: M. A. Morales-Betancourt (a-d), A. AcostaSantos (e, f). Autores Paula Sánchez-Duarte, Carlos A. Lasso, Astrid A. Acosta-Santos, Lina M. Ortiz-Arroyave, Mónica A. Morales-Betancourt, Adriana Guzmán, Edwin Agudelo-Córdoba, Guber A. Gómez-Hurtado, Cesar A. Bonilla-Castillo (Colombia), Marcelo R. de Carvalho y Maíra P. Ragno (Brasil). Sánchez-D. et al. 163 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Plesiotrygon nana Carvalho y Ragno 2011 Nombre común y/o indígena Raya antena enana, raya antena de cola negra (Brasil). Estatus de conservación Categoría global UICN: no evaluada. Caracteres distintivos Disco circular en preadultos y adultos, casi tan ancho como largo (longitud del disco entre 98,4 – 112,5% del AD), parte distal redondeada, sin una protuberancia en forma de botón. Superficie dorsal de color gris a marrón oscuro en el fondo, con líneas muy delgadas y curvas de color café claro o amarillo, que forman rosetas o manchas dispersas de forma irregular (más pequeñas que la distancia interorbital). Aletas pélvicas proyectadas posteriormente mucho más allá de los márgenes posteriores de disco y con los márgenes posteriores ondulados. Cola muy larga y filiforme (contenida más de dos veces en el ancho del disco), de color claro (ventral) y marrón oscuro (dorsal), coloración que se extiende a lo largo del látigo, con los 164 dentículos de la región dorsal pequeños, dispersos, sin formar filas y un solo pliegue carnoso ventral. Ojos muy pequeños, no pedunculados. Espiráculo redondeado (longitud media entre 2,8 y 6,9% del AD). Esta especie tiene proporcionalmente los espiráculos más pequeños de toda la familia Potamotrygonidae. Ancho de la boca en promedio, 6,3% del AD; ejemplares adultos con un número reducido de filas de dientes (20-21/19). Promedio de la distancia entre las narinas 6,3% del AD. Radios de las aletas pectorales: 90 – 91. Talla y peso Brasil. Para los machos se registró un ancho de disco máximo (AD) de 243 mm y para las hembras de 202 mm AD (Carvalho y Ragno 2011). En relación con el peso, sólo se tiene un dato puntual para un macho de 208 mm AD con 250 g. Plesiotrygon nana Plesiotrygon nana FAMILIA POTAMOTRYGONIDAE Colombia. En un principio se creía que era una especie pequeña, de ahí su epíteto específico “nana”. Carvalho y Ragno (2011) señalaron que probablemente no sobrepasaría los 250 mm AD. Sin embargo, el análisis de material colectado recientemente en la Amazonia colombiana y la frontera con Perú, muestra que las hembras pueden llegar a alcanzar 523 mm AD y 12,4 kg (Figura 22). Las otras dos hembras examinadas correspondían a un neonato de 80 mm AD (87 mm LD, 26 g) y un ejemplar de 120 mm AD (125 mm LD, 103 g), en vías de maduración. Para los machos la talla máxima registrada fue 165 mm AD (182 mm LD), correspondiente a un individuo maduro de 312 g (Tabla 9). En la figura 23 se muestra la relación AD (mm) vs. el peso, indistintamente del sexo. Perú. Se examinaron dos individuos (1 H : 1 M) y se consideraron tres datos bibliográficos (1 H : 2 M), provenientes de la Amazonia peruana. De estos, cuatro eran juveniles y uno un adulto (Tabla 10). Los machos mostraron un ancho discal mayor al de las hembras (Figura 24). Figura 22. Ejemplar hembra de Plesiotrygon nana (523 mm AD), colectada en el río Amazonas (lago El Correo), Puerto Nariño, Colombia. Foto: A. Acosta-Santos. Tabla 9. Datos y relaciones morfométricas para neonatos (n=2), juveniles (n=2) y adultos (n=3) de Plesiotrygon nana de la Amazonia colombiana. Ancho del disco (AD), longitud del disco (LD).. Estadio de desarrollo (proporción de sexos) Intervalo (mm) Promedio (mm) % AD AD LD AD LD AD LD Neonatos (1 H : 1 M) 75 - 80 87 - 95 77.5 91 100,1 117,4 Juveniles (1 H : 1 M) 120 - 150 163 523,4 125 - 150 135 137,5 101,3 101,9 170 - 522 283,8 291,4 133,4 102,7 Adultos (2 H : 1 M) Lasso et al. 165 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Figura 23. Relación talla (ancho discal) - peso de Plesiotrygon nana de la Amazonia colombiana. Cuatro machos (rombos) y tres hembras (asteriscos). a. b. Figura 24. Paratipo de Plesiotrygon nana. a) vista dorsal; b) vista ventral (MZUSP 108777, hembra juvenil, 463 mm LT, 81 mm LD, 72 mm AD, río Itaya, afluente del Río Nanay, cerca de Iquitos, Perú. Foto tomada de: Carvalho y Ragno (2011). 166 Plesiotrygon nana Plesiotrygon nana FAMILIA POTAMOTRYGONIDAE Distribución geográfica Países: Brasil, Colombia (primer registro) no 2011) y lagos de inundación, tanto en aguas blancas como negras. y Perú. Alimentación Perú); Solimoes (Brasil). Subcuencas: Amazonas (cauce principal del río Amazonas, Nanay, Putumayo, Ucayalí). Reproducción Cuencas: Amazonas (Brasil, Colombia, Nota: la especie era conocida únicamente para Brasil y Perú. El material proveniente del río Amazonas (Puerto Nariño-lago El Correo) y río Putumayo (Isla Nueva), constituyen los primeros registros para Colombia. Hábitat Río Amazonas, en el cauce principal del río, pequeños tributarios (Carvalho y Rag- Los ejemplares colectados en la época de aguas altas en el río Putumayo no registraron contenidos estomacales. Los datos reproductivos disponibles se refieren a la relación entre la longitud del clasper versus el ancho del disco para los ejemplares provenientes de la Amazonia peruana y colombiana. En esta, se evidencia la separación entre los neonatos, juveniles y adultos. Así, los machos deben alcanzar la madurez sexual a partir de los 200 mm AD (Figura 25). Estos individuos maduros fueron colectados a finales de julio en el río Putumayo (aguas altas) y la Registros de Plesiotrygon nana. Lasso et al. 167 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE N A Figura 25. Relación proporcional de la longitud del clasper vs. el ancho del disco en siete ejemplares de Plesiotrygon nana. Amazonia colombo-peruana (ríos Amazonas y Putumayo). Neonatos (N), juveniles (J) y adultos (A). Tabla 10. Datos y relaciones morfométricas para juveniles (n=5) y adultos (n = 1) de Plesiotrygon nana de la Amazonia peruana. Ancho del disco (AD), longitud del disco (LD). Estadio de desarrollo (proporción de sexos) Juveniles (3 H : 2 M) Adultos (1 M) Intervalo (mm) LD AD LD AD LD 72 - 202 81 - 233 152,8 170,7 116,6 111,7 243 247 243 247 100 101,6 Uso Ornamental. Aspectos pesqueros Método de captura. Manualmente con 168 % AD AD hembra adulta (madura) en diciembre en el río Amazonas, Puerto Nariño (subida de aguas). fines ornamentales. Promedio (mm) Comercialización y exportación. Se comercializa con cierta regularidad en el mercado de acuarios internacional de Iquitos – Perú (Carvalho y Ragno 2011). Amenazas Considerando que fue descrita y presentada oficialmente muy recientemente; anteriormente puede haber sido comercializada como juvenil de otra “raya antena” (Plesiotrygon iwamae). Por otra parte, dada Plesiotrygon nana Plesiotrygon nana FAMILIA POTAMOTRYGONIDAE su menor talla y presentación vistosa, resultaría muy atractiva en el mercado. Por lo tanto, podría estar expuesta en un futuro a sobreexplotación. Conservación Medidas de conservación propuestas. Realizar estudios sobre su biología y distribución de sus poblaciones en la región de Loreto (Perú), en el río Putumayo (Co- lombia y Perú) y en el río Amazonas (Puerto Nariño, Colombia). Asignación de cuotas pesqueras de exportación apropiadas, basadas en un mayor conocimiento de los aspectos básicos de su biología y ecología. Referencia de identificación Carvalho y Ragno (2011). Autores Carlos A. Lasso, Paula Sánchez-Duarte, Astrid Acosta-Santos, Edwin Agudelo-Córdoba (Colombia), Hernán Ortega (Perú), Marcelo R. de Carvalho y Maíra P. Ragno (Brasil). Lasso et al. 169 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Potamotrygon boesemani Rosa, Carvalho y Wanderley 2008 Nombre común y/o indígena Freshwater stingray, raya. Estatus de conservación Categoría global UICN: no evaluada. Caracteres distintivos Dorso con ocelos naranja intenso a rojo, de forma irregular y tamaños variados, rodeados por anillos negros relativamente anchos, sobre un fondo marrón claro u oscuro. Fue identificada como una especie no descrita por Rosa (1985), como Potamotrygon sp. B. Se distingue de las demás especies oceladas del género, por el patrón de coloración y la dentición: de Potamotrygon henlei y Potamotrygon leopoldi por no tener ocelos en la cola; de Potamotrygon motoro por presentar ocelos de formato irregular, no siempre circulares y por el mayor número de hileras de dientes en los maxilares. Con dientes pequeños, de 24 a 45 filas longitudinales en la mandíbula superior. Talla y peso Se examinaron 14 individuos (8 H : 6 M), con 87 a 427 mm AD, de los cuales tres 170 fueron embriones (Rosa et al. 2008). No hay datos de peso para estos ejemplares (Tabla 11). Distribución geográfica País: Surinam. Cuenca: Especie endémica de la cuenca del río Corantijn. Subcuenca: Corantijn. Reproducción Sólo hay datos de dos machos, uno de 250 mm AD, que tenía aún el clasper en condición juvenil (longitud del clasper 11,6% AD), y otro de 377 mm AD con el clasper totalmente desarrollado (longitud del clasper 27,5%AD). Se asume entonces que los machos maduran por lo menos a 377 mm AD. Uso Potencialmente ornamental. Potamotrygon boesemani Potamotrygon boesemani FAMILIA POTAMOTRYGONIDAE Tabla 11. Datos y relaciones morfométricas para embriones (n=3), juveniles (n=7) y adultos (n=4). Río Corantijn, Surinam. Ancho del disco (AD), longitud del disco (LD). Estadio de desarrollo (proporción de sexos) Embriones (1 H : 2 M) Juveniles (4 H : 3 M) Adultos (2 H : 2 M) Intervalo (mm) AD LD 87 - 91,7 92,9 - 95,6 128 - 275 141 - 322 356 - 427 416 - 446 Promedio (mm) AD LD 90 94,1 181 200,8 395,2 429,7 % AD AD LD 100 104,3 100 110,8 100 112 Registros de Potamotrygon boesemani. Referencia de identificación Rosa (1985), Rosa et al. (2008). Autores Ricardo S. Rosa, Marcelo R. de Carvalho, Thiago Loboda, João Paulo C. B. da Silva y João Pedro Fontenelle. Rosa et al. 171 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Potamotrygon constellata (Vaillant 1880) Nombre común y/o indígena Arraia (Brasil). Sinonimias y agudos, con 29 a 44 filas longitudinales en la mandíbula superior. Estatus de conservación Rosa (1985) propuso originalmente que Potamotrygon constellata era un sinónimo senior de Potamotrygon circularis Garman 1913, basado en la presencia de tubérculos dorsales alrededor del disco. Sin embargo, tubérculos similares han sido observados en otras especies como Potamotrygon humerosa, Potamotrygon motoro y Potamotrygon orbignyi. Por ello, Rosa et al. (2010) consideraron que eran necesarias más comparaciones para confirmar o refutar la validez de esta especie. Especie distribuida a lo largo del cauce principal del río Amazonas. Potamotrygon circularis Garman 1913. Categoría global UICN: Datos Insuficientes (Valenti 2009). Caracteres distintivos Coloración general del dorso variable, marrón o gris oscuro, con pequeñas manchas blancas o amarillas, formando rosetas cerca de los márgenes del disco; ocasionalmente con un patrón reticular de pigmento oscuro. Aletas pélvicas dorsalmente con el mismo patrón que el disco. Cola marrón dorsalmente, con franjas laterales oscuras y ventralmente moteada con manchas blancas irregulares. Disco áspero dorsalmente, con tubérculos grandes submarginales y ocasionalmente con tubérculos escapulares; cola también con tubérculos dorsales y laterales hasta la inserción del aguijón o espina caudal. Dientes pequeños 172 Talla y peso Se examinaron siete individuos de Brasil, incluyendo adultos y juveniles (2 H : 5 M), con tallas de 281 – 482 mm AD, pero Potamotrygon constellata Potamotrygon constellata FAMILIA POTAMOTRYGONIDAE Tabla 12. Datos y relaciones morfométricas para juveniles (n=2) y adultos (n=5) de Potamotrygon constellata. Ancho del disco (AD) , longitud del disco (LD). Estadio de desarrollo (proporción de sexos) Juveniles (1 H : 1 M) Adultos (1 H : 4 M) Intervalo (mm) Promedio (mm) AD LD AD LD 281 - 284 295 – 307 282,5 301 353 - 432 129,2 - 385,5 388 192,1 sin datos de peso (Rosa 1985) (Tabla 12). Thorson et al. (1983) reportaron 27 individuos (como Potamotrygon circularis) del río Ivari en Brasil y del río Arará en Colombia con tallas más grandes, hasta 550 mm AD y 13 kg. Un ejemplar macho colectado en el río Amazonas, Puerto Nariño, midió 490 mm AD y pesó 5,5 kg. En Ecuador la talla promedio registrada para hembras es 310 % AD AD LD 100 106,5 100 111,7 mm AD y para machos 290 mm AD. En relación al peso en hembras fue 16,8 kg y en machos 16,2 kg. Distribución geográfica Países: Brasil, Colombia y Ecuador. Posiblemente también presente en Perú. Cuencas: Amazonas. Registros de Potamotrygon constellata. Rosa et al. 173 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Subcuencas: afluentes de la parte media y baja del río Amazonas en Brasil, Colombia y Ecuador. Hábitat No hay datos publicados acerca del hábitat de P. constellata. Con base en las localidades del material examinado se infiere que sea una especie asociada al cauce principal del río Amazonas y posiblemente sus afluentes. Reproducción Los datos de Thorson et al. (1983) registrados solamente para tres individuos (1 H: 2 M) indican que la especie alcanza la madurez sexual con una talla media de 359 mm AD. Según estos mismos autores, la fecundidad uterina varió entre 4 y 11 embriones (promedio 5,8). En la figura 26 se muestra la relación entre la longitud del clasper versus el ancho del disco, se toma como edad de maduración la propuesta por los autores mencionados. En Ecuador, durante la época seca (noviembre a enero) no se han registrado hembras grávidas y tampoco se ha capturado embriones. Lo contrario sucede en la época húmeda (febrero a julio) donde se han registrado hembras grávidas y entre tres a 10 embriones. La talla de maduración gonadal para hembras es de 320 mm AD y para machos de 310 mm AD (Barriga, obs. pers.). Amenazas Pesca incidental. Conservación Colombia. Prioridad alta según el PAN tiburones-rayas, en relación con la pesca, comercio y distribución de la misma. En la figura 27 se muestran alguanas ilustraciones de P. constellata, incluyendo el holotipo. Referencia de identificación Rosa (1985). Figura 26. Relación proporcional de la longitud del clasper vs. el ancho del disco en seis ejemplares de Potamotrygon constellata. Amazonas (Brasil). Juveniles (J), adultos (A). 174 Potamotrygon constellata Potamotrygon constellata FAMILIA POTAMOTRYGONIDAE a. b. Figura 27. Potamotrygon constellata. a) Holotipo, b) Colombia, c) detalle de los tubérculos. Fotos: R. Rosa (a, c), T. B. Thorson (b). c. Autores Ricardo S. Rosa, Carlos A. Lasso, Paula Sánchez-Duarte, Mónica A. Morales-Betancourt y Ramiro Barriga. Rosa et al. 175 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Potamotrygon dumerilii (Castelnau 1855) Nombre común y/o indígena Arraia (Brasil). Estatus de conservación Categoría global IUCN: no evaluada. Caracteres distintivos Potamotrygon dumerilii ha sido tratada como una especie dudosa o un posible sinónimo de Potamotrygon orbignyi por Carvalho et al. (2003). Sin embargo, de acuerdo a observaciones personales de los presentes autores, se reconoce la separación entre las dos especies con base en el patrón de coloración, aunque no hayan diferencias morfométricas (Charvet y Gama, datos no publicados). Coloración general del dorso con un fondo marrón claro y con pequeñas manchas oscuras delimitando figuras casi triangulares, que conforman un patrón reticular abierto. Estas figuras triangulares, denominadas “monitos” por Castex (1964), constituyen el principal carácter diagnóstico de la especie. Dientes pequeños, con 36 a 37 filas longitudinales en la mandíbula superior. De apariencia similar 176 a Potamatrygon orbignyi, pero sin un pliegue de piel en las comisuras labiales inferiores (surcos labiales) y con las figuras denominadas “monitos” en la superficie dorsal del disco. Especie restricta a la parte baja de la cuenca del Amazonas (Brasil). Talla y peso Se examinaron 32 individuos (16 H : 16 M), de los cuales 17 fueron juveniles y 15 adultos (Tabla 13). El macho mayor tenía 278 mm AD y la mayor hembra, 415 mm AD, aunque la especie puede alcanzar un máximo de 483,5 mm AD y un peso máximo de 4,3 kg (Figura 28). Las hembras de Potamotrygon dumerilii mostraron un patrón de crecimiento de tipo isométrico, característico de peces que mantienen sus proporciones corporales a lo largo del proceso de crecimiento. Los machos mostraron patrones de crecimiento alométrico positivo con coeficien- Potamotrygon dumerilii Potamotrygon dumerilii FAMILIA POTAMOTRYGONIDAE Tabla 13. Datos y relaciones morfométricas para juveniles (n=17) y adultos (n=15) de Potamotrygon dumerilii del Amazonas (Brasil). Ancho del disco (AD), longitud del disco (LD). Estadio de desarrollo Intervalo (mm) Promedio (mm) % AD (proporción de sexos) AD LD AD LD AD LD Juveniles (6 H : 11 M) 120 - 278 122 - 289 196 192 - 107,1 Adultos (10 H : 5 M) 254 - 432 236 - 448 319 356 - 107,6 a. b. Figura 28. Relación talla (ancho discal)-peso de Potamotrygon dumerilii; a) machos (n=9); b) hembras (n= 21). Amazonas (Brasil). Gama y Rosa 177 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE te de alometría menor que lo observado en las hembras, indicando que las hembras invierten más en aumento de peso que los machos, hecho probablemente relacionado con el incremento de peso durante la gestación. Distribución geográfica País: Brasil. Cuenca: Amazonas. Subcuencas: distribuida en la parte baja de la cuenca del Amazonas, desde el río Araguaia hasta el río Pará, la Isla de Marajó y la costa de Amapá (Brasil). Rosa (1985) indicó su presencia en la cuenca del río Paraná (Argentina), pero estudios adicionales acerca de la taxonomía y distribución de esta especie son necesarios para confirmar esto. Hábitat En la desembocadura del Amazonas, en la Reserva Biológica (REBIO) de Parazinho, una isla fluvial en la desembocadura del río Amazonas (Amapá, Brasil), Potamotrygon dumerilii fue observada durante todo el año, con preferencia en las áreas con fondos fangosos y poca velocidad de corriente. Ocasionalmente también se encuentra en zonas de mayor velocidad y en sustratos arenosos. Alimentación Carnívora: carcinófaga - poliquetófaga entomófaga. N = 17 (14), provenientes de la REBIO de Parazinho (Amapá, Brasil), colectadas entre marzo de 2012 y enero de 2013 (Gama 2013). Los contenidos estomacales presentaron principalmente camarones y gusanos, así como sedimentos, Registros de Potamotrygon dumerilii. 178 Potamotrygon dumerilii Potamotrygon dumerilii FAMILIA POTAMOTRYGONIDAE material digerido y restos vegetales, ítems que presentaron los valores más altos del IAI (índice de importancia alimentaria de Kawakami y Vazzoler 1980). Otros ítems consumidos, pero en menor proporción, incluyeron: Pomacea sp., Sesarma sp., Armases benedicti, Grillotalpidae, larvas de Odonata, restos de peces, insectos no identificados, larvas de crustáceos, Isopoda, larvas de quironómidos, Hymenoptera y colémbolos. Estos items, debido a sus bajos volúmenes y frecuencias, se consideraron ocasionales o incidentales. La mayoría de los estómagos que contenían alimento, presentaron poco o muy poco contenido estomacal (grado de repleción <50%). Reproducción En la REBIO (Amapá, Brasil), entre marzo de 2012 y enero de 2013, fueron analizadas las gónadas de 17 ejemplares (8 H : 9 M). Se observaron tanto hembras embarazadas como inmaduras (juveniles). Entre las hembras en estado de gravidez, la menor tenía 254 mm AD. Los machos captu- rados también fueron inmaduros (50%) o estaban en etapa de maduración temprana. El macho reproductor más pequeño tenía 272 mm AD (Gama 2013). El promedio de fecundidad uterina fue 1,4 embrión/hembra, con los embriones alojados normalmente en el útero izquierdo. En la mayor hembra capturada se encontraron tres embriones abortados al momento de la captura. De los nueve machos analizados, dos estaban maduros y el resto eran inmaduros. De acuerdo a la longitud del clasper con respecto al ancho del disco, se observa una distinción clara entre los individuos inmaduros y los reproductivos, a pesar del bajo número de ejemplares examinados. Los machos reproductivos fueron mayores a 270 mm AD, con una longitud del clasper mayor que el 24% del AD (Figura 29). El análisis de las gónadas mostró un ejemplar en las primeras etapas de madurez con un clasper que alcanzó el 26% del AD. Potamotrygon dumerilii presentó un sólo periodo reproductivo, con Figura 29. Relación proporcional de la longitud del clasper vs. el ancho del disco en cinco ejemplares de Potamotrygon dumerilii, indicando separación entre juveniles (J) y adultos (A). Amazonas (Brasil). Gama y Rosa 179 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE machos maduros en marzo y hembras preñadas de mayo y julio (Gama 2013). das dado su tamaño pequeño y no participan en los desembarques de pescado. Aspectos pesqueros Amenazas Método de captura. Como otras espe- cies de potamotrigónidos de la región, Potamotrygon dumerilii es capturada accidentalmente por los pescadores que utilizan palangres de fondo y pesca de arrastre para camarón. En general no son consumi- La pesca incidental con redes y la pesca camaronera de arrastre. Los pescadores comúnmente cortan la cola o la matan para evitar futuros accidentes. Referencia de identificación Rosa (1985). Autores Cecile S. Gama y Ricardo S. Rosa 180 Potamotrygon dumerilii Potamotrygon falkneri FAMILIA POTAMOTRYGONIDAE Potamotrygon falkneri Castex y Maciel 1963 Nombre común y/o indígena Arraia (Brasil). Sinonimias Potamotrygon menchacai Achenbach 1967, Potamotrygon castexi Castello y Yagolkowski 1969. en la mandíbula superior y 29 a 43 en la mandíbula inferior. Categoría global IUCN: no evaluada. En la figura 30 se muestra una foto de la especie viva (Figura 30a) y un ejemplar recién capturado en la Amazonia boliviana (Figura 30b). Caracteres distintivos Talla y peso Estatus de conservación Coloración dorsal del disco marrón oscuro, con manchas o pintas claras o anaranjadas circulares, ovales, vermiculares y/o en rosetas. Las manchas son iguales o menores en tamaño que el diámetro ocular. Aletas pélvicas dorsalmente con el mismo patrón que el disco. Una a tres filas irregulares de espinas sobre el dorso anterior de la cola. Cola con la misma coloración dorsal y lateral que el disco, con manchas claras. Disco ventralmente oscuro, con manchas claras. Disco con dentículos pequeños, con formato de estrellas y asimétricos. Dientes pequeños con 30 a 45 filas longitudinales da Silva et al. Se examinaron 10 individuos en total (3 H : 7 M), con tallas de 225 – 432 mm AD, pero sin datos de peso (Silva y Carvalho 2011) (Tabla 14). No hay datos de peso para esta especie. Distribución geográfica Países: Brasil, Perú y Bolivia. Cuencas: Brasil (Amazonas, Paraná- Paraguay y La Plata), Bolivia (Amazonas), Perú (Amazonas). Subcuencas: Amazonas (parte superior del río Madre de Dios, Guaporé o Iténez 181 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE a. b. Figura 30. Potamotrygon falkneri. a) Vista subacuatica, Brasil; b) captura en el río Mamoré, Bolivia. Fotos: D. Garrone Neto (a), D. Lizarro (b). Tabla 14. Datos y relaciones morfométricas para los adultos (n=10) de Potamotrygon falkneri. Ancho del disco (AD), longitud del disco (LD). Estadio de desarrollo (proporción de sexos) Adultos (3 H : 7 M) Intervalo (mm) AD LD 225 - 432 234 - 488 Promedio (mm) AD LD 352,3 381,5 % AD AD LD 100 108,2 y Beni-Bolivia; Solimoes-Brasil; Madre de Dios y Marañón-Perú). Amenazas Cuenca del Amazonas superior en Bolivia (ríos Madre de Dios, Guaporé y Beni), Perú (ríos Madre de Dios y Marañón) y Brasil (rio Solimões). Referencia de identificación 182 Pesca incidental. Rosa (1985), Silva y Carvalho (2011) Potamotrygon falkneri Potamotrygon falkneri FAMILIA POTAMOTRYGONIDAE Registros de Potamotrygon falkneri. Autores João Paulo C. B. da Silva, João Pedro Fontenelle, Thiago Loboda, Ricardo S. Rosa y Marcelo R. de Carvalho. da Silva et al. 183 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Potamotrygon henlei (Castelnau 1855) Nombre común y/o indígena Arraia, raia de fogo (Brasil). Estatus de conservación Categoría global IUCN: no evaluada. Caracteres distintivos Coloración del dorso del disco variable: (1) generalmente con un fondo marrón o gris oscuro hasta negruzco, con ocelos circulares amarillos o naranja claro, rodeados por un anillo negro; (2) fondo marrón o gris oscuro hasta negruzco, con ocelos irregulares, a veces fusionados dos a dos, con una mancha oscura en el centro. Dientes grandes y anchos, con 14 a 26 filas longitudinales en la mandíbula superior. Se distingue de las demás especies oceladas del género, por la presencia de ocelos en la cola, a excepción de Potamotrygon leopoldi. Talla y peso Se examinaron 56 individuos (29 M : 27 H), de los cuales 35 fueron embriones y neonatos, 10 juveniles y 11 adultos (Tabla 15). El macho más grande examinado tenía 346 mm AD y 1,9 kg, mientras que la hembra más grande tenía 710 mm AD y 17 kg. Se estima una talla al nacer de alrede- 184 dor de 130-150 mm AD, con un peso aproximado de 80-90 g (neonatos). En la figura 31 se observa la relación talla (ancho discal) - peso para 27 ejemplares (hembras – machos) de la especie. Distribución geográfica País: Brasil. Cuenca: parte baja de la cuenca del Amazonas. Subcuencas: posiblemente restricta a las subcuencas del Tocantins y Araguaia. Hábitat Común en aguas turbias con preferencia por los fondos rocosos donde hay grandes concentraciones de su alimento preferido, los gasterópodos, peces pequeños y larvas de insectos. Abundante en áreas donde se limpia el pescado, alrededor de las ciudades y pueblos costeros en los puertos de desembarque. Abundante aguas abajo de la confluencia de los ríos Araguaia y Tocantins, hasta la represa de Tucuruí. Se ha registrado con frecuencia a partir del río Potamotrygon henlei Potamotrygon henlei FAMILIA POTAMOTRYGONIDAE Tabla 15. Datos y relaciones morfométricas para neonatos y/o embriones (n=35), juveniles (n=10), y adultos (n=11), de Potamotrygon henlei. Ancho del disco (AD), longitud del disco (LD). Estadio de desarrollo (proporción de sexos) Neonatos (14 H : 21 M) Juveniles (6 H : 4 M) Adultos (7 H : 4 M) Intervalo (mm) AD LD 118 - 170 150 - 282 163 - 302 300 - 710 - Promedio (mm) AD LD 141 198 210 481 - % AD AD LD 100 100 107,2 100 - Figura 31. Relación talla (ancho discal)-peso Potamotrygon henlei. Se incluye tanto machos como hembras (n=27). Araguaia medio hasta su confluencia con el Tocantins. En el medio y alto río Tocantins es rara. Alimentación Carnívora: entomófaga - malacófaga - ictiófaga. N = 18 (18). Oportunista, que se alimenta incluso de peces capturados en las redes de pesca, por lo que es mal vista por los pescadores (represa de Tucuruí). Se observan cambios en la dieta entre juveniles y adultos, los jóvenes consumen larvas de insectos (Ephemeroptera, Trichoptera, Rincón et al. Diptera y Odonata), que son menos frecuentes en los adultos, siendo reemplazados progresivamente por gastrópodos (Pomacea sp. Thiara sp. y Melanoides sp.), camarones, otras larvas de insectos más grandes y eventualmente peces (Tabla 16) (Rincon 2006). Reproducción Las hembras alcanzan la madurez sexual aproximadamente entre 390-400 mm AD (según la fecundidad ovárica, Figura 32). La fecundidad aumenta progresivamente 185 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Registros de Potamotrygon henlei. Tabla 16. Índice de importancia relativa-IRI para Potamotrygon henlei (n = 18). N % = número de ítems de un mismo taxón en los estómagos analizados; P % = peso de los ítems de un mismo taxón en los estómagos analizados; F.A. % = frecuencia de aparición de los ítems de un mismo taxón en los estómagos analizados. N% P% FA % IRI IRI % Pomacea sp. Ítem 5,7 3,8 33,3 318,28 3,3 Gastrópodo no identificado 45,9 26,9 66,7 4855,1 50 Odonata 6,6 3,6 66,7 337,3 3,5 Ephemeroptera 4,9 0,5 100 537,53 5,5 Trichoptera 14,8 2,8 66,7 1172 12,1 Diptera 1,6 0 33,3 56,096 0,6 Macrobrachium acanthurus 20,5 52,3 33,3 2425,4 25 0 10,1 100 1011,4 10,4 Material digerido 186 Potamotrygon henlei Potamotrygon henlei FAMILIA POTAMOTRYGONIDAE Figura 32. Relación entre la fecundidad ovárica (número de folículos vetelogénicos) y el ancho discal AD (mm). con el tamaño corporal, de una o dos crías, hasta un máximo de nueve embriones (Figura 33). Se observó una fecundidad ovárica de hasta 11 folículos maduros, lo que indica una posible fecundidad uterina aún mayor. La vitelogénesis ocurre al mismo tiempo que el embarazo, lo que indica un breve periodo de descanso y un ciclo reproductivo continuo. Esta estrategia reproductiva probablemente agota demasiado las hembras, lo que justifica el pobre estado de condición que se observa en algunas hembras después del parto y la menor frecuencia reproductiva en las hembras mayores. Los machos tenían un mayor crecimiento relativo del clasper en- Figura 33. Relación entre la fecundidad uterina (número de embriones) y el ancho discal AD (mm). Rincón et al. 187 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE tre 300-320 mm AD, cuando este alcanza longitudes entre 17 y 23 % de LD (Figura 34). Un individuo con 252 mm AD, tenía aún los claspers en condición juvenil. Movimientos y comportamiento Especie oportunista que se asocia rápidamente a las áreas de pesca, aglomerándose cerca de las zonas de desembarque y limpieza de pescado. En el lago de la hi- droeléctrica de Tucuruí, las rayas remueven los peces de la red mordiéndoles la cabeza. Tienen una estructura mandibular capaz de triturar los cráneos de los peces, aunque P. henlei normalmente es una especie malacófaga. Más activa en la noche. Los individuos mayores permanecen en aguas más profundas a 1 o 2 metros de profundidad. Figura 34. Relación proporcional de la longitud del clasper vs. el ancho del disco de Potamotrygon henlei. Todos los individuos son juveniles (n=7). Uso Solamente los ejemplares menores son capturados por la pesca ornamental (a menudo 30 cm AD) (Figura 35a-b). A los ejemplares mayores los pescadores les cortan la cola y los sueltan o los matan y devuelven al río (Figura 35 c). El uso como fuente alimenticio no es común. Pueden ser utilizadas como cebo para otros peces. Aspectos pesqueros Método de captura. Palangre, lo que ocasiona la mortalidad acentuada de indi- 188 viduos mayores. Los juveniles son capturados por buceo o redes de menor talla. Amenazas La distribución restringida de esta especie en el río Araguaia y la parte baja del río Tocantins es una amenaza intrínseca frente a los cambios antrópicos en esta cuenca, especialmente la construcción de embalses. La pesca ornamental sin fiscalización o normas de exportación. Evidencias sugieren que P. henlei fue beneficiada con la construcción del lago de la hidroeléctrica de Tucuruí en respuesta al crecimiento del área inundable e interacción con la pesca. Potamotrygon henlei Potamotrygon henlei FAMILIA POTAMOTRYGONIDAE a. b. Figura 35. Potamotrygon henlei. a) Ejemplar listo para empaque y envio como pez ornamental; b) ejemplar juvenil; c) individuo capturado e el río Araguaria (parte inferior). Fotos: G. Rincón (a, b), G. M. Santos (c). c. Conservación El crecimiento del número de hidroeléctricas en la cuenca del río Tocantins propicia una oportunidad para el estudio de los cambios ecológicos y el impacto ambiental en las poblaciones de rayas de agua dulce. Sin embargo, estos ambientes unen poblaciones y alteran significativamente la posibilidad de variabilidad genética. Hibridización entre especies reconocidas se tornan cada vez más frecuentes y son reportados por los pescadores. Referencia de identificación Rosa (1985), Rincon (2006). Autores Getulio Rincón, Ricardo S. Rosa y Marcelo R. Carvalho Rincón et al. 189 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Potamotrygon humerosa Garman 1913 Nombre común y/o indígena Arraia (Brasil). Estatus de conservación Categoría global IUCN: no evaluada. Caracteres distintivos Coloración general del dorso variable. Superficie del disco y aletas pélvicas marrón oscuro o marrón claro, generalmente con un patrón reticular de pigmento oscuro, delimitando espacios circulares o hexagonales. Diámetro de la mayor forma reticular casi igual a la distancia entre los ojos. Dichos retículos o formas reticulares disminuyen en tamaño hacia los márgenes del disco. Cola marrón dorsalmente, con barras oscuras laterales y ventralmente moteada con manchas blancas irregulares. Disco áspero, con dentículos agudos y a veces con tubérculos submarginales; cola con espinas medianas dorsal y laterales agrandadas, distribuidas irregularmente desde la base de la cola hasta la inserción del aguijón o espina caudal. Dientes pequeños con 23 a 45 filas longitudinales en 190 la mandíbula superior. De apariencia similar a Potamotrygon orbignyi, pero se distingue de esta especie por su disco y cola relativamente más rugosa, con dentículos y espinas relativamente mayores en cualquier tamaño corporal. Especie distribuida en las partes media y baja de la cuenca del Amazonas (Brasil). Talla y peso Se examinaron 28 individuos de Brasil (14 H : 14 M), con tallas de 197 – 332 mm de ancho de máximo disco (AD) (Tabla 17), pero sin datos de peso (Silva 2010). No hay datos de peso disponibles para esta especie. Distribución geográfica País: Brasil. Cuencas: partes media y baja de la cuenca del Amazonas, desde el Río Negro hasta el Río Pará. Subcuencas: ríos Negro, Tapajós y Pará. Potamotrygon humerosa Potamotrygon humerosa FAMILIA POTAMOTRYGONIDAE Tabla 17. Datos y relaciones morfométricas para juveniles (n=14) y adultos (n=14) de Potamotrygon humerosa de la Amazonia brasileña. Ancho del disco (AD), longitud del disco (LD). Estadio de desarrollo (proporción de sexos) Juveniles (7 H : 7 M) Adultos (7 H : 7 M) Intervalo (mm) AD LD 86 - 216 91 - 222 197 - 332 212 - 378 Promedio (mm) AD LD 145,4 154,3 249,4 281,2 % AD AD 100 100 LD 106,1 112,7 Registros de Potamotrygon humerosa. Reproducción Sólo hay información sobre la madurez sexual de los machos, derivada del examen de material de museo (CAS y MZUSP). Así, parecen iniciar la madurez sexual a los 207 mm AD y con 237 mm AD ya están completamente maduros (Figura 36). da Silva et al. Amenazas Pesca incidental. Referencia de identificación Rosa (1985), Silva (2010). 191 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE A J Figura 36. Relación proporcional de la longitud del clasper vs. el ancho del disco en 14 ejemplares de Potamotrygon humerosa colectados en la Amazonia brasileña. Juveniles (J) y adultos (A). Autores João Paulo C. B. da Silva, Thiago Loboda, João Pedro Fontenelle, Ricardo S. Rosa y Marcelo R. de Carvalho. 192 Potamotrygon humerosa Potamotrygon leopoldi FAMILIA POTAMOTRYGONIDAE Potamotrygon leopoldi Castex y Castello 1970 Nombre común y/o indígena Arraia-de-fogo, arraia-negra, arraia-deletrinha (Xingú, Brasil). Estatus de conservación Categoria global IUCN: Datos Insuficientes (Charvet-Almeida et al. 2009). Caracteres distintivos Dorso con un fondo gris oscuro a negruzco con ocelos blancos o amarillos más irregulares hacia el centro del disco y circulares cerca de las márgenes del disco, extendidos sobre la parte basal de la cola. Espinas caudales medianas y dispuestas en tres series paralelas. Difiere de P. henlei por el mayor número de dientes, 23 a 35 filas longitudinales en la mandíbula superior. Talla y peso Seis ejemplares adultos (cuatro hembras y dos machos) de Potamotrygon leopoldi registrados en una captura realizada por Loboda en abril de 2013, mostraron un AD promedio de 47 cm (Tabla 18). El peso varió entre 4 y 20 kg (Loboda datos no publicados). Loboda et al. Distribución geográfica País: Brasil. Cuenca: Brasil (parte baja de la cuenca del Amazonas-río Xingú). Subcuenca: endémica de la subcuenca del rio Xingú, incluyendo el río Iriri y principales afluentes del Xingú, estado de Pará. Reproducción Un macho adulto del río Xingú (IRSBN 23936) mostró una longitud del clasper de unos 105 mm, luego se supone que los machos están maduros a partir de esa talla. Amenazas La construcción de obras y represas hidroeléctricas en el río Xingú. Las poblaciones de rayas en algunas zonas de Volta Grande do Xingú, cerca de las regiones municipales de Altamira y Vitória do Xingú (Pará), enfrentarán riesgos mayores. 193 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Tabla 18. Datos y relaciones morfométricas para adultos (n=6) de Potamotrygon leopoldi. Subcuenca del Xingú. Ancho del disco (AD), longitud del disco (LD). Estadio de desarrollo (proporción de sexos) Adultos (4 H : 2 M) Intervalo (mm) AD LD 420 - 720 458 - 755 Promedio (mm) AD LD 470,3 593 % AD AD LD 100 108,4 Registros de Potamotrygon leopoldi. Referencia de identificación Rosa (1985), Carvalho et al. (2003). Autores Thiago Loboda, João Paulo C. B. da Silva, João Pedro Fontenelle, Ricardo S. Rosa y Marcelo R. de Carvalho. 194 Potamotrygon leopoldi Potamotrygon magdalenae FAMILIA POTAMOTRYGONIDAE Potamotrygon magdalenae (Duméril 1865) Nombre común y/o indígena Raya del Magdalena, raya barranquillera, raya reticulada, raya roja, raya de río, raya (Colombia). Estatus de conservación Categoría global UICN: Casi Amenazada (Charvet-Almeida y Pinto 2004); categoría nacional: Casi Amenazada (Colombia) (Mojica et al. 2012). Caracteres distintivos Largo del disco (LD) mayor que el ancho discal (AD), su longitud es 1,1 a 1,18 veces el AD. Aletas pélvicas cubiertas generalmente por el disco. Cola relativamente larga, su longitud representa 1,1 a 2 veces el AD; con un pliegue dorsal y ventral bien desarrollado, la altura del pliegue dorsal representa el 1,8 al 2,3% del AD y el 2,1 al 3,5% de la altura de la cola. Superficie dorsal del cuerpo de coloración variable, marrón brillante a marrón oliváceo oscuro o grisáceo, por lo general moteado con pequeñas manchas amarillentas o claras que pueden formar un patrón reticulado más evidente en juveniles; estas manchas suelen ser más pequeñas que el diámetro del ojo. Lasso et al. Talla y peso Se examinaron 82 individuos (37 H : 45 M), de los cuales 18 fueron neonatos, 18 juveniles y 46 adultos (Tabla 19). Para los machos analizados se registró un ancho de disco máximo (AD) de 280 mm, correspondiente a un peso de 1,5 kg (Figura 37a); para las hembras se registró un máximo de 476 mm AD y un peso de 6,1 kg (Figura 37b). En la cuenca del Magdalena se han colectado hembras de hasta 422 mm AD y machos de 323 mm AD (Ramos-Socha 2010); en la cuenca media del río Atrato la hembra de mayor tamaño registró 350 mm AD y un peso de 1,6 kg y el macho de mayor tamaño tuvo 260 mm AD y 750 g de peso (Mosquera 2012). Las hembras alcanzan entonces un ancho discal mayor al de los machos. Distribución geográfica País: Colombia. 195 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Tabla 19. Datos y relaciones morfométricas para neonatos (n=18), juveniles (n=18) y adultos (n=46) de Potamotrygon magdalenae de la cuenca del Magdalena. Ancho del disco (AD), longitud del disco (LD). Estadio de desarrollo (proporción de sexos) Neonatos (8 H : 10 M) Juveniles (8 H : 10 M) Adultos (21 H : 25 M) Intervalo (mm) AD LD 45 - 88 50 - 95 91 - 204 99 - 229 125 - 476 139 - 498 Promedio (mm) AD LD 68,8 73,8 145,5 160,4 204,5 220,2 % AD AD 104,7 107,6 106 LD 107,2 110,3 107,7 a. b. Figura 37. Relación talla (ancho discal)-peso de Potamotrygon magdalenae, a) machos (n=29); b) hembras (n=18). Cuenca del Magdalena. 196 Potamotrygon magdalenae Potamotrygon magdalenae FAMILIA POTAMOTRYGONIDAE Cuencas: Caribe y Magdalena-Cauca. Subcuencas: Caribe (Atrato, San Jorge); Magdalena-Cauca (Magdalena hasta el Huila; en el Cauca hasta Puerto Valdivia y en el río San Jorge hasta unos 50 km arriba de Monte Líbano (Dahl 1971). Afluentes del río Magdalena, con registros en los ríos Cimitarra, Opón, La Miel, Guarinocito, Manso, Opia y Pata. Registrada en los embalses de Betania y Prado (JiménezSegura et al. 2011). abundancias se han registrado en marzo, seguido por los meses de noviembre y abril, y las más bajas en diciembre y febrero. Las densidades medias de captura con trasmallo fueron 1,4 +/-0,37 ind./h de faena de pesca y con chinchorro 59,3 +/-9 ind./h, en la época seca (Ramos-Socha 2010). En la región de Neiva, Hobo y el embalse de Betania muestra mayor abundancia en los meses de julio y agosto, y de noviembre a enero (Rojas-Ceballes et al. 2013). Hábitat Alimentación En los ríos Magdalena y Atrato es común tanto en el cauce principal del río como en las ciénagas y quebradas. Generalmente prefiere aguas turbias, fondos de arena y fango, con corrientes lentas (Dahl 1971). En las ciénagas del Magdalena las mayores Carnívora: entomófaga. N=15 (14) procedentes de la ciénaga de Sabayo (Guaimaral, Magdalena). La mayoría de presas consumidas fueron larvas del orden Diptera (IIR = 100%), con consumo preferente de Chironomidae; sólo una hembra ingirió un Registros de Potamotrygon magdalenae. Lasso et al. 197 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE organismo de Ceratopogonidae (Stilobezzia sp.). En la represa de Prado y la Ciénaga de Sabayo se considera consumidora primaria, detritívora, de hábitos bentónicos, con consumo ocasional de invertebrados acuáticos e insectos (Villa-Navarro 1999). También se alimenta de larvas (30,8%) y adultos (55,6%) de la familia Polymitarcidae (Ramos-Socha 2010). Aunque es catalogada como fundamentalmente entomófaga, en la cuenca del Atrato (ríos Cabí y Bete), muestra una dieta carnívora amplia, con los peces como el alimento más frecuente, seguido por cangrejos, renacuajos, caracoles e insectos (Dahl 1971, Lasso et al. 2011). bras entre 170 – 210 mm AD y para los machos entre 170 – 190 mm AD. En las ciénagas del Magdalena, Ramos-Socha (2010), registró que las hembras alcanzan la talla media de madurez sexual a los 240 mm AD mientras que los machos a los 202 mm AD. La talla mínima de madurez sexual en hembras fue 164 mm AD y en machos 160 mm AD. En la figura 39 se muestra la relación entre la longitud del clasper versus el ancho del disco. Individuos de 100 a 125 mm AD son considerados juveniles, a partir de 151 mm AD en adelante, ya se consideran como individuos maduros, lo cual es coincidente con las observaciones de Ramos-Socha (2010). Reproducción Para el río Atrato (cuenca media) la madurez sexual se evidenció en machos desde 210 mm AD y para hembras a partir de 230 mm AD. Una hembra de 280 mm AD presentó dos neonatos en su interior, con AD de 70 y 90 mm, respectivamente (Fi- Un solo embrión desarrollado en cada útero (Teshima y Takeshita 1992), ovario izquierdo más desarrollado que el derecho (Figura 38). Teshima y Takeshita (1992) reportan madurez sexual para las hem- Figura 38. Gónadas de hembra de Potamotrygon magdalenae. Foto: Semillero Yuma Challwani - Universidad Surcolombiana. 198 Potamotrygon magdalenae Potamotrygon magdalenae FAMILIA POTAMOTRYGONIDAE Figura 39. Relación proporcional de la longitud del clasper vs. el ancho del disco en 41 ejemplares de Potamotrygon magdalenae. Cuenca del Magdalena. Neonatos (N), juveniles (J), adultos (A). Figura 40. Aborto de Potamotrygon magdalenae en el río Atrato. Foto: J. Maldonado. gura 40). Para un año de muestreo, la proporción sexual de machos y hembras fue 1:1 durante todos los meses de estudio (Mosquera 2012). Lasso et al. En el alto Magdalena la madurez sexual se observa desde los 220 mm AD para machos y a partir de 261 mm para hembras. Ramos-Socha y Grijalba-Bendeck 199 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE (2011) registraron embriones desde 30 mm AD (estadio 1 – Tabla 20), hasta 95 mm AD (estadio 4 – Tabla 20). Los neonatos cuando nacen tienen una talla de 87 a 95 mm AD (Lasso et al. 2011). RamosSocha (2010) registra para la ciénaga de Sabayo, una mayor proporción de hembras maduras entre enero y marzo, con un pico en marzo y una disminución hacia mayo. Luego se encuentran hembras gestantes en noviembre y de nuevo en abril y mayo. Para el alto Magdalena la fecundidad uterina observada varió entre 7 y 9 embriones correspondientes al estadio 4, mientras que los pescadores reportan entre 8 y 10 embriones (Figura 41). Movimientos y comportamiento En el embalse de Betania los pescadores señalan su presencia (avistamientos) cuando el nivel del agua de la represa sube y se mantiene por quince días. Las rayas dejan de observarse y desaparecen cuando baja el nivel. Aparentemente dichas fluctuaciones en su presencia están asociadas con la búsqueda de ensenadas para la reproducción. En el alto Magdalena los pescadores reportan un comportamiento gregario (grupos de 5 a 6 rayas). Así mismo, durante la época reproductiva los arponeros del Magdalena han observado la formación de cardúmenes. Uso Se captura en estadio juvenil con fines ornamentales y ante el colapso de las pesquerías en la región, los adultos son utilizados con fines de consumo de subsistencia (Lasso et al. 2011). En la cuenca del Atrato muchos ejemplares se sacrifican al caer accidentalmente en las redes debido al temor a las lesiones que puede causar la espina caudal (Perdomo-Núñez 2005). En la región de Neiva, Hobo y en el embalse de Betania la especie se utiliza con fines de consumo de la carne (40,3%) y el más importante medicinal (66,2%). El aceite del hígado se emplea para tratar afecciones respiratorias, dolores de cabeza y fortalecimiento del feto durante el embarazo (Rojas-Ceballes et al. 2013). Tabla 20. Estadio de desarrollo de los embriones de Potamotrygon magdalenae en las ciénagas de la cuenca del Magdalena. Fuente: Ramos-Socha (2010). Estadio 1 2 3 4 200 Observaciones Cuerpo traslúcido, contenido alto de saco vitelino, sin dientes desarrollados. Espina caudal ausente. Cuerpo de color café, presencia de saco vitelino, indicios de la espina caudal. Cuerpo con manchas circulares más notables en la región dorsal, presencia de saco vitelino, espina caudal más desarrollada. Cuerpo y cola rígidos, de color oscuro y manchas diferenciadas. Desarrollo de dientes y espina caudal. Sin saco vitelino. Potamotrygon magdalenae Potamotrygon magdalenae FAMILIA POTAMOTRYGONIDAE a. b. c. d. Figura 41. Diferentes estadios de embriones y neonatos de Potamotrygon magdalenae. a) embriones en desarrollo; b) neonatos con saco vitelino (5,85 ± 0,07g y 115 ± 7,07 mm de LT; 43,5 mm AD); c) neonatos sin saco vitelino (85 mm AD estado 4); d) neonato completamente desarrollado, pigmentado, con dientes y espina caudal (parte inferior). Fotos: Semillero Yuma Challwani - Universidad Surcolombiana. Aspectos pesqueros Método de captura. Manualmente con fines ornamentales. Cae accidentalmente en atarrayas, trasmallos y chinchorros (Figura 42). Los pescadores del alto Magdalena usan mallas cuyas dimensiones varían de acuerdo a la profundidad de las ensenadas (2 m, 3 m y 5 m) (Figura 43). Son conocidos como “peludos”, debido a la fibra con la que Lasso et al. son elaboradas puesto que confiere la mayor resistencia, además de ser específicas para la captura de la raya de río. Comercialización y exportación. Según Perdomo-Núñez (2005) esta era la especie de raya de mayor demanda como pez ornamental y se estima que el 60-70% de las rayas exportadas, correspondían a esta especie. De acuerdo al Incoder, en el 2009 se exportaron 14.621 individuos cuyos principales sitios de captura fueron la Cié- 201 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE a. b. Figura 42 (a-b). Capturas incidentales de Potamotrygon magdalenae en el embalse de Betania. Fotos: Semillero Yuma Challwani - Universidad Surcolombiana. naga Grande de Santa Marta, el embalse del Gúajaro, pequeñas ciénagas o lagunas cercanas al aeropuerto de Barranquilla, así como en el embalse de Prado (Tolima). Se venden en la ciudad de Bogotá a un precio de $20.000 (individuos juveniles) (Lasso obs. pers. abril 2013). Para el sector del alto Magdalena, el producto se comercializa regionalmente en los puertos Seboruco, Momico, Betania, Brisas del Magdalena y Coovenpesca (Neiva) (Tabla 21). El producto se comercializa entero directamente en puerto y como subproducto el aceite de hígado, el cual se extrae artesanalmente (Figura 44). Tabla 21. Principales puertos de comercialización de Potamotrygon magdalenae para el sector del alto Magdalena. Localidad Municipio de Neiva 202 Puntos de comercialización Puerto Brisas del Magdalena Covenpesca Coordenadas Altura 02°55’46,8¨ N 75°17’48,3¨ W 493 m s.n.m. 02°55’34¨ N 75°17’38¨ W 493 m s.n.m. Municipio de Hobo Puerto Momico 02°36’0,84¨ N 75°28’162¨ W 570 m s.n.m. Municipio de Campoalegre Puerto Seburoco 02°41’39,1¨ N 75°25’22¨ W 570 m s.n.m. Potamotrygon magdalenae Potamotrygon magdalenae FAMILIA POTAMOTRYGONIDAE a. b. c. d. e. f. Figura 43. Secuencia de captura de Potamotrygon magdalenae. a) Identificación de los puntos de avistamiento por parte de los pescadores; b) preparación para tender la malla “peludo” de orilla a mitad de la ensenada; c) postura de la red; d) captura de Potamotrygon magdalenae; e) manipulación de la especie para evitar accidentes; f) raya lista para desenredar de la malla. Fotos: Semillero Yuma Challwani - Universidad Surcolombiana. Lasso et al. 203 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Amenazas Es un recurso de doble propósito, ornamental y consumo (subsistencia), lo cual puede potenciar las amenazas sobre las poblaciones (Lasso et al. 2011). Aunque es una especie abundante, su extracción con fines ornamentales es muy alta si se compara la cuota de exportación de otras especies del mismo género en Colombia y países vecinos. Todos los impactos sobre la cuenca del Magdalena aplican para esta especie (vertimientos de agroquímicos, metales pesados, desecamiento de humedales, aguas negras, deforestación, entre otros). Especial mención requiere la construcción de embalses en la cuenca que fracciona las poblaciones e interrumpe el flujo genético (Lasso et al. 2012). Como en otras especies de rayas, la pesca incidental trae consigo la muerte de la raya o la mutilación de la cola para dejarla sin la espina o aguijón caudal. En la Ciénaga del Sabayo (departamento del Magdalena), no tienen ningún interés ni uso, pero al caer en las artes de pesca los pescadores las desechan en las orillas de la ciénaga donde mueren, ya que según ellos interfieren en la captura de otras especies de interés comercial (Ramos-Socha y Grijalba-Bendeck 2011). Conservación Oportunidades de conservación. Considerada con prioridad muy alta en el PAN tiburones-rayas (Caldas et al. 2010). Medidas de conservación propuestas. Fortalecer el sistema de registro y seguimiento de las capturas (consumo y ornamentales) y exportaciones de rayas dulceacuícolas, que genere estadísticas confiables (Caldas et al. 2010). Además, regular la exportación mediante asignación de cuotas basadas en criterios científicos de abundancia en su medio natural, definición de áreas prioritarias para su conservación (por ejemplo, reservas de pesca) a través de planes de manejo conjunto con pescadores, acopiadores y exportadores. Apoyar estudios de reproducción en cautiverio (Lasso et al. 2012). Es importante motivar el consumo de la especie en aquellas localidades donde se realiza su captura como pesca incidental (p. e. ciénaga del Sabayo, Magdalena), donde actualmente se pierde y desecha dicha fuente de proteína. En la figura 45 se muestran algunos patrones de coloración de la espécie. Referencia de identificación Miles (1971), Rosa (1985), Lasso et al. (2011). 204 Potamotrygon magdalenae Potamotrygon magdalenae FAMILIA POTAMOTRYGONIDAE a. b. c. d. e. f. Figura 44. Secuencia de la extracción de aceite de hígado de Potamotrygon magdalenae. a) Ubicación del hígado en la raya; b) corte del hígado; c) colocación en una tapa de olla e inclinación para su exposición al sol -con el objeto de acelerar la extracción, se coloca detrás de la estufa a fuego lento-; d) empaque del aceite; e) presentación para comercialización en Betania; f) presentación para comercialización por onzas. Fotos: Semillero Yuma Challwani - Universidad Surcolombiana. Lasso et al. 205 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE a. b. c. d. e. f. Figura 45. Potamotrygon magdalenae. a) vista ventral macho maduro, ciénaga de Zapatosa, Magdalena; b) San Pablo, Magdalena; c) juvenil del medio Magdalena; d) río Atrato; e) Ciénaga de Sabayo, Magdalena; f) juveniles mostrando tres patrones de coloración, ciénaga de Sabayo. Fotos: G. Gálvis (a, b), M. Salcedo (c), J. Maldonado (d), H. Ramos (e, f). Autores Carlos A. Lasso, Paula Sánchez-Duarte, Claudia Milena Rodríguez Sierra, Marcela GrijalbaBendeck, Lina M. Ortiz-Arroyave y Herly B. Ramos-Socha. 206 Potamotrygon magdalenae Potamotrygon marinae FAMILIA POTAMOTRYGONIDAE Potamotrygon marinae Deynat 2006 Nombre común y/o indígena No conocidos. Estatus de conservación Categoría global IUCN: no evaluada. Caracteres distintivos Dorso del disco, aletas pélvicas y cola oscuras, entre marrón y negro, con numerosas manchas grandes anaranjadas o marrones, algo borrosas. Una sola fila de espinas regulares sobre la parte dorso-anterior de la cola. Cola pequeña. Ojos 1 a 5 veces más pequeños que los espiráculos. Surcos labiales presentes. Dientes pequeños, los centrales más robustos. Talla y peso Se examinaron cuatro individuos (3 H : 1 M), con tallas de 234 a 390 mm AD (Tabla 22). No hay datos de peso. . Distribución geográfica Países: Guayana Francesa y Surinam. Cuencas y subcuencas: Guayana Francesa (ríos Oyapoc, Maroni, Inini y Tampoc), Surinam (río Lawa y drenaje del Marowini). Tabla 22. Datos y relaciones morfométricas para adultos (n=4) de Potamotrygon marinae. Ancho del disco (AD), longitud del disco (LD). Estadio de desarrollo (proporción de sexos) Adultos (1 H : 3 M) da Silva et al. Intervalo (mm) Promedio (mm) AD LD AD LD 234 - 390 263 - 433 310,8 340,3 % AD AD 100 LD 105,9 207 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Reproducción De acuerdo al examen de material de museo (MNHN), las hembras con una talla superior a 234 mm AD son consideradas adultas; machos con 159 mm AD, juveniles (longitud clasper-LC 18 mm) y con 234 y 297 mm AD, adultos (LC 27 y 80 mm, respectivamente). Por esa razón, la talla de madurez sexual en machos podría estar entre 234 y 297 mm AD. Amenazas Pesca incidental. Referencia de identificación Deynat (2006). Registros de Potamotrygon marinae. Autores João Paulo C. B. da Silva, João Pedro Fontenelle y Marcelo R. de Carvalho. 208 Potamotrygon marinae Potamotrygon motoro FAMILIA POTAMOTRYGONIDAE Potamotrygon motoro (Müller y Henle 1841) Amazonas Nombre común y/o indígena Arraia-pintada, arraia-de-fogo, borô (Brasil), raya motoro, raya motora, raya pintada (Colombia, Venezuela). Sinonimias Trygon mulleri Castelnau 1855, Potamotrygon laticeps Garman 1913, Potamotrygon circularis (en parte) Garman 1913. Estatus de conservación Categoría global IUCN: Datos Insuficientes (Drioli y Chiaramonte 2005); categoría nacional: Vulnerable VU (A4d) (Colombia) (Mojica et al. 2012). Caracteres distintivos Coloración general del dorso y aletas pélvicas gris, marrón o beige, con ocelos de tamaños variables, distribuidos por todo el disco, generalmente tricolores con una mancha central de color amarillo, un ani- Lasso et al. Orinoco llo intermedio anaranjado y otro anillo negro periférico; cola generalmente con pequeñas manchas circulares, desde su base hasta el aguijón o espina caudal. Patrón de coloración dorsal variable en las poblaciones amazónicas, y en algunos lugares como en el Río Negro, los ocelos son un poco más oscuros, mientras que los de las márgenes del disco pueden encontrarse unidos. En la cuenca del Orinoco también se observa una variabilidad cromática importante ya que pueden observarse individuos con el patrón similar a las especies amazónicas brasileñas y tres patrones: a) ocelos con una mancha central grande (aunque a veces pueden ser dos más pequeñas), de color amarillo o anaranjado, rodeados de un anillo negro; b) una mancha central pequeña, negra, rodeada por un anillo grande amarillo o anaranjado, este último rodeado también por otro anillo negro; c) una mancha negra grande con dos a cinco manchas amarillas mas peque- 209 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE ñas en su interior. Una sola hilera dorsal de espinas puntiagudas en la cola, y de una a dos hileras de espinas laterales, desde la base de la cola hasta el aguijón. Distancias interespiracular e interorbital proporcionalmente largas, alredor de 15-16% del ancho de disco (AD) y 22-25% del largo del disco (LD), respectivamente. Boca relativamente ancha, entre 9-12% AD. Surcos labiales ausentes. Dientes largos y sin punta, excepto en machos adultos, con 18 a 39 filas longitudinales en la mandíbula superior. Referencia de identificación Rosa (1985), Loboda (2010). Distribución geográfica Descrita originalmente de la cuenca del río Paraguay, Potamotrygon motoro está presente prácticamente en todas las áreas bajas de la cuenca del Amazonas, desde el cauce principal del río Solimões/Amazonas, hasta a sus afluentes principales. No se encuentra en las partes más altas de la mayoría de los tributarios amazónicos, limitados por grandes cascadas, saltos y/o caídas de agua. Presente también en la cuenca amazónica de Colombia, Venezuela (Río Negro), Ecuador, Perú y Bolivia. En Brasil, también está presente en las cuencas de los ríos Mearim y Parnaíba (Maranhão) y en Argentina y Uruguay, en la cuenca de río Paraná. En Venezuela y Colombia se distribuye también en la cuenca del Orinoco. Debido a su amplia distribución, Rosa et al. (2010) sugirieron que Potamotrygon motoro posiblemente incluya un complejo de especies, hecho confirmado parcialmente por los estudios citogenéticos de García-Villamil et al. (Capítulo 6.1), donde los individuos de la cuenca amazónica se encuentran separados de las del Orinoco. Sin embargo, Loboda (2010) mediante un 210 análisis morfológico, refuta que P. motoro sea un complejo de especies, sino una única especie con distribución geográfica amplia y diferencias entre las poblaciones (p. e. la coloración). Introducida en Singapur (Ng et al. 2010). Países: Argentina, Bolivia, Brasil, Colombia, Ecuador, Guyana, Paraguay, Perú, Uruguay y Venezuela. Cuencas: Argentina (Paraná), Bolivia (Amazonas), Brasil (Amazonas, Mearim y Parnaíba), Colombia (Amazonas y Orinoco), Ecuador (Amazonas), Guyana (Essequibo), Paraguay (Paraná), Perú (Amazonas), Uruguay (Paraná) y Venezuela (Amazonas, Essequibo y Orinoco). Subcuencas: Amazonas (Abacaxi, Aguarico, Aracará, Araguaia, Ariari, Aripuanã, Branco, Camatia, Capahuari, Caquetá, Cuiabá, Conambo, Corrientes, Curaray, Curuá, Cuyabeno, Huasaga, Imuya, Jatuncocha, Jivino, Lagartococha, Liquino, Madre de Dios, Manu, Marañón, Morona, Nanay, Napo, Nashiño, Negro, Pacaya, Pará, Pintoyaco, Potro, Purus, Putumayo, Solimões, Tarauacá, Tapajós, Tefé, Teteya, Tiputini, Tiquié, Tivacuno, Tocantins, Trombetas, Uatuma, Ucayali, Xingú y Yanayacu); Essequibo (Cuyuní); Orinoco (Apure, Arauca, Atabapo, Bita, Casanare, Cravo Norte, Cinaruco, Cusay, Ele, Inírida, Manapiare, Meta, Orinoco, Tame, Tomo, Ventuari); Paraná (Gerónimo). CUENCA DEL ORINOCO Talla y peso Colombia y Venezuela. Se examinaron 90 individuos (79 H : 11 M), provenientes de los ríos Atabapo, Bita, Cinaruco, Iníri- Potamotrygon motoro Potamotrygon motoro FAMILIA POTAMOTRYGONIDAE Registros de Potamotrygon motoro. da, Manapiare, Orinoco (Puerto Carreño), Tomo y Ventuari, incluyendo seis neonatos, 114 juveniles y 70 adultos (Tabla 23). Para las hembras el mayor AD registrado fue 395 mm con un peso de 2,6 kg, pero otra hembra con menor AD (365 mm), registró un mayor peso (3,5 kg). Para los machos el mayor AD registrado fue 442 mm con un peso de 4,2 kg (Figuras 46 a y b). Para estas muestras los machos alcanzan un ancho discal y un peso mayor al de las hembras. Hábitat Típica de ríos de aguas claras y negras, muy ocasionalmente en aguas blancas, tanto en el cauce de los grandes ríos y caños como en zonas de inundación (Lasso y Sánchez-Duarte 2012b). Lasso et al. Alimentación Carnívora: entomófaga – carcinófaga - ictiófaga. Colombia. N = 82 (31). Se registró el consumo de insectos como ítem predominante, con Díptera (58,5%) y Ephemeroptera (26,3%) como los grupos más representativos en relación al IIR, los otros cuatro grupos de insectos aportaron el 9,5%. De los crustáceos se registró el orden Decapoda (5,2%) y entre los peces se observaron individuos de los órdenes Characiformes, Siluriformes y Perciformes que representaron el 0,5% del IIR (Figura 47). Venezuela. N=2 (2). Los camarones (Palaemonidae) fueron el ítem más importante según el IIR (32,2%), seguido de 211 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Tabla 23. Datos y relaciones morfométricas neonatos (n=6), juveniles (n=114) y adultos (n=70) de Potamotrygon motoro de la cuenca del río Orinoco (Colombia y Venezuela). Ancho del disco (AD). Estadio de desarrollo (proporción de sexos) Intervalo (mm) Promedio (mm) % AD AD LD AD LD AD LD Neonatos (2 H : 4 M) 71 - 120 84 - 128 100,3 112 102,8 111,6 Juveniles (61 H : 53 M) 121 - 242 131 - 281 185,3 206,6 103,2 111,5 Adultos (16 H : 54 M) 250 - 490 260 - 520 342,5 365 103,4 106,5 a. b. Figura 46. Relación talla (ancho discal)-peso de Potamotrygon motoro; a) machos (n=57); b) hembras (n=51). Cuenca del río Orinoco (Colombia y Venezuela). 212 Potamotrygon motoro Potamotrygon motoro FAMILIA POTAMOTRYGONIDAE Figura 47. Índice de importancia relativa (% IIR) de los ítems consumidos por 31 ejemplares de Potamotrygon motoro. Cuenca del Orinoco. los peces (Gymnotiformes, Loricariidae, Doradidae) (30,6%) y los insectos (Ephemeroptera, Odonta, Trichoptera) (21,4%). Reproducción Colombia. En la región de Puerto Carre- ño (laguna El Pañuelo y caño Dagua), se registraron hembras grávidas en marzo. Los datos de las hembras y los embriones se muestran en la tabla 24 y figura 48 a-c. La fecundidad ovárica (n = 3) varió entre uno y cuatro óvulos (Tabla 24). Lasso et al. Dos hembras colectadas en febrero en el río Inírida, con AD 380 y 400 mm, abortaron tres y seis embriones, respectivamente. Los embriones tuvieron en promedio 60 mm AD (Figura 48 d-e). Tabla 24. Datos sobre hembras grávidas y sus embriones. Orinoquia colombiana. AD (mm) 225 280 365 417 Peso (kg) 0,7 0,9 3,5 3,1 n embriones 1 1 7 6 AD (mm) 70 110 213 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE a. b. c. d. Figura 48. Embriones de Potamotrygon motoro. a) Embrión abortado por una hembra de 300 mm AD, febrero 2013, río Orinoco, Bojonawi; b) hembra adulta (365 mm AD) con 7 embriones, c) embriones (60 mm AD promedio), abortados por una hembra de 400 AD y d) hembra de 380 mm AD, con tres embriones abortados, febrero 2008, río Inírida, Colombia. Fotos: M. A. Morales-Betancourt (a-b), C. A. Lasso (c, d). Tabla 25. Fecundidad ovárica en ocho hembras de Potamotrygon motoro. Orinoquia colombiana. AD (mm) Fecundidad ovárica (diámetro óvulos - mm) 214 230 280 1 (10) 4 280 2 (10 - 5) En la figura 49 se muestra la relación entre la longitud del clasper versus el ancho del disco para 102 ejemplares provenientes de la Orinoquia colombiana. Se observa la separación de los ejemplares según el estado de desarrollo: neonato, juvenil y adulto. Uso Se captura con fines ornamentales en estadio juvenil o preadulto (Colombia) (Lasso y Sánchez-Duarte 2012b). Potamotrygon motoro Potamotrygon motoro FAMILIA POTAMOTRYGONIDAE Figura 49. Relación proporcional de la longitud del clasper vs. el ancho del disco en 102 ejemplares de Potamotrygon motoro. Orinoquia colombiana. Neonatos (N), juveniles (J), adultos (A). Aspectos pesqueros Método de captura. Manualmente para fines ornamentales. Incidentalmente con anzuelo, calandrio y redes de enmalle. Comercialización y exportación. Es la segunda especie de raya de agua dulce con mayor nivel de extracción y exportación y de la cual se cuenta con registros históricos más fidedignos, aunque probablemente incluya un complejo de especies (Lasso y Sánchez-Duarte 2012b). Durante los últimos 12 años se exportaron 81.109 ejemplares, distribuidos como se muestra en la tabla 26 (Incoder 2012). Hay datos de movilización de individuos desde Inírida para los años 2007 (3635 ind.), 2008 (7474 ind.), 2009 (2179 ind.) y 2010 (1260 ind.). Desde Puerto Carreño la movilización fue para 2007 (610 ind.), 2008 (533 ind.), 2009 (497 ind.) y 2010 (75 ind.). Lasso et al. Tabla 26. Número de ejemplares de Potamotrygon motoro exportados desde Colombia en el periodo 1999 - 2011. Fuente: Incoder (2012). Año n ejemplares 1999 266 2000 1.624 2001 2.756 2002 3.445 2004 2.296 2005 4.322 2006 6.267 2007 11.253 2008 20.200 2009 12.146 2010 6.889 2011 9.645 215 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Durante el periodo antes mencionado (5 años), Colombia exportó Potamotrygon motoro a seis países: Alemania, Estados Unidos, Hong Kong, Japón, Tailandia y Taiwan. La mayor exportación se produjo en el 2011 hacia Hong Kong con 8648 ejemplares (Figura 50). En la comunidad de Yurí (región de la Estrella Fluvial de Inírida) se capturan 5 ind./semana por pescador de Potamotrygon motoro. Según los pescadores, la mejor época de oferta natural es de noviembre a febrero y se pesca de 18:00 a 6:00. Las rayas son pagadas en el sitio a $8.000. En la comunidad de Santa Rosa se pesca la misma cantidad de ejemplares pero tienen un valor de $10.000 a $15.000 y la época de mayor oferta natural es de agosto a abril. La faena de pesca diurna se extiende desde las 8:00 a las 13:00 horas y la nocturna de las 18:00 a las 3:00 horas. En ambas comunidades se compran los ejemplares a crédito (Franco et al. 2013). Amenazas Recurso pesquero ornamental muy importante, siendo la segunda especie más exportada de Colombia. La mayor amenaza en la Orinoquia es la extracción desmedida de individuos inmaduros (juveniles) y en ocasiones adultos para el mercado negro asiático como reproductores (Lasso y Sánchez-Duarte 2012b). Conservación Oportunidades de conservación. Considerada con prioridad alta en el PAN tiburones-rayas (Caldas et al. 2010). Medidas de conservación propuestas. Fortalecer el sistema de registro y seguimiento de las capturas de consumo y ornamentales y exportaciones de rayas dulceacuícolas, que genere estadísticas confiables (Caldas et al. 2010). Regular la exportación mediante asignación de cuotas basadas en criterios científicos de Figura 50. Principales países que importaron ejemplares de Potamotrygon motoro. Periodo 2007 – 2011. Fuente: Incoder (2012). 216 Potamotrygon motoro Potamotrygon motoro FAMILIA POTAMOTRYGONIDAE abundancia en su medio natural. Definir áreas prioritarias para su conservación (por ejemplo, reservas de pesca) a través de planes de manejo conjunto con pescadores, acopiadores y exportadores. Promover la reproducción en cautiverio. Prohibir la exportación de individuos adultos como posibles parentales. Regulación conjunta de vedas y tallas con países limítrofes (Brasil, Perú, Ecuador) y especialmente con Venezuela, de donde vienen muchos individuos por contrabando (Lasso y Sánchez-Duarte 2012b). Autores Carlos A. Lasso, Paula Sánchez-Duarte, Mónica A. Morales-Betancourt, Lina M. OrtizArroyave, Oscar M. Lasso-Alcalá, María T. Sierra-Quintero y Juliana Agudelo. Potamotrygon motoro, río Ventuari, Venezuela. Foto: O. M. Lasso-Alcalá Lasso et al. 217 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE tonces un ancho discal y un peso mayor al de los machos. CUENCA DEL AMAZONAS Talla y peso Colombia, Ecuador y Perú. Se exami- naron 77 individuos (37 H : 40 M), 55 provenientes del Amazonas colombiano (28 H : 27 M), seis del Amazonas ecuatoriano (3 H : 3 M) y 14 del Amazonas peruano (5 H : 9 M). De estos, 11 fueron neonatos, 32 juveniles y 34 adultos (Tabla 27). Para los machos se registró un ancho de disco máximo (AD) de 52 cm, correspondiente a un peso de 7,3 kg (Colombia, río Putumayo) (Figura 51a). Para las hembras se registró un máximo de 62,5 cm AD con un peso de 11 kg (Colombia, río Putumayo) (Figura 51b). Las hembras alcanzan en- Para Ecuador se reporta una talla promedio para machos de 32 cm AD y un peso promedio de 17,8 kg y para hembras, 28 cm AD con un peso de 16,5 kg (Barriga obs. pers.). Brasil. En la Amazonia brasileña los ejemplares adultos alcanzan en promedio 40 cm AD y una longitud total de 65 a 70 cm, con un peso entre 10-20 kg (Tabla 28); aunque Cramer (obs. pers.) observó una hembra de 28 kg del río Guaporé. Se examinaron 66 individuos (37 H : 29 M). De estos, siete fueron neonatos, 34 Tabla 27. Datos y relaciones morfométricas para neonatos (n=11), juveniles (n=32) y adultos (n=34) de Potamotrygon motoro para la cuenca del río Amazonas en Colombia, Ecuador y Perú. Ancho del disco (AD), longitud del disco (LD). Estadio de desarrollo (proporción de sexos) Intervalo (mm) Promedio (mm) % AD AD LD AD LD AD LD 74,5 - 120 87 - 130 101,8 112,3 102,3 110,4 Juveniles (15 H : 17 M) 123 - 248 138 - 275 176,3 189,6 105,1 107,5 Adultos (17 H : 17 M) 260 - 695 347 376 106,7 108,4 Neonatos (5 H : 6 M) 250 - 625 Tabla 28. Datos y relaciones morfométricas para neonatos (n=14), juveniles (n=23) y adultos (n=23) de Potamotrygon motoro en la Amazonia brasileña. Ancho del disco (AD), longitud del disco (LD). Estadio de desarrollo (proporción de sexos) 218 Intervalo (mm) AD Promedio (mm) % AD LD AD LD AD LD Neonatos (8 H : 6 M) 87 - 112 94 - 182 128 133,6 100 104,4 Juveniles (16 H : 7 M) 169 - 265 178 - 280 219 233,1 100 106,5 Adultos (11 H : 12 M) 255 - 518 276 - 585 351,3 383,2 100 108,3 Potamotrygon motoro Potamotrygon motoro FAMILIA POTAMOTRYGONIDAE a. b. Figura 51. Relación talla (ancho discal)-peso de Potamotrygon motoro, a) machos (n=29); b) hembras (n=30). Cuenca del río Amazonas (Colombia, Ecuador y Perú). juveniles y 25 adultos (Tabla 29). Para las hembras el mayor AD registrado fue de 518 mm y para los machos el mayor AD registrado fue de 427 mm. Para este material no hay datos de peso. Ecuador. Colectadas en el río y en las Hábitat lagunas del bosque de inundación. En los primeros sobre playas y en las segundas sobre cieno cubierto con vegetación acuática y corriente lenta. La profundidad de los sitios de colección no fue mayor a los 2,5 m (Barriga obs. pers.). Brasil. En la desembocadura del río Ama- Alimentación zonas (isla de Marajó), P. motoro es la especie más abundante, representando el 50,3% de la abundancia total de rayas de agua dulce y el 60,5% de la biomasa general (Almeida et al. 2009). Sánchez-D. et al. Carnívora: entomófaga – carcinófaga ictiófaga. Brasil. En la isla de Marajó, muestra un amplio espectro en su dieta, incluyendo 219 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Tabla 29. Datos y relaciones morfométricas para neonatos (n=7), juveniles (n=34) y adultos (n=25) de Potamotrygon motoro del material examinado de la Amazonia brasileña. Ancho del disco (AD), longitud del disco (LD). Estadio de desarrollo (proporción de sexos) Intervalo (mm) Promedio (mm) % AD AD LD AD LD AD LD 87 - 119 94 - 126 105 110,9 101,3 105,6 Juveniles (21 H : 13 M) 126 - 265 129 - 265 201,2 212,6 103,9 105,7 Adultos (12 H : 13 M) 276 - 585 346.2 373.1 103 95.7 Neonatos (4 H : 3 M) 255 - 518 insectos, moluscos, crustáceos, anélidos y peces. Los crustáceos decápodos y peces fueron respectivamente, el primer y segundo ítem alimenticio más importante (Almeida et al. 2010). Para Ecuador se reporta una talla de maduración para machos de 380 mm AD y para hembras de 340 mm AD. El número de embriones reportado es de 5 a 10 (Barriga obs. pers.). Colombia. N = 15 (9). Se registró el consu- En la figura 54 se muestra la relación entre la longitud del clasper versus el ancho del disco para 33 machos provenientes de la cuenca del río Amazonas en Colombia, Ecuador y Perú. Se observa la separación de los ejemplares según el estado de desarrollo: neonato, juvenil y adulto. mo de insectos como ítem predominante, siendo los grupos Ephemeroptera (55,5%) y Diptera (43%) los más representativos en relación al IIR, los otros dos grupos de insectos aportaron el 0,2%. Del grupo de los crustáceos se registró el orden Decapoda (0,4%) y entre los peces el aporte fue del 0,8% del IIR (Figura 52). Reproducción Colombia, Ecuador y Perú. En el río Putumayo, en noviembre, una hembra de 270 mm AD y 1 kg, registró una fecundidad ovárica de cinco óvulos (Figura 53). En el río Amazonas, en la región de Leticia, en febrero, se registraron hembras maduras a partir de 300 mm AD y 1,1 kg de peso. Durante la época de ascenso de aguas (enero) se observó una hembra adulta: con cuatro crías nadando encima de la madre, sobre la superficie del canal que comunica el río Loreto Yacu con el lago Tarapoto (Trujillo com. pers.) 220 Brasil. En la Amazonia (cuenca del Río Negro) se han observado nacimientos durante cuatro meses de la época de lluvias, tras un periodo de gestación de seis meses (la maduración gonadal toma de tres a cuatro meses) y la cópula tiene lugar durante la estación de lluvias. La fecundidad ovárica observada fue de 6 a 11 huevos, la uterina de 4 a 11 embriones, así como una talla de madurez sexual de 390 mm AD (machos) y 440 mm AD (hembras) (Charvet-Almeida et al. 2005). Para tres hembras procedentes del río Yavarí (Amazonas), Thorson et al. (1983) registraron camadas de dos, seis y siete crías. Sólo el ovario izquierdo es funcional. Se observó una hembra de 245 mm AD en maduración y un ejemplar de 360 mm AD, ya te- Potamotrygon motoro Potamotrygon motoro FAMILIA POTAMOTRYGONIDAE Figura 52. Índice de importancia relativa (% IIR) de los ítems consumidos por nueve ejemplares de Potamotrygon motoro. Cuenca del Amazonas, Colombia. Figura 53. Gónadas de Potamotrygon motoro, hembra 270 mm AD, río Putumayo. Foto: M. A. Morales-Betancourt. Sánchez-D. et al. 221 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE N Figura 54. Relación proporcional de la longitud del clasper vs. el ancho del disco en 33 ejemplares de Potamotrygon motoro. Cuenca del río Amazonas (Colombia, Ecuador y Perú). Neonatos (N), juveniles (J), adultos (A). nía seis embriones entre 27 y 30 mm AD. Otros datos disponibles para neonatos de la Amazonia, corresponden a dos machos (75 y 87 mm AD) y dos hembras (74 y 94 mm AD). Loboda (datos no publicados) observó hembras con camadas de 15 a 25 crías. En la figura 55 se muestra la relación entre la longitud del clasper y el ancho del disco para 28 ejemplares procedentes de la Amazonia brasileña. Cautiverio A continuación se describen las observaciones basadas en una pareja reproductiva y dos generaciones sucesivas nacidas en el acuario de Belle Isle, Detroit (USA), procedentes de la Amazonia brasileña (Thorson et al. 1983). El apareamiento ocurre principalmente en la noche. El inicio del periodo de la cópula es evidenciado por la aparición de marcas de mordeduras en los bordes del disco de 222 las hembras, periodo durante el cual los márgenes de la cloaca en las hembras se enrojecen e incluso sangran. Una observación en el momento exacto de la cópula mostró que el macho se coloca al lado de la hembra y no sobre ella. Una pareja nacida en cautiverio en 1977, tuvo tres eventos reproductivos (nacimientos) en el mismo año: uno el 5 de marzo, otro entre el 9 y 10 de junio y el tercero entre el 17 y 25 de septiembre, mostrando que el periodo de gestación no es superior a los tres meses. Las hembras en cautiverio tuvieron sus crías a una talla de 330, 350 y 355 mm AD. La maduración en las hembras parece ocurrir entre los 240-320 mm AD. Para los machos, aunque sólo presentaran datos de individuos inmaduros, los autores estimaron la madurez sexual entre los 200 a 250 mm AD (Thorson et al. 1983). Thorson et al. (op. cit.) señalan que del total de los 27 nacimientos observados tanto en cautiverio como en campo, la frecuencia de machos fue del 55,6% y las hembras 44,4%. Potamotrygon motoro Potamotrygon motoro FAMILIA POTAMOTRYGONIDAE N Figura 55. Relación proporcional de la longitud del clasper vs. el ancho del disco en 28 ejemplares provenientes de la Amazonia brasileña. N (neonatos), J (juveniles) y A (adultos). Basado en ejemplares de museos (CAS, INPA, MNRJ, MPEG, MZUSP). Uso Amenazas Colombia. Se aprovecha como ornamen- No registradas, probablemente la sobrepesca en algunas localidades. Brasil. Pesquero, alimento y ornamental. Conservación Aspectos pesqueros Colombia. Las mismas oportunidades y medidas de conservación tomadas y propuestas para la especie en la Orinoquia. tal en Leticia. Método de captura Brasil. El método de captura más frecuente con fines alimenticios es el palangre, aunque también se usan lanzas o arpones. Para aprovechamiento ornamental, se captura con redes de mano en las riberas de los ríos (Loboda obs. pers.). En las figuras 56 (a-l) y 57 (a-k) se muestran diferentes patrones de coloración observados en las cuencas del Orinoco, Amazonas y Essequibo. Autores Paula Sánchez-Duarte, Carlos A. Lasso, Lina M. Ortiz-Arroyave, Mónica A. MoralesBetancourt (Colombia), Thiago Loboda, Marcelo R. de Carvalho (Brasil), Astrid AcostaSantos, Edwin Agudelo-Córdoba, Cesar A. Bonilla-Castillo, Guber A. Gómez-Hurtado (Colombia), Ramiro Barriga (Ecuador) y Hernán Ortega (Perú). Sánchez-D. et al. 223 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE a. b. c. d. e. f. Figura 56. Potamotrygon motoro. a) Río Ventuari, Venezuela; b) río Cinaruco, Venezuela; c) hembra adulta, río Inírida, Colombia; d) hembra adulta (vista ventral); e) macho adulto, sin cola, caño Chorrobocón, río Inírida; f) hembra adulta en su hábitat natural, río Inírida; 224 Potamotrygon motoro Potamotrygon motoro FAMILIA POTAMOTRYGONIDAE g. h. i. j. k. l. Figura 56. Continuación. Potamotrygon motoro. g, h, i) macho adulto, caño Dagua, Orinoquia colombiana; j) río Inírida; k) individuo en su hábitat natural, PNN El Tuparro, Colombia; l) río Cuyuní, cuenca Essequibo, Venezuela. Fotos: O. M. Lasso-Alcalá (a, l), C. Montaña (b), C. A. Lasso (c-f), M. A. Morales-Betancourt (g- j), A. Trujillo (k). Sánchez-D. et al. 225 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE a. b. c. d. e. f. Figura 57. Potamotrygon motoro. a) Patrón de coloración 1; b) patrón 2; c) patrón 3 (centro de acopio, Pto. Carreño), Orinoquia colombiana; d) río Amazonas, Pto. Nariño, Colombia, e) dos patrones cromáticos, río Putumayo; f) río Putumayo. 226 Potamotrygon motoro Potamotrygon motoro FAMILIA POTAMOTRYGONIDAE g. h. i. j. k. l. Figura 57. Continuación. Potamotrygon motoro. g) río Putumayo; h) río Yarí, Perú; i) río Curaray, Amazonia ecuatoriana; j) río Solimões, Brasil; k) río Tuputini, Amazonas ecuatoriano; l) hembra (29 kg) río Guaporé, Brasil. Fotos: F. Trujillo (a-c), M. A. Morales-Betancourt (e-g), A. Acosta-Santos (d), M. Hidalgo (h), I. Jacomé (i), M. D. Escobar (j), R. Barriga (k), C. Cramer (l). Sánchez-D. et al. 227 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Potamotrygon orbignyi (Castelnau 1855) Amazonas Nombre común y/o indígena Raya tigrita, raya pintada, raya común (Colombia, Venezuela); arraia (Brasil). Estatus de conservación Categoría global UICN: Preocupación Menor (Góes de Araújo et al. 2009); categoría nacional: Casi Amenazada NT (Colombia) (Mojica et al. 2012). Caracteres distintivos Se distingue de las otras especies de Potamotrygon por la siguiente combinación de caracteres. Fondo de la superficie dorsal del disco de color marrón oscuro a negro, con un patrón reticulado beige, marrón y/o negro, formando manchas hexagonales o redondeadas grandes, en ocasiones dispuestas de manera aleatoria como rosetas o manchas redondas grandes. Este patrón es más marcado en ejemplares de aguas claras y negras que en los provenientes de aguas blancas y tiende a difuminarse 228 Orinoco más en individuos de mayor talla (Lasso obs. pers.). Dorso de la cola con bandas verticales transversales oscuras o negras, ventralmente estas son blanquecinas. Boca pequeña, provista de cinco papilas bucales; surcos labiales bien marcados y evidentes. Dientes pequeños, tricúspides, con coronas trapezoides en machos juveniles y hembras, monocúspides triangulares en machos adultos. Dorso del disco con tubérculos submarginales en algunos individuos; espinas grandes y puntiagudas dirigidas posteriormente, con bases redondeadas. Cola con espinas dorsales dispuestas generalmente en una sola fila regular, en ocasiones irregular y muy raro en dos filas. Rosa et al. (2010) mencionan que P. orbignyi podría corresponder a un complejo de especies distribuido en diferentes cuencas hidrográficas. Las especies de la cuenca del Orinoco tienen una mancha negra u oscura a modo de “ceja” situada detrás de los ojos y espiráculos. Potamotrygon orbignyi Potamotrygon orbignyi FAMILIA POTAMOTRYGONIDAE Talla y peso Otra prueba, ya más del tipo biológico, que apoyaría esta hipótesis, estaría relacionada con la diferencia entre las tallas y pesos tan diferentes que alcanza en las cuencas del Orinoco y Amazonas (Lasso obs. pers.). Silva (2009) realizó una revisión morfológica y taxonómica del complejo Potamotrygon orbignyi. Amazonas Brasil. En la cuenca del río Tocantins se examinaron 129 individuos (57 H: 72 M), incluyendo 94 juveniles y 35 adultos, donde las hembras alcanzaron 460 mm AD con un peso de 6,4 kg y los machos 370 Tabla 30. Datos y relaciones morfométricas para juveniles (n=94) y adultos (n=35) de Potamotrygon orbignyi de la cuenca del río Tocantins (Brasil). Ancho del disco (AD), longitud del disco (LD). Estadio de desarrollo (proporción de sexos) Intervalo (mm) Promedio (mm) % AD AD LD AD LD AD LD Juveniles (40 H : 54 M) 139 - 250 - 197,5 - 102,5 - Adultos (17 H : 18 M) 252 - 460 - 302,4 - 102,5 - mm AD y 3,9 kg. (Tabla 30). Sin embargo, la mayor parte de la población se encuentra entre los 140 y 280 mm AD. Las hembras alcanzan un ancho discal y un peso mayor al de los machos, con cerca de un 60% más de peso (Figura 58). Silva (2009) examinó 291 individuos (121 H : 170 M), donde el ancho de disco varió entre 112 a 475 mm (machos) y de 91 a 610 mm (hembras). En el río Tocantins, Rincon-Filho (2006) examinó 84 individuos (47 H : 37 M) y registró tallas entre 153 a 371 mm AD (machos) y 150 a 460 mm AD (hembras). Orinoco Colombia. Se examinaron 62 individuos (33 H : 29 M), provenientes de los ríos Bita, Orinoco y Orotoy. De estos, tres fueron neonatos, 29 juveniles y 30 adultos, según Lasso et al. la talla de madurez establecida para esta cuenca (hembras 185 mm AD y machos 230 mm AD) (Lasso et al. 1996) (Tabla 31). Para las hembras el mayor AD registrado fue 530 mm con un peso de 6,3 kg y para los machos el mayor AD fue 310 mm con un peso de 1,5 kg (Figura 59). Las hembras alcanzan un ancho discal y un peso mayor al de los machos. Venezuela. Estudios previos (Lasso et al. 1996), mostraron que las hembras alcanzaban un AD máximo de 325 mm con un peso de 2 kg y los machos 290 mm AD y 1,4 kg (Tabla 32). Sin embargo, muestras adicionales disponibles (64 H : 61 M) y analizadas posteriormente (2013), mostraron resultados novedosos y nuevos record de talla y peso para esta especie (Lasso datos no publicados). Se examinaron 125 individuos (64 H : 61 M), de los cuales 16 fueron 229 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE a. b. Figura 58. Relación talla (ancho discal)- peso de Potamotrygon orbignyi, a) machos (n=54); b) hembras (n=48). Río Tocantins. Tabla 31. Datos y relaciones morfométricas para neonatos (n=3), juveniles (n=29) y adultos (n=30) de Potamotrygon orbignyi de la cuenca del río Orinoco (Colombia). Ancho del disco (AD), longitud del disco (LD). Estadio de desarrollo (proporción de sexos) Promedio (mm) % AD AD LD AD LD AD LD 81 - 90 83 - 101 86,3 93 100,2 107,7 Juveniles (12 H : 17 M) 100 - 220 110 - 240 161,2 171,1 105,6 106,8 Adultos (18 H : 12 M) 240 - 370 288,2 311,7 99,5 111,4 Neonatos (3 H) 230 Intervalo (mm) 230 - 530 Potamotrygon orbignyi Potamotrygon orbignyi FAMILIA POTAMOTRYGONIDAE a. b. Figura 59. Relación talla (ancho discal)-peso de Potamotrygon orbignyi, a) machos (n=29); b) hembras (n=34). Cuenca del río Orinoco (Colombia). juveniles y 109 adultos (Tabla 33). Así, se observó que las hembras pueden alcanzar mayor talla, 770 mm AD con un peso de 26,5 kg (caso de una hembra con 11 embriones intrauterinos); otra hembra (no grávida) alcanzó 560 mm AD y 12 kg (Figura 60a). En el caso de los machos también hay nuevos record, con tallas de 490 Lasso et al. mm AD (5,8 kg), aunque machos menores (460 y 475 mm AD), alcanzaron también 5,8 kg (Figura 60b). Guayana Francesa La información disponible sobre el AD y LD de ejemplares de museo (BMNH) se muestra en la tabla 34. 231 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Tabla 32. Datos y relaciones morfométricas para neonatos (n=2), juveniles (n=2), individuos en maduración sexual (n=11) y adultos (n=2) de la cuenca del río Orinoco (Venezuela). Fuente: Lasso et al. (1996). Ancho del disco (AD), longitud del disco (LD). Estadio de desarrollo (proporción de sexos) Intervalo (mm) Promedio (mm) % AD AD LD AD LD AD LD 105 - 106 115 105 115 100 109 140 120 - 142 125,3 129 100 102,9 En maduración sexual (7 H : 4 M) 185 - 290 192 - 315 260,7 280,7 100 107,7 Adultos (2 H) 335 - 340 310 337,5 100 108,9 Neonatos (1 H : 1 M) Juveniles (2 M) 310 a. b. Figura 60. Relación talla (ancho discal)- peso de Potamotrygon orbignyi, a) machos (n=61); b) hembras (n=64) provenientes del río Orinoco (Venezuela). 232 Potamotrygon orbignyi Potamotrygon orbignyi FAMILIA POTAMOTRYGONIDAE Tabla 33. Datos y relaciones morfométricas para juveniles (n=16) y adultos (n=109) de Potamotrygon orbignyi de la cuenca del río Orinoco (Venezuela). Ancho del disco (AD), longitud del disco (LD). Estadio de desarrollo (proporción de sexos) Intervalo (mm) Promedio (mm) % AD AD LD AD LD AD LD Juveniles (2 H : 14 M) 165 - 216 - 192,3 - 100,8 - Adultos (62 H : 47 M) 196 - 770 - 326,8 - 109,2 - Tabla 34. Ancho discal (AD) y longitud discal (LD) para tres ejemplares de Potamotrygon orbignyi de la Guayana Francesa (río Approuague). AD (mm) 174 179 179 LD (mm) 180 185 189 Guyana La información disponible sobre el AD y LD basada en ejemplares de museo (AMNH, FMNH, UMMZ) se muestra en la tabla 35. Tabla 35. Ancho discal (AD) y longitud discal (LD) para cinco ejemplares de Potamotrygon orbignyi de Guyana (río Essequibo). AD (mm) 145 146 172 184 245 Lasso et al. LD (mm) 156 155 188 198 267 Surinam La información disponible sobre el AD y LD basada en ejemplares de museo (BMNH, RMNH) se muestra en la tabla 36. Tabla 36. Ancho discal (AD) y longitud discal (LD) para seis ejemplares de Potamotrygon orbignyi de Surinam (río Surinam). AD (mm) 141,3 143,3 159 163 209 220 LD (mm) 155 165 175 175 230 229 Distribución geográfica Ampliamente distribuida en el norte de América del Sur, desde la cuenca del Orinoco en Venezuela y Colombia, las Guayanas hasta la Amazonia brasileña, colombiana y peruana. Países: Brasil, Colombia, Guyana, Guayana Francesa, Perú, Surinam y Venezuela. Cuencas: Amazonas (Brasil, Colombia y Perú); Approuague (Guayana Francesa); 233 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Registros de Potamotrygon orbignyi. Essequibo (Guyana); Orinoco (Colombia y Venezuela); Surinam (Surinam) Subcuencas: en Brasil, a lo largo de toda la cuenca amazónica desde Acre-río Breu; Amazonas-ríos Solimoes, Río Negro, Branco; Roraima-río Urariquera; Mato Grosso-río Pindaiba; Pará (ríos Amazonas-Tapajos-Xingú; Amapá-río Jari; hasta la porción más baja de la cuenca, río Tocantins y secciones alta y media del río Araguaia). Registrada recientemente en la cuenca del río Parnaíba (Moro et al. 2011). Orinoco (alto Orinoco, Apure, Arauca, Atabapo, Bita, Caquetá, Capanaparo, Caroní, Casiquiare, Cataniapo, Caura, Cinaruco, Delta, Guaviare, Inírida, Meta, Morichal Largo, Orinoco, Suapure, Tomo, Ventuari). Guayanas: Approvague, Essequibo y Surinam. 234 Hábitat Todo tipo de ambientes, tanto lóticos como lénticos y en los tres tipos de agua. Alimentación Amazonas Carnívora: entomófaga-carcinófaga. Brasil. Shibuya (2009) en un estudio realizado con ejemplares colectados en el medio Río Negro y río Amazonas, reportó una dieta predominantemente insectívora. Otro estudio en la cuenca del río Parnaíba (Moro et al. 2011), mostró una dieta compuesta exclusivamente de insectos, donde los ítems principales fueron las larvas de Ephemeroptera. Se observaron diferen- Potamotrygon orbignyi Potamotrygon orbignyi FAMILIA POTAMOTRYGONIDAE cias sexuales cuando se compara el índice de importancia relativa (%IRI), siendo las larvas de dípteros (49,9%) y ninfas de Ephemeroptera (50,1%), los principales items consumidos por las hembras, y las ninfas de Ephemeroptera (82,9%) por los machos. En la cuenca del río Tocantins/Araguaia la especie se alimenta básicamente de larvas y ninfas de insectos. Los principales órdenes son en grado de importancia relativa Ephemeroptera (IRI = 15352,8), Diptera (IRI = 1863,1) y Trichoptera (IRI = 281,9), que representan en conjunto el 99,72% del IRI. Los órdenes Odonata (IRI = 48,1) y Coleoptera (IRI = 0,15) reunieron menos del 0,3% del IRI. Sin embargo, esta especie parece adaptarse fácilmente a la disponibilidad de recursos alimenticios del ambiente, alimentándose de ítems compatibles con su capacidad de depredación y morfología del sistema digestivo. El principal ítem alimenticio de esta especie en la cuenca de la bahía de Marajó fueron los crustáceos isópodos (Bragança et al. 2004), los cuales no fueron registrados en ejemplares de la misma especie en la cuenca alta del río Tocantins. Moro et al. (2011) confirma la dieta insectívora en la cuenca del río Parnaíba, donde el principal ítem de la dieta para ejemplares de pequeño tamaño fueron larvas del orden Diptera. Rincon-Filho (2006) identifica un cambio en la dieta a partir de los 160 – 180 mm AD con la sustitución de larvas de Diptera por ninfas de Ephemeroptera. Familia: Palaemonidae, Macrobranchium brasiliense y peces (%IIR=30.9). También se registra el consumo de Diptera: Chironomidae (%IIR: 69,09) (Figura 61). Venezuela. N=126 (89), provenientes de los Llanos de Venezuela. Estos mostraron una dieta muy amplia (13 items), con predominio de larvas de efemerópteros, dípteros (quironómidos fundamentalmente) y crustáceos (ostrácodos y decápodos), tanto en términos de frecuencia de aparición como en volumen. Los efemerópteros más importantes en orden de abundancia fueron las ninfas de Campsurus spp y Astenopus sp. (Polymitarcidae) y ninfas de Traverella sp. (Leptophlebidae). Entre los crustáceos no ostrácodos, los camarones del género Macrobrachium (M. jelskii y M. amazonicum) fueron los más representativos (Lasso et al. 1996). Otros ítems alimenticios importantes fueron los peces (especialmente en las rayas de mayor talla), oligoquetos y otros insectos acuáticos, tanto en fases inmaduras (odonatos, tricópteros, tanipodínos, ceratopogónidos), como adultas (coleópteros y hemípteros). No se observó una diferencia significativa en la dieta entre hembras y machos (Figuras 62 a y b). Reproducción Amazonas Carnívora: carcinófaga-entomófaga. Brasil. Silva (2009) examinó 291 individuos (121 H : 170 M), de los cuales el macho maduro más pequeño midió 252 mm AD y el mayor macho inmaduro, 342 mm AD. Para las hembras, la menor hembra madura midió 252 mm AD y la hembra inmadura mayor alcanzó 336 mm AD. Colombia. N = 3 (3), provenientes de la cuenca del Orinoco en los ríos Vichada y Meta (Colombia). La categoría dominante en la dieta fue Decapoda (%IIR= 100; El ciclo reproductivo está estrechamente relacionado con el ciclo hidrológico de las cuencas y este desencadena el inicio o influye directamente en todas las fases de la Orinoco Lasso et al. 235 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Figura 61. Índice de importancia relativa (% IIR) de los ítems consumidos por tres ejemplares de Potamotrygon orbignyi. Cuenca del Orinoco (Colombia). reproducción. Para el Río Negro, CharvetAlmeida et al. (2005) registraron un periodo de gestación cercano a los 11 meses, con una fecundidad ovárica de 3 a 7 óvulos y fecundidad embrionaria de dos embriones en promedio. La cópula tiene lugar en la época de aguas altas, el periodo de gestación durante la época de bajada de aguas y el nacimiento ocurre en la época de subida de aguas. A partir de 237 machos estudiados, dichos autores establecen la talla mínima de madurez sexual en 390 mm AD y para 212 hembras analizadas, la talla mínima de madurez sexual propuesta fue de 440 mm AD. En ejemplares provenientes de la cuenca del Tocantins/Araguaia (Rincón-Filho 236 2006) el ancho del disco en hembras (n = 47) varió entre 150 - 460 mm AD, donde la hembra madura de menor tamaño midió 243 mm AD y la hembra inmadura de mayor tamaño 280 mm AD. La talla media de la primera maduración fue estimada entre 244 y 260 mm AD (métodos gráfico y de regresión logística). Para esta cuenca, las hembras presentan una fecundidad uterina de un sólo embrión, independiente del tamaño de la madre y una fecundidad ovárica máxima de 5 óvulos (Figura 63). Los juveniles nacen con 100 – 115 mm AD y con un peso entre 48 a 61 g. La reproducción parece ser continua, ya que se colectaron simultáneamente ejemplares en distintas etapas del desarrollo. Potamotrygon orbignyi Potamotrygon orbignyi FAMILIA POTAMOTRYGONIDAE a. b. Figura 62. Análisis de los contenidos estomacales de Potamotrygon orbignyi. N = 126 (89). a) Método de frecuencia de aparición; b) método volumétrico. Abreviaturas: COL (Coleoptera), HEM (Hemiptera), ODO (Odonata), TRI (Trichoptera), NI (no identificado), DIP-TA (Diptera-Tanypodinae), DIP-CH (Diptera-Chironomidae), DIP-CER (DipteraCeratopogonidae), DEC-CAG (Decapoda-cangrejos), (DEC-PAL Decapoda-Palaemonidae), OST (Ostracoda), RP (restos de plantas), PECES (peces), OLI-HAP (OligochaetaHaplatoxida). Lasso et al. 237 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Figura 63. Relación entre la fecundidad ovárica (número de folículos vitelogénicos) y el ancho discal AD (mm). El ancho de disco en machos (n = 37) varió entre 153 - 371 mm AD. El menor macho maduro tenía 225 mm AD y el mayor macho inmaduro tenía 278 mm AD. La talla media de la primera maduración fue estimada en 251 mm AD, que representa el 67,6% del AD máximo observado. N Los claspers mostraron un aumento en el crecimiento desde 207 mm AD hasta 250 mm AD cuando el crecimiento tiende a estabilizarse. En la figura 64 se muestra la relación entre la longitud del clasper versus el ancho del disco para 64 ejemplares provenientes de la Amazonia brasileña. A Figura 64. Relación proporcional de la longitud del clasper vs. el ancho del disco en 64 ejemplares de Potamotrygon orbignyi. Amazonia brasileña. Neonatos (N), juveniles (J), adultos (A). 238 Potamotrygon orbignyi Potamotrygon orbignyi FAMILIA POTAMOTRYGONIDAE Se observa la separación de los ejemplares según el estado de desarrollo: neonato, juvenil y adulto. Los estudios de Lasso et al. (1996), Rincon-Filho (2006) y Silva (2009) ratifican que los machos maduran a menores tamaños de AD que las hembras. Para el río Approuague, en la Guayana Francesa se tiene el dato de clasper para dos machos, AD 174 mm y longitud del clasper 19,9 mm y el otro, AD 179 mm y longitud del clasper 20,8 mm. Para el río Essequibo en la Guyana, un macho con AD 172 mm presentó un clasper de 20,1mm de longitud. En la figura 65 se muestra la relación entre la longitud del clasper versus el ancho del disco para seis ejemplares provenientes del río Surinam, todos los ejemplares son juveniles. Colombia. En el río Bita, se registraron hembras grávidas en los meses de enero, febrero y marzo. Los datos de las hembras y los embriones se muestran en la tabla 37. Orinoco Figura 65. Relación proporcional de la longitud del clasper vs. el ancho del disco en seis ejemplares de Potamotrygon orbignyi colectados en el río Surinam. La fecundidad ovárica (n = 5) varió entre tres y cuatro óvulos (Tabla 38). Una hembra de 259 mm AD y 1,4 kg con dos embriones machos (AD: 81 y 90 mm; peso: 32 y 48 g, respectivamente). Adicionalmente, en los meses de enero y marzo se registraron varias hembras grávidas. Una con 290 mm AD y 1,4 kg, abortó dos embriones, uno hembra (9,5 mm AD y 57 g) y otro Lasso et al. macho (9 mm AD y 50,4 g). Una de 310 mm AD y 1,9 kg de peso, abortó un embrión macho de 83 mm AD y 27 g, además presentó cuatro óvulos. Otra con 325 mm AD y 2 kg, abortó un embrión macho de 82 mm AD y 22,8 g. Una tercera, de 330 mm AD y 2,2 kg, abortó un embrión macho de 102 mm AD y 51,1 g de peso, también presentó tres óvulos (Figura 66). 239 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Tabla 37. Datos sobre hembras grávidas y sus embriones. Orinoquia colombiana. Mes ♀ AD (cm) Peso (kg) n embriones AD (mm) Peso (g) Sexo L clasper (mm) Enero 325 2 1 82 23 M 330 2,2 1 102 51 M 310 1,9 1 83 27 M a. b. c. d. Febrero 259 1,4 1 2 81 90 32 48 M M Marzo 290 1,4 1 95 57 H 2 90 50 M 10 Figura 66. Potamotrygon orbignyi. a) Hembra de 330 mm AD en inicio de aborto; b) embrión abortado; c) vista embrión macho abortado 102 mm AD; d) vista dorsal de madre y embrión mostrando el patrón de coloración. Río Bita, Orinoquia colombiana (enero 2013). Fotos: M. A. Morales-Betancourt. 240 Potamotrygon orbignyi Potamotrygon orbignyi FAMILIA POTAMOTRYGONIDAE Tabla 38. Fecundidad ovárica en hembras de Potamotrygon orbignyi. Orinoquia colombiana. AD (mm) 310 330 Fecundidad 4 3 ovárica (diámetro (6 - 37) (10 - 19) óvulos - mm) En la figura 67 se muestra la relación entre la longitud del clasper versus el ancho del disco para 33 ejemplares provenientes de la Orinoquia colombo-venezolana. Se observa la separación de los ejemplares según el estado de desarrollo: neonato, juvenil y adulto. Venezuela. Las hembras a partir de los 185 mm AD empiezan a mostrar signos de madurez sexual y con 295 mm AD ya están completamente maduras (Lasso et al. 1996). Durante la época seca (diciembreabril) se registró información sobre diez N eventos reproductivos referentes a partos y/o abortos (Lasso datos no publicados). La fecundidad intrauterina (número de embriones o fetos) para un n=10, varió de 1 (hembra 320 mm AD) a 17 (hembra 770 mm AD) (Tabla 38). La talla de los embriones fluctuó entre 85 y 126 mm AD, con un peso de 21 a 120 g, respectivamente (Tabla 39). La proporción de sexos (M : H) para un n=10, fue variable, pero con mayor número de machos en la mayoría de los casos, 1 M : 1 H, 2 M : 1 H, 1 M : 3 H, 5 M : 2 H y 8 M : 3 H) (Tabla 38). La fecundidad ovárica (n=8) varió de 4 óvulos (hembra 320 mm AD) a 17 óvulos (hembra 560 mm AD) (Tabla 39) (Figura 68a – c). Para los machos, siete fetos (100-116 mm AD) mostraron una longitud del clasper de 6,6 a 14 mm y no pudieron ser separados de los neonatos (116 – 140 mm AD), con 10 – 12, 6 mm longitud clasper. Con 230 – 250 mm AD (longitud clasper 32,6 y 33,7 mm, respectivamente), se encuentran en J A Figura 67. Relación proporcional de la longitud del clasper vs. el ancho del disco en 33 ejemplares de Potamotrygon orbignyi. Orinoquia colombo-venezolana. Neonatos (N), juveniles (J), adultos (A). Lasso et al. 241 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE maduración y a partir de 285 mm AD (74,6 mm longitud clasper), ya están maduros (Tabla 40). Fernández et al. (2006) señalan una fecundidad ovárica de 29 óvulos para una hembra de 11 kg de peso capturada en la época seca en el río Cataniapo. Movimientos y comportamiento Los ejemplares adultos presentan movimientos verticales, durante el día se encuentran en zonas de aguas profundas y por la noche se desplazan a áreas de poca profundidad (Góes de Araújo et al. 2009). a. Uso Ornamental y subsistencia. Aspectos pesqueros Comercialización y exportación b. c. Figura 68. a) Hembra de Potamotrygon orbignyi (770 mm AD y 26,5 kg) con 11 embriones abortados al momento de su captura; b) hembra de 520 mm AD y 9 kg, con siete embriones; c) óvulos y embriones en diferentes estadios de desarrollo. Llanos de Venezuela. Foto: Archivo EBEF (a), C. A. Lasso (b, c). 242 Colombia. Hay datos de movilización de individuos desde Inírida para los años 2007 (353 ind.), 2008 (43 ind.), 2009 (38 ind.), 2010 (31 ind.), 2011 (836 ind.) y 2012 (625). Para Puerto Carreño hay datos de movilización para los años 2007 (88 ind.) y 2008 (12 ind.). En relación a las exportaciones durante el periodo 2000– 2006 se exportaron de 74.961 ejemplares, distribuidos así: 2000 (11.043 ind.), 2001 (18.767 ind.), 2002 (23.459 ind.), 2004 (18.977 ind.), 2005 (1198 ind.) y 2006 (1517 ind.) (Incoder 2012) (Figura 69). Normativa Brasil. El Instituto Brasileño del Medio Ambiente y de los Recursos Naturales Renovables -IBAMA- promulgó la normativa Nº 204 del 22 de octubre de 2008, donde se establecen normas, criterios y estándares para la explotación ornamental y de acuariofilia de ejemplares vivos de rayas Potamotrygon orbignyi Potamotrygon orbignyi FAMILIA POTAMOTRYGONIDAE Tabla 38. Datos sobre hembras embarazadas y sus embriones. Llanos de Venezuela. 2 90 25 H 1 90 M 10 10 25 4 111 H 75 111 3 2 115 75 75 9 M 14 H M 420 H H 80 M 11 119 105 122 M 105 H 121 M 100 8 125 M 115 7 125 M 105 6 122 110 H 5 120 M 100 4 121 110 H 3 120 M 105 2 126 M 120 1 115 M 120 7 11 68 H 6 111 60 55 M M 5 65 H 106 4 60 H 111 3 60 Sexo H 110 2 Peso (g) 60 105 1 1 116 1 69 97 48 H 17 2 1 100 93 40 M 11 54 3 2 95 90 45 M 10 45 1 1 M 58 400 770 H AD (mm) 395 520 110 n embriones 395 M ♀ AD (mm) 375 100 1 87 M L clasper (mm) 6,5 24 2 90 Sexo H 25 1 320 320 Peso (g) 85 AD (mm) 320 21 ♀ AD (mm) n embriones Tabla 39. Fecundidad ovárica de ocho hembras de Potamotrygon orbignyi. Llanos de Venezuela. AD (mm) Fecundidad ovárica (diámetro óvulos - mm) 320 320 375 4 7 13 (8-30) 460 470 560 590 480 15 9 17 13 4 Tabla 40. Ancho de disco y longitud del clasper de siete fetos de Potamotrygon orbignyi. Llanos de Venezuela. AD (mm) embrión Longitud clasper (mm) 90 6,6 90 10,4 de la familia Potamotrygonidae, en temas como captura, cuotas de venta, reventa y transporte. Desde los estados de Amazonas y Pará se pueden comercializar 2.400 individuos de esta especie al año, con un AD máximo de 30 cm. Lasso et al. 95 11 116 14 90 10 100 11,3 106 12 Amenazas Por su valor ornamental, la mayor amenaza en la Orinoquia es la extracción desmedida de individuos inmaduros (juveniles). Censos recientes en la Estrella Fluvial Inírida (ríos Inírida, Guaviare, Atabapo y 243 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Figura 69. Ejemplares de Potamotrygon orbignyi exportados desde Colombia. Periodo 2000-2006, no se cuenta con datos del año 2003. Fuente: Incoder (2012). Orinoco) realizados entre febrero-mayo (2011), indican la ausencia de esta especie en la región (Lasso y Sierra-Quintero obs. pers.), lo cual es otro factor de preocupación. Probablemente se trate de una especie que ha estado sometida a una extracción importante en la última década y que no ha quedado registrada correctamente en las estadísticas oficiales dada la dificultad en su identificación, elevado policromismo y que los pre-adultos y juveniles son confundidos a veces con los juveniles de otras especies. En la Amazonia no parece tener una presión pesquera tan marcada (Lasso y Sánchez-Duarte 2012c). Conservación Oportunidades de conservación. Especie con priorización alta según el PAN tiburones-rayas de Colombia (Caldas et al. 2010). Medidas de conservación propuestas. Colombia. Fortalecer el sistema de (consumo y ornamentales) y exportaciones de rayas dulceacuícolas, que genere estadísticas confiables (Caldas et al. 2010). Regulación de la exportación mediante asignación de cuotas basadas en criterios científicos de abundancia en su medio natural. Definición de áreas prioritarias para su conservación (p. e. reservas de pesca) a través de planes de manejo conjunto con pescadores, acopiadores y exportadores. Promover la reproducción en cautiverio. Prohibir la exportación de individuos adultos como posibles parentales. Regulación conjunta de vedas y tallas con países limítrofes (Brasil, Perú, Ecuador y Venezuela) (Lasso y Sánchez-Duarte 2012c). En las figura 70 (a-k) se muestran algunos patrones de coloración de la especie en la Orinoquia y Amazonia. Referencia de identificación Rosa (1985) y Silva (2009). registro y seguimiento de las capturas 244 Potamotrygon orbignyi Potamotrygon orbignyi FAMILIA POTAMOTRYGONIDAE a. b. c. d. e. f. Figura 70. Patrones de coloración de Potamotrygon orbignyi. a) Vista dorsal y (b) vista ventral, Cumaral, Orinoquia colombiana; c) hembra y d) macho, río Orinoco, Bojonawi; e) Puerto Carreño, centro acopio; f) juvenil, río Orinoco, Bojonawi. Fotos: G. Galvis (a, b), M. A. Morales-Betancourt (c, d, f), F. Trujillo (e). Lasso et al. 245 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE g. h. i. j. k. l. Figura 70. Continuación. Patrones de coloración de Potamotrygon orbignyi. g) río Orinoco, Amazonas (Venezuela), h) río Caura, Venezuela; i) río Amazonas, Colombia; j) río Apure, Venezuela; k) caño Dagua, Orinoquia, Colombiana; l) río Orinoco. Fotos: M. A. MoralesBetancourt (k, l), M. Sabaj (g), A. Ferrer (h), A. Acosta (i), A. Barbarino (j). Autores Carlos A. Lasso, Paula Sánchez-Duarte, Mónica A. Morales-Betancourt, Lina M. OrtizArroyave, Juliana Agudelo y Oscar M. Lasso-Alcalá (Colombia-Venezuela), Getulio Rincon, João Paulo C. B. da Silva, Thiago Loboda, João Pedro Fontenelle, Ricardo S. Rosa y Marcelo R. de Carvalho (Brasil). 246 Potamotrygon orbignyi Potamotrygon schroederi FAMILIA POTAMOTRYGONIDAE Potamotrygon schroederi Fernández-Yépez 1957 Nombre común y/o indígena Raya flor (Brasil); guacamaya, raya trébol, raya perla (Colombia); raya guacamaya, raya guayanesa (Venezuela). Estatus de conservación Categoría global UICN: Datos Insuficientes (Góes de Araújo 2009); Vulnerable VU (A4d) (Colombia) (Mojica et al. 2012). Caracteres distintivos Disco oval, más ancho que largo y más ensanchado hacia la parte media del disco (longitud del disco entre 106 – 116,4% del AD); superficie dorsal de color gris oscuro a azulado con manchas amarillas o anaranjadas, vermiculadas o con forma de cerebro, cuyo patrón irregular en su disposición decrece hacia los márgenes del disco. Cola ancha en su base, el ancho equivalente al espacio interorbital, con una a tres filas de espinas no muy definidas. Cola con cinco o seis bandas contrastantes, amarillas o anaranjadas separadas por bandas negras; ambos tipos de bandas, aproximadamente del mismo ancho. Este patrón es más marcado en ejemplares de aguas claras y negras que en blancas. Hocico oval, con una pequeña protuberancia Lasso et al. que sobresale en la parte anterior del disco en ejemplares más pequeños, pero muy reducido y apenas perceptible en individuos de mayor tamaño. Longitud preorbital del hocico contenida más de dos veces la distancia interorbital (entre 18,7 - 29,8% AD). Ojos más pequeños que el diámetro de los espiráculos, sobresaliendo ligeramente del disco. Dientes pequeños, con el margen anterior cóncavo. Talla y peso Colombia-Venezuela. Se examinaron 21 individuos (13 H : 8 M), 14 provenientes del Orinoco colombiano (8 H : 6 M) y siete del Orinoco venezolano (5 H : 2 M), de los cuales 16 fueron juveniles y cinco adultos (Tabla 41). Para machos se registró un ancho discal máximo (AD) de 524 mm, con un peso de 3,3 kg, aunque un macho adulto de menor talla (490 mm AD), presentó un peso superior (5,6 kg) (Figura 71a). Para las hembras se observó algo 247 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Tabla 41. Datos y relaciones morfométricas para juveniles (n=16) y adultos (n=5) de Potamotrygon schroederi de la Orinoquia (Colombia-Venezuela). Ancho del disco (AD), longitud del disco (LD). Estadio de desarrollo (proporción de sexos) Juveniles (9 H : 7 M) Adultos (4 H : 1 M) Intervalo (mm) AD LD 210 - 380,5 230 - 430,5 490 - 612 520 - 640 Promedio (mm) % AD AD LD AD LD 308,6 334 103,0 108,3 553,3 588,5 97,5 106,4 a. b. Figura 71. Relación talla (ancho discal)-peso de Potamotrygon schroederi; a) machos (n=8); b) hembras (n=30). Orinoquia (Colombia-Venezuela). 248 Potamotrygon schroederi Potamotrygon schroederi FAMILIA POTAMOTRYGONIDAE parecido, ya que se registró un máximo de 612 mm AD con un peso de 9,3 kg, sin embargo una hembra más pequeña (580 mm AD) alcanzó un peso mayor (10,5 kg) (Figura 71b). Las hembras mostraron entonces un ancho discal y peso mayor al de los machos. Brasil. Se examinaron cinco ejemplares (3 H : 2 M), uno juvenil (170 mm AD) y cuatro adultos (3H : 1 M) de 385 a 420 mm AD (Tabla 42). La talla promedio en la Amazonia para los adultos es 285 mm AD con una longitud total de 560 mm. No hay datos de peso (Carvalho obs. pers.). Tabla 42. Datos y relaciones morfométricas para un juvenil (n=1) y adultos (n=4) de Potamotrygon schroederi de la Amazonia (Brasil). Ancho del disco (AD), longitud del disco (LD). Estadio de desarrollo (proporción de sexos) Juveniles (1 M) Adultos (3 H : 1 M) Intervalo (mm) AD LD AD LD 170 181 170 181 100 106,5 358 - 420 395 - 470 395,5 438,2 100 110,8 Distribución geográfica Países: Brasil, Colombia y Venezuela. Cuencas: Brasil (Amazonas); Colombia (Amazonas, Orinoco); Venezuela (Amazonas - Río Negro, Orinoco). Subcuencas: Amazonas (Apaporis, Itu, Putumayo (bajo y medio), Río Negro – Brasil o Guainía - Colombia, Yarí); Orinoco (alto Orinoco, Apure, Arauca, Bita, Capanaparo, Casiquiare, Cataniapo, Caura, Cinaruco, Delta, Inírida, Meta -entre la desembocadura del río Tomo y Guaviare-, Ocamo, Siapa, Ventuari). A pesar de que la localidad tipo de la especie es un río de aguas blancas (río Apure), Lasso et al. % AD LD Góes de Araújo (2009) menciona que la especie nace con una talla de 140 mm AD y alcanza una talla máxima de 540 mm AD. Hábitat Promedio (mm) AD no es muy común en este tipo de ambientes, salvo ejemplares de gran tamaño que han sido observados en el cauce principal de los grandes ríos de la cuenca del Orinoco. Común en ríos de aguas claras y negras, tanto en el cauce de los grandes ríos como en caños o afluentes menores, no en zonas de inundación. Entre los potamotrigónidos es la especie que muestra la preferencia más marcada por zonas de flujo rápido del agua (mayor velocidad de la corriente) y en especial en la zona central del cauce o canal de los ríos. En la Orinoquia colombiana es frecuente observarla en caños de aguas claras en zonas de corriente fuerte, a unos 2 m de profundidad, denominadas localmente “porongos” (individuos grandes), o en zonas más someras de playas arenosas tanto de ríos pequeños (individuos de menor talla), como en el propio Orinoco (individuos pequeños y grandes). 249 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Registros de Potamotrygon schroederi. En la Amazonia brasileña esta especie muestra preferencia por hábitats cercanos a las playas de las islas del cauce medio del Río Negro (aguas negras) (Duncan y Fernandes 2010). tal no identificado (1,5% IIR) (Figura 72). Según Góes de Araújo (2009), en la Amazonia brasileña consume peces pequeños, camarones, gusanos y larvas de insectos. Alimentación Prácticamente sin información reproductiva en la Orinoquia, salvo un dato puntual de la talla de madurez sexual en machos, a partir 395 mm AD en Venezuela (Lasso obs. pers.) y observaciones en marzo 2013 en la Orinoquia colombiana (caño Dagua), de dos hembras con óvulos en diferentes estadios de desarrollo: hembra de 580 mm AD (2 óvulos de 10 y 16 mm); hembra de 370 mm AD (2 óvulos de 5 y 10 mm) (Lasso y Morales-Betancourt obs. pers.). Carnívora: entomófaga - carcinófaga - ictiófaga. N=4 (1) provenientes de la cuenca del Orinoco en Colombia, de los cuales el único estómago con contenido registró un camarón (orden Decápoda) del género Macrobrachium (100% IIR). N=2 (2) para dos ejemplares colectados en el río Orinoco en Venezuela, donde se encontraron restos de peces (Gymnotiformes) (85,7% IIR), restos de insectos (Odonata) (12,8% IIR) y restos de material animal y vege- 250 Reproducción Potamotrygon schroederi Potamotrygon schroederi FAMILIA POTAMOTRYGONIDAE Figura 72. Índice de importancia relativa (%IIR) de los ítems consumidos por dos ejemplares de Potamotrygon schroederi colectados en el río Orinoco (Venezuela). En la Amazonia brasileña (cuenca del Río Negro) se han observado nacimientos durante cuatro meses de la época de lluvias, tras un periodo de gestación de seis meses (la maduración gonadal toma de 3 a 4 meses), con una fecundidad ovárica de 3 a 7 huevos y fecundidad uterina de 1 a 3 embriones, así como una talla de madurez sexual de 420 mm AD (machos) y 440 mm AD (hembras). La cópula tiene lugar durante la estación de lluvias (CharvetAlmeida et al. 2005). En la figura 73 se muestra la relación entre la longitud del clasper vs. el ancho del disco para cinco ejemplares provenientes de la Orinoquia colombo-venezolana. Todos los ejemplares son considerados juveniles ya que la especie alcanza la madurez sexual a partir de los 420 mm AD. Lasso et al. Movimientos y comportamiento Los adultos y juveniles realizan movimientos diariamente entre el cauce principal del río y las playas arenosas (Góes de Araújo 2009). Uso Se captura principalmente con fines ornamentales, tanto en estadio juvenil o preadulto. Aspectos pesqueros Método de captura. Manualmente con fines ornamentales. Comercialización y exportación Brasil. Especie de importancia secundaria en la pesca ornamental. Su comercio está 251 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Figura 73. Relación proporcional de la longitud del clasper vs. el ancho del disco. Ejemplares juveniles de Potamotrygon schroederi colectados en la Orinoquia colombo-venezolana. limitado a 1.000 ejemplares en el estado de Amazonas y sólo los ejemplares menores de 300 mm AD pueden ser comercializados. En la figura 76 se muestran el número de ejemplares exportados de 2003 a 2005 y 2008 (Ramos 2009). Colombia. Es la tercera especie de raya de agua dulce con mayor nivel de extracción y exportación en el país. Durante los últimos cinco años se exportaron en total 14.081 ejemplares (Incoder 2012) (Figura 74). De los ejemplares exportados en el año 2009, 1886 individuos provenían de la Orinoquia: Puerto Carreño (61), Puerto Inírida (1825) (CCI 2009), una cifra enorme para la región de la Estrella Fluvial de Inírida. Otros datos de captura en la región de la Orinoquia son 2007 (3.113 ind.), 2008 (488 ind.) y 2010 (940 ind.). Figura 74. Número de ejemplares de Potamotrygon schroederi exportados desde Colombia. Periodo 2007-2011. Fuente: Incoder (2012). 252 Potamotrygon schroederi Potamotrygon schroederi FAMILIA POTAMOTRYGONIDAE Desde Inírida se movilizaron en 2010 (1.079 ind.), 2011 (1.263 ind.) y en 2012 (1.362 ind.). Gran parte de los registros de la región de Inírida, corresponden a individuos provenientes de Venezuela que entran de manera ilegal a Colombia (Lasso y Sánchez-Duarte 2012d). Durante el periodo de cinco años mencionado, Colombia exportó ejemplares de Potamotrygon schroederi a 28 países. De estos, Alemania, Canadá, Corea, Estados Unidos, Japón, Singapur y Taiwán, comercializaron la especie durante todo el periodo. Hong Kong y Tailandia no compraron ejemplares de esta raya durante alguno de los años y para China se reportó la mayor exportación (4.297 ejemplares) en el 2009 (Figura 75). Los acopiadores de Puerto Carreño prefieren comprar a los pescadores rayas de una cuarta de ancho de disco (aproximadamente 230 mm) a $44.000 (23,26 dólares), para luego revenderlas a los ex- portadores a $77.000 (40,71 dólares). Sin embargo, las tallas de comercialización dependen, como la mayor parte de la cadena comercial, de la demanda del exportador. Estos acopiadores reconocen tres tipos de Potamotrygon schroederi en función del patrón de coloración y los pagan a diferente precio (Mejía-Falla et al. 2010). Normativa Brasil. El Instituto Brasileño del Medio Ambiente y de los Recursos Naturales Renovables -IBAMA- promulgó la normativa Nº 204 del 22 de octubre de 2008, donde se establecen normas, criterios y estándares para la explotación ornamental y de acuariofilia de ejemplares vivos de rayas de la familia Potamotrygonidae, en temas como captura, cuotas de venta, reventa y transporte. Amenazas Es un recurso ornamental de importancia y es la tercera especie en las exportaciones Figura 75. Principales países importadores de Potamotrygon schroederi. Periodo 2007 – 2011. Fuente: Incoder (2012). Lasso et al. 253 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Figura 76. Número de ejemplares de Potamotrygon schroederi exportados desde Brasil en los años 2003 a 2005; los datos de 2008 corresponden a los últimos 15 días de diciembre. Fuente: Ramos (2009). colombianas. La mayor amenaza en la Orinoquia también es la extracción desmedida de individuos juveniles, mucho mayor que en el caso de Potamotrygon motoro. Censos realizados entre enero-mayo del 2011 en la región de la Estrella Fluvial de Inírida (confluencia de los ríos Inírida, Guaviare, Orinoco y Atabapo), no indican la presencia de esta especie en el medio natural (Sierra-Quintero y Lasso, obs. pers.), a pesar de aparecer en las estadística oficiales en cifras tan elevadas. Desde el 2009 o quizás antes, existe un comercio no declarado en la frontera colombo-venezolana, donde individuos de esta especie provenientes de la región de la confluencia Orinoco-Ventuari entran ilegalmente a Colombia vía Inírida (Lasso y Sánchez-Duarte 2012d). Conservación Oportunidades de conservación. Considerada con prioridad alta en el PAN tiburones-rayas de Colombia (Caldas et al. 2010). Medidas de conservación propuestas. Fortalecer el sistema de registro y 254 seguimiento de las capturas (consumo y ornamentales) y exportaciones de rayas dulceacuícolas, que genere estadísticas confiables (Caldas et al. 2010). Además, regular la exportación mediante asignación de cuotas basadas en criterios científicos de abundancia en su medio natural. Definición de áreas prioritarias para su conservación (por ejemplo, reservas de pesca) a través de planes de manejo conjunto con pescadores, acopiadores y exportadores. Promover la reproducción en cautiverio. Prohibir la exportación de individuos adultos como posibles parentales. Regulación conjunta de vedas y tallas con Venezuela, de donde provienen muchos individuos por contrabando (Lasso y Sánchez-Duarte 2012d). En la figura 77 (a-f) se muestran diferentes patrones de coloración en la Orinoquia (Colombia-Venezuela). Referencia de identificación Rosa (1985), Carvalho et al. (2011). Potamotrygon schroederi Potamotrygon schroederi FAMILIA POTAMOTRYGONIDAE a. b. c. d. e. f. Figura 77. Potamotrygon schroederi. a, b) Alto Orinoco; c) río Cataniapo; d) río Ventuari; e) Amazonas venezolano; f) caño Dagua. Fotos: N. Lujan (a), D. Taphorn (b), J. Fernández (c), J. C. Señaris (d), M. Sabaj (e), M. A. Morales-Betancourt (f). Autores Carlos A. Lasso, Paula Sánchez-Duarte, Oscar M. Lasso-Alcalá, Lina M. Ortiz-Arroyave, Mónica A. Morales-Betancourt, Juliana Agudelo (Colombia - Venezuela), Marcelo R. de Carvalho, João Paulo C. B. da Silva, Thiago Loboda y João Pedro Fontenelle (Brasil). Lasso et al. 255 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Potamotrygon scobina Garman 1913 Nombre común y/o indígena Raya (Brasil), raya mariposa (Colombia). Estatus de conservación Categoría global UICN: Datos Insuficientes. Caracteres distintivos Coloración general del dorso del disco variable, con tres patrones diferentes: (1) fondo marrón oscuro o marrón claro, con pequeñas manchas circulares blancas o amarillo claro; (2) fondo totalmente marrón oscuro; (3) con manchas blancas pequeñas y numerosas, formando rosetas circulares sobre un fondo marrón claro u oscuro. Aletas pélvicas dorsalmente con el mismo patrón de coloración que el disco. Cola larga y aguzada posteriormente al aguijón o espina caudal. Una fila regular de espinas con la base ovalada y grande, situada sobre el dorso de la cola. Dientes pequeños, con 30 a 36 filas longitudinales en la mandíbula superior y una sola superficie cortante. Los machos adultos tienen una sola cúspide afilada en los dientes medianos. 256 Talla y peso Se examinaron 15 individuos adultos (9 H: 6 M de la Amazonia brasileña) (Tabla 43). Los machos alcanzan 590 mm AD y las hembras 617 mm AD, con un peso de 6 kg y 9 kg, respectivamente (Gama 2013). Sólo hay información de la relación talla (AD)peso para nueve hembras (Figura 78). Los ejemplares de la Orinoquia colombiana fueron dos machos de 370 mm AD - 400 mm LD (1,2 kg) y 490 mm AD - 520 mm LD (5,6 kg) (Figura 79). Distribución geográfica Países: Brasil y Colombia (primer registro). Cuencas: parte media y baja de la cuenca del Amazonas, desde el río Solimões hasta el río Pará y la costa de Amapá. Parte baja del río Tocantins; Orinoco (Colombia). Subcuencas: Amazonas (ríos Solimões, Tapajós, Tocantins, Trombetas y Pará). Orinoco (cauce principal, Bita). Potamotrygon scobina Potamotrygon scobina FAMILIA POTAMOTRYGONIDAE Tabla 43. Datos y relaciones morfométricas para adultos (n=15) de Potamotrygon scobina. Ancho del disco (AD), longitud del disco (LD). Estadio de desarrollo (proporción de sexos) Adultos (9 H : 6 M) Intervalo (mm) Promedio (mm) % AD AD LD AD LD AD LD 205 - 617 212 - 579 282,8 293 - 105,8 Figura 78. Relación talla (ancho discal)-peso para nueve hembras de Potamotrygon scobina. Hábitat Sin ninguna preferencia por un tipo particular de hábitat, común en fondos con arena o lodo y en zonas con diferentes velocidades de corriente , aguas blancas y claras (Orinoquia). Alimentación Carnívora: carcinófaga -ictiófaga. Para un N = 5 (Brasil), los ítems principales fueron camarones y cangrejos (Gama, datos no publicados). El ejemplar de la Orinoquia colombiana consumió peces (Characidae). Reproducción Se analizaron las gónadas de cinco ejemplares hembras de Potamotrygon scobina de la Rosa et al. Reserva Biológica (REBIO) do Parazinho, Amapá (294-579 mm AD). Una sola hembra estaba embarazada (cuatro embriones en el útero), que fueron abortados durante la captura (noviembre de 2012), al término del periodo seco. La hembra de menor tamaño (294 mm AD) era inmadura. Las demás hembras estaban en la fase de reposo o vitelogénesis reproductiva (Gama 2013). Según Almeida (2003), los ejemplares con un AD mayor de 200 mm se consideran adultos. En la figura 80 se muestra la información disponible sobre el AD y la longitud del clasper para cuatro machos de la Amazonia. De acuerdo a eso, ejemplares entre 205 y 230 mm AD son juveniles y a partir de los 350 mm AD aproxima- 257 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE a. b. c. d. e. f. Figura 79. Potamotrygon scobina. a) macho inmaduro 370 mm AD, b) detalle porción anterior, río Orinoco; macho inmaduro de 490 mm AD, c) vista dorsal, d) vista ventral, e) detalle del porción anterior, f) detalle de la cola, río Bita, Colombia. Fotos: M. A. MoralesBetancourt. 258 Potamotrygon scobina Potamotrygon scobina FAMILIA POTAMOTRYGONIDAE Registros de Potamotrygon scobina. J Figura 80. Relación proporcional de la longitud del clasper vs. el ancho del disco en cuatro ejemplares de Potamotrygon scobina colectados en la Amazonia brasileña. Juveniles (J) y adultos (A). Rosa et al. 259 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE damente, adultos. El ejemplar macho de la Orinoquia colombiana de 370 mm AD era inmaduro y el de 490 mm AD ya estaba completamente maduro. Movimientos y comportamiento En el área de la REBIO-Parazinho en Brasil, entre marzo de 2011 y enero de 2013, se capturó durante todo el año (Gama 2013). Esta especie tiene un comportamiento más agresivo que otros potamotrigónidos al momento de la captura. Su cola es proporcionalmente mayor que otras especies y su movimiento vigoroso es el princiapl riesgo para los pescadores. Aspectos pesqueros Método de captura. Por su comportamiento carnívoro, se captura con mayor facilidad con palangres cebados con pescado. Sin embargo, debido a su larga cola provista de muchos tubérculos es a menudo capturada incidentalmente en redes de enmalle (mono y multifilamento). Amenazas Pesca incidental. Referencia de identificación Almeida (2003) y Rosa (1985). Autores Ricardo S. Rosa, Cecile Gama, João Pedro Fontenelle y Marcelo R. de Carvalho (Brasil); Carlos A. Lasso y Mónica A. Morales-Betancourt (Colombia). 260 Potamotrygon scobina Potamotrygon tatianae FAMILIA POTAMOTRYGONIDAE Potamotrygon tatianae Silva y Carvalho 2011 Nombre común y/o indígena Arraia (Brasil). Estatus de conservación Categoría global IUCN: no evaluada. Caracteres distintivos Coloración dorsal del disco oscura, entre marrón y negro, con manchas o pintas vermiculares claras o marrones, organizadas de manera cohesiva. Aletas pélvicas dorsalmente con el mismo patrón que el disco. Una sola hilera irregular de espinas sobre el dorso de la cola. Cola con la misma coloración dorsal y lateral que el disco, con manchas o pintas claras. Disco ventralmente claro, márgenes con manchas oscuras. Disco con dentículos pequeños, los cuales tienen forma de estrella y se concentran en la porción central del disco. Ojos dos o tres veces más pequeños que los espiráculos. Surcos labiales presentes. Dientes pequeños, aunque los de la parte central de las mandíbulas son más robustos, con 36 a 46 filas longitudinales en la mandíbula superior y 33 a 45 en la mandíbula inferior. Fontenelle et al. Talla y peso Se examinaron siete individuos (1 H : 6 M), con tallas de 265 – 362 mm AD, pero sin datos de peso (Silva y Carvalho 2011) (Tabla 44). No hay datos de peso conocidos para esta especie. Distribución geográfica País: Perú. Cuenca: Amazonas. Subcuenca: Potamotrygon tatianae es conocida únicamente del río Madre de Dios, cuenca superior del río Madeira, Perú. Alimentación Ictiófaga (Silva obs. pers.). Reproducción No hay datos sobre reproducción de P. tatianae. Los ejemplares depositados en el MZUSP (107667, 107669 y 107770), con 293, 300 y 362 mm AD, tenían una longitud del clasper de 69, 73 y 92 mm, respec- 261 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Tabla 44. Datos y relaciones morfométricas para adultos (n=7) de Potamotrygon tatianae. Ancho del disco (AD), longitud del disco (LD). Estadio de desarrollo (proporción de sexos) Adultos (1 H : 6 M) Intervalo (mm) Promedio (mm) % AD AD LD AD LD AD LD 265 - 362 283 - 475 617 350 100 110,3 Registros de Potamotrygon tatianae. tivamente (Figura 81) y ya se encontraban maduros. Referencia de identificación Silva (2010), Silva y Carvalho (2011). Amenazas No son conocidas las amenazas directas a esta especie, a excepción de la pesca incidental. 262 Potamotrygon tatianae Potamotrygon tatianae FAMILIA POTAMOTRYGONIDAE Figura 81. Relación proporcional de la longitud del clasper vs. el ancho del disco en tres ejemplares de Potamotrygon tatianae colectados en la Amazonia peruana. Todos los individuos son adultos. Autores João Pedro Fontenelle, João Paulo C. B. da Silva y Marcelo R. de Carvalho. Fontenelle et al. 263 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Potamotrygon tigrina Carvalho, Sabaj-Pérez y Lovejoy 2011 Nombre común y/o indígena Raya “tigre” (así es conocida en el mercado de acuarismo en Perú). Estatus de conservación Categoría global IUCN: no evaluada. Caracteres distintivos Disco más o menos ovalado, más largo que ancho y más amplio en la región mediana. Ojos pequeños, su diámetro menor que el del espiráculo, protuberantes y claramente visibles sobre el disco. Cola robusta en la base, su ancho ligeramente superior que el espacio interorbital. Espinas dorsales de la cola cortas y bien espaciadas entre sí, generalmente en dos hileras poco definidas, originándose posteriormente a la base de la cola. Dientes dispuestos en 42 filas longitudinales en la mandíbula superior (en los dos ejemplares examinados de la descripción original de Carvalho et al. 2011). Superficie dorsal del disco de color marrón claro a oscuro, ligeramente más claro hacia los márgenes del disco, con un patrón vermiculado irregular, de color amarillo a naranja, más fino hacia 264 la región interorbital y más grueso en la parte posterior del disco, región mediodorsal y base de la cola. Margen del disco con manchas pequeñas de color blanco cremoso o amarillo, casi del tamaño del diámetro del ojo. Estas manchas del disco pueden unirse formando patrones reticulares. Superficie dorsal de las aletas pélvicas con manchas pequeñas de color blanco cremoso o amarillo, que pueden unirse formando vermiculos. Porción basal de la cola con manchas oscuras en forma de silla de montar, separadas por espacios más claros. Porción distal de la cola con cinco o seis franjas oscuras, alternadas con espacios más claros (Carvalho et al. 2011). De apariencia similar a Potamotrygon schroederi por las franjas oscuras en la porción distal de la cola, pero se distingue de esta especie por su patrón de coloración vermiculado y no dispuesto en Potamotrygon tigrina Potamotrygon tigrina FAMILIA POTAMOTRYGONIDAE rosetas en forma de cerebro como en esta última especie. Distribución geográfica País: Perú. Cuenca: Amazonas. Subcuencas: Nanay. Una única localidad es mencionada en la descripción original, la del holotipo (río Nanay, tributario del río Amazonas, en Pampa Chica, cerca de Iquitos, Perú) (Carvalho et al. 2011). Probablemente la distribución sea más amplia incluyendo el alto río Amazonas, Tigre y Putumayo. Talla y peso Los dos ejemplares examinados en la descripción original (Carvalho et al. 2011) fueron un macho juvenil con 258 mm AD y una longitud total de 560 mm, y una hembra sub-adulta con 250 mm AD (Tabla 44). Hábitat La localidad tipo es un río de aguas negras y el holotipo fue capturado en una playa arenosa. No hay datos sobre la abundancia. Reproducción Las especie posiblemente alcanza la madurez sexual con grandes tallas, una vez que el holotipo, un macho con 258 mm AD tenía los claspers muy poco desarrollados (34 mm) (Carvalho et al. 2011). Se infiere que la talla de madurez sexual para machos sea de 400 mm AD, ya que el macho tipo de 285 mm AD no estaba desarrollado (Carvalho et al. 2011). Registros de Potamotrygon tigrina. Carvalho et al. 265 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Tabla 44. Datos y relaciones morfométricas para juveniles y sub-adultos (n=2) de Potamotrygon tigrina del material examinado de la Amazonia. Ancho del disco (AD), longitud del disco (LD). Estadio de desarrollo (proporción de sexos) Adultos (1 H : 1 M) Uso Intervalo (mm) Promedio (mm) % AD AD LD AD LD AD LD 250 - 258 271 - 282 254 276,5 100 108,9 El uso y comercio de Potamotrygon tigrina como especie ornamental ha sido registrado durante al menos 13 años (Carvalho et al. 2011). Amenazas Probablemente la pesca incidental sea una amenaza. Referencia de identificación Carvalho et al. (2011). Autores Marcelo R. de Carvalho, João Paulo C. B. da Silva, Thiago Loboda, João Pedro Fontenelle, Ricardo S. Rosa y Hernán Ortega. 266 Potamotrygon tigrina Potamotrygon yepezi FAMILIA POTAMOTRYGONIDAE Potamotrygon yepezi Castex y Castello 1970 Nombre común y/o indígena Raya del Lago de Maracaibo (Venezuela); raya cuarterona (rayas grandes), raya tartaguita (rayas pequeñas o neonatos) (Colombia). Estatus de conservación Categoría global IUCN: Datos Insuficientes; categoría nacional: Vulnerable VU B2b (iii) (Colombia) (Mojica et al. 2012). Caracteres distintivos Coloración general del dorso variable. (1) Fondo marrón o gris oscuro con manchas negras irregulares (redondeadas o alargadas), sin un patrón definido; (2) fondo marrón a gris, pero con las manchas unidas formando un patrón vermiculado, estas manchas pueden ser negruzcas o amarillentas. La coloración de los juveniles es muy diferente a la de los adultos, ya que presentan un patrón reticulado oscuro que deja ver manchas claras a lo largo de la superficie del disco, mientras que en los adultos no hay ese patrón con retículos. Dientes pequeños, con 22 a 27 filas longitudinales en la mandíbula superior. De apariencia similar a Potamatrygon magdalenae (patrón de coloración tipo 2), pero con un pliegue Lasso et al. o prolongación cónica carnosa en la parte posterior de cada espiráculo, también tiene muchos menos dentículos dérmicos (y menos desarrollados) que P. magdalenae. Especie restricta a la cuenca del Lago de Maracaibo (Venezuela) y subcuenca del río Catatumbo (Colombia). Talla y peso Se examinaron 64 individuos (39 H : 25 M), de los cuales 12 fueron neonatos, 21 juveniles y 31 adultos (Tabla 46). Las hembras parecen alcanzar mayor talla y peso que los machos. Es muy escasa la información disponible para los machos (sólo se examinaron 3 individuos adultos), con datos de un ancho de disco máximo (AD) de 220 mm, correspondiente a un peso de 420 g, por lo que tanto su talla (AD) como peso máximo, seguramente sean mayores (Figura 82a). Para las hembras analizadas se registró un máximo de 483,5 mm AD y un peso de 3,7 kg (Figura 82b). 267 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Tabla 46. Datos y relaciones morfométricas para neonatos (n=12), juveniles (n=21) y adultos (n=31) de Potamotrygon yepezi de la cuenca del Lago de Maracaibo. Ancho del disco (AD), longitud del disco (LD). Estadio de desarrollo (proporción de sexos) Intervalo (mm) Promedio (mm) % AD AD LD AD LD AD LD Neonatos (6 H : 6 M) 54,1 - 72,7 57,8 - 77,6 65,9 71,6 100,8 108,7 Juveniles (12 H : 9 M) 77,3 - 117,5 80 - 131,5 94,9 103,7 101,2 109,3 Adultos (21 H : 10 M) 119 - 483,5 129,2 - 391 176,5 189,4 111,3 107,3 a. b. Figura 82. Relación talla (ancho discal)-peso de Potamotrygon yepezi, a) machos (n=20); b) hembras (n=34). Cuenca del Lago de Maracaibo. 268 Potamotrygon yepezi Potamotrygon yepezi FAMILIA POTAMOTRYGONIDAE Fernández-Yépez y Espinosa (1970) con base en 277 ejemplares examinados en el Lago de Maracaibo (especie identificada para la fecha como Potamotrygon magdalenae), señalaron que la talla y peso máximo en machos fue de 380 mm AD y 1,8 kg. Las hembras fueron mucho más grandes y pesadas, con 560 mm AD y 4,5 kg. Entre los 277 ejemplares capturados, el intervalo de talla más frecuente estuvo entre 200 y 280 mm AD, correspondiente a 400 g y 1 kg. Los pescadores de la región del Catatumbo en Colombia informan haber atrapado rayas con un ancho discal de aproximadamente 60 cm y 6 kg (sin especificar sexos). Distribución geográfica Endémica de la cuenca del Lago de Maracaibo (Colombia y Venezuela). Países: Colombia y Venezuela. Cuencas: Colombia (Catatumbo); Vene- zuela (Maracaibo). Colombia (Catatumbo), desde la parte baja hasta la población de La Gabarra y en el río Zulia, hasta las inmediaciones del Distrito de Riego del Zulia (Mojica y Usma 2012), río Sardinata; Venezuela (toda la hoya del Lago de Maracaibo, registrada para los ríos Catatumbo, Escalante, Guasare, Limón, Misoa, Motatán, Palmar y Santa Ana). Subcuencas: Registros de Potamotrygon yepezi. Lasso et al. 269 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Hábitat Común en ambientes fangosos de lagunas y ciénagas, ríos, caños y quebradas con aguas turbias y tranquilas, menos frecuente en aguas claras. Muy abundante en el Lago de Maracaibo y sus afluentes, especialmente hacia el sur del Lago. Tolera ciertos niveles de salinidad, ha sido colectada en ambientes de playas rocosas con aguas salobres en la localidad de Altagracia entre la Bahía de El Tablazo y la hoya del Lago. Fernández-Yépez y Espinosa (1970) la capturaron con redes de arrastre camaronera en ambientes salobres con una fauna acompañante típicamente estuarina. Es una especie muy abundante en toda la cuenca del Lago de Maracaibo en Venezuela, especialmente hacia la parte sur y en los embalses, donde parece haber prosperado, como es el caso del embalse El Tulé (Taphorn com. pers.). Sin embargo, en Colombia en la cuenca del Catatumbo, aunque no hay estimativos poblacionales, pareciera ser una especie poco abundante. Alimentación Carnívora: entomófaga. N=11 (1). De los 11 ejemplares examinados (cuenca del Catatumbo), tan solo uno tenía algún tipo de contenido estomacal, que correspondió en un 100% a Chironomidae. Galvis et al. (1997) señalan también para este río una dieta basada en insectos acuáticos (estadios larvales). Reproducción En la quebrada Agualazal, afluente del río Catatumbo (Colombia), las hembras parecen alcanzar la madurez sexual al menos con un ancho discal de 141 mm, ya que se registró un aborto en el momento de su captura. En esta zona los pescadores informan de manera anecdótica, que algunas rayas grandes pueden llegar a tener hasta 270 12 crías, pero esto no ha sido corroborado. Una hembra, colectada en septiembre, con 241,5 mm AD y un peso de 670 g, tuvo tres abortos, dos machos y una hembra, cada uno con un ancho de disco y un peso como se indica a continuación: M: 68,5 mm AD, 15,2 g; M: 55,4 mm AD, 12 g; H: 65,4 mm AD, 13,4 g. En el Lago de Maracaibo, Fernández-Yépez y Espinosa (1970), reportan nacimientos durante los meses de enero, marzo, mayo y junio, con ejemplares recién nacidos de una talla de 89 mm AD y 10 g. Los machos alcanzan la madurez sexual luego de los 117,5 mm AD, según muestra la relación de la longitud del clasper versus el ancho del disco (Figura 83). Movimientos y comportamiento Los habitantes de las zonas ribereñas en la cuenca media y baja del río Catatumbo en Colombia, indican que las rayas llegan por temporadas, especialmente entre los meses de septiembre a enero, desplazándose desde las ciénagas de las partes bajas hacia el cauce principal del río. También algunos de los pescadores señalan que se encuentran todo el año pero solo en las quebradas. Uso Hay información sobre su uso como especie ornamental en el mercado venezolano. Según Cabrera (com. pers.) la especie es enviada desde la ciudad de Maracaibo a los mayoristas de peces ornamentales en Caracas que la distribuyen a los minoristas (tiendas de acuarios) en esta ciudad para su venta. Se desconoce si se incluye en las exportaciones de peces ornamentales de dicho país. Ocasionalmente se consume en el sur del Lago de Maracaibo y algunos afluentes como pesca de subsistencia. Potamotrygon yepezi Potamotrygon yepezi FAMILIA POTAMOTRYGONIDAE Figura 83. Relación proporcional de la longitud del clasper vs. el ancho del disco en 27 ejemplares. Cuenca de Maracaibo. Neonatos (N), juveniles (J), adultos (A). En Colombia también forma parte ocasional de la pesca de subsistencia en la cuenca media y baja del Catatumbo. Es una especie que tiene importancia medicinal (la grasa del hígado es utilizada para tratar enfermedades asmáticas). En la región de Puerto Santander, se las captura para comercializarlas como especie ornamental, aunque no es muy frecuente debido a la aparente baja abundancia de las poblaciones. Aspectos pesqueros Método de captura. Manualmente con fines ornamentales. Se captura con guaral (nylon y anzuelo) usando como carnadas lombrices de tierra, ocasionalmente ejemplares de tamaño pequeño son capturados con atarraya. Cae accidentalmente en las redes de pesca de arrastre camaronera, también en redes de ahorque o trasmallos. Desembarques. En el sur del Lago de Maracaibo, todavía se capturan rayas en Lasso et al. lagunas y caños, con pequeñas embarcaciones de madera sin motor (cayucos) que miden entre 5 a 6 m de largo. Las capturas mensuales varían entre 20-30 kg incluyendo en dichas capturas a la raya hocicona (Dasyatis guttata) (Andrade de Pasquier com. pers.). Comercialización y exportación. En Venezuela, la especie se comercializa eventualmente como ornamental a nivel interno (2013) a un precio de 250 Bs. (US $ 0,83) (Cabrera com. pers.). Amenazas En Colombia la principal amenaza es su distribución restringida a una fracción muy pequeña de una cuenca (Catatumbo) de 25.600 km2, además de la afectación de sus hábitats. Dicha cuenca recibe también vertimientos de hidrocarburos por atentados al oleoducto Caño Limón-Coveñas. Como amenaza potencial se destaca la contaminación por agroquímicos en el 271 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Distrito de Riego del Zulia y el vertimiento de aguas negras de Cúcuta (Mojica y Usma 2012). En Venezuela las amenazas están relacionadas con la intensa actividad petrolera (derrames) en su área de distribución dentro del Lago. Medidas de conservación tomadas. Como en otras especies de rayas, la pesca incidental trae consigo la muerte de la raya (Figura 84) o la mutilación de la cola para dejarla sin la espina. Medidas de conservación propuestas. Se propone la protección de su hábitat Conservación Oportunidades de conservación. Especie con priorización media según el Plan de Acción de Nacional para la conservación y manejo de tiburones, rayas y quimeras de Colombia (Caldas-Aristizábal et al. 2010). En Venezuela se encuentra protegida dentro de la Reserva de Fauna Silvestre Ciénagas de Juan Manuel de Aguas Blancas y Aguas Negras. En Colombia no tiene ningún tipo de protección. e investigación científica que incluya las evaluaciones poblacionales, distribución espacial, estudios reproductivos y tróficos, a lo largo del tiempo. Dado que esta especie habita en una cuenca compartida con Venezuela, se considera que las medidas de conservación deben ser concertadas con las autoridades ambientales y pesqueras de ambos países (Mojica y Usma 2012). En la figura 85 se muestran diferentes patrones de coloración Figura 84. Potamotrygon yepezi, ejemplar encontrado muerto en el sur del Lago de Maracaibo. Foto. Oscar M. Lasso Alcala 272 Potamotrygon yepezi Potamotrygon yepezi FAMILIA POTAMOTRYGONIDAE a. b. c. d. Figura 85. Potamotrygon yepezi. a) río Catatumbo, Colombia; b) Aguazal, Catatumbo, Colombia; c-d) Lago Maracaibo, Venezuela. Fotos: G. Gálvis (a), A. Ortega-Lara (b), J. Hernández (c, d). Referencia de identificación Rosa (1985), Castex y Castello (1970), Galvis et al. (1997). Autores Carlos A. Lasso, Oscar M. Lasso-Alcalá, Paula Sánchez-Duarte, Lina M. Ortiz-Arroyave, Armando Ortega-Lara, João Paulo C. B. da Silva, Thiago Loboda y João Pedro Fontenelle. Lasso et al. 273 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE Bibliografía • • • • • • • 274 Almeida, M. P. 2003. Pesca, policromatismo e aspectos sistemáticos de Potamotrygon scobina Garman, 1913 (Chondrichthyes: Potamotrygonidae) da região da ilha de Colares - Baía de Marajó - Pará. Disertación de Maestría, Museu Paraense Emílio Goeldi, Universidade Federal do Pará. 145 pp. Almeida, M. P., R. B. Barthem, A. S. Viana y P. Charvet-Almeida. 2009. Factors affecting the distribution and abundance of freshwater stingrays (Chondrichthyes: Potamotrygonidae) on Marajó Island, mouth of the Amazon River. Pan-American Journal of Aquatic Sciences 4: 1-11. Almeida, M. P., P. M. O. Lins, P. CharvetAlmeida y R. B. Barthem. 2010. Diet of the freshwater stingray Potamotrygon motoro (Chondrichthyes: Potamotrygonidae), at Marajó Island (Pará, Brazil). Brazilian Journal of Biology 70: 155-162. Barbarino, A. y C. A. Lasso. 2005. Pesquería y aspectos biológicos de la raya manta Paratrygon aiereba (Müller y Henle 1841) (Myliobatiformes, Potamotrygonidae), en el río Apure (Venezuela). Memoria de la Fundación La Salle de Ciencias Naturales 163: 93-108. Barbarino, A. y C. A. Lasso. 2009. La pesca comercial de la raya manta Paratrygon aiereba (Müller y Henle, 1841) (Myliobatiformes, Potamotrygonidae) en el río Apure, Venezuela. Acta Apuroquia 1 (1): 24-31. Bragança, A. J. M., P. Charvet-Almeida y R. B. Barthem. 2004. Preliminary observations on the feeding of the freshwater stingrays Potamotrygon orbignyi, Potamotrygon scobina and Plesiotrygon iwamae (Chondrichthyes: Potamotrygonidae) in the Cotijuba Island region - Pará - Brazil. Pp. 44-59. En: Proceedings of 6 International Congress on the Biology of Fish. Manaus: American Fisheries Society. Caldas-Aristizábal, J. P., E. Castro-González, V. Puentes, M. Rueda, C. A. Lasso, L. O. Duarte, M. Grijalba-Bendeck, F. Gómez, A. F. Navia, P. A. Mejía-Falla, S. Bessudo, M. C. Diazgranados y L. A. Zapata-Padilla (Eds.). 2010. Plan de Acción Nacional para la conservación y manejo de tiburones, ra- • • • • • • yas y quimeras de Colombia (PAN-Tiburones Colombia). Instituto Colombiano Agropecuario, Secretaria Agricultura y Pesca San Andrés Isla, Ministerio de Ambiente, Vivienda y Desarrollo Territorial, Instituto de Investigaciones Marinas y Costeras, Instituto Alexander von Humboldt, Universidad del Magdalena, Universidad Jorge Tadeo Lozano, Pontificia Universidad Javeriana, Fundación SQUALUS, Fundación Malpelo, Conservación Internacional, WWF Colombia. Editorial Produmedios, Bogotá D.C. 70 pp. Carvalho, M. R. de, N. R. Lovejoy y R. S. Rosa. 2003. Family Potamotrygonidae. Pp. 22-29. En: Reis, R. E, C. J. Ferraris Jr. y S. O. Kullander (Eds.). Checklist of the Freshwater Fishes of South and Central America. EDIPUCRS, Porto Alegre. 729 pp. Carvalho, M. R. y N. R. Lovejoy. 2011. Morphology and phylogenetic relationships of a remarkable new genus and two new species of Neotropical freshwater stingrays from the Amazon basin (Chondrichthyes: Potamotrygonidae). Zootaxa 2776: 13-48. Carvalho, M. R. y M. P. Ragno. 2011. An unusual, dwarf new species of Neotropical freshwater stingray, Plesiotrygon nana sp. nov., from the upper and mid Amazon basin: the second species of Plesiotrygon (Chondrichthyes: Potamotrygonidae). Papéis Avulsos de Zoologia 51 (7): 101-138. Carvalho, M. R., M. H. Sabaj-Pérez y N. R. Lovejoy. 2011. Potamotrygon tigrina, a new species of freshwater stingray from the upper Amazon basin, closely related to Potamotrygon schroederi Fernández-Yépez, 1958 (Chondrichthyes: Potamotrygonidae). Zootaxa 2827: 1-30. Castex, M. N. 1964. Estado actual de los estudios sobre la raya fluvial neotropical. En: Cincuentenario del Museo Provincial de Ciencias Naturales “Florentino Ameghino”. Museo Provincial de Ciencias Naturales “Florentino Ameghino”. 50 pp. Castex, M. N. y H. P. Castello. 1970. Potamotrygon yepezi, n. sp. (Condrichthyes, Potamotrygonidae), a new species of freshwater stingray from Venezuelan rivers. Acta Scientifica/Instituto Latinoamericano de Fisiología y Reproducción – ILAFIR 8: 15-39. M. A. Morales-B. • • • • • • • • • Charvet-Almeida, P. y M. Pinto. 2004. Potamotrygon magdalenae. En: IUCN 2011. IUCN Red List of Threatened Species. (w w w. iu c n re d l i s t .or g /ap p s/re d l i s t / details/161385/0). Charvet-Almeida, P., M. G. Araújo y M. Almeida. 2005. Reproductive aspects of freshwater stingrays (Chondrichthyes: Potamotrygonidae) in the Brazilian Amazon Basin. Journal Northwest Atlantic Fisheries Science 35: 165-171. Charvet-Almeida, P., M. Pinto de Almeida y R. S. Rosa. 2009. Plesiotrygon iwamae. En: IUCN 2013. IUCN Red List of Threatened Species. Version 2013.1. <http://www.iucnredlist.org/details/full/161699/0>. Consultada el 16 de julio 2013. Charvet-Almeida, P., R. S. Rosa y M. P. Almeida. 2009. Potamotrygon leopoldi. En: IUCN 2013. IUCN Red List of Threatened Species. Version 2013.1. <www.iucnredlist. org>. Consultada el 09 septiembre 2013. Dahl, G. 1971. Los peces del norte de Colombia. Ministerio de Agricultura, Instituto de Desarrollo de los Recursos Naturales Renovables (INDERENA). Talleres Litografía Arco. Bogotá D.C., Colombia. 391 pp. Deynat, P. 2006. Potamotrygon marinae. n. sp., une nouvelle espèce de raies d’eau douce de Guyane (Myliobatiformes, Potamotrygonidae). Comptes Rendus Biologies 329: 483-493. Drioli, M. y G. Chiaramonte. 2005. Potamotrygon motoro. En: IUCN 2013. IUCN Red List of Threatened Species. Version 2013.1. (http://www.iucnredlist. org/details/39404/0). Consultada el 31 Octubre 2013. Duncan, W. P. y M. N. Fernandes. 2010. Physicochemical characterization of the white, black, and clearwater rivers of the Amazon Basin and its implications on the distribution of freshwater stingrays (Chondrichthyes, Potamotrygonidae). PanAmerican Journal of Aquatic Sciences 5 (3): 454-464. Fernández, J., F. Provenzano y C. A. Lasso. 2006. Catálogo ilustrado de los peces de la cuenca del río Cataniapo. Instituto Nacional de Investigaciones Agrícolas. Publica- • • • • • • • • ción Especial. Número 19. Maracay. 272 pp. Fernández-Yépez, A. y V. Espinosa. 1970. Observaciones en el peso y ancho del disco de la raya pintada Potamotrygon magdalenae (Duméril). Acta Scientífica / Instituto Latinoamericano de Fisiología y Reproducción 8 ILAFIR (2): 7-10. Franco Jaramillo, M., P. A. Zuluaga, M. T. Sierra Quintero, C. L. Sánchez, C. A. Lasso, J. S. Usma Oviedo. 2013. Avances en el proceso de ordenamiento pesquero de las cuencas bajas de los ríos Atabapo, Inírida y Guaviare. En: Usma, J. S., F. Trujillo y C A. Lasso (Eds.). Biodiversidad de la Estrella Fluvial de Inírida. WWF Colombia-CDAFundación Omacha-IAvH. Bogotá DC (en prensa). Galvis, G., J. I. Mojica y M. Camargo. 1997. Peces del Catatumbo. ECOPETROL / OXY / SHELL-Asociación Cravo Norte. D’Vinni Edit. Ltda, Santa Fe de Bogotá. 118 pp. Gama, C. S. 2013. Diversidade e ecologia das raias de água doce (Chondrichthyes: Potamotrygonidae) da Reserva Biológica do Parazinho, AP. Tesis Doctoral. Universidade Federal da Paraíba, João Pessoa. 255 pp. Góes de Araújo, M. L. 2009. Potamotrygon schroederi. En: IUCN 2013. IUCN Red List of Threatened Species. Version 2013.1. (w w w.iucnredlist.org/apps/redlist/details/ 161365/0). Consultada el 04 julio 2013. Góes de Araújo, M. L. 2011. Dinâmica de população de Paratrygon aiereba (Chondrichthyes-Potamotrygonidae) no médio Rio Negro, Amazonas. Tesis de Doctorado, Universidad Federal del Amazonas, Manaos. 106 pp. Góes de Araújo, M. L. y G. Rincón. 2009. Paratrygon aiereba. En: IUCN 2013. IUCN Red List of Threatened Species. Version 2013.1. (http://www.iucnredlist.org/details/161588/0). Consultada el 08 Agosto 2013. Góes de Araújo, M. L., M. Pinto de Almeida, G. Rincón, P. Charvet-Almeida, P. y R. S. Rosa. 2009. Potamotrygon orbignyi. En: IUCN 2013. IUCN Red List of Threatened 275 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE • • • • • • 276 Species. Version 2013.1. (http://www.iucnredlist.org/details/161609/0). Consultada el 26 Agosto 2013. Gutiérrez, M. 2007. Plesiotrygon iwamae. Pp. 58–59. En: Galvis, G., P. Sánchez-Duarte, L. M. Mesa S., Y. López, M. A. Gutiérrez, A. Gutiérrez C., M. Leiva C. y C. Castellanos. 2007. Peces de la Amazonía colombiana con énfasis en especies de interés ornamental. Instituto Colombiano de Desarrollo Rural (Incoder), Universidad Nacional de Colombia e Instituto Amazónico de Investigaciones Científicas (Sinchi), Bogotá, Colombia. 489 pp. Instituto Colombiano de Desarrollo Rural – Incoder. 2012. Estadísticas de exportación de especies de la familia Potamotrygonidae (2007-2011). Bogotá, Colombia. IUCN 2013. IUCN Red List of Threatened Species. Version 2013.1. <www.iucnredlist.org>. Consultada 09 octubre 2013. Jiménez-Segura, L. F., R. Álvarez-León, F. Gutiérrez-Bonilla, S. Hernández, M. Valderrama-Barco y F. Villa-Navarro. 2011. La pesca y los recursos pesqueros en los embalses colombianos. Capítulo 7.2. Pp. 233-281. En: Lasso, C. A., F. de P. Gutiérrez, M. A. Morales-Betancourt, E. Agudelo, H. Ramírez-Gil y R. E. Ajiaco-Martínez (Eds.). II. Pesquerías continentales de Colombia: cuencas del Magdalena-Cauca, Sinú, Canalete, Atrato, Orinoco, Amazonas y vertiente del Pacífico. Serie Editorial Recursos Hidrobiológicos y Pesqueros Continentales de Colombia. Instituto de Investigación de los Recursos Biológicos Alexander von Humboldt. Bogotá, D. C., Colombia. Kawakami, E. y G. Vazzoler. 1980. Método grafico e estimative do indice alimentar aplicado no estudo de limentacao de peixes. Boletin Instituto Oceanográfico de Sao Paulo 29 (2): 250-207. Lasso, C. A. y P. Sánchez-Duarte. 2012a. Paratrygon aiereba. Pp. 132 - 134. En: Mojica, J. I., J. S. Usma, R. Álvarez-León y C. A. Lasso (Eds.). 2012. Libro rojo de peces dulceacuícolas de Colombia 2012. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt, Instituto de Ciencias Naturales de la Universidad • • • • • • • • Nacional de Colombia, WWF Colombia y Universidad de Manizales Bogotá, D. C., Colombia. Lasso, C. A. y P. Sánchez-Duarte. 2012b. Potamotrygon motoro. Pp. 146 - 148. En: Mojica, J. I. et al. (Eds.). 2012. Libro rojo de peces dulceacuícolas de Colombia 2012. Lasso, C. A. y P. Sánchez-Duarte. 2012c. Potamotrygon orbignyi. Pp. 243 - 245. En: Mojica, J. I. et al. (Eds). 2012. Libro rojo de peces dulceacuícolas de Colombia 2012. Lasso, C. A. y P. Sánchez-Duarte. 2012d. Potamotrygon schroederi. Pp. 149 - 151. En: Mojica, J. I. et al. (Eds.). 2012. Libro rojo de peces dulceacuícolas de Colombia 2012. Lasso, C. A., A. Rial y O. Lasso-Alcalá. 1996. Notes on the biology of the freshwater stingrays Paratrygon aiereba (Müller y Henle, 1841) and Potamotrygon orbignyi (Castelnau, 1855) (Chondrichthyes: Potamotrygonidae) in the Venezuelan Llanos. Aqua, Journal of Ichthyology & Aquatic Biology 2 (3): 39-50. Lasso, C. A., A. Acosta-Santos y E. AgudeloCórdoba. 2010. Primer registro de la raya látigo o antena Plesiotrygon iwamae Rosa, Castello y Thorson 1987 (Chondrichthyes: Potamotrygonidae) para Colombia. Biota Colombiana 11 (1 - 2): 173-175. Lasso, C. A., H. B. Ramos-Socha, T. S. Rivas-Lara y C. E. Rincón-López. 2011. Potamotrygon magdalenae. Pp. 136-137. En: Lasso, C. A., E. Agudelo Córdoba, L. F. Jiménez-Segura, H. Ramírez-Gil, M. Morales-Betancourt, R. E. Ajiaco-Martínez, F. de P. Gutiérrez, J. S. Usma, S. E. Muñoz Torres y A. I. Sanabria Ochoa (Eds.). I. Catálogo de los recursos pesqueros continentales de Colombia. Serie Editorial Recursos Hidrobiológicos y Pesqueros Continentales de Colombia. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt (IAvH). Bogotá, D. C., Colombia. Lasso, C. A., H. B. Ramos-Socha, T. S. Rivas-Lara y C. E. Rincón-López. 2012. Potamotrygon magdalenae. Pp. 240 - 242. En: Mojica, J. I. et al. (Eds.). 2012. Libro rojo de peces dulceacuícolas de Colombia 2012. Loboda, T. S. 2010. Revisão taxonômica e morfológica de Potamotrygon motoro (Müller M. A. Morales-B. • • • • • • • y Henle, 1841) na bacia Amazônica (Chondrichthyes: Myliobatiformes: Potamotrygonidae). Disertación de Maestria, Instituto de Biociências, Universidade de São Paulo, São Paulo. 305 pp. Maldonado-Ocampo, J. A., A. Ortega-Lara, J. S. Usma., G. Galvis., F. A. Villa-Navarro, L. Vásquez, S. Prada-Pedreros y C. Ardila. 2005. Peces de los Andes de Colombia. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Bogotá, D. C. Colombia. 346 pp. Mejía-Falla, P. A., A. Ramirez, J. S. Usma, L. A. Muñoz, J. Maldonado-Ocampo, A. I. Sanabria y J. C. Alonso. 2009. Estado del conocimiento de las rayas dulceacuícolas de Colombia. Pp. 197-245. En: Puentes, V., A. F. Navia, P. A. Mejía-Falla, J. P. Caldas, M. C. Diazgranados y L. A. Zapata (Eds.). Avances en el conocimiento de tiburones, rayas y quimeras de Colombia. Fundación SQUALUS, Ministerio de Ambiente Vivienda y Desarrollo Territorial, Instituto Colombiano Agropecuario, COLCIENCIAS, Conservación Internacional, WWF. Mejía-Falla, P. A., L. Muñoz, V. Ramírez y A. F. Navia. 2010. Caracterización biológica-pesquera y socioeconómica de la pesca de rayas de agua dulce en Puerto Carreño, Orinoquia Colombiana. Documento técnico Fundación SQUALUS No FS0410. 16 pp. Miles, C. 1971. Los peces del río Magdalena. Ministerio de Economía Nacional. Sección de piscicultura, pesca y caza. Bogotá, Colombia. 242 pp. Mojica, J. I. y J. S. Usma. 2012. Potamotrygon yepezi. Pp. 152 - 153. En: Mojica, J. I. et al. (Eds.). 2012. Libro rojo de peces dulceacuícolas de Colombia 2012. Mojica, J. I., J. S. Usma, R. Álvarez-León y C. A. Lasso (Eds.). 2012. Libro rojo de peces dulceacuícolas de Colombia 2012. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt, Instituto de Ciencias Naturales de la Universidad Nacional de Colombia, WWF Colombia y Universidad de Manizales Bogotá, D. C., Colombia, 319 pp. Moro, G., P. Charvet y R. S. Rosa. 2011. Aspectos da alimentação da raia de água doce • • • • • • • • Potamotrygon orbignyi (Chondrichthyes: Potamotrygonidae) da bacia do rio Parnaíba, nordeste do Brasil. Revista Nordestina de Biologia 20: 47-57. Mosquera, M. D. 2012. Aspectos bioecológicos de la raya de río Potamotrygon magdalenae en la cuenca media del río Atrato – Colombia. Tesis de pregrado, Universidad Tecnológica del Choco “Diego Luis Córdoba”, Facultad de Ciencias Básicas, Programa de Biología con énfasis en Recursos Naturales. Quibdó, Colombia. 52 pp. Muñoz-Osorio, L. A. y P. A. Mejía-Falla. 2013. Primer registro de la raya manzana, Paratrygon aiereba (Müller y Henle, 1841) (Batoidea: Potamotrygonidae) para el río Bita, Orinoquia, Colombia. Latin American Journal of Aquatic Research 41 (1): 189-193. Ng, H. H., H. H. Tuin, D. C. J. Yeo y P. K. L. Ng. 2010. Stinger in a strange land: South American freshwater stingrays (Potamotrygonidae) in Singapore. Biological Invasions 12: 2385 - 2388. Perdomo-Nuñez, J. M. 2005. Rayas de agua dulce del género Potamotrygon utilizadas como ornamentales en Colombia. ACOLPECES. Bogotá D. C. Informe técnico 15 pp. Ramos, H. A. C. 2009. Exploration and commerce of freshwater stingrays in Brazil. Report to the Regional Workshop on South American Freshwater Stingrays, Geneva, 15–17 April 2009. Ramos-Socha, H. 2010. Algunos aspectos biológicos de la raya de agua dulce Potamotrygon magdalenae (Duméril, 1865) (Chondrichthyes: Myliobatiformes) en la Ciénaga de Sabayo, Guaimaral, MagdalenaColombia. Trabajo de Grado, Universidad de Bogotá Jorge Tadeo Lozano, Facultad de Ciencias Naturales, Programa de Biología Marina, Santa Marta. 80 pp. Ramos-Socha, H. y M. Grijalba-Bendeck. 2011. Bioecología de la raya de agua dulce Potamotrygon magdalenae (Duméril, 1865) (Myliobatiformes) en la ciénaga de Sabayo, Guaimaral, Colombia. Revista U.D.C.A. Actualidad y Divulgación Científica 14 (2): 109 – 118. Rincon-Filho, G. 2006. Aspectos taxonômicos, alimentação, e reprodução da raia 277 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FAMILIA POTAMOTRYGONIDAE • • • • • • 278 de água doce Potamotrygon orbignyi (Castelnau) (Elasmobranchii: Potamotrygonidae) no rio Paranã-Tocantins. Tesis de Doctorado, Universidad Estatal Paulista, Campus de Rio Claro. 132 pp. Rojas-Ceballes, K., C. Rubio-Pérez, F. Lozano-Devia y C. Rodríguez-Sierra. 2013. Conocimiento local enfocado al uso del recurso hidrobiológico raya (Potamotrygon magdalenae) para las áreas de influencia Neiva, Hobo y Betania frente al aprovechamiento de los productos y subproductos del recurso. En: Resumenes del XII Congreso colombiano de ictiología y III encuentro de ictiólogos suramericanos. Bogotá, Colombia. Rosa, R. S., M. R. de Carvalho y C. A. Wanderley. 2008. Potamotrygon boesemani (Chondrichthyes: Myliobatiformes: Potamotrygonidae), a new species of neotropical freshwater stingray from Surinam. Neotropical Ichthyology 6: 1–8. Rosa, R. 1985. A systematic revision of the South American freshwater stingrays (Chondrichthyes: Potamotrygonidae). Tesis Doctoral. Williamsburg, College of William and Mary, Virginia. 523 pp. Rosa, R., P. Charvet-Almeida y C. C. Diban. 2010. Biology of the South American Potamotrygonid Stingrays. Chapter 5. Pp. 241 – 286. En: Carrier, J. C., J. A. Musick y M. R. Heithaus (Eds.). Sharks and their relatives II. Biodiversity, adaptive physiology and conservation. CRC Press. 639 pp. Shibuya, A., M. L. G. Araújo y J. A. S. Zuanon. 2009. Analysis of stomach contents of freshwater stingrays (Elasmobranchii, Potamotrygonidae) from the middle Negro River, Amazonas, Brazil. Pan-American Journal of Aquatic Sciences 4 (4): 466-475. Silva, J. P. C. B. 2009. Revisão taxonômica e morfológica do complexo Potamotrygon orbignyi (Castelnau, 1855) (Chondrichthyes: Myliobatiformes: Potamotrygonidae). Te- • • • • • • • sis de Maestría, Universidad de São Paulo, São Paulo. 214 pp. Silva, J. P. C. B. y M. R. de Carvalho. 2011. A new species of Neotropical freshwater stingray of the genus Potamotrygon Garman, 1877 from the Río Madre de Díos, Peru (Chondrichthyes: Potamotrygonidae). Papéis Avulsos de Zoologia 51: 139 - 154. Silva, J. P. C. B. y M. R. de Carvalho. 2011. A taxonomic and morphological redescription of Potamotrygon falkneri Castex y Maciel, 1963 (Chondrichthyes: Myliobatiformes: Potamotrygonidae). Neotropical Ichthyology 9 (1): 209 - 232. Silva, J. P. C. B. 2010. Revisão taxonomica e morfologica do complex Potamotrygon orbignyi (Castelnau, 1855) (Chondrichthyes: Myliobatiformes: Potamotrygonidae). (Master’s Dissertation). Universidade de São Paulo, São Paulo. 198 pp. Teshima, K. y K. Takeshita. 1992. Reproduction of the freshwater stingray, Potamotrygon magdalenae taken from the Magdalena River system in Colombia, South America. Bulletin Seikai National Fisheries Research Institute 70: 11-27. Thorson, T. B., J. K. Langhammer y M. I. Oetinger. 1983. Reproduction and development of the South American freshwater stingrays, Potamotrygon circularis and P. motoro. Environmental Biology of Fishes 9: 3–24. Valenti, S. V. 2009. Potamotrygon constellata. En: IUCN 2013. IUCN Red List of Threatened Species. Version 2013.1. <www.iucnredlist.org>. Consultada el 08 agosto 2013. Villa-Navarro, F. 1999. Estudio biológico pesquero de la represa de Prado para la determinación de especies promisorias en acuicultura. Informe Final. Universidad del Tolima, Cortolima, Inpa, Gobernación del Tolima y Comité Departamental de Cafeteros del Tolima. Ibagué. 105 pp. Ciénaga de Paredes, caserío Campo Duro, Puerto Wilches. Foto: N. Ortíz 6. Sistemática y citogenética: estado actual, limitaciones y alcances 6.1 Aproximación a la filogenia molecular de la familia Potamotrygonidae en Colombia y Venezuela: aplicaciones en sistemática y conservación 6.2 Estatus cario-evolutivo de las rayas con énfasis en las especies de agua dulce (Potamotrygonidae) 281 Río Meta entre Sugranel y Primavera. Foto: J. Delgado M. A. Morales-B. 6.1 Aproximación a la filogenia molecular de la familia Potamotrygonidae en Colombia y Venezuela: aplicaciones en sistemática y conservación David A. García-Villamil, Carlos A. Lasso y Susana Caballero La filogenética y la filogeografía permiten esclarecer las relaciones evolutivas y estimar la diversificación genética de las especies a través de su área de distribución, así como el factor histórico de esa misma diversificación incluyendo la evaluación de hipótesis evolutivas (Whelan et al. 2001, Hebert et al. 2003a, b, Ward et al. 2008, Ward et al. 2009). Este tipo de información es relevante para entender la diversidad genética de las especies, dato clave en el establecimiento de medidas de manejo y conservación de las mismas. En este capítulo se revisan las aproximaciones moleculares sobre la sistemática de la familia Potamotrygonidae. Dentro de esta familia se incluyen las rayas de agua dulce distribuidas en los principales ríos de Suramérica y cuya taxonomía aún no es clara (Araújo et al. 2004). Pocos trabajos se han enfocado en el estudio de las relaciones evolutivas y la filogeografía de rayas de agua dulce. Para poder aclarar la taxonomía de estos organismos y entender las dinámicas genético-poblacionales de estas especies, es necesario entonces tener claridad en la sistemática de la familia, con mi- ras a profundizar en el estudio de las especies, las cuales tienen un valor importante como peces ornamentales y podrían estar siendo sometidas a sobre-explotación. Se resumen brevemente los trabajos realizados hasta el momento en sistemática molecular de este grupo y se presentan los resultados de una investigación realizada recientemente por la Universidad de Los Andes y el Instituto Humboldt, sobre la sistemática molecular de las especies de rayas presentes en Colombia y Venezuela, sugiriendo puntos importantes a tener en cuenta para aclaraciones taxonómicas a futuro. Antecedentes y aproximaciones metodológicas Sistemática molecular de las rayas de agua dulce y la paleobiogeografía de Suramérica La investigación de Lovejoy et al. (1998) a pesar de no estar enfocada específicamente en la sistemática de estos organismos, fue una de las primeras en incorporar da- 283 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FILOGENIA MOLECULAR tos moleculares de rayas de agua dulce. El objetivo del estudio consistía en evaluar la hipótesis de incursiones marinas en los sistemas de agua dulce de América del Sur desde el Caribe, donde se propone que el grupo hermano de los potamotrigónidos debía tener su origen o al menos ser parte de su área de distribución. También se plantea que el tiempo de divergencia del grupo concuerda con las incursiones marinas del Mioceno y finalmente, que los taxones basales de Potamotrygonidae deberían estar distribuidos en las cuencas al norte de Suramérica. En este estudio se sugiere al género Himantura (raya chupare) como el grupo hermano de los potamotrigónidos, derivando de un ancestro común que habría entrado al sistema de ríos de Suramérica por las incursiones del Caribe en el Mioceno medio. Estos planteamientos fueron presentados en la investigación debido a evidencias obtenidas mediante estimaciones de reloj molecular, usando el marcador molecular Citocromo b Oxidasa (Cyt-b), que permitieron inferir un tiempo de divergencia en un intervalo de 15 y 23 millones de años atrás para la divergencia entre la familia Potamotrygonidae y su grupo hermano, junto a tiempos de diversificación de al menos ocho millones de años para especies de esta familia en los ríos de América del Sur. La figura 1 muestra la filogenia molecular obtenida en esta investigación, donde se plantea a Paratrygon como el género basal del grupo y se muestra a Potamotrygon como un grupo no monofilético, sin embargo, se requieren un mayor número de muestras para reconstruir adecuadamente la filogenia del grupo (Funk y Omland 2003). Evolución de las rayas de agua dulce y sus parásitos Marques (2000) realizó una investigación utilizando sistemática molecular y datos parasitológicos, dirigida a estudiar los orígenes y patrones de diversificación de la familia Potamotrygonidae, utilizando los Figura 1. Topología del gen Cyt-b con escala de tiempo de incursiones marinas a Suramérica. Fuente: Lovejoy et al. (1998). 284 M. A. Morales-B. parásitos para estudiar los componentes biogeográficos de las rayas de agua dulce. Por medio de datos de los marcadores moleculares ARN ribosomal12S (12S), ARN ribosomal 16S (16S), Citocromo c Oxidasa subunidad 1 (COI) y Cyt-bcombinados con 65 caracteres morfológicos, esta investigación soportó la monofilia de la familia y a su vez que el género marino más cercano era Himantura. El análisis filogenético se realizó mediante análisis de parsimonia máxima, donde se encontraron ambigüedades en la agrupación de los géneros Potamotrygon y Plesiotrygon. Individuos provenientes del Río Negro no mostraron una relación clara, indicando que Potamotrygon no era un grupo monofilético (Figura 2). Además de estos análisis filogenéticos, en dicha investigación se realizó un reloj molecular que permitió estimar que la divergencia de las rayas de agua dulce ocurrió aproximadamente 19 millones de años atrás en el Mioceno temprano. Sin embargo, los limites de confianza abarcaban cualquier punto entre 6 - 38 millones de años atrás. Esta investigación fue la primera en intentar definir las relaciones entre especies dentro del género Potamotrygon, aunque estuvo basada en pocos ejemplares por especie y algunas especies no fueron muestreadas en toda su área de distribución geográfica, por lo que no es muy clara la relación entre las mismas (Toffoli et al. 2008). Códigos de barras moleculares: utilidad del “barcoding” de ADN en la identificación de especies y el estudio de la radiación de rayas de agua dulce del género Potamotrygon La investigación de Toffoli et al. (2008) puso a prueba la utilidad del marcador molecular COI como herramienta para lograr Figura 2. Topología de parsimonia máxima para los genes concatenados 12S, 16S, Cyt-b y COI incluyendo caracteres morfológicos. Fuente: Marques (2000). 285 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FILOGENIA MOLECULAR la identificación molecular de especies de la familia Potamotrygonidae. Se conoce como “código de barras”, en inglés “barcode” molecular, una secuencia corta de ADN que permite la identificación a nivel de especie de un organismo (Hebert et al. 2003a). Los códigos de barras moleculares son importantes en el campo de la genética de la conservación ya que permiten la identificación a nivel de especies, que de otra manera puede presentar dificultades para su diferenciación morfológica. En el caso de las rayas de la familia Potamotrygonidae permitirían la identificación de especies y el monitoreo de cantidades de éstas sujetas a tráfico y su comercialización como peces ornamentales en diversos países (Baker 2008). Por lo general, se considera que el “código de barras” universal para especies animales, es una porción del gen mitocondrial codificante para el COI, donde se establece como premisa que si mediante esta porción del gen son agrupados los individuos, entonces estos deben pertenecer a la misma especie (Hebert et al. 2003a). En el estudio de Toffoli y colaboradores (2008), se realizó un análisis filogenético exhaustivo de la familia usando el gen COI mediante tres métodos de análisis filogenético distintos. El primero es el “neighbor-joining”, que es el método estándar utilizado en “barcoding”; el segundo es la verosimilitud máxima y el tercero el análisis de inferencia bayesiana. En este trabajo se incluyeron diez de las 18 especies descritas para el género Potamotrygon y una especie del género Plesiotrygon. No se incluyeron muestras pertenecientes a los géneros Paratrygon y Heliotrygon. Como se puede ver en la figura 3, dentro de los resultados de este trabajo se situó al género Plesiotrygon dentro de Potamotrygon, indicando que posiblemente el segundo no sea monofilético. Así mismo, un grupo 286 de especies del género Potamotrygon, presentaron falta de monofilia recíproca: Potamotrygon motoro, Potamotrygon orbignyi, y Potamotrygon scobina. Esto pudo deberse a que a pesar del extenso muestreo, en el que se tomaron al menos dos localidades para cada especie y al menos cuatro individuos por especie, se encontraron haplotipos compartidos extensamente, causando la falta de monofilia recíproca, lo cual llevaría a dudar sobre la identidad real de algunas especies dentro de este género (Toffoli et al. 2008). Según la investigación, el agrupamiento de estas tres especies por haplotipos compartidos puede indicar varias cosas. En primer lugar que la validez taxonómica de las especies debe ser reevaluada o que los linajes no han tenido suficiente tiempo de divergencia como para adquirir monofilia recíproca. Adicionalmente se sugiere la posibilidad de que haya hibridación entre especies. Para explicar lo ocurrido con P. motoro, P. orbignyi y P. scobina, la investigación planteó dos hipótesis. Una hipótesis sugiere la posibilidad de que estas especies nominales puedan estar representando a una sola especie altamente policromática con un área amplia de distribución ya que se ha visto sobrelapamiento en algunos de sus caracteres morfológicos. La segunda plantea que cada especie es distinta y válida, donde P. motoro es el ancestro, dado que se puede ver que las otras dos especies están anidadas con P. motoro, y en ese caso P. scobina y P. orbignyi podrían estar en un proceso de especiación incipiente. Para probar esta última hipótesis es necesario obtener datos adicionales sobre la ecología, el comportamiento y de la distribución poblacional de estas especies. M. A. Morales-B. Figura 3. Topología de análisis de inferencia bayesiana con el gen COI para la familia Potamotrygonidae. Fuente: Toffoli et al. (2008). En cuanto a la utilidad del “barcoding” la conclusión es que para una correcta asignación de ejemplares a especies es posible sólo adicionando otros tipos de datos, como morfológicos, ecológicos y etológicas. Es decir, el marcador COI no 287 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FILOGENIA MOLECULAR es un buen “código de barras” a nivel de especies en el caso de rayas de la familia Potamotrygonidae. deben ser implementadas en cada cuenca del río (o subcuencas) y no sólo a nivel de la gran cuenca del Amazonas. Filogeografía y genética de la conservación de la raya manta (Paratrygon aiereba) Resultados actuales La investigación de Frederico et al. (2012) se enfocó en el estudio del género Paratrygon, donde se analizó la estructura genética de cinco ríos de la región amazónica utilizando dos marcadores moleculares mitocondriales, ATP sintetasa F0 subunidad 6 (ATPasa 6) y COI. El análisis de los sets de datos se realizó mediante verosimilitud máxima y en el caso de COI se usó también “neighbor-joining”. Los resultados indicaron que Paratrygon es el grupo hermano de los demás potamotrigónidos y que las poblaciones de cada río presentan estructura genética, es decir, que existe mínimo o casi nulo flujo genético mediado por hembras entre estos ríos. También se evidenció correlación entre las distancias genéticas y las distancias geográficas, es decir, que entre más alejadas geográficamente se encuentren las poblaciones, se encuentran genéticamente más diferenciadas. Teniendo en cuenta las premisas del “barcoding”, concluyeron que la distribución alopátrica de tres clados de P. aiereba y su divergencia en las topologías, prueba que son probablemente tres especies biológicas diferentes (Figura 4). También se concluye que el análisis del marcador molecular COI en esta investigación permite apoyar lo que se ha planteado sobre un posible complejo de especies dentro del género Paratrygon y dado que las rayas de agua dulce de esta familia son altamente aprovechadas en la pesca ornamental, las estrategias de conservación 288 Sistemática molecular de las rayas de agua dulce en las cuencas del Amazonas, Orinoco, Magdalena, Essequibo, Caribe y Maracaibo (Colombia- Venezuela): evidencia de genes mitocondriales A partir del 2010, en la Universidad de los Andes se ha venido realizando una investigación enfocada en la sistemática molecular de las rayas de agua dulce en Colombia y Venezuela en colaboración con el Instituto Alexander von Humboldt y la Fundación La Salle de Ciencias Naturales (García-Villamil 2012). El objetivo de este estudio estuvo enmarcado en el Plan de Acción Nacional de Tiburones, PANTiburones, Colombia (Caldas et al. 2010), que establece la necesidad de incluir herramientas moleculares que puedan contribuir a la conservación y manejo de los elasmobranquios. Se buscó reconstruir una aproximación sistemática del grupo analizando los marcadores moleculares Cyt-b, COI y ATPasa 6, de muestras colectadas en las cuencas de los ríos Amazonas, Orinoco, Magdalena, Essequibo, Atrato y Lago de Maracaibo. En esta investigación se amplificó por PCR y secuenciaron un aproximado de 500 pares de bases (pb) para el gen mitocondrial Cyt-b,700 pb para COI y 800 pb para ATPasa 6. La investigación manejó los métodos de verosimilitud máxima e inferencia bayesiana para obtener las topologías del grupo, las cuales comparten la mayoría de clados en común (Figura 5). Se realizó un análisis independiente de cada gen y se concatenaron los fragmen- M. A. Morales-B. Figura 4. Topología de “neighbor-joining” para Paratrygon con soportes en las ramas. Se incluyeron secuencias de otro estudio (línea verde) en la topología; marcador molecular COI. Fuente: Frederico et al. (2012). tos. Todos los marcadores mostraron un soporte alto en las ramas, pero se pudo ver que Cytb (Figura 6), soporta relaciones previamente establecidas a nivel morfológico. Este marcador ha probado ser efectivo resolviendo relaciones en linajes divergentes (Martin et al. 1992, Zhu et al. 1994, García et al. 2000), incluso previamente dentro de Batoidea, donde mostró también mayor compatibilidad entre los datos moleculares morfológicos probando ser más efectivo (Dunn et al. 2003). El marcador molecular COI, que es el marcador molecular estándar en el “barcoding” de ADN, comparte muchas similitudes en su topología comparándolo con los otros dos 289 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FILOGENIA MOLECULAR marcadores, aunque en estudios anteriores no ha provisto ninguna ventaja clara en la identificación de potamotrigónidos (Toffoli et al. 2008). El marcador molecular ATPasa6 ha sido previamente usado en potamotrigónidos en el estudio poblacional del género Paratrygon (Frederico et al. 2012) y muestra muchas similitudes con las otras topologías. Sin embargo, se ve en esta topología una clara diferencia ya que sitúa al género Plesiotrygon dentro de Potamotrygon, asociación que se ha presentado ya en los estudios previos presentados en el capítulo, por lo que hay que considerar que Potamotrygon puede no ser monofilético. Sin embargo, se debe tener en cuenta que es el género más diverso de la familia y que se ha propuesto que ha sufrido un proceso reciente de radiación (Toffoli et al. 2008), por lo que el modelo evolutivo en este caso puede estar subestimando la divergencia de las secuencias dentro de estos grupos con divergencia reciente. Para confirmar el efecto de un solo marcador sobre la topología es necesario tener información genética completa, incluyendo ADN tanto mitocondrial como nuclear (Duchêne et al. 2011). Los resultados de la investigación sitúan a la especie Heliotrygon gomesi en el punto más basal del árbol (Nodo A), estableciendo al género Heliotrygon como el más basal la familia y situando también a Paratrygon como el grupo hermano de Plesiotrygon y Potamotrygon (Figura 5). Dentro del género Paratrygon existe una evidente separación en dos grupos principales (Nodo B). Esta separación está definida por los dos principales sistemas fluviales al que pertenece la cuenca donde fueron tomadas las muestras, Orinoco y Amazonas. En cuanto al género Plesiotrygon (Nodo C) se soporta su monofilia, pero la topología de 290 Cyt-b (Figura 6), difiere en su ubicación con la topología concatenada (Figura 5), ya que se ubica como grupo hermano del género Potamotrygon. Dentro del género Potamotrygon se observa que las especies P. schroederi y P. orbigny se agrupan como hermanas (Nodo F) y a su vez el grupo de estas dos se agrupa junto a P. yepezi como grupo hermano y en un punto más basal se ubica a P. magdalenae como hermana del grupo de las tres primeras especies (Nodo E). En la topología concatenada, la última relación planteada no se ve bien resuelta, lo que puede deberse a la subestimación de datos previamente planteada. Finalmente, la especie P. motoro aparece junto al grupo anterior pero forma un complejo (Nodo D), porque dentro de la especie se ubican los individuos pertenecientes a las rayas encontradas en el delta del río Orinoco (Potamotrygon sp.), que presentan diferencias morfológicas, pero que genéticamente no parecen mostrar diferencias. A pesar de esto, se puede ver un patrón interesante en la forma en que se agrupan los ejemplares de este complejo, donde hay agrupaciones que pueden dar indicios de una radiación definida por cuencas. Aún no se puede hablar de especiación por cuencas, no sin determinar los límites que definen a una especie en este grupo, límites que deben incluir estudios a nivel morfológico, ecológico y poblacional, pero sí se puede decir que hay una evidente separación de poblaciones por cuencas que debe ser evaluada. En cuanto la población del delta del río Orinoco, las diferencias morfológicas y su parecido genético con P. motoro son parte de su historia evolutiva, es decir, son características que pueden no estar relacionadas entre si debido a factores ecológicos y que deben ser evaluadas de forma holística para establecer la divergencia real de la población (Toffoli et al. 2008). M. A. Morales-B. Figura 5. Topología de inferencia bayesiana para los genes concatenados con probabilidad posterior en las ramas. Géneros y especies de Potamotrygonidae provenientes de las cuencas del Amazonas, Orinoco, Essequibo (Cuyuní), Maracaibo y Magdalena (ColombiaVenezuela), junto a ríos y localidades de muestreo. Discusión Las diferencias entre topologías y las relaciones aún sin resolver, sugieren que el proceso evolutivo de estas especies de potamotrigónidos no puede ser evaluado solo con estos marcadores mitocondriales, sino que es necesaria información genéti- ca mas completa, incluyendo ADN tanto mitocondrial como nuclear para obtener la historia evolutiva de la familia (Bernardi et al. 1993, Duchêne et al. 2011). Sobre las especies Paratrygon aiereba y Potamotrygon motoro se discute una posible separación por cuencas que debe ser estudiada a ni- 291 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FILOGENIA MOLECULAR Figura 6. Topología de inferencia bayesiana para Cyt-b con probabilidad posterior en las ramas.Géneros y especies de Potamotrygonidae provenientes de las cuencas del Amazonas, Orinoco, Esequibo (Cuyuní), Maracaibo y Magdalena (Colombia-Venezuela), junto a ríos y localidades de muestreo. * Secuencias tomadas de NCBI (http://www.ncbi.nlm.nih.gov/); Códigos de acceso: JF358007 y JF358008. vel poblacional, ya que se han encontrado evidencias de esto en otras especies como Potamotrygon schroederi (Toffoli et al. 2008). Estos resultados sugieren una posible separación entre cuencas donde el 292 flujo genético no ha sido constante y puede estar relacionado a procesos de paleogeografía (Posada y Crandall 2001). Estos procesos paleogeográficos corresponden al levantamiento de los Andes, donde el M. A. Morales-B. sistema paleo Amazonas-Orinoco, lugar en que muchas especies compartían el mismo sistema fluvial, se separó. La separación del sistema ocurrió alrededor de 10 a 11 millones de años atrás, cuando se levantó la cordillera oriental de los Andes, definiendo gradualmente el flujo actual de los dos sistemas de ríos (Lundberg et al. 1998), que en la actualidad están conectados de la siguiente manera: río AmazonasRío Negro- brazo del Casiquiare- río Orinoco. Esta conectividad actual puede ser tanto una barrera como una oportunidad para mantener poblaciones de los dos sistemas conectadas (Winemiller et al. 2008). Se ha sugerido que en el caso de Paratrygon aiereba y Potamotrygon motoro actúa como barrera separándolas en diferentes unidades evolutivas independientes. La especie P. motoro fue descrita del río Paraná (Rosa 1985), y debido a la distancia geográfica entre la especie P. motoro muestreada en este estudio (Amazonas-Essequibo-Orinoco) y el río Parana, es posible que la similaridad entre los dos organismos sea debido a sus patrones cromáticos aun cuando genéticamente sean distintas. Para comprobar esta hipótesis se requiere un muestreo amplio de las dos cuencas y de puntos geográficos intermedios para realizar análisis poblacionales. El efecto del brazo del Casiquiare como posible barrera puede ser un factor determinante para separar estas especies en nuevas especies o subespecies y a su vez el estatus taxonómico de ambas. Recomendaciones • • Se plantea finalmente la necesidad de profundizar en el estudio de estas rayas para aclarar estas separaciones, hecho que puede generar información requerida para delimitar planes de conservación en los países que comparten estas cuencas. Las investigaciones que se enfocan en estudiar la filogeografía de las es- • • pecies pueden generar información útil para la conservación de las mismas (Avise 2000). Si un linaje representa diferentes especies en distintos puntos geográficos, las políticas de manejo y conservación deben ser modificadas para reflejar esa nueva distribución de la diversidad genética. La importancia de la diversidad genética radica en que representa el intervalo de adaptaciones evolutivas y ecológicas a cierta condición ambiental, es decir la historia evolutiva de las especies y su diversidad (Frederico et al. 2012). Dado que las rayas de agua dulce en Colombia y Venezuela son ampliamente aprovechadas en el mercado ornamental, es fundamental resolver su historia evolutiva para generar planes de conservación (Araújo et al. 2004). Un ejemplo de la aplicación de estos planes es Paratrygon aiereba que tiene un estado de conservación vulnerable y en Brasil es prohibida su exportación, pero aun se sigue aprovechando en Colombia y Venezuela, ya sea como ornamental o como consumo (Araújo et al. 2004, Barbarino y Lasso 2005). Es por esto, que es de gran importancia desarrollar la investigación genética en estas especies. El “barcoding” de ADN plantea una forma fácil y de bajo costo para identificar capturas o pescas y exportaciones ilegales, por lo menos a nivel de género o de una región geográfica determinada, que debe ser estudiada más a fondo para poder ser utilizada a nivel de especies. El adquirir esa facilidad de identificación permitiría implementar programas de conservación en las rayas de agua dulce verificando qué se está exportando y en qué áreas se está reali- 293 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA FILOGENIA MOLECULAR zando la pesca y aprovechamiento de estas especies (Frederico et al. 2012). • Bibliografía • • • • • • 294 Araújo, M. L., P. Charvet-Almeida, M. P. Almeida y H. Pererira. 2004. Freshwater stingrays (Potamotrygonidae): status, conservation and management challenges. Information document AC 20 Inf. 8. En: Twentieth Meeting of the Animals Committee. Avise, J. C. 2000. Phylogeography: the history and formation of species. Cambridge, M A, Harvard University Press. 384 pp. Baker, C. S. 2008. A truer measure of the market: the molecular ecology of fisheries and wildlife trade. Molecular Ecology 17: 3985–3998. Barbarino A. y C. A. Lasso. 2005. La pesca comercial de la raya manta Paratrygon aiereba (Müller y Henle, 1841) (Myliobatiformes, Potamotrygonidae), en el río Apure, Venezuela. Acta Apuroquia 1: 24-31. Bernardi, G., P. Sordino y D. A. Powers. 1993. Concordant mitochondrial and nuclear DNA phylogenies for populations of the teleost fish Fundulus heteroclitus. Proceedings of the National Academy of Sciences 90 (20): 9271-9274. Caldas, J. P., E. Castro-González, V. Puentes, M. Rueda, C. A. Lasso, L. O. Duarte, M. Grijalba-Bendeck, F. Gómez, A. F. Navia, P. A. Mejía-Falla, S. Bessudo, M. C. Diazgranados y L. A. Zapata Padilla. (Eds.). 2010. Plan de Acción Nacional para la Conservación y Manejo de Tiburones, Rayas y Quimeras de Colombia (PAN-Tiburones Colombia). Instituto Colombiano Agropecuario, Secretaria Agricultura y Pesca de San Andrés Isla, Ministerio de Ambiente, Vivienda y Desarrollo Territorial, Instituto de Investigaciones Marinas y Costeras, Instituto Alexander Von Humboldt, Universidad del Magdalena, Universidad Jorge Tadeo Lozano, Pontificia Universidad Javeriana, Fundación SQUALUS, Fundación Malpelo y otros Ecosistemas Marinos, Conservación Internacional, WWF Colombia. Editorial Produmedios.Bogotá. 60 pp. • • • • • • • Duchêne, S., F. I. Archer, J. Vilstrup, S. Caballero y A. Morin. 2011. Mitogenome phylogenetics: The impact of using single regions and partitioning schemes on topology, substitution rate and divergence time estimation. Public Library of Science ONE 6 (11): e27138. Dunn, K. A., J. D. McEachran y R. L. Honeycutt. 2003. Molecular phylogenetics of myliobatiform fishes (Chondrichthyes: Myliobatiformes), with comments on the effects of missing data on parsimony and likelihood. Molecular Phylogenetics and Evolution 27 (2): 259-270. Frederico, R. G., I. P. Farias, M. L. G. de Araújo, P. Charvet-Almeida y J. A. AlvesGomes. 2012. Phylogeography and conservation genetics of the Amazonian freshwater stingray Paratrygon aiereba Müller y Henle, 1841 (Chondrichthyes: Potamotrygonidae). Neotropical Ichthyology 10 (1): 71-80. Funk, D. J. y K. E. Omland. 2003. Specieslevel paraphyly and polyphyly: frequency, causes, and consequences, with insights from animal mitochondrial DNA. Annual Review of Ecology, Evolution, and Systematics 34: 397-423. Garcia, G., G. Wlasiuk y E. Lessa. 2000. High levels of mitochondrial Cytochrome b divergence in annual killifishes of the genus Cynolebias (Cyprininodontformes, Rivulidae). Zoological Journal of the Linnean Society 129: 93-110. García-Villamil, D. 2012. Molecular systematics of the freshwater stingrays (Myliobatiformes: Potamotrygonidae) of the Amazon, Orinoco, Magdalena, Essequibo, Caribe and Maracaibo basins (ColombiaVenezuela): evidence from mitochondrial genes. Tesis de Maestría, Universidad de los Andes, Colombia, Bogotá. 32 pp. Hebert, P. D., S. Ratnasingham y de J. R. Waard. 2003a. Barcoding animal life: cytochrome c oxidase subunit 1 divergences among closely related species. Proceedings of the Royal Society B: Biological Sciences 270: Suppl 1, S96-9. Hebert, P. D., A. Cywinska, S. L. Ball y J. R. de Waard.2003b. Biological identifica- M. A. Morales-B. • • • • • • tions through DNA barcodes.Proceedings of the Royal Society B: Biological Sciences 270: 313-321. Lovejoy, N. R., E. Bermingham y A. P. Martin. 1998. Marine incursion into South America. Nature 1: 421-422. Lundberg, J., O.J. Linares, M.E. Antonio y P. Nass. 1988. Phractocephalus hemiliopterus (Pimelodidae: Siluriformes) from the upper Miocene Urumaco formation, Venezuela: afurther case of evolutionary stasis and local extinction among South American fishes. Journal of Vertebrate Paleontology 8: 131-138. Martin, A.P., G.J.P. Naylor y S.R. Palumbi. 1992. Rate of mitochondrial DNA evolution is slow in sharks compared to mammals. Nature 357: 153–155. Marques, F. 2000. Evolution of Neotropical freshwater stingrays and their parasites: taking into account space and time. Tesis Doctoral. Department of Zoology. University of Toronto. Toronto. 324 pp. Posada, D. y K.A. Crandall. 2001. Intraspecific gene genealogies: trees grafting into networks. Trends in Ecology and Evolution 16 (1): 37-45. Rosa, R. S. 1985. A systematic revision of the South American freshwater stingrays (Chondrichthyes: Potamotrygonidae). Tesis Doctoral, College of William and Mary, Williamsburg, Virginia. 523 pp. • • • • • • Toffoli, D., T. Hrbek, M. L. G. de Araujo, M. P. de Almeida, P. Charvet-Almeidab e I.P. Farias. 2008. A test of the utility of DNA barcoding in the radiation of the freshwater stingray genus Potamotrygon (Potamotrygonidae, Myliobatiformes). Genetics and Molecular Biology 31 (1): 324-336. Ward, R. D., B. H. Holmes, W. T. White y P. R. Last. 2008. DNA barcoding Australasian chondrichthyans: results and potential uses in conservation. Marine and Freshwater Research 59 (1): 57-71. Ward, R. D., R. Hanner y P. D. Hebert. 2009. The campaign to DNA barcode all fishes, FISH-BOL. Journal of Fish Biology 74 (2): 329-356. Whelan, S., P. Liò y N. Goldman. 2001. Molecular phylogenetics: state of the art methods for looking into the past. Trends in Genetics 17: 262–272. Winemiller, K. O., H. López-Fernández, D. C. Taphorn, L. G. Nico y A. Barbarino. 2008. Fish assemblages of the Casiquiare River, a corridor and zoogeographical filter for dispersal between the Orinoco and Amazon basins. Journal of Biogeography 35: 1551–1563. Zhu, D., B. G. M. Jamieson, A. Hugall y C. Moritz. 1994. Sequence evolution and phylogenetic signal in control-region and Cytochrome b sequences of rainbow fishes (Melanotaeniidae). Molecular Biology and Evolution 11: 672–683. 295 Confluencia de los rios Tefe (aguas negras) y Amazonas (aguas blancas), Brasil. Foto: F. Trujillo M. A. Morales-B. 6.2 Estatus cario-evolutivo de las rayas con énfasis en las especies de agua dulce (Potamotrygonidae) Francisco Carlos de Souza Valentim, Maria Claudia Gross y Eliana Feldberg En América del sur, tanto en la cuenca amazónica como en aquellas que drenan directamente hacia el océano Atlántico, se encuentra una gran diversidad de rayas de agua dulce (Rosa 1985, Lovejoy et al. 1998, Carvalho et al. 2004). Este grupo de peces tuvo su origen a partir de un ancestro marino que entró a los ambientes dulceacuícolas tras las transgresiones marinas que tuvieron lugar en la porción oriental de la cuenca amazónica durante el Mioceno (Lovejoy 1996, Carvalho et al. 2004). Desde entonces, sufrieron modificaciones fisiológicas severas durante su adaptación al nuevo ambiente, tales como la osmoregulación (Thorson et al. 1978, Thorson et al. 1983) y a partir de allí, se han irradiado y se continúan irradiando por todos los ambientes dulceacuícolas (Toffoli et al. 2008). La clasificación de estas rayas a nivel de especie ha sido bastante confusa, a partir de los criterios que se han utilizado para su identificación. Por ejemplo, el patrón de coloración dorsal genera mucha confusión toda vez que muchas rayas presentan policromatismo dorsal y en algunas especies esa característica es bastante variada, lo que ha conducido a identificaciones erróneas. Así, Rosa (1985) inició un trabajo de importancia fundamental para organizar y ofrecer caracteres diagnósticos para la descripción correcta de las rayas de forma estandarizada. Ese trabajo definió la existencia de tres géneros: Paratrygon y Plesiotryon (monoespecíficos) y Potamotrygon, con unas 18 especies válidas y dos con caracteres dudosos. Mould (1997) también reconoció la existencia de tres géneros de potamotrigónidos y 20 especies válidas y Compagno (1999) reconoció también 20 especies, pero sugiriendo la existencia de un nuevo género basado en datos de Ishihara y Taniushi (1995). Este género fue confirmado por Chavert-Almeida et al. (2002) y Carvalho y Lovejoy (2011). Entre tanto, Carvalho et al. (2003), reconocieron la existencia de apenas 18 especies. Actualmente todas estas rayas están agrupadas dentro de la familia Potamotrygonidae (Garman 1877), con cuatro géneros aceptados: Paratrygon (monoespecífico), Heliotrygon (dos especies), Plesiotrygon (dos especies) y Potamotrygon (20 especies) 297 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA ESTATUS CARIO-EVOLUTIVO (Rosa 1985, Carvalho et al. 2004, Rosa et al. 2010, Carvalho y Lovejoy 2011). Por otro lado, análisis de genes mitocondriales en Paratrygon aiereba sugiere la existencia de un complejo de especies dada la estructuración de las poblaciones dentro de los diferentes ríos (Frederico et al. 2012). Caracterización cromosómica Las técnicas citogenéticas han evolucionado mucho desde el inicio de su aplicación, siendo cada vez de mejor resolución y óptimas herramientas en los estudios taxonómicos para inferir sobre la historia evolutiva y correlaciones de similaridad de los organismos cuando están en simpatría o alopatría (Ojima et al. 1976, Futuyma 2002). Tiburones y rayas marinas Los análisis citogenéticos todavía son incipientes para los Elasmobranchii, especialmente para las rayas y estos están restringidos en su mayoría al número diploide, número fundamental (NF), fórmula cariotípica y tamaño del genoma (Tabla 1). Una revisión de los datos citogenéticos de los Chondrichthyes, reveló que el superorden Batoidea dispone de datos cromosómicos para 34 especies distribuidas en 15 géneros, 16 familias y cinco órdenes, cuyo número cromosómico varía de 2n=28 en Narcine brasiliensis hasta 2n=104 en Raja meerdervoortii, con predominio de cromosomas metacéntricos en la primera especie y acrocéntricos y micro-cromosomas en la segunda (Stingo y Rocco 2001). Análisis de regiones organizadoras de nucléolo (RON), heterocromatina constitutiva y enzimas de restricción han sido realizados para cinco especies de peces cartilaginosos. La heterocromatina fue localizada en regiones diferentes, es decir, centromérica en Raja asteria (raya) y 298 principalmente telomérica en Scyliorhinus stellaris (tiburón). En dos especies del género Torpedo (T. marmorata y T. ocellata), fueron localizados bloques heterocromáticos en posiciones diferentes, es decir, pericentroméricos en los cromosomas meta/ submetracéntricos de Torpedo ocellata y digeridas por diferentes enzimas de restricción; centromérica en los telocéntricos de Torpedo marmorata y no diferidos por las enzimas de restricción. Esas diferencias en la distribución de la heterocromatina puede estar relacionada con la morfología de los distintos cromosomas y sugiere participación de secuencias altamente repetitivas de los reacomodos robertsonianos (Stingo et al. 1995, Stingo y Rocco 2001). La localización de las AgRON en las especies marinas T. marmorata y T. ocellata fue observada en la región terminal de hasta tres cromosomas en ambas especies (Stingo y Rocco 2001), por tanto RON simples fueron encontradas en varias especies de rayas marinas (Stingo et al. 1995). Técnicas citomoleculares también son relatadas en el estudio de las rayas marinas como la coloración por fluorocromo DAPI, uso de las enzimas de restricción y más recientemente, hibridización in situ fluorescente (FISH). Estas técnicas han sido informativas y eficientes en la separación de especies y también en el entendimiento de la cario-evolución de las rayas marinas (Rocco et al. 2002b, 2005, 2007). Rayas de agua dulce (Potamotrygonidae) En rayas de agua dulce los estudios cromosómicos son aún más escasos, con datos reportados para seis especies del género Potamotrygon, Plesiotrygon iwamae y Paratrygon aiereba de la cuenca amazónica (Valentim et al. 2006, Valentim 2011) y para Potamotrygon aff. motoro y Potamotrygon falkneri A. Ortega-Lara de la cuenca del alto Paraná (Cruz et al. 2011). Dentro de estas especies, el menor número diploide fue observado en Potamotrygon leopoldi, con 2n=64 y el mayor para Paratrygon aireba con 2n=90 (Figura 1). El número de brazos (NF) varió de 102 a 122 (Valentim et al. 2006, Valentim 2011, Cruz et al. 2011). Apenas se han descrito sistemas de cromosomas sexuales tanto simples como múltiples teniendo al macho como heterogameto y no ha sido detectado ningún caso de heterogametía femenina (Tabla 1), además de las diferencias careotípicas intra e interespecíficas en lo que respecta al número y fórmula cromosómica, número y posición de las regiones organizadoras de nucléolo (RON). También han sido observadas similitudes en cuanto a la cantidad y localización de heterocromatina constitutiva, pues en todas las especies esta se mostró en pequeñas cantidades y restringida al centrómero (Valentim et al. 2006, Valentim 2011, Cruz et al. 2011). Todas las especies de rayas de agua dulce analizadas hasta ahora han presentado RON múltiples localizadas en la región terminal de los brazos largos, con dos excepciones en Potamotrygon constellata y Potamotrygon sp. C1, que presentaron RON localizadas en los brazos cortos de un par cromosómico. Entre tanto, el número de RON consideradas activas (AgRON) es variable, observándose hasta en cuatro sitios en Paratrygon aiereba (Valentim et al. 2006), seis en Plesiotrygon iwamae y ocho en las especies de Potamotrygon (Valentim 2011). A pesar de que los potamotrigónidos están entre los vertebrados menos investigados desde el punto de vista cito-taxonómico, ya es posible tener una idea de la problemática de la descripción y clasificación taxonómica de este grupo. Valentim et al. (2006) describieron el cariotipo de Potamotrygon motoro de la cuenca amazónica con 2n=66 cromosomas, fórmula careotípica 18m+sm+10st+26a, NF=106, mientras que Cruz et al. (2011), describieron la misma especie (Potamotrygon aff. motoro) presente en la cuenca del Paraná-Paraguay con 2n=65♂/66♀ y presencia de dos fórmulas cariotípicas relacionadas con la localidad de muestreo: 21m+9sm+19st+16 a/22m+8sm+20st+16a y 20m+10sm+25s t+10a/22m+10sm+26st+10a, además de dos NF (Tabla 1). Con todo eso, y a pesar de la variabilidad, los datos disponibles indican que las especies de Potamotrygon se pueden agrupar preliminarmente en tres grupos: 2n=64, 2n=66 y 2n=68, con derivaciones internas asociadas con heteromorfismos cromosómicos sexuales. Cromosomas sexuales Un carácter cromosómico de gran importancia en un estudio cito-taxonómico en peces, es la presencia de cromosomas sexuales diferenciados entre machos y hembras, toda vez que la gran mayoría de los peces no lo presentan. Entre las rayas marinas varios casos de cromosomas sexuales heteromórfitos han sido descritos. Para las rayas de agua dulce esta característica solo fue constatada entre especies del género Potamotrygon, mientras que Paratrygon aiereba y Plesiotrygon iwamae no tienen cromosomas sexuales diferenciados (Valentim et al. 2006, Valentim 2011). Así, este es un carácter apomórfico para Potamotrygon, donde ya fueron encontrados tres tipos de sistemas a saber: (a) un sistema simple XX/XY en P. orbignyi y probablemente en P. scobina y P. cf. scobina (apenas machos analizados) (Valentim 2011); (b) un sistema simple XX/X0 en Potamotrygon sp. C (Valentim et al. 2013); y (c) un siste- 299 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA ESTATUS CARIO-EVOLUTIVO Figura 1. Especies representativas de tres géneros da familia Potamotrygonidae estudiados citogeneticamente hasta el momento: a) Paratrygon aiereba con 2n=90 cromosomas; b) Plesiotrygon iwamae con 2n=74 cromosomas; c) Potamotrygon motoro con 2n=66 cromosomas (m=metacéntrico, sm=submetacéntrico, st=subtelocéntrico y a=acrocéntrico). ma múltiple X 1 X1 X 2 X 2/X1 X 2Y en P. aff. motoro y P. falkneri (Cruz et al. 2011). La diferenciación de cromosomas sexuales principalmente en los sistemas simples puede ocurrir a partir de los reacomodos cromosómicos que actúan en la reducción de la recombinación entre los cromosomas reacomodados. Entre los peces también es frecuente el proceso de heterocromatinización en la diferenciación de los cromosomas sexuales (Almeida-Toledo y Foresti 2001). Entre tanto en el caso específico de las rayas del género Potamotrygon no hay evidencias de que la diferenciación de los cromosomas sexuales haya ocurrido por 300 pérdida o ganancia de heterocromatina. Así, los reacomodos cromosómicos o incluso las pérdidas de segmentos o de cromosomas enteros, pueden estar asociados a los procesos de diferenciación de los sistemas detectados en este grupo. En Potamotrygon, de los nueve taxa analizados, seis tienen cromosomas sexuales y en todos el macho es el sexo heterogamético. Así, tanto el sistema XX/X0 como el sistema múltiple X1 X1 X 2 X 2/X1 X 2Y pudo haberse diferenciado a partir de un sistema ancestral XX/XY o incluso, de un sistema ancestral todavía indiferenciado, como ya fue constatado en otros grupos A. Ortega-Lara de peces (Cioffi y Bertollo 2010, Cioffi et al. 2011). Un aspecto interesante es que las especies portadoras de cromosomas sexuales simples se encuentran en la cuenca amazónica (P. orbignyi, Potamotrygon sp. C), en cuanto que las especies con sistemas de cromosomas sexuales múltiples aparecen en la cual alta del río Paraná: P. aff. motoro y P. falkneri. La especie clasificada como P. motoro de la región amazónica, no aparece como heterogamética en ninguno de los lugares donde fue colectada, lo que lleva a cuestionar la certeza de la identificación de la especie para ambas cuencas. Cambios cromosómicos y evolución La proposición filogenética más reciente basada en análisis morfológicos y moleculares (gen Citocromo b), reveló que el árbol más parsimonioso agrupa Heliotrygon y Paratrygon, los cuales forman un clado. Este clado es un grupo hermano del clado que incluye Plesiotrygon y las especies de Potamotrygon (Carvalho y Lovejoy 2011). Los datos moleculares obtenidos sugieren que Potamotrygon es parafilético y que Plesiotrygon estaría incluido en Potamotrygon, corroborando lo encontrado por Toffoli et al. (2008). Cariotípicamente las especies de los tres géneros son diferentes en relación al número y la fórmula cromosómica. Cuando se comparan los cariotipos de Paratrygon aiereba (2n=90, 4m + 2sm + 10st + 74a) con Plesiotrygon iwamae (2n=74, 26m+8sm+12st+28a) se observa una notoria reducción del número diploide (Valentim et al. 2006, Valentim 2011). Comparando los cariotipos entre estas dos especies y de estas con los cariotipos de las especies de Potamotrygon, se encuentra que la reducción o el aumento es todavía mayor (2n=90 ó 2n=74 ó 2n=64-68) (Valentim et al. 2006, Valentim 2011). Conclusiones Potamotrygonidae es una familia de peces que agrupa peces de una gran diversidad cariotípica, siendo evidente la presencia de reacomodos cromosómicos por fusiones o fisiones céntricas durante la evolución cariotípica, toda vez que el número diploide varía de 66 a 90 cromosomas y el número de brazos varía de 102 a 122. Al mismo tiempo, los reacomodos tipo inversiones pericéntricas y/o translocaciones, deben haber participado de ese proceso, contribuyendo a la diversidad cariotípica constatada entre las especies de esta familia. Dichos reacomodos también explican la variabilidad de las regiones organizadoras del nucléolo y la presencia de mecanismos de determinación sexual, una vez que la diferenciación cromosómica sexual no fue por heterocromatinización ni por adicción de heterocromatina. Todavía los diferentes sistemas de cromosomas sexuales simples y múltiples representan caracteres derivados de la evolución cromosómica de este grupo y estos solo fueron evidenciados en el género Potamotrygon. 301 302 12m/sm+54t 12m/sm+54t 86ª 66 66 86 Torpedo ocellata Torpedo ocellata Torpedo tokionis Rhinobatos productus 44m/sm+48t 12m/sm+54t 66 Torpedo ocellata 92 86st-a 86 Torpedo marmorata Rhinobatidae 86st-a 86 Torpedo marmorata 28m/sm+26t 28m/SM FC 4m/sm+78st/a 54 28 2n 82 n Torpedo californica Torpedinidae Narke japonica Narkinae Narcine brasiliensis Narcinidae Torpediniformes Ordem/Família/ Subfamília Especie 136 86 78 78 78 86 86 86 82 56 NF XY CS 4 4 Num. RON T/p. T/p RON Stingo (1979) Ida et al. (1985) Ida et al. (1985) Donahue (1974) Referencia Schwartz y Maddock (1986); Maddock y Schwartz (1996) Asahida e Ida (1990) Centr. Stingo et al. (1995) Stingo y Capriglione Centr. (1986) Stingo (1976) Centr. Stingo et al. (1995) HC Tabla 1. Tabla de datos cromosómicos de rayas marinas y dulceacuícolas (n=número haploide; 2n=número diploide; FC=fórmula cromosómica; NF=número fundamental; CS=cromosomas sexuales; Num RON= número de RONS; RON=región organizadora del nucleolo; HC=heterocromatina constitutiva; T=telomerica; TC= telomérica y centromérica; p=brazo mayor; q= brazo menor). RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA ESTATUS CARIO-EVOLUTIVO 64 Rhinobatos schlegelii F 6m/sm+92t 6m/sm+92t 9m/sm+8st+31t 18m/sm+16st+62a 98 98 48 96 Raja asterias Raja asterias Raja montagui Platyrhinidae Myliobatiformes Raja polystigma 0m/sm+104t 104 6m/sm+92t Raja (Akamejei) meerdervoortii Raja clavata 98 30m/sm+28t 58 Raja eglantéria 49 6m/sm+92ª 98 Dipturus (Raja) batis Amblyraja (Raja) radiata 6m/sm+ 92t 55m/sm+9t 54m/sm+9t 51m/sm+9t 50m/sm+9t FC 98 49 63 Rhinobatos schlegelii M Rajidae 60 Rhinobatos hynnicephalus F 2n 59 n Rhinobatos hynnicephalus M Especie Tabla 1. Continuación. 114 104 104 104 104 104 88 104 104 119 117 111 109 NF ND ND ND ND CS 3 3 Num. RON TC/p T/p RON Olmo et al. (1982) Makino (1937) Nygre y Jahnke (1972) Schwartz y Maddock (1986) Stingo (1979); Nygre y Jahnke (1972) Nygre et al. (1971) Kikuno y Ojima (1987) Kikuno y Ojima (1987) Asahida e Ida (1995) Asahida e Ida (1995) Referencia Centr Rocco et al. (2007) Rocco et al. (2002b) Centr Rocco et al. (2002a) HC A. Ortega-Lara 303 304 69m/sm+9t 40m/sm+24t 28m/sm+40t 34m/sm+34t 46m/sm+12t 64 64 68 68 58 Dasyatis kuhlii Dasyatis matsubari Dasyatis sabina Dasyatis sayi Dasyatis violácea Dasyatis ajakei 78 34m/sm+38t 20m/sm+52t Dasyatis americana 72 72 44m/sm+8t 32m/sm+32t 64 52 FC 2n 20m/sm+64t 42 n 84 Dasyatis ajakei Dasyatidae Urobatis (Urolophus) halleri Urotrygonidae Urolophus aurantiacus Urolophidae Platyrhinoidis triseriata Especie Tabla 1. Continuación. 104 102 96 104 87 104 106 92 96 NF XY XY XY CS Num. RON RON HC Hinegardner (1976) Asahida et al. (1993) Asahida et al. (1993) Asahida et al. (1993) Donahue (1974); Kirpichnikov (1981) Donahue (1974); Maddock y Schwartz (1996) Nogusa (1960) Asahida et al. (1987) Schwartz y Maddock (1986) Asahida et al. (1987) Schwartz y Maddock (1986); Maddock y Schwartz (1996) Referencia RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA ESTATUS CARIO-EVOLUTIVO 30m/sm+28t 38m/sm+26/a 58 64 Dasyatis violácea Taeniura lymma 32m/sm+24t 56 Gymnura japônica 40m/sm+14t 54 Myliobatis tobijei Potamotrygon motoro Potamotrygonidae Mobula japônica Mobulinae Rhinoptera bonasus 66 66 18m+12sm+10st+26a 38m/sm+28t 42m/sm+22t 32m/sm+20t 52 Myliobatis aquila 64 50m/sm+2t 52 Myliobatis californica Rhinopterinae 50m/sm+2t 52 Myliobatis freminvillei Myliobatidae 44m/sm+12t 56 Gymnura micrura Gymnuridae FC n 2n Especie Tabla 1. Continuación. 106 104 94 84 102 102 88 100 102 88 NF CS 6a8 4 Num. RON T/q TC/p RON Olmo et al. (1982) Referencia Valentim et al. (2006) Asahida et al. (1993) Schwartz y Maddock (1986) Schwartz y Maddock (1986) Schwartz y Maddock (1986) Stingo y Capriglione (1986) Asahida et al. (1987) Asahida e Ida sin publicar Rocco et al. (2002a); Cent. Rocco et al. (2005) HC A. Ortega-Lara 305 306 24m+4sm+10st+26a 64 Potamotrygon leopoldi Paratrigon aiereba Plesiotrygon iwamae Potamotrygon sp C. 19m+7sm+12st+28a 66 Potamotrygon scobina 90 74 4m+2sm+10st+74a 26m+8sm+12st+28a 19m+8sm+10st+30a/20 33/34 67♂/68♀ m+8sm+10st+30a 22m+8sm+14st+22a 65♂/66♀ 65♂/66♀ 65♂/66♀ 20m+9sm+14st+22a/ 20m+10sm+14st+22a 20m+9sm+18st+18a/ 20m+10sm+18st+18a 21m+9sm+19st+16a/ 22m+8sm+20st+16a 20m+10sm+25st+10a/ 22m+10sm+26st+10a 22m+10sm+8st+26a 66 65♂/66♀ FC 2n 66 n Potamotrygon constellata Potamotrygon falkineri (Ilha Solteira) Potamotrygon falkneri (Porto Rico) Potamotrygon cf. motoro (Ilha Solteira) Potamotrygon cf. motoro (Porto Rico) Potamtrygon orbignyi Especie Tabla 1. Continuación. 106 120 104/106 102 104 110 120/122 114/116 112/114 108/110 106 NF XX/X0 XX/XY X1X1X2X2/ X1X2Y X1X1X2X2/ X1X2Y X1X1X2X2/ X1X2Y X1X1X2X2/ X1X2Y XX/XY CS T/pq T/pq 8 10 2a4 4a6 7a8 4a6 6a8 T/pq T/q T/q T/q T/q T/pq T/q 8 8 T/q T/q RON 10 6a8 Num. RON Cent Cent Cent Cent Cent Cent Cent Cent Cent Cent Cent HC Valentim et al. (2006) Valentim (2011) Valentim (2011) Valentim (2011) Valentim (2011) Valentim (2011) Cruz et al. (2011) Cruz et al. (2011) Cruz et al. (2011) Cruz et al. (2011) Valentim et al. (2006); Valentim (2011) Referencia RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA ESTATUS CARIO-EVOLUTIVO A. Ortega-Lara Bibliografía • • • • • • • • • • Almeida-Toledo, L. F. y F. Foresti. 2001. Morphologically differentiated sex chromosomes in Neotropical freshwater fish. Genetica 111: 91-100. Asahida, T., H. Ida y S. Inoue. 1987. Karyotypes of three rays in the order Myliobatiformes. Japanese Journal of Ichthyology 33: 426–430. Asahida, T. y H. Ida. 1990. Karyotypes of two rays, Torpedo tokionis and Dasyatis matsubarai, and their systematic relationships. Japanese Journal of Ichthyology 37: 71–75. Asahida, T., H. Ida, H. Terashima y H.Y Chang. 1993. The karyotype and cellular DNA content of a ray, Mobula japonica. Japanese Journal of Ichthyology 40: 317– 322. Asahida, T. y H. Ida. 1995. Karyotype and cellular DNA content of a guitarfish, Rhinobatos schlegelii. La Kromosomo 2 (79– 80): 2725–2730. Carvalho, M. R., N. R. Lovejoy y R. S. Rosa. 2003. Family Potamotrygonidae (river stingrays). Pp. 22–28. En: Reis, R. E., S. O. Kullander y C. J. Ferraris Jr. (Eds.). Check List of the freshwater fishes of South and Central America. EDIPUCRS, Porto Alegre, Brasil. Carvalho, M. R., J. G. Maisey y L. Grande. 2004. Freshwater stingrays of the Green River Formation of Wyoming (Early Eocene), with the description of a new genus and species and an analysis of its phylogenetic relationships (Chondrichthyes: Myliobatiformes). Bulletin of the American Museum of natural History 284: 1-36. Carvalho, M. R. y N. R. Lovejoy. 2011. Morphology and phylogenetic relationships of a remarkable new genus and two new species of Neotropical freshwater stingrays from the Amazon basin (Chondrichthyes: Potamotrygonidae). Zootaxa 2776: 13–48. Chavert-Almeida, P., M. L. G. Araújo, R. S. Rosa y G. Rincón. 2002. Neotropical freshwater stingrays: Diversity and Conservation status. Shark News 14: 1-2. Cioffi, M. B. y L. A. C. Bertollo. 2010. Initial steps in XY chromosome differentiation in • • • • • • • • • • Hoplias malabaricus and the origin of an X1X2Y sex chromosome system in this fish group. Heredity 105: 554–561. Cioffi, M. B., J. P. M. Camacho y L. A. C. Bertollo. 2011. Repetitive DNAs and differentiation of sex chromosomes in Neotropical fishes. Cytogenetic and Genome Research 132: 188-194. Compagno, L. J. V. 1999. Checklist of living elasmobranchs. p. 471–498. En: Hamlett, W.C. (Ed.). Sharks, skates and rays, the biology of elasmobranch fishes. John Hopkins University Press, Baltimore. Cruz, V. P., C. K. Shimabukuro-Dias, C. Oliveira y F. Foresti. 2011. Karyotype description and evidence of multiple sex chromosome system X1X1X 2X 2/X1X 2Y in Potamotrygon aff. motoro and P. falkneri (Chondrichthyes: Potamotrygonidae) in upper Paraná River basin, Brazil. Neotropical Ichthyology 9 (1): 201-208. Donahue, W. H. 1974. A karyotypic study of three species of Rajiformes (Chondrychthyes, Pisces). Canadian Journal of Genetics Cytology 16: 203-211. Frederico, R. G., I. P. Farias, M. L. G. Araújo, P. Charvet-Almeida y J. A. Alves-Gomes. 2012. Phylogeography and conservation genetics of the Amazonian freshwater stingray Paratrygon aiereba Müller y Henle, 1841 (Chondrichthyes: Potamotrygonidae). Neotropical Ichthyology 10 (1): 71-80. Futuyma, D. J. 2002. Biologia evolutiva. Editora Ribeirão Preto, São Paulo, Brasil. 567 pp. Garman, S. 1877. On the pelvis and external sexual organs of selachiens, with special reference to the new genera Potamotrygon and Disceus. Proceedings of the Boston Society of Natural History 19: 197-215. Hinegardner, R. T. 1976. The Celular DNA content of sharks, rays and some other fishes. Comparative Biochemistry and Physiology 55B: 367-370. Ida, H., I. Sato y N. Miuawaki. 1985. Karyotypes of two rays in the order Torpediniformes. Japanese Journal of Ichthyology 32 (1): 107-111. Ishihara, H. y T. Taniushi. 1995. A strange potamotrygonid ray (Chondrichthyes: Potamotrygonidae) from the Orinoco 307 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA ESTATUS CARIO-EVOLUTIVO • • • • • • • • • • • • • 308 River system. Journal of Aquariculture and Aquatic Sciences 7: 91-97. Kikuno, T. E y Y. Ojima. 1987. A Karyotypic studies of a guitar fish, Rhinobatos hyinnicephalus Richardson (Pisces, Rajiformes). La Kromosomo II-47-48: 1538-1544. Kirpichnikov, V. S. 1981. Genetic Bases of Fish Selection. Translated by G.G. Gause. Berlin/New York: Springer Verlag. 410 pp. Lovejoy, N. R. 1996. Systematics of myliobatoid elasmobranchs: with emphasis on the phylogeny and historical biogeography of Neotropical freshwater stingrays (Potamotrygonidae: Rajiformes). Zoological Journal of the Linnean Society 117: 207–257. Lovejoy, N. R., E. Bermingham y A. P. Martin. 1998. Marine incursion into South America. Nature 396: 421–422. Maddock, M. B. y F. J. Schwartz. 1996. Elasmobranch cytogenetics: methods and sex chromosomes. Bulletin of Marine Science 58: 147-155. Makino, S. 1937. The chromosomes of two elasmobranch fishes. Cytologia 2: 867-876. Mould, B. 1997. Classification of the recent elasmobranchii. A classification of the living sharks and rays of the world. Copyright. 173pp. <http://ibis.nott.ac.uk/ elasmobranch.html>. Consultado agosto/2011. Nelson, J.S. 2006. Fishes of the world. 4 ed. John Wiley and Sons, New York. 600 pp. Nogusa, S. 1960. A comparative study of the chromosomes of fishes with particular considerations in taxonomy and evolution. Memories Hyogo University Agriculture 3: 1-16. Nygren, A. y M. Jahnke. 1972. Microchromosomes in primitive fish. Swedish Journal of Agricultural Research 2: 229-238. Nygren, A., B. Nilsson y M. Jahnke. 1971. Cytological study in Hypotremata and Pleurodremata (Pisces). Hereditas 67: 275282. Ojima, Y., K. Ueno y M. Hayashi. 1976. A review of chromosome numbers in fishes. La Kromosomo 2: 19-47. Olmo, E., V. Stingo, O. Cobror, T. Capriglione y G. Odierna. 1982. Repetitive DNA and polyploidy in selachians. Comparative Biochemistry and Physiology 73B: 739-745. • • • • • • • • • • Rocco, L., M. A. Morescalchi, D. Costagliola y V. Stingo. 2002a. Karyotype and genome characterization in four cartilaginous fishes. Gene 295: 289–298. Rocco, L., D. Costagliola, A. Marsilio y V. Stingo. 2002b. Localizzazione cromosomica dei cistroni ribosomali in due Batoidea. Atti 63_ Convegno UZI: 120. Rocco, L., D. Costagliola, M. Fiorillo, F. Tinti y V. Stingo. 2005. Molecular and chromosomal analysis of ribosomal cistrons in two cartilaginous fish, Taeniura lymma and Raja montagui (Chondrichthyes, Batoidea). Genetica 123: 245–253. Rocco, L., I. Liguori, D. Costagliola, M.A. Morescalchi, F. Tinti y V. Stingo. 2007. Molecular and karyological aspects of Batoidea (Chondrichthyes, Elasmobranchi) phylogeny. Gene 389: 80–86. Rosa, R. S. 1985. A systematic revision of the South American Freshwater stingrays (Chondrychthyes: Potamotrygonidae). A dissertation presented to the Faculty of the school of Marine Science the college of William and Mary in Virginia. 523 pp. Rosa, R. S., P. Charvet-Almeida y C. C. D. Quijada. 2010. Biology of the South American potamotrygonid stingrays. Pp. 241– 281. En: Carrier, J. C., J. A. Musick y M. R. Heithaus (Eds.). Sharks and Their Relatives Ii: Biodiversity, Adaptative Physiology, and Conservation. CRC Press, Florida. Schwartz, F. J. y M. B. Maddock. 1986. Comparisons of karyotypes and cellular DNA contents within and between major lines of elasmobranch. Pp. 148-157. En: Uyeno, T., R. Arai, T. Taniuchi y K. Matsura. (Eds.) Indo-Pacific fish Biology. Ichthyological Society Japan, Tokyo. Stingo, V. 1976. Cariologia di due torpedini italiane. Bollettino di Zoologia 43: 406–407. Stingo, V. 1979. New developments in vertebrate citotaxonomy. II. The chromosomes of the cartilaginous fishes. Genetica 50: 227–239. Stingo, V. y T. Capriglione. 1986. DNA and chromosomal evolution in cartilaginous fish. Pp. 140–147. En: Uyeno, T., R. Arai, T. Tuniuchi y K. Matsuura (eds). Indo-Pacific Fish Biology. Ichthyological Society Japan, Tokyo. A. Ortega-Lara • • • • • Stingo, V., L. Rocco, G. Odierna y M. Bellitti. 1995. NOR and heterochromatin analysis in two cartilaginous fishes by C-, Ag- and RE (restriction endonuclease)banding. Cytogenetics Cell Genetics 71: 228–234. Stingo, V. y L. Rocco. 2001. Selachian cytogenetics: A review. Genetica 111: 329-347. Thorson, T. B., R. M. E. Wotton y T. A. Georgi. 1978. Retal gland of freshwater stingrays, Potamotrygon spp (Chondrichthyes: Potamotrygonidae). Biology Bulletin 154: 508-516. Thorson, T. B., J. K. Langhammer y M. I. Oetinger. 1983. Reproduction and development of the South America freshwater stingrays Potamotrygon circulares and Potamotrygon motoro. Environmental Biology of Fishes: 9 (1): 3-24. Toffoli, D., T. Hrbek, M. L. G. Araújo, M. P. Almeida, P. Charvet-Almeida y I. P. Farias. 2008. A test of the utility of DNA barcoding • • • in the radiation of the freshwater stingray genus Potamotrygon (Potamotrygonidae, Myliobatiformes). Genetics and Molecular Biology 31 (1) (suppl): 324-336. Valentim, F. C de S., J. N. Falcão, J. I. R. Porto y E. Feldberg. 2006. Chromosomes of three freshwater stingrays (Rajiformes, Potamotrygonidae) from the Rio Negro Basin, Amazon, Brazil. Genetica 128: 33-39. Valentim, F. C de S. 2011. Citotaxonomia de arraias de água doce (Myliobatiformes, Potamotrygonidae) da bacia amazônica central. Tese de doutorado, Instituto Nacional de Pesquisas da Amazônia. Manaus, Amazonas, Brasil. 77 pp. Valentim, F. C. S., J. I. R. Porto, L. A. C. Bertollo, M. C. Gross y E. Feldberg. 2013. XX/XO, a rare sex chromosome system in Potamotrygon freshwater stingray from the Amazon Basin, Brazil. Genetica 141: 7-9 (DOI 10.1007/s10709-013-9737-2). Potamotrygon orbignyi, río Orinoco, Colombia. Foto: M. A. Morales-Betancourt 309 Viveros para rayas, río Ventuari, Venezuela. Foto: J. C. Señaris. M. Sabaj-P. 7. Marco normativo y comercialización de las rayas de agua dulce (Potamotrygonidae) en el norte de América del Sur Paula Sánchez-Duarte, María P. Baptiste, Carlos A. Lasso, Adriana M. Suárez Q. y Adriana Guzmán La familia Potamotrygonidae fue descrita por Garman (1877) e incluye las especies de rayas de agua dulce que se encuentran restringidas al continente suramericano. Este es el grupo más numeroso de los elasmobranquios que viven en agua dulce (Rosa et al. 2010) y actualmente se reconocen cuatro géneros: Paratrygon Duméril 1865, Potamotrygon Garman 1877, Plesiotrygon Rosa, Castello y Thorson 1987 y Heliotrygon Carvalho y Lovejoy 2011, con unas 25 especies descritas. Las especies de rayas de agua dulce son un recurso pesquero con demanda comercial internacional, ya que son utilizadas como especies ornamentales. A diferencia de muchos otros peces ornamentales de agua dulce, las rayas se comercializan de forma individual y tienen un alto valor por unidad para pescadores, acopiadores, comerciantes, exportadores e importadores. En este sentido, la captura, manipulación y transporte son diferentes a las otras especies de peces que suelen capturarse por millares (Rosa et al. 2010). Sin embargo, las características especiales de los potamotrigónidos (similares a los elasmobranquios marinos), como fecundidad baja, maduración tardía y crecimiento lento (Araujo et al. 2004), los hacen más vulnerables ante diferentes presiones, tanto directas como indirectas. Desde el 2008, en el taller regional realizado por la Secretaría de la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestre - CITES, se acordó la importancia de analizar los volúmenes de comercio de las especies suramericanas. Esto fue mencionado posteriormente en diferentes resoluciones al respecto. En la 16va Conferencia de las Partes (COP) de CITES, realizada en Bangkok (Tailandia), en marzo de 2013, se adoptaron las decisiones 16.130 a 16.135 dirigidas a la Secretaría, los países de distribución natural y al Comité de Fauna. Este escenario hace necesario considerar que frente a la vulnerabilidad intrínseca de las especies de rayas dulceacuícolas y su im- 311 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA MARCO NORMATIVO Y COMERCIALIZACIÓN portancia económica comercial y social, se analice la información disponible en los diferentes países sobre el comercio de las especies de la familia Potamotrygonidae. Así mismo, la información y normativa que es aplicada en los países para hacer evidente los vacíos y necesidades nacionales y regionales, de manera que se orienten e implementen las acciones e investigaciones necesarias para la gestión, ordenamiento y el uso sustentable de este grupo de especies en América del Sur, de manera que las autoridades competentes puedan tomar decisiones a partir de la mejor evidencia científica disponible. Por ello, el objetivo de este capítulo es presentar un resumen sobre el marco normativo y la información disponible y “accesible” sobre el uso, comercio y efectos del mismo, en Brasil, Colombia, Ecuador, Perú y Venezuela. Marco normativo Acuerdos internacionales vinculantes Entre los instrumentos de carácter internacional relacionados con el recurso rayas de agua dulce para Suramérica, vale la pena mencionar los siguientes: 1. Organización del Tratado de Cooperación Amazónica (OTCA), que a través de su Secretaria Permanente coordina los procedimentos en el marco del Tratado de Cooperación Amazónica (TCA) y dinamiza la ejecución de sus decisiones. El TCA fue suscrito el 3 de julio de 1978 por representantes de Bolivia, Brasil, Colombia, Ecuador, Guyana, Perú, Surinam y Venezuela y entró en vigencia el 28 de mayo de 1980, luego de la ratificación por parte de los Estados miembros. 312 2. Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora (CITES). Compromete a los países a estabelecer controles para asegurar que el comercio internacional de las especies amenazadas incluidas en los apéndices de la CITES se cumpla. 3. Convención de Bonn (1979) o Convención sobre la Conservación de las Especies Migratorias de Animales Silvestres (CMS). Tratado intergubernamental para la conservación de la vida silvestre y de sus hábitats a escala mundial. 4. Convención para la Protección del Patrimonio Mundial, Cultural y Natural. Establecida por la UNESCO en 1972, mediante la cual se crea el compromisso mundial para identificar, proteger, preservar y transmitir a las generaciones futuras, el patrimonio cultural y natural situado en su territorio. 5. Convenio sobre la Diversidad Biológica (CDB). Establece los compromisos mundiales y nacionales referentes a la conservación, al uso sostenible de los componentes de la diversidade biológica y la distribución justa y equitativa de los benefícios derivados de la utilización de los recursos genéticos. 6. Agenda 21. Suscrita en la Conferencia Mundial sobre el Medio Ambiente y Desarrollo Sostenible organizada por las Naciones Unidas en Río de Janeiro (Brasil) en el año de 1992, también conocida como cumbre de la Tierra. Orientada a apoyar inicativas que construyen un modelo de desarrollo sostenible para el siglo XXI. Los países se comprometen a aplicar políticas ambientales, económicas y sociales en el ámbito local encaminadas a lograr un desarrollo sostenible. M. D. Escobar Colombia El manejo y administración de los recursos hidrobiológicos es uno de los aspectos que mayores cambios ha presentado en Colombia. En 1974 la Ley 2811 definió por recurso hidrobiológico: el conjunto de organismos animales y vegetales cuyo ciclo de vida se cumple totalmente dentro del medio acuático y a los recursos pesqueros como: aquella parte de los recursos hidrobiológicos susceptibles de ser extraída o efectivamente extraída, sin que se afecte su capacidad de renovación con fines de consumo, procesamiento, estudio u obtención de cualquier otro beneficio. Como parte de los recursos pesqueros se encuentran las especies ícticas ornamentales y dentro de éstas se incluyen las rayas de agua dulce. La definición legal de peces ornamentales es: especies ícticas cuyos ejemplares pueden mantenerse vivos como adorno en acuarios, estanques y pozos y que en ningún caso su cultivo o aprovechamiento tiene como finalidad servir de alimento humano o animal. Parágrafo 1º, Artículo 1º de la Resolución 3532 de 2007 del Instituto Colombiano de Desarrollo Rural - INCODER. En este se expiden normas para el ejercicio, administración y control de la actividad pesquera comercial ornamental precisando las especies ícticas ornamentales aprovechables comercialmente, y otras disposiciones. Como se mencionó anteriormente, el manejo de los recursos pesqueros ha sido responsabilidad de varias entidades gubernamentales a través del tiempo. Un pequeño resumen se presenta a continuación basado en información de Negrete (2011). Conforme al Código Nacional de los Recursos Naturales y de Protección al Medio Ambiente y sus decretos reglamentarios 1608 y 1681 de 1978, la administración y manejo de los recursos naturales renova- bles, entre ellos la fauna silvestre (fauna terrestre), como los recursos hidrobiológicos (fauna y flora acuática), estaba radicada en cabeza del INDERENA y de las corporaciones autónomas existentes a la fecha. A raíz de la expedición de la Ley 13 de 1990 y su Decreto reglamentario 2256 de 1991, se generó un fraccionamiento en el manejo y administración del recurso hidrobiológico en el componente de la fauna acuática, bajo el considerando de que al señalarse que cierto tipo de especies pueden ser objeto de extracción y establecerle además un volumen susceptible de ser aprovechado, por esas circunstancias se convierten en recurso pesquero y por ende su administración y manejo pasó a manos del INPA. Posteriormente a INCODER y a partir del 1 de enero de 2012 a la Autoridad Nacional de Acuicultura y Pesca – AUNAP -, creada a través del Decreto Ley 4181 de 2011, mientras que los demás recursos hidrobiológicos continuaron en cabeza de las autoridades ambientales. Este mismo decreto 2256 establece permisos de pesca artesanal, permisos de comercialización de peces ornamentales, permisos de cultivo, medidas de manejo y conservación del recurso íctico ornamental. Dicho decreto también crea el Comité Ejecutivo Para la Pesca, conformado hoy en día por el Ministerio de Ambiente y Desarrollo Sostenible, el Ministerio de Agricultura y Desarrollo Rural y la Autoridad Nacional de Acuicultura y Pesca. A través de la Ley 99 de 1993, se establecieron las funciones del Ministerio de Ambiente (ente rector de la política ambiental) y de las corporaciones autónomas regionales (entes administradores de los recursos naturales). Lo anterior, 313 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA MARCO NORMATIVO Y COMERCIALIZACIÓN sin entrar a modificar las funciones señaladas a la autoridad pesquera mediante la Ley 13 de 1990, de manera tal que se mantuvo esa distinción entre el manejo y administración del recurso pesquero (INPA) y el recurso hidrobiológico (autoridades ambientales). Sin embargo, es importante señalar que si bien la Ley 13 de 1990 contemplaba que las actividades de acuicultura que involucran a los recursos hidrobiológicos en general y no solamente a los pesqueros, eran de competencia del INPA, este aspecto fue modificado por la Ley 99 de 1993 al señalar que la administración de los recursos naturales renovables está radicada en cabeza de las corporaciones autónomas regionales (Cars), motivo por el cual debe entenderse que los recursos hidrobiológicos, con excepción de los pesqueros, les corresponde su administración y manejo a las Car’s. El manejo, la ordenación, el control y vigilancia administrativa en materia de recursos pesqueros y por lo tanto del recurso íctico ornamental, está bajo la responsabilidad de la Autoridad Pesquera. También ejercen normas sobre este recurso el Instituto Colombiano Agropecuario (ICA) como autoridad sanitaria, la Dirección de Impuestos y Aduanas Nacionales (DIAN) entidad que autoriza las exportaciones y la Policía Ambiental y Ecológica que apoya el control y vigilancia operativo en puertos y aeropuertos. A nivel internacional Colombia forma parte de la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres (CITES). El uso y aprovechamiento de los recursos ícticos ornamentales están enmarcados en normas tanto ambientales como pesqueras y en su manejo intervienen también varias entidades, lo que 314 hacen complejos los procesos de manejo y conservación que se adelanten con este grupo de especies (Ajiaco-Martínez et al. 2012). Para el caso de las rayas de la familia Potamotrygonidae, se adoptó el Plan de Acción Nacional para la Conservación y Manejo de Tiburones, Rayas y Quimeras de Colombia – PAN Tiburones Colombia, mediante el decreto 1124 del 31 de mayo de 2013 del Ministerio de Agricultura y Desarrollo Rural, formando parte integral de este el documento PAN Tiburones Colombia, en el cual se recomiendan las acciones a adelantar para el caso de las rayas de agua dulce en el país. Brasil La normativa No. 203 del 22 de octubre de 2008, del Ministerio del Medio Ambiente Instituto Brasileño del Medio Ambiente y de los Recursos Naturales Renovables (Ibama), prevé normas, estándares y un sistema de cuotas basado en la distribución conocida y la dinámica de las poblaciones de las especies, para la explotación de peces nativos o exóticos de aguas continentales, con fines ornamentales y de acuario. Más específicamente sobre las rayas de agua dulce (familia Potamotrygonidae), se declara la normativa No. 204 del 22 de octubre de 2008, del Ministerio del Medio Ambiente – Ibama, donde se considera, terminología y particularmente: • • • • Capítulo I, disposiciones preliminares (artículos 1º y 2º). Capítulo II, captura y explotación (artículos 3º, 4º y 5º). Capítulo III, distribución de cuotas de venta (artículos 6º y 7º). Capítulo IV, sobre la reventa (artículo 8º). M. D. Escobar • • Capítulo V, transporte (artículos 9º y 10º). Capítulo VI, disposiciones finales (artículos 11º a 14º). Esta normativa incluye además, listados de especies permitidas y cuotas particulares por especie y región. También anexos con formatos de guía de tránsito de las especies, de ventas y reventas. Ecuador La Ley para la conservación y uso sustentable de la biodiversidad Artículo 12.- El Ministerio de Comercio Exterior, Industrialización y Pesca, es el competente de un efectivo manejo y control de la biodiversidad marina, costera y dulceacuícola, en el marco de la legislación ecuatoriana y los instrumentos internacionales vigentes. En las áreas que conforman el Sistema Nacional de Áreas Naturales Protegidas, el Ministerio del Ambiente será la entidad competente para el manejo y control de la biodiversidad marina, costera y dulceacuícola. Artículo 53.- El Ministerio de Comercio Exterior, Industrialización y Pesca autorizará el establecimiento y supervisará el funcionamiento de acuarios públicos y privados destinados a la conservación ex situ y a la reproducción en cautiverio o en condiciones controladas de especies silvestres marinas y dulceacuícolas, en particular aquellas amenazadas de extinción que consten en la lista CITES, en las expedidas periódicamente por el Ministerio del Ambiente, o que sean de interés comercial. El Reglamento General de aplicación de esta Ley definirá las condiciones y requisitos para su funcionamiento. De acuerdo al Ministerio del Ambiente (MAE 2012), no se ha registrado la exportación y comercialización de rayas. Tampoco existen estadísticas aduaneras que hayan motivado el establecimiento de una legislación destinada al tráfico lícito de especies de la familia Potamotrygonidae. Según datos del Ministerio del Ambiente la proliferación de peces ornamentales es casi nula, por lo que esto representa una gran oportunidad para promocionar la acuariofilia y la creación de nuevas leyes. Actualmente sólo existe legislación para la crianza de peces para consumo humano, es decir criaderos de truchas, tilapia y corvina, por lo que se ha generado un conflicto entre el Ministerio de Agricultura y Pesca y el Ministerio del Ambiente. Perú Mediante Decreto Ley Nº 25977 se aprobó la Ley General de Pesca en 1994, con el objeto de normar la actividad pesquera y acuícola, promover su desarrollo sostenible y asegurar el aprovechamiento responsable de los recursos hidrobiológicos. Dicho decreto fue modificado en el 2001, donde se aprobó el reglamento de la Ley General de Pesca, que consta de 151 artículos, 11 títulos, cuatro disposiciones transitorias, tres disposiciones complementarias y tres disposiciones finales. El título IV hace referencia específicamente a los recursos hidrobiológicos para fines ornamentales con el Artículo 56. Especies ornamentales y acuarios comerciales: • 56.1. La extracción de recursos hidrobiológicos para fines ornamentales y el funcionamiento de acuarios comerciales, requieren permiso de pesca otorgado por el Ministerio de Pesquería o, por delegación expresa, por las correspondientes dependencias regionales de pesquería. 315 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA MARCO NORMATIVO Y COMERCIALIZACIÓN • 56.2. La importación de recursos hidrobiológicos para fines ornamentales requiere autorización del Ministerio de Pesquería y la certificación sanitaria del país de procedencia, así como de la autoridad sanitaria nacional. La Ley General de Pesca (Decreto Ley No. 25977), define al Ministerio de la Pesquería (hoy Ministerio de la Producción), como el ente rector del sector y responsable de la administración de los recursos hidrobiológicos el cual determina, según el tipo de pesquería y sobre la base de evidencias científicas disponibles y de factores socioeconómicos, los sistemas de ordenamiento pesquero, las cuotas de captura permisibles, las temporadas y zonas de pesca, la regulación del esfuerzo pesquero, los métodos de pesca, las tallas mínimas de captura y demás normas que requieren la preservación y explotación nacional de los recursos hidrobiológicos. El Estado peruano, a través del Viceministerio de Pesquería del Ministerio de la Producción (Produce), norma la actividad pesquera, regula su manejo integral y promueve su desarrollo sostenible como fuente de alimento, empleo y divisas, para lo cual adopta políticas en materia pesquera que tienden al logro de un desarrollo pesquero sustentable, en concordancia con la normativa nacional e internacional. Las medidas de conservación biológica que están comprendidas en las normas de ordenamiento pesquero, se basan en la información científica que genera el Instituto del Mar Perú (IMARPE), como organismo de investigación técnico-científica del sub-sector pesquero. Mediante Resolución Ministerial No. 2952013 – Produce, se publicó el proyecto de- 316 nominado Plan de Acción Nacional para la Conservación y Ordenamiento de Tiburones, Rayas y Quimeras y Especies afines en el Perú, el cual hace mención a las ocho (8) especies de rayas de la familia Potamotrygonidae presentes en la Amazonia peruana, las cuales son reconocidas como un recursos pesquero ornamental.de importancia comercial. Venezuela El decreto Nº 5.930 con Rango, Valor y Fuerza de Ley de Pesca y Acuicultura publicado en Gaceta Oficial de la República Bolivariana de Venezuela Nº 5.877, extraordinario de fecha 14 de marzo de 2008, del Instituto Socialista de Pesca y Acuicultura, es la ley más reciente que regula la pesca, la acuicultura y sus actividades conexas en el país. En la Gaceta Oficial Nº 34.921 del 12/03/92 se encuentra la Resolución de la Dirección General de Pesca y Acuicultura Nº 52 sobre normas que regulan las actividades relacionadas con ejemplares vivos de la ictiofauna con valor ornamental. En esta resolución se hace una clasificación de la pesca, donde se incluye la pesca ornamental y en el Artículo 2 se define como especies ornamentales: aquellos ejemplares vivos de los recursos hidrobiológicos que por su belleza, colorido o rareza en cualquier fase de su ciclo de vida, se capturan o se cultivan con fines de exhibición. Se incluyen entre éstos, los ejemplares de consumo o con valor deportivo, que en su fase adulta se encuentren amparados por otras normativas y que durante sus estadios juveniles tengan valor ornamental. Actividades relacionadas. Artículos 3 y 4. Las actividades relacionadas con los peces ornamentales se clasifican en producción (cría), captura (pesca), comerciali- M. D. Escobar zación e investigación. Toda persona natural o jurídica dedicada a las actividades de producción y comercialización de peces ornamentales, debe estar registrada ante el Instituto Nacional de la Pesca y Acuicultura (INAPESCA), ahora Instituto Socialista de la Pesca y Acuicultura (INSOPESCA). Traslados y movilizaciones. Artículos 6 al 8. Los traslados de peces ornamentales se realizan a través del permiso individual del pescador, que los moviliza desde el sitio de captura hasta el centro de acopio indicado en el mismo permiso. Una guía de movilización, para el transporte desde los centros de acopio hasta otros lugares debidamente habilitados y permisados. La constancia de registro de criadero para el traslado de peces ornamentales provenientes de criaderos. Exportación. Artículo 11. Las personas jurídicas que se dedican a la exportación de peces ornamentales, deberán obtener un permiso de exportación, emitido por INSOPESCA (anteriormente INAPESCA), cuya validez será de 90 días. Reportes trimestrales. Artículo 12 y 13. Las personas naturales o jurídicas que se dedican a la cría, captura y transporte de peces ornamentales, deberán presentar ante INSOPESCA, reportes trimestrales sobre producción o ingresos a centros de acopio, indicando entre otros: nombre común y científico de las especies; cantidades; zonas de captura y destino de los ejemplares. Plan mínimo de inversión. Artículo 14. Las empresas dedicadas a la captura y comercialización de peces ornamentales deberán presentar un plan mínimo de inversión para la reproducción y cría de peces ornamentales y someterlo a la consideración de INSOPESCA. Prohibiciones. Artículo 9. Queda pro- hibida la captura de ejemplares de las siguientes especies para su comercialización como peces ornamentales: Cichla spp (pavones), Pseudoplatystoma spp (bagres rayados), Brachyplatystoma vaillanti (valentón), Brachyplatystoma rousseauxii (dorado), Phractocephalus hemiliopterus (cajaro), Brycon whitei (palambra) y Salminus hilarii (sauta). Artículo 16. Para la captura de peces ornamentales se prohíbe el uso de sistemas de pesca nocivos para el ambiente acuático, tales como: explosivos, barbasco y rotenona, así como la desecación de cuerpos de aguas naturales. Artículo 19. Queda prohibida la captura de peces ornamentales en las cuencas de los lagos de Valencia y Maracaibo. Artículo 20. No podrán liberarse ejemplares vivos en áreas diferentes a sus sitios de captura, ni realizarse alteración alguna del hábitat natural de la fauna íctica ornamental. Veda. Artículo 17. Se establece una veda total de dos meses al año en todo el territorio nacional para la captura de peces ornamentales continentales durante el periodo comprendido entre el 15 de mayo y el 15 de julio, ambas fechas inclusive. Otras medidas regulatorias sobre rayas de agua dulce Como parte de las medidas adoptadas por la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres – CITES, las rayas de agua dulce hacen parte de las decisiones adoptadas en la Conferencia de las partes (Cop16) en marzo de 2013, en donde se adoptaron mediante las decisiones (16.130 a 16.135), 317 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA MARCO NORMATIVO Y COMERCIALIZACIÓN recomendaciones a los países de distribución. Estas incluyeron que el Comité de Fauna conforme un grupo de trabajo de rayas de agua dulce (familia Potamotrygonidae) de los países de distribución, para que se evalúen las especies y su necesidad de inclusión en los apéndices de Cites y que los países de distribución natural entreguen información referente al estatus poblacional de las mismas. Colombia. Teniendo como referencia lo citado en el Plan de Acción Nacional para la conservación y manejo de tiburones, rayas y quimeras de Colombia, con respecto a la necesidad de formular una regulación estricta en lo que se refiere a las tallas de exportación de rayas (Caldas et al. 2010), el Incoder (ver Bustamante y SánchezPáez 2010), realizó una revisión bibliográfica sobre las tallas máximas, de madurez sexual y comerciales de las rayas objeto de aprovechamiento, con el fin de proponer la proyección de un acto administrativo alrededor de este recurso (Tabla 1). De acuerdo con las tallas de comercialización revisadas para cada una de las especies y los valores de las tallas medias de madurez sexual consignados en la tabla 1, es claro que todas las especies sometidas a comercio están por debajo de su talla de madurez sexual. Estas especies como recursos ornamentales, son solo atractivas para el mercado de la acuarioflia en su fase de neonatos, juveniles o sub-adultos, es decir individuos de tamaño pequeño, que sean manejables y puedan ser mantenidos en cautiverio por el acuarófilo tradicional o estándar. En el mercado del acuarismo internacional las tallas comerciales más atractivas (individuos pequeños) se conocen como “cup te”. En pocas palabras, es una pesquería selectiva dirigida a individuos neonatos, juveniles y sub-adultos que 318 no han alcanzado su madurez sexual. El reto o la necesidad impostergable, es evaluar el efecto de esta extracción selectiva sobre las poblaciones naturales en virtud de que su captura, dado su tamaño, coincide con la época de reproducción. Bustamante y Sánchez-Páez (2010) proponen un intervalo de tallas comercial de 18 a 22 cm de ancho discal para las especies Paratrygon aiereba (raya manzana), Potamotrygon constellata (raya ocelada), Potamotrygon magdalenae (raya de río), Potamotrygon motoro (raya motora), Potamotrygon orbignyi (raya común o tigrita) y Potamotrygon schroederi (raya guacamaya). Las exportaciones de individuos adultos, es decir, con ancho de disco mayores a 22 cm deben hacerse con sumo cuidado y con una autorización adicional, pues es muy probable que estos individuos vayan al mercado asiático para su reproducción en cautiverio (rejuvenecimiento genético de los parentales) y creación de híbridos. Es esencial que la pesquería de las especies de la familia Potamotrygonidae se maneje con un enfoque precautorio y participativo, tal que permita a las comunidades hacer un uso y manejo de las especies acorde con la vulnerabilidad de las mismas. Utilización y comercio a) Comercio lícito: comercialización - cuotas de exportación Colombia. En Colombia las especies de la familia de rayas de agua dulce (Potamotrygonidae) son reconocidas como un recurso pesquero ornamental de gran importancia económica. Su explotación para comercio “principalmente internacional”, es considerada una de sus principales ame- Potamotrygon magdalenae Amazonas Potamotrygon constellata 47,6 (H) 28 (M) - San Jorge 40 - 42 (H) 52 (M) 45 62 4,9 (H) 4,5 (M) 17-21 (H) 17-19 (M) 15 - 12 a 15 - 32-34 (M) 35-45 (H) 80 (H) - - 76 (M) 85 (H) 157 (H) 114 (M) Tcom. (cm) - 72 (H) 60 (M) 37 (H) 44,7 (M) 100 - Tmm (cm) Ancho disco Tmáx. (cm) Magdalena MagdalenaCauca Atrato Amazonas Orinoco Amazonas Cuenca Plesiotrygon iwamae Paratrygon aiereba Especie Teshima y Takeshita (1992) Ver fichas de especies, Capítulo 5 - Colombia Carvalho et al. (2003) Thorson et al. (1983) Ross y Shafer (2000) de Carvalho et al. (2003) Ver fichas de especies, Capítulo 5 - Colombia Ver fichas de especies, Capítulo 5 - Colombia Barbarino y Lasso (2005) Venezuela Ver fichas de especies, Capítulo 5 - Colombia Charvet-Almeida et al.(2005) Brasil Ross y Shafer (2000) Fuente No Si Si Si Recurso limítrofe compartido Tabla 1. Propuesta de zonificación y tallas máximas (T máx.), media de madurez (T mm) y comercial (T com) de las rayas continentales presentes en el territorio colombiano. H (hembras), M (machos). Fuente: Bustamante y Sánchez-Páez (2010). M. D. Escobar 319 320 24-32 (H) 39 (M) 44 (H) 23 (M) 29,5 (H) 8,1 (H) 10 (M) 39 (M) 44 (H) 37 (H) 39,5 (M) - - 30-35 62,5 (H) 52 (M) 32,5 (H) 29 (M) 53 (H) 29,4 (M) 61,2 (H) 52,4 (M) 40 Amazonas Orinoco Amazonas Orinoco Amazonas - 60 42 (M) 44 (H) 27-31 (H) - - 10 (H) 11,3 (M) 39,5 (H) 44,2 (M) Orinoco Tmm (cm) Ancho disco Tmáx. (cm) Cuenca (*) dic-15 15-20 20-25 25-30 - - - - (*) 15-20 20-25 25-30 30-35 Tcom. (cm) Charvet-Almeida et al.(2005) Brasil Carvalho et al. (2003) Ross y Schaefer (2000) Ver fichas de especies, Capítulo 5 - Colombia, Venezuela Charvet-Almeida et al.(2005) Brasil Ver fichas de especies, Capítulo 5 - Colombia Lasso et al. (1996) -Venezuela Ver fichas de especies, Capítulo 5 - Colombia Ross y Schaefer en: Carvalho et al. (2003) Charvet-Almeida et al. (2005) Brasil Thorson et al. (1983) Argumedo (2008) Ver fichas de especies, Capítulo 5 - Colombia Fuente (*) Información tomada del “stocklist” de una tienda extranjera de peces ornamentales - Aquarium glaser (Alemania). Potamotrygon schroederi Potamotrygon orbignyi Potamotrygon motoro Especie Tabla 1. Continuación. Si Si SI Recurso limítrofe compartido RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA MARCO NORMATIVO Y COMERCIALIZACIÓN M. D. Escobar nazas y causa de reducción de las poblaciones silvestres (Araujo et al. 2004, Ramos 2009). En el país, los adultos de la especie del Magdalena (Potamotrygon magdalenae) son capturados también con fines de pesca de subsistencia (Lasso et al. 2011). En la región de Neiva, Hobo y el embalse de Betania al suroccidente de Colombia, además del consumo de la carne, tiene un uso medicinal muy asentado en la población. El aceite del hígado es empleado para tratar afecciones respiratorias, dolores de cabeza y fortalecimiento del feto para mujeres en estado de embarazo. La onza de aceite tiene un costo de $5.000 (US $ 2,60, aproximadamente) (Rojas-Ceballos et al. 2013). El empleo de grasa del hígado, extraído de especies como Potamotrygon motoro y Potamotrygon yepezi, con el fin de controlar el asma y la gripa, también ha sido referenciada para el área del Casanare (Castro y Peñuela 2006) y en la cuenca media y baja del río Catatumbo (ver ficha de especie, Capítulo 5), respectivamente. Prácticamente, esta actividad es común en todo el país y se aprovechan todas las especies a nivel artesanal, aunque existe un comercio incipiente. La de mayor interés -dado su tamaño-, es la raya manta (Paratrygon aiereba). En Puerto Carreño unos 500 ml pueden costar $200.000 (US $ 105) (Lasso y Morales-Betancourt obs. pers.) (Figura 1). Según la Resolución 3532 del Diario Oficial N0 46.854 de 27 de diciembre 2007, el Instituto Colombiano de Desarrollo Rural (Incoder), estableció como especies ícticas ornamentales aprovechadas comercialmente 444 especies, lo que representa el 30% de la ictiofauna continental colombiana. Como parte de este listado se encuentran ocho especies de la familia Potamotrygonidae: una del género Plesiotrygon, una del género Paratrygon y seis del géne- a. b. Figura 1. a) Extracción del hígado de Paratrygon aiereba, río Bita, Colombia; b) producto elaborado con aceite de hígado de P. aiereba para la venta, Puerto Ayacucho, Venezuela. Fotos: M. A. Morales-Betancourt. ro Potamotrygon. La especie Potamotrygon hystrix, citada erróneamente en dicha lista, no se encuentra registrada en el país y sus registros estadísticos corresponden 321 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA MARCO NORMATIVO Y COMERCIALIZACIÓN probablemente a la raya común o tigrita (Potamotrygon orbignyi) (Lasso obs. pers.). Esta lista no incluye a la raya del Catatumbo, Potamotrygon yepezi, perteneciente a la cuenca del Caribe (río Catatumbo) y compartida con Venezuela (Tabla 2). (raya espinosa, raya ocelada), Potamotrygon magdalenae (raya de río), Potamotrygon motoro (raya motoro, raya ocelada), Potamotrygon orbignyi (raya común, tigrita o reticulada) y Potamotrygon schroederi (raya guacamaya) (Tabla 2). Las especies de rayas permitidas en el comercio ornamental tanto a nivel nacional como para exportación son: Paratrygon aiereba (raya manzana), Pleisotrygon iwamae (raya antena), Potamotrygon constellata En Colombia el Decreto 2256 de octubre de 1991, por medio del Comité Ejecutivo para la Pesca, determina las especies y los volúmenes susceptibles de ser aprovechados o la asignación de cuotas globales anuales. Tabla 2. Lista y distribución en Colombia de las especies de rayas de agua dulce registradas en la Resolución 3532 de 2007. Especie Cuenca Amazonas Orinoco Magdalena - Cauca Paratrygon aiereba X X Plesiotrygon iwamae X Potamotrygon constellata X Potamotrygon magdalenae X Potamotrygon motoro X X Potamotrygon orbignyi X X Potamotrygon schroederi X X Las principales ciudades de acopio de especies de rayas son Leticia, Inírida, Puerto Carreño y Villavicencio (Figuras 2 y 3). Hay registros para Inírida (Tabla 3) y Leticia (Tabla 4). Los datos correspondientes a Puerto Carreño no están disponibles a pesar de que existe un mercado importante en la región. En la cuenca amazónica colombiana la raya motora se captura en las tres cuencas (Amazonas, Putumayo y Caquetá) y es la 322 que alcanza mayor valor. Los pescadores las venden a los acopiadores de Puerto Nariño a $5.000. Estos las llevan a Leticia y las venden a los acopiadores locales en $7.000 – 10.000, quienes por último las venden al exportador a $18.000 – 25.000, dependiendo de la especie y tamaño. La raya común cuesta en el punto de captura unos $3.000. Aunque no aparece registrada en las estadísticas oficiales, se captura también la M. D. Escobar Tabla 3. Número de especies de rayas comercializadas desde Inírida. Fuente: AUNAP (2012). Nota: los valores de Potamotrygon hystrix fueron agregados a Potamotrygon orbignyi ya que ambos nombres corresponden en realidad a esta última especie (Lasso obs. pers.). Especie Nombre común Potamotrygon orbignyi Raya común Potamotrygon schroederi Raya guacamaya, raya perla Potamotrygon aireba Raya manzana Potamotrygon motoro Raya motora 2010 30 1.079 0 2.083 2011 2012 Total 879 644 1.553 1.263 1.362 3.704 466 1.494 1.960 3.759 221 6.063 Tabla 4. Número de especies de rayas comercializadas desde Leticia. Fuente: AUNAP 2012. 2007 2008 2009 Potamotrygon motoro Especie Raya motoro Nombre común 0 758 24 49 47 878 Potamotrygon orbignyi Raya común 609 406 15 12 15 1.057 raya manzana (P. aiereba) en el sector de Tarapacá, río Putumayo, río Yavarí y con menor frecuencia en el cauce principal del Amazonas. Lo mismo ocurre con la raya guacamaya o perla (P. schroederi), que se pesca en el río Putumayo y Yavarí. Recientemente se ha incorporado al mercado la raya antena (Plesiotrygon iwamae) proveniente del río Putumayo, Caquetá y Amazonas y la raya ocelada o espinosa (Potamotrygon constellata), capturada en el lago Tarapoto, río Yavaría, río Tacana, quebrada Yahuarcaca y el caño Boiauasú, afluente del río Atacuarí. Se cuenta con información global sobre la exportación de la familia para el periodo 1994 – 2012. Luego de un incremento en las exportaciones en el periodo 2006 – 2008, se evidencia una disminución a partir de 2009. A partir de ese año se fijan cuo- 2010 2011 Total tas para la exportación de las especies de esta familia (Ajiaco et al. 2012) (Figura 4). De acuerdo con el seguimiento a los informes de exportaciones de la AUNAP, en el 2012 se exportaron aproximadamente 19.293 ejemplares de la familia Potamotrygonidae. Sus precios en el mercado internacional reflejan el interés de los acuarófilos por este grupo. Así, el valor comercial en los mercados europeos de la raya del Magdalena (Potamotrygon magdalenae), puede alcanzar valores de hasta de 49 euros por ejemplar, mientras que para otras especies el valor en estos mercados varía de acuerdo con su tamaño y son superiores dado su mayor vistosidad y colorido. Por ejemplo, la raya motora (Potamotrygon motoro) puede costar entre 130 y 210 euros, la raya común (Potamotrygon orbignyi) entre 175 y 225 euros y la guacamaya (Potamotrygon schroederi) de 145 a 225 euros. 323 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA MARCO NORMATIVO Y COMERCIALIZACIÓN a. b. c. d. e. f. Figura 2. a) Piscina de acopio para rayas, Inírida; b) uso de nasa para la captura de rayas en piscinas de acopio; c) manejo de ejemplares de Potamotrygon motoro para embalaje; d) ejemplar de Potamotrygon schroederi listo para envío; e) centro de acopio, Inírida; f) transporte de rayas desde el puerto a los centros de acopio, Inírida. Fotos: M. A. Morales-Betancourt (a, c), C. A. Lasso (f). 324 M. D. Escobar a. b. c. Figura 3. a) Potamotrygon motoro; b) Potamotrygon orbignyi; c) Potamotrygon orbignyi; d) Ejemplar de Potamotrygon schroederi (parte superior) y Potamotrygon orbignyi (parte inferior), centro de acopio, Puerto Carreño. Fotos: F. Trujillo. d. La información de la AUNAP a junio de 2013 menciona 42 empresas con permiso de exportación, de las cuales 33 registraron exportaciones entre enero y noviembre de 2012. De acuerdo con el seguimiento de las exportaciones a partir de los informes presentados por las empresas a la AUNAP, entre enero a diciembre de 2012 se registraron un total de 14`659.018 individuos de peces ornamentales de todas las familias exportados desde Colombia. Sin embargo, es importante señalar que estos informes no consideran la mortalidad generada entre el proceso de captura, acopio, estancia en las bodegas en las diferentes regiones de procedencia y transporte aéreo a Bogotá. Tampoco, tienen en cuenta la pesca furtiva y el comercio ilegal que ocurre con los países fronterizos. 325 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA MARCO NORMATIVO Y COMERCIALIZACIÓN Figura 4. Número de ejemplares de rayas (familia Potamotrygonidae) exportadas desde Colombia en el periodo 1994 – 2012. Fuente: 1994 – 1998 (INPA), 1999 – 2008 Barreto et al. (2009), 2009 (CEP 2010), 2010 – 2012 (Barreto et al. 2011) y AUNAP 2013. Con relación a todos los peces ornamentales que se exportan desde Colombia, los principales países de destino son Estados Unidos, Japón, Alemania y Taiwan (Figura 5). En la tabla 5 se presentan el número de individuos por especie de rayas exportados en Colombia, entre el 2008 y el 2012. Cabe resaltar que de acuerdo a las cifras reportadas por la AUNAP 2013 (modificado), la especie con el mayor número de ejemplares exportados fue P. magdalenae y se destacan P. motoro y P. orbignyi, lo que puede evidenciar tendencias en las demandas en el mercado en los últimos cuatro años. Del total de individuos exportados de enero a Figura 5. Principales países a los cuales son exportados los peces de agua dulce de Colombia. Fuente: Puentes et al. (2013). 326 M. D. Escobar En relación con el comercio nacional, la especie más solicitada es P. motoro. Los precios de esta especie (individuos de 30 cm AD) varían entre $ 100.000 y 150.000 (Bogotá), seguido por individuos de talla pequeña (10 – 15 cm AD) de P. magdalenae que se venden a $ 20.000 (Bogotá) (Lasso obs. pers.). noviembre de 2012, 19.293 peces correspondieron a la familia Potamotrygonidae, reportando el mayor número Potamotrygon magdalenae (13.473) y Potamotrygon motoro (2391) (Tabla 6). Estos datos son registrados en los informes mensuales presentados por las empresas exportadoras de peces ornamentales a la autoridad pesquera. Para el caso del establecimiento de cuotas globales de pesca de las diferentes especies de peces de uso ornamental en las cuencas continentales del país, para la familia Potamotrygonidae se definió para la vigencia del 2012, 2013 y 2014, una cuota de 23.000 unidades, mediante resolución del Ministerio de Agricultura y Desarrollo Rural, teniendo en cuenta las decisiones del Comité Ejecutivo para la Pesca – CEP y las recomendaciones del Comité Técnico Interinstitucional. En dichas instancias Otros datos disponibles sobre la exportación detallada por especie según reportes del Incoder 2005 (ver Acolpeces s/f), incluyen información sobre el número de ejemplares que las empresas exportadoras reportaron al Incoder entre los años 2003 y 2005 (Tabla 6). Esta información no incluye cuatro especies mencionadas en reportes del 2008 al 2012 como son Paratrygon aiereba, Potamotrygon constellata, Potamotrygon schroederi y Plesiotrygon iwamae. Tabla 5. Número de ejemplares exportados de la familia Potamotrygonidae en Colombia 2008-2012. Fuente: modificado AUNAP (2013). Se subrayan los valores más altos de ejemplares exportados por año. Nota: los valores de Potamotrygon hystrix fueron agregados a Potamotrygon orbignyi ya que ambos nombres corresponden realidad a esta última especie (Lasso obs. pers.). Especies 2008 2009 2010 2011 2012 8 150 42 Potamotrygon constellata 304 4 2 8 1 Potamotrygon magdalenae 6.437 14.619 14.481 6.036 13.473 Potamotrygon motoro 20.283 12.307 7.817 11.414 2.431 Potamotrygon orbignyi 21.813 9.455 3.117 2.833 2.288 Potamotrygon schroederi 12.580 6.346 2.042 1.226 1.094 487 1.265 3 Paratrygon aiereba Potamotrygon sp. Plesiotrygon iwamae Total 61.912 44.146 27.462 21.559 19.289 327 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA MARCO NORMATIVO Y COMERCIALIZACIÓN Tabla 6. Número de ejemplares reportados como exportados entre 2003 y 2005. NR: no relacionado. Fuente: Acolpeces (s/f). Nota: los valores de Potamotrygon hystrix fueron agregados a Potamotrygon orbignyi ya que ambos nombres corresponden realidad a esta última especie (Lasso obs. pers.). Especies 2003 2004 2005 Potamotrygon magdalenae 279 1.315 NR Potamotrygon motoro 225 497 3.212 Potamotrygon orbignyi 28 85 26 532 1.897 3.238 Total se ha evidenciado la necesidad de tener información biológico – pesquera y socioeconómica a nivel de especie, a fin de tomar decisiones de manejo de este recurso basados en la mejor evidencia científica disponible y no sólo a partir de la variabilidad de las exportaciones registradas en los informes de los exportadores a nivel general para la familia. Brasil. Los usos y las pesquerías de las rayas de agua dulce en Brasil incluyen, además de las pesquerías ornamentales, las pesquerías negativas y recreacionales, que se generan por conflictos con actividades de ecoturismo. Las pesquerías con propósito alimenticios están dirigidas a Paratrygon aiereba, Potamotrygon cf. scobina, Potamotrygon motoro y Potamotrygon orbignyi (Bessa et al. 2008 en Ramos 2009). De igual manera, de acuerdo a Araujo et al. (2004), los principales compradores de la carne de rayas de agua dulce son ciudades de las regiones norte y centro de Brasil, además de Japón y Corea del Sur. En relación con la pesca ornamental, según la normativa vigente (Normativa 204 de 2008), las especies permitidas para uso 328 ornamental en los estados del Amazonas y Pará, de acuerdo al ancho del disco incluyen seis especies (Ibama 2008) (Tabla 7). De acuerdo a Ramos (2009), algunas estadísticas para Brasil reportan los valores más altos de exportación en 2004 (Tabla 8). Las especies con mayores exportaciones entre 2003 y 2009 exceptuando 2006 y 2007 fueron P. motoro, P. leopoldi y P. cf. hystrix (Tabla 7). Ecuador. En este país las espinas se han utilizado para hacer pequeños arpones, flechas y adornos de manera local (MAE 2012). Perú. La información sobre rayas es limitada, la poca información existente de la familia Potamotrygonidae está referida a la identificación taxonómica de las especies que están incluidas en esta familia. Hay un catálogo de peces del Instituto de Investigaciones de la Amazonia peruana. Se reportan capturas para el consumo humano de las especies Paratrygon aiereba (raya ceja), Plesiotrygon iwamae (raya antena) y Potamotrygon castexi (raya otorongo) (sinónimo de Potamotrygon falkneri), dado M. D. Escobar Tabla 7. Especies de rayas de agua dulce permitidas para explotación en Brasil, con fines ornamentales o de acuariofilia. Fuente: Ibama (2008). AD máx. (cm): longitud del disco máxima permitida. Cuotas AD máx. (cm) Amazonas Pará Nombre común Nombre científico Total Potamotrygon motoro Motoro 30 4.000 1.200 5.200 Potamotrygon cf. hystrix Cururu 14 6.000 - 6.000 Potamotrygon schroederi Schroederi 30 1.000 - 1.000 Potamotrygon orbignyi Orbingnyi 30 1.200 1.200 2.400 Potamotrygon cf. henlei Henlei 30 - 1.000 Potamotrygon leopoldi Leopoldi 30 - 5.000 Total 12.200 8.400 20.600 Tabla 8. Rayas de agua dulce exportadas desde Brasil entre 2003 y 2009 (* valores tomados a partir del 15 de diciembre). Fuente: Ramos (2009). Especies 2003 2004 2005 2008* 2009 7.367 7.166 3.271 110 110 545 218 286 18 0 P. orbgnyi 1.058 1.236 533 62 10 P. leopoldi 375 806 1.259 454 697 P. cf. henley 343 758 562 56 35 P. cf. hystrix 1.355 2.522 1.090 454 273 11.043 12.706 7.001 1.154 1.125 P. motoro P. schroederi Total el gran tamaño que logran alcanzar en estado adulto. Esta información está basada en la Resolución Ministerial N0 295-2013 – Produce. Durante los años (2000-2008) se han registrado exportaciones de la familia Po- 2006 2007 tamotrygonidae de 274.815 unidades, correspondientes a un valor comercial de 5’473.680.5 soles, (equivalente a US $ 1’937.997.45). La especie con mayor aporte en unidades de ejemplares fue Potamotrygon motoro (raya motoro), con 233.670 unidades, (85% del total), seguido de Po- 329 330 0 103 758 341 13.112 10 0 0 76 1.281 359 9.687 2 0 Potamotrygon scobina Potamotrygon castexi Potamotrygon cf. histrix Potamotrygon falkneri Potamotrygon motoro Potamotrygon orbignyi Potamotrygon cf. schroederi Total 12.798 15.305 423 278 853 Plesiotrygon iwamae 251 253 258 Paratrygon aiereba Potamotrygon sp. 27 2001 31 2000 Heliotrygon sp. Especies / año 19.943 528 3 11 16.978 667 1.152 123 0 285 142 54 2002 25.405 829 1 54 20.923 843 1.916 202 0 358 227 52 2003 34.441 1.246 12 38 27.860 1508 1.086 2.219 0 188 218 66 2004 34.591 877 0 81 30.129 1.081 1.939 123 0 152 157 52 2005 38.769 1.286 31 99 32.531 1.485 2.730 133 4 243 194 33 2006 42.513 1.003 11 114 36.756 1.287 2.933 105 0 145 116 43 2007 51.050 846 4 73 45.694 930 3.081 119 0 178 92 33 2008 274.815 7.289 62 482 23.3670 8501 16.876 3.203 4 2.680 1.657 391 Total Tabla 9. Número de ejemplares de rayas de agua dulce exportados desde Perú entre 2000 y 2008. Fuente: Sánchez-Riveiro (2012). RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA MARCO NORMATIVO Y COMERCIALIZACIÓN M. D. Escobar tamotrygon cf. hystrix (raya común) con 16.876 ejemplares, (6,1%). Según los datos obtenidos, las especies con menor aporte en las exportaciones estuvieron representados por Potamotrygon cf. schroederi y Potamotrygon scobina, con 4 y 62 unidades, respectivamente. Durante el periodo de obtención de datos, Potamotrygon motoro ha ido incrementando su comercialización en forma exponencial de 9687 individuos (año 2000), hasta 45.694 ejemplares (año 2008) (Tabla 9) (Sánchez-Riveiro 2012). En relación con el valor comercial, de los 5´473.680.5 soles obtenidos entre 20002008, la especie con mayor aporte fue Potamotrygon motoro con 2´612.660.1 soles (US $ 921.345.7) (47,7%), seguido por Potamotrygon falkneri con 2´012,463.9 soles (US $ 709.688.26) (36,8%) del total de los ingresos. Durante el periodo analizado Potamotrygon falkneri, ha incrementado su valor desde 22,319.2 soles (US $ 7,87) en el 2000, hasta alcanzar su máximo valor 481,004.01 soles (US $ 169.62) en el 2006. En los últimos dos años (2007-2008) descendió su valor comercial. Por otro lado, Potamotrygon motoro, ha aumentado su valor comercial desde 56,510 soles (US $ 19,93) en 2000, hasta 458,378.68 soles (US $ 161.65) en 2008 (Tabla 10) (Sánchez-Riveiro 2012). Se cuenta con información del Gobierno Regional de Ucayalí, sobre el número de rayas comercializadas desde esta región en el periodo 2000 – 2011 (Tabla 11). Durante esos 11 años se extrajeron 3.196 individuos. Venezuela. El aceite de hígado de Paratrygon aiereba es utilizado como medicina para tratar afecciones respiratorias como gripa y asma en toda la Orinoquia. Igual función tiene el aceite de hígado de Po- Tabla 11. Número de ejemplares de rayas comercializados desde el departamento de Ucayalí para el periodo 2000 - 2011. Fuente: Sánchez-Riveiro (2012). Año 2000 2001 2002 2003 2004 2005 2006 2007 2008 2009 2010 2011 Ejemplares 1.070 182 624 64 205 42 19 34 392 402 139 23 tamotrygon yepezi, en el área del Lago del Maracaibo (Lasso obs. pers.). En relación a la pesca comercial, desde 1996 en el río Apure existe una pesquería artesanal, con fines de consumo. Se realiza en época de aguas altas (junio a agosto), cuando las capturas de las especies tradicionales y de mayor valor económico (como bagres y coporos), son más escasos (Barbarino y Lasso 2005) (Figura 6). En el periodo 1996 a 2002 se extrajeron en total 2525 kg, por parte de 65 arponeros en casi 100 horas de pesca, con una CPUE promedio de 5,6 kg/arponero/hora (Figura 7). En total durante dicho periodo se capturaron unos 75 individuos (Figura 8). La comercialización es a nivel local y las capturas totales para el periodo 1996 – 2002 fueron del orden de las 2,7 toneladas (Barbarino y Lasso 2005). Posteriormente, los autores realizaron otro estudio sobre la pesca co- 331 332 32,429.78 15,663.63 15,864.69 15,011.51 18,951.16 20,018.28 12,145.40 174,918.28 501.17 11,217.20 921,345.73 709,688.58 Total 158,573,536.69 237,896.04 230,153.37 343,428.41 333,404.58 265,580.95 1,930,274.89 29.97 81.52 270.83 0 78.29 8.82 31.74 1,249.01 2,112.35 2,160.10 1,330.95 862.93 971.54 248.62 2,276.05 88,411.04 98,517.65 45,230.30 44,368.24 29,480.55 161,645.69 79,369.69 152,947.24 146,815.87 140,948.12 169,624.43 115,917.73 105,569.94 85,684.70 86,011.86 52,692.40 Potamotrygon cf. hystrix 0 14,035.11 6,630.94 6,757.46 5,892.34 4,510.68 3,576.71 4,397,216.91 4,325.46 2,464.77 Potamotrygon castexi 32,373.45 1,904.20 1,915.13 1,820.56 2,173.73 9,516.83 2,322.03 5,684.63 6,391.01 645,34 35.26 0 0 35.26 0 0 0 0 0 0 Potamotrygon scobina 2,479.51 15,752.66 1,410.57 1,297.29 1,779.34 993.93 1,267.87 1,908.13 2,987.34 3,075.30 1,032.88 Plesiotrygon iwamae 7,870.79 14,804.24 699.30 962.56 1,352.05 1,018.27 1,423.85 1,530.69 3,397.79 3,271.55 1,148.18 Paratrygon aiereba 19,928.07 8,603.19 496.17 496.88 594.21 785.52 1,217.28 856.49 1,315.55 2,418.03 423,06 Heliotrygon sp. 5,64 Total 2008 2007 2006 2005 2004 2003 2002 2001 2000 Especie / año 0 Potamotrygon sp. 180,801.01 Potamotrygon schroederi 41,966.45 Potamotrygon orbignyi 144,036.13 Potamotrygon motoro 2,867.38 Potamotrygon falkneri 36,400.89 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA MARCO NORMATIVO Y COMERCIALIZACIÓN Tabla 10. Variación del valor comercial (en dólares), de las rayas de agua dulce exportados desde Perú entre 2000 y 2008. Fuente: Sánchez-Riveiro (2012). M. D. Escobar a. b. Figura 6. Captura con arpón de manta raya (Paratrygon aiereba) en el río Apure, Venezuela. Fotos: A. Barbarino. Figura 7. Evolución los volúmenes de captura en kilogramos. Periodo: 1996 - 2002. Fuente: Barbarino y Lasso (2005). Figura 8. Evolución del número de individuos capturados en el periodo 1996 a 2002. Fuente: Barbarino y Lasso (2005). 333 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA MARCO NORMATIVO Y COMERCIALIZACIÓN mercial de la especie en el río Apure (Barbarino y Lasso 2009). En relación a la pesca ornamental, en el 2004 el grupo de las rayas de agua dulce, familia Potamotrygonidae, ocupó el cuarto lugar en comercialización representando el 6,9% del total de las capturas, luego de los cíclidos (Perciformes) con el 39,6%, bagres (Siluriformes) 27,7% y sardinas (Characiformes) con 25,8%. Para ese año se registró la exportación de 68 especies de peces, tres pertenecientes a la familia Potamotrygonidae, estas fueron: Potamotrygon motoro, Potamotrygon orbignyi y Potamotrygon schroederi (Cabrera 2005) (Figura 9). Según Cabrera (com. pers.), Potamotrygon yepezi es enviada desde la ciudad de Maracaibo a los mayoristas de peces ornamentales en Caracas que la distribuyen a los minoristas (tiendas de acuarios) en esta a. ciudad para su venta. Se desconoce si se incluye en las exportaciones de peces ornamentales de dicho país. b) Cría en cautiverio y reproducción artificial Colombia. Actualmente se registran solo dos permisos autorizados para la cría en cautiverio de rayas a nivel experimental, otorgado a ACUICA (Asociación de Acuicultores de Caquetá) en Florencia – departamento del Caquetá. Esta empresa ha realizado ensayos de cría en cautiverio, pero no ha registrado resultados satisfactorios a la fecha (AUNAP com. pers Evelio Moncada). Recientemente, la Universidad de la Amazonia (Florencia –Caquetá) ha llevado a cabo experiencias exitosas con la reproducción de Potamotrygon motoro y Potamotrygon orbignyi (Franco-Rojas y Peláez-Rodríguez datos no publicados) (ver recuadro). b. Figura 9. a) Viveros para rayas, río Atapabo, Colombia; b) detalle de vivero para rayas, río Atabapo, frontera Colombia - Venezuela. Fotos: M. A. Morales-Betancourt (a), C. A. Lasso (b). 334 M. D. Escobar Experiencias en la producción comercial de juveniles de la raya motoro (Potamotrygon motoro) y raya tigrita (Potamotrygon orbignyi), en la región andino-amazónica colombiana Hugo Hernán Franco-Rojas y Marlon Peláez-Rodríguez Lugar: Estación Piscícola Pirarucú (Florencia-Caquetá), Colombia. Especies: Potamotrygon motoro y Potamotrygon orbignyi. Origen reproductores: ríos Caguán y Caquetá. Periodo de la experiencia: 2009 – 2012. Manejo. A los reproductores se les extrae la espina caudal o aguijón para evitar accidentes durante la captura, registro de sexo y siembra de individuos. Se toman datos de ancho discal-AD (cm), longitud del disco-LD (cm), peso (g), sexo y se les asigna un código a cada a. b. c. d. Figura 10. a) Adultos reproductores de Potamotrygon motoro procedentes del río Caquetá y Caguán, Amazonia Colombiana; b) macho reproductor de Potamotrygon motoro; c) extirpación de la espina caudal en Potamotrygon orbignyi; d) manipulación de macho reproductor de Potamotrygon motoro. Fotos: H. Franco-Rojas (a-c), E. Argumedo (d). 335 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA MARCO NORMATIVO Y COMERCIALIZACIÓN uno de los individuos (Figura 10). Los ejemplares son marcados mediante “Chips Avid System”, los cuales se insertan en la región dorsal de la margen derecha de la cola (Tabla 12). Tabla 12. Datos de los ejemplares marcados para reproducción. Peso LD AD (g) (cm) (cm) 106-769-852 1.060 46,6 27,3 H 106-785-084 1.050 50 27 H 106-812-819 920 46 27 H 106-639-353 920 46 28 H 106-810-024 820 49 28,5 H 106-811-541 800 44,3 25,8 H 106-809-514 402 51,5 25 H 106-773-592 302 41,3 23,5 M 106-772-613 978 58,7 38,7 M Código Sexo Tabla 13. Pasos, tiempo y objetivo para el cultivo de rayas de agua dulce. Acción 336 Tiempo (semana) Objetivo Retirar la maleza de las orillas y exceso de lodo y fango del piso del estanque, dándole mayor firmeza. Se seca el fondo del estanque. Desinfectar el estanque y subir el pH. Preparar nuevamente el estanque. Tiempo suficiente para que se inicie la producción biológica en el estanque. Limpieza y secado del estanque 1ª Encalado (50/m2) 2ª Llenado 3ª Fertilización (100/ m2) gallinaza) 3ª Aumenta la productividad del estanque. Siembra de peces presa (2,5 peces / m2) 4ª Proliferar la producción de los peces forrajeros para garantizar abundante alimento en el momento de la siembra de los reproductores. Siembra de los reproductores de raya. 8ª Producción de alevinos de raya. M. D. Escobar Cultivo en estanques Características: profundidad aprox. 80 cm, suelo firme, sin exceso de lodo, previamente acondicionado para la producción de peces forrajeros (p. e. Poecilia reticulata) (Tabla 13). Calidad del agua T = 26 – 28ºC. pH = 6,5 – 8. Transparencia: 30 – 60 cm. Oxígeno disuelto: superior a 4 mg/l. a. Alimentación reproductores Ración comercial peletizada en “pelets” de 5 mm al 45% de proteína, complementada con alimento vivo (peces forrajeros), producidos naturalmente en el estanque. Reproducción b. Los machos maduran a partir del cuarto año de vida. La hembra se nota hinchada y la gestación dura unos tres meses aproximadamente, con un parto de 1 a 12 crías, sin necesidad de inducción hormonal. Los partos tuvieron lugar cada seis meses para ambas especies (Figura 11). Manejo de neonatos Previo aislamiento de los reproductores, los neonatos son capturados con nasas y trasportados al laboratorio de manejo, donde se acopian en estanques plásticos de 1000 litros, a una densidad de 50 l/pez y con un recambio de agua del 100% al día (temperatura 26 -28ºC) (Figura 11). Alimentación neonatos Ración comercial peletizada en “pelets” de 2 mm al 45% de proteína, complementado con peces forrajeros. Se mantienen estas condiciones hasta que alcanzan un AD X = 10 cm. A partir de este tamaño se considera la talla comercial. c. Figura 11. a) Neonato de Potamotrygon motoro; b) juveniles de Potamotrygon motoro, de una semana de nacidos, cultivados en estanques de la piscícola Pirarucú; c) ejemplar de Potamotrygon orbignyi, sin espina caudal, con 20 días de nacido, listo para comercializar. Fotos: E. Argumedo (a - b), H. Franco-Rojas (c). 337 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA MARCO NORMATIVO Y COMERCIALIZACIÓN A nivel mundial es reconocida la importancia de las rayas de agua dulce como peces de acuario y su reproducción exsitu se realiza incluso en países fuera de su área de distribución natural, principalmente en países asiáticos. Durante la exposición internacional de acuaristas realizada en Taipei - Taiwan (septiembre de 2013) se exhibieron cruces o morfotipos raros como el conocido bajo el nombre común de “Batman” (el disco no se fusiona en la parte frontal del ejemplar durante el desarrollo embrionario) que alcanzan valores de US $ 100.000. c) Comercio ilícito Colombia En Colombia no hay cifras oficiales sobre el tráfico de especies de la familia Potamotrygonidae, aunque la AUNAP registra en sus estadísticas (2013) especies con distribución en Brasil (Potamotrygon signatus y Potamotrygon humerosa) y otros países como Paraguay y Uruguay (Potamotrygon brachyura) (Tabla 14). Esto probablemente corresponda a determinaciones erróneas. Lo que si es un hecho comprobado in situ, es la entrada a Colombia proveniente de Venezuela en la región de la Estrella Fluvial de Inírida y Puerto Carreño, de especies que han declinado poblacionalmente en el lado colombiano. Se trata de la raya guacamaya (Potamotrygon schroederi) (Lasso y SánchezDuarte 2012) y más recientemente de la raya motora (Potamotrygon motoro) y la común o tigrita (Potamotrygon orbignyi) (Lasso obs. pers.). Estas capturas aparecen consignadas en las estadísticas nacionales. Existen indicios de que entran a Colombia individuos en la región fronteriza del Trapecio Amazónico, pero en la actualidad no es fácil dimensionar la problemática de este tráfico de especies, dada la ausencia de una vigilancia y control efectivo, así como la falta de consolidación de las estadísticas nacionales, acordes con una reglamentación apropiada, generada por los cambios administrativos que ha tenido la Autoridad Pesquera Nacional, lo que ha dificultado contar con datos históricos de seguimiento a la actividad. Tabla 14. Número de ejemplares de la familia Potamotrygonidae reportados como parte de las estadísticas nacionales, pero que corresponden a especies con distribución en otros países de Suramérica. Fuente: Basado en Puentes et al. (2013). Especies 338 2008 2009 2012 Potamotrygon brachyura 1 Potamotrygon humerosa 12 2 4 Potamotrygon nigrolinetus 26 Potamotrygon signatus 31 4 Total 70 6 4 M. D. Escobar Para los restantes países (Brasil, Ecuador, Perú y Venezuela) no se cuenta con información. d) Efectos reales o potenciales del comercio: recomendaciones La combinación de factores intrínsecos de las especies de la familia Potamotrygonidae, relacionados con su historia de vida, aunado a los grandes volúmenes hasta ahora exportados en el país y la gran demanda internacional que existe por estas, las hacen muy vulnerables a la sobre-explotación. Lo anterior evidencia la necesidad de implementar medidas de ordenación, para el establecimiento de cuotas mediante la identificación de umbrales de aprovechamiento, soportado con información biológica de línea base, así como estudios sobre las tendencias poblacionales. En este mismo sentido habría que considerar la creación de mecanismos de seguimiento interinstitucionales, incluyendo las medidas adoptadas en la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestre -CITES- y las estrategias de conservación de las especies, que garanticen que los niveles de comercialización nacional e internacional no vayan en detrimento de las poblaciones. El país debe analizar cuál es la dimensión y potencialidad del comercio de ejemplares criados en cautiverio, potencializando ejercicios comunitarios que puedan tener lugar en torno a este recurso. Por último, y no por ello menos importante, se requiere de una apuesta económica del sector público ambiental y pesquero, así como del privado (exportadores), que apoyen los estudios biológicos, ecológicos y poblacionales, ya que estos son la base adecuada para el establecimiento de las cuotas anuales y medidas de manejo, tanto nacionales como regionales. Colombia ha avanzado mucho en el conocimiento taxonómico de las especies (ver capítulo 6.1) o en aspectos biológicos, pero es necesario más trabajo de campo especialmente en la Orinoquia y Amazonia para tratar aspectos poblacionales. Este es el reto que tiene Colombia para los años venideros. Bibliografía • • • • • • Acolpeces- Asociación colombiana de Productores y Exportadores de Peces Ornamentales. Rayas de agua dulce del género Potamotrygon utilizadas como ornamentales en Colombia. Informe técnico. Sin fecha. Ajicaco-Martínez, R. E., H. Ramírez-Gil, P. Sánchez-Duarte, C. A. Lasso y F. Trujillo. 2012. IV. Diagnóstico de la pesca ornamental en Colombia. Serie Editorial Recursos Hidrobiológicos y Pesqueros Continentales de Colombia. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Bogotá, D. C., Colombia. 152 pp. Araujo, M. L. G., P. Charvet-Almeida, M. Pinto y H. Pereira. 2004. Freshwater stingrays (Potamotrygonidae): status, conservation and management challenges. Information document AC20 (8): 1-6. Barbarino, A. y C. A. Lasso. 2005. Pesquería y aspectos biológicos de la raya manta Paratrygon aiereba (Müller y Henle 1841) (Myliobatiformes, Potamotrygonidae), en el río Apure (Venezuela). Memoria de la Fundación La Salle de Ciencias Naturales 163: 93-108. Barbarino, A. y C. A. Lasso. 2009. La pesca comercial de la raya manta Paratrygon aiereba (Müller y Henle, 1841) (Myliobatiformes, Potamotrygonidae) en el río Apure, Venezuela. Acta Apuroquia 1 (1): 24-31. Barreto, C., C. A. Borda, J. C. Otto, C. L. Sánchez-Páez, A. I. Sanabria-Ochoa, V. 339 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA MARCO NORMATIVO Y COMERCIALIZACIÓN • • • • • 340 Puentes y S. Muñoz. 2009. Propuesta de cuotas globales de pesca y otras medidas de manejo para el aprovechamiento de los recursos pesqueros colombianos, vigencia 2010. ICA. 113 pp. Barreto, C., C. A. Borda, L. Guillot, L. F. Maldonado, C. Bustamante, C. L. SánchezPáez, A. I. Sanabria-Ochoa y S. Muñoz. 2011. Documento técnico de cuotas globales de pesca para la vigencia 2012. Incoder. 331 pp. Bustamante, C. C. y C. L. Sánchez-Páez 2010. Concepto técnico: talla mínima de captura para las especies de la familia Potamotrygonidae comercializadas como peces ornamentales en Colombia. Incoder: Dirección Técnica de Investigación y Ordenación. Cabrera, A. 2005. Situación del recurso peces ornamentales continentales en Venezuela. Pp: 16 – 17. En: Memorias del taller internacional “Aspectos socioeconómicos y de manejo sostenible del comercio internacional de peces ornamentales de agua dulce del norte de Sudamérica”. Bogotá, D.C. Caldas-Aristizábal, J. P., E. Castro-González, V. Puentes, M. Rueda, C. A. Lasso, L. O. Duarte, M. Grijalba-Bendeck, F. Gómez, A. F. Navia, P. A. Mejía-Falla, S. Bessudo, M. C. Diazgranados, L. A. Zapata-Padilla y A. M. Suárez (Eds.). 2010. Plan de Acción Nacional para la conservación y manejo de tiburones, rayas y quimeras de Colombia (PAN-Tiburones Colombia). Instituto Colombiano Agropecuario, Secretaria Agricultura y Pesca San Andrés Isla, Ministerio de Ambiente, Vivienda y Desarrollo Territorial, Instituto de Investigaciones Marinas y Costeras, Instituto Alexander von Humboldt, Universidad del Magdalena, Universidad Jorge Tadeo Lozano, Pontificia Universidad Javeriana, Fundación SQUALUS, Fundación Malpelo, Conservación Internacional, WWF Colombia. Editorial Produmedios, Bogotá, D.C. 70 pp. Castro, F. y L. Peñuela. 2006. Caracterización de usos de la biodiversidad e identificación de opciones de manejo de recursos de la biodiversidad en el resguardo indígena caño Mochuelo, Casanare. Fundación horizonte verde. Documento final del con- • • • • • • • • • • venio de cooperación Nº 06-02-GTZ-0397. Villavicencio. 25 pp. Comité Ejecutivo para la Pesca - CEP. 2010. Documento técnico de evaluación de las especies efectivamente aprovechadas - propuesta de cuotas globales de pesca para la vigencia 2011. Incoder. 339 pp. Charvet-Almeida, P., M. L. G Araújo y M. P. Almeida. 2005 Reproductive aspects of freshwater stingrays (Chondrichthyes: Potamotrygonidae) in the Brazilian Amazon Basin. Journal of Northwest Atlantic Fishery Science 35: 165–171. Carvalho, M. R., N. R. Lovejoy y R. S. Rosa. 2003. Potamotrygonidae. Pp 22–29. En: Reis, R. E., C. J. Jr Ferraris y S. O. Kullander (Eds). Checklist of freshwater fishes of South and Central America. Editora da Pontifícia Universidade Católica, Porto Alegre. Garman, S. 1877. On the pelvis and external sexual organs of selachiens, with special reference to the new genera Potamotrygon and Disceus. Proceedings of the Boston Society of Natural History 19: 197–215. Inpa. 1994. Boletín estadístico pesquero. División de Sistemas y Estadísticas. Bogotá, D. C. 47 pp. Inpa. 1995. Boletín estadístico pesquero. División de Sistemas y Estadísticas. Bogotá, D. C. 54 pp. Inpa. 1996. Boletín estadístico pesquero. Grupo de Estadísticas. Bogotá, D. C. 107 pp. Inpa. 1999. Boletín estadístico pesquero 1997-1998. Grupo de Estadísticas. Bogotá, D. C 120 pp. Lasso, C. A., A. Rial y O. Lasso-Alcalá. 1996. Notes on the biology of the freshwater stingrays Paratrygon aiereba (Müller y Henle, 1841) and Potamotrygon orbignyi (Castelnau, 1855) (Chondrichthyes: Potamotrygonidae) in the venezuelan Llanos. Aqua, Journal of Ichthyology & Aquatic Biology 2(3): 39-50. Lasso, C. A. y P. Sánchez-Duarte. 2012. Potamotrygon schroederi. Pp. 149 - 151. En: Mojica, J. I.; J. S. Usma; R. Álvarez-León y C. A. Lasso (Eds.). 2012. Libro rojo de peces dulceacuícolas de Colombia 2012. Instituto de Investigación de Recursos Bioló- M. D. Escobar • • • • gicos Alexander von Humboldt, Instituto de Ciencias Naturales de la Universidad Nacional de Colombia, WWF Colombia y Universidad de Manizales Bogotá, D. C., Colombia. 319 pp. Lasso, C. A., H. B. Ramos-Socha, T. S. Rivas-Lara y C. E. Rincón-López. 2011. Potamotrygon magdalenae (Myliobatiformes, Potamotrygonidae). Capítulo 7.4. Pp. 136 – 137. En: Lasso, C. A, E. Agudelo Córdoba, L. F. Jiménez-Segura, H. Ramírez-Gil, M. A. Morales-Betancourt, R. E. Ajiaco-Martínez, F. de P. Gutiérrez, J. S. Usma Oviedo, S. E. Muñoz Torres y A. I. Sanabria Ochoa (Eds.). 2011. I. Catálogo de los recursos pesqueros continentales de Colombia. Serie Editorial Recursos Hidrobiológicos y Pesqueros Continentales de Colombia. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt (IAvH). Bogotá, D. C., Colombia. 715 pp. MAE- Ministerio de Ambiente de Ecuador. 2012. Informe técnico sobre las rayas de agua dulce familia Potamotrygonidae. Documento de trabajo. Autoridad Administrativa Cites Ecuador. 9 pp. Negrete, R. E. 2011. Análisis y la formulación de lineamientos y recomendaciones de ajuste a la normatividad nacional, relacionada con fauna silvestre. Informe Técnico Final para el Instituto Humboldt. Contrato 11-11-020-225PS. Bogotá. 66 pp. Puentes, V., C. J. Polo, J. G. Ramírez, A. M. Suárez, D. F. Mojica, J. Plata, G. Salazar, J. E. Gutiérrez y A. C. Amado. 2013. Propuesta técnica para el establecimiento de cuotas globales de pesca y otras medidas de manejo para los recursos pesqueros de Colombia, Vigencia 2014. En: Puentes, V. E. J. Gutiérrez y A. C. Amado.(Eds.). Propuesta técnica presentada al Comité Ejecutivo para la Pesca 2013. Oficina Generación del Conocimiento y la Información –OGCI-. • • • • • • • Autoridad Nacional de Acuicultura y Pesca – AUNAP. 109 p. Ramos, H. A. C. 2009. Exploration and commerce of freshwater stingrays in Brazil. Report to the Regional Workshop on South American Freshwater Stingrays, Geneva, 15–17 April 2009. Rojas-Ceballes, K., C. Rubio-Pérez, F. Lozano-Devia, C. Rodríguez-Sierra. 2013. Conocimiento local enfocado al uso del recurso hidrobiológico raya (Potamotrygon magdalenae) para las áreas de influencia Neiva, Hobo y Betania frente al aprovechamiento de los productos y subproductos del recurso. Pp. 67. En: Memorias del XII Congreso Colombiano de Ictiología y III Ecuentro de ictiólogos Suramericanos. Rosa, R., P. Charvet-Almeida y C. C. Diban. 2010. Biology of the South American Potamotrygonid stingrays. Pp. 241 – 281. En: Carrier, J. C., J. A . Musick y M. R. Heithaus (Eds.). Sharks and their relatives II: biodiversity, adaptive physiology and conservation. CRC Press, Nueva York. Ross, R. A. y F. Scheafer. 2000. Freshwater rays. Aqualog. ACS Gaser. Germany. 69 pp. Sánchez-Riveiro, H. 2012. Análisis de las propuestas de enmiendas a los apéndices de Cites respecto a especies hidrobiológicas y proceso de categorización de especies de peces de aguas continentales distribuidas en el Perú. Seminario Taller. Lima, diciembre 14 y 15. Teshima, K. y K. Takeshita. 1992. Reproduction of the freshwater stingray, Potamotrygon magdalenae taken from the Magdalenae river system in Colombia, South America. Bulletin of Seikai National Fisheries Research Institute 70: 11–27. Thorson, T. B., D. R. Brooks y M. A. Mayes. 1983. The evolution of freshwater adaptation in stingrays. National Geographic Research Reports 15: 663–694. 341 Parque Wisirare, Casanare. Foto: M. A. Morales-Betancourt M. A. Morales-B. 8. Envenenamientos causados por rayas de agua dulce (Potamotrygonidae) en Brasil, con notas sobre los países vecinos (Colombia, Venezuela y Ecuador): implicaciones en la salud pública Vidal Haddad Jr., Domingos Garrone Neto, Carlos A. Lasso, Mónica A. Morales-Betancourt, Ramiro Barrriga y Aniello Barbarino Las rayas no son peces agresivos por naturaleza, solo reaccionan en actitud de defensa cuando la gente las manipula inadecuadamente o las pisa accidentalmente. Históricamente, las lesiones provocadas por rayas apenas se mencionan porque siempre han sido parte del día a día de las comunidades ribereñas de Suramérica. “Si la víctima se caga no es un hombre, si no lo hace, no lo picó una raya”, decía un pescador del medio oeste brasilero, refiriéndose al dolor insoportable causado por el aguijón o la espina caudal de la raya (Garrone Neto y Haddad Jr. 2010). Los envenamientos por picaduras de raya son relativamente comunes entre las comunidades de pescadores (Almeida y Rocha 1989, Haddad Jr. et al. 2004). Tales accidentes se caracterizan por ser poco letales pero muy dolorosos y desagradables, y ya que suelen ocurrir en áreas remotas, casi nunca son reportados, no se atienden apropiadamente o apenas son tratadas con medicina tradicional (Garrone Neto et al. 2005, Haddad Jr. 2008). La información disponible sobre este problema se basa en la búsqueda activa de casos o historias clínicas incompletas, disponibles en los establecimientos de salud de los diferentes países, con las restricciones inherentes a los métodos de recolección de datos (Pardal 2003, Garrone Neto y Haddad Jr. 2008). A continuación se comentan aspectos históricos de las lesiones causadas por rayas en Brasil, país donde se han realizado la mayor parte de las investigaciones, complementado con información de Venezuela, Ecuador y Colombia. Para el resto de los países objeto de este volumen (Perú, Guayana, Surinam y Guayana Francesa), no se encontró ningún tipo de información, aunque se sospecha que su situación es la misma que en los países vecinos. Se incluye también un estudio sobre su distribución, con especial énfasis en las comunidades 343 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA ENVENENAMIENTOS ribereñas de las regiones norte y centrooeste de la Amazonia brasileña y áreas adyacentes. Por último se destacan también los aspectos clínicos de la picadura, su tratamiento y las medidas preventivas. Breve reseña histórica Desde el descubrimiento de Brasil, tanto las rayas (marinas y de agua dulce) como las lesiones que causan en humanos, han sido descritas en muchos tratados. En un intento de citar cronológicamente las referencias sobre este tema, se encontró que el primer autor en mencionar las rayas de la familia Potamotrygonidae fue Claude D’Abbeville (*?, † 1616), sacerdote capuchino enviado al estado de Maranhão por la empresa colonial para fundar La France Équinoxiale. En su libro publicado en 1614 afirma: “El jauebuíre tiene una cola larga en cuyo centro hay una espina en forma de dardo más grande que un dedo y cuya lesión es tan peligrosa, que a veces es mejor quitar la extremidad afectada” (Nomura 1996). En el mismo periodo, el sacerdote misionero Frei Cristóvão de Lisboa (* 1583, † 1652), registró 103 especies de peces y publicó los primeros dibujos de rayas de agua dulce (jabepurapeni en lengua indígena) incluidos los informes sobre las especies de la Amazonia oriental (estados de Pará y Maranhão). Su libro “Historia de los animales y los árboles de Maranhão”, se considera un trabajo de documentación iconográfica magnífico, en el cual es posible hallar historias asociadas con rayas de la familia Potamotrygonidae: “Jabebura [...] es muy fuerte y tiene espinas en la espalda , tras su secado, la piel sirve como papel de lija, son tan fuertes que ni una flecha ni una espada puede traspasarlas, tienen una espina en la cola que es muy peligrosa y sus picaduras ya han matado a algunas 344 personas [...]. Jabepurapeni es la raya de agua dulce, de un palmo y medio de largo, que puede alcanzar los cuatro y medio tramos de diámetro, son muy redondas, de color marrón con manchas rojas, el cuello está cubierto de pequeñas espinas y dos más largas en la cola que son muy peligrosas y venenosas, es un animal muy peligroso“ (Lisboa 2000). El naturalista y explorador Henry W. Bates (* 1825, † 1892) aporta una colección de textos sobre los peces y el folclore “[...]. Las rayas son comunes en bahías tranquilas y los nadadores a menudo son gravemente heridos por ellas. El arma de este pez es un aguijón con bordes dentados y tres pulgadas de largo, que crece desde el lado de la larga cola carnosa. Una vez ví a una mujer que resultó herida mientras se bañaba, ella gritó horriblemente y tuvo que ser llevada a la cama, donde permaneció durante una semana padeciendo el dolor. He visto a hombres fuertes que quedaron lisiados durante muchos meses debido a su aguijón “ (Bates 1944, Nomura 1996). Un siglo más tarde, Ricardo de Souza Rosa (1985) recuperó los estudios sobre las rayas de agua dulce en Brasil, así como diverso material relacionado con la historia y la taxonomía de la familia Potamotrygonidae, incluyendo la experiencia de los indígenas suramericanos con accidentes causados por estos animales: “Los indios de América del Sur fueron probablemente los primeros seres humanos afectados por las rayas de agua dulce. Los primeros informes sobre estos animales, provenientes de misioneros y exploradores, revelaron que muchas tribus tenían diferentes nombres para las rayas en sus vocabularios, y en consecuencia llamaron a algunos, ríos de rayas, debido a su abundancia (...). Los indios probablemente desarrollaron el M. A. Morales-B. método de arrastrar los pies en el fondo del río para cruzarlos, para evitar lesiones por rayas (...) también desarrollaron los primeros tratamientos naturales para las heridas causadas por rayas, utilizando extractos de plantas “ (Rosa 1985). En el caso de la Orinoquia, las narraciones de José Gumilla en “El Orinoco Ilustrado y Defendido” (edición de 1963) que datan del periodo colonial (1741), son más que elocuentes en cuanto a la importancia y los problemas que ya causaban estas especies (ver López-Corcuera 1984). Epidemiología Se presenta a continuación los datos recolectados y los casos observados en el norte y centro-oeste de Brasil, en los ríos, comunidades ribereñas y hospitales situados en la Amazonia y sus adyacencias; también en la Amazonia ecuatoriana, Orinoquia colombo-venezolana (especialmente en la región de los Llanos venezolanos) y registros puntuales de la cuenca del Magdalena (Figura 1). En la cuenca del Araguaia -Tocantins, norte y centro-oeste Brasil - principalmente en los estados de Tocantins, Mato Grosso y Pará-, las lesiones causadas por rayas son más frecuentes durante la sequía, sobre todo entre julio y septiembre (Haddad Jr. et al. 2004, Haddad Jr. y Garrone Neto 2009, Haddad Jr. et al 2013). En éste periodo se forman las playas y bancos de arena en los ríos (por ejemplo Araguaia, Xingú y ríos Tocantins), donde miles de personas llevan a cabo actividades recreativas. Las víctimas suelen ser picadas en las extremidades inferiores durante el día, mientras nadan o vadean en el agua o de un banco de arena a otro. Los accidentes tienden a disminuir a lo largo del año pero siguen ocurriendo esporádicamente entre los pescadores profesionales y aficionados (Figura 2). En este grupo de personas, los accidentes suceden generalmente cuando los animales son pisados o cuando se utilizan atarrayas, porque al emplear esta técnica, los pescadores deben quedarse en el agua para recoger la red. El desembarco de los peces en la orilla o las labores de mantenimiento de las embarcaciones también han dado lugar a accidentes en las regiones norte y centro-oeste de Brasil. Los pescadores aficionados se lesionan con frecuencia entre abril y mayo pues es la temporada de pesca abierta para las especies nativas, momento en el que las personas de las regiones sur y sudeste del país buscan los ríos amazónicos y del medio-oeste para la práctica de esta pesca. En estas ocasiones, las picaduras son el resultado de la manipulación de los animales capturados accidentalmente con anzuelos o de haber sido pisadas mientras se encuentran camufladas en las playas o bancos de arena. En el curso medio del río Araguaia (donde se encuentran importantes centros turísticos de pesca), la principal especie observada suele ser Potamotrygon orbignyi. En la misma región Potamotrygon henlei suele habitar cerca de las rocas, mientras que Potamotrygon leopoldi es endémica del río Xingu donde es capturada frecuentemente. Estas especies tienden a acercarse a las orillas durante la noche, lo que debe servirnos de alerta. En el río Tocantins, la inundación de zonas extensas por efecto de las centrales hidroeléctricas formó islas artificiales y playas que sirven de áreas de recreo para los habitantes locales. En esos sitios tienden a ocurrir accidentes con rayas durante todo el año. También en los embalses, en donde ciertas condiciones ambientales como la reducción del flujo de la corriente o la proliferación de presas que son parte de la dieta de las rayas, pueden 345 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA ENVENENAMIENTOS Figura 1. Localidades de los registros de las lesiones causadas por las rayas de agua dulce relacionadas con los casos de estudio considerados en este capítulo. 346 M. A. Morales-B. a. b. c. d. Figura 2. Situaciones de riesgo para los pescadores profesionales debidas a los accidentes con rayas: a) pesca de cerco y otras actividades en el agua; b) y c) un pescador aficionado pescando en un afluente del río Araguaia (Brasil Centro-Oeste); d) cuando fue herido por una raya de agua dulce. Fotos: D. Garrone Neto (a - b), L. F. B. Gonçalves (c - d). dar lugar a un aumento de la población de rayas y por ende, a una mayor probabilidad de interacción con los seres humanos, tal como se ha observado en áreas circundantes del lago Tucuruí (Marabá y Tucuruí, estado de Pará) y en la presa hidroeléctrica de Lajeado (Palmas, estado de Tocantins). En la cuenca del río Paraguay, oeste medio de Brasil -así como en los ríos de la región norte de Brasil-, las picaduras y envenenamientos por rayas de agua dulce son parte de la vida cotidiana de las comunidades indígenas y ribereñas. Pero los accidentes también ocurren entre los pescadores profesionales y ribereños, quienes sufren heridas en las extremidades inferiores a causa de las picaduras durante las labores de servicio en los puertos o mientras se recrean en los ríos. Los niños también son susceptibles a estas lesiones, especialmente cuando juegan en los ríos. Las lesiones que sufren los pescadores aficionados, son causadas principalmente por el manejo inadecuado de los animales capturados accidentalmente con anzuelos. También hay informes de accidentes con turistas y animales, incluyendo caballos y ganado, mientras cruzaban o se bañaban en los ríos. En un estudio realizado en Corumbá, Mato Grosso do Sul, frontera entre Brasil y Bolivia, se encontró que durante 347 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA ENVENENAMIENTOS el invierno austral, de julio a septiembre, los accidentes fueron más frecuentes (Haddad Jr. et al. 2004). De los 18 casos investigados, el 90% ocurrieron durante el día y las víctimas fueron hombres entre 29 y 46 años. La especie Potamotrygon motoro fue la más común en el área de investigación, lo que sugiere que estaba involucrada en la mayoría de los casos. Potamotrygon falkneri también se encuentra en la cuenca del río Paraguay y se relaciona con lesiones humanas. En la Amazonia ecuatoriana los accidentes son frecuentes entre las comunidades indígenas Cofanes, Shuaras, Qechuas, Achuaras y Huaoranis, mientras realizan actividades de pesca en las orillas de ríos y lagunas, tanto durante el día como la noche. El mayor número de accidentes de rayas se producen en la época seca cuando disminuye el nivel de las aguas. En la tabla 1 se muestra el número aproximado de casos provenientes de los nativos, quienes han sufrido las picaduras de rayas, especialmente de la pumaraya (Potamotrygon motoro), que es la especie más abundante. Todos los casos fueron tratados tanto con medicina tradicional como en centros hospitalarios. Se registraron 56 casos en tres años (2011-2013). En Colombia, aunque no hay estadísticas al respecto, es ampliamente conocido los accidentes con este tipo de especies. En todas las comunidades ribereñas hay reportes anecdóticos de pobladores, trabajadores agrícolas, bañistas, pescadores e indígenas de la Orinoquia y Amazonia, donde la mayor parte de las lesiones están relacionadas con picaduras de Potamotrygon orbignyi y Potamotrygon motoro. Los centros de salud evaluados (Puerto Inírida y Puerto Carreño-Orinoquia, y 348 Leticia-Amazonia), no llevan registros específicos de accidentes con rayas y en algunos casos los médicos que atienden a los pacientes no están familiarizados con este tipo de situaciones. Además, estos casos no son de notificación obligatoria y los documentados son muy pocos, por lo que el subregistro es muy alto (Gómez-C. 2011). De manera muy aproximada, de acuerdo a la consulta con especialistas y lugareños, la región de Colombia que experimenta el mayor índice de accidentes, corresponde a la cuenca del río Magdalena-Cauca y sus tributarios, donde la raya barranquillera (Potamotrygon magdalenae) es muy abundante. Los afectados incluyen principalmente a los pescadores y trabajadores del campo (Lasso obs. pers.). En Venezuela hay algo más de información documentada al respecto. La búsqueda permitió encontrar seis trabajos que datan desde 1965 hasta el 2004, cuatro de ellos referentes a la región de los Llanos, donde parecen ser más frecuentes los encuentros con rayas de agua dulce. Dichos trabajos tocan varios tópicos relacionados con aspectos clínicos, epidemiológicos, tratamiento y prevención. Dao (1965) con base en datos recogidos entre 1941 y 1964 en los Llanos de Venezuela, especialmente en los ríos Aguaro-Guariquito y Mocapra, estudió 23 casos clínicos de lesiones producidas por la raya tigrita (Potamotrygon orbignyi) y la guacamaya (Potamotrygon schroederi). De estos pacientes, siete acudieron antes de las primeras 24 horas a recibir atención médica y 16 eran casos infectados, con intervalos de cuatro días hasta cinco meses después de producirse las lesiones por las rayas. Así, se puede observar que es mayor el número de casos infectados que fueron a los hospitales a recibir el tratamiento, que los otros con lesiones recientes. X X Río Huasanga Río Morona-Cangaimi 4 X X Río Pastaza (bajo) X Río Pastaza (medio) Río Upano-Santiago 5 X Río Curaray (medio) 4 2 2 2 4 5 X X 4 Río Napo (bajo) X Río Napo (medio) 3 Río Napo (bajo) X Río Napo (alto) 4 8 X X Río Aguarico 9 n casos X Medicina natural Río Aguarico (medio) Río Putumayo Cuenca hidrográfica/ río 1 1 1 3 4 2 2 2 2 1 1 3 4 2011 1 1 1 2 2 1 3 1 1 2 2 3 3 2012 0 0 0 0 0 0 0 1 1 1 1 2 2 2013 Hospital San Jose Taisha Hospital San Jose Taisha Hospita Provincial de Macas Hospital Provincial Shell Hospital Provincial Puyo Centro de Salud Lorocachi Hospital Nuevo Rocafuerte Centro de Salud Tiputini Centro de Salud Limoncocha H. Provincial Fco.Orellana H. Provincial Lago Agrio Centro de Salud Tarapoa Centro de Salud Pto. El Carmen Centros médicos 3 5 2 2 3 5 4 5 3 4 4 2 5 n casos 1 2 1 1 1 2 2 3 1 1 2 1 2 2011 2 2 1 1 1 2 2 2 1 3 1 1 2 2012 0 1 0 0 1 1 0 0 1 1 1 0 1 2013 Tabla 1. Lesiones o picaduras de rayas atendidas por curanderos y centros médicos en la Amazonia ecuatoriana. Periodo 2011-2013. M. A. Morales-B. 349 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA ENVENENAMIENTOS Rodríguez-Acosta (2005) realizó un análisis clínico y epidemiológico de accidentes ocasionados por rayas de río y más recientemente, Gutiérrez et al. (2004), publicaron un análisis descriptivo de 20 casos atendidos entre enero del 2000 a diciembre del 2003 en la región de San Rafael de Atamaica, cuenca de los ríos Apure-Arauca. La distribución fue como sigue: año 2000 (4), 2001 (5), 2002 (6) y 2003 (5). El 70% de los casos tuvieron lugar en la estación seca (febrero-abril), con un predominio de pacientes masculinos (90%) en la tercera y cuarta década de la vida durante la realización de actividades recreacionales (80%) o pesca (20%). La mayoría de los pacientes acudieron al Ambulatorio de Atamaica poco después del accidente, sólo la mitad volvieron al control semanal. San Fernando de Apure, capital del Estado Apure y principal ciudad de los Llanos inundables venezolanos, tiene un hospital central y varios centros de salud. Varios de ellos fueron visitados por el último autor durante el 2013 y la información obtenida -tras varias averiguaciones indirectas, pues la información es de acceso restringido-, fue de 59 casos (2011), 65 casos (2012) y 37 casos (agosto 2013). De estos accidentes, entre 4 a 8 corresponden a bañistas de la propia ciudad, el resto provienen de poblados vecinos y tanto los campesinos, llaneros y pescadores poco van a los centros de salud salvo que la herida se infecte gravemente. En otras regiones de Venezuela como el Lago de Maracaibo y las áreas pantanosas del delta del Orinoco, los accidentes son frecuentes. Para todo el país, los habitantes más afectados en orden de importancia suelen ser pescadores, indígenas, bañistas y trabajadores del campo (Lasso 1985). 350 Aspectos clínicos del envenenamiento El dolor y la necrosis de los tejidos en el sitio de la picadura, son aspectos constantes y destacados por varios autores desde los primeros informes sobre las lesiones de rayas de agua dulce, incluso desde épocas coloniales (ver p. e. las narraciones de J. Gumilla de 1741, re-editadas en 1963 y reseñadas por López-Corcuera 1984). Ya Vellard en 1931, describió las manifestaciones clínicas del envenenamiento producido por la raya: “Las rayas a menudo pican en los pies o parte baja de la tercera parte de la pierna. Las heridas son profundas y amplias; independientemente de la acción del veneno, el tejido desgarrado ya produce intenso dolor. Sólo unos minutos más tarde, de cinco a diez o incluso más, los síntomas comienzan a manifestarse. Inicialmente hay calambres muy fuertes que se extienden hasta la base de la extremidad lesionada, que a veces son generalizados. La extremidad lesionada se inmoviliza en flexión y comienzan contracturas muy dolorosas; el sufrimiento se vuelve intolerable y el paciente no puede dejar de gritar. El dolor persiste con la misma intensidad durante diez o veinte horas y luego va disminuyendo lentamente, desapareciendo sólo pasados unos pocos días. Poco después del accidente, el área lesionada empieza a arder, se vuelve caliente y roja y la sensación es a menudo acompañada por profusión sanguínea. En general estas heridas son mal atendidas, por lo que suelen complicarse derivando en linfangitis y adenitis. Más tarde, los tejidos necróticos se separan debido a las úlceras, provocando en muchos casos, la amputación espontánea de los pies o las manos. La cura de estas lesiones siempre toma largo tiempo. Aparte del dolor, los síntomas generales suelen ser en general de menor importancia“ (Vellard 1931). Mello-Leitão (1948) M. A. Morales-B. reproduce el texto anterior en su libro. En 1934 Couto de Magalhães observó que “ [...] la herida resultante (de la picadura) es un problema, ya que la irregularidad del corte-el aguijón deja un producto viscosocontribuye en gran medida a complicar la lesión. La gente de la tripulación le teme mas a estos peces que a las serpientes” (de Magalhães 1934). síntomas fueron el edema y el eritema local, así como necrosis cutánea de intensidad variable (Figura 3). En Venezuela los estudios también muestran una mayor incidencia en el pie, tanto en la región dorsal como en el tendón de Aquiles (Dao 1965, Machado-Allison y Rodríguez-Acosta 2005, Rodríguez-Acosta 1997) (Figura 4). Castex y Loza (1964) definen la llamada “Enfermedad Paratrygónica” después de ver decenas de casos en Argentina: “El inicio es repentino, con dolor desgarrante agudo y violento con o sin cólicos, ansiedad e inquietud y poco o nada de los síntomas generales”. Durante este estado o periodo hay “malestar (no constante), ansiedad e inquietud (no constante), hipertermia discreta (no constante), dolor, edema rojizo moderado y localizado, escaras, constante formación y segregación perilesional y úlcera tórpida”. La enfermedad evoluciona durante “20 días a varios meses” y las complicaciones pueden ser “traumática con infección superpuesta, gangrena, fístula, trastornos neurotróficos, hipersensibilización a diversos alergenos y vasos sanguíneos rotos por el proceso ulceroso” (Castex et al. 1964). Las lesiones por rayas de agua dulce, son más graves que las causadas por rayas marinas si se tiene en cuenta la necrosis de la piel como un parámetro comparativo, ya que el dolor es intenso en ambos casos (Haddad Jr. 2008). La tasa de necrosis de la piel por rayas marinas fue de aproximadamente 75%, mientras que fue casi del 100% en el caso de rayas de agua dulce. Segun Haddad Jr. et al. (2004) y Barbaro et al. (2007) la comparación de muestras de tejido afectadas por la picadura de Dasyatis guttata (Dasyatidae) y Potamotrygon falkneri (Potamotrygonidae), demostraron que la necrosis de la piel observada en los animales de laboratorio, fue más intensa en los ratones inyectados con extractos derivados de rayas de agua dulce, que de rayas marinas, como ya se observó durante la asistencia a las víctimas de ambos tipos de rayas. Las observaciones basadas en más de 270 accidentes registrados a lo largo de los ríos de Brasil, muestran que cerca del 60% de las víctimas se encontraban caminando en el agua o capturando cebos para la pesca entre las macrófitas, o prestando servicios en los puertos cuando sufrieron la picadura. Más del 90% de los pacientes tenía picaduras en las extremidades inferiores y menos del 10% en las manos. El síntoma principal es el dolor intenso, el cual aparece inmediatamente después de la picadura y provoca cambios de conducta en los pacientes debido a su intensidad. Otros Sólo se detectaron actividades letales, dermonecróticas y miotóxicas en extractos tisulares de aguijones o espinas caudales de P. falkneri, mientras que la acción edematosa fue dependiente de la dosis y similar en ambos extractos. No se detectó presencia de acción coagulante, hemólisis directa o fosfolipasa A2. Ambos extractos mostraron actividades caseinolíticas, gelatinolíticas y fibrinogenolíticas que no fueron causadas por las metaloproteinasas. La actividad de la hialuronidasa se detectó en extractos de P. falkneri y se probó la presencia de reacción cruzada empleando 351 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA ENVENENAMIENTOS a. b. c. d. Figura 3. Necrosis en las extremidades inferiores de los pescadores aficionados y profesionales del norte y centro-oeste de Brasil. a-c) El envenenamiento por rayas de agua dulce tienden a causar necrosis de la piel; b, d) úlceras crónicas en la víctima. El patrón de las úlceras crónicas es como ondas “una piedra arrojada al agua” o “rebanadas”. Fotos: V. Haddad Jr. a. b. Figura 4. Pie de indígena Yekwuana con lesión causada por Potamotrygon schroederi. Fotografía tomada dos meses después del accidente. Río Caura, Venezuela. Foto: C. A. Lasso. 352 M. A. Morales-B. las técnicas ELISA y Western Blot en anticuerpos de conejo. Se observó acción nociceptiva en ambos extractos, dos veces mayor en P. falkneri respecto a D. guttata, lo que sugiere mayor toxicidad. Aunque las manifestaciones clínicas son claramente más intensas en los accidentes causados por rayas de agua dulce, la diferencia entre la actividad nociceptiva observada en ambos grupos sugiere la necesidad de profundizar en la investigación, ya que la termolabilidad de las toxinas que causan dolor, está estrechamente relacionada con las condiciones ambientales. El patrón de la úlcera resultante suele consistir en necrosis grandes, acompañadas de nuevas áreas circulares de necrosis radiando desde el punto central de la herida; semejantes a los círculos concéntricos (ondas) que se forman en el agua cuando se lanza una piedra o la superficie de una cebolla cortada longitudinalmente (Figura 3). Estas úlceras que se ven como “una piedra arrojada al agua” o “una cebolla en rodajas”, no aparecen en todos los accidentes, pero cuando está presente, ayudan al diagnóstico clínico. La curación de la úlcera se logra pasados varios meses de evolución pero suelen quedar grandes cicatrices en las áreas comprometidas. Los síntomas sistémicos observados suelen ser: fiebre, sudores fríos, náuseas, vómitos y agitación asociados al dolor y al estrés de las víctimas. Las manifestaciones agudas (dentro de las 24 horas) son extremadamente incapacitantes, lo que demuestra la gravedad de este tipo de envenenamiento desde el punto de vista de la salud en el trabajo. El periodo de curación de las úlceras fue de alrededor de tres meses, pero no fue posible evaluar la tasa de infección secundaria que sucede en el proceso. En Colombia estos envenenamientos son considerados como accidentes laborales que afectan no sólo a los trabajadores, sino a sus familias, a veces con consecuencias graves del tipo social y económico, por la incapacidad que estos generan (GómezC. 2011). Algunos autores mencionan que las reacciones frente a la picada de una raya no son siempre las mismas en diferentes individuos (López-Corcuera 1984), aunque si se puede hablar de un patrón más o menos generalizado como el descrito arriba. Para mayor detalle de las lesiones causadas por rayas y sus síntomas en Venezuela se recomienda ver a Dao (1965), López-Corcuera (op. cit), Machado-Allison y RodríguezAcosta (2005) y Rodríguez-Acosta (1997). En Colombia hay reportes de accidentes con Potamotrygon magdalenae. En 1993, en el Municipio de Puerto Berrío, se documentó un caso clínico que sucedió en el río Magdalena en un paciente de sexo masculino, pescador, lesionado en la región femoral que le ocasionó una fístula arterial (Restrepo y Girón 1993). Esta especie es una de las de mayor importancia clínica en el país, ya que es bastante frecuente en el río Magdalena y sus tributarios (GómezC. 2011), una de las regiones más pobladas del país y por ende con mayor probabilidad de accidentes. Tratamiento El tratamiento de las lesiones causadas por rayas de agua dulce incluye una gran variedad de remedios populares, caseros, supersticiones y leyendas. Estas datan incluso de la época colonial. Los españoles encontraban alivio aplicándose sobre la herida un trozo de queso caliente, pero esto no evitaba la formación de una úlcera; probablemente el alivio se producía por el calor que descomponía la toxina. Otros 353 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA ENVENENAMIENTOS tratamientos más brutales consistían en la aplicación de un hierro al rojo vivo (López-Corcuera 1984). También existían otros tratamientos más pintorescos como el descrito por el padre Gumilla quien así los describió: “… al primer chico que me trajeron herido, saqué una vena que hay en el centro de los ajos, que es la que pasa a retoño cuando nacen y la introduje por la herida de la púa; a corto espacio brotó de ella tal copia de sangre, que arrojó a la dicha vena o nervio del ajo; después de que paró la sangre, puse otro semejante y volvió al cabo del rato a salir sangre, pero en menor cantidad y reteniendo en mi casa al paciente, a los tres días ya estaba sano, sin habérsele inflamado la herida ni poco ni mucho; de modo que se infiere que lo cálido del ajo pone fluída la sangre coagulada con el frío del veneno, y se ve que con la misma sangre, sale el veneno que la púa había entremetido” (extraído de LópezCorcuera op. cit.). En la actualidad en el Llano venezolano se aplican toda clase de tratamientos caseros sobre la herida, como por ejemplo la gasolina, líquido de frenos, tabaco mascado (chimó) y arena entre otros (López-Corcuera 1984, Lasso 1985, Gutiérrez et al. 2004). Los indígenas de las costas del río Orinoco y Apure en Venezuela, suelen usar fomentos o cataplasmas calientes de ajo frito en aceite de Castilla, baños de agua caliente con sal y otros aplican localmente el casabe o la torta de yuca húmeda. También suelen tomar agua del río o laguna donde fueron picados por la raya (Dao 1965). En la Amazonia ecuatoriana los indígenas hacen las curaciones en base al conocimiento ancestral, que consiste en el uso del latex del árbol de higuerón (Pentagonia spathicalyx), especie que habita en las orillas de las lagunas y caños de las áreas de inundación. Los 354 indígenas y colonos calientan el látex que es vertido en la herida (de la Torre et al. 2008). También es usual que los nativos se apliquen agua caliente, higado de pescado e incluso gasolina entre otros productos. Los indígenas brasileños y los habitantes ribereños recomiendan la aplicación de orina humana en el punto afectado, el roce de los ojos de un bagre (probablemente algún Siluriforme de la familia Pimelodidae) o incluso –y muy común en el Araguaia, ríos Paraguay y sus afluentes-, el contacto de la zona afectada por la picadura con los genitales femeninos humanos (!), procedimiento que se considera infalible en la mitigación del dolor. Esta costumbre también es conocida en Venezuela, donde la creencia generalizada en el Llano es que la picadura de raya se alivia tomando el agua de un lavado vaginal de una mujer, que cuanto más vieja y fea sea y si además está menstruando, más efectivo será (LópezCorcuera 1984). Este brebaje es conocido popularmente como “carato de cuchara” (Lasso obs. pers.). Por supuesto, no todas las recomendaciones son aceptables desde el punto de vista de la ciencia. Castex (1965) en su comunicación sobre la “Enfermedad Paratrygónica”, presentado en el VIII Congreso Internacional de Medicina Interna en la Argentina, propuso medidas para el tratamiento del envenenamiento por raya. El objetivo inmediato debe ser el control del dolor y la prevención de la necrosis de la piel. Por lo tanto, el autor sugirió el lavado intensivo de la herida y la eliminación temprana de la zona afectada en un intento por eliminar el veneno. Propuso el uso de analgésicos locales (novocaína) u opiáceos sistémicos para controlar el dolor, antibióticos en la primera señal de infección y tiosulfato de sodio y gluconato de calcio por vía M. A. Morales-B. intravenosa para prevenir la cronicidad de la lesión. En el tratamiento de las lesiones crónicas, las medidas fueron el uso de corticosteroides y la limpieza de la úlcera con solución salina y peróxido de hidrógeno (Castex 1965). También mencionó la incapacidad temporal del paciente y la necesidad de permanecer en la cama durante 60 días. Esta incapacidad es absoluta los primeros quince días. No existe actualmente un protocolo para el cuidado de los pacientes que sean lesionados por rayas. Se recomienda la inmersión de la extremidad afectada en agua caliente -no hirviendo (aproximadamente 60 º C)- debido a las propiedades termolábiles de algunas toxinas de la rayas y a la vasodilatación causada por la temperatura caliente, pues el veneno promueve la vasoconstricción y la isquemia (Haddad Jr. et al. 2004, Garrone Neto y Haddad Jr. 2008). El dolor por lo general disminuye con esta medida. Otros procedimientos incluyen la exploración quirúrgica de los fragmentos, la limpieza intensiva de las heridas, la profilaxis contra el tétano, el uso de antibióticos y anestésicos en el área afectada y de analgésicos sistémicos, incluyendo los opioides en caso de dolor persistente tras las primeras dos horas. La escisión temprana de la zona afectada es recomendada por algunos autores, pero su aplicación no siempre es posible dada la dificultad de delimitar con precision la zona necrótica durante las primeras etapas de la enfermedad. Las complicaciones de la fase crónica se tratan con medidas empleadas en la curación de úlceras crónicas: reposo, lavado intenso con agua y jabón y antibióticos tópicos. El uso de corticoides es controvertido ya que estos fármacos pueden alargar el tiempo de curación de la úlcera. En Venezuela se ha recomendado que la cobertura antibiótica debe abarcar Staphylococus, Streptococus y gérmenes del agua, aunque también otros antibióticos recomendados incluyen quinolonas (ciprofloxacina, levofloxacina), doxicilina, trimetoprin-sulfametoxazol, cefurime y aminoglósidos (Machado-Allison y Rodríguez-Acosta 2005). La mayoría de los médicos recomiendan para el tratamiento antibiótico profiláctico un ciclo corto de 5 a 7 día por vía oral (Gutiérrez et al. 2004). El médico venezolano David MachadoAranda (1997) señala el siguiente tratamiento: 1) lavado de la herida con abundante agua y jabón; 2) ciclos alternados de calor y frío; 3) limpieza quirúrgica para retirar los pedazos de tejido glandular u óseo de la espina o aguijón de la raya, que haya podido quedar dentro de la herida; 4) cubrir la herida con cremas antisépticas; 5) antibioticoterapia de amplio espectro VO (beta-lactámico); 5) analgesia con diclofenaco sódico 100 mg VO TID, si es muy fuerte el dolor Meperidina o Nalbufina 1 ampolla IM. A continuación se narra una experiencia sobre la lesión ocasionada por Potamotrygon orbignyi, en uno de los investigadores colombianos que se encontraba en el río Orinoco durante una de las salidas de campo (enero 2013), recogiendo información bioecológica sobre las rayas para incluir en este libro: “Apenas ocurrió el accidente (22:00 horas aproximadamente) en la orilla del río, no apoye el pie e intenté mantener la calma (respirar pausada y profundamente). Se me extrajo uno de los aguijones o espinas caudales de la raya, que quedó clavada en el tobillo y luego me retiraron la bota de goma y la media. Inmediatamente después me sumergieron la herida en agua 355 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA ENVENENAMIENTOS caliente con sal, alterando con compresas con hielo y se limpió la herida con el material disponible del equipo de primeros auxilios (alcohol, Isodine y agua oxigenada) (Figura 5a). La persona que estaba haciendo los primeros auxilios hizó presión sobre las dos heridas (la raya clavó los dos aguijones o espinas caudales), para que se saliera la toxina; al principio salía sangre un poco diluída con un fluído algo espeso y transparente. Para el dolor tomé dos analgésicos (Ibuprofeno 800 mg). Además del dolor intenso sentía “calambres” en los músculos. El dolor y estos “calambres” se extendían desde el tobillo donde fue la herida, hasta la cintura. Esa noche dormí con el pie levantado sobre una almohada. Al otro día, amanecí con el pie hinchado y con un gran morado (edema) alrededor de la herida. Nos fuimos a Puerto Carreño y por recomendaciones de los lugareños, pues apenas llegue al puerto todos identificaron que me había picado una raya y me contaron sus experiencias -con lo cual quedamos muy sorprendidos puesto una gran cantidad de personas habían sido picadas y no sólo una vez sino hasta seis veces tanto hombres como mujeres-, me fui a que me tratara un curandero el cual me rezó. Ese mismo curandero me recomendó ir al centro médico para que me recetaran un antibiótico, el cual tomé por siete días, el médico de guardia no tenía experiencia en este tipo de lesiones y ese fue su primer caso (p. e. no recetó el tratamiento para la profiláxis del tétano). Al tercer día del accidente viajé a Bogotá (Figura 5b), quedé en incapacidad (no podía caminar) y estuve curando la herida diariamente (desinfección con agua oxigenada y rifocina), tratándola con desinflamantes naturales como la caléndula (sumergía el pie en agua caliente con flores de caléndula) y mantenía la herida sin cubrir para que secara. Sin embargo, tuve que cubrir con medias 356 gruesas el resto del pie puesto que permanecía muy frío continuamente. Todo parecía transcurir de manera normal, pero a los diez días empecé a notar que la herida se estaba necrosando, por lo que fui a un centro de atención (Figura 5c). El médico que me atendió, afortunadamente tenía experiencia con este tipo de lesiones (aprendidas en la cuenca del Magdalena) y me dijo que era indispensable que me hubieran colocado una inyección para el tétano apenas había ocurrido el accidente. Finalmente retiró el tejido necrosado, limpió la herida (Figura 5d), y volvió a recetar el mismo antibiótico por otros siete días. Estuve bajo control clínico durante los cuatro días siguientes. Después de dos meses afortunadamente me recuperé (puesto que la información que encontraba al respecto no era nada alentadora, hasta seis meses de incapacidad) (Figura 5e) y volví a campo a seguir con el trabajo (Figura 5f)”. Como puede evidenciarse, no existe un tratamiento definitivo y realmente eficaz para las lesiones producidas por las rayas. La única forma de neutralizar las consecuencias de los accidentes es inactivando las toxinas del veneno, para lo cual sería necesario producir un suero. Se sabe que el envenenamiento es severo, incapacitante y potencialmente fatal si se infecta la lesión. Dao (1965) señala la muerte de pacientes lesionados por rayas en los Llanos venezolanos, que no recibieron el tratamiento antitetánico y cuyas heridas se infectaron. Sin embargo, aún no hay “justificación estadística” para la producción del antídoto, debido al bajo número de lesiones o casos reportados. A pesar de esto, hay que tener en cuenta, que la producción del suero tendría más validez y sería un objetivo a cumplir a corto plazo, si se considerara realmente la gravedad de los síntomas y M. A. Morales-B. a. b. c. d. e. f. Figura 5. Lesión de raya de agua dulce (Potamotrygon orbignyi) en el río Orinoco, Colombia. a) Día del accidente , se observan las dos marcas de las dos espinas caudales; b) al tercer día; c) día diez: se observa necrosis; d) día 11: herida después de la limpieza en el centro clínico, e) día 17; f) herida ya curada a los diez meses. Fotos: C. A. Lasso (a-d), M. A. Morales-Betancourt (e-f). 357 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA ENVENENAMIENTOS padecimientos de las víctimas, reconociendo que los accidentes por esta causa siguen teniendo lugar en muchos lugares a pesar de la ausencia de reportes clínicos por ocurrir estos en áreas remotas, lo que conduce a una subestimación importante de esta dolencia. Prevención Las lesiones causadas por rayas, así como por otros animales venenosos pueden minimizarse mediante la implementación de programas educativos en las poblaciones en riesgo. Poner a disposición de estas poblaciones humanas material informativo, carteles, señales de advertencia, ofrecer charlas y talleres en sus localidades e información sobre el tema a través de los medios de comunicación, son medidas que pueden prevenir o reducir el número de accidentes por picadura de rayas de agua dulce en Brasil y otros lugares de América del Sur. El trabajo de Haddad Jr. et al. (2012) en Pontal do Paranapanema del estado de Sao Paulo, es un buen precedente y ejemplo informativo en este sentido. Las rayas de la familia Potamotrygonidae son de hábitos predominantemente bentónicos y su camuflaje a menudo las hace invisibles, especialmente cuando el agua es turbia, además de que suelen enterrarse. Por lo tanto, la recomendación para aquellos que deban caminar en aguas habitadas por rayas, es que arrastren los pies o usen un palo o paleta para tantear el sustrato delante de ellos y alejar a cualquier animal que pueda estar en el fondo. En situaciones en las que es necesario manipular rayas, por ejemplo cuando son capturadas con ganchos o redes de pesca, se recomienda inmovilizar la cola a nivel de las espinas antes de cualquier otro contacto. Para ello, se pueden emplear alicates, trozos de madera, cajas de pesca u 358 objetos similares, teniendo cuidado de no dañar al animal. No se recomienda pisar sus colas, incluso si se está protegido con botas de goma. Está demostrado por la experiencia narrada más arriba, relativa al accidente en Colombia, que esta protección no es ninguna garantía, aunque es posible que haya minimizado el efecto al actuar como una barrera al momento de recibir el impacto de la espina. Los buzos y buceadores también deben ser precavidos al nadar cerca del fondo y de las plantas acuáticas sumergidas, pues son lugares de refugio y alimentación de las rayas, las cuales en caso de contacto accidental, pueden reaccionar con hostilidad. Al respecto, Machado-Allison y Rodríguez-Acosta (2005) señalan la existencia de accidentes con consecuencias fatales, en buceadores que nadando o fondeando encima de una raya, recibieron el latigazo de cola, siendo clavada la espina caudal en la región torácica. Es muy importante destacar, que a diferencia del resto de animales venenosos como serpientes, escorpiones y arañas, que utilizan el apéndice o aparato venenoso para capturar las presas, en las rayas este aparato ha sido heredado ancestralmente como un mecanismo para ahuyentar a los depredadores y no para capturar a sus presas. Este hecho refuerza el concepto de que las rayas no son animales que atacan a los humanos, sino por el contrario, usan sus aguijones, púas o espinas caudales, cuando se sienten vulnerables, es decir, sólo para su defensa. Conclusiones Las rayas son peces venenosos que pueden generar envenenamientos y lesiones severas en muchas comunidades de pescadores, bañistas y pobladores locales de los ríos suramericanos. Las lesiones causan M. A. Morales-B. un dolor local intenso y necrosis cutánea, que puede complicarse por infecciones secundarias y por la retención de fragmentos de la espina caudal en la herida. El envenenamiento ha sido poco estudiado, una vez que las victimas suelen vivir en poblaciones lejanas y remotas, que se tratan con medidas populares y que no se registran en las estadisticas clínicas, aunque los cuestionarios respondidos por pescadores y poblaciones ribereñas, indican hasta un 25% de víctimas entre ellos. El tratamiento actual se basa sólo en medidas sintomáticas -como el empleo de agua caliente para el control del dolor-, mientras que las medidas preventivas son prácticamente inexistentes. • El conocimiento adquirido y resumido en este capítulo, podría ser una herramienta de difusión y aplicación en muchas comunidades, ya que se trata del accidente más grave con peces en los ambientes acuáticos continentales de Suramérica y representa un problema global de salud pública hasta ahora desatendido. • Bibliografía • • • • • • Almeida, V. y C. Rocha. 1989. Registro dos acidentes com peixes peçonhentos e/ou venenosos. Revista da Sociedade Brasileira de Toxicologia 2(1): 49–51. Bates, H. W. 1944. O naturalista no rio Amazonas. São Paulo. Cia. Editora Nacional. 398 pp. Barbaro, K. C., M. S. Lira, M. B. Malta, S. L. Soares, D. Garrone Neto, J. L. C. Cardoso, M. L. Santoro y V. Haddad Jr. 2007. Comparative study on extracts from the tissue covering the stingers of freshwater (Potamotrygon falkneri) and marine (Dasyatis guttata) stingrays. Toxicon 50: 676–687. Castex, M. N. y F. Loza. 1964. Etiologia de la Enfermedad Paratrygónica: estudo anatómico, histológico y funcional del aparato agressor de la raya fluvial americana. Revista Asociación Médica Argentina 78: 314–324. • • • • • • • • Castex, M. N, E. Pedace, I. Maciel, J. Meyer, M. Murphy y G. Remonda. 1964. La enfermedad paratrygónica. Notas bibliográficas y estudio clínicoexperimental. Prensa Medica Argentina 51: 217–222. Castex, M. N. 1965. Clínica e Terapeutica de la Enfermedad Paratrygónica. Revista Asociación Médica Argentina 79: 547–556. de Magalhães, J.V.C. 1934. Viagem ao Araguaya. São Paulo: Cia. Editora Nacional. 150 pp. Dao, L. 1965. Lesiones producidas por las rayas Potamotrygonidae en rios de Venezuela. Dermatología Internationalis, octubre-diciembre: 219-224. de la Torre, L., H. D. Alarcon, L. P. Kvist y J. Salazar-Lecaro. 2008. Usos medicinales de las plantas. Enciclopedia de las Plantas Útiles del Ecuador. Herbario QCA & Hervario AAU. Quito & Aarhus 2008: 105-114. Garrone Neto, D, R. C. Cordeiro, V. Haddad Jr. 2005. Acidentes do trabalho em pescadores artesanais da região do Médio Rio Araguaia, TO, Brasil. Cadernos de Saúde Pública 21(3): 795–803. Garrone Neto, D y V Haddad Jr. 2003. Acidentes por raias. Pp: 295–305. En: J. L.C. Cardoso et al. 2ª ed. Animais peçonhentos do Brasil: biologia, clínica e terapêutica dos acidentes. São Paulo: Sarvier. Garrone Neto, D y V. Haddad Jr. 2010. Arraias em rios da região Sudeste do Brasil: locais de ocorrência e impactos sobre a população. Revista Sociedade Brasileira de Medicina Tropical 43(1): 82–88. Gómez-C., J. P. 2011. Accidentes por animales ponzoñosos y venenosos: su impacto en la salud ocupacional en Colombia. Revista Facultad Nacional de Salud Pública 29 (4): 419 – 431. Gumilla, J. 1963. El Orinoco Ilustrado y Defendido. Biblioteca de la Academia Nacional de la Historia. Caracas. Gutiérrez, J., I. Benítez-Guerra y G. Benítez-Guerra. 2004. Envenenamiento por rayas de agua dulce. Revista de la Facultad de Medicina 7 (2): 1-8. Haddad Jr, V. 2008. Animais Aquáticos Potencialmente Perigosos do Brasil: guia médico e biológico. São Paulo: Editora Roca. 359 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA LESIONES • • • • • • 360 Haddad Jr., V., D. Garrone Neto, J. B. P. Neto, F. P. L. Marques y K. C. Barbaro. 2004. Freshwater stingrays: study of epidemiologic, clinic and therapeutic aspects based on 84 envenomings in humans and some enzymatic activities of the venom. Toxicon 48: 287–294. Haddad Jr., V., E. L. Favero Junior, F. A. Horácio Ribeiro. B. da Costa Ancheschi, G. I. Pereira de Castro, R. Costa Martins, G. Borghini Pazuelo, J. R. Fujii, R. Brum Vieira y D. Garrone Neto. 2012. Trauma and envenoming caused by stingrays and other fish in a fishing community in Pontal do Paranapanema, State of Sao Paulo, Brazil: epidemiology, clinical aspects, and therapeutic and preventive measures. Revista da Sociedade Brasileira de Medicina Tropical 45 (2): 238-242. Lasso, C. A. 1985. Las rayas de agua dulce. Natura 77: 6 – 9. Lisboa, F. C. 2000. História dos animais e árvores do Maranhão. 2ª ed. Lisboa: Instituto de Investigação Tropical. López-Corcuera, G. 1984. Fauna Legendaria. Rayas, tembladores, caimanes y culebras de água. Colección Fauna de Los Llanos de Venezuela. Fundación Científica Fluvial de Los Llanos. Editorial Arte. Caracas. 131 pp. Machado-Aranda, D. 1997. Guías de diagnóstico y tratamientos mas comúnes. Raya de rio o de mar. Familias Potamotrygonidae y otras. Pp. 104. En: Machado-Allison, • • • • • • • • A. y A. Rodríguez-Acosta. 1997. Animales venenosos y ponzoñosos de Venezuela. Primera edición. CDCH, Universidad Central de Venezuela. Machado-Allison, A. y A. Rodríguez-Acosta. 2005. Animales venenosos y ponzoñosos de Venezuela. Segunda edición. CDCH, Universidad Central de Venezuela. 122 pp. Mello-Leitão, A. C. G. 1948. Animais peçonhentos. Rio de Janeiro: Ministério da Agricultura. Nomura, H. 1996. Usos, crendices e lendas sobre peixes. Mossoró: ETFRN/UNED. Pardal, P. P. O. 2003. Ictismo por Arraia. Pp: 279–285. En: Cardoso, J. L. C. et al. 2ª ed. Animais peçonhentos do Brasil: biologia, clínica e terapêutica dos acidentes. Edited by São Paulo: Sarvier. Restrepo, E. y R. Girón. 1993. Fisura arterio-venosa secundaria a picadura de raya de río. IATREIA 6 (3): 163 – 165. Rodríguez-Acosta, A. 1997. Análisis clinico y epidemiológico de accidentes por rayas de río (Potamotrygonidae). Archivos Venezolanos de Medicina Tropical 1997 (1): 64-66. Rosa, R. S. 1985. A systematic revision of the South American freshwater stingrays (Chondrichthyes: Potamotrygonidae). PhD (Thesis) – College of William and Mary, Williamsburg. Vellard, J. 1931. Venin des rais (Taeniura) du Rio Araguaya (Brésil). Comp .Rend. Acad. Sci. 192: 1279–1281. Lagunas de aguas negras en el río Aguarico, Ecuador. Foto: F. Trujillo Parque Wisirare, Casanare. Foto: M. A. Morales-Betancourt M. Sabaj 9. Conclusiones y recomendaciones para la conservación Carlos A. Lasso y Mónica A. Morales-Betancourt • • • Las rayas de agua dulce (Potamotrygonidae) constituyen un grupo muy complejo desde el punto de vista taxonómico, con unas 25 especies conocidas. No obstante, estudios que se desarrollan en la actualidad muestran que todavía hay una diversidad desconocida en el grupo, con especies aún por describir de los géneros Heliotrygon, Paratrygon y Potamotrygon, especialmente en las cuencas de Brasil, Colombia, Perú y Venezuela. Varios factores explican este desconocimiento, entre los que se destacan la pobreza o falta de detalle de las descripciones originales; variabilidad intraespecífica en los patrones de coloración (principal carácter utilizado en la identificación del grupo); posible existencia de híbridos en el medio natural y por último, poca representatividad en los museos y colecciones ictiológicas, así como grandes vacíos espaciales de colección. Las rayas de agua dulce tienen un origen marino y hay diferentes hipótesis (biogeografía descriptiva, filogenia y • • • biogeografía histórica, para explicar este fenómeno evolutivo. Están restringidas al Neotrópico, en todos los países de América del Sur, excepto Chile. Brasil es el país con la mayor riqueza (17 sp.), seguido de Colombia (11 sp.), Perú (10 sp.), Venezuela y Argentina (5 sp. c/u), Ecuador y Paraguay (4 sp. c/u), Uruguay (3 sp.) y finalmente Bolivia y las Guayanas (Guyana, Surinam y Guayana Francesa), con dos especies cada uno. Adicional a los métodos tradicionales de captura y colección de ejemplares en campo, existen algunos métodos no letales muy efectivos para el registro de datos. Estos incluyen observaciones y censos subacuáticos mediante buceo a pulmón libre, marcación tradicional y biotelemetría. En cuanto a la información biológicopesquera de las especies de rayas, hay muchas diferencias en cuanto al nivel de conocimiento por especie y por país. Los estudios más completos están centrados en unas pocas especies 363 RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA CONCLUSIONES Y RECOMENDACIONES • • • 364 (p. e. Paratrygon aiereba, Potamotrygon magdalenae, Potamotrygon motoro y Potamotrygon orbignyi) y los países con mayor desarrollo investigativo son Brasil y Colombia. La citogenética y su relación con la sistemática son herramientas de gran utilidad para la identificación de las especies, conocer su filogenia y entender su distribución actual, así como aplicar sus resultados directamente a la conservación in situ. Los resultados de los trabajos aquí presentados ya aportan soluciones a los tomadores de decisiones (autoridades pesqueras y ambientales). Todos los países considerados en este estudio tienen legislaciones de tipo ambiental y pesquero para el tema de los peces ornamentales, en ocasiones normativas específicas (cuotas, tallas, etc.) para las rayas de agua dulce. Se presenta un análisis detallado para Colombia, Venezuela, Ecuador, Perú y Brasil. No se obtuvo información para las tres Guayanas. Además de su importancia como recurso ornamental especialmente en países como Colombia, Perú y Brasil, las rayas de agua dulce son de interés como pesca comercial (alimento) en Brasil y Venezuela, donde ya hay pesquerías artesanales e incluso comerciales, desarrolladas. En toda su área de distribución también son im- • • • portantes en la pesca de subsistencia, en particular en áreas remotas y comunidades indígenas. Aunado a lo anterior, también tienen un impacto crucial en la salud pública por los envenenamientos y lesiones que éstas especies pueden causar en los pescadores artesanales, población indígena y rural, pescadores deportivos y turistas. Su incidencia no ha sido debidamente evaluada dado que dichos accidentes no siempre son registrados en las estadísticas oficiales. Tampoco hay un tratamiento específico realmente efectivo para estos accidentes, aunque si ciertas recomendaciones. Se requieren estudios más detallados en todas las especies y todos los países. Estos incluyen temas básicos como su taxonomía -vista desde los enfoques tradicionales y de la sistemática molecular-, distribución geográfica e historia natural (talla, peso, alimentación, reproducción, etc.). Por último, la asignación de cuotas de exportación deben estar basada en criterios biológico-pesqueros adecuados. También deben existir acuerdos locales e internacionales de pesca, reservas de pesca, planes de acción, etc. De igual forma son necesarios los estudios de zoocría en cautiverio y por supuesto, toda la parte biomédica. Caño Dagua. Foto: M. A. Morales-Betancourt RAYAS DE AGUA DULCE (POTAMOTRYGONIDAE) DE SURAMÉRICA ANOTACIONES DE CAMPO 366 M. A. Morales-B. 367