FÍSICA NUCLEAR
Anuncio

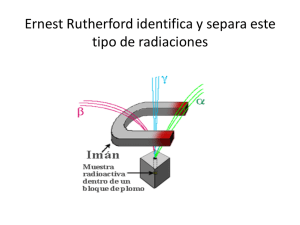
ELEMENTOS BÁSICOS DE FÍSICA NUCLEAR FELIPE MORENO ROMERO LCDO. CIENCIAS QUÍMICAS (JUNIO, 2007) Contenidos: 1.- Composición del núcleo. Isótopos. 2.- Estabilidad de los núcleos. Energía de enlace. 3.- Radiactividad. 4.- Reacciones nucleares. ۞۞۞۞ El inicio de la física nuclear se puede establecer en 1896 con el descubrimiento de la radiactividad por parte de Henri Becquerel. Becquerel estudiaba por entonces la luz emitida por algunas sustancias, llamada fluorescencia. Una de estas sustancias fluorescentes es el sulfato de potasio y uranilo: UO2KSO4. La fluorescencia es la propiedad de una sustancia para emitir luz cuando es expuesta a radiaciones del tipo ultravioleta, rayos catódicos o rayos X. Las radiaciones absorbidas (invisibles al ojo humano), son transformadas en luz visible, o sea, de una longitud de onda mayor a la incidente. Un día que estaba nublado no permitía a Becquerel exponer el sulfato de potasio y uranilo a las radiaciones del Sol así que las guardó en un cajón en el que también tenía unas placas fotográficas sin velar (protegidas con un grueso papel negro para que no se velaran al darles la luz). Días más tarde comprobó que la película fotográfica de estas placas estaba velada cuando “en teoría” no había sido expuesta a ningún tipo de luz. Becquerel pensó que la sal de uranilo emitía algún tipo de radiación invisible capaz de velar la placa fotográfica. A partir de este descubrimiento casual comprobó que otros compuestos de uranio también velaban las placas fotográficas, llamando a esa radiación invisible radiactividad. -1- Dos años más tarde Pierre y Marie Curie descubrieron otros dos elementos nuevos en la tabla periódica, el polonio y el radio, ambos radiactivos. La física nuclear estudia el comportamiento de los núcleos atómicos. 1.- Composición del núcleo. Isótopos El átomo es básicamente vacío tal como descubrió E. Rutherford en 1911 a partir de su famosa experiencia (esquematizada en la figura adjunta). El polonio es una fuente radiactiva de partículas α (partículas cargadas positivamente).El haz de partículas se hace incidir sobre una fina lámina de oro de forma que se observa que la mayoría de ellas atraviesa dicha lámina y son detectadas en una pantalla de sulfuro de zinc en forma de un centelleo en el momento en que una partícula incide sobre dicha pantalla. No obstante Rutherford observó que algunas partículas eran desviadas y que incluso algunas salían rebotadas de la lámina de oro. A partir de esta experiencia Rutherford estableció junto a sus colaboradores (Geiger y Mariden) su conocido modelo atómico. Este modelo permitía explicar los resultados del experimento tal como se muestra en la figura adjunta. Las flechas negras indican la trayectoria de las partículas α: el primer caso se trataría del modelo atómico anterior de Thomson, el segundo caso es el modelo de Rutherford. Actualmente sabemos que el núcleo atómico contiene dos tipos de partículas, los protones (de carga positiva e igual en valor, cada uno, a la carga elemental del electrón) y los neutrones, sin carga y de masa aproximadamente igual a la de los protones aunque un poco superior. Los neutrones no fueron descubiertos realmente hasta 1932 aunque su existencia se sospechaba con anterioridad. Las características básicas de las tres partículas atómicas fundamentales son: Partícula Masa (kg) Masa (u.m.a.) Carga (C) Ubicación Protón 1’6726 · 10-27 1’0073 1’6 · 10-19 Núcleo Neutrón 1’675 · 10-27 1’0087 0 Núcleo Electrón 9’1 · 10-31 0’00055 1’6 · 10-19 Corteza -2- Conceptos necesarios La masa del electrón es 1836 veces menor a la del protón. En general se llaman nucleones a las partículas que hay en el núcleo (protones o neutrones), y núclido a cada especie nuclear de un elemento químico. El número atómico (Z) es el número de protones que hay en el núcleo, coincide con el número de electrones de la periferia para el átomo neutro y es el que define al elemento químico como tal. A la suma del número de protones (Z) y del número de neutrones (N) de un núcleo se le llama número másico (A): A=Z+N Para simbolizar un átomo, por ejemplo el elemento general X, se sigue el siguiente criterio en cuanto a la disposición de estos números: A Z por ejemplo: 37 Li, Li , 7 3 1 1 H, 13 6 C, X C arg a 235 92 U . Normalmente el número atómico se suele obviar. Isótopos son átomos de un mismo elemento que tienen distinto número de neutrones. Los más “famosos” entre ellos tienen nombre específico: son los isótopos del hidrógeno, 1 1 H Hidrógeno (un único protón y un electrón) 2 1 H Deuterio (también “D”) 3 1 H Tritio (también “T”) Los demás isótopos no tienen un nombre establecido. Para nombrarlos se hace mención al número másico correspondiente. Por ejemplo, el carbono tiene tres isótopos, el carbono-12, el carbono-13 y el carbono-14, éste último radiactivo: 12 6 C, 13 6 C, 14 6 C Proporciones isotópicas en la naturaleza En una sustancia pura hay siempre varios isótopos (la mayoría estables y, en algunos casos, alguno radiactivo). Por ejemplo, si tenemos un kilogramo del elemento cloro sabemos que estará formado por átomos de dicho elemento del que existen dos isótopos: el cloro-35 y el cloro-37. La proporción de cada uno determina el peso atómico que aparece en la tabla periódica ya que este es en realidad el peso atómico medio de los diferentes isótopos naturales que lo forman. Si el 50% de todo el cloro fuera cloro-35 y el otro 50% fuera cloro-37, el peso atómico del cloro sería 36 u.m.a., pero resulta que es en realidad 35’45 u.m.a., es decir, hay una mayoría de cloro-35 frente a cloro-37. Para conocer dicha proporción exacta debemos resolver la ecuación: 35x 37(1 x) 35'45 donde x es el tanto por uno de cloro-35 y 1-x es el tanto por uno de cloro 37. Si resolvemos obtendremos que x = 0’754, es decir, hay un 75’4% de cloro-35 y un 24’6% de cloro-37. -3- Este procedimiento de cálculo es similar para otros elementos aunque se complicará un poco la ecuación si en la naturaleza son posibles más de dos isótopos para un elemento. Habría que recurrir a sistemas de ecuaciones. Unidad de masa atómica Se ha utilizado ya en estos apuntes la unidad de masa atómica, u.m.a. o simplemente “u”, para designar la masa de un átomo. Dado que la masa de los electrones es despreciable, la masa de un átomo es en realidad la masa de su núcleo. Pero como esta masa en kilogramos es muy pequeña, se utiliza la u.m.a. Actualmente (no siempre ha sido así) se ha consensuado que la unidad e masa atómica sea la doceava parte de la masa del isótopo carbono-12. En base a esta unidad decidida están expresados lo pesos atómicos que aparecen en la tabla periódica (mejor debería ser “masas atómicas” aunque en estos apuntes se utilizarán los dos nombres indistintamente). Problema: Calcular la energía que corresponde a 1 u. Solución: Si buscamos la masa atómica del carbono vemos que es de 12 u, es decir, 12 gramos de carbono-12 contienen 6’023 · 1023 átomos del elemento (nº de Avogadro). Con un simple cálculo podemos conocer la masa de un átomo de carbono-12: 12 1'99 ·10 23 g 1'99 ·10 26 kg 23 6'023 ·10 1 u.m.a es la doceava parte de esta masa, es decir: 1’66 · 10-27 kg. La energía que corresponde a esta masa se puede conocer con la ecuación de Einstein: E mc2 1'66 ·10-27 · (3 ·108 ) 2 1'49 ·10-10 J 9'34 ·108 eV 934 MeV El equivalente energético de la unidad de masa atómica calculado más exactamente 1 es de 931 MeV 2.- Estabilidad de los núcleos. Energía de enlace. El tamaño de un núcleo atómico obedece aproximadamente la siguiente expresión: R 1'2 ·1015· A1/ 3 por ejemplo, para el carbono-12: R 1'2·1015·3 12 2'7·1015 m 1 1 u · c2 = (1.66054 × 10-27 kg) × (2.99792 × 108 m/s)2 = 1.49242 × 10-10 kg (m/s)2 = 1.49242 × 10-10 J × (1 MeV / 1.60218 × 10-13 J) = 931.49 MeV, -4- Si suponemos que el núcleo es esférico, podemos determinar la densidad del mismo: d m 12 ·1'66 ·10 27 2'29·1017 kg / m3 4 V R 3 3 Un valor bastante elevado por cierto. ¿Cómo pueden permanecer juntos los protones en el núcleo si éstos se repelen eléctricamente y más aún cuando la distancia entre dos protones es tan “grande” como 10-15 m (= 1 fermi). Si quisiéramos determinar el valor de la fuerza de repulsión eléctrica según la ley de Coulomb veríamos que FK -19 2 q1q2 ) 9 (1'6 ·10 9 · 10 230 N 2 15 2 d (10 ) esta fuerza provocaría una aceleración en el protón de a F 230 1'37 ·1039 m / s 2 -27 m 1'673 ·10 es decir, una exageración. Debe existir una fuerza que a nivel nuclear sea más intensa que la repulsión eléctrica entre los protones y que sea la responsable de que los protones se mantengan unidos en el núcleo. Esta interacción se llama nuclear fuerte y es también responsable de que los neutrones (partículas sin carga y, por tanto, sin necesidad de estar en el núcleo pues la fuerza gravitatoria es mínima) permanezcan también fuertemente ligadas en el núcleo. Cuatro características básicas que resumen la interacción nuclear fuerte son: - Sólo se manifiesta en el interior del núcleo, es decir su alcance es de un fermi. - Es la más intensa de todas las interacciones conocidas (gravitatoria, electromagnética y nuclear débil de la que se hablará más adelante). Concretamente es 100 veces superior a la electromagnética que es la segunda interacción más intensa. - Sólo se manifiesta entre dos protones, entre dos neutrones o entre un protón y un neutrón. - Es de carácter atractivo. Defecto de masa Cuando nos planteamos la cuestión de pesar un núcleo atómico tenemos dos opciones: 1ª) Cálculo teórico: determino el número de protones que tiene y lo multiplico por la masa del protón. Determino el número de neutrones que tiene y lo multiplico por la masa del neutrón. Finalmente sumo las dos cantidades obtenidas. 2ª) Determinación experimental: utilizando un espectrómetro de masas (ver apéndice). El valor obtenido experimentalmente es siempre menor al obtenido de forma teórica. De hecho, si ocurriera al revés el núcleo no sería estable, no existiría. A este defecto entre la masa -5- calculada de forma teórica y la masa determinada experimentalmente se le denomina defecto de masa y se puede determinar (en u.m.a.) según la siguiente expresión: m Zmp ( A Z )mn M donde Z es el número atómico, mp es la masa del protón, A-Z es el número de neutrones, mn es la masa del neutrón y M es la masa del núcleo determinada experimentalmente. Este defecto de masa equivale a energía: E mc2 que se denomina energía de enlace del núcleo. Es la energía que se libera cuando los nucleones constituyentes del núcleo se unen (desde el infinito) para formar el núcleo o, también, la energía necesaria para romper el núcleo totalmente. Las energías de enlace de los núcleos son enormes, oscilan entre 2’2 MeV para el deuterio 2 1 ( H ) y 1640 MeV para el isótopo 209 83 Bi . Tengamos en cuenta que un kilogramo de gasolina tiene una energía interna de 4’6 · 104 kJ y que un kilogramo de núcleos, por término medio, desprenden al formarse 1012 kJ, es decir, unas veinte millones de veces más energía. Todos sabemos lo que se puede hacer con un kilo de gasolina. En lugar de energía de enlace del núcleo se suele hablar de energía de enlace por nucleón, que se obtiene de dividir la primera entre el número de nucleones que tiene el núcleo considerado. La gráfica siguiente representa cómo varía esta energía de enlace por nucleón (ΔE/A) con respecto al número másico (A) para los diferentes isótopos conocidos. Se puede observar que cuanto mayor es la energía de enlace por nucleón más estable es el núcleo, no obstante a partir del hierro esta energía empieza a disminuir paulatinamente. El núcleo más estable es el hierro-56. al que corresponde una energía de enlace de 8’8 MeV/nucleón. Las mayores energías de enlace por nucleón se presentan para números másicos comprendidos entre 40 y 100 aproximadamente. Si un núcleo pesado se divide en dos núcleos más ligeros (fisión nuclear), o si dos núcleos ligeros se unen para formar uno más pesado (fusión nuclear), se obtienen núcleos más estables, es decir, con mayor energía de enlace por nucleón entre los productos de la reacción nuclear que la que tenían el o los núcleos de partida. Problema: Determina el defecto de masa, la energía de enlace y la energía de enlace por nucleón para el núcleo de carbono-12. Solución: -6- El defecto de masa de un núcleo es la diferencia entre la masa de sus constituyentes y la masa real del núcleo. Como el número atómico del carbono es Z=6, su núcleo está formado por seis protones y seis neutrones. La masa total de estas partículas es la siguiente: Masa de 6 protones = 6 · 1’0073 u = 6’0438 u Masa de 6 neutrones = 6 · 1’0087 u = 6’0522 u Masa total . . . . . . . . . . . . . . . . . . . . . . . 12’0960 u Masa del núcleo de carbono-12 = 12’0000 u Defecto de masa . . . . . . . . . . . . . . . . . . 0’0960 u Como 1 u equivale a 931 MeV, la energía de enlace será: E = 0’096 u · 931 MeV/u = 89’4 MeV El núcleo de carbono-12 está formado por 12 nucleones, en consecuencia, la energía de enlace por nucleón es: E 89'4 MeV 7'4 MeV / nucleón A 12 nucleones 3.- Radiactividad. Todos los núcleos atómicos son susceptibles de desintegrarse más o menos lentamente. El núcleo de hierro-56 que es el más estable también se puede desintegrar aunque lo hace muy, muy lentamente. De todos los isótopos conocidos se dice que son estables aquellos que no se desintegran o permanecen sin desintegrarse durante muchos miles de años. Los núcleos inestables se desintegran convirtiéndose en otros núcleos que pueden ser a su vez estables o no. Desde que se formó la Tierra han desaparecido muchos núcleos inestables que se han transformado en otros estables: son los más rápidos en desintegrarse, pero aún quedan núcleos que se están desintegrando. A estos elementos que todavía quedan, inestables, se les llama elementos radiactivos naturales. También se han sintetizado en laboratorio o en centrales nucleares elementos inestables, llamados radiactivos artificiales. El primer elemento radiactivo natural encontrado fue el uranio por Henri Becquerel en 1896. Dos años más tarde los esposos Curie descubrieron el radio y el polonio. Se llaman elementos radiactivos porque en un primer momento se creía que emitían rayos cuya naturaleza no se conocía, pero que eran capaces de velar placas fotográficas. Este nombre ha permanecido aunque posteriormente se ha comprobado que la “radiación” que emiten son en realidad partículas en su mayor parte. En la radiactividad natural se pueden encontrar tres tipos diferentes de emisiones radiactivas (también tres tipos de radiaciones): Radiación α: Consiste en la emisión por parte del núcleo inestable de una partícula α, es decir de un núcleo de helio-4: -7- partícula 24He2 Esta partícula suele ser emitida por núcleos grandes (uranio, torio, radio, plutonio….). La explicación de esta emisión es la siguiente: en los núcleos pequeños se observa que el número de protones es aproximadamente igual al número de neutrones, pero en núcleos mayores (estables) el número de neutrones es mayor al de protones para compensar la repulsión electrostática creciente debido al aumento de cargas positivas en el núcleo. En la gráfica adjunta se han representado el número de neutrones de los núcleos estables frente al número de protones de los mismos. Se puede observar que la igualdad entre el número de protones y neutrones en un núcleo atómico estable se mantiene para números atómicos inferiores a 30 y a partir de entonces se desvía de esa tendencia cada vez más. Cuando los núcleos son muy grandes llega un momento en que el exceso de protones es grande, las repulsiones eléctricas entre ellos son tan grandes que ya ni un exceso de neutrones puede compensar y el núcleo “simplemente se deshace de 2 protones y dos neutrones” emitiéndolos en forma de partícula α. Por ejemplo, el radio descubierto por el matrimonio Curie contiene un isótopo, el radio-226, que es un emisor α según la siguiente reacción: 226 88 Ra He2 Rn 222 86 4 2 vemos que la el radio, al perder dos electrones pasa a tener número atómico 86, es decir, pasa a ser radón. Como también se han perdido dos neutrones el número másico se ha reducido en 4 unidades, se trata del isótopo radón-222. Se observa en la reacción anterior, que podemos llamar reacción nuclear, se debe conservar en todo momento la carga total (protones) y el número de nucleones. El descubrimiento en 1913 de las leyes que regulan el desplazamiento en las transformaciones radiactivas se debe a K. Fajans y a R. Soddy y llevan el nombre de leyes de Fajans-Soddy. Para el caso de la emisión α hemos visto que cuando un núcleo emite una partícula α, el nuevo núcleo disminuye en 4 unidades sus nucleones y en dos unidades sus protones. En general: A Z X A- 4 Z-2 Y He2 4 2 La partícula α es relativamente pesada y su carga eléctrica (2+) la hace interaccionar rápidamente con el entorno; ello hace que sea emitida a velocidades no muy altas. La partícula α tiene un poder de penetración muy pequeño, siendo detenida por una lámina de cartón o unos pocos centímetros de aire. No es capaz de atravesar la piel de nuestro cuerpo. No obstante, es peligrosa por ingestión de un emisor α (o por respiración de polvo radiactivo) ya que en el interior del cuerpo, durante su corto trayecto produce ionizaciones locales y alteraciones químicas muy importantes. -8- Radiación β: Consiste en la emisión, por parte del núcleo, de una partícula β y de un neutrino (ν). La partícula β es en realidad un electrón rápido y el neutrino es una partícula neutra y de masa despreciable. Para las pretensiones de estos apuntes, el neutrino no se tendrá en cuenta. Se suele producir cuando la relación A-Z/Z es demasiado grande, entonces en el núcleo un neutrón se transforma en un protón: 1 0 n p 1 1 0 1 e Esta es la explicación de que un núcleo emita electrones. ¿Cómo es posible que de un núcleo atómico se emitan electrones? Acabamos de ver que lo que en realidad ocurre es que uno de los neutrones del núcleo, de carga nula, se divide en dos partículas, un protón y un electrón (la carga neta sigue siendo nula). Por ejemplo, el isótopo carbono-14 es un emisor β, circunstancia que se puede aprovechar para datar la antigüedad de restos fósiles. La reacción de desintegración correspondiente sería: C 14 6 N 14 7 0 -1 e por curiosidad vemos que en este ejemplo la relación A-Z/Z es 8/6 = 1’3. Otro ejemplo de emisor β es el bismuto-214: Bi 214 83 Po 214 84 0 -1 e La ley de Fajans y Soddy para la emisión β establece, por tanto, que cuando un núcleo emite una partícula β, se transforma en un nuevo núcleo cuyo número de protones ha aumentado en una unidad y sus nucleones no han variado, en general A Z X Y A Z 1 0 -1 e Las partículas β se emiten con velocidades próximas a la de la luz, su masa es mucho menor que la de las partículas α y, por tanto, su poder de penetración en mucho mayor. Son frenadas por unos metros de aire, una lámina de aluminio o unos centímetros de agua. Podemos imaginar que el material que frena una partícula radiactiva no es indicativo de su peligrosidad; sí lo es lo que la partícula puede hacer mientras está siendo frenada. Radiación γ: En este caso sí se trata de una radiación propiamente dicha ya que en los dos casos anteriores son partículas concretas. Por tanto, se trata de ondas electromagnéticas emitidas por los núcleos radiactivos cuya longitud de onda es muy pequeña siendo, por tanto, muy energéticas. La radiación γ acompaña generalmente o a la emisión α o a la emisión β ya que el núcleo que emite estas partículas queda en un estado excitado de energía. Vuelve a su nivel o estado -9- fundamental emitiendo energía en forma de cuantos de radiación γ. Por tanto, una emisión γ no cambia la naturaleza de la especie que la emite. El poder de penetración de los rayos γ es considerablemente mayor al de las partículas α ó β. Atraviesan el cuerpo humano y sólo se frenan con planchas de plomo y muros gruesos de hormigón. La radiación γ es muy peligrosa para la vida en general. Ley de la desintegración radiactiva. Los tres tipos de radiactividad mencionados aquí son los que se presentan en los núcleos radiactivos naturales. No son, sin embargo, los únicos tipos de radiactividad. En núcleos radiactivos artificiales se han observado otros tipos de emisiones radiactivas como la desintegración β+ o la captura electrónica. El estudio de las características de estas emisiones se aleja de las pretensiones de estos apuntes aunque se puede decir que toda emisión radiactiva (natural o artificial) sigue una ley conocida como ley de la desintegración radiactiva. En 1900 Rutherford sugirió que el ritmo de emisión radiactiva de una sustancia disminuye exponencialmente con el tiempo. Los procesos radiactivos son aleatorios, han de estudiarse estadísticamente, basando las deducciones en el cálculo de probabilidades: de probabilidad de que un núcleo concreto se desintegre en un instante concreto. Para ver cómo es este estudio imaginemos una muestra con N0 núcleos radiactivos en el tiempo t0. Cuando pase un tiempo t , parte de los núcleos se han desintegrado y quedan concretamente N núcleos radiactivos (N<N0). La velocidad de desintegración será el ritmo de cambio del número de núcleos radiactivos en función del tiempo transcurrido, es decir: velocidad de desintegra ción N - N 0 N t - t0 t Se puede comprobar (Rutherford y Soddy, 1902) que esta velocidad es proporcional al número de núcleos existentes, es decir: N N t donde λ es llamada constante de desintegración, característica de cada núcleo y cuyas unidades son, en el S.I., s-1 (aunque no debemos confundirla con la unidad de frecuencia). El signo menos de la ecuación anterior indica que el número de núcleos disminuye con el tiempo. - 10 - Si reordenamos la ecuación y consideramos intervalos de tiempo infinitesimales, los incrementos pasan a diferenciales: N t N dN dt N Si queremos conocer el número de núcleos (N) que quedan después de un tiempo (t), siendo N0 el número de núcleos al principio, debemos integrar dN dt N ln N t N0 N N 0e t Las dos últimas ecuaciones son dos formas de expresar la ley de desintegración radiactiva. Es una expresión general aplicable a cualquier desintegración radiactiva. La representación gráfica de la última ecuación nos da una idea de cómo va disminuyendo el número de núcleos radiactivos desde una cantidad inicial para tiempo cero (figura adjunta) Otros términos o conceptos muy utilizados en el análisis de la desintegración radiactiva son 3: 1- Actividad o velocidad de desintegración: es la velocidad de desintegración, es decir el número de emisiones de una sustancia por unidad de tiempo. Su unidad en el S.I. es el becquerel (Bq), que es una desintegración por segundo. Por tanto: A dN N N 0 e t A0 e t , donde A0 N 0 es la actividad en el instante inicial dt 2- Periodo de semidesintegración: o periodo de semivida (T1/2), es el tiempo que tiene que transcurrir para que el número de átomos radiactivos de una muestra determinada baje a la mitad. Apliquemos esta definición en la ley de desintegración radiactiva: N0 N 0 e T1/2 2 1 e T1/2 2 ln 1 T1/ 2 ln e 2 - 11 - 0'693 T1/ 2 T1/ 2 0'693 ln 2 A modo de ejemplo, en la tabla siguiente aparecen los periodos de semidesintegración de algunos núcleos radiactivos. Berilio-8 Polonio-213 -16 4 · 10 s 10 s -6 Aluminio28 Yodo-131 Estroncio90 Radio-226 Carbono-14 Rubidio-87 2’25 min. 8 días 28 años 1600 años 5730 años 5’7 · 10 años 10 3- Vida media (τ): es el promedio de vida o tiempo que, por término medio, tarda un núcleo en desintegrarse. Es la inversa de la constante de desintegración: 1 T1/ 2 ln 2 Problema En una muestra de madera de un sarcófago ocurren 13536 desintegraciones en un día por cada gramo, debido al 14C presente, mientras que una muestra actual de madera análoga experimenta 920 desintegraciones por gramo en una hora. El período de semidesintegración del 14C es de 5730 años. a) Establezca la edad del sarcófago. b) Determine la actividad de la muestra del sarcófago dentro de 1000 años. Solución a) Hay que pasar los dos datos de actividad a desintegraciones por segundo. En ambos casos el dato ofrecido es por gramo de muestra, por tanto, en el caso de la muestra del sarcófago: A 13536 desintegra ciones 1 día desintegra ciones x 0'157 día 86400 segundos segundo Para el caso de la muestra actual la actividad se puede considerar como actividad en el instante inicial pues es un trozo de madera es de las mismas características a la del sarcófago: A0 920 desintegra ciones 1 hora desintegra ciones x 0'256 hora 3600 segundos segundo Por otra parte, con el dato de T1/2 podemos conocer la constante de desintegración del carbono-14: T1/ 2 5730 años 1'81·1011 s ln 2 ; 3'83 ·10-12 s 1 De la expresión de la actividad todo es conocido y podemos obtener el tiempo transcurrido: A A0 e t ; A A 0'157 e t ; ln t ; ln 3'83 ·10-12 t A0 A0 0'256 t = 1’276 · 1011 s = 4045 años. b) Dentro de 1000 años (1000 x 365’25 x 86400 = 3’156 · 107 s) el sarcófago tendrá una antigüedad de 5045 años (1’592 · 1011 s). Su actividad será de - 12 - A 0'256 e( 3'83·10 -12 ·1'592·10 11) 0'139 desintegra ciones por segundo y por gramo Problema Una muestra de una sustancia radiactiva de 0’8 kg se desintegra de tal manera que, al cabo de 20 horas, su actividad se ha reducido a la cuarta parte. Calcule el periodo de semidesintegración. Solución En primer lugar, 20 horas son 20 · 3600 = 72000 segundos. La actividad inicial de la muestra se debe a los 0’8 kg de sustancia radiactiva que hay al principio. En 20 horas dicha actividad ha bajado a la cuarta parte según informa el enunciado del problema. Por tanto, la cantidad de muestra se debe haber reducido a la cuarta parte de la inicial: - Al cabo de 72000 s, A = A0/4 = 0’25·Ao - Cantidad de sustancia radiactiva que queda = 0’8/4 = 0’2 kg No obstante, la cantidad de muestra no es necesaria para resolver el problema: A A0 e t ; 0'25A0 e t ; ln 0'25 · 72000 ; 1'925 ·10-5 s 1 A0 Tenemos ahora los datos necesarios para calcular T1/2: T1/ 2 ln 2 36000 s Problema Tenemos 70 gramos del isótopo radiactivo cromo-51 (artificial), con un periodo de semidesintegración de 27 días. ¿Cuántos átomos quedarán de dicho isótopo al cabo de seis meses? Solución Con el dato del periodo de semidesintegración obtenemos la constante de desintegración del cromo-51: T1/ 2 27 días 2'33 · 106 s ln 2 ; 2'97 ·10-7 s 1 Por otra parte, 70 gramos de cromo-51 son 70 g · 1 mol átomos · 6'023 ·10 23 8'27 ·10 23 átomos 51 g mol Tenemos ya todos los datos necesarios para calcular el número de átomos que quedarán al cabo de seis meses (6 x 10 x 86400 = 1’56 · 107 s) N N 0e t 8'27 ·1023 · e( 2'97 ·10 -7 ·1'56·10 7 ) 8'04 ·1021 átomos Familias radiactivas Si el periodo de semidesintegración del radio es de sólo 1600 años, ¿cómo es posible que fuera descubierto en la pechblenda (mineral de uranio) por el matrimonio Curie si la edad de la Tierra es lo suficientemente grande como para que ya no hubiera ni rastro de elemento? - 13 - Se puede comprobar que con ese periodo de semidesintegración, de una muestra inicial en la tierra de N0 átomos de radio, en 4500 millones de años, el número de átomos habría bajado en un 99’999982%, es decir, sería indetectable. Marie y Pierre Curie procesaron varias toneladas de pechblenda para obtener un gramo de radio, pero con el porcentaje calculado la cantidad debería haber sido mucho mayor. La respuesta está en que el radio-226 que actualmente hay en la pechblenda es un núcleo resultado de una desintegración radiactiva del torio-230 que a su vez procede de la desintegración radiactiva del uranio-234, que a su vez procede de la desintegración radiactiva del protoactino-234, que a su vez procede de la desintegración radiactiva del torio-234 que, por fin, procede de la desintegración radiactiva del uranio-238. El radio-226 va apareciendo en el mineral a medida que se van desintegrando sus “progenitores”. El primero de la lista, el uranio238, tiene un periodo de semidesintegración de 4’51 · 109 años, lo suficientemente grande como para ser responsable de que todavía exista el radio-226. Una serie radiactiva, también familia radiactiva, es una serie encadenada de desintegraciones radiactivas que desembocan en un núcleo estable no radiactivo. En la naturaleza hay 4 series radiactivas que se nombran atendiendo al núcleo que empieza la serie. Existen además un gran número de series radiactivas artificiales. En la figura adjunta, a modo de ejemplo, aparece la serie radiactiva del Uranio-238. En la tabla siguiente aparecen las características más relevantes de las cuatro series radiactivas naturales. Serie Nº másico Núcleo padre T1/2 Núcleo final Torio 4n Torio-232 1’39 · 1010 años plomo-208 Neptunio 4n+1 Neptunio-237 2’25 · 106 años bismuto-209 Uranio 4n+2 Uranio-238 4’51 · 109 años plomo-206 Uranio - Actinio 4n+3 Uranio-235 7’07 · 108 años plomo-207 La columna del número másico significa que todos los números másicos de los núcleos de cada serie responden a esa expresión siendo n u número entero. - 14 - El periodo de semidesintegración del neptunio no es lo suficientemente grande como para que este núcleo exista en cantidades “apreciables” a no ser que se busque en una gran cantidad de mineral, sin embargo el actinio-89 que forma parte de esta serie si tiene un periodo de semidesintegración alto. 4.- Reacciones nucleares. Una reacción nuclear es un proceso de combinación y transformación de las partículas y núcleos atómicos. Una reacción nuclear se representa mediante una ecuación que muestra el proceso en el que intervienen núcleos atómicos. Ya se han visto a lo largo de estos apuntes algunas reacciones referentes a procesos radiactivos ya que la desintegración α y β pueden considerarse como reacciones nucleares. Existen otro tipo de reacciones nucleares consistentes en el bombardeo de un núcleo con otros núcleos de menor tamaño o, incluso, con partículas subatómicas. La primera reacción nuclear (diferente a la desintegración radiactiva) estudiada lo fue por parte de Rutherford en 1919: consiste en el bombardeo de núcleos de nitrógeno-14 con partículas α (procedentes de la desintegración del radio-226): 14 7 N He O 4 2 17 8 1 1 p Podemos pensar que el sueño de los alquimistas está cerca pues el nitrógeno se ha convertido en oxígeno de forma artificial. Otro ejemplo de reacción nuclear, utilizada por IreneJoliot Curie (hija de Marie y Pierre Curie) y su esposo Jean Fréderic Joliot-Curie les permitió descubrir la radiactividad artificial: 27 13 Al He P 4 2 30 15 1 0 n el fósforo-30 es radiactivo, fue el primer isótopo radiactivo sintetizado en un laboratorio y permitió al matrimonio descubridor recibir el premio Nobel en 1935. Podemos ver en la última reacción nuclear un motivo del porqué de la peligrosidad de la partícula α ya que produce reacciones nucleares que dan lugar a nuevos núcleos radiactivos. Más ejemplos: 7 3 Li 27 13 Al p 1 1 n 1 0 He 4 2 4 2 Mg 27 12 He 1 1 p Podemos ver en todas estas reacciones que se debe conservar la masa (la suma de los números másicos de los productos y reactivos es la misma) y la carga (la suma de los números atómicos –protones- en productos y reactivos es la misma). El catálogo de partículas y núcleos utilizados para bombardear es muy extenso. Las más importantes, junto con sus símbolos, son: Partícula α, 24 He Protón, 11 p ó - 15 - 1 1 H Deuterio, 12 H Electrón, 0 1 Neutrón, 01 n e Las partículas con carga eléctrica se pueden acelerar con campos eléctricos y magnéticos con el objeto de facilitar el choque y la reacción (aceleradores de partículas) al impactar a gran velocidad con el blanco. El neutrón y otras partículas neutras no se pueden acelerar dado su carácter neutro. Reacción de fisión Es un tipo de reacción nuclear que se produce cuando un núcleo pesado se divide en dos o más núcleos ligeros. En estas reacciones se libera mucha energía. La fisión nuclear fue descubierta en 1939 por O. Hahn y F. Strassmann al bombardear un núcleo de uranio-235 con un neutrón. Se produce uranio-236, un núcleo muy inestable que se fisiona en dos núcleos más ligeros según la reacción: 235 92U 1 0n 236 92U 141 56Ba 92 36Kr 3 01n Energía A pesar de que el uranio-235 es energéticamente menos estable que sus productos de fisión, no se fisiona de forma espontánea. Es necesaria una energía de activación que se obtiene de la captura de un neutrón por el núcleo. La energía desprendida se puede determinar calculando exactamente el defecto de masa entre productos y reactivos pues aunque la suma de los números másicos de productos y reactivos se conserva, hay una diferencia entre el las masas experimentales de productos y reactivos. Una serie de consideraciones a temer en cuenta: 1ª) El uranio-235 que permitió descubrir la fisión nuclear no es precisamente el isótopo más abundante del uranio. Enriquecer una muestra de un elemento en un isótopo concreto no es una tecnología que esté al alcance de todos los países. 2ª) Los dos fragmentos producto de la fisión no son siempre los mismos. En la reacción anterior los fragmentos son el bario-141 y el kriptón-92, pero estos fragmentos son el caso más probable de ruptura. La gráfica adjunta nos muestra cómo varía la probabilidad de fisión del uranio-235 en función del número másico de los núcleos producto de la misma. La mayor parte de los núcleos obtenidos en la fisión son radiactivos y dan lugar a sus propias series radiactivas. 3ª) La energía liberada es del orden de 200 MeV por reacción, es decir, por átomo de uranio fisionado. Si suponemos que tenemos 235 g de uranio-235, tendremos un número de Avogadro de átomos de uranio fisionales a 200 MeV por átomo dan un total de 12 · 1025 MeV de energía = 192 · 1011 J. - 16 - Un kilogramo de uranio-235 produciría por fisión una energía cuya cantidad es 1.800.000 veces superior a la obtenida por quemar 1 kg de gasolina (1 kg de gasolina produciría 4’6 · 107 J). 4ª) En las reacciones de fisión se producen entre 2 y 3 neutrones, dependiendo de los núcleos producto de la reacción de fisión. Estos neutrones pueden fisionar a otros núcleos de uranio-235 y producir una reacción en cadena. Para que se produzca dicha reacción en cadena debe haber un número determinado de núcleos del elemento fisionable, es su masa crítica. Enrico Fermi fue el primer físico que produjo una reacción en cadena en 1942 en Chicago. 5ª) Otros núcleos fisionables son el torio, protoactinio, plutonio,… Fusión nuclear Es un tipo de reacción nuclear en la que núcleos ligeros se unen para producir un núcleo más pesado. Sería la una reacción inversa a la fisión nuclear: 2 1 H 3 1 H He n Energía 4 2 1 0 La energía desprendida en el ejemplo anterior es de 17’6 MeV ya que los productos presentan un defecto de masa de 0’0189 u. El desprendimiento de energía se produce porque el núcleo de helio-4 es más estable que los núcleos de deuterio y tritio y se desprende la energía de enlace correspondiente. Tal como sucede en la fisión, para iniciar un proceso de fusión nuclear es necesaria una energía de activación. En el caso de la fusión, la energía necesaria para que los núcleos se unan venciendo las repulsiones electrostáticas es proporcionada por una energía térmica muy elevada (correspondiente a temperaturas superiores al millón de grados Kelvin). Los núcleos de pequeño peso atómico, como el deuterio o el tritio, son los más adecuados para producir fusión nuclear. Las reacciones de fusión, también llamadas termonucleares, tienen lugar de forma natural en el Sol y las estrellas, gracias a las altas temperaturas de su interior. De forma artificial, en cambio, el ser humano sólo ha conseguido (hasta ahora) la fusión en cadena de forma explosiva: se trata de la bomba de hidrógeno o bomba H. Mediante una bomba atómica de fisión se alcanza la temperatura necesaria para llevar a cabo la reacción de fusión, es decir, en una bomba H una bomba atómica es el detonador. Problema En la explosión de una bomba de hidrógeno se produce la reacción: 2 1 H 3 1 H He 4 2 1 0 n Calcule: La energía liberada en la formación de 10 g de helio. Masa deuterio = 2’01474 u; masa tritio = 3’01700 u; masa partícula α = 4’00388 u; masa del neutrón = 1’0087 u; 1 u = 1’66 · 10-27 kg; c = 3 · 108 m/s. Solución - 17 - Masa de reactivos = 2’01474 + 3’01700 = 5’03174 u Masa de productos = 4’00388 + 1’0087 = 5’01258 u Defecto de masa = 0’01916 u. Pasamos ahora este defecto de masa a kilogramos con objeto de obtener la energía correspondiente en julios: 0'01916 u ·1'66 ·10-27 kg 3'18056 ·10-29 kg u La energía correspondiente a este defecto de masa es: E mc2 3'18056 ·10-29 · (3 ·108 ) 2 2'8625 ·10-12 J Esta energía es liberada para la formación de 4’00388 u de helio según la estequiometría de reacción nuclear del enunciado, es decir, se ha calculado la energía liberada para la formación de un núcleo de helio-4 cuya masa es: 4'00388 u ·1'66 ·10-27 kg 6'64644 ·10-27 kg 6'64644 ·10-24 g u Cuando se hayan formado por fusión 10 g de helio-4, la energía total liberada será: 2'8625 ·10-12 J 10 g · 4'31·1012 J -24 6'64644 ·10 g - 18 - Apéndice: Espectrómetro de masas Este instrumento se utiliza para determinar la masa de átomos y moléculas así como para determinar la abundancia relativa de los diferentes isótopos que contiene un material. El primer espectrómetro de masas fue diseñado por J. J. Thomson y posteriormente fue perfeccionado por F. W. Aston, J. Dempster y K. Bainbridge. Un esquema básico del espectrómetro es el siguiente: Los cationes del átomo que se quiere estudiar se aceleran entre las láminas L1 y L2, entre las que existe una diferencia de potencial de varios miles de voltios. Después los átomos pasa a través de un selector de velocidades compuesto por un campo eléctrico y otro magnético perpendiculares, por lo que sólo pasan los iones que se mueven a una determinada velocidad. Luego los iones se encuentran con un campo magnético B perpendicular al plano de la figura y describen una trayectoria circular que cumple: Fm Fc ; qvB mv2 ; r r v ·m qB Como la razón v/qB es la misma para todos los iones, los radios son directamente proporcionales a las masas de los iones. Los iones más pesados describen circunferencias de mayor radio. Como los iones de masas diferentes describen trayectorias distintas, inciden sobre la placa fotográfica o sobre otro detector, en posiciones distintas. La masa del ión se puede calcular a partir de su velocidad y del radio de la semicircunferencia descrita. ۞۞۞۞ Estos apuntes se finalizaron el 25 de junio de 2007 en Villanueva del Arzobispo, Jaén (España) Autor: Felipe Moreno Romero - 19 - fresenius1@gmail.com http://es.geocities.com/apuntes_ensayos/index.htm - 20 -