Racemasa, Ronda 31. pdf
Anuncio

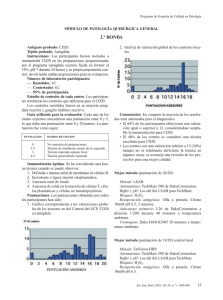
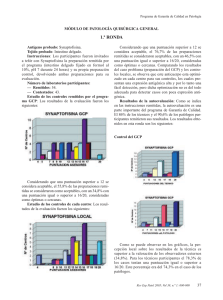
SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología Módulo de Inmunohistoquímica GENERAL Ronda nº 32, 17 de Abril de 2014 Antígeno probado: alfa-methilacil-CoA Racemasa (Racemasa) Tejido probado: Próstata, Riñón 1. Instrucciones Los participantes fueron invitados a teñir con Racemasa la preparación remitida por el programa (riñón fijado en formol al 10%, pH 7 durante 24 horas) y su propia preparación control, devolviendo ambas preparaciones para su evaluación. El cristal enviado para teñir con inmunohistoquímica (IHQ) para Racemasa contenía: · · Prostata, con adenocarcinoma infiltrante, neoplasia intraepitelial prostática (PIN, prostate intraepithelial neoplasia) y epitelio glandular hiperplásico. Riñón, con presencia de túbulos renales proximales 2. Inmunotinción óptima Los criterios para considerar como óptima la tinción para Recemasa fueron los siguientes (figuras 1, 2 y 3): · · · · Una tinción granular citoplasmática, de moderada a fuerte, en las células epiteliales de los túbulos renales proximales. Una tinción citoplasmática, de moderada a fuete, de la mayoría de las células neoplásicas del PIN y en las del adenocarcinoma. Una tinción citoplásmica negativa o débil y focal en las células del epitelio glandular hiperplásico prostático. Una tinción citoplásmica negativa o débil y focal en las células estromales. Además, con una adecuada relación en la intensidad de la tinción con respecto al contraste empleado y con mínimo o ausente artefacto tanto de técnica inmunohistoquímica (degradación del tejido por sobrecalentamiento, tinción de fondo, etc.) como de técnica histológica (contraste inadecuado, ausencia de hidratación, etc.). Los criterios generales de puntuación empleados son los reflejados en las hojas de resultados individuales remitidas. Para ejemplos de las diferentes valoraciones se puede visitar la página web de la SEAP, en el apartado del programa de Garantía de Calidad. Las puntuaciones para cada control varían entre 0 (no entregado) y 20 (tinción óptima por los cuatro evaluadores). Los rangos de puntuación se agrupan como sigue: 4-7 Pobre, 8-11 Regular, 12-15 Buena, 16-20 Óptima. Una puntuación de 12 fue la considerada como punto de corte para considerar el control como adecuado para diagnóstico. 3. Laboratorios 77 laboratorios han participado en esta ronda de control. De estos, 55 (71,4%) devolvieron los controles para su evaluación y 22 (28,6%) no lo hicieron. 4. Anticuerpos Los anticuerpos empleados de acuerdo con la información proporcionada por los diferentes laboratorios son: 13H4 39 (DAKO 25, Master Diagnostica 8, Master Diagnostica-Vitro 2, Master Diagnostica-ROCHE 1, Vitro 1) P504S 4 (ROCHE 2, Master Diagnostic 2, Diagnostic Biosystem 1) 2876 1 (ROCHE) 3E6 1 (DAKO) 13H4+4A4 1 (Vitro-Master Diagnostica) p504S/p63 1 (BIOCARE Medical) Policlonal 2 (BIOCARE 1, En blanco 1) No especificado 10: en blanco 6 (DAKO 2, DBS 1, en blanco 3), N/A 2 (BIOCARE), no determinado 1 (BIOCARE), Racemasa 1 (ROCHE) 5. Estudio de los controles De cada centro (gráfico 1.1): 48 (62,3) de las preparaciones remitidas se consideraron como adecuadas. 16 (20,7 %) de las preparaciones obtuvieron una puntuación igual o superior a 16/20, consideradas como óptimas o próximas al grado óptimo. La puntuación más repetida fue de 12, con una valoración de buena. Los tejidos utilizados como control, en los laboratorios que lo especificaron fueron: • Próstata (incluidos TMA y trucut) 41 • Riñón: 5 • Apéndice cecal 1 • Multitejido (apéndice, riñón, placenta y páncreas) 1 • Próstata y riñón 2 • Próstata tumoral y no tumoral 1 • Próstata normal 1 Programa GCP (gráfico 1-2): 50 (64,9%) de las preparaciones remitidas se consideraron adecuadas. 25 (32,5%) obtuvieron una puntuación igual o superior a 16/20, consideradas como óptimas o muy cerca de la tinción óptima. La puntuación más repetida fue de 16, con una valoración óptima. El principal de los problemas detectados, para ambos tipos de controles, han sido una alta frecuencia de pretratamiento excesivo (por sobrecalentamiento o pH inadecuado) (figuras 7,9 y 10); aunque, generalmente, este sobretratamiento no afecta a la aptitud de la técnica, si afecta a su idoneidad cuando se da en grado moderado o alto. Asimismo, ha sido la observación más común, en las tinciones dentro del rango de idónea (16-20 puntos). Dentro del rango de tinciones buenas (12-15 puntos), los problemas más frecuentes son una disminución de la calidad de la tinción de las células neoplásicas, ya sea por una tinción más débil que la deseable o por una tinción inadecuada en algunas células. Una tinción de fondo moderada es el siguiente problema por frecuencia, observándose en 17/44 (39%) de los casos; aunque no dificulta la interpretación de la técnica, si tendría fácil solución: un pretratamiento de menor intensidad con una buena digestión enzimática y un bloqueo adecuado en tampón de buena calidad impedirían la difusión excesiva del anticuerpo. Dentro del rango de las técnicas con menos puntuación (<12 puntos), el principal problema es una tinción muy débil, insuficiente, de las células neoplásicas diana (figuras 5, 6 y 8). La solución en estos casos vendría dada por el uso de un anticuerpo de buena calidad (aunque el 13H4 es el más utilizado no podemos afirmar que sea mejor que los demás) con un pH elevado (entre 8 y 9) sobre un tejido desenmascarado con calor, sin parecer importar tanto la duración o la temperatura de la incubación. En estos casos con menor puntuación, además, destacaba la tinción inespecífica (figuras 4 y 7) a los que se añadían con relativa frecuencia los artefactos técnicos generales (hidratación, contraste inadecuado por exceso o defecto, defectos en la manipulación con rotura del corte, etc.) (figura 10) que suponen una merma global de la calidad de la técnica. La elección de control en relación a la puntuación obtenida está cerca de la significación estadística en el análisis univariante, con una media de puntuaciones para el grupo del control GCP del 14,67 y para el grupo de control local del 13,69 (0,060). Estas diferencias se atenúan cuando consideramos la adecuación de la prueba en el punto de corte definido en 12 puntos, independientemente de cualquier otro factor. 6. Resultados de la autoevaluación Como se indica en las instrucciones remitidas, la autoevaluación es una parte importante del programa de Garantía de Calidad. 53 (68,8%) de los GCP y 51 (66,2%) de los controles locales se acompañaron de una autoevaluación por parte de técnico o patólogo local. Si consideramos solo el grupo de los controles remitidos para evaluación, 51/54 (94%) se acompañan de una autoevaluación por parte de técnicos y/o patólogos, lo que supone una cifra superior a las rondas previas. Estos son los resultados: Control Local (gráficos2 y 3): al igual que en las rondas anteriores la percepción local sobre los resultados de la técnica es superior a la valoración de los observadores externos. Tanto dentro de los técnicos participantes como de los patólogos, 43 (80%) los casos tenían una puntuación igual o superior a 16, mientras que solo 25 de estos casos son óptimos según los evaluadores; estas valoraciones, aunque son casi el doble de óptimas con respecto a lo observado de acuerdo con la valoración externa, suponen una disminución con respecto a rondas previas. Control del GCP (gráficos 2 y 3): los resultados son similares al control local, con 45 (81,8%) de preparaciones con una puntuación igual o superior a 16 tanto para los técnicos como para los patólogos. Es evidente la notable discrepancia con las valoraciones de los asesores externos (27 % frente a 85 % de media). La apreciación de los técnicos y de los patólogos sigue siendo muy superior a la de los asesores externos. De nuevo se observa una discrepancia importante pero menor que en rondas anteriores, posiblemente debido a un mayor porcentaje de técnicas óptimamente realizadas (casi un tercio del total según la valoración externa) 7. Mejores métodos 1 de los controles de GCP mostro una puntuación 20/20. Fijación: Formol tamponado, 24 horas, a temperatura ambiente, sobre tejido tallado previamente, con una dimensión de 2 cm. Método: MULTIMERO Bloqueo: Agua oxigenada Automatización: BENCHMARK XT de ROCHE VENTANA Digestión enzimática: NO Recuperación antigénica: con calor, en tampón CC1 a pH 8,3, con un tiempo total en MO de 30 minutos. Anticuerpo primario: 13H4, prediluido, de DAKO, 48 minutos a 37ºC Cromógeno: DAB de ROCHE VENTANA, prediluido, con un tiempo de incubación no especificado. 1 de los controles mostró una puntuación de 19/20. Fijación: Formaldehido al 10%, 24 horas, a temperatura ambiente, sobre tejido tallado previamente con una dimensión de 2x1 cm. Método: ENVISION FLEX Bloqueo: Agua oxigenada Automatización: AUTOSTAINER LINK 48 de DAKO Digestión enzimática: NO Recuperación antigénica: con calor, en sistema PTLINK, a pH 9, con un tiempo total en MO no especificado. Anticuerpo primario: 13H4, prediluido, de DAKO, 20 minutos a temperatura ambiente. Cromógeno: DAB de DAKO, con una predilución y un tiempo de incubación no especificados. 8. Comentarios La Racemasa es una enzima que realiza la oxidación de las cadenas ramificadas de los ácidos grasos y sus derivados. La Racemasa es una proteína que se encuentra en las mitocondrias y peroxisomas de numerosas células de numerosos tejidos, como son próstata, hígado, tracto biliar, riñón y pulmón. Mediante IHQ, las células de la próstata muestran una tinción débil o focal, citoplasmática, en aproximadamente un 20% de los casos, incluidas las células de las glándulas periuretrales y seminales. La reactividad de la tinción tiende a disminuir con la edad, pero el coeficiente de correlación es bajo (1). Mediante IHQ para Racemasa, se ha descrito una tinción difusa en más del 90% de los carcinomas de próstata, independientemente de su grado de Gleason. Sin embargo, y particularmente, las variantes hipernefroide, pseudohiperplásica y atrófica del adenocarcinoma de próstata pueden ser negativas. En el PIN, los rangos de positividad para este anticuerpo varían entre el 13 y el 72%. La detección de la expresión de Racemasa mediante IHQ es utilizada principalmente en el diagnóstico de lesiones prostáticas sospechosas de ser carcinoma. La tinción aislada de proteínas de alto peso molecular (HMW-CK, High Molecular Weight Cytokeratins) y/o p63 puede no ser suficiente para realizar el diagnostico de malignidad; es por ello que la tinción de Racemasa y HMW-CK o p63 debe realizarse conjuntamente, ya sea por separado o en forma de coctel de anticuerpos. La recuperación antigénica mediante calor es el método predominante, mientras que solamente un laboratorio utilizo la digestión enzimática. El anticuerpo primario no parece tener importancia en los resultados de la técnica, si bien el número de anticuerpos no 13H4 es pequeño y no se han podido establecer conclusiones definitivas. En conjunto, la mayoría de los laboratorios muestran tinciones adecuadas para su utilización rutinaria, con casi un tercio de inmunotinciones óptimas. Sin embargo hay un porcentaje apreciable con deficiencias, especialmente en la intensidad de la tinción, que podrían ocasionar una disminución en la sensibilidad de la técnica para la detección de células con relativamente escasa cantidad de antígeno, que habitualmente no son percibidas ni por el técnico responsable ni por el patólogo. Parece ser que la labor de instrucción sobre la valoración de la técnica, sobre la que se incidió hace varias rondas con la puesta bajo el dominio público de las imágenes en la web de la SEAP, con ejemplos de diferentes casos representativos de cada uno de los distintos problemas, así como la mejor en la automatización y estandarización de las técnicas han permitido una mejora en la calidad global de los controles valorados. Asimismo, el conocimiento de los criterios a puntuar en una valoración en profundidad de un control de inmunohistoquímica no solo ha disminuido la variabilidad interobservador entre los distintos laboratorios y los evaluadores de la SEAP sino que ha contribuido en la mejora de la calidad antes referida, al menos, para esta proteína en concreto. En resumen, los resultados son heterogéneos, muestran gran dispersión con gran cantidad de variables, que impide extraer conclusiones estadísticamente significativas, en gran medida por las características de la diana, el tipo de anticuerpo empleado y el método de la recuperación antigénica. Una combinación adecuada de los diferentes factores implicados podría ser la clave para obtener unos buenos resultados, teniendo como referencia principal los mejores métodos reseñados. 9. Bibliografía seleccionada 1. Gologan A, Bastacky S, McHale T, Yu J, Cai C, Monzon-Bordonaba F, Dhir R. AgeAssociated Changes in Alpha-Methyl CoA Racemase (AMACR) Expression in Nonneoplastic Prostatic Tissues. Am J Surg Pathol. 2005 Nov;29(11):1435-41. 2. Hameed O, Humphrey PA. p63/AMACR antibody cocktail restaining of prostate needle biopsy tissues after transfer to charged slides: a viable approach in the diagnosis of small atypical foci that are lost on block sectioning. Am J Clin Pathol. 2005 Nov;124(5):708-15. 3. Jiang Z, Woda BA. Diagnostic utility of alpha-methylacyl CoA racemase (P504S) on prostate needle biopsy. Adv Anat Pathol. 2004 Nov;11(6):316-21. 4. Kunju LP, Chinnaiyan AM, Shah RB. Comparison of monoclonal antibody (P504S) and polyclonal antibody to alpha methylacyl-CoA racemase (AMACR) in the work-up of prostate cancer. Histopathology. 2005 Dec;47(6):587-96. 5. Varma M, Jasani B. Diagnostic utility of immunohistochemistry in morphologically difficult prostate cancer: review of current literature. Histopathology. 2005 Jul;47(1):116. Figuras Figura 1. Una zona representativa de una tinción óptima, 20/20, con una tinción citoplasmática fuerte en las células de los túbulos renales proximales, con buen contraste, sin tinción en el túbulo renal y nada de fondo. Figura 2. Una zona representativa de una tinción óptima, 20/20, con una tinción citoplasmática fuerte en las células neoplásicas de un adenocarcinoma de próstata grado 3+3 de Gleasson, con buen contraste, sin tinción en células estromales y nada de fondo. Figura 3. Control con tinción optima, 20/20, con una tinción citoplasmática fuerte en las células neoplásicas tanto del adenocarcinoma infiltrante como del PIN, con tinción negativa en el epitelio ductal glandular hiperplásico, con buen contraste y nada de fondo. Figura 4. Zona representativa de una tinción tinción inadecuada 8/20, con una tinción citoplasmática moderada-fuerte en las células de los túbulos renales proximales, pero con tinción inadecuada moderadafuerte de células mesangiales renales y de la capsula de Bowman. Figura 5. Control con tinción insuficiente 8/20, con una tinción citoplasmática muy débil en las células de los túbulos renales proximales, con buen contraste pero discreta tinción de fondo, así como depósitos de colorante inespecíficos sin lavar. Figura 6. Tinción insuficiente 8/20 en una zona de adenocarcinoma infiltrante, correspondiente al mismo control que en la figura 5. De nuevo tinción débil y parcheada, irregular, además de un pobre contraste en la contratinción. Figura 7. Zona representativa de una tinción insuficiente 8/20, con una tinción citoplasmática fuerte en las células epiteliales y moderada en otras, destacando una pérdida de contraste y un marcado daño tisular por excesivo pretratamiento. Además, tinción citoplasmática inespecífica en células mesenquimales. Figura 8. Zona representativa de una tinción insuficiente 8/20, con una tinción citoplasmática muy débil o inexistente, parcheada en las células neoplásicas de un adenocarcinoma infiltrante de próstata. Además, depósitos de tinción inespecíficos en parte superior derecha, probablemente debidos a un lavado incompleto. Figura 9. Zona representativa de una tinción deficiente, 4/20, con una tinción inespecífica y muy débil en células aparentemente mesenquimales, sin contraste, con marcado daño tisular por excesivo pretratamiento. El control local estaba, aparentemente, elegido de un parénquima prostático no neoplásico Figura 10. Zona representativa de un control insuficiente 8/20, con una tinción citoplasmática débil y parcheada en las células de los túbulos renales proximales, con daño tisular por excesivo tratamiento, tinción inespecífica en dicha zonas y manchas claras no contrastadas por pobre desparafinado. Gráficos Grafico 1. Valoración de la técnica por los asesores externos (n=55) 15 Total 4 8 9 11 12 13 14 15 16 17 18 19 20 Recuento 10 5 0 1 2 ControlGCP __ Gráfico 2. Autoevaluación de la técnica según técnicos. (n=55) 30 TecnicoLocal -1 10 12 14 15 16 17 18 19 20 Recuento 20 10 0 Racemasa (GCP) Racemasa (LOCAL) Control __ Gráfico 3. Autoevaluación de la técnica según patólogos. (n=55) 30 PatologoLocal -1 8 9 12 14 15 16 17 18 19 20 Recuento 20 10 0 Racemasa (GCP) Racemasa (LOCAL) Control __