Anatomofisiología y fisiopatología del estómago y el
Anuncio

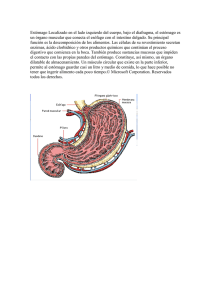
13 Anatomofisiolog ía y f isio p a t o lo gía d el estómago y e l du o de n o Javier Molina Infante Servicio de Aparato Digestivo. Hospital San Pedro de Alcántara. Cáceres 13.1. Anatomía básica del estómago y el duodeno 5. El píloro, una estructura tubular que sirve de unión entre el estómago y el duodeno, mediante el esfínter circular pilórico, que se encuentra habitualmente a la altura de la primera vértebra lumbar. Anatomía regional El estómago es una dilatación sacular del tracto digestivo proximal, en forma de “J”, que se continúa proximalmente con el esófago y distalmente con el duodeno. Sus dos funciones principales son: 1) servir como reservorio del alimento e iniciar el proceso de la digestión, mediante la producción de ácido y pepsina; y 2) liberar su contenido de manera controlada para adecuarse a la capacidad limitada del intestino delgado, mediante la motilidad coordinada del estómago, el píloro y el duodeno. La cámara gástrica se compone de cinco regiones anatómicas diferenciadas, que se describen en la Figura 13.1: 1. El cardias, que está inmediatamente contiguo a la unión gastroesofágica, habitualmente a la altura de la décima o undécima vértebra dorsal. 2. El fundus, que es una región abovedada que queda por encima de la unión esofagogástrica. Es la parte más superior del estómago y contacta con el hemidiafragma izquierdo, la cola del páncreas y el bazo. 3. El cuerpo, que es la parte más grande del estómago y se extiende desde el fundus hasta una depresión marcada en la unión de los dos tercios superiores y el tercio inferior de la curvatura menor, llamada incisura angularis. 4. El antro, que continúa el cuerpo hasta la unión entre el píloro y duodeno. Figura 13.1. Anatomía regional del estómago y el duodeno Respecto al duodeno, conforma una “C” que rodea la cabeza del páncreas y mide aproximadamente 30 cm. Se subdivide en cuatro partes, limitadas por los cambios angulares que se suceden en la trayectoria del órgano: la primera (el bulbo duodenal) se relaciona con el hilio hepático y la vesícula biliar; la segunda, con la ampolla de Vater; la tercera, con la pinza aortomesentérica, formada entre la arteria/vena mesentérica superior y la 211 Práctica Clínica en Gastroenterología y Hepatología Sección IV - Estómago arteria aorta y vena cava inferior; y la cuarta, que contacta con el borde inferior del páncreas y concluye en la flexura duodenoyeyunal, está anclada por el ligamento de Treitz. El duodeno es retroperitoneal y contiene válvulas conniventes, a excepción del bulbo duodenal, que está recubierto de peritoneo y no contiene válvulas conniventes. Vascularización La vascularización arterial del estómago proviene de ramas del tronco celíaco. El hemiestómago derecho superior está irrigado por la arteria gástrica izquierda, que nace del tronco celíaco, mientras que la porción inferior está irrigada por la arteria gástrica derecha, que nace de la arteria hepática. El hemiestómago izquierdo proximal está irrigado por las arterias gástricas cortas y la gastroepiploica izquierda, que nacen de la arteria esplénica, mientras que la porción inferior está irrigada por la arteria gastroepiploica derecha, que nace de la rama gastroduodenal de la arteria hepática. El retorno venoso se realiza en tres lugares distintos: a nivel portal, las venas gástricas derecha e izquierda; a nivel de la vena esplénica, las venas gástricas cortas y la gastroepiploica izquierda; y a nivel de la vena mesentérica superior, la gastroepiploica derecha. La vascularización arterial del duodeno proximal es compartida con el estómago distal (rama gastroduodenal de la arteria hepática), mientras que el duodeno distal se irriga mediante la arteria pancreatoduodenal inferior, que proviene de la arteria mesentérica superior. El drenaje venoso se corresponde con la vascularización arterial. Inervación En el estómago, los nervios simpáticos, provenientes de los segmentos medulares torácicos finales, ingresan a través del plexo celíaco. La inervación parasimpática proviene del nervio vago, que conecta el tronco cerebral con el estómago. El nervio vago izquierdo inerva la superficie anterior del estómago, el antro distal y el píloro, mientras el nervio vago derecho inerva la porción posterior del estómago. Las terminaciones parasimpáticas conectan con los plexos de Meissner y Auerbach y sus fibras postganglionares, que inervan el componente mucoso (secreción ácida) y el componente muscular (motilidad gástrica) funcional del estómago. En el duodeno la inervación es similar, con la diferencia de que hacen sinapsis ambos sistemas con los nervios mesentéricos superiores. Estratos tisulares del estómago La pared gástrica está constituida por cuatro capas: mucosa, submucosa, muscular propia y serosa. La mucosa gástrica tapiza la luz del estómago y contiene la mayor parte de los elementos secretores funcionales del estómago. La submucosa contiene tejido conjuntivo, arteriolas, vénulas y el plexo nervioso submucoso. La muscular propia, cuya misión principal es la motilidad gástrica, está constituida por tres capas musculares: oblicua interna, circular media (rodea el cuerpo engrosándose distalmente hasta conformar el esfínter pilórico) y longitudinal externa. La última capa del estómago es la serosa transparente, una prolongación del peritoneo visceral. En la Figura 13.2 se muestran con mayor detalle los distintos estratos tisulares del estómago. Figura 13.2. Sección anatómica del estómago, junto con la localización y la anatomía comparada de las glándulas oxínticas y pilóricas 212 Anatomofisiología y fisiopatología del estómago y el duodeno 13.2. Anatomía y fisiología de la secreción ácida gástrica 13 !! RECUERDA. Durante la fase intestinal se libera secretina y otras enterogastronas con capacidad para inhibir la secreción gástrica de ácido, evitando con ello una carga excesiva de hidrogeniones en la luz duodenal durante la fase postprandial tardía. El ácido no es imprescindible para el desarrollo de la vida, aunque la preservación universal de la secreción de ácido en los vertebrados indica que se trata de una ventaja adquirida durante el proceso evolutivo. El ácido gástrico, junto con la pepsina, permite la digestión de las proteínas, favorece la absorción de hierro, calcio y vitamina B12 en el intestino delgado y previene la entrada de bacterias en el tubo digestivo (con la excepción de Helicobacter pylori, cuyo hábitat natural es el medio ácido) y, por tanto, el desarrollo de infecciones gastroentéricas y el sobrecrecimiento bacteriano. Respecto a la producción de ácido y sus reguladores, la mucosa del estómago consta de dos áreas funcionales bien diferenciadas: las glándulas oxínticas (del griego oxys, “ácido”) y las glándulas pilóricas. Ambas áreas glandulares se organizan en unidades tubulares verticales divididas en cuatro regiones: apical o foveola, istmo (donde se localizan las células progenitoras que dan lugar a todas las células epiteliales), cuello y base. En las glándulas oxínticas, las células parietales se crean en el istmo y descienden progresivamente hasta las regiones inferiores, donde se reduce su producción de ácido en tanto coexisten con otras células. Las principales diferencias entre ambas regiones se encuentran expuestas en la Tabla 13.1, mientras que en la Figura 13.2 se ilustra la localización y la anatomía pormenorizada de dichas estructuras. La estimulación fisiológica de la secreción gástrica de ácido (SGA) se ha dividido clásicamente en tres fases interdependientes: 1. La fase cefálica, activada por los cinco sentidos y la deglución. Se cree que está mediada por un reflejo colinérgico/ vagal. Así, el pensamiento, la visión o la olfacción activan núcleos bulbares del vago, estimulando la secreción gástrica de ácido por parte de las células parietales. El ácido se crea en las células parietales, que secretan ácido clor2. La fase gástrica, que es la más importante y viene media- hídrico (pH 0,8) hacia la luz gástrica. La secreción basal de ácido, da por la liberación de gastrina (un potente estimulante de aquélla que se produce sin estímulo, es variable y habitualmente la SGA) por parte de las células G del antro, en respuesta al menor de 10 mEq/h, con un valor promedio de 2 mEq/h. El áciestímulo químico del alimento y la distensión de la cámara do gástrico cataliza el paso de pepsinógeno inactivo (producido gástrica. Existe un mecanismo de biorretroalimentación (bio- por las células principales) a pepsinas con actividad proteolítica. feedback) que inhibe la secreción de gastrina ante la presen- La adición de pepsina, por su capacidad mucolítica, incrementa cia de un pH ácido, contribuyendo con ello a regular la SGA exponencialmente la capacidad ulcerogénica del ácido (motivo por parte de las células parietales. por el que la patología ulcerosa gastroduodenal se tipifica co3. La fase intestinal, que es un periodo en el que se conju- múnmente como “péptica”). Existen dos tipos de pepsinógeno: el gan mecanismos de secreción e inhibición de la secreción tipo I, secretado en cuerpo y fundus, y el tipo II, creado a lo largo gástrica. Las células parietales son nuevamente estimula- de todo el estómago y el cardias. Ambos son detectables en sandas por dos hormonas (enterooxintina y enterobombesi- gre y sólo el tipo I se puede detectar en orina. En general, todos na). A su vez, el contacto del ácido con la mucosa de la los agentes que estimulan la producción de ácido, especialmensegunda porción duodenal libera secretina, una hormona te la estimulación por el nervio vago, promueven la secreción de inhibidora de la SGA, mediante el bloqueo de la liberación pepsinógeno. de gastrina por parte del antro. Paralelamente, la secretina estimula la secreción pancreática de bicarbonato, contribuyendo Célula efectora Localización principal Otras células con ello a neutralizar el ácido prey extensión (producto (producto secretado) sente en la luz duodenal y a crear en el estómago secretado) un pH favorable para la acción del Fundus y cuerpo Célula parietal Células enterocromafines (histamina) jugo pancreático. Además de la se75% (ácido y factor Células principales (pepsinógeno I y II) cretina, se liberan otras hormonas Glándulas intrínseco) Células D (somatostatina) oxínticas en respuesta a la presencia de graCélulas superficiales (moco sas (péptido YY, neurotensina, VIP, y bicarbonato) glucagón) y de sustancias hiperosCélulas G (gastrina) Células D (somatostatina) Antro y píloro molares (GIP) en la luz del intestino. Células principales (pepsinógeno II) Glándulas 25% Células superficiales (moco pilóricas Estas hormonas también poseen y bicarbonato) un efecto inhibidor de la SGA, denominándose por este motivo enTabla 13.1. Regiones funcionales del estómago que participan en la regulación del ácido terogastronas. 213 Práctica Clínica en Gastroenterología y Hepatología Sección IV - Estómago tostatina (inhibidora de la producción de ácido), mientras que la ausencia de ácido inhibe la secreción de somatostatina y se desarrolla hipergastrinemia compensadora. El complejo proceso de regulación de la producción de ácido se encuentra detallado en la Figura 13.3. !! RECUERDA. El pepsinógeno liberado por las células principales del cuerpo gástrico precisa de un pH ácido para su transformación en pepsina, una enzima que inicia el proceso de hidrólisis de las proteínas ingeridas con la dieta. Las propiedades mucolíticas de la pepsina incrementan la capacidad ulcerogénica del ácido, de ahí el nombre de “úlcera péptica”. Mecanismos reguladores de la secreción ácida Mecanismo protector Factores defensivos Moco Barrera física Bicarbonato Mantiene pH neutro en la mucosa Barrera mucosa Impide retrodifusión de hidrogeniones luminales Flujo sanguíneo Elimina hidrogeniones luminales Prostaglandinas (PG) Estimulan la creación de moco y bicarbonato, favorecen el flujo sanguíneo y promueven la renovación celular Ácido y pepsina Destrucción celular por causticación e hidrólisis Helicobacter pylori Citotoxinas e hipergastrinemia secundaria AINE Inhibición de la síntesis de PG Alcohol Eliminación del moco y el bicarbonato Tabaco Inhibición de flujo sanguíneo y prostaglandinas Inhibición de la liberación de secretina La mucosa gastroduodenal normal se distingue por su capacidad de defenderse de la actividad acidopéptica presente en el jugo gástrico y de reparar con rapidez el daño causado. El organismo siempre trata de guardar un equilibrio adecuado entre los factores protectores y los lesivos para conservar íntegra la mucosa gastroduodenal. Cuando existe un desequilibrio a favor de los factores agresivos, puede aparecer la enfermedad ulcerosa péptica. Los distintos factores defensivos y lesivos de la mucosa gastroduodenal se encuentran resumidos en la Tabla 13.2. Tabla 13.2. Factores defensivos y lesivos de la mucosa gastroduodenal, con sus respectivos mecanismos fisiopatológicos protectores y lesivos Los principales estimuladores de la secreción ácida son: 1) gastrina (hormonal), producida por las células G de las glándulas pilóricas antrales; 2) histamina (paracrino), producida por las células enterocromafines, presentes en la base de las glándulas oxínticas; y 3) acetilcolina (neuronal), producida por las neuronas postganglionares del sistema nervioso entérico. Por el contrario, el principal inhibidor de la secreción ácida es la somatostatina (paracrino), producida en las células D, que se encuentran presentes a lo largo de todo el estómago. Tras la ingesta de una comida, el principal estímulo para la producción de ácido proviene del nervio vago, que realiza sinapsis con neuronas postganglionares del sistema nervioso entérico (el “cerebro gástrico”), una compleja red neuronal presente en la submucosa y en el plexo mientérico. Desde este “cerebro gástrico” se estimulan directamente las células parietales y neuroendocrinas que regulan la secreción de ácido del estómago. La presencia de ácido luminal estimulará la producción de soma- Figura 13.3. Modelo ilustrativo de la regulación neuronal, paracrína y hormonal de la secreción gástrica. Las fibras eferentes del nervio vago realizan sinapsis en el sistema nervioso entérico por vía colinérgica (acetilcolina) a lo largo de toda la cámara gástrica. A nivel del fundus (glándulas oxínticas), la señal neuronal estimula directamente las células parietales e inhibe la secreción de somatostatina, eliminando su efecto inhibidor sobre las células parietales y enterocromafines: éstas últimas generan histamina, que amplifica la inhibición de la somatostatina. A nivel antral, el estímulo nervioso promueve la secreción de gastrina, la cual estimula a nivel proximal las células parietales y enterocromafines, e inhibe la secreción de somatostatina. En ambos niveles, existe regulación paracrina bidireccional entre los reguladores. Una vez liberado ácido a la luz gástrica, se restablece la secreción de somatostatina en el fundus y antro. Mecanismo lesivo Factores agresores 214 Anatomofisiología y fisiopatología del estómago y el duodeno 13 Producción de ácido en la célula parietal Todos los estimuladores de la secreción ácida poseen receptores específicos en la célula parietal, induciendo la activación de la adenilato ciclasa o AMPc (histamina) o del calcio intracelular (gastrina, acetilcolina). El principal estímulo de la secreción ácida es la gastrina, que tiene una acción directa sobre la célula parietal (receptor CCK2), a la vez que estimula este mismo receptor en las células enterocromafines, para la producción de histamina. La histamina activa la célula parietal al unirse al receptor H2 (bloqueado por los fármacos anti-H2, como la ranitidina). Por último, la acetilcolina posee un receptor muscarínico M3 activador en la célula parietal (bloqueado por los fármacos anticolinérgicos, como la atropina). !! RECUERDA. La célula parietal dispone de tres receptores distintos cuya activación promueve la secreción de ácido (receptor CCK2 estimulado por la gastrina, receptor H2 activado por la histamina y receptor muscarínico M3 activado por la acetilcolina). Figura 13.4. Modelo ilustrativo de la producción de ácido y su regulación dentro de la célula parietal. Los principales estímulos de la secreción ácida a este nivel son la gastrina (hormonal), histamina (paracrino) y la acetilcolina (neuronal). Todas estas sustancias poseen receptores específicos dentro de la célula, que pueden ser bloqueados por fármacos como la atropina (receptor M3 muscarínico) o la ranitidina (receptor H2 de la histamina). La gastrina y la acetilcolina provocan un aumento de Ca2+ citoplasmático, mientras que la histamina induce la producción de AMPcíclico. Las señales intracelulares convergen finalmente en la activación de la bomba de protones H+K+-ATPasa que dona H+ a la luz (que al unirse al Cl da lugar al ácido clorhídrico) e introduce K+ a la célula. Los inhibidores de la bomba de protones (por ejemplo, omeprazol) actúan bloqueando dicha bomba H+K+-ATPasa. LECTURAS RECOMENDADAS Una vez activados los distintos mecanismos intracelulares en la célula parietal, se activan proteínas cinasas que estimulan finalmente la bomba H+K+-ATPasa, comúnmente conocida como bomba de protones. La bomba de protones es una enzima de la célula parietal que consta de dos subunidades (α y β) y regula el intercambio de K+ luminal y H+ citoplásmico. El ácido es sintetizado dentro de la célula parietal mediante la hidratación del CO2, para formar H+ y HCO3–. Cada hidrogenión (H+) liberado a la luz gástrica es intercambiado por la bomba de protones por un ión potasio (K+), que pasa al interior celular. Los iones HCO3– (bicarbonato) son permutados por iones Cl– por un intercambiador iónico existente en la membrana lateral, pasando el bicarbonato rápidamente a la sangre (marea alcalina) y el Cl– a la célula, desde donde se libera a la luz para formar el ácido clorhídrico junto al H+. Los mecanismos receptores, los reguladores y los distintos eventos en la producción de ácido en la célula parietal se representan en la Figura 13.4. !! RECUERDA. Cada hidrogenión (H+) liberado a la luz gástrica es intercambiado por la bomba de protones por un ión potasio (K+), que pasa al interior celular. Este paso es catabolizado por la enzima ATP-asa H+/K+. Su inhibición explica el poder antisecretor de los inhibidores de la bomba de protones. Schubert ML, Peura DA. Control of gastric acid secretion in health and disease. Gastroenterology 2008; 134: 1842-1860. Feldman M. Secreción ácida. En: Sleisenger y Fortrand (eds). Enfermedades digestivas y hepáticas. Fisiopatología. Diagnóstico y Tratamiento. Madrid, Elsevier, 2008: 1029-1048. 13.3. Fisiopatología de la secreción ácida Estados hiposecretores e hipersecretores Las principales entidades clínicas que pueden condicionar hiposecreción e hipersecreción ácida, con su mecanismo fisiopatológico asociado, están descritas en la Tabla 13.3. • La hipoclorhidria, independientemente de la causa original, puede condicionar maldigestión, malabsorción de proteínas, lípidos, hierro (ferropenia), calcio (hipocalcemia), magnesio (hipomagnesemia) y vitamina B12, y aumento del riesgo de sobrecrecimiento bacteriano intestinal e infecciones entéricas. 215 Práctica Clínica en Gastroenterología y Hepatología Sección IV - Estómago Enfermedad o condición clínica Hiposecreción ácida Base fisiopatológica Gastritis atrófica Destrucción autoinmune de las células parietales Fármacos antiH2 Bloqueo receptor H2 en la célula parietal Fármacos IBP Bloqueo de la bomba H+K+-ATPasa en la célula parietal Síndrome de Zollinger-Ellison Tumor productor de gastrina (gastrinoma) Infección crónica por: · H. pylori Hipergastrinemia · Hiperplasia células G Hipersecreción ácida · Síndrome del antro retenido · Síndrome de intestino corto · Hipergastrinemia por exposición alcalina mantenida de glándulas pilóricas residuales postgastrectomía · Fallo en la liberación de enterogastronas intestinales inhibidoras de la secreción ácida Enfermedad celíaca Fallo en la liberación de secretina y enterogastronas intestinales por atrofia vellositaria · Tumor carcinoide · Mastocitosis sistémica Hiperhistaminemia Tabla 13.3. Principales enfermedades o medicaciones que condicionan estados hipo e hipersecretores gástricos, con su mecanismo fisiopatológico asociado • • • • Los pacientes ancianos pueden presentar un estado hiposecretor mantenido multifactorial (toma de inhibidores de la bomba de protones [IBP] como gastroprotectores, ante la gastritis crónica atrófica) que, junto con la inmunosenescencia y el fallo de aclaramiento bacteriano intestinal secundario a enfermedades comunes como la diabetes o el Parkinson, pueden condicionar el desarrollo de diarrea crónica. Las consecuencias de la malabsorción de hierro y de vitamina B12, secundaria a la hiposecreción gástrica de ácido, también son comunes en el anciano y deben ser tenidas en firme consideración. La hipersecreción ácida, definida por una producción basal de ácido superior a 15 mEq/h, se encuentra asociada especialmente a la úlcera duodenal (con o sin infección por H. pylori concomitante, aunque no todos los ulcerosos presentan niveles incrementados de SGA), el síndrome de ZollingerEllison, el síndrome del antro retenido, el síndrome de intestino corto, la enfermedad celíaca, la hiperplasia de las células G y la mastocitosis. La presencia de un marcado incremento de la SGA (por ejemplo, en el síndrome de Zollinger-Ellison) puede producir ulceraciones de localización atípica en el esófago, el estómago y el intestino delgado proximal y distal, así como diarrea y malabsorción debido a la acción irritativa del ácido, la neutralización del bicarbonato y la inactivación de las enzimas pancreáticas (véase más arriba). La infección aguda por H. pylori condiciona un periodo transitorio de hipoclorhidria, mientras que la infección crónica a menudo eleva los niveles de secreción ácida basal y se ve estimulada, probablemente, por hipergastrinemia y, de manera muy especial, en pacientes con úlcera duodenal. La erradicación del microorganismo hace que la producción de ácido regrese a sus niveles normales pasado un año aproximadamente del tratamiento erradicador. • La hipergastrinemia mantenida asociada a las gastritis autoinmunes (hiposecreción ácida) y al síndrome de Zollinger-Ellison (hipersecreción ácida) puede condicionar hiperplasia, displasia y, eventualmente, neoplasia (tumor carcinoide) por hiperestimulación crónica de las células enterocromafines. • Las consecuencias del déficit de producción de factor intrínseco por parte de las células parietales en la gastritis crónica autoinmune (hipoclorhidria o aclorhidria, hipergastrinemia, malabsorción de vitamina B12, anemia perniciosa y neuropatía) son estudiadas en otra sección de esta obra. Fármacos inhibidores de la bomba de protones Los inhibidores de la bomba de protones (IBP; omeprazol, pantoprazol, lansoprazol, rabeprazol, esomeprazol) son los fármacos más comúnmente utilizados para suprimir la secreción ácida del estómago. Son bases débiles (pKa 4-5) que se mantienen en su forma inactiva, no protonizados, al pasar a sangre (pH 7,4). Sin embargo, a su paso por el canalículo secretor de la célula parietal (pH 1), el 99,9% del fármaco se protoniza y queda atrapado en su forma ionizada activa, lo que le permite inactivar la bomba H+K+-ATPasa mediante la unión covalente a la subunidad α. Dado que la bomba de protones es el último paso en la secreción de ácido, los IBP son las moléculas más eficaces ya que inhiben la producción de H+ ácida sea cual sea el estímulo sobre la célula parietal (gastrina, histamina o acetilcolina). Un medio ácido es, por tanto, imprescindible para el atrapamiento y la activación de los IBP en la célula parietal, y cuanto más ácido sea el medio, más eficaz será el fármaco. La eficacia de los IBP puede verse notablemente reducida si se administra durante la comida o en el periodo postprandial, cuando el pH ácido gástrico ya ha sido modificado por los alimentos. El momento en el que la producción basal de ácido es superior tiene lugar tras el descanso nocturno, en el que han pasado 6-8 h de ayuno. En consecuencia, los IBP deben ser administrados entre media y una hora antes del desayuno y, si se precisara, una segunda dosis antes de la cena. La causa más frecuente de ineficacia de los IBP es su toma inadecuada en relación con las comidas. Ya se ha mencionado la necesidad de monitorizar niveles de hierro, calcio, vitamina D, magnesio y vitamina B12 en pacientes que reciben una terapia de mantenimiento a largo plazo con IBP. 216 Anatomofisiología y fisiopatología del estómago y el duodeno 13.4. Anatomía y fisiología de la función motora gástrica El estómago se distingue por su capacidad para alojar y almacenar la comida ingerida, moler o triturar las partículas sólidas y vaciarlas al duodeno de manera controlada. En este proceso de digestión, aparte del ácido y las proteasas, desempeña un papel clave la musculatura especializada del estómago, el píloro y el duodeno. Para esta función y, a diferencia del resto del tubo digestivo, el estómago posee una gruesa capa de músculo liso, dispuesto en tres capas principales con fibras en distintos ejes: circular, oblicua y longitudinal. El control de la función motora normal del estómago se encuentra regulado a tres niveles principales: • El sistema nervioso autonómico (parasimpático y simpático). La inervación parasimpática proviene del nervio vago, que conecta el tronco cerebral con el estómago, realizando conexión sináptica en el plexo mientérico y submucoso, pero no de forma directa en el músculo. El neurotransmisor más importante de esta vía es la acetilcolina. La inervación simpática viene de la región torácica (T5-T10) de la médula espinal, que accede al estómago a través de los ganglios celíacos. El neurotransmisor más importante de este sistema es la noradrenalina. • • El sistema nervioso entérico. Se trata de una extensa red de plexos, localizados en las capas submucosa y muscular, que interconectan los estímulos extrínsecos (vía parasimpática y simpática) y las aferencias sensoriales luminales. El plexo muscular profundo se compone de células intersticiales de Cajal, principales generadoras de la actividad motora gástrica, que dirigen hacia las células del músculo liso. De hecho, los defectos celulares más comúnmente encontrados en la gastroparesia son la pérdida de expresión neuronal de las células de Cajal y del óxido nítrico. Las propias células del músculo liso gástrico. Poseen receptores específicos de membrana para múltiples péptidos y neurotransmisores. El “marcapasos gástrico”, que controla la coordinación motora entre el fundus y antro, se encuentra localizado en la porción media de la curvatura mayor. Este marcapasos tiene un patrón eléctrico característico de tres ciclos de ondas lentas por minuto, creados por las células intersticiales de Cajal, las cuales avanzan en sentido longitudinal y circunferencial con dirección distal. En ayunas, el patrón característico de motilidad gástrica es el complejo mayor migratorio, compuesto de tres fases: fase I (inactividad motora), fase II (actividad irregular) y fase III (contracciones fásicas regulares), que comienzan y terminan simul- 13 táneamente en todos los puntos sin propagarse. Este patrón motor en ayunas genera una actividad contráctil a nivel antral que permite el vaciamiento de las partículas no digeribles, cuyo tamaño no ha podido ser reducido por la trituración de la comida anterior. Al ingerir una nueva comida, se pone en marcha una secuencia de acontecimientos que ocurren en tres áreas motoras claves para el normal funcionamiento del vaciamiento gástrico, a través del píloro y el duodeno: • Estómago proximal (fundus y cuerpo alto). Realiza funciones de reservorio. A la llegada del alimento, los receptores de tensión del estómago proximal desencadenan una pérdida de tono muscular (relajación receptiva), mediada por el nervio vago, la cual se mantiene posteriormente (relajación adaptativa). Esta pérdida de tono hace que el volumen del estómago se duplique o triplique para permitir la llegada de la comida (reflejo de acomodación). Debido a la pérdida de tono, el contenido sólido queda retenido a nivel proximal, donde se inicia la digestión al entrar en contacto el ácido y la pepsina, mientras que la mayoría del líquido suele pasar de manera pasiva al estómago distal. Durante el periodo postprandial acontece una recuperación progresiva del tono del estómago proximal, lo cual facilita la propulsión distal de los alimentos sólidos, una vez eliminado el líquido a nivel distal. La distensión antral (reflejo gastrogástrico) produce un estímulo retrógrado que favorece la relajación del fundus. • Estómago distal (antro y cuerpo distal). La llegada del alimento elimina el complejo motor migratorio y se inicia un patrón prandial, que genera contracciones de gran amplitud –habitualmente tres por minuto–, para la trituración, la pulverización y el vaciamiento del alimento sólido. Este “molinillo antral” propulsa el contenido sólido en dirección anterógrada y retrógrada de manera reiterada, hasta que las partículas sólidas alcanzan un tamaño inferior a 1 mm, aptas para su paso a través del píloro. La velocidad de vaciado gástrico se ve ralentizada por el mayor volumen, osmolaridad, acidez o contenido graso del alimento ingerido. A nivel extragástrico, la presencia de grasa en el íleon (freno ileal), la distensión del colon y la hiperglucemia también frenan el vaciamiento del estómago. • Píloro. Se trata de un esfínter de presión alta en reposo, al que se sobreponen las contracciones antrales, que se continúan por el esfínter pilórico y el duodeno, constituyendo una contracción simultánea y coordinada de toda la unión antroduodenal. Al contrario de lo que se suele pensar, la llegada de una contracción peristáltica antral no se acompaña de una apertura del píloro, sino que éste se cierra atrapando los líquidos y sólidos en el antro terminal. El peristaltismo comprime con fuerza el contenido antral mientras el píloro está cerrado, triturando el contenido sólido. El paso transpilórico del alimento suele acontecer entre contracciones 217 Práctica Clínica en Gastroenterología y Hepatología Sección IV - Estómago • antrales, momento en que el píloro se mantiene abierto y permeable. Duodeno. Debido a su tamaño, su actividad motora es más frecuente que la del antro gástrico (12 contracciones por minuto). El duodeno posee sensores luminales de pH, concentración osmótica, grasa y proteínas cuya función es regular el volumen de contenido que accede al duodeno. Si la concentración de grasas, hidratos de carbono o proteínas es demasiado alta en el duodeno, o bien el pH es excesivamente ácido, se cierra el píloro con un patrón de contracciones rítmicas, bien con cadencia antral (tres por minuto) o duodenal (12 por minuto), que evita la sobrecarga de alimento en el duodeno. La distensión o perfusión con grasas del duodeno condiciona igualmente la relajación retrógrada del fundus. !! RECUERDA. Una concentración elevada de glúcidos, grasas y proteínas o una carga excesiva de ácido favorece el cierre del píloro con un patrón de contracciones rítmicas que evita la sobrecarga de alimento en el duodeno, condicionando, a su vez, un retraso en el vaciamiento. 13.5. Fisiopatología de la función motora gástrica Aceleración del vaciamiento gástrico de la comida. Los síntomas tempranos se deben a la malabsorción precoz de hidratos de carbono, la incorporación de líquido desde el espacio vascular al intestino (diarrea osmótica) y la liberación de hormonas vasoactivas (serotonina, VIP), mientras que la hipoglucemia tardía es secundaria a la liberación patológica de enteroglucagón en respuesta a la presencia de elevadas concentraciones de carbohidratos en la luz del intestino delgado, y la consiguiente secreción endógena de insulina y adrenalina. !! RECUERDA. El síndrome de vaciamiento rápido postgrastrectomía (o postvagotomía; síndrome de dumping) conduce tanto a síntomas precoces –dependientes primordialmente de la atracción osmótica de fluido desde el compartimento vascular a la luz intestinal– como tardíos –dependientes de la liberación de sustancias vasoactivas (VIP, serotonina), insulina y adrenalina–. Retraso del vaciamiento gástrico o gastroparesia El retraso patológico del vaciamiento gástrico, sin una causa mecánica que lo justifique, puede ser multifactorial y a menudo es causa de náuseas, vómitos, saciedad precoz, distensión y dolor abdominal e incluso pérdida ponderal. En la Tabla 13.4 se exponen las causas más comunes de gastroparesia y su correlación fisiopatológica. La causa más común es la idiopática (36%), si bien la más reconocible en la práctica clínica es la gastroparesia diabética (29%), en la que se puede afectar la relajación fúndica, la actividad propulsiva antral y la relajación pilórica. En estos pacientes la endoscopia permite ver, a menudo, restos alimentarios retenidos en la luz gástrica tras una fase de ayuno prolongado pese a que no existe una causa mecánica que oponga resistencia al vaciado del alimento. Este síndrome puede acontecer en el 10% de las gastrectomías (habitualmente gastrectomías Billroth I y II) y en el 1% de las vagotomías, y se produce por la rápida llegada de alimento no diFunción motora Patologías gerido y de contenido hiperosmolar al intestino delgado. El mecanismo que · Vagotomía · Relajación receptiva subyace en este síndrome es multifacEstómago proximal · Funduplicatura y adaptativa (fundus y cuerpo · Gastrectomía torial e incluye la pérdida de relajación · Almacenamiento alto) · Diabetes mellitus receptiva (vagotomía), la pérdida del · Propulsión distal · Dispepsia funcional reservorio gástrico proximal y la au· Gastroparesia idiopática sencia de control pilórico (gastrectoEstómago distal · Mezcla y pulverización · Diabetes mellitus (cuerpo bajo de alimento sólido mía). La presentación clínica de este · Esclerosis sistémica y antro) · Propulsión distal síndrome comprende manifestaciones · Dispepsia funcional precoces (“dumping temprano”), como Coordinación motora entre antro · Hipertrofia idiopática del píloro Píloro dolor abdominal, cólico, náuseas, bory duodeno · Diabetes mellitus borigmos, diarrea y diaforesis (10-20 · Vaciamiento del contenido Pseudoobstrucción intestinal min tras la ingesta), o tardías (“dumping Duodeno gástrico al intestino delgado crónica distal tardío”), especialmente hipoglucemia, diaforesis, hipotensión y taquicardia, Tabla 13.4. Regiones motoras del estómago y el duodeno, junto a las patologías que con mayor frecuencia afectan a cada nivel produciendo retraso del vaciamiento gástrico o gastroparesia. que pueden aparecer a los 90-120 min 218 Anatomofisiología y fisiopatología del estómago y el duodeno La dispepsia funcional, tipo estrés postprandial, es aquélla en la que los pacientes presentan síntomas de gastroparesia, sin evidencia de enfermedad orgánica en los estudios realizados. En estos pacientes se ha documentado la existencia de alteraciones a nivel motor (reducción de la distensibilidad fúndica, hipomotilidad antral, tránsito lento de intestino delgado), pero igualmente alteraciones sensitivas como hipersensibilidad a la distensión gástrica o duodenal. En el Tema 14 (Síntomas y signos de enfermedad gastroduodenal) se expone con mayor detalle la patogenia, la presentación, el diagnóstico y el tratamiento de la dispepsia funcional. !! RECUERDA. En la dispepsia funcional coexisten a menudo diversas alteraciones motoras, incluyendo un fracaso de los mecanismos de relajación adaptativa a nivel fúndico, una hipomotilidad antral y un tránsito lento en intestino delgado. Estas alteraciones, a menudo, coexisten con alteraciones en la percepción visceral (hipersensibilidad e hiperalgesia) que ejercen un efecto modulador sobre la percepción sintomática. LECTURAS RECOMENDADAS Tack J. Gastric motor disorders. Best Pract Res Clin Gastroenterol. 2007; 21: 633-644. Camilleri M, Parkman HP, Shafi MA, Abell TL, Gerson L. American College of Gastroenterology. Clinical guideline: management of gastroparesis. Am J Gastroenterol 2013; 108: 18-37 Oh JH, Pasricha PJ. Recent advances in the pathophysiology and treatment of gastroparesis. J Neurogastroenterol Motil 2013; 19: 18-24. 13 Bibliografía Camilleri M, Parkman HP, Shafi MA, Abell TL, Gerson L. American College of Gastroenterology. Clinical guideline: management of gastroparesis. Am J Gastroenterol 2013; 108: 18-37. Feldman M. Secreción ácida. En: Enfermedades digestivas y hepáticas. Sleisenger y Fordtran. Madrid, Elsevier, 2008: 10291048. Oh JH, Pasricha PJ. Recent advances in the pathophysiology and treatment of gastroparesis. J Neurogastroenterol Motil 2013; 19: 18-24. Russo MA, Redel C. Anatomy, Histology, Embriology and Develomental Anomalies of the Stomach and duodenoum. En: Pathophysiology, Diagnosis and Management (8th edition). Feldman M, Friedman L and Brandt L (eds). Sleisenger & Fordtran-Gastrointestinal and Liver Disease. Saunders-Elsevier, 2006: 981-998. Semrin MG, Russo M. Anatomy, Histology, Embriology and Develomental Anomalies of the Stomach and duodenoum. En: Pathophysiology, Diagnosis and Management (9th edition). Feldman M, Friedman L and Brandt L (eds). Sleisenger & Fordtran-Gastrointestinal and Liver Disease. Saunders-Elsevier, 2010: 773-788. Schubert ML, Peura DA. Control of gastric acid secretion in health and disease. Gastroenterology 2008; 134: 1842-1860. Tack J. Gastric motor disorders. Best Pract Res Clin Gastroenterol 2007; 21: 633-644 219