Relación entre el sistema inmune y la esquizofrenia
Anuncio

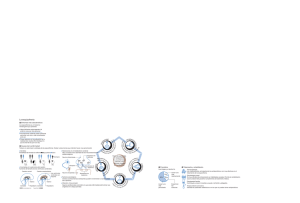
Relación entre el sistema inmune y la esquizofrenia ■ La participación del sistema inmunológico en la etiolo- gía de la esquizofrenia es un tema que ha despertado interés desde hace tiempo. A mediados del siglo pasado se intentaron estudiar aspectos tales como la cuantificación de leucocitos en los pacientes, o bien se buscó determinar el efecto de los antipsicóticos sobre el sistema inmune. Posteriormente surgió la hipótesis viral de la enfermedad, sustentada en parte en las confirmaciones epidemiológicas de que el riesgo de padecerla se incrementaba en aquellos individuos nacidos durante los meses invernales. Hace más de dos décadas aparecieron las primeras evidencias que sugerían la posibilidad de una etiología autoinmune mediada posiblemente por una exposición viral prenatal. Recientemente, debido a los avances obtenidos en la comprensión a nivel celular de la complejidad del sistema inmunológico, resurge el interés en estudiar esta área al identificarse que si bien las alteraciones de la vías dopaminérgicas están presentes en la esquizofrenia, existen mecanismos subyacentes en el sistema del glutamato los cuales están modulados a su vez por procesos inmunológicos. Los trabajos iniciales sobre esta interacción generaron poca información debido a la falta de replicación de sus hallazgos, así como por el reducido tamaño de sus muestras. Estas limitaciones empiezan a superarse en la actualidad con los datos que aportan los estudios de meta-análisis los cuales confirman la importancia de la interacción entre la esquizofrenia y el sistema inmune. Aspectos básicos del sistema inmunológico El sistema inmunológico le permite al organismo adoptar mecanismos de defensa contra microorganismos que amenazan su homeostasis. Ahora se reconoce que este sistema es mucho más complejo y más diferenciado de lo que antes se pensaba. La respuesta inmune es un proceso altamente coordinado que involucra la participación de varios tipos celulares que protegen al organismo de los factores patógenos y, al mismo tiempo, mantienen una condición de tolerancia tanto para los auto-antígenos como para los antígenos inofensivos del ambiente. Tradicionalmente se le divide en dos tipos: el sistema inmune innato y el adaptativo, cada uno de ellos con sus componentes celulares y humorales los cuales constantemente intercambian información. Al innato pertenecen los mecanismos primarios que son producto de la evolución y que conforman la primera línea de defensa. Sus componentes celulares incluyen a los monocitos y a los macrófagos, a las células dendríticas y a Vol. 25, Número 4, Abril 2014 las células NK (siglas que corresponden a la denominación “natural killer” en idioma inglés). Estas reconocen a los patógenos y promueven la defensa en su contra, sin embargo no presentan las características más finas de otros componentes inmunológicos que permiten capacidad de adaptación. Por lo que respecta a su componente humoral, éste está conformado por las proteínas de fase aguda (como la proteína C reactiva), la cascada de complementos que le permite a las células fagocitarias eliminar a los patógenos del organismo y a varias citocinas. La cascada de complemento está integrada por pequeñas proteínas de síntesis hepática que normalmente circulan como precursores inactivos. Cuando se les activa dan por resultado una acción masiva amplificada de los mecanismos de muerte celular. Por su parte, las citocinas son proteínas de bajo peso molecular que actúan como clave de señalización para coordinar ambos componentes del sistema inmune. El segundo elemento del sistema inmune es el sistema adaptativo el cual está más organizado y tiene un mayor nivel de complejidad; su actividad básica es sobre la memoria inmunológica, la re-exposición y la capacidad de generar una respuesta condicionada. Sus componentes celulares incluyen a los linfocitos o células T y B. Dentro de las células T se incluyen a los componentes de los denominados sistema T cooperador 1 (Th1) y T cooperador 2 (Th2). El Th1 produce a las citocinas pro inflamatorias tales como la interleucina 2 (IL-2), el interferón gamma (IF-γ) y el factor de necrosis tumoral alfa (TNF-α). El sistema Th2 promueve la generación y mantenimiento de las respuestas inmunes mediadas por anticuerpos así como la producción de citocinas anti inflamatorias tales como IL-4, IL-10 e IL-13. Con respecto a su componente humoral, en éste se incluyen a las citocinas circulantes y anticuerpos específicos. Recientemente se han identificado como parte del componente humoral a las células supresoras T y otras células T cooperadoras. En la figura 1 se muestra una representación esquemática de los procesos de inmunidad celular. La teoría inmunológica de la esquizofrenia La teoría de las citocinas en la esquizofrenia propone que, en individuos con predisposición genética a la enfermedad, la exposición a las infecciones virales maternas durante la etapa fetal interfiere con el desarrollo normal del cerebro debido a la respuesta inmune a la infección. Diversos estudios en modelos animales han encontrado que no es por exposición a un virus en particular, sino que es la reacción inmune general la que determina el riesgo. Se ha comprobado que las citocinas intervienen en el proceso de sinaptogénesis tanto en el periodo del desarrollo como en los periodos de plasticidad neural de la etapa adulta. Por 37 Sistema inmunológico celular Neutrófilos Eosinófilos Basófilos Células mononucleares periféricas Linfocitos Células B Células B sin memoria CD5 +VB CD5 -VB Monocitos Cél. dendríticas mieloideas Células NK Células T Células B con memoria IgG IgA IgE Células T CD4 Th2 Th1 Th1 7 Th2 2 Células dendriticas plasmoides Células Tc CD8 IgE nTreg Células T NK Tf1 Figura 1. Representación esquemática de los procesos de inmunidad celular. consiguiente, la infección materna modifica el balance de las citocinas o bien activa a la microglía, lo cual generará alteraciones que van a ser evidentes en etapas posteriores. Se han identificado como de riesgo para esquizofrenia al virus de la influenza, al borna y a los de clamidia y toxoplasma. Las infecciones generan influencias directas sobre el desarrollo cerebral del feto por medio de un mecanismo común relacionado con la respuesta inmune materna. De igual manera, la exposición prenatal a una respuesta inflamatoria temprana imprime una huella que producirá reacciones inmunológicas más vigorosas, o bien atípicas, cuando se presenten exposiciones ambientales posteriores. De esta forma, la exposición a infecciones prenatales seguirá produciendo alteraciones en etapas subsecuentes de la vida como por ejemplo en la adolescencia, la cual es una fase de importante plasticidad neuronal. Las evidencias que demuestran que esta respuesta inmunológica anormal genera alteraciones que favorecen el desarrollo de esquizofrenia se han agrupado en tres hipótesis principales: 1) hipótesis de los macrófagos y linfocitos T crónicamente activados; 2) hipótesis del desbalance del sistema T cooperador; 3) hipótesis de la microglía. La primera hipótesis postula que, con el tiempo, la activación crónica de macrófagos y de linfocitos T liberan citocinas inflamatorias que, a su vez, llevan a cambios neuronales. Los monocitos con marcadores CD54 se pegan a las moléculas intracelulares, facilitando una migración de más monocitos a través de las células endoteliales de los vasos. Varios estudios han identificado que los pacientes en fases activas de psicosis tienen un incremento significativo de la cuenta leucocitaria total y mayores proporciones de linfocitos CD8, CD4 y DC56. En los pacientes bajo tratamiento las cifras de los dos primeros se reducen. Estos 38 datos hacen pensar a los investigadores en este campo que cuando las concentraciones elevadas de citocinas se mantienen por mucho tiempo, se generan alteraciones en los sistemas de neurotransmisión de dopamina y de GABA. Se propone entonces que en la esquizofrenia, desde el punto de vista inmune, existe un marcador de estado relacionado al balance DC4/CD8 y un marcador de rasgo relacionado a la concentración de CD56. La hipótesis del desbalance del sistema T cooperador sostiene que en los pacientes se genera un desbalance Th1 y Th2 con un predominio del último. Como ya se mencionó, el Th1 produce a las citocinas pro inflamatorias mientras que el Th2 promueve la generación y mantenimiento de las respuestas inmunes mediadas por anticuerpos. Finalmente, la hipótesis microglial se basa en el conocimiento de que los activadores de las citocinas inflamatorias (como IF-γ) activan a la microglía. Como se sabe, la microglía está conformada por los fagocitos mononucleares del cerebro, los cuales participan en el desarrollo cerebral, en la sinaptogénesis y en la poda sináptica. Su activación libera citocinas que van a producir degeneración neuronal, anormalidades de la sustancia blanca y una reducción de la neurogénesis. Algunos investigadores consideran que el estado hipoglutamatérgico y las alteraciones de señalización del receptor NMDA, que se han identificado en la esquizofrenia, son el resultado del exceso de activación inmune. Por ejemplo, se ha comprobado que el administrar ketamina (un antagonista del receptor NMDA) se activa la microglía y se producen síntomas psicóticos. También está comprobado que los antipsicóticos atípicos reducen los niveles séricos de citocinas lo cual sugiere que parte de sus efectos farmacológicos pudiesen estar mediados por esta acción de tipo antiinflamatoria sobre el sistema microglial. Vol. 25, Número 4, Abril 2014 La esquizofrenia como una enfermedad autoinmune pan en forma importante alteraciones del sistema inmune. Sin embargo, el aspecto de mayor importancia es determinar si el avance en estos conocimientos se puede traducir en mejores alternativas de tratamiento. Hay algunos estudios iniciales que muestran que con el uso de fármacos inmunomoduladores tales como la cicloxigenasa 2 (COX-2) se pueden obtener resultados promisorios. En la actualidad se está estudiando a la minociclina, un antibiótico con efectos antiinflamatorios y neuroprotectores como posible tratamiento antipsicótico particularmente para los síntomas negativos. Sin embargo, no debe dejarse a un lado el concepto de la esquizofrenia como un padecimiento de causas múltiples. Es seguro que en la medida en que se avance en el conocimiento del sistema inmune y de su codificación genética, se podrán encontrar nuevos elementos para entender cómo las alteraciones de este sistema generan manifestaciones de tipo psicótico. En los futuros estudios se deberá considerar el efecto que pueden tener otras variables tales como la precisa definición fenotípica, el tabaquismo, el peso y sobre todo el efecto de los antipsicóticos. Es por ello que la información más adecuada deberá originarse a partir de estudios con muestras de sujetos con un primer episodio de psicosis. El estudio del sistema inmune es, con toda seguridad, un campo que no deberá perderse de la visión integral de las neurociencias y de la psiquiatría en particular. A lo largo del tiempo se ha establecido una relación clínica entre enfermedades autoinmunes y la esquizofrenia. Por ejemplo, se sabe que la esquizofrenia se presenta con mayor frecuencia en familiares con antecedentes de padecimientos tales como la psoriasis, la enfermedad de Graves o la enfermedad celiaca. Por otra parte, como ya se mencionó, la hipótesis del desbalance del sistema T cooperador sugiere que en la esquizofrenia se da una sobreactividad del brazo productor de auto-anticuerpos del sistema inmune. Por consiguiente, en su conjunto estos datos sugieren que hay evidencia sustancial para considerar a la enfermedad como resultado de una reacción autoinmune. Esta evidencia se ha fortalecido recientemente con la identificación del síndrome de encefalitis autoinmune (enfermedad con síntomas neuropsiquiátricos), pero sobre todo porque se ha identificado que este padecimiento genera alteraciones en el funcionamiento de los receptores NMDA, lo que se corresponde con una de las hipótesis neurobiológicas de la esquizofrenia. En la actualidad se puede diagnosticar a la encefalitis autoinmune por medio de diversos análisis que detectan la presencia de anticuerpos responsables del cuadro. Entre ellos se incluye a los antígenos de proteínas sinápticas como los del receptor NMDA y del GABA, así como antígenos de superficie como el del canal de potasio dependiente de voltaje. Esto ha llevado a considerar que Bibliografía puede ser importante la prevalencia de cuadros psicóticos de origen autoinmune. Se calcula que del total de pacientes UPTHEGROVE R, BARNES N M: The immune system and schizophrecon un primer episodio de psicosis, el 10% podría perte- nia: an update for clinicians. Adv Psychiatr Treat, 20:83-91, 2014. necer a esta causa. De hecho hay reportes de tratamientos FINEBER AM, ELLMAN LM: Inflammatory cytokines and neurological and neurocognitive alterations in the course of schizophrenia. Biol exitosos con el uso de inmunomoduladores, de inmunog- Psychiatry, 73:951-966, 2013. lobulinas intravenosas y de otros procedimientos de inmu- RICKARDS HE, JABOS S, LENNO B y cols.: Autoimmune encephalitis: a potentially treatable cause of mental disorder. Adv Psychiatr Treat, nosupresión. En conclusión, los avances más recientes sobre la fisio- 20:92-100, 2014. patología de la esquizofrenia sugieren que en ésta partici- Vol. 25, Número 4, Abril 2014 39