composición química de los seres vivos - Educa Ciencias TIC
Anuncio

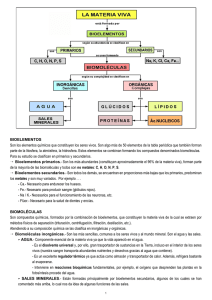
BIOELEMENTOS Y BIOMOLÉCULAS INORGÁNICAS INTRODUCCIÓN El análisis químico de la materia viva revela una gran similitud para todos los organismos, tanto animales como vegetales. Lo mismo ocurre, en general, con las reacciones químicas que se llevan a cabo con tales sustancias. Esta homogeneidad química es de gran importancia para abordar el problema del origen de la vida, ya que uno de los argumentos más sólidos a favor de la unidad de origen y procedencia de los seres vivos es su similitud a nivel molecular. Los elementos químicos que forman parte de los seres vivos se denominan bioelementos. No obstante, rara vez, se encuentran en estado libre. En general, se combinan entre sí para formar sustancias más complejas (moléculas) denominadas biomoléculas principios inmediatos (P.I.). Dentro de ellos, distinguimos entre biomoléculas o P.I. inorgánicos, más simples (de bajo peso molecular), y las biomoléculas o P.I. orgánicos, más complejos. Estos últimos tienen algo en común, todos están compuestos por unidades básicas denominadas monómeros. La asociación de estos monómeros para formar moléculas más complejas es un proceso conocido como polimerización; en el que los compuestos básicos (monómeros) se asocian para formar compuestos más complejos (polímeros) por medio de enlaces químicos. Así, los glúcidos están compuestos por monosacáridos, las proteínas por aminoácidos… 1. BIOELEMENTOS Las biomoléculas están formadas por cuatro elementos básicos: C,H, O y N. Estos elementos suman en conjunto el 96% de los seres vivos, se les denomina bioelementos primarios. Estos elementos presentan una serie de ventajas: - Abundan en las capas más externas de la Tierra. Por lo que seres vivos los pueden conseguir fácilmente - Estos elementos establecen entre sí enlaces estables, aunque se pueden romper con relativa facilidad dando lugar a otras moléculas. - El C puede formar con mucha facilidad grandes cadenas, lo que permite conseguir la enorme diversificación y complejidad molecular que la materia viva requiere. Los restantes elementos químicos que intervienen en la composición de la materia se denominan bioelementos secundarios. Los más importantes son: P, Ca, K, Cl, Na, S y Mg. Las funciones de estos bioelementos secundarios son muy variadas, así el Ca aparece en esqueletos y caparazones de organismos. Na, K y Cl aparecen en forma iónica en los líquidos internos, jugando un papel fundamental en el equilibrio osmotico y en la transmisión del impulso nervioso. Los elementos químicos que aparecen en cantidades muy pequeñas, menor del 0,1%, se consideran elementos vestigiales, también llamados oligoelementos. A pesar de su escasez, su papel puede ser muy imprtante, tal es el caso del hierro que es parte esencial de la molécula de hemoglobina o el cobre de la molécula de hemocianina (pigmentos de la sangre de artrópodos). 1 Biología y Geología (1º Bachillerato) 2. BIOMOLÉCULAS INORGÁNICAS 2.1 AGUA Es el principal compuesto de los seres vivos, representa del 70 al 100% del ser vivo, aunque este porcentaje varía bastante de un organismo a otro y según la clase de órgano que se considere. La molécula de agua es polar. Muchas de las propiedades que presenta el agua derivan de este hecho. La polaridad se debe a la asimetría de su molécula. Ésta favorece la aparición de enlaces de puente de Hidrógeno entre moléculas. Características fundamentales del agua • Alto poder disolvente y elevada fuerza de cohesión entre sus moléculas debido a los puentes de Hidrógeno. Esta última característica es aprovechada por las plantas para ascender la savia a las hojas. • Elevado calor específico. Esto lo convierte en un excelente estabilizador térmico del organismo frente a cambios bruscos de temperatura. Funciones del agua en los seres vivos • Función transporte de sustancias. Esta función se ve favorecida por su alto poder disolvente. • Función termoreguladora. El agua actúa como agente regulador de la temperatura manteniéndola constante en el cuerpo. • Función mecánica-amortiguadora. Su reducida viscosidad favorece el desplazamiento de órganos lubricados por líquidos ricos en agua. Por ejemplo, el líquido sinovial que evita el roce entre los huesos. • Función estructural. El volumen y forma de las células se mantiene gracias a la presión que ejerce el agua en su interior. 2.2 SALES MINERALES En todos los seres vivos se encuentran siempre determinadas cantidades de sales minerales. Entre ellas destacan los cloruros, fosfatos y bicarbonatos de Na +, K+, Ca2+ y Mg2+. Las sales pueden agruparse en tres categorías con funciones distintas: • Sólidas. Como los componentes de los huesos, con una misión claramente estructural. Es típico de este grupo el fosfato de Calcio. • En solución. Generalmente se encuentran ionizadas jugando un papel importante en los procesos fisiológicos. Los aniones más importantes son: Cl-, CO32-, PO42-, CO3H-, SO42-, NO3-, etc. Los cationes más frecuentes son: K+, Na+, Mg2+, y Ca2+ . • Combinadas con moléculas orgánicas como ocurre en fosfolípidos, proteínas, etc. Las sales minerales desempeñan en los seres vivos numerosas funciones: estructural, impulso nervioso, intervienen en fenómenos de contracción muscular, etc. Pero de una forma particular merecen mención dos funciones (llevadas a cabo por las sales en solución) 2 Biología y Geología (1º Bachillerato) - Regulación de los fenómenos osmóticos. - Regulación del equilibrio ácido-base. Regulación de los fenómenos osmóticos. Cuando dos soluciones salinas las separamos por una membrana semipermeable (llamada así porque sólo permite el paso de agua pero no de los iones disueltos en ella) las dos soluciones tienden a equilibrar sus concentraciones, como los iones no pueden atravesar la membrana, es el agua de la solución diluida la que va pasando a la mas concentrada hasta alcanzar ambas soluciones la misma concentración. El agua desplazada origina una presión denominada presión osmótica. Dicha presión es proporcional a la diferencia de concentración de las soluciones salinas. Decimos que dos soluciones son isotónicas cuando tienen las misma presión osmótica, es decir la misma concentración salina. Cuando dos soluciones tienen diferente presión osmótica se dice que es hipertónica la de mayor concentración e hipotónica la de menor. Gracias a las sales minerales las células mantienen su presión osmótica constante. Una variación de la misma puede traer graves consecuencias. Por ejemplo: en una solución hipertónica el glóbulo rojo sufre un arrugamiento, en el caso de una solución hipotónica se dilata llegando a estallar, fenómeno conocido como hemolisis. Regulación del equilibrio ácido-base (amortiguación del pH) En los seres vivos existe una cierta cantidad de iones H+ (protones) y OH- (hidroxilos). El pH del medio dependerá de la proporción en que se encuentren los dos tipos de iones. Los protones e hidroxilos del medio proceden de diversas fuentes o reacciones que tienen lugar de forma continua: - Disolución del agua - Disociación de sales ácidas. - Disociación de sales básicas. Para que los fenómenos vitales puedan desarrollarse con normalidad es necesario un medio neutro. No obstante, las reacciones anteriores están liberando continuamente productos ácidos y básicos que tienden a desviar la neutralidad. Para evitar esta desviación del pH es necesario la presencia de sistemas amortiguadores que se opongan a dicha variación. Las sales minerales cumplen esta función. Son mucho más frecuentes la desviación del pH hacia el lado ácido que hacia el básico por lo que nos referiremos únicamente a este tipo de sistemas amortiguadores. De ellos los más importantes son los constituidos por el ácido carbónico H2CO3 y el bicarbonato sódico HNa CO3. Acción del CO3HNa. Si el pH del medio disminuye, por ejemplo, con la entrada de HCl, la sal reacciona de la siguiente forma: HNa CO3 + HCl = NaCl + H2CO3 El NaCl es neutro y además se elimina en la orina y el H2CO3 se descompone: H2CO3 = CO2 + H2O El CO2 se libera en la respiración y el H2O es neutro 3 Biología y Geología (1º Bachillerato) 3. BIOMOLÉCULAS ORGÁNICAS Las biomoléculas orgánicas se dividen en: Glúcidos, Lípidos, Proteínas y Acidos nucleicos. Los Glúcidos recibían antiguamente el nombre de hidratos de carbono porque en su constitución intervienen carbono, oxígeno e hidrógeno en la proporción del agua. Químicamente son el resultado de la unión de pequeñas moléculas (monómeros) denominados monosacáridos, según su número distinguimos entre mono, di y polisacáridos. La función de los glúcidos es variada. La gran mayoría representan sustancias que sirven para suministrar energía. Los lípidos son sustancias relativamente variadas que tienen en común la escasez de oxígeno y riqueza en hidrógeno. Son insolubles en agua y untuosos al tacto. Al igual que su composición, su función es también muy variada. Dentro de este grupo encontramos sustancias energéticas (grasas), hormonas, vitaminas, etc.. 4 Biología y Geología (1º Bachillerato)