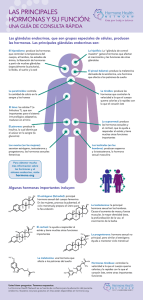
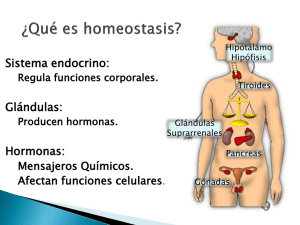
2010 [primer parcial ]
Anuncio
![2010 [primer parcial ]](http://s2.studylib.es/store/data/007979187_1-d5dcaf4311d2e153afad81fd1e1b5ff4-768x994.png)
2010 CLASE ENDOCRINOLOGIA DR. Edgar A. Luna Para Estudiantes UTESA [PRIMER PARCIAL ] ENDOCRINOLOGIA Página 1 CONTENIDO Tema I Breve introducción a Endocrinología………………….Pag 1-5 Tema la II Sistema endocrino Tema III Eje Hipotálamo e hipófisis Anatomía hipotálamo-hipofisaria Fisiología. Ejes hormonales hipotálamoadenohipofisarios Eje somatotropo Eje lactotropo Eje corticotropo Eje gonadotropo Tumores hipofisarios Etiopatogenia. Cuadro clínico. 1. Manifestaciones endocrinológicas 2. Manifestaciones neurológicas Diagnóstico Trastornos de la neurohipófisis Déficit de ADH: diabetes insípida central Exceso de ADH: síndrome de secreción inapropiada de hormona antidiurética (SIADH) ENDOCRINOLOGIA Página 2 Bases históricas de la endocrinología: 1830 MULLER: Monografía sobre glándulas, separando las que llamó "de secreción interna" (tiroides, suprarrenales y páncreas). 1786 PARRY: hipertiroidismo. Descripción 1835 ADDISON: Descripción insuficiencia suprarrenal. del de 1863 GULL: Descripción cretinismo y mixedema. la del 1865 C.BERNARD: Concepto homeostasis / secreción interna. de elorganismo humano el sistema integración tiene tres partes: de -SNC - Sistema endocrino - Sistema inmunológico El sistema nervioso es muy rápido en actuar, el sistema endocrino utiliza mediadores químicos y es más lento. El sistema inmunitario necesita anticuerpos, citocinas, linfoquinas... y por eso también tarda más tiempo que el SNC. 1. Diabetes: 5-6% de la población entre 0-100 años y 20% de la población >60 años. Los tres sistemas están interrelacionados. Hay hormonas que modulan la respuesta. inmunológica y hay enfermedades inmunologías que afectan a las glándulas endocrinas.La integración entre sistema nervioso y sistema endocrino es un hecho muy conocido desde que se sabe que el hipotálamo fabrica hormonas (las neuronas también fabrican hormonas). Es en la eminencia media del hipotálamo donde se encuentran las neuronas productoras de hormonas, donde se puede decir que hay células endocrinas. Esta eminencia fabrica más o menos hormonas según las señales que recibe de estructuras más altas, así que el cerebro también se considera hoy día como órgano endocrino. 2. Hipertiroidismo (Revisar en su libro pag 1-5) 3. Hipotiroidismo Sistema endocrino 4. Bocio nodular no tóxico 5. Enfermedades de la hipófisis 1889 BROWN SEQUARD: Inyección de extracto testicular de animales (monos) demuestra ser eficaz para combatir la impotencia. 1902 STARUNG: Secretina y Gastrína, las primeras hormonas descubiertas. 1905 La revista CRONICA LECTURES acuña el término de Hormona. Importancia de la endocrinología en la clínica: Son enfermedades muy frecuentes. En una consulta de medicina general. Dentro de las consultas de endocrinología, las más frecuentes son por este orden: 6. Enfermedades suprarrenales de ¿Qué es un sistema? las ¿qué es la endocrinología?: Es la parte de la mediana que se ocupa del sistema endocrino y su funcionamiento en la fisiología del cuerpo. Además, se ocupa de la integración de los seres vivos.En ENDOCRINOLOGIA Página 3 "Combinación de varias partes reunidas para conseguir cierto resultado o formar un conjunto".( Definición dada por el resultado de varias definiciones agrupadas en congruencia y sistematización). ¿Qué es el sistema endocrino? El cuerpo realiza funciones específicas que deben controladas como reguladas," muy ser el sistema endocrino es el sistema que logra que estos cambios se puedan dar a simple vista cuando son muy externos, aunque normalmente suelen ser internos"(DEBUSE N. Lo esencial en Sistema endocrino y aparato reproductor. Cursos "Crash" de Mosby. Harcourt-Brace. 1998. ). Es de noche y la habitación esta a obscuras, mientras buscas el interruptor de la luz a tientas, algo caliente roza tu pierna. Lanzas un fuerte grito o tal vez te quedas sin aliento. Recién lanzas un suspiro de alivio, cuando te das cuenta que fue el gato. A medida que disminuyen los latidos de tu corazón y tu cuerpo se relaja te empieza a invadir la calma. Tal vez y en forma un tanto más común, cuando vas por la calle y al pasar a un lado de un portón, un perro grande corre desde adentro de la casa hasta llegar a el portón y ladrarte, entonces gritas o solo saltas de miedo. Estos son hechos de que existen reacciones en el cuerpo que logran hacer cambiar de estado a los órganos; todo esto es hecho por el sistema endocrino. La Endocrinología como ciencia "La Endocrinología es la especialidad médica que estudia las glándulas que producen las hormonas"( Bernstein, R. & S. Bernstein. 1998. Biología. McGraw Hill. Colombia. 729 p.); es decir, las glándulas de secreción interna o glándulas endocrinas. Estudia los efectos normales de sus secreciones, y los trastornos derivados del mal funcionamiento de las mismas. Las glándulas endocrinas más importantes son: • • • • • • • La hipófisis La glándula tiroides Las paratiroides El páncreas Las suprarrenales Los ovarios Los testículos "El Sistema Endocrino es el conjunto de órganos y tejidos del organismo que liberan un tipo de sustancias llamado hormonas"( DEBUSE N. Lo esencial en Sistema endocrino y ENDOCRINOLOGIA Página 4 aparato reproductor. Cursos "Crash" de Mosby. Harcourt-Brace. 1998). Los órganos endocrinos también se denominan glándulas sin conducto o glándulas endocrinas, debido a que sus secreciones se liberan directamente en el torrente sanguíneo, mientras que las glándulas exocrinas liberan sus secreciones sobre la superficie interna o externa de los tejidos cutáneos, la mucosa del estómago o el revestimiento de los conductos pancreáticos. Las hormonas secretadas por las glándulas endocrinas regulan el crecimiento, desarrollo y las funciones de muchos tejidos, y coordinan los procesos metabólicos del organismo. Los tejidos que producen hormonas se pueden clasificar en tres grupos: glándulas endocrinas, cuya función es la producción exclusiva de hormonas; glándulas endo-exocrinas, que producen también otro tipo de secreciones además de hormonas; y ciertos tejidos no glandulares, como el tejido nervioso del sistema nervioso autónomo, que produce sustancias parecidas a las hormonas. "La endocrinología es la rama de la ciencias biológicas encargadas del estudio del sistema hormonal o endocrino"( Bernstein, R. & S. Bernstein. 1998. Biología. McGraw Hill. Colombia. 729 p.). El sistema endocrino, junto con el nervioso (y el inmune en parte), participan de manera coordinada en todas las funciones generales de regulación del cuerpo humano, como son mantener la temperatura, la presión sanguínea, la cantidad de glucosa en sangre, etc... La comunicación entre las distintas células y glándulas del sistema endocrino se lleva a cabo mediante un tipo especial de biomoléculas, unos mensajeros químicos que se denominan hormonas. "Las hormonas son sustancias de naturaleza orgánica (biomoléculas) con unas características muy peculiares"( D. W. Fawcett. Tratado de Histología. 12da. edición. Ed. Interamericana. 1995. ). Una vez liberadas al medio interno, se dispersan en él, y a concentraciones muy bajas, actúan provocando una respuesta fisiológica a cierta distancia del segregado. lugar donde se han Las hormonas afecta a determinados órganos o células diana, debido a la presencia en éstos de receptores específicos para la hormona. Estos receptores pueden encontrarse en la superficie de estas células, o bien en el interior de ellas. Trastornos de la función endocrina Las alteraciones en la función endocrina se pueden clasificar como de hiperfunción (exceso de actividad) o hipofunción (actividad insuficiente), en el lactante, y mixedema, caracterizado por rasgos tosco y disminución de las reacciones físicas y mentales, en el adulto. La hiperfunción tiroidea (enfermedad de graves, bocio tóxico) se caracteriza por abultamiento de los ojos, temblor y sudoración, aumento de la frecuencia del pulso, palpitaciones cardiacas e irritabilidad nerviosa. La diabetes insípida se debe al déficit de hormona antidiurética, y la diabetes mellitus, a un defecto de la hormona pancreática insulina, o pede ser consecuencia de una respuesta inadecuada del organismo. GLÁNDULAS Concepto de Glándula "Órgano de origen Epitelial cuya función es la de segregar ciertas sustancias."(Este concepto es sacado de la deducción de que la glándula es representada como un órgano por provenir de un sistema y esta compuesto de tejidos de células epiteliales). La glándula como cuerpo pineal "Se le llama cuerpo pineal a la glándula por poseer y tener un aspecto o unas dimensiones de cono de pino"(GARCIA-PELAYO Ramón y aportadores, Diccionario enciclopédico ilustrado de la salud,3ra Edición TOMO 1). "La glándula es un órgano de epitelial cuya función es segregar ciertas sustancias del organismo" (La glándula órgano de tejidos como lo ENDOCRINOLOGIA Página 5 origen la de fueras es un es el corazón u otro con la excepción de que este despide sustancias en una forma un tanto parecida al sudar de una persona, pero dado que este órgano desecha sustancias y las deja correr por las venas y arterias, utilizándolas como cañerías de desagüe para ir a su depósito). Tipos de glándulas Las glándulas que existen en el cuerpo poseen distintas formas como estructuras, por lo que se dividen en distintos grupos según su función, las siguientes son los grupos más representativos de glándulas segregadoras de sustancias. Las glándulas endocrinas "El sistema endocrino esta formado por glándulas que producen mensajeros químicos llamados hormonas"( Bernstein, R. & S. Bernstein. 1998. Biología. McGraw Hill. Colombia. 729 p.). Las hormonas que producen las glándulas endocrinas, ayudan a controlar como a regular partes, sistemas, aparatos y hasta órganos individuales del cuerpo . "El sistema endocrino es el conjunto de órganos y tejidos del organismo que liberan hormonas"( D. W. Fawcett. Tratado de Histología. 12da. edición. Ed. Interamericana. 1995. ). Los órganos endocrinos también se denominan glándulas sin conducto o glándulas endocrinas, debido a que sus secreciones se liberan directamente en el torrente sanguíneo. Las hormonas secretadas por las glándulas endocrinas regulan el crecimiento, el desarrollo y las funciones de muchos tejidos, y coordinan los procesos metabólicos del organismo. Las encargadas de producir las hormonas son las glándulas endocrinas. Dentro de ellas, el primer lugar lo ocupa sin duda la hipófisis o glándula pituitaria, que es un pequeño órgano de secreción interna localizado en la base del cerebro, junto al hipotálamo. Tiene forma ovoide (de huevo) y mide poco más de diez milímetros. A pesar de ser tan pequeñísima, su función es fundamental para el cuerpo humano, por cuanto tiene el control de la las sean los lagrimales, como axilas o tejidos cutáneos. El sistema endocrino no tiene una localización anatómica única, sino que está disperso en todo el organismo en glándulas endocrinas y en células asociadas al tubo digestivo. Al conjunto de células que poseen una actividad secretora se le denomina glándulas. Además de las glándulas endocrinas existen otro tipo de glándulas, que corresponden a otros sistemas y que mencionaremos brevemente. Unicelulares: compuesta por una sola célula secretora. P. ejemplo. Células calicifores. secreción de casi glándulas endocrinas. todas También las glándulas pueden ser de distintos tipos. Cuando la secreción se libera al exterior (como los jugos digestivos), estamos hablando de glándulas exocrinas (como las glándulas lacrimales, las glándulas sudoríparas, o el páncreas y la vesícula biliar que vierten su contenido al duodeno). Por el contrario, cuando los productos de secreción se liberan al medio interno (tal es el caso de las hormonas) decimos que hay una secreción por glándulas endocrinas. Multicelulares: Se clasifican según la forma de sus partes secretoras en: alveolares, acinosas, tubuloalveolares, etc. Estas también se pueden clasificar según el grado de ramificación de los conductos excretores en: simples o compuestas. Según la forma de los adenómeros, las G. Simples y compuestas se dividen en: • • • • • • Los ciclos endocrinos El sistema endocrino ejerce un efecto regulador sobre los ciclos de la reproducción, incluyendo el desarrollo de las gónadas, el periodo de madurez funcional y su posterior envejecimiento, así como el ciclo menstrual y el periodo de gestación. El patrón cíclico del estro (estro es la abreviatura de estrógeno, refiriéndose a una hormona que primordialmente produce la mujer) , que es el periodo durante el cual es posible el apareamiento fértil en los animales, esta regulado también por hormonas. • • • Glándula tubular: La parte secretora tiene forma de tubo. Alveolar: Si la parte secretora es en forma de bolsa o alvéolo. Acinosa: Cuando la parte externa tiene forma de bolsa, mientras que la luz es tubular. Tubuloalveolares Tubuloacinosas. Las glándulas compuestas se clasifican según el producto de secreción en: Mucosas Serosas Mixtas. Contienen células serosas y mucosas. Regulación de la secreción exocrina Algunas son estimuladas únicamente por el sistema nervioso autónomo, mientras que otras sólo son estimuladas por medio de hormonas. Otras son estimuladas tanto por el S.N.A como por medio de hormonas. Glándulas holocrinas Las glándulas exocrinas Las glándulas del sistema exocrino no poseen solo mensajeros químicos como las hormonas, que llevan el mensaje a lugares de todo el cuerpo, ya que estos los envían por ductos o tubos, ya que no son como las hormonas del sistema endocrino que llevan sus hormonas por todo el torrente sanguíneo hasta el lugar indicado, mientras que las glándulas exocrinas al secretar estas hormonas van directo al lugar indicado receptor de susodicha hormona, ya ENDOCRINOLOGIA Página 6 "Las glándulas holocrinas son aquellas donde los productos de secreción se acumulan en los cuerpos células, luego las células mueren y son excretadas como la secreción de la glándula"( DEBUSE N. Lo esencial en Sistema endocrino y aparato reproductor. Cursos "Crash" de Mosby. Harcourt-Brace. 1998.). Constantemente se forman nuevas células para reponer a las perdidas. Las glándulas sebáceas pertenecen a este grupo. Glándulas epocrinas HORMONAS "Las glándulas epocrinas son intermedias entre las epocrinas y las exocrinas"( Bernstein, R. & S. Bernstein. 1998. Biología. McGraw Hill. Colombia. 729 p.). Sus secreciones se reúnen en los extremos de las células glandulares. Luego estos extremos de las células se desprenden para formar la secreción. El núcleo y el citoplasma restante, luego en un corto periodo de recuperación. El núcleo y repite el proceso. Las glándulas mamarias pertenecen a este grupo. Definición conceptual de hormona Glándulas unicelulares Las glándulas unicelulares ( una célula) están representadas por células mucosas o coliformes que se encuentran en el epitelio de recubrimiento de los sistemas digestivos, respiratorio y urogenital. En animales inferiores, tales como los peces y los anfibios, son comunes en la piel. Producen un material proteico, la mucita, la cual con el agua forma moco para lubricar las superficies libres de las membranas. La forma de las células mucosas es como una copa y de ahí el nombre de células caliciciformes. El extremo interno o basal es delgado y contiene el núcleo. Una célula caliciforme puede verter su contenido poco a poco y retener su forma, o vaciarse rápidamente y colapsarse. Otra vez se llena y se repite el ciclo. Periódicamente estas células mueren y son remplazadas. "Una hormona es una sustancia química secretada en los lípidos corporales, por una célula o un grupo de células que ejerce un efecto fisiológico sobre otras células del organismo"( MARTÍN VILLAMOR Y SOTO ESTEBAN. Serie de manuales de Enfermería: AnatomoFisiología, tomo I y II. MassoSalvat. 1994. ). Para facilitar la comprensión, las hormonas son sustancias fabricadas por las glándulas endocrinas, que al verterse en el torrente sanguíneo activan diversos mecanismos y ponen en funcionamientos diversos órganos del cuerpo. "Las hormonas son sustancias químicas producidas por el cuerpo que controlan numerosas funciones corporales"( DEBUSE N. Lo esencial en Sistema endocrino y aparato reproductor. Cursos "Crash" de Mosby. Harcourt-Brace. 1998.). Las hormonas actúan como "mensajeros" para coordinar las funciones de varias partes del cuerpo. La mayoría de las hormonas son proteínas que consisten de cadenas de aminoácidos. Algunas hormonas son esteroides, sustancias grasas producidas a base de colesterol. Las hormonas van a todos lugares del cuerpo por medio del torrente sanguíneo hasta llegar a su lugar indicado, logrando cambios como aceleración del metabolismo, aceleración del ritmo cardíaco, producción de leche, desarrollo de órganos sexuales y otros. Glándulas multicelulares Las glándulas multicelulares (se les llama así a cualquier cosa que posea más de dos células) presentan formas variadas. Las más simples tienen forma de platos aplanados de células secretoras o son grupos de células secretoras que constituyen un pequeño hueco dentro del epitelio y secretan a través de una abertura común. El sistema hormonal se relaciona principalmente con diversas acciones metabólicas del cuerpo humano y controla la intensidad de funciones químicas en las células. Algunos efectos hormonales se producen en segundos, otros requieren varios días para iniciarse y durante semanas, meses, incluso años. 3.2 Funciones hormonas que controlan Entre las funciones que las hormonas se incluyen: ENDOCRINOLOGIA Página 7 las controlan • • • • • • Las actividades de órganos completos. El crecimiento y desarrollo. Reproducción Las características sexuales. El uso y almacenamiento de energía Los niveles en la sangre de líquidos, sal y azúcar. 3.3 Metabolismo Hormonal que recibe, activando la secreción de una glándula o contracción de un músculo), en la hipófisis las neuronas hipotalámicas no hacen contacto directo con sus efectoras. Estas últimas pasan a la sangre y alcanzan la adenohipófisis a través de una red capilar que se extiende entre el hipotálamo y la hipófisis anterior. En consecuencia, los núcleos hipotalámicos son fundamentales para el normal funcionamiento de la hipófisis. El hígado y los riñones desempeñan un papel fundamental en la depuración y excreción de estas hormonas, pero poco se sabe acerca del proceso detallado de su metabolismo. La vida media de la prolactina es de 12 minutos; la de la LH y FSH es cercana a la hora, mientras que la HCG tiene una vida media de varias horas. Si el contenido de ácido siálico es mayor, más prolongada es la supervivencia de la hormona en la circulación. 3.5 Regulación de las hormonas 3.4 Fábrica de hormonas Los factores de crecimiento son producidos por expresión local de genes. Operan por unión a receptores en la membrana celular. Los receptores generalmente contienen un componente intracelular con tirosina-quinasa. Otros factores actúan a través de segundos mensajeros, tales como el AMPc y el fosfoinositol. Las encargadas de producir las hormonas son las glándulas endocrinas. Dentro de ellas, el primer lugar lo ocupa sin duda la hipófisis o glándula pituitaria, que es un pequeño órgano de secreción interna localizado en la base del cerebro, junto al hipotálamo. Tiene forma ovoide (de huevo) y mide poco más de diez milímetros. A pesar de ser tan pequeñísima, su función es fundamental para el cuerpo humano, por cuanto tiene el control de la secreción de casi todas las glándulas endocrinas. La hipófisis está formada por dos glándulas separadas, conocidas como adenohipófisis y neurohipófisis. La primera corresponde al lóbulo anterior y la segunda al lóbulo posterior. Se comunica anatómica y funcionalmente a través de la sangre con el hipotálamo, lo que articula una gran coordinación entre el sistema nervioso y el endocrino. La relación hipotálamo-hipófisis es bastante particular, puesto que, a diferencia del resto del sistema nervioso, en que las neuronas se relacionan directamente con su efector (órgano terminal que distribuye los impulsos nerviosos ENDOCRINOLOGIA Página 8 La regulación de hormonas en general incluye tres partes importantes: heterogeneidad de la hormona regulación hacia arriba abajo de los receptores y hacia regulación de la adenil-ciclasa. Los factores de crecimiento requieren condiciones especiales para actuar; para inducir la mitogénesis se requiere la exposición secuencial a varios de ellos, con limitantes importantes en cantidad y tiempo de exposición. Pueden actuar en forma sinérgica con hormonas; por ejemplo el IGF-I en presencia de FSH induce receptores para LH. 3.5.1 abajo Regulación de arriba hacia "La modulación positiva o negativa de los receptores por hormonas homólogas es conocida como regulación hacia arriba y hacia abajo" (Bernstein, R. & S. Bernstein. 1998. Biología. McGraw Hill. Colombia. 729 p.). Poco se conoce sobre la regulación hacia arriba, pero se sabe que hormonas como la prolactina y la GnRH pueden aumentar la concentración de sus propios receptores en la membrana. La principal forma biológica como las hormonas peptídicas controlan el número de receptores y por ende, la actividad biológica, es a través del proceso de internalización. Esto explica el por qué de la secreción pulsátil de las gonadotropinas para evitar la regulación hacia abajo. "Cuando hay concentraciones elevadas de hormona en la circulación, el complejo hormona-receptor se mueve hacia una región especial en la membrana, el hueco revestido (coated pit)". A medida que esta región se va llenando sufre el proceso de endocitosis mediada por receptores. Esta región de la membrana celular es una vesícula lipídica que está sostenida por una canasta de proteínas específicas llamadas clatrinas. Cuando está completamente ocupada la vesícula es invaginada, se separa e ingresa a la célula como una vesícula cubierta, llamada también receptosoma. Es transportada a los lisosomas donde sufre el proceso de degradación. El receptor liberado puede ser reciclado y reinsertado en la membrana celular; a su vez, tanto el receptor como la hormona pueden ser degradados disminuyendo la actividad biológica. Este proceso de internalización no solo es utilizado para el control de la actividad biológica sino para transporte intracelular de sustancias como hierro y vitaminas. Los receptores de membrana han sido divididos en dos clases. Los de clase I son utilizados para modificar el comportamiento celular por regulación hacia abajo; son ocupados por FSH, LH, HCG, GnRH, TSH, TRH e insulina. Los receptores de clase II son utilizados para ingreso de sustancias indispensables para la célula y para remover noxas; por ejemplo son usados por la LDL para el transporte de colesterol a las células esteroidogénicas. 3.5.2 Heterogeneidad ENDOCRINOLOGIA Página 9 Las glicoproteínas tales como FSH y LH no son proteínas únicas sino una familia de formas heterogéneas (isoformas) con diversa actividad biológica e inmunológica. Las isoformas tienen variación en la vida media y peso molecular. Esta familia de glicopéptidos incluye la FSH, LH, TSH y HCG. Todas son dímeros compuestos de dos subunidades polipeptídicas glicosiladas, las subunidades a y b. Todas comparten la subunidad a que es idéntica, conformada por 92 aminoácidos. Las cadenas b difieren tanto en los aminoácidos como en el contenido de carbohidratos, lo cual les confiere especificidad. El factor limitante en la producción hormonal está dado por la disponibilidad de cadenas b, ya que las a se encuentran en cantidad suficiente a nivel tisular y sanguíneo. Las glicoproteínas pueden variar en su contenido de carbohidratos. La remoción de residuos de la FSH lleva a la producción de compuestos capaces de unirse al receptor pero no de desencadenar acciones biológicas. La prolactina consta de 197 a 199 aminoácidos; tiene también variaciones estructurales que incluyen glicosilación, fosforilación y cambios en unión y carga eléctrica. Se encuentran varios tamaños que han llevado a utilizar términos como pequeña, grande y gran-gran prolactina. Todas estas modificaciones e isoformas llevan a que el inmunoanálisis no siempre pueda reflejar la situación biológica. 3.6 Receptores de hormonas "Los receptores de hormonas son selectivos tejidos formados por células que reaccionan a ciertas sustancias como las hormonas y se aceleran o cambian en alguna forma según la instrucción y el trabajo que desempeñan".( Esta definición es dada por conclusión de que las hormonas son sustancias que sirven como catalizadores y solo algunas células son sensibles a estos). 3.7 Clases Hormonas La acción selectiva de las hormonas en tejidos específicos depende de la distribución entre los tejidos de los receptores específicos y varias proteínas efectoras que median las respuestas celulares inducidas por hormonas. Los receptores componentes clave: tienen 1. 2. 3. 4. a) Dominio específico de unión a ligando donde se une estereoespecíficamente la hormona correcta para ese receptor. La unión de la hormona al ligando produce cambios finos pero críticos en el ambiente del sitio efector, de manera que se inicia la transducción, puede haber interacción con otros componentes celulares para completar la señal del proceso de transducción. ENDOCRINOLOGIA Página 10 de Aminas prostaglandinas esteroides péptidos y proteinas. Esteroideas- Solubles en lípidos, se difunden fácilmente hacia dentro de la célula diana. Se une a un receptor dentro de la célula y viaja hacia algún gen el núcleo al que estimula su trascripción. b) Dominio efector que reconoce la presencia de la hormona unida al domino del ligando y que inicia la generación de la respuesta biológica Para ejercer su acción, todas las hormonas deben unirse a su receptor específico, estas uniones inician mecanismos intracelulares que conllevan las respuestas celulares. Las hormonas esteroideas y tiroideas son liposolubles y entran a las células libremente y se unen a las proteínas del citosol. Los complejos resultantes translocan al núcleo donde se unen a elementos regulatorios en el DNA estimulando o inhibiendo la transcripción de genes específicos. Todas las demás hormonas se unen a los receptores celulares localizados en la membrana de las células diana. Esta unión disipara uno o más de las vías de transducción que llevan a las respuestas celulares. clasificación Inicialmente las hormonas se clasificaban en tres grupos de acuerdo a su estructura química: hormonas peptídicas y proteicas, las hormonas asteroideas y las hormonas relacionadas con aminoácidos.En vertebrados se clasifican en: dos Los receptores están compuestos principalmente por proteínas, pero tienen modificaciones secundarias de carbohidratos y pueden estar selectivamente inmersos en la membrana lipídica, también pueden estar fosforilados, o formar oligómeros por puentes de disulfuro o interacciones covalentes. y No esteroideasDerivadas de aminoácidos. Se adhieren a un receptor en la membrana, en la parte externa de la célula. El receptor tiene en su parte interna de la célula un sitio activo que inicia una cascada de reacciones que inducen cambios en la célula. La hormona actúa como un primer mensajero y los bioquímicos producidos, que inducen los cambios en la célula, son los segundos mensajeros. • • • • aminasaminoácidos modificados. Ej : adrenalina, NE péptidos- cadenas cortas de aminoácidos. Ej: OT, ADH proteicasproteínas complejas. Ej: GH, PTH glucoproteínas- Ej: FSH, LH CLASIFICACIÓN Está hecha a partir de relaciones anatómicas entre célula A y la célula B. las la 1.- Sistémica La hormona se sintetiza y almacena en células específicas asociadas con una glándula endocrina, esta libera a la hormona al torrente sanguíneo hasta que recibe la señal fisiológica adecuada. La hormona viaja hacia un blanco celular lejano que usualmente tiene una alta afinidad por la hormona. La hormona se acumula en este blanco y se inicia una respuesta biológica que suele resultar en un cambio de concentración de un componente sanguíneo que sirve como señal de retroalimentación para la glándula endocrina que disminuye la biosíntesis y secreción de la hormona. Ejemplo: liberación del hormonas del hipotálamo en un sistema porta cerrado lo que asegura que las hormonas lleguen a la pituitaria anterior, que contiene células receptoras de dichas hormonas. 2.- Paracrina La distancia entre las células A y B es pequeña de manera que A sintetiza y secreta la hormona que difunde hasta B. Ejemplo: producción de testosterona por las células intersticiales de Leydig, después difunde en los túbulos seminíferos adyacentes. 3.- Autocrina Es una variación del sistema paracrino en el que la célula que sintetiza y secreta la hormona también es la célula blanco. Ejemplo: prostaglandinas. 4.- Neurotransmisores Cuando la señal eléctrica de la neurona es sustituido por un mediador químico, (el neurotransmisor) que es secretado por el axón. El neurotransmisor difunde localmente en la sinapsis hasta el receptor de la célula adyacente. Neurotransmisores como acetilcolina y norepinefrina se clasifican como neurohormonas parácrinas. Eje Hipotálamo e hipófisis Anatomía hipotálamo-hipofisaria El hipotálamo está situado en la base del diencéfalo, debajo del tálamo. Su límite anterior es la lamina terminalis y el posterior una línea imaginaria que une los cuerpos mamilares con la comisura posterior. Formando parte del infundíbulo se encuentra la eminencia media, donde confluyen las neurohormonas ENDOCRINOLOGIA Página 11 hipotalámicas antes de pasar a los vasos porta hipotálamo-hipofisarios. En el área supraóptica del hipotálamo destacan los núcleos supraóptico y paraventricular, que contienen las neuronas productoras de vasopresina y de oxitocina, las cuales, tras discurrir por vía axonal a través del tallo hipofisario, son liberadas a la circulación en la neurohipófisis. El núcleo supraquiasmático está implicado en la generación de los ritmos circadianos y los ritmos hormonales, así como en la regulación del comportamiento. En el área intermedia o tuberal se encuentran los núcleos ventromedial y dorsomedial, en contacto con el núcleo arqueado, los cuales tienen abundantes conexiones con otras áreas del SNC. La neurohipófisis y el tallo hipofisario son un continuum anatómico de tejido nervioso. Por el contrario, la adenohipófisis no es tejido neural y no tiene contacto neural con el hipotálamo y debe comunicarse con él a través de la rica vascularización que forma la red portal hipofisaria. La hipófisis funciona como una unidad anatómica especialmente protegida dado que reside en la silla turca y se encuentra rodeada por tejido óseo en su totalidad, excepto en su parte superior, donde presenta una membrana extraordinariamente resistente, la duramadre, la cual es atravesada por el tallo hipofisario. Irrigación. El hipotálamo recibe su sangre arterial desde el polígono de Willis. Las arterias cerebrales anteriores y comunicantes anteriores nutren el hipotálamo anterior, mientras que el hipotálamo medio recibe sangre de las arterias comunicantes posteriores, y el hipotálamo posterior es irrigado por las arterias de la bifurcación de la basilar y las cerebrales posteriores. El aporte sanguíneo al hipotálamo basal, el infundíbulo, el tallo hipofisario y la hipófisis deriva de las arterias carótidas a través de las hipofisarias superior e inferior. La eminencia media anterior y la mayor parte del tallo hipofisario reciben su aporte sanguíneo de las arterias hipofisarias superiores y la zona posterior de la eminencia media está irrigada por otros vasos derivados del polígono de Willis, mientras que la zona ventral del tallo hipofisario lo está por la sangre arterial que recorre los vasos porta. La mayor parte del aporte de la adenohipófisis no deriva de las arterias hipofisarias, sino de la sangre arterial que llega recorriendo el plexo venoso de los vasos porta. Los vasos porta con sangre arterial conteniendo las neurohormonas hipotalámicas recogida en esta capa de la eminencia media descienden por el tallo hipofisario en los denominados vasos porta "largos", los cuales alcanzan e irrigan la adenohipófisis. Sin embargo, en la base del tallo y antes de la unión con la adenohipófisis, estos vasos largos se unen con los vasos porta hipofisarios "cortos" que nacen en la zona ventral del tallo y que en parte derivan de las arterias hipofisarias inferiores. El 90% de la sangre que llega a la adenohipófisis deriva de los vasos porta largos, los cuales en la hipófisis drenan en el sistema sinusoidal del plexo secundario. Fisiología. La unidad hipotálamo-hipofisaria regula, a través de la neurohipófisis o hipófisis posterior, el balance hídrico y algunos componentes de la función reproductiva, y a través de la adenohipófisis o hipófisis anterior, entre otros, el estado metabólico, la función reproductiva, el crecimiento y la respuesta hormonal al estrés. El hipotálamo per se regula el balance calórico y diversas funciones adaptativas. ENDOCRINOLOGIA Página 12 En la unidad funcional hipotálamoneurohipófisis, la neurohormona es liberada directamente en los vasos de la hipófisis posterior y pasa a la circulación general sin etapa intermedia, conteniendo la cadena de mensajes sólo dos eslabones: señales neuronales-neurohormona (vasopresina u oxitocina). Por el contrario, la unidad hipotálamo-adenohipófisis opera con mayor complejidad, las señales hipotalámicas modulan la liberación de una neurohormona determinada, también denominada hormona hipotalámica, hormona liberadora o releasing hormone, en la eminencia media. De aquí es transportada a la hipófisis anterior, donde alcanza determinados grupos celulares estimulando o inhibiendo la liberación de una hormona hipofisaria, la cual, a su vez, pasará a la circulación general para ejercer sus acciones periféricas. El flujo de mensajes para esta unidad es: neurotransmisor-neurohormona-hormona hipofisaria. Ejes hormonales adenohipofisarios hipotálamo- La hipófisis libera a la circulación periférica una hormona determinada que ejerce sus acciones periféricas y el resultado puede ser la génesis de una acción biológica, la liberación de una nueva hormona que a su vez originará una acción biológica, o ambas. La acción biológica iniciada o los niveles de la hormona liberada cierran el circuito mediante un mecanismo de retroalimentación (feedback) negativa, inhibiendo la liberación hipofisaria de la hormona que puso en marcha el proceso. La neurohormona hipotalámica o releasing hormone tendría como misión sacar al sistema de su estabilidad, como generar un ritmo o modificar la tasa de secreción al cambiar la etapa vital del individuo y además tienen acción trófica sobre las células hipofisarias y son, a su vez, reguladas por la hormona o por la acción biológica periférica. Las hormonas hipotalámicas que regulan la función hipofisaria con relevancia clínica son las siguientes: GHRH: hormona hipotalámica estimulante de la secreción de hormona del crecimiento (44 aminoácidos). CRH: hormona hipotalámica estimulante de la secreción de adrenocorticotropina. TRH: hormona hipotalámica estimulante de la secreción de hormona tirotropa y de prolactina (PRL), si bien no es el regulador fisiológico de esta última. Gn-RH: u hormona hipotalámica liberadora de gonadotropinas (10 aminoácidos), también denominada LHRH. Somatostatina (GHRIH, SS, SRIF, 14 aminoácidos). Su función fisiológica más relevante es inhibir la liberación de hormona del crecimiento (GH), pero es capaz de inhibir la secreción de una gran variedad de hormonas. Dopamina: es una amina biógena y su acción fisiológica es inhibir la secreción PRL. Las hormonas neurohipofisarias las siguientes: son Oxitocina (9 aminoácidos): sus funciones básicas de estimulación son la contracción uterina y la del alvéolo mamario para provocar la expulsión de leche. Vasopresina (9 aminoácidos): es conocida como vasopresina, por su potente acción presora, y como hormona antidiurética (ADH), por su notable papel en la regulación hídrica. Las 6 hormonas adenohipofisarias con relevancia clínica son las siguientes: ENDOCRINOLOGIA Página 13 GH: hormona del crecimiento u hormona somatotropa, de 191 aminoácidos. Actúa sobre receptores periféricos y sus funciones son promover el crecimiento somático y modular el metabolismo intermediario. PRL: prolactina, de 199 aminoácidos. Su función corporal es promover la producción de leche por la glándula mamaria. ACTH: hormona corticotropa o adrenocorticotropina, de 39 aminoácidos, cuya función es estimular la corteza suprarrenal. TSH: hormona tirostimulante, estimulante del tiroides o tirotropa, de 201 aminoácidos. Estimula la liberación de hormonas tiroideas y el trofismo de los folículos tiroideos. LH: hormona luteinizante o luteostimulante, de 204 aminoácidos, estimula las células de Leydig en la gónada masculina y la función del cuerpo lúteo en la femenina. FSH: hormona foliculostimulante o estimulante del folículo, de 204 aminoácidos. Estimula el folículo de De Graaf en la gónada femenina y las células de Sertoli en la masculina. Eje somatotropo La secreción de GH ocurre en varias descargas a lo largo del día que duran 1-2 h, una de las más características e importante es la que ocurre durante el sueño profundo. Regulación somatotropa - Hipotálamo: GHRH (estimulante) y somatostatina (inhibidora) de la secreción de GH. La GHRH abunda en los tejidos intestinales, por lo que no es útil determinar sus concentraciones. La somatostatina posee una multiplicidad de acciones centrales y periféricas, como la inhibición de la secreción hipofisaria de TSH y la inhibición de la secreción pancreática de insulina y glucagón, y al igual que ocurre con la GHRH, tiene una distribución intestinal muy abundante. - La GH actúa sobre diversos tejidos periféricos generando su acción biológica directamente o a través de un factor de crecimiento, el factor de crecimiento similar a la insulina (IGF-I), que es producido por el hígado tras la estimulación del mismo por la GH circulante. - Tanto la GH como su producto IGF-I cierran el circuito de regulación inhibiendo la secreción somatotropa a nivel hipotalámico e hipofisario. A lo largo de la vida se produce un incremento en la secreción de GH en el inicio del proceso puberal y desde la edad adulta en adelante, una reducción progresiva de la misma, llegando a etapas de la vejez con una casi ausencia de secreción de GH y niveles bajos de IGF-I. Estímulos que provocan liberación de GH: hipoglucemia, disminución de AGL, administración de glucagón, lDOPA, clonidina, agonistas colinérgicos, ejercicio físico, sueño profundo y estrés. Estímulos que inhiben la liberación de GH: administración de glucosa, AGL o fármacos que presumiblemente aumentan la liberación de somatostatina (atropina, pirenzepina). Acciones - La principal acción de la GH es promover el crecimiento somático. Sobre los huesos provoca el crecimiento longitudinal actuando sobre el cartílago de crecimiento. La acción sobre éste es dual; por una parte, la GH inicia la replicación de los condrocitos, los cuales en su proceso madurativo segregan IGF-I y, al mismo tiempo, desarrollan los receptores para este factor de crecimiento. El crecimiento óseo es por tanto una acción desencadenada por la GH, pero luego conducida por el binomio GH ENDOCRINOLOGIA Página 14 más IGF-I. En el tejido muscular la GH promueve la incorporación de aminoácidos y la síntesis proteica, siendo por tanto anabólica y trófica sobre el mismo. Por el contrario, en el tejido adiposo, la GH promueve la lipólisis liberando glicerol y AGL. La hormona somatotropa tiene acciones antagonistas a la insulina sobre todo cuando es liberada en grandes concentraciones. Eje lactotropo La PRL es la hormona que inicia y mantiene la lactación, producida por las células lactotropas de la adenohipófisis, con estructura molecular es muy similar a la de la GH y al igual que ella actúa sobre tejidos periféricos y no sobre otra glándula. Regulación lactotropa La PRL es la única hormona hipofisaria que se halla sometida a un control negativo por el hipotálamo, lo cual confiere peculiaridades a su regulación. Si se corta el tallo hipofisario se produce una atrofia parcial de las células hipofisarias con reducción de la secreción de todas las hormonas, excepto la PRL. También es la única hormona hipofisaria cuyo regulador hipotalámico no es un péptido sino una amina, la dopamina, la cual inhibe la liberación de PRL. La administración intravenosa de TRH libera PRL y la hipoglucemia insulínica estimula su secreción por un efecto estimulante hipotalámico. Ambas pruebas son eficaces para evaluar la reserva hipofisaria de PRL. Como todas las hormonas hipofisarias, la secreción de PRL se produce en brotes o pulsos a lo largo del día y, de forma más acusada, por la noche, pero, a diferencia de la GH, la hipersecreción nocturna ocurre al comienzo de la noche y no se relaciona con etapas específicas del sueño. Otro factor que estimula la secreción de PRL es el estrés inespecífico, los estrógenos, la lactación y el coito en la mujer, y el hipotiroidismo en ambos sexos. Acciones Las acciones fisiológicas de la PRL sólo se consideran importantes en la mujer gestante o lactante. La PRL, durante el embarazo, prepara la lactación y, tras el parto, en una mama preparada por dosis adecuadas de estrógenos y progesterona, estimula la síntesis de proteínas específicas de la leche. Tras el parto y durante el amamantamiento, el estímulo de succión sobre el pezón produce una señal nerviosa que es transmitida por vía espinal hasta el hipotálamo, donde provoca una inhibición de la secreción de dopamina y la subsiguiente descarga de PRL para estimular la síntesis de las proteínas de la leche. Este estímulo provoca también una descarga de oxitocina que contrae los folículos mamarios para su eyección. Cuando la madre deja de amamantar, la ausencia de estímulo en el pezón provoca, en aproximadamente una semana, la pérdida de secreción de PRL, tras lo cual todo el sistema vuelve a la situación previa al parto. Eje corticotropo La ACTH es una hormona hipofisaria que regula una glándula periférical. Es un péptido producido por células corticotropas, cuya función es estimular la corteza suprarrenal para la producción de hormonas esteroides, principalmente cortisol. Regulación corticotropa - Hipotálamo: CRH, que establece una dinámica de secreción de ACTH y, por tanto, de cortisol, característico, el ritmo circadiano de cortisol, con niveles más elevados de ambas hormonas en las primeras horas de la mañana (6.00-8.00 h), que en la tarde y la noche (18.00-20.00 h). Fuera de situaciones de estrés o circadianas, el sistema mantiene su estado estable a través de la retroalimentación ejercida por el ENDOCRINOLOGIA Página 15 cortisol sobre la secreción hipofisaria de ACTH. Al CRH le correspondería establecer el nivel de equilibrio de este sistema, según las diversas situaciones del individuo. La acción negativa del cortisol sobre el hipotálamo es de menor importancia que la ejercida sobre la hipófisis. Eje tirotropo Tambien la TSH regula una glándula periférica, el tiroides. En este eje intervienen tres escalones hormonales sucesivos como etapa previa a la acción biológica en los tejidos periféricos. El hipotálamo regula la secreción de las células tirotropas hipofisarias y el nivel de equilibrio del sistema mediante la secreción de TRH, la cual activa la liberación hipofisaria de TSH. Ésta, a través de la circulación general, estimula los folículos tiroideos para liberar las hormonas tiroideas T3 y T4, las cuales ejercen sus acciones biológicas en los tejidos periféricos del organismo. A continuación las hormonas tiroideas inhiben la liberación de TSH en la hipófisis, cerrando de esta forma el circuito. Regulación tirotropa - La administración intravenosa de TRH provoca una respuesta secretora de TSH. Las concentraciones elevadas de hormonas tiroideas inhiben la secreción de TSH por la hipófisis, así como la liberación hipotalámica de TRH. Eje gonadotropo Está constituido en el hipotálamo por la neurohormona Gn-RH y en la hipófisis por dos hormonas hipofisarias, bicatenarias, glucoproteicas y producidas en la misma célula (célula gonadotropa), la LH y la FSH. A su vez, estas dos hormonas actúan sobre las gónadas activando un gran número de procesos e incluso la secreción de un gran número de hormonas peptídicas y esteroides. El hecho de que la mujer y el varón tengan una regulación diferente aumenta la complejidad de este eje. Regulación gonadotropa - Hipotálamo: Gn-RH. La regulación hipotalámica de Gn-RH es compleja e incompletamente conocida. Su secreción es pulsátil, que se traduce en una pulsatilidad secretora de LH y FSH por la hipófisis, tanto en el varón como en la mujer. En la fase folicular en la mujer, la mayoría de los pulsos de LH son seguidos de un pulso de estrógenos, pero en el varón los pulsos de LH no determinan una elevación posterior inmediata de testosterona. Durante las fases media y avanzada de la fase lútea los pulsos de LH estimulan la secreción de progesterona. En el varón, los pulsos de LH y FSH son altamente variables y poco intensos; por el contrario, en la mujer tienen gran relevancia, dependen de la etapa vital y, después de la adolescencia, son más importantes en la fase folicular del ciclo ovárico, en la cual el incremento de los pulsos de LH provoca una secreción aumentada de estradiol por el folículo. El estradiol, que junto a la progesterona ejerce normalmente una retroalimentación negativa sobre la secreción de LH, en esta fase del ciclo se transforma en estimulante e induce una descarga elevada de LH, la cual a su vez provoca la ovulación. En el varón no hay retroalimentación positiva ni tampoco esta gran descarga de LH; el sistema, por tanto, es más simple y sólo la retroalimentación negativa es operativa. La testosterona y su metabolito activo, la dihidrotestosterona, inhiben tanto la liberación de LH como la de FSH, a través de acciones directas hipofisarias y también sobre el hipotálamo alterando el generador de Gn-RH. En el varón los estrógenos inhiben la acción hipofisaria de la Gn-RH. La retroalimentación negativa de la gónada sobre la secreción de FSH se ejerce a través de una hormona ENDOCRINOLOGIA Página 16 peptídica, la inhibina, que es sintetizada en las células de la capa granulosa ovárica en la mujer y en las células de Sertoli en el varón; se trata de una glucoproteína, bicatenaria, cuyos niveles se incrementan en la fase folicular tardía, durante la cual, junto con el estradiol, inhibe la síntesis y liberación de FSH, inhibición que es sobrepasada en el momento de la descarga preovulatoria de gonadotropinas. La combinación de dos unidades beta de la inhibina genera otra hormona, la activina, capaz de estimular la liberación de FSH por la hipófisis. Tumores hipofisarios - Tienen un especial significado debido a que la hipófisis está en un espacio cerrado con muy poca capacidad para acomodar la masa y porque pueden estar formados por células que segregan hormonas, dando lugar a síndromes de sobreproducción hormonal y a la vez la invasión del resto de la glándula provocará síndromes de hipoproducción hormonal. - Son prácticamente siempre adenomas (sarcomas, carcinomas o metástasis son excepcionales). Se clasifican de acuerdo con la hormona o las hormonas secretadas (funcionantes o no funcionantes) y los funcionantes se clasifican de acuerdo con el cuadro clínico específico que causan. Además van a clasificarse según su tamaño: macroadenomas (más de 1 cm de diámetro) o microadenomas (menos de 1 cm de diámetro); y según su capacidad para perforar la pared ósea de la silla turca o extenderse fuera de la duramadre: invasivos o no invasivos. Etiopatogenia Se originan por una lesión primitiva de la adenohipófisis (iniciación)debido a una mutación en la subunidad alfa de una proteína GTP citosólica que normalmente regula la señal de transducción estimulante del crecimiento, pero luego el desarrollo sería favorecido por la acción de las hormonas hipotalámicas (promoción). Cuadro clínico La presentación clínica de los tumores hipofisarios puede ser a través de sus manifestaciones endocrinológicas (exceso o deficiencia de una o más hormonas) o neurológicas (proceso expansivo intracraneal). Como regla general, los tumores hipotalámicos y los macroadenomas hipofisarios tienden a manifestarse clínicamente por las alteraciones neurológicas, mientras que los microadenomas hipofisarios lo hacen por sus signos y síntomas endocrinos. 1. Manifestaciones endocrinológicas 1.1. Hipopituitarismo. Los hipopituitarismos son un conjunto de afecciones de etiología diversa que ocasionan la pérdida total o parcial de la función adenohipofisaria. Cuando están involucradas todas las hormonas hipofisarias se denomina panhipopituitarismo. Etiología: Hipopituitarismos primarios (ausencia o destrucción de las células hipofisarias): Tumores hipofisarios (lo más frecuente) y otras causas (aneurismas, necrosis isquémica de la hipófisis, traumatismos craneales, infecciones, granulomas, autoinmune, hemocromatosis, metástasis, iatrógenos por cirugía o radioterapia). - Hipopituitarismos secundarios: por alteraciones del tallo hipofisario (traumatismos y cirugía, tumores hipofisarios o extraselares y aneurismas) o alteraciones hipotalámicas (tumores, granulomas, traumatismos, malnutrición, anorexia nerviosa) o causas yatrógenas (tratamientos prolongados con glucocorticoides, anticonceptivos y citostáticos o irradiación). ENDOCRINOLOGIA Página 17 Cuadro clínico: - Depende de la extensión de la afección, del número de hormonas implicadas, de la edad del paciente y de la rapidez con que se instaura, y es más relevante cuando las hormonas deficitarias controlan glándulas periféricas (TSH, ACTH) que cuando controlan funciones sin localización (PRL,GH) y se produce cuando se ha destruido el 75% de la glándula (con la destrucción del 90% de la glándula se produce un déficit hipofisario total). Las manifestaciones fundamentales son debidas a los síndromes de deficiencia de los órganos finales (insuficiencia adrenal, el hipotiroidismo y la diabetes insípida) y menos crucial pero a menudo lo más sensible es la amenorrea en la mujer y la infertilidad o la impotencia en el varón. - En general, en los niños se manifiesta por una alteración del crecimiento y del desarrollo puberal, mientras que en los adultos se presenta como un hipogonadismo. - En el panhipopituitarismo, es típica la despigmentación de la piel, sobre todo en las aréolas mamarias, y la pérdida del vello axilar y pubiano. La piel pierde la turgencia característica y adquiere un aspecto céreo y frío. La cara está abotargada y pálida con arrugas muy finas características, sobre todo alrededor de la boca, cejas despobladas y un aspecto prematuramente avejentado. También hay pérdida del vello axilar y pubiano en ambos sexos y atrofia de mamas o testículos. Psíquicamente, los pacientes pueden presentar un cuadro que varía desde la apatía hasta síntomas psicóticos acusados. Diagnóstico: El patrón clínico y bioquímico en los casos de panhipopituitarismo es el de los déficit aislados de cada hormona hipofisaria. 1.2. Hiperprolactinemia. Es la alteración hipotálamo-hipofisaria más frecuente. Etiopatogenia: Tiene muchas causas además de los tumores hipofisarios ( prolactinomas, que son los tumores hipofisarios más frecuentes, y otros funcionantes o no funcionantes), como son determinadas situaciones fisiológicas (embarazo y lactancia, el sueño, el ejercicio físico y el estrés) y fármacos (psicotropos y antidopaminérgicos), enfermedades hipotalámicas y del tallo hipofisario (granulomas, tumores, radiación craneal, cirugía, traumatismos y otros), lesiones irritativas torácicas (herpes zoster y traumatismos torácicos o lesiones medulares espinales) y otros procesos (cirrosis hepática, insuficiencia renal crónica). Fisiopatología: La hiperprolactinemia produce: - Alteraciones hipotalámicas: En la mujer provoca alteración en la regulación hipotalámica de Gn-RH, lo que provoca que la frecuencia de los pulsos de LH y la descarga ovulatoria de gonadotropinas estén abolidas. En el varón se inhibe la espermatogénesis probablemente por acción hipotalámica (los efectos sobre el testículo son más discutibles). - En el ovario, inhibe la síntesis de estradiol y progesterona y bloquea la maduración del folículo ovárico. Interfiere en la conversión periférica de testosterona a dihidrotestosterona. - En la mama provoca galactorrea, aunque requiere la sensibilización previa del tejido mamario con estrógenos para manifestarse. - En el hueso, directamente o a través del hipoestrogenismo que causa, provoca pérdida de tejido óseo. ENDOCRINOLOGIA Página 18 Cuadro clínico: - En la mujer provoca alteraciones menstruales (oligomenorrea o amenorrea secundaria) e infertilidad, y en el 40-80% galactorrea espontánea o tras expresión mamaria (producción de leche fuera del posparto). - En el varón produce pérdida de la libido, impotencia, reducción del fluido seminal e infertilidad y si el trastorno comienza antes de la pubertad, se reducen los cambios corporales de masculinización. La galactorrea es excepcional. Diagnóstico: Una vez excluidas las causas fisiológicas, el diagnóstico se establece basándose en una clínica compatible y cifras elevadas de PRL en plasma de forma repetida. 1.3. Acromegalia. Enfermedad producida por la hipersecreción crónica e inapropiada de GH que se inicia después del cierre de los cartílagos de conjunción. Cuando el aumento de secreción ocurre mientras éstos permanecen abiertos se origina el gigantismo. Etiopatogenia: Es producida casi constantemente por un tumor hipofisario secretor de GH. Fisiopatología: La secreción aumentada de GH ocasiona una elevación en las concentraciones circulantes de IGF-I. La acción de GH e IGF-I provoca un crecimiento de las partes acras del esqueleto (hueso perióstico) y de todos los tejidos blandos. La acción antiinsulínica de la GH ocasiona el empeoramiento de una diabetes mellitus preexistente o su aparición. El engrosamiento de la piel es debido al depósito en la dermis de glucosaminoglicanos, ácido hialurónico y condroitinsulfato. Cuadro clínico: - Comienza habitualmente de una manera insidiosa con cambios muy progresivos que frecuentemente pasan desapercibidos para el paciente y las personas próximas. - Piel y tejidos blandos. Aumento de los tejidos blandos y de las porciones extremas del esqueleto. La nariz, labios, orejas, lengua, manos, pies, mandíbula, arcos superciliares y cigomáticos experimentan un crecimiento progresivo, dando lugar al aspecto facial característico con engrosamiento y tosquedad de los rasgos, prognatismo, maloclusión dentaria (diastema) y aumento de manos, pies y cabeza. El grosor de la piel aumenta de manera generalizada. Existe hipersudoración importante y la piel se vuelve aceitosa por hipersecreción sebácea. Aparecen fibromas cutáneos, moluscum pendulum o acrocordones. En la mujer, hay hirsutismo sin masculinización por hipercrecimiento del pelo y acné en los individuos más jóvenes. - Astenia, debilidad muscular y cansancio fácil, con miopatía proximal en el 50%. - Neuropatía compresiva. Síndrome del túnel carpiano (30-50%). - Depresión frecuente, disminución de la iniciativa y espontaneidad, apatía, malhumor e hipersomnia. - Organomegalias y frecuente que se desarrolle un bocio multinodular, en general no tóxico. Hipertensión frecuente que general. arterial es más en la población - Problemas respiratorios. Apneas durante el sueño hasta en el 60% de los casos, fundamentalmente por obstrucción de las vías aéreas superiores, con voz más profunda por aumento de las estructuras laríngeas y senos paranasales. ENDOCRINOLOGIA Página 19 - Problemas cardíacos. Hipertrofia concéntrica del ventrículo izquierdo e hipertrofia septal asimétrica, ECG anormal en el 50% de los pacientes, alteraciones del segmento ST y de la onda T y alteraciones de la conducción (bloqueo de rama). Pero sólo el 15-20% presenta enfermedad coronaria, insuficiencia cardíaca congestiva o arritmias. Alteraciones del metabolismo hidrocarbonado (25-60%), con diabetes clínica en 10-20%. Afectación articular, por hipercrecimiento de los huesos periarticulares, hipertrofia sinovial y de los cartílagos articulares, con articulación inestable que provoca artralgias, artrosis y episodios de artritis. Es característica la cifosis dorsal. - Aumento de incidencia de pólipos intestinales y cáncer de colon. - Radiología de esqueleto típica. En la radiografía de cráneo, aparte de los hallazgos selares, destacan aumento del diploe con hiperostosis frontal interna. En la de manos existe un aumento del grosor de los tejidos blandos, engrosamiento de los extremos de las falanges distales en penacho o cabeza de flecha. En el pie, además de las alteraciones óseas, es característico el engrosamiento de la almohadilla plantar. En el gigantismo, la hipersecreción de GH se produce cuando aún están abiertos los cartílagos de conjunción, por lo que se produce una importante aceleración del crecimiento lineal. La talla suele encontrarse más de tres desviaciones estándar por encima de la media. El cuadro clínico acostumbra a ser de comienzo y progresión más rápidos y las concentraciones de GH no muy altas. Existe casi siempre hipogonadismo asociado. Diagnóstico: -El diagnóstico clínico de la acromegalia resulta fácil cuando la enfermedad está claramente establecida, pero es difícil, sin embargo, en los estadios iniciales. El examen retrospectivo de fotografías del paciente ayuda a establecer el inicio de la enfermedad. y VI, ocasionando ptosis palpebral, midriasis, oftalmoplejía y diplopía. - Hipertensión intracraneal grave. - Afectación hipotalámica: náuseas, alteración del sueño, del apetito y de la termorregulación, diabetes insípida, manifestaciones psicóticas, desorientación temporospacial y alucinaciones. -Determinación de GH e IGF-I (aumentados) en condiciones basales Convulsiones por crecimiento tumoral hacia el lóbulo temporal. -Ausencia de inhibición de la GH tras la sobrecarga oral de glucosa. Es la prueba más importante en la confirmación diagnóstica de la acromegalia, ya que es patológica en casi el 100% de los enfermos. - Cambios en la personalidad por crecimiento hacia el lóbulo frontal. 1.4. Enfermedad de Cushing, por hiperproducción de ACTH. Es la causa más frecuente de hipercorticismo. El síndrome de Nelson es una progresión rápida de un adenoma productor de ACTH tras una adrenalectomía bilateral para controlar los síntomas de un exceso de cortisol. 2. Manifestaciones neurológicas Cefalea. Es el síntoma más frecuente, generalmente frontal, temporal o retrorbitaria. Se produce por la compresión que ejerce el tumor en su crecimiento hacia arriba sobre la duramadre y las estructuras próximas. Signos neuroftalmológicos por afectación del quiasma óptico. El cuadro más frecuente consiste en una hemicuadrantanopsia bitemporal superior, que si continúa progresando se convierte en una hemianopsia bitemporal (defecto clásico). La evaluación de los campos visuales por simple inspección no es suficientemente precisa, por lo que se debe complementar mediante campimetría o valoración de los potenciales evocados visuales. - Afectación del seno cavernoso, por extensión lateral del adenoma, puede afectar los pares craneales III, IV ENDOCRINOLOGIA Página 20 - Si invade hacia abajo, la rotura del suelo de la silla turca y la invasión del seno esfenoidal por el tumor pueden ocasionar rinolicuorrea persistente e, incluso, presentación nasofaríngea del tumor. - Apoplejía hipofisaria. Necrosis isquémica o hemorragia intratumoral aguda. Provoca cefalea brusca e intensa de comienzo súbito, acompañada de pérdida de visión, desorientación, hipotensión e hipertermia, en algunos casos asociado a desvanecimiento, coma y alteraciones cardiovasculares. Riesgo elevado de pérdida de la visión e incluso riesgo vital para el paciente. Diagnóstico Debe orientarse en dos direcciones: Estudio endocrinológico para determinar si es o no funcionante y sus efectos sobre otras hormonas hipofisarias. Valores normales de determinaciones hormonales las - Técnicas de imagen para localizar y precisar la extensión del tumor y la afección de estructuras próximas. La técnica de imagen más sensible es la RM. La gammagrafía con octreótido marcado con isótopos radiactivos (Octreoscan), puede aportar información con potencialidad terapéutica, indicando que el tumor detectado puede responder positivamente al tratamiento con el análogo de la somatostatina. Trastornos de la neurohipófisis La AVP tiene una acción antidiurética, lo que junto con la sensación de sed y la consiguiente ingesta de agua, es fundamental para el mantenimiento del volumen y osmolalidad de los líquidos corporales. Actúa aumentando la permeabilidad al agua de los túbulos colectores, por medio de unión a receptores específicos (receptores V2), que generan AMPc como segundo mensajero, e inducen la emigración a la superficie luminal de las células de unas proteínas intracelulares, las aquoporinas, que forman canales permeables al agua, que de esta forma pueden atravesar la membrana de las células de la pared tubular hasta el intersticio medular y facilita la producción de una orina muy concentrada. La secreción de ADH está regulada por los osmorreceptores hipotalámicos que detectan mínimas variaciones en la concentración de sodio y otros solutos plasmáticos. Su sensibilidad extrema hace que la osmolalidad plasmática se mantenga constante, ya que sus pequeñas variaciones modifican la secreción y concentraciones plasmáticas de AVP. Cuando la osmolalidad plasmática es inferior a 280 mOsm/kg, por ejemplo tras una sobrecarga acuosa, la secreción de AVP está inhibida y la orina se encuentra diluida (osmolalidad inferior a 100 mOsm/kg). Cuando la osmolalidad plasmática supera los 290 mOsm/kg, por ejemplo tras la restricción hídrica o la perfusión de solución salina hipertónica, se alcanzan las concentraciones plasmáticas más elevadas de AVP con una concentración urinaria máxima, que es de 3 a 4 veces la plasmática (de 900 a 1.200 mOsm/kg). ENDOCRINOLOGIA Página 21 La sensación de sed también está regulada por osmorreceptores hipotalámicos, en estrecha relación con la secreción de AVP y de angiotensina II. La sensación de sed aparece en presencia de osmolalidades de alrededor de 290 mOsm/kg, es decir, cuando la secreción de AVP y la antidiuresis son máximas. En las lesiones hipotalámicas que ocasionan disminución de la sensación de sed, hipo y adipsia se produce hipernatremia, especialmente cuando aumentan las pérdidas corporales, aunque se mantengan intactos la secreción de AVP y los mecanismos renales de conservación del agua. La reducción del volumen plasmático y de la tensión arterial también son desencadenantes muy potentes de la liberación de AVP. Cuando hay reducción de volumen o hipotensión arterial grave se produce una secreción máxima de AVP, aun cuando se acompañe de una osmolalidad baja; de esta forma, se supedita el mantenimiento de la osmolalidad a la corrección de la depleción de volumen o la hipotensión arterial grave. Por otra parte, la síntesis y secreción de AVP, su aclaramiento plasmático y su acción sobre el túbulo renal pueden verse modificados en muy diversas situaciones. Inhiben su secreción o acción: el alcohol, el litio, los glucocorticoides, la demeclociclina y el factor natriurético atrial, entre otras sustancias. Estimulan su secreción o potencian su acción: la edad, estímulos relacionados con la anestesia y la cirugía, diversos fármacos (psicotropos, antidepresivos, analgésicos, antidiabéticos orales, hipolipemiantes, etc.) y el déficit de cortisol. Déficit central de ADH: diabetes insípida Secreción de AVP insuficiente para concentrar de forma adecuada la orina. Etiología -Diabetes insípida central: Hereditaria (autosómica dominate) o adquirida (las causas más frecuentes son traumática y posquirúrgica, aunque puede haber otras causas). Se produce por destrucción celular o alteración funcional que conduce a una cese de la secreción de ADH. -Diabetes insípida nefrogénica: Hereditaria o adquirida (hipokaliemia, hipercalcemia, obstrucción posrenal, fármacos-Li y demeclociclina, anemia de cálulas falciformas, amiloidosis y embarazo). Se produce por disminución de la sensibilidad del receptor de la ADH. Clínica - La única manifestación clínica de la diabetes insípida es la poliuria que se acompaña de nicturia y polidipsia. La orina es hipotónica y su volumen oscila entre 4 y 10 L al día. El cuadro suele ser de inicio brusco, con necesidad imperiosa de beber agua, de día y de noche, y una preferencia llamativa por las bebidas frías. Esta poliuria persiste en circunstancias en las que aparece una disminución de la orina (ej:deshidratación), acompañada de sed. No existe clínica de deshidratación, ni de hipernatremia, excepto si alguna circunstancia interfiere con la sensación de sed o el acceso al agua (anestesia, traumatismo o disminución del nivel de conciencia) o cuando el proceso llega a afectar los centros hipotalámicos reguladores de la sed y se desarrolla hipodipsia o adipsia. ENDOCRINOLOGIA Página 22 Diagnóstico La concentración circulante de AVP es baja, con orina diluida, a pesar de que la osmolalidad plasmática tiende a estar elevada y se produce un aumento adecuado de la osmolalidad urinaria al administrar ADH exógena. - El diagnóstico se basa en la demostración de un déficit de liberación de AVP de forma indirecta por la relación entre las osmolalidades plasmática y urinaria en general por medio de la prueba de deshidratación*), que es anormal, aunque también puede determinarse directamente la concentración plasmática de AVP que está disminuida y comprobar que existe una respuesta renal normal a su administración exógena. * Prueba de deshidratación, con o sin la administración final de AVP exógena. Se somete al paciente a una restricción total de líquidos, y se determina la osmolalidad en plasma y orina, así como el peso del paciente y el volumen y osmolalidad urinarios, cada hora. La máxima concentración urinaria (de 800 a 1.200 mOsm/kg) suele alcanzarse a las 4-10 h de deshidratación. En este momento se interrumpe la restricción hídrica y se administra, en su caso, AVP exógena; la prueba acaba con la determinación del volumen y la osmolalidad urinarios alcanzados a la hora o 2 h de la inyección de AVP. Un individuo normal alcanza una concentración urinaria máxima a las 6-10 h de iniciada la restricción de líquidos y su osmolalidad urinaria no se modifica al administrar AVP exógena. En los pacientes con diabetes insípida central completa, la osmolalidad urinaria se mantiene por debajo de la plasmática y se incrementa en más de un 50% tras la inyección de AVP. Los individuos con diabetes insípida por déficit parcial de AVP aumentan moderadamente su osmolalidad urinaria durante la restricción hídrica y, a diferencia de los normales, aquélla se incrementa en más de un 10% en respuesta a la administración de la hormona exógena. Los pacientes con diabetes insípida nefrogénica muestran incremento escaso durante la prueba, sin modificación alguna tras la administración de AVP. progresivamente se desencadena la aparición de anorexia, náuseas, vómitos, agitación psicomotriz, confusión, llegando a presentarse convulsiones y coma, por edema cerebral. Exceso de ADH: síndrome de secreción inapropiada de hormona antidiurética (SIADH) Debe sospecharse ante una hiponatremia con hipoosmolalidad, que paradójicamente se acompañe de orina concentrada y de una excreción relativamente alta de sodio, en ausencia de la administración de diuréticos o de pérdidas renales o extrarrenales con deshidratación, que puedan explicar el cuadro. El diagnóstico sólo puede realizarse después de excluir otras causas de hiponatremia, que incluyen el hipotiroidismo y la insuficiencia renal y suprarrenal. Secreción mantenida e inapropiada de AVP, en ausencia de estímulos osmóticos y no osmóticos y de cualquier otra causa de hiponatremia, que hace que se excrete una orina concentrada, con una osmolalidad superior a la plasmática, a pesar de la hipoosmolalidad existente en el plasma. - La expansión de volumen, sin edemas, induce una inhibición del eje renina-aldosterona y la liberación del factor natriurético atrial, con una excreción de sodio relativamente elevada (> 20 mEq/L). Etiología Causas múltiples, entre las que se encuentran: neoplasias malignas (sobre todo carcinoma microcítico de pulmón), enfermedades del SNC (tumores, abscesos, hematomas, infecciones, ACV y otros), enfermedades pulmonares (infecciones, insuficiencia respiratoria aguda), fármacos (vasopresina, desmopresina, clorpropamida, clofibrato, carbamacepina y otras) o bien idiopático. Clínica La presentación clínica cardinal del SIADH es hiponatremia sin edemas. En general, si la hiponatremia es moderada (>130 mEq/L) o el cuadro se ha desarrollado lentamente, suele ser asintomático. Cuando la hiponatremia es grave (<110 o 120 mEq/L), aparece la sintomatología neurológica sobre todo si el desarrollo es rápido, ENDOCRINOLOGIA Página 23 Diagnóstico - Determinación de la concentración de AVP en plasma, que es normal o incluso está elevada a pesar de la hipoosmolalidad, existiendo una desviación hacia la izquierda en su relación con la osmolalidad plasmática. -A veces debe recurrirse a la prueba de sobrecarga acuosa que permite observar la dificultad y el retraso en la excreción de agua. En un individuo normal, el aporte de líquido suprime la AVP, alcanzándose una dilución máxima de la orina (inferior a 100 mOsm/kg) y excretándose en las 5 h siguientes más del 80% del agua administrada. En el SIADH no se inhibe la secreción de AVP y sigue produciéndose orina concentrada, apreciándose la incapacidad para excretar el agua administrada. TIROIDE Anatomía ........................... Fisiología ......................... Metabolismo del yodo ............... Síntesis de hormonas tiroideas ..... Regulación de la función tiroidea .. Transporte de las hormonas tiroideas .......................... Metabolismo periférico de las hormonas tiroideas ................. Mecanismo de acción de las hormonas tiroideas .......................... Efectos de las hormonas tiroideas .. Patología del tiroides ............. Estudio del paciente con patología tiroidea ........................... Pruebas diagnósticas ............... - Pruebas funcionales .............. Estudio de los trastornos inmunológicos ...................... - Diagnóstico morfológico .......... Bocio simple ....................... Síndrome del eutiroideo enfermo .... - Síndrome del enfermo eutiroideo con T4 normal (síndrome de la T3 baja). ............................. - Síndrome del enfermo eutiroideo con T4 baja. ....................... - Síndrome del enfermo eutiroideo con T4 elevada. .................... - Fármacos y función tiroidea ...... - Enfermedad tiroidea subclínica. .. Hipotiroidismo ..................... Etiología .......................... Cuadro clínico ..................... Diagnóstico ........................ Hipertiroidismo .................... Etiología .......................... Etiopatogenia ...................... Cuadro clínico ..................... Diagnóstico ........................ Nódulos tiroideos. ................. Anatomía - Es un órgano situado en la región anterior del cuello, consta de dos lóbulos simétricos. Surge, desde el punto de vista embriológico, de una proliferación del suelo de la faringe que desciende hasta alcanzar su situación definitiva, permaneciendo unida a su origen primitivo por el conducto tirogloso, cuya parte distal persiste en el adulto y puede hiperplasiarse constituyendo el ENDOCRINOLOGIA Página 24 lóbulo piramidal. Tiene una rica vascularización, a partir de las dos arterias tiroideas superiores que nacen de las carótidas externas y de las dos arterias tiroideas inferiores procedentes de la subclavia. Está inervado por los sistemas adrenérgico y colinérgico, con ramas procedentes, respectivamente, de los ganglios cervicales y del nervio vago. Relaciones anatómicas importantes: nervios recurrentes y glándulas paratiroideas. - Está constituido por folículos cerrados revestidos de células epiteliales cilíndricas y llenos de sustancia coloide (material proteináceo constituido principalmente de tiroglobulina y hormonas tiroideas almacenadas). Cuando la glándula está inactiva los folículos son grandes y el coloide abundante, cuando está activa son pequeños y el coloide escaso. Junto a estas células foliculares puede identificarse, por sus distintas características tintoriales, otro tipo de células denominadas células C o parafoliculares, secretoras de calcitonina, una hormona que inhibe la reabsorción ósea y baja el nivel de calcio plasmático. Fisiología Metabolismo del yodo El yodo es indispensable para la biosíntesis de las hormonas tiroideas. La fuente de yodo del organismo depende exclusivamente de la ingesta, aumentando las necesidades en el embarazo y en la lactancia. El yodo es absorbido en el intestino delgado proximal tanto en forma orgánica como inorgánica. La liberación del yoduro tras hidrólisis enzimática se completa posteriormente en el hígado y en el riñón. De este modo, el yoduro forma parte del denominado conjunto (pool) del yoduro del fluido extracelular. Este yoduro, a su paso por el torrente circulatorio, es captado por el riñón, el tiroides, las células gástricas y las de las glándulas salivales. Como el yoduro captado por las células parietales gástricas y por las glándulas salivales es reabsorbido y recuperado por el pool del yoduro, de hecho, la competencia en la práctica se establece sólo entre el riñón y el tiroides. La eliminación del yodo se efectúa fundamentalmente por el riñón en forma de yoduro y, en menor cantidad, por las heces, sobre todo en forma de yodo orgánico. las fundamentales son tres: TBG (thyroxine binding-globulin), TBPA: thyroxine binding-prealbumin) y albúmina. El transporte de la triyodotironina (T4) es realizado por la TBG y en un pequeño grado por la albúmina. La acción biológica es realizada por la fracción libre. Síntesis de hormonas tiroideas Para la biosíntesis de estas hormonas es esencial la captación del yoduro de la sangre circulante. Una vez elaboradas, las hormonas son almacenadas en el coloide, en la molécula de tiroglobulina, y de ahí son vertidas a la sangre según las necesidades del organismo. El mecanismo de la biosíntesis puede ser esquematizado del siguiente modo: a) Captación del yodo plasmático mediante la bomba del yoduro de la célula tiroidea. b) Organificación del yodo por medio de las peroxidasas. c) Yodación de los componentes tirosílicos de la tiroglobulina, previamente formada por la célula tiroidea, para la elaboración de monoyodotirosina (MIT) y diyodotirosina (DIT). d) Acoplamiento de las yodotirosinas para formar triyodotironina (T3) y tetrayodotironina o tiroxina (T4) por medio de la acción de las peroxidasas, e) Captación de gotitas de coloide por parte de la célula tiroidea por pinocitosis o endocitosis y, tras la rotura proteolítica de los enlaces tiroglobulina-hormonas tiroideas, liberación de estas últimas a la sangre. Metabolismo periférico de las hormonas tiroideas De la secreción diaria de tiroxina, el 35% se convierte en la periferia en triyodotironina, constituyendo el origen del 80% de la T3 circulante. La actividad biológica de la T3 es varias veces mayor que la de la T4 y sus efectos metabólicos más rápidos. El metabolismo de la T3 es también más rápido, siendo su recambio unas 5 veces superior al de la T4. Estos datos demuestran la importancia decisiva de la T3 en la determinación del estado metabólico del individuo, dudándose de que la T4 posea una actividad intrínseca, de modo que quizá toda su acción se produzca después de su transformación periférica en T3. Estos hechos fisiológicos revelan la importancia de la transformación periférica de T4 en T3, constituyendo de hecho este proceso metabólico un mecanismo de regulación extraglandular de la función tiroidea de singular importancia. Regulación de la función tiroidea Su principal regulación está vinculada al sistema hipotálamohipofisario (TRH, TSH) y además existe una autorregulación tiroidea, íntimamente relacionada con la cantidad de yodo del organismo (cuanto más yodo contiene la dieta, menos capta el tiroides, y viceversa). Transporte de las hormonas tiroideas La tiroxina (T4) circula casi en su totalidad fuertemente unida a diversas proteínas, de las cuales, ENDOCRINOLOGIA Página 25 Mecanismo de acción de las hormonas tiroideas Ejercen su acción en el interior de la célula y no requieren de su unión previa a receptores citosólicos para penetrar en el núcleo de la célula (si las esteroideas), donde se unen a receptores nucleares formando complejos T3-TR, que se unen a secuencias específicas de DNA, activando el metabolismo energético, incrementando el consumo calórico, y regulando el crecimiento y la maduración de los tejidos y el recambio de prácticamente todos los sustratos, vitaminas y hormonas. Efectos de las hormonas tiroideas -Corazón: Efecto cronotrópico (incrementando el número y afinidad de los receptores betaadrenérgicos) e inotrópico (aumentando la respuesta a las catecolaminas circulantes y aumentando la proporción de cadenas pesadas de alfa miosina. -Tejido graso: Efecto catabólico (estímulo de la lipólisis). -Músculo: Efecto catabólico (aumentando la descomposición de las proteínas). -Hueso: Efecto de desarrollo y metabólico (promociona el crecimiento normal y desarrollo esquelético; acelera el recambio óseo). -Sistema nervioso: Efecto desarrollo (promociona el desarrollo normal del cerebro). -Intestino: Efecto metabólico (aumenta la tasa de absorción de los carbohidratos. -Lipoproteínas: Efecto metabólico (estímulo de la formación de receptores de la LDL. -Otros: Efecto calorigénico (estímulo del consumo de O2 por los tejidos metabólicamente activos y aumenta la tasa metabólica) Estudio del paciente con patología tiroidea Anamnesis familiar. Debe preguntarse si algún familiar directo ha padecido bocio, con intervención quirúrgica o sin ésta, o algún otro tipo de afección tiroidea. - Anamnesis personal. Búsqueda de síntomas de hiper o hipotiroidismo. - Exploración detallada: física correcta y Exploración local: paciente sentado. Inspección, puede descubrir la presencia de cicatrices operatorias, lesiones dérmicas, secuelas de una antigua irradiación y bocio. Hacer que trague saliva o que ingiera algún sorbo de agua para comprobar que se moviliza con la deglución en caso de bocio. Palpación: Abordaje posterior con palpación simultánea de ambos lóbulos (punta de los dos primeros dedos de ambas manos a ambos lados de la tráquea, ligeramente por ENDOCRINOLOGIA Página 26 debajo del cartílago tiroideo) con un movimiento rotatorio e indicando que a la vez trague saliva, después palpación del lóbulo izquierdo flexionanado el cuello hacia la izquierda palpando con la mano derecha y palpación del lóbulo derecho flexionando el cuello hacia la deecha y palpando. Abordaje anterior con palpación del lóbulo derecho flexionando el cuello hacia la derecha y palpando con el pulgar y los dos primeros dedos de la mano izquierda, desplazando la glándula con el pulgar derecho y el lóbulo izquierod a la inversa. Abordaje en decúbito para valorar tiroides retroesternal colocando una almohada debajo de los hombros manteniendo la cabeza hacia atrás. Tamaño (bocio grado 1: tiroides palpable pero no visible, con el cuello en posición normal, y que se moviliza con la deglución, o bien palpación de nódulos tiroideos aunque la glándula no esté aumentada de tamaño; bocio grado 2 es visible con el cuello en posición normal y la palpación cervical confirma que se trata de un tiroides aumentado de tamaño; grado 0: ausencia de bocio palpable o visible), consistencia blanda, firme, dura, y pétrea, dolor en la palpación, frémito y búsqueda de adenopatías. Auscultación suele ofrecer datos poco relevantes. Exploración general. Debe dirigirse con especial atención a los posibles signos producidos por los citados síndromes en los diversos aparatos y sistemas del organismo. Con especial relevancia: estado general, peso, agudeza mental, TA, pulso, temperatura, aspecto de la piel, fuerza muscular, alteraciones oculares, temblor y ROT osteotendinosos. Pruebas diagnósticas - Pruebas funcionales Determinación de la concentración sérica de T4 libre. Con la valoración simultánea de las concentraciones de TSH, la determinación de T4 libre es la exploración inicial y de mayor utilidad en el estudio de la función tiroidea. Las concentraciones de T4 libre están elevadas en el hipertiroidismo y son bajas cuando existe hipofunción tiroidea. Determinación de la concentración sérica de T3 libre. Utilidad en el síndrome de la T3 baja o en la T3tirotoxicosis. La T3 libre sérica aumenta en el hipertiroidismo y disminuye en fases avanzadas del hipotiroidismo. Determinación de la concentración sérica de TSH. La TSH aumenta en el hipotiroidismo primario y disminuye en el hipertiroidismo. Cuando coexisten concentraciones bajas de hormonas tiroideas y TSH debe sospecharse la existencia de un hipotiroidismo de origen hipotalámico o hipofisario. El hallazgo de hormonas tiroideas y TSH elevadas sugiere el diagnóstico de adenoma hipofisario productor de TSH o de resistencia a la acción de las hormonas tiroideas. Valores normales de determinaciones hormonales Estudio de inmunológicos los las trastornos Determinación de anticuerpos antitiroperoxidasa (antimicrosoma) y antitiroglobulina. Su positividad sugiere el diagnóstico de afección tiroidea autoinmunitaria. Determinación de anticuerpos antirreceptor de TSH (inmunoglobulinas inhibidoras de la unión de TSH a su receptor (TSHRAb o TBII). Diagnóstico de la enfermedad de Graves. - Diagnóstico morfológico Ecografía cervical. Gran utilidad para el estudio de la localización, el tamaño y las características tanto del tejido tiroideo normal como de las lesiones nodulares intratiroideas. Altamente sensible tanto para detectar nódulos muy ENDOCRINOLOGIA Página 27 pequeños y distinguir los sólidos de los quísticos o mixtos. Se considera, en la actualidad, la técnica de elección para la valoración morfológica inicial de la glándula. También resulta de gran utilidad para la práctica de la punción-aspiración con aguja fina. Gammagrafía tiroidea. Proporciona información sobre la situación, el tamaño y la morfología de la glándula o del tejido tiroideo residual o ectópico. Puede facilitar información para aclarar la etiología del hipertiroidismo (hipercaptación contra gammagrafía "blanca") y permite conocer la intensidad de captación del isótopo por los nódulos tiroideos, que pueden ser "fríos" o hipocaptantes, isocaptantes y "calientes" o hipercaptantes. Tomografía computarizada cervical (TC). Reservada para aquellos casos en los que la gammagrafía y ecografía planteen dudas importantes. Sólo se considera de utilidad la TC para valorar la extensión retroesternal de un bocio o para el diagnóstico de este proceso en un paciente con una masa mediastínica no filiada. Citología tras punción-aspiración con aguja fina. Método de gran rendimiento en el estudio de las afecciones tiroideas, tanto nodulares como difusas. Bocio simple Bocio es todo aumento de tamaño de la glándula tiroides y bocio simple cuando no se debe a la existencia de una enfermedad tiroidea autoinmunitaria, una tiroiditis ni una neoplasia maligna, aunque, en ocasiones, alguno de estos procesos puede acompañarlo. Es la enfermedad más frecuente del tiroides. Etiología - Alteración en la disponibilidad de yodo por el tiroides. Déficit en el aporte de yodo (por déficit de ingesta o por aumento del aclaración renal) o aumento del aporte de yodo. - Ingesta de bociógenos (alteración de la captación tiroidea de yodo: tiocianato, perclorato y otros; alteración d ela organificación del yodo: fármacos drl grupo tiouracilo, salicilatos, sulfonilureas y goitrinas; aumento de la excreción fecal de tiroxina: harina de soja, aceite de girasol, cacahuete y algodón; interferencia en la liberación: exceso de yodo, litio, vinblastina y colchicina). Defectos congénitos de la hormonosíntesis tiroidea y de la acción de las hormonas tiroideas. Otros factores (fenómenos autoinmunes, factores de crecimiento y mutación de oncogenes) utilidad, ya que proporciona información tanto sobre su tamaño como sobre las características de la glándula y permite identificar los posibles nódulos y clasificarlos en sólidos o quísticos. En algunos casos puede ser útil realizar una gammagrafía tiroidea, que mostrará la existencia de un bocio difuso en las fases iniciales o de captación heterogénea del trazador, con áreas de hipocaptación e hipercaptación, en casos de multinodularidad. Raras veces es necesario practicar una TC cervicotorácica o una RM para precisar la existencia de prolongación endotorácica. La patogenia del bocio es la secreción insuficiente de hormonas tiroideas que produce un aumento de la secreción de TSH. Esta TSH ocasiona hipertrofia e hiperplasia de las células foliculares y determina la formación de nuevos folículos y el crecimiento de la glándula. En muchas ocasiones, el aumento del tejido tiroideo consigue la secreción de una cantidad suficiente de T4 y T3 y se normaliza la TSH, por lo que el paciente presenta entonces bocio y eutiroidismo. Ciclos sucesivos de hiperplasia e involución de los folículos originan la formación de los distintos nódulos que caracterizan al bocio multinodular. Síndrome del eutiroideo enfermo Cuadro clínico El bocio simple no suele dar sintomatología, excepto de la relacionada directamente con la compresión de estructuras vecinas, como disfonía, disfagia o disnea. En las fases iniciales de la enfermedad, el bocio es difuso y de consistencia firme. En fases más avanzadas se hace nodular, con zonas más o menos duras, pudiendo alcanzar un tamaño extraordinario. El estudio citológico del material aspirado mediante PAAF debe realizarse en todos los casos de bocio, con punciones múltiples sobre los diferentes nódulos, cuando existe multinodularidad. Anomalías observadas en los resultados de pruebas funcionales tiroideas en pacientes sin evidencia de enfermedad tiroidea. Puede presentarse en enfermedades graves, agudas o crónicas, en el ayuno prolongado, en traumatismos importantes o en otras situaciones que produzcan estrés. - Síndrome del enfermo eutiroideo con T4 normal (síndrome de la T3 baja). Es lo que habitualmente aparece en las situaciones citadas. Se detecta una T4 normal o algo elevada, T3 baja, rT3 elevada y TSH es normal. Se debe a la disminución de la actividad 5'-desyodinasa y al déficit de capacidad de fijación de las proteínas transportadoras. Puede verse en la acromegalia, síndrome nefrótico, hipoproteinemia, cirrosis hepática, tumores productores de testosterona o cuadros hereditarios. Diagnóstico - Síndrome del enfermo eutiroideo con T4 baja. Bocio con normofunción tiroidea. La ecografía cervical resulta de gran Se presenta en pacientes en situaciones de especial gravedad ENDOCRINOLOGIA Página 28 (UCI). También se debe al déficit de 5'-desyodinasa y de capacidad de fijación de las proteínas transportadoras, pero además existe un déficit de secreción de TSH con una respuesta insuficiente a la TRH, probablemente por efecto de las citocinas sobre la célula tirotropa. Los pacientes presentan T4 y T3 bajas, rT3 elevada, T4 libre normal o subnormal y TSH normal o baja, con falta de respuesta a la TRH. Estos datos analíticos pueden prestarse a confusión en un paciente gravemente enfermo con un hipotiroidismo hipofisario. La valoración de los datos clínicos y del resto de la función adenohipofisaria suelen permitir llegar al diagnóstico, así como la determinación de la rT3 (rT3 disminuida en el hipotiroidismo hipofisario). - Síndrome del enfermo eutiroideo con T4 elevada. Muy poco frecuente, durante el curso de una enfermedad grave y en el momento de su recuperación, sobre todo en enfermos de edad avanzada, especialmente del sexo femenino, tratados con preparados que contienen yodo y en pacientes con trastornos psiquiátricos agudos. También puede verse en el embarazo, hepatitis aguda o crónica, porfiria aguda intermitente, tumores productores de estrógenos y alteracions hereditarias, así como por fármacos como estrógenos, contraceptivos orales, metadona, heroína, perfenazina y clofibrato. En este caso, el síndrome puede confundirse con un hipertiroidismo que curse con T4 elevada y T3 normal. No obstante, en la hiperfunción tiroidea las concentraciones de TSH son subnormales y no responden a la estimulación con TRH. ENDOCRINOLOGIA Página 29 - Fármacos y función tiroidea Muchos fármacos son capaces de alterar la función tiroidea. Es excepcional, no obstante, que un medicamento no administrado en relación con una afección tiroidea produzca un cuadro clínico de hipotiroidismo o hipertiroidismo, salvo la amiodarona y lo habitual es que produzcan alteraciones en las pruebas funcionales que pueden dificultar su interpretación, dificultad añadida si además el paciente presenta alguna anomalía relacionada con el síndrome del enfermo eutiroideo . Fármacos que producen alteraciones: Propanolol, amiodarona, andrógenos, estrógenos, fenitoína, carbamacepina, glucocorticoides, dopamina, furosemida, metadona, danazol. - Enfermedad tiroidea subclínica. Pacientes eutiroideos clínicamente con disminución o elevación de TSH pero niveles de T3 y T4 normales. El hipotiroidismo subclínico es definido como una TSH >5 mU/L, con niveles de hormonas tiroideas circulantes normales. En presencia de autoanticuerpos tiroideos circulantes, el 5% de individuos con hipotiroidismo subclínico progresará a hipotiroidismo cada año. Puede estar asociado a alteraciones neuropsiquiátricas que pueden mejorar con tiroxina hasta normalizar la TSH. El hipertiroidismo subclínico se define como TSH < 0,1 mU/L con hormonas circulantes normales, su historia natural no se conoce bien aunque es esperable que ocurran muchos nódulos tiroideos autónomos y tiene más riesgo de desarrollar fibrilación auricular y osteoporosis. Hipotiroidismo Situación clínica debida a un déficit de hormonas tiroideas. Si se origina en alteraciones tiroideas se designa primario, si depende de una insuficiente secreción de TSH se lo denomina secundario y si la alteración procede del hipotálamo, terciario. El hipotiroidismo subclínico aparecería en situaciones asintomáticas en las que la reducción de la función tiroidea ha sido compensada por un aumento en la secreción de TSH. El hipotiroidismo es frecuente, con una incidencia muy superior en el sexo femenino. Etiología - Hipotiroidismos primarios, por destrucción o pérdida del tejido tiroideo (hipotiroidismo idiopático, tiroiditis crónica autoinmune - causa más frecuente , tiroiditis subaguda, cirugía, radioteapia) o por alteraciones en la biosíntesis de las hormonas tiroideas.. Hipotiroidismo secundario y terciario. Déficit de secreción de TSH o trastorno hipotalámico que afecte la secreción normal de TRH. - Resistencia periférica a las hormonas tiroideas. Presentan concentraciones elevadas de hormonas tiroideas. Los pacientes no suelen cursar con hipotiroidismo clínico y en ocasiones se observa una combinación de signos de hipotiroidismo e hipertiroidismo. Cuadro clínico En el adulto es de comienzo insidioso y se manifiesta por las siguientes alteraciones: 1. Alteraciones generales Los pacientes refieren intolerancia al frío y, en casos avanzados, puede comprobarse hipotermia. Son frecuentes la astenia y la disminución del apetito. El peso suele mantenerse normal, o incluso aumentar por la retención de agua y ENDOCRINOLOGIA Página 30 sal, secundaria al depósito de tejido mucoide. La voz es ronca y áspera, muy característica, debido a la infiltración mucoide de la lengua y la laringe. El tiroides casi nunca es palpable. 2. Piel y faneras El signo más llamativo, que incluso ha dado el nombre a la afección (mixedema del adulto), es una singular tumefacción de la piel, que se distingue del edema común porque la presión digital no deja fóvea. Se manifiesta sobre todo en la cara, la nuca y el dorso de las manos y pies. La piel suele estar muy seca, dura y escamosa y a menudo es pálida y amarillenta por la frecuente aparición de anemia, vasoconstricción cutánea e hipercarotinemia. Las secreciones sudorípara y sebácea están reducidas. El cabello, las cejas, las pestañas y el pelo corporal se vuelven secos, gruesos y frágiles, y tienden a caer. Las alteraciones citadas, junto con la tendencia a la somnolencia y al desinterés por lo que le rodea, producen unos cambios muy característicos en la facies del hipotiroideo. Las uñas también sufren cambios importantes, se vuelven quebradizas y crecen muy lentamente. 3. Aparato circulatorio Entre las diversas alteraciones observadas destaca la disminución del gasto cardíaco, tanto por reducción del volumen sistólico como de la frecuencia cardíaca. Hay vasoconstricción periférica y puede observarse un aumento del área cardíaca en la radiografía de tórax, en parte debido a la dilatación del corazón, pero con relativa frecuencia relacionado con la existencia de un derrame pericárdico rico en proteínas y polisacáridos. 4. Aparato respiratorio Con cierta frecuencia se observan derrames pleurales. En formas avanzadas puede producirse infiltración de los músculos respiratorios y alteración del centro respiratorio, capaces de conducir a una hipoventilación alveolar. 5. Aparato digestivo Es frecuente la macroglosia, por infiltración mixedematosa. Puede haber hinchazón y palidez de las encías. La aclorhidria es un trastorno frecuente que afecta a la mitad de los pacientes. En ocasiones puede aparecer malabsorción. Hay una disminución de los movimientos peristálticos, que produce estreñimiento. La ascitis aparece rara vez y, cuando lo hace, suele acompañar a derrames de las otras cavidades serosas. 6. Riñón En general se observan discretas alteraciones funcionales, que se traducen en una disminución del filtrado glomerular, una reducción de la capacidad secretora y reabsortiva de los túbulos y una disminución de la capacidad de concentración de la orina. Existe un retraso en la eliminación acuosa que, junto con la hidrofilia del tejido mucoide, conduce a un incremento en el volumen total de agua del organismo, que produce hiponatremia dilucional. Pese a ello, el volumen plasmático está reducido. 7. Sangre Las principales alteraciones se observan en la serie roja. Suele aparecer anemia, que puede ser de tres tipos: normocítica y normocrómica por disminución de los requerimientos de oxígeno y de la producción de eritropoyetina, macrocítica, casi siempre relacionada con un déficit de vitamina B12, y microcítica o hipocrómica debido a un déficit de hierro en relación con la presencia de hemorragias o de un déficit de absorción. La anemia perniciosa aparece en el 12% de los casos de hipotiroidismo de origen autoinmunitario. ENDOCRINOLOGIA Página 31 8. Sistema nervioso y muscular En el sistema nervioso central destaca la lentitud de las funciones intelectuales, incluida el habla. El paciente se vuelve lento e indiferente y puede aparecer ataxia de tipo cerebeloso. La falta de concentración y de memoria y la somnolencia son habituales. Las alteraciones psiquiátricas de tipo depresivo o paranoide son relativamente frecuentes, y a veces se observan cuadros de agitación y una auténtica demencia, que puede confundirse con una encefalopatía senil. Entre las alteraciones de los órganos de los sentidos y del sistema nervioso periférico destacan la ceguera nocturna, la sordera y la frecuente aparición de neuropatías periféricas por atrapamiento, muy especialmente en el nervio mediano, producido por depósitos de sustancia mucoide (síndrome del túnel carpiano). El retraso del período de relajación de los reflejos osteotendinosos es muy característico. Los movimientos de los músculos esqueléticos suelen ser lentos, aunque la fuerza está bastante conservada. En ocasiones aparece un síndrome seudomiotónico con gran incremento de la masa muscular y notable retraso de la actividad muscular. Con mucha frecuencia se detectan en el suero incrementos de enzimas de origen muscular, como la creatinfosfocinasa (CPK) y la aspartato-aminotransferasa (ASAT). 9. Sistema endocrino En el hipotiroidismo primario de duración prolongada pueden aparecer algunas alteraciones importantes del sistema endocrino. Entre ellas cabe citar la hipertrofia y la hiperplasia de las células tirotropas hipofisarias, que rara vez producen de modo secundario una insuficiencia adenohipofisaria. En cambio, es muy habitual la hiperprolactinemia, a veces acompañada de galactorrea. En cuanto a las suprarrenales, destaca la prolongación de la semivida del cortisol. Mientras que la cortisolemia se mantiene normal, la eliminación urinaria de cortisol está disminuida. En casos graves puede haber una respuesta inadecuada al estrés, de modo que un tratamiento inicial demasiado enérgico con hormonas tiroideas puede desencadenar una insuficiencia suprarrenal grave. En el área gonadal suelen existir alteraciones en ambos sexos. En la mujer es común la disminución de la libido y la aparición de ciclos anovulatorios con hemorragias genitales. En algunos casos, si existe depresión hipofisaria, aparece amenorrea por atrofia uterovárica. En el varón pueden observarse disminución de la libido, impotencia y oligospermia. 10. Metabolismo Entre las alteraciones del metabolismo intermediario que pueden aparecer en el paciente hipotiroideo cabe destacar alteraciones en la sobrecarga oral de glucosa, con una respuesta insulínica retrasada, aumento de la lipemia, muy especialmente de la colesterolemia en el hipotiroidismo primario, y de la carotinemia. En cuanto al metabolismo óseo, puede producirse una disminución de los niveles de formación y resorción del hueso, que se traduce en un incremento de la densidad ósea en el examen radiológico. Coma mixedematoso El coma mixedematoso constituye una grave emergencia de aparición infrecuente que pone en peligro la vida del paciente hipotiroideo. Puede representar el último estadio de un mixedema de duración muy prolongada y abandonado a su evolución espontánea. Esta complicación se da sobre todo en pacientes ancianos y predomina en invierno. En otros casos, el coma mixedematoso representa una complicación de la enfermedad ya diagnosticada, aunque no siempre bien tratada. Unas veces su ENDOCRINOLOGIA Página 32 aparición es espontánea, pero otras es desencadenada por una serie de causas, entre las que cabe citar la exposición al frío, la infección, la insuficiencia respiratoria, la intoxicación acuosa, la hipoglucemia y el consumo de analgésicos, mal metabolizados por el paciente hipotiroideo. El enfermo en coma mixedematoso presenta, además de un coma más o menos profundo, los signos y síntomas correspondientes a un hipotiroidismo de larga evolución no tratado o insuficientemente tratado. La hipotermia es común, a veces muy intensa; se considera que una temperatura rectal inferior a 32 °C constituye un índice de mal pronóstico. La hipoglucemia es poco frecuente y, cuando aparece, suele estar producida por insuficiencia suprarrenal, ya sea por tratarse de un hipotiroidismo hipofisario o bien por la asociación de una enfermedad autoinmunitaria tiroidea y suprarrenal (síndrome de Schmidt). La eliminación de agua está disminuida, observándose con bastante frecuencia una importante hiponatremia dilucional. Este trastorno se ha atribuido a una secreción inadecuada de hormona antidiurética. La intoxicación acuosa y la hiponatremia pueden ser factores coadyuvantes del deterioro de la conciencia. Por último, otro dato muy importante es la frecuencia con que aparecen graves trastornos ventilatorios. Se han citado como posibles causas la depresión del centro respiratorio, la interferencia de la conducción neuronal o de la transmisión neuromuscular respiratoria, la infiltración mucoide del árbol bronquial y alteraciones en la membrana alveolocapilar. Diagnóstico El diagnóstico de la forma completa de hipotiroidismo del adulto es fácil de establecer clínicamente. En las formas poco avanzadas o paucisintomáticas, el diagnóstico clínico es más difícil, por lo que la enfermedad a menudo pasa inadvertida. Las formas asintomáticas del hipotiroidismo subclínico sólo se pueden descubrir mediante las pruebas de laboratorio. - La determinación más útil para el diagnóstico del hipotiroidismo primario es la TSH basal, que está invariablemente elevada, habitualmente >20. La solicitud de la T4 libre suele acompañar la de la TSH basal para establecer el diagnóstico de hipotiroidismo. Cuando ante un caso inequívoco de hipotiroidismo con disminución de la T4 libre la TSH es normal o baja, debe sospecharse hipotiroidismo secundario o terciario. - La realización de otras pruebas tiroideas raras veces está indicada. El estudio de la presencia en el suero de anticuerpos antitiroideos es una exploración válida para establecer el diagnóstico de tiroiditis autoinmunitaria como etiología del hipotiroidismo. La gammagrafía tiroidea no está indicada en el hipotiroidismo del adulto. La determinación de los anticuerpos anticélula parietal gástrica está justificada en el hipotiroidismo de origen autoinmunitario, ya que estos anticuerpos son positivos en un tercio de los casos y pueden acompañar o preceder a la aparición de una anemia perniciosa. 3. 4. 5. Tratamiento El tratamiento tiene como objetivo restituir a la normalidad los valores circulantes de hormonas tiroideas y sus efectos metabólicos y, consecuentemente, los de TSH. Los elementos básicos a considerar en el tratamiento son: 1. La tiroxina es el tratamiento específico y de elección en el hipotiroidismo; la dosis recomendada corresponde aproximadamente a 1,6 µg/kg de peso ideal. Los niños requieren dosis proporcionalmente mayores. Dada la vida media del medicamento, se usa sólo una dosis diaria. 2. Si la TSH no baja a niveles normales, se considera que el tratamiento es insuficiente; a la inversa, ENDOCRINOLOGIA Página 33 6. 7. TSH suprimida implica sobretratamiento y deberá ser ajustada la dosis. Para estos efectos, y poder conseguir aportes intermedios de las formulaciones farmacéuticas disponibles, puede usarse una dosis distinta por uno o algunos días de la semana, de modo de obtener un promedio semanal acotado a las exactas necesidades del paciente. Los requerimientos de tiroxina exógena disminuyen con la edad por menor metabolización de ella. Para controlar el tratamiento se usa TSH, idealmente medida por un método sensible como el IRMA radioinmunométrico. Es muy útil agregar la cuantificación de T4 total o libre, según corresponda. La cuantificación de T3 tiene limitaciones, ya que estará supeditada a los cambios que ocurran en la conversión periférica de T4 a T3. En pacientes de edad avanzada, cardiópatas, coronarios, etc, el inicio del tratamiento con tiroxina debe ser cuidadoso en cuanto a las dosis y a la progresión de las mismas. En estas circunstancias se recomienda empezar con dosis no mayores a 25 µg/día, y efectuar ascensos de dosis cada 4 a 6 semanas, vigilando la respuesta y las repercusiones clínicas. En personas jóvenes y sanas se pueden iniciar el tratamiento con dosis mayores y aumentarlo en plazos menores. El hipotiroidismo debe ser entendido como una enfermedad de por vida y requiere controles anuales con TSH y T4. En el caso de hipotiroidismo secundario o terciario se controla con T4 y T3 solamente. En el hipotiroidismo secundario o terciario debe considerarse la posibilidad de una eventual insuficiencia suprarrenal, que al aumentar el metabolismo con tiroxina podría ponerse de manifiesto. Este punto debe ser aclarado antes del tratamiento. Hipertiroidismo Secreción y consiguiente paso a la sangre de cantidades excesivas de hormonas tiroideas. Etiología Sobreproducción de hormonas tiroideas (enfermedad de GravesBasedow - causa más frecuente -, adenoma tóxico y bocio multinodular), destrucción de la glándula tiroidea (tiroiditis linfocítica, subaguda y de Hashimoto) y otras (tirotoxicosis por amiodarona). Etiopatogenia Enfermedad de Graves-Basedow Anticuerpos de la clase IgG dirigidos contra el receptor de la TSH (TSI-Thyroid Stimulating Immunoglobulins), que se unen al receptor de la TSH (R-TSH) presente en la membrana celular de las células foliculares tiroideas estimulando la proliferación y la producción de hormonas tiroideas. Los mecanismos que inician y controlan la respuesta autoinmunitaria contra el R-TSH y otros autoantígenos tiroideos (tiroglobulina, tiroperoxidasaTPO)no se conocen, aunque existen datos que sugieren que intervienen alteraciones del propio tejido tiroideo (expresión excesiva de moléculas de HLA y de moléculas de adhesión, de citocinas y quimiocinas que inducen la infiltración linfocitaria) y alteraciones en la tolerancia inmunitaria. En el 5 al 10% de los casos, se asocia con otras enfermedades autoinmunitarias de tipo órganoespecífico (diabetes mellitus tipo 1, anemia perniciosa, miastenia grave, enfermedad de Addison ENDOCRINOLOGIA Página 34 autoinmunitaria, etc.) y el 25% de los enfermos afectos de tiroidopatías autoinmunitarias tienen algún otro autoanticuerpo órgano-específico (anticélula parietal gástrica, antisuprarrenal, anticélulas del islote pancreático) que, en general, indican una forma subclínica de la enfermedad correspondiente. La oftalmopatía infiltrativa de la enfermedad de Graves-Basedow es una enfermedad autoinmunitaria dirigida contra los antígenos de la musculatura extraocular. Adenoma tóxico. Mutaciones somáticas en el receptor de la TSH. Produciría hiperactividad e hiperplasia de una clona de células foliculares tiroideas que se expandiría y provocaría el adenoma hiperfuncionante. Bocio multinodular tóxico. Su patogenia es la del bocio simple. Los episodios sucesivos de hiperplasia e involución conducen a la tercera fase evolutiva o fase de nodularidad del bocio simple. Algunos de estos nódulos son "fríos" no funcionales y otros son "calientes", seudoadenomatosos. El exceso de aporte yódico aumentaría la función alguno de los calientes, originando hipertiroidismo autónomo, independiente de la regulación por la TSH endógena que se inhibiría, originando reposo funcional del resto del parénquima tiroideo. Cuadro clínico 1. Alteraciones generales Aumento de sensibilidad al calor y sudación excesiva, que es caliente y generalizada. Además astenia, poliuria y polidipsia frecuente y pérdida de peso, aunque el apetito suele estar conservado o incluso aumentado 2. Piel y faneras Piel caliente y húmeda (vasodilatación cutánea y excesiva sudación), con frecuencia se aprecia eritema palmar y puede observarse hiperpigmentación cutánea (hipersecreción de ACTH secundaria a un metabolismo acelerado del cortisol). El cabello se vuelve fino y en ocasiones frágil y las uñas, blandas y friables, con ocasionales uñas de Plummer (onicólisis con despegamiento de la parte distal de la uña del lecho ungueal. 3. Aparato circulatorio La resistencia vascular periférica está disminuida y el gasto cardíaco aumentado como consecuencia del incremento del volumen sistólico y de la frecuencia cardíaca. El pulso es saltón como consecuencia de un incremento de la presión sistólica y de un descenso de la diastólica. Son muy frecuentes los trastornos del ritmo, y muy especialmente la fibrilación auricular. Los pacientes afectos de enfermedad de Graves-Basedow presentan con mayor frecuencia prolapso de la válvula mitral (patogenia desconocida). La denominada cardiopatía tirotóxica es más frecuente en los pacientes que presentan alguna cardiopatía subyacente y puede manifestarse por trastornos del ritmo, insuficiencia cardíaca e insuficiencia coronaria. En ocasiones se trata de una miocardiopatía reversible. 4. Aparato digestivo Alteraciones del ritmo intestinal, con deposiciones más frecuentes y de menor consistencia, aunque la diarrea intensa es infrecuente. Pueden aparecer alteraciones de las enzimas hepáticas, hepatomegalia e ictericia. 5. Sangre y sistema hematopoyético Puede aparecer anemia normocrómica y normocítica. Las alteraciones de la serie blanca no son relevantes y en casos muy graves pueden observarse esplenomegalia y adenopatías. 6. Sistemas nervioso y muscular Nerviosismo, agitación, inquietud, taquilalia, hiperactividad y labilidad emocional. Temblor fino sobre todo con las manos extendidas, pero también en la ENDOCRINOLOGIA Página 35 lengua y en los párpados semicerrados. Reflejos osteotendinosos rápidos y vivos. Aumento de la fatigabilidad muscular de predominio proximal, en ocasiones una auténtica miopatía tirotóxica. 7. Sistema endocrino Alteraciones funcionales endocrinas, pero de escasa relevancia clínica, como el aceleramiento del metabolismo del cortisol. En el área gonadal pueden producirse diversas alteraciones (en el varón puede haber una disminución de la potencia, pero al inicio del proceso existe en ocasiones un aumento de la libido y en algunos casos ginecomastia relacionada con un incremento del nivel de conversión de andrógenos a estrógenos; en la mujer pueden observarse alteraciones menstruales, disminución de la fertilidad y abortos más frecuentes). 8. Metabolismo Curva de glucemia anormal (aparición de un pico elevado a la hora, con una cifra normal o casi normal a las 2 h) y secreción de insulina aumentada. El metabolismo de las grasas está muy acelerado, tanto su producción como su degradación, y las anomalías resultantes son un aumento de los ácidos grasos libres circulantes y una disminución de la colesterolemia. El metabolismo de las proteínas está muy aumentado, pero sobre todo su degradación, lo que provoca un balance negativo de nitrógeno, pérdida de peso, debilidad muscular e hipoalbuminemia. Se favorece la resorción ósea, que puede provocar hipercalcemia, eliminación elevada de calcio y fósforo por la orina y por las heces e incremento en la fosfatasa alcalina y como consecuencia, una desmineralización del hueso. 9. Alteraciones específicas en las causas autoinmunes (Graves- Basedow). Además del hipertiroidismo, es típica la existencia de bocio difuso (generalmente pequeño, con aumento de la vascularización pudiendo apreciarse pulsaciones por el tacto y un soplo en la auscultación), oftalmopatía (no infiltrativa: retracción bilateral del párpado superior que simula exoftalmos, signo de Graefe; infiltrativa: infiltración del tejido retroorbitario y a veces miopatía extraocular, con exoftalmos que puede acompañarse de parálisis de los músculos oculares y en sus fases avanzadas puede conducir a la ceguera)y menos frecuentemente, pero característico, mixedema pretibial (acompaña a la oftalmopatía infiltrativa, se debe a la acumulación de mucopolisacáridos en la dermis y se caracteriza por una induración violácea de la piel, casi siempre en la región pretibial). También vitíligo, anemia perniciosa, miastenia grave y crisis tirotóxica (rara complicación grave, de inicio agudo, con fiebre alta, gran sudación, taquicardia extrema con fibrilación auricular o sin ésta, temblor, agitación psicomotriz, diarrea, deshidratación y, por último, postración progresiva, delirio, coma y muerte en el 20%). 10. Alteraciones específicas en el bocios nodulares tóxicos. Nódulo tiroideo de pequeño o mediano tamaño, indoloro y de consistencia firme, que crece lentamente, en el adenoma tóxico y bocio multinodular, grande, en el boico multinodular tóxico. Nunca se observa oftalmopatía infiltrativa o mixedema pretibial. Diagnóstico Cuadro clínico compatible y determinación de las concentraciones de T4 libre y de TSH (y T3 si T4 libre normal). - Anticuerpos antitiroideos tiene poco interés práctico para el diagnóstico de la enfermedad. Los anticuerpos antirreceptor de la TSH ENDOCRINOLOGIA Página 36 no son necesarios para el diagnóstico, pero puede resultar útiles en el diagnóstico diferencial con otras formas de hipertiroidismo. - Pruebas de imagen no sirven para el diagnóstico, pero si pueden servir para el diagnóstico diferencial (Gammagrafía en un adenoma tóxico-nódulo caliente, en el bocio multinodular tóxicocaptación heterogénea con nódulos calientes y frios, y en la tiroiditis subaguda-ausencia de captación). Tratamiento Hay tres opciones terapéuticas en el hipertiroidismo, las cuales no son mutuamente excluyentes: drogas antitiroideas, radioyodo y cirugía. La elección de terapia dependerá de la edad y condiciones personales del paciente, de las características semiológicas de la glándula tiroides y de la presencia de situaciones como embarazo, oftalmopatía grave o aporte masivo de yodo. Drogas Antitiroideas El tratamiento con drogas está indicado por tiempo breve para preparar a la cirugía o al radioyodo. Su uso prolongado sólo se justifica para tratar el hipertiroidismo de la enfermedad de Graves-Basedow. En Chile disponemos sólo de propiltiouracilo, una tioamida que se concentra en el tejido tiroideo e inhibe la síntesis de hormonas tiroideas, bloqueando la oxidación y organificación del yodo. Además tiene un leve efecto de bloqueo de la conversión periférica de T4 a T3, cuando se usa en dosis altas. El tratamiento se suele iniciar con 300 mg diarios divididos en 3 dosis. Los efectos adversos son raros y por lo general de poca importancia: prurito, rashes en extremidades. Sin embargo hay 3 efectos adversos serios sobre los cuales es preciso advertir al paciente: agranulocitosis, daño hepático y síndrome lúpico. Es preciso indicar al paciente las manifestaciones iniciales de estos cuadros y recomendar la suspensión del tratamiento con consulta médica inmediata si llegaran a ocurrir. Si hay síntomas adrenérgicos importantes (hipersudoración, taquicardia, temblor) es aconsejable agregar un bloqueador ß adrenérgico (ejemplo: propranolol 20 mg cada 8 horas) a menos que exista una contraindicación como asma bronquial u otra. El eutiroidismo se suele conseguir a las 6 a 8 semanas de tratamiento, si bien antes de eso ya se experimenta mejoría clínica. La causa más frecuente por la que se retarda la obtención del eutiroidismo es la falta de cumplimiento del tratamiento. Otras causas son la presencia de bocio muy grande, el aporte masivo de yodo antes del tratamiento, un hipertiroidismo muy intenso o una dosis insuficiente de propiltiouracilo. En la enfermedad de Basedow-Graves, una vez obtenido el eutiroidismo, puede disminuirse la dosis de propiltiouracilo a 200 ó 100 mg diarios, según la evolución de los niveles de TSH y T4. El tratamiento debe durar largo tiempo, por lo general uno a dos años, período en el cual suele observarse una remisión espontánea del fenómeno autoinmune que originó el hipertiroidismo. No es recomendable usar hormona tiroidea (tiroxina o triyodotironina) junto con el propiltiouracilo durante el tratamiento del hipertiroidismo de la enfermedad de Graves-Basedow, ya que hay abundante evidencia de que ello es inútil. El hipertiroidismo tiende a recurrir después de la suspensión del tratamiento en porcentajes que van entre el 30 y el 70% de los casos. A mayor ENDOCRINOLOGIA Página 37 duración de la terapia antitiroidea, menores son las probabilidades de recidiva. En cambio, la persistencia de TSH suprimida o de un "índice de inhibición" elevado, dado por sustancias que desplazan a la TSH de su receptor, presumiblemente el anticuerpo estimulador del receptor de tirotropina (TRAb), favorecen la recidiva. El primer año después de suspender el tratamiento es el período en que con mayor frecuencia aparecen las recidivas. En caso de que así sea, puede reiniciarse el tratamiento con propiltiouracilo, pero debe considerarse con más fuerza el uso de radioyodo o la cirugía. Radioyodo Es el tratamiento más indicado para el hipertiroidismo de la enfermedad de Graves, especialmente si se trata de una recidiva después de usar drogas. También es de elección en el bocio multinodular tóxico, en pacientes con cardiopatías y en sujetos con graves reacciones adversas a las drogas. En cambio, está contraindicado en el embarazo y en la lactancia y no debe usarse si ha habido recientemente un aporte masivo de yodo (medios de contraste, amiodarona). En pacientes con oftalmopatía intensa es preferible no usarlo, porque hay ciertas evidencias de que ella podría agravarse, especialmente si se trata de fumadores. Los pacientes con bocio difuso hipertiroideo por lo general se tratan con propiltiouracilo hasta 3 a 5 días antes de recibir radioyodo, para conseguir el eutiroidismo, a fin de evitar la exacerbación del hipertiroidismo que puede ocurrir con la tiroiditis actínica que induce el radioyodo. Esto es especialmente importante en ancianos y en cardiópatas. En cambio, los pacientes con bocio nodular tóxico pueden recibir directamente el radioisótopo, que se acumula en los nódulos hiperfuncionantes y no en el tejido tiroideo normal, que está funcionalmente suprimido por la ausencia de TSH. El tratamiento previo con propiltiouracilo en estos casos puede hacer que aparezca secreción de TSH y que aumente la captación de radioyodo por el tejido sano, con lo que aumenta la incidencia de hipotiroidismo postradioyodo. No hay criterios uniformes para calcular las dosis terapéuticas de radioyodo. Esta indicación debe ser hecha por el endocrinólogo, que tendrá en cuenta elementos como el tamaño tiroideo, la captación de radioyodo, la presencia o ausencia de nódulos y su funcionalidad, si ha habido o no pretratamiento con propiltiouracilo, y la condición general del paciente, con especial atención a las enfermedades concomitantes. El radioyodo es capaz de curar el hipertiroidismo en más del 80% de los casos, con una sola administración. Su efecto no es inmediato, sino que tarda 1 a 3 meses, por lo que a veces es preciso agregar propiltiouracilo en dosis bajas mientras se manifiesta. La complicación más frecuente del radioyodo es el hipotiroidismo, al cual finalmente llegan casi todos los pacientes. Muchos no lo consideran una complicación, sino un objetivo del tratamiento, ya que su manejo es más fácil. Hasta un 20% de los pacientes pueden manifestar un hipotiroidismo dentro del primer año de administración del radioyodo, el cual muchas veces es transitorio. Después de ese plazo, la incidencia sube a razón de 2 a 3% al año. Por esto es importante que todo paciente que reciba radioyodo sea controlado al menos una vez al año por el resto de su vida. No hay ninguna evidencia, después de más de 50 años de uso, de que el radioyodo como tratamiento del ENDOCRINOLOGIA Página 38 hipertiroidismo, se asocie a mayor riesgo de teratogénesis, infertilidad o leucemias. Un estudio, sin embargo, detectó un leve aumento del riesgo de cáncer. Por ello no es aconsejable su uso como terapia de primera elección en niños o adolescentes. Cirugía De ser la única terapia, la cirugía ha pasado a ser la menos utilizada entre las alternativas terapéuticas del hipertiroidismo. Su uso se reserva para los casos de mala respuesta o complicaciones del propiltiouracilo en embarazadas o niños, para casos de bocios muy grandes o multinodulares, especialmente aquéllos con extensión intratorácica que den manifestaciones de compresión, para adenomas tóxicos de más de 3 cm, y para casos en que el hipertiroidismo se acompaña de carcinoma tiroideo diagnosticado en punción con aguja fina. Medición TSH en Suero Aumentada Disminuida T4 Serica Normal T4 Sérica No Disfunción Aumentada Disminuida Aumentada Normal ¿Hipotiroi‐ dismo Subclínico? Disminuida Normal HIPOTIROIDISMO Tirotoxicosis Subclínica Medir T3 Medir Anticuerpos TIROTOXICOSIS Normal HIPERTIROIDISMO HIPOFISIARIO (FRENTE A RESISTENCIA DE LA HORMONA TIROIDEA) ENDOCRINOLOGIA Página 39 HIPOTIROIDISMO Aumentada HIPOFISIARIO GÓNADA FEMENINA Y CICLO MENSTRUAL reproductora. 1. Ciclo genital femenino III. MADUREZ: dura unos 30 años. Hay Es un período Desde el nacimiento a la muerte, se una capacidad sexual completa. suceden tres diferenciadas: IV. CLIMATERIO: es etapas de transición. bien el intermedio entre la madurez y la senectud. Dura I. INFANCIA: desde el nacimiento hasta los 10-12 años de edad. Se unos 10-12 años, entre los 45 y los 58 años aproximadamente. Cesa la caracteriza por el predominio de los función procesos de crecimiento. Genitales externos: la vulva menopausia. una situación el clítoris diferenciado, mayores - está más en ovárica V. SENECTUD: el y tiene aparato lugar la genital se anterior, atrofia, los ovarios se reducen. Las esta ya bien los labios trompas también sufren un descenso de longitud y de espesor. El útero están poco se adelgaza y se atrofia el desarrollados y sobresalen los menores. Ovarios: son muy endometrio. Las paredes vaginales se adelgazan y se secan. La vulva pequeños, pero van aumentando a lo largo de la infancia, adelgaza, disminuyendo los labios mayores y casi desapareciendo los gracias a que los folículos menores. El tienen cierto grado de actividad. La mayoría de los tiende a atrofian relajarse. Las mamas se y pierden el tejido folículos glandular. en desarrollo pierde el vello pubiano. La piel se suelo de la pelvis entran en atresia precoz, y - su número desciende de 10 millones hasta 300.000 en la El ciclo serie pubertad. Útero: tiene anatomofisiológicos un cuello dos veces mayor que el - cuerpo uterino. Vagina: poco - desarrollada. Mamas: iguales - desde la menopausia genital de femenino es una fenómenos que pubertad de forma se repiten hasta la periódica y regido por estructuras superiores a través de hormonas. a las El fenómeno fundamental es la de los varones. Unos años antes de la pubertad empiezan ovulación, que se produce en el ovario. Este órgano tiene una a formarse los esbozos de los función doble: conductos galactóforos. Hormonas: la FSH y la LH se los 4 mantienen años. altas Luego hasta son muy bajas. Los estrógenos y la progesterona son muy bajos. 1. Liberación germinales. de células 2. Secreción de hormonas. Ocurre cada 28 días, pero es normal entre los 26 y 32 días. (la Federación Internacional de Ginecólogos y Obstetras (FIGO) II. PUBERTAD: entre años. Aparece la primera regla) y los 10 y 18 menarquia (la la ENDOCRINOLOGIA Página 40 capacidad admite entre 21 y 37 días) con escasas variaciones en la misma mujer. Grandes variaciones son normalmente patológicas y suelen ser la selección folicular. Al final de ciclos anovuladores. Sin embargo, la fase lútea de un ciclo, comienza estas situaciones pueden darse de manera esporádica en mujeres un crecimiento más acelerado para formar la cohorte folicular, de la normales. cual A lo largo de la vida de una mujer, dominante que será el que ovule en ese ciclo. se dan unos 450 ciclos (y habría que - se seleccionará Proliferación un de folículo las células restar los embarazos, lactancias, ciclos anovulatorios y toma de cúbicas para formar la membrana granulosa: Las células del estroma fármacos anticonceptivos). Estos que ciclos se acompañan de la secreción diferenciarse cíclica de hormonas ováricas, que preparan al organismo para la interna vascularizada. Entre la granulosa y la teca se interpone una fecundación. Si ésta no tiene lugar, membrana. el ciclo vuelve al punto de partida y ocurre la menstruación. Debido a estructura se denominafolículo primario o preantral. que la menstruación es el fenómeno - Vacuolización de las células de la más llamativo del ciclo, se considera el inicio del ciclo. granulosa confluyen le rodea comienzan en El conjunto la cavidad esta espacios elantro antral. forma de este modo secundario o antral. 2. Ciclo ovárico de hasta que los para dar folicular o a la teca Se el folículo En la zona cortical de los ovarios, - La mayoría de los folículos de la se encuentran primordiales y en cohorte degeneran, mientras que uno se convierte en el folículo los folículos su interior se localiza la célula germinal u oocito dominante, primario de antral y se acerca a la superficie diplotene de la profase meiótica desde poco antes del nacimiento de ovárica hasta hacer una prominencia ricamente vascularizada, llegando a la niña). La célula germinal está ocupar rodeada de una capa de células epiteliales planas que corresponden denominándosefolículo terciario o de De a las células de la granulosa. formado por: (detenido en la fase liberación ovulación del distingue oocito dos en fases del cavidad ovario, maduro, Graaf. Está del polisacáridos que es la zona Maduración folicular. II. mitad su Oocito: de 150-200 µm y envuelto por una membrana de ciclo: I. la agranda la o La que Fase de cuerpo lúteo. o pelúcida. Cúmulo ovígero o prolíjero: envoltura es una disco de células de la granulosa. Su capa interna, la corona radiada, adopta I. FASE DE MADURACIÓN FOLICULAR. disposición radial. - Transformación de las células planas de la granulosa en cúbicas. unas finas prolongaciones que llagan hasta el oocito para Este hecho ocurre simultáneamente en nutrirlo varios folículos, generalmente del mismo ovario. Puede tener lugar información. El encuentra en la varios ciclos antes de que se inicie ENDOCRINOLOGIA Página 41 y una Tiene transmitirle cúmulo se pared del antro o más alejada de la teca dando el folículo hemorrágico superficie del ovario. que se cierra por la formación de un Licor folicular: está en el interior del antro. Es un tapón de fibrina hemático central. y un coágulo líquido de aspecto en agua de roca. Las paredes del antro están tapizadas por células de la granulosa en 2-3 capas y se asientan sobre membrana vítrea o la de Slaviansky. o II. FASE DE CUERPO LÚTEO. Tiene una duración de 14±2 días y se subdivide en cuatro periodos: a) Teca: son células redondeadas con lípidos provenientes del estroma ovárico diferenciado y vascularizado. Por fuera, está el estroma normal del ovario, que antes se denominó Proliferación: las células de la granulosa y de la teca sufren un proceso de proliferación y diferenciación especifica células luteínicas. a b) Vascularización: se teca externa. Los vasos de la produce angiogénesis a partir teca no ovígero, de los capilares de la teca e invaden los espacios entre las células luteínicas. llegan al cúmulo por lo que la granulosa y el cúmulo se nutren por difusión. En dos semanas, se produce un rápido crecimiento del folículo, c) Florescencia: fase de máxima actividad endocrina. Es una glándula de 17-20mm de se ensanchan los espacios intercelulares en el cúmulo (se dice diámetro de color amarillento esta forma, se despega el oocito más debido a la gran cantidad de sustancias lipoides. El la corona radiada de la zona de anclaje. La rotura folicular o coágulo se ha completamente. que las células se expanden). De dehiscencia folicular se produce en una zona cónica prominente avascular y clara: El estigma. Con la rotura del folículo se libera el liquido antral, el oocito y la corona radiada. Esta salida del ovario se produce gracias a la activación del activador tisular del plasminógeno, que activa a la plasmina, que a su vez activa a la colagenasa disuelva la membrana zona de la rotura. basal en que la - Se reanuda la meiosis del ovocito y da lugar a dos células desiguales, el oocito II y el primer corpúsculo polar, ambos encerrados en el interior de la zona pelúcida. - Se produce el colapso de la cavidad folicular, apareciendo focos de hemorragia desde los vasos de la ENDOCRINOLOGIA Página 42 d) reabsorbido Regresión involución: si embarazo, o hay no el cuerpo lúteo comienza su involución el día 10 después de la ovulación. Las células luteínicas se vacuolizan y degeneran, y se inicia una invasión por fibroblastos, pero sobre todo por leucocitos y macrófagos, que generan una brusca liberación de radicales O2, que tienen deletérea sobre una el lúteo. se otras También sustancias de acción cuerpo liberan como la PG F2α, citokinas y factores inhibidores del crecimiento celular, lo que lleva a una rápida involución. Al final, lo cual, como corresponde a las se características de la sustituye por tejido conjuntivo que permanece como una cicatriz fibrosa que es descamación, se produce de forma irregular. Al principio, el elcuerpo la estroma es denso y las glándulas ovario estas son estrechas, de luces poco evidentes y paredes tapizadas de albicans. En menopausia, todo el está lleno de cicatrices, lo que le confiere un aspecto arrogado y por eso se llama ovarium gyratum. Si hay embarazo, en el día 14 aumenta su tamaño y producción hormonal. Su función permanece hasta bien entrado el tercer mes de gestación y por eso se denomina cuerpo lúteo verdadero o de embarazo. 2. Ciclo endometrial El endometrio sufre una serie de transformaciones destinadas a albergar el huevo en caso de que se produzca la fecundación. En el endometrio se distinguen dos capas: 1. Capa basal, donde se sitúan los fondos de saco de las glándulas. Es un tejido conjuntivo denso y que no sufre alteraciones cíclicas ni descamaciones. 2. Capa funcional, de un epitelio alo con frecuentes mitosis y pseudoestratificaciones. En la segunda semana prosigue el aumento de espesor y la actividad glandular es evidente, ensanchándose las glándulas y teniendo unas luces más visibles. El estroma no crece tan rápido y aparece más laxo, lo que hace que las glándulas se hagan flexuosas (solo en la parte media y profunda del endometrio, la desembocadura permanece recta) Esto permite distinguir: o Capa superficial o compacta: con los tubos glandulares rectos. o Capa profunda o esponjosa: con tubos festoneados. La vascularización también crece, adoptando una disposición helicoidal tejido conjuntivo laxo y rica en glándulas, que se descama en la parte profunda y alrededor de las glándulas hay una profusa red en cada menstruación para capilar. luego volverse a regenerar. En el ciclo endometrial también Este crecimiento es máximo el día 14 del ciclo. se distinguen dos etapas: I. FASE DE PROLIFERACIÓN Se inicia con la descamación del II. FASE DE SECRECIÓN. endometrio, que se produce en un periodo de tiempo variable y de Después de la ovulación, disminuye su espesor durante unas horas, forma fragmentaria. A partir de debido a la brusca disminución de la la zona basal se va tapizando totalmente la cavidad uterina, secreción hormonal causada por el colapso del folículo. Luego recupera ENDOCRINOLOGIA Página 43 y aumenta su filancia (capacidad de estirarse) su tamaño e incluso lo supera. Las glándulas aumentan su volumen, sus células ya no se dividen, sino que se alargan y desaparece la - pseudoestratificación. El núcleo se Periodo preovulatorio: tiene desplaza de la base al centro de las células. y tiene la capacidad de cristalizar al desecarse, en forma de hojas de helecho del sistema tetragonal. En el día 17 comienza a notarse el depósito de glucógeno en la base de las células. Con los días, llega un índice refractométrico mínimo incluso a superar al núcleo. En el Fase luteínica: se hace más denso, con aspecto estroma hay un ligero edema y los vasos se hacen más espiralados. sucio, capacidad En la última semana, aumenta aún más espermatozoides el edema. Las glándulas se dilatan más y el endometrio crece en óptimo para ascender en los días de la ovulación. espesor. Las células vierten llena las Estas para luces En los 2-3 últimos días, se produce no hay embarazo, - ni cristalizar. un sirven los medio capa participa en Fase preovulatoria: el cuello y el istmo están abiertos. El estroma, con gran la de modificaciones ofrecer a El miometrio también los cambios cíclicos: miometrio presenta alternancias contráctiles que cantidad de citoplasma y un núcleo prominente. Si filancia 4. Ciclo miometrial la reacción predecidual, que afecta a las células del aumentando de volumen sin sus secreción al tubo glandular y el núcleo vuelve a la posición basal; el glucógeno glandulares. - favorecen el ascenso de los espermatozoides. - Fase postovulatoria: el cuello y el istmo se cierran, el funcional se desmorona y produce pequeñas hemorragias que se extenderánà la menstruación. miometrio permanece reposo, favoreciendo nidación del huevo en fondo uterino. en la el 3. Ciclo endocervical Las células secretoras de moco desarrollan también un ciclo en conexión con la función ovárica: - Fase folicular: aumento progresivo de la secreción, que se hace más abundante, fluida, clara ENDOCRINOLOGIA Página 44 Menstruación: las contracciones son evidentes, el cuello y el istmo se relajan, lo que favorece la salida de la sangre. 5. Ciclo vaginal El epitelio formado por de la tres vagina capas: está basal, intermedia y superficial. En el momento de la menstruación el grosor total es de 150-180µm. ovular, fecundación y trasmigración del huevo. 7. Ciclo mamario Se produce un aumento de volumen y También se distinguen dos fases: tensión mamaria a lo largo del ciclo Proliferación: comi debido al aumento de Vascularización y a la proliferación celular, junto enza por el ascenso de los estrógenos. En la capa basal cambios son máximos en el período - aparecen mitosis y las otras capas crecen en espesor. con un cierto grado de edema. Estos premenstrual, pero son inconstantes y distintos en cada mujer. Comienza a aparecer glucógeno en los citoplasmas, sobre todo en la capa intermedia. Así alcanza un grosor de 200300µm en la ovulación. - Descamación: las células hinchan superficiales y comienzan 8. Manifestaciones generales Las hormonas ováricas también tienen acciones colaterales en otros aparatos: en el sistema endocrino, se a descamarse. Lo mismo pasa con la capa intermedia. en la piel, en el SNC, en el metabolismo y en el sistema termorregulador. Así se explican: - En una citología, las células al principio son eosinófilas y con gran citoplasma. Después de la ovulación, descaman en placas, con citoplasma plegado basófilo y núcleos vesiculares. el con Alteraciones psíquicas: jaquecas catameniales, síndromes premenstruales. - Ascenso de la temperatura basal en 0,5ºC en la segunda fase del ciclo por la progesterona. HIPOGONADISMO 6. Ciclo tubárico Se ha descrito proliferación y una de fase de descamación coincidiendo con las del endometrio, aunque con menor relevancia. Su finalidad sería la posible nutrición del huevo útero. en su camino hacia el La musculatura también sufre cambios en su actividad contráctil, relacionados con la captación ENDOCRINOLOGIA Página 45 El eje hipotálamo-hipófisis-testículo regula la actividad gonadal y su función depende de varias hormonas. Las alteraciones de dicho eje causan hipogonadismo masculino primario o secundario y para el manejo adecuado de los pacientes es indispensable una comprensión profunda de los mecanismos fisiopatogénicos involucrados. La función gonadal normal garantiza la ejecución de la misión reproductiva y sexual del hombre. Sus alteraciones conducen a la disfunción de varios órganos tales como el cerebro, y los músculos, junto con profundos trastornos del área sexual. El funcionamiento del EHHT depende de varias hormonas: la HLGn, secretada por el hipotálamo estimula la producción hipofisaria de gonadotropinas (HFE y HL). Mientras que la HFE regula la espermatogénesis por las células foliculares del testículo, la HL controla la secreción de testosterona por las células de Leydig. A su vez la producción de inhibina por las células de Sertoli y de testosterona por las células de Leydig regulan la secreción de gonadotropinas, pues la inhibina frena la secreción de HFE y la testosterona controla la producción de HL (figura 1). tono de la voz, la formación ósea y el desarrollo puberal. Causas de hipogonadismo masculino El hipogonadismo masculino se presenta cuando los testículos dejan de producir los espermatozoides, la testosterona o ambos. Hay tres mecanismos básicos: en primer lugar, daño testicular intrínseco (hipogonadismo primario); en segundo término, defectos del eje hipotálamo-hipófisis-testículo (hipogonadismo secundario) y, por último, una respuesta disminuida o ausente de los órganos blanco (piel, vello, próstata) a los andrógenos (resistencia androgénica). En los dos primeros casos la producción hormonal está disminuida, pero la respuesta de los órganos periféricos a la hormona es normal, en tanto que en la resistencia androgénica, aunque la síntesis de testosterona es normal, la respuesta biológica está disminuida.(1, 2) La testosterona testicular se convierte en dihidrotestosterona por acción de la enzima 5-a-reductasa en la próstata y la piel. La dihidrotestosterona es más potente que la testosterona y media algunos de los efectos androgénicos de esta última. Los andrógenos actúan en la diferenciación de los genitales externos, el deseo sexual, el crecimiento del vello axilar y pubiano, el desarrollo de la masa muscular, la textura de la piel, el ENDOCRINOLOGIA Página 46 La deficiencia hormonal puede presentarse antes de nacer, antes de la pubertad o después de esta. La ausencia de testosterona en el feto conduce a la presencia de genitales ambiguos al nacer. La insuficiencia testicular prepuberal se caracteriza por disminución del tamaño testicular (menor de 2,5 cm de largo o menos de 5 mL de volumen), pene pequeño (3-5 cm), disminución del vello corporal, voz femenina, próstata pequeña, disminución de la libido y de la masa muscular. En algunos casos se presenta el hábito eunucoide, es decir que la distancia del pubis al piso es mayor que la del cráneo al pubis y la envergadura (distancia entre la punta de los dedos medios con los brazos extendidos) es mayor a la estatura. La deficiencia hormonal puede presentarse antes de nacer, antes de la pubertad o después de esta. La ausencia de testosterona en el feto conduce a la presencia de genitales ambiguos al nacer. La insuficiencia testicular prepuberal se caracteriza por disminución del tamaño testicular (menor de 2,5 cm de largo o menos de 5 mL de volumen), pene pequeño (3-5 cm), disminución del vello corporal, voz femenina, próstata pequeña, disminución de la libido y de la masa muscular. En algunos casos se presenta el hábito eunucoide, es decir que la distancia del pubis al piso es mayor que la del cráneo al pubis y la envergadura (distancia entre la punta de los dedos medios con los brazos extendidos) es mayor a la estatura. comportamiento antisocial, enfermedad crónica de los pulmones, venas varicosas, intolerancia a la glucosa, hipotiroidismo primario y carcinoma del seno. Las concentraciones de testosterona están en el límite bajo normal y las gonadotropinas hipofisiarias están elevadas. El extendido de la mucosa oral revela un patrón femenino y el cariotipo es XXY (figura 2). Para un adecuado enfoque del hipogonadismo es útil diferenciar entre la falla testicular (hipogonadismo primario o hipergonadotrópico) y los trastornos del EHHT, que corresponden al hipogonadismo secundario, también denominado hipogonadotrópico. Hipogonadismo primario La deficiencia primaria de la gónada masculina puede presentarse como parte integral de varios síndromes, tales como el síndrome de Klinefelter, el síndrome de Reifenstein y el síndrome de UlrichNoonan, o aparecer a consecuencia de destrucción del testículo (por trauma, compromiso vascular o tuberculosis), enfermedades sistémicas o autoinmunes y anorquia. Síndrome de Klinefelter Este síndrome está asociado a aberraciones cromosómicas, en las cuales un cromosoma femenino extra se adquiere a través de anomalías en la meiosis; por lo general es detectado durante la pubertad, pero muchos casos se diagnostican en edad tardía. La presentación clínica comprende un amplio rango de manifestaciones, desde un fenotipo casi normal hasta la ausencia de desarrollo sexual, pero los rasgos distintivos incluyen testículos pequeños, firmes y fibróticos, ginecomastia, proporciones esqueléticas anormales y hábito eunucoide. Puede existir un ENDOCRINOLOGIA Página 47 Síndrome de Reifenstein Esta afección se caracteriza por una resistencia androgénica parcial que puede detectarse al nacimiento en forma de hipospadia, criptorquidia y fusión del escroto. Puesto que el cariotipo de los pacientes es XY, durante la pubertad, aumenta la producción de testosterona con algo de efecto virilizante, pero las anomalías de los genitales persisten. La testosterona sirve como sustrato para la producción de estrógenos en el hígado y el tejido adiposo, de modo que hay ginecomastia. Los niveles plasmáticos de testosterona y dihidrotestosterona son normales o aumentados y las gonadotropinas (HFE y HL) también están aumentadas. Esto se debe al hecho de que la deficiencia de receptores androgénicos también existe en la hipófisis. La mayoría de estos pacientes crecen como hombres, pero algunos pueden educarse como mujeres si se extirpan los testículos tempranamente y se instaura tratamiento estrogénico. Síndrome de Ulrich-Noonan También conocido coma síndrome de Noonan o síndrome de Turner masculino porque los hallazgos físicos son muy similares (estatura baja, cuello alado, baja implantación de la línea del cabello, cúbito valgo). A diferencia de las mujeres con síndrome de Turner, los hombres con síndrome de Noonan tienen cromosomas normales (XY). También se presenta retraso mental, proptosis, hipertelorismo e implantación baja de las orejas. Estenosis de la válvula pulmonar y defecto interauricular son malformaciones congénitas frecuentes. Los niveles hormonales pueden ser normales o consistentes con hipogonadismo (testosterona baja, HFE y HL altos). Lesiones destructivas El traumatismo testicular puede producir infertilidad o deficiencia de testosterona. Incluso el daño testicular unilateral, como ocurre con la tensión del cordón espermático, en ocasiones causa atrofia testicular bilateral por compromiso vascular. Los tubos seminíferos son más sensibles a la radiación que las células de Leydig, pues dosis de 15 rad ocasionan disminución del número de espermatozoides, pero el efecto es reversible hasta que se llega a 600 rad. La quimioterapia también ejerce efectos nocivos sobre el testículo, sobre todo si se administra en combinación con radioterapia. Ciertas infecciones, como parotiditis epidémica, tuberculosis y lepra pueden afectar los testículos. La orquitis del virus de ENDOCRINOLOGIA Página 48 las paperas por lo general ocasiona infertilidad sin alterar la secreción testicular de testosterona; por su parte, la invasión del testículo por las micobacterias de la tuberculosis y la lepra provoca inflamación y aparición de granulomas con la consiguiente infertilidad y disminución de la síntesis de hormonas testiculares. Enfermedades sistémicas La función testicular se ve comprometida en diversos trastornos sistémicos; en los alcohólicos, el consumo excesivo de alcohol está asociado a hipogonadismo, tanto por acción directa sobre los testículos, como por el daño hepático que conduce a alteraciones en el metabolismo de las hormonas sexuales y ello se traduce, además, en el desarrollo de ginecomastia debido al aumento de la producción de estrógenos. El hipogonadismo es común en los pacientes con insuficiencia renal crónica y está relacionado con la hiperprolactinemia, la deficiencia de zinc y la acumulación de compuestos tóxicos que lesionan los testículos. La distrofia miotónica es un desorden trasmitido en forma autosómica dominante que se caracteriza por la inhabilidad para relajar músculos después de contraerse (miotonía) y sus manifestaciones clínicas comprenden atrofia muscular, calvicie frontal, opacidades del cristalino y atrofia testicular (acompañada de bajas concentraciones plasmáticas de testosterona y aumento de las cifras circulantes de gonadotropinas). Falla testicular autoinmune El daño del testículo como resultado de trastornos autoinmunes conduce a dos tipos de infertilidad: la primera, debida a la producción de anticuerpos contra los espermatozoides y la segunda, como resultado de la acción de anticuerpos contra los microsomas de las células de Leydig ,que afectan la secreción de testosterona. Deficiencia de 5-a-reductasa Esta enzima convierte la testosterona en dihidrotestosterona y su deficiencia es una entidad de transmisión autosómica recesiva caracterizada por genitales externos ambiguos (escroto bífido, pene pequeño con hipospadia)y criptorquidia (los testículos pueden estar situados en cualquier parte entre el escroto y el abdomen). Casi siempre, los pacientes son criados como niñas, pero en la pubertad, la producción de testosterona por los testículos permite el desarrollo masculino, que se traduce en engrosamiento de la voz y aumento del tamaño del pene y de la masa muscular. No obstante, los órganos que responden normalmente a la dihidrotestosterona (escroto, testículos, próstata) continúan siendo prepuberales debido a la deficiencia de este esteroide. Síndrome de feminización testicular Clínicamente estos pacientes son mujeres que se desarrollan como tales pero no menstruan. Desde el punto de vista cromosómico son hombres con ausencia de receptor androgénico. Durante la pubertad desarrollan crecimiento mamario y la vagina es ciega. Hay ausencia de vello axilar y pubiano. Los testículos pueden estar dentro del abdomen, el canal inguinal o los labios mayores. No hay respuesta a la administración de andrógenos pero sí de estrógenos. Anorquia En este caso no hay testículos, bien sea por defecto de su desarrollo o a consecuencia de extirpación ENDOCRINOLOGIA Página 49 quirúrgica. Aparecen las manifestaciones clínicas de hipogonadismo con concentraciones plasmáticas bajas de testosterona. Hipogonadismo secundario El rasgo distintivo del hipogonadismo secundario es la deficiencia de gonadotropinas y es el resultado de daño de la hipófisis o del área tuberal del hipotálamo, donde están localizadas las células productoras de HLGn. Tumores hipofisiarios Los tumores de la hipófisis afectan en mayor o menor grado la secreción de la HLGn, bien sea a consecuencia de la destrucción de las células secretoras de HFE u HL o como resultado de la hiperprolactinemia, que inhibe la síntesis de gonadotropinas. El tumor más común antes de la pubertad es el craneofaringioma y después de la pubertad el adenoma cromóforo. Sea cual sea el mecanismo involucrado, la deficiencia de HLGn o de gonadotropinas, lleva a la aparición de hipogonadismo. Síndrome de Kalimann Este síndrome se caracteriza por deficiencia aislada de gonadotropinas y anosmia o hiposmia, debido a desarrollo defectuoso del bulbo olfatorio. Los individuos afectados suelen presentar anomalías cardíacas, epilepsia, sordera, acortamiento del cuarto metacarpiano y malformaciones craneofaciales (en particular labio y paladar hendidos). La enfermedad se transmite de manera autosómica dominante y tiene una incidencia de 1 por cada 10.000 nacimientos masculinos. Hay hábito eunucoide, ginecomastia, atrofia testicular, masa muscular prepuberal y ausencia de vello corporal. Las gonadotropinas séricas están disminuidas y se normalizan con la administración repetida de HLGn pulsátil, lo cual indica que el defecto del EHHT está localizado en el hipotálamo. Lesiones infiltrativas Los granulomas hipofisarios de la sarcoidosis y de la tuberculosis, así como la infiltración de la hipófisis con hierro en los pacientes con hemocromatosis son causas relativamente raras de deficiencia de gonadotropinas. En estas afecciones tanto la testosterona como las gonadotropinas séricas están disminuidas.(1, 2) Función gonadal durante envejecimiento masculino el Los cambios del funcionamiento gonadal que se presentan durante el envejecimiento masculino son graduales y variables. Generalmente ocurren más tarde que en la mujer y afectan tanto al eje hipotálamohipófisis como los testículos. La producción de HL y HFE en respuesta a la administración de HLGn está disminuida y la secreción pulsátil de HFE y HL se va perdiendo de manera paulatina. Con el paso de los años el volumen testicular es cada vez menor, lo cual conduce a una disminución del número y calidad de los espermatozoides y a menores concentraciones séricas de testosterona total y libre. Como respuesta compensadora a la deficiencia de testosterona, hay hipersecreción de gonadotrofinas (HLE y HL), pero la respuesta testicular a tales hormonas es deficiente. Contribuyen al problema las enfermedades sistémicas de la edad, el uso de medicamentos y el consumo de alcohol y cigarrillo. Los síntomas son similares a los que ocurren en la mujer perimenopáusica e incluyen oleadas de calor, irritabilidad, debilidad muscular, disminución de la libido y disfunción eréctil. También se puede presentar ginecomastia y hay tendencia a la osteoporosis. ENDOCRINOLOGIA Página 50 Diagnóstico El diagnóstico del hipogonadismo se inicia con la toma meticulosa de la historia clínica y la búsqueda de hallazgos pertinentes durante el examen físico, pues el laboratorio sólo verifica la sospecha clínica. Una testosterona sérica total o libre por debajo de los límites normales con HFE y HL aumentadas confirma la presencia de hipogonadismo primario. En sujetos con hipogonadismo secundario la testosterona sérica está ligeramente disminuida o se encuentra en el limite bajo normal, al igual que las gonadotrofinas (HFE y HL)(tabla). Hay controversia sobre la utilidad de la testosterona total versus libre, ya que en algunos casos puede encontrarse disminución de la testosterona total con testosterona libre normal; esto se debe a una disminución de la globulina transportadora de las hormonas. Sin embargo, es más difícil y costoso, medir la testosterona libre, por lo que es más conveniente ordenar una testosterona total y reservar la testosterona libre para aquellos casos dudosos.