unidad11_fisicanuclear - Las cosas que me interesan
Anuncio
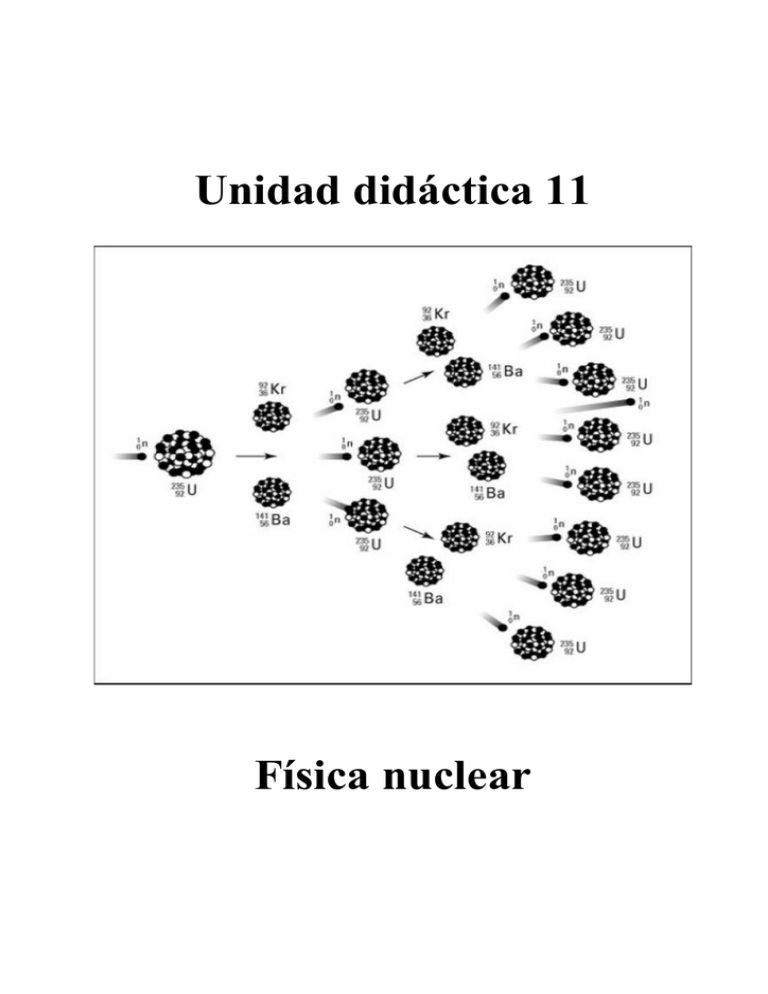
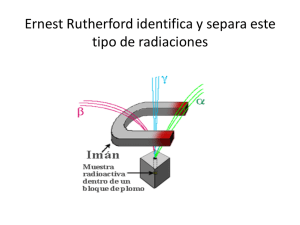
Unidad didáctica 11 Física nuclear 1.- Conceptos básicos. • Átomo: es la cantidad de materia más pequeña que conserva sus propiedades. El átomo está formado por dos partes: núcleo y corteza. El núcleo es muy pequeño comparado con el átomo en su conjunto y en él está concentrada casi toda la masa del átomo. Las partículas que se encuentran en el núcleo se llaman nucleones. • Protón, (p+): tiene carga eléctrica positiva y una masa igual a la del neutrón pero 1840 veces mayor que la del electrón. • Neutrón, (n0): no tiene carga eléctrica y su masa es igual que la del protón. • Electrón, (e-): tiene carga eléctrica negativa y una masa 1840 veces más pequeñas que el protón. Se encuentra girando alrededor del núcleo del átomo a distintas distancias del mismo, llamadas niveles energéticos u órbitas. Se encuentra en la corteza • Elemento: está formado por átomos que tienen el mismo número de protones. El número de protones que tiene el átomo determina los distintos tipos de los elementos químicos que existen en la naturaleza. Por ejemplo, si tiene un protón la sustancia se llama hidrógeno; si tiene dos se llama helio; si tiene 3 protones se llama litio, etc. • Número atómico (Z): es el número de protones que tiene un átomo. Dado que el átomo es neutro, el número de protones tiene que ser igual al número de electrones, para que se igualen las cargas eléctricas de distinto signo. Z = nº de protones = nº de electrones. • Número másico (A): es igual a la suma del número de protones y el número de neutrones. Nos da una idea de la masa del átomo. En general, en los átomos ligeros el número de neutrones suele coincidir con el de protones, pero en los átomos pesados el número de neutrones suele ser mucho mayor. A = nº de protones + nº de neutrones. Para facilitar el trabajo, los átomos se representan utilizando su número atómico Z, su número másico A y su símbolo: A Z X . Por ejemplo: 16 8 O • Isótopos son aquellos átomos de un mismo elemento químico que teniendo igual el número de protones tienen distinto el número de neutrones. Es decir, los isótopos tienen igual Z y distinto A; como poseen el mismo número atómico poseen el mismo símbolo químico. • Ión: es un átomo con carga eléctrica. Catión: átomo que ha perdido electrones y queda cargado positivamente. Anión átomo que ha capturado electrones y queda cargado negativamente. • Unidad de masa atómica, u: es la doceava parte de la masa del átomo de carbono-12. 1 u = 1’67 · 1027 kg. • Masa atómica relativa de un átomo: es el número de veces que la masa de ese átomo es mayor que la unidad de masa atómica, es decir, que la doceava parte de la masa del átomo de carbono-12. Unidad didáctica 11: Física nuclear pag. 1 2.- Fuerza nuclear fuerte. Los nucleones se encuentran a distancias muy cortas unos de otros, por tanto la fuerza repulsiva entre los protones debería desestabilizar el núcleo, pero esto no sucede porque la fuerza eléctrica se equilibra con una fuerza atractiva llamada fuerza nuclear fuerte, que se caracteriza por: • • • Es una fuerza atractiva, de corto alcance, unos 10-15 m. Longitud conocida como Fermi. Su intensidad es muy alta, cien veces mayor que la de la fuerza electromagnética. No depende de la carga. Actúa igual entre protones, entre neutrones y entre protones y neutrones. Pese a la interacción fuerte, un núcleo puede ser inestable y desintegrarse espontáneamente por radiactividad, o fisionarse, rompiéndose en fragmentos. Es propio de núcleos pesados, como el del uranio. En el núcleo, existe también la fuerza nuclear débil, responsable de la desintegración beta. Las dos fuerzas nucleares, junto con la gravitatoria y la electromagnética constituyen las cuatro fuerzas fundamentales de la naturaleza. 2.1.- Estabilidad Nuclear. La formación de los núcleos y su cohesión interna están directamente relacionadas con las fuerzas que actúan entre protones y neutrones. La estabilidad nuclear es el equilibrio entre las fuerzas de repulsión eléctrica de los protones y la fuerza atractiva nuclear de corto alcance, que experimentan los protones y neutrones del núcleo. La relación entre el número de protones (Z) y neutrones (N) es clave para la estabilidad del núcleo. Como la interacción fuerte se satura o agota con los nucleones más próximos, pero la repulsión eléctrica afecta a todo el núcleo, los núcleos pesados son inestables. En la gráfica se representan los valores de N y Z para los núcleos estables de la naturaleza. Los núcleos ligeros tienen N aproximadamente igual a Z, es decir la relación N/Z =1, por lo que son estables. Pero, a medida que se hacen más pesados, se tiende a que N > Z para garantizar que la fuerza nuclear fuerte contrarreste la repulsión electrostática. La relación N/Z puede llegar a ser de hasta 1’56, desviándose del valor 1 en el que el núcleo es estable. Los núcleos que están fuera del cinturón de estabilidad son radiactivos. No hay núcleos estables con Z > 83. Tanto en núcleos pesados como ligeros existe otra causa de inestabilidad nuclear que depende de la interacción débil. Es la tendencia de neutrones y protones a intercambiarse dando lugar a emisiones β+, β- y a la captura electrónica: • Emisión β-: 1 0 • • 1 1 p+ Emisión β : 1 1 p 1 0 n + e (positrón) + ν (neutrino) Captura electrónica: 1 1 p + −01 e + 0 −1 e + ν (antineutrino) n 0 1 1 0 n +ν Los antineutrinos y neutrinos son casi indetectables. Uno es la antipartícula o antimateria del otro. El positrón es la antipartícula del electrón. Unidad didáctica 11: Física nuclear pag. 2 3.- Defecto de masa y energía de enlace. Experimentalmente se sabe que la masa de cualquier núcleo siempre es inferior a la suma de las masas de los nucleones que lo forman. Esta pérdida de masa se llama defecto de masa, Δm: Δm = Z . mp + N . mn - m Donde N es el número de neutrones, mp y mn, son respectivamente las masas de un protón y un neutrón y m es la masa nuclear. El equivalente en energía del defecto de masa, que se libera cuando se forma un núcleo, recibe el nombre de energía de enlace. Esta energía que se desprende indica que el núcleo es más estable que sus partículas libres porque tiene menos energía. La energía de enlace o de ligadura, Ee, de un núcleo, es la energía liberada en la formación de éste a partir de los nucleones libres, o la necesaria para disgregar un núcleo y separar sus nucleones. Para calcular esta energía, se usa la ecuación de Einstein que relaciona masa y energía: E=m · c2. Donde c = 3 · 108 m/s Aplicándola a la energía de enlace se obtiene: Ee = ΔE = Δm · c2 y, por tanto: Ee = (Z · mp + N · mn - m) · c2 La energía de los procesos nucleares es mucho mayor que la que corresponde a los procesos químicos ordinarios, por eso se utiliza una nueva unidad de energía, que no es del sistema internacional, el Mega-electrón-Voltio (MeV). 1 MeV = 1´6 · 10-13 J 3.1.- Energía de enlace por nucleón. Para calcular la intensidad con que es retenido cada nucleón dentro del núcleo, se emplea la energía de enlace nuclear por nucleón, que es la energía media que se debe suministrar a un núcleo para arrancarle uno de sus nucleones: E En = e A Un núcleo será tanto más estable cuanto mayor sea la energía que hay que darle para que los nucleones dejen de estar ligados entre sí. Esta energía coincide con la que se libera cuando se forma el núcleo a partir de los nucleones libres. Al analizar la gráfica, que representa como varía la energía de enlace por nucleón frente al número másico, se observa: • En los núcleos ligeros se produce un aumento brusco de la energía de enlace frente al número másico. Existiendo núcleos especialmente estables como los de He, C y O. • Para elementos con número másico > 20 la energía de enlace por nucleón es de aproximadamente 8’5 MeV. Unidad didáctica 11: Física nuclear pag. 3 • Entre los números másicos 40 y 80, los valores de energía son máximos, esto quiere decir que los núcleos correspondientes son los más estables, siendo, en la naturaleza, el más estable de todos, el núcleo de hierro con número másico 56. • Las variaciones de energía de enlace por nucleón son pequeñas para números másicos superiores a 20. Este hecho significa que la fuerza nuclear no aumenta al hacerlo el número de nucleones. La fuerza nuclear se ejerce entre los nucleones más próximos y es independiente del número total de nucleones. Esta característica de la fuerza nuclear se llama saturación. • En la zona central, la energía de enlace por nucleón da unos valores prácticamente constantes. Sin embargo, existen dos zonas de menor estabilidad nuclear, correspondientes a núcleos ligeros y a núcleos pesados, con valores menores de esta energía. Por tanto, las dos formas de ganar energía por nucleón en una reacción nuclear, y por lo tanto pasar a una situación más estable, con el consiguiente desprendimiento de energía, son la fisión de un núcleo pesado en dos más ligeros de la zona central o la fusión de dos núcleos ligeros para dar uno más pesado, más próximo a esa zona central. 4.- Desintegración radiactiva. En 1896 Henry Becquerel descubrió que una sal de uranio velaba un papel fotográfico y llamó a este fenómeno radiactividad. Posteriormente, Marie Curie comprobó que otros elementos pesados como el radio y el polonio también emitían radiactividad. La radiactividad, es un proceso de desintegración espontánea de núcleos pesados inestables en núcleos más ligeros, por emisión de radiación. Es una propiedad característica del núcleo. 4.1.- Tipos de radiaciones. En la desintegración radiactiva se emiten tres tipos de radiaciones que se caracterizan por su poder de penetración en la materia y por ionizar el aire, es decir, convertir en iones las moléculas del aire. Estas radiaciones son: • Radiación alfa, α: constituida por núcleos de helio ( 42 He ). Su velocidad es del orden del 5 % de la de la luz. Es un tipo de radiación poco penetrante que puede ser detenida por una simple hoja de papel o unos centímetros de aire, pero, por su elevada masa, poseen gran capacidad de ionizar la materia que atraviesa. • Radiación beta, β: está constituida por electrones ( −01 e ). Su velocidad puede ser el 99’95 % de la de la luz. Su poder de penetración es algo mayor que el de la radiación α, pues se necesitan metros de aire, una lámina de aluminio o unos centímetros de agua para detenerla. Sin embargo, al ser más ligeras, esta radiación es menos ionizante. • Radiación gamma, γ: es radiación electromagnética constituida por fotones muy energéticos. Tiene un poder de penetración muy alto, atraviesa el cuerpo humano y sólo se frena con planchas de plomo y muros gruesos de hormigón. Pero su capacidad de ionización es baja. Al ser tan penetrante y tan energética, es la más peligrosa de las tres. Unidad didáctica 11: Física nuclear pag. 4 4.2.- Procesos radiactivos. Para tratar de explicar los procesos de desintegración de átomos radiactivos Rutherford y Soddy propusieron, en 1902, la siguiente hipótesis: Cuando un núcleo emite radiación α o β, se transforma en otro elemento químico diferente, se dice que el núcleo se ha transmutado o desintegrado. 4.3.- Leyes de Soddy y Fajans o de los desplazamientos radiactivos. • 1ª ley de los desplazamientos radiactivos o desintegración α. Cuando un núcleo emite una partícula α, ( 42 He +2 ), se transforma en otro núcleo diferente, cuyo número másico es cuatro unidades menor, y cuyo número atómico es dos unidades menor que el núcleo de partida: A Z Ejemplo: • 235 92 A−4 Z−2 Y + 42 He X 231 90 Th + 42 He U 2ª ley de los desplazamientos radiactivos o desintegración β−. Cuando un núcleo emite una partícula β ( −01 e ), su numero másico no varía pero su número atómico aumenta en una unidad. A Z Ejemplo: 210 83 Bi 210 84 A Z+1 Y+ X Po + 0 −1 0 −1 e + antineutrino (ν ) e Algunos núcleos pueden emitir otra partícula, el positrón, 01 e, que procede de la desintegración β+ de un protón del núcleo. Cuando un núcleo emite una partícula β+, ( 01 e ), su numero másico no varía pero su número atómico disminuye en una unidad. A Z Ejemplo: • 30 15 P 30 14 X Y + 01 e + ν (neutrino) A Z−1 Si + 01 e 3ª ley de los desplazamientos radiactivos o desintegración gamma, γ. En este tipo de desintegración el núcleo no pierde su identidad. Mediante esta radiación el núcleo se desprende de la energía que le sobra para pasar de un estado excitado a otro estado de energía más baja o estado fundamental. Los rayos gamma son fotones muy energéticos. Este tipo de emisión acompaña tanto a las radiaciones alfa como a las radiaciones beta. Es una radiación muy penetrante. * A A ZX ZX + γ Unidad didáctica 11: Física nuclear pag. 5 4.4.- Series Radiactivas. Cuando un núcleo se va desintegrando, emite radiación y da lugar a otro núcleo distinto que también puede ser radiactivo y emitirá, a su vez, nuevas radiaciones. El proceso continuará hasta que aparezca un núcleo estable, no radiactivo. Todos los núcleos que proceden del inicial (núcleo padre) hasta llegar a otro estable, forman una serie o cadena radiactiva. Se conocen cuatro series radiactivas, tres de las cuales existen en la naturaleza ya que proceden de núcleos radiactivos primigenios, que son aquellos que sobreviven en la Tierra desde su formación. Esto se debe a que su semivida es comparable a la edad de la Tierra. A Cadena del 4n 4n+1 Series radiactivas Padre Semivida (años) Producto final Torio 232 90 Th 1'41.1010 208 82 Pb Neptunio 237 93 Np 2’14.106 209 82 Pb 4n+2 Uranio-Radio 238 92 U 4’51.109 206 82 Pb 4n+3 Uranio-Actinio 235 92 U 7’18.108 207 82 Pb La otra serie radiactiva es la del Np-297, que se había extinguido, pero que, con las pruebas nucleares realizadas en los últimos años, ha vuelto aparecer. En cada serie todos los núcleos están relacionados, en la del Th-232, por ejemplo, todos los núcleos de la serie tienen números másicos iguales a 4n, siendo n un número entero cualquiera. 4.5.- Ley de desintegración radiactiva En 1902 Ernest Rutherford y Frederick Soddy, sugirieron que el ritmo con que una sustancia radiactiva emite partículas radiactivas disminuye exponencialmente con el tiempo. La desintegración de un núcleo cualquiera se produce al azar, y el número de núcleos que se desintegran en un tiempo, t, es directamente proporcional al tiempo y al número de núcleos existentes. Su expresión matemática es: N = N 0 ⋅ e − λ⋅t Donde N es el número de núcleos que quedan sin desintegrar después de un tiempo t, N0 es el número de núcleos iniciales y la constante, λ, es la constante de desintegración o constante radiactiva, que tiene un valor característico para cada sustancia radiactiva y mide la probabilidad, por unidad de tiempo, de que los núcleos pertenecientes a esa población se desintegren. 4.6.- Semivida o periodo de semidesintegración, T1/2, es el tiempo que tarda una muestra radiactiva en reducirse a la mitad. ln 2 T1 = 2 λ 4.7.- Actividad radiactiva o velocidad de desintegración, A: es el número de desintegraciones que se producen por unidad de tiempo. Unidad: Becquerelio, Bq. 1 Bq=1 d.p.s (desintegración por segundo) A = λ⋅N Como la actividad, A, y la masa, m, de una sustancia radiactiva son directamente proporcionales al número de núcleos, N, también se cumple que: y A = A 0 ⋅ e − λ⋅t m = m 0 ⋅ e − λ⋅t Donde A0 es la actividad inicial y A la actividad a cabo de un tiempo t. De la misma forma, m0 es la masa inicial y m, la masa cuando ha transcurrido un tiempo t. Unidad didáctica 11: Física nuclear pag. 6 5.- Datación de muestras con fuentes radiactivas. En 1949, W. F. Libby publicó los resultados de las primeras dataciones realizadas con el método del carbono-14, un isótopo radiactivo natural del carbono descubierto en 1940. El elemento carbono presenta tres isótopos distintos: 12C (el más abundante), 13C y 14C. Los dos primeros no son radiactivos, pero el tercero se desintegra de forma espontánea, emitiendo partículas β (desintegración β-): 14 14 + −01 β 6C 7N El 146 C se origina de forma continua en las capas altas de la atmósfera, al incidir neutrones procedentes de la radiación cósmica con átomos de nitrógeno: 14 7 N + 01 n 14 6 C + 11 p Este isótopo del carbono, al igual que el otro isótopo, 12C, se combina con el oxígeno y forma CO2. Los seres vivos intercambian continuamente CO2 con la atmósfera, de forma que mientras están vivos mantienen constante la proporción de 14 12 C/ C, y su composición isotópica es la misma que la de la atmósfera que le rodea (en cada gramo de carbono de nuestro cuerpo hay suficiente 14C para que se produzcan 15 emisiones beta por minuto). Cuando el organismo muere, cesa este equilibrio y la desintegración del 14C no es compensada con el carbono atmosférico. La cantidad de 14C va disminuyendo con el tiempo, por lo que basta medir el número de desintegraciones que se producen por gramo de carbono, es decir, la actividad de la muestra, para determinar la fecha en la que murió un organismo determinado. El isótopo 14C tiene un periodo de semidesintegración (T1/2) de 5730 años, lo que lo hace muy adecuado para fechar objetos, de origen orgánico, de hasta 25.000 años de antigüedad. Otros isótopos, con T1/2 más grandes, se usan para fechar periodos de tiempos mayores. La serie radiactiva del 238U, por ejemplo, se puede usar para determinar la edad de las rocas de la Tierra. El método consiste en hallar la razón entre el 238U y su producto final, el 206Pb. 6.- Reacciones nucleares: Fisión y fusión. Las reacciones nucleares son procesos en los que intervienen directamente los núcleos atómicos transformándose en otros distintos. En toda reacción nuclear se cumplen los siguientes principios de conservación: • Conservación del número de nucleones: la suma de lo números másicos de los reactivos es igual a la suma de los números másicos de los productos. • Conservación de la carga eléctrica: la suma de los números atómicos de los reactivos coincide con la suma de los números atómicos de los productos. • Conservación de la cantidad de movimiento: la cantidad de movimiento total de los reactivos es igual a la de los productos. Unidad didáctica 11: Física nuclear pag. 7 • Conservación de la masa-energía: la diferencia entre las masa de reactivos y productos se transforma en energía según el principio de equivalencia masa-energía: ΔE = Δm · c2 Ejemplo: 14 7 17 8 N + 42 He O + 11 H Otra forma de representar la ecuación: 147 N (α,p) 178 O. Dentro del paréntesis están las partículas incidente y emergente. A la izquierda del paréntesis está el núcleo inicial y a la derecha, el final. 6.1.- Fisión nuclear. La fisión nuclear es un proceso en el que un núcleo pesado se divide en otros más ligeros de tamaño variable. Se produce cuando se bombardean núcleos pesados con neutrones. Ejemplo: 235 92 U + 01 n 141 56 Ba + 92 36 Kr + 3 01 n Los neutrones producidos en la fisión reaccionan con otros núcleos de uranio y el número de neutrones aumenta de forma exponencial. Se origina una reacción nuclear en cadena, que libera una gigantesca cantidad de energía. Si se descontrola el proceso, habrá una explosión nuclear (bomba atómica); pero si se controla el número de neutrones, utilizando una sustancia llamada moderador que los absorbe, la energía producida se puede mantener constante y el proceso puede ser usado en un reactor nuclear para producir electricidad. 6.2.- Fusión nuclear. Fusión nuclear es un proceso por el que dos núcleos de número másico bajo se combinan para formar un núcleo más pesado con mayor energía de enlace por nucleón. La energía producida en las estrellas tiene su origen en la reacción de fusión del hidrógeno: 4 11 H 4 2 He + 2 +01 e + 24’7 MeV La bomba de hidrógeno se basa en la siguiente reacción: 21 H + 31 H 4 2 He + 01 n + 17’6 MeV Aunque las reacciones de fusión nuclear podrían ser una importante fuente de energía, las altísimas temperaturas y presiones que se requieren para conseguir que los núcleos superen la repulsión eléctrica y lleguen a unirse, hacen el proceso técnicamente inviable de momento. Unidad didáctica 11: Física nuclear pag. 8 Resumen de fórmulas de Física nuclear Emisión β- 1 0 n 1 1 p+ Emisión β+ 1 1 p 1 0 n + 01 e (positrón) + ν (neutrino) Captura electrónica 1 1 p + −01 e Desintegración α o 1ª ley de los desplazamientos radiactivos A Z X A Z X A Z+1 A Z X A Z−1 A Z X* Desintegración β− o 2ª ley de los desplazamientos radiactivos Emisión de un positrón Desintegración, γ o 3ª ley de los desplazamientos radiactivos 0 −1 1 0 e + ν (antineutrino) n +ν A−4 Z−2 Y + 42 He Y+ 0 −1 e + antineutrino (ν ) Y + 01 e + ν (neutrino) A Z X+γ Defecto masa formación de un núcleo Δm = Z . mp + N . mn - m Defecto masa en un reacción nuclear Δm = Energía de enlace Ee = ΔE = Δm · c2 Energía de enlace por nucleón En = ∑ reactivos − ∑ productos Ee A N = N 0 ⋅ e − λ⋅t Ley de desintegración radiactiva m = m 0 ⋅ e − λ⋅t Semivida o periodo de semidesintegración T1 = 2 14 7 N + 01 n Desintegración del C-14 14 6 C 14 6 14 7 C + 11 p N + −01 β Fisión nuclear 235 92 Fusión nuclear en las estrellas 4 11 H Fusión nuclear bomba de hidrógeno 2 1 Unidad didáctica 11: Física nuclear λ A = λ⋅N A = A 0 ⋅ e − λ⋅t Actividad radiactiva o velocidad de desintegración Formación del C-14 ln 2 U + 01 n H + 31 H 141 56 4 2 Ba + 92 36 Kr + 3 01 n He + 2 +01 e 4 2 He + 01 n pag. 9 Problemas 1.- El cloro natural está formado por un 75 % de atómica del cloro natural. 35 17 Cl y un 25 % de 37 17 Cl. Calcula la masa 2.- La energía de enlace del núcleo de 42 He es 28’296 MeV. Calcula la energía, expresada en Julios, que se desprende cuando se forman 0’5 g de helio a partir de protones y neutrones que se encuentran libres. mHe = 4’002603 u, NA = 6’023.1023 núcleos /mol 3.- La energía de enlace de los núcleos 105 B, 115 B, 125 B son respectivamente 64’751, 76’205 y 79’575 MeV. a) Calcula la energía de enlace por nucleón. b) Justifica cuál de los núcleos anteriores es más estable. 4.- Sabiendo que el oxígeno 16 tiene 8 protones en su núcleo y su masa atómica es 15’9949 u, calcula: a) Su defecto de masa. b) La energía de enlace en julios. c) La energía de enlace por nucleón también en julios. mp =1’0073 u, mn =1’0087 u, 1 u =1’67·1027 kg, c =3·108 m/s 5.- Calcula el defecto de masa y la energía de enlace por nucleón, que se produce al formarse los núcleos de 42 He y 31 H (tritio). Datos: mnuclear He-4 = 4’001506 u, mnuclear H-3 = 3’015501 u, mp = 1’007276 u, mN= 1’008665 u. 6.- Completa las siguientes desintegraciones: 234 a) 238 92 U 90 Th + … b) 210 83 c) 238 86 Bi 210 84 Po + … Rn 234 84 Po + … 7.- El 233 92 U se desintegra en Th emitiendo una partícula α. El núcleo que se obtiene emite también una partícula α, desintegrándose en otro de Ra que, a su vez emite una partícula β y se transforma en un núcleo de Ac. Escribe las correspondientes ecuaciones nucleares. 8.- Indica el tipo de emisión que tiene lugar en los procesos radiactivos siguientes: 137 22 22 241 237 a) 137 10 Ne c) 95 Am 93 Np 55 Cs 56 Ba b) 11 Na 9.- Completa las reacciones nucleares: a) 73 Li (p, …) 74 Be, b) 19 9 F(p,α) …, c) 63 Li(… ,p) 73 Li 10.- La actividad inicial de una sustancia radiactiva es 7’91.1016 Bq y el periodo de semidesintegración es 2’72.106 s. Calcula: a) El número inicial de núcleos. b) el número de núcleos que quedarán sin desintegrar cuando hayan pasado 5 días. c) La actividad en ese instante. 11.- Se dispone de una muestra de 80 mg de Rn (λ = 0’182 días-1). Calcula la masa que quedará al cabo de una semana. b) ¿Cuánto tiempo debe transcurrir para que queden 10 mg? 12.- En una excavación se ha encontrado una herramienta de madera de roble. Sometida a la prueba del 14C se observa que se desintegran 100 átomos cada hora mientras que una muestra de madera de roble actual presenta una tasa de desintegración de 600 átomos/hora. Sabiendo que el periodo de semidesintegración del 14C es de 5730 años, calcula la antigüedad de la herramienta. Unidad didáctica 11: Física nuclear pag. 10 13.- La actividad de 14C de un resto arqueológico es de 60 desintegraciones por segundo. Una muestra actual de idéntica composición e igual masa posee una actividad de 360 desintegraciones por segundo. El periodo de semidesintegración del 14C es de 5700 años. a) Explique a qué se debe dicha diferencia y calcule la antigüedad de la muestra arqueológica. b) ¿Cuántos núcleos de 14C tiene la muestra arqueológica en la actualidad? ¿Tienen las dos muestras el mismo número de átomos de carbono? Razone las respuestas. 14.- Una muestra de 80 g de 60Co, tiene una constante de desintegración de 2·10-6 s-1. a) Determina el periodo de semidesintegración de este núclido. b) Determina el tiempo que ha de transcurrir para que la muestra quede reducida a 60 g. c) Determina la actividad inicial de la muestra. Datos: NA = 6’023·1023, MCo = 59’93 u. 15.- a) En la reacción del 63 Li con un neutrón se obtiene un núclido X y una partícula α. Escriba la reacción nuclear y determine las características del núclido resultante. 4 b) Calcule la energía liberada en la reacción de fusión: 21 H + 21 H 2 He c = 3 · 108 ms-1, 1 u = 1’66 · 10-27 kg, m 42 He = 4’0026 u, m 21 H = 2’0141 u 1 133 99 1 16.- Dada la reacción nuclear: 235 92 U + 0 n 31 Sb + 41 Nb + 4 0 n a) Explique de qué tipo de reacción se trata y determine la energía liberada por átomo de uranio. 6 b) ¿Qué cantidad de 235 92 U se necesita para producir 10 kWh? Datos: c= 3·108 ms-1, NA= 6’023·1023 mol-1, mU= 235’124 u, mSb= 132’942 u, mNb= 98’932 u, mn = 1’0086 u, 1 u = 1’66 · 10-27 kg Unidad didáctica 11: Física nuclear pag. 11 Problemas de selectividad 222 1.- (Junio 2005) El 226 88 Ra se desintegra radiactivamente para dar 86 Rn. a) Indique el tipo de emisión radiactiva y escriba la correspondiente ecuación. b) Calcule la energía liberada en el proceso. c =3.108 m s–1; mRa =225,9771 u; mRn =221,9703 u; mHe =4,0026 u ; 1 u =1,67.10–27 kg 2.- (Junio 2006) El período de semidesintegración del 226Ra es de 1620 años. a) Explique qué es la actividad y determine su valor para 1 g de 226Ra. b) Calcule el tiempo necesario para que la actividad de una muestra de 226Ra quede reducida a un dieciseisavo de su valor original. NA = 6,02 · 1023 mol-1 3.- (Junio 2007) a) La masa de un núcleo atómico no coincide con la suma de las masas de las partículas que los constituye. ¿Es mayor o menor? ¿Cómo justifica esa diferencia? b) ¿Qué se entiende por estabilidad nuclear? Explique cualitativamente la dependencia de la estabilidad nuclear con el número másico. 4.- (Junio 2008) La masa atómica del isótopo 147 N es 14’0001089 u. a) Indique los nucleones de este isótopo y calcule su defecto de masa. b) Calcule su energía de enlace. c = 3.108 ms-1, 1 u = 1’67.10-27 kg, mp = 1’007276 u, mN = 1’008665 u 5.- (Junio 2009) a) Explique el origen de la energía liberada en una reacción nuclear basándose en el balance de masa-energía. b) Dibuje aproximadamente la gráfica que relaciona la energía de enlace por nucleón con el número másico y, a partir de ella, justifique por qué en una reacción de fisión se desprende energía. 6.- (Junio 2010) a) Estabilidad nuclear. Explique el origen de la energía liberada en los procesos de fisión y fusión nucleares. 7.- (Junio 2011) La fisión de un átomo de 235 92 U se produce por captura de un neutrón, siendo los 144 56 productos principales de este proceso Ba y 90 36 Kr. a) Escriba y ajuste la ecuación nuclear correspondiente y calcule la energía desprendida por cada átomo que se fisiona. b) En una determinada central nuclear se liberan mediante fisión 45 · 108 W. Determine la masa del material fisionable que se consume cada día. c = 3.108 ms-1, 1 u = 1’7.10-27 kg, mU = 143’92 u, mKr= 89’94 u, mn= 1’008665 u 8.- (Junio 2012) Entre unos restos arqueológicos de edad desconocida se encuentra una muestra de carbono en la que sólo queda una octava parte del carbono 14C que contenía originalmente. El periodo de semidesintegración del 14C es de 5730 años. a) Calcule la edad de dichos restos. b) Si en la actualidad hay 1012 átomos de 14C en la muestra, ¿cuál es su actividad? Unidad didáctica 11: Física nuclear pag. 12