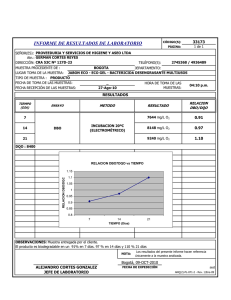
MEMORIA (Pdf 937 Kb)
Anuncio

Tratamiento de efluentes acuosos con glicoles Escalado del tratamiento de efluentes acuosos con glicoles 1. Antecedentes Hoy en día, las plantas de inyección de aluminio tienden a emplear fluidos hidráulicos que no arden para evitar los accidentes provocados por fugas de aceite hidráulico en las cercanías de los hornos que mantienen el metal fundido. Este tipo de fluidos están compuestos básicamente por agua y glicoles, e incluyen distintos aditivos para conferirles unas propiedades adecuadas para su utilización en sistemas hidráulicos (inhibidores de la corrosión [aminas], lubricantes [poliglicoles]...). En las plantas de producción se producen derrames y pequeñas fugas de los fluidos empleados en las distintas maquinas, recogiéndose normalmente mediante un sistema general de captación de vertidos. En muchos casos en la planta existen máquinas que funcionan con aceites hidráulicos, las cuales no están exentas de fugas y derrames. El efluente resultante de la operación de la planta productiva, contaminado además con polvo, virutas... se envía a la planta de depuración de aguas donde ha de ser convenientemente tratado antes de su vertido al cauce público. Las operaciones de depuración a aplicar dependen del efluente concreto a tratar y de los niveles de contaminantes exigidos por la autoridad pertinente. La naturaleza del efluente variará según los medios productivos y la manera de operar de cada instalación. En general, el efluente se viene tratando mediante un sistema físico-químico que consta básicamente de una etapa de separación de aceites, una etapa de coagulación y una etapa de floculación y decantación. Este sencillo esquema de tratamiento (completado según las necesidades concretas de cada planta) permitía que la fase acuosa fuera vertida al cauce público. Con la paulatina sustitución de los aceites hidráulicos por fluidos hidráulicos agua/glicol, la fase acuosa ha aumentado su contenido en materia orgánica disuelta, aumentando por tanto los niveles de DQO, llegando a imposibilitar su vertido al cauce público con la normativa actual. Teniendo en cuenta la elevada solubilidad de los glicoles en agua y que estos problemas han surgido con la implantación de los fluidos hidráulicos agua/glicol es razonable pensar que los elevados valores de DQO obtenidos son debidos a estos compuestos. Además, hay que tener presente que algunos de los glicoles empleados en las formulaciones son tóxicos. En un estudio previo (2009) a escala de laboratorio, realizado por Fundación Inatec con la financiación de Ihobe y la colaboración de 4 empresas dedicadas a la inyección de piezas de aluminio, se ha comprobado que el tratamiento con el reactivo de Fenton (agua oxigenada/hierro II) de los efluentes acuosos de las plantas de inyección de aluminio permite reducir los valores de DQO de los mismos hasta niveles cercanos e incluso por debajo de los límites de vertido establecidos en cada caso. 1 En dicho estudio se trataron de establecer las condiciones óptimas para la oxidación, alcanzándose reducciones en el valor de la DQO superiores al 60%. El tratamiento se realizó a muy pequeña escala, realizándose los tratamientos en batch (es decir, adicionando la totalidad de los reactivos a una cantidad determinada de efluente al comienzo de la reacción). El seguimiento del tratamiento se realizó mediante mediciones de DQO y COD antes y después del tratamiento. En un estudio posterior (2010) abordado por Fundación Inatec con la cofinanciación de URA, se ha realizado un aumento de escala (entre 200 y 320 veces) del tratamiento oxidativo con el reactivo de Fenton sobre mezclas de agua y dietilenglicol, considerando la sensorización del proceso (pH, Tª y potencial redox). Las actividades de optimización del proceso de tratamiento oxidativo abordadas en la mencionada actuación (determinación de tiempo de residencia, estrategia de alimentación de reactivos...) han permitido establecer que el progreso de la reacción de oxidación de la materia orgánica empleando este sistema de oxidación avanzado depende fundamentalmente de la cantidad de agua oxigenada (relación V H2O2 / V total), la concentración de hierro y del modo de adición de estos reactivos. La aplicación de las condiciones óptimas en el tratamiento con el reactivo de Fenton (H2O2) conduce a reducciones eficaces del nivel de DQO de disoluciones acuosas de dietilenglicol, reduciéndose el valor del citado parámetro desde 8.000 mg/l hasta valores inferiores a 500 mg/l con 30 minutos de tratamiento, siendo éste el límite superior establecido para el vertido de efluentes a cauce público. El coste estimado del tratamiento viene a ser de unos 46,88 €/m3 de efluente, el cual viene determinado fundamentalmente por el consumo de agua oxigenada y, en menor medida, por el consumo de hierro II y sosa cáustica. Hay que tener presente que el consumo de reactivos, y por tanto el coste del tratamiento, depende tanto del nivel de DQO inicial del efluente como del nivel de DQO admisible tras el tratamiento. Así, la mencionada estimación del coste del proceso se refiere al tratamiento de disoluciones acuosas de dietilenglicol con una DQO inicial superior a 8.000 mg/l para obtener valores finales de DQO por debajo de 500 mg/l. También hay que destacar que la variación de las características del efluente (presencia de otros compuestos orgánicos con diferente oxidabilidad, electrolitos...) puede condicionar la eficacia del tratamiento y el coste del mismo. Por último, hay que destacar que los rendimientos de la oxidación química de la materia orgánica en disolución empleando agua oxigenada y hierro II podrían ser mejorados empleando otros catalizadores (luz UV, óxidos de hierro). Dicha mejora en el rendimiento podría contribuir a reducir los costes asociados al tratamiento. La mayor eficiencia del proceso Foto-Fenton con respecto al proceso Fenton convencional se puede racionalizar en base a las distintas reacciones involucradas en la generación de especies activas. Los procesos de oxidación con el reactivo de Fenton se basan en la generación de especies radicalarias de elevado poder oxidante (radicales hidroxilo), las cuales poseen una alta efectividad para la oxidación de la materia orgánica y permiten: Escalado del tratamiento de efluentes acuosos con glicoles 2 • • La transformación de los contaminantes en compuestos más biodegradables y/o menos tóxicos. La mineralización de los contaminantes, en especial de los compuestos orgánicos recalcitrantes, hasta su completa transformación en dióxido de carbono, agua y aniones inorgánicos, evitando la formación de subproductos y/o residuos. En el proceso Fenton, la generación de los radicales hidroxilo se produce debido a la interacción redox entre el agua oxigenada y el hierro II. El proceso de oxidación tiene lugar según las siguientes reacciones: Fe2 + + H 2O 2 → Fe3+ + OH - + ⋅ OH ⋅ OH + H 2O 2 → H 2O + HO 2 ⋅ HO 2 ⋅ + H 2O 2 → H 2O + O 2 + ⋅ OH (1) (2) (3) Fe3+ (4) (5) (6) (7) + H 2O 2 → Fe2 + 3+ + HO 2 ⋅ + H + 2+ Fe + HO 2 ⋅ → Fe + O2 3+ 2+ Fe + OH → FeOH ⋅ OH + S → P + H + En exceso de peróxido y con altas concentraciones de HO• tienen lugar reacciones competitivas que producen un efecto inhibitorio para la degradación de la materia orgánica. Los radicales generados en el medio, además de reaccionar con la materia orgánica, son susceptibles de recombinarse o de reaccionar con el agua oxigenada o las especies de hierro de acuerdo con las reacciones (2), (3) y (5), así como a través de las siguientes reacciones: 2 HO2• → H2O2 + O2 (8) HO2 + HO → H2O + O2 (9) • • Todas estas reacciones conducen a un consumo de especies activas no relacionado con la oxidación de la materia orgánica, lo cual conduce a un incremento del consumo de reactivos. La radiación UV puede inducir la fotólisis del peróxido de hidrógeno (H2O2) según la siguiente reacción: H2O2 + hν → 2 HO• (10) En el caso del reactivo de Fenton, la irradiación con luz UV permite reducir las cantidades de hierro necesarias para la descomposición catalítica del agua oxigenada, lo que a su vez incide en la minimización de las reacciones de consumo de especies activas relacionadas con las mismas (5), incrementando la eficacia global del sistema. Además, la reacción de Fenton aumenta su eficacia por irradiación luminosa debido a otros factores, entre ellos la reacción adicional: Escalado del tratamiento de efluentes acuosos con glicoles 3 Fe(III)(OH)2+ + hν → Fe(II) + HO• (11) Por último, la irradiación con luz UV puede provocar la fotolisis de los compuestos químicos, contribuyendo a la destrucción de los mismos. La mayoría de los compuestos químicos absorben energía lumínica en el rango de la luz UV y la energía absorbida puede producir la ruptura de enlaces químicos siempre y cuando dicha energía sea superior a la del enlace químico. Por tanto, los sistemas de oxidación basados en la utilización conjunta del reactivo de Fenton y la luz UV (Procesos Foto-Fenton) tienden a ser más eficaces en la degradación de la materia orgánica una vez se optimiza la adición del agua oxigenada y la irradiación con luz UV, minimizando las reacciones secundarias entre las especies activas y maximizando la destrucción de la materia orgánica. En este sentido, la actuación abordada por Fundación Inatec en el año 2011, con la cofinanciación de URA, ha ahondado en el tratamiento oxidativo con el reactivo de Fenton sobre mezclas de agua y fluido hidráulico, introduciendo la catálisis por luz UV. Por un lado, se ha comprobado que el tratamiento desarrollado en la actuación precedente mantiene su eficacia a la hora de tratar mezclas de agua y fluido hidráulico industrial. Por otro lado, se ha desarrollado un proceso de tratamiento conjugando el reactivo de Fenton y la radiación UV. Las actividades de optimización del proceso de tratamiento foto-oxidativo abordadas en 2011 han permitido alcanzar grados de reducción de la DQO similares a los observados en las actuaciones precedentes (DQO final < 500 mg/l) reduciendo considerablemente el consumo de reactivos. Aunque el progreso de la reacción de oxidación de la materia orgánica empleando el proceso Foto-Fenton continúa dependiendo fundamentalmente de la cantidad de agua oxigenada (relación V H2O2 / V total), la catálisis combinada del Fe (II) y la luz UV permite incrementar la eficiencia del tratamiento oxidativo, si bien ello implica tiempos de tratamiento superiores. La aplicación de las condiciones óptimas en el tratamiento con el proceso Foto-Fenton (H2O2/Fe2+/Luz UV) conduce a reducciones eficaces del nivel de DQO de disoluciones acuosas de fluido hidráulico, reduciéndose el valor del citado parámetro desde 8.000 mg/l hasta valores inferiores a 500 mg/l con 140 minutos de tratamiento. El coste estimado del tratamiento foto-oxidativo viene a ser de unos 29,72 €/m3 de efluente, el cual viene determinado fundamentalmente por el consumo de agua oxigenada y, en menor medida, por el consumo energético de la lámpara de luz UV. La reducción del coste de tratamiento con respecto al tratamiento oxidativo desarrollado previamente se aproxima al 40%. 2. Planteamiento inicial En esta actuación se plantea el escalado del tratamiento foto-oxidativo de los efluentes acuosos contaminados con glicoles a escala piloto con el objetivo de evaluar la aplicabilidad y la robustez del proceso de oxidación foto-química desarrollado con vistas a su utilización en el tratamiento de efluentes acuosos de las plantas de inyección de aluminio. Escalado del tratamiento de efluentes acuosos con glicoles 4 Para ello se plantea el diseño y construcción de una instalación piloto con capacidad para tratar entre 150 y 300 litros de efluente acuoso por batch. Los parámetros operativos de dicha instalación se optimizarán en primera instancia sobre disoluciones acuosas de fluidos hidráulicos industriales. De esta manera, se pretende evaluar la efectividad del tratamiento foto-oxidativo en la reducción de la DQO sobre efluentes acuosos cuya composición se asemeje a la de los efluentes acuosos industriales. Una vez optimizada la operación de la instalación piloto, se procederá al tratamiento de un efluente acuoso industrial in situ con el objeto de verificar la aplicabilidad y efectividad del tratamiento foto-oxidativo para reducir la DQO de los efluentes acuosos contaminados con glicoles. Además, la consecución de los citados ensayos sobre efluentes reales a escala demostración permitirán realizar una estimación más precisa del coste del tratamiento. 3. Actividades acometidas Para lograr alcanzar los objetivos planteados en la actuación se han acometido las siguientes tareas: Tarea 1. Escalado del tratamiento foto-oxidativo sobre efluentes acuosos en condiciones controladas Tarea 2. Aplicación del tratamiento oxidativo avanzado sobre efluente industrial real Tarea 3. Evaluación de costes. En el siguiente diagrama se muestra el cronograma finalmente ejecutado: 1.- Escalado del tratamiento foto-oxidativo en condiciones controladas 2.- Aplicación del tratamiento oxidativo avanzado sobre efluente real 3.- Evaluación de costes En el ámbito de la Tarea 1 se ha contactado con distintos suministradores de sistemas foto-fenton con objeto de seleccionar aquel cuya oferta técnico-económica se ajuste a los requisitos de la actuación. Una vez seleccionado el suministrador, se ha procedido al diseño de la instalación con vistas a asegurar que dicha instalación permita aplicar el proceso foto-fenton desarrollado en la actuación precedente teniendo en cuenta las limitaciones prácticas existentes. Una vez establecidos los elementos a incluir y las especificaciones a cumplir por los mismos, se ha procedido a la construcción de la instalación piloto por parte del suministrador. Debido a problemas derivados del suministro de algunos componentes se ha producido un desfase con respecto al cronograma previsto, retrasándose la entrega de la instalación hasta principios de noviembre. Ello ha obligado a atrasar el comienzo de de las restantes actividades del proyecto, con la consiguiente alteración de la planificación inicialmente prevista. Escalado del tratamiento de efluentes acuosos con glicoles 5 Dic Oct Nov Sep Jul Ago Jun Abr May Feb Mar Dic Ene Oct Nov Sep Jul 2013 Ago Jun Abr May Feb Mar TAREAS Ene 2012 Una vez que la instalación se encuentra operativa se han realizado ensayos para verificar su correcta operación y su aplicabilidad al problema concreto del tratamiento de efluentes acuosos con glicoles, considerándose mezclas de fluido hidráulico/agua. En primera instancia, se ha sometido a la mezcla agua/fluido hidráulico al tratamiento fotooxidativo empleando las condiciones experimentales óptimas establecidas en la actuación precedente, constatándose la existencia de limitaciones experimentales derivadas de la espumación del medio reactante y de la evolución de la temperatura del mismo. Dichas limitaciones han obligado a optimizar distintos parámetros, como la cantidad de oxidante, la cantidad de catalizador y el modo de adición de los reactivos, con vistas a ralentizar las cinéticas de reacción y tratar de aunar una reducción eficaz de los glicoles con una operación segura de la instalación. De esta manera se han minimizado el riesgo de sobrepresiones en el reactor derivadas del taponamiento de las conducciones por la espumación del medio reactante o la ruptura de la lámpara UV por un incremento excesivamente rápido de temperatura. Dentro de la Tarea 2 se ha procedido a optimizar los parámetros operativos de la instalación piloto para el tratamiento de mezclas de agua/fluido hidráulico. Se han variado tanto los volúmenes de efluente a tratar como la adición de los reactivos manteniendo la eficacia del tratamiento foto-oxidativo con respecto a la actuación precedente, permitiendo alcanzar los valores de DQO objetivo (< 500 mg/l). Una vez adecuados las variables operativas del proceso foto-oxidativo a las características operacionales de la instalación piloto, se ha procedido a su traslado hasta una planta de inyección de aluminio con el objeto de cursar ensayos de tratamiento sobre un efluente industrial real. Se han realizado ensayos de tratamiento en días diferenciados con vistas a establecer la viabilidad del proceso independientemente de las fluctuaciones en la naturaleza y carga orgánica del efluente. Se ha constatado que el proceso desarrollado permite reducir la DQO por debajo del valor objetivo (< 500 mg/l), pudiendo ajustarse el consumo de oxidante dependiendo de la DQO inicial del efluente a tratar. La evaluación de costes del tratamiento (Tarea 3) se efectúa extrapolando los datos obtenidos en los ensayos efectuados a un volumen determinado de efluente a tratar a escala industrial, estimándose los consumos de reactivos, de energía y la generación de subproductos (barros férricos) en el tratamiento y su adecuada gestión. Dicha evaluación ha permitido estimar el coste del tratamiento en base a los datos obtenidos en el tratamiento de efluentes industriales reales con un sistema experimental semiindustrial y reactivos de características comerciales, obteniéndose una evaluación de los costes variables del proceso más representativa y robusta. En este sentido, se ha considerado el tratamiento de efluentes con una carga orgánica relativamente elevada (DQOi: 3.000-5.000 mg/l) reduciendo la DQO del efluente tratado por debajo del límite superior de vertido a cauce público (500 mg/l). Dado que la inversión precisa depende fundamentalmente del caudal de efluente a tratar y que dicho caudal varía considerablemente dependiendo de la magnitud de cada planta de inyección de aluminio, se ha optado por no cuantificar el montante de inversión requerido para aplicar el proceso. Escalado del tratamiento de efluentes acuosos con glicoles 6 4. Resultados obtenidos Tarea 1. Escalado del tratamiento foto-oxidativo sobre efluentes acuosos en condiciones controladas T1.1. Diseño del sistema de tratamiento A la hora de considerar el diseño del sistema de tratamiento foto-oxidativo a escala piloto se han considerado las siguientes premisas básicas: • • • • • • • Volumen de efluente a tratar por batch: 150-300 litros. Adición semicontínua de oxidante y reductor. Necesidad de acidificación previa al tratamiento oxidativo. Necesidad de neutralización posterior al tratamiento oxidativo. Recirculación del medio reactante (200 l/h) a través de la lámpara UV (reactor secundario). Lámpara de mercurio de media presión con 2,5 kW de potencia. Agitación del medio reactante. Posibilidad de refrigeración. En el siguiente diagrama se puede apreciar el aspecto de la instalación adoptada: El sistema consta de los siguientes componentes: • • • • • • • Reactor principal de 450 litros de capacidad total. Reactor secundario (lámpara UV). Bomba de recirculación de alta capacidad (20 m3/h). Doble circuito de recirculación. Dosificación de ácido, base, oxidante y catalizador. Sensorización: pH, ORP y Tª. Bomba de admisión del efluente Escalado del tratamiento de efluentes acuosos con glicoles 7 En lo que se refiere al reactor principal se consideró la utilización de un reactor cerrado construido en acero inoxidable, equipado con un nivel, una escotilla de limpieza, una salida inferior para la recirculación del efluente y varias entradas superiores: dos para la recirculación del efluente, tanto el proveniente del reactor secundario como el proveniente del circuito de recirculación secundario, una para la adición de catalizador, una para la adición de ácido y otra para la adición de base. Así mismo, existe una abertura superior adicional para una válvula de venteo con el objeto de evitar sobrepresiones en el reactor. A continuación se muestra el plano constructivo de este elemento: El doble circuito de recirculación permite controlar el caudal de efluente que circula a través del reactor secundario por medio de válvulas de accionamiento manual, de forma que el caudal total (20 m3/h) se reparte entre ambas conducciones. La rama del reactor secundario cuenta con un rotámetro para determinar el caudal que circula a través del mismo. Se ha considerado un caudal de recirculación (20 m3/h) muy superior al aplicado en la actuación precedente (200 l/h) con vistas a asegurar la agitación del reactor principal y la homogeneidad del medio reactante, por cuanto que en la instalación a escala piloto el reactor no cuenta con un sistema de agitación específico. Como fuente de irradiación se considera una lámpara de mercurio de media presión. Éstas lámparas presentan un espectro de emisión mucho más amplio que las lámparas de baja presión lo cual, si bien les confiere unas peores propiedades germinicidas al emitir con menor intensidad a la longitud de onda a la que absorben los microorganismos (254 nm), amplia su versatilidad a la hora de catalizar procesos fotoquímicos que absorban a distintas longitudes de onda, por cuanto que dichas lámparas presentan picos de emisión entre 250 nm y 600 nm. Escalado del tratamiento de efluentes acuosos con glicoles 8 Tomando en consideración el proceso desarrollado en una actuación precedente, para el tratamiento de aproximadamente 150 l de efluente se necesita una lámpara de mercurio de media presión con una potencia de 2,5 kW. Las lámparas UV de la citada potencia requieren de un sistema de refrigeración para evitar que calienten el medio reactante, lo cual encarece notablemente el coste y la operación de las mismas. En consecuencia se optó por emplear una lámpara UV no refrigerada de menor potencia (1 kW), incrementando el caudal de recirculación del medio reactante a través del reactor secundario para incrementar la exposición del medio de reacción a la luz UV y refrigerar la propia lámpara. De la misma manera, con el objeto de disipar en mayor medida el calor inducido por la lámpara y por la propia reacción de oxidación, se optó por ampliar la carcasa metálica del reactor secundario y emplear conducciones metálicas para la recirculación del medio reactante entre el reactor principal y el reactor secundario. Adicionalmente se ha incorporado un intercambiador de calor a la entrada del reactor secundario con objeto de refrigerar el efluente a la entrada del mismo en caso de estimarse oportuno. La dosificación de reactivos se realiza por medio de bombas independientes, seleccionándose las mismas en función de los caudales previstos y del grado de precisión requerido para el caudal. Así, para la adición de ácido y base se han seleccionado bombas peristálticas por su versatilidad en cuanto a los caudales con los Escalado del tratamiento de efluentes acuosos con glicoles 9 que permiten trabajar. Para la dosificación del catalizador (cloruro de hierro II) se emplea una bomba centrífuga ya que un volumen determinado de dicho reactivo se adiciona de forma muy rápida al comienzo del tratamiento. Sin embargo, para la dosificación del peróxido se emplea una bomba de membrana de elevada precisión por cuanto que la cantidad de peróxido adicionada determina el grado de reducción de la DQO y, por tanto, la eficacia del tratamiento. El sistema piloto equipa además una bomba de inmersión para facilitar el llenado del sistema con el efluente a tratar, de forma que la instalación pueda operar de forma autónoma a la hora de realizar los ensayos en un emplazamiento industrial. La sensorización del sistema es similar a la planteada en la actuación precedente, con sensores para la determinación de pH, temperatura y potencial redox. No obstante, en lugar de colocar los sensores en el reactor principal, estos se sitúan en la conducción del reactor secundario (reactor UV), de forma que los valores recogidos se corresponden con los que presenta el efluente a la entrada del mismo. Los sensores se conectan a un controlador, el cual, además de registrar los valores de los parámetros monitorizados, puede permitir la regulación tanto de la dosificación de los reactivos como de la temperatura en caso de considerarse necesario. En las siguientes imágenes se puede apreciar el aspecto de la instalación una vez finalizada su construcción. Escalado del tratamiento de efluentes acuosos con glicoles 10 La instalación cuenta con un PLC para su operación, tanto manual como automatizada, permitiendo el arranque secuencial de los distintos elementos que componen el sistema. Dicho sistema permite la automatización de la operación según una secuencia programada, incluyendo el ajuste automático del pH dado que el citado módulo se conecta con el controlador. En la siguiente imagen se puede apreciar el sinóptico de control de la instalación El sistema se completa con el cuadro eléctrico general y el cuadro eléctrico de control de la lámpara UV. Así mismo, cabe destacar que todos los componentes mencionados se montan sobre una bancada construida en acero inoxidable que cuenta con una cubierta para posibilitar la operación de la instalación a la intemperie. Escalado del tratamiento de efluentes acuosos con glicoles 11 T1.2. Puesta en operación Una vez que la instalación descrita en el apartado anterior se encuentra operativa se han realizado ensayos para verificar su correcta operación y su aplicabilidad al problema concreto del tratamiento de efluentes acuosos con glicoles, considerándose mezclas de fluido hidráulico/agua. En primera instancia, se ha sometido a la mezcla agua/fluido hidráulico al tratamiento foto-oxidativo empleando las condiciones experimentales óptimas establecidas en la actuación precedente (experimento 1), constatándose la existencia de limitaciones experimentales derivadas de la evolución de la temperatura del medio reactante y la espumación del mismo, con el consiguiente riesgo de sobrepresión en el reactor principal y fugas del contenido. Dichas limitaciones han obligado a optimizar distintos parámetros (experimentos 2-7), como la cantidad de oxidante, la cantidad de catalizador y el modo de adición de los reactivos, con vistas a ralentizar las cinéticas de reacción y tratar de aunar una reducción eficaz de los glicoles con una operación segura de la instalación. De esta manera se han minimizado el riesgo de sobrepresiones en el reactor derivadas del taponamiento de las conducciones por la espumación del medio reactante o la ruptura de la lámpara UV por un incremento excesivamente rápido de temperatura. Para el seguimiento de las reacciones se ha considerado la toma de muestras del medio reactante y la determinación de la demanda química de oxígeno (DQO), concentración de peróxido, carbono orgánico disuelto (COD), carbono inorgánico disuelto (CID) y cromatografía gaseosa. Los métodos empleados en la determinación de estos parámetros se describen brevemente a continuación. La determinación de DQO se ha llevado a cabo según la norma UNE 77004:2002, siendo preciso realizar los siguientes análisis, además del análisis de las propias muestras, para asegurar la veracidad de las determinaciones: • • • Variación diaria de la disolución de Fe(II) [(NH4)2Fe(SO4)2 6H2O] con K2Cr2O7 - HgSO4. Análisis diario de la calidad del agua: permite determinar si la calidad del agua es apropiada para la determinación de la DQO y permite obtener los blancos con respecto a los que se han de comparar las muestras cuyo contenido en materia orgánica quiere ser determinado. Análisis de patrones comerciales de DQO: permite determinar el error en la determinación del valor de DQO. El método de análisis seguido para determinar el valor de DQO implica el empleo de una disolución de dicromato potásico. La cantidad de dicromato consumido es directamente proporcional a la concentración de materia orgánica. Sin embargo, la presencia de determinadas especies inorgánicas en la disolución puede provocar el aumento del consumo de dicho reactivo, lo que origina una determinación del valor de DQO por exceso. El peróxido de hidrógeno es, precisamente, una de las especies que interfiere en la determinación de DQO. Por lo tanto, ha sido necesario plantear la Escalado del tratamiento de efluentes acuosos con glicoles 12 determinación del contenido en peróxido de hidrógeno de las distintas alícuotas de análisis tomadas para tratar de evaluar la magnitud de la interferencia debida a este compuesto a la hora de determinar el valor de DQO. La determinación de la concentración de peróxido de hidrógeno se ha realizado mediante valoración con permanganato potásico. Además, cabe señalar que el análisis de las muestras de efluente consideradas se ha realizado tras el filtrado de las mismas, con el objeto de minimizar la presencia de especies de Fe(II)/Fe(III), que pueden interferir también en la determinación de DQO. En una etapa previa a la realización de los ensayos considerados, se ha tratado de proponer una estrategia de actuación que permita eliminar la interferencia en la determinación de DQO causada por la presencia del peróxido de hidrógeno. Para ello, se abordó el tratamiento de disoluciones de peróxido de hidrógeno con distintos reactivos para promover su descomposición. Se ha considerado el empleo de hipoclorito de sodio, polvo de Zn metálico, MnO y NaOH. Con los 3 reactivos indicados en primer lugar la reacción de descomposición del peróxido no ha cursado con un rendimiento adecuado. Sin embargo, la modificación del valor de pH hasta valores de pH básicos (pH> 10) ha favorecido la reacción de descomposición indicada en un tiempo relativamente corto, por lo que en algunos de los experimentos de oxidación considerados se ha llevado a cabo una basificación hasta pH > 10 una vez finalizada la reacción de oxidación con el objeto de descomponer el peróxido remanente. Una vez descompuesto el peróxido, el pH del medio reactante se lleva hasta pH neutro mediante la adición de ácido. El análisis del contenido en carbono orgánico (COD) e inorgánico (CID) se ha planteado con el fin de poder seguir la evolución de la reacción de oxidación ya que dicho parámetro está relacionado con el contenido en DQO de la muestra en análisis, por lo que a partir de medidas de COD es posible estimar el valor de DQO de la muestra en análisis. Dicha estrategia se ha seguido con vistas a evaluar la posible interferencia en la determinación de la DQO así como para evaluar el grado de mineralización inducido por el tratamiento oxidativo. Para llevar a cabo la determinación del contenido en carbono se recurre al empleo de un analizador de carbono, el cual se calibra empleando como patrones los reactivos C8H5KO4 (patrón de carbono orgánico), Na2CO3 y NaHCO3 (patrones de carbono inorgánico). A partir de dichos reactivos se preparan patrones en los que se fija la concentración de carbono inorgánico y carbono total, ya que el equipo considera el análisis de estos parámetros y determina el contenido en carbono orgánico disuelto por diferencia. El análisis de las muestras de efluentes consideradas se ha realizado tras llevar a cabo el filtrado de las mismas. Para evaluar el error en la determinación de COD se ha considerado el análisis de patrones de concentración conocida. Por otro lado, se ha recurrido al empleo de la cromatografía de gases (GC-FID) para el seguimiento de las especies presentes en el medio durante el tratamiento oxidativo. Si bien no se identifican los compuestos orgánicos, el seguimiento por cromatografía permite evaluar la desaparición de los compuestos originales y la formación de nuevos compuestos durante el tratamiento oxidativo. El pico cromatográfico correspondiente al glicol se registra aproximadamente a 3 minutos y a medida que avanza el proceso de oxidación disminuye el área de dicho pico y aparecen otros picos a diferentes tiempos Escalado del tratamiento de efluentes acuosos con glicoles 13 de elución, lo que indica la transformación del compuesto en estudio en otros compuestos. De hecho, se alcanza un punto en el cual el pico de glicol no llega a ser detectado y en su lugar se registran picos de área muy pequeña a diferentes tiempos de retención, lo que sugiere, además de la completa transformación del glicol en otros compuestos, la mineralización prácticamente completa de la materia orgánica presente en el efluente tratado. Además de los citados parámetros, el seguimiento de las reacciones en los distintos experimentos considerados se ha realizado de forma continua mediante medidas en línea de pH, temperaturay potencial redox. Experimento nº 1 En este ensayo se ha tratado 302,7 l de una disolución de fluido hidráulico al 0,9 % considerando la adición de H2O2 y de una disolución de Fe(II). El caudal de circulación entre el reactor principal y el reactor secundario se mantiene constante. Se ha considerado el modo de adición de reactivos empleado en la actuación precedente, lo que supone la adición de la disolución de Fe(II) en un único batch, seguida de la adición de peróxido de hidrógeno en dos lotes. De forma paralela a la adición de Fe(II) se inició la irradiación del efluente con la luz UV. Durante el transcurso de la reacción se registró un incremento acusado de temperatura que no pudo ser compensado por el intercambiador de calor. Al alcanzar la temperatura máxima de reacción (65 ºC) el efluente experimentó una espumación excesiva, obturándose la válvula de venteo, lo cual indujo que el reactor se presurizada, provocando la pérdida de parte del volumen de efluente en tratamiento. A pesar de los citados problemas operativos, se abordó la toma de muestras del medio reactante. Así, se consideró una muestra antes de comenzar la adición de reactivos (M1) y una muestra final vez finalizada la reacción de oxidación (M2). Ambas muestras fueron caracterizadas en cuanto a la DQO. La tabla siguiente resume los resultados más destacados obtenidos en este experimento. t (min) treacción (min) DQO (mg/l) 14 0 7188 M1 100 132 415 M2 referido al periodo de tiempo comprendido desde el inicio de la adición de reactivos hasta la toma de la alícuota M2. Alicuota treacción Los resultados obtenidos muestran que el tratamiento oxidativo planteado en la actuación precedente permite reducir el valor de DQO por debajo de 500 mg/l, límite de vertido en cauce público, lo que pone de manifiesto la viabilidad del sistema de tratamiento a escala semiindustrial. Se confirma, por tanto, que la concentración de reactivos así como el modo de adición de los mismos resulta adecuada para el tratamiento de los efluentes acuosos considerados. Escalado del tratamiento de efluentes acuosos con glicoles 14 Sin embargo, las condiciones de operación planteadas no permiten controlar el progreso de la reacción de oxidación por lo que en los experimentos posteriores ha sido necesario replantear las condiciones de trabajo, considerando el tratamiento de un menor volumen de efluente (150 l). Además, se ha considerado el empleo de una menor cantidad de peróxido de hidrógeno y de catalizador para tratar de aumentar el grado de control sobre la reacción. Experimento nº 2 En este experimento se ha considerando el tratamiento de 151,35 l de efluente (fluido hidráulico al 0,9 %) adicionando ambos reactivos se han adicionado en un solo lote. La cantidad de reactivos empleada supone una reducción significativa con respecto al experimento 1, habiéndose empleado la sexta parte de peróxido y la cuarta parte de Fe(II). Al no disminuir en la misma proporción la cantidad adicionada de ambos reactivos, la relación en masa entre ambos reactivos varía con respecto al experimento 1. Se pretende así, evaluar posibles diferencias en la cinética de la reacción de oxidación. La adición de Fe(II) se ha realizado en primer lugar y se ha conectado la lámpara a los 22 minutos de dicha adición. Previa a la adición de peróxido, se ha mantenido el efluente en circulación entre el reactor principal y el reactor secundario durante casi una hora con el objeto de determinar si el hecho de irradiar el efluente en presencia de Fe modifica el grado de oxidación del mismo, encontrándose que no tiene lugar reacción de oxidación alguna en dichas condiciones. La irradiación de la muestra se ha detenido a las 3 horas de reacción, considerando el inicio de la reacción el momento en el que se ha comenzado con la adición de reactivos. Posteriormente, se consideró la basificación del medio reactante con NaOH con el fin de promover la descomposición del peróxido de hidrógeno que no hubiera sido consumido en la reacción de oxidación, seguida de una etapa final de neutralización para acondicionar el efluente para su vertido. La tabla siguiente resume los resultados más destacados obtenidos en este experimento. Alicuota G1 M1 M2 M3 M4 M5 t (min) 27 120 170 236 259 309 treacción (min) 0 90 140 205 229 279 DQO (mg/l) 7125 5474 Las condiciones de operación planteadas han permitido el control de la reacción de oxidación, no habiéndose registrado incrementos de temperatura acusados ni una espumación excesiva. El potencial redox aumenta con la adición de reactivos, alcanzando el valor máximo de 671 mV a las tres horas y media de reacción. Escalado del tratamiento de efluentes acuosos con glicoles 15 Para determinar el alcance de la reacción de oxidación se ha determinado el valor de DQO de las alícuotas G1 y M5. Los análisis realizados evidencian que la concentración de reactivos empleada no da lugar a una reducción significativa del valor de DQO. El análisis de las distintas alícuotas mediante cromatografía de gases confirma los valores de DQO registrados ya que el pico a 3,1 minutos, correspondiente a glicol, apenas experimenta modificación alguna, observándose únicamente una pequeña disminución en el área del mismo y la aparición de pequeños picos correspondientes a subproductos de reacción a tiempos de retención mayores. Las figuras siguientes muestran gráficamente los valores de pH, ORP y temperatura registrados durante el ensayo. 0,010 pH 14 DQO = 5474 mg/l 12 8 pH Fe H2O2 0,006 DQO = 7125 mg/l 0,004 6 H2O2 / Fe 0,008 10 4 0,002 2 0 0,000 0 75 150 225 300 Tiempo (min) ORP (mV) Fe H2O2 ORP (mV) 800 600 0,012 0,010 0,008 400 0,006 200 DQO = 7125 mg/l 0,004 0 H2O2 / Fe DQO = 5474 mg/l 0,002 -200 0,000 0 75 150 225 300 Tiempo (min) Escalado del tratamiento de efluentes acuosos con glicoles 16 40 T (ºC) 50 T (ºC) Fe H2O2 0,012 DQO = 5474 mg/l 0,010 0,008 0,006 20 0,004 10 H2O2 / Fe DQO = 7125 mg/l 30 0,002 0 0,000 0 75 150 225 300 Tiempo (min) Experimento nº 3 En esta ocasión se ha considerado el tratamiento de 151,36 l de efluente (fluido hidráulico al 0,9 %) manteniendo el caudal de recirculación del efluente con respecto a los ensayos previos. La cantidad de reactivos empleada es significativamente inferior con respecto al experimento 1, habiéndose reducido en un 60 %, aproximadamente, el consumo de ambos reactivos. La adición de la disolución de Fe(II) se ha realizado en primer lugar en modo batch y a los 39 minutos se ha adicionado el peróxido de hidrógeno precisando 23 minutos para realizar dicha adición. El efluente fue irradiado durante 2 horas y media aplicando dos periodos de irradiación. El primer periodo de adición se mantuvo durante dos horas, desconectando la lámpara al registrarse un incremento significativo de temperatura. Una vez refrigerado el efluente, se procedió a irradiarlo de nuevo durante un periodo de 16 minutos. La tabla siguiente resume los resultados más destacados obtenidos en este experimento. Alicuota G1 M1 M2 M3 M4 t (min) 17 151 190 239 383 treacción (min) DQO (mg/l) 0 7835 142 181 230 4973 374 3506 El valor de DQO de las alícuotas M3 y M4 muestra una reducción en el contenido de DQO de 33,3 % y 53,0 % con respecto al efluente no tratado (G1). La alícuota M4 ha sido tomada antes de iniciar la etapa de basificación-neutralización, mientras que la alícuota M5 se tomó una vez fue acondicionado el efluente para su vertido. La variación de pH al que ha sido sometido el efluente permite reducir el valor de DQO en un 19,7 %, lo que parece indicar que ha tenido lugar la descomposición del peróxido de hidrógeno remanente en el medio tratado. La reducción del 53,0 % alcanzada en el valor de DQO constituye un avance significativo, ya que se ha empleando un tercio del peróxido de hidrógeno considerado en el experimento 1 y menos de la mitad de Fe(II) empleado en dicho experimento. Escalado del tratamiento de efluentes acuosos con glicoles 17 El análisis mediante GC-FID de las alícuotas tomadas durante el periodo de reacción indica que la reacción de oxidación tiene lugar de forma parcial, dado que el área del pico cromatográfico correspondiente a glicol no experimenta una reducción significativa. Al comparar los cromatogramas correspondientes a las muestras tomadas antes de iniciar el tratamiento oxidativo y una vez finalizado el mismos se observa que tiene lugar la formación de un compuesto intermedio parcialmente oxidado, por lo que sigue registrándose un alto valor de DQO. La formación de dicho compuesto limita el rendimiento de la reacción de oxidación, lo que parece indicar que sería preciso adicionar una mayor cantidad de peróxido de hidrógeno para promover su oxidación. Las figuras siguientes muestran gráficamente los valores de pH, ORP y temperatura registrados durante el ensayo. pH Fe H2O2 pH 14 12 0,025 DQO = 3506 mg/l 0,020 10 0,015 DQO = 7835 mg/l 6 0,010 DQO = 4937 mg/l H2O2 / Fe 8 4 0,005 2 0 0,000 0 50 100 150 200 250 300 350 400 Tiempo (min) 700 DQO = 4937 mg/l 600 ORP (mV) Fe H2O2 0,025 0,020 500 300 200 DQO = 7835 mg/l 0,015 0,010 100 H2O2 / Fe ORP (mV) 400 DQO = 3506 mg/l 0 0,005 -100 -200 0,000 0 50 100 150 200 250 300 350 400 Tiempo (min) Escalado del tratamiento de efluentes acuosos con glicoles 18 T (ºC) Fe H2O2 30 T (ºC) 40 0,025 DQO = 3506 mg/l 0,020 0,015 DQO = 4937 mg/l 20 0,010 H2O2 / Fe 50 DQO = 7835 mg/l 10 0,005 0,000 0 0 50 100 150 200 250 300 350 400 Tiempo (min) Experimento nº 4 En el presente experimento se ha tratado 151,4 l de efluente (fluido hidráulico al 0,9 %) manteniendo el caudal de recirculación del efluente. El consumo de peróxido y de hierro se ha reducido en un 65 % y un 45,9 % respectivamente con respecto al experimento 1. A diferencia de los casos anteriores se ha considerado la adición de la disolución de Fe(II) de forma intercalada entre las adiciones de peróxido y en modo semicontínuo con el objeto de minimizar posibles reacciones de complejación que pueda presentar este ión. El tiempo de espera entre la adición de ambos lotes de peróxido ha sido de dos horas. La conexión de la lámpara se efectuó tras la adición del primer lote de peróxido y el efluente fue irradiado durante un periodo de 2 horas. La tabla siguiente resume los resultados más destacados obtenidos en este experimento. Alicuota G1 M1 M2 M3 M4 M5 t (min) 35 178 245 321 408 436 treacción (min) 0 129 196 272 359 387 DQO (mg/l) 7432 _ _ 2751 _ 2151 Las alícuotas M3 y M5 muestran una reducción en el contenido de DQO del 61,2 % y 69,3 % con respecto al efluente no tratado (G1). Ambas alícuotas han sido tomadas una vez finalizada la reacción y difieren entre ellas únicamente en el valor de pH. El aumento de pH conlleva una reducción adicional del valor de DQO debido a que se promueve la descomposición del peróxido de hidrógeno. El análisis mediante GC-FID de las alícuotas tomadas durante el periodo de reacción indica que el glicol se oxida parcialmente, lo cual fue confirmado al determinar el valor de DQO de dichas alícuotas. Escalado del tratamiento de efluentes acuosos con glicoles 19 Las figuras siguientes muestran gráficamente los valores de pH, ORP y temperatura registrados durante el ensayo. 0,025 DQO = 2151 mg/l pH Fe H2O2 pH 12 10 0,020 0,015 8 DQO = 7432 mg/l 6 DQO = 2751 mg/l 0,010 H2O2 / Fe 14 4 0,005 2 0 0,000 0 100 200 300 400 500 Tiempo (min) T (ºC) Fe H2O2 T (ºC) 40 30 0,025 DQO = 3506 mg/l 0,020 0,015 DQO = 4937 mg/l 20 0,010 H2O2 / Fe 50 DQO = 7835 mg/l 10 0,005 0 0,000 0 50 100 150 200 250 300 350 400 Tiempo (min) T (ºC) Fe H2O2 50 0,020 T (ºC) 30 0,015 DQO = 2751 mg/l DQO = 7432 mg/l 20 0,010 10 0,005 0 H2O2 / Fe 40 0,025 DQO = 2151 mg/l 0,000 0 100 200 300 400 500 Tiempo (min) Escalado del tratamiento de efluentes acuosos con glicoles 20 Experimento nº 5 En el presente experimento se ha tratado 151,5 l de efluente (fluido hidráulico al 0,9 %) manteniendo el caudal de recirculación del efluente. Al igual que en los experimentos 3 y 4 el consumo de peróxido de hidrógeno se ha reducido en un 64 %. Sin embargo, se ha incrementado el consumo de hierro. La adición de la disolución de Fe(II) se ha realizado una vez finalizada la adición de peróxido. Con el fin de modificar la cinética de la reacción de oxidación se consideró el empleo de una mayor cantidad de dicho reactivo ya que aumenta la velocidad de reacción. La adición de Fe(II) se realizó en semicontinuo. La mayor parte de peróxido (93,5 %) se añadió en el primer lote y la pequeña fracción restante se adicionó en batch a los 17 minutos de haber adicionado el primer lote de dicho reactivo. La conexión de la lámpara se efectuó al comenzar la adición de peróxido y el efluente fue irradiado durante una hora y cuarto. La tabla siguiente resume los resultados más destacados obtenidos en este experimento. Alicuota G1 M1 M2 M3 M4 t (min) 31 152 185 268 377 treacción (min) 0 113 146 229 298 DQO (mg/l) 10096 4180 3720 Las alícuotas M3 y M4 muestran una reducción en el contenido de DQO del 55,3 % y 60,1 % con respecto al efluente no tratado (G1). La diferencia en el valor de DQO que presentan las dos alícuotas indica que el proceso de basificación al que se ha sometido el efluente permite descomponer parcialmente el peróxido de hidrógeno remanente, por lo que la carga de DQO registrada sería atribuible a la presencia de materia orgánica parcialmente oxidada. El progreso de la reacción de oxidación se ha seguido mediante GC-FID y análisis de DQO. Al igual que en los experimentos 2-4 se observa la formación de un compuesto de reacción parcialmente oxidado. Escalado del tratamiento de efluentes acuosos con glicoles 21 Las figuras siguientes muestran gráficamente los valores de pH, ORP y temperatura registrados durante el ensayo. pH 14 12 0,025 DQO = 3720 mg/l DQO = 10096 mg/l 0,020 10 pH Fe H2O2 6 4 0,010 H2O2 / Fe 0,015 8 0,005 2 DQO = 4180 mg/l 0 0,000 0 200 100 300 400 Tiempo (min) DQO = 4180 mg/l 0,025 ORP (mV) Fe H2O2 OPR (mV) 700 600 500 400 0,020 0,015 300 200 DQO = 3720 mg/l 100 0,010 H2O2 / Fe 800 0 0,005 -100 DQO = 10096 mg/l -200 -300 0,000 0 100 200 300 400 Tiempo (min) 50 T (ºC) 40 0,020 DQO = 10096 mg/l DQO = 3720 mg/l 30 0,015 T (ºC) Fe H2O2 25 20 0,010 H2O2 / Fe 35 0,025 DQO = 4180 mg/l 45 15 10 0,005 5 0 0,000 0 100 200 300 400 Tiempo (min) Experimento nº 6 En este caso se ha considerado la adición simultánea de peróxido y de la disolución de Fe(II), adicionando ambos reactivos en modo batch. Se ha adicionado el 73,5 % de peróxido en un primer lote y el 26,4 % restante a los 21 minutos de reacción. De forma paralela se ha conectado la lámpara, irradiando el efluente durante casi dos horas. La cantidad de peróxido y de hierro adicionada supone una reducción del 64 % y del 18 % respecto al experimento 1. Escalado del tratamiento de efluentes acuosos con glicoles 22 En la siguiente tabla se indican los resultados obtenidos. t (min) 5 60 83 127 158 255 330 380 434 Alicuota G1 M1 M2 M3 M4 M5 M6 M7 M8 treacción (min) 0 45 68 112 143 240 315 365 419 DQO (mg/l) 7169 3052 2662 2413 El empleo de una mayor cantidad de peróxido con respecto a los experimentos 2-5 permite alcanzar un mayor grado de oxidación del efluente, lo cual se refleja en los cromatogramas registrados. Como puede verse, en el cromatograma correspondiente al efluente tratado el área del pico cromatográfico correspondiente al intermedio de reacción ha disminuido considerablemente con respecto a los casos anteriores. Además de los análisis cromatográficos y del seguimiento del valor de DQO, se ha considerado la determinación de la concentración de peróxido en las distintas alícuotas tomadas. Se ha observado una disminución progresiva en la concentración de peróxido con el tiempo, lo que indica que dicho reactivo se consume en la reacción de oxidación de la materia orgánica. La concentración final de peróxido es prácticamente despreciable, lo que indica que el valor de DQO que presentan las alícuotas M4-M8 corresponde a la presencia de materia orgánica. C H2O2 (M) 0,100 0,050 0,000 0 100 200 300 400 500 Tiempo (min) Escalado del tratamiento de efluentes acuosos con glicoles 23 En las condiciones indicadas se ha alcanzado una reducción de casi el 65 % en el valor de DQO. Sin embargo, para lograr reducir la DQO por debajo de 500 mg/l se debería adicionar una mayor cantidad de peróxido. Las figuras siguientes muestran gráficamente los valores de pH, ORP y temperatura registrados durante el ensayo. 14 0,020 DQO = 2413 mg/l DQO = 7169 mg/l 0,018 12 pH 0,014 0,012 8 0,010 6 pH Fe H2O2 DQO = 3052 mg/l 4 0,008 H2 O2 / Fe 10 0,016 DQO = 2662 mg/l 0,006 0,004 2 0,002 0 0 50 100 150 200 250 300 350 400 0,000 450 Tiempo (min) 800 DQO = 2413 mg/l DQO = 7169 mg /l 0,020 700 0,018 600 0,016 0,014 DQO = 3052 mg/l 400 0,012 DQO = 2662 mg/l 300 0,010 ORP (mV) Fe H2O2 200 100 0,008 0,006 0 0,004 -100 0,002 -200 0 50 100 150 H2 O2 / Fe ORP (mV) 500 200 250 300 350 400 0,000 450 Tiempo (imin) 50 0,020 45 0,018 40 0,016 35 T (ºC) 0,012 DQO = 2662 mg/l 25 0,010 DQO = 2413 mg/l 20 10 0,008 T (ºC) Fe H2O2 15 DQO = 7169 mg /l H2 O2 / Fe 0,014 DQO = 3052 mg/l 30 0,006 0,004 5 0,002 0 0,000 0 50 100 150 200 250 300 350 400 450 Tiempo (min) Experimento nº 7 En el presente experimento se ha procedido de forma similar que en el experimento 6, adicionando de forma paralela el peróxido y la disolución de Fe(II) en modo batch. Sin embargo, se ha considerado la adición de una mayor cantidad de peróxido con el fin de aumentar el porcentaje de reducción de DQO. Aun así, se ha empleado únicamente el 46,4 % de la cantidad de peróxido contemplada en el experimento 1. El peróxido de hidrógeno se ha adicionado en dos lotes. La lámpara se conectó al comenzar la adición de reactivos y se mantuvo la irradiación del efluente durante un periodo de dos horas. Escalado del tratamiento de efluentes acuosos con glicoles 24 En la siguiente tabla se recogen los datos más relevantes del ensayo. Alícuota G1 M1 M2 M3 M4 M5 M6 M7 t (min) 28 61 124 166 228 247 263 300 treacción (min) 0 30 31 135 197 DQO (mg/l) 7368 1700 1594 1346 216 232 269 COD (mg/l) 2.358 2.196 2.162 1.925 1.052 1.000 996 CID (mg/l) 45,4 13,3 17,5 37,0 50,6 323,2 498,0 El seguimiento de la reacción de oxidación se realizó en base a medidas de DQO y COD/CID. Se logra alcanzar un valor de DQO final de 1.346 mg/l empleando la mitad del peróxido considerado en el experimento 1. Se observa así mismo una reducción proporcional en el carbono orgánico disuelto, que se reduce desde 2.400 mg/l hasta 1.000 mg/l. Así mismo, en los estadios finales del tratamiento se observa un incremento sustancial del carbono inorgánico lo cual podría ser indicativo de la formación de carbonatos y bicarbonatos a partir del CO2 derivado de la mineralización de la materia orgánica durante la neutralización del pH. La representación de la variación de la concentración de peróxido con el tiempo muestra que dicho reactivo se consume en la reacción de oxidación de la materia orgánica, por lo que sería preciso adicionar una mayor cantidad de peróxido para lograr reducir la DQO hasta 500 mg/l. 0,60 0,50 C H2O2 (M) 0,40 0,30 0,20 0,10 0,00 25 75 125 175 225 275 325 Tiempo (min) Al igual que en el experimento 6, el aumento de la concentración de peróxido con respecto a la empleada en los experimentos 2-5 permite oxidar casi en su totalidad el efluente, como muestra el cromatograma registrado en este caso, reduciendo significativamente el valor de DQO del efluente tratado. Escalado del tratamiento de efluentes acuosos con glicoles 25 Las figuras siguientes muestran gráficamente los valores de pH, ORP y temperatura registrados durante el ensayo. pH 14 pH Fe H2O2 DQO = 7358 mg/l 12 0,030 0,025 10 0,015 DQO = 1700 mg/l 6 H2 O2 / Fe 0,020 DQO = 1594 mg/l 8 0,010 4 DQO = 1346 mg/l 0,005 2 0 0,000 0 50 100 150 200 250 300 350 Tiempo (min) 0,030 ORP (mV) 700 500 0,025 DQO = 1700 mg/l 400 0,020 DQO = 1346 mg/l ORP (mV) 300 DQO = 1594 mg/l Fe 200 0,015 H2O2 100 H2 O2 / Fe 600 0,010 DQO = 7358 mg/l 0 0,005 -100 -200 0,000 0 50 100 150 200 250 300 350 Tiempo (min) 60 T (ºC) 50 0,030 DQO = 1346 mg/l 0,025 40 0,020 DQO = 7358 mg/l 30 0,015 DQO = 1594 mg/l T (ºC) Fe H2O2 20 H2 O2 / Fe DQO = 1700 mg/l 0,010 10 0,005 0 0,000 0 50 100 150 200 250 300 350 Tiempo (min) Experimento nº 8 En los experimentos anteriores se ha modificado el orden de adición de los reactivos, así como su concentración, con respecto a las condiciones consideradas como óptimas en la actuación precedente y aplicadas en el experimento 1. En este sentido, el orden de adición de los reactivos no parece influir en el rendimiento de la reacción de oxidación. El aumento de concentración de Fe(II) en disolución conlleva un incremento de la velocidad de reacción, sin embargo, no da lugar a un mayor grado de reducción del valor de DQO. Por otro lado, el empleo de una menor cantidad de peróxido con respecto Escalado del tratamiento de efluentes acuosos con glicoles 26 al experimento 1 no permite reducir la DQO hasta los valores deseados. Por lo tanto, en el presente experimento se ha considerado el empleo de la concentración de reactivos y modo de adición indicado en el experimento 1 (condiciones óptimas), pero tratando 150 l de efluente en lugar de 300 l para tratar de operar bajo condiciones controladas. En primer lugar se ha adicionado la disolución de Fe(II) en modo batch y, seguidamente, se ha adicionado el primer lote de peróxido. El segundo lote de este reactivo se ha adicionado transcurridos 20 minutos tras la adición del primer lote. La radiación del efluente se realizó de forma paralela a la adición de reactivos durante un periodo de 52 minutos. En la siguiente tabla se recogen los datos más relevantes del ensayo. Alícuota G1 M1 M2 M3 t (min) 31 131 151 240 treacción (min) DQO (mg/l) 0 7.568 96 950 116 639 205 592 COD (mg/l) 2.368 351,3 312,0 351,6 CID (mg/l) 8,5 12,1 123,3 198,7 El seguimiento de la reacción de oxidación se realizó en base a medidas de DQO, COD/CID. Los resultados obtenidos muestran que la reacción de oxidación cursa de forma efectiva, alcanzando un valor de DQO final próximo a 500 mg/l, a pesar de haber empleado un 7,7 % de peróxido menos que en el experimento 1. La reducción de COD observada es proporcional a la observada para la DQO. El seguimiento de la concentración de peróxido indica que dicho reactivo se ha consumido completamente durante el tratamiento. 0,80 0,70 C H2O2 (M) 0,60 0,50 0,40 0,30 0,20 0,10 0,00 75 150 Tiempo (min) 225 La comparación de los cromatogramas registrados para las muestras G1 y M3, correspondientes a efluente no tratado y efluente sometido a tratamiento oxidativo respectivamente, evidencian la eficacia de la reacción de oxidación. En el cromatograma correspondiente a M3 no se observa el pico correspondiente a glicol ni a intermedios de reacción. La ausencia de subproductos de reacción parece indicar que el proceso de oxidación del efluente conduce a la mineralización del mismo. Escalado del tratamiento de efluentes acuosos con glicoles 27 Las figuras siguientes muestran gráficamente los valores de pH, ORP y temperatura registrados durante el ensayo. 12 0,06 DQO = 592 mg/l pH 14 DQO = 7568 mg/l 0,05 DQO = 639 mg/l 10 0,03 6 DQO = 950 mg/l pH Fe H2O2 4 H2 O2 / Fe 0,04 8 0,02 0,01 2 0 0,00 0 50 150 200 ORP (mV) Fe H2O2 ORP (mV) 800 100 Tiempo (min) 700 600 0,06 0,05 500 0,04 400 300 0,03 DQO = 592 mg/l 200 0,02 100 H2 O2 / Fe DQO = 950 mg/l DQO = 639 mg/l DQO = 7568 mg/l 0 0,01 -100 -200 0,00 0 50 100 150 200 Tiempo (min) 0,06 DQO = 950 mg/l 70 T (ºC) Fe H2O2 60 0,05 0,04 DQO = 639 mg/l T (ºC) 50 40 30 DQO = 592 mg/l DQO = 7568 mg/l 0,03 0,02 H2 O2 / Fe 80 20 0,01 10 0 0,00 0 50 100 150 200 Tiempo (min) Escalado del tratamiento de efluentes acuosos con glicoles 28 Conviene mencionar que la adición de una cantidad de peróxido próxima a la óptima (94%) produce un fuerte disparo térmico y una espumación excesiva, siendo preciso aliviar la sobrepresión en el tanque de reacción vaciando parcialmente su contenido. Resumen de experimentos nº 1-8 Al comparar los experimentos 1-8 se observa que es preciso adicionar la cantidad de peróxido considerada como óptima en la actuación anterior para lograr disminuir el valor de DQO por debajo de 500 mg/l. En la figura siguiente se muestra el porcentaje de reducción de DQO alcanzado en función del porcentaje de peróxido de hidrógeno empleado con respecto a la cantidad óptima de peróxido determinada en la actuación precedente (exp. 1-8). 100 % Reducción 80 60 40 20 0 0 20 40 60 % H2 O2 respecto al óptimo 80 100 Como puede verse, es preciso emplear al menos el 50 % de la cantidad óptima de peróxido para alcanzar reducciones elevadas (> 80%) en el valor de DQO. Sin embargo, para alcanzar valores finales de DQO inferiores a 500 mg/l, es preciso incrementar la dosificación de peróxido, probablemente debido a que los compuestos intermedios formados durante la oxidación exhiben una menor oxidabilidad que los glicoles y que, por tanto, requieren de condiciones de reacción más severas para lograr su total oxidación. Por lo tanto, es preciso emplear una cantidad de peróxido próxima a la óptima para lograr incrementar el grado de oxidación inducido por el tratamiento. De hecho, al determinar la concentración de peróxido de hidrógeno en cada una de las alícuotas tomadas en los diferentes experimentos se pone de manifiesto que dicho reactivo se consume totalmente en la oxidación de la materia orgánica contenida en el efluente independientemente de la dosificación efectuada. Operando con una dosificación de peróxido cercana a la óptima, la materia orgánica disuelta en el agua experimenta un proceso de mineralización muy acusado, tal y como reflejan los valores de COD registrados, permitiendo que el valor de la demanda química de oxígeno se sitúe a niveles próximos al objetivo establecido (500 mg/l). Escalado del tratamiento de efluentes acuosos con glicoles 29 Tarea 2. Aplicación del tratamiento oxidativo avanzado sobre efluente industrial real Teniendo en cuenta los resultados obtenidos en la tarea precedente, se optó por diseñar una estrategia de dosificación del peróxido que permitiese reducir el valor de DQO por debajo del valor establecido y posibilitase, simultáneamente, evitar los problemas operativos derivados del disparo térmico y la espumación del medio reactante así como ajustar la citada dosificación al nivel de DQO inicial del efluente. Así, se plantea la adición del peróxido en lotes siguiendo la línea de lo establecido en la actuación previa (cantidad óptima de peróxido en dos lotes), manteniéndose una dosificación mayoritaria en el primer lote y dividiendo el segundo lote en fracciones, de forma que la dosificación final del peróxido sea la óptima. De esta manera, al fraccionar la segunda adición de peróxido se persigue que no se produzca un disparo térmico tan acusado al acumularse una menor cantidad de oxidante en el reactor, procediendo a la adición de las fracciones restantes una vez ralentizada la reacción con vistas a alcanzar el valor objetivo de DQO (< 500 mg/l). Así mismo, esta estrategia de alimentación, permite ajustar la cantidad de agua oxigenada a las necesidades concretas del efluente (DQO inicial), puesto que una vez alcanzado el valor objeto de la DQO puede suspenderse la adición de las fracciones restantes o incluir fracciones adicionales. En primera instancia dicha aproximación se aplicó sobre una mezcla sintética agua/fluido hidráulico para verificar su aplicabilidad antes de proceder al tratamiento de efluentes industriales reales con dicha aproximación. T2.1. Optimización del proceso Experimento nº 9 En el presente experimento se ha considerado el empleo de la relación optimizada de peróxido y disolución de hierro indicada en el experimento 1, pero con la estrategia de dosificación optimizada. Al igual que en el experimento 8 se ha adicionando en primer lugar la disolución de Fe(II) en modo batch y seguidamente el primer lote de peróxido. Sin embargo, se ha modificado el modo de adición del segundo lote de peróxido con el fin de poder operar bajo condiciones controlables. De este modo, el volumen de peróxido correspondiente al segundo lote se ha dividido en 3 fracciones de igual volumen y se ha considerado un tiempo de espera de 30 minutos entre cada una de las adiciones. La conexión de la lámpara se realizó al mismo tiempo que se inició la adición de reactivos y se irradió el efluente durante 62 minutos. En la siguiente tabla se recogen los datos más relevantes del ensayo. Escalado del tratamiento de efluentes acuosos con glicoles 30 Alícuota G1 M1 M2 M3 M4 M5 M6 t (min) 18 80 105 141 216 255 336 treacción (min) DQO (mg/l) COD (mg/l) 0 7819 2356 49 1786,2 74 441,3 110 460 275,8 185 178,2 224 171,0 305 305 146,9 CID (mg/l) 46,4 105,4 8,0 6,3 13,0 16,3 68,2 Como puede verse, se ha logrado reducir el valor de DQO por debajo de 500 mg/l. El modo de operación ha permitido controlar adecuadamente el progreso de la reacción de oxidación, por lo que se considerará la adición fraccionada de peróxido a la hora de tratar el efluente industrial. Así mismo, el grado de mineralización inducido es muy elevado. La determinación del contenido en peróxido de las alícuotas analizadas revela que el peróxido se consume durante el proceso de oxidación de la materia orgánica, por lo que fue suficiente con neutralizar la muestra para su posterior vertido. 0,0035 C H2O2 (M) 0,0030 0,0025 0,0020 0,0015 0,0010 0,0005 0,0000 75 125 175 225 Tiempo (min) 275 325 Al igual que en el experimento 8, el cromatograma registrado una vez ha finalizado la reacción de oxidación no muestra la presencia ni de glicol ni de subproductos de reacción. Esto viene a confirmar que el tratamiento oxidativo ha dado lugar a la mineralización de los contaminantes orgánicos presentes en el efluente. Las figuras siguientes muestran gráficamente los valores de pH, ORP y temperatura registrados durante el ensayo. Escalado del tratamiento de efluentes acuosos con glicoles 31 pH 12 0,06 DQO = 7819 mg/l 10 0,05 DQO = 305 mg/l 0,04 DQO = 460 mg/l 6 0,03 pH Fe H2O2 4 0,02 2 H2 O2 / Fe 8 0,01 0 0,00 0 50 100 150 200 250 300 350 Tiempo (min) 0,06 DQO = 7819 mg/l ORP (mV) Fe H2O2 ORP (mV) 10 8 0,05 0,04 DQO = 460 mg/l 6 4 0,03 0,02 DQO = 305 mg/l 2 H2 O2 / Fe 12 0,01 0 0,00 0 50 100 150 200 250 300 350 T(ºC) Tiempo (min) 0,06 T (ºC) Fe H2O2 10 8 0,05 0,04 DQO = 460 mg/l 6 0,03 DQO = 7819 mg/l 4 0,02 DQO = 305 mg/l 2 H2 O2 / Fe 12 0,01 0 0,00 0 50 100 150 200 Tiempo (min) 250 300 350 T2.2. Tratamiento de efluentes acuosos industriales Por un lado, el tratamiento oxidativo optimizado ha logrado alcanzar un valor final de DQO inferior a 305 mg/l considerando el empleo de la totalidad del peróxido. De hecho se logra reducir el valor de la DQO por debajo del valor objetivo (460 mg/l) antes de la adición de la última fracción del segundo lote de peróxido (es decir, con un 8% menos de peróxido que en las condiciones óptimas). Por otro lado, la adición fraccionada de peróxido ha permitido controlar la reacción de oxidación, ralentizando el disparo térmico y evitando los problemas operativos derivados de la espumación excesiva del medio reactante. De esta forma, se plantea la evaluación de la aplicabilidad del proceso oxidativo propuesto sobre un efluente industrial real, adicionando un primer lote de peróxido seguido de otros 3 lotes de pequeño volumen, dejando transcurrir la reacción antes de la adición del 3er y sucesivos lotes de peróxido. Así, tras la adición del primer lote se fijará un tiempo de espera de 1 h y, transcurrido dicho periodo, se procederá a la adición de los lotes restantes esperando 30 minutos entre cada adición. Escalado del tratamiento de efluentes acuosos con glicoles 32 Previo a la adición de reactivos se procederá a acidificar el efluente en torno a un valor de pH igual a 2 empleando H2SO4. Seguidamente se realizará la adición del catalizador en modo batch, conectando la lámpara tras la adición de dicho reactivo y antes de proceder a la adición de peróxido. La lámpara UV se desconecta cuando la temperatura del medio de reacción alcanza 45 ºC. Una vez adicionada la última fracción de peróxido y transcurrido el correspondiente tiempo de reacción se procede a la neutralización del efluente mediante el empleo de NaOH al 50 %. Con el objeto de evaluar la influencia la variabilidad de la composición del efluente en la eficacia del tratamiento foto-oxidativo se ha considerado la realización de 5 ensayos distintos en días diferentes. Se ha constatado que se pueden producir variaciones significativas en las características del efluente a tratar en función del momento concreto de muestro pese a que todos los ensayos se han efectuado en la misma instalación industrial tomando el efluente a la salida del sistema de tratamiento físicoquímico implantado en la misma. De este hecho se deriva que la composición del efluente depende de las fugas concretas de fluidos hidráulicos y otros líquidos que se puedan dar en las instalaciones productivas. Así se ha constatado que la DQO del efluente puede variar considerablemente de un día a otro. Así mismo, se ha observado que la cantidad de sólidos en suspensión o la tendencia del efluente a espumar varían considerablemente de un día a otro. Cabe señalar que el efluente industrial parece estar parcialmente oxidado, ya que el pico cromatográfico correspondiente al efluente no tratado es similar al registrado para las muestras de fluido hidráulico parcialmente oxidado. En los cromatogramas siguientes se compara el efluente industrial no tratado con una muestra de fluido hidráulico no tratada y una muestra de dicho reactivo parcialmente oxidado. Escalado del tratamiento de efluentes acuosos con glicoles 33 Los resultados obtenidos en el tratamiento foto-oxidativo de efluentes industriales acuosos según el proceso propuesto se resumen en los siguientes apartados. Experimento nº 10 En la siguiente tabla se recogen los datos más relevantes del ensayo. Alícuota G1 M1 M2 M3 M4 M5 t (min) 23 90 125 168 236 300 treacción (min) DQO (mg/l) COD (mg/l) 0 2978 1005,1 53 546 249,3 88 429 202,1 131 153,7 199 141,0 263 287 118,2 CID (mg/l) 61,6 12,7 6,2 14,8 7,4 28,9 El efluente industrial a tratar presenta una DQOi relativamente baja (2.978 mg/l). Se observa que presenta sólidos en suspensión y tiene cierta tendencia a espumar, si bien ambos aspectos parecen no influir significativamente en cuanto a la operación del sistema de tratamiento foto-oxidativo o la eficiencia del proceso. El tratamiento oxidativo planteado ha permitido alcanzar un valor de DQO inferior a 500 mg/l (alícuota M2) empleando el 83,3 % de la cantidad de peróxido considerada como óptima, lo que supone una reducción en el consumo de dicho reactivo del 16,7 %. A medida que progresa la reacción de oxidación del efluente la concentración de peróxido en disolución disminuye, alcanzando un valor final de 6·10-4 M. 0,0060 C H2O2 (M) 0,0050 0,0040 0,0030 0,0020 0,0010 0,0000 75 125 175 225 Tiempo (min) 275 325 Los cromatogramas obtenidos confirman que la materia orgánica es mineralizada en su práctica totalidad: Escalado del tratamiento de efluentes acuosos con glicoles 34 Las figuras siguientes muestran gráficamente los valores de pH, ORP y temperatura registrados durante el ensayo. 12 DQO = 2978 mg/l DQO = 287 mg/l 0,06 0,05 10 0,04 DQO = 546 mg/l 6 pH Fe H2O2 DQO = 429 mg/l 4 2 0,03 0,02 H2 O2 / Fe pH 8 0,01 0 0,00 0 50 100 150 200 250 300 Tiempo (min) ORP (mV) 0,06 Fe H2O2 0,05 ORP (mV) 600 500 0,04 DQO = 429 mg/l DQO = 546 mg/l 400 0,03 DQO = 287 mg/l 300 DQO = 2978 mg/l 0,02 200 H2 O2 / Fe 700 0,01 100 0 0,00 0 50 100 150 200 250 300 Tiempo (min) 0,06 T (ºC) DQO = 546 mg/l 60 50 0,05 DQO = 2978 mg/l 40 0,04 DQO = 287 mg/l DQO = 429 mg/l T (ºC) Fe H2O2 30 20 0,03 0,02 H2 O2 / Fe 70 0,01 10 0 0,00 0 50 100 150 200 250 300 Tiempo (min) Escalado del tratamiento de efluentes acuosos con glicoles 35 No se observan grandes diferencias en cuanto al comportamiento del efluente industrial con respecto al tratamiento foto-oxidativo con respecto a las mezclas agua-fluido hidráulico. Experimento nº 11 En la siguiente tabla se recogen los datos más relevantes del ensayo. Alícuota G1 M1 M2 M3 M4 M5 t (min) 14 98 137 169 214 246 treacción (min) DQO (mg/l) 0 4247 73 624 112 475 144 397 189 221 297 COD (mg/l) 1381,0 302,8 240,1 195,0 169,2 127,5 CID (mg/l) 40,8 23,5 9,6 11,7 14,6 40,1 En este caso el efluente a tratar presenta una DQOi significativamente mayor que la del experimento previo (4.247 mg/l). Se observa que presenta un mayor contenido en sólidos en suspensión y tiene una tendencia a espumar sensiblemente mayor que el efluente del experimento previo, si bien ambos aspectos parecen no influir significativamente en cuanto a la operación del sistema de tratamiento foto-oxidativo o la eficiencia del proceso en este caso. Los resultados experimentales obtenidos son similares a los mostrados en el experimento 10, alcanzándose un valor de DQO inferior a 500 mg/l (alícuota M2) empleando un 16,7 % menos de peróxido con respecto a la cantidad establecido como óptima. Al igual que en el caso anterior, con el progreso de la reacción de oxidación la concentración de peróxido en disolución disminuye, alcanzando un valor final de 5·10-4 M. 0,0030 C H2O2 (M) 0,0025 0,0020 0,0015 0,0010 0,0005 0,0000 75 125 175 Tiempo (min) 225 Al igual que en el caso anterior, los cromatogramas obtenidos confirman que la materia orgánica presente en el efluente se destruye en su mayoría. Escalado del tratamiento de efluentes acuosos con glicoles 36 Las figuras siguientes muestran gráficamente los valores de pH, ORP y temperatura registrados durante el ensayo. pH Fe H2O2 10 0,06 0,05 DQO = 297 mg/l 8 0,04 pH DQO = 624 mg/l 6 0,03 DQO = 475 mg/l 4 0,02 DQO = 397 mg/l 2 H2 O2 / Fe DQO = 4247 mg/l 12 0,01 0,00 0 0 800 50 100 150 Tiempo (min) DQO = 4247 mg/l 200 250 DQO = 297 mg/l 0,06 700 0,05 DQO = 397 mg/l 400 DQO = 475 mg/l DQO = 624 mg/l 300 200 100 0 0 60 100 150 Tiempo (min) 0,02 ORP (mV) Fe H2O2 200 0,01 0,00 250 0,06 T (ºC) Fe H2O2 0,05 T (ºC) 50 40 30 50 0,03 0,04 DQO = 397 mg/l DQO = 4247 mg/l 20 H2 O2 / Fe 0,04 500 0,03 DQO = 475 mg/l DQO = 624 mg/l 0,02 DQO = 297 mg/l 10 H2 O2 / Fe ORP (mV) 600 0,01 0 0,00 0 50 100 150 Tiempo (min) Escalado del tratamiento de efluentes acuosos con glicoles 200 250 37 Experimento nº 12 En la siguiente tabla se recogen los datos más relevantes del ensayo. Alícuota G1 M1 M2 M3 M4 t (min) 47 163 202 246 280 treacción (min) DQO (mg/l) 0 5228 92 920 131 694 175 209 541 COD (mg/l) 1708,0 451 346,5 278,3 254,4 CID (mg/l) 59,6 8,9 12,2 8,8 72,3 En este caso el efluente a tratar presenta una DQOi mayor que la del experimento 11 (5.228 mg/l), observándose así mismo un contenido en sólidos en suspensión relativamente elevado y una tendencia a espumar elevada, en consonancia con el efluente considerado en el experimento precedente. Con el objetivo de evaluar la posibilidad de reducir el consumo de peróxido, a diferencia de los experimentos 10 y 11, en esta ocasión se ha incrementado el tiempo de espera entre la adición el primer y segundo lote de 60 a 90 minutos y se ha obviado la adición del cuarto lote de peróxido. Las modificaciones introducidas no han repercutido favorablemente en el rendimiento de oxidación y, en este caso, la DQO final presenta un valor de 541 mg/l empleando el 91 % de la totalidad de peróxido. Si bien el grado de reducción de la DQO obtenido (∼89,65%) es muy próximo al observado en los experimentos precedentes (90,36% y 93,24 %), en este ensayo no se consigue reducir la DQO por debajo del valor establecido como objetivo. Al igual que en los experimentos anteriores, el peróxido reacciona en su práctica totalidad en el transcurso de la reacción, alcanzando una concentración final de 1,1·10-3 M. Al igual que en los casos anteriores, los datos obtenidos de la cromatografía gaseosa indican que la concentración de sustancia orgánicas se reduce considerablemente como consecuencia del tratamiento, confirmando el elevado grado de mineralización resultante de los datos de COD. Escalado del tratamiento de efluentes acuosos con glicoles 38 Las figuras siguientes muestran gráficamente los valores de pH, ORP y temperatura registrados durante el ensayo. pH 10 8 0,06 DQO = 541 mg/l 0,05 0,04 DQO = 694 mg/l 6 0,03 DQO = 920 mg/l 4 0,02 2 H2 O2 / Fe pH Fe H2O2 12 0,01 DQO = 5228 mg/l 0 0,00 0 50 100 250 150 200 Tiempo (min) 300 700 0,06 DQO = 5228 mg/l 0,05 ORP (mV) 500 0,04 300 ORP (mV) Fe H2O2 DQO = 694 mg/l 200 DQO = 920 mg/l 400 0,03 0,02 H2 O2 / Fe 600 0,01 100 DQO = 541 mg/l 0 0,00 100 50 150 200 Tiempo (min) 250 300 T (ºC) Fe H2O2 70 60 0,05 T (ºC) 50 0,06 40 0,04 DQO = 694 mg/l 0,03 30 DQO = 5228 mg/l DQO = 541 mg/l 0,02 DQO = 920 mg/l 20 H2 O2 / Fe 0 0,01 10 0 0,00 0 50 100 150 200 Tiempo (min) 250 300 Experimento nº 13 En la siguiente tabla se recogen los datos más relevantes del ensayo. Alícuota G1 M1 M2 M3 M4 M5 t (min) 28 114 155 190 234 272 treacción (min) DQO (mg/l) 0 5.605 73 978 114 811 149 681 193 231 542 COD (mg/l) 1400,2 455,0 375,6 307,9 255,6 236,9 CID (mg/l) 1,4 6,1 22,4 25,9 10,1 55,6 En este caso el efluente a tratar presenta una DQOi similar a la del experimento previo (5.605 mg/l), observándose así mismo un contenido en sólidos en suspensión relativamente elevado y una tendencia a espumar elevada, en consonancia con el efluente considerado en el experimento precedente. Escalado del tratamiento de efluentes acuosos con glicoles 39 En este caso, se ha mantenido la dosificación del peróxido con respecto a la aplicada en los experimentos 10 y 11. No obstante, en este caso la DQO final no se reduce por debajo del valor objetivo, presentando un valor de 542 mg/l empleando el 100 % del peróxido. Si bien el grado de reducción de la DQO obtenido (90,32%) es similar al observado en los experimentos 10 y 11 (90,36% y 93,24 %), en este ensayo, dada la mayor demanda química de oxígeno inicial, no se consigue reducir la DQO por debajo del valor establecido como objetivo, si bien está muy próximo al mismo. De la misma forma que en los experimentos anteriores, el peróxido reacciona en su práctica totalidad en el transcurso de la reacción, alcanzando una concentración final de 4·10-4 M. 0,0030 0,0025 C H2O2 (M) 0,0020 0,0015 0,0010 0,0005 0,0000 100 150 200 250 300 Tiempo (min) Al igual que en los casos anteriores, los datos obtenidos de la cromatografía gaseosa indican que la concentración de sustancia orgánicas se reduce considerablemente como consecuencia del tratamiento, confirmando el elevado grado de mineralización resultante de los datos de COD. Las figuras siguientes muestran gráficamente los valores de pH, ORP y temperatura registrados durante el ensayo, los cuales siguen evoluciones similares a las observadas en los experimentos anteriores. Escalado del tratamiento de efluentes acuosos con glicoles 40 pH Fe H2O2 12 10 0,06 0,05 DQO = 542 mg/l 0,04 8 pH 6 0,03 DQO = 681 mg/l DQO = 978 mg/l 4 0,02 2 0,01 0 H2 O2 / Fe DQO = 811 mg/l 0,00 0 50 100 150 200 250 300 Tiempo (min) ORP (mV) Fe H2O2 700 ORP (mV) 600 400 300 0,05 0,04 DQO = 978 mg/l DQO = 681 mg/l 0,03 H2 O2 / Fe 500 0,06 DQO = 542 mg/l DQO = 5605 mg/l 0,02 200 DQO = 811 mg/l 0,01 100 0 0,00 0 50 100 150 200 250 300 Tiempo (min) 70 0,06 DQO = 811 mg/l DQO = 978 mg/l 50 DQO = 5605 mg/l 40 T (ºC) 60 0,05 30 T (ºC) Fe H2O2 20 0,03 DQO = 542 mg/l 0,02 H2 O2 / Fe 0,04 DQO = 681 mg/l 0,01 10 0 0,00 0 50 100 150 200 250 300 Tiempo (min) Experimento nº 14 Teniendo en cuenta que en los experimentos 12 y 13 no se consigue reducir la DQO por debajo del límite establecido como objetivo, en este ensayo se ha contemplado la adición de fracciones adicionales de peróxido con vistas de asegurar el cumplimiento del citado objetivo. Conviene mencionar que, en este experimento el efluente presentaba un menor contenido en sólidos y una menor tendencia a formar espumas que los efluentes considerados en los 3 experimentos precedentes. Así mismo, la DQO de partida es inferior a la de los experimentos 11-13 (3.566 mg/l). En la siguiente tabla se recogen los datos más relevantes del ensayo. Alícuota G1 M1 M2 M3 M4 M5 M6 M7 t (min) 6 89 126 161 198 232 264 296 treacción (min) DQO (mg/l) 0 3566 71 704 108 582 143 492 180 441 214 246 278 274 Escalado del tratamiento de efluentes acuosos con glicoles COD (mg/l) 1153,0 338,8 278,7 226,9 197,6 158,3 118,4 106,5 CID (mg/l) 28,7 18,2 11,2 10,0 6,7 12,6 10,5 23,2 41 Como se ha mencionado anteriormente, en este caso se ha considerado la adición de peróxido en exceso con objeto de asegurar que la DQO se redujese por debajo del valor objetivo. Sin embargo, dicha adición no es realmente necesaria puesto que dicho valor se alcanza al adicionar el 91 % de la cantidad de peróxido considerada como óptima. Se constata, no obstante, que la adición de cantidades adicionales de peróxido permiten reducir aún más la DQO. De la misma forma que en los experimentos anteriores, el peróxido reacciona en su práctica totalidad en el transcurso de la reacción, independientemente de las cantidades de peróxido adicionadas en exceso, alcanzando una concentración final de 2·10-4 M. 0,0025 C H2O2 (M) 0,0020 0,0015 0,0010 0,0005 0,0000 75 125 175 225 275 325 Tiempo (min) Nuevamente, la cromatografía gaseosa confirma que la mineralización de la carga orgánica es muy notable, reduciéndose el número de compuestos presentes así como la concentración de los remanentes. Las figuras siguientes muestran gráficamente los valores de pH, ORP y temperatura registrados durante el ensayo. Escalado del tratamiento de efluentes acuosos con glicoles 42 pH Fe H2O2 0,07 0,06 0,05 DQO = 3566 mg/l DQO = 582 mg/l 0,04 DQO = 274 mg/l DQO = 704 mg/l DQO = 492 mg/l 0,03 H2 O2 / Fe pH 9 8 7 6 5 4 3 2 1 0 0,02 0,01 DQO = 441 mg/l 0,00 50 ORP (mV) 700 100 600 500 150 200 Tiempo (min) 300 0,07 DQO = 704 mg/l 0,06 0,05 DQO = 274 mg/l 0,04 DQO = 582 mg/l DQO = 441 mg/l 400 300 DQO = 492 mg/l 200 250 DQO = 3566 mg/l 0,03 ORP (mV) Fe H2O2 H2 O2 / Fe 0 0,02 100 0,01 0,00 0 50 T (ºC) 0 DQO = 441 mg/l DQO = 274 mg/l 70 150 200 Tiempo (min) 250 300 0,07 0,06 DQO = 3566 mg/l 60 50 0,05 DQO = 492 mg/l 40 DQO = 582 mg/l 30 T (ºC) Fe H2O2 DQO = 704 mg/l 20 0,04 0,03 0,02 H2 O2 / Fe 80 100 0,01 10 0 0,00 0 50 100 150 200 250 300 Tiempo (min) Resumen de experimentos nº 10-14 Los experimentos llevados a cabo con el efluente industrial (Exp. 10-14) muestran la eficacia del tratamiento fotooxidativo propuesto, ya que se alcanzan porcentajes de reducción del valor de DQO superiores al 90% independientemente de las variaciones en la carga orgánica inicial, lo que supone que el efluente tratado presenta un valor de DQO inferior a 500 mg/l en la mayoría de los casos, alcanzable en todos ellos a través de aportes adicionales de H2O2. El modo de adición de los reactivos planteado ha permitido operar la instalación piloto bajo condiciones controlables, minimizando los riesgos derivados de la presurización del reactor principal. Al reducir la intensidad del disparo térmico y evitar la espumación excesiva del efluente en tratamiento ha sido posible alcanzar el volumen de peróxido óptimo sin riesgo de desbordamiento del efluente. Con la primera adición de peróxido, que supone aproximadamente ¾ de la cantidad de peróxido óptima, se llegan a alcanzar valores de DQO muy próximos a 500 mg/l. Se Escalado del tratamiento de efluentes acuosos con glicoles 43 observa una pequeña variación de dicho parámetro entre 546 mg/l y 920 mg/l, lo que indica que la oxidación del efluente tiene lugar mayoritariamente en esta primera etapa. El rendimiento de la reacción de oxidación del efluente alcanzado con la primera adición de peróxido, condiciona en gran medida el valor final de DQO del efluente tratado. En este sentido, en función del valor de DQO alcanzado tras la primera adición de peróxido, la segunda adición de este reactivo (que supone una disminución en el consumo de peróxido del 16,7 %) puede conducir a un valor de DQO inferior a 500 mg/l o, por el contrario, puede ser preciso tener que adicionar la totalidad de peróxido para alcanzar dicho valor. La adición de los sucesivos lotes de agua oxigenada permiten asegurar que el valor de la DQO final se sitúe por debajo del valor objetivo independientemente de la DQO inicial, el contenido en sólidos o la tendencia a la espumación del efluente 2500 DQO 2000 DQO H2 O2 al 100 % 9000 8000 1500 7000 1000 6000 5000 500 4000 0 V H2O2 / V total 0,018 0,022 0,026 0,030 3000 2000 1000 0 0 0,005 0,01 0,015 0,02 0,03 0,025 0,035 V H2O2 / V total El progreso de la reacción de oxidación es similar en los 5 experimentos considerados, tal y como se puede observar en función de la evolución del rendimiento del tratamiento oxidativo. Una vez oxidado el efluente tras la primera adición de peróxido (valores de DQO próximos a 500 mg/l), las adiciones posteriores de dicho reactivo conducen a la mineralización del efluente oxidado disminuyendo el valor de DQO con cada una de las adiciones. Se observa que, independientemente del valor de DQO de partida del efluente, la cinética de reacción es similar en todos los casos. Como puede observarse, la variación del valor de DQO con las adiciones de pequeño volumen de peróxido presenta un comportamiento lineal y la pendiente de las rectas trazadas es similar en los 5 experimentos realizados. 100 90 80 70 % Reducción 92 50 40 % Reducción 97 60 87 82 30 77 20 72 10 67 V H2O2 / V total 0,018 0,022 0,026 0,03 0 0 0,005 0,01 0,015 0,02 V H2O2 / V total Escalado del tratamiento de efluentes acuosos con glicoles 0,025 0,03 0,035 44 Parámetros de vertido condicionados por el proceso El tratamiento foto-oxidativo considerado supone la adición de una disolución de cloruro férrico al efluente y, por tanto, es preciso verificar que una vez finalizado el tratamiento, neutralizado el efluente y decantados los barros férricos, la concentración de hierro y cloruros en disolución no exceden los límites de vertido a cauce público. Por este motivo, en los ensayos de oxidación realizados sobre efluente industrial se ha considerado la determinación del contenido en cloruro y hierro de dicho efluente con el fin de verificar que cumple los requisitos de vertido. De este modo, se han analizado las alícuotas finales de los experimentos 11-13 obtenidas tras neutralizar el efluente tratado y sometidas a una etapa de filtrado simple. En la tabla siguiente se resumen los resultados obtenidos. Exp. Alícuota Cl- (mg/l) Fe (mg/l) 11 M5 M5 < 0,5 < 0,5 12 M4 M4 13 M5 M5 1370,8 1377,4 Media 1374,1 1377,4 1442,9 Media 1410,1 1377,4 1421,1 Media 1374,1 < 0,5 < 0,5 < 0,5 < 0,5 Los valores registrados son inferiores a los valores límite de vertido establecidos para el vertido a cauce público tanto para el hierro (2-10 mg/l) como para los cloruros (2.000 mg/l). T2.3. Conclusiones Dado que a lo largo del documento se han expresado las conclusiones extraídas en los distintos experimentos llevados a cabo, en este apartado únicamente se recogen las conclusiones principales referentes a la reducción de la DQO de efluentes acuosos con fluido hidráulico glicólico. Los experimentos realizados han permitido comprobar la efectividad del proceso FotoFenton para tratar efluentes acuosos industriales a escala piloto. En este sentido, se ha logrado reducir el valor de DQO desde 3.000-5.000 mg/l hasta valores inferiores a 500 mg/l. El tratamiento oxidativo según el proceso Foto-Fenton escalado en la presente actuación es más efectivo que el proceso Fenton desarrollado una la actuación precedente en tanto en cuanto se logra reducir la DQO por debajo del límite superior de vertido para cauce público empleando una cantidad menor de reactivos. La reducción en el consumo de agua oxigenada alcanzado es cercano a un 50% y la cantidad de catalizador requerida se reduce en cerca de un 80%, si bien se requiere de un incremento considerable del tiempo necesario para el tratamiento (300%). En cualquier caso, el consumo de Escalado del tratamiento de efluentes acuosos con glicoles 45 peróxido depende, además de la propia naturaleza del efluente, de la concentración de materia orgánica a oxidar y del valor objetivo establecido para la demanda química de oxígeno. Los experimentos realizados indican que el elevado grado de reducción de la DQO es debido a la completa mineralización de la carga orgánica, de forma que el tratamiento conlleva una reducción del COD proporcional a la de la DQO. Por tanto, es de esperar que la posible toxicidad del efluente sea prácticamente eliminada con el tratamiento aplicado. Tarea 3. Evaluación de costes. T3.1. Consideraciones generales Hoy en día, las plantas de inyección de aluminio tienden a emplear fluidos hidráulicos que no arden para evitar los accidentes provocados por fugas de aceite hidráulico en las cercanías de los hornos que mantienen el metal fundido. Este tipo de fluidos están compuestos básicamente por agua y glicoles, e incluyen distintos aditivos para conferirles unas propiedades adecuadas para su utilización en sistemas hidráulicos (inhibidores de la corrosión [aminas], lubricantes [poliglicoles]...). En las plantas de producción se producen derrames y pequeñas fugas de los fluidos empleados en las distintas maquinas, recogiéndose normalmente mediante un sistema general de captación de vertidos. En muchos casos en la planta existen máquinas que funcionan con aceites hidráulicos, las cuales no están exentas de fugas y derrames. El efluente resultante de la operación de la planta productiva, contaminado además con polvo, virutas..., se envía a la planta de depuración de aguas donde ha de ser convenientemente tratado antes de su vertido al cauce público. Las operaciones de depuración a aplicar dependen del efluente concreto a tratar y de los niveles de contaminantes exigidos por la autoridad pertinente. La naturaleza del efluente variará según los medios productivos y la manera de operar de cada instalación. En general, el efluente se viene tratando mediante un sistema físico-químico que consta básicamente de una etapa de separación de aceites, una etapa de coagulación y una etapa de floculación y decantación, tal y como se recoge en el siguiente esquema: Efluente Aceites Coagulante Floculante Sólidos Separación de aceites Rotura emulsiones Floculación Decantación Cauce público o colector Escalado del tratamiento de efluentes acuosos con glicoles 46 Este sencillo esquema de tratamiento (completado según las necesidades concretas de cada planta, como por ejemplo con una etapa final de tratamiento biológico) permitía que la fase acuosa fuera vertida a colector e incluso a cauce público. Con la paulatina sustitución de los aceites hidráulicos por fluidos hidráulicos agua/glicol, la fase acuosa ha aumentado su contenido en materia orgánica disuelta, aumentando por tanto los niveles de DQO, llegando a imposibilitar su vertido al cauce público con la normativa actual. Teniendo en cuenta la elevada solubilidad de los glicoles en agua y que estos problemas han surgido con la implantación de los fluidos hidráulicos agua/glicol es razonable pensar que los elevados valores de DQO obtenidos son debidos a estos compuestos. Además, hay que tener presente que algunos de los glicoles empleados en las formulaciones son tóxicos. Conviene mencionar que el problema de los efluentes acuosos con glicoles no es exclusivo de las plantas de inyección de aluminio. Los anticongelantes empleados en los sistemas de refrigeración del motor de coches están basados en sistemas agua/glicol. Los líquidos para quitar el hielo de las alas de los aviones en los aeropuertos también se basan en agua/glicol. Estos efluentes deben recogerse una vez han sido utilizados y tratarse bien para recuperar el glicol o bien para purificar el agua antes de su vertido a cauce público. Tal y como se ha comprobado en este estudio, los valores de DQO de los efluentes acuosos con glicoles pueden reducirse significativamente mediante la utilización del reactivo de Fenton, con y sin la conjunción de la luz UV. Mediante la correcta aplicación del sistema de oxidación sobre efluentes con una DQO de partida de unos 8.000 mg/l se pueden reducir los niveles de DQO por debajo del valor límite superior establecido para el vertido a cauce público (500 mg/l). No obstante, los tratamientos oxidativos tienden a ser más efectivos como sistema de pretratamiento, cuando los niveles de DQO son elevados, tal y como se verificó en un estudio precedente. Este hecho se debe a que al reducirse la concentración de los contaminantes orgánicos la selectividad de los radicales hidroxilo disminuye, reduciéndose la concentración de dichas especies activas a través de reacciones paralelas. El sistema de tratamiento oxidativo con el reactivo de Fenton y luz UV puede ser integrado en los sistemas de tratamiento físico-químico actualmente operativos. La cuestión que se plantea es la integración de la etapa de oxidación en las etapas de tratamiento físico-químico. Dicha integración dependerá fundamentalmente del efluente a tratar y del diseño del sistema de tratamiento físico-químico. Los efluentes pre-oxidados son generalmente más apropiados para los sistemas de tratamiento convencionales, como por ejemplo la floculación o el tratamiento biológico. Así, la presencia de hierro puede facilitar la etapa de coagulación/floculación, lográndose reducciones adicionales de la DQO del efluente. Por un lado, el incremento de la fuerza iónica del medio facilita la coagulación de las emulsiones. Por otro lado, la oxidación parcial de compuestos orgánicos da lugar a compuestos polares, los cuales son más susceptibles de ser adsorbidos en los flóculos. Escalado del tratamiento de efluentes acuosos con glicoles 47 Así mismo, el tratamiento de oxidación puede favorecer la separación física (flotación) de los aceites y grasas. La descomposición del agua oxigenada genera oxígeno, lo cual conlleva la formación de microburbujas uniformemente dispersas que contribuyen a hacer subir a los mencionados compuestos orgánicos a la superficie. Al reducirse la presencia de dichos compuestos se requiere menor cantidad de coagulantes posteriormente. La utilización de agua oxigenada/hierro II de forma previa a tratamientos biológicos resulta beneficiosa ya que, por un lado, puede reducir la toxicidad y/o carga orgánica del efluente de forma considerable y, por otro lado, se aumenta la concentración de oxígeno disuelto en el efluente objeto de tratamiento favoreciendo la actividad de las bacterias empleadas en los mencionados tratamientos. Sin embargo, hay que tener presente que la aplicación de un tratamiento fotooxidativo de forma previa al tratamiento físico-químico puede reducir considerablemente la eficacia del primero. Así, la presencia de sólidos en suspensión, emulsiones y aceites y grasas incrementa la absorbancia del efluente, reduciendo la cantidad de luz UV para el proceso oxidativo. Así mismo, la presencia de compuestos orgánicos distintos de los glicoles (aceites y grasas, emulsificantes...) contribuye a incrementar el consumo de oxidante para un grado de reducción de la DQO dado. Por tanto, para asegurar la máxima eficacia en el tratamiento oxidativo es aconsejable que éste se aplique después de un tratamiento físico-químico apropiado. Tal y como se deduce de lo anterior, la implantación del sistema de tratamiento oxidativo no es una tarea trivial y, por tanto, cada caso debe estudiarse de forma particular. A priori, dicho tratamiento puede incluirse tanto como una etapa previa o como una etapa posterior al tratamiento físico-químico actualmente aplicado por la industria transformadora del aluminio por inyección. En este sentido, es preciso considerar los requisitos de depuración exigidos por cada efluente particular y los distintos factores que influyen en la efectividad del tratamiento foto-oxidativo con el objeto de evaluar las distintas opciones de integración existentes. T3.2. Factores que influyen en la efectividad del tratamiento foto-oxidativo La efectividad del tratamiento foto-oxidativo depende del efluente concreto a tratar por cuanto que existen distintas variables que influyen en el proceso, así como por las condiciones operacionales del propio proceso. Básicamente se pueden distinguir los siguientes aspectos: • Características del efluente: o pH o Absorbancia UV o Estructura química y concentración de los contaminantes o Presencia o formación de inhibidores radicalarios. o Estabilidad del agua o Color o Sólidos en suspensión Escalado del tratamiento de efluentes acuosos con glicoles 48 • o Metales solubles o Aceites y grasas Condiciones operativas o Temperatura o Dosificación del oxidante o Longitud de onda e intensidad de la luz UV o Cantidad de catalizador o Tiempo de retención hidráulico o Objetivo del tratamiento 3.2.1. Características del efluente Entre las características del efluente que afectan el rendimiento del tratamiento fotooxidativo se pueden considerar el pH, la absorbancia UV del efluente , la naturaleza y concentración de los compuestos a oxidar, la presencia y/o formación de compuestos antioxidantes, la presencia de compuestos inestables o que absorban luz UV, los sólidos en suspensión o compuestos que puedan dar lugar a la formación de los mismos y los aceites y grasas. En la siguiente tabla se recogen algunos ejemplos tanto de compuestos que pueden estar presente como de parámetros del efluente que influyen en los tratamientos fotooxidativos de efluentes acuosos: Escalado del tratamiento de efluentes acuosos con glicoles 49 3.2.1.1. pH. Si bien el pH no influye en la generación de los radicales hidroxilo por fotólisis, puede influir en la generación de las especies activas catalizada por especies metálicas. Así para mantener el Fe en disolución es aconsejable que el pH sea inferior a 3,5, puesto que a pHs superiores se produce la precipitación de óxidos e hidróxidos de hierro, reduciéndose la actividad catalítica. Este aspecto también es relevante ante otras especies metálicas que puedan estar disueltas en el efluente a tratar. Además, el pH puede influir en la eficiencia en el uso de los radicales hidroxilo. El pH del influente puede condicionar la presencia de determinados compuestos, como los carbonatos o bicarbonatos, que pueden exhibir un comportamiento inhibidor de la actividad radicalaria. Así por ejemplo, el pH del medio controla el equilibrio entre carbonatos, bicarbonatos y ácido carbónico, cada uno de los cuales presenta distinta actividad inhibidora de los radicales. Si el efluente acuoso presenta una alcalinidad elevada (> 400 mg/l CaCO3), se recomienda reducir el pH por debajo de 4 ya que los mencionados compuestos se descomponen a pH ácidos. Por último, hay que tener presente que el agua oxigenada puede descomponerse por vía no radicalaria a pHs muy ácidos, normalmente a valores inferiores a 1, requiriéndose de dosificaciones mayores para compensar dicho efecto. 3.2.1.2. Absorbancia UV. La absorbancia del fondo del efluente es una medida de la transparencia del mismo para longitudes de onda entre 200 nm y 400 nm. Esta es una característica crítica del efluente puesto que condicionará los procesos fotoquímicos para una potencia de irradiación dada. Así, cuanto mayor sea la absorbancia del efluente, mayor será la necesidad de radiación UV para que un proceso fotoquímico determinado progrese a la misma velocidad. Así mismo, cuanto mayor es la absorbancia del efluente menor es la eficiencia del proceso foto-fenton ya que hay una menor cantidad de luz disponible para la descomposición fotolítica del agua oxigenada o la reducción fotoquímica del Fe III a Fe II. De la misma manera, la transparencia del efluente influye en la distancia a la que se transmite la luz UV y, por tanto, incide en la cantidad de efluente expuesto a la luz UV. 3.2.1.3. Estructura química y concentración de los contaminantes orgánicos. En primera instancia, la propia naturaleza de los compuestos a eliminar condiciona la eficacia del tratamiento, por cuanto a que dependiendo de la oxidabilidad de los mismos o de los compuestos intermedios que se formen durante el tratamiento, la reacción progresa de manera más o menos rápida y efectiva, llegando a transformar los compuestos orgánicos en CO2 y H2O (mineralización completa). Escalado del tratamiento de efluentes acuosos con glicoles 50 Así por ejemplo, los compuestos orgánicos con dobles enlaces (alquenos, compuestos aromáticos...) reaccionan muy rápidamente con los radicales hidroxilo, mientras que los compuestos saturados o los alcoholes presentan menores velocidades de reacción y son por tanto más difíciles de destruir. Es con estos últimos compuestos donde la posibilidad de fotólisis directa cobra especial importancia. La naturaleza de la carga orgánica del efluente acuoso también condiciona la efectividad del tratamiento. Así, el ataque de los radicales hidroxílo sobre un determinado compuesto químico puede dar lugar a especies intermedias difícilmente oxidables, inhibidoras de actividad radicalaria y/o complejantes del hierro, requiriéndose cantidades de agua oxigenada significativamente mayores para hacer progresar la reacción más allá de dicho punto. Así, la formación de compuestos refractarios, en muchos casos de bajo peso molecular (ácidos acético, oxálico y maleico, acetona...) obliga a incrementar la adición de peróxido para inducir la mineralización de los mismos y reducir la DQO del efluente. Otro aspecto que incide en la eficiencia del tratamiento oxidativo es la presencia en el efluente, o formación durante el tratamiento, de compuestos inhibidores de la actividad radicalaria (por ejemplo, compuestos fenólicos, quinonas...), así como de compuestos con capacidad de complejar el hierro (fosfatos, formaldehído, ácido oxálico...). Los primeros reducen la capacidad de oxidación de materia orgánica de este sistema por cuanto a que contribuyen a eliminar radicales hidroxilo, obligando a mayores dosificaciones de peróxido. Los agentes complejantes pueden reducir la actividad catalítica del hierro, dando lugar a cinéticas de generación de radicales más lentas, alargando los tiempos de tratamiento y, en algunos casos, reduciendo la eficacia del tratamiento. Además de por la propia acción de la luz UV sobre el peróxido o el catalizador, la posibilidad de fotolisis de los compuestos a eliminar hace que la longitud de onda de la luz UV aplicada sea importante. Así, entre las lámparas UV comerciales para procesos de oxidación fotoquímica destacan las lámparas de mercurio de baja presión y las lámparas de mercurio de media presión. Las primeras emiten la práctica totalidad de la luz a una longitud de onda de 254 nm, mientras que las lámparas de media presión Escalado del tratamiento de efluentes acuosos con glicoles 51 producen luz en un mayor rango de longitudes de onda, tal y como se recoge en la siguiente figura: Dado que el H2O2 absorbe la luz a longitudes de onda próximas a 200 nm (ver siguiente figura), las lámparas de media presión son más apropiadas para promover la descomposición fotolítica del oxidante. De la misma manera, los contaminantes de interés en la presente actuación (glicoles), así como algunos de los compuestos que se pueden derivar de la oxidación de los mismos (ácido acético, .ácido maleico...), absorben mayoritariamente la luz UV por debajo de 220 nm, por lo que la irradiación de los mismos con luz UV proveniente de lámparas de media presión puede inducir su fotólisis, contribuyendo a una mayor eficacia del tratamiento foto-oxidativo. Escalado del tratamiento de efluentes acuosos con glicoles 52 Agua + Dietilenglicol Agua + Fluido hidráulico acuoso La concentración del contaminante en el efluente usualmente influye en la efectividad del tratamiento, en la cantidad de oxidante a emplear y en la potencia lumínica a aplicar. Las concentraciones elevadas de contaminantes requieren por un lado de mayores cantidades de oxidante y luz UV y, por otro lado, de mayores tiempos de tratamiento. Dependiendo de la complejidad de las moléculas orgánicas a destruir, la concentración inicial puede influir en el rendimiento del tratamiento. La concentración inicial de contaminantes con uno o dos átomos de carbono en su estructura no suele influir en gran medida en la eficiencia del proceso puesto que prácticamente la reacción progresa sin la formación de compuestos intermedios. Sin embargo, en el caso de aquellos contaminantes con estructuras más complejas la concentración inicial suele exhibir una gran influencia ya que, por un lado, los compuestos intermedios generados en el tratamiento consumen radicales y, por otro lado, se reduce la trasmitancia de la luz UV al ser ésta absorbida en mayor medida por los contaminantes. Así mismo, cuando existe una concentración suficientemente elevada de compuestos orgánicos, los radicales hidroxilo reaccionaran principalmente con los mismos. Sin embargo, según se reduce la concentración de los compuestos orgánicos a oxidar, las reacciones de terminación entre radicales crecerán exponencialmente, dando lugar a un consumo de peróxido menos eficiente. 3.2.1.4. Especies inhibidoras de la actividad radicalaria. Tal y como se ha mencionado en el apartado precedente, la presencia o la formación de compuestos que consuman radicales conduce a una reducción de la eficiencia del proceso ya que se reduce el número de radicales disponibles para atacar el compuesto objetivo Entre las sustancias inhibidoras de la actividad radicalaria más comunes se incluyen los materiales húmicos, el ión cloruro, los carbonatos y bicarbonatos, nitritos, sulfitos, sulfuros, bromuros, cianuros, grupos alquilo y los alcoholes terciarios. Así mismo, hay que considerar que la propia reacción oxidativa de lugar a sustancias inhibidoras de la acción radicalaria. Un ejemplo típico es el caso del fenol, cuya oxidación por radicales hidroxilo puede originar la formación de hidroquinona, la cual es un potente antioxidante. Escalado del tratamiento de efluentes acuosos con glicoles 53 3.2.1.5. Estabilidad del agua. En algunos efluentes acuosos, pequeños cambios de pH, temperatura o potencial redox pueden provocar la precipitación de compuestos inorgánicos solubles, como el calcio, hierro y manganeso. Los precipitados pueden generar incrustaciones en las lámparas UV, reduciendo la trasmitancia de la luz UV y reduciendo el rendimiento del proceso foto-químico. En algunos casos extremos, se aplica una etapa de reducción química previa al tratamiento oxidativo para formar óxidos e hidróxidos insolubles, los cuales se separan del efluente por sedimentación antes del tratamiento fotooxidativo. Así mismo, las lámparas UV suelen incluir sistemas de escobillas para limpiar la superficie de la lámpara en contacto con el líquido con vistas a asegurar la correcta transmisión de la luz. 3.2.1.6. Color. El color en el rango visible (por encima de los 400 nm) no incide en la transmisividad UV. Sin embargo, algunos compuestos orgánicos que normalmente colorean el agua, como las sustancias támicas y húmicas, pueden absorber también luz UV, reduciendo la cantidad de luz UV disponible para el proceso foto-oxidativo. En algunos casos extremos, los procesos foto-oxidativos no son aplicables en el tratamiento de aguas coloreadas. Así, se han desarrollado catalizadores específicos para incrementar la eficiencia de la absorción de la luz. Estos catalizadores suelen ser normalmente compuestos de hierro que, por la radicación UV, se descomponen en moléculas más pequeñas que absorben la luz UV en un espectro más ancho, incrementando la eficiencia. La reacción en cadena entre componentes y subproductos produce la recombinación del catalizador original, iniciándose nuevamente el ciclo. 3.2.1.7. Sólidos en suspensión. Los sólidos en suspensión tienen tendencia a absorber luz UV y a reaccionar con los oxidantes en disolución. Además, altos niveles de sólidos en suspensión reducen la transmisión de la luz UV, reduciendo la eficiencia del tratamiento. Además, los sólidos en suspensión, bien contenidos en el efluente o bien generados en el transcurso de la oxidación, pueden precipitar e incrustarse en la lámpara UV, reduciendo la cantidad de luz transmitida por la lámpara a la disolución. Tal y como se ha mencionado anteriormente, las lámparas UV suelen equipase con sistemas de limpieza para eliminar las incrustaciones de su superficie. En general, los efluentes con contenidos en sólidos superiores a 30 mg/l suelen tratarse previamente para eliminar los mismos, considerándose tanto sistemas de filtración (filtros de cartucho, filtros de arena...) como decantadores. Escalado del tratamiento de efluentes acuosos con glicoles 54 3.2.1.8. Sólidos disueltos Las sales en disolución como los carbonatos, bicarbonatos, nitritos, sulfuros, bromuros o cianuros actúan como antioxidantes. Estas sales consumen oxidante destinado a destruir los contaminantes objetivo, incrementando la necesidad del mismo. Cuando los contenidos en dichas sales son muy elevados (> 400 mg/l) se recomienda su eliminación de forma previa al tratamiento oxidativo. Los metales presentes en su estado reducido, como el Cr III, Fe II o el Mn II, pueden oxidarse durante el tratamiento, dando lugar a compuestos más tóxicos (Cr VI) o más insolubles (óxidos e hidróxidos de hierro o manganeso) que pueden precipitar y originar incrustaciones en las lámparas UV o absorber la misma con intensidad. 3.2.1.9. Aceites y grasas Los aceites y grasas libres o emulsificadas por encima de 50 mg/l tienden a ralentizar el tratamiento foto-oxidativo ya que compiten con el contaminante objetivo por los radicales hidroxilo, incrementan la absorbancia UV del influente y pueden recubrir la lámpara UV reduciendo su transmitancia. Los compuestos orgánicos hidrofóbicos, como el benceno o el tolueno, se disolverán preferencialmente en la fase orgánica y no serán atacados por los radicales hidroxilo generados en la fase acuosa 3.2.2. Condiciones operativas 3.2.2.1. Temperatura En las reacciones oxidativas, al igual que en muchas reacciones químicas, según aumenta la temperatura aumenta la velocidad global de la reacción. Ahora bien, la fotólisis del peróxido o la regeneración del hierro II por acción de la luz UV no deben verse alteradas como consecuencia de un incremento de temperatura por lo que es de esperar que la generación de radicales hidroxilo no se vea afectada en gran medida por la temperatura. Por tanto, es de esperar que un incremento de la temperatura favorezca la eficiencia del tratamiento oxidativo. No obstante, hay que tener presente que el agua oxigenada se puede descomponer térmicamente por vías no radicalarias cuando la temperatura supera los 60-70ºC, lo cual obliga a incrementar la dosificación de este reactivo para compensar las perdidas derivadas de la citada descomposición. 3.2.2.2. Dosificación del oxidante La velocidad de generación de radicales hidroxilo depende de la concentración de peróxido en disolución, de forma que al incrementarse esta última aumenta la generación de radicales y la concentración de los mismos en disolución. Ahora bien, el incremento de la concentración de agua oxigenada no lleva implícito un incremento del rendimiento del tratamiento por cuanto a que el agua oxigenada en exceso puede actuar como inhibidor radicalario, reduciendo la concentración de Escalado del tratamiento de efluentes acuosos con glicoles 55 radicales hidroxilo, o puede absorber energía lumínica que de otra manera se consumiría en la fotolisis de los compuestos orgánicos a descomponer. 3.2.2.3. Longitud de onda e intensidad de la luz UV En los procesos de oxidación avanzada, la radiación UV debe ser absorbida en primera instancia por el oxidante o el catalizador con el objeto de generar radicales hidroxilo, siendo la absorción de luz por parte del contaminante y su consiguiente fotolisis aspectos secundarios. La absorción de la luz por parte del oxidante y de otros compuestos depende de la absorbancia de los mismos en las distintas longitudes de onda y de la longitud de onda emitida por la lámpara, interesando que esta última emita con la mayor intensidad posible en la región donde la absorbancia del oxidante es máxima. Por otro lado, la velocidad de las reacciones fotolíticas depende de la intensidad de la luz. Cuanto mayor sea la intensidad lumínica aportada al medio reactante se incrementará la velocidad de las reacciones foto-catalizadas, como la generación de radicales hidroxilo a partir de la descomposición fotocatalítica del agua oxigenada, la regeneración foto-química de Fe II a Fe III o la foto-descomposición de los compuestos orgánicos, redundando en una mayor eficiencia en el proceso fotooxidativo. Sin embargo, cuando la intensidad de la luz se incrementa por encima de un valor crítico, las citadas reacciones pasan de estar controladas cinéticamente a estar controladas por la transferencia de masa. A partir de este punto, la velocidad de la reacción no se ve influenciada por incrementos adicionales en la intensidad de la luz. 3.2.2.4. Cantidad de catalizador La adición de catalizador, hierro II en el caso del tratamiento foto-fenton, permite incrementar la velocidad de generación de radicales hidroxilo y, por tanto de la reacción de oxidación. Si bien la presencia de catalizador no incide directamente en la fotolisis del agua oxigenada u otras reacciones fotoquímicas, la luz UV contribuye a regenerar el catalizador, incrementando su acción. No obstante, la adición de catalizador debe controlarse cuidadosamente puesto que una utilización excesiva puede originar la aparición de precipitados en el sistema que reduzcan la absorbancia de luz UV por las especies implicadas en el proceso. Así mismo, una velocidad excesiva de la reacción de oxidación puede dar lugar a otros efectos perjudiciales, como los disparos térmicos y la consiguiente descomposición no radicalaria del oxidante. 3.2.2.5. Tiempo de retención hidráulico El tiempo de retención hidráulico (TRH) es el tiempo de exposición del contaminante a la luz UV en presencia del oxidante. Dependiendo de dicho tiempo de retención, el tratamiento oxidativo progresa en mayor o menor medida, en especial en aquellos sistemas que no recurren a la utilización de catalizador. El TRH es función del caudal a través del reactor secundario y del modo de operación de la instalación concreta. En general se distinguen 3 tipos de instalaciones: Escalado del tratamiento de efluentes acuosos con glicoles 56 • • • En flujo En flujo con recirculación En batch En los siguientes diagramas se pueden apreciar los mencionados modos operativos: En las instalaciones que operan en flujo, se adiciona el peróxido al efluente y se bombea a través de un reactor UV, pasando a través del mismo una única vez. En este caso, el tiempo de residencia viene determinado por el caudal de efluente y por el volumen del reactor UV. En general, estas instalaciones presentan bajos TRH y se aplican en el tratamiento de efluentes con contaminantes orgánicos en muy baja concentración (< 10 ppm). Para el tratamiento de efluentes con mayores contenidos en contaminantes orgánicos se puede incrementar el TRH colocando reactores UV en línea o bien se puede optar por recircular parte del efluente en el reactor UV. Para efluentes con unas cargas orgánicas muy elevadas y caudales relativamente bajos, el sistema de tratamiento más efectivo opera en modo batch. En este caso, se trata un volumen concreto de efluente en cada ciclo, recirculándose el mismo entre un reactor tanque y el reactor UV hasta que la carga orgánica se reduce por debajo del valor deseado. En este caso, el TRH es función del caudal de recirculación entre reactores, los volúmenes de estos y el tiempo total del ciclo. Este sistema, si bien es el más efectivo y polivalente, también presenta inconvenientes. Así, el calor generado por la lámpara UV tiende a acumularse en el sistema, contribuyendo al incremento de la temperatura Escalado del tratamiento de efluentes acuosos con glicoles 57 asociado al tratamiento oxidativo. Para mitigar este problema se suelen emplear lámparas UV de menor potencia e incluso se recurre a la instalación de sistemas de intercambio de calor para controlar la evolución de la temperatura en el sistema. El modo de operación de la instalación determina el TRH y por tanto el grado de destrucción de los contaminantes alcanzable en cada caso. El modo de operación se selecciona dependiendo de los caudales de efluente a tratar, la tipología y cantidad de contaminantes a eliminar y el grado de destrucción de los mismos que se desee alcanzar. 3.2.2.6. Objetivo del tratamiento El tratamiento oxidativo de contaminantes orgánicos en efluentes acuosos en una reacción en cadena, en la que el contaminante se va fragmentando paulatinamente hasta alcanzar la mineralización completa. Es decir, mediante la adición de cantidades suficientes de oxidante, luz UV y/o catalizador se puede llegar a eliminar completamente la contaminación orgánica del efluente acuoso. En el siguiente esquema se puede seguir la evolución de la degradación oxidativa de un compuesto orgánico simple (metanol): En muchos casos, no es preciso mineralizar completamente el contaminante. Así por ejemplo, para reducir la demanda química de oxígeno o la toxicidad del efluente basta con oxidar en primera instancia el contaminante original. Ahora bien, hay que tener presente que los compuestos intermedios pueden resultar más tóxicos que el contaminante original, por lo que en aquellos tratamientos en los que se aplique una oxidación parcial es preciso considerar la toxicidad del efluente tratado con vistas a las etapas de tratamiento posterior (tratamiento biológico) o su vertido. T3.3. Equipamiento para la implantación del tratamiento foto-oxidativo Un sistema de tratamiento oxidativo con el reactivo de Fenton a integrar en una instalación de tratamiento físico-químico existente requiere de un equipamiento relativamente sencillo (se señalan en negrita los equipos principales): • • • Tanque pulmón. Bomba de alimentación al reactor. Reactor tanque. Escalado del tratamiento de efluentes acuosos con glicoles 58 • • • • • • • • Reactor secundario con luz UV. Sistema de recirculación del medio reactante entre ambos reactores. Almacenamiento y dosificación de oxidante. Módulos de almacenamiento y dosificación de reactivos. Sistema de control de pH, temperatura y nivel. Bomba de descarga del reactor (opcional). Tanque de mantenimiento (opcional). Decantador de sólidos (opcional). El reactor tanque, el reactor secundario y el sistema de recirculación entre los mismos deben diseñarse en función del caudal de efluente concreto a tratar y el tiempo de retención hidráulico requerido para alcanzar el grado de destrucción deseado, teniendo en consideración las posibles variaciones en el caudal del efluente o la concentración del contaminante. En cuanto a los materiales constructivos es preciso considerar materiales apropiados para su contacto con agua oxigenada concentrada, tanto para los elementos principales (cuerpo de reactor, conducciones...) como para los elementos auxiliares (válvulas, juntas...). Entre los materiales compatibles se pueden mencionar: • • • • • • Vidrio HDPE PTFE Aleaciones de aluminio (356) Aceros inoxidables (preferentemente 304 y 316) Elastómeros halogenados. Independientemente de su mayor o menor compatibilidad, es recomendable que todos los elementos metálicos sean pasivados de forma previa a su puesta en operación. Para el cuerpo de los reactores se recomienda el acero inoxidable 316, dada su excelente resistencia a la corrosión y elevada durabilidad. La utilización de dicho metal en las conducciones y en las válvulas es también recomendable, si bien se puede recurrir a materiales más económicos en algunos de estos elementos (inoxidable 304), en especial en aquellos que no están expuestos permanentemente a la acción del medio reactante. En el caso de la lámpara UV, se recomienda que la misma se aloje en un revestimiento de cuarzo óptico de elevada calidad, para asegurar su resistencia al medio manteniendo la transparencia óptica a la luz UV. Es recomendable que la lámpara incluya un sistema de limpieza automática con escobillas, en especial si la neutralización del efluente se va a llevar a cabo en el propio sistema de reacción puesto que los precipitados metálicos pueden dar lugar a incrustaciones en la superficie de las lámparas. Así mismo, dependiendo de la potencia de luz UV a instalar, puede ser recomendable que las lámparas se introduzcan en una camisa de refrigeración, la cual debe estar constituida por cuarzo de calidad óptica. Escalado del tratamiento de efluentes acuosos con glicoles 59 El sistema de almacenamiento del agua oxigenada debe considerarse con especial atención. La elevada presión de vapor del citado reactivo y la generación de gases por su descomposición obliga a que el tanque de almacenamiento disponga de válvulas de aireación y venteo que, aun previniendo la entrada de impurezas del exterior, permitan evacuar los gases del interior del tanque. El tanque de almacenamiento debe situarse preferentemente en el exterior por lo que debe estar construido en un material completamente opaco a la luz. Así mismo, debe aislarse de los depósitos de otros reactivos, en especial de materiales comburentes, y debe incluirse un sistema de recogida de posibles fugas Para el tanque pulmón se puede plantear la utilización de un depósito de plástico reforzado con fibra de vidrio, dimensionado convenientemente para almacenar el efluente acuoso producido por la planta durante la duración del tratamiento oxidativo. En el almacenamiento de los reactivos se pueden considerar depósitos de HDPE convencionales. Dichos depósitos pueden incorporar medidores de nivel por ultrasonidos. La aplicación del proceso foto-fenton requiere de la neutralización del efluente y la eliminación de los barros férricos resultantes. En general, dichos barros pueden separarse por decantación simple, preferentemente con la adición de floculantes dado que por el tamaño de partícula de los barros férricos se requieren de tiempos de decantación relativamente elevados. T3.4. Evaluación de costes Se pretende realizar una evaluación previa de los costes asociados a la realización del tratamiento de oxidación química empleando agua oxigenada y hierro II. Aunque el citado tratamiento se podría realizar intercalado en distintos puntos de los sistemas físico-químicos operativos en la actualidad, en este apartado se ha considerado como una etapa adicional. El siguiente diagrama recoge las operaciones básicas para la aplicación del sistema de tratamiento estudiado. Ácido Efluente H2O2 Reactor principal Fe2+ Base Basificación Reactor secundario Decantación/ Filtración Efluente Barros Fe Luz UV Escalado del tratamiento de efluentes acuosos con glicoles 60 En cuanto al equipamiento necesario para aplicar las etapas consideradas: • • • • • • Depósitos de reactivos y sistemas de dosificación de los mismos. Reactor principal con agitación. Reactor secundario con lámpara UV. Sistema de recirculación de medio reactante entre reactores. Depósito de gasificación. Sistema de decantación/filtración. En cualquier caso se trata de equipamiento estándar en sistemas de depuración de aguas cuya operación habría de ajustarse a las características particulares de los efluentes y reactivos considerados. Como ya se ha mencionado, algunas de estas etapas se podrían realizar en los sistemas de tratamiento físico-químico implantados en la actualidad. Habría que estudiar las particularidades de cada sistema de tratamiento y el equipamiento requerido por el mismo para evaluar la posibilidad de realizar el tratamiento de oxidación en las instalaciones existentes. Con respecto a las inversiones necesarias para una instalación completa o para modificar las instalaciones existentes, éstas no se han evaluado ya que el dimensionamiento de las mismas depende fundamentalmente del caudal de efluente a tratar, el cual varía ampliamente según la empresa considerada. Así, los caudales de efluente a tratar pueden oscilar desde menos de 1 m3/h hasta unos 5 m3/h. Se han evaluado los costes de los reactivos empleados en el tratamiento por metro cúbico de un efluente genérico, si bien dichos consumos deberán ajustarse dependiendo de los valores de DQO del efluente de partida y los valores de DQO exigidos tras el tratamiento. Para la evaluación de costes se ha considerado una DQO inicial en torno a 8.000 mg/l y una DQO final por debajo de 500 mg/l. Así mismo, en la evaluación de costes se ha tenido en cuenta el consumo energético derivado del empleo de la radiación UV. También se ha evaluado el coste de gestión de los barros férricos generados en el tratamiento. Dicho coste de gestión ha sido considerado ya que la cantidad de hierro contenida en el efluente también está limitada por la legislación para el vertido del efluente. La siguiente tabla recoge las estimaciones realizadas en cuanto al coste de los reactivos y los consumos asociados al tratamiento Foto-Fenton desarrollado en la presente actuación. Escalado del tratamiento de efluentes acuosos con glicoles 61 Proceso Foto-Fenton Parámetro Coste (€/m3) Ácido 0,15 H2O2 18,81-22,44* FeCl2 0,61 NaOH 1,35 Consumo energético lámpara UV 0,68 Barros Fe 0,25 Total tratamiento 21,85-25,48 *Dependiendo de la DQO inicial del efluente a tratar Los precios reflejados en la tabla se han obtenido de suministradores industriales en base a suministro en cisterna. Dichos precios pueden variar dependiendo del modo de suministro y de las cantidades consumidas. Con respecto a los barros férricos generados en la etapa de basificación se ha considerado la gestión de los mismos como residuos peligrosos con un coste de 150 €/t. Los mencionados barros contienen en torno a un 27% de agua. Tal y como se puede apreciar, el proceso escalado en la presente actuación sobre la base del sistema Foto-Fenton supone un coste inferior (entre un 14 % y un 26%) al obtenido según el mismo proceso a escala de laboratorio (29,72 €/m3), debiéndose la citada reducción fundamentalmente a la reducción de la potencia eléctrica requerida por la lámpara UV por unidad de volumen de efluente a tratar. Con respecto al proceso Fenton establecido en una actuación previa (46,88 €/m3), la reducción de coste es superior a un 45% manteniendo un nivel de eficacia superior Ahora bien,. hay que tener presente que el proceso foto-fenton requiere de más tiempo para lograr la misma reducción de la DQO, pasando de tiempos de tratamiento de 30-60 minutos a tiempos de tratamiento próximos a las 2,5 horas, lo cual también repercute en los costes unitarios del proceso al requerirse equipamientos más grandes para una capacidad de tratamiento determinada. No obstante, hay que tener en cuenta que el incremento de precio no es lineal con el incremento del precio del reactor y los tanques ya que constan del mismo equipamiento anexo y únicamente difieren las dimensiones de los recipientes, siendo estos elementos los que menos influyen en el coste de la instalación. Así mismo, hay que tener en cuenta que la incorporación de la luz UV también conlleva un incremento del coste de la instalación de tratamiento con respecto al proceso Fenton. No obstante, los sistemas de luz UV son empleados industrialmente en distintas operaciones y pueden considerarse un equipamiento estándar, lo cual contribuye a que su precio no sea demasiado elevado. Tanto los consumos como la eficiencia del tratamiento deberían ser ajustados y comprobados experimentalmente para cada tipo de efluente, tomando en consideración los distintos factores que influyen en el mismo (sólidos en suspensión, contenido en aceites y grasas...), dependiendo del nivel de DQO inicial y el nivel de DQO final Escalado del tratamiento de efluentes acuosos con glicoles 62 admisible en cada caso y, de esta manera, estimar de una manera más realista los costes asociados al tratamiento en cada caso particular. Tal y como se desprende de la evaluación de costes, tanto para el proceso Foto-Fenton como para el proceso Fenton, el coste del tratamiento viene determinado fundamentalmente por el consumo de agua oxigenada (80-90 %). La negociación del precio de compra de este reactivo se considera trascendental con el objeto de reducir el coste del tratamiento. Escalado del tratamiento de efluentes acuosos con glicoles 63