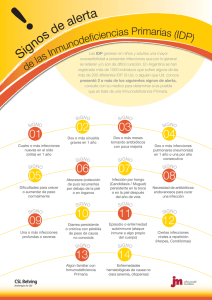
Monografía del producto Hizentra
Anuncio

Monografía del producto Hizentra ® Inmunoglobulina subcutánea (humana) líquida al 20% 2 Índice 1Prefacio 2Características del producto 24 4.1 Inmunodeficiencias primarias. . . . . . . . . . . . . . . . . . 24 4.2 Epidemiología de las IDP. . . . . . . . . . . . . . . . . . . . . 24 4.3 Fisiopatología de las IDP. . . . . . . . . . . . . . . . . . . . . 27 4.4 Presentación clínica de las IDP . . . . . . . . . . . . . . . . 28 4.5 Diagnóstico de las IDP . . . . . . . . . . . . . . . . . . . . . . 28 4.6 Impacto socioeconómico . . . . . . . . . . . . . . . . . . . . 29 4.7 Inmunodeficiencias secundarias . . . . . . . . . . . . . . . 30 4.8 Experiencia con el tratamiento con IgSC en IDP e IDS. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 32 4.9 Progreso en las terapias con IgSC. . . . . . . . . . . . . . 34 4.10 Conclusiones . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 34 4.11 Bibliografía . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 35 5Propiedades farmacocinéticas 16 3.1 Introducción . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 16 3.2 Selección de donantes . . . . . . . . . . . . . . . . . . . . . . 17 3.3 Cribado del plasma donado . . . . . . . . . . . . . . . . . . 18 3.4 Análisis de las mezclas para fabricación . . . . . . . . . 18 3.5 Eliminación de patógenos potenciales durante el proceso de fabricación . . . . . . . . . . . . . . . . . . . . 19 3.6 Normas de correcta fabricación y garantía de calidad. . . . . . . . . . . . . . . . . . . . . . . . 19 3.7 Validación. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 19 3.8 Eliminación de virus en cada paso de fabricación . . 20 3.9 Estudios sobre eliminación de priones. . . . . . . . . . . 21 3.10 Bibliografía . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 23 4Inmunodeficiencias primarias y secundarias 9 2.1 Descripción. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 9 2.2 Propiedades clave de Hizentra®. . . . . . . . . . . . . . . . . 9 2.3 Producción de Hizentra®. . . . . . . . . . . . . . . . . . . . . 12 2.4 Bibliografía . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 14 3Eliminación de patógenos potenciales 4 1.1 Hizentra®. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4 1.2 Enfermedades de inmunodeficiencia primaria. . . . . . 5 1.3 Desarrollo de la terapia con inmunoglobulinas. . . . . . 5 1.4 Acerca de CSL Behring. . . . . . . . . . . . . . . . . . . . . . . 7 1.5 Bibliografía . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7 39 5.1 Farmacocinética de Hizentra® en la inmunodeficiencia primaria . . . . . . . . . . . . . . . . . . . 39 5.2 Conclusiones . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 42 5.3 Bibliografía . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 43 6Eficacia clínica 45 6.1 Indicaciones clínicas. . . . . . . . . . . . . . . . . . . . . . . . 45 6.2 Diseño y metodología del estudio . . . . . . . . . . . . . . 46 6.3 Análisis de la eficacia. . . . . . . . . . . . . . . . . . . . . . . . 48 6.4 Conclusiones . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 50 6.5 Bibliografía . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 51 Apéndice. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 52 7Tolerabilidad clínica 55 7.1 Estudios clínicos de tolerabilidad. . . . . . . . . . . . . . . 55 7.2 Acontecimientos adversos graves. . . . . . . . . . . . . . 56 7.3 Acontecimientos adversos. . . . . . . . . . . . . . . . . . . . 57 7.4 Acontecimientos adversos relacionados de modo causal con la infusión de Hizentra® . . . . . . . . . . . . . 58 7.5 AA relacionados con la edad. . . . . . . . . . . . . . . . . . 60 7.6 Tolerabilidad local – reacciones en la zona de inyección . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 60 7.7 Comparación de la tolerabilidad local con otras preparaciones de IgSC. . . . . . . . . . . . . . . . . . . . . . 63 7.8 Conclusiones . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 64 7.9 Bibliografía . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 64 8Dosificación, administración y almacenamiento 65 8.1 Indicaciones y uso. . . . . . . . . . . . . . . . . . . . . . . . . . 65 8.2 Dosificación. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 65 8.3 Administración . . . . . . . . . . . . . . . . . . . . . . . . . . . . 66 8.4 Formulaciones y presentaciones. . . . . . . . . . . . . . . 67 8.5 Almacenamiento. . . . . . . . . . . . . . . . . . . . . . . . . . . 67 8.6 Manipulación. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 67 8.7 Bibliografía . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 67 9Calidad de vida relacionada con la salud 68 9.1 Impacto de la inmunodeficiencia primaria sobre la calidad de vida relacionada con la salud. . . . . . . . . 68 9.2 Efecto de Hizentra® sobre la calidad de vida relacionada con la salud . . . . . . . . . . . . . . . . . . . . . 70 9.3 Evaluaciones de la HRQL y resultados del ensayo. . 72 9.4 Conclusiones . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 75 9.5 Bibliografía . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 75 10Resumen de las características del producto 77 11Lista de abreviaturas 79 3 1 Prefacio ●●Hizentra® ofrece la mayor concentración a la máxima velocidad de infusión aprobada, al mismo tiempo que proporciona un tratamiento con IgSC bien tolerado*. ●●La terapia con IgSC cada vez gana más terreno sobre la terapia con IgIV en el tratamiento de la IDP. ●●La IgSC ofrece a los pacientes con IDP una mayor flexibilidad e independencia que la IgIV. ●●CSL Behring es un líder mundial en el tratamiento con inmunoglobulinas. 1.1 Hizentra® Hizentra es el primer tratamiento con inmunoglobulina (Ig) líquida al 20% formulada específicamente para utilizarse por vía subcutánea (SC) y representa un avance en el tratamiento de pacientes con inmunodeficiencia primaria (IDP) humoral e inmunodeficiencias secundarias (IDS). obtiene utilizando L-prolina como estabilizador. En consecuencia, Hizentra® es estable a temperatura ambiente (hasta los 25°C) durante 30 meses y no necesita refrigeración. Hizentra® es el segundo producto de Ig de CSL Behring, después de Privigen® (inmunoglobulina normal humana, líquida al 10%; IgPro10, para infusión intravenosa), para el que se utiliza este estabilizador. Hizentra® es un preparado de inmunoglobulina G (IgG) humana polivalente lista para su uso, estabilizada con L-prolina, que combina un volumen de infusión bajo con la comodidad de la administración en el entorno que más le convenga al paciente. Esta combinación proporciona a los pacientes la posibilidad de un menor tiempo de administración en comparación con otros tratamientos con inmunoglobulina intravenosa (IgIV) o SC. Hizentra® tiene una tolerabilidad comparable a otra inmunoglobulina SC (IgSC), Vivaglobin® [1]. Con más de seis décadas de experiencia en el fraccionamiento del plasma humano, CSL Behring garantiza que los pasos de eliminación de patógenos potenciales utilizados en la fabricación de Hizentra® ofrecen el mismo alto nivel de calidad que los utilizados en el resto de sus productos derivados del plasma. Asimismo, Hizentra® tiene una pureza de Ig ≥ 98%, calidad que se espera normalmente para los productos de Ig intravenosa (como Privigen®). ® La mejora de la eficiencia global de la administración de IgSC con Hizentra® se logra gracias a la concentración proteica de Ig líquida al 20% del producto final. Esta alta concentración se * Hasta Marzo 2012 4 Esta monografía describe las propiedades y el desarrollo clínico de Hizentra®, que está indicado para el tratamiento de pacientes con IDP e IDS, que incluyen, entre otras, agammaglobulinemia congénita, inmunodeficiencia común variable, agammaglobulinemia ligada al cromosoma X, síndrome de Wiskott-Aldrich e inmunodeficiencias combinadas graves, mieloma múltiple y leucemia linfocítica crónica. Tabla 1.1 Principales logros e hitos en la historia de CSL Behring 1.2 Enfermedades de inmunodeficiencia primaria Las inmunodeficiencias primarias humorales son trastornos graves, crónicos y raros del sistema inmunitario que afectan a los pacientes de formas muy diversas. Los cuatro tipos principales son los trastornos de los linfocitos B (70% de todas las IDP), los trastornos de los linfocitos T (20% de todas las IDP), los trastornos fagocíticos (9% de todas las IDP) y las deficiencias del complemento (< 1% de todas las IDP) [2]. La mayoría de las IDP, de las que existen más de 150 [3], están causadas por una anomalía en un único gen, y aproximadamente el 80% se diagnostican en niños y adultos jóvenes antes de los 20 años de edad, con predominancia en el género masculino. En los adultos, las IDP son ligeramente más predominantes en el género femenino [4]. Debido a que los pacientes con IDP no pueden desarrollar una respuesta inmunitaria de protección suficiente, tienen una mayor susceptibilidad a padecer infecciones recurrentes, infecciones difíciles de controlar o infecciones provocadas por patógenos oportunistas. terapia con Ig [7], que incluyó vías de administración más eficientes. Estos trastornos son de por vida y sus complicaciones pueden poner en peligro la vida de los pacientes, por lo que es importante hacer un diagnóstico precoz e iniciar un tratamiento adecuado [5]. Históricamente, la terapia sustitutiva con Ig fue utilizada de forma satisfactoria en 1952 para tratar la IDP en un niño con agammaglobulinemia [6]. En los años siguientes, se hizo un progreso considerable en el conocimiento y la mejora de los efectos de la En un inicio, en la década de 1950, las inyecciones intramusculares (IM) de IgG se convirtieron rápidamente en el tratamiento estándar para la agammaglobulinemia [8]. No obstante, el dolor local en el lugar de la inyección representaba una limitación de la dosis que se podía administrar. La alternativa en ese momento era administrar plasma por vía intravenosa, pero esto requería grandes volúmenes en adultos para proporcionar suficiente IgG. La 1.3 Desarrollo de la terapia con inmunoglobulinas 5 administración intravenosa de las preparaciones de Ig (entonces disponibles) no era posible debido a acontecimientos adversos graves. Estos efectos se atribuyeron a la activación del complemento por los agregados de IgG. El desarrollo posterior de preparaciones seguras para su administración IV promovió el uso de IgIV [8]. Una encuesta realizada por la Immune Deficiency Foundation de EE.UU. registró un mayor uso de IgIV a partir de 1978 y hasta 1995, momento en el que se estimó que 7 de cada 10 pacientes estaban recibiendo IgG por esta vía [9]. Una encuesta de seguimiento realizada el 2002 registró que el 67% de 1.526 pacientes recibían IgIV en un hospital, una consulta o un lugar específico para infusiones, mientras que el 32% recibía la infusión en casa, como autoadministración (7%) o administrada por un enfermero o enfermera (28%) [10]. Se estima que la duración media de la infusión de IgIV en pacientes con IDP es de 3,5 horas y se cree que acortar el tiempo de infusión ofrecería más comodidad y autonomía para el paciente, además de suponer un ahorro de costes en cuanto al tiempo que se necesita al personal de enfermería y los recursos del hospital [7]. Sin embargo, el acceso venoso puede ser un problema para los pacientes que requieren IgIV [8]. Asimismo, la administración por vía IV puede causar niveles máximos elevados de IgG en suero fuera del intervalo fisiológico que pueden provocar acontecimientos adversos sistémicos como cefalea [11]. La infusión de IgSC cada vez se utiliza más en Escandinavia [8,12] y otros países europeos y, en la actualidad, el uso de IgSC varía entre el 2% aproximadamente en Italia, el 54% aproximadamente en Alemania [13] y más del 80% en Suecia [14]. Se han desarrollado protocolos de tratamiento que emplean una infusión rápida subcutánea en varios 6 lugares de forma simultánea. A diferencia de la IgIV mensual, el tratamiento por vía SC permite un mejor mantenimiento de niveles séricos estables de Ig. La aceptación de la autoadministración o la administración en casa de la IgSC ha aumentado considerablemente, así como la mayor independencia que proporciona [8]. Una encuesta realizada en 1995 acerca de los pacientes en Escandinavia mostró que el tratamiento domiciliario con IgSC proporcionaba a los pacientes flexibilidad, libertad y una mayor independencia de los profesionales sanitarios [12]. Una evaluación posterior de la calidad de vida relacionada con la salud (HRQL) en niños y adultos con IDP realizada en 2004 mostró que la IgSC administrada en casa mejoraba las valoraciones de la HRQL y proporcionaba a los pacientes y a sus familias una mayor independencia, menos limitaciones del tiempo personal y menos restricciones de las actividades familiares [11]. La infusión domiciliaria de IgSC permitió a los pacientes asistir al trabajo o a la escuela sin necesidad de tener que tomarse tiempo de permiso para recibir las infusiones en el hospital. Asimismo, la IgSC se puede administrar con más frecuencia que la IgIV, lo que permite un mejor mantenimiento de niveles séricos estables de Ig que son bien tolerados [8]. Una revisión reciente de la literatura internacional sobre el uso de IgSC concluyó que el tratamiento administrado en casa estaba asociado a una mejor puntuación en la calidad de vida y con una mayor sensación de salud por parte de adultos, niños y sus cuidadores. Además, se observó que los costes asociados a la IgSC administrada en casa eran inferiores que los costes del tratamiento en el hospital, incluido el equipamiento, los suministros, la asistencia del personal de enfermería y los traslados de los pacientes al hospital [15]. 1.4 Acerca de CSL Behring 1.5 Bibliografía La historia de CSL Behring se remonta a hace más de un siglo y, desde sus inicios, la compañía ha sido líder en el campo de los productos hemoderivados y ha llevado a cabo un trabajo de vanguardia en el fraccionamiento del plasma y la purificación de la inmunoglobulina (tabla 1). Durante este tiempo, la compañía ha desarrollado un sistema altamente controlado de recogida, fabricación y distribución de plasma humano para garantizar que sus preparaciones de inmunoglobulina cumplen las normas de calidad más altas para el beneficio de los pacientes. En concreto, la compañía está comprometida con la producción de productos que cumplan las más altas normas de calidad en cuanto a la seguridad frente a patógenos, la eficacia y la tolerabilidad. Los sistemas y controles de garantía de calidad utilizados por CSL Behring son de los más rigurosos de la industria de la bioterapia. 1) Berger M. L- proline-stabilized human IgG: Privigen(R) 10% for intravenous use and Hizentra® 20% for subcutaneous use. Immunotherapy 2011; 3:163-176. CSL Behring está comprometida con el desarrollo de terapias que mejoren y salven la vida de personas que padecen enfermedades graves y raras, incluidas las enfermedades de inmunodeficiencia primaria. 4) Kumar A, Teuber SS, Gershwin E. Current perspectives on primary immunodeficiency diseases. Clin Dev Immunol 2006;13:223-59. 2) Champi C. Primary immunodeficiency disorders in children: prompt diagnosis can lead to lifesaving treatment. J Pediatr Health Care 2002;16:16-21. 3) Geha RS, Notarangelo LD, Casanova J-L, Chapel H, Conley ME, Fischer A, Hammarström L, Nonoyama S, Ochs HD, Puck J, Roifman C, Seger R, Wedgwood J. The International Union of Immunological Societies (IUIS) Primary Immunodeficiency Diseases (PID) Classification Committee. J Allergy Clin Immunol 2007;120:776-94. 5) Lederman HM. The clinical presentation of primary immunodeficiency diseases. Clinical Focus on Primary Immune Deficiencies 2000; 2(Issue 1). Available at: http://www. primaryimmune.org/publications/clinic_focus/ cf_aug00.pdf. Accessed June 24, 2009. 6) Bruton O. Agammaglobulinemia. Pediatrics 1952;9:722-28. 7) Ballow M, Notarangelo L, Grimbacher B, Cunningham-Rundles C, Stein M, Helbert M, Gathmann B, Kindle G, Knight AK, Ochs HD, Sullivan K, Franco JL. Immunodeficiencies. Clin Exp Immunol 2009;158(Suppl 1):14-22. 7 8) Berger M. Subcutaneous immunoglobulin replacement in primary immunodeficiencies. Clin Immunol 2004;112:1-7. 14) Gardulf A. Immunoglobulin treatment for primary antibody deficiencies. Advantages of the subcutaneous route. Biodrugs 2007;21:105-16. 9) Immune Deficiency Foundation. Primary immune deficiency diseases in America. The first national survey of patients and specialists. Available at: http://www.primaryimmune.org/publications/ surveys/First_National_Survey_of_Patients_and_ Specialists_(1995).pdf. Accessed July 20, 2009. 15) Moore ML, Quinn JM. Subcutaneous immunoglobulin replacement therapy for primary antibody deficiency: advancements into the 21st century. Ann Allergy Asthma Immunol 2008;101:114-21. 10) Immune Deficiency Foundation. Primary immune deficiency diseases in America: 2002. The second national survey of patients. Available at: http://www.primaryimmune.org/publications/ surveys/second_national_survey_of_patients_ (2002).pdf. Accessed July 20, 2009. 11) Gardulf A, Nicolay U, Asensio O, Bernatowska E, Böck A, Costa-Carvalho BT, Granert C, Haag S, Hernández D, Kiessling P, Kus J, Matamoros N, Niehues T, Schmidt S, Schulze I, Borte M. Children and adults with primary antibody deficiencies gain quality of life by subcutaneous IgG self-infusions at home. J Allergy Clin Immunol 2004;114:936-42. 12) Gardulf A, Björvell J, Andersen V, Björkander J, Ericson D, Frøland SS, Gustafson R, Hammarström L, Nyström T, Søeberg B, Smith CIE. Lifelong treatment with gammaglobulin for primary antibody deficiencies: the patients’ experiences of subcutaneous self-infusions and home therapy. J Adv Nurs 1995;21:917-27. 13) Gathmann B, Grimbacher B, Beauté J, Dudoit Y, Mahlaoui N, Fischer A, Knerr V, Kindle G, for the ESID Registry Working Party. The European internet-based patient and research database for primary immunodeficiencies: results 2006–2008. Clin Exp Immunol 2009;157(Suppl 1):3-11. 8 2 Características del producto ●●Hizentra® tiene una alta concentración de IgG, lo que permite que el volumen de infusión sea bajo y que se acorte el tiempo de infusión, siendo así más cómodo para el paciente. ●●Hizentra® es estable durante 30 meses a ≤ 25 °C. 2.1 Descripción Hizentra es una formulación líquida al 20% de inmunoglobulina (Ig) humana purificada, lista para su uso para administración subcutánea. Hizentra® se fabrica utilizando la misma avanzada tecnología que se utiliza para el producto de inmunoglobulina intravenosa (IgIV) Privigen® (IgPro10), y está específicamente formulado para ser administrado por vía subcutánea gracias a que se le ha añadido L-prolina para estabilizar la proteína de alta concentración. ® Tabla 2.1 Reactividades antigénicas de Hizentra® [1] menores. Esto ofrece potencialmente a los pacientes con inmunodeficiencia primaria humoral (IDP) e inmunodeficiencia secundaria (IDS) la oportunidad de autoadministrarse el tratamiento en casa, lo que se traduce en una mejor calidad de vida, una mayor independencia y también en ahorro en los costes sanitarios. Hizentra® se purifica a partir de una mezcla de plasmas de hasta 60.000 donantes sanos, por lo que contiene una enorme variedad de especificidades de anticuerpos e idiotipos disponibles en la población humana general. Esta característica hace de Hizentra® un agente inestimable para el tratamiento de múltiples trastornos inmunitarios, ya que a los pacientes con estos trastornos proporcionará anticuerpos protectores contra numerosos patógenos que se hallan habitualmente. La tabla 2.1 muestra las reactividades antigénicas contra algunos patógenos habituales. 2.2 Propiedades clave de Hizentra® Hizentra® contiene una concentración de inmunoglobulina más alta que otros productos de inmunoglobulinas subcutáneas (IgSC) y de IgIV, lo que permite que el tiempo y el volumen de infusión sean 2.2.1 Concentración de IgG y composición Hizentra® contiene una alta concentración (20%) de inmunoglobulina G (IgG) en comparación con otras IgSC (p. ej., 16% en Vivaglobin® y Subcuvia™ y 16,5% en Gammanorm™), lo que resulta en un volumen de infusión menor y en un tiempo de infusión reducido (una mediana de 1,6 a 2 horas por semana en el estudio de fase III en EE.UU. [2]). La calidad 9 de Hizentra® se logra gracias a la aplicación de un completo y avanzado proceso de purificación, que tiene como resultado una pureza final de la Ig de ≥ 98%, comparable a la de los productos de IgIV más avanzados. asocia con una baja tolerabilidad en el tratamiento de los pacientes con insuficiencia renal y otras enfermedades (p. ej., diabetes). En cambio, se han utilizado aminoácidos, como la glicina, como estabilizadores [6]. La mayor concentración de IgG y la administración por vía subcutánea resultarán potencialmente en una mayor comodidad, ya que los pacientes pueden administrársela en casa, lo que mejora su independencia y su calidad de vida. El aumento de la concentración de inmunoglobulina se asocia con una mayor viscosidad; sin embargo, la presencia de la L-prolina en Hizentra® reduce la viscosidad de la solución hasta un nivel comparable al de una IgSC al 16% ya autorizada (Vivaglobin®) [1]. La L-prolina, un aminoácido no esencial que se produce de forma natural, fue investigada como excipiente para las IgIV durante el desarrollo de Privigen® y demostró ofrecer ventajas respecto a la glicina en la prevención de la agregación y la fragmentación de la IgG [7], así como en la prevención de la decoloración amarillenta durante el almacenamiento [7, 8]. La L-prolina no solo mostró ser superior a la glicina como agente estabilizador, sino que también mostró un perfil de tolerabilidad favorable [6]. La distribución de las subclases de IgG en Hizentra® es similar a la que se encuentra en el plasma de sujetos sanos (tabla 2.2). Tabla 2.2 Distribución de subclases de IgG en Hizentra® [1,3-5] 2.2.2 Formulación de Hizentra® La formulación de Hizentra® como una solución de IgG de alta concentración supuso un importante reto científico. Las proteínas disueltas en solución acuosa tienden a agregarse y precipitar si no se estabilizan de forma suficiente con los aditivos adecuados. Los hidratos de carbono se utilizan a veces como estabilizadores; sin embargo, una mayor concentración de hidratos de carbono se 10 La L-prolina es una molécula anfifílica que contiene un grupo químico polar (hidrófilo) y uno no polar (hidrófobo). En las preparaciones de IgG concentrada, los compuestos anfifílicos pueden cubrir los lugares de unión hidrófobos de las moléculas de IgG y de este modo evitar la agregación de las proteínas [9]. El efecto de las moléculas anfifílicas sobre la IgG es reversible [9] y no afecta a la integridad ni a la eficacia de la sustancia farmacológica. La formulación de Hizentra® incluye la L-prolina como estabilizador, ofreciendo un producto que es estable durante 30 meses cuando se almacena a temperatura ambiente (≤ 25 ˚C) [10]. La estabilidad a temperatura ambiente de Hizentra® proporciona una mayor flexibilidad y comodidad de administración para los pacientes con IDP e IDS en comparación con otras IgSC menos concentradas que se deben conservar refrigeradas [11, 12]. Las soluciones de IgG de alta concentración (≥ 15%) muestran un aspecto más opalescente y tienen tendencia a mostrarse no homogéneas cuando se mueven los viales. Esta apariencia no homogénea se debe muy probablemente a minúsculas burbujas de aire que quedan atrapadas y no pueden escapar de la densa solución proteica. Hizentra® se formula con cantidades residuales (10-30 mg/L) del detergente polisorbato 80 (P80), dando lugar a una solución de IgG estable y homogénea [1, 10]. 2.2.3 Tolerabilidad de los excipientes de Hizentra® Hizentra® contiene L-prolina como estabilizador y cantidades residuales de P80 como excipiente. A diferencia de otros productos de inmunoglobulinas, Hizentra® no contiene hidratos de carbono, como la sacarosa, ni conservantes. Se ha observado insuficiencia renal tras la administración de diferentes productos de IgIV; aquellos que contienen sacarosa como estabilizador causaron una parte desproporcionada del número total de acontecimientos adversos renales [13]. Se ha recomendado el uso de productos de inmunoglobulinas sin sacarosa en aquellos pacientes con factores de riesgo de insuficiencia renal [14]. La L-prolina está presente de forma natural en el cuerpo humano y forma parte de productos comercializados como las soluciones de aminoácidos para uso parenteral y en Privigen®. En las soluciones de aminoácidos, la L-prolina se administra a dosis más elevadas que las que se asocian con el tratamiento con Hizentra®. La seguridad de la L-prolina fue investigada en estudios preclínicos durante el desarrollo de Privigen® y Sandoglobulin® líquido, un producto anterior de IgIV [12]. Se evaluó la L-prolina a dosis de hasta 75 veces la dosis máxima utilizada en pacientes tratados con Hizentra® en estudios de toxicidad con dosis repetidas, estudios de toxicidad reproductiva, estudios de mutagenicidad y estudios farmacológicos de seguridad (sistema nervioso central), y no se observaron acontecimientos Figura 2.1 Proceso de producción de Hizentra® [19, 20] Descongelación y mezcla de plasmas Centrifugación Crioprecipitado Factores de coagulación Fraccionam. en etanol Filtración profundidad 1 Fraccionamiento en ácido octanoico Filtración profundidad Albúmina Inhibidor de la alfa1-proteinasa Inactivación en 2 Incubación a pH bajo condiciones ácidas Filtración profundidad 3 Filtración de profundidad CH9 Z+ Cromatografía de intercambio aniónico Filtración de virus 4 (Nano) filtración de virus Ultrafiltración/ Formulación Filtración estéril/ Dispensación Hizentra adversos [6]. Este perfil de toxicidad favorable indica que la L-prolina es un estabilizador apropiado en Hizentra®. No obstante, no se debería administrar Hizentra® a pacientes con hiperprolinemia. El P80 es un surfactante ampliamente utilizado como excipiente en productos comercializados para administración IV o SC, incluidos varios productos de IgIV a dosis similares o superiores. El excipiente tiene una baja toxicidad [15] y, por tanto, es un componente adecuado de Hizentra® 11 a la concentración especificada (10-30 mg/L). No se debería administrar Hizentra® a pacientes que han sufrido una reacción anafiláctica o una reacción sistémica grave tras la administración de P80. 2.2.4 Contenido de inmunoglobulina A Hizentra® contiene no más de 50 mg/L de inmunoglobulina A (IgA) [16]. No obstante, en los pacientes sensibilizados a IgA, no se puede excluir totalmente el riesgo de una reacción anafiláctica, y el producto no debería utilizarse en estos pacientes. 2.2.5 Eliminación de patógenos potenciales La eliminación de patógenos se logra mediante una meticulosa selección de donantes y mediante una selección tanto de las donaciones individuales como de las mezclas de plasmas para detectar marcadores de infección. El riesgo de transmisión de agentes infecciosos disminuye aún más gracias al uso de técnicas de reducción de patógenos validadas durante el proceso de fabricación [17]. Cuatro etapas de eliminación de patógenos, basadas en tres mecanismos diferentes, garantizan un nivel extremadamente alto de aclaramiento de patógenos en el producto final. Las técnicas de reducción de patógenos son las mismas que las que se utilizan durante la preparación del producto de IgIV al 10% Privigen® [18]. 2.3 Producción de Hizentra® 2.3.1 Desarrollo de Hizentra En un esfuerzo por mejorar continuamente la reducción de patógenos potenciales, la estabilidad del producto y la comodidad de uso, Hizentra® es la primera IgSC de alta concentración optimizada para uso subcutáneo. Hizentra® ha demostrado ofrecer: ® • Eficacia y seguridad clínica demostradas [2]. • Riesgo mínimo de transmisión de virus y otros patógenos desde el plasma de donantes al producto final y al paciente. • Alta pureza y tolerabilidad. 12 • Comodidad de uso. • Estabilidad durante 30 meses a temperatura ambiente (≤ 25˚C). 2.3.2 Descripción del proceso de producción Gracias a las mejoras constantes en sus plantas de producción, CSL Behring garantiza la utilización de los últimos avances tecnológicos en el proceso de producción de Hizentra®. El resultado es un proceso de fabricación eficiente basado en los más altos estándares tecnológicos, de seguridad y de pureza. Las principales características de la producción de Hizentra® incluyen: • Un proceso de fabricación diseñado para ofrecer un producto de máxima calidad. • Una sofisticada combinación de las fases de purificación y “perfeccionamiento” cromatográfico. • Cuatro etapas separadas que incluyen tres procesos de fabricación diseñados para eliminar o inactivar agentes patógenos potenciales [17], los mismos procesos utilizados en la producción del producto de IgIV al 10% Privigen® [18]. • Fabricación en condiciones rigurosamente controladas (pH, temperatura, conductividad). • Fabricación en una nueva planta de última generación. Hizentra® se purifica a partir de plasma obtenido mediante plasmaféresis (plasma fuente) o a partir de sangre completa tras la separación de las células sanguíneas (plasma recuperado). La mezcla de plasmas se somete a un paso de precipitación con etanol frío (figura 2.1), que aísla y enriquece la fracción de IgG eliminando la albúmina y las globulinas α y ß [19, 20]. El posterior fraccionamiento mediante ácido octanoico, seguido de una filtración clarificante, está diseñado para eliminar los lípidos plasmáticos y la mayoría de las proteínas plasmáticas restantes (excepto la IgG); también se sabe que este paso contribuye a la seguridad frente a patógenos. Tabla 2.3 Propiedades y composición de Hizentra® [1, 16, 21-23] El tratamiento con pH bajo se lleva a cabo para la inactivación de virus, mientras que la filtración en profundidad posterior elimina algunas proteínas (p. ej. la inmunoglobulina M [IgM]), agregados proteicos y virus que pueden estar presentes [17]. La cromatografía de intercambio aniónico es un paso de “perfeccionamiento” que elimina casi toda la IgA, la IgM restante y otros contaminantes, lo que permite lograr una pureza de IgG de ≥ 98%. La filtración de virus (nanofiltración), que elimina partículas de incluso 20 nm, completa el ciclo de producción. La dia/ultrafiltración se utiliza para eliminar sustancias residuales del procesamiento y para concentrar el producto a un contenido proteico del 12%. Al agregar la L-prolina, el producto presenta una concentración del 20%. A continuación se añade el P80 para producir el producto final Hizentra®, que se envasa en viales de cristal que se cierran con tapón de goma y se sellan con un tapón de encapsulado de aleación de aluminio. 2.3.3 Control de calidad La producción de Hizentra® cumple con los más altos estándares de calidad. El control de calidad cubre todas las fases del proceso de fabricación de Hizentra®, desde la recogida de plasma al análisis completo del producto final y el seguimiento constante durante su período de validez. El producto final se evalúa para garantizar que cada lote cumpla las estrictas especificaciones del producto establecidas por las autoridades reguladoras (tabla 2.3). 13 2.4 Bibliografía 1) CSL Behring data on file: 3.2.P.2.2 Drug Product. Biologics License Application. 2) CSL Behring data on file: Clinical Study Report ZLB04_009CR. 3) Shakib F, Stanworth DR, Drew R, Catty D. A quantitative study of the distribution of IgG sub-classes in a group of normal human sera. J Immunol Methods 1975;(1-2):17-28. 4) French M. Serum IgG subclasses in normal adults. Monogr Allergy 1986;19:100-107. 5) Aucouturier P, Mounir S, Preud’homme JL. Distribution of IgG subclass levels in normal adult sera as determined by a competitive enzyme immunoassay using monoclonal antibodies. Diagn Immunol 1985;3(4):191-196. 6) Spycher MO, Kronthaler U, Dickneite G. Investigation of potential neurological effects of stabilizers used in immunoglobulin products for intravenous use: comparison of L-proline and glycine. Presented at the American College of Allergy, Asthma and Immunology, Dallas, Texas, USA; November 8-14, 2007. Abstract P224. Available at: http://www.acaai.org/NR/ rdonlyres/24A21830-DA60-4ADF-8E76182153F9A731/0/Abstracts_Posters_p2193.pdf. 7) Bolli R, Woodtli K, Bärtschi M, Höfferer L, Lerch P. L-Proline reduces IgG dimer content and enhances the stability of intravenous immunoglobulin (IVIG) solutions. Biologicals 2010;38(1):150-157. 14 8) Cramer M, Frei R, Sebald A, Mazzoletti P, Loepfe C, Maeder W. 36 months stability of a new liquid 10% polyclonal immunoglobulin product (IgPro10) stabilized with L-proline. Presented at the American College of Allergy, Asthma and Immunology, Dallas, Texas, USA; November 8-14, 2007. Abstract P96. Available at: http://www.acaai.org/NR/ rdonlyres/24A21830-DA60-4ADF-8E76182153F9A731/0/Abstracts_Posters_p2193.pdf. 9) Bolli R, Spycher MO, Brügger R, Wüst B, Gennari K. IgG-dimer formation in liquid intravenous immunoglobulin G preparations is inhibited by nicotinamide and other amphiphilic compounds. Presented at the 2nd International Congress of Autoimmunity, Tel Aviv, Israel; March 7-12, 1999. 10) Maeder W, Lieby P, Sebald A, Spycher M, Pedrussio R, Bolli R. Local tolerance and stability up to 24 months of a new 20% proline-stabilized polyclonal immunoglobulin for subcutaneous administration. Biologicals 2011; 39:43-49. 11) Vivaglobin® Package Insert, CSL Behring. 12) CSL Behring data on file: Hizentra Investigator’s brochure. 13) Centers for Disease Control and Prevention (CDC). Renal insufficiency and failure associated with immune globulin intravenous therapy – United States, 1985-1998. Morb Mortal Weekly Rep 1999;48(24):518-521. 14) Itkin YM, Trujillo TC. Intravenous immunoglobulinassociated acute renal failure: case series and literature review. Pharmacotherapy 2005;25:886892. 15) BIBRA. Toxicity profile: polysorbate 80. 1992. http://www.bibra-information.co.uk/profile-337. html; Accessed 23 June 2009. 23) CSL Behring data on file: 3.P.2.P.1 Components of the Drug Product. Biologics License Application. 16) CSL Behring data on file: 3.2.P.5.4 Batch Analyses. Biologics License Application. 17) Stucki M, Schäfer W, Hostettler T, Käsermann F, Nowak T, Sebald A, Gröner, A, Kempf C. Pathogen safety of a new 20% liquid immunoglobulin product. J Allergy Clin Immunol 2009;123:S89. (abstract 331) and poster presented at AAAAI Annual Meeting, March 1317, 2009, Washington DC. 18) Stucki M, Boschetti N, Schäfer W, Hostettler T, Käsermann F, Nowak T, Gröner, Kempf C. Investigations of prion and virus safety of a new liquid IVIG product. Biologicals 2008;36:239-247. 19) Kistler P, Nitschman H. Large scale production of human plasma fractions. Eight years experience with the alcohol fractionation procedure of Nitschmann, Kistler and Lergier. Vox Sang 1962;7:414-424. 20) Oncley JL, Melin M. The separation of the antibodies, isoagglutinins, prothrombin, plasminogen and beta1-lipoprotein into subfractions of human plasma. J Am Chem Soc 1949;71(2):541-550. 21) CSL Behring data on file: 2.3.P.2 Pharmaceutical development. Biologics License Application. 22) CSL Behring data on file: 2.3.P.1 Description and composition of the drug product. Biologics License Application 15 3 Eliminación de patógenos potenciales ●●Una selección rigurosa garantiza que se utilice únicamente plasma de donantes sanos para la producción de Hizentra®. ●●Cuatro pasos de producción basados en tres mecanismos diferentes de eliminación de patógenos potenciales garantizan la eliminación y la inactivación de patógenos importantes como el VIH, el VHB, el VHC y priones. 3.1 Introducción Eliminar la transmisión de patógenos potenciales fue uno de los objetivos más importantes en el desarrollo de Hizentra®. A pesar de que no existe ningún caso documentado de transmisión de enfermedades causado por productos con inmunoglobulinas de CSL Behring, los métodos de eliminación de patógenos se siguen mejorando constantemente utilizando los últimos avances tecnológicos y científicos. El proceso de fabricación de la inmunoglobulina subcutánea (IgSC) al 20% Hizentra® está basado en el proceso de la inmunoglobulina intravenosa (IgIV) al 10% Privigen® (excepto para la formulación y la con­centración proteica final). La eliminación de patógenos potenciales en Hizentra® se logra utilizando una combinación de tres métodos de eliminación, que han demostrado ser efectivos en la fabricación de Privigen® [1]: • Filtración de virus (nanofiltración). • Inactivación de virus en condiciones ácidas. • Partición. El paso de filtración de virus utiliza filtros capaces de eliminar patógenos de incluso 20 nm. 16 Los principales patógenos relevantes en la fabricación de productos derivados del plasma humano son los virus, principalmente los virus de la inmunodeficiencia humana (VIH-1 y VIH-2), los virus de la hepatitis A, B y C (VHA, VHB y VHC, respectivamente), el virus B19 (VB19, antes llamado parvovirus B19) y los priones. Los priones son agentes causales de encefalopatías espongiformes transmisibles (EET) neurodegenerativas, incluida la variante de la enfermedad de Creutzfeldt-Jakob (vECJ) (tabla 3.1). Hasta la fecha, nunca se ha demostrado que se hayan transmitido priones por productos de inmunoglobulinas. Tabla 3.1 Patógenos relevantes en la fabricación de productos derivados de plasma humano [1] A pesar de las medidas de precaución que CSL Behring utiliza durante la recogida de plasma, es importante diseñar procesos para inactivar y eliminar la mayor cantidad de patógenos posible, tanto los conocidos como los de nueva aparición. La seguridad frente a patógenos de Hizentra® se basa en cinco criterios (figura 3.1): • Selección meticulosa de donantes. • Cribado de las donaciones para detectar patógenos importantes. • Análisis de las mezclas de plasmas. • Inclusión de pasos en el proceso de fabricación para eliminar o inactivar los patógenos que potencialmente puedan estar presentes a pesar de los tres primeros pasos. • Cumplimiento riguroso de las normas de correcta fabricación actuales (NCFa) y medidas de garantía de calidad (QA). 3.2 Selección de donantes El plasma que se utiliza actualmente para fabricar Hizentra® proviene de donantes de EE.UU., Canadá, Alemania, Dinamarca o Suiza. El producto que se vende en cada parte del mundo está fabricado preferentemente a partir de donantes de la misma región. CSL Behring utiliza tanto plasma recuperado, que se obtiene de donaciones de sangre completa, como plasma original, que se obtiene por plasmaféresis. Los donantes se someten a una rigurosa evaluación previa a la donación. Esta evaluación incluye una exploración física y un cuestionario detallado para documentar la historia clínica y la exposición a posibles actividades de alto riesgo de cada donante. De acuerdo con los requisitos de la Directiva Europea sobre la Sangre, la Food and Drug Administration (FDA) de EE.UU. y la Organización Mundial de la Salud, los sujetos no pueden donar sangre o plasma si: Figura 3.1 El avanzado proceso de reducción de patógenos para la fabricación de Hizentra® NCFa y QA Eliminación de patógenos Análisis de las mezclas (NAT) Cribado de las donaciones Selección de donantes Paciente Riesgo relativo Población de donantes Recogida de plasma y producción de Hizentra NCFa = normas de correcta fabricación actuales; NAT = técnicas de amplificación de ácidos nucleicos; QA = garantía de calidad 17 • El donante parece estar en riesgo de padecer una enfermedad infecciosa transmitida a través de la sangre (p. ej., signos y síntomas del síndrome de inmunodeficiencia adquirida —SIDA— o del complejo relacionado con el SIDA, contacto próximo con el VHB o el VHC antes de la donación). • El donante ha podido estar expuesto a actividades de alto riesgo como prácticas sexuales no seguras o uso de drogas intravenosas. • El donante tiene un diagnóstico confirmado o sospechado de ECJ o vECJ. • El donante está en riesgo de padecer ECJ (p. ej., ha recibido sustancias derivadas de la pituitaria humana, trasplantes de córnea o trasplante de duramadre). • El donante ha podido estar expuesto a vEJD (p. ej. haber residido en el Reino Unido durante un período acumulado de 6 meses o más entre 1980 y 1996 o haber recibido una inyección de insulina bovina a partir de 1980). de minipools pueden utilizarse en los pasos de fabricación posteriores. 3.4 Análisis de las mezclas para fabricación Las mezclas para fabricación, que contienen varios miles de donaciones, se analizan de acuerdo con los requisitos de la Farmacopea Europea utilizando kits de análisis aprobados para anti-VIH-1/2, HBsAg y ARN del VHC. Además de estos requisitos reguladores, CSL Behring también analiza todas las mezclas de fabricación para detectar ARN del VIH-1 y ácido desoxirribonucleico (ADN) del VHB mediante NAT. Como medida de control de calidad, para la fabricación solo se utilizan las mezclas que no sean reactivas ante el ARN del VHC, el ADN del VHB y el ARN del VIH-1. Las mezclas para fabricación también se analizan para detectar ADN del VB19* [2]. Figura 3.2 Proceso de reducción de patógenos utilizado en la fabricación de Hizentra® [1, 3] Paso Mecanismo Precipitado A resolubilizado (o adherir II+III) 3.3 Cribado del plasma donado 3.3.1 Análisis de cada donación Todas las donaciones se analizan de acuerdo con los requisitos de la FDA y/o la Farmacopea Europea con kits de análisis aprobados para anticuerpos frente al VIH-1 y VIH-2 (anti-VIH-1/2), el antígeno de superficie del virus de la hepatitis B (HBsAg) y anticuerpos frente al VHC (anti-VHC). Solo las unidades de plasma que no sean reactivas a los análisis anteriores pueden utilizarse en los pasos de fabricación posteriores. Las unidades de plasma que den positivo se destruyen. 1 Fraccionamiento en ácido octanoico y posterior filtración de profundidad en presencia complementos filtro a pH bajo Partición 2 Incubación a pH 4 Inactivación 3 Filtración de profund. para clarificación en presencia complementos filtro a pH neutro Partición Cromatografía de intercambio aniónico 3.3.2 Análisis de minipools Además de los requisitos reguladores, se analizan como mínimo minipools de donaciones para detectar la presencia de ácido ribonucleico (ARN) del VHC, VB19 y VIH-1 utilizando técnicas de amplificación de ácidos nucleicos (NAT) [2]. Solo las unidades de plasma que pasen la selección en los análisis *Análisis del VB19 requerido para EEUU y los países de la UE. 18 4 Filtración de virus Eliminación 3.5 Eliminación de patógenos potenciales durante el proceso de fabricación Tabla 3.2 Virus modelo utilizados para los estudios de validación en el proceso de producción de Hizentra® [5, 6] Después del riguroso proceso de selección, la posibilidad de que un lote de plasma contenga un patógeno es mínima, pero no se puede excluir por completo. Por lo tanto, es crucial que todos los patógenos que puedan quedar se eliminen durante el proceso de fabricación. En la fabricación de Hizentra® se utilizan tres métodos de eliminación de patógenos, idénticos a los del proceso de producción de Privigen® (figura 3.2) [1,3]: • Inactivación de virus mediante un tratamiento a pH 4. • Filtración de virus, basada en la exclusión por tamaño (nanofiltración). • Partición por precipitación y filtración en profundidad. Estos tres métodos complementarios se centran en una amplia gama de patógenos, incluidos los virus envueltos y los no envueltos. Los priones se eliminan mediante dos mecanismos complementarios: la partición y la filtración de virus (nanofiltración) [1, 3]. 3.6 Normas de correcta fabricación y garantía de calidad El estricto cumplimiento de las NCFa y las medidas de QA garantiza que todas las medidas descritas anteriormente se aplican a cada uno de los lotes de Hizentra®. 3.7 Validación Los estudios de validación viral se realizan para evaluar el proceso de fabricación de Hizentra® en lo referente a su capacidad de eliminar o inactivar diversos virus. Estos estudios de validación viral son idénticos a los utilizados en la preparación de Privigen® [1] hasta la formulación del producto final. La validación de la capacidad de inactivación y eliminación de virus del proceso de fabricación se realiza en un laboratorio de virología, y se utiliza un modelo a escala reducida muy preciso del proceso de fabricación real [1, 3]. 3.7.1 Virus modelo La mayoría de los virus relevantes durante una transfusión no se pueden utilizar para medir la capacidad de reducción de virus del proceso de producción de Hizentra®, ya que el plasma original (y las subsiguientes fracciones que contienen inmunoglobulina G) contendrán anticuerpos contra estos virus que interfieren en la medición de la reducción de la carga viral en cada paso (p. ej., antiVHA o anti-VB19). Asimismo, algunos virus (como el VHB y el VHC) no se pueden cultivar in vitro. En consecuencia, se utilizan virus modelo [1, 3-6]. Estos virus modelo se escogen por su similitud con los contaminantes potenciales y por sus propiedades físico-químicas. El uso de una amplia variedad de virus modelo en los estudios de validación ayuda a 19 garantizar que los diferentes virus que puedan estar presentes en el plasma sean eliminados o inactivados durante el proceso de fabricación. La tabla 3.2 muestra los virus modelo utilizados para validar la eliminación de patógenos en Hizentra® [5, 6]. 3.7.2 Metodología de validación de la reducción de virus Los procesos de fabricación de Hizentra® y Privigen® son idénticos hasta la formulación del producto final. Cada paso de este proceso de fabricación compartido ha sido validado por separado en un laboratorio de virología [1]. El material inicial se obtiene directamente de la planta de fabricación y se “inocula” con una cantidad conocida de virus modelo [1]; posteriormente, se mide la capacidad de eliminación de virus de este paso. A continuación, los resultados de cada paso se combinan para obtener el factor de reducción general del proceso. Los resultados de los estudios de validación viral se notifican como reducciones de “x log10”. El valor x se calcula comparando la concentración de virus en el material inicial con la concentración de virus en el material después del paso de eliminación de virus. El log10 del cociente entre estas concentraciones es una forma conveniente de expresar la reducción de la carga viral. Cada incremento de una unidad corresponde a una reducción en 10 veces de la carga. Por tanto, un factor de reducción de log10 (LRF) de 5 significa que el número de virus que quedan tras el proceso se ha reducido 100.000 veces (105veces). Un LRF ≥ 4 se considera un indicador de un efecto de aclaramiento [7]. 3.8 Eliminación de virus en cada paso de fabricación 3.8.1 Inactivación viral El tratamiento a pH 4 representa un paso exclusivo de inactivación viral, que destruye los virus al dañar de manera irreparable sus capas lipídicas 20 y sus revestimientos proteicos. Sus dianas son principalmente los virus con envoltura lipídica, como el VIH-1, el VIH-2, el VHB y el VHC [4]. Asimismo, algunos estudios han demostrado que el VB19 no envuelto también se inactiva por tratamiento a pH 4 (LRF > 5) [6, 8]. Se ha determinado la cinética de la inactivación asociada con el tratamiento a pH 4 para diversos virus modelo. Los virus modelo para VIH, VHC y grandes virus de ADN complejos se inactivan satisfactoriamente, lo que produce LRF de 4,6 a ≥ 7,8, según el virus analizado (tabla 3.3) [6]. 3.8.2 Filtración de virus (nanofiltración) El paso de filtración de virus utiliza un filtro para eliminar patógenos de un tamaño incluso tan pequeño como 20 nm. Este proceso de filtración de virus elimina partículas que superen un determinado tamaño y es en gran medida independiente de otras propiedades físico-químicas de estas partículas. De este modo, el filtro en cuestión elimina virus envueltos (p. ej. VIH-1, VIH-2 y VHC) y virus no envueltos (p. ej., VHA, parvovirus y virus de la poliomielitis). La filtración de virus es un proceso pasivo y, por tanto, tiene poco o ningún efecto sobre los anticuerpos de IgG. La filtración de virus en el proceso de fabricación de Hizentra® ha demostrado ser muy eficaz, y produce la completa eliminación de todos los virus modelo por debajo del límite de detección (tabla 3.3) [6]. En particular, el MVM, un parvovirus perteneciente a los virus más pequeños conocidos (18-24 nm), es completamente eliminado [6]. 3.8.3 Partición El tercer mecanismo de eliminación de patógenos es la partición, que se basa en la separación físicoquímica de los compuestos. Algunas de las técnicas más importantes en la fabricación de productos biológicos que son ejemplos de mecanismos de partición incluyen la precipitación y la subsiguiente Tabla 3.3 Resumen de los resultados de la reducción de virus en Hizentra® (media de los LRF) [3, 6]* ≥ 5,4≥ 5,94,6≥ 7,8 n.e. n.e. ≥ 9,9≥ 12,6≥ 8,1≥ 10,4 4,2 2,2 ≥ 4,6≥ 5,5≥ 5,4≥ 5,9 ≥ 5,4 ≥ 5,5 ≥ 19,9≥ 24,0≥ 18,1≥ 24,1 ≥ 9,6 ≥ 7,7 separación de fases, adsorción a una fase sólida, filtración de profundidad y cromatografía. El proceso de fabricación de Hizentra® incluye los mismos dos pasos de partición que el proceso de fabricación de Privigen® [1], es decir, fraccionamiento en ácido octanoico y la subsiguiente filtración de profundidad, así como una filtración en presencia de complementos a través de un filtro CH9 combinado con uno Z+ (figura 3.2), que han demostrado eliminar diferentes virus. Los LRF obtenidos por partición se detallan en la tabla 3.3 [3, 6]. El Z+ posterior al filtro CH9 es introducido para reducir impurezas [1]. 3.9 Estudios sobre eliminación de priones Los procesos de fabricación de Hizentra® y Privigen® son idénticos hasta la formulación del producto final. El potencial del proceso de fabricación compartido para eliminar agentes causantes de EET ha sido analizado con diferentes técnicas, que incluyen bioensayos en hámsters, análisis por inmunotransferencia de Western e inmunoensayos dependientes de la conformación (CDI) [1]. Los estudios se han realizado utilizando métodos a escala de laboratorio para los siguientes pasos del proceso de fabricación [1]: • Fraccionamiento en ácido octanoico y posterior filtración de profundidad en la presencia de complementos de filtro (paso 1). • Filtración de profundidad con CH9 en presencia de complementos de filtro combinados con una posterior filtración por Z+ (paso 2). • Filtración de virus (nanofiltración) (paso 3). Se desconoce el estado físico de las formas patógenas de las proteínas priónicas (PrPSc) en sangre o plasma humanos procedentes de animales de laboratorio infectados deliberadamente. Por tanto, se utilizaron diversos preparados inoculados en diferentes experimentos. Se utilizó un agente Scrapie adaptado a hámster 263K en forma de 21 Tabla 3.4 Resumen de los resultados de la reducción de priones (media de los LRF) [1] homogeneizado de cerebro para los experimentos de inoculación en bioensayo. Las concentraciones de infectividad se midieron mediante la dilución final de fracciones inoculadas intracerebralmente en hámsters dorados [1]. Las mismas muestras también se analizaron mediante inmunotransferencia de Western para comparar ambos métodos. Se realizaron experimentos utilizando CDI como sistema de detección con priones asociados a membrana en la forma de microsomas y PrPSc purificada, una forma no asociada a membrana de infectividad priónica, preparada a partir de agente Scrapie adaptado a hámster 263K en forma de homogeneizado de cerebro no tratado con proteinasa. Los datos demostraron una eliminación sustancial del agente infeccioso por el proceso de fabricación en todos los sistemas modelo [1]. Los resultados de los estudios de infectividad en hámster, que mostraron LRF ≥ 9,0 log10 para la partición y ≥ 5,8 log10 para la filtración de virus, fueron confirmados por los resultados del análisis por inmunotransferencia de Western. Además, se obtuvieron resultados casi idénticos en estudios independientes utilizando CDI para detectar proteína 22 priónica aberrante. Por tanto, los datos obtenidos con los tres preparados de inoculación diferentes proporcionaron una mayor confianza en los factores de reducción obtenidos (tabla 3.4) [1]. Estos datos proporcionan la certeza de que, teóricamente, se eliminarán los posibles niveles de infectividad del agente de la vECJ que puedan estar presentes en el material inicial utilizado para la fabricación de Hizentra®. Además, los requisitos reguladores predominantes exigen la retirada de productos que contengan contribuciones de donantes con vECJ, así como procedimientos de limpieza validados para el equipo de fabricación, higie­n ización del equipo con NaOH o NaClO alcalino [1]. Resumen de los pasos de eliminación de patógenos potenciales 3) Stucki M, Schäfer W, Hostettler T, Käsermann F, Nowak T, Sebald A, Gröner A, Kempf C. Pathogen safety of a new 20% liquid immunoglobulin product. J Allergy Clin Immunol 2009;123:S89 (abstract 331) and poster presented at AAAAI Annual Meeting, March 1317, 2009, Washington DC. 4) Kempf C, Morgenthaler JJ, Rentsch M, Omar A. Viral safety and manufacturing of an intravenous immunoglobulin. In: Kazatchkine MD, Morell A (eds). Intravenous Immunoglobulin Research and Therapy. New York; NY: Informa Health Care, 1996, pp 11-18. 5) CSL Behring data on file: 2.3.A.2 Adventitious agents safety evaluation. Biologics License Application. 6) CSL Behring data on file: Hizentra® Prescribing information (US package insert, March 2010). 7) Committee for Proprietary Medicinal Products (CPMP). Note for guidance on virus validation studies: the design, contribution and interpretation of studies validating the inactivation and removal of viruses. CPMP/BWP/268/95. Issued 14 February 1996. 8) Boschetti N, Niederhauser I, Kempf C, Stühler A, Löwer J, Blümel J. Different susceptibility of B19 virus and mice minute virus to low pH treatment. Transfusion 2004;44:1079-1086. 3.10 Bibliografía 1) Stucki M, Boschetti N, Schäfer W, Hostettler T, Käsermann F, Nowak T, Gröner A, Kempf C. Investigations of prion and virus safety of a new liquid IVIG product. Biologicals 2008;36:239-247. 2) CSL Behring data on file: 2.3.S.2 Manufacture. Biologics License Application. 23 4 Inmunodeficiencias primarias y secundarias ●●Las inmunodeficiencias primarias (IDP) incluyen un enorme grupo de trastornos genéticos que tienen como resultado una mayor susceptibilidad a las infecciones. ●●Las inmunodeficiencias secundarias (IDS) son más comunes que las IDP y están causadas por otras enfermedades o factores ambientales. ●●Las IDP son de por vida, y sus complicaciones pueden ser discapacitantes. ●●El tratamiento con inmunoglobulina subcutánea (IgSC) tiene cada vez más aceptación, tanto entre pacientes como entre médicos, como terapia sustitutiva con inmunoglobulinas adecuada para pacientes con IDP e IDS. ●●El tratamiento con IgSC autoadministrado es, por lo general, bien tolerado y puede ofrecer más comodidad a los pacientes. 4.1 Inmunodeficiencias primarias 4.2 Epidemiología de las IDP Las inmunodeficiencias primarias (IDP) son trastornos graves crónicos que afectan a pacientes de formas muy diversas y que pueden llegar a ser discapacitantes. Existen más de 150 IDP, muchas de las cuales suelen aparecer en los primeros años de vida acompañadas por signos clínicos distintivos, como la incapacidad de los pacientes para desarrollar una respuesta inmunitaria lo suficientemente protectora (tablas 4.1, 4.2) [1]. Los problemas relacionados con la salud suelen ser de por vida [2] y pueden ser mortales si no se tratan [1]. 4.2.1 Incidencia y prevalencia de las IDP Las IDP son relativamente raras y su incidencia varía considerablemente entre los diversos tipos. Sin embargo, se desconocen la incidencia y la prevalencia reales de las IDP, ya que actualmente (junio de 2010) no se lleva a cabo un cribado de la población para detectar estos trastornos. Con el fin de poder determinar la información epidemiológica, diversos centros de Europa, Irán, Egipto y Rusia especializados en IDP están colaborando para documentar sus pacientes en la base de datos de la Sociedad Europea para las Inmunodeficiencias (ESID) [3], que actualmente incluye a más de 11.000 pacientes [4]. La información sobre los pacientes con 24 Figura 4.1 Distribución de las IDP registradas en la base de datos de la Sociedad Europea para las Inmunodeficiencias (ESID) [5] Predominantemente trastornos de anticuerpos Predominantemente deficiencias de linfocitos T Trastornos fagocíticos Deficiencias del complemento Otras IDP bien definidas Síndromes desreguladores autoinmunes e inmunes Síndromes autoinflamatorios Inmunodeficiencias no clasificadas IDP es introducida en la base de datos por los 68 centros de documentación registrados [4]. Gracias al actual registro de pacientes con IDP, la base de datos ofrecerá nueva información acerca de la prevalencia de las IDP en cada país. Por ejemplo, en Francia, la estimación mínima de prevalencia según la ESID es de 3,72 pacientes con IDP por cada 100.000 habitantes [5]. Se ha iniciado un registro telefónico similar para pacientes con IDP en Estados Unidos (EE.UU.). La Red de Inmunodeficiencias de Estados Unidos (USIDNET) está recopilando datos de pacientes con enfermedad granulomatosa crónica (EGC), inmunodeficiencia común variable (IDCV), síndrome de DiGeorge, síndrome de la hiperinmunoglobulina M (IgM), defecto de la adhesión de leucocitos, inmunodeficiencia combinada grave (IDCG), síndrome de Wiskott-Aldrich (SWA) y agammaglobulinemia ligada al cromosoma X (ALX) [6]. Una encuesta reciente realizada en una muestra aleatoria a nivel nacional en EE.UU. se puso en contacto con 10.000 hogares por marcación aleatoria de números y preguntó a casi 27.000 miembros de estos hogares para saber cuántos habían sido diagnosticados con una IDP. La tasa de prevalencia de IDP calculada fue de 1 en 1.200 para todas las personas, lo que equivale a una estimación de población de entre 150.000 y 360.000 personas en EE.UU. con un diagnóstico de IDP. Esto sugiere que los diagnósticos de IDP en EE.UU. puede ser más común de lo que se indica en la literatura [7]. La diferencia entre las estimaciones de prevalencia según la ESID y la encuesta de la muestra aleatoria se puede explicar por los diferentes métodos de recopilación de datos. La Unión Internacional de Sociedades de Inmunología reconoce más de 150 enfermedades de IDP [8], el 70% de las cuales son deficiencias de anticuerpos (linfocitos B; p. ej., la ALX, la IDCV o la deficiencia de inmunoglobulina A [IgA]) [9]. En la base de datos de la ESID, el 54,8% de los pacientes han sido diagnosticados principalmente con trastornos de anticuerpos (figura 4.1), de los cuales el más frecuente es la IDCV (20,7%) [5]. El diagnóstico notificado con más frecuencia por los pacientes con IDP en la encuesta de prevalencia en la población de EE.UU. fue también la IDCV (35%) [7]. El sexo de los pacientes con IDP es, por lo general, similar entre la base de datos de la ESID (hombres, 61% y mujeres, 39%) [5] y el estudio de prevalencia de EE.UU. (hombres, 56% y mujeres, 44%) [7]. Aproximadamente el 80% de los casos de IDP se diagnostican en niños y adultos jóvenes antes de los 20 años de edad [1]; especialmente en los 25 adultos, las IDP pueden estar infradiagnosticadas. Existe un amplio intervalo de frecuencias entre los diversos síndromes de inmunodeficiencia. Las inmunodeficiencias raras, como la IDCG, se dan en aproximadamente 1 de cada 500.000 nacimientos. Debido a su gravedad, la IDCG se diagnostica cuando los pacientes son muy jóvenes [10]. Por otro lado, la deficiencia selectiva de IgA es difícil de diagnosticar, ya que la mayoría de los pacientes no presentan síntomas. Las tasas de frecuencia estimadas de esta enfermedad van de 1 de cada 600 a 1 de cada 18.500, según la etnia; la incidencia más elevada se observa en las personas de origen europeo [11]. Figura 4.2 Herencia recesiva ligada al cromosoma X (RLX) de las IDP [12] XY A En la herencia AR de las IDP, se hereda un gen defectuoso de cada uno de los padres. Los trastornos de herencia AR afectan a hombres y a mujeres con la misma frecuencia y es consecuencia 26 XX O N A X Y XX N O XX N A Esperm N O X X YX N O Hombres normales Madre portadora Padre no afectado XX N N Óvulos X X N Mujer portadora N O Esperma A XX XY N YX Mujeres portadoras A A N Óvulos Esperma A 4.2.2 Genética de las IDP La mayoría de las IDP están causadas por uno de los siguientes dos modos de herencia: recesiva ligada al cromosoma X (RLX) o autosómica recesiva (AR) (figura 4.2). En condiciones de herencia RLX, son evidentes los antecedentes familiares en el linaje masculino. Los hombres solo tienen un cromosoma X, y si este es anómalo, padecerán la misma enfermedad [12]. Las mujeres tienen menos probabilidades de padecer enfermedades RLX que los hombres, ya que tienen dos cromosomas X; solo padecerán enfermedades RLX si el padre padece la enfermedad y la madre le transmite un cromosoma X anómalo. Si una mujer recibe un cromosoma X anómalo del padre y un cromosoma X normal de la madre, será portadora. Los portadores tienen un 50% de posibilidades de transmitir el cromosoma X afectado a su descendencia. Algunas IDP de herencia RLX son la ALX, el SWA, un trastorno de IDCG y una forma de EGC [12]. Madre no afectada Padre afectado XY A N N O Hombre afectado X XX N Mujer normal Y N O XY N O Hombre normal A: anómalo; N: normal; O: ordinario de que los dos padres son, al menos, portadores (figura 4.3). Algunas IDP de herencia AR incluyen varios tipos de IDCG y trastornos de EGC [12]. Figura 4.3 Herencia autosómica recesiva de las IDP [12] Madre portadora I D C G ma Padre portador I D C G N Óvulos Esperma I D C G I D C G N I D C G Hijo afectado N I D C G N Hijo portador I D C G N N I D C G Hijo portador N N Hijo normal N: normal; IDCG: inmunodeficiencia combinada grave Algunas IDP tienen más de un patrón hereditario. Por ejemplo, la IDCV se puede heredar de forma AR, ligada al cromosoma X o de forma autosómica dominante (en la que un niño tiene un 50% de posibilidades de heredar el gen defectuoso si uno de los padres padece la enfermedad). Sin embargo, la mayoría de los casos de IDCV ocurren de forma esporádica, lo que significa que pueden ser el resultado de interacciones entre varios factores genéticos y/o ambientales [10]. células presentadoras de antígeno. La respuesta inflamatoria y la destrucción de los patógenos extracelulares reciben la ayuda de las proteínas del complemento. Después de la respuesta inicial, el cuerpo se adapta al patógeno mediante respuestas celulares y humorales (inmunidad adquirida). La inmunidad celular (linfocitos T) es importante para la prevención de las infecciones intracelulares, incluidas las de virus, parásitos y micobacterias que viven dentro de células huésped y no pueden ser controlados por los linfocitos B. La respuesta humoral (linfocitos B) incluye la producción de anticuerpos para ayudar a controlar a los patógenos que circulan en los espacios extracelulares (patógenos extracelulares) [13, 14]. Durante la respuesta humoral primaria, se producen inmunoglobulinas M y D. A continuación, los genes de las Ig de los linfocitos B se reorganizan a medida que progresa la respuesta inmunitaria, lo que resulta en la producción de IgG, IgA e IgE, esenciales para desarrollar resistencia ante las infecciones bacterianas [1]. Como se muestra en la tabla 4.1, los patrones de la susceptibilidad Tabla 4.1 Clasificación de los trastornos de IDP [1, 9] 4.3 Fisiopatología de las IDP El sistema inmunitario es un complejo entramado de componentes cuyas funciones individuales son dependientes las unas de las otras. Entre los principales componentes del sistema inmunitario se incluyen los linfocitos B, los linfocitos T, el complemento y los fagocitos. La respuesta inmunitaria innata inicial ante patógenos extraños no es específica y comprende a las células fagocíticas, linfocitos citolíticos naturales, y a las 27 Tabla 4.2 Características típicas y presentación de los diferentes tipos de IDP [13, 16] a patógenos varían según el déficit inmunitario específico [1]. Los defectos combinados de linfocitos B y T (p. ej., IDCG, SWA) se caracterizan por anomalías tanto en la respuesta inmunitaria humoral como celular, y las infecciones asociadas pueden estar causadas tanto por patógenos intracelulares como extracelulares [1]. 4.4 Presentación clínica de las IDP La presentación clínica de las IDP varía según el componente inmunitario disfuncional. La mayoría de los pacientes con un síndrome de inmunodeficiencia presentarán infecciones recurrentes o persistentes. Los pacientes con deficiencias de linfocitos B suelen presentar infecciones bacterianas, mientras que los pacientes con deficiencias combinadas de linfocitos T y B también presentarán infecciones víricas o fúngicas [15, 16]. Otros síntomas pueden ser falta de crecimiento, afectación gastrointestinal, trastornos autoinmunes y discrasias sanguíneas. La tabla 4.2 destaca las características típicas de cada tipo [13, 16]. 28 4.5 Diagnóstico de las IDP En Europa, se ha desarrollado una lista de 12 signos de alarma de posibles inmunodeficiencias congénitas. Estos signos de alarma son los siguientes [17]: 1. Antecedentes familiares de inmunodeficiencia congénita. 2. Ocho o más episodios de otitis purulenta en un año. 3. Dos o más episodios de sinusitis grave en un año. 4. Dos o más episodios de neumonía en un año. 5. Dos o más meses con antibióticos sin ningún efecto. 6. Complicaciones tras la vacunación con vacunas de virus vivos (especialmente el bacilo de Calmette-Guérin [BCG] y la vacuna antipoliomielítica de Sabin). 7. Falta de crecimiento en las primeras etapas de la infancia, con o sin diarrea crónica. 8. Abscesos cutáneos profundos u orgánicos recurrentes. 9. Dos o más infecciones viscerales (meningitis, osteomielitis, artritis séptica, enfisema, sepsis). 10. Infección por cándidas persistente en la piel o en la mucosa después del primer año de vida. 11. Enfermedad del injerto contra el huésped (p. ej., eritema de origen desconocido). 12. Infecciones sistémicas recurrentes con micobacteria atípica. 7. Aftas bucales persistentes o infección cutánea fúngica. 8. Necesidad de antibióticos intravenosos para eliminar las infecciones. 9. Dos o más infecciones muy arraigadas, incluida la septicemia. 10. Antecedentes familiares de inmunodeficiencia primaria. Además, la ESID ha desarrollado una lista de signos de alarma para las IDP en los adultos [18]: 1. Cuatro o más infecciones que requieren antibióticos en un año (otitis, bronquitis, sinusitis, neumonía). 2. Infecciones recurrentes o infección que requiere un tratamiento prolongado con antibióticos. 3. Dos o más infecciones bacterianas graves (osteomielitis, meningitis, septicemia, celulitis). 4. Dos o más ataques de neumonía confirmados radiológicamente en 3 años. 5. Infección de localización inusual o por un patógeno inusual. 6. IDP en la familia. Además de evaluar la edad de aparición y los tipos de infecciones, el diagnóstico del síndrome de IDP incluye la obtención de una historia familiar, una exploración física, un hemograma completo con recuento diferencial, los niveles cuantitativos de inmunoglobulinas (IgG, IgM e IgA), la respuesta específica de los anticuerpos a las vacunas, el análisis de subclase de IgG y un análisis del complemento [16]. De forma similar, en EE.UU. la Jeffrey Modell Foundation (un grupo de apoyo a pacientes) ha desarrollado una lista de 10 signos de alarma para las IDP. Los pacientes que experimenten dos o más de estos signos deben consultar a su médico para que los evalúe [19]. Estos signos de alarma son los siguientes: 1. Cuatro o más infecciones de oído en un año. 2. Dos o más infecciones sinusales graves en un año. 3. Dos o más meses con tratamiento antibiótico con poco efecto. 4. Dos o más ataques de neumonía en un año. 5. Ausencia de ganancia de peso o crecimiento normal en un bebé. 6. Abscesos cutáneos profundos u orgánicos recurrentes. 4.6 Impacto socioeconómico La IDP tiene un considerable impacto socioeconómico. Los síndromes no tratados o tratados de forma inadecuada pueden tener como resultado hospitalizaciones debido a infecciones, días de baja en el trabajo o en la escuela y cansancio emocional [2]. Una investigación sueca en la que se utilizó el perfil de impacto de la enfermedad (PIE) (figura 4.4) mostró un estado funcional significativamente peor (p < 0,05 a p < 0,0001) entre los pacientes con agammaglobulinemia no tratados en comparación con una población de referencia [20]. Esta investigación mostró que los pacientes con inmunodeficiencia por hipogammaglobulinemia tenían el mismo estado funcional que los pacientes con otros trastornos crónicos, como la insuficiencia renal y los trastornos reumatoides [20]. El impacto económico de la IDP es difícil de cuantificar dada la complejidad de esta enfermedad. El tratamiento de infecciones repetidas —incluidas las hospitalizaciones; las terapias antimicrobianas 29 Figura 4.4 Estado funcional de pacientes con agammaglobulinemia no tratados en comparación con una población de referencia [20] 30 Puntuación del PIE Pacientes con agammaglobulinemia Población de referencia 20 10 0 Deambulación Movilidad Conducta emocional Interacción social Sueño/descanso Gestión del hogar Trabajo Ocio Una puntuación del PIE más alta indica un peor estado funcional selectivas; el diagnóstico, tratamiento y el manejo de las complicaciones como los trastornos autoinmunes; el manejo del tratamiento de los acontecimientos adversos; y los costes asociados con el tratamiento adicional— contribuye a los gastos globales. También debe considerarse el coste de las diferentes opciones de tratamiento [21, 22]. EE.UU., es el segundo cáncer hematológico más común y representa aproximadamente el 1% de todos los cánceres [26], con unos 100.000 pacientes recibiendo tratamiento al mismo tiempo [25]. La enfermedad tiene un mal pronóstico, con una supervivencia a los cinco años de aproximadamente el 35% [23]. 4.7 Inmunodeficiencias secundarias La enfermedad tiene un curso crónico y recurrente [24] y se caracteriza por la proliferación de células plasmáticas malignas en la médula ósea, lo que provoca una sobreproducción de la inmunoglobulina monoclonal intacta. El crecimiento anómalo de células sanas formadoras de sangre provoca fatiga, debilidad y cefaleas. Debido a que la producción de inmunoglobulinas policlonales normales se ve notablemente disminuida, existe una mayor susceptibilidad a las infecciones, lo que puede ser potencialmente mortal, especialmente cuando el paciente está recibiendo quimioterapia y, por lo tanto, su sistema inmunitario está debilitado [27]. La terapia sustitutiva con inmunoglobulinas ayuda a reducir la frecuencia de las infecciones. Las inmunodeficiencias secundarias (IDS) son más comunes que las variantes primarias. Las IDS no están causadas por defectos genéticos, sino que son consecuencia de otras enfermedades o el resultado de factores ambientales. Algunos ejemplos de enfermedades que cursan frecuentemente con IDS son el mieloma múltiple y la leucemia linfocítica crónica. 4.7.1 Mieloma múltiple En Europa, el mieloma múltiple (MM) es el cáncer de médula ósea más frecuente. Afecta a 77.000 pacientes y su incidencia va en aumento [23]. La mayoría de los pacientes tienen entre los 60 y los 80 años cuando aparece la enfermedad [24, 25]. En 30 4.7.2 Leucemia linfocítica crónica La leucemia linfocítica crónica (LLC) es el tipo de leucemia más común en el mundo occidental y la mediana de edad de aparición es entre los 65 y los 70 años [28]; en EE.UU., la mediana de edad de aparición se estima a los 72 años [29]. La incidencia global es de aproximadamente 3 por cada 100.000 al año [28]. En EE.UU., la incidencia es de 5,6 por cada 100.000 al año [29]. Esta enfermedad está causada por la proliferación clonal neoplásica de linfocitos B que se acumulan en la médula ósea y en la sangre. La mayoría de los pacientes (70-80%) son diagnosticados a causa de un resultado inesperado de un hemograma de rutina. El diagnóstico de LLC se basa en una combinación de linfocitosis, una morfología linfocítica característica y el inmunofenotipo. Los linfocitos que coexpresan marcadores de superficie celular característicos, CD5 y CD23, pueden ayudar a confirmar el diagnóstico de LLC [28]. Las complicaciones causadas por infecciones son comunes en los pacientes con LLC, con una incidencia de 0,26-0,47 por paciente-año [28]. Los factores de riesgo para la infección incluyen edad avanzada, número de tratamientos previos y tratamiento en curso. Además, del 20 al 70% de los pacientes con LLC desarrollan hipogammaglobulinemia secundaria a medida que la enfermedad progresa, empeorando por tanto su estado inmunodeficiente. La mayoría de las infecciones son bacterianas (neumococo, Haemophilus influenzae y estafilococo), pero las infecciones fúngicas, víricas y oportunistas son cada vez más prevalentes. Las complicaciones causadas por infecciones representan el 50% de todas las muertes relacionadas con la LLC [28]. una revisión sistemática y en un metaanálisis [30]. Las variables primarias fueron la mortalidad por cualquier causa y las infecciones graves. Una variable secundaria fueron las infecciones documentadas clínicamente. De los nueve ensayos controlados y aleatorizados incluidos en la revisión sistemática, cinco proporcionaron información útil para el metaanálisis. A pesar de que no se demostró un beneficio en la supervivencia en los dos ensayos que compararon las IgIV con el control, tres ensayos notificaron una reducción significativa de las infecciones graves (riesgo relativo [RR] = 0,45; IC del 95%: 0,27-0,75) y las infecciones documentadas clínicamente (RR = 0,49; IC del 95%: 0,39-0,61). Según el metaanálisis de los datos de este reducido número de estudios, se concluyó que las IgIV podían ser recomendadas de manera individual para el tratamiento del MM o la LLC, pero no como uso rutinario. Uno de los estudios incluidos en el metaanálisis fue un estudio doble ciego y controlado con placebo en pacientes con mieloma múltiple, y que demostró una reducción significativa de la sepsis y la neumonía (p = 0,002) [31]. Los resultados están respaldados por los hallazgos de otros estudios clínicos [32-34]. Otro estudio incluido en el metaanálisis fue un estudio aleatorizado, doble ciego y controlado con placebo que evaluó el beneficio de la terapia sustitutiva con IgIV en pacientes con LLC [35]. La IgIV redujo significativamente el número de infecciones bacterianas (p = 0,01) y el tiempo hasta la primera aparición de una infección bacteriana grave en comparación con el grupo de control (p = 0,026). Estos resultados fueron confirmados en estudios posteriores de la administración de IgIV dentro de este intervalo de dosis [36]. 4.7.3 Experiencia con IgIV en las IDS Recientemente, se ha evaluado el papel de la profilaxis con IgIV en el mieloma múltiple y la LLC en 31 Figura 4.5 Todos los usos de IgIV en comparación con los de IgSC en países europeos, según la base de datos de la ESID [5] Alemania (336) Suiza (16) Reino Unido (505) Bélgica (53) Francia (1022) Grecia (38) Irlanda (36) República Checa (34) Polonia (86) Italia (452) Turquía (156) Rusia (51) 0% 10% IgIV 20% 30% 40% 50% 60% 70% 80% 90% 100% IgSC El número total de pacientes documentados que recibieron sustitución de Ig en cada país se indica entre paréntesis. 4.8 Experiencia con el tratamiento con IgSC en IDP e IDS El principal objetivo del tratamiento de los pacientes con IDP e IDS es reducir la frecuencia y la gravedad de las infecciones [2], y el inicio precoz del tratamiento es esencial para evitar el daño de los órganos diana [37]. La terapia sustitutiva con IgG se recomienda en todos los pacientes con una mayor susceptibilidad a la infección y con niveles disminuidos de IgG o defectos en la producción de anticuerpos, independientemente de si la función de los linfocitos T es normal o no [38]. Las preparaciones de inmunoglobulina intravenosa se han utilizado ampliamente para tratar a pacientes con trastornos de los linfocitos B y T y con defectos combinados de linfocitos T y B [38]. No obstante, las infusiones de IgIV requieren la supervisión por parte de personal médico cualificado y normalmente se 32 administran en las instalaciones sanitarias. Además, las infusiones de IgIV requieren más tiempo para completarse, una media de 3,5 horas [3] frente a las 1-2 horas necesarias para la IgSC [39], y los pacientes deben recibir infusiones IV siguiendo un programa regular. Para los pacientes con IDP e IDS que prefieren llevar una vida que no tenga que planificarse en torno a su tratamiento, el tratamiento con inmunoglobulina subcutánea (IgSC) puede proporcionarles una alternativa al tratamiento con IgIV más cómoda. Sin embargo, su éxito depende del cumplimiento por parte del paciente. Las terapias con IgSC se han hecho populares, particularmente en Escandinavia [2, 40, 41], y el uso de la IgSC en Europa varía ahora de una estimación del 2% en Italia a aproximadamente el 54% en Alemania (figura 4.5) [5] y más del 90% en los países escandinavos. Las terapias con IgSC presentan varias ventajas respecto a la terapia con IgIV: No se requiere acceso venoso: en algunos pacientes, particularmente en niños y bebés, el acceso venoso es difícil, por lo que la administración subcutánea de la terapia con Ig evita las múltiples venopunciones necesarias para la terapia con IgIV [42]. Autoadministración en un lugar cómodo: el tratamiento con IgSC puede administrarse en un lugar que sea cómodo para el paciente (p. ej., en casa). Esto evita las múltiples visitas al hospital requeridas por la terapia con IgIV y tiene como resultado una mayor comodidad, más independencia y menos ausencias en el trabajo [43]. El método para la administración subcutánea es fácil de aprender y llevar a cabo [40, 44], incluso para pacientes mayores [40], y permite que la autoadministración y la administración a niños pequeños por parte de sus padres o cuidadores sea cómoda [44]. El tratamiento con IgSC es muy aceptable para la mayoría de los pacientes; una encuesta realizada a 152 personas con IDP (media de edad de 44 años) mostró que la terapia en casa con IgSC permitía tener una mayor independencia del personal sanitario y ofrecía una sensación de flexibilidad y libertad [41]. Sin embargo, se debe hacer especial hincapié en ofrecer apoyo a los pacientes más jóvenes, quienes pueden experimentar mayores molestias debido a las infusiones subcutáneas y tener una menor determinación para continuar con el tratamiento [41]. Además, se ha notificado que la autoadministración en casa de IgSC en niños y adultos mejora la calidad de vida relacionada con la salud, el funcionamiento social y escolar, el bienestar emocional, la vitalidad, la salud mental y la satisfacción con el tratamiento, al mismo tiempo que reduce las limitaciones en la vida familiar [2]. Reducciones potenciales en los costes sanitarios*: el coste de la autoadministración del tratamiento con IgSC es inferior que la terapia con IgIV administrada en el hospital [45]. Un análisis del impacto sobre el presupuesto en Alemania mostró que tratar al 60% de los pacientes con IDP con IgSC en vez de con IgIV permitiría ahorrar al sistema sanitario nacional de Alemania entre 17 y 77 millones de euros anualmente [46]. Menos acontecimientos adversos (AA) sistémicos: las terapias con IgSC se asocian con muy pocos acontecimientos adversos (AA) sistémicos [43, 47]. Las evaluaciones de la seguridad de la infusión rápida de IgSC en pacientes con IDP han mostrado un bajo índice de AA sistémicos, ninguno de los cuales fue grave [40, 48]. Cambiar a la IgSC puede reducir los AA, como la cefalea, la mialgia y la fatiga que sienten los pacientes que reciben IgIV [49]. Asimismo, en una encuesta realizada en 165 pacientes con IDP, un total de 33.168 infusiones de IgSC causaron 106 (< 1%) AA sistémicos, todos ellos leves o moderados [50]. La mayoría de los pacientes notifican reacciones locales en el lugar de la inyección. Estas reacciones incluyen inflamación, dolor, enrojecimiento, induración y picor [49, 51], y su gravedad va de leve a moderada [51]. La frecuencia de las reacciones suele disminuir sustancialmente durante las primeras 8-10 semanas de tratamiento [48]. Mantenimiento de concentraciones mínimas más elevadas de IgG sérica: el tratamiento con IgSC evita las concentraciones máximas elevadas y las concentraciones mínimas bajas de IgG que se observan después de la infusión de IgIV [44]. Con la terapia con IgIV, se espera que los niveles séricos de Ig se disparen y luego disminuyan y “desaparezcan” en el transcurso de 3 a 4 semanas. La administración de IgSC tiene como resultado unas concentraciones séricas mínimas de IgG más altas de forma constante [40, 48, 51] y puede eliminar los efectos de *El impacto depende de los precios en cada país. 33 “desaparición” experimentados por algunos pacientes tratados con IgIV. Tradicionalmente, los pacientes recién diagnosticados con IDP reciben una dosis de carga de IgIV, y pueden cambiar al tratamiento con IgSC una vez sus niveles séricos de IgG se hayan normalizado. Más recientemente, algunos estudios han descrito el uso de terapias con IgSC en pacientes con IDCV y ALX no tratados previamente. Los datos de estos estudios sugieren que las IgSC pueden utilizarse para iniciar el tratamiento de pacientes recién diagnosticados con IDP, y este enfoque puede mejorar aún más la calidad de vida global de esta población de pacientes [43, 47]. 4.9 Progreso en las terapias con IgSC Las IgSC con una concentración de Ig del 16% se han convertido en una alternativa conveniente a la terapia estándar con IgIV. Más recientemente, los avances logrados por CSL Behring en la fabricación de inmunoglobulinas han llevado a la presentación de Hizentra®, una preparación de IgSC al 20% que se puede conservar a temperatura ambiente (≤ 25°C) durante 30 meses, en comparación con otras IgSC menos concentradas que tienen un tiempo de conservación limitado a temperatura ambiente o que se deben conservar refrigeradas. En la UE, tanto Vivaglobin® como Hizentra® están indicados como terapias sustitutivas en adultos y niños con síndromes de IDP, tales como la agammaglobulinemia y la hipogammaglobulinemia congénitas; la inmunodeficiencia común variable; la inmunodeficiencia combinada grave; y las deficiencias de subclases de IgG con infecciones recurrentes, así como terapia sustitutiva en el mieloma o la leucemia linfocítica crónica con hipogammaglobulinemia secundaria grave e infecciones recurrentes [52, 53]. 34 En general, la terapia con IgSC ha demostrado ser eficaz, y la vía de administración SC es la preferida en comparación con la IV en pacientes con IDP [54]. La mayor concentración proteica en Hizentra® tiene como resultado un menor volumen de infusión y una velocidad de infusión más elevada, y es una opción que ahorra tiempo a los pacientes con IDP e IDS en comparación con otras terapias con IgIV disponibles actualmente. 4.10 Conclusiones Las IDP comprenden un gran número de trastornos genéticamente heterogéneos que afectan al sistema inmunitario adaptativo e innato. Las IDS son secundarias a otras enfermedades o provocadas por factores ambientales. Una consecuencia de las inmunodeficiencias es que los pacientes presentan una mayor susceptibilidad a la infección y a menudo requieren tratamiento de por vida para reducir la frecuencia y la gravedad de las infecciones. Las preparaciones intravenosas han sido ampliamente utilizadas para administrar IgG sustitutiva a pacientes con inmunodeficiencias. Sin embargo, las IgSC son cada vez más aceptadas por los pacientes y los médicos. Por lo general, las IgSC son bien toleradas y ofrecen varias ventajas respecto a las IgIV, incluidas una menor duración de la infusión y la libertad de administrar el tratamiento en una ubicación cómoda, lo que permite a los pacientes con enfermedades de IDP o IDS llevar una vida menos planificada en torno a su tratamiento. 4.11 Bibliografía 1) Kumar A, Teuber SS, Gershwin ME. Current perspectives on primary immunodeficiency diseases. Clin Dev Immunol 2006; 13(2-4):223259. 2) Gardulf A, Nicolay U, Math D, Asensio O, Bernatowska E, Böck A, Costa-Carvalho BT, Granert C, Haag S, Hernández D, Kiessling P, Kus J, Matamoros N, Niehues T, Schmidt S, Schulze I, Borte M. Children and adults with primary antibody deficiencies gain quality of life by subcutaneous IgG self-infusions at home. J Allergy Clin Immunol 2004;114(4):936-942. 3) Ballow M, Notarangelo L, Grimbacher B, Cunningham-Rundles C, Stein M, Helbert M, Gathmann B, Kindle G, Knight AK. Immunodeficiencies. Clin Exp Immunol 2009;158(Suppl 1):14-22. 4) European Society for Immunodeficiencies (ESID). ESID Registry: Number of patients. Available at http://www.esid.org/statistics.php. 2010. Accessed February 1, 2010. 5) Gathmann B, Grimbacher B, Beaute J, Dudolt Y, Mahlaout N, Fischer A, Knerr V, Kindle G, ESID Registry Working Party. The European internet-based patient and research database for primary immunodeficiencies: results 2006-2008. Clin Exp Immunol 2009;157(Suppl 1):3-11. 6) Primary immunodeficiency diseases registry at USIDNET. Available at http://www.usidnet.org/ pub/Registries-Info. 2009. Accessed February 1, 2010. 7) Boyle JM, Buckley RH. Population prevalence of diagnosed primary immunodeficiency diseases in the United States. J Clin Immunol 2007;27(5):497-502. 8) Geha RS, Notarangelo LD, Casanova J-L, Chapel H, Conley ME, Fischer A, Hammarström L, Nonoyama S, Ochs HD, Jennifer P, Roifman C, Seger R, Wedgwood J. The International Union of Immunological Societies (IUIS) Primary Immunodeficiency Diseases (PID) Classification Committee. J Allergy Clin Immunol 2007;120(4):776-794. 9) Champi C. Primary immunodeficiency disorders in children: prompt diagnosis can lead to lifesaving treatment. J Pediatr Health Care 2002;16(1):16-21. 10) National Institute of Child Health and Human Development. Available at http://www.nichd.nih. gov/publications/pubs/primary_immuno.cfm. 2009. Accessed February 1, 2010. 11) Selective IgA deficiency. Available at http://www. info4pi.org/aboutPI/index.cfm?section=aboutPI& content=syndromes&area=2&CFID=7126502&C FTOKEN=209223. 2009. Accessed January 1, 2010. 12) Immunodeficiency Foundation website. Available at http://www.primaryimmune.org/publications/ book_pats/e_ch15.pdf. 2009. Accessed February 1, 2010. 13) Cooper MA, Pommering TL, Koranyi K. Primary immunodeficiencies. Am Fam Physician 2003;68(10):2001-2008. 35 14) Janeway CA, Travers P, Walport MSM. The humoral response in immunobiology. In: Immunobiology. London: Garland Science, 2001. 15) Riminton DS, Limaye S. Primary immunodeficiency diseases in adulthood. Intern Med J 2004;34:348-354. 16) Bonilla FA, Geha RS. 12. Primary immunodeficiency diseases. J Allergy Clin Immunol 2003;111(2 Suppl):S571-S581. 17) Wahn V, von Bernuth H. Diagnostic approach when suspecting primary immunodeficiency (PID). LaboratoriumsMedizin 2009;33(4):179187. 18) European Society for Immunodeficiencies (ESID). 6 warning signs for PID in adults. Available at http://www.esid.org/workingparty. php?party=3&sub=2&id=175. 2010. Accessed April 19, 2010. 19) 10 warnings of primary immunodeficiency. Available at http://www.info4pi.org/index.cfm?se ction=home&CFID=35810965&CFTOKEN=5085 8829&CFID=35810965&CFTOKEN=50858829. 2009. Accessed February 1, 2010. 20) Gardulf A, Björvell H, Gustafson R, Hammarström L, Smith CI. The life situations of patients with primary antibody deficiency untreated or treated with subcutaneous gammaglobulin infusions. Clin Exp Immunol 1993;92(2):200-204. 21) National Bone Marrow Transplant Link. Resource guide for stem cell transplant - including bone marrow, peripheral blood, and cord blood. Southfield MI: National Bone Marrow Transplant Link, 2006. 36 22) Boyle ML, Schalchunes C. Impact of intervenous immunoglobulin (IVIG) treatment among patients with primary immunodeficiency diseases. Pharmaceut Policy Law 2008;10:133-146. 23) European Network of Myeloma Patient Groups. Multiple Myeloma Manifesto: Silent No More: A Call to Action on Behalf of People Living with Multiple Myeloma. Available at http://www. myeloma-euronet.org/en/manifesto/manifesto. php. 2010. Accessed March 18, 2010. 24) Smith A, Wisloff F, Samson D. Guidelines on the diagnosis and management of multiple myeloma 2005. Br J Haematol 2006;132(4):410-451. 25) Durie BGM. Patient Handbook: Multiple myeloma. Cancer of the Bone Marrow. International Myeloma Foundation, 2009:1-40. 26) National Cancer Institute. A snapshot of myeloma. Available at http://www. cancer.gov/ aboutnci/servingpeople/snapshots/myeloma.pdf. 2009. Accessed March 18, 2010. 27) Leukaemia and Lymphoma Research website. Available at http://lrf.redsnapper.net/en/1/ infdispatmul.html. 2010. Accessed February 1, 2010. 28) Oscier D, Fegan C, Hillmen P, Illidge T, Johnson S, Maguire P, Matutes E, Milligan D. Guidelines on the diagnosis and management of chronic lymphocytic leukaemia. Br J Haematol 2004;125(3):294-317. 29) Surveillance Epidemiology and End Results. SEER Stat Fact Sheets: chronic lymphocytic leukemia. Available at http://seer.cancer.gov/ statfacts/html/clyl.html. 2010. Accessed March 18, 2010. 30) Raanani P, Gafter-Gvili A, Paul M, Ben-Bassat I, Leibovici L, Shpilberg O. Immunoglobulin prophylaxis in chronic lymphocytic leukemia and multiple myeloma: systematic review and metaanalysis. Leuk Lymphoma 2009;50(5):764-772. 31) Chapel HM, Lee M, Hargreaves R, Pamphilon DH, Prentice AG. Randomised trial of intravenous immunoglobulin as prophylaxis against infection in plateau-phase multiple myeloma. The UK Group for Immunoglobulin Replacement Therapy in Multiple Myeloma. Lancet 1994;343(8905):1059-1063. 32) Musto P, Brugiatelli M, Carotenuto M. Prophylaxis against infections with intravenous immunoglobulins in multiple myeloma. Br J Haematol 1995;89(4):945-946. 33) Chapel H, Dicato M, Gamm H, Brennan V, Ries F, Bunch C, Lee M. Immunoglobulin replacement in patients with chronic lymphocytic leukaemia: a comparison of two dose regimes. Br J Haematol 1994;88(1):209-212. 34) Griffiths H, Brennan V, Lea J, Bunch C, Lee M, Chapel H. Crossover study of immunoglobulin replacement therapy in patients with low-grade B-cell tumors. Blood 1989;73(2):366-368. 35) Intravenous immunoglobulin for the prevention of infection in chronic lymphocytic leukemia. A randomized, controlled clinical trial. Cooperative Group for the Study of Immunoglobulin in Chronic Lymphocytic Leukemia. N Engl J Med 1988;319(14): 902-907. 36) Molica S, Musto P, Chiurazzi F, Specchia G, Brugiatelli M, Cicoira L, Levato D, Nobile F, Carotenuto M, Liso V, Rotoli B. Prophylaxis against infections with low-dose intravenous immunoglobulins (IVIG) in chronic lymphocytic leukemia. Results of a crossover study. Haematologica 1996;81(2):121-126. 37) Lederman HM. The clinical presentation of primary immunodeficiency diseases. Clinical Focus on Primary Immune Deficiencies 2000;2(1):1-6. 38) Schiff RI. Intravenous gammaglobulin: pharmacology, clinical uses and mechanisms of action. Pediatr Allergy Immunol 1994;5(2):63-87. 39) CSL Behring. IgPro20 Immune Globulin Subcutaneous (Human), 20% Liquid US Package Insert. 2009. 40) Gardulf A, Hammarström L, Smith CIE. Home treatment of hypogammaglobulinaemia with subcutaneous gammaglobulin by rapid infusion. Lancet 1991;338(8760):162-166. 41) Gardulf A, Björvell H, Andersen V, Björkander J, Ericson D, Frøland SS, Gustafson R, Hammarström L, Nyström T, Søeberg B. Lifelong treatment with gammaglobulin for primary antibody deficiencies: the patients’ experiences of subcutaneous self-infusions and home therapy. J Adv Nurs 1995;21(5):917-927. 42) Gaspar J, Gerritsen B, Jones A. Immunoglobulin replacement treatment by rapid subcutaneous infusion. Arch Dis Child 1998;79(1):48-51. 37 43) Gardulf A. Immunoglobulin treatment for primary antibody deficiencies: advantages of the subcutaneous route. Biodrugs 2007;21(2):105116. 44) Berger M. Subcutaneous immunoglobulin replacement in primary immunodeficiencies. Clin Immunol 2004;112(1):1-7. 45) Simoens S. Pharmacoeconomics of immunoglobulins in primary immunodeficiency. Expert Rev Pharmacoecon Outcomes Res 2009;9(4):375-386. 46) Hogy B, Keinecke HO, Borte M. Pharmacoeconomic evaluation of immunoglobulin treatment in patients with antibody deficiencies from the perspective of the German statutory health insurance. Eur J Health Econ 2005;6(1):24-29. 47) Misbah S, Sturzenegger MH, Borte M, Shapiro RS, Wasserman RL, Berger M, Ochs HD. Subcutaneous immunoglobulin: opportunities and outlook. Clin Exp Immunol 2009;158(Suppl 1):51-59. 48) Gardulf A, Nicolay U, Asensio O, Bernatowska E, Böck A, Carvalho BC, Granert C, Haag S, Hernández D, Kiessling P, Kus J, Pons J, Niehues T, Schmidt S, Schulze I, Borte M. Rapid subcutaneous IgG replacement therapy is effective and safe in children and adults with primary immunodeficiencies – a prospective, multi-national study. J Clin Immunol 2006;26(2): 177-185. 49) Radinsky S, Bonagura VR. Subcutaneous immunoglobulin infusion as an alternative to intravenous immunoglobulin. J Allergy Clin Immunol 2003;112(3):630-633. 38 50) Gardulf A, Andersen V, Björkander J, Ericson D, Frøland SS, Gustafson R, Hammarström L, Jacobsen MB, Jonsson E, Moeller G, Nyström J, Søeberg B, Smith CIE. Subcutaneous immunoglobulin replacement in patients with primary antibody deficiencies: safety and costs. Lancet 1995;345(8946):365-369. 51) Ochs HD, Gupta S, Kiessling P, Nicolay U, Berger M. Safety and efficacy of self-administered subcutaneous immunoglobulin in patients with primary immunodeficiency diseases. J Clin Immunol 2006;26(3):265-273. 52) CSL Behring. IgPro20 EU product information. 2010. 53) CSL Behring. Vivaglobin®: Summary of product characteristics. Available at http:// emc.medicines.org.uk/medicine/15933. 2009. Accessed February 1, 2010. 54) Berger M. Subcutaneous administration of IgG. Immunol Allergy Clin North Am 2008;28(4):779802, viii. 5 Propiedades farmacocinéticas ●●Hizentra®, administrado semanalmente a dosis equivalentes a la IgIV o IgSC previamente administrada, mantuvo los niveles de concentración sérica de IgG en estado de equilibrio. ●●Las concentraciones séricas de los anticuerpos específicos analizados se mantuvieron en un nivel estable. 5.1 Farmacocinética de Hizentra® en la inmunodeficiencia primaria En pacientes con inmunodeficiencia primaria (IDP), la terapia sustitutiva de inmunoglobulina (Ig) con Ig humana derivada de plasma donado ha demostrado reducir la frecuencia y la gravedad de infecciones, al mismo tiempo que mantiene unos niveles séricos de inmunoglobulina G (IgG) dentro del intervalo de la normalidad [1-3]. La concentración mínima de IgG sérica más baja (Cmín) que proporciona una protección efectiva contra la infección en pacientes con IDP es de aproximadamente 5 g/L [4], aunque pruebas recientes sugieren que, en pacientes con inmunodeficiencia común variable, una concentración mínima sérica por encima de 7 g/L es ventajosa para la salud del paciente [5]. La IgG se administra ampliamente en forma de formulación subcutánea (IgSC) o intravenosa (IgIV), aunque la IgSC ofrece una serie de ventajas sobre la vía de administración IV como, por ejemplo, la eliminación de la necesidad de acceso intravenoso, menos efectos secundarios sistémicos y la autoadministración en un lugar cómodo para el paciente. Asimismo, se obtienen concentraciones mínimas de IgG más altas y se mantienen de forma continua unos niveles de anticuerpos más fisiológicos con IgSC que con IgIV. Además, los niveles de IgG disminuyen menos hacia el final del intervalo de dosificación; la disminución (o desaparición) se observa frecuentemente al final del ciclo de dosificación para la administración de IgIV, y se puede manifestar en los pacientes en forma de fatiga, síntomas articulares u otras formas de malestar general [6]. En Europa, los organismos reguladores consideran que el mantenimiento de concentraciones mínimas de IgG sérica más altas están asociadas con la respuesta clínica [7] y recomiendan la dosificación de IgSC equivalente a la dosis previa de IgIV del paciente. La experiencia clínica de los últimos 20 años respalda este enfoque; las infusiones de IgSC semanales, basadas en dosis equivalentes a la IgIV mensual, han tenido como resultado concentraciones mínimas de IgG sérica más altas en comparación con el tratamiento con IgIV [2, 8-11]. A pesar de que se consiguen concentraciones mínimas de IgG sérica más elevadas en los pacientes tratados con IgSC, la biodisponibilidad, medida mediante la relación entre el área total bajo la curva de IgG sérica y el tiempo (AUCSC: AUCIV), puede disminuir en comparación con el AUC obtenida con dosis equivalentes de IgIV en los mismos pacientes. Se desconoce la relevancia clínica de las diferencias entre las AUC de IgG; sin embargo, los organismos reguladores de EE.UU. requieren que la dosis de IgSC se ajuste para lograr un AUC equivalente a la del tratamiento previo con IgIV [1, 5]. 39 Se realizó en toda Europa un estudio de fase III abierto y diseñado de forma prospectiva para evaluar la eficacia, la seguridad, la tolerabilidad y la farmacocinética de Hizentra® administrado por vía subcutánea a sujetos con IDP. Los sujetos habían recibido previamente IgIV o IgSC a intervalos regulares durante al menos seis meses a una dosis estable. De los 51 sujetos incluidos en este estudio, 24 fueron incluidos en el subestudio de farmacocinética (PK), de los que 23 sujetos lo completaron (definidos como “población del subestudio”); un sujeto fue excluido de la población del subestudio debido a una variación de la dosis > 10% durante las 12 semanas anteriores a las evaluaciones de la PK. Todos los sujetos del subestudio de PK debían ser ≥ 6 años de edad (o ≥ 16 años de edad en el Reino Unido). Las evaluaciones de PK se llevaron a cabo durante un intervalo de tratamiento en estado de equilibrio (semana 28 ± 1) [12]. En la figura 5.1 se muestra un esquema del diseño del estudio. Las variables de PK evaluadas durante el subestudio fueron: el AUC hasta la última concentración medida (AUCúlt); el AUC durante un intervalo de dosificación regular (AUCi); la concentración sérica máxima de IgG (Cmáx); el tiempo hasta la concentración sérica máxima de IgG (Tmáx); y la concentración sérica de las subclases de IgG , anticuerpos específicos de la IgG y la L-prolina [12]. 5.1.1 Concentraciones séricas totales de IgG en estado de equilibrio La media de las concentraciones séricas totales de IgG se mantuvieron estables en la población del subestudio de PK durante un intervalo de dosificación (los valores medios oscilaron entre 7,44 y 7,98 g/L) (figura 5.2). Cuando se analizó por categoría de edad (de 2 a < 12 años, de 12 a < 16 años y de 16 a < 65 años), se observó una concentración media de IgG ligeramente inferior en los niños de entre 2 y < 12 años; no obstante, no se Figura 5.1 Descripción del diseño del estudio de fase III, incluido el subestudio PK [12] Concentración sérica de IgG IgIV Inicio del estudio, dosificación semanal al 100% de la dosis semanal previa equivalente de IgIV o IgSC Fin del estudio, los sujetos pudieron continuar con el tratamiento con IgPro20 en el estudio de extensión IgSC IgIV o IgSC a intervalos regulares Período de lavado/selección Período de eficacia ≥ 6 meses previos a este estudio 12 semanas 12 meses -7 o -4 o -1 1 -9 -5 HRQL (nivel basal, de 1 a 4 semanas antes del inicio del estudio) 5 9 13 17 HRQL (seguimiento) IgG = inmunoglobulina G; IgIV = inmunoglobulina intravenosa; PK = farmacocinética; IgSC = inmunoglobulina subcutánea; HRQL = calidad de vida relacionada con la salud 40 21 25 29 HRQL Subestudio PK (seguimiento) Semanas 40 HRQL (seguimiento) Figura 5.2 Media (EE) de las concentraciones séricas totales de IgG a lo largo de un intervalo de dosificación en estado de equilibrio (semana 28 ± 1) en la población del subestudio [12] Tabla 5.1 Farmacocinética de la IgG sérica tras el tratamiento con Hizentra® en estado de equilibrio (semana 28 ± 1) en la población del subestudio [12] 12 11 IgG (g/L) 10 9 8 7 6 5 2 3 4 5 6 Pre/10 1 min/2 h Tiempo después de la infusión (días) 7 Pre = antes de la infusión; 10 min = 10 minutos antes del final de la infusión; 2 h = 2 horas después del final de la infusión EE = error estándar observaron diferencias clínicamente relevantes entre los grupos. 5.1.2 Farmacocinética de las concentraciones séricas totales de IgG en estado de equilibrio Los parámetros PK para la IgG sérica total en estado de equilibrio tras el tratamiento con Hizentra® se evaluaron en tres categorías de edad (tabla 5.1) [12]. Algunos valores (Cmáx, AUCúlt y AUCi) fueron ligeramente inferiores en niños de entre 2 y < 12 años, pero no se observaron diferencias clínicamente relevantes entre los grupos. La media de la Cmáx (8,26 g/L) se alcanzó aproximadamente dos días después de la dosis en todos los grupos de edad. Se observó que la media del AUCúlt (53,70 día x g/L) y del AUCi (53,61 día x g/L) fueron prácticamente iguales (tabla 5.1) [12]. 5.1.3 Subclases de IgG Los cambios en las concentraciones séricas de las subclases de IgG —IgG1, IgG2, IgG3 e IgG4— durante un intervalo de dosificación único fueron menores (figura 5.3) y similares a los observados para las concentraciones séricas totales de IgG (figura 5.2) [12]. Las medias de la Cmáx de IgG1 e IgG2 se alcanzaron dos días después de la dosis, y las medias de la Cmáx de IgG3 e IgG4 se alcanzaron entre uno y cuatro días después de la dosis. La contribución de las subclases de IgG a la IgG total fue comparable al intervalo fisiológico normal [13, 14]. Como se esperaba, la IgG1 y la IgG2 estaban presentes a concentraciones más elevadas que la IgG3 y la IgG4. 5.1.4 Anticuerpos específicos En el transcurso de un intervalo de dosificación, los cambios en las concentraciones séricas de los anticuerpos específicos de la IgG (figura 5.4) —anti-sarampión, anti-citomegalovirus (CMV), anti-Haemophilus influenzae, anti-tétanos y antiStreptococcus pneumoniae— fueron similares a los de la IgG sérica total y a las subclases de IgG (figura 5.2 y figura 5.3). No se observaron diferencias importantes entre las categorías de edad (no se muestran). La media de la Cmáx se alcanzó tres días 41 Figura 5.3 Media (EE) de las concentraciones séricas de las subclases de IgG en estado de equilibrio (semana 28 ± 1) en la población del subestudio [12] IgG1 IgG2 IgG3 IgG4 500 480 460 50 440 Anti-H.influenzae Anti-sarampión 46 250 230 210 40 20 0 Anti-S.pneumoniae Anti-CMV Anti-tétanos 48 420 Concentración de IgG* Concentración de IgG (mg/dL) Figura 5.4 Media (EE) de las concentraciones séricas de anticuerpos específicos de la IgG a lo largo de un único intervalo de dosificación en estado de equilibrio (semana 28 ± 1) en la población del subestudio [12] 2 3 4 5 6 Pre/10 1 min/2 h Tiempo después de la infusión (días) 7 Pre = antes de la infusión; 10 min = 10 minutos antes del final de la infusión; 2 h = 2 horas después del final de la infusión EE = error estándar después de la infusión para la IgG anti-sarampión, anti-CMV, anti-Haemophilus influenzae, anti-tétanos y anti-Streptococcus pneumoniae. Las concentraciones séricas se mantuvieron a un nivel estable [12]. 44 42 40 10 8 6 4 2 0 2 3 4 5 6 Pre/10 1 min/2 h Tiempo después de la infusión (días) 7 *Las unidades son UI/mL excepto para anti-H.influenzae y anti-S.pneumoniae (mg/L) Pre = antes de la infusión; 10 min = 10 minutos antes del final de la infusión; 2 h = 2 horas después del final de la infusión EE = error estándar; CMV = citomegalovirus 5.2 Conclusiones 5.1.5 Concentraciones séricas de L-prolina Las concentraciones séricas de L-prolina, medidas durante un intervalo de dosificación, alcanzaron un máximo a los 10 minutos anteriores a la finalización de la infusión de Hizentra® (figura 5.5) [12]. Un día después de la infusión, la L-prolina sérica volvió a aproximadamente el mismo nivel de antes de la infusión, algo coherente con una rápida eliminación de la circulación y una ausencia de acumulación [15]. El patrón de eliminación de la L-prolina observado tras la administración de Hizentra® fue similar al observado con la IgIV estabilizada con L-prolina (Privigen®) [16]. 42 A una dosis de Hizentra® equivalente a la dosis anterior para el sujeto de IgIV o IgSC, la media de las concentraciones séricas totales de IgG durante un único intervalo de dosis en estado de equilibrio fue estable (7,44 a 7,98 g/L) y la media de la Cmáx (8,26 g/L) se alcanzó tras una mediana de tiempo de 2,06 días. No se observaron diferencias clínicamente relevantes entre las categorías de edad. Otras evaluaciones PK con Hizentra® mostraron que las proporciones de las subclases de IgG individuales (IgG1, IgG2, IgG3, IgG4) que contribuyen a la IgG total en estado de equilibrio durante el período de eficacia fueron comparables a las establecidas por la literatura. Los cambios en las concentraciones Figura 5.5 Media (EE) de las concentraciones séricas de L-prolina a lo largo de un único intervalo de dosificación en estado de equilibrio (semana 28 ± 1) en la población del subestudio [12] de >2 a <12 a. de >12 a <16 a. de >16 a <65 a. de <65 a total Concentración de L-prolina (µmol/L) 600 550 500 450 400 350 300 250 200 150 100 2 3 4 5 6 Pre/10 1 min/2 h Tiempo después de la infusión (días) 7 Pre = antes de la infusión; 10 min = 10 minutos antes del final de la infusión; 2 h = 2 horas después del final de la infusión; a = años EE = error estándar séricas de anticuerpos específicos de la IgG a lo largo del tiempo fueron comparables, en general, con las concentraciones séricas totales de IgG y de las subclases de IgG. La L-prolina sérica se eliminó rápidamente de la circulación y no mostró acumulación, lo que confirma los resultados de estudios anteriores. Bibliografía 1) Ochs HD, Gupta S, Kiessling P, Nicolay U, Berger M. Safety and efficacy of self-administered subcutaneous immunoglobulin in patients with primary immunodeficiency diseases. J Clin Immunol 2006; 26: 265-273. 2) Gardulf A, Nicolay U, Asensio O, Bernatowska E, Böck A, Carvalho BC, Granert C, Haag S, Hernández D, Kiessling P, Kus J, Pons J, Niehues T, Schmidt S, Schulze I, Borte M. Rapid subcutaneous IgG replacement therapy is effective and safe in children and adults with primary immunodeficiencies – a prospective, multi-national study. J Clin Immunol 2006; 26: 177-185. 3) Gardulf A, Andersen V, Björkander J, Ericson D, Frøland SS, Gustafson R, Hammarström L, Jacobsen MB, Jonsson E, Moeller G, Nyström J, Søeberg B, Smith CIE. Subcutaneous immunoglobulin replacement in patients with primary antibody deficiencies: safety and costs. Lancet 1995; 345: 365-369. 4) Bonilla FA. Pharmacokinetics of immunoglobulin administered via intravenous or subcutaneous routes. Immunol Allergy Clin North Am 2008; 28: 803-19, ix. 5) Ballow M, Notarangelo L, Grimbacher B, Cunningham-Rundles C, Stein M, Helbert M, Gathmann B, Kindle G, Knight AK. Immunodeficiencies. Clin Exp Immunol 2009; 158: 14-22. 6) Berger M. Subcutaneous immunoglobulin replacement in primary immunodeficiencies. Clin Immunol 2004; 112: 1-7. 7) EMEA. Note for guidance on the investigation of human normal immunoglobulin for subcutaneous and intramuscular use. CPMP/BPWG/283/00. Available at EMEA, 2002: www.emea.europa. eu/pdfs/human/bpwg/028300.en.pdf. Accessed April 15, 2010. 8) Chapel HM, Spickett GP, Ericson D, Engl W, Eibl MM, Björkander J. The comparison of the efficacy and safety of intravenous versus subcutaneous immunoglobulin replacement therapy. J Clin Immunol 2000; 20: 94-100. 43 9) Gardulf A, Hammarström L, Smith CIE. Home treatment of hypogammaglobulinaemia with subcutaneous gammaglobulin by rapid infusion. Lancet 1991; 338: 162-166. 10) Gardulf A, Björvell H, Gustafson R, Hammarström L, Smith CI. The life situations of patients with primary antibody deficiency untreated or treated with subcutaneous gammaglobulin infusions. Clin Exp Immunol 1993; 92: 200-204. 11) Radinsky S, Bonagura VR. Subcutaneous immunoglobulin infusion as an alternative to intravenous immunoglobulin. J Allergy Clin Immunol 2003; 112: 630-633. 12) CSL Behring data on file: Clinical Study Report ZLB06_001CR. 13) French M. Serum IgG subclasses in normal adults. Monogr Allergy 1986; 19: 100-107. 14) Shakib F, Stanworth DR. Human IgG subclasses in health and disease. (A review). Part I. Ric Clin Lab 1980; 10: 463-479. 15) Wasserman RL, Melamed I, Nelson RP Jr, Knutsen AP, Fasano MB, Stein MR, Rojavin MA, Church JA. Pharmacokinetics of subcutaneous IgPro20 in patients with primary immunodeficiency. Clin Pharmacokinet. 2011 Jun;50(6):405-14. 16) Stein MR, Nelson RP, Church JA, Wasserman RL, Borte M, Vermylen C, Bichler J, for the IgPro10 in PID study group. Safety and efficacy of Privigen®, a novel 10% liquid immunoglobulin preparation for intravenous use, in patients with primary immunodeficiencies. J Clin Immunol 2009; 14: 227-236. 44 6 Eficacia clínica ●●Hizentra® es altamente eficaz en la protección contra infecciones en pacientes con inmunodeficiencias, ya que mantiene las concentraciones de IgG en estado de equilibrio. No se notificaron infecciones bacterianas graves durante el período de eficacia en pacientes que recibieron Hizentra® en el marco de estudios clínicos. ●●La IgSC Hizentra® es una alternativa adecuada a las pautas de tratamiento actuales con IgIV para los pacientes con IDP que desean disfrutar de una mayor independencia de las visitas y la asistencia hospitalaria. 6.1 Indicaciones clínicas Las inmunodeficiencias primarias (IDP) comprenden un extenso grupo de trastornos genéticos que impiden el funcionamiento normal de las células del sistema inmunitario. Los pacientes con estas inmunodeficiencias son más susceptibles a las infecciones y tienen problemas de salud de por vida. Las inmunodeficiencias secundarias (IDS) son consecuencia de otras enfermedades o de factores ambientales. Las frecuencias de las IDP más comunes y de las enfermedades que originan IDS se muestran en la tabla 6.1. La administración de inmunoglobulinas humanas, tanto por vía intravenosa (IV) como subcutánea (SC), en el tratamiento de las IDP [1] está bien establecida. La terapia sustitutiva profiláctica con inmunoglobulinas ha demostrado reducir la incidencia de infecciones en pacientes con IDS que presentan infecciones recurrentes [2, 3]. Para muchos pacientes con IDP e IDS, la IgSC ofrece la flexibilidad de la autoadministración de la terapia sustitutiva de IgG Tabla 6.1 Prevalencia/incidencia de las IDP más comunes y de las enfermedades que causan IDS [5-10] en un lugar cómodo sin la necesidad de acudir a la consulta del médico o al hospital [4]. Hizentra®, una inmunoglobulina G (IgG) humana normal, líquida al 20%, es una formulación SC de IgG humana polivalente lista para su uso, indicada para el tratamiento de pacientes con IDP e IDS. Como se 45 describe en la tabla 6.1, estas inmunodeficiencias incluyen, entre otras, la agammaglobulinemia congénita, la inmunodeficiencia común variable, la agammaglobulinemia ligada al cromosoma X, el síndrome de Wiskott-Aldrich, las inmunodeficiencias combinadas graves, el mieloma y la leucemia linfocítica crónica con hipogammaglobulinemia secundaria grave e infecciones recurrentes. Hizentra® ha demostrado, en dos estudios de fase III prospectivos, abiertos, multicéntricos y de un solo grupo, que es capaz de prevenir las infecciones bacterianas graves (IBG) gracias al mantenimiento de concentraciones séricas de IgG suficientes sin provocar ningún acontecimiento adverso grave inesperado [13]. Los datos de eficacia del estudio europeo de fase III se presentan a continuación; los datos del estudio de fase III de Estados Unidos (EE. UU.) se presentan en el apéndice. 6.2 Diseño y metodología del estudio La eficacia, la seguridad y la tolerabilidad de Hizentra® se investigaron en un estudio de fase III prospectivo, abierto, multicéntrico y de un solo brazo realizado en 15 centros de Europa [14]. El tratamiento de los sujetos con IDP previamente tratados con inmunoglobulina intravenosa (IgIV) o IgSC se cambió a Hizentra®, a una dosis equivalente a su dosis anterior de IgIV o IgSC. Durante los nueve meses previos a la inclusión, 28 sujetos (60,9%) habían recibido IgIV y 18 sujetos (39,1%) habían recibido IgSC a dosis semanales medias de 131,5 mg/kg y 107,0 mg/kg de peso corporal (pc), respectivamente [14]. En la figura 6.1 se muestra un esquema del diseño del estudio. De los 53 sujetos seleccionados, 51 fueron incluidos en el estudio y fueron tratados con Hizentra® [14]. De estos, 46 sujetos (15 mujeres y 31 Figura 6.1 Diseño del estudio [14] Concentración sérica de IgG IgIV Inicio del estudio, dosificación semanal al 100% de la dosis semanal previa equivalente de IgIV o IgSC Fin del estudio, los sujetos pudieron continuar con el tratamiento con IgPro20 en el estudio de extensión IgSC IgIV o IgSC a intervalos regulares Período de lavado/selección Período de eficacia ≥ 6 meses previos a este estudio 12 semanas 12 meses -7 o -4 o -1 1 -9 -5 HRQL (nivel basal, de 1 a 4 semanas antes del inicio del estudio) 5 9 13 17 HRQL (seguimiento) IgG = inmunoglobulina G; IgIV = inmunoglobulina intravenosa; PK = farmacocinética; IgSC = inmunoglobulina subcutánea; HRQL = calidad de vida relacionada con la salud 46 21 25 29 HRQL Subestudio PK (seguimiento) - Semanas 40 HRQL (seguimiento) Figura 6.2 Distribución de sujetos [14] Seleccionados: 53 sujetos No cumplieron los requisitos de inclusión: 2 sujetos Incluidos en el subestudio PK: 24 sujetos Incluidos y tratados con IgPro20: 51 sujetos Abandonaron durante el período de lavado/ selección: 5 sujetos Tratados en el período de eficacia (inicio en semana 13): 46 sujetos Completaron el subestudio PK (semana 28 ±1): 23 sujetos Abandonaron durante período de eficacia: 3 sujetos Completaron período eficacia (semana 40): 43 sujetos hombres) con una media de edad de 21,5 años completaron el período de lavado/selección de 12 semanas y 43 de ellos completaron el período de eficacia de 28 semanas hasta la semana 40 (figura 6.2). Los 46 sujetos, incluidos 22 niños (47,9%) de edades comprendidas entre los 2 y < 16 años, que fueron tratados en el período de eficacia, comprendieron a la población por intención de tratar (ITT). Cinco sujetos abandonaron durante el período de lavado/selección, tres de ellos a causa de acontecimientos adversos (AA), dos retiraron su consentimiento y tres sujetos abandonaron (todos a causa de AA) durante el período de eficacia. De los tres sujetos que abandonaron a causa de AA, uno experimentó mialgia, pirexia y náuseas de intensidad moderada, y dolor torácico y aumento de la proteína C reactiva de intensidad grave; el investigador consideró que estos problemas no estaban relacionados con el tratamiento. Otro sujeto notificó una reacción en el lugar de la inyección (intensidad moderada), fatiga y sensación de frío (leves) que el investigador consideró que podían estar relacionadas con el tratamiento. El tercer sujeto experimentó una reacción en el lugar de la inyección (moderada) e hipersensibilidad (leve); el investigador consideró que estos AA podían estar relacionados con el tratamiento. Un sujeto experimentó una infección bacteriana grave durante el período de lavado/selección. En el grupo ITT, los tipos de enfermedad primaria fueron la inmunodeficiencia común variable (60,9%), la agammaglobulinemia ligada al cromosoma X (37,0%) y la agammaglobulinemia autosómica recesiva (2,2%) [14]. El tratamiento con Hizentra® fue principalmente domiciliario y autoadministrado por los sujetos o sus cuidadores, quienes recibieron formación acerca de la técnica de infusión correcta. Hizentra® se administró por vía SC en intervalos semanales durante un máximo de 40 semanas [14]. Para los sujetos que habían recibido anteriormente IgIV, la dosis semanal inicial de Hizentra® fue un tercio de la dosis de IgIV, si esta se administraba a intervalos de tres semanas, y un cuarto de la dosis, si se administraba a intervalos de cuatro semanas. Para los sujetos que ya estaban siendo tratados con IgSC, la dosis semanal inicial de Hizentra® fue igual a la dosis anterior de IgSC. En la población ITT, la media (DE) de la dosis semanal individual de Hizentra® fue de 118,8 mg/kg de pc [37,33] durante el período de lavado/selección y de 120,1 mg/kg de pc [34,32) durante el período de eficacia [14]. 6.2.1 Evaluaciones del estudio/eficacia El objetivo principal de este estudio fue obtener unos valores estables de la Cmín de IgG sérica total en la población ITT comparables a los observados con el tratamiento previo con IgG. 47 Los objetivos secundarios de eficacia se basaron en lo siguiente [14]: • La tasa de IBG clínicamente documentadas en la población ITT. Las IBG se definieron como: neumonía bacteriana bacteriemia/septicemia osteomielitis/artritis séptica meningitis bacteriana absceso visceral • El número de episodios infecciosos. • El número de días de ausencia en el trabajo/ la escuela/la guardería/el centro de día o de incapacidad para llevar a cabo actividades cotidianas a causa de las infecciones. • El número de días de hospitalización a causa de las infecciones. • El uso de antibióticos para la profilaxis y el tratamiento de las infecciones. 6.3 Análisis de la eficacia 6.3.1 Variable principal de eficacia: concentraciones mínimas de IgG En este estudio, tanto los sujetos adultos como los pediátricos tratados con Hizentra® mantuvieron concentraciones séricas estables de IgG, como muestran las medias de los valores de la Cmín de la IgG, que oscilaron entre 7,99 y 8,25 g/L durante el período de eficacia (figura 6.3). En general, la media de los valores medianos individuales de la Cmín de IgG aumentó en un 8,1%, de 7,49 a 8,10 g/L en el grupo ITT. En sujetos tratados previamente con IgIV, la media de los valores medianos individuales de la Cmín de IgG aumentó en un 17,0% durante el estudio, mientras que se mantuvo relativamente estable en los sujetos tratados previamente con IgSC (tabla 6.2). Se cumplió el principal objetivo de obtener valores estables de la Cmín de IgG en comparación con el tratamiento previo [14]. Figura 6.3 Media de los niveles de la Cmín de la IgG sérica por visita (grupo de población ITT) [14] 8,8 8,6 Nivel mínimo de IgG (g/L) 8,4 8,2 8 7,8 7,6 7,4 7,2 Selección 1 IgG = inmunoglobulina G 48 4 8 12 13 14 15 16 Infusión 17 20 24 28 32 36 40 Tabla 6.2 Media de los valores medianos individuales de la Cmín de IgG antes y durante el estudio europeo, global y por terapia sustitutiva de Ig previa (población ITT) [14] (se incluyen los datos de EE.UU. a modo de comparación [15]) observada en los ensayos de autorización de todas las preparaciones de IgIV aprobadas en EE.UU. desde el 2000 [1]. Treinta y seis sujetos (78,3%) experimentaron una infección durante el período de eficacia, lo que resultó en una tasa anual de infección de 5,18 por sujeto y año (IC del 95%: 4,3, 6,2). Las infecciones más frecuentes fueron tos, infección de las vías respiratorias superiores, bronquitis, nasofaringitis, sinusitis y tos productiva (tabla 6.3). Sin embargo, un sujeto (sujeto A), una niña de cinco años con inmunodeficiencia común variable, sufrió episodios recurrentes de neumonía que desequilibraron los resultados de algunas de las variables de eficacia (véase el apartado 6.3.2.2) [14]. Tabla 6.3 Número de episodios infecciosos y tasa anual de infecciones (incidencia de > 4 efectos) [grupo ITT] [14] 6.3.2 Variables secundarias de eficacia 6.3.2.1 Episodios infecciosos Hizentra® fue altamente eficaz en la protección de los sujetos contra infecciones. No se produjeron IBG en el grupo ITT durante el período de eficacia, lo que equivale a una tasa anual de 0 IBG/sujeto (límite superior de confianza unilateral del 99%: 0,192) [14]. Los hallazgos son comparables a los observados en el ensayo pivotal de Hizentra® en EE.UU. (0 IBG/ sujeto; límite superior de confianza unilateral del 99%: 0,132) [16]. Esta tasa ofrece una buena comparación con la tasa anual de 0,04 IBG por sujeto obtenida con Vivaglobin® [17, 18] y es similar a la notificada para dos productos de IgIV líquidos al 10%, Privigen® (0,08 IBG por sujeto y año) [20], y Gamunex (< 0,2 infecciones sinopulmonares comprobadas por sujeto y año) [19]. Sin embargo, la tasa anual de IBG en el estudio de fase III de Hizentra® es ligeramente mejor que la media global de 0,068 IBG por sujeto y año 6.3.2.2 Otras variables secundarias clínicas Los resultados de otras evaluaciones clínicas de los sujetos de la población ITT se muestran en la tabla 6.4 [14]. Tras el tratamiento con Hizentra®, 20 sujetos (43,5%) se ausentaron del trabajo/la escuela/la guardería/el 49 centro de día o no fueron capaces de llevar a cabo las actividades cotidianas a causa de las infecciones en 198 días, una tasa anual de 8,00 días por sujeto y por año [14]. Esto es comparable con una media de 7,3 días de ausencia en el trabajo por año de un trabajador típico sin inmunodeficiencia en Alemania (datos de 2008) [21]. La tasa anual de ausencia en el trabajo/la escuela/la guardería/el centro de día en el período de eficacia principal fue diferente entre las categorías de edad, y la proporción más alta se observó en la categoría de edad pediátrica (≥ 2 a < 12 años: 14,90 días por sujeto; ≥ 12 a < 65 años: 3,83 días por sujeto). El valor relativamente alto en los niños de entre ≥ 2 y < 12 años se vio afectado de una forma importante por el sujeto A, que se ausentó durante un total de 71 días durante el período de eficacia. Un análisis post-hoc, en el que se excluyeron los datos de este sujeto, tuvo como resultado una Tabla 6.4 Resumen de resultados para otras variables de eficacia secundarias (grupo ITT) [14] reducción del número de días de ausencia en el trabajo/la escuela de 198 a 127 y de la tasa media anual de días de ausencia de 8,00 a 5,25 días por sujeto y año (tabla 6.4) [14]. Cuatro sujetos fueron hospitalizados a causa de infecciones durante el período de eficacia, uno durante 63 días y el resto entre seis y nueve días [14]. Esto dio como resultado una tasa anual de 3,48 días de hospitalización por sujeto y año, que disminuyó a una tasa anual de 0,95 días de hospitalización por sujeto y año cuando se excluyó al sujeto A del análisis. En general, se trató a 32 sujetos (69,6%) con antibióticos durante el período de eficacia, lo que representó una tasa anual de 72,75 días por sujeto y año [14]. La mediana de la duración del uso de antibióticos fue de 23,0 días (intervalo: 4-197 días) [14]. 6.4 Conclusiones La eficacia de Hizentra® se evaluó en un estudio abierto en sujetos pediátricos con IDP que habían sido tratados previamente con IgIV o IgSC. El tratamiento SC con Hizentra® resultó en unos niveles estables de la Cmín de IgG sérica comparables a los de la terapia sustitutiva con IgG anterior y fue, por tanto, un tratamiento eficaz para estos sujetos. Ninguno de los sujetos de este estudio sufrió una IBG durante el período de eficacia. La tasa anual de 5,18 infecciones por sujeto indica que Hizentra® proporciona una protección eficaz contra la infección en sujetos con IDP. Las infecciones observadas estaban previstas y representan los tipos de infecciones que los pacientes con IDP contraen habitualmente a causa de su enfermedad subyacente, incluso cuando reciben terapia sustitutiva con IgG. 50 Hizentra® es una alternativa adecuada y eficaz a las pautas actuales de tratamiento con IgIV y a las de IgSC de menor concentración en los pacientes con IDP que desean disfrutar de una mayor libertad y flexibilidad en sus opciones de tratamiento con IgG. 6.5 Bibliografía 1) Berger M. Subcutaneous administration of IgG. Immunol Allergy Clin North Am 2008; 28: 779802, viii. 2) Smith A, Wisloff F, Samson D. Guidelines on the diagnosis and management of multiple myeloma 2005. Br J Haematol 2006; 132: 410-451. 3) Raanani P, Gafter-Gvili A, Paul M, Ben-Bassat I, Leibovici L, Shpilberg O. Immunoglobulin prophylaxis in chronic lymphocytic leukemia and multiple myeloma: systematic review and metaanalysis. Leuk Lymphoma 2009; 50: 764-772. 4) Gardulf A, Nicolay U, Math D, Asensio O, Bernatowska E, Bock A, Costa-Carvalho BT, Granert C, Haag S, Hernández D, Kiessling P, Kus J, Matamoros N, Niehues T, Schmidt S, Schulze I, Borte M. Children and adults with primary antibody deficiencies gain quality of life by subcutaneous IgG self-infusions at home. J Allergy Clin Immunol 2004; 114: 936-942. 5) Lin RY, Schwartz RA, Berger M, Talavera F, Simon MR, Rice TD, Kaliner MA. Immunoglobulin G deficiency. Available at http://emedicine. medscape.com/article/136897-overview. 2009. Accessed July 13, 2009. 6) Bascom R, Dolina MY, Hilman BC, Ballas Z, Talavera F, Simon MR, Rice TD, Kaliner MA. Immunoglobulin A deficiency. Available at http:// emedicine.medscape.com/article/885935overview. 2006. Accessed July 13, 2009. 7) Jeffrey Modell Foundation. Primary immunodeficiency diseases: Selective IgA deficiency. Available at http://www.info4pi.org/ aboutPI/index.cfm?section=aboutPI&content= syndromes&area=2&CFID=35810965&CFTOK EN=50858829. 2010. Accessed July 13, 2009. 8) Park CL, Shigeoka AO, Windle ML, Georgitis JW, Pallares D, Jyonouchi H. Common variable immunodeficiency. Available at http://emedicine. medscape.com/article/885935-overview. 2008. Accessed July 13, 2009. 9) Chin T, Oleske JM, Windle ML, Georgitis JW, Pallares D, Jvonouchi H. Bruton agammaglobulinemia. Available at http:// emedicine.medscape.com/article/885625overview. 2008. Accessed July 13, 2009. 10) Dibbern DA, Routes JM, Kirkpatrick CH, Talavera F, Simon MR, Rice TD, Kaliner MA. WiskottAldrich syndrome. Available at http://emedicine. medscape.com/article/137015-overview. 2009. Accessed July 13, 2009. 11) Prevalence and incidence of multiple myeloma. Available at http://www.wrongdiagnosis.com/m/ multiple_myeloma/prevalence.htm. 2010. Accessed April 7, 2010. 12) Prevalence and incidence of chronic lymphocytic leukaemia. Available at http://www. wrongdiagnosis.com/c/chronic_lymphocytic_ leukemia/prevalence.htm. 2010. Accessed April 7, 2010. 13) Hagan JB, Fasano MB, Spector S, Wasserman RL, Melamed I, Rojavin MA, Zenker O, 51 Orange JS. Efficacy and safety of a new 20% immunoglobulin preparation for subcutaneous administration, IgPro20, in patients with primary immunodeficiency. J Clin Immunol. 2010 Sep;30(5):734-745. 14) CSL Behring data on file: Clinical Study Report ZLB06_001CR. 15) CSL Behring data on file: US Pharmacokinetic Substudy. Clinical study report ZLB04_009CR. 16) CSL Behring data on file: Clinical Study Report ZLB04_009CR. 17) Gardulf A, Nicolay U, Asensio O, Bernatowska E, Böck A, Carvalho BC, Granert C, Haag S, Hernández D, Kiessling P, Kus J, Pons J, Niehues T, Schmidt S, Schulze I, Borte M. Rapid subcutaneous IgG replacement therapy is effective and safe in children and adults with primary immunodeficiencies – a prospective, multi-national study. J Clin Immunol 2006; 26: 177-185. 18) Ochs HD, Gupta S, Kiessling P, Nicolay U, Berger M. Safety and efficacy of self-administered subcutaneous immunoglobulin in patients with primary immunodeficiency diseases. J Clin Immunol 2006; 26: 265-273. 19) Gamunex prescribing information. Available at http://www.gamunex.com/csm/prescribing_ information.aspx. 2010. Accessed 1-2-2010. 20) Stein MR, Nelson RP, Church JA, Wasserman RL, Borte M, Vermylen C, Bichler J, for the IgPro10 in PID study group. Safety and efficacy of Privigen®( a novel 10% liquid immunoglobulin preparation for intravenous use, in patients 52 with primary immunodeficiencies. J Clin Immunol 2009; 29: 137-144. 21) Institute for Employment Research of the German Federal Employment Agency. Breakdown of average working hours in Germany. Available at http://doku.iab.de/grauepap/2010/tab-az09.pdf. Accessed May 24, 2010. Apéndice La eficacia de Hizentra® en pacientes con IDP fue investigada en dos estudios de fase III prospectivos, abiertos y multicéntricos [a1-a3]. En general, ambos estudios alcanzaron sus variables principales. En el estudio realizado en EE.UU., se incluyeron 49 sujetos (27 mujeres y 22 hombres) con una media de edad de 34,4 años y fueron tratados con Hizentra®. De estos, 38 sujetos completaron el período de lavado/selección de 12 semanas y 28 completaron el período de eficacia de 12 meses. La investigación incluyó a tres niños de edades comprendidas entre los 2 y < 12 años y a siete adolescentes de edades comprendidas entre los 12 y < 16 años. El objetivo principal fue determinar si la tasa anual de infecciones bacterianas graves por sujeto fue < 1 [a1, a2]. En el estudio realizado en Europa, se incluyeron 51 sujetos que fueron tratados con Hizentra®. De estos, 46 (15 mujeres, 31 hombres) con una media de edad de 21,5 años completaron el período de lavado/ selección y 43 completaron el período de eficacia de 7 meses. El estudio incluyó a 17 niños de edades comprendidas entre los 2 y < 12 años y a cinco adolescentes de edades comprendidas entre los 12 y < 16 años [a3]. El objetivo principal fue obtener unas concentraciones mínimas estables de IgG sérica comparables al tratamiento anterior de los sujetos. Las tablas A.1 y A.2 resumen los resultados de eficacia de ambos estudios [a1-a3]. Tabla A.1 Resultados de eficacia con Hizentra® durante los estudios en Europa (población ITT) y EE.UU. (población MITT) [a1-a3] Tabla A.2 53 Hizentra® ha mostrado una eficacia excelente en estos dos estudios pivotales. El tratamiento SC con Hizentra® ofrece un mayor nivel de eficacia en pacientes adultos y pediátricos con IDP, a la hora de proporcionar inmunidad pasiva y de mantener unas concentraciones séricas adecuadas y estables de IgG. Asimismo, el tratamiento con Hizentra® tiene como resultado una tasa anual baja de cualquier tipo de infección y una tasa baja de días de ausencia en el trabajo/la escuela, días de hospitalización y de uso de antibióticos a causa de infecciones. Bibliografía del apéndice a1) Hagan JB, Fasano MB, Spector S, Wasserman R, Melamed I, Rojavin MA, Zenker O, Orange J. Efficacy and safety of a new 20% immunoglobulin preparation for subcutaneous administration, IgPro20, in patients with primary immunodeficiency. J Clin Immunol 2010. (Epub ahead of print). a2) CSL Behring data on file: Clinical Study Report ZLB04_009CR. a3) CSL Behring data on file: Clinical Study Report ZLB06_001CR. 54 7 Tolerabilidad clínica ●●Hizentra® presenta la concentración más elevada de IgG a la velocidad de infusión aprobada más alta, al mismo tiempo que proporciona un tratamiento con inmunoglobulina subcutánea bien tolerado y con un buen perfil de seguridad. ●●Hizentra® es bien tolerado por los pacientes con inmunodeficiencia primaria, y la mayoría de los acontecimientos adversos son de intensidad leve o moderada. ●●En los ensayos pivotales no se notificaron acontecimientos adversos graves que estuvieran, al menos, posiblemente relacionados con Hizentra® 7.1 Estudios clínicos de tolerabilidad El perfil de seguridad de Hizentra , una inmunoglobulina subcutánea (IgSC) al 20%, fue examinado en dos estudios clínicos prospectivos abiertos, uno en Europa y otro en Estados Unidos (EE.UU.) [1]. ® El estudio europeo de fase III se llevó a cabo durante 41 semanas y evaluó la seguridad de Hizentra® en 51 sujetos con inmunodeficiencia primaria (IDP) de edades comprendidas entre los 3 y los 60 años (media de edad: 22,6 años), incluidos 18 sujetos pediátricos (edad < 12 años). Durante el período de lavado/selección de 12 semanas, los sujetos recibieron una dosis de Hizentra® equivalente a su tratamiento previo con inmunoglobulina intravenosa (IgIV) o con IgSC [1]. No se hicieron ajustes de la dosis durante el período de eficacia de 28 semanas, excepto los debidos a cambios del peso corporal [2]. El estudio de EE.UU. de fase III se llevó a cabo durante 66 semanas y evaluó la seguridad de Hizentra® en 49 sujetos con IDP de edades comprendidas entre los 5 y los 72 años (media de edad 34,4 años), incluidos 3 sujetos pediátricos (edad < 12 años) [1, 3]. Durante el período inicial de lavado/selección de 12 semanas, los sujetos recibieron una pauta de dosificación individualizada de 1,30 veces su dosis semanal previa equivalente de IgIV (Privigen®), con el objetivo de lograr la misma área bajo la curva de IgG sérica-tiempo con ambos tratamientos. La dosis de Hizentra® utilizada en la fase de eficacia posterior se aumentó de forma individual para los sujetos del subestudio farmacocinético (PK), según los resultados de una evaluación PK [3], y hasta un ajuste medio de la dosis de 1,53 veces la dosis semanal previa equivalente de IgIV para los sujetos que no participaron en el subestudio PK. Debido a las diferencias en la práctica clínica entre Europa y EE.UU. con relación al tratamiento de la IDP (generalmente se administran dosis más bajas en Europa) y a las diferencias entre los diseños de los estudios, basados en los requisitos reguladores, las dosis de Hizentra® fueron aproximadamente dos 55 veces más altas en el estudio de EE.UU. que en el europeo. Asimismo, se evaluó a los sujetos durante un período más largo en el estudio de EE.UU. Por lo tanto, los datos de estos dos estudios no son directamente comparables y no se pudo realizar un análisis agrupado. Los resultados de los estudios europeo y de EE.UU. se presentan paralelamente [1]. Se administró un total de 1.831 infusiones subcutáneas semanales de Hizentra® a 51 sujetos durante el estudio europeo, y un total de 2.264 infusiones a 49 sujetos durante el estudio de EE.UU. La dosis semanal individual máxima (durante cuatro semanas consecutivas) fue de 272 mg/kg de peso corporal (pc) y de 386,0 mg/kg de pc en los estudios europeo y de EE.UU., respectivamente [1]. La media de las dosis medianas individuales y las Tabla 7.1 Exposición a Hizentra® durante los estudios europeo (población ITT) y de EE.UU. (población ITT) [2, 4] velocidades de infusión globales se muestran en la tabla 7.1 [2, 4]. En los estudios de eficacia realizados en Europa y EE.UU., el número de infecciones se evaluó como un indicador de la eficacia para el tratamiento con Hizentra®; por lo tanto, las infecciones se excluyeron de los datos de tolerabilidad presentados para “todos los acontecimientos adversos“ (AA) y los “AA relacionados de modo causal con la infusión de Hizentra®” (apartados 7.3 y 7.4) [1]. Se incluyeron las infecciones en los datos presentados para los acontecimientos adversos graves (AAG), para las interrupciones debidas a AA (apartado 7.2) y la intensidad de los AA (apartado 7.3). Se examinaron los AAG y los AA de la población de todos tratados (TT) en el estudio europeo (51 sujetos), definida como todos los sujetos que fueron tratados durante cualquier período del estudio; y de la población por intención de tratar (ITT) en el estudio de EE.UU. (49 sujetos), definida como todos los sujetos que fueron tratados con Hizentra®. 7.2 Acontecimientos adversos graves Los AAG se definieron como cualquier experiencia médica no deseable que cause la muerte o sea potencialmente mortal, que requiriera la hospitalización del paciente o que provoque una discapacidad, un defecto de nacimiento o cualquier otro trastorno médico importante [1]. Hizentra® fue bien tolerado por los sujetos con IDP. El número de sujetos con AAG y la tasa por infusión de AAG fueron bajos en ambos estudios (estudio europeo: 7 AAG [una tasa de 0,004] en cinco sujetos [9,8%]; estudio de EE.UU.: 10 AAG [tasa de 0,004] en siete sujetos [14,3%]). Todos los AAG de ambos estudios fueron considerados como no relacionados con Hizentra® 56 por el investigador. No se produjeron AAG a causa de la reacción en el lugar de la inyección y no se produjeron muertes, ni relacionadas con Hizentra® ni con otras causas [1, 3]. En el estudio europeo, ningún AA fue motivo de interrupción de ninguna infusión; en el estudio de EE.UU., se produjo un AA (reacción local de intensidad moderada). El número de sujetos con AA que llevaron a la interrupción de la participación en el estudio y la tasa por infusión de AA que llevaron a la interrupción fueron bajos en ambos estudios (estudio europeo: 14 AA [tasa de 0,008] en seis sujetos; estudio de EE.UU.: 2 AA [tasa < 0,001] en dos sujetos [4,1%]). Los AA que provocaron la interrupción en el estudio europeo fueron mialgia, pirexia, náuseas, dolor torácico, aumento de la concentración de la proteína C reactiva, dolor en la zona de inyección, prurito en la zona de inyección, tuberculosis pulmonar, reacción en la zona de inyección (2 acontecimientos), fatiga, sensación de frío, hipersensibilidad y anemia [1]. En el estudio realizado en EE.UU., los AA que llevaron a la interrupción fueron reacción en la zona de inyección y miositis [1]. Los AA que causaron la interrupción se consideraron, al menos, posiblemente relacionados con Hizentra® en tres sujetos (5,9%) en el estudio europeo y en un sujeto (2%) en el estudio de EE.UU. [1]. 7.3 Acontecimientos adversos Los AA se definieron como cualquier experiencia médica no deseable en un sujeto que recibía Hizentra® y que podía estar o no relacionada de modo causal con el tratamiento [1]. Los AA también fueron registrados por los sujetos en los diarios y se evaluaron como: • Leve: no interfiere en las actividades cotidianas. • Moderado: interfiere un poco en las actividades cotidianas. • Grave: imposibilita llevar a cabo las actividades cotidianas. En lo que se refiere a AA, Hizentra® fue bien tolerado en ambos estudios. En el estudio europeo, el AA más frecuente fue la reacción en la zona de inyección, que se produjo en el 49,0% de los sujetos (véase el apartado 7.6). Los siguientes AA más frecuentes por término preferido, excluidas las infecciones, fueron cefalea (25,5%), pirexia (17,6%), diarrea, tos y erupción cutánea (9,8% cada uno) (tabla 7.2). El resto de AA ocurrieron en un máximo de cuatro sujetos (≤ 7,8%) [1]. En el estudio de EE.UU., el AA más frecuente fue la reacción en la zona de inyección, que se produjo en todos los sujetos (véase el apartado 7.6). Los siguientes AA más frecuentes por término preferido, excluidas las infecciones, fueron cefalea (26,5%), diarrea (14,3%), fatiga y nasofaringitis (12,2% cada uno) (tabla 7.2). El resto de AA ocurrieron en un máximo de cinco sujetos (≤10,2%) [1]. En el análisis de la tolerabilidad basado en la tasa por infusión, el AA más frecuente en ambos estudios fue la reacción local (estudio europeo: 0,060; estudio de EE.UU.: 0,592); la mayor frecuencia de reacciones locales en el estudio de EE.UU. reflejó las diferencias entre los dos estudios en cuanto a la evaluación y la notificación de reacciones (véase el apartado 7.6). Las siguientes tasas más altas de AA por infusión en ambos estudios fueron por cefalea (estudio europeo: 0,029; estudio de EE.UU.: 0,018) (tabla 7.2), seguida de prurito (0,008), pirexia y dolor orofaríngeo (0,005 cada uno) en el estudio europeo, y de dolor de espalda (0,005), diarrea y nasofaringitis (0,004 cada uno) en el estudio de EE.UU. [1]. Tanto en el estudio europeo como en el de EE.UU., la mayoría de los AA fueron de intensidad leve o moderada. En el estudio realizado en Europa, el 57 Tabla 7.2 Incidencia de acontecimientos adversos, excluidas las infecciones, en los estudios en Europa (población TT) y EE.UU. (población ITT) (experimentados por ≥ 5 sujetos en cada población) [1] 98,7% de los AA (incluidas las infecciones) fueron de intensidad leve o moderada. Los AA de intensidad grave fueron dolor torácico, prurito en la zona de inyección, apendicitis, bronquitis, neumonía, aumento de la concentración de proteína C reactiva y tos (todos en un 2%) [1]. En el estudio realizado en EE.UU., el 99 % de los AA (incluidas las infecciones) fueron de intensidad leve o moderada [1, 3]. Los AA de intensidad grave fueron cefalea (8,2%), reacción en la zona de inyección (6,1%), dolor torácico (4,1%), obstrucción del intestino delgado, dolor dental, hepatitis crónica, gastroenteritis, infección tras el procedimiento, rigidez musculoesquelética, cáncer papilar tiroideo, migraña y asma (2% cada uno) [1]. A pesar de que la cefalea es uno de los AA más frecuentes asociados con el tratamiento con IgIV [5], se notifican tasas bajas en pacientes tratados con IgSC, como confirman los estudios con Hizentra®. En los estudios realizados en Europa y EE.UU., menos sujetos experimentaron cefalea, en comparación 58 con los notificados en un estudio de Privigen®, una formulación de IgIV al 10%, en el que el 43,8% de los sujetos notificó cefalea en las 72 horas posteriores a la infusión [6]. Son necesarias más investigaciones para identificar posibles diferencias entre la tolerabilidad de las terapias con inmunoglobulina IV y SC. 7.4 Acontecimientos adversos relacionados de modo causal con la infusión de Hizentra® Los AA se consideraron relacionados de modo causal con la infusión de Hizentra® si estuvieron, según el criterio del investigador, al menos posiblemente relacionados con la medicación en estudio, de acuerdo con las siguientes definiciones: • Posiblemente relacionado: un acontecimiento clínico, incluidas las anomalías analíticas, con una secuencia temporal razonable con la administración del fármaco del estudio, pero que también podría explicarse por una enfermedad concurrente u otros fármacos o sustancias Tabla 7.3 Incidencia de acontecimientos adversos, excluidas las infecciones, relacionados de modo causal con la infusión de Hizentra® en los estudios de Europa (población TT) y EE.UU. (población ITT) (experimentados por ≥ 1 sujeto en cada población ) [1] químicas. La información sobre la retirada del fármaco puede estar ausente o poco clara. • Probablemente relacionado: la relación temporal con la administración del fármaco del estudio fue convincente, y el acontecimiento no se pudo explicar por ningún trastorno médico ni por otros tratamientos del sujeto. • Relacionado: el acontecimiento se produjo en una secuencia temporal razonable después de la administración del fármaco del estudio, siguió un patrón de respuesta conocido o sospechado para el fármaco en estudio, fue confirmado mediante la mejoría tras la interrupción del fármaco en estudio (retirada) y reapareció tras repetir la exposición (reexposición). En el estudio realizado en Europa, se produjeron un total de 179 AA relacionados de modo causal con la infusión de Hizentra® (0,098 acontecimientos por infusión). El AA relacionado de modo causal más frecuente fue la reacción en la zona de inyección (experimentada por el 49,0% de los sujetos). Los AA relacionados de modo causal más frecuentes fueron la cefalea (11,8%) y el prurito (7,8%). El resto de AA relacionados de modo causal con la infusión de Hizentra® se produjeron en un máximo de tres sujetos (≤ 5,9%) (tabla 7.3) [1]. En el estudio de EE.UU., se produjeron un total de 1.430 AA relacionados de modo causal con la infusión de Hizentra® (0,632 acontecimientos por infusión). El AA relacionado de modo causal más 59 Figura 7.1 Ejemplos de reacciones locales en la zona de inyección (a) al final de la infusión de Hizentra® y (b) 24 horas después de finalizar la infusión de Hizentra® frecuente fue la reacción en la zona de inyección, que experimentaron todos los sujetos. Los siguientes AA relacionados de modo causal más frecuentes fueron cefalea (experimentada por el 24,5% de los sujetos), fatiga y dolor (ambos en un 6,1%). El resto de AA relacionados de modo causal con la infusión se notificaron para un máximo de dos sujetos (≤ 4,1%) (tabla 7.3) [1]. 7.5 AA relacionados con la edad El 35% de la población del estudio europeo eran sujetos pediátricos, por lo que los AA relacionados con la edad se evaluaron en este estudio. El porcentaje de sujetos con AA al menos posiblemente relacionados con Hizentra® fue bajo en los sujetos de entre 2 y < 12 años en comparación con los sujetos de entre 16 y < 65 años (38,9% vs. 78,6%). No se percibió ninguna diferencia relevante relacionada con la edad en el número de sujetos con 60 AAG o AA que llevaron a la interrupción [2]. 7.6 Tolerabilidad local – reacciones en la zona de inyección Las reacciones en la zona de inyección son una característica prevista del tratamiento con IgSC [7, 8], debido a la formación de un depósito temporal del fármaco debajo de la piel en la zona de infusión. En la figura 7.1 se muestran ejemplos de los tipos de reacciones en la zona de inyección asociadas con el tratamiento con IgSC. A pesar de que las reacciones locales fueron los AA notificados con mayor frecuencia en los estudios realizados en Europa y EE.UU. (tabla 7.2), se utilizaron diferentes métodos y momentos para evaluar las reacciones locales en cada estudio, tal como se describe a continuación. Figura 7.2 Intensidad de las reacciones en la zona de inyección en (a) el estudio de Europa y (b) en el estudio de EE.UU., valorada por el investigador (a) (b) Leve Moderada Grave La tolerabilidad local en el estudio europeo fue evaluada por los sujetos mediante una escala de “muy buena”, “buena”, “aceptable” y “mala”. Los sujetos evaluaron la tolerabilidad local entre 24 y 72 horas después del fin de la infusión como “muy buena” o “buena” en 1.767 de las 1.831 infusiones (96,5%); posteriormente, solo 6 infusiones (0,3%) se evaluaron como de “mala” tolerabilidad local [1]. Estos datos fueron revisados por el investigador, que les asignó una valoración de leve, moderada o grave; la mayoría de las reacciones locales fueron valoradas por el investigador como de intensidad leve (87,3%) o moderada (11,8%); solo el 0,9% de las reacciones fueron graves (figura 7.2a) [1]. En el estudio realizado en EE.UU., los sujetos evaluaron la tolerabilidad local 24 horas después de finalizar la infusión de Hizentra® mediante una escala de cinco puntos de “ninguna”, “muy leve”, “leve”, “moderada” o “grave” [4]. La mayor parte de las reacciones de tolerabilidad local (94,8%) fueron evaluadas por los sujetos como “muy leves” o “leves”; una de las reacciones se evaluó como grave [1]. El investigador revisó los datos de los sujetos en 1 de cada 4 visitas obligatorias del estudio. La mayoría de las reacciones locales, valoradas por el investigador, fueron de intensidad leve (93,4%) o moderada (6,3%); solo el 0,3% fueron graves (figura 7.2b) [1, 3]. Asimismo, los investigadores valoraron las reacciones locales 15-45 minutos después de la infusión para las 4 primeras infusiones del estudio y en cada visita posterior del estudio, en las que evaluaron síntomas individuales de eritema, induración, aumento de la temperatura local, picor y dolor local. Se notificó eritema en el 32,4-60,7% de los sujetos; induración en el 57,6-82,1% de los sujetos; aumento de la temperatura local en el 4,8-27,3% de los sujetos; picor en el 0-21,2% de los sujetos; y dolor local en el 2,6-26,7% de los sujetos [1]. Debido a que las evaluaciones de la tolerabilidad local por parte de los sujetos fueron realizadas en diferentes momentos y con diferentes escalas de valoración en los estudios de Europa y EE.UU., los resultados no 61 Sujetos con reacciones locales (%) Figura 7.3 Incidencia de sujetos con reacciones locales por infusión en el estudio europeo (población de seguridad) [2] 30 20 10 0 1 5 9 13 17 21 25 29 33 37 41 44 44 44 43 5 Infusión Número de infusiones 51 49 49 46 45 se pueden comparar de forma directa. Las evaluaciones de la tolerabilidad local fueron realizadas por los propios sujetos en ambos estudios, y también por los investigadores en el estudio de EE.UU. Las evaluaciones de los sujetos y los investigadores también están reflejadas en el informe de reacciones locales como AA, por lo que estas diferencias pueden explicar la mayor parte de las discrepancias entre las frecuencias de los AA de reacción local observadas en los dos estudios [1]. De acuerdo con las evaluaciones de los investigadores de EE.UU., aproximadamente el 75% de los sujetos (intervalo de 64,9-87,0%) sufrieron reacciones en la zona de inyección después de cada infusión. De acuerdo con las evaluaciones de los sujetos, aproximadamente el 40% de los sujetos (intervalo de 26,7-54,3%) sufrieron reacciones en la zona de inyección cada semana. La diferencia podría indicar que aproximadamente el 50% de las reacciones locales observadas por los investigadores se resolvieron en 24 horas. No obstante, la diferencia entre las evaluaciones de los investigadores y los sujetos también refleja diferentes variables analizadas; mientras que el investigador evaluó síntomas específicos (p. ej. eritema, induración, aumento de la temperatura local, picor y dolor local) poco después del final de la 62 44 infusión, los sujetos valoraron su percepción global 24 horas después de la infusión [4]. En el estudio realizado en Europa, la incidencia de reacciones locales disminuyó con el tiempo; aproximadamente el 20% de todos los sujetos experimentó una reacción local tras la primera infusión de Hizentra®, < 5% de los sujetos experimentó una reacción local después de 24 de las 29 infusiones del período de eficacia (semanas 13-41), y ningún sujeto experimentó una reacción local después de las infusiones 24 a 30, 35, 37 y 41 (figura 7.3) [2]. Se observó una disminución similar en las reacciones locales con el tiempo en un estudio europeo de Vivaglobin® en el que pacientes con IDP recibieron terapia sustitutiva de IgG a una dosis equivalente a su tratamiento previo con IgIV. En este estudio, el 78% de los pacientes notificaron una reacción tisular local tras su primera infusión; después de 10 infusiones, el número de reacciones tisulares locales en pacientes tratados en su domicilio disminuyó al 14-30% [7]. La frecuencia y la naturaleza de las reacciones locales notificadas en los dos estudios de Hizentra® son comparables con las observadas en otros estudios con IgSC. En el estudio europeo de Vivaglobin® antes descrito, el 98% de las reacciones locales fueron de Tabla 7.4 Estimaciones e intervalos de confianza (IC) para la diferencia en las puntuaciones máximas y medias de la EVA para el dolor [9] intensidad leve [7]. En otro estudio de Vivaglobin® realizado en EE.UU., se trató a pacientes con IDP con Vivaglobin® a una dosis equivalente a 1,37 veces su dosis previa de IgIV; la frecuencia de las reacciones en la zona de inyección fue del 91% (59 de 65 sujetos) y el 96% de estas fue de intensidad leve o moderada [8]. En una investigación independiente, cuando se hizo una comparación directa de Hizentra® y Vivaglobin® en voluntarios sanos, la tolerabilidad local fue equiparable (véase el apartado 7.7 más adelante) [9]. 7.7 Comparación de la tolerabilidad local con otras preparaciones de IgSC La tolerabilidad local de la infusión de Hizentra se investigó en un estudio cruzado aleatorizado en 28 voluntarios sanos. El objetivo de este estudio era investigar si el aumento de la concentración proteica en Hizentra®, en comparación con otras preparaciones de IgSC, tenía algún efecto adverso sobre la tolerabilidad local. El estudio constó de cuatro períodos de tratamiento, y los voluntarios recibieron cada uno de los tratamientos durante una semana a una velocidad de infusión de 25 mL/h [9]. Se administraron los siguientes tratamientos: ® • Vivaglobin® (16%) 15 mL; 2,4 g de IgG. • IgPro16 (16%) 15 mL; 2,4 g de IgG (una preparación experimental utilizando la tecnología de Hizentra® y Privigen® a una concentración de IgG del 16%). • Hizentra® (20%) 12 mL; 2,4 g de IgG. • Hizentra® (20%) 15 mL; 3,0 g de IgG. La tolerabilidad local fue evaluada por un investigador sin conocimiento del tipo de tratamiento administrado y se observó a los voluntarios durante las 72 horas después de finalizar la infusión. El dolor, valorado mediante una escala visual analógica de 100 mm (EVA), fue la variable primaria del estudio. Las diferencias en las puntuaciones máximas y medias de la EVA para el dolor entre los grupos de tratamiento y el grupo de referencia se muestran en la tabla 7.4 [9]. Los resultados de la tolerabilidad local fueron equiparables entre los dos grupos, con una ligera tendencia hacia una puntuación EVA a favor de Hizentra®. Si se compara con Vivaglobin® actualmente aprobado y con otras preparaciones experimentales, Hizentra® ofrece una concentración proteica más alta sin desventajas en cuanto a la tolerabilidad local [9]. 63 7.8 Conclusiones El perfil de seguridad de Hizentra®, el primer tratamiento SC de IgG líquida al 20%, parece ser equiparable al de otros productos de inmunoglobulina, con la naturaleza, la frecuencia y la relevancia de AA típicos de la enfermedad y su tratamiento. Hizentra® fue evaluado en dos estudios abiertos que determinaron que el producto es bien tolerado por los sujetos con IDP. No se produjeron AAG ni muertes relacionadas con el tratamiento con Hizentra®. Las reacciones en la zona de inyección, características de la administración de IgSC, fueron los AA más frecuentes. La mayoría de las reacciones en la zona de inyección con Hizentra® fueron de intensidad leve, y para los sujetos que pasaron al tratamiento con IgSC, la incidencia disminuyó durante las primeras semanas. Los AA restantes no difirieron de los AA típicos ya conocidos para este tipo de tratamiento e indicación. Al compararlo con Vivaglobin®, Hizentra® ofrece una mayor concentración de IgG con una tolerabilidad similar. 7.9 Bibliografía 1) CSL Behring data on file: 2.7.4 Summary of clinical safety. 2) CSL Behring data on file: Clinical Study Report ZLB06_001CR. 3) Hagan JB, Fasano MB, Spector S, Wasserman R, Melamed I, Rojavin MA, Zenker O, Orange JS. Efficacy and safety of a new 20% immunoglobulin preparation for subcutaneous administration, IgPro20, in patients with primary immunodeficiency. J Clin Immunol 2010. [Epub ahead of print]. 4) CSL Behring data on file: Clinical Study Report ZLB04_009CR. 64 5) Orbach H, Katz U, Sherer Y, Shoenfeld Y. Intravenous immunoglobulin: adverse effects and safe administration. Clin Rev Allergy Immunol 2005; 29: 173-184. 6) Stein MR, Nelson RP, Church JA, Wasserman RL, Borte M, Vermylen C, Bichler J, for the IgPro10 in PID study group. Safety and efficacy of Privigen®, a novel 10% liquid immunoglobulin preparation for intravenous use, in patients with primary immunodeficiencies. J Clin Immunol 2009; 14: 227-236. 7) Gardulf A, Nicolay U, Asensio O, Bernatowska E, Böck A, Carvalho BC, Granert C, Haag S, Hernández D, Kiessling P, Kus J, Pons J, Niehues T, Schmidt S, Schulze I, Borte M. Rapid subcutaneous IgG replacement therapy is effective and safe in children and adults with primary immunodeficiencies – a prospective, multi-national study. J Clin Immunol 2006; 26: 177-185. 8) Ochs HD, Gupta S, Kiessling P, Nicolay U, Berger M. Safety and efficacy of self-administered subcutaneous immunoglobulin in patients with primary immunodeficiency diseases. J Clin Immunol 2006; 26: 265-273. 9) Berger M. L- proline-stabilized human IgG: Privigen(R) 10% for intravenous use and Hizentra® 20% for subcutaneous use. Immunotherapy 2011; 3:163-176. 8 Dosificación, administración y almacenamiento ●●Hizentra®, la primera Ig subcutánea al 20%, ofrece la concentración más alta, además de un volumen inferior y una velocidad de infusión más elevada que otros tratamientos con IgSC con menor concentración. ●●Hizentra® está pensado para la infusión SC y no debe inyectarse en los vasos sanguíneos. ●●Hizentra® se puede almacenar a temperatura ambiente (≤ 25°C) hasta un máximo de 30 meses. 8.1 Indicaciones y uso Hizentra es una formulación líquida al 20% lista para su uso de inmunoglobulina G (IgG) humana normal desarrollada para su administración por vía subcutánea (SC) a pacientes con inmuno­deficiencias primarias (IDP). Estas incluyen, entre otras, la agammaglobulinemia congénita, la hipogammaglobulinemia congénita, la inmunodeficiencia común variable, la inmunodeficiencia combinada grave y también a los pacientes con deficiencia de subclases de IgG que presentan infecciones recurrentes. Hizentra® también está indicado como terapia sustitutiva con inmuno­ globulina en pacientes con mieloma y leucemia linfática crónica con hipogammaglobu­linemia secundaria grave e infecciones recurrentes [1]. ® Para algunos pacientes, es adecuada la infusión SC domiclliaria (autoadministración) y puede ser preferible a tener que acudir a un hospital para recibir tratamiento. Hizentra® es una opción que permite ahorrar tiempo en el tratamiento SC, ya que ofrece un menor volumen de inyección y una velocidad de infusión más alta que otros tratamientos con inmunoglobulina SC (IgSC) con menor concentración. Cuando se planifica la autoadministración, el profesional sanitario que trata al paciente debe facilitarle instrucciones y formación para que pueda realizar la infusión SC en su domicilio o en el lugar que le convenga. 8.2 Dosificación La pauta de dosificación con IgSC debería alcanzar un nivel constante de IgG. Se puede dividir una dosis de carga de al menos 0,2 a 0,5 g/kg de peso corporal (pc) (de 1,0 a 2,5 mL/kg de pc) en varios días. Una vez obtenidos unos niveles de IgG en estado de equilibrio, se administran dosis de mantenimiento a intervalos regulares para llegar a una dosis mensual acumulada de 0,4 a 0,8 g/kg de pc (de 2,0 a 4,0 mL/kg de pc), que corresponde a una dosis semanal de 0,1 a 0,2 g/kg de pc o de 0,5 a 1 mL/kg de pc [1]. Para los pacientes que cambian desde un tratamiento con inmunoglobulina intravenosa (IgIV), la dosis mensual se divide normalmente en dosis semanales. Se debería hacer una medición de los niveles mínimos de IgG para ajustar la dosis y el intervalo de dosificación de Hizentra® [1]. 65 En el estudio pivotal europeo, se evaluó Hizentra® en 51 sujetos con IDP y de edades comprendidas entre los 3 y los 60 años (media de edad de 22,6 años), incluidos 18 sujetos pediátricos (de edad < 12 años) (población de “todos tratados”). Durante el período de lavado/selección de 12 semanas, los sujetos recibieron una dosis de Hizentra® equivalente a su tratamiento previo con IgIV o IgSC [2]. En caso necesario, la dosis podía ajustarse para obtener una concentración mínima total de IgG de ≥ 5 g/L. No se hicieron más ajustes de la dosis durante el período de eficacia de 28 semanas, excepto los debidos a cambios del peso corporal [2]. En la población por intención de tratar (ITT) (46 sujetos), la media de las dosis medianas individuales de Hizentra® fue de 120,0 mg/kg de pc durante el estudio, con una media similar de dosis medianas individuales durante el período de lavado/selección (118,8 mg/kg de pc) y durante el período de eficacia (120,1 mg/kg de pc). La dosis semanal individual máxima (durante cuatro semanas consecutivas) fue de 272 mg/kg de pc [2]. 8.3 Administración Hizentra® está diseñado para su administración por vía SC y normalmente se administra cada semana. Para facilitar la administración, se pueden utilizar bombas de infusión adecuadas para la administración de IgSC [1]. La velocidad de infusión inicial recomendada no debería exceder los 25 mL por hora y por zona [1]. Si se tolera bien, se puede incrementar gradualmente la velocidad de infusión hasta un máximo de 35 mL/h [2]. Durante el estudio pivotal europeo, se administraron un total de 1.831 infusiones SC semanales a 51 sujetos. La velocidad de infusión no debía exceder los 25 mL/h durante el período de lavado/ selección y podía incrementarse durante el período de eficacia, dependiendo de la tolerabilidad local. La mediana de la duración de la infusión por semana fue de 1,17-1,25 horas durante el período de lavado/ 66 selección y de 1,14-1,27 horas durante el período de eficacia (semanas 13 a 40). Durante todo el período del estudio, la mediana de la duración de la infusión global para la población ITT fue de 1,17 horas [2]. En el estudio de extensión de seguimiento que se está llevando a cabo actualmente en Europa, los sujetos del estudio deben empezar con la misma velocidad de infusión de Hizentra® que utilizaban al finalizar el estudio pivotal, con opción a incrementar o disminuir la velocidad dependiendo de la tolerabilidad y la recomendación del médico; los resultados de esta investigación aún no están disponibles [3]. 8.3.1 Autoadministración La autoadministración puede ser apropiada para algunos pacientes. No obstante, se recomienda que un profesional sanitario ofrezca formación inicial sobre la técnica de infusión, seguida de: • mantenimiento de un diario o libro de registro del tratamiento; • instrucciones sobre las medidas que se deben tomar en caso de reacciones adversas graves; • formación sobre el procedimiento adecuado de eliminación de residuos médicos [1]. 8.3.2 Instrucciones para la administración • Hizentra® se suministra como una formulación lista para su uso. Cuando se almacena a temperatura ambiente, no es necesario atemperarla antes de su uso. • Se debe examinar el líquido de cada vial para garantizar que no está turbio ni contiene depósitos, y para comprobar que es de color entre amarillo pálido y marrón claro. • Hizentra® debe administrarse únicamente por vía SC. Se debe utilizar una técnica aséptica. • Cualquier producto no utilizado o material de desecho debe eliminarse de acuerdo con los requisitos locales. • Se recomienda registrar la infusión en el diario o libro de registro del tratamiento. Se recomienda anotar la fecha de administración, el número de lote del producto y el volumen inyectado y la tasa de infusión [1]. 8.4 Formulaciones y presentaciones Hizentra® está disponible en viales de tres tamaños, y se suministra en viales de un solo uso que contienen 0,2 g de proteína por mL (20%), como se muestra a continuación: • 1 g en 5 mL; • 2 g en 10 mL; y • 4 g en 20 mL [1]. 8.7 Bibliografía 1) CSL Behring. Hizentra® EU Product information. 2) CSL Behring data on file: Clinical Study Report ZLB06_001CR. 3) Jones CA, Rojavin M, Baggish JS. Patients with primary immunodeficiency receiving subcutaneous immune globulin Hizentra maintain health-related quality of life and treatment satisfaction in a multicentre extension study of efficacy, tolerability and safety. JPHSR 2012, 3: 41–47. El contenido y el volumen total de IgG del recipiente se indica en la esquina superior derecha de la cara principal del envase externo [1]. 8.5 Almacenamiento Hizentra® contiene el establilizador L-prolina, un aminoácido de origen natural que permite el almacenamiento a temperatura ambiente. Hizentra® es estable durante un máximo de 30 meses si se almacena a temperatura ambiente (hasta 25 °C). Hizentra® no contiene conservantes, por lo que es imprescindible desechar cualquier vial de Hizentra® que no se haya utilizado [1]. 8.6 Manipulación • Los viales de Hizentra® son de un solo uso. • Hizentra® no debe congelarse y no se debe utilizar si ha estado congelado en algún momento. • Se recomienda conservar Hizentra® en su envase original para protegerlo de la luz. • Hizentra® debe utilizarse antes de la fecha de caducidad impresa en el vial. • Hizentra® no debe mezclarse con ningún otro producto [1]. 67 9 Calidad de vida relacionada con la salud ●●Los pacientes con inmunodeficiencia primaria experimentan un deterioro de su calidad de vida relacionada con la salud, en comparación con la población general. ●●En los ensayos clínicos, se utilizan cuestionarios específicos para evaluar los cambios en la calidad de vida relacionada con la salud durante un período de tiempo prolongado. ●●En los sujetos tratados previamente con IgIV, Hizentra® mejoró aspectos específicos de la calidad de vida relacionada con la salud. ●●La satisfacción con el tratamiento respecto a la IgIV mejoró de manera significativa. 9.1 Impacto de la inmunodeficiencia primaria sobre la calidad de vida relacionada con la salud La calidad de vida relacionada con la salud (HRQL) se define como la evaluación subjetiva del impacto de la enfermedad y del tratamiento sobre las cualidades físicas, psicológicas, sociales y somáticas del bienestar de los pacientes y sobre la capacidad para funcionar [1]. La HRQL de los pacientes con inmunodeficiencia primaria (IDP) se ha investigado en relativamente pocos estudios en las últimas décadas. No obstante, las investigaciones indican que el impacto de los trastornos de la IDP perjudica la calidad de vida del paciente. Por ejemplo, si se comparan con la población general, los pacientes con hipogammaglobulinemia no tratados presentan una mayor discapacidad en los parámetros de la HRQL 68 [2]. Asimismo, el estado funcional de estos pacientes no tratados fue equiparable al estado funcional de un grupo que sufría otras enfermedades crónicas como insuficiencia renal o trastornos reumáticos [2]. En este estudio sueco, los pacientes no tratados percibieron una frecuencia significativamente mayor de infecciones y disfunciones en la realización de actividades (p. ej. movilidad, interacción social, mantenimiento del hogar, aficiones) en comparación con un grupo de personas sanas de la misma edad [2]. De forma similar, una encuesta de la Immune Deficiency Foundation (IDF) de Estados Unidos determinó que, en el año previo a su diagnóstico, la mayoría de los pacientes con IDP valoraron su estado general de salud como “aceptable” o “‘malo” [3]. 9.1.1 Impacto de la terapia sustitutiva con inmunoglobulina sobre la calidad de vida relacionada con la salud Durante muchos años, el tratamiento estándar para la IDP ha sido la inmunoglobulina intravenosa (IgIV), que requiere que el paciente acuda mensualmente al hospital. Las directrices para el tratamiento de los pacientes con IDP fomentan el uso de la terapia sustitutiva con inmunoglobulina G (IgG) y reconocen que la identificación precoz de la IDP se traduce en unos mejores resultados clínicos [4], incluida la calidad de vida [5]. Por ejemplo, a diferencia del estado de salud “aceptable” o “malo” notificado por los pacientes con IDP no tratados de la encuesta de la IDF, después de un año recibiendo tratamiento con IgIV, el 73% de los pacientes encuestados valoraron su estado de salud como “excelente”, “muy bueno” o “bueno”. Además de las mejorías en el estado de salud, el tratamiento con IgIV también redujo notablemente las limitaciones para trabajar, jugar o llevar a cabo actividades cotidianas normales, y mejoró la calidad de vida de estos pacientes [3]. Más recientemente, la disponibilidad de la inmunoglobulina subcutánea (IgSC) ha ofrecido a los pacientes la flexibilidad de administrarse la IgG semanalmente en lugares más cómodos para ellos o sus cuidadores, como en el domicilio, por ejemplo [6]. Además de ofrecer una opción de tratamiento más conveniente, se ha notificado que el uso de IgSC aumenta de forma significativa el funcionamiento relacionado con la salud y mejora la autovaloración de la salud por parte de los pacientes con IDP, hasta niveles equiparables con los de personas sanas [2]. En una clínica alemana, se recogieron las opiniones de los pacientes sobre el tratamiento subcutáneo (SC) mediante un cuestionario. Las opiniones acerca del tratamiento SC dependieron de si los pacientes habían decidido pasar del tratamiento con IgIV al tratamiento con IgSC. A los encuestados tratados Figura 9.1 Principales ventajas del tratamiento subcutáneo percibidas por los pacientes que reciben tratamiento con IgSC (n = 33) [7] 7% 9% 17% 50% 17% Flexibilidad Niveles constantes de IgG Menos efectos secundarios Autorresponsabilidad Otras con IgIV (n = 28) se les había ofrecido cambiar al tratamiento SC, pero lo rechazaron porque creían que la IgSC era más “incómoda” (48%) y les preocupaban las reacciones adversas (31%). Estas percepciones contrastaron notablemente con la experiencia de los pacientes que cambiaron de IgIV a IgSC (n = 33) y que estaban muy satisfechos con el tratamiento SC; la principal ventaja respecto a la IgIV fue una mayor “flexibilidad” (50%) (figura 9.1). También se observó que en el grupo de IgSC había un mayor porcentaje de pacientes con empleo que en el grupo de IgIV (69% vs. 28%, respectivamente) [7]. Otros estudios indican que tanto los pacientes como los cuidadores prefieren la IgSC a la IgIV. En investigaciones en las que el impacto sobre la calidad de vida del cambio de un tratamiento con IgIV en el hospital 69 a un tratamiento con IgSC en el domicilio se midió mediante el formulario abreviado del cuestionario 36 (SF-36) en adultos y el formulario para padres 50 del cuestionario de salud infantil (CHQ-PF50) en niños, y en las que también se midió la satisfacción respecto al tratamiento mediante el índice de calidad de vida (LQI), la IgSC estuvo muy bien considerada tanto por pacientes adultos como pediátricos [8-10]. En comparación con la IgIV, mejoraron varios aspectos de la HRQL después del tratamiento con IgSC en adultos y niños con IDP, entre los que se incluyeron menos restricciones e interrupciones de las actividades familiares, menos interferencias con las actividades cotidianas, la escuela y el trabajo, y una mejoría de la vitalidad, la salud mental y el funcionamiento social [9]. Otros estudios han demostrado que, cuando los pacientes que ya reciben IgIV en casa cambian a IgSC, la mayoría de los pacientes prefieren la administración por vía SC [11, 12]. Debido a la naturaleza multidimensional de la evaluación de la calidad de vida de un paciente, se recomienda llevar a cabo una exhaustiva serie de evaluaciones de la HRQL en los estudios clínicos [1]. 9.2 Efecto de Hizentra® sobre la calidad de vida relacionada con la salud La HRQL se investigó en un estudio de fase III de Hizentra® en sujetos con IDP, mediante instrumentos seleccionados que permitieran la evaluación del funcionamiento y del bienestar después del tratamiento. En este estudio prospectivo, abierto y de un solo brazo (figura 9.2), el objetivo principal fue lograr unas concentraciones séricas mínimas estables de IgG, equiparables a las del tratamiento previo con IgG de los sujetos (IgSC o IgIV) [13]. Uno de los objetivos secundarios fue evaluar y comparar la HRQL y la satisfacción del sujeto con el tratamiento entre la terapia sustitutiva con IgG previa y el tratamiento con Hizentra®. Debido a que no se esperaban cambios Figura 9.2 Diseño del estudio Concentración sérica de IgG IgIV Inicio del estudio, dosificación semanal al 100% de la dosis semanal previa equivalente de IgIV o IgSC Fin del estudio, los sujetos pudieron continuar con el tratamiento con IgPro20 en el estudio de extensión IgSC IgIV o IgSC a intervalos regulares Período de lavado/ selección Período de eficacia ≥ 6 meses previos a este estudio 12 semanas 12 meses -7 o -4 o -1 1 -9 -5 HRQL (nivel basal, de 1 a 4 semanas antes del inicio del estudio) 5 9 13 17 HRQL (seguimiento) IgG = inmunoglobulina G; IgIV = inmunoglobulina intravenosa; PK = farmacocinética; IgSC = inmunoglobulina subcutánea; HRQL = calidad de vida relacionada con la salud 70 21 25 29 HRQL Subestudio PK (seguimiento) Semanas 40 HRQL (seguimiento) a corto plazo en la HRQL, el efecto de Hizentra® se evaluó en todos los sujetos a nivel basal y al final del período de eficacia (semana 40). Este estudio no fue diseñado para comparar la HRQL en los pacientes tratados con Hizentra® y en los pacientes no tratados, ni tenía la capacidad de detectar una diferencia en la HRQL entre el tratamiento con IgSC e IgIV. Tabla 9.1 Características de dos instrumentos generales de la calidad de vida relacionada con la salud [11, 12] Se escogieron instrumentos específicos de la HRQL que permitieran evaluar el funcionamiento y el bienestar después del tratamiento con Hizentra®. Estos instrumentos incluyeron [13]: • Instrumentos de la HRQL para el estado de salud genérico para medir el estado general de salud, el funcionamiento y el bienestar, que incluyeron: Encuesta de salud SF-36 (para adultos) [14]. CHQ-PF50 (para niños) [15]. • Cuestionario de satisfacción con el tratamiento médico (TSQM) [16]. • Índice de calidad de vida (LQI) [17]. • Escala visual analógica de evaluación del estado de salud (EVA). Las comparaciones estadísticas de las puntuaciones de la HRQL se realizaron utilizando una prueba no paramétrica que comparaba las puntuaciones de la HRQL al final del estudio con las puntuaciones basales de la HRQL. Pacientes que cambiaron de tratamiento con IgIV (N = 17) 100 80 Puntuación mediana La población del estudio incluyó a 48 sujetos que tenían una evaluación basal y al menos una evaluación de seguimiento de la HRQL. Todos los instrumentos fueron utilizados por los propios sujetos o por los padres o el tutor en el caso de los sujetos menores de 14 años. Los sujetos completaron estos cuestionarios validados en el nivel basal y después de recibir Hizentra®. Una puntuación más alta en cualquiera de los instrumentos representaba un mejor estado de la calidad de vida. Figura 9.3 Puntuaciones medias de las dimensiones del SF-36 60 40 20 0 Nivel basal Funcionamiento físico Papel físico Dolor corporal Salud general Fin del estudio* Vitalidad Funcionamiento social Papel emocional Salud mental * Última observación disponible después del nivel basal para cada paciente 71 9.3 Evaluaciones de la HRQL y resultados del ensayo 9.3.1 Cuestionarios de salud general Los dos instrumentos genéricos de HRQL, el SF-36 y el CHQ-PF50, se han utilizado para evaluar la HRQL en pacientes con IDP [11] y para facilitar las comparaciones con la calidad de vida en la población general. El formulario SF-36 evalúa un amplio espectro de conceptos de salud, funcionamiento general y bienestar [11, 12]. El cuestionario está pensado para adultos (≥ 14 años). El CHQ-PF50 está diseñado para evaluar el bienestar físico y psicosocial de los niños a partir de los 5 años. Las características de estos dos instrumentos se resumen en la tabla 9.1. Para la mayoría de las dimensiones del SF-36 y el elemento de transición de la salud, la mediana del cambio entre el nivel basal y el fin del estudio fue 0, independientemente de la terapia sustitutiva con IgG previa (figura 9.3) [13]. En el estudio de Hizentra®, no se pudieron sacar conclusiones en firme del análisis de los datos del CHQ-PF50 debido al reducido número de cuidadores (n = 6) que completaron el cuestionario. La mayoría de los niños menores de 14 años de este estudio eran de Polonia y Rumanía, y estos niños no fueron incluidos en las evaluaciones de la HRQL porque no se disponía de una traducción aprobada del cuestionario CHQ-PF50 en polaco y rumano [13]. Son necesarias más investigaciones para determinar el efecto de Hizentra® sobre la HRQL genérica en los niños. No obstante, otros estudios con capacidad suficiente han mostrado un efecto beneficioso en la calidad de vida con el tratamiento con IgSC. Un estudio anterior demostró mejorías en el CHQ-PF50 en pacientes pediátricos que recibían tratamiento con IgSC (Vivaglobin®) en comparación con la IgIV [9, 10]. Más recientemente, un análisis de datos combinados de otros dos estudios que evaluaron el mismo tratamiento con IgSC determinaron mejorías Tabla 9.2 Puntuaciones de los dominios del TSQM y cambios desde el nivel basal por tratamiento de IgG previo 72 Figura 9.4 Cuestionario de satisfacción del tratamiento para la medicación: cambio en las puntuaciones de los cuatro dominios con el tiempo Figura 9.5 Cambio en las puntuaciones del Índice de Calidad de Vida desde el nivel basal hasta el final del estudio en sujetos que recibían previamente IgIV Pacientes que cambiaron de tratamiento con IgIV (N = 29) 100 100 60 Efectividad Efectos secundarios Comodidad Satisfacción global 40 Puntuación mediana Puntuación mediana 80 p<0,05 80 60 40 20 20 0 0 Nivel basal valores p* <0,05 <0,0001 <0,0001 <0,0332 Nivel basal Puntuación total del LQI Entorno del tratamiento Interferencia del tratamiento Problemas relacionados con el tratamiento Fin del estudio** Fin del estudio* *El final del estudio fue definido como la última observación disponible después del nivel basal para cada paciente (semana 40 o antes). p < 0,05 Prueba de rangos con signo de Wilcoxon para comparar las puntuaciones del nivel basal y del final del estudio. significativas en la HRQL (puntuaciones del SF36, el CHQ-PF50 y el LQI) y en la satisfacción del tratamiento, en particular en los pacientes que habían recibido previamente IgIV en el hospital. Los factores de pronóstico asociados con un peor resultado fueron los trastornos articulares, musculares y esqueléticos y la edad. Asimismo, las puntuaciones bajas del SF-36 a nivel basal fueron factores de pronóstico altamente significativos asociados con una mejoría de la HRQL tras el tratamiento con IgSC administrado en casa [11]. 9.3.2 Cuestionario de satisfacción del tratamiento para la medicación El TSQM es un instrumento genérico de HRQL diseñado para medir la satisfacción del tratamiento en cuatro dominios: eficacia, acontecimientos adversos, conveniencia y satisfacción global (beneficio en relación a las consecuencias) [16]. El "coste del tratamiento" no se interpretó en este estudio, ya que los sujetos no pagaron por el tratamiento. *Prueba de rangos con signo de Wilcoxon. **El final del estudio fue definido como la última observación disponible después del nivel basal para cada paciente (semana 40 o antes). En sujetos tratados previamente con IgIV, se observó una mejoría estadísticamente significativa desde el nivel basal hasta el final del estudio en el dominio del TSQM de “conveniencia” tras el tratamiento con Hizentra® (mediana del cambio +33,3 [IC del 95%: 22,2, 38,9]; p < 0,05. tabla 9.2; figura 9.4). Se observó una ligera mejoría, aunque no significativa, desde el nivel basal hasta el final del estudio en otros dos dominios: el de “eficacia” (mediana del cambio: +5,6) y el de “satisfacción global” (mediana del cambio: +14,3). No se observó ningún cambio en el dominio de “acontecimientos adversos”. En sujetos tratados previamente con IgSC, la mediana del cambio en la “eficacia” fue de +5,6, lo que no fue estadísticamente significativo. No se produjeron cambios en los otros tres dominios [13]. No obstante, los valores basales fueron más altos en comparación con los sujetos tratados previamente con IgIV. 73 Tabla 9.3 Puntuación del estado de salud en el nivel basal y en la semana 40 (EVA en mm) Figura 9.6 Cambio en la evaluación del estado de salud (puntuación de EVA) Escala visual analógica (mm) 100 80 60 40 Cambio desde IgIV (N = 29) Cambio desde IgSC (N = 19) 20 0 Nivel basal Semana 40 EVA = escala visual analógica que va del peor (0) al mejor (100) estado de salud imaginable. 9.3.3 Índice de calidad de vida El LQI es un instrumento diseñado para examinar las preferencias de tratamiento específicamente en pacientes con IDP [12, 17]. Este instrumento evalúa cuatro dominios: la interferencia del tratamiento en las actividades cotidianas; los problemas relacionados con el tratamiento; el entorno del tratamiento; y los costes del tratamiento en pacientes con IDP que reciben tratamiento con IgG en el hospital o en casa [18]. Después del tratamiento con Hizentra®, se observó una mejoría significativa en la puntuación total del LQI desde el nivel basal hasta el final del estudio 74 en pacientes que habían recibido previamente IgIV (mediana del cambio en la puntuación 17,2 [IC del 95%: 8,5, 26,0]; p < 0,05). Las puntuaciones medianas mejoraron en todos los dominios respecto al nivel basal (figura 9.5). Los dominios “interferencia del tratamiento”, “problemas relacionados con el tratamiento” y “entorno del tratamiento” del LQI mostraron mejorías estadísticamente significativas (p < 0,05) cuando los pacientes cambiaron del tratamiento con IgIV al tratamiento con IgSC. Debido a que ninguno de los pacientes en el ensayo tuvo que hacerse cargo de su tratamiento con IgG, los datos de los “costes del tratamiento” no fueron aptos para ser interpretados. Para los sujetos tratados previamente con otro producto de IgSC, las puntuaciones del LQI no mostraron una mejoría estadísticamente significativa [13]. 9.3.4 Evaluación del estado de salud (escala visual analógica) Esta escala de evaluación mide el estado de salud global y permite hacer una estimación del uso de los recursos sanitarios, un parámetro utilizado para el cálculo de las repercusiones económicas sanitarias. El estado de salud se mide mediante una escala visual analógica (EVA) de 0 a 100, una evaluación de un solo elemento del estado de salud. La escala va de 0 (el peor estado de salud imaginable) a 100 (el mejor estado de salud imaginable). Los pacientes hacen una marca en la línea de 100 mm para indicar su percepción de su estado de salud, donde la distancia (en mm) representa la puntuación de la escala. 9.3.4.1 Resultados de la EVA en la evaluación del estado de salud No se observó un cambio estadísticamente significativo en la mediana del estado de salud entre el nivel basal y la semana 40, independientemente del tratamiento previo con IgG, aunque se observó una mejoría numérica en los sujetos que cambiaron desde la IgIV (tabla 9.3, figura 9.6). 9.4 Conclusiones La HRQL de los pacientes con IDP es peor que la de la población general. La naturaleza crónica de la enfermedad hace que sea necesaria una terapia sustitutiva crónica con IgG en forma de infusiones intravenosas o subcutáneas. La terapia sustitutiva con IgG ha demostrado mejorar la HRQL de los pacientes con IDP. En este estudio se evaluó el efecto sobre la HRQL de Hizentra® mediante instrumentos específicamente seleccionados. El tratamiento con Hizentra®, a una dosis equivalente al tratamiento previo con IgIV, mejoró la calidad de vida y la satisfacción con el tratamiento de los sujetos. Los resultados concuerdan con los estudios anteriores que muestran que el tratamiento con IgSC mejora la calidad de vida, limitada, de los pacientes con IDP [2, 8, 18]. Los sujetos que cambiaron de IgIV a Hizentra® mostraron una mayor mejoría en la HRQL que los sujetos que cambiaron de otra IgSC a Hizentra®. Los aspectos más significativos que contribuyen a la mejoría de la calidad de vida de los sujetos fueron la “interferencia con el tratamiento”, los “problemas relacionados con el tratamiento” y el “entorno del tratamiento”. Asimismo, los sujetos notificaron la “conveniencia” como el principal factor que contribuye a una mejoría global en la satisfacción con el tratamiento cuando cambian a Hizentra®. Estos hallazgos concuerdan con los resultados previos que muestran una mejoría de la calidad de vida cuando los sujetos cambian del tratamiento con IgIV al tratamiento con IgSC [11]. 9.5 Bibliografía 1) Revicki DA, Osoba D, Fairclough D, Barofsky I, Berzon R, Leidy NK, Rothman M. Recommendations on health-related quality of life research to support labeling and promotional claims in the United States. Qual Life Res 2000; 9: 887-900. 2) Gardulf A, Björvell H, Gustafson R, Hammarström L, Smith CI. The life situations of patients with primary antibody deficiency untreated or treated with subcutaneous gammaglobulin infusions. Clin Exp Immunol 1993; 92: 200-204. 3) Boyle ML, Schalchunes C. Impact of intravenous immunoglobulin (IVIG) treatment among patients with primary immunodeficiency diseases. Pharmaceuticals Policy and Law 2008; 10: 133146. 4) Turvey SE, Bonilla FA, Junker AK. Primary immunodeficiency diseases: a practical guide for clinicians. Postgrad Med J 2009; 85: 660-666. 5) Wood P. Primary antibody deficiencies: recognition, clinical diagnosis and referral of patients. Clin Med 2009; 9: 595-599. 6) Abrahamsen TG, Sandersen H, Bustnes A. Home therapy with subcutaneous immunoglobulin infusions in children with congenital immunodeficiencies. Pediatrics 1996; 98: 1127-1131. 7) Kittner JM, Grimbacher B, Wulff W, Jäger B, Schmidt RE. Patients’ attitude to subcutaneous immunoglobulin substitution as home therapy. J Clin Immunol 2006; 26: 400-405. 75 8) Gardulf A. Immunoglobulin treatment for primary antibody deficiencies: advantages of the subcutaneous route. Biodrugs 2007; 21: 105116. 9) Gardulf A, Nicolay U, Math D, Asensio O, Bernatowska E, Böck A, Costa-Carvalho BT, Granert C, Haag S, Hernández D, Kiessling P, Kus J, Matamoros N, Niehues T, Schmidt S, Schulze I, Borte M. Children and adults with primary antibody deficiencies gain quality of life by subcutaneous IgG self-infusions at home. J Allergy Clin Immunol 2004; 114: 936-942. 10) Hoffmann F, Grimbacher B, Thiel J, Peter H-H, Belohradsky BH, Vivaglobin® Study Group. Home-based subcutaneous immunoglobulin G replacement therapy under real-life conditions in children and adults with antibody deficiency. Eur J Med Res 2010; 15: 1-8. 11) Gardulf A, Borte M, Ochs HD, Nicolay U, Vivaglobin® Clinical Study Group. Prognostic factors for health-related quality of life in adults and children with primary antibody deficiencies receiving SCIG home therapy. Clin Immunol 2008; 126: 81-88. 12) Nicolay U, Kiessling P, Berger M, Gupta S, Yel L, Roifman CM, Gardulf A, Eichmann F, Haag S, Massion C, Ochs HD. Health-related quality of life and treatment satisfaction in North American patients with primary immunedeficiency diseases receiving subcutaneous IgG self-infusions at home. J Clin Immunol 2006; 26: 65-72. 13) CSL Behring data on file: Clinical Study Report ZLB06_001CR. 76 14) McHorney CA, Ware JE, Jr., Raczek AE. The MOS 36-Item Short-Form Health Survey (SF-36): II. Psychometric and clinical tests of validity in measuring physical and mental health constructs. Med Care 1993; 31: 247-263. 15) Landgraf JM, Maunsell E, Speechley KN, Bullinger M, Campbell S, Abetz L, Ware JE. Canadian-French, German and UK versions of the Child Health Questionnaire: methodology and preliminary item scaling results. Qual Life Res 1998; 7: 433-445. 16) Atkinson MJ, Sinha A, Hass SL, Colman SS, Kumar RN, Brod M, Rowland CR. Validation of a general measure of treatment satisfaction, the Treatment Satisfaction Questionnaire for Medication (TSQM), using a national panel study of chronic disease. Health Qual Life Outcomes 2004; 2: 12. 17) Daly PB, Evans JH, Kobayashi RH, Kobayashi AL, Ochs HD, Fischer SH, Pirofsky B, Sprouse C. Home-based immunoglobulin infusion therapy: quality of life and patient health perceptions. Ann Allergy 1991; 67: 504-510. 18) Nicolay U, Haag S, Eichmann F, Herget S, Spruck D, Gardulf A. Measuring treatment satisfaction in patients with primary immunodeficiency diseases receiving lifelong immunoglobulin replacement therapy. Qual Life Res 2005; 14: 1683-1691. CSL Behringde las características del producto 10 Resumen 1. NOMBRE DEL MEDICAMENTO Hizentra 200 mg/ml solución para inyección subcutánea 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Inmunoglobulina humana normal (IgSC) Un ml contiene: Proteína plasmática humana ................................................................................................................200 mg (pureza de al menos 98% de IgG) Un vial de 5 ml de solución contiene: 1 g de proteína plasmática humana Un vial de 10 ml de solución contiene: 2 g de proteína plasmática humana Un vial de 15 ml de solución contiene: 3 g de proteína plasmática humana Un vial de 20 ml de solución contiene: 4 g de proteína plasmática humana Distribución aproximada de las subclases de IgG: IgG1 62 - 74% IgG2 22 - 34% IgG3 2 - 5% IgG4 1 - 3% El contenido máximo de IgA es de 0,050 mg/ml. Producida a partir del plasma de donantes humanos. Hizentra se considera esencialmente ”exento de sodio”. Para consultar la lista completa de excipientes, ver sección 6.1. 3. FORMA FARMACÉUTICA Solución para inyección subcutánea. La solución es límpida y de color amarillo pálido o marrón claro. Hizentra tiene una osmolalidad de aproximadamente 380 mOsmol/kg. 4. DATOS CLÍNICOS 4.1 Indicaciones terapéuticas Terapia sustitutiva en adultos y niños con síndromes de inmunodeficiencia primaria como: - Agammaglobulinemia e hipogammaglobulinemia congénitas. - Inmunodeficiencia común variable. - Inmunodeficiencia combinada grave. - Deficiencias de subclases de IgG con infecciones recurrentes. Terapia sustitutiva en mieloma o leucemia linfocítica crónica con hipogammaglobulinemia secundaria grave e infecciones recurrentes. 4.2 Posología y forma de administración Un profesional sanitario con experiencia en el tratamiento de la inmunodeficiencia debe comenzar y supervisar inicialmente el tratamiento. Posología Adultos y niños Puede ser necesario personalizar la dosis para cada paciente, dependiendo de la farmacocinética, de la respuesta clínica y de la concentración mínima de IgG en suero. Las siguientes pautas de dosificación se proporcionan como guía. La pauta de dosificación por vía subcutánea debe alcanzar un nivel sostenido de IgG. Puede ser necesaria una dosis de carga de al menos 0,2 a 0,5 g/kg (1,0 a 2,5 ml/kg) de peso corporal. Puede ser necesario dividir la administración de esta dosis en varios días. Una vez logrados unos niveles estables de IgG, deben administrarse dosis de mantenimiento a intervalos repetidos para alcanzar una dosis mensual acumulada del orden de 0,4 a 0,8 g/kg (2,0 a 4,0 ml/kg) de peso corporal. Se debe medir y evaluar la concentración mínima conjuntamente con la respuesta médica del paciente. Dependiendo de la respuesta clínica (p. ej. el índice de infección), se puede considerar ajustar la dosis y/o el intervalo entre las dosis para aspirar a una concentración mínima más elevada. Puesto que la posología se determina en función del peso corporal y se ajusta en función de los resultados clínicos de las condiciones mencionadas anteriormente, no se considera diferente la posología para la población pediátrica que aquélla para pacientes adultos. Se evaluó Hizentra en 33 sujetos pediátricos (21 niños de 3 a 11 años y 12 adolescentes de 12 a 16 años) con síndrome de inmunodeficiencia primaria (IDP). No se requirieron dosis pediátricas específicas para alcanzar los niveles deseados de IgG en suero. Forma de administración El medicamento debe administrarse únicamente por vía subcutánea. Hizentra se puede inyectar en puntos tales como el abdomen, el muslo, el brazo y la cadera lateral. En caso de dosis altas (> 25 ml), se recomienda su administración en múltiples puntos. La velocidad de perfusión inicial recomendada depende de las necesidades individuales del paciente y no debe exceder de 15 ml/hora por punto (ver también sección 4.4). En caso de buena tolerancia, la velocidad de perfusión puede aumentarse gradualmente hasta 25 ml/hora por punto. Se pueden utilizar bombas de perfusión adecuadas para la administración subcutánea de las inmunoglobulinas. Las inyecciones se pueden aplicar hasta en cuatro puntos simultáneamente, siempre que la velocidad de perfusión máxima para todos los puntos combinados no exceda de 50 ml/hora. Los puntos donde se aplican las inyecciones deben distar al menos 5 cm entre ellos. La perfusión subcutánea para el tratamiento a domicilio debe comenzarla y supervisarla inicialmente un profesional sanitario con experiencia en instrucción de pacientes para el tratamiento en casa. Se debe instruir al paciente o a un cuidador en las técnicas de perfusión, en el mantenimiento de un diario de tratamiento y en las medidas a adoptar en caso de reacciones adversas graves. 4.3 Contraindicaciones Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1. Pacientes con hiperprolinemia. Hizentra no debe administrarse por vía intravascular. 4.4 Advertencias y precauciones especiales de empleo Hizentra está indicada únicamente por vía subcutánea. En caso de administración accidental de Hizentra en un vaso sanguíneo, los pacientes pueden entrar en estado de shock. Debe respetarse estrictamente la velocidad de perfusión indicada en la sección 4.2. Es necesario controlar estrechamente a los pacientes durante todo el periodo de perfusión, y se debe observar cuidadosamente la presencia de cualquier acontecimiento adverso. Algunas reacciones adversas pueden producirse con mayor frecuencia en los pacientes que reciben inmunoglobulina humana normal por primera vez o, en casos muy infrecuentes, cuando se cambia el producto de inmunoglobulina humana normal o se ha interrumpido el tratamiento durante más de ocho semanas. Las reacciones alérgicas verdaderas son infrecuentes. En particular, pueden producirse en pacientes con anticuerpos anti-IgA, que deben ser tratados con especial precaución. Los pacientes con anticuerpos anti-IgA para los que el tratamiento con medicamentos de IgG sea la única opción, deberán cambiar al tratamiento con Hizentra únicamente bajo una estrecha supervisión médica. En casos muy infrecuentes, la inmunoglobulina humana normal puede causar un descenso súbito de la presión arterial con reacción anafiláctica, incluso en pacientes que habían tolerado un tratamiento anterior con inmunoglobulina humana normal. Con frecuencia, las posibles complicaciones pueden evitarse, comprobando que: - No sean sensibles a la inmunoglobulina humana normal, mediante la perfusión inicial lenta del producto (ver sección 4.2). - Durante todo el periodo de perfusión, se vigile minuciosamente la presencia de cualquier síntoma en los pacientes. A fin de detectar posibles signos adversos, se vigile durante la primera perfusión y durante una hora después de la misma en especial a los pacientes que no hayan recibido nunca tratamiento con inmunoglobulina humana normal, los pacientes a los que se cambie el tratamiento con un producto alternativo, o cuando haya transcurrido un periodo prolongado desde la perfusión anterior. Se debe observar a todos los demás pacientes por lo menos durante 20 minutos después de la administración. La sospecha de una reacción alérgica o anafiláctica exige la detención inmediata de la inyección. En caso de shock, debe administrarse el tratamiento médico habitual. Información acerca de la seguridad con respecto a agentes transmisibles Entre las medidas habituales para prevenir infecciones producidas a causa del empleo de medicamentos preparados a partir de sangre o plasma humano se cuentan la selección de los donantes, las pruebas de detección de marcadores específicos de infección en donaciones individuales y en mezclas de plasmas, y la inclusión de pasos eficaces de fabricación para la inactivación o eliminación de virus. A pesar de estas medidas, al administrar medicamentos preparados a partir de sangre o plasma humano, no se puede excluir completamente la posibilidad de transmitir agentes infecciosos. Esto también es aplicable en el caso de cualquier virus desconocido o emergente, o de otros agentes patógenos. Las medidas adoptadas se consideran eficaces para virus con envoltura, como el VIH, el VHB y el VHC, y para los virus sin envoltura VHA y el parvovirus B19. La experiencia clínica que existe es tranquilizadora en lo que se refiere a la ausencia de transmisión de la hepatitis A o del parvovirus humano B19 con inmunoglobulinas, y también se asume que el contenido de anticuerpos tiene una contribución importante para la seguridad vírica. Se recomienda encarecidamente que, cada vez que se administre Hizentra a un paciente, se tome nota del nombre y del número de lote del medicamento, a fin de mantener un vínculo entre el paciente y el lote del medicamento. Interferencia con las pruebas serológicas Después de la inyección de inmunoglobulina, el incremento transitorio de los diversos anticuerpos transferidos pasivamente en la sangre del paciente puede llevar a unos resultados positivos confusos en las pruebas serológicas. La transmisión pasiva de anticuerpos contra los antígenos eritrocíticos, por ejemplo, A, B, D, puede interferir con algunas pruebas serológicas de detección de aloanticuerpos eritrocíticos (por ejemplo, la prueba de Coombs). 4.5 Interacción con otros medicamentos y otras formas de interacción Vacunas con virus atenuados vivos La administración de inmunoglobulina puede reducir la eficacia de las vacunas con virus vivos atenuados, como la vacuna antisarampión, antirrubeola, antiparotiditis y antivaricela, durante un periodo mínimo de seis semanas y hasta tres meses. Después de la administración de este medicamento debe transcurrir un intervalo de tres meses antes de la administración de vacunas con virus vivos atenuados. En el caso del sarampión, esta reducción de la eficacia puede persistir hasta un año. Por lo tanto, en los pacientes que reciban la vacuna antisarampión debe comprobarse la concentración de anticuerpos. 4.6 Fertilidad, embarazo y lactancia Embarazo Los datos de ensayos clínicos prospectivos relativos al uso de inmunoglobulina humana normal en mujeres embarazadas son limitados. Por lo tanto, Hizentra debe administrarse con extrema precaución a las mujeres embarazadas y a las madres en periodo de lactancia. La experiencia clínica con inmunoglobulinas indica que no deben esperarse efectos perjudiciales sobre el curso del embarazo, ni sobre el feto o el recién nacido. El tratamiento continuado de la mujer embarazada asegura la inmunidad pasiva del recién nacido. Lactancia Las inmunoglobulinas se excretan por la leche y pueden contribuir a la transferencia de anticuerpos protectores al recién nacido. Fertilidad La experiencia clínica con inmunoglobulinas sugiere que no deben esperarse efectos perjudiciales en relación a la fertilidad. 4.7 Efectos sobre la capacidad para conducir y utilizar máquinas La influencia de Hizentra sobre la capacidad para conducir y utilizar máquinas es nula o insignificante. 4.8 Reacciones adversas Resumen del perfil de seguridad En ocasiones pueden producirse reacciones adversas como escalofríos, cefalea, fiebre, vómitos, reacciones alérgicas, náuseas, artralgia, hipotensión arterial y lumbalgia moderada. En casos muy infrecuentes, las inmunoglobulinas humanas normales pueden causar un descenso súbito de la presión arterial y, en casos aislados, shock anafiláctico, incluso cuando el paciente no ha mostrado hipersensibilidad a la administración previa. Reacciones locales en los puntos de perfusión: hinchazón, dolor, enrojecimiento, induración, calor local, picor, hematomas y erupción. Para consultar la información relativa la seguridad con respecto a agentes transmisibles, ver sección 4.4. Tabla resumen de reacciones adversas Se han observado Reacciones Adversas (RA) en un estudio de fase I con pacientes sanos (n = 28) y en dos estudios de fase III con pacientes con inmunodeficiencia primaria (n = 100) con Hizentra. Las reacciones adversas notificadas en los tres ensayos se resumen y clasifican a continuación según el sistema MedDRA de clases de órganos y sistemas, y frecuencias. La frecuencia por perfusión se ha evaluado utilizando los criterios siguientes: muy frecuentes (≥ 1/10), frecuentes (≥ 1/100 a < 1/10), poco frecuentes (≥ 1/1.000 a < 1/100) y muy poco frecuentes (≥ 1/10.000 a < 1/1.000). Frecuencia de las reacciones adversas (RA) en estudios clínicos con Hizentra Sistema MedDRA de clasificación de órganos y sistemas (COS, MedDRA) Frecuencia de RA (Término preferido de MedDRA, TP) Muy frecuentes (≥ 1/10) Frecuentes (≥ 1/100 a < 1/10) Poco frecuentes (≥ 1/1.000 a < 1/100) Raras (≥ 1/10.000 a < 1/1.000) Infecciones e infestaciones; Nasofaringitis; Trastornos del sistema inmunológico; Hipersensibilidad; Trastornos del sistema nervioso; Mareos, migrañas, hiperactividad psicomotora, somnolencia; Cefalea; En un ensayo europeo, un total de 51 sujetos con síndrome de inmunodeficiencia primaria, con edades comprendidas entre los 3 y los 60 años, fueron tratados con Hizentra hasta 41 semanas. La dosis media semanal administrada fue de 0,12 g/kg de peso corporal. Durante el periodo de tratamiento se alcanzaron concentraciones mínimas sostenidas de IgG de 7,99 a 8,25 g/l. Los sujetos recibieron en total 1.831 perfusiones semanales de Hizentra. En un ensayo en EE. UU, un total de 49 sujetos con síndrome de inmunodeficiencia primaria, con edades comprendidas entre los 5 y los 72 años, fueron tratados con Hizentra hasta 15 meses. La dosis media semanal administrada fue de 0,23 g/kg de peso corporal. Durante el periodo de tratamiento se alcanzaron concentraciones mínimas sostenidas de IgG de 12,53 g/l. Los sujetos recibieron en total 2.264 perfusiones semanales de Hizentra. No se observaron infecciones bacterianas graves en sujetos que recibieron Hizentra en los estudios clínicos durante el periodo de eficacia. 5.2 Propiedades farmacocinéticas Tras la administración subcutánea de Hizentra, se alcanzan los niveles máximos en suero después de aproximadamente dos días. En un ensayo clínico con Hizentra (n = 46), los sujetos alcanzaron concentraciones mínimas sostenidas (mediana 8,1 g/l) durante un periodo de 29 semanas en el que recibieron dosis medias de entre 0,06 y 0,24 g/kg de peso corporal. Las IgG y los complejos de IgG se metabolizan en células del sistema reticuloendotelial. Población pediátrica No se observaron diferencias en los parámetros farmacocinéticos entre los pacientes adultos y los pediátricos en el estudio. 5.3 Datos preclínicos sobre seguridad Las inmunoglobulinas son un constituyente normal del organismo humano. La L-prolina es un aminoácido fisiológico, no esencial. Se ha evaluado la seguridad de Hizentra en varios estudios preclínicos, con especial referencia al excipiente, L-prolina. Los datos no clínicos no revelan ningún riesgo especial para los seres humanos, según los estudios de seguridad farmacológica y de toxicidad. Trastornos cardiacos; Taquicardia; 6. DATOS FARMACÉUTICOS Trastornos vasculares; Hematoma, eritema; Trastornos respiratorios, torácicos y mediastínicos; Tos; 6.1 Lista de excipientes L-prolina Polisorbato 80 Agua para preparaciones inyectables Trastornos gastrointestinales; Vómitos; Trastornos de la piel y del tejido subcutáneo; Prurito; Malestar abdominal, distensión abdominal, dolor abdominal, dolor abdominal bajo, dolor abdominal alto, diarrea, náuseas; 6.2 Incompatibilidades En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros. Dermatitis de contacto, eritema, erupción, urticaria; 6.4 Precauciones especiales de conservación No conservar a temperatura superior a 25 °C. No congelar. Conservar el vial en el embalaje exterior para protegerlo de la luz. Trastornos musculoesqueléticos y del tejido conjuntivo; Artralgia, dolor lumbar, espasmos musculares, debilidad muscular, dolor musculoesquelético, mialgia, dolor en el cuello, dolor en las extremidades; Trastornos renales y urinarios; Hematuria; Trastornos generales y alteraciones en el lugar de administración; Reacciones en el lugar de inyección/ perfusión Exploraciones complementarias Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos Fatiga, dolor; Dolor en el pecho, sensación de frío, hipotermia, enfermedad de tipo gripal, malestar, pirexia; EIncremento de la aldolasa, incremento de la creatinina fosfoquinasa en la sangre, incremento de la lactato deshidrogenasa en la sangre, incremento de la presión arterial, incremento de la temperatura corporal, pérdida de peso. Contusión 4.9 Sobredosis No se conocen las consecuencias de una sobredosis. 5. PROPIEDADES FARMACOLÓGICAS 5.1 Propiedades farmacodinámicas Grupo farmacoterapéutico: sueros inmunes e inmunoglobulinas: inmunoglobulinas humanas normales, para administración extravascular, código ATC: J06BA01. La inmunoglobulina humana normal contiene principalmente inmunoglobulina G (IgG) con un espectro amplio de anticuerpos contra agentes infecciosos. La inmunoglobulina humana normal contiene los anticuerpos IgG presentes en la población normal. Por lo general, se prepara a partir de mezcla de plasmas procedente de una cantidad no inferior a 1.000 donantes. Tiene una distribución de subclases de inmunoglobulina G estrechamente proporcional a la del plasma humano nativo. Las dosis adecuadas de este producto farmacéutico pueden restablecer las concentraciones anormalmente bajas de inmunoglobulina G hasta los valores normales. CSL Behring, S.A. HIZA/200/FT.01/02.12 6.3 Periodo de validez 30 meses. Una vez abierto el vial, se debe usar la solución inmediatamente. 6.5 Naturaleza y contenido del envase 5, 10, 15 o 20 ml de solución en un vial (vidrio tipo I), con un tapón (halobutilo), una cápsula de cierre (de aluminio plegado) y un disco flip-off (de plástico). Tamaños de envase en 1, 10 o 20 viales: 1 g/5 ml 2 g/10 ml 3 g/15 ml 4 g/20 ml Puede que solamente estén comercializados algunos tamaños de envases. 6.6 Precauciones especiales de eliminación y otras manipulaciones Hizentra se presenta como solución lista para usar, en viales monouso. Dado que la solución no contiene conservante, Hizentra debe utilizarse/perfundirse lo antes posible después de abrir el vial. El medicamento debe estar a temperatura ambiente o corporal antes de su uso. La solución debe ser límpida y de color amarillo pálido o marrón claro. No deben utilizarse soluciones que estén turbias o contengan partículas. La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local. 7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN CSL Behring GmbH Emil-von-Behring-Strasse, 76 D-35041 Marburg Alemania 8. NÚMEROS DE AUTORIZACIÓN DE COMERCIALIZACIÓN EU/1/11/687/001 EU/1/11/687/002 EU/1/11/687/003 EU/1/11/687/004 EU/1/11/687/005 EU/1/11/687/006 EU/1/11/687/007 EU/1/11/687/008 EU/1/11/687/009 EU/1/11/687/010 EU/1/11/687/011 EU/1/11/687/012 9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN Fecha de la primera autorización: 14 de abril de 2011 10. FECHA DE LA REVISIÓN DEL TEXTO Octubre 2011 La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu/ Lista de abreviaturas 79 CSL Behring, S.A Av. Països Catalans, 34 08950 Esplugues de Llobregat (Barcelona) Tel. 93 367 18 70 Fax 93 367 18 68 2012/05.10/P/M/HIZ/7 www.cslbehring.es