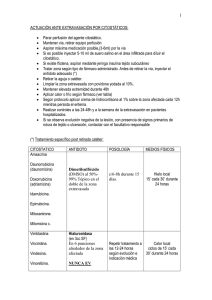
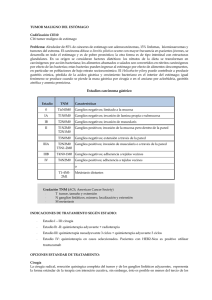
SU VIDA.
Anuncio

SU VIDA. Tratamiento de primera línea y de mantenimiento con ALIMTA para el cáncer de pulmón de células no pequeñas (CPCNP) no escamosas avanzado ALIMTA está aprobado por la FDA en combinación con cisplatino (otro medicamento de quimioterapia) para el tratamiento inicial del cáncer de pulmón de células no pequeñas (CPCNP) no escamosas avanzado, un tipo específico de CPCNP. ALIMTA está aprobado por la FDA para el tratamiento de pacientes con cáncer de pulmón de células no pequeñas (CPCNP) no escamosas avanzado, un tipo especial de CPCNP, para mantener el efecto del tratamiento inicial con quimioterapia y cuya enfermedad no haya empeorado. ALIMTA no está indicado para pacientes que tengan otro tipo de CPCNP, llamado cáncer de células escamosas. ALIMTA puede suprimir la función de la médula ósea, lo que puede provocar un recuento bajo de células sanguíneas. Para obtener más información sobre el perfil de seguridad de ALIMTA, lea la Información importante de seguridad en las páginas 40-44, la Información de prescripción para el paciente y la Información de prescripción, visite www.ALIMTA.com o llame al 1-800-545-5979. Se le recomienda reportar cualquier efecto secundario negativo de los medicamentos de venta bajo receta médica a la Administración de Medicamentos y Alimentos (FDA). Visite www.fda.gov/medwatch o llame al 1-800-FDA-1088. Índice Introducción 2 ¿Qué es ALIMTA® (pemetrexed inyectable)? 3 Histología (tipos de células cancerosas) 4 Su plan de tratamiento 5 Quimioterapia de primera línea 9 ¿Cómo se administra su tratamiento? 11 Efectos secundarios 13 Tratamiento de mantenimiento ALIMTA® (pemetrexed inyectable) puede suprimir la función de la médula ósea, lo que puede provocar un recuento bajo de células sanguíneas. Para obtener más información sobre el perfil de seguridad de ALIMTA, lea la Información importante de seguridad en las páginas 40-44, la Información de prescripción para el paciente y la Información de prescripción, visite www.ALIMTA.com o llame al 1-800-545-5979. 23 ¿Cómo se administra su tratamiento? 25 Efectos secundarios 28 Preguntas frecuentes 38 Su equipo de atención médica 39 Información importante de seguridad sobre ALIMTA 40 Recursos 46 Se le recomienda reportar cualquier efecto secundario negativo de los medicamentos de venta bajo receta médica a la Administración de Medicamentos y Alimentos (FDA). Visite www.fda.gov/medwatch o llame al 1-800-FDA-1088. www.ALIMTA.com 1-800-545-5979 1 Introducción Al igual que muchas personas que viven con cáncer, probablemente se encuentre lidiando con asuntos que nunca antes había enfrentado. Y es normal estar preocupado por los nuevos desafíos que se le presentan. Su médico ha elegido ALIMTA® (pemetrexed inyectable) porque es un tratamiento recetado específicamente para su tipo de cáncer. • Si usted se acaba de enterar de que tiene cáncer de pulmón de células no pequeñas (CPCNP) no escamosas avanzado, puede recibir ALIMTA y cisplatino (otro medicamento de quimioterapia) como tratamiento de primera línea. • Si usted ya recibió quimioterapia de primera línea para su cáncer de pulmón, su médico puede recetarle tratamiento de mantenimiento con ALIMTA. El tratamiento de mantenimiento es la continuación del tratamiento con medicamentos para el cáncer para pacientes cuyo cáncer no se ha expandido o no ha crecido luego del tratamiento de primera línea. Si se encuentra recibiendo tratamiento de primera línea o de mantenimiento, debe saber que su equipo de atención médica está para apoyarlo y debe sentirse cómodo al hablar con ellos. Al trabajar junto a ellos (formular preguntas, hablar sobre los efectos secundarios que pueda experimentar y comprender sus opciones), usted puede ayudar a su equipo a comprender cómo progresa su tratamiento. Esta guía incluye secciones específicas sobre el tratamiento con ALIMTA. Lea las páginas 9-21 (sección azul) para informarse sobre el tratamiento de primera línea con ALIMTA y los posibles efectos secundarios. Para obtener información sobre el tratamiento de mantenimiento con ALIMTA y los efectos secundarios, lea las páginas 23-35 (sección verde). El resto de la guía contiene información para todos los pacientes que están siendo tratados con ALIMTA (páginas 3-7, 37-44), incluidos recursos para pacientes y cuidadores en las páginas 46-47. 2 www.ALIMTA.com ¿Qué es ALIMTA ® (pemetrexed inyectable)? ALIMTA (también conocido como pemetrexed) es un medicamento inyectable de quimioterapia o antineoplásico. La quimioterapia es un tratamiento con uno o más medicamentos que buscan matar las células cancerosas. Se utiliza ALIMTA para tratar un determinado tipo de cáncer de pulmón llamado CPCNP no escamosas avanzado. Explicaremos lo que significa en la próxima sección. ALIMTA parece funcionar al interferir con un proceso muy importante que permite a las células cancerosas reproducirse y expandirse. Para obtener más información sobre el perfil de seguridad de ALIMTA, lea la Información importante de seguridad en las páginas 40-44, la Información de prescripción para el paciente y la Información de prescripción, visite www.ALIMTA.com o llame al 1-800-545-5979. 1-800-545-5979 3 Histología (tipos de células cancerosas) Su plan de tratamiento Los tumores son grupos de células que se dividen más de lo que deberían y no mueren cuando deberían. Los tumores varían en apariencia, tipo de células que los componen y forma de crecer. Estas diferencias permiten a los profesionales de atención médica identificar los tipos de cáncer de pulmón. Las decisiones sobre su tratamiento se deben realizar en función a dicha información. Los tipos de células específicos que componen un tumor se conocen como la histología del tumor. Dentro del cáncer de pulmón de células no pequeñas (CPCNP), los dos grupos principales son el de células no escamosas (que incluye los subtipos adenocarcinoma, carcinoma de células grandes y otros tipos de células) y el carcinoma de células escamosas. Las investigaciones han demostrado que hay una conexión entre la histología y la efectividad de ALIMTA® (pemetrexed inyectable) en el CPCNP. Usted recibe ALIMTA para el tratamiento del tipo de cáncer de pulmón específico que tiene. Antes de comenzar el tratamiento, es importante que haga algunas cosas que lo ayudarán a prepararse para el tratamiento. Si tiene alguna duda sobre la siguiente información de seguridad, asegúrese de preguntarle a su equipo de atención médica. Trabajar con su equipo es muy importante durante el transcurso de su tratamiento. ¿Por qué es importante para usted? Conocer la histología del tumor le ha permitido a su equipo de atención médica ofrecerle un tratamiento indicado específicamente para su tipo de cáncer. Probablemente ya hayan hablado sobre esta información con usted. De lo contrario, no dude en hablar con su oncólogo sobre su tipo histológico específico. Referencia 1. Scagliotti GV, et al. J Clin Oncol. 2008;26(21):3543-3551. ¿Qué debe saber? • Si sabe que es alérgico a ALIMTA, infórmele a su médico ya que no debería recibirlo. • Si cree que está embarazada, planea estarlo, o está amamantando, infórmele a su equipo de atención médica. ALIMTA puede perjudicar a su feto o bebé lactante. Su médico puede indicarle tomar anticonceptivos (control de natalidad) para evitar el embarazo mientras recibe el tratamiento con ALIMTA. • Siete días antes de comenzar a recibir ALIMTA, deberá tomar una tableta de ácido fólico (un tipo de vitamina B) una vez por día para disminuir el riesgo de presentar ciertos efectos secundarios perjudiciales. Su equipo de atención médica le dirá exactamente qué tomar: la cantidad recomendada es de entre 400 y 1000 mcg por día. Seguirá tomando una tableta de ácido fólico por día durante 21 días luego de su última dosis de ALIMTA. (continúa en la página siguiente) Para obtener más información sobre el perfil de seguridad de ALIMTA, lea la Información importante de seguridad en las páginas 40-44, la Información de prescripción para el paciente y la Información de prescripción, visite www.ALIMTA.com o llame al 1-800-545-5979. 4 www.ALIMTA.com 1-800-545-5979 5 Su plan de tratamiento ¿Qué debe saber? (continuación) • Su equipo de atención médica le administrará una inyección (intramuscular) de vitamina B12 una semana antes de comenzar con ALIMTA® (pemetrexed inyectable) para disminuir el riesgo de presentar ciertos efectos secundarios perjudiciales. Posteriormente, su equipo de atención médica le administrará una inyección cada 9 semanas aproximadamente, probablemente el mismo día en que reciba la quimioterapia con ALIMTA, durante el resto de sus ciclos de tratamiento. • Le administrarán un medicamento oral con esteroides llamado corticoesteroide para disminuir el riesgo de presentar efectos secundarios relacionados con la piel (como erupciones). No olvide tomar este medicamento dos veces por día, el día anterior a recibir el tratamiento, el día en que recibe el tratamiento y el día posterior al tratamiento, a menos que su equipo de atención médica le indique lo contrario. Este folleto contiene información adicional importante sobre el perfil de seguridad y los efectos secundarios del tratamiento con ALIMTA que debe conocer. Lea las secciones “Información importante de seguridad sobre ALIMTA” y “Efectos secundarios” de este folleto. • Para ayudar a su equipo de atención médica a supervisar efectivamente su tratamiento, asegúrese de informarle sobre sus condiciones médicas. • Si usted tiene problemas de hígado o riñón, asegúrese de informarle al respecto a su equipo de atención médica. Puede que se deba modificar su dosis de ALIMTA, o que ALIMTA no sea adecuado para usted. • Informe a su equipo de atención médica si está tomando otros medicamentos, incluidos medicamentos recetados o sin receta médica, vitaminas y suplementos herbarios. ALIMTA y otros medicamentos pueden afectarse mutuamente y causar efectos secundarios graves (como erupciones). • Si está tomando medicamentos antinflamatorios no esteroides (un AINE, como el ibuprofeno u otros medicamentos usados para tratar el dolor y la artritis), debe informarle a su equipo de atención médica. Dependiendo de su situación, puede que le soliciten que deje de tomarlos durante un tiempo. Para obtener más información sobre el perfil de seguridad de ALIMTA, lea la Información importante de seguridad en las páginas 40-44, la Información de prescripción para el paciente y la Información de prescripción, visite www.ALIMTA.com o llame al 1-800-545-5979. 6 www.ALIMTA.com 1-800-545-5979 7 Quimioterapia de primera línea para el cáncer de pulmón de células no pequeñas no escamosas avanzado ALIMTA® (pemetrexed inyectable) está aprobado por la FDA en combinación con cisplatino (otro medicamento de quimioterapia) para el tratamiento inicial del cáncer de pulmón de células no pequeñas (CPCNP) no escamosas avanzado, un tipo específico de CPCNP. ALIMTA está aprobado por la FDA para el tratamiento de pacientes con cáncer de pulmón de células no pequeñas (CPCNP) no escamosas avanzado, un tipo especial de CPCNP, para mantener el efecto del tratamiento inicial con quimioterapia y cuya enfermedad no haya empeorado. ALIMTA no está indicado para pacientes que tengan otro tipo de CPCNP, llamado cáncer de células escamosas. ALIMTA puede suprimir la función de la médula ósea, lo que puede provocar un recuento bajo de células sanguíneas. Para obtener más información sobre el perfil de seguridad de ALIMTA, lea la Información importante de seguridad en las páginas 40-44, la Información de prescripción para el paciente y la Información de prescripción, visite www.ALIMTA.com o llame al 1-800-545-5979. 1-800-545-5979 9 ¿Cómo se administra su tratamiento? Si usted se acaba de enterar de que tiene cáncer de pulmón de células no pequeñas (CPCNP) no escamosas avanzado, puede recibir ALIMTA® (pemetrexed inyectable) combinado con cisplatino (otro medicamento de quimioterapia que contiene platino) como quimioterapia de primera línea para tratar su cáncer. La quimioterapia de primera línea es el primer tratamiento que usted recibe para el cáncer luego de haber recibido el diagnóstico. Durante el tratamiento de primera línea, su equipo de atención médica puede hablarle sobre otras opciones de tratamiento, incluso continuar el tratamiento con ALIMTA solo (mantenimiento de continuación) si califica para ello. Solo los profesionales de atención médica le pueden administrar ALIMTA. Su equipo de atención médica preparará ALIMTA ALIMTAen una solución y se ALIMTA mezclándolo lo administrará con una aguja en una vena; esto se conoce como infusión por vía intravenosa (IV). El cisplatino también se le administrará mediante IV. Agente platino— Comenzar tratamiento inicial Elegibilidad para el tratamiento de mantenimiento* Quimioterapia de primera línea Cisplatino El tratamiento de primera línea con ALIMTA más cisplatino se administrará una vez cada 21 días (3 semanas equivalen a un ciclo del tratamiento). Conversación sobre el mantenimiento Administración del tratamiento con ALIMTA más cisplatino minutos ALIMTA Se le administrará cisplatino en una infusión de 2 horas por vía IV. Las siguientes secciones le brindarán Pausa información sobre cómo se de administra el tratamiento de primera línea con ALIMTA más cisplatino y los posibles efectos secundarios que puede experimentar. 30 minutos ALIMTA Platinum Agent— Cisplatin 1st Line ALIMTA Maintenance Tumor Gets Worse† (continúa en la página siguiente) * Hable con su médico para ver si es elegible para el tratamiento de mantenimiento luego de recibir ALIMTA y cisplatino. 10 Se le administrará ALIMTA en una infusión de 10 minutos por vía IV. Luego de ambas infusiones, no recibirá más quimioterapia durante los próximos 21 días. Estos “días de descanso” son normales en el tratamiento con ALIMTA. Conversación sobre el mantenimiento Se le administrará ALIMTA en una infusión de 10 minutos por vía IV. 30 Maintenance Eligibility* Agente platino— Cisplatino Pausa de Start Initial Treatment ALIMTA Elegibilidad para el tratamiento de mantenimiento* Comenzar tratamiento inicial Tratamiento de primera línea y de mantenimiento con ALIMTA Para CPCNP no escamosas avanzado Different Treatme Se le administrará cisplatino en una infusión de 2 horas por vía IV. Para obtener más información sobre el perfil de seguridad de ALIMTA, lea la Información importante de seguridad en las páginas 40-44, la Información de prescripción para el paciente y la Información de prescripción, visite www.ALIMTA.com o llame al 1-800-545-5979. www.ALIMTA.com 1-800-545-5979 2nd Line 11 Quimioterapia de primera línea Quimioterapia de primera línea ¿Cómo se administra su tratamiento? (continuación) Efectos secundarios ¿Qué debería esperar? Como parte del tratamiento, usted también recibirá medicamentos adicionales (entre ellos vitamina B12, ácido fólico y corticoesteroides) para ayudarlo a reducir los efectos secundarios perjudiciales. Le harán análisis de sangre periódicos, antes y durante su tratamiento con ALIMTA® (pemetrexed inyectable). Su médico puede ajustar su dosis de ALIMTA o retrasar el tratamiento según los resultados de sus análisis de sangre y de su estado general, incluidos los efectos secundarios que pueda haber tenido. Su equipo de atención médica puede pedirle que regrese para visitas de seguimiento luego de recibir el tratamiento con ALIMTA para verificar su estado. Es importante hablar sobre cómo se siente y sobre cualquier efecto secundario que pueda experimentar. Su equipo de atención médica necesita esta información para poder monitorear el progreso de su tratamiento. Si tiene preguntas sobre cómo se administra ALIMTA, asegúrese de formulárselas a su equipo de atención médica. Quimioterapia Los efectos secundarios de la quimioterapia son diferentes según el tipo de cáncer que tenga y la combinación de medicamentos que se le administren. Los efectos secundarios también pueden variar según el paciente y según el tratamiento. En esta sección se explican los efectos secundarios más frecuentes y graves que los pacientes experimentaron en los estudios clínicos que estudiaron el tratamiento con ALIMTA más cisplatino para el cáncer de pulmón de células no pequeñas (CPCNP) avanzado. Tanto usted como su equipo de atención médica deben estar atentos a los efectos secundarios de la quimioterapia. Algunos ejemplos son fatiga (cansancio), náuseas y vómitos. Otro tipo de efectos secundarios, como el cambio en el recuento de células sanguíneas, son monitoreados mediante exámenes de sangre periódicos, pero también se pueden identificar mediante los signos y síntomas que usted pueda percibir. Hablaremos sobre algunos de ellos en las siguientes páginas. Los efectos secundarios pueden ser graves, pero la mayoría pueden ser tratados. Aunque algunos efectos secundarios pueden ser permanentes, muchos duran solo un breve tiempo y desaparecen después de disminuir la dosis o suspender el tratamiento. Se le recomienda reportar cualquier efecto secundario negativo de los medicamentos de venta bajo receta médica a la Administración de Medicamentos y Alimentos (FDA). Visite www.fda.gov/medwatch o llame al 1-800-FDA-1088. (continúa en la página siguiente) Para obtener más información sobre el perfil de seguridad de ALIMTA, lea la Información importante de seguridad en las páginas 40-44, la Información de prescripción para el paciente y la Información de prescripción, visite www.ALIMTA.com o llame al 1-800-545-5979. 12 www.ALIMTA.com 1-800-545-5979 13 Quimioterapia de primera línea Efectos secundarios ¿Qué debería esperar? (continuación) ALIMTA® (pemetrexed inyectable) en combinación con cisplatino La mayoría de los pacientes que utilizan ALIMTA más cisplatino experimentará efectos secundarios. A los efectos del presente folleto, explicaremos algunos de los efectos secundarios más frecuentes y/o graves que puede experimentar si recibe tratamiento de primera línea con ALIMTA más cisplatino para el cáncer de pulmón de células no pequeñas (CPCNP) no escamosas avanzado. No siempre es posible saber si es ALIMTA, el cisplatino, otro medicamento o el cáncer mismo el que causa estos efectos secundarios. Informe siempre a su equipo de atención médica si experimenta algo nuevo. Llame a su equipo de atención médica de inmediato si tiene fiebre, escalofríos, diarrea o úlceras orales. Estos síntomas podrían provenir de una infección que puede ser grave y llevarlo a la muerte. Para obtener más información sobre todos estos efectos secundarios observados en el estudio clínico del tratamiento del CPCNP avanzado con ALIMTA más cisplatino, hable con su equipo de atención médica, lea la Información de prescripción para el paciente y la Información de prescripción que acompaña a este folleto, visite www.ALIMTA.com o llame al 1-800-545-5979. Efectos secundarios que usted y su equipo de atención médica deberían observar Antes y durante el tratamiento con ALIMTA más cisplatino, usted se realizará exámenes de sangre para que su equipo de atención médica pueda observar si hay recuentos bajos de células sanguíneas. También puede tener otros síntomas que debe informar a su equipo de atención médica. En las próximas secciones se describen algunos de estos efectos secundarios y síntomas. Los efectos secundarios del tratamiento de primera línea con ALIMTA más cisplatino se evaluaron en un estudio clínico. En las siguientes secciones se presentan los efectos secundarios frecuentes y/o graves de dicho estudio. Recuento bajo de glóbulos blancos (neutropenia/leucopenia) Los glóbulos blancos (leucocitos) ayudan a combatir las infecciones. El recuento bajo de glóbulos blancos se llama leucopenia. Los neutrófilos son un tipo de glóbulo blanco, y cuando el recuento es bajo, el paciente tiene neutropenia. En este caso es probable desarrollar una infección, por lo que se deberían evitar los lugares llenos de gente y estar con personas resfriadas. Debe llamar a su equipo de atención médica de inmediato si tiene signos de infección, como escalofríos o temperatura mayor a 100.4°F. En el estudio clínico del tratamiento de primera línea, el 29% de los pacientes tratados con ALIMTA más cisplatino tuvo neutropenia y el 18% experimentó leucopenia. (continúa en la página siguiente) Se le recomienda reportar cualquier efecto secundario negativo de los medicamentos de venta bajo receta médica a la Administración de Medicamentos y Alimentos (FDA). Visite www.fda.gov/medwatch o llame al 1-800-FDA-1088. Para obtener más información sobre el perfil de seguridad de ALIMTA, lea la Información importante de seguridad en las páginas 40-44, la Información de prescripción para el paciente y la Información de prescripción, visite www.ALIMTA.com o llame al 1-800-545-5979. 14 www.ALIMTA.com 1-800-545-5979 15 Quimioterapia de primera línea Efectos secundarios que usted y su equipo de atención médica deberían observar (continuación) Recuento bajo de glóbulos rojos (anemia) Los glóbulos rojos ayudan a transportar oxígeno de los pulmones a otras partes del cuerpo. El recuento bajo de glóbulos rojos se llama anemia. Si su recuento de glóbulos rojos es bajo, puede sentirse cansado, cansarse fácilmente, tener un aspecto pálido y tener dificultades para respirar. En el estudio clínico del tratamiento de primera línea, el 33% de los pacientes tratados con ALIMTA® (pemetrexed inyectable) más cisplatino tuvo anemia. Recuento bajo de plaquetas (trombocitopenia) Las plaquetas ayudan a coagular la sangre. Un recuento bajo de plaquetas lo expone a un mayor riesgo de sangrado. Si su equipo de atención médica le dice que tiene un recuento bajo de plaquetas, puede que le solicite tomar algunas precauciones, entre ellas evitar lastimarse, evitar el estreñimiento, usar un cepillo de dientes de cerdas suaves, etc. Es importante que llame a su equipo de atención médica si identifica señales de sangrado, como por ejemplo, hematomas sin explicación o sangre en sus heces (heces negras, alquitranadas). Otros efectos secundarios a los que debe estar atento Fiebre La fiebre puede ser el primer síntoma de infección. Hay medicamentos que pueden bajar la fiebre, que se pueden administrar junto con la quimioterapia. Si tiene una temperatura de 100.4°F o más, debe llamar a su equipo de atención médica de inmediato. Cansancio (fatiga) Si experimenta cansancio o fatiga, algunas ideas para contrarrestarlo incluyen equilibrar sus periodos de actividad con descanso, aumentar la ingesta de fluidos y seguir una dieta bien balanceada. En el estudio clínico del tratamiento de primera línea, el 43% de los pacientes tratados con ALIMTA más cisplatino experimentó algún grado de fatiga. Malestar gastrointestinal (GI) Asegúrese de hablar con su equipo de atención médica si nota alguno de los siguientes efectos secundarios o algo diferente en la forma en que se siente: • Náuseas y/o vómitos Es importante que le informe a su equipo de atención médica si tiene náuseas o vómitos. Existen medicamentos que pueden ayudarlo a prevenir y tratar las náuseas y vómitos. En el estudio clínico del tratamiento de primera línea, el 10% de los pacientes tratados con ALIMTA más cisplatino tuvo un recuento bajo de plaquetas. Se le recomienda reportar cualquier efecto secundario negativo de los medicamentos de venta bajo receta médica a la Administración de Medicamentos y Alimentos (FDA). Visite www.fda.gov/medwatch o llame al 1-800-FDA-1088. 16 www.ALIMTA.com (continúa en la página siguiente) Para obtener más información sobre el perfil de seguridad de ALIMTA, lea la Información importante de seguridad en las páginas 40-44, la Información de prescripción para el paciente y la Información de prescripción, visite www.ALIMTA.com o llame al 1-800-545-5979. 1-800-545-5979 17 Quimioterapia de primera línea Úlceras en la boca, garganta, labios o esófago (estomatitis, faringitis, esofagitis) Otros efectos secundarios a los que debe estar atento (continuación) Puede aparecer enrojecimiento o úlceras en la boca, la garganta o los labios unos días después del tratamiento. También puede sentir dolor o tener dificultad al beber o tragar alimentos. Hable con su equipo de atención médica sobre los cuidados adecuados para la boca, los labios y la garganta si tiene alguno de estos síntomas. En el estudio clínico del tratamiento de primera línea, el 56% de los pacientes tratados con ALIMTA® (pemetrexed inyectable) más cisplatino tuvo algún grado de náuseas y el 40% tuvo vómitos. • Pérdida del apetito (anorexia) Si experimenta pérdida del apetito, asegúrese de informarle al respecto a su equipo de atención médica. Además, el Instituto Nacional del Cáncer cuenta con un folleto útil titulado Eating Hints (Sugerencias de alimentación), que puede obtener llamando al 1-800-4-CANCER (1-800-422-6237) o visitando el sitio web del NCI, www.cancer.gov. En el estudio clínico del tratamiento de primera línea, el 27% de los pacientes tratados con ALIMTA más cisplatino experimentó pérdida del apetito. • Estreñimiento Su equipo de atención médica puede ayudarlo a tratar el estreñimiento. Es importante que hable con ellos antes de tomar laxantes o ablandadores de heces sin receta. En el estudio clínico del tratamiento de primera línea, el 21% de los pacientes tratados con ALIMTA más cisplatino tuvo estreñimiento. • Diarrea Infórmele a su equipo de atención médica si tiene diarrea. Es muy importante que hable con ellos antes de tomar medicamentos sin receta para la diarrea. En el estudio clínico del tratamiento de primera línea, el 14% de los pacientes tratados con ALIMTA más cisplatino presentó enrojecimiento o úlceras en la boca, la garganta o los labios. Caída del cabello (alopecia) La caída del cabello por lo general no es permanente. Hable con su equipo de atención médica sobre la caída de cabello que pueda sufrir. En el estudio clínico del tratamiento de primera línea, el 12% de los pacientes tratados con ALIMTA más cisplatino experimentó algún grado de alopecia. Daño neurológico (neuropatía) Los síntomas de la neuropatía pueden incluir debilidad, dolor, sensación de cosquilleo y/o adormecimiento, en especial en los pies y las puntas de los dedos. En el estudio clínico del tratamiento de primera línea, el 9% de los pacientes tratados con ALIMTA más cisplatino experimentó algún tipo de daño neurológico. Se le recomienda reportar cualquier efecto secundario negativo de los medicamentos de venta bajo receta médica a la Administración de Medicamentos y Alimentos (FDA). Visite www.fda.gov/medwatch o llame al 1-800-FDA-1088. En el estudio clínico del tratamiento de primera línea, el 12% de los pacientes tratados con ALIMTA más cisplatino tuvo diarrea. (continúa en la página siguiente) Para obtener más información sobre el perfil de seguridad de ALIMTA, lea la Información importante de seguridad en las páginas 40-44, la Información de prescripción para el paciente y la Información de prescripción, visite www.ALIMTA.com o llame al 1-800-545-5979. 18 www.ALIMTA.com 1-800-545-5979 19 Quimioterapia de primera línea Otros efectos secundarios a los que debe estar atento (continuación) Erupción Puede sufrir erupciones o picazón durante el tratamiento. Estas reacciones normalmente aparecen entre cada tratamiento con ALIMTA® (pemetrexed inyectable) y por lo general desaparecen antes del próximo tratamiento. Las reacciones o erupciones de la piel que incluyen ampollas o descamación pueden ser severas y podrían ocasionar la muerte. Llame a su médico si usted tiene alguno de estos síntomas. Antes de comenzar el tratamiento con ALIMTA, su equipo de atención médica le dará un medicamento (esteroide) para ayudarlo a reducir este efecto secundario. En el estudio clínico del tratamiento de primera línea, el 7% de los pacientes tratados con ALIMTA más cisplatino tuvo erupciones. Los efectos secundarios pueden o no ser causados por el tratamiento mismo con el medicamento; algunos efectos pueden deberse a la enfermedad u otras razones. Póngase en contacto con su equipo de atención médica de inmediato si tiene fiebre, escalofríos, diarrea o úlceras orales. Estos síntomas podrían provenir de una infección que puede ser grave y llevarlo a la muerte. Hable con su equipo de atención médica si tiene algún efecto secundario que le preocupa o no desaparece. Para obtener más información sobre todos estos efectos secundarios observados en el estudio clínico del tratamiento del cáncer de pulmón de células no pequeñas (CPCNP) avanzado con ALIMTA más cisplatino, hable con su equipo de atención médica, lea la Información de prescripción para el paciente y la Información de prescripción que acompaña a este folleto, visite www.ALIMTA.com o llame al 1-800-545-5979. Se le recomienda reportar cualquier efecto secundario negativo de los medicamentos de venta bajo receta médica a la Administración de Medicamentos y Alimentos (FDA). Visite www.fda.gov/medwatch o llame al 1-800-FDA-1088. Retraso y suspensión del medicamento Le harán análisis de sangre periódicos, antes y durante su tratamiento con ALIMTA más cisplatino. Su equipo de atención médica puede cambiar su dosis de ALIMTA o suspender el tratamiento durante un tiempo según los resultados de sus exámenes de sangre o su estado general. Para obtener más información sobre el perfil de seguridad de ALIMTA, lea la Información importante de seguridad en las páginas 40-44, la Información de prescripción para el paciente y la Información de prescripción, visite www.ALIMTA.com o llame al 1-800-545-5979. 20 www.ALIMTA.com 1-800-545-5979 21 Tratamiento de mantenimiento para el cáncer de pulmón de células no pequeñas no escamosas avanzado ALIMTA® (pemetrexed inyectable) está aprobado por la FDA para el tratamiento de pacientes con cáncer de pulmón de células no pequeñas (CPCNP) no escamosas avanzado, un tipo especial de CPCNP, para mantener el efecto del tratamiento inicial con quimioterapia y cuya enfermedad no haya empeorado. ALIMTA no está indicado para pacientes que tengan otro tipo de CPCNP, llamado cáncer de células escamosas. ALIMTA puede suprimir la función de la médula ósea, lo que puede provocar un recuento bajo de células sanguíneas. Para obtener más información sobre el perfil de seguridad de ALIMTA, lea la Información importante de seguridad en las páginas 40-44, la Información de prescripción para el paciente y la Información de prescripción, visite www.ALIMTA.com o llame al 1-800-545-5979. 1-800-545-5979 23 En un estudio clínico grande, las personas con el tipo de cáncer que usted tiene (cáncer de pulmón de células no pequeñas (CPCNP) no escamosas avanzado), que comenzaron el tratamiento con ALIMTA más cisplatino y continuaron con ALIMTA solo, tuvieron un retraso en el crecimiento de su cáncer y vivieron más en comparación con las personas que no continuaron con la quimioterapia de mantenimiento. Hable con su médico para ver si usted es elegible para el tratamiento de mantenimiento luego de recibir ALIMTA y cisplatino. ALIMTA Tumor Gets Worse† ALIMTA Maintenance Eligibility* Luego del tratamiento de primera línea, si usted recibió ALIMTA® (pemetrexed inyectable) más cisplatino u otro tipo de quimioterapia, su médico puede recetarle ALIMTA solo como tratamiento de mantenimiento. El tratamiento de mantenimiento es la continuación del tratamiento con medicamentos para el cáncer después del tratamiento de primera línea, si su cáncer no se ha expandido o no ha crecido. Las siguientes secciones le brindarán información sobre cómo se administra el tratamiento de mantenimiento con ALIMTA y los posibles efectos secundarios que puede experimentar. Start Initial Treatment Tratamiento de mantenimiento Different Treatment ¿Cómo se administra su tratamiento? Platinum Agent— Cisplatin Solo los profesionales de atención médica le pueden administrar ALIMTA. Su equipo de atención médica preparará ALIMTA mezclándolo en una solución y se lo administrará con una aguja en 1st Line Maintenance 2nd Line una vena; esto se conoce como infusión por vía intravenosa (IV). Luego del tratamiento de primera línea, el tratamiento de mantenimiento con ALIMTA solo se administrará una vez cada 21 días (3 semanas equivalen a un ciclo del tratamiento). Administración del tratamiento con ALIMTA ALIMTA Agente platino— Cisplatino Elegibilidad para el tratamiento de mantenimiento* Comenzar tratamiento inicial Tratamiento de primera línea y de mantenimiento con ALIMTA Para CPCNP no escamosas avanzado Se le administrará ALIMTA en una infusión de 10 minutos por vía IV. ALIMTA Luego de esta infusión, no recibirá más quimioterapia durante los próximos 21 días. Estos “días de descanso” son habituales en el tratamiento con ALIMTA. Your second-line therapy and Información importante de how it’s given seguridad seleccionada If your cancer has gotten worse after initially being treated by another chemotherapy drug, second-line treatment with ALIMTA by itself will be given usually once every 21 days (3 weeks equals 1 treatment cycle). How your treatment will be administered: Si sabe que es alérgico a ALIMTA (pemetrexed inyectable), infórmele a su médico de inmediato ya que no debería recibirlo. Conversación sobre el mantenimiento (continúa en la página siguiente) * Hable con su médico para ver si usted es elegible para el tratamiento de mantenimiento luego de recibir ALIMTA y cisplatino. Para obtener más información sobre el perfil de Pausa seguridad de de ALIMTA, lea la Información importante de seguridad en las páginas 40-44, la Información de prescripción para el paciente y la Información de prescripción, visite www.ALIMTA.com o llame al 1-800-545-5979. 30 ALIMTA will be given to you as a 10-minute After this infusion, you won’t be given any intravenous (IV) infusion more chemotherapy for the next 21 days. Referencias “rest days” a normal part of your 1. ALIMTA (pemetrexed inyectable) [prospecto].These Indianápolis, IN: are Eli Lilly treatment with ALIMTA and Company; 2013. 2. Paz-Ares LG, et al. J Clin Oncol. 2013;31(23):2895-2902. minutos 24 Se le administrará ALIMTA en una infusión de 10 minutos por vía IV. www.ALIMTA.com Se le administrará cisplatino en una infusión de 2 horas por vía IV. 1-800-545-5979 25 Tratamiento de mantenimiento ¿Cómo se administra su tratamiento? (continuación) Como parte del tratamiento, usted también recibirá medicamentos adicionales (entre ellos vitamina B12, ácido fólico y corticoesteroides) para ayudarlo a reducir los efectos secundarios perjudiciales. Le harán análisis de sangre periódicos, antes y durante su tratamiento con ALIMTA® (pemetrexed inyectable). Su médico puede ajustar su dosis de ALIMTA o retrasar el tratamiento según los resultados de sus análisis de sangre y de su estado general, incluidos los efectos secundarios que pueda haber tenido. Su equipo de atención médica puede pedirle que regrese para visitas de seguimiento luego de recibir el tratamiento con ALIMTA para verificar su estado. Es importante hablar sobre cómo se siente y sobre cualquier efecto secundario que pueda experimentar. Su equipo de atención médica necesita esta información para poder monitorear el progreso de su tratamiento. Si tiene preguntas sobre cómo se administra ALIMTA, asegúrese de formulárselas a su equipo de atención médica. Para obtener más información sobre el perfil de seguridad de ALIMTA, lea la Información importante de seguridad en las páginas 40-44, la Información de prescripción para el paciente y la Información de prescripción, visite www.ALIMTA.com o llame al 1-800-545-5979. 26 www.ALIMTA.com Tratamiento de mantenimiento Efectos secundarios ¿Qué debería esperar? Quimioterapia Los efectos secundarios de la quimioterapia son diferentes según el tipo de cáncer que tenga y la combinación de medicamentos que se le administren. Los efectos secundarios también pueden variar según el paciente y según el tratamiento. En esta sección se explican los efectos secundarios más frecuentes y graves que los pacientes experimentaron en los estudios clínicos que estudiaron el tratamiento con ALIMTA® (pemetrexed inyectable) para el cáncer de pulmón de células no pequeñas (CPCNP) avanzado. Tanto usted como su equipo de atención médica deben estar atentos a los efectos secundarios de la quimioterapia. Algunos ejemplos son fatiga (cansancio), náuseas y vómitos. Otro tipo de efectos secundarios, como el cambio en el recuento de células sanguíneas, son monitoreados mediante exámenes de sangre periódicos, pero también se pueden identificar mediante los signos y síntomas que usted pueda percibir. Hablaremos sobre algunos de ellos en las siguientes páginas. Los efectos secundarios pueden ser graves, pero la mayoría pueden ser tratados. Aunque algunos efectos secundarios pueden ser permanentes, muchos duran solo un breve tiempo y desaparecen después de disminuir la dosis o suspender el tratamiento. ALIMTA® (pemetrexed inyectable) como agente único (solo) La mayoría de los pacientes que utilizan ALIMTA experimentará efectos secundarios. A los efectos del presente folleto, explicaremos algunos de los efectos secundarios más frecuentes y/o graves que puede experimentar si recibe ALIMTA solo para el tratamiento del cáncer de pulmón de células no pequeñas (CPCNP) no escamosas avanzado para mantener los efectos del tratamiento inicial. No siempre es posible saber si es ALIMTA, otro medicamento o el cáncer mismo el que causa estos efectos secundarios. Informe siempre a su equipo de atención médica si experimenta algo nuevo. Llame a su equipo de atención médica de inmediato si tiene fiebre, escalofríos, diarrea o úlceras orales. Estos síntomas podrían provenir de una infección que puede ser grave y llevarlo a la muerte. Para obtener más información sobre todos estos efectos secundarios observados en los estudios clínicos del tratamiento del CPCNP avanzado con ALIMTA como agente único, hable con su equipo de atención médica, lea la Información de prescripción para el paciente y la Información de prescripción que acompaña a este folleto, visite www.ALIMTA.com o llame al 1-800-545-5979. Se le recomienda reportar cualquier efecto secundario negativo de los medicamentos de venta bajo receta médica a la Administración de Medicamentos y Alimentos (FDA). Visite www.fda.gov/medwatch o llame al 1-800-FDA-1088. Para obtener más información sobre el perfil de seguridad de ALIMTA, lea la Información importante de seguridad en las páginas 40-44, la Información de prescripción para el paciente y la Información de prescripción, visite www.ALIMTA.com o llame al 1-800-545-5979. 28 www.ALIMTA.com 1-800-545-5979 29 Tratamiento de mantenimiento En el segundo estudio de mantenimiento, el 9% de los pacientes tratados con ALIMTA tuvo neutropenia. Efectos secundarios que usted y su equipo de atención médica deberían observar Recuento bajo de glóbulos rojos (anemia) Antes y durante el tratamiento con ALIMTA® (pemetrexed inyectable), a usted se le realizarán exámenes de sangre para que su equipo de atención médica pueda observar si hay recuentos bajos de células sanguíneas. También puede tener otros síntomas que debe informar a su equipo de atención médica. En las próximas secciones se describen algunos de estos efectos secundarios y síntomas. Se realizaron dos estudios clínicos para estudiar el tratamiento de mantenimiento con ALIMTA. En las siguientes secciones se presentan los efectos secundarios frecuentes y/o graves de ambos estudios. Recuento bajo de glóbulos blancos (neutropenia/leucopenia) En el primer estudio de mantenimiento, el 15% de los pacientes tratados con ALIMTA tuvo anemia. En el segundo estudio de mantenimiento, el 15% de los pacientes tratados con ALIMTA tuvo anemia. Se le recomienda reportar cualquier efecto secundario negativo de los medicamentos de venta bajo receta médica a la Administración de Medicamentos y Alimentos (FDA). Visite www.fda.gov/medwatch o llame al 1-800-FDA-1088. (continúa en la página siguiente) Los glóbulos blancos (leucocitos) ayudan a combatir las infecciones. El recuento bajo de glóbulos blancos se llama leucopenia. Los neutrófilos son un tipo de glóbulo blanco, y cuando el recuento es bajo, el paciente tiene neutropenia. En este caso es probable desarrollar una infección, por lo que se deberían evitar los lugares llenos de gente y estar con personas resfriadas. Debe llamar a su equipo de atención médica de inmediato si tiene signos de infección, como escalofríos o temperatura mayor a 100.4°F. En el primer estudio de mantenimiento, el 6% de los pacientes tratados con ALIMTA tuvo neutropenia y el 6% experimentó leucopenia. Para obtener más información sobre el perfil de seguridad de ALIMTA, lea la Información importante de seguridad en las páginas 40-44, la Información de prescripción para el paciente y la Información de prescripción, visite www.ALIMTA.com o llame al 1-800-545-5979. 30 Los glóbulos rojos ayudan a transportar oxígeno de los pulmones a otras partes del cuerpo. El recuento bajo de glóbulos rojos se llama anemia. Si su recuento de glóbulos rojos es bajo, puede sentirse cansado, cansarse fácilmente, tener un aspecto pálido y tener dificultades para respirar. www.ALIMTA.com Tratamiento de mantenimiento Efectos secundarios que usted y su equipo de atención médica deberían observar (continuación) Recuento bajo de plaquetas (trombocitopenia) Las plaquetas ayudan a coagular la sangre. Un recuento bajo de plaquetas lo expone a un mayor riesgo de sangrado. Si su equipo de atención médica le dice que tiene un recuento bajo de plaquetas, puede que le solicite tomar algunas precauciones, entre ellas evitar lastimarse, evitar el estreñimiento, usar un cepillo de dientes de cerdas suaves, etc. Es importante que llame a su equipo de atención médica si identifica señales de sangrado, como por ejemplo, hematomas sin explicación o sangre en sus heces (heces negras, alquitranadas). En ambos estudios de mantenimiento, menos del 5% de los pacientes tratados con ALIMTA® (pemetrexed inyectable) tuvo un recuento bajo de plaquetas. Se le recomienda reportar cualquier efecto secundario negativo de los medicamentos de venta bajo receta médica a la Administración de Medicamentos y Alimentos (FDA). Visite www.fda.gov/medwatch o llame al 1-800-FDA-1088. Otros efectos secundarios a los que debe estar atento Cansancio (fatiga) Si experimenta cansancio o fatiga, algunas ideas para contrarrestarlo incluyen equilibrar sus periodos de actividad con descanso, aumentar la ingesta de fluidos y seguir una dieta bien balanceada. En el primer estudio de mantenimiento, el 25% de los pacientes tratados con ALIMTA experimentó fatiga. En el segundo estudio de mantenimiento, el 18% de los pacientes tratados con ALIMTA experimentó fatiga. Malestar gastrointestinal (GI) Asegúrese de hablar con su equipo de atención médica si nota alguno de los siguientes efectos secundarios o algo diferente en la forma en que se siente: • Náuseas y/o vómitos Es importante que le informe a su equipo de atención médica si tiene náuseas o vómitos. Existen medicamentos que pueden ayudarlo a prevenir y tratar las náuseas y vómitos. En el primer estudio de mantenimiento, el 19% de los pacientes tratados con ALIMTA tuvo algún grado de náuseas y el 9% experimentó vómitos. En el segundo estudio de mantenimiento, el 12% de los pacientes tratados con ALIMTA tuvo algún grado de náuseas y el 6% experimentó vómitos. (continúa en la página siguiente) Para obtener más información sobre el perfil de seguridad de ALIMTA, lea la Información importante de seguridad en las páginas 40-44, la Información de prescripción para el paciente y la Información de prescripción, visite www.ALIMTA.com o llame al 1-800-545-5979. 32 www.ALIMTA.com 1-800-545-5979 33 Tratamiento de mantenimiento Otros efectos secundarios a los que debe estar atento (continuación) • Pérdida del apetito (anorexia) Si experimenta pérdida del apetito, asegúrese de informarle al respecto a su equipo de atención médica. Además, el Instituto Nacional del Cáncer cuenta con un folleto útil titulado Eating Hints (Sugerencias de alimentación), que puede obtener llamando al 1-800-4-CANCER (1-800-422-6237) o visitando el sitio web del NCI, www.cancer.gov. En el primer estudio de mantenimiento, el 19% de los pacientes tratados con ALIMTA® (pemetrexed inyectable) experimentó pérdida del apetito. En el segundo estudio de mantenimiento, menos del 5% de los pacientes tratados con ALIMTA tuvo pérdida del apetito. • Diarrea Infórmele a su equipo de atención médica si tiene diarrea. Es muy importante que hable con ellos antes de tomar medicamentos sin receta para la diarrea. En el primer estudio de mantenimiento, el 5% de los pacientes tratados con ALIMTA tuvo diarrea. En el segundo estudio de mantenimiento, menos del 5% de los pacientes tratados con ALIMTA tuvo diarrea. Erupción Puede sufrir erupciones o picazón durante el tratamiento. Estas reacciones suelen aparecer entre cada tratamiento con ALIMTA y por lo general desaparecen antes del próximo tratamiento. Las reacciones Para obtener más información sobre el perfil de seguridad de ALIMTA, lea la Información importante de seguridad en las páginas 40-44, la Información de prescripción para el paciente y la Información de prescripción, visite www.ALIMTA.com o llame al 1-800-545-5979. 34 www.ALIMTA.com o erupciones de la piel que incluyen ampollas o descamación pueden ser severas y podrían ocasionar la muerte. Llame a su médico si usted tiene alguno de estos síntomas. Antes de comenzar el tratamiento con ALIMTA, su equipo de atención médica le dará un medicamento (esteroide) para ayudarlo a reducir este efecto secundario. En el primer estudio de mantenimiento, el 10% de los pacientes tratados con ALIMTA tuvo erupciones. En el segundo estudio de mantenimiento, menos del 5% de los pacientes tratados con ALIMTA tuvo erupciones. Retraso y suspensión del medicamento Le harán análisis de sangre periódicos, antes y durante su tratamiento con ALIMTA. Su equipo de atención médica puede cambiar su dosis de ALIMTA o suspender el tratamiento durante un tiempo según los resultados de sus exámenes de sangre o su estado general. Los efectos secundarios pueden o no ser causados por el tratamiento mismo con el medicamento; algunos efectos pueden deberse a la enfermedad u otras razones. Póngase en contacto con su equipo de atención médica de inmediato si tiene fiebre, escalofríos, diarrea o úlceras orales. Estos síntomas podrían provenir de una infección que puede ser grave y llevarlo a la muerte. Hable con su equipo de atención médica si tiene algún efecto secundario que le preocupa o no desaparece. Para obtener más información sobre todos estos efectos secundarios observados en los estudios clínicos del tratamiento del cáncer de pulmón de células no pequeñas (CPCNP) avanzado con ALIMTA como agente único, hable con su equipo de atención médica, lea la Información de prescripción para el paciente y la Información de prescripción que acompaña a este folleto, visite www.ALIMTA.com o llame al 1-800-545-5979. Se le recomienda reportar cualquier efecto secundario negativo de los medicamentos de venta bajo receta médica a la Administración de Medicamentos y Alimentos (FDA). Visite www.fda.gov/medwatch o llame al 1-800-FDA-1088. 1-800-545-5979 35 Preguntas frecuentes Su equipo de atención médica Información importante de seguridad sobre ALIMTA® (pemetrexed inyectable) Recursos Para obtener más información sobre el perfil de seguridad de ALIMTA, lea la Información importante de seguridad en las páginas 40-44, la Información de prescripción para el paciente y la Información de prescripción, visite www.ALIMTA.com o llame al 1-800-545-5979. 1-800-545-5979 37 Su equipo de atención médica ¿Cuándo debería llamarlos? Probablemente esté atento a los cambios en su cuerpo más que nunca. Nunca tome por sentado ninguno de los cambios que sienta. Al vivir con cáncer, debe sentirse lo mejor posible para continuar con los desafíos de su vida diaria, pero siempre debe estar atento a las infecciones. Si sospecha que tiene una infección de algún tipo, llame a su equipo de atención médica de inmediato. También debe llamar a su equipo de atención médica de inmediato si nota algún otro cambio en su cuerpo o experimenta alguno de los síntomas que se muestran más abajo durante el tratamiento de quimioterapia. Ellos le dirán qué hacer o decidirán si debe ir a la sala de emergencias. Preguntas frecuentes ¿Por qué son tan importantes el ácido fólico y la vitamina B12? Es muy importante tomar ácido fólico y vitamina B12 tal como lo receta su equipo de atención médica para reducir las posibilidades de sufrir efectos secundarios perjudiciales. ¿Dónde obtengo más información sobre los efectos secundarios? Para obtener más información sobre todos estos efectos secundarios observados en los estudios clínicos del tratamiento con ALIMTA® (pemetrexed inyectable) como agente único o en combinación con cisplatino, hable con su equipo de atención médica, lea la Información de prescripción para el paciente y la Información de prescripción que acompaña a este folleto, visite www.ALIMTA.com o llame al 1-800-545-5979. Para obtener más información sobre el perfil de seguridad de ALIMTA, lea la Información importante de seguridad en las páginas 40-44, la Información de prescripción para el paciente y la Información de prescripción, visite www.ALIMTA.com o llame al 1-800-545-5979. 38 www.ALIMTA.com • Temperatura por encima de los 101°F en una ocasión o temperatura por encima de los 100.4°F durante más de una hora • Confusión o cambios en el estado mental, incluidas alucinaciones • Dificultad para respirar • Una nueva erupción • Problemas para tragar, babeo, o hinchazón facial, de cuello o lengua • Aumento del dolor • Dolor de cabeza • Dolor abdominal • Estreñimiento o diarrea incontrolable • Náuseas y/o vómitos incontrolables • Sangrado • Piernas o brazos hinchados Referencia 1. Red Nacional de Centros Oncológicos Integrales. Cuándo ir a la sala de emergencias. http://www.nccn.org/patients/resources/life_with_cancer/managing_ symptoms/emergency_room.aspx. Acceso del 4 de febrero de 2015. 1-800-545-5979 39 Información importante de seguridad sobre ALIMTA (pemetrexed inyectable) • Su médico le recetará un medicamento llamado “corticoesteroide” que debe tomar el día anterior a recibir el tratamiento, el día en que recibe el tratamiento y el día posterior al tratamiento de ALIMTA para reducir las erupciones. ¿Qué es lo más importante que debo saber sobre ALIMTA? Le harán análisis de sangre periódicos, antes y durante su tratamiento con ALIMTA. Su médico puede ajustar la dosis de ALIMTA o retrasar el tratamiento según los resultados de sus exámenes de sangre y de su estado general. ® ALIMTA puede suprimir la función de la médula ósea, lo que puede provocar un recuento bajo de células sanguíneas. ALIMTA puede no ser adecuado para algunos pacientes. Si es alérgico a ALIMTA, infórmele a su médico ya que no debería recibirlo. Si usted tiene problemas de hígado o riñón, asegúrese de informarle a su médico. Puede que se deba modificar su dosis de ALIMTA, o que ALIMTA no sea adecuado para usted. Es muy importante tomar los siguientes medicamentos antes y durante su tratamiento con ALIMTA para reducir las posibilidades de sufrir efectos secundarios perjudiciales: • Debe tomar ácido fólico todos los días por vía oral comenzando 7 días antes de su primera dosis de ALIMTA. Usted debe seguir tomando ácido fólico todos los días mientras dure el tratamiento con ALIMTA, y durante 21 días luego de recibir su última dosis de ALIMTA. ¿Qué le debería decir a mi médico antes de utilizar ALIMTA? Si cree que está embarazada, planea estarlo, o está amamantando, infórmele a su equipo de atención médica. ALIMTA puede perjudicar a su feto o bebé lactante. Su médico puede aconsejarle tomar anticonceptivos efectivos (control de natalidad) para evitar el embarazo mientras recibe el tratamiento con ALIMTA. Informe a su médico si está tomando otros medicamentos, incluidos medicamentos recetados o sin receta médica, vitaminas y suplementos herbarios. ALIMTA y otros medicamentos pueden afectarse mutuamente y causar efectos secundarios graves. En particular, informe a su médico si está tomando medicamentos denominados “fármacos antinflamatorios no esteroides” (AINES) para el dolor o la hinchazón. (continúa en la página siguiente) • Su médico le dará las inyecciones de vitamina B12 mientras recibe tratamiento con ALIMTA. Recibirá su primera inyección de vitamina B12 una semana antes de su primera dosis de ALIMTA, y luego aproximadamente cada 9 semanas durante el tratamiento. Para obtener más información sobre el perfil de seguridad de ALIMTA, lea la Información de prescripción para el paciente y la Información de prescripción, visite www.ALIMTA.com o llame al 1-800-545-5979. 40 www.ALIMTA.com 1-800-545-5979 41 Información importante de seguridad sobre ALIMTA (pemetrexed inyectable) (continuación) ® – Bajo nivel de plaquetas. Un nivel bajo de plaquetas produce una mayor probabilidad de hemorragia. Su médico le realizará análisis de sangre para ver sus recuentos sanguíneos antes y durante el tratamiento con ALIMTA. ¿Cuáles son los posibles efectos secundarios de ALIMTA? • Cansancio. Puede sentirse cansado o débil durante algunos días después del tratamiento con ALIMTA. Si usted sufre debilidad o cansancio intenso, llame a su médico. La mayoría de los pacientes que utilizan ALIMTA experimentará efectos secundarios. No siempre es posible saber si ALIMTA, otro medicamento o el cáncer en sí mismo están provocando estos efectos secundarios. • Enrojecimiento o úlceras en la boca, la garganta, los labios o el tubo que conecta la garganta y el estómago (esófago). Puede experimentar enrojecimiento o úlceras en la boca, la garganta, los labios o el esófago (estomatitis, faringitis, esofagitis), o puede sentir dolor o tener dificultad al beber o tragar alimentos. Estos síntomas pueden ocurrir unos días después de recibir el tratamiento de ALIMTA. Hable con su médico si tiene alguno de estos síntomas. Llame a su médico de inmediato si tiene fiebre, escalofríos, diarrea o úlceras orales. Estos síntomas podrían provenir de una infección que puede ser grave y llevarlo a la muerte. Los efectos secundarios más frecuentes de ALIMTA cuando se administra solo o en combinación con cisplatino son: • Malestar estomacal, incluidos vómitos, náuseas, diarrea o estreñimiento. Puede tomar algún medicamento para intentar controlar algunos de estos síntomas. Llame a su médico si tiene alguno de estos síntomas. • Recuentos sanguíneos bajos: – Glóbulos rojos bajos. Los glóbulos rojos bajos pueden hacer que se sienta cansado, que se canse con facilidad, que tenga un aspecto pálido y que tenga dificultades para respirar. • Pérdida del apetito. Puede perder el apetito y bajar de peso durante el tratamiento. Hable con su médico si lo considera un problema. • Erupción. Puede sufrir erupciones o picazón durante el tratamiento. Estas reacciones suelen aparecer entre cada tratamiento con ALIMTA y por lo general desaparecen antes del próximo tratamiento. Las reacciones o erupciones de la piel que incluyen ampollas o descamación pueden ser severas y podrían ocasionar la muerte. Llame a su médico si usted tiene alguno de estos síntomas. – Glóbulos blancos bajos. Los glóbulos blancos bajos pueden hacer que tenga una mayor probabilidad de infección. Si usted tiene fiebre (temperatura superior a 100.4°F) u otros signos de infección, llame a su médico de inmediato. (continúa en la página siguiente) Para obtener más información sobre el perfil de seguridad de ALIMTA, lea la Información de prescripción para el paciente y la Información de prescripción, visite www.ALIMTA.com o llame al 1-800-545-5979. 42 www.ALIMTA.com 1-800-545-5979 43 Información importante de seguridad sobre ALIMTA (pemetrexed inyectable) (continuación) ® Hable con su médico, enfermero o farmacéutico sobre cualquier efecto secundario que le moleste o que no desaparezca. Estos no son todos los efectos secundarios de ALIMTA. Para obtener más información, consulte con su médico, enfermero o farmacéutico. ¿Cómo se administra ALIMTA? ALIMTA se infunde lentamente (se inyecta) en una vena. La inyección o infusión durará unos 10 minutos. Por lo general, recibirá ALIMTA una vez cada 21 días (3 semanas). Para obtener más información sobre todos estos efectos secundarios de ALIMTA, hable con su equipo de atención médica, lea la Información de prescripción para el paciente y la Información de prescripción que acompaña a este folleto, visite www.ALIMTA.com o llame al 1-800-545-5979. Se le recomienda reportar cualquier efecto secundario negativo de los medicamentos de venta bajo receta médica a la Administración de Medicamentos y Alimentos (FDA). Visite www.fda.gov/medwatch o llame al 1-800-FDA-1088. PM_CON_ISI_All_17OCT2012 Para obtener más información sobre el perfil de seguridad de ALIMTA, lea la Información de prescripción para el paciente y la Información de prescripción, visite www.ALIMTA.com o llame al 1-800-545-5979. 44 www.ALIMTA.com 1-800-545-5979 45 Recursos LUNGevity www.lungevity.org Para obtener más información sobre el cáncer de pulmón, cómo es vivir con cáncer y grupos de apoyo para pacientes y familiares, visite los siguientes sitios web. Estos recursos son independientes de Lilly Oncology; Lilly no controla su contenido. Recursos específicos para el cáncer de pulmón American Lung Association (Asociación Americana del Pulmón) www.lung.org La Asociación Americana del Pulmón ha luchado por más de 100 años para salvar vidas mediante la mejora de la salud pulmonar y la prevención de enfermedades pulmonares a través de la educación, defensa e investigación. Esta organización ofrece varios grupos de apoyo, entre ellos la Lung Connection Community. Esta comunidad gratuita en línea es para personas que viven con enfermedades pulmonares y para sus cuidadores. Lung Cancer Alliance (Alianza contra el Cáncer de Pulmón) www.lungcanceralliance.org La Alianza contra el Cáncer de Pulmón es una organización sin fines de lucro que se dedica únicamente a salvar vidas y avanzar en la investigación fortaleciendo a quienes viven con cáncer de pulmón y quienes tienen riesgo de presentarlo. Ofrecen apoyo profesional personalizado, trabajan para obtener mayor financiamiento para la investigación del cáncer de pulmón y llevan a cabo campañas educativas en todo el país. Para obtener más información sobre el perfil de seguridad de ALIMTA® (pemetrexed inyectable), lea la Información importante de seguridad en las páginas 40-44, la Información de prescripción para el paciente y la Información de prescripción, visite www.ALIMTA.com o llame al 1-800-545-5979. 46 www.ALIMTA.com LUNGevity está enfocado en cambiar los resultados de las personas que viven con cáncer de pulmón a través de la investigación, la educación y el apoyo. LUNGevity financia estratégicamente una sólida cartera de investigaciones de transferencia para detectar el cáncer de pulmón a tiempo y tratarlo de forma más efectiva. La organización también ofrece una comunidad de apoderamiento, apoyo y esperanza, para todos aquellos que se ven afectados por el cáncer de pulmón, a través de amplios recursos de educación, apoyo en línea entre pares y programas de supervivencia en persona. Bonnie J. Addario Lung Cancer Foundation (Fundación para el Cáncer de Pulmón Bonnie J. Addario) www.lungcancerfoundation.org La Bonnie J. Addario Lung Cancer Foundation (ALCF) es una organización sin fines de lucro que trabaja de forma activa con médicos, organizaciones y personas que se ven afectadas por el cáncer de pulmón. Su objetivo es identificar soluciones y progresar para que el cáncer de pulmón sea una enfermedad crónica manejable. Hasta ahora, esta filantropía (fundada por pacientes, enfocada hacia los pacientes y dirigida por pacientes) ha recaudado $25 millones para investigación y programas sobre el cáncer de pulmón. Recursos oncológicos generales American Cancer Society (Sociedad Americana del Cáncer) www.cancer.org/treatment The LIVESTRONG Foundation (Fundación LIVESTRONG) www.livestrong.org Cancer Support Community (Comunidad de Apoyo a Personas con Cáncer) www.cancersupportcommunity.org CancerCare www.cancercare.org/counseling Patient Advocate Foundation (Fundación para la Defensa del Paciente) www.patientadvocate.org 1-800-545-5979 47 Notas 48 Notas www.ALIMTA.com 1-800-545-5979 49 Notas Para obtener más información sobre el perfil de seguridad de ALIMTA, lea la Información importante de seguridad en las páginas 40-44, la Información de prescripción para el paciente y la Información de prescripción, visite www.ALIMTA.com o llame al 1-800-545-5979. Se le recomienda reportar cualquier efecto secundario negativo de los medicamentos de venta bajo receta médica a la Administración de Medicamentos y Alimentos (FDA). Visite www.fda.gov/medwatch o llame al 1-800-FDA-1088. 50 www.ALIMTA.com 1-800-545-5979 51 SU VIDA. Su guía para el tratamiento con ALIMTA. Cáncer de pulmón de células no pequeñas (CPCNP) no escamosas avanzado • Sepa qué esperar durante el tratamiento • Encuentre respuestas a sus preguntas sobre el tratamiento • Localice recursos para obtener información y apoyo ALIMTA puede suprimir la función de la médula ósea, lo que puede provocar un recuento bajo de células sanguíneas. www.ALIMTA.com 1-800-545-5979 PP-PM-US-0137 09/2015 © Lilly USA, LLC 2015. Todos los derechos reservados. ALIMTA® es una marca registrada de Eli Lilly and Company y está disponible solo con receta médica. ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN Estos aspectos destacados no incluyen toda la información necesaria para utilizar ALIMTA con seguridad y eficacia. Véase la información de prescripción completa de ALIMTA. ALIMTA (pemetrexed inyectable), para uso intravenoso Aprobación inicial de los EE. UU.: 2004 CAMBIOS IMPORTANTES RECIENTES Dosificación y administración, régimen de premedicación y medicamentos concomitantes (2.3) Advertencias y precauciones, requisito para la premedicación y medicamentos concomitantes para reducir la toxicidad (5.1) Advertencias y precauciones, requisito de monitoreo de laboratorio (5.5) PRESENTACIÓN Y CONCENTRACIONES • Frasco inyectable de 100 mg (3) • Frasco inyectable de 500 mg (3) CONTRAINDICACIONES Antecedentes de reacciones de hipersensibilidad severas a pemetrexed. (4) ADVERTENCIAS Y PRECAUCIONES • Régimen de premedicación: antes del tratamiento con ALIMTA, se debe iniciar la suplementación con ácido fólico oral y vitamina B12 intramuscular para reducir la gravedad de la toxicidad hematológica y gastrointestinal de ALIMTA. (5.1) • Supresión de la médula ósea: se debe reducir la dosis para ciclos posteriores en función de los grados de toxicidad hematológica y no hematológica. (5.2) • Función renal: No se debe administrar cuando la depuración de creatinina sea <45 mL/min. (2.4, 5.3) • AINES (antinflamatorios no esteroides) con insuficiencia renal: deben administrarse con precaución en pacientes con insuficiencia renal de leve a moderada (depuración de creatinina de 45-79 mL/min). (5.4) • Monitoreo de laboratorio: no se debe iniciar un ciclo a menos que el Recuento Absoluto de Neutrófilos (ANC) sea ≥1500 células/mm3, las plaquetas sean ≥100,000 células/mm3 y la depuración de creatinina sea ≥45 mL/min. (5.5) • Embarazo: se puede producir daño fetal cuando se administra en mujeres embarazadas. Se debe advertir a las mujeres que utilicen medidas anticonceptivas eficaces para evitar el embarazo durante el tratamiento con ALIMTA. (5.6) 10/2012 10/2012 10/2012 INDICACIONES Y USO ALIMTA® es un inhibidor metabólico análogo del folato indicado para: • Cáncer de pulmón de células no pequeñas no escamosas localmente avanzado o metastásico: • Tratamiento inicial en combinación con cisplatino. (1.1) • Tratamiento de mantenimiento de pacientes cuya enfermedad no haya progresado después de cuatro ciclos de quimioterapia de primera línea con platino. (1.2) • Después de quimioterapia previa como único agente. (1.3) • Mesotelioma: en combinación con cisplatino. (1.4) Limitaciones de uso: • ALIMTA no está indicado para el tratamiento de pacientes con cáncer de pulmón de células no pequeñas y escamosas. (1.5) DOSIFICACIÓN Y ADMINISTRACIÓN • Uso combinado en cáncer de pulmón de células no pequeñas y mesotelioma: la dosis recomendada de ALIMTA es de 500 mg/m2 por vía intravenosa en el primer día de cada ciclo de 21 días en combinación con 75 mg/m2 de cisplatino por vía intravenosa, que comienzan a administrarse 30 minutos después de la administración de ALIMTA. (2.1) • Como agente único en cáncer de pulmón de células no pequeñas: la dosis recomendada de ALIMTA es de 500 mg/m2 por vía intravenosa en el primer día de cada ciclo de 21 días. (2.2) • Antes de iniciar el tratamiento con ALIMTA, se debe comenzar la suplementación con ácido fólico oral y vitamina B12 intramuscular. Se debe continuar con la suplementación con ácido fólico y vitamina B12 durante todo el tratamiento. Se indica administrar corticoesteroides el día anterior, el día de la administración de ALIMTA y al día siguiente. (2.3) • Reducciones de dosis: podrá ser necesaria la reducción o suspensión de la dosis en función del grado de toxicidad observado en el ciclo anterior. (2.4) INFORMACIÓN DE PRESCRIPCIÓN COMPLETA: CONTENIDO* 1 INDICACIONES Y USO 2 DOSIFICACIÓN Y ADMINISTRACIÓN 1.1 1.2 1.3 1.4 1.5 2.1 2.2 2.3 2.4 2.5 2.6 3 4 5 Cáncer de pulmón de células no pequeñas no escamosas – Combinación con cisplatino Cáncer de pulmón de células no pequeñas no escamosas – Mantenimiento Cáncer de pulmón de células no pequeñas no escamosas – Después de quimioterapia previa Mesotelioma Limitaciones de uso Uso combinado con cisplatino para cáncer de pulmón de células no pequeñas no escamosas o para mesotelioma pleural maligno Uso como agente único de mantenimiento después de quimioterapia de primera línea o como quimioterapia de segunda línea Régimen de premedicación y medicamentos concomitantes Monitoreo de laboratorio y Recomendaciones de reducción/suspensión de la dosis Precauciones de preparación y administración Preparación para la administración de la infusión por vía intravenosa REACCIONES ADVERSAS 7 INTERACCIONES CON OTROS MEDICAMENTOS 6.1 6.2 7.1 7.2 • AINES: se deben administrar con precaución. (7.1) • Medicamentos nefrotóxicos: el uso concomitante de estos medicamentos y/o sustancias de secreción tubular puede provocar una depuración retrasada. (7.2) Véase el punto 17 para obtener INFORMACIÓN DE ASESORAMIENTO PARA PACIENTES y el etiquetado para pacientes aprobado por la FDA. Versión revisada: 09/2013 USO EN POBLACIONES ESPECÍFICAS 8.1 8.3 8.4 8.5 8.6 8.7 8.8 8.9 Embarazo Madres lactantes Uso pediátrico Uso geriátrico Pacientes con insuficiencia hepática Pacientes con insuficiencia renal Género Raza 10 SOBREDOSIS 11 DESCRIPCIÓN 12 FARMACOLOGÍA CLÍNICA 12.1 Mecanismo de acción 12.2 Farmacodinámica 12.3 Farmacocinética 13 TOXICOLOGÍA NO CLÍNICA 13.1 Carcinogénesis, Mutagénesis, Problemas de Fertilidad 14 ESTUDIOS CLÍNICOS Requisito de premedicación y medicamentos concomitantes para reducir la toxicidad Supresión de la médula ósea Disminución de la función renal Uso con antinflamatorios no esteroides (AINES) con insuficiencia renal de leve a moderada Requisito de monitoreo de laboratorio Categoría D para embarazo 6 Para informar sobre SOSPECHA DE REACCIONES ADVERSAS, comuníquese con Eli Lilly and Company llamando al 1-800-LillyRx (1-800-545-5979) o a la Administración de Alimentos y Medicamentos (FDA) al 1-800-FDA-1088 o en www.fda.gov/medwatch. INTERACCIONES CON OTROS MEDICAMENTOS 8 PRESENTACIÓN Y CONCENTRACIONES CONTRAINDICACIONES ADVERTENCIAS Y PRECAUCIONES 5.1 5.2 5.3 5.4 5.5 5.6 REACCIONES ADVERSAS Las reacciones adversas más frecuentes (incidencia ≥20%) cuando se utiliza como agente único son fatiga, náuseas y anorexia. Otras reacciones adversas observadas cuando se utiliza en combinación con cisplatino incluyen vómitos, neutropenia, leucopenia, anemia, estomatitis/ faringitis, trombocitopenia y estreñimiento. (6.1) 14.1 14.2 14.3 14.4 Cáncer de pulmón de células no pequeñas (CPCNP) – Combinación con cisplatino Cáncer de pulmón de células no pequeñas – Mantenimiento Cáncer de pulmón de células no pequeñas – Después de quimioterapia previa Mesotelioma pleural maligno 15 REFERENCIAS 16 SUMINISTRO/ALMACENAMIENTO Y MANEJO 16.1 Suministro 16.2 Almacenamiento y Manejo 17 INFORMACIÓN DE ASESORAMIENTO PARA PACIENTES Experiencia en ensayos clínicos Experiencia poscomercialización *No se enumeran las secciones o subsecciones omitidas de la información de prescripción completa. Medicamentos antinflamatorios no esteroides (AINES) Medicamentos nefrotóxicos ALIMTA (pemetrexed inyectable), para uso intravenoso PV 8927 AMP ALIMTA (pemetrexed inyectable), para uso intravenoso PV 8927 AMP INFORMACIÓN DE PRESCRIPCIÓN COMPLETA 1 Tabla 3: Reducción de la dosis de ALIMTA (como agente único o en combinación) y cisplatino – Neurotoxicidad INDICACIONES Y USO 1.1 Cáncer de pulmón de células no pequeñas no escamosas – Combinación con cisplatino ALIMTA® está indicado en combinación con tratamiento con cisplatino para el tratamiento inicial de pacientes con cáncer de pulmón de células no pequeñas no escamosas localmente avanzado o metastásico. 1.2 Cáncer de pulmón de células no pequeñas no escamosas – Mantenimiento ALIMTA está indicado para el tratamiento de mantenimiento de pacientes con cáncer de pulmón de células no pequeñas no escamosas localmente avanzado o metastásico, cuya enfermedad no ha progresado después de cuatro ciclos de quimioterapia de primera línea con platino. 1.3 Cáncer de pulmón de células no pequeñas no escamosas – Después de quimioterapia previa ALIMTA está indicado como agente único para el tratamiento de pacientes con cáncer de pulmón de células no pequeñas no escamosas localmente avanzado o metastásico después de la quimioterapia previa. 1.4 Mesotelioma ALIMTA en combinación con cisplatino está indicado para el tratamiento de pacientes con mesotelioma pleural maligno cuya enfermedad es inoperable o que no son candidatos para una cirugía curativa. 1.5 Limitaciones de uso ALIMTA no está indicado para el tratamiento de pacientes con cáncer de pulmón de células no pequeñas y escamosas. [véase Estudios clínicos (14.1, 14.2, 14.3)] 2 Dosis de ALIMTA (mg/m2) Dosis de cisplatino (mg/m2) 0-1 100% de la dosis previa 100% de la dosis previa 2 100% de la dosis previa 50% de la dosis previa Grado según los CTC Recomendaciones de suspensión El tratamiento con ALIMTA debe interrumpirse si el paciente experimenta alguna toxicidad hematológica o no hematológica de Grado 3 o 4 después de 2 reducciones de la dosis o de inmediato si se observa una neurotoxicidad de Grado 3 o 4. Pacientes con insuficiencia renal En los estudios clínicos, los pacientes con depuración de creatinina ≥45 mL/min no requirieron ajustes de la dosis que fueran diferentes de los recomendados para todos los pacientes. Debido a que la cantidad de pacientes con depuración de creatinina inferior a 45 mL/min es escasa no se pueden hacer recomendaciones de dosis para este grupo de pacientes [véase Farmacología Clínica (12.3)]. Por lo tanto, ALIMTA no debe administrarse a pacientes cuya depuración de creatinina sea <45 mL/min utilizando la fórmula estándar de Cockcroft y Gault (abajo) o el Índice de Filtración Glomerular (GFR), determinados mediante el método de depuración sérica de Tc99m-DTPA: Hombres: DOSIFICACIÓN Y ADMINISTRACIÓN 2.1 Uso combinado con cisplatino para cáncer de pulmón de células no pequeñas no escamosas o para mesotelioma pleural maligno La dosis recomendada de ALIMTA es de 500 mg/m2 administrado como infusión intravenosa durante 10 minutos durante el primer día de cada ciclo de 21 días. La dosis recomendada de cisplatino es de 75 mg/m2 infundidos durante 2 horas comenzando aproximadamente 30 minutos después de finalizar la administración de ALIMTA. Véase el prospecto de cisplatino para obtener más información. 2.2 Uso como agente único de mantenimiento después de quimioterapia de primera línea o como quimioterapia de segunda línea La dosis recomendada de ALIMTA es de 500 mg/m2 administrado como infusión intravenosa durante 10 minutos durante el primer día de cada ciclo de 21 días. 2.3 Régimen de premedicación y medicamentos concomitantes Suplementación con vitaminas Debe indicarse a los pacientes que comiencen la administración de 400 mcg a 1000 mcg de ácido fólico por vía oral una vez al día, 7 días antes del inicio de la primera dosis de ALIMTA. Se debe continuar con la ingesta de ácido fólico durante la totalidad del tratamiento y durante los 21 días posteriores a la última dosis de ALIMTA [véase Advertencias y precauciones (5.1)]. Se debe administrar 1 mg de vitamina B12 por vía intramuscular una semana antes de la primera dosis de ALIMTA y posteriormente cada 3 ciclos. Las inyecciones subsiguientes de vitamina B12 pueden administrarse el mismo día que el tratamiento con ALIMTA [véase Advertencias y precauciones (5.1)]. Corticoesteroides Se deben administrar 4 mg de dexametasona por vía oral, dos veces al día, el día anterior, el día en que se administra ALIMTA y el día posterior [véase Advertencias y precauciones (5.1)]. 2.4 Monitoreo de laboratorio y Recomendaciones de reducción/suspensión de la dosis Monitoreo Debe realizarse un conteo completo de células rojas, incluidos recuentos de plaquetas, en todos los pacientes que reciben ALIMTA. Los pacientes deben ser monitoreados para determinar la cifra mínima y la recuperación, los cuales fueron evaluados en el estudio clínico antes de cada dosis y en los días 8 y 15 de cada ciclo. Los pacientes no deben comenzar un nuevo ciclo de tratamiento a menos que el recuento absoluto de neutrófilos sea ≥1500 células/mm3, el recuento de plaquetas sea ≥100,000 células/mm3 y la depuración de creatinina sea ≥45 mL/min. Se deben realizar pruebas químicas periódicas para evaluar la función renal y hepática [véase Advertencias y precauciones (5.5)]. Recomendaciones para la reducción de la dosis Los ajustes de dosis en el inicio de un ciclo posterior deben basarse en la cifra mínima de los recuentos hematológicos o en la toxicidad máxima no hematológica del ciclo de tratamiento precedente. El tratamiento puede retrasarse para permitir que haya suficiente tiempo para la recuperación. Al recuperarse, los pacientes deben ser tratados nuevamente utilizando las pautas de las Tablas 1 a 3, que son adecuadas para el uso de ALIMTA como agente único o en combinación con cisplatino. Tabla 1: Reducción de la dosis de ALIMTA (como agente único o en combinación) y cisplatino – Toxicidades hematológicas Cifra mínima del recuento absoluto de neutrófilos <500/mm3 75% de la dosis previa (pemetrexed y cisplatino). y cifra mínima de plaquetas ≥50,000/mm3. Cifra mínima de plaquetas <50,000/mm3 sin sangrado independientemente de la cifra mínima del recuento absoluto de neutrófilos. 75% de la dosis previa (pemetrexed y cisplatino). Cifra mínima de plaquetas <50,000/mm3 con sangradoa, 50% de la dosis previa (pemetrexed y cisplatino). independientemente de la cifra mínima del recuento absoluto de neutrófilos. a Estos criterios cumplen con la definición de Criterios comunes de toxicidad (CTC) del Instituto Nacional del Cáncer (NCI) (1998) (versión 2.0) desangrado ≥ Grado 2 según los CTC. Si los pacientes desarrollan toxicidades no hematológicas (sin incluir la neurotoxicidad) ≥ Grado 3, el tratamiento debe ser suspendido hasta alcanzar una resolución a un valor inferior o igual al que tenía el paciente antes del tratamiento. El tratamiento debe reanudarse según las pautas de la Tabla 2. Tabla 2: Reducción de la dosis de ALIMTA (como agente único o en combinación) y cisplatino – Toxicidades no hematológicasa,b Dosis de ALIMTA Dosis de cisplatino (mg/m2) (mg/m2) Cualquier toxicidad de Grado 3 o 4, excepto mucositis 75% de la dosis previa 75% de la dosis previa Cualquier diarrea que requiera hospitalización (independientemente del grado) o diarrea de Grado 3 o 4 75% de la dosis previa 75% de la dosis previa 50% de la dosis previa 100% de la dosis previa Mucositis de Grado 3 o 4 Criterios comunes de toxicidad (CTC) del NCI. b Excluyendo la neurotoxicidad (véase la Tabla 3). a En el caso de la neurotoxicidad, los ajustes de dosis recomendados para ALIMTA y cisplatino se describen en la Tabla 3. Los pacientes deben interrumpir el tratamiento si experimentan una neurotoxicidad de Grado 3 o 4. ALIMTA (pemetrexed inyectable), para uso intravenoso PV 8927 AMP Mujeres: [140 - Edad en años] × Peso corporal real (kg) 72 × Creatinina en suero (mg/dL) Depuración de creatinina calculado para hombres × 0.85 = mL/min Se debe tener precaución al administrar ALIMTA simultáneamente con AINES a pacientes cuya depuración de creatinina es <80 mL/min [véase Interacciones con otros medicamentos (7.1)]. 2.5 Precauciones de preparación y administración Al igual que sucede con otros agentes antineóplasicos potencialmente tóxicos, se debe tener cuidado en el manejo y preparación de las soluciones para infusión de ALIMTA. Se recomienda el uso de guantes. Si una solución de ALIMTA entra en contacto con la piel, se debe lavar la piel inmediatamente con abundante agua y jabón. Si ALIMTA entra en contacto con las membranas mucosas, se debe enjuagar con abundante agua. Hay disponibles varias guías publicadas para el manejo y la eliminación de agentes antineoplásicos [véase Referencias (15)]. ALIMTA no es una sustancia vesicante. No existe un antídoto específico para la extravasación de ALIMTA. Hasta la fecha, se han registrado pocos casos de extravasación de ALIMTA, los cuales no fueron considerados graves por el investigador. Para la extravasación de ALIMTA se debe implementar la práctica estándar local utilizada para la extravasación al igual que con otras sustancias no vesicantes. 2.6 Preparación para la administración de la infusión por vía intravenosa 1. Emplear una técnica aséptica durante la reconstitución y posterior dilución de ALIMTA para la administración de la infusión por vía intravenosa. 2. Calcular la dosis de ALIMTA y determinar la cantidad de frascos necesarios. Los frascos contienen 100 mg o 500 mg de ALIMTA. Los frascos contienen un exceso de ALIMTA para facilitar la administración de la cantidad indicada en la etiqueta. 3. Reconstituir los frascos de 100 mg con 4.2 ml de cloruro de sodio al 0.9% (sin conservantes) para inyección. Reconstituir los frascos de 500 mg con 20 ml de cloruro de sodio al 0.9% (sin conservantes) para inyección. En ambos casos se obtiene una solución que contiene 25 mg/mL de ALIMTA. Agitar suavemente cada frasco hasta que el polvo se disuelva completamente. La solución resultante es clara y su color varía de incoloro a amarillo o amarillo verdoso sin afectar de manera adversa la calidad del producto. La solución reconstituida de ALIMTA tiene un pH que oscila entre 6.6 y 7.8. SE REQUIERE SU POSTERIOR DILUCIÓN. 4. Los medicamentos parenterales deben ser inspeccionados visualmente antes de su administración para detectar la presencia de partículas y decoloración, siempre que la solución y el envase lo permitan. Si se observan partículas no debe administrarse el producto. 5. El volumen apropiado de la solución reconstituida de ALIMTA debe diluirse posteriormente hasta completar 100% con solución de cloruro de sodio al 0.9% (sin conservantes) para inyección. ALIMTA se administra como infusión intravenosa durante 10 minutos. 6. Se comprobó la estabilidad química y física de las soluciones reconstituidas y para infusión de ALIMTA de hasta 24 horas después de la reconstitución inicial, cuando se conservan en refrigeración. Cuando se preparan según las instrucciones, las soluciones reconstituidas y para infusión de ALIMTA no contienen conservantes antimicrobianos. Desechar las partes que no se utilicen. Solo se recomienda la reconstitución y posterior dilución antes de la infusión por vía intravenosa con cloruro de sodio al 0.9% (sin conservantes) para inyección. ALIMTA es físicamente incompatible con diluyentes que contienen calcio, incluidas la solución de lactato Ringer para inyección, Farmacopea de los Estados Unidos (USP) y de la solución de Ringer para inyección, USP, y por lo tanto estos no deben ser utilizados. La administración concomitante de ALIMTA con otros medicamentos y diluyentes no ha sido estudiada y, por lo tanto, no se recomienda. ALIMTA es compatible con equipos estándar de administración de policloruro de vinilo (PVC) y bolsas para solución intravenosa. 3 PRESENTACIÓN Y CONCENTRACIONES ALIMTA, pemetrexed inyectable, es un polvo blanco a amarillo claro o amarillo verdoso liofilizado disponible en frascos estériles de un solo uso que contienen 100 mg o 500 mg de pemetrexed. 4 5 CONTRAINDICACIONES ALIMTA está contraindicado en pacientes con antecedentes de reacciones de hipersensibilidad severas al pemetrexed. ADVERTENCIAS Y PRECAUCIONES 5.1 Requisito de premedicación y medicamentos concomitantes para reducir la toxicidad Suplementación con vitaminas Antes del tratamiento con ALIMTA, inicie la suplementación con ácido fólico oral y vitamina B12 intramuscular para reducir la gravedad de la toxicidad hematológica y gastrointestinal de ALIMTA [véase Dosificación y administración (2.3)]. No se debe sustituir la vitamina B12 oral por la vitamina B12 intramuscular. En los estudios clínicos, la incidencia de las siguientes toxicidades de Grado 3-4 fue mayor en los pacientes con mesotelioma a los que nunca se les administró la suplementación en comparación con los pacientes a los que se les administró la totalidad de la suplementación con ácido fólico y vitamina B12, antes y durante el tratamiento con ALIMTA: neutropenia [38% versus 23%], trombocitopenia [9% versus 5%], neutropenia febril [9% versus 0.6%] e infección con neutropenia [6% versus 0%]. Corticoesteroides Se debe administrar dexametasona el día anterior, el día de la administración de ALIMTA y al día siguiente [véase Dosificación y administración (2.3)]. 5.2 Supresión de la médula ósea ALIMTA puede suprimir la función de la médula ósea, manifestada por neutropenia, trombocitopenia y anemia (o pancitopenia) [véase Reacciones adversas (6.1)]; la mielosupresión es normalmente la toxicidad que limita la dosis. Las reducciones de la dosis para ciclos posteriores se basan en la cifra mínima del recuento absoluto de neutrófilos, el recuento de plaquetas y la toxicidad máxima no hematológica observada en el ciclo anterior [véase Dosificación y administración (2.4)]. 5.3 Disminución de la función renal ALIMTA se excreta principalmente por vía renal sin cambios. No es necesario ajustar la dosis en pacientes con depuración de creatinina ≥45 mL/min. Debido a que la cantidad de pacientes con depuración de creatinina inferior a 45 mL/min es escasa no se pueden hacer recomendaciones de dosis para este grupo. Por lo tanto, ALIMTA no debe ser administrado a pacientes cuya depuración de creatinina es <45 mL/min [véase Dosificación y administración (2.4)]. ALIMTA (pemetrexed inyectable), para uso intravenoso PV 8927 AMP Un paciente con insuficiencia renal grave (depuración de creatinina de 19 mL/min) que no recibió ácido fólico ni vitamina B12, falleció por la toxicidad relacionada con el medicamento tras la administración de ALIMTA únicamente. 5.4 Uso con antinflamatorios no esteroides (AINES) con insuficiencia renal de leve a moderada Se debe tener precaución al administrar AINES simultáneamente con ALIMTA a pacientes con insuficiencia renal de leve a moderada (depuración de creatinina de 45 a 79 mL/min) [véase Interacciones con otros medicamentos (7.1)]. 5.5 Requisito de monitoreo de laboratorio Se debe realizar un conteo completo de sangre y pruebas de función renal al principio de cada ciclo y según sea necesario. No se debe iniciar un ciclo de tratamiento a menos que el recuento absoluto de neutrófilos sea ≥1500 células/mm3, el recuento de plaquetas sea ≥100,000 células/mm3 y la depuración de creatinina sea ≥45 mL/min [véase Dosificación y administración (2.4)]. 5.6 Categoría D para embarazo Basado en su mecanismo de acción, ALIMTA puede producir daño fetal cuando se administra en mujeres embarazadas. Administrado por vía intraperitoneal a ratones durante la organogénesis, el pemetrexed registró efectos embriotóxicos, fetotóxicos y teratogénicos en ratones a una dosis recomendada superior a 1/833 de la dosis recomendada en humanos. Si ALIMTA se utiliza durante el embarazo, o si la paciente queda embarazada mientras toma este medicamento, se debe advertir a la paciente de los posibles riesgos para el feto. Se debe advertir a las mujeres en edad fértil para que eviten quedar embarazadas. Se debe advertir a las mujeres que utilicen medidas anticonceptivas eficaces para evitar el embarazo durante el tratamiento con ALIMTA [véase Uso en poblaciones específicas (8.1)]. 6 REACCIONES ADVERSAS Incidencia inferior al 1% Trastornos cardiovasculares — arritmia Trastornos generales — dolor en el pecho Trastornos en el metabolismo y Nutrición — aumento de GGT Trastornos neurológicos — neuropatía motora Cáncer de pulmón de células no pequeñas (CPCNP) – Mantenimiento Mantenimiento con ALIMTA después del tratamiento de inducción sin ALIMTA con platino La Tabla 5 proporciona la frecuencia y gravedad de las reacciones adversas que se han informado en >5% de 438 pacientes con CPCNP que recibieron mantenimiento con ALIMTA y 218 pacientes con CPCNP que recibieron placebo después de un tratamiento de inducción con platino. Todos los pacientes recibieron el tratamiento del estudio inmediatamente después de 4 ciclos de tratamiento con platino para tratar el CPCNP localmente avanzado o metastásico. Los pacientes en ambos grupos del estudio recibieron la totalidad de la suplementación con ácido fólico y vitamina B12. Tabla 5: Reacciones adversas en pacientes que recibieron ALIMTA versus los que recibieron placebo para tratar el CPCNPa después del tratamiento de inducción con platino Reacciónb ALIMTA (N=438) Todos los grados Toxicidad de de toxicidad (%) Grado 3-4 (%) 66 16 Placebo (N=218) Todos los grados Toxicidad de de toxicidad (%) Grado 3-4 (%) 37 4 A los efectos de esta tabla se utilizó un límite del 5% para incluir todos los eventos en los que el informante consideró una posible relación con ALIMTA. b Véase los Criterios comunes de toxicidad del NCI versión 2.0 para cada grado de toxicidad. c Según los Criterios comunes de toxicidad del NCI versión 2.0, esta duración del efecto adverso solo debe ser informada como Grado 1 o 2. No se observaron diferencias clínicamente significativas en las reacciones adversas en los pacientes, según la histología. Además de la menor incidencia de la toxicidad hematológica en el brazo al que se aplicó ALIMTA y cisplatino, el empleo de transfusiones (glóbulos rojos y plaquetas) y los factores de crecimiento hematopoyéticos fueron menores en el brazo al que se aplicó ALIMTA y cisplatino en comparación con el brazo al que se aplicó gemcitabina y cisplatino. Se observaron las siguientes reacciones adversas adicionales en pacientes con cáncer de pulmón de células no pequeñas aleatorizados para recibir ALIMTA más cisplatino. Incidencia del 1% al 5% Organismo en general — neutropenia febril, infección, pirexia Trastornos generales — deshidratación Trastornos en el metabolismo y Nutrición — aumento de la alanina aminotransferasa (AST) y aumento de la aspartato aminotransferasa (ALT) Trastornos renales — disminución de la depuración de creatinina, insuficiencia renal Trastornos en los órganos de los sentidos — conjuntivitis Todas las reacciones adversas Laboratorio Trastornos hematológicos Anemia 15 3 6 1 Neutropenia 6 3 0 0 Leucopenia 6 2 1 1 Hepáticas Aumento de ALT 10 0 4 0 Aumento de AST 8 0 4 0 Trastornos clínicos Síntomas inespecíficos Fatiga 25 5 11 1 Trastornos gastrointestinales Náuseas 19 1 6 1 Anorexia 19 2 5 0 Vómitos 9 0 1 0 Mucositis/estomatitis 7 1 2 0 Diarrea 5 1 3 0 Infección 5 2 2 0 Trastornos neurológicos Neuropatía sensorial 9 1 4 0 Trastornos dermatológicos/Piel Erupción/Descamación 10 0 3 0 a A los efectos de esta tabla se utilizó un límite del 5% para incluir todos los eventos en los que el informante consideró una posible relación con ALIMTA. b Véase los Criterios comunes de toxicidad del NCI versión 3.0 para cada grado de toxicidad. No se observaron diferencias clínicamente significativas en las reacciones adversas de Grado 3/4 en los pacientes según la edad, el género, el origen étnico o la histología, excepto una mayor incidencia de la fatiga de Grado 3/4 en los pacientes caucásicos en comparación con los pacientes no caucásicos (6.5% versus 0.6%). Se evaluó la seguridad mediante exposición en pacientes que recibieron al menos una dosis de ALIMTA (N=438). Se evaluó la incidencia de las reacciones adversas en los pacientes que recibieron ≤6 ciclos de ALIMTA, y se comparó con los pacientes que recibieron >6 ciclos de ALIMTA. Se observaron aumentos de las reacciones adversas (todos los grados) con la exposición más extensa; sin embargo, no se observaron diferencias clínicamente significativas en las reacciones adversas de Grado 3/4. En consonancia con la mayor incidencia de la anemia (todos los grados) en el grupo que recibió ALIMTA, el empleo de transfusiones (glóbulos rojos principalmente) y de agentes de estimulación eritropoyética (ESA; eritropoyetina y darbepoetina) fue mayor en el grupo que recibió ALIMTA en comparación con el grupo que recibió placebo (transfusiones 9.5% versus 3.2%, agentes de estimulación eritropoyética de 5.9% versus 1.8%). Se observaron las siguientes reacciones adversas adicionales en pacientes con cáncer de pulmón de células no pequeñas que recibieron ALIMTA. Incidencia del 1% al 5% Trastornos dermatológicos/Piel — alopecia, prurito/comezón Trastornos gastrointestinales — estreñimiento Trastornos generales — edema, fiebre (en ausencia de neutropenia) Trastornos hematológicos — trombocitopenia Trastornos renales — disminución de la depuración de creatinina, aumento de la creatinina, disminución de la tasa de filtración glomerular Trastornos en los órganos de los sentidos — enfermedad de la superficie ocular (incluida conjuntivitis), aumento del lagrimeo Incidencia inferior al 1% Trastornos cardiovasculares — arritmia supraventricular Trastornos dermatológicos/Piel — eritema multiforme Trastornos generales — neutropenia febril, reacción alérgica/hipersensibilidad Trastornos neurológicos — neuropatía motora Trastornos renales — insuficiencia renal Continuación del mantenimiento con ALIMTA después del tratamiento de inducción ALIMTA más platino La Tabla 6 proporciona la frecuencia y gravedad de las reacciones adversas que se han informado en >5% de 500 pacientes con cáncer de pulmón de células no pequeñas no escamosas que recibieron al menos un ciclo de mantenimiento con ALIMTA (n=333) o placebo (n=167) en la continuación del ensayo de mantenimiento. La mediana de los ciclos de mantenimiento administrados a pacientes que recibieron una o más dosis del tratamiento de mantenimiento fue de 4, tanto en el grupo que recibió pemetrexed como en el grupo que recibió placebo. Se aplicaron reducciones de la dosis por eventos adversos en el 3.3% de los pacientes en el grupo que recibió ALIMTA y en el 0.6% en el grupo que recibió placebo. Se retrasó la administración la dosis por eventos adversos en el 22% de los pacientes en el grupo que recibió ALIMTA y en el 16% en el grupo que recibió placebo. Los pacientes en ambos grupos del estudio recibieron la suplementación con ácido fólico y vitamina B12. ALIMTA (pemetrexed inyectable), para uso intravenoso ALIMTA (pemetrexed inyectable), para uso intravenoso 6.1 Experiencia en ensayos clínicos Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas no se pueden comparar directamente con las tasas en otros ensayos clínicos, y pueden no reflejar las tasas observadas en la práctica clínica. En los ensayos clínicos, las reacciones adversas más frecuentes (incidencia ≥20%) durante el tratamiento con ALIMTA como agente único fueron fatiga, náuseas y anorexia. Otras reacciones adversas observadas (incidencia ≥20%) durante el tratamiento con ALIMTA, cuando se utiliza en combinación con cisplatino, incluyen vómitos, neutropenia, leucopenia, anemia, estomatitis/faringitis, trombocitopenia y estreñimiento. Cáncer de pulmón de células no pequeñas (CPCNP) – ALIMTA en combinación con cisplatino La Tabla 4 proporciona la frecuencia y gravedad de las reacciones adversas que se han informado en >5% de 839 pacientes con CPCNP que fueron aleatorizados para recibir ALIMTA más cisplatino y 830 pacientes con CPCNP aleatorizados para recibir gemcitabina más cisplatino. Todos los pacientes recibieron el tratamiento del estudio como tratamiento inicial para tratar el CPCNP localmente avanzado o metastásico, y los pacientes en ambos grupos de tratamiento recibieron la totalidad de la suplementación con ácido fólico y vitamina B12. Tabla 4: Reacciones adversas en pacientes que recibieron la totalidad de la suplementación y ALIMTA más cisplatino para tratar el CPCNPa ALIMTA/cisplatino (N=839) Reacciónb Gemcitabina/cisplatino (N=830) Todos los grados de toxicidad (%) Toxicidad de Grado 3-4 (%) Todos los grados de toxicidad (%) Toxicidad de Grado 3-4 (%) Todas las reacciones adversas 90 37 91 53 Laboratorio Trastornos hematológicos Anemia Neutropenia Leucopenia Trombocitopenia 33 29 18 10 6 15 5 4 46 38 21 27 10 27 8 13 Trastornos renales Aumento de la creatinina 10 1 7 1 Trastornos clínicos Síntomas inespecíficos Fatiga 43 7 45 5 Trastornos gastrointestinales Náuseas Vómitos Anorexia Estreñimiento Estomatitis/Faringitis Diarrea Dispepsia/Acidez 56 40 27 21 14 12 5 7 6 2 1 1 1 0 53 36 24 20 12 13 6 4 6 1 0 0 2 0 Trastornos neurológicos Neuropatía sensorial Alteración del gusto 9 8 0 0c 12 9 1 0c Trastornos dermatológicos/Piel Alopecia Erupción/Descamación 12 7 0c 0 21 8 1c 1 a PV 8927 AMP PV 8927 AMP Tabla 6: Reaccionesb adversas seleccionadasa registradas en ≥5% de los pacientes que recibieron ALIMTA para tratar el cáncer de pulmón de células no pequeñas no escamosas después del tratamiento de inducción con ALIMTA más cisplatino ALIMTA (N=333) Placebo (N=167) Sistema de órganos afectados por las reacciones adversas y Todos los gradosa Toxicidad de Todos los gradosa Toxicidad de duración de toxicidad (%) Grado 3-4a (%) de toxicidad (%) Grados 3-4a (%) Todas las reacciones adversas 53 17 34 4.8 Laboratorio Trastornos hematológicos Anemia 15 4.8 4.8 0.6 Neutropenia 9 3.9 0.6 0 Trastornos clínicos Síntomas inespecíficos Fatiga 18 4.5 11 0.6 Trastornos gastrointestinales Náuseas 12 0.3 2.4 0 Vómitos 6 0 1.8 0 Mucositis/estomatitis 5 0.3 2.4 0 Trastornos generales Edema 5 0 3.6 0 a Reacciones adversas de cualquier gravedad (todos los grados) registradas con mayor frecuencia (≥5%) o reacciones adversas de Grado 3-4 registrada con mayor frecuencia (≥2%) en pacientes tratados con ALIMTA en comparación con los que recibieron placebo b Criterios comunes de toxicidad del NCI versión 3.0 La administración de transfusiones de glóbulos rojos (13% versus 4.8%) y de plaquetas (1.5% versus 0.6%), agentes de estimulación eritropoyética (12% versus 7%) y factores estimulantes de colonias de granulocitos (6% versus 0%) fue mayor en el grupo que recibió ALIMTA en comparación con el grupo que recibió placebo. Se observaron las siguientes reacciones adversas adicionales de Grado 3 o 4 más frecuentemente en el grupo que recibió ALIMTA. Incidencia del 1% al 5% Sangre/Médula ósea — trombocitopenia Trastornos generales — neutropenia febril Incidencia inferior al 1% Trastornos cardiovasculares — taquicardia ventricular, síncope Trastornos Generales — dolor Trastornos gastrointestinales — obstrucción gastrointestinal Trastornos neurológicos — depresión Trastornos renales — insuficiencia renal Trastornos vasculares — embolia pulmonar Cáncer de pulmón de células no pequeñas (CPCNP) – Después de quimioterapia previa La Tabla 7 proporciona la frecuencia y gravedad de las reacciones adversas que se han informado en >5% de 265 pacientes aleatorizados para recibir ALIMTA como agente único con suplementación con ácido fólico y vitamina B12 y 276 pacientes aleatorizados para recibir docetaxel como agente único. Todos los pacientes fueron diagnosticados con CPCNP localmente avanzado o metastásico y recibieron quimioterapia previa. Tabla 7: Reacciones adversas en pacientes que recibieron la totalidad de la suplementación y ALIMTA más docetaxel para tratar el CPCNPa Reacciónb ALIMTA (N=265) Toxicidad de Grados 3-4 (%) Todos los grados de toxicidad (%) Docetaxel (N=276) Toxicidad de Grados 3-4 (%) Todos los grados de toxicidad (%) Laboratorio Trastornos hematológicos Anemia Leucopenia Neutropenia Trombocitopenia 19 12 11 8 4 4 5 2 22 34 45 1 4 27 40 0 Hepáticas Aumento de ALT Aumento de AST 8 7 2 1 1 1 0 0 Trastornos clínicos Trastornos gastrointestinales Náuseas Anorexia Vómitos Estomatitis/Faringitis Diarrea Estreñimiento 31 22 16 15 13 6 3 2 2 1 0 0 17 24 12 17 24 4 2 3 1 1 3 0 Síntomas inespecíficos Fatiga Fiebre 34 8 5 0 36 8 5 0 Trastornos dermatológicos/Piel Erupción/Descamación Prurito Alopecia 14 7 6 0 0 1c 6 2 38 0 0 2c a A los efectos de esta tabla se utilizó un límite del 5% para incluir todos los eventos en los que el informante consideró una posible relación con ALIMTA. Véase los Criterios comunes de toxicidad del NCI versión 2.0 para conocer los valores de laboratorio de cada grado de toxicidad. c Según los Criterios comunes de toxicidad del NCI versión 2.0, esta duración del efecto adverso solo debe ser informada como Grado 1 o 2. No se observaron diferencias clínicamente significativas en las reacciones adversas en los pacientes, según la histología. Las reacciones adversas clínicamente significativas registradas en <5% de los pacientes que recibieron tratamiento con ALIMTA, pero en >5% de los pacientes que recibieron docetaxel, incluyen neutropenia febril de Grado 3/4 según los CTC (ALIMTA 1.9%, docetaxel 12.7%). b Se observaron las siguientes reacciones adversas adicionales en pacientes con cáncer de pulmón de células no pequeñas aleatorizados para recibir ALIMTA. ALIMTA (pemetrexed inyectable), para uso intravenoso PV 8927 AMP Incidencia del 1% al 5% Organismo en general — dolor abdominal, reacción alérgica/hipersensibilidad, neutropenia febril, infección Trastornos dermatológicos/Piel — eritema multiforme Trastornos neurológicos — neuropatía motora, neuropatía sensorial Trastornos renales — aumento de la creatinina Incidencia inferior al 1% Trastornos cardiovasculares — arritmias supraventriculares Mesotelioma pleural maligno (MPM) La Tabla 8 proporciona la frecuencia y gravedad de las reacciones adversas que se han informado en >5% de 168 pacientes con mesotelioma aleatorizados para recibir cisplatino y ALIMTA, y 163 pacientes con mesotelioma aleatorizados para recibir cisplatino como agente único. En ambos grupos del tratamiento, a estos pacientes que nunca habían recibido quimioterapia se les administró la totalidad de la suplementación con ácido fólico y vitamina B12. Tabla 8: Reacciones adversas en pacientes que recibieron la totalidad de la suplementación y ALIMTA más cisplatino para tratar el MPMa ALIMTA/cisplatino (N=168) Reacciónb Laboratorio Trastornos hematológicos Neutropenia Leucopenia Anemia Trombocitopenia Todos los grados de toxicidad (%) Cisplatino (N=163) Toxicidad de Todos los grados Toxicidad de Grado 3-4 (%) de toxicidad (%) Grado 3-4 (%) 56 53 26 23 23 15 4 5 13 17 10 9 3 1 0 0 11 16 1 1 10 18 1 2 Trastornos clínicos Trastornos oculares Conjuntivitis 5 0 1 0 Trastornos gastrointestinales Náuseas Vómitos Estomatitis/Faringitis Anorexia Diarrea Estreñimiento Dispepsia 82 57 23 20 17 12 5 12 11 3 1 4 1 1 77 50 6 14 8 7 1 6 4 0 1 0 1 0 Síntomas inespecíficos Fatiga 48 10 42 9 Trastornos en el metabolismo y Nutrición Deshidratación 7 4 1 1 Trastornos renales Aumento de la creatinina Disminución de la depuración de creatinina Trastornos neurológicos 10 1 Neuropatía sensorial 10 0 6 0c Alteración del gusto 8 0c Trastornos dermatológicos/Piel 5 0 Erupción 16 1 6 0c Alopecia 11 0c a A los efectos de esta tabla se utilizó un límite del 5% para incluir todos los eventos en los que el informante consideró una posible relación con ALIMTA. b Véase los Criterios comunes de toxicidad del NCI versión 2.0 para cada grado de toxicidad, excepto el término “disminución de la depuración de creatinina”, que deriva del término “renal/genitourinario-otros” según tales criterios. c Según los Criterios comunes de toxicidad del NCI versión 2.0, esta duración del efecto adverso solo debe ser informada como Grado 1 o 2. Se observaron las siguientes reacciones adversas adicionales en pacientes con mesotelioma pleural maligno aleatorizados para recibir ALIMTA más cisplatino. Incidencia del 1% al 5% Organismo en general — neutropenia febril, infección, pirexia Trastornos dermatológicos/Piel — urticaria Trastornos generales — dolor en el pecho Trastornos en el metabolismo y Nutrición — aumento de AST, aumento de ALT, aumento de GGT Trastornos renales — insuficiencia renal Incidencia inferior al 1% Trastornos cardiovasculares — arritmia Trastornos neurológicos — neuropatía motora Efectos de la suplementación con vitamina sobre la toxicidad La Tabla 9 compara la incidencia (porcentaje de pacientes) de las toxicidades de Grado 3/4 según los CTC en pacientes que recibieron la totalidad de la suplementación con ácido fólico y vitamina B12 diariamente desde el momento de la inscripción en el estudio con la incidencia en pacientes que nunca recibieron la suplementación durante el estudio en el grupo que recibió ALIMTA más cisplatino. Tabla 9: Comparación de los eventos adversos de Grado 3/4 seleccionados en pacientes a los que se les administró la totalidad de la suplementación versus los que nunca recibieron la suplementación en el grupo que recibió ALIMTA más cisplatino (% de incidencia) Pacientes a los que se les Pacientes a los que nunca se les administró la administró la totalidad de a la suplementación (N=168) suplementación (N=32) Evento Adverso (%) Neutropenia/granulocitopenia 23 38 Trombocitopenia 5 9 Vómitos 11 31 Neutropenia febril 1 9 Infección con neutropenia de Grado 3/4 0 6 Diarrea 4 9 a Véase los Criterios comunes de toxicidad del NCI versión 2.0 para conocer los valores de laboratorio y los que no son de laboratorio de cada grado de toxicidad. ALIMTA (pemetrexed inyectable), para uso intravenoso PV 8927 AMP Los siguientes eventos adversos tuvieron mayor incidencia en el grupo al que se le administró la totalidad de la suplementación en comparación con el grupo al que nunca se le administró la suplementación: hipertensión (11%, 3%), dolor de pecho (8%, 6%) y trombosis/embolia (6%, 3%). No se identificó ningún efecto relevante para la seguridad de ALIMTA debido al género o a la raza, excepto una mayor incidencia de erupciones en los hombres (24%) en comparación con las mujeres (16%). Otras experiencias en ensayos clínicos Se registró sepsis, que en algunos casos fue fatal, en aproximadamente el 1% de los pacientes. Se registró esofagitis en menos del 1% de los pacientes. 6.2 Experiencia poscomercialización Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de ALIMTA. Debido a que estas reacciones son informadas voluntariamente por una población de volumen incierto, no siempre es posible estimar de manera fiable su frecuencia o establecer una relación causal con la exposición al medicamento. Se registraron estas reacciones con la administración de ALIMTA como agente único y en tratamientos de combinación. Trastornos en la sangre y el sistema linfático — anemia hemolítica mediada inmunológicamente Trastornos gastrointestinales — colitis, pancreatitis Trastornos generales y Condiciones del lugar de administración — edema Lesiones, intoxicaciones y complicaciones del procedimiento — Se ha informado la existencia de reacciones evocadoras de radiación en pacientes que han recibido radioterapia anteriormente. Trastornos respiratorios — neumonitis intersticial Piel — Condiciones ampollosas, incluido el síndrome de Stevens-Johnson y la necrólisis epidérmica tóxica. Algunos casos fueron fatales. 7 INTERACCIONES CON OTROS MEDICAMENTOS 7.1 Medicamentos antinflamatorios no esteroides (AINES) Aunque el ibuprofeno (400 mg cuatro veces al día) puede disminuir la depuración de pemetrexed, se puede administrar con ALIMTA en pacientes con función renal normal (depuración de creatinina ≥80 mL/min). No es necesario ajustar la dosis de ALIMTA con AINES concomitantes en pacientes con función renal normal [véase Farmacología clínica (12.3)]. Se debe tener precaución al administrar AINES simultáneamente con ALIMTA a pacientes con insuficiencia renal de leve a moderada (depuración de creatinina de 45 a 79 mL/min). Deben evitarse los AINES con vida media de eliminación corta (por ejemplo, diclofenaco, indometacina) durante un período de 2 días antes, el día de la administración de ALIMTA y 2 días después. A falta de datos con respecto a la posible interacción entre ALIMTA y AINES con vida media más extensa (por ejemplo, meloxicam, nabumetona), los pacientes que reciban estos AINES deberían interrumpir la dosis durante al menos 5 días antes, el día de la administración de ALIMTA y 2 días después. De ser necesaria la administración concomitante de AINES, los pacientes deben ser vigilados cuidadosamente para detectar algún grado de toxicidad, especialmente mielosupresión y toxicidad gastrointestinal y renal. 7.2 Medicamentos nefrotóxicos ALIMTA se elimina principalmente sin cambios por vía renal como resultado de la filtración glomerular y la secreción tubular. La administración concomitante de medicamentos nefrotóxicos podría producir la eliminación retrasada de ALIMTA. La administración concomitante de sustancias de secreción tubular (por ejemplo, probenecid) podría retrasar la eliminación de ALIMTA. 8 USO EN POBLACIONES ESPECÍFICAS 8.1 Embarazo Efectos teratogénicos – Categoría D para embarazo [véase Advertencias y precauciones (5.6)] Basado en su mecanismo de acción, ALIMTA puede producir daño fetal cuando se administra en mujeres embarazadas. No existen estudios adecuados y correctamente controlados de ALIMTA en mujeres embarazadas. El pemetrexed registró efectos embriotóxicos, fetotóxicos y teratogénicos en los ratones. En los ratones, las dosis intraperitoneales repetidas de pemetrexed, cuando fueron administradas durante la organogénesis, causaron malformaciones fetales (osificación incompleta del talus y del hueso del cráneo; aproximadamente 1/833 de la dosis intravenosa recomendada en humanos sobre una base mg/m2) y paladar hendido (1/33 de la dosis intravenosa recomendada en humanos sobre una base mg/m2). La embriotoxicidad se caracterizó por el aumento de las muertes embriofetales y la reducción del tamaño de las crías. Si ALIMTA se utiliza durante el embarazo, o si la paciente queda embarazada mientras toma este medicamento, se debe advertir a la paciente de los posibles riesgos para el feto. Se debe advertir a las mujeres en edad fértil que utilicen medidas anticonceptivas eficaces para evitar el embarazo durante el tratamiento con ALIMTA. 8.3 Madres lactantes Se desconoce si ALIMTA o sus metabolitos se excretan en la leche materna. Debido a que muchos medicamentos se excretan en la leche materna y debido al potencial de reacciones adversas graves de ALIMTA en lactantes, se debe tomar la decisión de suspender la lactancia o interrumpir el medicamento, teniendo en cuenta la importancia del medicamento para la madre. 8.4 Uso pediátrico No ha sido comprobada la eficacia de ALIMTA en pacientes pediátricos. ALIMTA se administró como infusión por vía intravenosa durante 10 minutos el primer día de un ciclo de 21 días a pacientes pediátricos con tumores sólidos recurrentes en un estudio de fase 1 (32 pacientes) y un estudio de fase 2 (72 pacientes). Todos los pacientes recibieron tratamiento previo con suplementación con vitamina B12 y ácido fólico y dexametasona. El aumento de la dosis en el estudio de fase 1 determinó que la dosis máxima tolerada fue de 1910 mg/m2 y esta dosis (o 60 mg/kg para pacientes <12 meses de edad) se evaluó en el estudio de fase 2 de pacientes con osteosarcoma refractario o recidivante, sarcoma de Ewing/Tumores neuroectodérmicos primitivos (PNET) periféricos, rabdomiosarcoma, neuroblastoma, ependimoma, meduloblastoma/PNET supratentoriales o glioma de grado alto que no forma parte del tronco encefálico. No se observaron reacciones entre los 72 pacientes en este ensayo de fase 2. Las toxicidades más frecuentes registradas fueron anomalías hematológicas (leucopenia, neutropenia/granulocitopenia, anemia, trombocitopenia y linfopenia), anomalías de la función hepática (aumento de ALT/AST), fatiga y náuseas. Se evaluó la farmacocinética de dosis única de ALIMTA administrada en dosis que van desde 400 hasta 2480 mg/m2 en el ensayo de fase 1 en 22 pacientes (13 hombres y 9 mujeres) de edades que oscilaban entre 4 y 18 años (la edad promedio era de 12 años). La exposición a pemetrexed (Área bajo la curva [AUC] y Cmax [concentración máxima]) pareció aumentar proporcionalmente con la dosis. La depuración de pemetrexed promedio (2.30 L/h/m2) y la vida media (2.3 horas) en pacientes pediátricos fue comparable a los valores obtenidos en adultos. 8.5 Uso geriátrico Se sabe que ALIMTA se excreta principalmente por los riñones, y el riesgo de reacciones adversas a este medicamento puede ser mayor en pacientes con función renal deficiente. Se recomienda el monitoreo de la función renal durante la administración de ALIMTA. No son necesarias las reducciones de dosis diferentes a las recomendadas a todos los pacientes en personas de 65 años o mayores [véase Dosificación y administración (2.4)]. De 3,946 pacientes (34.0% ≥65) estudiados en los cinco ensayos clínicos [véase Estudios clínicos (14.1, 14.2, 14.3 y 14.4)], el efecto de ALIMTA en la supervivencia fue similar en los pacientes <65 comparado con los ≥65 años. No hubo diferencias en la seguridad con la excepción de las siguientes reacciones adversas de Grado 3-4, que se comprobaron que fueron superiores en al menos uno de los cinco ensayos en los pacientes de 65 años y mayores, en comparación con los pacientes más jóvenes: anemia, fatiga, trombocitopenia, hipertensión y neutropenia. 8.6 Pacientes con insuficiencia hepática No hubo efectos de AST y ALT o de la bilirrubina total elevadas en la farmacocinética de pemetrexed. Sin embargo, no se han realizado estudios formales para examinar la farmacocinética de pemetrexed en pacientes con insuficiencia hepática [véase Farmacología clínica (12.3)]. 8.7 Pacientes con insuficiencia renal Se sabe que ALIMTA se excreta principalmente por los riñones. La disminución de la función renal se traducirá en la reducción de la depuración y en una mayor exposición (AUC) a ALIMTA en comparación con los pacientes con función renal normal [véase Dosificación y administración (2.4) y Farmacología clínica (12.3)]. No se ha estudiado la administración concomitante de cisplatino con ALIMTA en pacientes con insuficiencia renal moderada. 8.8 Género De 3,946 pacientes (70.5% masculinos) analizados en los cinco estudios de registro para las indicaciones de ALIMTA [véase Estudios clínicos (14.1, 14.2, 14.3 y 14.4)], el efecto de ALIMTA en la supervivencia fue similar en los pacientes masculinos y femeninos. 8.9 Raza De 3,946 pacientes (78.6% caucásicos) analizados en los cinco estudios de registro para las indicaciones de ALIMTA [véase Estudios clínicos (14.1, 14.2, 14.3 y 14.4)], el efecto de ALIMTA en la supervivencia fue similar en los pacientes caucásicos y no caucásicos. 10 SOBREDOSIS Hubo pocos casos de sobredosis con ALIMTA. Los casos de toxicidad informados incluyeron neutropenia, anemia, trombocitopenia, mucositis y erupción. Las complicaciones por sobredosis previstas incluyen supresión de la médula ósea, manifestada por neutropenia, trombocitopenia y anemia. Además, puede observarse infección con o sin fiebre, diarrea y mucositis. Si se produce una sobredosis, se deberán establecer las medidas de apoyo generales que el médico tratante considere necesarias. En los ensayos clínicos, se permitió el uso de leucovorina para leucopenia de Grado 4 según los CTC, que duraba ≥3 días, para neutropenia de Grado 4 según los CTC, que duraba ≥3 días, e inmediatamente para trombocitopenia de Grado 4 según los CTC, para hemorragia asociada con trombocitopenia de Grado 3 o mucositis de Grado 3 o 4. Para uso intravenoso se recomendaron las siguientes dosis y esquemas de administración de leucovorina: 100 mg/m2, por vía intravenosa una vez, seguidos de leucovorina, 50 mg/m2, por vía intravenosa cada 6 horas durante 8 días. Se desconoce la capacidad de ALIMTA para ser dializado. 11 DESCRIPCIÓN El pemetrexed disódico heptahidratado lleva el nombre químico L-Ácido glutámico, N-[4-[2-(2-amino-4, 7-dihidro-4-oxo-1H-pirrolo[2,3-d]pirimidin-5-il)etil] benzoil]-, sal disódica, heptahidratada. Es un sólido de color blanco a blanquecino, cuya fórmula molecular es C20H19N5Na2O6•7H2O y tiene un peso molecular de 597.49. La fórmula estructural es la siguiente: ALIMTA (pemetrexed inyectable), para uso intravenoso ALIMTA (pemetrexed inyectable), para uso intravenoso PV 8927 AMP ALIMTA se presenta en polvo liofilizado estéril para infusión por vía intravenosa disponible en frascos de dosis unitaria. El producto es un sólido liofilizado que va de color blanco a amarillo claro o amarillo verdoso. Cada frasco ampolla de 100 mg o 500 mg de ALIMTA contiene pemetrexed disódico, equivalente a 100 mg de pemetrexed y 106 mg de manitol o 500 mg de pemetrexed y 500 mg de manitol, respectivamente. Se puede haber añadido ácido clorhídrico y/o hidróxido de sodio para ajustar el pH. 12 FARMACOLOGÍA CLÍNICA 12.1 Mecanismo de acción ALIMTA, pemetrexed inyectable, es un inhibidor metabólico análogo del folato que ejerce su acción mediante la interrupción de los procesos metabólicos dependientes del folato esenciales para la replicación celular. Los estudios in vitro han demostrado que pemetrexed inhibe la timidilato sintasa (TS), la dihidrofolato reductasa (DHFR) y la glicinamida ribonucleótido formiltransferasa (GARFT), que son enzimas dependientes del folato implicadas en la biosíntesis de novo de los nucleótidos timidina y purina. El pemetrexed es transportado hacia las células por los transportadores de membrana, como el transportador de folato reducido y los sistemas de transporte de la proteína de unión a folato asociada a la membrana. Una vez en la célula, la enzima folilpoliglutamato sintasa convierte al pemetrexed en formas de poliglutamato. Las formas de poliglutamato se retienen en las células y son inhibidores de la TS y la GARFT. La poliglutamación es un proceso dependiente del tiempo y de la concentración que ocurre en las células tumorales, y se cree que en menor medida en los tejidos normales. Se cree que los metabolitos poliglutamados tienen una mayor vida media intracelular, lo que da como resultado una acción prolongada del medicamento en las células malignas. 12.2 Farmacodinámica Los estudios preclínicos han demostrado que pemetrexed inhibe el crecimiento in vitro de las líneas celulares del mesotelioma (MSTO-211H, NCI-H2052). Los estudios con línea celular de mesotelioma MSTO-211H mostraron efectos sinérgicos cuando pemetrexed se administró simultáneamente con cisplatino. El recuento absoluto de neutrófilos después de la administración como agente único de ALIMTA a pacientes que no recibieron la suplementación con ácido fólico y vitamina B12 fue descrito mediante análisis farmacodinámicos de población. La gravedad de la toxicidad hematológica, medida por la profundidad de la cifra mínima del recuento absoluto de neutrófilos, se correlaciona con la exposición sistémica o el área bajo la curva (AUC) de pemetrexed. También se observó que se produjeron cifras mínimas del recuento absoluto de neutrófilos inferiores en pacientes con concentraciones basales elevadas de cistationina u homocisteína. Los niveles de estas sustancias pueden verse reducidos por la suplementación con ácido fólico y vitamina B12. No se observa ningún efecto acumulativo de la exposición de pemetrexed en la cifra mínima del recuento absoluto de neutrófilos a lo largo de los múltiples ciclos de tratamiento. El tiempo hasta la cifra mínima del recuento absoluto de neutrófilos con la exposición sistémica de pemetrexed (AUC) osciló entre 8 y 9.6 días en un rango de exposiciones de 38.3 a 316.8 mcg•hr/mL. El recuento absoluto de neutrófilos volvió a los niveles basales entre 4.2 y 7.5 días después de la cifra mínima en el mismo rango de exposiciones. 12.3 Farmacocinética Absorción Se evaluó la farmacocinética de ALIMTA administrado como agente único en dosis que varían desde 0.2 hasta 838 mg/m2 infundidas durante un período de 10 minutos en 426 pacientes con cáncer con una variedad de tumores sólidos. La exposición sistémica total de pemetrexed (AUC) y la concentración máxima en plasma (Cmax) aumentan proporcionalmente con la dosis. La farmacocinética de pemetrexed no cambia a lo largo de los múltiples ciclos de tratamiento. PV 8927 AMP Tabla 10: Quimioterapia de primera línea: Resumen de las características de los pacientes en el estudio sobre el CPCNP (continuación) Distribución El pemetrexed tiene un volumen de distribución constante de 16.1 litros. Los estudios in vitro indican que pemetrexed se une a las proteínas plasmáticas aproximadamente en un 81%. La unión no se ve afectada por el grado de insuficiencia renal. Metabolismo y excreción Características del paciente El pemetrexed no se metaboliza en una medida considerable y se elimina principalmente en la orina, con un 70% a 90% de la dosis recuperada sin cambios dentro de las primeras 24 horas posteriores a la administración. La depuración disminuye y la exposición (AUC) aumenta, a medida que la función renal disminuye. La depuración sistémica total de pemetrexed es de 91.8 mL/min y la vida media de la eliminación de pemetrexed es de 3.5 horas en pacientes con función renal normal (depuración de creatinina 90 mL/min). Se examinó la farmacocinética de pemetrexed en poblaciones especiales en unos 400 pacientes en estudios controlados y de un solo grupo. Los estudios in vitro indican que pemetrexed es un sustrato del transportador de aniones orgánicos 3 (OAT3), un transportador que puede desempeñar un papel en la secreción activa de pemetrexed. Estadio al ingresar IIIb/IV Histología CPCNP no escamosasa Adenocarcinoma Células grandes Otrosb Escamosas PS del ECOGc,d 0/1 Antecedentes de tabaquismoe Fumador/No fumador Efecto de la edad, el género o la raza No se observó ningún efecto relacionado con la edad sobre la farmacocinética de pemetrexed en un rango de edades de 26 a 80 años. La farmacocinética de pemetrexed no fue diferente en pacientes masculinos y femeninos. La farmacocinética de pemetrexed fue similar en pacientes caucásicos y pacientes de ascendencia africana. No existen datos suficientes para comparar la farmacocinética para otros grupos étnicos. Efecto de la insuficiencia hepática No hubo efectos de AST y ALT o de la bilirrubina total elevadas en la farmacocinética de pemetrexed. Sin embargo, no se han realizado estudios en pacientes con insuficiencia hepática [véase Dosificación y administración (2.4) y Uso en poblaciones específicas (8.6)]. Efecto de la insuficiencia renal Los análisis farmacocinéticos de pemetrexed incluyeron 127 pacientes con función renal reducida. La depuración plasmática de pemetrexed disminuye a medida que se reduce la función renal, con el consiguiente aumento en la exposición sistémica. Los pacientes con depuración de creatinina de 45, 50 y 80 mL/min registraron aumentos del 65%, 54% y 13%, respectivamente, en la exposición sistémica total de pemetrexed (AUC), en comparación con los pacientes con depuración de creatinina de 100 mL/min [véase Advertencias y precauciones (5.4) y Dosificación y administración (2.4)]. Efecto de fluidos del tercer espacio No está completamente definido el efecto de los fluidos del tercer espacio en ALIMTA, como el derrame pleural y la ascitis. Se realizó un estudio con ALIMTA de 500 mg/m2 en 31 pacientes con tumores sólidos con fluidos estables del tercer espacio (Todos menos 2 de los 31 pacientes incluidos en el estudio registraron cantidades leves o moderadas de fluidos del tercer espacio). Se determinó que el derrame pleural moderado en el estudio fue inferior a 1/3 ascendente en un lado con oscurecimiento de la totalidad del hemidiafragma. Se determinó que la ascitis moderada es detectable en el examen físico. Las concentraciones de pemetrexed en plasma en estos pacientes fueron comparables con las observadas en los ensayos clínicos previos en pacientes sin acumulaciones de fluidos del tercer espacio. Por lo tanto, debe considerarse el drenaje de la acumulación de leve a moderada de los fluidos del tercer espacio antes del tratamiento con ALIMTA, pero probablemente no sea necesario. Se desconoce el efecto de la acumulación grave de fluidos en el tercer espacio en la farmacocinética. La aspirina, administrada en dosis bajas a moderadas (325 mg cada 6 horas), no afecta a la farmacocinética de pemetrexed. Se desconoce el efecto de mayores dosis de aspirina en la farmacocinética de pemetrexed. Efecto del cisplatino El cisplatino no afecta la farmacocinética de pemetrexed y la farmacocinética del platino total se mantiene inalterada por pemetrexed. Efecto de las vitaminas a b Se realizó un estudio multicéntrico, aleatorizado y abierto en 1725 pacientes con estadio IIIB/CPCNP IV que nunca habían recibido quimioterapia para comparar la supervivencia total después del tratamiento con ALIMTA en combinación con cisplatino (AC) versus gemcitabina en combinación con cisplatino (GC). Se administró ALIMTA por vía intravenosa durante 10 minutos a una dosis de 500 mg/m2 con cisplatino administrado por vía intravenosa a una dosis de 75 mg/m2 después de la administración de ALIMTA el primer día de cada ciclo de 21 días. La gemcitabina se administró a una dosis de 1250 mg/m2 el día 1 y el día 8, y el cisplatino se administró por vía intravenosa a una dosis de 75 mg/m2 después de la administración de gemcitabina, el primer día de cada ciclo de 21 días. Se administró el tratamiento hasta un total de 6 ciclos, y los pacientes en ambos grupos de tratamiento recibieron ácido fólico, vitamina B12 y dexametasona [véase Dosificación y administración (2.3)]. La demografía de los pacientes de la población con intención de tratar (ITT) se muestra en la Tabla 10. Se ajustaron los datos demográficos y las características de la enfermedad. Tabla 10: Quimioterapia de primera línea: Resumen de las características de los pacientes en el estudio sobre el CPCNP ALIMTA más cisplatino (AC) Gemcitabina más cisplatino (GC) Características del paciente (N=862) (N=863) Edad (años) Mediana (rango) 61.1 (28.8-83.2) 61.0 (26.4-79.4) Género Masculinos/Femeninos 70.2%/29.8% 70.1%/29.9% Origen 680 (78.8%) 669 (77.6%) Caucásico 23 (2.7%) 27 (3.1%) Hispano 141 (16.3%) 146 (16.9%) Asiático 18 (2.1%) 18 (2.1%) Ascendencia africana ALIMTA (pemetrexed inyectable), para uso intravenoso PV 8927 AMP 634 (73.5%) 411 (47.6%) 77 (8.9%) 146 (16.9%) 229 (26.5%) 35.4%/64.6% 35.6%/64.3% 83.1%/16.9% 83.9%/16.1% 1.0 0.9 Probabilidad de supervivencia 14 ESTUDIOS CLÍNICOS 14.1 Cáncer de pulmón de células no pequeñas (CPCNP) – Combinación con cisplatino 618 (71.7%) 436 (50.6%) 76 (8.8%) 106 (12.3%) 244 (28.3%) Ajustado por género, estadio, base del diagnóstico y estado de desempeño. El cociente de riesgo que es inferior a 1.0 indica que la supervivencia es mejor en el grupo AC que en el grupo GC. Alternativamente, el cociente de riesgo que es superior a 1.0 indica que la supervivencia es mejor en el grupo GC que en el grupo AC. 13 TOXICOLOGÍA NO CLÍNICA 13.1 Carcinogénesis, mutagénesis, problemas de fertilidad No se realizaron estudios de carcinogenicidad con pemetrexed. El pemetrexed fue clastogénico en el ensayo de micronúcleos in vivo en la médula ósea de ratón, pero no fue mutagénico en varios ensayos in vitro (ensayo de Ames, ensayo de células de ovario de hámster chino [CHO]). Pemetrexed administrado en dosis intravenosas de 0.1 mg/kg/día o superiores a ratones macho (aproximadamente 1/1666 de la dosis recomendada en humanos sobre una base de mg/m2) dio como resultado una reducción de la fertilidad, hipospermia y atrofia testicular. 24.3%/75.7% Tabla 11: Quimioterapia de primera línea: Eficacia en el CPCNP – Población con intención de tratar ALIMTA más cisplatino Gemcitabina más (N=862) cisplatino (N=863) Mediana de supervivencia total (IC de 95%) 10.3 meses (9.8-11.2) 10.3 meses (9.6-10.9) Cociente de riesgo ajustado (HR)a,b (IC de 95%) 0.94 (0.84-1.05) Mediana de supervivencia sin progresión 4.8 meses (4.6-5.3) 5.1 meses (4.6-5.5) (CI del 95%) Cociente de riesgo ajustado (HR)a,b 1.04 (0.94-1.15) (IC de 95%) Tasa total de respuesta (IC de 95%) 27.1% (24.2-30.1) 24.7% (21.8-27.6) Efecto de la aspirina Los resultados de los estudios in vitro con microsomas hepáticos humanos predicen que pemetrexed no causaría una inhibición clínicamente significativa de la depuración metabólica de los medicamentos metabolizados por las enzimas CYP3A, CYP2D6, CYP2C9 y CYP1A2. 23.8%/76.2% Incluye adenocarcinoma, células grandes y otras histologías, excepto aquellas con tipo de células escamosas. b El subgrupo de “otros” representa a los pacientes con un diagnóstico primario de CPCNP cuya enfermedad definitivamente no califica como adenocarcinoma, carcinoma de células escamosas o carcinoma de células grandes. c Estado de desempeño del Grupo Oncológico Cooperativo del Este. d El Estado de desempeño del Grupo Oncológico Cooperativo del Este no fue informado por todos los pacientes aleatorizados. Los porcentajes son representativos de N=861 para el grupo de ALIMTA más cisplatino y N=861 para el grupo de gemcitabina más cisplatino. e Se recogieron antecedentes de tabaquismo en el 88% de los pacientes aleatorizados (N=757 para el grupo de ALIMTA más cisplatino y N=759 para el grupo de gemcitabina más cisplatino). Los pacientes recibieron una mediana de 5 ciclos de tratamiento en ambos grupos del estudio. Los pacientes tratados con ALIMTA más cisplatino recibieron una intensidad de dosis relativa del 94.8% de la intensidad de la dosis de ALIMTA especificada en el protocolo y el 95.0% de la intensidad de la dosis de cisplatino especificada en el protocolo. Los pacientes tratados con gemcitabina más cisplatino recibieron una intensidad de dosis relativa del 85.8% de la intensidad de la dosis de gemcitabina especificada en el protocolo y el 93.5% de la intensidad de la dosis de cisplatino especificada en el protocolo. El objetivo primario de este estudio fue la supervivencia total. La mediana de tiempo de supervivencia fue de 10.3 meses en el grupo de tratamiento de ALIMTA más cisplatino y de 10.3 meses en el grupo de gemcitabina más cisplatino, con un cociente de riesgo ajustado de 0.94. Las dosis de ibuprofeno de 400 mg administradas cuatro veces al día reducen la depuración de pemetrexed en un 20% aproximadamente (y aumentan el AUC en un 20%) en pacientes con función renal normal. Se desconoce el efecto de mayores dosis de ibuprofeno en la farmacocinética de pemetrexed [véase Interacciones de medicamentos (7.1)]. Medicamentos metabolizados por las enzimas del citocromo P450 Gemcitabina más cisplatino (GC) (N=863) a Efecto del ibuprofeno La administración concomitante de ácido fólico por vía oral o de vitamina B12 por vía intramuscular no afecta la farmacocinética de pemetrexed. ALIMTA más cisplatino (AC) (N=862) AC (ALIMTA más cisplatino) GC (gemcitabina más cisplatino) AC versus GC 0.8 0.7 0.6 Mediana (IC de 95%) 10.3 (9.8, 11.2) 10.3 (9.6, 10.9) Cociente de riesgo ajustado (IC de 95%) 0.94 (0.84, 1.05) 0.5 0.4 0.3 0.2 0.1 0.0 0 6 12 18 24 30 Tiempo de supervivencia (meses) Pacientes en riesgo AC (ALIMTA 862 más cisplatino) GC (gemcitabina más cisplatino) 863 598 341 146 45 0 590 327 139 34 0 Figura 1: Curvas de Kaplan-Meier para la supervivencia total de ALIMTA más cisplatino (AC) versus gemcitabina más cisplatino (GC) en CPCNP – Población con intención de tratar. Se examinó un análisis preespecificado del impacto de la histología del CPCNP sobre la supervivencia total. Se observaron diferencias clínicamente significativas en la supervivencia según la histología, las cuales se muestran en la Tabla 12. Esta diferencia en el efecto del tratamiento con ALIMTA basado en la histología que demuestra una falta de eficacia en la histología de células escamosas también se observó en el estudio de segunda línea como agente único y en el estudio de mantenimiento [véase Estudios clínicos (14.2, 14.3)]. ALIMTA (pemetrexed inyectable), para uso intravenoso PV 8927 AMP Tabla 12: Quimioterapia de primera línea: Supervivencia total en subgrupos histológicos del CPCNP Subgrupo histológico Mediana de supervivencia total en meses (IC de 95%) ALIMTA más cisplatino Gemcitabina más cisplatino Cociente de Cociente de riesgo ajustado riesgo no (HR)a,b,c ajustado (HR)a,b (IC de 95%) (IC de 95%) CPCNP no escamosasd (N=1252) 11.0 (10.1-12.5) N=618 10.1 (9.3-10.9) N=634 0.84 (0.74-0.96) 0.84 (0.74-0.96) Adenocarcinoma (N=847) 12.6 (10.7-13.6) N=436 10.9 (10.2-11.9) N=411 0.84 (0.71-0.98) 0.84 (0.71-0.99) Células grandes (N=153) 10.4 (8.6-14.1) N=76 6.7 (5.5-9.0) N=77 0.68 (0.48-0.97) 0.67 (0.48-0.96) Otrose (N=252) 8.6 (6.8-10.2) N=106 9.2 (8.1-10.6) N=146 1.12 (0.84-1.49) 1.08 (0.81-1.45) 9.4 (8.4-10.2) N=244 10.8 (9.5-12.1) N=229 1.22 (0.99-1.50) 1.23 (1.00-1.51) Células escamosas (N=473) 14.2 Cáncer de pulmón de células no pequeñas – Mantenimiento Mantenimiento con ALIMTA después del tratamiento de inducción sin ALIMTA con platino Se realizó un estudio multicéntrico, aleatorizado, doble ciego, controlado con placebo en 663 pacientes con estadio IIIb/ CPCNP IV que no progresaron después de cuatro ciclos de quimioterapia con platino. Los pacientes que no progresaron fueron aleatorizados 2:1 para recibir ALIMTA o placebo inmediatamente después de la quimioterapia con platino. De los pacientes aleatorizados, el 47.2% versus 52.7% logró una respuesta total o parcial al tratamiento de inducción y el 51.9% versus 47.3% experimentó una estabilización en la enfermedad después del tratamiento de inducción en los grupos de ALIMTA y placebo, respectivamente. ALIMTA se administró por vía intravenosa durante 10 minutos a una dosis de 500 mg/m2 el primer día de cada ciclo de 21 días, hasta la progresión de la enfermedad. Los pacientes de ambos grupos de estudio recibieron ácido fólico, vitamina B12, y dexametasona [véase Dosificación y administración (2.3)]. El objetivo del estudio fue demostrar una supervivencia superior sin progresión y la supervivencia total de ALIMTA sobre el placebo. Con una revisión independiente se evaluó la supervivencia sin progresión (PFS). Las características de los pacientes de la población con intención de tratar (ITT) se muestran en la Tabla 13. Se ajustaron los datos demográficos y las características de la enfermedad de base entre los grupos de estudio. Tabla 13: Tratamiento de mantenimiento después del tratamiento de inducción con platino: Resumen de las características de los pacientes en el estudio sobre el CPCNP Características del paciente a El cociente de riesgo que es inferior a 1.0 indica que la supervivencia es mejor en el grupo AC que en el grupo GC. Alternativamente, el cociente de riesgo que es superior a 1.0 indica que la supervivencia es mejor en el grupo GC que en el grupo AC. b Sin ajustar para comparaciones múltiples. c Cociente de riesgo ajustado para el PS del ECOG, género, estadio de la enfermedad y la base para el diagnóstico patológico (histopatológico/citopatológico). d Incluye adenocarcinoma, células grandes y otras histologías, excepto aquellas con tipo de células escamosas. e El subgrupo de “otros” representa a los pacientes con un diagnóstico primario de CPCNP cuya enfermedad definitivamente no califica como adenocarcinoma, carcinoma de células escamosas o carcinoma de células grandes. Edad (años) Mediana (rango) CPCNP no escamosas 1.0 Probabilidad de supervivencia AC (ALIMTA más cisplatino) GC (gemcitabina más cisplatino) 0.8 0.6 0.4 0.2 0.0 0 6 12 18 24 Tiempo de supervivencia (meses) CPCNP de células escamosas 30 1.0 Probabilidad de supervivencia AC (ALIMTA más cisplatino) 0.8 GC (gemcitabina más cisplatino) 0.6 0.4 60.6 (25.6-82.6) 60.4 (35.4-78.5) 73.0%/27.0% 72.5%/27.5% Origen étnico Caucásico De Asia Oriental Otros 279 (63.3%) 104 (23.6%) 58 (13.2%) 149 (67.1%) 50 (22.5%) 23 (10.4%) Estadio al ingresara IIIb/IV 18.0%/82.0% 21.2%/78.8% Histología (%) CPCNP no escamosasb Adenocarcinoma Células grandes Otrosc Escamosas 325 (73.7%) 222 (50.3%) 10 (2.3%) 93 (21.1%) 116 (26.3%) 156 (70.3%) 106 (47.7%) 10 (4.5%) 40 (18.0%) 66 (29.7%) PS del ECOGd 0/1 40.1%/59.9% 38.3%/61.7% Antecedentes de tabaquismoe Fumador/No fumador 74.1%/25.9% 71.5%/28.5% Tiempo desde el inicio del tratamiento de inducción para estudiar la aleatorización (meses) Mediana (rango) 3.25 (1.6-4.8) 3.29 (2.7-5.1) a El estadio al ingresar no fue informado por todos los pacientes aleatorizados. Los porcentajes son representativos de N=440 para el grupo de ALIMTA y N=222 para el grupo de placebo. b Incluye pacientes con adenocarcinoma, células grandes y otros diagnósticos histológicos. c El subgrupo de “otros” representa a los pacientes con un diagnóstico primario de CPCNP, cuya enfermedad definitivamente no califica como adenocarcinoma, carcinoma de células grandes o carcinoma de células escamosas. d El Estado de desempeño del Grupo Oncológico Cooperativo del Este (PS del ECOG) no fue comunicado por todos los pacientes aleatorizados. Los porcentajes son representativos de N=439 para el grupo de ALIMTA y N=222 para el grupo de placebo. e Los antecedentes de tabaquismo no fueron informados por todos los pacientes aleatorizados. Los porcentajes son representativos de N=437 para el grupo de ALIMTA y N=221 para el grupo de placebo. Los pacientes recibieron una mediana de 5 ciclos de ALIMTA y 3.5 ciclos de placebo. Los pacientes aleatorizados a ALIMTA recibieron una intensidad de dosis relativa del 95.7%. Un total de 213 pacientes (48.3%) completó ≥6 ciclos y un total de 98 pacientes (22.6%) completó ≥10 ciclos de tratamiento con ALIMTA. En la población total del estudio, ALIMTA fue estadísticamente superior al placebo en términos de supervivencia total (OS) (mediana de 13.4 meses versus 10.6 meses, cociente de riesgo=0.79 (IC de 95%): 0.65-0.95), valor p=0.012) y supervivencia sin progresión (mediana de 4.0 meses versus 2.0 meses, cociente de riesgo=0.60 (IC de 95%: 0.49-0.73), valor p<0.00001). Se observó una diferencia en los resultados del tratamiento de acuerdo con la clasificación histológica. Para la población de pacientes con CPCNP no escamosas, ALIMTA fue superior al placebo en cuanto a la supervivencia global (mediana de 15.5 meses versus 10.3 meses, cociente de riesgo=0.70 (IC de 95%: 0.56-0.88) y supervivencia sin progresión (mediana de 4.4 meses versus 1.8 meses, cociente de riesgo=0.47 (IC de 95%: 0.37-0.60)). Para la población de pacientes con CPCNP escamosas, ALIMTA no aumentó la supervivencia global en comparación con el placebo (mediana de 9.9 meses versus 10.8 meses, cociente de riesgo=1.07 (IC de 95%: 0.77-1.50) o supervivencia sin progresión (mediana de 2.4 meses versus 2.5 meses, cociente de riesgo=1.03 (IC de 95%: 0.71-1.49)). Esta diferencia en el efecto del tratamiento con ALIMTA según la histología que demuestra la ausencia de beneficios en la histología de células escamosas también se observó en los estudios de primera línea y segunda línea. [véase Estudios clínicos (14.1, 14.3)] Los resultados de eficacia para la población total de pacientes se presentan en la Tabla 14 y en la Figura 3, y los resultados de eficacia obtenidos por los subgrupos histológicos preespecificados se presentan en la Tabla 15 y en la Figura 4, a continuación. Tabla 14: Tratamiento de mantenimiento después del tratamiento de inducción con platino: Eficacia de ALIMTA versus placebo en el CPCNP – Población con intención de tratar Mediana de supervivencia totalc (IC de 95%) Coeficiente de riesgo (HR)c (IC de 95%) Valor p Mediana de supervivencia sin progresión (IC de 95%) Coeficiente de riesgo (HR)c (IC de 95%) Valor p 0.2 0 6 12 18 24 Tiempo de supervivencia (meses) 30 ALIMTA Placebo (N=441) (N=222) 13.4 meses (11.9-15.9) 10.6 meses (8.7-12.0) 0.79 (0.65-0.95) p=0.012 4.0 meses (3.1-4.4) 2.0 meses (1.5-2.8) 0.60 (0.49-0.73) p<0.00001 a Figura 2: Curvas de Kaplan-Meier para la supervivencia total de ALIMTA más cisplatino (AC) versus gemcitabina más cisplatino (GC) en CPCNP – CPCNP no escamosas y CPCNP de células escamosas. ALIMTA (pemetrexed inyectable), para uso intravenoso Placebo (N=222) Género Masculinos/Femeninos Parámetro de eficaciaa,b 0.0 ALIMTA (N=441) PV 8927 AMP La supervivencia sin progresión y la supervivencia global fueron calculadas desde el momento de la aleatorización, después de completar 4 ciclos de quimioterapia de inducción con platino. b Valores de la supervivencia sin progresión proporcionados según revisión independiente (ALIMTA N=387, placebo N=194). c Se proporcionan coeficientes de riesgo no ajustados. Un coeficiente de riesgo <1.0 indica que el resultado es mejor en el grupo de ALIMTA que en el grupo de placebo. ALIMTA (pemetrexed inyectable), para uso intravenoso PV 8927 AMP CPCNP de células escamosas Tabla 15: Tratamiento de mantenimiento después del tratamiento de inducción con platino: Eficacia del CPCNP según los subgrupos histológicosa Supervivencia sin progresiónb Placebo ALIMTA Placebo Mediana (meses) Mediana (meses) Mediana (meses) Mediana (meses) Coeficiente de riesgoc (IC de 95%) CPCNP no escamosasd N=481 15.5 10.3 Coeficiente de riesgoc (IC de 95%) 4.4 0.70 (0.56-0.88) Adenocarcinoma N=328 Carcinoma de células grandes N=20 16.8 11.5 4.6 0.73 (0.56-0.96) 8.4 N=133 7.9 Células escamosas 11.3 4.5 1.5 0.40 (0.12-1.29) 7.7 4.1 0.61 (0.40-0.94) 9.9 2.7 0.51 (0.38-0.68) 0.98 (0.36-2.65) Otrose 1.8 0.47 (0.37-0.60) 10.8 1.6 0.44 (0.28-0.68) 2.4 2.5 N=182 1.07 (0.77-1.50) 1.03 (0.71-1.49) a La supervivencia sin progresión y la supervivencia global fueron calculadas desde el momento de la aleatorización, después de completar 4 ciclos de quimioterapia de inducción con platino. Los resultados no se ajustaron para comparaciones múltiples. b Valores de la supervivencia sin progresión proporcionados según revisión independiente (ALIMTA N=387, placebo N=194). c Se proporcionan coeficientes de riesgo no ajustados. Un coeficiente de riesgo <1.0 indica que el resultado es mejor en el grupo de ALIMTA que en el grupo de placebo. Un coeficiente de riesgo >1.0 indica que el resultado es mejor en el grupo de placebo que en el grupo de ALIMTA. d Incluye pacientes con adenocarcinoma, carcinoma de células grandes y otras histologías. e El subgrupo de “otros” representa a los pacientes con un diagnóstico primario de CPCNP, cuya enfermedad definitivamente no califica como adenocarcinoma, carcinoma de células grandes o carcinoma de células escamosas. Mediana (IC de 95%) 13.4 (11.9, 15.9) 10.6 (8.7, 12.0) Cociente de riesgo no ajustado (IC de 95%) 0.79 (0.65, 0.95) Probabilidad de supervivencia Probabilidad de supervivencia Supervivencia total ALIMTA Tiempo de supervivencia (meses) Pacientes en riesgo Figura 3: Curva de Kaplan-Meier para la supervivencia total de ALIMTA (A) versus placebo (P) en el CPCNP – Población con intención de tratar. Probabilidad de supervivencia CPCNP no escamosas Tiempo de supervivencia (meses) Tiempo de supervivencia (meses) Figura 4: Curvas de Kaplan-Meier para la supervivencia total de ALIMTA versus al placebo en el CPCNP – CPCNP no escamosas y CPCNP de células escamosas. (continuación) Continuación del mantenimiento con ALIMTA después del tratamiento de inducción ALIMTA más platino Se realizó un estudio multicéntrico, aleatorizado, doble ciego, controlado con placebo para evaluar la continuación de ALIMTA en pacientes con CPCNP no escamosas en estadio IIIb/IV. Los pacientes que completaron el tratamiento de inducción de cuatro ciclos de ALIMTA más cisplatino con estabilidad o mejoría de la enfermedad y un estado de desempeño de 0/1 fueron aleatorizados (2:1) para el tratamiento de mantenimiento con ALIMTA o placebo. La aleatorización se estratificó por la respuesta a la inducción (respuesta completa (RC)/respuesta parcial (RP) versus enfermedad estable (EE)), estadio de la enfermedad (IIIb versus IV) y el estado de desempeño del ECOG (0 versus 1). ALIMTA se administró por vía intravenosa durante 10 minutos a una dosis de 500 mg/m2 el primer día de cada ciclo de 21 días y continuó hasta la progresión de la enfermedad. Los pacientes de ambos grupos de estudio recibieron ácido fólico, vitamina B12 y dexametasona [véase Dosificación y administración (2.3)]. El resultado de eficacia principal fue la supervivencia sin progresión evaluada por el investigador. Un total de 539 pacientes fueron aleatorizados; todos completaron cuatro ciclos de inducción de ALIMTA y cisplatino antes de la aleatorización. De los pacientes aleatorizados, el 44% versus 42% logró una respuesta total o parcial al tratamiento de inducción y el 53% versus 53% experimentó una estabilización en la enfermedad después del tratamiento de inducción en los grupos de ALIMTA y placebo, respectivamente. Los datos demográficos de los paciente de la población por intención de tratar (ITT) se muestran en la Tabla 16. Tabla 16: ALIMTA como tratamiento de mantenimiento después del tratamiento de inducción de ALIMTA más cisplatino: Resumen de las características de los pacientes en el estudio sobre el CPCNP no escamosas ALIMTA Placebo Características del paciente (N=359) (N=180) Edad (años) Mediana 61.0 62.4 Rango 31.9-78.7 34.9-83.3 Género (%) Hombres 201 (56%) 112 (62%) Mujeres 158 (44%) 68 (38%) Origen étnico (%) Caucásico 339 (94%) 171 (95%) Asiático 16 (4.5%) 8 (4.4%) Africano 4 (1.1%) 1 (0.6%) Estadio al ingresar IIIb 31 (9%) 18 (10%) IV 328 (91%) 162 (90%) Histología (%) CPCNP no escamosasa Adenocarcinoma 310 (86%) 161 (89%) Células grandes 24 (7%) 12 (7%) Otrosb 25 (7%) 7 (3.9%) PS del ECOG (%) 0 113 (32%) 60 (33%) 1 245 (68%) 118 (66%) c Antecedentes de tabaquismo Fumador 274 (76%) 144 (80%) No fumador 83 (23%) 34 (19%) a Se determinó que el diagnóstico histológico o citológico del CPCNP era distinto del de la histología predominantemente de células escamosas (en este estudio no se permitió evaluar la histología de células escamosas y/o células pequeñas mixtas, ni de células no pequeñas). b La subcategoría de “otros” representa a los pacientes con un diagnóstico primario de CPCNP, cuya enfermedad definitivamente no califica como adenocarcinoma o carcinoma de células grandes. c Los antecedentes de tabaquismo no fueron informados por todos los pacientes aleatorizados. Los pacientes recibieron una mediana de cuatro ciclos de mantenimiento con ALIMTA o placebo. Los porcentajes de pacientes que recibieron tratamiento posterior al estudio fueron similares (64% en el grupo de ALIMTA y 72% en el grupo de placebo). El ensayo mostró una mejoría estadísticamente significativa en la supervivencia sin progresión y en la supervivencia total en los pacientes aleatorizados al mantenimiento con ALIMTA. Los resultados de eficacia se presentan en la Tabla 17 y en la Figura 5. Figura 4: Curvas de Kaplan-Meier para la supervivencia total de ALIMTA versus al placebo en el CPCNP – CPCNP no escamosas y CPCNP de células escamosas. ALIMTA (pemetrexed inyectable), para uso intravenoso PV 8927 AMP ALIMTA (pemetrexed inyectable), para uso intravenoso PV 8927 AMP Tabla 17: ALIMTA como tratamiento de mantenimiento después del tratamiento de inducción de ALIMTA más cisplatino: Eficacia de ALIMTA versus placebo en el CPCNP no escamosas ALIMTA Placebo Parámetro de eficaciaa,b (N=359) (N=180) Figura 5: Curvas de Kaplan-Meier para la supervivencia total de ALIMTA frente al placebo en CPCNP no escamosas después del tratamiento de inducción con ALIMTA más cisplatino. 14.3 Cáncer de pulmón de células no pequeñas – Después de quimioterapia previa Se realizó un estudio multicéntrico, aleatorizado y abierto en pacientes con CPCNP en estadio III o IV después de la quimioterapia previa para comparar la supervivencia total después del tratamiento con ALIMTA versus docetaxel. ALIMTA se administró por vía intravenosa durante 10 minutos a una dosis de 500 mg/m2 y docetaxel se administró a 75 mg/m2 en forma de infusión por vía intravenosa de 1 hora. Ambos medicamentos se administraron el primer día de cada ciclo de 21 días. Todos los pacientes tratados con ALIMTA recibieron suplementación con ácido fólico y vitamina B12. El objetivo del estudio era mostrar una superioridad en la supervivencia global o la no inferioridad de ALIMTA versus docetaxel. Los datos demográficos de los pacientes de la población por intención de tratar (ITT) se muestran en la Tabla 18. Tabla 18: Quimioterapia de segunda línea: Resumen de las características de los pacientes en el estudio sobre el CPCNP ALIMTA Docetaxel Características del paciente (N=283) (N=288) Edad (años) Mediana (rango) 59 (22-81) 57 (28-87) Género (%) Masculinos/Femeninos 68.6/31.4 75.3/24.7 Estadio al ingresar (%) III/IV 25.1/74.9 25.3/74.7 Diagnóstico/Histología (%) 142 (49.3) 154 (54.4) Adenocarcinoma 94 (32.6) 78 (27.6) Escamosas 1 (0.3) 4 (1.4) Broncoalveolar 51 (17.7) 47 (16.6) Otros Estado de desempeño (%)a 0-1 234 (88.6) 240 (87.6) 2 30 (11.4) 34 (12.4) a El estado de desempeño no fue informado por todos los pacientes aleatorizados. Los porcentajes son representativos de N=264 para el grupo de ALIMTA y N=274 para el grupo de docetaxel. El objetivo primario de este estudio fue la supervivencia total. La mediana de tiempo de supervivencia fue de 8.3 meses en el grupo de tratamiento con ALIMTA y de 7.9 meses en el grupo de docetaxel, con un cociente de riesgo de 0.99 (véase la Tabla 19). El estudio no evidenció una superioridad de supervivencia global de ALIMTA. Tabla 19: Eficacia de ALIMTA versus Docetaxel en el cáncer de pulmón de células no pequeñas – Población con intención de tratar ALIMTA Docetaxel (N=283) (N=288) Mediana de supervivencia total (Intervalo de confianza 8.3 meses (7.0-9.4) 7.9 meses (6.3-9.2) [IC de 95%]) Cociente de riesgo (HR) (IC de 95%) 0.99 (0.82-1.20) Mediana de supervivencia sin progresión (IC de 95%) 2.9 meses (2.4-3.1) 2.9 meses (2.7-3.4) Cociente de riesgo (HR) (CIC de 95%) 0.97 (0.82-1.16) Tasa total de respuesta (IC de 95%) 8.5% (5.2-11.7) 8.3% (5.1-11.5) Se examinó un análisis retrospectivo del impacto de la histología del CPCNP sobre la supervivencia total. Se observaron diferencias clínicamente significativas en la supervivencia según la histología, las cuales se muestran en la Tabla 20. Esta diferencia en el efecto del tratamiento con ALIMTA basado en la histología que demuestra una falta de eficacia en la histología de células escamosas también se observó en el estudio de combinación de primera línea y en el estudio de mantenimiento [véase Estudios clínicos (14.1, 14.2)]. Tabla 20: Quimioterapia de segunda línea: Supervivencia total de ALIMTA versus docetaxel en CPCNP según subgrupos histológicos Cociente de Mediana de supervivencia total en meses Cociente de riesgo ajustado (IC de 95%) riesgo no Subgrupo histológico ajustado (HR)a,b (HR)a,b,c (IC de ALIMTA Docetaxel (IC de 95%) 95%) CPCNP no escamosasd 9.3 N=205 8.0 N=194 0.89 0.78 (N=399) (7.8-9.7) (6.3-9.3) (0.71-1.13) (0.61-1.00) Adenocarcinoma 9.0 N=158 9.2 N=143 1.09 0.92 (N=301) (7.6-9.6) (7.5-11.3) (0.83-1.44) (0.69-1.22) Células grandes 12.8 N=18 4.5 N=29 0.38 0.27 (N=47) (5.8-14.0) (2.3-9.1) (0.18-0.78) (0.11-0.63) Otrose (N=51) 9.4 N=29 7.9 N=22 0.62 0.57 (6.0-10.1) (4.0-8.9) (0.32-1.23) (0.27-1.20) Células escamosas 6.2 N=78 7.4 N=94 1.32 1.56 (N=172) (4.9-8.0) (5.6-9.5) (0.93-1.86) (1.08-2.26) a El cociente de riesgo que es inferior a 1.0 indica que la supervivencia es mejor en el grupo de ALIMTA que en el grupo de docetaxel. Alternativamente, el cociente de riesgo que es superior a 1.0 indica que la supervivencia es mejor en el grupo de docetaxel que en el grupo de ALIMTA. b Sin ajustar para comparaciones múltiples. c Cociente de riesgo ajustado para el PS del ECOG, tiempo desde la quimioterapia previa, estadio de la enfermedad y género. d Incluye adenocarcinoma, células grandes y otras histologías, excepto aquellas con tipo de células escamosas. e El subgrupo de “otros” representa a los pacientes con un diagnóstico primario de CPCNP cuya enfermedad definitivamente no califica como adenocarcinoma, carcinoma de células escamosas o carcinoma de células grandes. 14.4 Mesotelioma pleural maligno Un estudio multicéntrico, aleatorizado, simple ciego en 448 pacientes sin quimioterapia previa con mesotelioma pleural maligno (MPM) comparó la supervivencia en pacientes tratados con ALIMTA en combinación con cisplatino con la supervivencia en pacientes que recibieron cisplatino solamente. ALIMTA se administró por vía intravenosa durante 10 minutos a una dosis de 500 mg/m2 y cisplatino se administró por vía intravenosa durante 2 horas a una dosis de 75 mg/m2 comenzando aproximadamente 30 minutos después del final de la administración de ALIMTA. Ambos medicamentos se administraron el primer día de cada ciclo de 21 días. Después de tratar a 117 pacientes, la toxicidad gastrointestinal y en los glóbulos blancos llevó a realizar un cambio en el protocolo, por el que todos los pacientes recibieron suplementación con ácido fólico y vitamina B12. El análisis primario de este estudio se realizó en la población de todos los pacientes aleatorizados al tratamiento que recibieron el medicamento del estudio (aleatorizados y tratados). También se realizó un análisis en los pacientes que recibieron la totalidad de suplementación con ácido fólico y vitamina B12 durante todo el tratamiento del estudio, ya que se recomienda administrar suplementación [véase Dosificación y administración (2.3)]. Los resultados en todos los pacientes y en aquellos a los que se les administró la totalidad de suplementación fueron similares. Los datos demográficos de los pacientes se muestran en la Tabla 21. Tabla 21: Resumen de las características de los pacientes en el estudio sobre el MPM Pacientes aleatorizados y Pacientes a los que se les tratados administró la totalidad de la suplementación Características del paciente ALIMTA/cisplatino Cisplatino ALIMTA/cisplatino Cisplatino (N=226) (N=222) (N=168) (N=163) Edad (años) Mediana (rango) 61 (29-85) 60 (19-84) 60 (29-85) 60 (19-82) Género (%) Hombres 184 (81.4) 181 (81.5) 136 (81.0) 134 (82.2) Mujeres 42 (18.6) 41 (18.5) 32 (19.0) 29 (17.8) Origen (%) 153 (93.9) 150 (89.3) 206 (92.8) 204 (90.3) Caucásico 7 (4.3) 10 (6.0) 12 (5.4) 11 (4.9) Hispano 3 (1.8) 7 (4.2) 4 (1.9) 10 (4.4) Asiático 0 1 (0.6) 0 1 (0.4) Ascendencia africana Estadio al ingresar (%) 12 (7.4) 15 (8.9) 14 (6.3) 16 (7.1) I 27 (16.8) 27 (16.2) 33 (15.0) 35 (15.6) II 49 (30.4) 51 (30.5) 68 (30.6) 73 (32.4) III 73 (45.3) 74 (44.3) 105 (47.2) 101 (44.9) IV 2 (1.2) 1 (0.6) 2 (0.9) 1 (0.4) Sin especificar Diagnóstico/Histologíaa (%) 113 (69.3) 117 (69.6) 152 (68.5) 154 (68.1) Epitelial 25 (15.3) 25 (14.9) 36 (16.2) 37 (16.4) Mixto 17 (10.4) 14 (8.3) 25 (11.3) 18 (8.0) Sarcomatoide 8 (4.9) 12 (7.1) 9 (4.1) 17 (7.5) Otros KPSb de referencia (%) 70-80 109 (48.2) 97 (43.7) 83 (49.4) 69 (42.3) 90-100 117 (51.8) 125 (56.3) 85 (50.6) 94 (57.7) a Solo el 67% de los pacientes tenía el diagnóstico histológico del mesotelioma maligno confirmado por un examen independiente. b Escala funcional de Karnofsky (KPS). La Tabla 22 y la Figura 6 resumen los resultados de supervivencia para todos los pacientes aleatorizados y tratados, independientemente del estado de la suplementación con vitaminas y de aquellos pacientes que recibieron la suplementación con vitaminas desde el momento de la inscripción en el ensayo. ALIMTA (pemetrexed inyectable), para uso intravenoso ALIMTA (pemetrexed inyectable), para uso intravenoso Mediana de supervivencia totalc (IC de 95%) 13.9 meses (12.8-16.0) 11.0 meses (10.0-12.5) Probabilidad de supervivencia 0.78 (0.64-0.96) Coeficiente de riesgo (HR)c (IC de 95%) Valor p p=0.02 Mediana de supervivencia sin progresión (IC de 95%) 4.1 meses (3.2-4.6) 2.8 meses (2.6-3.1) 0.62 (0.49-0.79) Coeficiente de riesgo (HR)c (IC de 95%) Valor p p<0.0001 a La supervivencia sin progresión y la supervivencia global fueron calculadas desde el momento de la aleatorización, después de completar 4 ciclos de quimioterapia de inducción con ALIMTA más cisplatino. b Valores de la supervivencia sin progresión basados en la evaluación del investigador. c Un cociente de riesgo de menos de 1 indica que el tratamiento de mantenimiento con pemetrexed se asocia a un menor riesgo de progresión o muerte en comparación con el tratamiento con placebo. Tiempo de supervivencia (meses) Pacientes en riesgo PV 8927 AMP PV 8927 AMP Función de distribución de la supervivencia Tabla 22: Eficacia de ALIMTA más cisplatino versus cisplatino en el mesotelioma pleural maligno Pacientes aleatorizados y Pacientes a los que se les tratados administró la totalidad de la suplementación Parámetro de eficacia ALIMTA/ Cisplatino ALIMTA/ Cisplatino cisplatino (N=222) cisplatino (N=163) (N=226) (N=168) Mediana de supervivencia total 12.1 meses 9.3 meses 13.3 meses 10.0 meses (IC de 95%) (10.0-14.4) (7.8-10.7) (11.4-14.9) (8.4-11.9) Cociente de riesgo 0.77 0.75 0.020 0.051 Valor p según prueba de log ranka a El valor p se refiere a la comparación entre los grupos. Se observaron resultados similares en el análisis de los pacientes (N=303) con diagnóstico histológico confirmado de mesotelioma pleural maligno. Había muy pocos pacientes que no eran de raza blanca para evaluar posibles diferencias étnicas. El efecto en las mujeres (mediana de supervivencia de 15.7 meses con la combinación versus 7.5 meses con cisplatino solamente), sin embargo, fue mayor que el efecto en los hombres (mediana de supervivencia de 11 versus 9.4, respectivamente). Como con cualquier análisis exploratorio, no está claro si esta diferencia es real o es un hallazgo casual. 17 INFORMACIÓN DE ASESORAMIENTO PARA PACIENTES Véase el etiquetado para pacientes aprobado por la FDA (PPI) Se debe indicar a los pacientes que lean el prospecto para el paciente antes de iniciar el tratamiento con ALIMTA. • Se debe informar a los pacientes sobre la necesidad de la suplementación con ácido fólico y vitamina B12 para reducir la toxicidad hematológica y gastrointestinal relacionada con el tratamiento y la necesidad de corticoesteroides para reducir la toxicidad dermatológica relacionada con el tratamiento [véase Dosificación y administración (2.3) y Advertencias y precauciones (5.1)]. • Se debe informar a los pacientes sobre el riesgo de los recuentos bajos de células sanguíneas y proporcionar directivas para que se pongan en contacto de inmediato con su médico si hubiera signos de infección, incluidos fiebre, hemorragia o síntomas de anemia. • Se debe indicar a los pacientes que se comuniquen con su médico si aparecen vómitos persistentes, diarrea o signos de deshidratación. • Se debe indicar a los pacientes que informen a su médico sobre todos los medicamentos concomitantes recetados o sin receta médica que estén tomando, especialmente aquellos para el dolor o inflamación, como medicamentos antinflamatorios no esteroides [véase Interacciones con otros medicamentos (7.1)]. Mediana de supervivencia = 12.1 meses 0.77 Cociente de riesgo Valor p según prueba de log rank 0.020 32 Porcentaje de censura estadística Mediana de supervivencia = 9.3 meses Tiempo de supervivencia (meses) ALIMTA + cisplatino (N=226) Cisplatino (n=222) Figura 6: Estimaciones de Kaplan-Meier relacionadas con el tiempo de supervivencia con ALIMTA más cisplatino y cisplatino solo en todos los pacientes aleatorizados y tratados. La respuesta tumoral objetiva para el mesotelioma pleural maligno es difícil de medir y los criterios de respuesta no fueron acordados universalmente. Sin embargo, sobre la base de criterios definidos de forma prospectiva, la tasa de respuesta tumoral objetiva con ALIMTA más cisplatino fue mayor que la tasa de respuesta tumoral objetiva con cisplatino solo. También hubo una mejoría en la función pulmonar (capacidad vital forzada) en el grupo de ALIMTA más cisplatino en comparación con el grupo de control. Los pacientes que recibieron la totalidad de la suplementación con ácido fólico y vitamina B12 durante el tratamiento del estudio recibieron una mediana de 6 y 4 ciclos en los grupos de ALIMTA/cisplatino (N=168) y cisplatino (N=163), respectivamente. Los pacientes que nunca recibieron suplementación con ácido fólico y vitamina B12 durante el tratamiento del estudio recibieron una mediana de 2 ciclos en ambos grupos del tratamiento (N=32 y N=38 para el grupo de ALIMTA/cisplatino y cisplatino, respectivamente). Los pacientes que reciben ALIMTA en el grupo al que se le administró la totalidad de la suplementación recibieron una intensidad de dosis relativa del 93% de la intensidad de la dosis de ALIMTA especificada en el protocolo; los pacientes tratados con cisplatino en el mismo grupo recibieron el 94% de la intensidad de la dosis proyectada. Los pacientes tratados con cisplatino solo recibieron una intensidad de dosis del 96%. 15 REFERENCIAS 1. Prevención de exposiciones ocupacionales a los antineoplásicos y otros medicamentos peligrosos en los centros de atención de salud. Alerta del Instituto Nacional para la Seguridad y Salud Ocupacional (NIOSH) 2004-165. 2. Manual Técnico de la Administración de Seguridad y Salud Ocupacional (OSHA), TED 1-0.15A, Sección VI: Capítulo 2. Controlling Occupational Exposure to Hazardous Drug (Control de la exposición ocupacional a medicamentos peligrosos). OSHA, 1999. http://www.osha.gov/dts/osta/otm/otm_vi/otm_vi_2.html 3. Sociedad Americana de Farmacéuticos del Sistema de Salud (ASHP). Directrices de la ASHP sobre el manejo de medicamentos peligrosos. Am J Health-Syst Pharm (American Journal of Health-System Pharmacy). 2006; 63:1172-1193. 4. Polovich, M., White, J. M., & Kelleher, L. O. (eds.) 2005. Chemotherapy and biotherapy guidelines and recommendations for practice (2nd. ed.) (Directrices de la quimioterapia y bioterapia, y recomendaciones para la práctica, segunda edición) Pittsburgh, PA: Oncology Nursing Society (Sociedad de Enfermería Oncológica). 16 SUMINISTRO/ALMACENAMIENTO Y MANEJO 16.1 Suministro ALIMTA, pemetrexed inyectable, está disponible en frascos estériles de un solo uso que contienen 100 mg de pemetrexed. NDC 0002-7640-01 (VL7640): frasco de un solo uso con tapa hermética color marfil, de apertura fácil, envasado individualmente en una caja de cartón. ALIMTA, pemetrexed inyectable, está disponible en frascos estériles de un solo uso que contienen 500 mg de pemetrexed. NDC 0002-7623-01 (VL7623): frasco ampolla de un solo uso con tapa hermética color marfil, de apertura fácil, envasado individualmente en una caja de cartón. 16.2 Almacenamiento y Manejo ALIMTA, pemetrexed inyectable, se debe almacenar a 25°C (77°F); traslados permitidos de 15-30°C (59-86°F) [véase Temperatura ambiente controlada por la USP]. Se comprobó la estabilidad química y física de las soluciones reconstituidas y para infusión de ALIMTA hasta 24 horas después de la reconstitución inicial, cuando se conservan en refrigeración, 2-8°C (36-46°F). Cuando se preparan según las instrucciones, las soluciones reconstituidas y para infusión de ALIMTA no contienen conservantes antimicrobianos. Deseche la porción no utilizada [véase Dosificación y administración (2.5)]. ALIMTA no es sensible a la luz. Impreso en papel reciclado postconsumo. PV 8927 AMP ALIMTA (pemetrexed inyectable), para uso intravenoso PV 8927 AMP Comercializado por: Lilly USA, LLC Indianápolis, IN 46285, EE.UU. Copyright © 2004, 2013, Eli Lilly and Company. Todos los derechos reservados. ALIMTA (pemetrexed inyectable), para uso intravenoso PV 8927 AMP INFORMACIÓN PARA EL PACIENTE ALIMTA® (pemetrexed inyectable) Lea la Información para el paciente incluida con ALIMTA antes de iniciar el tratamiento y cada vez que reciba tratamiento con ALIMTA. Es posible que haya nueva información. Este folleto no reemplaza la consulta con su médico sobre su condición médica o tratamiento. Hable con su médico si tiene alguna pregunta sobre ALIMTA. ¿Qué es ALIMTA? ALIMTA es un tratamiento para: ¿Qué debo evitar mientras esté utilizando ALIMTA? • Las mujeres en edad fértil no deben quedar embarazadas durante el tratamiento con ALIMTA. ALIMTA puede dañar al feto. • Pregúntele a su médico antes de tomar medicamentos llamados AINES. Existen muchos medicamentos AINES. Si no está seguro, pregunte a su médico o farmacéutico si alguno de sus medicamentos se consideran AINES. ¿Cuáles son los posibles efectos secundarios de ALIMTA? • Mesotelioma pleural maligno. Este tipo de cáncer afecta el revestimiento interior de la cavidad torácica. ALIMTA se administra junto con cisplatino, otro medicamento contra el cáncer (quimioterapia). • Cáncer de pulmón de células pequeñas no escamosas. Este cáncer es una enfermedad en la cual se forman células malignas (cancerosas) en los tejidos del pulmón. Si usted está recibiendo tratamiento inicial para el cáncer de pulmón, ALIMTA puede administrarse solo o en combinación con otro medicamento para la quimioterapia. Si esta es la primera vez que ha sido tratado por su cáncer de pulmón, ALIMTA se puede administrar con otro medicamento antineoplásico llamado cisplatino. Si usted ha completado el tratamiento inicial para el cáncer de pulmón, ALIMTA puede administrarse solo inmediatamente después de su tratamiento inicial. Si usted está recibiendo tratamiento debido a que su cáncer ha regresado o si ha tenido problemas para tolerar un tratamiento previo, ALIMTA puede ser administrado solo. Su médico hablará con usted acerca de si ALIMTA es apropiado para su tipo específico de cáncer de pulmón de células no pequeñas. Para reducir las probabilidades de efectos secundarios de ALIMTA, también debe tomar ácido fólico y vitamina B12 antes y durante su tratamiento con ALIMTA. Su médico le recetará un medicamento llamado “corticoesteroide” para tomar durante 3 días a lo largo del tratamiento con ALIMTA. En niños, ALIMTA no ha demostrado ser eficaz. No hay diferencias importantes en los efectos secundarios observados en niños en comparación con los adultos (véase “¿Cuáles son los posibles efectos secundarios de ALIMTA?”). ¿Qué le debería decir a mi médico antes de utilizar ALIMTA? Informe a su médico sobre todas sus condiciones médicas, incluido si usted: • está embarazada o planea quedar embarazada. ALIMTA puede dañar al feto. • está en período de lactancia. No se sabe si ALIMTA pasa a la leche materna. Debe dejar de amamantar una vez que comience el tratamiento con ALIMTA. • está tomando otros medicamentos, incluidos medicamentos recetados, o sin receta médica, vitaminas y suplementos herbarios. ALIMTA y otros medicamentos pueden afectarse mutuamente y causar efectos secundarios graves. En particular, informe a su médico si está tomando medicamentos denominados “fármacos antinflamatorios no esteroides” (AINES) para el dolor o la hinchazón. Existen muchos medicamentos AINES. Si no está seguro, pregunte a su médico o farmacéutico si alguno de sus medicamentos se consideran AINES. ¿Cómo se administra ALIMTA? • ALIMTA se infunde lentamente (se inyecta) en una vena. La inyección o infusión durará unos 10 minutos. Por lo general, recibirá ALIMTA una vez cada 21 días (3 semanas). • Si usted está recibiendo tratamiento con ALIMTA y cisplatino para el tratamiento inicial del mesotelioma o del cáncer de pulmón de células no pequeñas, ALIMTA se administrará por primera vez como una infusión de 10 minutos en la vena y el cisplatino (otro medicamento contra el cáncer) también se administrará a través de la vena unos 30 minutos después de la administración de ALIMTA y finalizará cerca de 2 horas más tarde. • Si usted ha completado el tratamiento inicial para el cáncer de pulmón de células no pequeñas, puede recibir ALIMTA solo, administrado como una infusión de 10 minutos en la vena. • Si usted está recibiendo el tratamiento debido a que el cáncer de pulmón de células no pequeñas ha regresado, puede recibir ALIMTA solo, administrado como una infusión de 10 minutos en la vena. • Su médico le recetará un medicamento llamado “corticoesteroide” para tomar durante 3 días a lo largo del tratamiento con ALIMTA. • Es muy importante tomar ácido fólico y vitamina B12 durante su tratamiento con ALIMTA para reducir las posibilidades de efectos secundarios perjudiciales. Usted debe comenzar a tomar 400-1000 microgramos de ácido fólico todos los días durante al menos 5 días de los 7 días previos a la primera dosis de ALIMTA. Usted debe seguir tomando ácido fólico todos los días durante el tiempo que esté recibiendo tratamiento con ALIMTA y durante 21 días después de su último tratamiento. Puede obtener las vitaminas de ácido fólico sin prescripción. El ácido fólico también se encuentra en muchas píldoras multivitamínicas. Pregúntele a su médico o farmacéutico si no está seguro de cómo elegir un producto de ácido fólico. Su médico le dará las inyecciones de vitamina B12 mientras recibe tratamiento con ALIMTA. Usted recibirá su primera inyección de vitamina B12 durante la semana anterior a la primera dosis de ALIMTA, y luego alrededor de cada 9 semanas durante el tratamiento. ALIMTA (pemetrexed inyectable), para uso intravenoso • Le harán análisis periódicos de sangre, antes y durante su tratamiento con ALIMTA. Su médico puede ajustar su dosis de ALIMTA o retrasar el tratamiento según los resultados de sus análisis de sangre y de su estado general. PX 0040 AMP La mayoría de los pacientes que utilizan ALIMTA experimentará efectos secundarios. No siempre es posible saber si ALIMTA, otro medicamento o el cáncer en sí mismo están provocando estos efectos secundarios. Llame a su médico de inmediato si tiene fiebre, escalofríos, diarrea o llagas orales. Estos síntomas podrían provenir de una infección que puede ser grave y llevarlo a la muerte. Los efectos secundarios más comunes de ALIMTA cuando se administra solo o en combinación con cisplatino son: • Malestar estomacal, incluidos vómitos, náuseas y diarrea. Puede tomar algún medicamento para intentar controlar algunos de estos síntomas. Llame a su médico si tiene alguno de estos síntomas. • Recuentos sanguíneos bajos: • Glóbulos rojos bajos. Los glóbulos rojos bajos pueden hacer que se sienta cansado, que se canse con facilidad, que tenga un aspecto pálido y que tenga dificultades para respirar. • Glóbulos blancos bajos. Los glóbulos blancos bajos pueden hacer que tenga una mayor probabilidad de infección. Si usted tiene fiebre (temperatura superior a 100.4°F) u otros signos de infección, llame de inmediato a su médico. • Bajo nivel de plaquetas. El bajo nivel de plaquetas produce una mayor posibilidad de hemorragia. Su médico le realizará análisis de sangre para ver sus recuentos sanguíneos antes y durante el tratamiento con ALIMTA. • Cansancio. Puede sentirse cansado o débil durante algunos días después del tratamiento con ALIMTA. Si usted sufre debilidad o cansancio intenso, llame a su médico. • Enrojecimiento o llagas en la boca, la garganta, los labios o el tubo que conecta la garganta y el estómago (esófago). El enrojecimiento y las llagas pueden comenzar pocos días después de su tratamiento con ALIMTA. Llame a su médico si esto sucede, o si tiene dolor o problemas para beber o tragar alimentos. • Pérdida del apetito. Puede perder el apetito y bajar de peso durante el tratamiento. Hable con su médico si lo considera un problema. • Erupción. Puede sufrir erupciones o comezón durante el tratamiento. Estas reacciones suelen aparecer entre cada tratamiento con ALIMTA y por lo general desaparecen antes del próximo tratamiento. Las reacciones o erupciones de la piel que incluyen ampollas o descamación pueden ser graves y podrían ocasionar la muerte. Llame a su médico si usted tiene alguno de estos síntomas. Hable con su médico, enfermero o farmacéutico sobre cualquier efecto secundario que le moleste o que no desaparezca. Estos no son todos los efectos secundarios de ALIMTA. Para obtener más información, consulte con su médico, enfermero o farmacéutico. Información general sobre ALIMTA Los medicamentos suelen recetarse para condiciones distintas de las enumeradas en los prospectos informativos para los pacientes. ALIMTA fue recetado para su condición médica. Este prospecto resume la información más importante acerca de ALIMTA. Si desea más información, hable con su médico. Puede solicitar a su médico o farmacéutico información sobre ALIMTA escrita para los profesionales de la salud. También puede llamar al 1-800-LILLY-RX (1-800545-5979) o visitar www.ALIMTA.com. Revisado en septiembre de 2013 Impreso en papel reciclado postconsumo. Comercializado por: Lilly USA, LLC Indianápolis, IN 46285, EE.UU. www.ALIMTA.com Copyright © 2004, 2013, Eli Lilly and Company. Todos los derechos reservados. PX 0040 AMP ALIMTA (pemetrexed inyectable), para uso intravenoso PX 0040 AMP