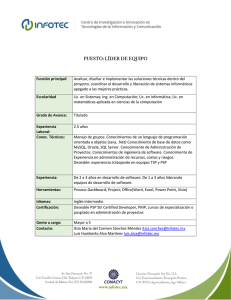
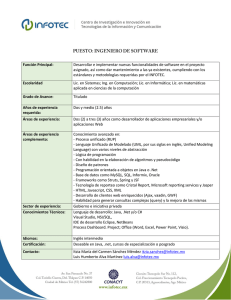
INSTITUTO POLITÉCNICO NACIONAL UNIDAD PROFESIONAL
Anuncio

Manual de Practicas Laboratorio de Química- Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez INSTITUTO POLITÉCNICO NACIONAL UNIDAD PROFESIONAL INTERDISCIPLINARIA DE BIOTECNOLOGÍA ACADEMIA DE QUÍMICA LABORATORIO DE QUÍMICA BIOORGÁNICA MANUAL DE PRÁCTICAS Autores: Alejandro Cruz Itzia I. Padilla Martínez Efrén V. García Báez México D.F. Octubre-2009 -1- Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez CONTENIDO PRÓLOGO 3 GUÍA PARA EL TRABAJO DE LABORATORIO 4 ORGANIZACIÓN DE LOS INFORMES DEL LABORATORIO 4 COMPORTAMIENTO PERSONAL EN EL LABORATORIO 5 PRÁCTICA 1. Separación y purificación de compuestos orgánicos. Punto de fusión y cristalización. 6 PRÁCTICA 2. Extracción y Cromatografía 13 PRÁCTICA 3. Propiedades quimicas de halogenuros de alquilo y Alcoholes 28 PRÁCTICA 4. Medición de la densidad, indice de refracción y punto de ebullición de una serie homologa de hidrocarburos alifáticos (C6,C8,C10,C12) 40 PRÁCTICA 5. Síntesis del cloruro de terc-butilo a partir de terc-butanol 48 PRÁCTICA 6. Aldehidos y cetonas. Síntesis de dibenzalacetona 51 PRÁCTICA 7. Acidos carboxilico. Síntesis del acido acetil salicílico (aspirina) 65 PRÁCTICA 8. Aminas, propiedades químicas y síntesis de acetanilida 71 PRÁCTICA 9. Síntesis de la benzocaina I 79 PRÁCTICA 10. Síntesis de la benzocaina II 84 PRÁCTICA 11. Reacciones de identificación de aminoácidos y proteínas 95 PRÁCTICA 12. Reacciones de identificación de carbohidratos 102 PRÁCTICA 13. Cinética de la hidrólisis de la sacarosa mediante rotación óptica 117 PRACTICA 14. Reconocimiento de lípidos 121 -2- Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez PRÓLOGO El objetivo principal de compilar este conjunto de prácticas de LABORATORIO DE QUÍMICA BIOORGANICA es que éstas apoyen y complementen el programa teórico que se imparte de la asignatura. La selección de las prácticas se hizo con la intención de ilustrar algunos de los métodos de obtención de los diferentes tipos de compuestos aromáticos y no aromáticos y mostrar también las diferentes técnicas de aislamiento y purificación de los productos de reacción obtenidos ó biomoléculas para uso de interés farmacéutico. Con este manual de prácticas se pretende que el alumno maneje algunos reactivos tanto orgánicos como inorgánicos para la obtención de compuestos que contengan nuevos grupos funcionales y que conozca sus aplicaciones, alcances y limitaciones en su preparación. Además, se pretende que el alumno compruebe las características de algunos de los métodos más comunes en la síntesis de compuestos orgánicos. Las prácticas se presentan explícitamente, de tal forma que el alumno sea capaz de proceder por sí solo. Además, el profesor proporcionará información complementaria para lograr la exitosa realización de la práctica. Con la finalidad de facilitar la comprensión y el desarrollo del tema involucrado, cada práctica contiene una breve introducción sobre la naturaleza de los compuestos a obtener y una serie de cuestiones que involucra la revisión de material adicional. Se anexa a esta serie de prácticas una práctica relacionada con el reconocimiento de los lípidos que son moléculas con función de RESERVA ENERGÉTICA. Se consumen para producir energía cuando se han agotado los Glúcidos. Se acumulan en las células del Tejido Adiposo Subcutáneo, o en el que rodea a algunos órganos o incrustándose en las paredes arteriales en forma de Colesterol. -3- Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez I. GUÍA PARA EL TRABAJO DE LABORATORIO. El programa experimental aquí esbozado requiere de mucha actividad y organización. El logro de su exitosa realización depende de que el alumno revise cuidadosamente los protocolos escritos, así como los antecedentes teóricos, antes de que inicie su trabajo en el laboratorio. Todos los experimentos están probados y optimizados para consumir la menor cantidad de reactivos posibles, respete las cantidades utilizadas y evite el desperdicio de sustancias químicas. La mayoría de los experimentos se harán en grupos pequeños de tres a cinco personas. Independientemente del trabajo en equipo, todos los estudiantes son particularmente responsables de colectar el total de datos obtenidos y de hacer su reporte individual. ORGANIZACIÓN DE LOS INFORMES DE LABORATORIO Un buen reporte (cuaderno de trabajo) debe mostrar: - Que se han entendido los principios básicos del experimento. - La habilidad para seguir el protocolo. - La habilidad para realizar las manipulaciones prácticas de tal manera que se obtengan los resultados esperados. - La habilidad para describir en forma ordenada y lógica los resultados obtenidos. - La capacidad para obtener conclusiones razonables de los resultados obtenidos. Su reporte se calificará de forma individual en este manual de trabajo de acuerdo a: los Resultados, el Análisis, el Cuestionario y las Conclusiones. Los mismos deben presentarse con pulcritud, claridad y sin faltas de ortografía. Si el reporte requiere de la presentación de gráficas, recuerde que todos los ejes deben estar perfectamente rotulados, con unidades claramente definidas, cada gráfica o tabla deberá llevar su pie de figura. Por último, toda información obtenida de referencias bibliográficas que usted incluya en su -4- Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez reporte deberá ser citada en el texto en los espacios correspondientes a las referencias adicionales. COMPORTAMIENTO PERSONAL EN EL LABORATORIO Tratar todos los reactivos como si fueran cáusticos o tóxicos, si se derrama cualquiera de ellos limpie inmediatamente el sitio en el que ocurrió. Si los reactivos se derraman en su piel, limpie inmediatamente y lave la zona de contacto. Familiarícese con la localización y uso de extinguidores así como con las regaderas de emergencias. Precauciones especiales se señalan en las instrucciones particulares de cada práctica, ponga atención en ellas. Los estudiantes deberán portar una bata blanca para proteger sus ropas, así como guantes y lentes de seguridad para protección de manos y ojos. Cualquier accidente que resulte en un daño personal, no importa que tan leve sea, repórtelo a la brevedad con el profesor encargado del laboratorio. Esto es para su propia protección. Ciertos instrumentos estarán presentes, otros no. No utilice el equipo si tiene usted dudas o dificultades para operarlo, solicite el apoyo de su profesor. Si usted deja material para ser almacenado en el laboratorio, deberá estar adecuadamente identificado, indicando fecha, contenido y propietario, de no ser así será desechado. Parte de su responsabilidad en el laboratorio es su seguridad, no introduzca alimentos, ni utilice equipo de sonido que pueda distraer su atención. Deje limpia el área de trabajo, esto incluye desechar los materiales químicos en el lugar o depósito adecuado. Pregunte a su profesor el lugar en el que se colocarán los residuos obtenidos durante la experimentación. -5- Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez PRÁCTICA No. 1 SEPARACION Y PURIFICACION DE COMPUESTOS ORGANICOS. PUNTO DE FUSIÓN Y CRISTALIZACIÒN 1. OBJETIVOS Que el alumno: 1.1. Separé y purifique una sustancia orgánica mediante de la técnica de cristalización. 1.2. Mida el punto de fusión de sustancias puras y de mezclas y utilice el punto de cómo medida de pureza. 2. INTRODUCCIÓN El fundamento de la separación de una mezcla química, se basa en la diferencia de solubilidad del componente a separar en el disolvente de la mezcla y el disolvente extrayente. En la práctica es muy utilizada para separar compuestos orgánicos de raíces, semillas, hojas, etc. La cristalización es un proceso típico de laboratorio en el que un sólido cristalino en solución se separa de una mezcla a través de cambios en su solubilidad. La disminución en este parámetro conlleva a la producción de soluciones saturadas y sobresaturadas que resultan en la formación de cristales a partir de la solución. El proceso de cristalización depende del grado de sobresaturación que se logre en la solución, formación de núcleos y el crecimiento de cristales ó partículas amorfas. La sobresaturación se puede alcanzar por: evaporación del disolvente de la solución, el enfriamiento de la solución por la adición de otros solutos, o el cambio en la polaridad de los disolventes. Dependiendo de las condiciones de la cristalización, es posible controlar o modificar la naturaleza de los cristales obtenidos. Una variante a la cristalización simple es el proceso fraccionado que también es muy útil. La disolución de sólidos similares puede evaporarse hasta que empieza la cristalización. Los cristales serán más ricos en un sólido que en otro. Cristalizaciones repetidas (recristalización) conducen a la preparación de cristales más puros del -6- Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez componente menos soluble y a una disolución que contiene solamente disolvente con el componente más soluble. Frecuentemente el uso de una mezcla de dos disolventes en el proceso de cristalización es más satisfactorio que un solo disolvente, esta mezcla debe ser homogénea totalmente, es decir, los componentes deben ser miscibles y uno de los disolventes debe disolver fácilmente al compuesto a separar, mientras que el otro sólo debe disolverlo ligeramente. El proceso de cristalización consta de los siguientes pasos: * Disolver la sustancia en el disolvente a una temperatura elevada. * Filtrar la solución caliente para remover las impurezas insolubles. * Dejar enfriar la solución para que se depositen los cristales de la sustancia. * Filtrar la solución fría para separar los cristales de la solución sobrenadante (conocido como licor o líquido madre). * Lavar los cristales para remover el licor madre adherido. * Secar los cristales para remover las trazas del disolvente. Existen varios factores que se deben considerar para seleccionar un disolvente para la cristalización. Un buen disolvente para este proceso es aquel que disuelva una moderada cantidad de la sustancia a elevadas temperaturas, pero que solo disuelva una pequeña cantidad de este a bajas temperaturas; el disolvente deberá disolver fácilmente a las impurezas (excepto a las impurezas mecánicas) aún a bajas temperaturas, el disolvente no debe reaccionar con la sustancia a purificar, de preferencia debe tener baja flamabilidad, baja toxicidad y bajo costo. Las impurezas pueden colocarse en las siguientes categorías: impurezas mecánicas (partículas insolubles en la mayoría de los disolventes comunes, se pueden eliminar filtrando la solución caliente), impurezas coloridas (el color puede eliminarse por la adición de algún adsorbente como el carbón activado y filtrando la solución en caliente) y las impurezas solubles (compuestos que se remueven por cristalización, dado que al ser altamente solubles en el disolvente se retienen en el licor o líquido madre). Una sustancia cristalina pura presenta generalmente un punto de fusión característico y un rango de la temperatura de fusión muy pequeño, aproximadamente de 0.5 a 1.0 °C. -7- Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez La presencia de impurezas producen generalmente una disminución de la temperatura de fusión, es decir, el compuesto empieza a fundir a temperaturas inferiores a la esperada, esto trae como consecuencia que el rango de fusión se incremente, mientras mayor es la cantidad de impurezas mayor es la depresión del punto de fusión y por tanto mayor también el rango de fusión. La depresión en el punto de fusión producida por las impurezas es una consecuencia de los efectos que estos compuestos producen en la presión de vapor de la mezcla sólida, la presencia de contaminantes solubles produce una disminución en la presión de vapor de la mezcla y simultáneamente un descenso en la temperatura de fusión. Tomando como base este fenómeno, la determinación de esta constante física se usa frecuentemente como criterio de identidad y de pureza. 3 SECCION EXPERIMENTAL 3.2 PRIMERA PARTE: Determinación del Punto de Fusión 3.2.1 Material y equipo Cubreobjetos Equipo para determinar el punto de fusión Fisher-Johns Equipo para la determinación del punto de fusión Fisher-Johns -8- Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 3.2.3 Procedimiento experimental 1. Limpiar perfectamente la platina metálica del aparato para determinar puntos de fusión. 2. Colocar aproximadamente 0.05 g (3 ó 4 cristales pequeños) de la sustancia a probar en un cubre objetos limpio, y llevarlo a la superficie de la platina metálica. 3. Ajustar la lupa a la altura de los ojos para observar los cristales e iniciar el calentamiento, tomar la lectura de las temperaturas en el termómetro del aparato, cuando se inicie y finalice la fusión del compuesto. NOTA: Conservar la velocidad de calentamiento entre 3 y 5 o C por minuto 4. Bajar la temperatura de la platina antes de repetir la operación. 5. Determinar la temperatura y rango de fusión de los siguientes compuestos y mezclas. a) ácido benzóico; b) 75% de ácido benzóico y 25% de anhídido ftálico; c) 50% de ácido benzóico y 50% de anhídido ftálico; d) 25% de ácido benzóico y 75% de anhídido ftálico; e) anhídrido ftálico. NOTA: En una misma corrida, se pueden colocar varias muestras. 3.3 SEGUNDA PARTE. Purificación de acetanilida por recristalización 3.3.1 Material y equipo 2 Vasos de precipitados de 250 mL 3 Matraces Elenmeyer de 125 mL 1 Embudos de filtración de vidrio 1 Agitador 1 Soporte universal Cubreobjetos 1 Pinza de tres dedos 1 Probeta de 100 mL 1 Anillo Euipo para medir el punto de fusión 1 Baño maría Parrilla de calentamiento 3.3.2 Reactivos Anhídrido ftálico Carbón activado Acetanilida grado técnico Ácido benzóico -9- Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 3.3.3 Procedimiento experimental a). Pesar 0.5 g de muestra de acetanilida grado técnico. b). Observar su color y determinar su punto de fusión. c). Transferir el resto de la muestra a un matraz Erlenmeyer de 125 mL, adicionar 20 mL de agua destilada y calentar la mezcla hasta ebullición. d). Si no se ha disuelto, adicionar pequeñas porciones de agua caliente y agitar hasta que la acetanilida se disuelva completamente. e). Adicionar 5 mL más de agua caliente y dejar enfriar. f). Adicionar con mucho cuidado 0.1 g de carbón activado. g). Volver a calentar durante 5 minutos para facilitar la eliminación de impurezas coloridas. h). Filtrar la solución en caliente y recibir el filtrado en otro matraz Erlenmeyer de 125 mL. Si en el transcurso de la filtración se solidifica el compuesto, agregar un poco de agua caliente. i). El filtrado se deja enfriar para que cristalice la acetanilida. j). Filtrar para recuperar los cristales en un pedazo de papel filtro previamente pesado. k). Lavar los cristales dos veces con una pequeña cantidad de agua fría, ya que la acetanilida es soluble aún en agua fría (0.5 g /100 mL). 3.4. Instrucciones particulares 3.4.1. No pipetear los reactivos con la boca. Usar probeta para medirlos. 3.4.2. En el procedimiento de cristalización de acetanilida, disolver el compuesto en la mínima cantidad de agua caliente posible, si durante la filtración en caliente se forman cristales, calentar nuevamente la solución hasta su disolución. 4. RESULTADOS Y DISCUSIÓN 4.1. Reportar la masa en gramos de ácido benzóico y acetanilida obtenidos en la extracción. Calcular el rendimiento porcentual y reportar los puntos de fusión del ácido benzóico, de la acetanilida. Cálculos: - 10 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 4.2. Indicar los cálculos realizados para determinar el volumen de NaOH requerido para extraer el ácido benzóico. 4.3. Reportar los puntos de fusión obtenidos para el ácido benzóico, el anh. ftálico y las mezclas en la siguiente tabla y compararlos con los reportados en la literatura. Rango de fusión Rango de fusión teórico. experimental Substancias a) Ácido benzóico b) 75% de ácido benzóico y 25% de anhídrido ftálico. c) 50% de ácido benzóico y 50% de anhídido ftálico. d) 25% de ácido benzóico y 75% de anhídrido ftálico. e) Anhídrido ftálico 4.4. Haga una gráfica de punto de fusión contra el % de composición para las mezclas anteriores. Discuta el resultado. 4.5 Reportar las temperaturas de fusión de la acetanilida antes y después de cristalizar. Investigar en la bibliografía a que se debe la variación del punto de fusión de la acetanilida 4.6. Hacer el cálculo de rendimiento en el proceso de recristalización. 5. CONCLUSIONES Los integrantes de equipo, analizaran su información práctica con la teoría y concluirán sobre el resultado de su practica. 6. CUESTIONARIO 6.1 ¿Se podrá extraer el ácido benzóico de su mezcla con acetanilida usando solo agua destilada en vez de NaOH? Por qué? 6.2 ¿Que ventajas y desventajas tiene la cristalización con respecto a la extracción como métodos de purificación? 6.3 Definir el concepto de punto de fusión. 6.4 ¿Qué se entiende por solvatación? 6.5 ¿Por qué algunas sustancias se disuelven en un disolvente y otras no? - 11 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 6.6 ¿Cómo se elige el disolvente adecuado para efectuar una cristalización? 6.7 ¿Cuándo y para que se utiliza el carbón activado? 6.8 ¿Qué precauciones deben tomarse con los disolventes inflamables y tóxicos? 6.9 ¿Cuáles son los métodos que se emplean para inducir la cristalización? 7. BIBLIOGRAFIA 7.1. Abbott, D. y Andrews, R. S., Introducción a la Cromatografía, 3ª Ed., Alhambra, España, 1983. 7.2. Brewster, R.Q., Curso Práctico de Química Orgánica, 2ª Ed.., Alhambra, España, 1979. 7.3 Wilcox, C.F., Experimental Organic Chemistry a Small-Scalle Approach, Mc Millan, U.S.A., 1976. 7.4. McKay, D.C., Dale G. H., and Weedman J. A., Ind. Eng.Chem. 52, 197-198 (1960). 7.5. Vogel, A. I., Elementary Practical Organic Chemistry Part I, Small Scale Preparations, Longmans, (1978). 7.6. Wilcox, C.F., Experimental Organic Chemistry. A Small Scale Aproach, Mc Millan Jr, (1988). 7.7. Barrow, Gordon M. Química Física, Reverte(1976). 7.8. Pomilio, A. y Vitale, A. Métodos Experimentales de Laboratorios en Química Orgánica Serie de Química Monografía No. 33. OEA. 8. BIBLIOGRAFIA ADICIONAL. - 12 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez PRÁCTICA No. 2 EXTRACCION Y CROMATOGRAFIA 1. OBJETIVOS Que el alumno: 1.1. Separe los componentes de una mezcla mediante la aplicación de las técnicas de extracción y purificación de compuestos orgánicos. 1.2. Realice una cromatografía de adsorción mediante la aplicación de los conceptos fundamentales. 1.3 .Elija el eluyente apropiado para extraer y separar una mezcla de colorantes mediante una cromatografía en capa fina. 1.4 .Separe una mezcla de colorantes mediante una cromatografía en columna. 2. INTRODUCCIÓN La gran mayoría de los compuestos orgánicos, ya sean naturales o sintéticos no se encuentran puros, y para determinar sus propiedades físicas y químicas o poderlos usar como medicamentos, conservadores, edulcorantes, intermediarios de reacción, etc. es necesario que lo sean. La extracción y la cromatografía son técnicas muy importantes, ya que permiten separar y purificar sustancias químicas. La extracción es la técnica más empleada para separar un producto orgánico de su mezcla de reacción o aislarlo de sus fuentes naturales. Puede definirse como la separación de un componente de una mezcla por medio de un disolvente. Si el compuesto a separar se encuentra en una mezcla líquida, la extracción se llama líquido-líquido, si se encuentra en una mezcla sólida, la extracción se llama sólido-líquido. La cromatografía es una técnica que permite separar los componentes de una mezcla. Esta separación se logra utilizando un sistema bifásico: fase estacionaria donde se retienen los compuestos a separar y fase móvil que desplaza de forma diferencial los compuestos a través de la fase estacionara. (A) Dependiendo de la naturaleza de las fases, se pueden distinguir distintos tipos de cromatografía: - 13 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez Cromatografía sólido-líquido: la fase estacionaria es un sólido y la móvil un líquido. Cromatografía líquido-líquido: ambas fases son líquidos y en la estacionaria el líquido se ancla a un soporte sólido. Cromatografía líquido-gas: la fase estacionaria es un líquido no volátil sobre soporte sólido y la fase móvil un gas. Cromatografía sólido-gas: la fase estacionaria es un sólido y la móvil un gas. La mezcla a separar se deposita sobre la fase estacionaria y la fase móvil atraviesa el sistema desplazándo los componentes de la mezcla a distintas velocidades que dependen de la afinidad de los mismos por cada una de las fases (Figura 1). Se denomina elución a la migración de los componentes de la mezcla a lo largo de la fase estacionaria impulsados por la móvil. Existen otras clasificaciones para los distintos tipos de cromatografía: (B) En función de la interacción que se establece entre los componentes de la mezcla y las fases móvil y estacionaria: Cromatografía de adsorción: se producen interacciones de tipo polar siendo la fase estacionaria un sólido. Cromatografía de partición: la separación se basa en las diferencias de solubilidad de los componentes de la mezcla entre las dos fases siendo ambas líquidas. Cuando la fase estacionaria es menos polar que la móvil se denomina cromatografía en fase inversa. Cromatografía de intercambio iónico: se producen intercambios entre iones presentes en la fase estacionaria y los del compuesto orgánico solubilizado e ionizado en la fase móvil. - 14 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez Figura 1. Elución de los componentes de una mezcla (C) En función del tipo de soporte empleado para la fase estacionaria: Cromatografía en columna: utiliza como soporte una columna de vidrio. Cromatografía en capa fina: el soporte es una placa de vidrio, aluminio o plástico. La cromatografía se puede emplear para: Conocer el número de componentes de una mezcla e identificarlos por comparación con patrones, a este tipo de cromatografía se le conoce como Cromatografía Analítica. Separar mezclas de compuestos y como método de purificación, con este fin se le conoce como Cromatografía Preparativa. Cromatografía de adsorción La cromatografía de adsorción emplea una fase estacionaria sólida de carácter polar, adsorbente y una fase móvil líquida, eluyente. Se utiliza tanto con fines analíticos como preparativos y la separación de los componentes de la mezcla viene determinada por las interacciones polares de los componentes de la misma con las fases estacionaria y móvil. Por lo tanto, los compuestos más difíciles de separar mediante este tipo de cromatografía, serán aquellos que tengan una polaridad muy similar. Fase estacionaria: adsorbente - 15 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez Está constituida por un sólido poroso, finamente granulado, con centros activos polares en su superficie donde se adsorben las moléculas de los compuestos que se van a cromatografiar. Cuanto menor sea el tamaño de partícula de este material mayor será la capacidad de adsorción. La adsorción se debe a interacciones intermoleculares del tipo dipolo-dipolo, dipolo-dipolo inducido o enlaces de hidrógeno entre el adsorbente y el soluto. El adsorbente más utilizado es la gel de sílice (Figura 2) donde las interacciones tienen lugar entre los grupos Si—OH y Si—O—Si; también se emplea con relativa frecuencia alúmina (Al2O3). Figura 2. Estructura del gel de sílice e interacciones con algunos compuestos polares El adsorbente debe ser inerte con las sustancias a cromatografiar. La gel de sílice presenta carácter ácido y la alúmina puede adquirirse con carácter neutro, ácido o básico. Fase móvil: eluyente Es un disolvente en el que los componentes de las mezcla son, al menos, parcialmente solubles. Al aumentar la polaridad del disolvente aumenta la velocidad de elución de los compuestos de la mezcla. Se puede utilizar un único disolvente o una mezcla de disolventes e incluso llevar a cabo la elución con un gradiente de polaridad aumentando progresivamente la proporción del disolvente más polar. Retención Las moléculas de soluto S se adsorben en los centros polares de la fase estacionaria X y, a medida que se produce la elución, van siendo desplazadas por las moléculas de disolvente/s que constituyen la fase móvil M. La retención de un soluto se puede justificar por la - 16 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez competencia que se establece entre S y M por adsorberse a los centros polares X, es decir, depende de los valores de las constantes de los equilibrios: —X + S —X•••S —X + M —X•••M que están en función de: • La polaridad del compuesto a eluir que depende de sus grupos funcionales. • La naturaleza del adsorbente. • La naturaleza del disolvente. Orden de polaridad de los compuestos orgánicos: Ácidos carboxílicos > Fenoles > Alcoholes y Tioles > Aminas > Ésteres > Aldehídos y Cetonas > Hidrocarburos Aromáticos > Hc. Halogenados > Éteres > Hc Insaturados > Alcanos Cuanto más polar sea un compuesto mas se retendrá en la fase estacionaria. Por ejemplo, se retiene más un alcohol que un hidrocarburo. Orden de polaridad de los eluyentes más habituales: H2O > CH3-OH > (CH3)2CH-OH > CH3-CN > Dioxano > CH3COOEt > THF > CH2Cl2 (Cloruro de metileno) > CHCl3 (Cloroformo) > CCl4 (Tetracloruro de carbono) > CH3(CH2)4CH3 Para un mismo compuesto, un aumento en la polaridad de la fase móvil hace que se desplace con más facilidad de la fase estacionaria. Por ejemplo, se eluirá más rapidamente una amina en acetonitrilo que en hexano. Para compuestos poco polares, que se retienen poco en el adsorbente, se utilizan eluyentes apolares o poco polares como, por ejemplo, hexano. Para compuestos muy polares, que quedan muy retenidos en el adsorbente, se emplean eluyentes muy polares como, por ejemplo, metanol o mezclas metanol-diclorometano. - 17 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez Para compuestos de polaridad media se emplean eluyentes de polaridad intermedia y son muy aconsejables en estos caso las mezclas en distintas proporciones de hexano acetato de etilo Cromatografía analítica en capa fina (CCF) La fase estacionaria (adsorbente) se encuentra depositada, formando una capa fina de un espesor uniforme sobre una placa de vidrio, plástico o una lámina metálica. La mezcla a analizar se deposita con un capilar a una pequeña distancia del borde inferior de la placa (3 mm) (Figura 3) y se introduce en una cubeta donde está la fase móvil (eluyente), que ascenderá a lo largo de la capa por capilaridad eluyendo a los componentes de la mezcla a distintas velocidades, lo que provoca su separación (Figura 4). Cuando el frente del disolvente se encuentra a 3 mm del borde superior, se saca la placa de la cubeta, se marca hasta donde ha llegado el eluyente y se deja secar para, a continuación, proceder al la visualización de las manchas correspondientes a los productos cromatografiados. Figura 3. Aplicación de la muestra. Figura 4. Desarrollo de la placa Determinación del Rf Se conoce como Rf (rate factor) la relación entre las distancias recorridas por un compuesto y por el disolvente desde el origen del cromatograma. - 18 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez Rf = Distancia recorrida por el compuesto/ Distancia recorrida por el disolvente Cada compuesto en unas condiciones cromatográficas determinadas: adsorbente, disolvente, temperatura, etc., tiene un valor constante y característico de Rf. Sin embargo, solo se pueden establecer comparaciones entre los Rf de dos compuestos cuando los dos se eluyan juntos en la misma placa. La distancia recorrida por el compuesto se mide desde el centro de la mancha (Figura 5). Figura 5.- Determinación del Rf de dos compuestos A y B. Visualización del Cromatograma Con luz UV (ultravioleta). Las placas suelen llevar incorporado un indicador fluorescente que absorbe luz UV y emite luz visible, generalmente verde. Cuando se cromatografían sustancias que absorben en el UV donde se encuentra el compuesto no absorbe el indicador y como resultado vemos una mancha que indica su presencia. Con un agente revelador. Se emplea cuando las sustancias no absorben radiación UV. El revelador reacciona con los productos absorbidos dando lugar a compuestos coloreados y por tanto se utilizará uno u otro en función del compuesto que se quiera visualizar. Algunos ejemplos: H2SO4 concentrado en etanol para azúcares, ninhidrina para aminoácidos y yodo para compuestos insaturados y aromáticos. Aplicaciones de la CCF La CCF es una técnica cualitativa muy utilizada en los laboratorios de Química Orgánica para: - 19 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez Determinar el número de componentes de una muestra: Precaución si solo hay una mancha muy retenida o aparece junto al frente del disolvente hay que probar otro eluyente (Figura 6). Figura 6.- Separación de dos componentes A y B de una mezcla. (a) Eluyente poco polar (b) Eluyente de polaridad adecuada (c) Eluyente muy polar Comprobar la pureza de un compuesto: aparecerá una sola mancha. Se debe comprobar que solo hay una mancha utilizando distintos eluyentes. Determinar la identidad de dos compuestos: Hay que tener precaución, pues valores deRf iguales (o prácticamente iguales) para dos compuestos en una misma placa no garantizan inequívocamente su identidad. En la misma placa hay que cromatografiar una mezcla de los compuestos cuya identidad se quiere comprobar (Figura 7). Figura 7. Comprobación de la no identidad de dos compuestos A y B. M, Mezcla de ambos. Seguir la evolución de una reacción: cada cierto tiempo se cromatografían en una misma placa los reactivos y la mezcla de reacción (Figura 8). - 20 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez Figura 8. Evolución de una reacción entre dos compuestos A y B (reactivos) para dar lugar a un compuesto C. Mezcla de reacción = MR. Determinar el disolvente más apropiado para llevar a cabo una separación mediante una cromatografía preparativa (en columna o en placa). Seguir el progreso de una cromatografía en columna (CC). Cromatografía en columna (CC) Es el método más utilizado para la separación y purificación de compuestos orgánicos, sólidos o líquidos, a escala preparativa. La fase estacionaria (adsorbente) se coloca en una columna de vidrio que termina en un estrechamiento con una llave y se impregna con el eluyente (fase móvil). La mezcla a separar se deposita en la parte superior de la columna y la fase móvil atraviesa el sistema (Figura 9). Los compuestos se van eluyendo disueltos en el eluyente, se van recogiendo ordenadamente en fracciones de pequeño volumen (1,2,.....) y se analizan por CCF (Figura 8). Los productos van saliendo de la columna según su polaridad, primero salen los menos polares que son los menos retenidos por el adsorbente y los últimos los más polares por su mayor retención en la fase estacionaria. El adsorbente más utilizado para este tipo de cromatografía es la gel de sílice y en segundo lugar la alúmina. El tamaño de partícula del adsorbente es importante para la separación y su elección depende en gran medida de que la elución de la cromatografía se realice por gravedad o a media presión (flash chromatography). En una elución a media presión se pueden emplear tamaños de partícula más pequeños, que permiten una separación más eficaz. Sin embargo, en una elución por gravedad el uso de tamaños de partícula pequeños impedirían el flujo del disolvente. Antes de realizar una separación en cromatografía de columna hay que elegir adecuadamente el disolvente haciendo ensayos en CCF. - 21 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez Figura 9.- Esquema de montaje de una Cromatografía en Columna 3..SECCIÓN EXPERIMENTAL EXTRACCION 3.1 Material y equipo para la extracción 3.1.2 Reactivos 1 Propipeta (jeringa) Ácido benzóico 1 Matraz erlenmeyer de 125 mL. Solución de NaOH 0.1 N 3 Pipetas graduadas de 1mL (1), 5mL (2) y 10mL (1) Acetanilida 2 Vasos de precipitados de 100 mL HCl conc. 1 Soporte universal Cloruro de Metileno 1 Pinza de tres dedos con nuez Equipo para medir el punto de fusión Balanza granataria y analítica 3.1.1 Procedimiento experimental Separación de una mezcla de ácido benzóico-acetanilida (1:1) por extracción sólidolíquido 1. Agregar 0.5 g de la mezcla en un matraz erlenmeyer de 125 mL. 2. Calcular el volumen de NaOH 0.1 N necesario para que reaccione completamente el ácido benzóico. 3. Adicionar el volumen calculado de NaOH 0.1 N al matraz erlenmeyer y agitar vigorosamente. - 22 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 4. Filtrar con papel filtro para separar el sólido que no se disolvió. 5. Regresar el sólido retenido en el papel filtro al matraz y extraer una vez más con igual volumen de NaOH. 6. Filtrar, recibiendo el líquido en el mismo recipiente donde se tiene el primer filtrado. 7. Adicionar HCl concentrado al filtrado hasta llegar a pH = 2. 8. Separar el sólido precipitado por filtración (en un papel previamente pesado). 9. Dejar secar el sólido obtenido, pesarlo y calcular el % de rendiniento de la reacción. 10. Medir el punto de punto de fusión del producto. CROMATOGRAFIA 3.2.1. Materiales 1 Soporte universal 1 Vaso de precipitados de 100 mL 2 Pinzas de tres dedos con nuez 1 Pipeta de 1 mL 1 Bureta de 25 mL 3 Matraces erlenmeyer 1 Probeta de 100 mL 4 Tubos de ensaye de 5 mL 1 Placa cromatográfica de gel de sílice 1 Cubeta para cromatografía o un vaso de sobre alumninio de 2 x 5 cm precipitdos de 50 mL y un vidrio de reloj 1 Embudo pequeño 1 Varilla de vidrio de 15 cm 3.2.2, Sustancias 1g Arena Algodón 5g Silica gel 100 mL Etanol 96° 5 mL Hexano 5 mL Acetato de etilo 5 mL Metanol 5 mL Agua destilada 5 mL Acetona 5 mL Trietilamina 20 mg Violeta cristal 20 mg Anaranjado de metilo - 23 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 3.3. Determinación del eluyente apropiado para separar una mezcla de violeta cristal (VC) y anaranjado de metilo(AM). 3.3.1. Preparación de la cromatoplaca. Se marca una línea recta sobre la placa coromatográfica con lápiz, a 3-5 mm del borde inferior mas corto, debe cuidarse de no estropear la superficie. Se disuelve un cristal de VC en 1 mL de etanol (disolución de V), un cristal de anaranjado de metilo en 1 mL de etanol (disolución de A) y un cristal de cada uno de ellos en 2 mL de etanol (M). Se tienen tres disoluciones: V, A y M. Se introduce un tubo capilar en la disolución V, tomando una pequeña cantidad de la misma y por su extremo se coloca en la placa de cromatografía, sobre la línea de origen, a unos 2 mm del borde izquierdo de la placa. A la misma altura y a unos 2 mm del borde derecho se coloca con otro capilar una mancha de la solución A y en la parte central de la placa una mancha de la solución M de nuevo con un capilar diferente (¡Cuidado, no confundir los capilares de cada disolución!). Se puede utilizar el mismo capilar para hacer la aplicación, siempre y cuando se lave con etanol agua 1:1 antes de volver a usarse (ver Figuras 3 y 4). 3.3.2 Elución de la cromatoplaca. Las aplicaciones (manchas) se dejan secar y se introducen en el interior de una cubeta de cromatografía conteniendo de 3-5 mL del disolvente a probar, de modo que el disolvente no toque la zona en la que se encuentran las aplicaciones (Figura 4). Se tapa la cubeta y cuando el disolvente ha ascendido a alcanzar 5 mm del borde superior se saca la placa y se marca, con lápiz, el nivel del disolvente en un extremo de la misma. Es importante que mientras dure la elución, el sistema permanezca sin perturbaciones. Se deja secar y se miden las distancias recorridas por el frente del disolvente y para cada aplicación para calcular el valor de Rf ( Figura 5). Los eluyentes a probar son: cloroformo, acetato de etilo, etanol, agua, metanol, y etanol-trietilamina en una proporción 9:1. Un equipo puede utilizar un eluyente diferente y después comparar todos los cromatogramas. - 24 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez A partir de los resultados obtenidos, seleccionar el eluyente más adecuado o la combinación de eluyentes adecuada para separar la mezcla de colorantes VC y AM. Haga el análisis de los resultados y seleccione el eluyente más adecuado para esta separación. 3.3.3 Separación por cromatografía en columna de una mezcla de VC y AM. 3.3.3.1 Preparación de la columna y de la muestra. Se sujeta la columna, en posición vertical, a un soporte utilizando dos pinzas: una cerca de la llave y otra en la parte superior y se introduce un pequeño copo de algodón en su extremo inferior sin apretar y luego 1 cm aproximadamente ade arena o tierra de diatomáceas.. Se coloca un erlenmeyer debajo de la columna y un embudo en la parte superior (Figura 9). En un vaso de precipitados se prepara una suspensión con 5g de gel de sílice (adsorbente) y 50 mL del eluyente seleccionado. Se añade un poco de etanol a la columna y luego se vierte la suspensión previamente preparada en su interior. Se abre la llave, se golpean suavemente las paredes de la columna mientras dura la sedimentación del adsorbente para que este se compacte adecuadamente procurando que no se formen burbujas y evitando que se seque la gel de sílice. El eluyente que se va recogiendo de la columna se incorpora al vaso donde se preparó la suspensión adsorbente-eluyente para así recuperar la gel de sílice que hubiera podido quedar y se transvasa todo de nuevo a la columna. 3.3.3.2 Elución de la columna Se deja que el eluyente baje hasta una altura sobre el adsorbente de 1-2 mm, se cierra la llave de la columna se quita el embudo y con una pipeta se añade cuidadosamente 1 mL de una solución preparada de violeta cristal y naranja de metilo en etanol. Se abre la llave de la columna para que esta disolución quede inmersa en la gel de sílice y se vuelve a cerrar cuando la disolución de colorantes alcanza una altura de 1 mm sobre el adsorbente. Se añade con una pipeta 0.5 mL del eluyente con mucho cuidado y muy lentamente para no perturbar el frente de la columna. A continuación, se abre la llave y de deja que el nivel del eluyente alcance 1 mm por encima del adsorbente. Se coloca un copo de algodón sobre la superficie de adsorbente y se añaden 5 mL del eluyente, se abre la llave y se continúa - 25 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez añadiendo eluyente para desarrollar la columna hasta que se recoja el primer colorante. Después se utiliza una mezcla de disolventes: etanol/trietilamina en proporción 9:1 como eluyente para el segundo colorante ( Figura 10). Figura 10.- Esquema de separación de dos componentes por Cromatografía en Columna 3.4. Instrucciones Particulares No permitir que el nivel del líquido eluyente sobrepase el nivel de la fase móvil (sílica) durante todo el proceso. 4. RESULTADOS Y DISCUSIÓN 4.1 A partir de los resultados obtenidos por CCF: 4.1.1 Dibuje todos los cromatogramas obtenidos. 4.1.2 Calcule el Rf para cada compuesto. 4.1.3 ¿Cuál de los dos colorantes es el compuesto más polar? 4.1.4 ¿Cuál es el disolvente más adecuado para esta separación? 4.1.5 ¿Sería adecuado utilizar metanol en esta separación? 4.2 A partir de los resultados obtenidos por CC: 4.2.1 Haga seis dibujos que muestren el desarrollo de la columna durante el transcurso del experimento. 4.2.2 ¿Se separaron los colorantes de acuerdo con lo previsto por CCF? Explique. 4.2.3 ¿Cuál es la función de añadir trietilamina al etanol para eluir al segundo colorante? Explique. - 26 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 4.2.4 ¿Qué ventajas tiene la CC con respecto a la CCF? 4.2.5 Que esperaría si se utiliza una sílica gel de menor tamaño de partícula (mayor mallaje)? 5. CONCLUSIONES Los integrantes de equipo, analizaran su información práctica con la teoría y concluirán sobre el resultado de su practica 6. CUESTIONARIO 5.1. ¿Por qué los derivados halogenados suben más que los alcoholes en una cromatografía encapa fina? 5.2. Al cambiar un eluyente menos polar por otro más polar ¿cómo se afecta la velocidad de elución de un alcohol? ¿y la de una cetona? 5.3. El valor del Rf ¿depende del adsorbente utilizado? ¿y del eluyente? 5.4. Sugerir un ensayo para determinar la pureza de un compuesto por CCF 5.5. Investigue las estructuras químicas y los usos de los colorantes VC y AM, ¿a qué grupo genérico pertenecen c/u? 5.6. Investigue cinco referencias bibliográficas sobre cromatografía existentes en la biblioteca de UPIBI y cítelas. 7.- BIBLIOGRAFÍA 7.1 “Manual de prácticas de laboratorio de química orgánica”, Departamento de química orgánica, Facultad de Farmacia, Universidad de Alcalá, España: www2.uah.es/quimica-organica/docencia/ 7.2 Harris, C. Daniel, Análisis químico cuantitativo, 2ª Edición, Ed. Reverté, 2001, p. 628. 7.3 Douglas A. Skoog, F. James Holler, and Timothy A. Niewman, “Principios de análisis instrumental, Quinta ed. 1992, Ed. Mc Graw Hill. 8. BIBLIOGRAFIA ADICIONALES. - 27 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez PRÁCTICA No. 3 PROPIEDADES QUIMICAS DE HALOGENUROS DE ALQUILO Y ALCOHOLES 1. OBJETIVOS Que el alumno: 1.1. distinga los hidrocarburos: alcanos, alquenos y aromáticos, mediante reacciones químicas, 1.2.Identifique halogenuros de alquilo, mediante reacciones químicas específicas. 1.3.Identifique los alcoholes, mediante reacciones químicas específicas. 1.4.Compare halogenuros de alquilo y alcoholes mediante sus propiedades físicas y químicas. 2. INTRODUCCIÓN Halogenuros de alquilo Los compuestos orgánicos halogenados pueden ser considerados como derivados de los hidrocarburos (por la sustitución de uno o más hidrógenos por un halógeno). De acuerdo a sus características químicas, se pueden clasificar en las siguientes categorías. Alquilo Halogenuros Primarios R Secundarios R2 CH X Terciarios R3 C Alílicos CH2 Bencílicos Vinilo CH2 CH X X CH CH2 CH2 X X X X Arilo Los halogenuros de alquilo son en general moléculas relativamente reactivas y sufren reacciones de sustitución y eliminación. Los halogenuros de arilo y de vinilo generalmente - 28 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez son inertes a las reacciones de sustitución y eliminación debido a la influencia que ejercen las insaturaciones sobre el enlace carbono halógeno de estos compuestos. El enlace C−X es un enlace muy polarizado que conduce a la asociación de las moléculas por atracción de dipolos permanentes. En los alcoholes las asociaciones atractivas entre moléculas ocurren por enlaces del tipo puente de hidrógeno (un tipo particular de interacción dipolo-dipolo), lo que ocasiona que los puntos de ebullición de los halogenuros de alquilo sean más bajos que los alcoholes correspondientes La reacción principal de los R-X es la sustitución nucleofílica, las reacciones de los halogenuros de alquilo primarios usualmente sigue un mecanismo SN2 (substitución nucleofílica de segundo orden) y sus reactividades relativas presentan el siguiente orden: metílico >> primario > secundario. En muchas reacciones típicas que se efectúan por este mecanismo la velocidad de reacción para el Me-X puede ser de 10 a 20 veces más rápida que para su análogo de etilo (Et-X). Este tipo de reacción se evidenciará en esta práctica con el reactivo de KI en acetona. Las reacciones de los derivados terciarios siguen un mecanismo del tipo SN1 (sustitución nucleofílica unimolecular): el paso determinante de la reacción es el rompimiento heterolítico del enlace carbono-halógeno para formar el intermediario (carbocatión). Los halogenuros de alquilo secundarios pueden reaccionar por mecanismos del tipo SN1 y SN2 o un híbrido de ambos, esto dependerá de las condiciones de reacción. El proceso SN2 se ve favorecido por nucleófilos fuertes, alta concentración del reactivo y solventes poco polares. El mecanismo SN1 es favorecido por nucleófilos débiles y baja concentración, y especialmente en solventes altamente polares. Hidrocarburos Los hidrocarburos pueden clasificarse básicamente en tres tipos: a) los saturados que incluyen alcanos y los cicloalcanos, b) los insaturados dentro de los que se encuentran los alquenos (olefinas) y los alquinos (acetilenos), c) los aromáticos. Los alcanos y cicloalcanos son prácticamente inertes desde el punto de vista químico, a causa de esta baja reactividad, se les denomina parafinas (compuestos de poca afinidad). No existen pruebas químicas simples para identificar a los hidrocarburos saturados, estos - 29 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez deben en general ser detectados indirectamente al dar negativas las pruebas químicas de insaturación o aromaticidad. Para el caso de los alquenos, cicloalquenos y alquinos, la presencia de insaturaciones se puede confirmar por medio de reacciones de cishidroxilación, con una solución acuosa de permanganato de potasio (prueba de Baeyer) y por la adición de una molécula de Br2, entre otras pruebas. Casi todos los alquenos y alquinos reaccionan con estos reactivos. El número de dobles enlaces se puede determinar cuantitativamente si se mide la cantidad de bromo consumido. Prueba de Baeyer: R R R + 2 KMnO4 R HO R R R R OH + 2 MnO2 + 2 KOH Los alquenos son fácilmente oxidados por ciertos reactivos, incluyendo permanganato de potasio acuoso. El producto orgánico depende de las condiciones de reacción, la cis-hidroxilación se favorece bajo condiciones suaves y el rompimiento a un ácido dicarboxílico se favorece bajo condiciones más vigorosas: La prueba de permanganato de Baeyer es más selectiva que la reacción con Bromo; sin embargo, también presenta sus limitantes, puesto que casi todas las moléculas que se pueden oxidar, como los aldehídos y fenoles, dan positiva esta reacción. Afortunadamente, los dos procesos son complementarios, se recomienda realizar primero la prueba de Baeyer y si es positiva, continuar con la prueba del bromo. Los alquenos y los alquinos son los únicos hidrocarburos que son solubles en ácido sulfúrico frío. Adición de Br2 R R CCl4 + R R Br2 R R + Br - Br Br R - 30 - R R Br Br R R Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez La excepción a la reacción del bromo son aquellas moléculas que contienen grupos fuertemente atractores de electrones cerca del enlace múltiple; otra complicación de esta prueba es la tendencia de los enlaces C-H adyacentes al doble enlace a reaccionar con el bromo a través de una reacción de sustitución (vía radicales libres) que produce la formación de ácido bromhídrico. Estas reacciones de sustitución se pueden detectar por la formación de niebla ácida, cuando se sopla en la parte superior del tubo de reacción. Por otro lado, los compuestos aromáticos constituyen una familia de especies químicas muy extensa y variada; todos sus integrantes guardan una estrecha relación con el benceno, miembro más sencillo del grupo de los hidrocarburos aromáticos. La presencia de la estructura electrónica aromática, estabilizada por la deslocalización de los electrones pi, les confiere un comportamiento químico singular si se les compara con otras especies análogas. Los compuestos aromáticos no sufren las reacciones típicas de alquenos. Sin embargo, distan de ser inertes y en condiciones adecuadas, experimentan fácilmente reacciones de sustitución electrofílica aromática (reacciones en las que un electrófilo sustituye a uno de los hidrógenos del anillo aromático). Alcoholes Los alcoholes son derivados de los hidrocarburos saturados o insaturados a los que se les ha reemplazado un átomo de hidrógeno por un grupo hidroxilo (-OH). La química de los alcoholes también dependen del tipo de grupo R al que esté unido el OH, con base en esto se les puede clasificar en las siguientres especies: alquílicas, arílicas, vinílicas y bencílicas. Los alcoholes alquílicos pueden ser: primarios (RCH2OH), secundarios (R2-CH-OH), terciarios (R3C-OH) y alílicos (CH2=CH2-CH2-OH). Si el OH está unido directamente a un doble enlace se denomina vinílico. Los alcoholes reaccionan como ácidos con bases fuertes, sin embargo también pueden comportarse como bases con ácidos fuertes o de Lewis. Las principales reacciones químicas de los alcoholes involucran la ruptura heterolítica de la unión C-OH por lo que pueden sufrir reacciones de sustitución o eliminación de manera análoga a los halogenuros de alquilo. Algunas de las reacciones características de los alcoholes permiten distinguir alcoholes primarios y secundarios de los alcoholes terciarios. La prueba de Lucas - 31 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez proporciona cierta información de la estructura del alcohol, puesto que se basa en la conversión del alcohol al cloruro de alquilo correspondiente (insoluble en agua). La facilidad de dicha reacción depende de la estabilidad del carbocatión que se forma y permite diferenciar los alcoholes primarios y secundarios de los terciarios. Los alcoholes alílicos se comportan como los terciarios (puesto que pueden estabilizar la carga del catión por deslocalización). Si el grupo -OH está unido a un anillo aromático los compuestos se denominan fenoles. El efecto que el grupo hidroxilo ejerce sobre la molécula es el de proporcionar una polaridad considerable, les permite asociarse por medio de enlaces por puente de hidrógeno, presentan además características hidrofílicas (afinidad por el agua) y les confiere propiedades ácidas (ej. fenoles). Sus puntos de ebullición y de fusión son más altos que los de los alcanos y alquenos correspondientes debido a las fuerzas de atracción que se presentan entre los hidroxilos. Por otro lado, los fenoles poseen dos grupos funcionales importantes: el anillo bencénico y el grupo hidroxilo, por lo que las propiedades químicas de estos compuestos incluyen las características de ambos. El protón del grupo hidroxilo aromático es más ácido que el protón de los alcoholes alifáticos, así mismo el anillo bencénico es más susceptible al ataque por reactivos electrofílicos. Dos de las reacciones químicas que permiten identificar en forma rápida un fenol es su reacción con álcalis y su reacción con cloruro férrico. Muchos fenoles y algunos compuestos relacionados (enoles) forman complejos de coordinación con el ión férrico de colores rojos, azules, púrpuras o verdes. 3. SECCIÓN EXPERIMENTAL. 3.1 Materiales 20 Tubos de ensayo 1 Gradilla 3 Pipetas de 5 mL 1 Parrilla de calentamiento 1 Baño maría - 32 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 3.2 Reactivos 3.2.1. Halogenuros de alquilo Sustancias de prueba: clorobenceno, Solución de nitrato de plata cloruro de bencilo, diclorometano, cloruro de t-butilo y en etanol al 2% cloruro de sec-butilo KI al 15% en acetona Solución ácido nítrico diluido (1:20) 3.2.2. Hidrocarburos Solución de Br2 en CCl4 al Acetona 3% Sustancias de prueba: Ciclohexano, ciclohexeno, Tetracloruro de carbono aceite comestible, benceno y tolueno. Solución de KMnO4 al 1% -Solución acuosa de Br2 al 3% 3.2.3. Alcoholes Reactivo de Lucas solución acuosa de cloruro férrico al 3% Sustancias de prueba: metanol, n-butanol, t-butanol, sec- Sodio metálico butanol, fenol y resorcinol Reactivo de Lucas: Enfriar 21 mL de HCl concentrado y adicionar 27.2 g de ZnCl2 anhidro, agitar hasta disolución y colocarla a temperatura ambiente. 3.3 Procedimiento experimental 3.3.1. Propiedades Químicas de los halogenuros 3.3.1.1 Reacción con nitrato de plata. -Se colocan en diferentes tubos de ensayo 0.2 mL de los siguientes halogenuros: clorobenceno, cloruro de bencilo, diclorometano, cloruro de t-butilo y cloruro de secbutilo. Rotular cada tubo previamente. - 33 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez -Adicionar 1 mL de una solución etanólica de AgNO3 al 2%, agitar y dejar en reposo los tubos bien tapados. -Se tiene una prueba positiva si se presenta un precipitado del haluro de plata (blanco) dentro de los primeros cinco minutos. Si no se presenta reacción en este tiempo, abrir los tubos y calentar ligeramente en baño maría, hasta que la solución empiece a ebullir, durante dos minutos. Anotar sus observaciones. -Si se forma un precipitado, ya sea a temperatura ambiente o por calentamiento, verifique que se trata del haluro de plata y no de una sal de plata proveniente de un ácido orgánico, adicionar 1 gotas de ácido nítrico diluido. Las sales de plata se disuelven, el haluro de plata no. 3.3.1.2 Reacción con yoduro de potasio. -Se colocan en diferentes tubos de ensayo 0.2 mL de los halogenuros probados en el procedimiento anterior. -Adicionar 1 mL de una solución de KI al 15% en acetona, agitar y dejar reposar. -Se obtiene una prueba positiva cuando se presenta un precipitado blanco dentro de los primeros cinco minutos. Si no ocurre la reacción, calentar los tubos en baño de agua a 50°, después de cinco minutos enfriar a temperatura ambiente. Anotar las observaciones. 3.3.2. Reacciones Químicas de Insaturación. 3.3.2.1 Prueba de Permanganato o de Baeyer. Colocar en un tubo de ensayo 3 gotas del líquido (30 mg del sólido) a probar más 1 mL de acetona. Adicionar unas gotas de solución acuosa de permanganato de potasio al 1%, agitar vigorosamente y observar el tubo. Se tendrá una prueba positiva cuando en el lapso de 1 minuto se pierda el color púrpura y se forme un precipitado café insoluble. 3.3.2.2 Prueba de Bromo en Solución Orgánica. En un tubo de ensayo colocar 3 gotas del líquido (o 30 mg del sólido) a probar, adicionar 1 mL de tetracloruro de carbono y de 5 a 6 gotas de una solución de bromo al 3% - 34 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez en tetracloruro de carbono y agitar. La desaparición del color proporciona una prueba positiva, exponer el tubo a la luz y observar si existe la aparición de niebla en la parte superior del líquido. NOTA: Todos los experimentos anteriores hacerlos con ciclohexano, ciclohexeno, aceite comestible, benceno y tolueno. 3.3.3. Propiedades Químicas de Alcoholes y Fenoles. 3.3.3.1 Propiedades ácidas. -Se colocan en un tubo de ensaye 1.0 mL de etanol y en otro tubo de ensaye 1.0 mL de tbutanol. -A cada tubo se le añade un trozo muy pequeño de sodio metálico. -Observe y tome el tiempo que tarda en llevarse a cabo cada reacción. -Una vez terminada la reacción, vacíe el contenido de cada tubo en sendos vidrios de reloj, deje que se evapore el disolvente. -Añada 1 mL de agua destilada y mida el pH con papel indicador. 3.3.3.2 Prueba de Lucas. -Se colocan en un tubo de ensaye 1.5 mL del reactivo de Lucas -Se adicionan 5 gotas del alcohol a analizar (n-butanol, t-butanol y sec-butanol), se agita vigorosamente y se deja reposar. -Se anota el tiempo requerido para la formación del cloruro de alquilo, que aparece como una capa insoluble o una emulsión. Los alcoholes terciarios presentan una separación de fases inmediata, los secundarios requieren cerca de 5 minutos para reaccionar y los primarios aproximadamente una hora. 3.3.3.3 Reacción del Complejo Férrico. -Se colocan aproximadamente 10 mg (fenol, resorcinol y n-butanol) de la sustancia a analizar en un tubo de ensayo y se disuelve en 2 mL de etanol. - 35 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez -Se adicionan unas gotas de solución acuosa de cloruro férrico al 3%, y se agita vigorosamente. -Se compara el color de la solución con un tubo testigo al que solo se le debe agregar etanol y el cloruro férrico. Anotar sus observaciones. 3.4. INSTRUCCIONES PARTICULARES. 3.4.1 Varios de los reactivos utilizados en esta práctica son tóxicos, el bromo puede además causar quemaduras. 3.4.2 Manejar las soluciones con especial cuidado y en la campana de extracción. 3.4.3 Las pruebas químicas se realizarán con pequeñas cantidades que pueden ser manejadas fácilmente en frascos de reactivos por lo que la posibilidad de inhalación es mínima. 3.4.4 Manejar los reactivos en una área ventilada y con precaución, puesto que a los hidrocarburos aromáticos se consideran tóxicos y carcinógenos. 3.4.5 Los compuestos fenólicos en estado puro o soluciones concentradas son tóxicos y causan quemaduras, evite el contacto con la piel. 3.4.6 Evitar la inhalación de los vapores de los halogenuros de alquilo que se producen en la prueba de Lucas. Recuerde que son tóxicos. 3.4.7 La solución de FeCl3 3% debe prepararse el día de la práctica. 4. RESULTADOS Y DISCUSIÓN 4.1. Complete la siguiente tabla en base a reactividad observada de los Halogenuros Compuesto Reacciones Tipo de halogenuro AgNO3 T. amb. KI calor T. amb. Diclorometano Clorobenceno - 36 - calor Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez Cloruro de bencilo Cloruro de ter-butilo Cloruro de sec-butilo 4.1.2. Escriba las ecuaciones químicas que representen la reactividad observada. 4.1.3. Discuta la reactividad observada de los diferentes tipos de halogenuros probados con AgNO3 y KI. 4.1.4. Comente la reactividad en función del tipo de halogenuro empleado. Explique. 4.2. Reacciones Químicas de Insaturación Nombre del REACCIONES Compuesto Br2/CCl4 KMnO4 Ciclohexano Ciclohexeno Aceite comestible Benceno Tolueno 4.2.1 Escriba las ecuaciones químicas que representen la reactividad observada. 4.2.2 Discuta la reactividad observada de los alcanos, los alquenos y los hidrocarburos aromáticos con Br2/CCl4 y con KMnO4. 4.3. Reacciones Químicas de Alcoholes y Fenoles Propiedades ácidas Compuesto Tiempo de reacción (Observaciones) metanol t-butanol Prueba de Lucas n-butanol - 37 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez t-butanol sec-butanol Reacción con FeCl3 Compuesto Observaciones Fenol n-butanol Resorcinol 4.3.2. Escriba las ecuaciones químicas que representen la reactividad observada. 4.3.3. Discuta la reactividad observada de los alcoholes con sodio y con ZnCl2 (reactivo de Lucas). Comente el porqué los alcoholes no reaccionan como ácidos con hidróxido de sodio. 4.3.4. Comente la reactividad en función del tipo de alcohol empleado. Explique. 5. CONCLUSIONES Los integrantes de equipo, analizaran su información práctica con la teoría y concluirán sobre el resultado de su practica 6. CUESTIONARIO 6.1. Describa el mecanismo de reacción de un halogenuro de alquilo con AgNO3. 6.2. Describa el mecanismo de reacción de un halogenuro de alquilo con KI. 6.3. Escriba el mecanismo general para una reacción de eliminación E1 y E2. 6.4. Describa el mecanismo de reacción de los alcoholes en la reacción de substitución nucleofílica con el reactivo de Lucas. Explique a partir de esto la diferencia en la velocidad de reacción de los alcoholes probados. 6.5. ¿Qué prueba química utilizaría para diferenciar entre: 1-butanol y terbutanol, fenol y alcohol undecílico, 1-butanol y cloruro de butilo? Explique su respuesta. - 38 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 6.6. Investigue cuáles de los siguientes hidrocarburos son saturados y cuales insaturados, señale que tipo de pruebas le permiten diferenciarlos: Pineno, Aceite de parafina, Gasolina y Ciclohexano. Hidrocarburo saturado ó insaturado Prueba(s) química (s) Pineno Aceite de parafina Gasolina Ciclohexano 6.7. ¿Qué alqueno es el producto principal cuando cada uno de los siguientes alcoholes son deshidratados con ácido? Escriba las estructuras: a) 2-metil-2-butanol; b) 3-metil-2-butanol. 7. BIBLIOGRAFÍA. 7.1 Fessenden R. J., y Fessenden J.S., Química Orgánica. Grupo Editorial Interamericano(1983). 7.2 Solomons. T. W. G., Química Orgánica, Ed. Limusa, (1983). 7.3 Wingrove, A. S. y Caret, R. L., Química Orgánica, Harla, (1984).6.4. Hart, H. and Schuetz, R. D., Organic Chemistry, Hounghton Mifflin Company (1986). 7.4 Shriner, R. L., Fuson, R.C., and Curtin, D., Systematic Identification of Organic Compounds, John Wiley and Sons, (1964). 7.5 Wilcox, C. F., Experimental Oraganic Chemistry, A Small Scale Aproach., Mc. Millan Jr. (1988). 7.6 Wilcox, C.F., Experimental Organic Chemistry. A Small Scale Aproach, M. Millan Jr. (1983). 7.7 Vogel, A.I., Elementary PRÁCTICAl Organic Chemistry part I. Small Scale Preparations, Longmono (1978). 7.8 Pine, S. H. Hendrickson, J. B. Craw, D. J. y Hammond, G. S., Química Orgánica, Ed. Mc. Graw Hill (1985). 8. BIBLIOGRAFIA ADICIONAL - 39 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez PRACTICA No. 4 MEDICION DE LA DENSIDAD, INDICE DE REFRACCION Y PUNTO DE EBULLICION DE SERIE HOMOLOGA DE HIDROCARBUROS ALIFATICOS (C6,C8,C10 y C12) 1. OBJETIVOS: Que el alumno: -Determine la densidad de la serie homologa de alcanos -Discuta a partir de los resultados experimentales, algunas propiedades fisicoquiicas de alcanos -Analize, si la densidad se puede utilizar como criterio para establecer la pureza de un líquido. -Determine el índice de refracción de hexano, octano, decano, dodecano -Determine el punto de ebullición como criterio de pureza e identidad de substancias químicas. 2. INTRODUCCION La densidad de los líquidos se mide de una manera similar a como se midió la densidad de los sólidos. En este caso también se emplearán tres métodos: el del picnómetro, el de la probeta y el del principio de Arquímedes. Es necesario tener en cuenta la temperatura porque ésta influye en el valor de la densidad: a medida que aumenta la temperatura, la densidad del líquido se hace ligeramente menor. ¿Por qué? Un picnómetro (figura 1) es un pequeño frasco de vidrio de volumen exacto y conocido (Vp). Se pesa vacío (wp), luego se llena completamente (incluído el capilar) con el líquido cuya densidad se desea determinar y finalmente se pesa (wpl). Con estos datos se puede calcular la densidad del líquido: (1) - 40 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez Soluciones Una solución es una mezcla homogénea de dos o más componentes. A aquél componente que se encuentra en mayor cantidad se conviene en llamarlo solvente y a los demás solutos. Cuando uno de los componentes es el agua, entonces la solución se denomina acuosa y el solvente es el agua. Cuando la solución tiene únicamente dos componentes se llama binaria. Figura 1. Picnómetro La concentración de un soluto en una solución es la cantidad relativa del soluto con respecto a una determinada cantidad de solvente o de solución. Una de las formas más usadas para expresar la concentración es el porcentaje peso a peso que se calcula como: Porcentaje p/p = (2) Así por ejemplo, una solución de NaCl de concentración 2.5% p/p indica que por cada 100 g de la solución hay 2.5 g de NaCl. La densidad de una solución acuosa se mide del mismo modo como se mide la densidad de un líquido puro. El sentido de la vista es en extremo importante para el hombre en la observación , ya que proporciona una gran parte de información en torno al mundo. Cuando la luz pasa de un medio a otro, parte de la luz incidente se refleja en la frontera. El resto pasa al nuevo medio. Si un rayo de luz incide a cierto ángulo respecto de la superficie(no perpendicularmente), el rayo se desvía cuando entra al nuevo medio. Esta desviación se denomina refracción. La figura 2 muestra un rayo que pasa de un medio a otro. El ángulo θ1 es el ángulo de incidencia y es el ángulo de refracción. El rayo se desvía hacia la normal cuando entra al líquido, esto siempre sucede cuando el resto entra en un medio en el que la velocidad de luz es menor que en el aire. - 41 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez La refracción es la causa de varias ilusiones ópticas comunes. Por ejemplo una persona que permanece en pie en aguas pocos profundas parece como si tuviera piernas mas cortas. El ángulo de refracción depende de la velocidad de la luz en los dos medios así como el ángulo incidente. En tanto el índice de refracción de un líquido esta dado por la relación entre el seno del ángulo de incidencia de un rayo de luz en el aire, con respecto al seno del ángulo de refracción en el liquido, tal como lo muestra la figura 2. Figura 2. La aplicación del índice de refracción en la Química es que permite determinar características de los líquidos (en este caso sustancias orgánicas), como la pureza, composición, e igualmente características de las reacciones en la obtención de sustancias binarias a través del uso del refractómetro, instrumento muy utilizado en procesos químicos en el laboratorio como la destilación, rectificación, nitración y esterificación entre otras, porque permite analizar de una manera más eficiente y experimental los resultados obtenidos en los procesos anteriormente nombrados. La pureza e identidad de una substancia orgánica queda establecida cuando sus constantes físicas (punto de fusión y de ebullición, peso molecular, índice de refracción, rotación específica, espectro de absorción, etc.) y sus propiedades químicas son idénticas a las registradas en la bibliografía científica para dicha substancia. Por la sencillez de la determinación de los puntos de fusión y ebullición, y sobre todo porque son las constantes que con más frecuencia se pueden encontrar en la - 42 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez bibliografía, constituye su determinación una de las operaciones de rutina en el laboratorio de química orgánica. Recordemos que el punto de fusión de una substancia se define como la temperatura en que a la presión atmosférica, se encuentra en equilibrio con los estados sólido y líquido de dicha substancia. Los puntos de fusión para una substancia pura no deben tener variación mayor de un grado (1oC). El punto de ebullición de una substancia se define como la temperatura a la cual su presión de vapor es igual a la presión atmosférica normal (760 mmHg). Una determinación exacta requiere el uso de aparatos complicados, en los cuales el termómetro está tan cerca o en contacto con la fase líquida como con la gaseosa, cuando se ha alcanzado el equilibrio. Pero en las determinaciones de rutina en química, se puede emplear un matraz de destilación ordinario y alguno de los métodos semimicro (método de Siweloboff) o microquímico (Emich). 3. SECCIÓN EXPERIMENTAL 3.1 Materiales y reactivos: Medición de la densidad Picnómetro hexano Balanza analítica octano Papel higiénico decano decano 3.2 Materiales y reactivos Índice de refracción Tubos de ensayo. Reactivos Pipeta. Etanol al 96%. Refractómetro. Agua destilada. Termómetro. hexano Paño limpiador. octano Cetona. decano - 43 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 3.2 Materiales y reactivos punto de ebullición Equipo Reactivos Pinzas Hexano Mechero Octano Tubo de Thiele Decano Tubo de Ensaye (5x50 Tubos capilares Termómetro Fusímetro Tapones monohoradado 3.4.1 Determinación de la densidad por el método del picnómetro a) Mida en una balanza analítica el peso del picnómetro vacio, registre en su bitácora el peso y la temperatura. b) Enjuague primero el picnómetro con un poco del líquido de interés antes de llenarlo. Mida el peso del picnómetro con el líquido de interés y registre en su bitácora el peso y la temperatura. La densidad se calcula por medio de la ecuación 1. Temperatura del líquido (T): __________ ºC Peso del picnómetro vacío (wp): __________ g Volumen del picnómetro (Vp): __________ mL Anote los demás datos en la tabla 3.1. 3.4.2. Procedimiento índice de refracción La medición del índice de refracción se divide en dos partes: La primera parte consiste en aprender a cuidar y manejar el refractómetro, y tomando medidas precavidas se busca obtener el índice de refracción de el etanol en diferentes concentraciones cuando esta combinado con agua. cada grupo determinado procede a tomar dos medidas del índice de refracción de la sustancia en diferentes porcentajes de etanol; para ello cada grupo debe hacer las concentraciones adecuadas de etanol en el agua - 44 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez empleando alcohol etílico al 96% (ya que este es muy económico), y por medio de cálculos buscar la manera más apropiada para realizar dicha combinación binaria aproximándose a los porcentajes requeridos. En la segunda parte, teniendo hexano, octano y decano se procede a medir el índice de refracción empleando un refractómetro. Se mide la temperatura en la cual se obtuvieron las lecturas y se comparan con las reportadas en la literatura. 3.4.3 Procedimiento: determinar el punto de ebullición de la serie homologa 1 En un tubo pequeño (3 mm de diámetro de 6 a 8 cm de longitud), se colocan de 5 a 6 gotas de la muestra. 2 Se introduce un tubo capilar cerrado por un extremo y la sección abierta dirigida al fondo del primer tubo. Se liga al tubo, conteniendo el capilar, a un termómetro, procurando que la columna del líquido quede pegada al bulbo. 3 Tubo y termómetro se introducen en un Thiele o en un baño de los que se emplean para determinar puntos de fusión, se calienta el baño lentamente hasta que el capilar empiece a desprender burbujas. 4 Se detiene el calentamiento y se anota la temperatura que registró el termómetro en el momento en el que dejan de desprenderse burbujas. La temperatura leída corresponde al punto de ebullición de la muestra a la presión ambiente. Todas las demás muestras se determinan de la misma manera 4. DISCUSION Y RESULTADOS 4.1 Datos obtenidos con el picnómetro Método del picnómetro Líquido wpl (g) wpl- wp (g) pentano hexano octano decano - 45 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 4.2 Complete el cuadro. PUNTO DE EBULLICION Compuesto Formula Peso P. Ebullición P. Molecular teórico Ebullición experimental pentano hexano octano decano 4.3 INDICE DE REFRACCION Indice de fracción Teórico Practico pentano hexano octano decano 5. CONCLUSIONES El alumno concluirá si los objetivos se cumplieron. Se oberva alguna tendencia en la serie homologa? 6 CUESTIONARIO 6.1. ¿Qué factores afectan el índice de refracción? 6.2. Es posible identificar un liquido conociendo únicamente su índice de refracción? Justique su respuesta 6.3. ¿Son el índice de refracción y la densidad de un liquido directa o inversamente proporcional? - 46 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 6.4 ¿Cree usted que el índice de refracción se puede utilizar para determinar el fin de una reacción. 6.5. ¿Por que es importante la determinación de los puntos de fusión y de ebullición ? 6.6 ¿Como se determinan puntos de fusión mixtos ? (sustancias mezcladas) 6.7 ¿ Qué se entiende por curva de corrección ? 6.8 Defina lo que es Punto de ebullición. 6.9 ¿En que consiste el método microquímico de Emich para determinar puntos de ebullición ? 6.10 Cite otras propiedades físicas de las substancias que pueden ayudarnos a identificarlas. 7. BIBLIOGRAFIA 8.1http://docencia.udea.edu.co/cen/tecnicaslabquimico/02practicas/practica03.htm 8.2.http://www.google.com.mx/search?hl=es&q=practica+de+determinacion+puntos+de+e bullicion&btnG=Buscar&meta= 8. BIBLIOGRAFIA ADICIONAL - 47 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez PRÁCTICA No. 5 SINTESIS DEL CLORURO DE terc-BUTILO A PARTIR DE terc-BUTANOL 1. OBJETIVOS El alumno: 1.1. Síntetizará del cloruro de terc-butilo mediante reacción de susbstitución nucleofílica del terc-butanol. 1.2 Purificará y caracterizará el cloruro de tercbutilo. 2. INTRODUCCION La conversión de alcoholes en cloruros de alquilo se puede efectuar por varios procedimientos. Con alcoholes primarios y secundarios se usan frecuentement cloruro de tionilo y haluros de fósforo;tambien se pueden obtener calentando el alcohol con acido clorhidrico concentrado y cloruro de zinc anhidro. Los alcoholes terciarios s convierten al haluros de alquilo con ácido clorhidrico solo y en algunos casos sin calentamieno. CH3 H3C C OH CH3 HCl H3C CH3 C Cl + H2O CH3 Terc-butanol Cloruro de terc-butilo 3. SECCION EXPERIMENTAL Materiales Reactivos Parrilla calentamiento tercbutanol Balanza analítica Acido clorhídrico Sistema de destilaciónsimple Bicarbonato de sodio Matraz esférico 250 ml/junta 24/40 hielo 1.Embudo de separación 2. Vasos de precipitados de 100ml Barra de agitaciòn termomentro Bomba de agua - 48 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez En un matraz de fondo redondo provisto de una barra magnética se añaden 18 mL de alcohol terc-butílico y 60 mL de ácido clorhídrico concentrado. Sin tapar, se agita la mezcla suavemente. Después de un minuto aproximadamente, se aumenta la agitación y se agita vigorosamente durante cinco minutos más. Finalmente la mezcla se transvasa a un embudo de decantación y se deja en reposo hasta que las dos capas se separen completamente. La capa acuosa se saca del embudo y se desprecia. El cloruro de terc-butilo se lava con unos 25 mL de disolución saturada de bicarbonato sódico. El embudo de llave, destapado, se agita suavemente mediante un ligero movimiento circular hasta que cese el fuerte desprendimiento gaseoso. Entonces se tapa el embudo, se invierte cuidadosamente y se abre la llave para igualar la presión. A continuación se agita, primero con suavidad, luego enérgicamente, abriendo la llave con frecuencia para que salgan los gases. Por último se saca y se desprecia la capa de bicarbonato y el cloruro de terc-butilo se lava una vez más con unos 20 mL de agua. Tras decantar la capa acuosa, se transvasa el cloruro de terc-butilo bruto a un erlenmeyer pequeño y se deja secar con cloruro cálcico escoriforme (como el cloruro de terc-butilo es muy volátil, conviene mantener tapado el erlenmeyer y agitar éste de vez en cuando, para acelerar el secado). El líquido del erlenmeyer se decanta a un matraz de fondo redondo y se destila recogiendo la fracción que destila entre 48-52ºC(es aconsejable enfriar el matraz de recogida en un baño de agua-hielo). Determinar el rendimiento de la reacción. 4. RESULTADOS Y DISCUSIÓN 4.1 Anote las propiedades fisicoquimicas observadas del producto de reacción y comparelas con las reportadas en la literatura. 4.2 Calcule el rendimiento de la reacción 5. CONCLUSIONES El alumno concluirá en base a su experimentación si se alcanzaron los objetivos de la práctica. 6. CUESTIONARIO 6.1 ¿Cuál es el mecanismo de reacción para la obtención del cloruro de terbutilo - 49 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 6.2 Consulte la toxicidad del cloruro de terbutilo, del terbutanol, acido clorhidrico 6.3 Los residuos de la reacción contienen agua,cloruro de calcio y terbutanol. ¿Qué es necesario hacer antes de desecharlos por el drenaje? 6.6 Reporte los espectros de IR del terbutanol y del cloruro de terbutilo, asignado las bandas características de los grupos funcionales. 7. BIBLIOGRAFIA 7.1 "Curso Práctico de Química Orgánica" R. Brewster, C.A. Vanderwert y W.E. McEwen. Ed. Alhambra, Madrid, 1965. 7.2 "Química Orgánica Experimental". H.D. Durst y G.W. Gokel. Ed. Reverté, Barcelona, 1985 7.3.http://search.conduit.com/Results.aspx?q=SINTESIS+DEL+CLORURO+DE+TERTBUTILO&ctid=CT2 126482&octid=CT2126482 8. BIBLIOGRAFIA ADICIONAL - 50 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez PRACTICA No. 6 ALDEHIDOS Y CETONAS; SINTESIS DE DIBENZALACETONA 1. OBJETIVOS 1.1. Identificar el grupo carbonilo mediante reacciones químicas. 1.2. Demostrar la influencia de los sustituyentes del carbono carbonílico en los aldehídos y cetonas mediante reacciones químicas específicas. 1.3. Sintetizar la dibenzalacetona mediante una reacción de condenzación aldolica cruzada 2. INTRODUCCION Uno de los grupos funcionales más importantes en química orgánica es el grupo carbonilo (C=O), figura 1. Existen muchas clases de compuestos carbonílicos, dependiendo de que grupos R2 estén unidos a la unidad C=O, sin embargo, la química de los grupos carbonilo es muy similar, independientemente de su estructura exacta. Cuando un grupo R1 es un grupo alquilo, alquenilo, alquinilo o arilo, al grupo R1-C=O se le conoce como grupo acilo. El grupo acilo forma parte de la estructura de un gran número de compuestos, por ejemplo, los ácidos carboxílicos (R2 = OH), ésteres R2 = OR), tioésteres (R2 = SR), amidas (R2 = NHR), anhídridos (R2 = O(O=)CR), halogenuros de ácidos (R2 = Cl), que conjuntamente con los aldehídos (R2 = H) y cetonas [R2 = alquilo o fenilo], participan como intermediarios fundamentales en la biosíntesis de moléculas de importancia biológica en los organismos vivos. Figura 1. Grupo carbonilo - 51 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez Reactividad química de los compuestos carbonílicos Particularmente la conducta química y espectroscópica de de los compuestos carbonílcos dependen principalmente del grupo carbonilo, además de algunas variaciones que se manifiestan por las diferencias en la naturaleza química de los grupos R unidos a él. El doble enlace carbono-oxígeno del grupo carbonilo se encuentra polarizado debido a la alta electronegatividad del oxígeno respecto a la del carbono, por tanto los compuestos carbonílicos tienen momento bipolar grande. En consecuencia, el carbono carbonílico tiene carga parcial positiva por lo que es un sitio electrófilo y es atacado por nucleófilos. A la inversa, el oxígeno carbonílico tiene carga parcial negativa y es u sitio nucleófilo. Así, una de las reacciones más generales para esta clase de compuestos son las adiciones de agentes nucleófílicos. En los aldehídos y cetonas, los grupos H y R que están unidos al grupo acilo, no pueden estabilizar una carga negativa y por tanto no pueden actuar como grupos salientes. Sin embargo, en los ácidos carboxílicos y sus derivados, los grupos acilo que están unidos a sustituyentes G que contienen átomos de oxígeno, halógeno o nitrógeno, pueden estabilizar una carga negativa y por tanto pueden funcionar como grupos salientes en reacciones de sustitución nucleofílica. - 52 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez Ionización de los ácidos carboxílicos. Los ácidos carboxílicos, como su nombre lo indica, tienen la capacidad ionizarse en agua y producir iones hidronio (H3O+), por lo que sus soluciones tienen pH menor que 7.0. Para la mayoría de los ácidos carboxílicos, la constante de acidez Ka es del orden de 10-5. Por ejemplo, el ácido acético tiene Ka = 1.8 x 10-5 que corresponde a un pKa de 4.72. En términos prácticos, los valores de Ka del orden de 10-5 significan que solo están disociadas alrededor de 1 % de las moléculas en una solución 0.1 M, en contraste con el 100 % de disociación encontrado para los ácidos minerales como el HCl y H2SO4. Aunque mucho mas débiles que los ácidos minerales, los ácidos carboxílicos son mucho mas fuertes como ácidos que los alcoholes. Por ejemplo, la Ka para el etanol es aproximadamente de 10-16, lo que hace al etanol un ácido más débil. La mayor acidéz del ácido acético con respecto del etanol, se debe a que el anión carboxilato que resulta de la ionización se estabiliza por resonancia. - 53 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez Los ácidos carboxílicos reaccionan con bases como: a) hidróxidos de metales alcalinos o alcalinoterreos como el hidróxido de sodio (NaOH); b) carbonatos (Na2CO3) o bicarbonatos (NaHCO3) de metales alcalinos o alcalinoterreos para formar las sales carboxílicas (carboxilatos) de los metales correspondientes. c) con amoniaco (NH3) o aminas (RNH2) para formar carboxilatos de amonio o alquilamonio. Reactividad de hidrógenos α y condenzación aldólica. Muchas de las reacciones de importancia de los compuestos carbonílicos, tienen lugar sobre el átomo de carbono adyacente al grupo carbonilo (carbono α). Un ejemplo, es la enolización, proceso en el cual, un átomo de hidrógeno unido al carbono α de un compuesto carbonílico (hidrógeno α) se desplaza al oxígeno carbonílico, a este proceso también se le conoce como TAUTOMERIA CETO-ENOLICA. - 54 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez Los hidrógenos α al grupo carbonilo de aldehídos y cetonas, poseen una acidéz considerablemente mayor que sus hidrocarburos análogos. Eso es atribuído a la capacidad del grupo carbonilo de para deslocalizar la carga negativa de la base conjugada, mejor conocido como el equilibrio CARBANION-ENOLATO, especie que participa también en el proceso de enolización catalizada por bases. Los iones enolato participan en algunos procesos sintéticos de la química orgánica que son de mayor importancia. La mayoría de las reacciones del ión enolato, tiene lugar a través del carbanión como nucleófilo, y no a través del oxígeno del enolato, también sabemos que el átomo de carbono carbonílico es electrófilo. La combinación de ambas especies, la nucleofílica del carbanión enolato y la electrofílica del carbono carbonílico, conduce a un importante grupo de métodos sintéticos conocidos como REACCIONES DE CONDENSACION DEL CARBONILO. Un ejemplo de estas reacciones es la CONDENSACION ALDOLICA, que es el resultado de combinar dos moléculas de aldehído (monómeros) para generar un aldol (dímero). Por otra parte, los aldehídos que no contienen hidrógenos α, no pueden formar iones enolato, por lo que no pueden dimerizarse en una condenzación aldólica. Sin embargo, estos aldehídos se pueden hacer reaccionar con otros aldehídos o cetonas que contengan hidrógenos α, produciéndose una condenzación CONDENZACION ALDOLICA CRUZADA. - 55 - entre ambos, conocida como Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez Una condenzación aldólica cruzada es más útil cuando solo uno de los carbonos vecinos al grupo carbonilo tiene hidrógenos α. Por ejemplo, las metilcetonas pueden ser usadas en las condenzaciones aldólicas cruzadas con aldehídos que no contienen hidrógenos α (aldehídos aromáticos o formaldehído), ejemplo: O O H + O H3C BENZALACETOFENONA Pruebas de identificación de aldehidos y cetonas a) Centraremos nuestra atención en aquellas reacciones que permiten diferenciar los aldehídos y cetonas de otro tipo de compuestos y que proporcionan un esquema útil de identificación química, así como un criterio químico esencial. Por ejemplo, la reacción de aldehídos y cetonas con aminas primarias da lugar a la formación de iminas, conocidas como bases de Schiff, y constituyen intrmediarios importantes en la biosíntesis de aminoácidos. Algunos productos del tipo imínicos como las oximas, hidrazonas, fenilhidrazonas, 2,4-dinitrofenilhidrazonas y semicarbazonas, se forman a partir de aldehídos o cetonas con los compuestos nitrogenados hidroxilamina, hidracina, fenilhidrazina, 2,4-dinitrofenilhidrazina y semicarbazina respectivamente, constituyen derivados estables que se pueden caracterizar con relativa facilidad. En especial las 2,4-dinitrofenilhidrazonas (DNFH) son derivados sólidos de alto peso molecular, cuyo color depende del grado de conjugación de los aldehídos o cetonas, por lo que se les emplea como medio de identificación química de compuestos que tienen la función aldehído o cetona. b) Otro tipo de reacción que proporciona información valiosa es la oxidación. Las cetonas no se oxidan con facilidad como ocurre con los aldehídos que forman rápidamente ácidos carboxílicos. El permanganato de potasio (KMnO4) y el dicromato de potasio (K2Cr2O7) son los compuestos más empleados, pero no son los únicos que se pueden utilizar, también agentes oxidantes suaves como las sales de plata y cobre son muy empleadas. - 56 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez c) El reactivo de Tollens (solución alcalina de hidróxido de plata amoniacal), se utiliza para la identificación química de aldehídos, formandose un espejo de plata al oxidarse el compuesto en prueba. d) El reactivo de Benedict (solución alcalina de citrato o tartrato cúprico), también es útil , sin embargo es más sensible el reactivo de Tollens. e) Por otro lado, la prueba de la Fucsina de Shifft amoniacal, muestra la fácil formación de aductos de SO2 de aldehídos pero no de cetonas. Algunas otras reacciones se utilizan para distinguir a los aldehídos de las cetonas como lo es la prueba del Yodoformo, bisulfito, etc. 3. SECCION EXPERIMENTAL. 3.1. Material y equipo. 15 tubos de ensayo 2 pipetas graduadas de 1 mL 1 embudo de filtración 1 matraz erlenmeyer de 125 mL 1 agitador devidrio 2 vasos de precipitados de 250 mL 1 Baño maría. 3 pipetas graduadas de 5 mL 1 parrilla de calentamiento 1 pinza para tubo de ensayo 3.2. Reactivos Reactivos de prueba: Benzaldehído, Glucosa, Solución etanólica de verde de Acetaldehído, Ciclohexanona, acetona, etanol, ácido bromocresol al 0.02% acético y ácido benzoico. Solución de nitrato de plata al 5 % Agua destilada Solución de hidróxido de amonio al 2 % Etanol 96 % Solución acuosa de CuSO4 al 7 % Solución de KMnO4 al 0.3 % Solución de NaOH 0.5 N Acido sulfúrico concentrado Solución de NaOH al 10 % Solución de HCl concentrado Papel filtro - 57 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez Solución de 2,4-dinitrofenilhidrazina. a) Colocar 0.3 g de 2,4-dinitrofenilhidrazina en u vaso de precipitados de 50 mL. b) Adicionar 1 mL de agua y 1 mL de H2SO4 concentrado. c) Agitar, dejar enfriar y adicionar 15 mL de etanol. Solución alcalina de tartrato de sodio y potasio. a) Disolver 4 g de tartrato de sodio y potasio y 14 g de NaOH en 100 mL de agua. Solución de yodo al 10 % en yoduro de potasio. a) Disolver 10 g de yodo en una solución que contenga 20 g de yoduro de potasio 3.3. Procedimiento experimental 3.3.1. Reacciones del grupo carbonilo. 3.3.1.1 Reacción con la 2,4-dinitofenilhidracina a) A 1.0 mL de reactivo de 2,4-dinitrofenilhidracina, adicionar unas gotas del compuesto a identificar (glucosa, benzaldehído o acetona) o si es sólido, ± 50 mg disuelto en una mínima cantidad de etanol del 95 %. b) Una prueba positiva se obtiene con la formación de un precipitado de color amarillo a rojo. c) Si no aparece un precipitado dentro de los primeros 15 minutos, calentar ligeramente por 5 minutos, dejar reposar y observar. - 58 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 3.3.1.2. Reacción de Tollens, identificación del grupo aldehído (formación del espejo de plata. a) Colocar en un tubo d ensayo 1.0 mL de una solución de nitrato de plata al 5 %. b) Adicionar gota a gota 1.0 mL de solución de NaOH al 10 % (observar la formación de un precipitado) c) Con agitación constante, adicionar gota a gota una solución diluida de amoniaco (aproximadamente al 2 %) hasta que se disuelva el precipitado (no exceder la cantidad de amoniaco). d) Agregar unas gotas de la sustancia a identificar (benzaldehído o acetona), agitar y dejar reposar 10 minutos. e) Si no se observa ninguna reacción, calentar los tubos en un baño de agua a 40°C durante 10 minutos y dejar reposar. f) La prueba es positiva cuando se forma un espejo de plata. Hacer esta prueba con los 5 reactivos. Nota: los compuestos orgánicos insolubles en agua, se pueden disolver en alcohol. 3.3.1.3. Reacción con permanganato de potasio. a) En un tubo de ensayo, colocar 6 gotas del reactivo a evaluar (benzaldehído o acetona) b) Agregar 1 o 2 gotas de solución de permanganato de potasio al 0.3 % y agitar. c) Si en el transcurso de 1 minuto no se observa alguna reacción, adicionar 1 gota de solución de hidróxido de sodio al 10 %. 3.3.1.4. Reacción de Fehling (para aldehídos o azúcares reductores) a) En un tubo de ensayo adicionar: a) 1 mL de solución acuosa al 7 % de CuSO4 b) 1 mL de solución alcalina de tartrato de sodio y potasio c) 0.5 mL (0.5 g) de la muestra a analizar (glucosa o acetona). - 59 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez b) Colocar los tubos en un baño de agua hirviendo durante 10 minutos c) Anotar sus observaciones 3.3.1.5. Reacción del haloformo (identificación de metilcetonas) En un tubo de ensayo mezclar: a) Tres gotas del líquido a probar (benzaldehído y acetona) b) 2 mL de agua c) 2 mL de hidróxido de sodio al 10 %. d) Adicionar gota a gota y con agitación, una solución de yodo al 10 % en yoduro de potasio hasta que un color café persista (esto indica un exceso de yodo). Con algunos compuestos, el precipitado de yodoformo (color amarillo) aparece casi de inmediato y en frío. Si esto no ocurre en los primeros 5 minutos: a) Calentar la solución a 60 °C. b) Si desaparece el color café, adicionar más solución de yodo hasta que el color persista mínimo por dos minutos. c) En este momento, adicionar algunas gotas de la solución de hidróxido de sodio para eliminar el exceso de yodo y diluir la mezcla con 5 mL de agua. d) Dejar reposar 5 minutos a temperatura ambiente. 3.3.2. Reacción de neutralización de los ácidos carboxílicos (formación de una sal) a) En tres tubos de ensayo que contienen 2 mL de agua y 2 gotas de bromocresol, adicionar: b) En el primero, dos gotas de agua (control). c) En el segundo, dos gotas de ácido acético. d) En el tercero, un cristal de ácido benzoico y solubilizar. e) A cada uno de los tres tubos anteriores, adicionar gota a gota una solución de NaOH 0.5 M hasta el vire del indicador bromocresol. Anotar observaciones. - 60 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 3.3.3. Síntesis de dibenzalacetona. En un matraz erlenmeyer de 125 mL colocar: a) 0.4 g de hidróxido de sodio y disolver con 2 mL de agua destilada. b) 2 mL de alcohol etílico al 95 %. c) Enfriar a 0°C la solución formada sobre un baño de hielo-sal d) Adicionar 0.3 mL de acetona e) Adicionar 0.8 mL de benzaldehído f) Agitar la mezcla de reacción durante 15 minutos, tiempo en el cual se forma un sólido amarillo que posteriormente se convierte en un precipitado floculento. g) Filtrar sobre un embudo Buchner. h) Lavar el sólido resultante con agua fría. i) Recristalizar de alcohol etílico j) Filtrar, secar y determinar el punto de fusión y sacar el rendimiento de la reacción. Nota: Si al recristalizar el producto presenta una coloración rojiza, neutralizar el exceso de hidróxido de sodio con una solución de ácido clorhídrico al 50 % hasta obtener un pH de 78. 3.4. Instrucciones particulares a) El material de vidrio que se utiliza en cada prueba, debe estar perfectamente limpio para evitar interferencia de contaminantes que lleven a una falsa interpretación. b) No oler directamente ningún reactivo ni mezcla de reacción y evitar el contacto de los reactivos con la piel, particularmente tener especial cuidado con la 2,4dinitrofenilhidrazina porque es cancerígena y los ácidos carboxílicos son corrosivos. c) En la reacción de Tollens, el reactivo de hidróxido de plata amoniacal, debe prepararse justo en el momento de usarse. Una solución en reposo de éste compuesto puede descomponerse y depositar un precipitado explosivo de nitruro de plata (Ag3N). Para asegurar la eliminación total de trazas de este reactivo, adicionar al término de la prueba ácido nítrico concentrado a los tubos de ensayo y colocar esta solución en un frasco de desecho. - 61 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 4. RESULTADOS Y DISCUSIÓN 4.1. Resumir las observaciones de cada prueba en las tablas siguientes: 4.1.1 Reacción con la 2,4-dinitrofenilhidrazina Compuesto Observaciones Glucosa Benzaldehído Acetona 4.1.2 Diga que tipo de compuestos caracteriza esta prueba y cuales son sus limitantes: 4.1.2 Reacción de Tollens Compuesto Observaciones Benzaldehído Acetona 4.1.3 Diga que tipo de compuestos caracteriza esta prueba y cuales son sus limitantes 4.1.3 Reacción con permanganato de potasio Compuesto Observaciones Benzaldehído Acetona 4.1.4 Diga que tipo de compuestos caracteriza esta prueba y cuales son sus limitantes 4.1.4 Reacción de Fehling Compuesto Observaciones Glucosa Acetona 62 Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 4.1.5 Diga que tipo de compuestos caracteriza esta prueba y cuales son sus limitantes 4.1.5 Reacción del haloformo Compuesto Observaciones Benzaldehído Acetona 4.1.6 Diga que tipo de compuestos caracteriza esta prueba y cuales son sus limitantes 4.1.6 Reacción de ácidos carboxílicos con NaOH Compuesto Observaciones Control Ácido acético Ácido benzoico 4.1.7 Diga que tipo de compuestos caracteriza esta prueba y cuales son sus limitantes 4.2. Reportar el punto de fusión del compuesto sintetizado y compararlo con el de la literatura. 4.3. Anexar copia de los espectros infrarrojos reportados en la literatura para un aldehído y una cetona, (se discutirá al final del curso). 5. CONCLUSIONES El alumno concluirá si los objetivos se cumplieron 6. CUESTIONARIO 6.1. Escriba las ecuaciones de las reacciones químicas que tienen lugar en cada experimento. 5.2. Explicar: a) ¿a que se debe la reactividad del grupo carbonilo? b) ¿que tipo de reacciones pueden presentar? 63 Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 5.3 Investigar en que tipo de compuestos de origen natural se encuentran presentes el grupo aldehído y cetona. 7. BIBLIOGRAFÍA 7.1. Mayo, D. W. and P. Ke, R. M. Microscale Organic Laboratory. Jhon Wiley and Sons, 1977. 7.2.Wilcox, C. F. Experimental Organic Chemistry. A Small-Scale Approach. Ed. Mc. Millan, 1978. 7.3.Pavia, D. L., Lampan, G. M., Kriz, S. G. Introduction to Organic Laboratory Technique. W. B. Saunders Company. London, 1976. 7.4. Voguel, A. I. A Text book of Practical Organic Chemistry. Ed. Longmans, London, 1982. 7.5. Pasto, D., Jonson, C. R., Determinación de Estructuras Orgánicas. Ed. Reverté, S. A. México, 1974. 8. BIBLIOGRAFIA ADICIONAL 64 Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez PRÁCTICA No. 7 ACIDOS CARBOXILICOS-SINTESIS DEL ÁCIDO ACETILSALICÍLICO 1. OBJETIVOS Que el alumno: 1.1 Sintetice ácido acetilsalicílico (un analgésico) mediante reacción del ácido salicílico y anhídrido acético en un proceso no contaminante. 1.2 Analice la pureza de los principios activos obtenidos mediante las técnicas: purificación por cromatografía y punto de fusión. 1.3 Identifique la formación del ácido acetilsalicílico mediante la técnica espectroscópica de IR y RMN 1.4 Analice mediante comparación las dos metodologías de síntesis y concluya. 2. INTRODUCCIÓN El ácido acetilsalicílico se utiliza ampliamente como analgésico, para mitigar el dolor, y como antipirético, para bajar la fiebre. Mejor conocido como aspirina, también reduce la inflamación y aún es capaz de prevenir ataques cardiacos. No obstante que para algunas personas presenta efectos secundarios, se le considera lo bastante segura para ser vendida sin prescripción médica. Debido a que es fácil de preparar, la aspirina es uno de los fármacos disponibles menos costosos. Es producida en grandes cantidades. De hecho la industria farmoquímica produce cerca de 200 toneladas de éste farmoquímico cada año. Una tendencia actual dentro de la química es el desarrollo de tecnologías químicas benignas al medio ambiente, que utilicen en forma eficiente las materias primas, de preferencia renovables, eliminando la generación de desechos y evitando el uso de reactivos y disolventes tóxicos y/o peligrosos en la manufactura y aplicación de productos químicos. A esta nueva rama de la química se le ha denominado química verde. En esta práctica se sintetizará la aspirina utilizando anhídrido acético para acetilar el grupo fenólico del denominado ácido salicílico, utilizando un procedimiento libre de disolventes. - 65 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez O O 1) NaOH (TA) O OH + O O O OH 2) HCl + COOH OH O 3. SECCIÓN EXPERIMENTAL. 3.1 Materiales y equipos 3.2 Reactivos 1 Vaso de precipitados de 100 mL Ácido salicílico 0.560 g 1 Pipeta graduada de 10 mL Anhídrido acético 1.2 mL 1 Matraz kitazato c/manguera Acetato de etilo 10 mL 1 Espátula de acero inoxidable Hexano 10 mL 1 Embudo buchner Carbonato de sodio 1g 1 Matraz erlenmeyer de 125 mL Ácido clorhídrico 1:1 en agua 10 mL 1 Agitador de vidrio 1 Papel filtro 1 Mortero con pistilo 1 cromatoplaca 1 Vaso de precipitados de 10 mL 3.3 Procedimiento Experimental 3.3.1 Síntesis de la aspirina En un vaso de precipitados de 100 mL coloque 0.560 g (4 mmol) de ácido salicílico y 1.2 mL (1.3 g, 12.68 mmoles) de anhídrido acético. Con una varilla de vidrio mezcle bien los dos reactivos. Una vez que se obtenga una mezcla homogénea, adicione 4 lentejas de NaOH (o KOH) previamente molidas y agite nuevamente la mezcla con la varilla de vidrio por 10 minutos. Adicione lentamente 6 mL de agua destilada y posteriormente una solución de ácido clorhídrico 1:1 gota a agota, hasta que el pH de la solución sea de 3. La mezcla se deja enfriar en un baño de hielo. El producto crudo se aísla por medio de una filtración al vacío. Los cristales del ácido acetilsalicílico se bajan con agua bien fría (el ácido acetil salicílico se redisuelve en agua tibia). Purifique el producto crudo por medio de una recristalización con 9 - 66 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez mL de una mezcla de acetato de etilo:hexano (6:4). Aisle los cristales por medio de una filtración al vacío. Determine el rendimiento y el punto de fusión. 4. RESULTADOS Y DISCUSIÓN 4.1 Escriba el mecanismo para la transformación del ácido salicílico en el ácido acetilsalicílico. 4.2 Indique la función de cada una de las sustancias utilizadas en la síntesis. 4.3 Calcule el rendimiento con base en el ácido ácido salicílico 4.4 Dibuje la cromatoplaca, indicando los valores de Rf para el ácido salicílico y el ácido acetilsalicílico. 4.5 Obtenga sus conclusiones acerca de la pureza del producto obtenido, así como de la idoneidad del método de síntesis, con base en el punto de fusión (comparado con el punto de fusión reportado para el producto puro), el análisis del cromatrograma y el rendimiento obtenido. 4.6 Asigne las principales bandas de adsorción de los espectros de IR para el ácido salicílico y la aspirina. OH COOH MeO O O COOH - 67 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 5. CONCLUSIONES El alumno en base al trabajo experimental, concluirá si los objetivos de la práctica se alcanzaron en base a los resultados obtenidos. 6. CUESTIONARIO 6.1 Investigue las diferencias entre el los alcoholes y los fenoles. 6.2 Investigue si es posible obtener la aspirina a partir de ácido salicílico por reacción con cloruro de acetilo. 6.3 ¿Qué prueba química utilizaría para diferenciar entre el ácido salicílico y la aspirina? Explique su respuesta.. 6.4 ¿Cómo se identifica por IR la presencia de un éster? Explique. 7. BIBLIOGRAFÍA. 7.1 Fessenden, R.J. y Fessenden. J. S., Química Orgánica, Ed. Interamericana (1983). 7.2 Solomons. T. W. G., Química Orgánica, Ed. Limusa, (1983). 7.3 Wingrove, A. S. y Caret, R. L., Química Orgánica, Harla, (1984).6.4. Hart, H. and Schuetz, R. D., Organic Chemistry, Hounghton Mifflin Company (1986). 7.4 Shriner, R. L., Fuson, R.C., and Curtin, D., Systematic Identification of Organic Compounds, John Wiley and Sons, (1964). 7.5 Wilcox, C. F., Experimental Oraganic Chemistry, A Small Scale Aproach., Mc. Millan Jr. (1988). 7.6 Wilcox, C.F., Experimental Organic Chemistry. A Small Scale Aproach, M. Millan Jr. (1983). 7.7 Vogel, A.I., Elementary PRÁCTICAL Organic Chemistry part I. Small Scale Preparations, Longmono (1978). 7.8 Pine, S. H. Hendrickson, J. B. Craw, D. J. y Hammond, G. S., Química Orgánica, Ed. Mc. Graw Hill (1985). 7.9 Curzons, A.D.; Constable, D.J.C.; Mortimer, D.N; and Cunningham, V.L.; Green Chemistry, 2001, 3, 1-6. 8. BIBLIOGRAFIA ADICIONAL - 68 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez PRACTICA No. 8 IDENTIFICACIÓN Y REACTIVIDAD DE AMINAS 1.- OBJETIVOS. Que el alumno 1.1. Identificar los tipos de aminas alifáticas mediante reacciones químicas àcido-base. 1.2. Identificar aminas aromáticas mediante reacción con ácido nitroso. 1.3. Sintetizar acetanilida mediante reacción de anhídrido acético y anilina. 2.- INTRODUCCION. Las aminas son sustancias moderadamente polares; poseen puntos de ebullición mayores que los compuestos no polares, pero menores que los alcoholes o ácidos carboxílicos de peso molecular comparable. Las aminas primarias y secundarias forman enlaces de hidrógenos fuertes entre si y con el agua. Las aminas terciarias no forman enlaces de hidrógenos entre ellas, pero si lo hacen con moléculas de agua u otros disolventes próticos. R H R H N H H N H R O R H H N H H N H H N R H O H H N H H Puentes de hidrógeno entre si R Puentes de hidrógeno con el agua Las aminas son menos básicas que los iones hidróxido o etóxido, pero más básicas que los alcoholes, éteres y esteres, por la misma razón que el amoniaco es más básico que el agua, por lo tanto forma soluciones acuosas ligeramente alcalinas por formación del hidróxido de amonio. Acido 2 Base 2 _ + NH4(H2O) + OH (H2O) Base 1 Acido 1 NH3 + H2O Base 1 Acido 2 + N H Acido 1 Base 2 O O H H H Solución Alcalina N H H H H H Conjugados H Conjugados - 69 - _ Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez a)Aminas Alifáticas Una amina alifática es más básica que el amoniaco, porque los grupos alquilo donan densidad electrónica hacia el nitrógeno (efecto inductivo), dejando así mas disponible al par de electrones libres para ser compartido con un ácido. Por otro lado, cuando las aminas se convierten en su correspondiente ión amonio, los grupos alquilo liberadores de electrones tienden a dispersar la carga positiva, estabilizándola, del mismo modo que es estabilizado un carbocatión. Las diferencias en basicidad entre aminas alifáticas primarias < secundarias > terciarias se deben a una combinación de efectos inductivos (favorece) y estéricos (desfavorece). Aminas alifáticas N N R R H H Primaria a) H N R R Secundaria R R Terciaria Aminas Aromáticas Las aminas aromáticas son menos básicas que las aminas alifáticas debido a que el par de electrones del nitrógeno se encuentra comprometido parcialmente por resonancia con el anillo aromático, por lo que está menos disponible para ser compartido con un ión hidrógeno. Los sustituyentes (G) en la parte aromática tienen un efecto determinante en la basicidad, es decir sustituyentes electrodonadores ( electroatractores ( ) la incrementan, de lo contrario, sustituyentes ) la disminuyen. En la medida en que el grupo G sea mas electroatractor de densidad electrónica, la amina será menos básica, sin embargo, los hidrógenos serán más ácidos. G N H H Estas aminas se asemejan en muchas reacciones a las aminas alifáticas, pero difieren en el comportamiento químico con respecto al ácido nitroso. - 70 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez b) Aminas Heterocíclicas Un tipo de amina muy importante es aquel donde el nitrógeno forma parte de un anillo. Estas aminas heterocíclicas pueden ser saturadas o no, alifáticas o aromáticas. En algunos casos, el par de electrones del nitrógeno está en conjugación con los electrones π del anillo, lo que lo hace aromático y el nitrógeno pierde su bacicidad, haciendo a su hidrógeno más ácido como el pirrol, imidazol e indol. H N N N N Piperidina H H H H H Pirrolidina N N N imidazol Pirrol Aromáticos (6 e π) Piperazina N N Piridina N N Pirimidina Indol H N Quinolina d) Basicidad de aminas La manera más conveniente de medir la basicidad de una amina, consiste en considerar la acidez (pKa) de la sal de amonio correspondiente. Puesto que una amina muy básica retiene con fuerza a un protón, su ión amonio correspondiente es relativamente poco ácido (pKa alto). Por el contrario, una amina débilmente básica retiene a un protón con menos fuerza, y por tanto su ión amonio correspondiente es relativamente más ácido (pKa bajo). Las aminas pueden separarse de compuestos no básicos por su solubilidad en ácidos; una vez separados puede regenerarse alcalinizando la solución acuosa. - 71 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez e) Aminas naturales Las aminas se encuentran ampliamente distribuidas en la naturaleza, tanto en plantas como en animales y muchas de ellas tienen actividad biológica. Por ejemplo, la trimetilamina se halla en los tejidos animales y es en parte la causa del olor característico de muchos peces; la epinefrina (adrenalina) y la norepinefrina son catecolaminas y se conocen como aminas SIMPATOMIMETICAS, debido a que, en cierta medida, imitan la acción fisiológica de la ADRENALINA, como neurotransmisores en el sistema nervioso. OH OH N HO N HO H H CH3 H HO HO NOREPINEFRINA EPINEFRINA (ADRENALINA) Las aminas naturales de origen vegetal alguna vez fueron conocidas como “álcalis vegetales”, ya que sus soluciones acuosas son básicas, pero ahora se les conoce como alcaloides. Por ejemplo, la quinina es un antipalúdico importante aislado de la corteza del árbol sudamericano Cinchona; La cafeína es una sustancia aislada del café que se usa como estimulante del sistema nervioso central; la morfina fue el primer alcaloide puro aislado del opio (zumo de la adormidera) y se ha utilizado para aliviar el dolor; la heroína es un derivado de la morfina y se obtiene por síntesis química por diacetilación de la morfina. HO OCH3 O H OH H3C N N N N O CH3 Qinina (antipalúdico) Cafeína O O H N O CH3 N H N CH3 HO H Morfina (analgésico) O O H O H H N CH3 Heroína f) Reactividad de las aminas La química de las aminas está dominada por el par de electrones no compartido del nitrógeno. Debido a este par, las aminas son básicas y nucleófilas. Reaccionan con: - 72 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez a) ácidos de Bronsted para formar sales de amonio b) ácidos de Lewis (cationes metálicos) para formar compuestos de coordinación. c) halogenuros de alquilo para formar alquilaminas d) cloruros o anhídridos de ácidos carboxílicos] para formar amidas (acilamidas) Una reacción característica de las aminas aromáticas es con ácido nitroso para la formación de sales de diazonio, azocompuestos que son base de los colorantes orgánicos. - 73 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez e) Identificación de aminas Es posible identificar a las aminas primarias y secundarias de las terciarias por la preparación de derivados sólidos que tienen puntos de fusión conocidos. Por ejemplo, los derivados acetilados, que se obtienen rápidamente por la reacción con anhídrido acético, cloruro de benzoilo o cloruro de bencen sulfónilo. La caracterización de aminas terciarias es posible mediante la formación de sus correspondientes picratos de amonio y metilyoduros que son también derivados sólidos de puntos de fusión característicos. En el caso particular de aminas primarias aromáticas, es posible diferenciarlas por su reacción con el ácido nitroso para formar sales de diazonio, clase de compuestos que se caracterizan por su gran versatilidad en la síntesis de colorantes. 3. SECCION EXPERIMENTAL. 3.1. Material y equipo 10 tubos de ensaye 3 pipetas graduadas de 5 mL 1 refrigerante 1 termómetro 1 Balanza analítica 2 pinzas univerzales 1 embudo de filtración 1 soporte universal 1 barra magnética 1 parrilla de calentamiento 1 baño maría 1 bomba de recirculación H2O 2 vasos de precipitados de 50 ml 2vasos de precipitados de 200 ml 2 matraces erlenmeyer de 100ml 1 matraz erlenemyer de 100 ml 1 balanza granataria 1 determinador de puntos de fusión . 3.2. REACTIVOS Solución acuosa de HCl al 10% Anilina Solución acuosa de NaOH al 10% Trietilamina Solución acuosa de NaOH 3N o-toluidina Solución acuosa de nitrito de sodio al 20% β-naftol Acetato de sodio trihidratado agua destilada Ácido acetico Anhídrido acetico - 74 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez Ácico acetico glacial dietilamina 3.3. Reacciones de aminas 3.3.1. Basicidad Colocar en diferentes tubos de ensayo unas 3 gotas de las siguientes aminas: otoluidina, anilina, etilamina, dietilamina y trietilamina. A cada uno de los tubos: 1) Adicionar 1m de agua, agitar y tomar el valor del pH. 2) Calentar ligeramente la mezcla y observar la solubilidad del compuesto. 3) Agregar ácido clorhídrico al 10 % hasta disolver (calentar si es necesario). 4) Finalmente, adicionar unas gotas de solución de hidróxido de sodio al 10% hasta que se formen dos fases. 5) Anotar las observaciones de los pasos 1) al 4). 3.3.2. Reacción con ácido nitroso. 1) Preparación de la solución 1. a) En un vaso de precipitados de 50 mL disolver 0.1 g de β-naftol en 6.3 mL de hidróxido de sodio 3N. b) Enfriar la solución a una temperatura entre 0 - 5 °C. 2) Preparación de la solución 2. a) En un segundo vaso de precipitados de 50 mL colocar 1.0 mL de anilina, 3.0 mL de ácido clorhídrico concentrado y 5.0 mL de agua. b) Enfriar la mezcla en un baño de hielo-sal hasta una temperatura entre 0 - 5 °C. c) Adicionar a esta solución fría, 5.0 mL de solución acuosa fría y recientemente preparada de nitrito de sodio al 20%. d) Agitar vigorosamente y mantener la temperatura entre 0 – 5 °C, anotar observaciones. - 75 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 3) Adicionar lentamente y con agitación la solución 2 a la solución 1, dejar reposar el producto en el baño de hielo durante 15 minutos, y anotar sus observacio nes. 3.3.3. Síntesis de acetanilida. En un matraz balón de 100 mL: a) Adicionar 3.0 mL de ácido acético glacial b) Disolver 1.4 mL de anilina c) Adicionar 1.8 mL de anhídrido acético. d) Colocarle un refrigerante y la mezcla de reacción se calienta a reflujo en un baño maría durante 15 minutos. e) Enfriar el matraz a temperatura ambiente f) Adicionar con precaución por la parte superior del refrigerante1.0 mL de agua destilada (para hidrolizar el exceso de anhídrido acético o cualquier derivado bisacetilado) g) Calentar a reflujo durante 5.0 minutos y enfriar h) Verter con agitación la mezcla de reacción a un vaso de precipitados que contenga 7.08.0 mL de agua fría. i) Dejar reposar 15 minutos con agitación ocasional. j) Filtrar los cristales y lavarlos con un poco de agua fría. k) Dejar secar, pesar y determinar su punto de fusión 76 Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 3.4. Instrucciones particulares 3.4.1 Las aminas son tóxicas al contacto con la piel 3.4.2 Realice cada reacción para los tres tipos de aminas. 4. RESULTADOS Y DISCUSIÓN 4.1. Reportar las diferencias en la solubilidad de las aminas cuando se encuentran en medio ácido y básico. 4.2. Reportar las diferencias observadas para las aminas primarias, secundarias y terciarias al formar derivados sólidos y acetilados. 4.3. Anexar copias de los espectros infrarrojos reportados en la literatura de una amina primaria, secundaria y terciaria, así como una amina aromática (se analizarán al final del curso) 4.4. Calcular el rendimiento de la acetanilida 5. CONCLUSIONES Los integrantes de equipo, analizaran su información práctica con la teoría y concluirán sobre el resultado de su practica. 6. CUESTIONARIO. 5.1. Escribir las reacciones que tienen lugar en cada experimento. Basicidad. Reacción con ácido nitroso. 5.2. ¿Cómo podría distinguir fácilmente entre muestras de β-naftilamina y acetanilida? 5.3. ¿Se puede concluir que una sustancia es una amina terciaria porque forma un picráto?, Explique. 5.4. ¿como podría preparar anilina a partir de clorhidrato de anilina?. Escriba la reacción. 5.5. ¿Qué derivado prepararía para distinguir entre 4-metil anilina y metilanilina?. Escriba la reacción. - 77 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 7. BIBLIOGRAFÍA 7.1. Wingrove, S. A. y Carret, R. L. Química Orgánica, Ed. Harla, 1981. 7.2. Gould, E. S., Mechanism and Structure in Organic Chemistry, Ed. Holt Rinehart. 7.3. Wilcox, C. F., Experimental Organic Chemistry a Small-Scale Approach. MacMillan Publishing Company, 1988. 7.4. Fessenden R. J. Fessenden J. S., Química Orgánica, Ed. Iberoamericana, 1989. 7.5. March, J., Advanced Organic Chemistry, 5ª Edition, Ed. Wiley, 1988. 8. BIBLIOGRAFIA ADICIONAL. - 78 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez PRÁCTICA No. 9 OBTENCIÓN DE BENZOCAÍNA I 1. OBJETIVOS Que el alumno: 1.1 Sintetice ésteres mediante dos metodologías diferentes. 1.2 Sintetice benzocaína (un anestésico local) mediante reacción del ácido paminobenzoico con etanol en medio ácido. 1.3 Analice la pureza de los principios activos obtenidos mediante las técnicas: purificación por cromatografía y punto de fusión. la benzocaína mediante la técnica espectoscópica de IR. 1.4 Analice mediante comparación las dos metodologías de síntesis y concluya. 2. INTRODUCCIÓN Los fundamentos en cuanto a la reactividad de los ácidos carboxílicos se han planteado en la práctica anterior. En esta práctica se realizan dos procedimientos diferentes para esterificar. La síntesis de la benzocaína implica la esterificación de un ácido carboxílico con etanol en medio ácido. La síntesis de la benzocaina a partir de la p-Toluidina involucra cuatro reacciones, la primera consiste en transformar al grupo amino en la amida correspondiente, para protegerlo. El producto resultante se trata con KMnO4 para oxidar al metilo al ácido benzóico. En una tercera reacción, se desprotege al grupo amino mediante la hidrólisis de la amida, para generar al ácido p-amino benzoico (PABA), en cual finalmente es esterificado para dar como producto final el anestésico local benzocaina. A continuación se describen las distintas reacciones para la obtención de la benzocaina a partir de la p-toluidina. - 79 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez Formación de la amida. Esta reacción implica la conversión de la comercialmente disponible p-Toluidina es su correspondiente amida, la N-acetil-p-toluidina. El procedimiento empleado para la preparación de esta amida, es el tratamiento de la ptoluidina con anhídrido acético. La razón por la cual de realiza la acetilación es para proteger algrupo amino (-NH2) frente a la oxidación con KMnO4 que es el siguiente paso, de no ser protegido el grupo amino este se oxidaría hasta el grupo nitro (-NO2). En esta reacción se utiliza un grupo protector, este grupo protector es el grupo acilo. Un grupo protector es un grupo funcional que adherido durante una serie de reacciones protege una posición ó un grupo funcional de una molécula, un buen grupo protector es aquel que es fácilmente adherido al sustrato de la molécula y que es fácilmente extraído de la misma, una vez que halla cumplido su papel de protector. O H NH2 O O + O + O CH3 p-toluidina N OH CH3 anhídrido acético N-acetil-p-toluidina ácido acético Como resultado la amida formada es de gran estabilidad para las siguientes reacciones y el grupo metilo puede ser oxidado en el siguiente paso sin destruir la función del grupo amino durante el proceso. Oxidación con permanganato de potasio. En esta reacción de lleva a cabo la oxidación del grupo metilo al correspondiente grupo carboxílico, empleando para ello un agente oxidante fuerte, el KMnO4. Durante la oxidación, la solución de color violeta del ión permanganato se convierte en una precipitado de color marrón que es el dióxido de manganeso (MnO2), esto es porque durante el proceso de oxidación el ión Mn(VII) es reducido al ión Mn(IV). - 80 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez O H O H N N 1) OH- + + 2 KMnO4 2) H3O+ CH3 2 MnO2 COOH ácido-p-acetamidobenzóico N-acetil-p-toluidina Hidrólisis de la amida. En este procedimiento se hidroliza el grupo funcional amida, es decir, es retirado el grupo protector acilo, obteniéndose así el ácido p-Amino benzoico (PABA). El producto puede ser recristalizado en ácido acético diluido. O H N NH2 H3O+ COOH COOH ácido-p-acetamidobenzóico ácido p-aminobenzóico Esterificación. Finalmente, la benzocaina se prepara por la esterificación directa del ácido p-amino benzoico, empleando para ello etanol y H2SO4 concentrado. NH2 NH3 + 1) H3O+ OH 2) Na2CO3 COOH ácido p-aminobenzóico O O p-aminobenzoato de etilo - 81 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 3. SECCIÓN EXPERIMENTAL. 3.1 Materiales y equipos 3.2 Reactivos 1 Matraz bola de 50 mL juntas 19/23 0.560 g Ácido p-aminobenzóico 500 mg 1 Refrigerante 19/23 1.2 mL Alcohol etílico al 96% 50 mL 1 Baño de hielo 10 mL H2SO4 concentrado 0.5 mL 1 Parrilla con calentamiento 10 mL NaHCO3 1g 2 Pinzas de tres dedos con nuez 1g Acetato de etilo 10 mL 1 Soporte universal 10 mL Hexano 10 mL Papel pH 1 Papel filtro 1 Vaso de precipitados de 100 mL 1 Cromatoplaca 1 Vidrio de reloj de 5 cm 1 Bomba de vacío 3.3 SECCION EXPERIMENTAL 3.3.1 Síntesis de la benzocaína parte 1 En un matraz balón de 50 mL, coloque 500 mg del ácido p-aminobenzoico y adicione 10 mL de etanol al 95 %, enfríe la solución en un baño de hielo para luego adicionar 0.5 mL de H2SO4 concentrado, someta la mezcla a reflujo por 2 horas. Una vez transcurrido el tiempo del reflujo, la disolución se transfiere a un vaso de precipitados de 100 mL, el matraz se enjuaga con 5 mL de agua destilada y se transfiere el contenido al vaso de precipitados. Enfríe la solución en un baño de hielo-agua y añada poco a poco y con agitación NaHCO3 en forma sólida hasta que la solución deje de efervecer (pH = 9). Induzca a la cristalización por enfriamiento y filtre. El sólido resultante se recristaliza de una mezcla de etanol-agua y se determina su punto de fusión. Haga una cromatoplaca comparativa con el PABA, utilizando como eluyente una mezcla de hexano:acetato de etilo 4:6. Reporte los Rf de cada una. - 82 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 4. RESULTADOS Y DISCUSION 4.1. Escriba el mecanismo para la transformación del ácido p-aminobenzóico en el paminobenzoato de etilo. 4.2. Indique la función de cada una de las sustancias utilizadas en la síntesis. 4.3. Calcule el rendimiento con base en el ácido p-aminobenzóico. 4.4. Dibuje la cromatoplaca, indicando los valores de Rf para el PABA y la benzocaína cada sustancia. 4. CONCLUSIONES El alumno concluirá sobre los objetivos alcanzados en esta práctica 5. CUESTIONARIO 6.1 Calcule el rendimiento de la reacción para la obtención de la benzocaina 6.1 Reporte todas las propiedades fisicoquimicas de la benzocaina 7. BIBLIOGRAFIA 7.1 Fessenden, R.J. y Fessenden. J. S., Química Orgánica, Ed. Interamericana (1983). 7.2 Solomons. T. W. G., Química Orgánica, Ed. Limusa, (1983). 7.3 Wingrove, A. S. y Caret, R. L., Química Orgánica, Harla, (1984).6.4. Hart, H. and Schuetz, R. D., Organic Chemistry, Hounghton Mifflin Company (1986). 7.4 Shriner, R. L., Fuson, R.C., and Curtin, D., Systematic Identification of Organic Compounds, John Wiley and Sons, (1964). 7.5 Wilcox, C. F., Experimental Oraganic Chemistry, A Small Scale Aproach., Mc. Millan Jr. (1988). 7.6 Wilcox, C.F., Experimental Organic Chemistry. A Small Scale Aproach, M. Millan Jr. (1983). 8. BIBLIOGRAFIA ADICIONAL - 83 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez PRÁCTICA No 10 OBTENCIÓN DE BENZOCAÍNA II 1. OBJETIVOS Que el alumno: 1.5 Purifique y mida las propiedades fisicoquímicas de la benzocaina. 1.6 Analice la pureza de los principios activos obtenidos mediante las técnicas: purificación por cromatografía y punto de fusión. la benzocaína mediante la técnica espectoscópica de IR y RMN. . 2. INTRODUCCIÓN La benzocaína o p-aminobenzoato de etilo es el éster etílico del ácido p-aminobenzoico (PABA). Es un anestésico local, empleado como calmante del dolor. Actúa bloqueando la conducción de los impulsos nerviosos al disminuir la permeabilidad de la membrana neuronal a los iones sodio. La benzocaína es hidrolizada por las colinesterasas plasmáticas y, en un grado mucho menor, por las colinesterasas hepáticas, a metabolitos que contienen PABA. Se elimina principalmente por metabolismo, seguido de la excreción renal de los metabolitos. Está habitualmente indicada para la anestesia local previa de un examen, endoscopia o manipulación con instrumentos u otras exploraciones de esófago, laringe, intervenciones dentales y cirugía oral. Además, es incorporada a algunos preservativos masculinos (condones) con el objetivo de retardar la eyaculación debido a que reduce la sensibildad del glande, aunque también puede llegar a dificultar la erección y posteriormente la eyaculación. Además de los fármacos diseñados con la ayuda de métodos computacionales se ha determinado la estructura tridimensional de diversos fármacos en uso clínico, obtenidos o diseñados por otros métodos, y de sus respectivos blancos moleculares. Algunos ejemplos son la aspirina unida a la enzima cycloooxigenasa I (aunque se sabe que también se une a la cycloooxigenasa II; de ahí sus efectos secundarios de irritación del estómago, gastritis y - 84 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez daño renal), el imatinib (Gleevec®) empleado en el tratamiento de ciertos tipos de enfermedades malignas (específicamente la leucemia mieloide crónica y los tumores del estroma gastrointestinal) y la atorvastatina (Lipitor®), usada en el tratamiento de la hiperlipidemia. Esta información está siendo de gran utilidad para el diseño de nuevos fármacos. La Resonancia Magnetica Nuclear es importante para determinar las poibles estructuras de los fármacos, asi como las interacciones intermoleculares entre fármaco y receptor. 3. SECCIÓN EXPERIMENTAL. 3.1 Materiales y equipos 3.2 Reactivos 1 Baño de hielo 0.560 g Ácido p-aminobenzóico 500 mg 1 Parrilla con calentamiento 1.2 mL Alcohol etílico al 96% 50 mL 2 Pinzas de tres dedos con nuez 10 mL H2SO4 concentrado 0.5 mL 1 Soporte universal 10 mL NaHCO3 1g 1g Acetato de etilo 10 mL 10 mL Hexano 10 mL Papel pH 1 Papel filtro 1 Vaso de precipitados de 100 mL 1 Cromatoplaca 1 Vidrio de reloj de 5 cm 1 Bomba de vacío 1 equipo de RMN 1 1 Equipo de IR 3.1 Síntesis de la benzocaína parte 2. Una vez transcurrido el tiempo del reflujo, la disolución se transfiere a un vaso de precipitados de 100 mL, el matraz se enjuaga con 5 mL de agua destilada y se transfiere el contenido al vaso de precipitados. Enfríe la solución en un baño de hielo-agua y añada poco a poco y con agitación NaHCO3 en forma sólida hasta que la solución deje de efervecer (pH = 9). Induzca a la cristalización por enfriamiento y filtre. El sólido resultante se recristaliza de una mezcla de etanol-agua y se determina su punto de fusión. Haga una cromatoplaca - 85 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez comparativa con el PABA, utilizando como eluyente una mezcla de hexano:acetato de etilo 4:6. Reporte los Rf de cada una. Al polvo seco se toma un espectro de IR en KBr y un espectro de RMN para comprobar el producto obtenido. 4. RESULTADOS Y DISCUSIÓN 4.1 Síntesis de la benzocaína 4.1.1 Obtenga sus conclusiones acerca de la pureza del producto obtenido, así como de la idoneidad del método de síntesis, con base en el punto de fusión (comparado con el punto de fusión reportado para el producto puro), el análisis del cromatrograma y el rendimiento obtenido. 4.1.2 Asigne las principales bandas de adsorción de los espectros de IR para el PABA y la benzocaína. 5. CONCLUSIONES El alumno concluirá sobre el desarrollo de la práctica, si se alcanzaron los objetivos y metas iniciales. 6. CUESTIONARIO 6.1 Asigne las principales bandas de adsorción de los espectros de IR para el PABA y la benzocaína , figuras a y b Figura a - 86 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez Figura b 6.2 Asigne los espectros de RMN de 1H y 13C figuras c y d. Figura c Figura d Figura d - 87 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 7. BIBLIOGRAFÍA. 7.7 Fessenden, R.J. y Fessenden. J. S., Química Orgánica, Ed. Interamericana (1983). 7.8 Solomons. T. W. G., Química Orgánica, Ed. Limusa, (1983). 7.9 Wingrove, A. S. y Caret, R. L., Química Orgánica, Harla, (1984).6.4. Hart, H. and Schuetz, R. D., Organic Chemistry, Hounghton Mifflin Company (1986). 7.10 Shriner, R. L., Fuson, R.C., and Curtin, D., Systematic Identification of Organic Compounds, John Wiley and Sons, (1964). 7.11 Wilcox, C. F., Experimental Oraganic Chemistry, A Small Scale Aproach., Mc. Millan Jr. (1988). 7.12 Wilcox, C.F., Experimental Organic Chemistry. A Small Scale Aproach, M. Millan Jr. (1983). 8. BIBLIOGRAFIA ADICIONAL - 88 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez PRÁCTICA No. 11 REACCIONESDE IDENTIFICACIÓN DE AMINOÁCIDOS Y PROTEÍNAS 1. OBJETIVOS Que el alumno: 1.1 Identifique los aminoácidos mediante el ensayo de ninhidrina y otras pruebas colorimétricas. 1.2 Precipite las proteínas mediante diversos procedimientos fisicoquímicos. 1.3 Identifique cualitativamente la presencia de proteínas mediante la reacción del biuret. 1.4 Cuantifique la cantidad de proteínas como SAB (seroalbúmina bobina) presente en una muestra mediante el uso del método de Folin-Lowry. 2. INTRODUCCIÓN Estructura y clasificación de los aminoácidos. Como su nombre indica los aminoácidos son compuestos que poseen un grupo amino (-NH2) y un grupo ácido carboxílico (-COOH) en su estructura. Los aminoácidos son los precursores de los péptidos y de las proteínas, y en ellos el grupo amino y el grupo carboxilo, se encuentran unidos al mismo átomo de carbono, conocido como carbono-α (α-aminoácidos). La estructura general de los α-aminoácidos (a excepción de la prolina, que es cíclica) se muestra en la Figura. - 89 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez Como se puede apreciar, el carbono-α (a excepción de la glicina) es un carbono quiral y como tal presentan dos enantiómeros (l- y d-). Los 20 α-aminoácidos presentes en las proteínas son de la serie L- y en su representación de Fischer poseen el grupo amino hacia la izquierda. La diferencia entre los aminoácidos viene dada por el resto -R, o cadena lateral, unida al carbono-α. Atendiendo a la naturaleza del grupo -R los α-aminoácidos pueden clasificarse en: Neutros o apolares Polares sin carga Polares con carga negativa Polares con carga positiva Neutros o Apolares. Son 8 los aminoácidos que se clasifican como poseedores de cadenas laterales no polares. La alanina, valina, leucina e isoleucina, poseen cadenas laterales de hidrocarburos alifáticos. La metionina posee una cadena lateral de éter tiólico (C-S-C). La prolina es el único aminoácido cíclico, pues el grupo -R se cierra sobre el N del grupo α-amino (realmente es un amina secundaria). Por su parte, la fenilalanina y el triptófano contienen grupos aromáticos. Polares sin carga. Siete son los α-aminoácidos cuyo resto -R es polar pero sin carga. La glicina posee la cadena más simple, un átomo de hidrógeno. La serina y la treonina son portadores de un grupo hidroxilo (-OH). La asparragina y la glutamina, poseen cadenas laterales portadoras de un grupo amida, y por hidrólisis dan lugar, respectivamente, a aspartato y glutamato, dos aminoácidos con carga negativa. La tirosina posee un grupo fenólico y la cisteína debe su polaridad a la presencia de un grupo tiólico (SH). Polares con carga negativa. Existen dos α-aminoácidos cuyo resto polar posee carga negativa a pH fisiológico, debida a la presencia de un grupo carboxilo (-COOH) , el ácido glutámico y el ácido aspártico. Polares con carga positiva. Tres son los α-aminoácidos que poseen restos -R cargados positivamente a pH fisiológico. La lisina posee una cadena lateral de butilamonio, - 90 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez la arginina presenta un grupo -R de guanidina y la histidina es portadora de un grupo -R de imidazolio. Dentro del conjunto de los aminoácidos naturales, existen unos que pueden ser sintetizados por las células humanas a partir de otras sustancias, pero también hay aminoácidos que debemos tomarlos en la dieta, ya que nuestras células no pueden sintetizarlos o, cuando menos, no en cantidad suficiente para satisfacer la demanda del organismo; se conocen con el nombre de aminoácidos esenciales y son valina, leucina, isoleucina, treonina, metionina, fenilalanina, triptófano y lisina. Propiedades ácido-base de los aminoácidos y los péptidos El pH del medio en el que se encuentre el aminoácido es esencial para determinar sus propiedades ácido-base, aspecto importante pues de ello dependen las propiedades químicas y la funcionalidad biológica de los péptidos y proteínas que forman. Las propiedades ácido-base de un aminoácido vienen determinadas por los grupos protonables que posea. Un aminoácido puede actuar bien como ácido o como base (sustancias anfóteras), pudiendo tener hasta tres grupos con carácter ácido-base: el αamino, el α-carboxilo y, en algunos casos, el resto -R. Lo importante es que estos grupos poseen un carácter ácido-base débil, lo que hace que, dependiendo del pH, el correspondiente equilibrio pueda desplazarse en un sentido o en otro (hacia la forma protonada o hacia la desprotonada. El enlace peptídico Los aminoácidos se encuentran unidos en los péptidos y las proteínas mediante un enlace amida (-CO-NH-) Este enlace se forma por reacción entre el grupo α- 91 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez COOH de un aminoácido y el α-amino del siguiente (con pérdida de una molécula de agua) y recibe el nombre de enlace peptídico. Entre los años 1930-1940, Pauling y Corey, mediante el estudio de Rayos X de cristales de aminoácidos, dipéptidos y tripétidos, dilucidaron la estructura tridimensional del enlace peptídico. Así, descubrieron que la unión C-N del enlace peptídico era más corta que en la mayor parte de los demás enlaces C-N y llegaron a la conclusión de que el enlace debía tener algún carácter de doble enlace, por la aparición de dos formas resonantes. Luego dedujeron que los 4 átomos que rodeaban al enlace peptídico C-N (O, Cα, Cα, H) estaban situados en el mismo plano, de tal manera que el oxígeno del grupo carbonilo y el hidrógeno del N-H estarían en posición trans. Esta ordenación es rígida, y es el resultado de la estabilización por resonancia de las formas anteriormente citadas. Partiendo de estos dos hechos, puede describirse el armazón de una cadena polipeptídica como constituido por una serie de planos, con posibilidad de giro en los C-α. De esta forma se puede escribir la estructura de un péptido como una sucesión de planos en la que los grupos -R se van alternando. Niveles estructurales de las proteínas La conformación que presenta una proteína va a depender directamente de los distintos niveles estructurales que posee, niveles que a continuación se detallan: a) Estructura primaria. Se refiere a la posición que ocupa cada aminoácido en la cadena polipeptídica, es decir nos da idea de la secuencia de la proteína. La importancia de este - 92 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez nivel radica en que la posición que ocupa cada aminoácido dentro de la cadena va a condicionar enormemente el resto de los niveles estructurales y en último término la función que desempeña la proteína. b) Estructura secundaria. Se refiere a la ordenación regular y periódica de la cadena polipeptídica en una dirección determinada. Básicamente, podemos encontrar dos tipos de estructura secundaria, la hélice-α y la conformación-ß. c) Estructura terciaria. Hace referencia al modo en que se curvan o pliegan en el espacio los segmentos de hélice-α y/o conformación-ß, que presenta una cadena polipeptídica de los proteínas globulares. La conformación espacial de las proteínas depende lógicamente de su estructura primaria, así las cadenas laterales de los aminoácidos en las proteínas globulares se hallan distribuidas espacialmente de acuerdo con sus polaridades. d) Estructura cuaternaria. Muchas proteínas globulares son oligoméricas, es decir están formadas por más de una subunidad polipeptídica. La posición espacial que ocupa cada una de estas subunidades respecto a las otras queda determinada por la estructura cuaternaria. Propiedades fisicoquímicas de las proteínas Las proteínas son coloides y poseen las características propias de estos. Las proteínas son solubles en agua y en disoluciones acuosas de sustancias polares. El proceso de disolución de las proteínas está íntimamente ligado con la hidratación de las macromoléculas, así que cualquier factor que altere esta propiedad, disminuirá la solubilidad de las proteínas en agua y favorecerá la precipitación. La disminución de la hidratación de las partículas se logra fácilmente agregando sustancias deshidratantes como el alcohol, acetona o sales de metales alcalinos, que producen una precipitación reversible, mientras que las sales derivadas de metales pesados producen una precipitación irreversible por la pérdida de la carga eléctrica. Las proteínas son también electrolitos anfóteros esto es que poseen simultáneamente propiedades ácidas y básicas. En disolución, las partículas proteínicas pueden variar su carga de positiva a negativa, dependiendo del pH del medio, pudiendo llegar al punto isoiónico. En consecuencia, los factores principales en la estabilización del estado de agregación de los coloides proteínicos son la hidratación de las partículas y la aparición de la carga eléctrica del mismo signo debido a la disociación de los grupos básicos y ácidos. - 93 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 3. SECCIÓN EXPERIMENTAL 3.1 Materiales y equipos Identificación de aminoácidos 20 Tubos de ensaye de 10 mL Identificación de proteínas 1 Mortero con pistilo 1 Matraz aforado de 250 mL 4 Gasas 1 Matraz aforado de 100 mL 1 Espectrofotómetro a 750 nm 1 Celda para el espectrofotómetro 3.2 Reactivos Preparación de las muestras SAB 10 mg NaOH al 0.5% 30 mL Acido acético al 5% Identificación de aminoácidos Precipitación de proteínas Sol. de ninhidrina al 1% en etanol 2 mL Sol. saturada de (NH4)2SO4 Sol. de glicina al 0.2% en agua 2 mL Sol. de NaOH al 10% Sol. de cisteína al 0.2% en agua 2 mL (NH4)2SO4 cristalino Sol. de leucina al 0.2% en agua 2 mL H2SO4 conc. Sol. de ácido aspártico al 0.2% en agua 2 mL HCl conc. Sol. de fenilalanina al 0.2% en agua 4 mL HNO3 conc. Clara de huevo 1 Etanol absoluto Grenetina 1g acetona - 94 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez Vacuna de toxoide tetánico 1 Etilén glicol Sol. de fenol al 0.1 % en agua 2 mL CuSO4 al 1% en agua Sol de NaOH saturada Sol de NaOH al 10% Sol. de sacarosa al 10% Sol. de acetato de plomo al 0.5% 0.1 mL Determinación cuantitativa de proteínas Albúmina bobina (100 µg/mL) 2.0 mL Solución A (2g de NaOH , 10 g de Na2CO3 y 0.1 g de tartrato de sodio y potasio en 500 mL) Solución B ( 0.5 g de CuSO4-5H2O Reactivo C (mezclar, justo antes disolver y aforar a 100 mL con agua de usar, 100mL de solución A y destilada) 2.0 mL de solución B) Reactivo D (se toman 25 mL del reactivo de Folin (2N) con una pipeta volumétrica y se afora a 50 mL con agua destilada) 3.3. Procedimiento Experimental 3.3.1 Preparación de las muestras. 3.3.1.1 Preparación de la muestra de albúmina de huevo. Se separa una clara de huevo y se le adicionan 100 mL de agua destilada y 75 mL de una disolución saturada de NaCl. Se homogeneiza sin provocar espuma y se filtra a través de varias capas de gasa, se enjuaga la gasa con 20 mL más de agua destilada. La disolución se transfiere a un matraz aforado de 250 ml y se afora con agua destilada. 3.3.1.2 Preparación de la muestra de gelatina. Se prepara una disolución de grenetina comercial al 1% p/v. Se pesan 100 mg de grenetina y se añaden en 50 mL de agua destilada fría, se agita y deja reposar por 10 min. La disolución se calienta a ebullición, se enfría y se afora a 100 mL con agua destilada. - 95 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 3.3.1.3 Preparación de la muestra de vacuna. Se toman 1.0 mL de la vacuna y se diluyen a un volumen de 100 mL con agua destilada. 3.3.2 Reacciones de identificación de aminoácidos. 3.3.2.1 Reacción con ninhidrina. En sendos tubos de ensayo se vierten 2 mL de las disoluciones de glicina, cisteína, leucina, ácido aspártico, fenilalanina, clara de huevo, grenetina y vacuna. A cada tubo se le añaden cinco gotas de la disolución de ninhidrina y se calienta a baño maría hasta la aparición de una coloración violeta. _ O O O H OH + NH2 OH C COOH _ HO O + CO2 RCH R O O ( color púrpura) a-aminoácido O Ninhidrina + N 3.3.2.2 Ensayo xantoproteico (amarillo). Esta reacción es positiva para aminoácidos aromáticos. En diferentes tubos de ensayo se vierten 2 mL de las disoluciones de fenol, fenilalanina, albúmina, clara de huevo, grenetina y vacuna. Se añade 1 mL de HNO3 concentrado (¡cuidado!). Se calienta en baño maría hasta la aparición de un color amarillo. Los tubos con las proteínas y la fenilalanina se dejan enfriar y se neutralizan con una disolución saturada de NaOH (colocar los tubos en el hielo), esto hace que la coloración amarilla se convierta en anaranjada. La base de esta reacción se explica de acuerdo con el esquema siguiente para el fenol: NaO NO2 HO HNO3 HO NaOH -H2O Fenol N O O -H2O Nitrofenol amarillo - 96 - Sal nitroquinoidal anaranjada Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 3.3.2.3 Reacción del triptofano. En diferentes tubos de ensayo se vierte 1 mL de las disoluciones de proteína: albúmina, clara de huevo, grenetina y vacuna. Se les añaden 2 gotas de la disolución de sacarosa y se homogeneiza. En el fondo de cada tubo de ensaye de deja bajar 1 mL de H2SO4 no se agite, se deja reposar y en presencia de triptofano, en la región interfacial aparece una coloración rojo guinda en forma de un anillo. Esta reacción se basa en el hecho de que la sacarosa se hidroliza en medio ácido hasta hidroximetilfurfural que al combinarse con el triptofano forma un complejo de color rojo guinda. HOH2C HO HO O OH O CH2OH O HO Sacarosa HO OH + H CH2OH H H2 C C COOH O + Complejo Rojo-guinda N NH2 H Triptófano CHO Hidroximetilfurfural 3.3.2.4 Reacciones para aminoácidos con azufre. En sendos tubos de ensayo se vierten 2 mL de las disoluciones de glicina, cisteína, albúmina, clara de huevo, y vacuna. A cada tubo se le añaden 0.5 mL de la disolución saturada de NaOH, se calienta a ebullición, después de enfriar se agregan 2 gotas de la disolución de Pb(CH3COO)2. Observe la aparición o no de PbS como un precipitado negro. - 97 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 3.3.3 Reacciones de precipitación de las proteínas. 3.3.3.1 Precipitación con sulfato de amonio. En dos tubos de ensayo se vierte 1 mL de la disolución de clara de huevo. Al primer tubo se le agregan de 1 a 2 mL de la disolución de sulfato de amonio saturada, hasta observar la precipitación de la proteína, en ese momento se detiene la adición y se añade de 1 a 2 mL de agua destilada hasta la desaparición paulatina del precipitado. Al segundo tubo, se le añade 1 mL de la disolución saturada de sulfato de amonio hasta observar la precipitación de las globulinas. Dejar reposar durante 5-10 minutos, las disoluciones se decantan o filtran a otros tubos de ensayo y se les añade (NH4)2SO4 cristalino poco a poco hasta la precipitación de las albúminas. 3.3.3.2 Precipitación con ácido mineral. En tres tubos de ensaye se colocan 1 mL de HCl, H2SO4 y HNO3 concentrados. A cada tubo se le añade 1 mL de la disolución de clara de huevo, resbalando por la pared y sin agitar, de tal manera que se formen dos fases. En la interfase aparece el precipitado en forma de un anillo blanco. Homogeneizar con cuidado y observar si permanece o no el precipitado. 3.3.3.3 Precipitación con disolventes orgánicos. En tres tubos de ensayo se vierte 1 mL de la disolución de clara de huevo y se añade 200 mg de NaCl. Al primer tubo se le añaden 2-3 mL de acetona, al segundo 2-3 mL de etanol y al tercero 2-3 mL de etilénglicol, los tubos se agitan y se dejan en reposo en un baño de hielo-agua. Hacer las observaciones pertinentes después de 5 min. En los tubos donde aparezca un precipitado, decantar y dejar la proteína en el tubo, añadir 2 mL de agua destilada, agitar y observar si la proteína se redisuelve o no. 3.3.4 Reacciones de identificación de proteínas. 3.3.4.1 Reacción de Biuret. En tres tubos de ensaye se vierte 1 mL de las soluciones de proteína: clara de huevo, grenetina y vacuna. En otros cuatro tubos de ensaye se vierte 1 mL de las disoluciones de aminoácidos: glicina, cisteína, leucina, ácido aspártico y fenilalanina. A cada tubo se le añade 1 mL de la disolución saturada de NaOH, se mezcla y se añaden 3-5 gotas de la disolución de CuSO4. Se homogeniza y se observa la aparición o no de una coloración violeta-rojizo. - 98 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 3.3.5 Determinación cuantitativa de proteínas utilizando el método de Lowry. 3.3.5.1 Preparación de la curva patrón. Preparar siete tubos de ensayo y numerarlos. Añadir las cantidades de disolución patrón de albúmina bobina (100 µg/mL) y de reactivos C y D que se indican en la tabla siguiente. Se añade la disolución de albúmina, el agua y el reactivo C, se homogeneiza y se mantiene a temperatura ambiente por 10 minutos. Transcurrido ese tiempo se añade el reactivo D, se homogeneiza y se deja a temperatura ambiente por 30 minutos. Se registra la absorbancia a una longitud de onda de 750 nm. Tubo Patrón Reactivo Agua/mL E albúmina/µL C/mL Reactivo E A 750 proteína S D/mL S nm 1 0.0 3.0 0.7 P 0.3 P 2 100 3.0 0.6 E 0.3 E 3 200 3.0 0.5 R 0.3 R 4 300 3.0 0.4 A 0.3 A 5 400 3.0 0.3 0.3 6 500 3.0 0.2 10 0.3 7 700 3.0 0.0 0.3 8 100 3.0 0.6 M 0.3 M 9 200 3.0 0.5 I 0.3 I 10 500 3.0 0.2 N 0.3 N µg/mL 30 3.3.5.2 Preparación de las muestras. Las muestras para cuantificar el contenido de proteína se preparan de la forma en que se indica en la tabla anterior con los volúmenes de la disolución de proteína que se indica para los tubos 8 (clara de huevo), 9 (grenetina) y 10 (vacuna). - 99 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 4. RESULTADOS Y DISCUSIÓN 4.1 Reacciones de identificación de aminoácidos 4.1.1 Elabore una tabla en la que se sistematicen los resultados obtenidos de las pruebas para identificar aminoácidos. 4.1.3 Indique los posibles aminoácidos presentes en cada una de las proteínas de prueba. 4.2 Reacciones de precipitación de las proteínas 4.2.1 Elabore una tabla en la que sistematice los resultados obtenidos con los diferentes agentes precipitantes. 4.2.2 Explique por qué precipitan primero las globulinas y luego la albúmina de la clara de huevo utilizando el (NH4)2SO4. 4.2.3. Sistematice las diferencias en cuanto a la precipitación de las proteínas presentes en la clara de huevo utilizando sales, ácidos minerales y disolventes orgánicos. Explique las diferencias encontradas. 4.3 Reacciones de identificación de proteínas. Elabore una tabla en la que sistematice los resultados obtenidos la prueba del biuret. 4.3 Determinación cuantitativa de proteínas utilizando el método de Lowry. 4.3.1 Elabore una curva patrón de concentración de SAB (µg/mL) (eje x de las abscisas) contra la absorbancia (eje y de las ordenadas). 4.3.2 De acuerdo con la absorbancia medida para cada muestra de proteína (clara de huevo, grenetina y vacuna), determine la concentración de la misma en µg/mL de proteína. 4.3.3 Tomando en cuenta las diluciones hechas para preparar la muestra, calcule el contenido de proteína por huevo, por gramo de grenetina o por mL de vacuna. Desarrolle los cálculos explícitamente. - 100 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 5. CUESTIONARIO 5.1 La presencia de aminoácidos se puede determinar mediante la reacción con ninhidrina para formar un producto de color púrpura intenso. Explique la formación de este producto con un mecanismo de reacción detallado y comente la razón por la cual esta prueba es específica para α-aminoácidos. 5.2 Haga un esquema que de la reacción xantoprotéica con el triptofano. Mencione el nombre de otros aminoácidos dan positiva esta reacción. 5.3 Explique la razón por la cual las proteínas dan reacción positiva con la ninhidrina si se trata de polímeros en los que tanto los grupos amino como los ácidos carboxílicos se han convertido en enlaces peptídicos. 5.4 Mencione los fundamentos para la precipitación fraccionada de las proteínas presentes en la clara de huevo utilizando sales como el (NH4)2SO4. 5.5 Mencione los fundamentos para la precipitación de las proteínas utilizando ácidos y disolventes orgánicos. 5.6 Investigue la reacción química que se lleva a cabo en la prueba del biuret con proteínas. 5.7 En que rango de concentración la absorbancia es lineal con respecto a la concentración de proteína en la curva patrón. 6. CONCLUSIONES 7. BIBLIOGRAFÍA. 7.1. Fox, M. A., Whitesell, J. K., Química Orgánica, 2ª Ed. Addison Wesley Longman, México (2000). 7.2 Solomons. T. W. G., Química Orgánica, Ed. Limusa, (1983). 7.3 Wingrove, A. S. y Caret, R. L., Química Orgánica, Harla, (1984).6.4. Hart, H. and Schuetz, R. D., Organic Chemistry, Hounghton Mifflin Company (1986). 7.4 Chechetkin, A. V., Voronianski, V. I., Pokusay, G. G., Prácticas de bioquímica del ganado y aves de corral, Mir, Moscú (1984). 7.5 Henry, R. J., Cannon, D. C., Winkelman, J. W., Quimica Clínica, Bases y Técnicas, Tomo I, JIMS, Barcelona 1986. - 101 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez PRÁCTICA No. 12 REACCIONES DE IDENTIFICACIÓN DE CARBOHIDRATOS 1. OBJETIVOS Que el alumno: 1.1 Distinga a los azúcares reductores de los no-reductores mediante la prueba de Fehling y Tollens. 1.2 Reconozca efímeros mediante la formación de ozazonas. 1.3 Identifique almidón mediante la prueba del lugol. 1.4 Realice la hidrólisis enzimática de almidón mediante el uso de amilasa. 1.5 Hidrolice celulosa en medio ácido. 1.6 Identifique los productos de la hidrólisis de polisacáridos mediante la prueba de Fehling. 1.7 Identifique los grupos funcionales presentes en los azúcares mediante el uso de la técnica espectroscópica de IR. 2. INTRODUCCIÓN Los carbohidratos, también llamados glúcidos, se pueden encontrar casi de manera exclusiva en alimentos de origen vegetal. Constituyen uno de los tres principales grupos químicos que forman la materia orgánica junto con las grasas y las proteínas. Los carbohidratos son los compuestos orgánicos más abundantes de la biosfera y a su vez los más diversos. Normalmente se los encuentra en las partes estructurales de los vegetales y también en los tejidos animales, como glucosa o glucógeno. Estos sirven como fuente de energía para todas las actividades celulares vitales. Aportan 4 kcal/gramo al igual que las proteínas y son considerados macro nutrientes energéticos al igual que las grasas. Los podemos encontrar en una innumerable cantidad y variedad de alimentos y cumplen un rol muy importante en el metabolismo. Por eso deben tener una muy importante presencia de nuestra alimentación diaria. En una alimentación variada y equilibrada aproximadamente - 102 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez unos 300gr./día de hidratos de carbono deben provenir de frutas y verduras, las cuales no solo nos brindan carbohidratos, sino que también nos aportan vitaminas, minerales y abundante cantidad de fibras vegetales. Otros 50 a 100 g. diarios deben ser complejos, es decir, cereales y sus derivados. Siempre preferir a todos aquellos cereales que conservan su corteza, los integrales. Los mismos son ricos en vitaminas del complejo B, minerales, proteínas de origen vegetal y obviamente fibra. La fibra debe estar siempre presente, en una cantidad de 30 gr. diarios, para así prevenir enfermedades y trastornos de peso como la obesidad. En todas las dietas hipocalóricas las frutas y verduras son de gran ayuda, ya que aportan abundante cantidad de nutrientes sin demasiadas calorías. Las funciones que los glúcidos cumplen en el organismo son, energéticas, de ahorro de proteínas, regulan el metabolismo de las grasas y estructural. Energéticamente, los carbohidratos aportan 4 KCal (kilocalorías) por gramo de peso seco. Esto es, sin considerar el contenido de agua que pueda tener el alimento en el cual se encuentra el carbohidrato. Cubiertas las necesidades energéticas, una pequeña parte se almacena en el hígado y músculos como glucógeno (normalmente no más de 0,5% del peso del individuo), el resto se transforma en grasas y se acumula en el organismo como tejido adiposo. Se suele recomendar que minimamente se efectúe una ingesta diaria de 100 gramos de hidratos de carbono para mantener los procesos metabólicos. • Ahorro de proteínas: Si el aporte de carbohidratos es insuficiente, se utilizarán las proteínas para fines energéticos, relegando su función plástica. • Regulación del metabolismo de las grasas: En caso de ingestión deficiente de carbohidratos, las grasas se metabolizan anormalmente acumulándose en el organismo cuerpos cetónicos, que son productos intermedios de este metabolismo provocando así problemas (cetosis). • Estructuralmente, los carbohidratos constituyen una porción pequeña del peso y estructura del organismo, pero de cualquier manera, no debe excluirse esta función de la lista, por mínima que sea su contribución. Los carbohidratos son los compuestos más abundantes en la naturaleza, cuya fórmula molecular Cn(H2O)m indica que los átomos de carbono están combinado con moléculas de - 103 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez agua, de ahí el nombre de carbohidratos o hidratos de carbono. Casi todas las plantas y animales los sintetizan y emplean para almacenar energía. Las plantas almacenan energía convirtiendo la glucosa en almidón, mientras que los animales almacena energía convirtiendo la glucosa en glucógeno. La celulosa constituye las paredes celulares de las plantas y forma su armazón estructural, es el principal constituyente de la madera, un material resistente y muy flexible. En la mayor parte de los organismos vivos, la glucosa se oxida a dióxido de carbono y agua para suministrar la energía que requieren las células. Los carbohidratos se utilizan en la industria alimentaria, para la fabricación de materiales de construcción, en la industria textil y farmacéutica, entre otras. Recientemente, su uso se ha extendido a la fabricación de biocombustibles. Los azúcares o carbohidratos pueden ser monosacáridos, disacáridos, trisacáridos, oligosacáridos y polisacáridos. Monosacáridos. Los monosacáridos o azúcares simples son carbohidratos que no se pueden hidrolizar a compuestos más sencillos como la glucosa y la fructuosa. La glucosa es un polihidroxialdehído, mientras que la fructuosa es una polihidroxicetona. A los polihidroxialdehídos se les llama también aldosas (ald = aldehído, osa = azúcar) mientras que a las polihidroxicetonas se les llama cetosas (ceto = cetona, osa = azúcar). Los monosacáridos reaccionan de acuerdo a los grupos hidroxilo y carbonilo que poseen por lo tanto son compuestos bifuncionales. Las aldosas contienen un grupo aldehído y varios grupos hidroxilo por lo que forman hemiacetales cíclicos. La glucosa forma ciclo de seis miembros con un enlace hemiacetal - 104 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez entre el carbono del aldehído y el grupo hidroxilo en la posición C5. A este tipo de hemiacetales cíclicos de seis miembros también se les conoce como piranosas. Muchas aldopentaosas y cetohexosas forman anillos de cinco miembros, como en el caso de la fructosa. A este tipo de hemiacetales cíclicos de cinco miembros también se les conoce como furanosas. Disacáridos. Los disacáridos o azúcares simples son carbohidratos que no se pueden hidrolizar a compuestos más sencillos. Los disacáridos se producen cuando se combinan químicamente dos monosacáridos. Consideremos tres de los más importantes disacáridos: la maltosa, la lactosa y la sacarosa. La hidrólisis de estos tres disacáridos produce diferentes combinaciones de monosacáridos: - 105 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez maltosa glucosa + glucosa lactosa glucosa + galactosa sacarosa glucosa + fructosa Sacarosa Pruebas químicas de monosacáridos y disacáridos. Los monosacáridos y la mayoría de los disacáridos poseen poder reductor, que deben al grupo carbonilo que tienen en su molécula. Este carácter reductor puede ponerse de manifiesto por medio de una reacción redox llevada a cabo entre ellos y el sulfato de Cobre (II). Las soluciones de esta sal tienen color azul. Tras la reacción con el glúcido reductor se forma óxido de Cobre (I) de color rojo. De este modo, el cambio de color indica que se ha producido la citada reacción y que, por lo tanto, el glúcido presente es reductor. La sacarosa es un disacárido que no posee carbonos anoméricos libres por lo que carece de poder reductor y la reacción con el licor de Fehling es negativa. Sin embargo, en presencia de HCl y en caliente, la sacarosa se hidroliza, es decir, incorpora una molécula de agua y se descompone en los monosacáridos que la forman, glucosa y fructosa, que sí son reductores. La prueba de que se ha verificado la hidrólisis se realiza con el licor de Fehling y, si el - 106 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez resultado es positivo, aparecerá un precipitado rojo. Si el resultado es negativo, la hidrólisis no se ha realizado correctamente y si en el resultado final aparece una coloración verde en el tubo de ensayo se debe a una hidrólisis parcial de la sacarosa. Los azúcares no forman derivados simples con la fenilhidrazina, cada molécula de monosacárido condensa a dos moléculas de fenilhidrazina para formar una osazona, en la ue tanto C1 como C2 se han convertido en fenilhidrazonas. Por lo tanto, una cetosa forma la misma osazona que se aldosa relacionada, perdiendo la estereoquímica en C2. Por lo tanto los efímeros en C2 producen la misma osazona. Polisacáridos. Son compuestos formados por la unión de muchos monosacáridos. Pertenecen al grupo de los glúcidos y cumplen funciones tanto de reserva energética como estructurales. Los polisacáridos son polímeros cuyos monómeros son los monosacáridos, que se unen - 107 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez repetitivamente mediante enlaces glucosídicos. Estos compuestos llegan a tener un peso molecular muy elevado, que depende del número de residuos o unidades de monosacáridos que participen en su estructura. Pueden descomponerse en polisacáridos más pequeños, así como en disacáridos o monosacáridos, mediante hidrólisis, que en la materia viva es catalizada por enzimas llamadas glucosidasas. Los polisacáridos tienen la fórmula general: -[Cx(H2O)y)]n- donde y es generalmente igual a x - 1. Celulosa es un polisacárido Según la función biológica, los polisacáridos se clasifican en los siguientes grupos: Polisacáridos de reserva: la principal molécula proveedora de energía para las células de los seres vivos es la glucosa. Cuando ésta no es descompuesta en el catabolismo energético para extraer la energía que contiene, es almacenada en forma de polisacáridos de tipo α(1>4), representado en las plantas por el almidón y en los animales por el glucógeno. Polisacáridos estructurales: se trata de glúcidos que participan en la construcción de estructuras orgánicas. Entre los más importantes tenemos a la celulosa que es el principal componente de la pared celular en las plantas y a la quitina, que cumple el mismo papel en los hongos, además de ser la base del exoesqueleto de los artrópodos y otros animales emparentados. Otras funciones: la mayoría de las células de cualquier ser vivo suelen disponer este tipo de moléculas en su superficie celular. Por ello están involucrados en fenómenos de reconocimiento celular (ejemplo: Complejo Mayor de Histocompatibilidad), protección frente a condiciones adversas (Ejemplo: Cápsulas polisacarídicas en microorganismos) o adhesión a superficies (ejemplo: la formación de biofilmes o biopelículas, al actuar como una especie de pegamento.) Se distinguen dos tipos de polisacáridos según su composición: Homopolisacáridos: están formados por la repetición de un monosacárido. Heteropolisacáridos: están formados por puro bodyboarding y la repetición ordenada de un - 108 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez disacárido formado por dos monosacáridos distintos (o, lo que es lo mismo, por la alternancia de dos monosacáridos). Algunos heteropolisacáridos participan junto a polipéptidos (cadenas de aminoácidos) de diversos polímeros mixtos llamados peptidoglucanos, mucopolisacáridos o proteoglucanos. Se trata esencialmente de componentes estructurales de los tejidos, relacionados con paredes celulares y matrices extracelulares. El almidón. Es un polisacárido vegetal formado por dos componentes: la amilosa y la amilopectina. La primera se colorea de azul en presencia de yodo debido no a una reacción química sino a la adsorción o fijación de yodo en la superficie de la molécula de amilosa, lo cual sólo ocurre en frío. Como reactivo se usa una solución denominada lugol que contiene yodo y yoduro potásico. Como los polisacáridos no tienen poder reductor, la reacción de Fehling da negativa. Las disoluciones de almidón tienen numerosas propiedades típicas; la más conocida es la reacción con el yodo. Las disoluciones de yodo-yoduro potásico reaccionan con la amilosa y generan un fuerte color azul característico en la superficie de los gránulos de almidón. Esto se debe al complejo que se establece entre una molécula de yodo con cada 6-8 glucosas. Es decir, en presencia del yodo las cadenas de amilosa se estabilizan en una configuración helicoidal con seis restos de glucosa por vuelta de hélice, y las moléculas de yodo forman un complejo situándose en el eje. Como para desarrollar perfectamente la coloración se requiere un mínimo de 40 monosacáridos, las cadenas muy cortas de amilosa en lugar de azul, producen un color rojo. Esto significa que el color azul del complejo depende de la longitud de la cadena implicada. Aparentemente el complejo amilosa-yodo se establece por la inclusión del I2 en la hélice. Por otra parte, la amilopectina sólo acompleja una pequeña cantidad de I2 y desarrolla una coloración roja. - 109 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 3. SECCIÓN EXPERIMENTAL 3.1 Materiales 20 Tubos de ensaye de 10 mL 1 Gradilla 1 Pinzas para tubo de ensaye 2 Pipetas de 5 mL 1 Vaso de precipitaddos de 100 mL 1 Baño María 1 Parrilla de calentamiento 1 Tira papel pH 3.2 Sustancias 10 mL Sacarosa al 1% en agua 10 mL Glucosa al 1% en agua 10 mL Fructuosa al 1% en agua 10 mL Almidón al 1% en agua previamente hervido 10 mL Solución de Fehling Aa 5 mL Solución de NaOH al 10% 2 mL Solución de lugolc 6 mL Solución de AgNO3 al 2.5% 5 mL NH4OH al 5% 10 mL NaOH al 5% 100 mL Fenilhidrazina 12 mL Solución de resorcinold 1 mL Solución de sulfato de cobalto 100 mg al 2% 10 mL Solución de Fehling Bb Solución de HCl al 5% Algodón e 3 mL Acetona 3 mL Solución de H2SO4 al 72% 3 mL Hexano (a) Fehling A: 34.65 g de CuSO4·5H2O en 500 mL de agua. (b) Fehling B: 173 g de tartrato de sodio y potasio y 62.5g de NaOH en 500 mL de agua. (c) En 100 mL de agua se disuelven 20 g de yoduro de potasio y 10 g de yodo, se afora a 500 mL con agua. Esta disolución debe mantenerse en la oscuridad. (d) Se prepara al 0.05% en 100 mL de ácido clorhídrico al 20%. (d) Se prepara al 2% en agua. - 110 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 3.3.1 Identificación de monosacáridos. 3.3.1.1 Prueba de Fehling. Ponga en los tubos de ensayo 3 mL de la solución de glucosa, fructosa y sacarosa. Añada 1 mL de solución de Fehling A y 1 mL de Fehling B. Caliente los tubos en un baño de agua hirviendo por 10 min. La reacción será positiva si la muestra se torna de color rojo y será negativa si queda azul o cambia a un tono azul-verdoso. Observe y anote los resultados obtenidos en una tabla. 3.3.1.2 Prueba de Tollens. Coloque en un tubo de ensayo limpio 1 mL de solución de nitrato de plata al 2.5%, agregue una gota de hidróxido de sodio al 5% y después gota a gota y con agitación una solución de hidróxido de amonio al 5% justo hasta que se disuelva el óxido de plata que precipitó, evitando cualquier exceso de NH4OH. Este reactivo debe usarse recién preparado y debe destruirse con un exceso de ácido nítrico al terminar de utilizarlo, ya que forma compuestos explosivos. Agregue al reactivo recién preparado 3mL de solución del azúcar (glucosa, fructosa y sacarosa), agite y caliente brevemente en baño maría, sin dejar de agitar durante el calentamiento. La aparición de un espejo de plata indica prueba positiva para azúcar reductor. Una vez terminada la prueba el tubo de ensayo se deberá limpiar con ácido nítrico para destruir el espejo de plata. 3.3.1.3 Formación de ozazonas. Coloque en un tubo de ensayo limpio 10 gotas de la solución del azúcar y agregue tres gotas de fenilhidrazina. Caliente la mezcla en baño de agua durante 10-20 minutos. Decante y seque con papel adsorbente los cristales, obsérvelos en un microscopio y determine su punto de fusión. El tiempo de formación de la osazona y la apariencia de los cristales será diferente para los distintos azúcares, excepto para los epímeros en C-2. 3.3.1.4 Reacción con resorcinol. Coloque 2 mL de una disolución de resorcinol preparada con 0.05 g de resorcinol disueltos en 100 mL de ácido clorhídrico al 20% y añádale 3 mL de la disolución del azúcar y caliente 3 min a baño María. Observe. 3.3.2 Identificación de disacáridos. 3.3.2.1 Tome 3mL de solución de sacarosa. Realice la prueba de Fehling como se indica en el experimento anterior. Observe y anote los resultados en una tabla. 3.3.2.2 Tome 3mL de solución de sacarosa y añada 10 gotas de HCl diluido (5%). Caliente a ebullición en un baño María durante 15 min. Deje enfriar y neutralice - 111 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez añadiendo 3mL de solución alcalina de NaOH. Realice la prueba de Fehling como se indica en el experimento anterior. Observe y anote los resultados en una tabla. 3.3.2.3 Tome 3mL de solución de sacarosa y añada 10 gotas de disolución de sulfato de cobalto. Añada 1 mL de disolución de hidróxido de sodio al 10%. Observe y anote los resultados en una tabla. 3.3.3 Identificación de polisacáridos. 3.3.3.1 Coloque en un tubo de ensayo 3mL de la solución de almidón. Añada 3 gotas de la solución de lugol. Observe y anote los resultados. Caliente suavemente, sin que llegue a hervir, hasta que pierda el color. Enfríe el tubo de ensayo al grifo y observe cómo, a los 2-3 minutos, reaparece el color azul. 3.3.3.2 Coloque en un tubo de ensayo 3mL de la solución de almidón. Añada 1 mL de saliva humana, mantenga el tubo entre 37 a 40 °C durante 15 minutos. Enfríe el tubo al chorro del agua. Divida el contenido en dos porciones iguales en sendos tubos de ensaye, al primero añádale tres gotas de la solución de lugol; al segundo hágale la prueba de Fehling como se indica en el experimento 1.1. Observe y anote los resultados. 3.3.3.3 Coloque un poco de algodón en tres tubos de ensaye y añada 3 mL de agua al primero, 3 mL de acetona al segundo y 3 mL de hexano al tercero, observe. 3.3.3.4 Coloque un poco de algodón en un tubo de tal manera que ocupe sin compactar aproximadamente 1 mL, añada 3 mL de H2SO4 (72%) y espere hasta que el algodón se haya disuelto completamente (15-20 min), vacíe el contenido del tubo sobre 30 mL de agua (¡con precaución!) y se hierve. La disolución se neutraliza con una disolución de NaOH concentrada y se realiza la prueba de Fehling de acuerdo con el experimento 1.1, observe y anote los resultados. 3.3.4 Identificación de la muestra problema. 3.3.4.1 Realice las pruebas de identificación para monosacáridos a 3 mL de la muestra problema. 3.3.4.2 Realice las pruebas de identificación para sacarosa a 3 mL de la muestra problema. 3.3.4.3 De acuerdo con los resultados anteriores realice, si así lo estima conveniente, las pruebas para la identificación de polisacáridos. - 112 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 4. RESULTADOS Y DISCUSIÓN 4.1 Determinación colorimétrica de los carbohidratos Azúcar Resultado Resultado Resultado Feheling Tollens Fenilhidrazina Resorcinol Resultado Lugol Glucosa Fructosa Sacarosa Sacarosa hidrolizada Almidón Almidón hidrolizado Celulosa Celulosa hidrolizada Problema 4.2 Formulas químicas de los azucares empleados AZÚCAR FORMULA MOLECULAR GLUCOSA FRUCTOSA - 113 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez CELULOSA SACAROSA ALMIDÓN 5. CONCLUSIONES El alumno en base a su desarrollo experimental concluirá si los objetivos planteados al inicio de la práctica se realizaron con éxito, si no, explicará de una forma breve los inconvenientes en el desarrollo del experimento. 6. CUESTIONARIO 5.1 Presentar los datos obtenidos en la tabla 1.(resultado positivo ó negativo de la prueba, tipo de color, intensidad y tiempo en cada reacción). 5.2 Representar la fórmula estructurales de cada uno de los azucares ensayados en el recuadro que aparece en la tabla 2. 5.3 Sobre la base de la estructura química de cada azúcar, explicar. 5.4 por qué cada uno de ellos da o no da positivo en las distintas pruebas 5.5 las diferencias observadas en el desarrollo de la reacción para cada uno de ellos. 5.6 Investigue si el resorcinol dará prueba positiva para los azucares (justifique su respuesta). - 114 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 5.7 En base a los ensayos realizados a la muestra de problema, de que carbohidrato se trata? 5.8 El análisis de los espectros de IR de la glucosa y la fructuosa, muestra la ausencia de la banda característica para el grupo carbonilo, explique la razón de ésto. 7. BIBLIOGRAFÍA. 7.1 Wade, Química Orgánica, Prentice Hall (2006). 7.2 Solomons. T. W. G., Química Orgánica, Ed. Limusa, (1983). - 115 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 7.3 Wingrove, A. S. y Caret, R. L., Química Orgánica, Harla, (1984).6.4. Hart, H. and Schuetz, R. D., Organic Chemistry, Hounghton Mifflin Company (1986). 7.4 Shriner, R. L., Fuson, R.C., and Curtin, D., Systematic Identification of Organic Compounds, John Wiley and Sons, (1964). 7.5 Wilcox, C. F., Experimental Oraganic Chemistry, A Small Scale Aproach., Mc. Millan Jr. (1988). 7.6 Vogel, A.I., Elementary Practical Organic Chemistry part I. Small Scale Preparations, Longmono (1978). 8. REFERENCIAS ADICIONALES - 116 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez PRACTICA No.13 CINÉTICA DE HIDRÓLISIS DE LA SACAROSA MEDIANTE ROTACIÓN OPTICA 1. OBJETIVOS: El alumno: Realizara la hidrólisis e inversión de la sacarosa y comprobara la identificación de ésta mediante pruebas químicas y utilizando un polarímetro 2. INTRODUCCION Para calcular la rotación específica de azúcares tome en cuenta la siguiente información: el ángulo de rotación específica depende del espesor y concentración de la muestra, de la longitud de onda del rayo incidente y también, aunque en menor grado, de la temperatura del disolvente utilizado. De modo que la rotación específica [α] de una sustancia se expresa de la siguiente forma: [α ]tλ = 100 ⋅α l ⋅c Donde α representa los grados de rotación medidos en el polarímetro; t es la temperatura; λ es la longitud de onda, generalmente se usa la línea D del sodio; l es el largo del tubo en dm y c la concentración de la sustancia expresada en g/100 mL de disolución. 3. SECCION EXPERIMENTAL 3.1 Materiales 15 Tubos de ensayo. 1 1 Pipeta de 5 mL. 1 Probeta de 25 mL. 1 Erlenmeyer de 125 mL. 1 Vaso de pp. de 400 mL. 1 Gradilla. 1 Pinzas p/tubo de ensayo. 1 Vidrio de reloj. 1 Mechero c/manguera. 1 Anillo metálico. 1 Tela de alambre c/asbesto. 1 Recipiente eléctrico Baño María. 1 Pinza de 3 dedos c/nuez. - 117 - Espátula. Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 1 Recipiente de peltre. 1 Polarímetro. 1 Pipeta de 1 mL. 3.2 Reactivos 10 mL Solución de sacarosa al 10 %. 1 mL 1 mL Solución de HCl al 20% preparada 5 mL Fenolftaleína en solución. Reactivo de Fehling. por el profesor. 5 mL Solución de NaOH al 2 %. 10 mL Reactivo de Benedict. 2 mL Reactivo de yodo-yoduro. 2g Almidón soluble. 3mL HCl concentrado. 2 mL NAOH al 2%. NOTAS Nota 1: El alumno preparará la disolución de HCl al 20% a partir de HCl concentrado. Nota 2: La formación de un precipitado rojo y la decoloración de la disolución, indica prueba positiva para azúcar reductora. Nota 3: Una decoloración de la disolución y formación de un precipitado que va de amarillo hasta rojo, indica prueba positiva. Nota 4: Debido a la lentitud de la inversión del azúcar se recomienda preparar estas disoluciones al iniciar la sesión de laboratorio. Nota 5: Salmuera: disolución saturada de NaCl. Nota 6: Para efectuar la prueba del yodo deberá enfriar la muestra ya que el complejo yodoalmidón se disocia en caliente. Es muy importante verificar que las disoluciones tienen las concentraciones deseadas. 3.3 3.3.1- Hidrólisis de la sacarosa (inversión) Coloque en un tubo de ensaye 3 mL de una disolución de sacarosa al 10 %, agregue 0.5 mL ácido clorhídrico al 20 % (Nota1) y caliente en baño maría durante 10 minutos. Enfríe la disolución y neutralice con cuidado y lentamente con NaOH al 2% usando Fenolftaleína como indicador (o bien puede utilizar papel pH). Divida la disolución en 2 partes iguales y haga las siguientes pruebas: - 118 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez -Prueba de Fehling. Mezcle 1 mL de la disolución A* y 1 mL de la disolución B* en un tubo de ensayo, agregue una parte de la disolución de sacarosa invertida y caliente a ebullición (Nota2). Haga la misma prueba para una muestra de la disolución de sacarosa al 10%. Observe y anote sus resultados. -Prueba de Benedict. Coloque 1 mL de la disolución de Benedict y agregue 3 gotas de la disolución de sacarosa invertida, caliente a ebullición y deje enfriar a temperatura ambiente, (Nota3). Haga la misma prueba para una muestra de la disolución de sacarosa al 10%, observe y anote sus resultados. 3.4- Determinación de la rotación específica de la sacarosa y del azúcar invertido Prepare una disolución con 1 g de sacarosa en 10 mL de agua destilada, y úsela para llenar el tubo del polarímetro de modo que no queden burbujas. Identifique este tubo con la letra A y mida su rotación óptica. Prepare otra disolución con 1g de sacarosa en 10 mL de agua destilada y 4 mL de HCl al 20 %, y úsela para llenar otro tubo del polarímetro identificado con la letra B. Posteriormente determine su rotación óptica (Nota4). Por último, llene un tercer tubo con una mezcla de las disoluciones A y B en proporción de 40:60 y mida la rotación óptica. 4. RESULTADOS Y DISCUSION Con los datos de rotación específica [α] calculados llene la tabla 1, compare sus resultados con los reportados en la literatura y saque sus conclusiones: Tabla 1. Valores de rotación específica Sustancia [α]20 reportada Sacarosa. + 66.5º Glucosa. + 52º Fructosa. -92º Azúcar Invertido. -19.9º [α] experimental 5. CONCLUSIONES El equipo concluirá en base a sus datos experimentales lo importante de la práctica - 119 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 6. CUESTIONARIO 6.1¿Por qué el azúcar invertido es más dulce que la sacarosa? 6.2Explique por qué se le llama inversión a la hidrólisis de la sacarosa. 6.3¿Por qué no se pueden desechar libremente los afluentes líquidos al drenaje? 6.4Diga qué tratamiento debería dársele en cada uno para poder desecharlos. 6.5En la hidrólisis del almidón qué resultados espera de la prueba e Benedict, de la prueba yodo-yoduro efectuadas al inicio de la reacción de la hidrólisis y al final de la reacción. 6.6 Defina los siguientes conceptos: actividad óptica, rotación específica y luz polarizada 7. BIBLIOGRAFÍA 7.1. Moore J. A. y Dalrympe D. L. “Experimental Methods in Organic Chemistry” 2ª, Ed. W. B. Saunders Co. Pág 259-269. 7.2. Jacobs T.L., Truce W. E. Y Robertson G. Ross., “Laboratory Practice of Organic Chemistry”, 5ª Ed., Mac Millan Pub. Co. Inc., U.S.A. 1974. Pág. 311-316 7.3 Hudlicky, “Experiments in Organic Chemistry”, 3ª Ed. Avery Publishing Group, Inc. U.S.A., 1985, Pág. 104-106 7.4 Streitwieser A., Heathcok H. C., “Introduction to Organic Chemistry”, Mac Millan Pub. Co. Inc., U.S.A. 1976, Pág. 693-732. 7.5 Royston M. Roberts, John C. Gilbert, Stephen F. Martin, Experimental Organic Chemistry (A miniscale approach). U.S.A., Ed. Saunders College Publishing, 1994, Pág. 641-651. 7.6 Devore G, Química Orgánica, Editorial Publicaciones Cultural, S. A, México 1969. 8. BIBLIOGRAFIA ADICIONAL. - 120 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez PRACTICA No. 14 RECONOCIMIENTO DE LÍPIDOS 1. OBJETIVOS Que el alumno: 1.1 Identifique algunos lípidos mediante el uso de algunas propiedades de los lípidos. 1.2 Reconozca a los lípidos mediante sus propiedades fisicoquímicas 1.3 Identifique cualitativamente a los lípidos mediante tinción con Sudan II. 1.4 Elabore un jabón mediante la reacción de saponificación de una grasa. 1.5 Obtenga colesterol a partir de tejido nervioso. 1.6 Identifique el colesterol mediante pruebas colorimétricas cualitativas. 2. ANTECEDENTES Los lípidos, son un grupo de compuestos químicamente diversos, solubles en solventes orgánicos (como cloroformo, metanol o benceno), y casi insolubles en agua. La mayoría de los organismos, los utilizan como reservorios de moléculas fácilmente utilizables para producir energía (aceites y grasas). Los mamíferos, los acumulamos como grasas, y los peces como ceras; en las plantas se almacenan en forma de aceites protectores con aromas y sabores característicos. Los fosfolípidos y esteroles constituyen alrededor de la mitad de la masa de las membranas biológicas. Entre los lípidos también se encuentran cofactores de enzimas, acarreadores de electrones, pigmentos que absorben luz, agentes emulsificantes, algunas vitaminas y hormonas, mensajeros intracelulares y todos los componentes no proteícos de las membranas celulares. Los lípidos, pueden ser separados fácilmente de otras biomoléculas por extracción con solventes orgánicos y pueden ser separados por técnicas experimentales como la cromatografía de adsorción, cromatografía de placa fina y cromatografía de fase reversa. La función biológica más importante de losa lípidos es la de formar a las membranas celulares, que en mayor o menor grado, contienen lípidos en su estructura. En ciertas membranas, la presencia de lípidos específicos permiten realizar funciones especializadas, como en las células nerviosas de los mamíferos. La mayoría de las funciones de los lípidos, se deben a sus propiedades de autoagregación , que permite también su interacción con otras biomoléculas. De hecho, los lípidos casi nunca se encuentran en estado libre, generalmente - 121 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez están unidos a otros compuestos como carbohidratos (formando glucolípidos) o a proteínas (formando lipoproteínas). Estas importantes biomoléculas se clasifican generalmente en: Lípidos saponificables y no saponificables. Además de los anteriores, existen lípidos anfipáticos en cuya molécula existe una región polar opuesta a otra apolar. Estos lípidos forman las bicapas lipídicas de las membranas celulares y estabilizan las emulsiones (liquido disperso en un líquido). Los ácidos grasos de importancia biológica, son ácidos monocarboxílicos (ej. Ác laurico: CH3(CH2)10COOH) de cadenas alifáticas de diverso tamaño y que pueden contener o no insaturaciones: Los ácidos grasos naturales insaturados (líquidos a temperatura ambiente), son isómeros geométricos cis que pueden ser monoinsaturados (ej. Ácido oleíco (ácido 9octadecenoíco) CH3(CH2)7CH=CH(CH2)7COOH) o poliinsaturados (ej. Ácido araquidónico (ácido 5,8,11,14-eicosatetraenoico) CH3(CH2)4(CH=CHCH2)4(CH2)2COOH). Figura: representación del ácido oleico. Los ácidos grasos poliinsaturados, desde el punto de vista nutricional se consideran como esenciales pues no son sintetizados por los mamíferos; fisiológicamente, se encuentran formando sales o jabones (formando micelas). Los ácidos grasos de cadena larga, insolubles en agua, forman ésteres con alcoholes y tioésteres con la coenzima A. Compuestos de importancia biológica como las prostaglandinas, tromboxanos y leucotrienos, son derivados de ácidos grasos poliinsaturados de 20 carbonos como el ácido araquidónico. En los acilgliceroles (o acilglicéridos), uno o más de los grupos hidroxilo (OH) de la molécula de glicerol, están esterificados de ahí que se dividan en monoacil, diacil y triacilgliceroles; en estos últimos, todos los hidroxilos del glicerol (3), están esterificados con ácidos grasos. Estos ácidos grasos pueden ser iguales entre ellos o diferentes y dependiendo de la longitud de las cadenas que esterifican al glicerol y de su grado de insaturación, los - 122 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez triacilgliceroles (triacilglicéridos), se dividen en grasas (sólidas) o aceites (líquidos). Estas moléculas, son hidrofóbicas y no forman micelas. Glicerofosfolípidos, fosfogliceridos, fosfolipidos, fosfoacilgliceroles Componentes principales de las membranas, consisten de un glicerol-3-fosfato esterificado en C1 y C2 por ácidos grasos y en el grupo fosforil con un grupo X polar que es generalmente un derivado de un alcohol (X= agua: ácido fosfatídico; X= etanolamina: fosfatidiletanolamina; X= colina: fosfatidilcolina (lecitina); X= serina: fosfatidilserina; X= myo-inositol: fosfatidilinositol; X= glicerol: fosfatidilglicerol y X= fosfatidilglicerol: difosfatidilglicerol (cardiolipina)). Figura: representación del glicerol-3-fosfato y glicerofosfolípido. El grupo X polar derivado de un alcohol puede ser igual a: X= agua: ácido fosfatídico; X= etanolamina: fosfatidiletanolamina; X= colina: fosfatidilcolina (lecitina); X= serina: fosfatidilserina; X= myo-inositol: fosfatidilinositol; X= glicerol: fosfatidilglicerol y X= fosfatidilglicerol: difosfatidilglicerol (cardiolipina)). Los plasmalógenos son fosfoglicéridos en los que el glicerol fosfato tiene unido en el C1, mediante un enlace tipo éter, un alcohol de cadena larga. Comúnmente, la parte polar de los plasmalógenos es etanolamina, colina o serina. - 123 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez Los esfingolípidos, son componentes importantes de las membranas, derivados del aminoalcohol insaturado esfingosina o dihidroesfingosina (C18). Este alcohol, se une a un ácido graso de cadena larga por medio de un enlace amina para formar una ceramida. Las ceramidas, se encuentran en pequeñas cantidades en los tejidos de plantas y animales, pero dan origen a los esfingolípidos más abundantes: Las esfingomielinas, son los esfingolípidos más comunes; son ceramidas esterificadas con fosforilcolina o fosforiletanolamina. Aunque las esfingomielinas difieren químicamente de la fosfatidilcolina y la fosfatidiletanolamina, sus conformaciones y distribuciones de carga son muy similares. La mielina que rodea y aísla eléctricamente a muchos axones en las neuronas del tejido nervioso, es particularmente rica en esfingomielinas. - 124 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez Cuando las ceramidas se combinan con un azúcar forman a los glucoesfingolípidos, que se dividen en: cerebrósidos (o glucoesfingolípidos), son los esfingolípidos más simples, su cabeza polar consiste de una unidad de azúcar. Los galactocerebrósidos, que se encuentran en las membranas celulares neuronales del cerebro, tienen una cabeza polar de β-D galactosa. Los glucocerebósidos, que también tienen un residuo de β-D galactosa se encuentran en membranas celulares de otros tejidos. A diferencia de los fosfolípidos, los cerebrósidos carecen de grupos fosfato y por lo tanto, son frecuentemente compuestos no ionicos. Los residuos de algunos galactocerebrósidos están sulfatados en la posición 3 formando compuestos conocidos como sulfátidos. Los gangliósidos son el grupo más complejo de los esfingolípidos. Son oligosacáridos de ceramidas que incluyen entre sus residuos de azúcar al menos un residuo de ácido siálico (ácido N–acetilneuramínico (NAM) y sus derivados). Los gangliósidos son componentes primarios de la superficie de las membranas celulares y constituyen una fracción significativa (aproximadamente 6%) de los lípidos del cerebro, en otros tejidos, están presentes en cantidades mucho menores. - 125 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez Ceras Las ceras son lípidos completamente insolubles en agua; se encuentran en la superficie de plantas y animales, donde funcionan como impermeabilizante, están constituidas por ácidos grasos esterificados (generalmente con número par de átomos de carbono) a alcoholes de cadena larga (de 10 a 30 carbonos). Los ácidos grasos que forman parte de estos lípidos, pueden ser ramificados, insaturados o formar anillos. Terpenos Se encuentran en la mayoría de los organismos, pero constituyen el grupo más abundante de los aceites vegetales, de hecho son los responsables de los aromas y sabores específicos de las plantas, mientras mayor sea la cantidad de oxígeno en la molécula, mayor será su aroma. Estos compuestos, se forman a partir del ispreno (unidad de 5 átomos de carbono); pueden contener desde una hasta ocho unidades. Las unidades pueden arreglarse linealmente (como en el escualeno) o cíclicamente (como en la limonina). Dentro de los terpenos se clasifica a los carotenoides que son tetraterpenos muy importantes en los mamíferos, especialmente el β-caroteno que es precursor de la vitamina A (11-cis-retinal). También las vitaminas liposolubles D (colecalciferol) y K son consideradas como terpenos. Esteroides Los esteroides, son lípidos simples no saponificables, en su mayoría de origen eucarionte, derivados del ciclopentanoperhidrofenantreno El colesterol es el esteroide más abundante en los animales, se clasifica como un esterol por la presencia de un hidroxilo (OH) en el C3 y su cadena lateral alifática de 8 a 10 átomos de carbono. - 126 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez El colesterol, es un componente mayoritario de las membranas plasmáticas animales y se encuentra en menor cantidad en las membranas de los organelos. El grupo OH en la molécula, le da un débil carácter anfífilo y el núcleo esteroide, es una estructura no polar, rígida y planar. Por lo tanto, es un determinante importante de las propiedades de la membrana. Este esteroide, es abundante también en lipoproteínas del plasma sanguíneo, en donde aproximadamente el 70% de este es esterificado por ácidos grasos de cadena larga para formar ésteres de colesterol. EL colesterol es el precursor metabólico de las hormonas esteroides, que son substancias que regulan una gran variedad de funciones fisiológicas, que incluyen el desarrollo sexual y el metabolismo de los carbohidratos. El papel del colesterol en enfermedades cardiovasculares (link hormonas esteroides). Las plantas contienen muy poco colesterol. Entre los esteroles que se encuentran comúnmente en sus membranas se encuentran el estigmasterol y el β-sitosterol, que difieren del colesterol solo en las cadenas alifáticas. Las levaduras y hongos contienen otros esteroles en sus membranas como el ergosterol que tiene un doble enlace (C7-C8). Los procariontes no contienen en sus membranas ningún esterol, excepto los micoplasmas. Los derivados del colesterol son: los ácidos biliares, las hormonas esteroides – estrógenos, progestágenos, glucocorticoides, mineralocorticoides y andrógenos- y la vitamina D, que deriva del colesterol aunque propiamente no es un esteroide. 3. SECCIÓN EXPERIMENTAL 3.1 Materiales 3.2 Reactivos Tubos de ensayo Solución de NaOH al 20% Gradilla Solución de Sudán III Varillas de vidrio Tinta china roja Mechero ó parrilla éter, cloroformo o acetona Vasos de precipitados Aceite de oliva Pipetas Yeso Morteros de porcelana limpios y secos 50 g de sesos de animal desmenuzados Espátula Cloroformo Placa de vidrio Ácido súlfurico concentrado Embudos de vidrio Ácido acético Papel filtro Anhídrido acetico - 127 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 3.3 Procedimiento experimental 3.3.1 Saponificación 3.3.1.1Fundamento Las grasas reaccionan en caliente con el hidróxido sódico o potásico descomponiéndose en los dos elementos que las integran: glicerina y ácidos grasos. Éstos se combinan con los iones sodio o potasio del hidróxido para dar jabones, que son en consecuencia las sales sódicas o potásicas de los ácidos grasos. En los seres vivos, la hidrólisis de los triglicéridos se realiza mediante la acción de enzimas específicos (lipasas) que dan lugar a la formación de ácidos grasos y glicerina. 3.3.1.2 Técnica a)Colocar en un tubo de ensayo 2ml de aceite y 2ml de NaOH al 20%. . Agitar enérgicamente y colocar el tubo al baño María de 20 a 30 minutos. . Pasado este tiempo, se pueden observar en el tubo 3 fases: una inferior clara que contiene la solución de sosa sobrante junto con la glicerina formada, otra intermedia semisólida que es el jabón formado y una superior lipídica de aceite inalterado. . 3.3.2 Tinción 3.3.2.1 Fundamento Los lípidos se colorean selectivamente de rojo-anaranjado con el colorante Sudán III. 3.3.2.2 Técnica . Disponer en una gradilla 2 tubos de ensayo colocando en ambos 2ml de aceite. . Añadir a uno de los tubos 4-5 gotas de solución alcohólica de Sudán III. . Al otro tubo añadir 4-5 gotas de tinta roja. . Agitar ambos tubos y dejar reposar. - 128 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez . Observar los resultados: en el tubo con Sudán III todo el aceite tiene que aparecer teñido, mientras que en el tubo con tinta, ésta se irá al fondo y el aceite no estará teñido. 3.3.3 Solubilidad 3.3.3.1.Fundamento Los lípidos son insolubles en agua. Cuando se agitan fuertemente en ella se dividen en pequeñísimas gotas formando una emulsión de aspecto lechoso, que es transitoria, pues desaparece en reposo por reagrupación de las gotitas de grasa en una capa que, por su menor densidad, se sitúa sobre el agua. Por el contrario, las grasas son solubles en disolventes orgánicos, como el éter, cloroformo, acetona, benceno, etc. 3.3.3.2.Técnica . Poner 2ml de aceite en dos tubos de ensayo. . Añadir a uno de ellos 2ml de agua y al otro 2ml de éter u otro disolvente orgánico, . Agitar fuertemente ambos tubos y dejar reposar. . Observar los resultados: Se verá cómo el aceite se ha disuelto en el éter y, en cambio no lo hace en el agua y el aceite subirá debido a su menor densidad. 3.3.4 Aislamiento de Colesterol del Tejido Nervioso 3.3.4.1 Técnica 3 gramos de cerebro desmenuzado se tritura cuidadosamente en un mortero con 6 g de yeso. La masa espesa obtenida se aplica con ayuda de una espátula sobre la placa de vidrio en una capa fina y seca en el armario secador a 40ºC sobre la llama de un mechero. La masa reseca se separa de la placa con un escarpelo en un mortero seco y se tritura convirtiéndola en polvo. El polvo se traslada a un tuvo de ensayo, se le vierten 6 ml de cloroformo, se agita cuidadosamente durante 5 ml y se filtra. El filtrado obtenido se utiliza para las reacciones coloreadas de reconocimiento del colesterol. 3.3.5 Reacciones coloreadas del colesterol El principio del método. Bajo la acción de los agentes deshidratantes el colesterol se transforma en un hidrocarburo con dobles enlaces conjugados: el colesterileno, que al interaccionar con el ácido sulfúrico y el anhídrido acético, da compuestos complejos - 129 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez intensamente coloreados. Reacciones semejantes son características también para otros esteroles. 3.3.5.1 Reacción con el acido sulfurico Reacción de Schiff: en un tuvo de ensayo seco se vierte 1 ml de extracto de colesterol en cloroformo y con cuidado, por la pared, se hace deslizar 1ml de ácido sulfúrico concentrado. En el contacto de los líquidos se observa la aparición de un anillo de color rojo. Reacción de Salkovsky: En un tubo de ensayo seco se vierte 1ml de extracto de colesterol en cloroformo y 1ml de ácido sulfúrico. Los líquidos se mezclan agitando el tubo de ensayo. Al separarse las capas, el extracto superior de cloroformo resulta coloreado de rojo y el inferior de un color rojo amarillento con fluorescencia verde. Si al extracto inferior del liquido se le añade 1ml de ácido acetico, aparece una coloración roja rosada, mientras que la fluorescencia se mantiene. 3.3.5.2 Reacción con anhídrido acetico y acido sulfurico Reacción de Liebermann-Burkhardt:En un tubo de ensayo se vierten 2 ml de extracto de colesterol en cloroformo, se añaden gota a gota 10 ml de anhídrido acético, 2 gotas de ácido sulfúrico, y se mezcla todo cuidadosamente. El líquido adquiere primero una coloración roja, luego una violeta, azul y, por último, verde. 4. RESULTADOS Y DISCUSIÓN Reportar en su bitácora los resultados de todos y cada uno de los ensayos obtenidos. 5. CONCLUSIONES El alumno concluirán en base a la experiencia adquirida en el laboratorio sobre el desarrollo de esta práctica si los objetivos se cumplieron. 6. CUESTIONARIO 7.1 ¿Qué son los jabones? 7.2 ¿Cómo se pueden obtener los jabones? 7.3 ¿Por qué en la saponificación del aceite la glicerina aparece en la fase acuosa? 7.4 ¿Qué enzima logra en el aparato digestivo la hidrólisis de las grasas? 7.5 Indica lo que ocurre con la mezcla aceite-Sudán III y aceite-tinta y explica a qué se debe la diferencia entre ambos resultados. 7.6 ¿Qué ocurre con la emulsión de agua en aceite transcurridos unos minutos de reposo?, ¿Y que ocurre con la de benceno y aceite?¿A qué se deben las diferencias observadas entre - 130 - Manual de Practicas Laboratorio de Química-Bioorgánica Alejandro Cruz, Itzia I. Padilla Martínez, Efrén V. García Báez 7. BIBLIOGRAFIA: 7.1 V. Chechetkin, V.I. Voronianski, G.G. Pokusay, Practicas de Bioquímica del ganado y aves de corral, Editorial Mir-Moscu, 1994, paginas 128-149. 7.2 E. Vazquez-Contreras, Bioquímica y Biologogía Molecular en línea. Instituto de Química-UNAM. http://laguna.fmedic.unam.mx/~evazquez/0403/tipos%20lipidos.html. 8. BIBLIOGRAFIA ADICOIONAL - 131 -