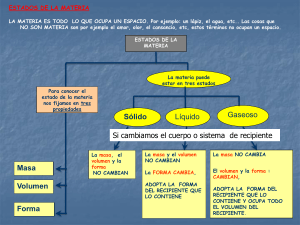
Estados de Agregación. Teoría Cinética
Anuncio
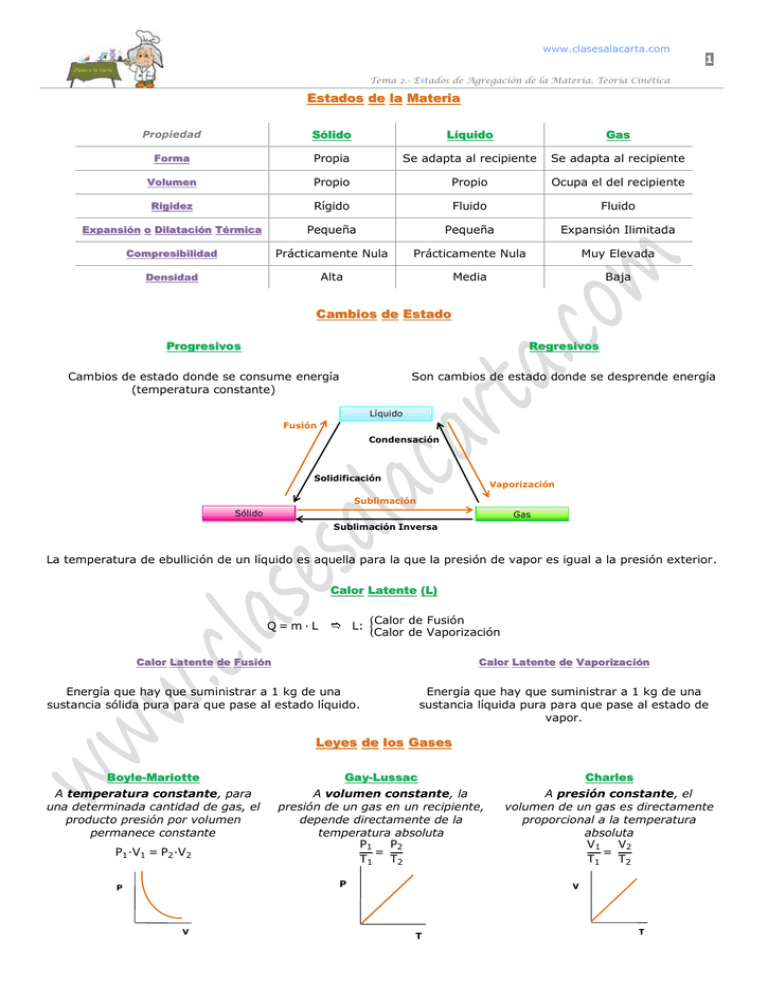
www.clasesalacarta.com 1 Tema 2.- Estados de Agregación de la Materia. Teoría Cinética Estados de la Materia Propiedad Sólido Líquido Gas Forma Propia Se adapta al recipiente Se adapta al recipiente Volumen Propio Propio Ocupa el del recipiente Rigidez Rígido Fluido Fluido Expansión o Dilatación Térmica Pequeña Pequeña Expansión Ilimitada Compresibilidad Prácticamente Nula Prácticamente Nula Muy Elevada Densidad Alta Media Baja Cambios de Estado Progresivos Regresivos Cambios de estado donde se consume energía (temperatura constante) Son cambios de estado donde se desprende energía Líquido Fusión Condensación Solidificación Vaporización Sublimación Sólido Gas Sublimación Inversa La temperatura de ebullición de un líquido es aquella para la que la presión de vapor es igual a la presión exterior. Calor Latente (L) Q=m·L L: Calor de Fusión Calor de Vaporización Calor Latente de Fusión Calor Latente de Vaporización Energía que hay que suministrar a 1 kg de una sustancia sólida pura para que pase al estado líquido. Energía que hay que suministrar a 1 kg de una sustancia líquida pura para que pase al estado de vapor. Leyes de los Gases Boyle-Mariotte Gay-Lussac Charles A temperatura constante, para una determinada cantidad de gas, el producto presión por volumen permanece constante A volumen constante, la presión de un gas en un recipiente, depende directamente de la temperatura absoluta P1 P2 = T1 T2 A presión constante, el volumen de un gas es directamente proporcional a la temperatura absoluta V1 V2 = T1 T2 P1 ·V1 = P2 ·V2 P P V V T T á á 2 Química _ 1º Bachillerato Ley de los Gases Ideales Son los que cumplen las leyes de Boyle y de Charles y Gay-Lussac P: atm V: L n: moles P·V=n·R·T R = 0’082 Ley de Dalton para las Presiones Parciales atm L mol K T: K En una mezcla de gases ideales, cada gas ejerce una presión parcial igual a la que ejercería si él solo ocupase todo el volumen a la misma temperatura. En la misma mezcla, la presión total coincide con la suma de las presiones parciales de todos los gases que la componen PT = P1 + P2 + P3+⋯ Teoría Cinético – Molecular de los Gases (Juoule, Clausius, Maxwell y Boltzman) 1. Los gases están formados por partículas (átomos o moléculas) de tamaño despreciable en relación con las distancias que las separan, de forma que las interacciones entre ellas pueden despreciarse 2. Las moléculas del gas se mueven continuamente y al azar, chocando entre sí y con las paredes del recipiente que las contiene 5 P=ρ·g·h 1 atm =760 mm Hg = 1,0.13·10 Pa 3. Los choques que se originan son completamente elásticos, es decir, no hay variación de su energía cinética m·v2 EC = R 4. La energía cinética media de las moléculas gaseosas es directamente proporcional a la temperatura de la muestra m·v2 EC = EC =k·T R Teoría Cinético – Molecular de Líquidos 1. La viscosidad de algunos líquidos se debe a que las interacciones entre sus partículas no se pueden despreciar 2. El aumento de EC de las partículas al aumentar la temperatura, explica el fenómeno de la evaporación 3. El descenso de EC de las partículas al descender la temperatura, explica el fenómeno de la condensación 4. Cada líquido tiene una presión de vapor a una determinada temperatura, de manera que cuando aquella iguala a la atmosférica, el líquido hierve Teoría Cinético – Molecular de los Sólidos 1. La interacción entre las partículas de un sólido es muy alta, lo que obliga a sus partículas a colocarse de manera ordenada formando estructuras geométricas cristalinas cuya simetría equilibra dichas interacciones en todas las direcciones del espacio 2. El punto de fusión de un sólido es poco sensible a la presión exterior 3. Un sólido sublima cuando su presión de vapor iguala a la atmosférica a una temperatura inferior a la de su punto de fusión