Nota informativa NI-9. Principios activos sin indicación reconocida
Anuncio

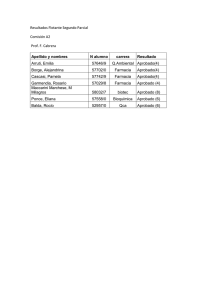
GOVERN DE LES ILLES BALEARS CONSELLERIA DE SALUT I CONSUM DIRECCIÓ GENERAL DE FARMÀCIA Asunto/assumpte: Nota Informativa PRINCIPIOS ACTIVOS SIN INDICACIÓN RECONOCIDA LEGALMENTE EN ESPAÑA Y PRODUCTOS INTERMEDIOS- FORMULACIÓN MAGISTRAL. Ref.: NI9 Us comunic que en data, 29-4-2009 s’ha rebut en aquesta Conselleria, ofici de la Subdirección General de Inspección y Control de Medicamentos, de la Agencia Española de Medicamentos y Productos Sanitarios, en el qual ens comunica el següent: Le comunico que en fecha, 29-4-2009 se ha recibido en esta Consellería, oficio de Subdirección General de Inspección y Control de Medicamentos, de la Agencia Española de Medicamentos y Productos Sanitarios, en el cual nos comunica lo siguiente: "En relación con las dudas surgidas respecto a las materias primas utilizadas en formulación magistral y a los efectos oportunos esta Subdirección informa lo siguiente: PRINCIPIOS ACTIVOS SIN INDICACIÓN RECONOCIDA LEGALMENTE EN ESPAÑA El artículo 42 de la Ley 29/2006, de 26 de julio, de garantías y uso racional de los medicamentos y productos sanitarios, establece en su apartado 1 que las fórmulas magistrales serán preparadas con sustancias de acción e indicación reconocidas legalmente en España. Esta condición para poder utilizar un determinado principio activo en formulación magistral se complementa con lo establecido en el apartado 6 del mismo artículo 42, que especifíca que, cuando se pretenda utilizar en un paciente, dentro del ámbito de la formulación magistral principios activos no autorizados en España, deberá disponerse de la preceptiva autorización condecida por la Agencia, recogida en el artículo 24 de la Ley 29/2006 y desarrollada en el artículo 28 del Real Decreto 223/2004, de 6 de febrero, por el que se regulan los ensayos clínicos con medicamentos. Respecto a la situación de autorización de un principio activo o medicamento a la que se refiere el artículo 42 apartado 6, hay que decir que, según se establece en el artículo 9 de la Ley 29/2006, de 26 de julio, el Registro de Medicamentos tiene carácter constitutivo y sólo podrán considerarse autorizados aquellos medicamentos que consten como tales en dicho registro. Los medicamentos cuya autorización se extinga o cause baja en este Registro no podrán considerarse autorizados, siéndoles de aplicación lo establecido en el artículo 42.6 de la Ley 29/2006, de 26 de julio, en lo referente a su uso en formulación magistral. PRODUCTOS INTERMEDIOS. Los pellets de omeprazol son un producto intermedio, resultante de un procesado de materias primas, sustancias activas y excipientes, llevado a cabo por un laboratorio fabricante autorizado, en los términos en que se definen en el artículo 8, punto h, de la Ley 29/2006, de 26 de julio. En su calidad de producto intermedio, los procesos de fabricación posteriores (incluyendo, por ejemplo, el fraccionamiento) únicamente pueden realizarse por una entidad legalmente autorizada para fabricar o elaborar medicamentos, un laboratorio fabricante autorizado conforme a lo dispuesto en el Real Decreto 1564/1992, de 18 de diciembre, que desarrolla y regula el régimen de autorización de C/ Tomas Forteza, 40. 07006 Palma. Mallorca. Tel.: 971 775 574 Fax.: 971 -17 68 72 GOVERN DE LES ILLES BALEARS CONSELLERIA DE SALUT I CONSUM DIRECCIÓ GENERAL DE FARMÀCIA los laboratorios farmacéuticos e importadores de medicamentos y la garantía de calidad en su fabricación industrial, o aquellas entidades autorizadas para elaborar fórmulas magistrales: oficinas de farmacia y servicios de farmacia hospitalaria. El artículo 67.2 de la Ley 29/2006, de 26 de julio, dispone "Excepcionalmente y cuando así lo requiera la atención a sus pacientes, los servicios de farmacia hospitalaria y oficinas de farmacia podrán encomendar, a una entidad legalmente autorizada por la Agencia Española de Medicamentos y Productos Sanitarios, la realización de alguna fase de la producción de una preparación concreta o de su control analítico". Esta disposición habilita a que con carácter excepcional una oficina de farmacia o servicio de farmacia pueda encomendar parte de la fabricación de una preparación o su control analítico a un laboratorio farmacéutico. Por otro lado, en cuanto al artículo 42.2 y 43.2 permite a las oficinas de farmacia o servicios de farmacia hospitalaria encomendar una o varias fases de la fabricación a otra oficina de farmacia o servicio de farmacia hospitalaria. En la fabricación de medicamentos, de acuerdo con la normativa vigente, para que una parte encomiende a otra la realización de determinadas etapas de este proceso y que los acuerdos entre ambas partes puedan considerarse válidos, las dos entidades deben de estar legalmente autorizadas para llevar a cabo actividades de producción de medicamentos, bien bajo la forma de fabricación industrial (laboratorio farmacéutico) o bien la elaboración de fórmulas magistrales (oficina de farmacia o servicio de farmacia hospitalaria). Un almacén de distribución no puede responsabilizarse de ninguna etapa en esta cadena de fabricación y suministro pues no está prevista en la normativa vigente, la intervención en estas actividades de fabricación, la contratación como tercero de almacenes de distribución, autorizados conforme al Real Decreto 2259/1994, de 25 noviembre, que regula los almacenes farmacéuticos y la distribución al por mayor de medicamentos de uso humano y productos farmacéuticos." Palma, 29 d'abril de 2009 C/ Tomas Forteza, 40. 07006 Palma. Mallorca. Tel.: 971 775 574 Fax.: 971 -17 68 72 GOVERN DE LES ILLES BALEARS CONSELLERIA DE SALUT I CONSUM DIRECCIÓ GENERAL DE FARMÀCIA C/ Tomas Forteza, 40. 07006 Palma. Mallorca. Tel.: 971 775 574 Fax.: 971 -17 68 72 GOVERN DE LES ILLES BALEARS CONSELLERIA DE SALUT I CONSUM DIRECCIÓ GENERAL DE FARMÀCIA C/ Tomas Forteza, 40. 07006 Palma. Mallorca. Tel.: 971 775 574 Fax.: 971 -17 68 72