ESTRUCTURA ATÓMICA - IES Juan de Aréjula
Anuncio

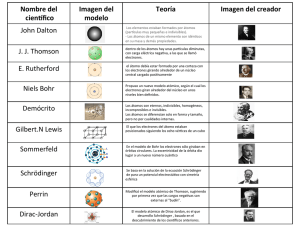
ESTRUCTURA ATÓMICA ESTRUCTURA ATÓMICA Contenidos 1. Modelos atómicos 1. 2. 3. 4. 5. 2. Niveles: 2º Bachillerato Química Dalton Thomson Rutherford Bohr Mecánico cuántico El Sistema Periódico 1. 2. Configuración electrónica y periodicidad Propiedades periódicas Modelo atómico de Dalton John Dalton (1766-1844) Químico y físico británico 1. Los elementos químicos están formados por partículas muy pequeñas e indivisibles llamadas átomos 2. Todos los átomos de un elemento químico dado son idénticos en su masa y demás propiedades 3. Los átomos de diferentes elementos químicos son distintos, en particular sus masas son diferentes 4. Los átomos son indestructibles y retienen su identidad en los cambios químicos 5. Los compuestos se forman cuando átomos de diferentes elementos se combinan entre sí, en una relación de números enteros sencilla, formando entidades definidas (hoy llamadas moléculas) 6. En las reacciones químicas los átomos simplemente se redistribuyen. Símbolo Elemento Masa Hidrógeno 1 Nitrógeno 5 Carbono 6 Oxígeno 8 Representación de un cambio químico, según Dalton: + El descubrimiento del electrón Fueron los experimentos de Faraday sobre la electrólisis, realizados hacia 1830, los que sugirieron que los átomos no eran tan simples e indivisibles como Dalton supuso. El hecho de que la corriente eléctrica produjera un cambio químico indicaba la existencia de una relación entre electricidad y materia, o en otras palabras, que los átomos debían poseer una estructura de naturaleza eléctrica. Un tubo de vacío es un tubo de vidrio equipado con dos placas a modo de electrodos que pueden conectarse a los dos polos de un generador. Si se encierra en él un gas, no se observa fenómeno alguno, aunque apliquemos un alto voltaje, ya que los gases son aislantes casi perfectos en condiciones habituales. Pero al hacer el vacío manteniendo un voltaje elevado, el gas comienza a conducir la electricidad, fenómeno que va acompañado de emisión de luz. Si el vacío se intensifica, la luz desaparece. En estas circunstancias puede verse una débil fluorescencia en la pared del tubo opuesta al cátodo. Como al colocar cualquier objeto entre los electrodos aparece una sombra, ya los primeros científicos, que estudiaron estos fenómenos en la segunda mitad del siglo XIX, supusieron que la fluorescencia era producida por una radiación invisible que salía del cátodo. De ahí el nombre de rayos catódicos. El descubrimiento del electrón Tubo de descargas William Crookes (1832-1919) Químico y físico británico Cátodo Tubo de Crookes 1875 Gas a baja presión El descubrimiento del electrón Los rayos catódicos tienen las siguientes propiedades: • Están constituidos por partículas con masa. • Esas partículas viajan en línea recta hasta el ánodo. • Las partículas se desvían en campos eléctricos o magnéticos. • Sus características no dependen del gas ni electrodos utilizados. Ánodo El descubrimiento del electrón En 1897, Joseph John Thomson deja claro la naturaleza de los rayos catódicos • Se trata de unas partículas procedentes de los átomos del cátodo y a las que llama electrones y de las cuales determina la relación carga/masa • Dicha relación no depende del gas ni de los electrodos usados J.J. Thomson (1856-1940) Físico británico q/m=1,759·1011 C/kg El descubrimiento del electrón En 1909 Robert Andrews Millikan determina la carga eléctrica del electrón con su famoso experimento de la gota de aceite qe =1,602·10-19 C ¡Casi 2000 veces más pequeña que el menor de los átomos (hidrógeno)! me =1,602·10-19 C/1,759·1011 C/kg= =9,107·10-31 kg Robert Andrews Millikan (1868-1953) Físico norteamericano El modelo atómico de Thomson En 1904 Joseph John Thomson habla de un nuevo modelo atómico • El átomo es como una esfera maciza y uniforme en la que se encuentra toda la carga positiva. • Los electrones se encuentran incrustados en ella compensando la carga. • Los iones negativos se forman al adicionarse más electrones. • Los iones positivos se forman al perderse electrones. J.J. Thomson (1856-1940) Físico británico El descubrimiento del protón En 1886 Eugen Goldstein descubre los rayos canales, para ello utilizó un tubo de descarga con el cátodo perforado por un pequeño orificio o “canal”. • • Mediante estudios sobre su comportamiento en campos eléctricos y magnéticos se demostró que estos rayos canales estaban formados por partículas cargadas positivamente y que eran características del gas encerrado en el tubo de descarga. La partícula de menor masa (gas hidrógeno) tenía una carga igual a la del electrón pero positiva, y una masa unas 2000 veces mayor. Carga Masa Protón +1,6·10-19C 1,67·10-27kg Electrón -1,6·10-19C 9,11·10-31kg Eugen Goldstein (1850-1931) Físico alemán H → H + + 1e − El modelo atómico de Rutherford Ernest Rutherford (1871-1937) Químico y físico británico Hans Wilhelm Geiger Ernest Marsden El modelo atómico de Rutherford 1911 El modelo atómico de Rutherford En 1911 Ernest Rutherford plantea un modelo planetario del átomo: • El átomo está formado por el núcleo, situado en su centro, muy pequeño en comparación con el tamaño del átomo y que contiene toda la carga positiva y casi toda la masa del mismo. Contiene todos los protones del átomo • Cuenta también con una corteza, donde se sitúan los electrones, que giran alrededor del núcleo en órbitas circulares (a modo de planetas alrededor de su estrella). • Existen tantos electrones en la corteza como protones en el núcleo cuando el átomo no está ionizado. • Los electrones se sitúan muy alejados del núcleo, de manera que casi todo el espacio del átomo está vacío El descubrimiento del neutrón En 1920 Rutherford sugiere la existencia de un tercer tipo de partícula, con masa parecida a la del protón y sin carga, a la que propuso llamarle neutrón y que permitiría explicar los cálculos realizados sobre la estabilidad del núcleo. El neutrón fue identificado por primera vez, en 1932 por James Chadwick estudiando los resultados de los experimentos realizados por los esposos Joliot-Curie, que habían producido un tipo de radiación, al producirse la interacción de partículas alfa con núcleos de berilio. Carga Masa Protón +1,6·10-19C 1,67·10-27kg Electrón -1,6·10-19C 9,11·10-31kg Neutrón 0 1,67·10-27kg 9 4 Be + 24 He → 126 C + 01n James Chadwick (1891-1974) Físico británico Números atómico y másico Se define el número atómico (Z) como el número de protones que tiene un átomo. Expresa pues la carga positiva del mismo. • Todos los átomos de un mismo elemento químico tienen el mismo número atómico. • Si el átomo es neutro el número atómico también coincide con el número de electrones que posee. • Si se trata de un catión el número de electrones coincide con el número atómico menos la carga del ion. • Si se trata de un anión el número de electrones coincide con el número atómico más la carga del ion. Elemento o ion Z A Nº electrones Nº protones Nº neutrones Na 11 23 11 11 12 Na+ 11 23 10 11 12 Cl 17 37 17 17 20 Cl- 17 37 18 17 20 Se define el número másico (A) como el número de protones y neutrones (nucleones) que tiene un átomo en su núcleo. Expresa pues la casi totalidad de la masa del mismo. A = Z + n º neutrones A Z X • No todos los átomos de un elemento químico tienen porqué tener el mismo número de neutrones, por tanto su número atómico puede variar. • El núcleo de un átomo se representa con el símbolo del elemento al que pertenece e indicando su número atómico como subíndice y su número másico como superíndice. Isótopos Se denominan isótopos a aquellos átomos que, perteneciendo al mismo elemento, tienen diferente número másico, es decir, son aquellos que tienen el mismo número atómico y difieren en su número másico. • La mayoría de los elementos están formados por mezclas isotópicas de dos o más isótopos. • La masa atómica de un elemento es la media ponderada de las masas atómicas de sus isótopos. • Las masas de los isótopos son algo más que pequeñas que sus números atómicos porque se produce una pérdida de masa, liberada en forma de energía, en la formación del núcleo. Elemento C O Isótopo Abundancia Masa atómica C12 98,93% 12,000000000 C13 1,07% 13,003354000 C14 10-10% 14,003241982 O16 99,757% 15,99491463 O17 0,038% 16,9991312 O18 0,205% 17,9991603 Masa atómica 12,0107 15,9994 M at = A1M at1 + A2 M at2 + ... + An M atn M atO = 0,99757·15,99491463u + 0,00038·16,9991312u +0,00205·17,9991603u = 15,9994u Un elemento químico es una sustancia pura formada por átomos que tienen el mismo número atómico. La radiación del cuerpo negro • A la radiación emitida por un cuerpo debido a su temperatura se le denomina radiación térmica. • Todos los cuerpos emiten radiación térmica y al mismo tiempo la absorben de otros de sus inmediaciones. • Cuando se alcanza el equilibrio térmico las velocidades de emisión y absorción se igualan. • La materia en estado condensado (sólido y líquido) emiten radiación de todas las frecuencias del espectro, pero dependiendo de la temperatura y de la sustancia en sí emite más en unas frecuencias que en otras. El hierro emite principalmente en la frecuencia del rojo cuando su temperatura es próxima a la de fusión • Los cuerpos a temperatura ordinaria se ven por la luz que reflejan y no por la que emiten, pero a temperaturas altas se vuelven auto-luminosos. La radiación del cuerpo negro • La radiación térmica es mayor cuanto mayor sea la temperatura, además la frecuencia de emisión más intensa cambia con ésta (Esta relación se utiliza en los radiotelescopios para medir la temperatura de las estrellas) • Los cuerpos negros son aquellos que absorben todas las frecuencias de la radiación térmica que reciben (se ven negros) • El espectro de emisión depende del cuerpo que emite, pero en los llamados cuerpos negros no depende del material de que estén hechos La radiación del cuerpo negro 1900 Resultados obtenidos a partir de las consideraciones clásicas de emisión continua de energía (Rayleigh y Jeans) Resultados obtenidos a partir de las consideraciones cuánticas de Planck que supone emisión de cuantos energéticos donde h = 6.63·10-34 Js es la constante de Planck, n es un número entero y ν es la frecuencia correspondiente al respectivo modo. Véase aquí la radiación del cuerpo negro para distintas temperaturas Hipótesis de Planck En 1900 Max Planck formula la primera explicación satisfactoria del espectro de radiación del cuerpo negro • Admite que la materia está formada por un gran número de partículas que oscilan, emitiendo cada una de ellas energía en forma de ondas electromagnéticas. • Postula que esas partículas no emiten cualquier valor de energía sino cuantos de la misma de valor hν, donde h=6,6256·10-34 J·s y ν es la frecuencia de la radiación emitida • El número de osciladores a baja frecuencia es muy superior al de osciladores a alta frecuencia. E = h ⋅ν Cuanto de energía de frecuencia ν Constante de Planck h = 6,6256·10-34 J·s Max Planck (1858-1947) Físico alemán La radiación electromagnética La radiación electromagnética es una forma de transmisión de energía en la que campos eléctricos y magnéticos se propagan mediante ondas a través del espacio vacío o de un medio. Su origen está en la aceleración de una partícula cargada. La longitud de onda es la distancia que separa a un punto del siguiente que se encuentra en su mismo estado de vibración La radiación electromagnética • La luz visible es solo una de las muchas formas de radiación electromagnética. • Las ondas de radio, TV, calor, rayos ultravioletas o rayos X, son también radiaciones electromagnéticas, que difieren en su longitud de onda. • Todas estas ondas radian según la teoría electromagnética de Maxwell. • Las ondas electromagnéticas viajan todas a la misma velocidad. Así, en el vacío su velocidad es la velocidad de la luz, c=3·108m/s. • Como en toda onda, se cumple la relación v=λν. Frecuencia v = λυ Velocidad de propagación Longitud de onda El espectro electromagnético El espectro electromagnético es el conjunto de la radiación electromagnética de todas las longitudes de onda. El espectro electromagnético no tiene una frecuencia máxima o mínima, sino que se extiende indefinidamente, más allá de los estrechos límites de sensibilidad del ojo humano. En orden creciente de frecuencias (y por tanto, de energía) el espectro está compuesto por las ondas de radio, ondas de TV, microondas, el infrarrojo, la luz visible, el ultravioleta, los rayos X y los rayos gamma. El espectro electromagnético El efecto fotoeléctrico El efecto fotoeléctrico fue descubierto por Heinrich Hertz en 1887 Heinrich Hertz (1857-1894) Físico alemán El efecto fotoeléctrico consiste en la obtención de una corriente eléctrica mediante la iluminación de un metal El efecto fotoeléctrico ¿Será mayor la energía de los electrones liberados cuanto mayor sea la intensidad de iluminación? ¿Será entonces mayor el número de electrones liberados cuanto mayor sea la intensidad de iluminación? Si eso es así el voltaje de parada, V0, sería más negativo para intensidades luminosas mayores Si eso es así la intensidad de la corriente medida por el amperímetro aumentará con la intensidad luminosa Interesante Flash para comprender el efecto fotoeléctrico El efecto fotoeléctrico ¿Dependerá la velocidad de salida de los electrones de la frecuencia (color) de iluminación? Si eso es así el voltaje de parada, V0, sería más negativo para frecuencias mayores ¿Habrá una frecuencia por debajo de la cual no se produzca efecto fotoeléctrico? ¿De qué depende dicha frecuencia? Si eso es así por debajo de dicha frecuencia el voltaje de parada es nulo. El efecto fotoeléctrico Según la teoría clásica (electromagnetismo clásico de Maxwell): • La energía de los electrones emitidos debe ser tanto mayor cuanto mayor sea la intensidad luminosa (mayor amplitud de la onda electromagnética, es decir, mayor fuerza eléctrica aplicada al electrón) • La intensidad de corriente eléctrica debe depender de la intensidad luminosa (en esto coincide) • La energía de la onda no depende de la frecuencia (color) de la onda, sino de su amplitud, lo que no explica que los electrones reciban más energía cuando la frecuencia de la luz crece Albert Einstein (1879-1955) Físico norteamericano Según la interpretación de Einstein de 1905: • La radiación está compuesta de unos paquetes indivisibles de energía llamados fotones, con una energía que depende de la frecuencia de dicha radiación según la expresión E=hν • Cada fotón, al alcanzar la superficie del metal interacciona con un único electrón, el cual absorbe su energía Frecuencia umbral 1 hν = hν 0 + mv 2 2 Trabajo de extracción • La energía adquirida por el electrón se emplea en escaparse del metal (trabajo de extracción) y el resto en aumentar su energía cinética Planck habla de que la radiación electromagnética interacciona con la materia en forma de cuantos energéticos. Einstein habla de que la misma radiación electromagnética cuando viaja está constituida por esos cuantos a los que él denomina fotones. Espectros atómicos • La luz blanca se descompone haciéndola pasar por un prisma de vidrio. • El resultado se denomina espectro continuo de la luz blanca, y contiene todas las frecuencias (colores) visibles por el ojo. • Un espectro es el resultado del análisis de las distintas frecuencias que integran una radiación electromagnética compleja. Joseph von Fraunhofer (1787-1826) Óptico y físico bávaro • Los espectros se obtienen con un espectroscopio o espectrógrafo. Gustav Kirchhoff (1824-1887) Físico alemán Robert Bunsen (1811-1899) Químico alemán Espectros atómicos • Los espectros pueden ser de emisión, cuando se analiza la radiación procedente de una muestra excitada, o de absorción, cuando se analiza la radiación que ha atravesado la muestra, es decir, la no absorbida. • También pueden clasificarse en continuos: cuando proceden de muestras líquidas o sólidas; y en discontinuos. Éstos a su vez pueden ser de bandas, propios de los gases moleculares; o de líneas, correspondientes a los elementos en estado gaseoso. Espectro de emisión Espectro de absorción Aquí puedes ver los espectros de todos los elementos Aquí puedes ver los espectros de todos los elementos Espectros atómicos Espectro de absorción del H Espectro de emisión del H Espectro de absorción del He Espectro de emisión del He El espectro del hidrógeno 1885 SERIE DE BALMER ν = 1 1 = RH 2 − 2 λ 2 n 1 RH = 10967757, 6 m Johann Jakob Balmer (1825-1898) −1 Físico suizo Constante de Rydberg RESTO DE LAS SERIES DEL HIDRÓGENO Johannes Robert Rydberg (1854-1919) Físico sueco El espectro del hidrógeno Carga núcleo: +Ze Átomos hidrogenoides Carga electrónica: -e FÓRMULA DE LOS ESPECTROSCOPISTAS PARA ÁTOMOS HIDROGENOIDES ν = 1 1 = RH Z 2 2 − 2 λ n1 n2 1 Serie de Lyman n1=1 n2=2, 3, 4,… Ultravioleta Serie de Balmer n1=2 n2=3, 4, 5,… Visible Serie de Pashen n1=3 n2=4, 5, 6,… Serie de Brackett n1=4 n2=5, 6, 7,… Serie de Pfund n1=5 n2=6, 7, 8,… Infrarrojo El modelo atómico de Bohr Los postulados del modelo atómico de Bohr fueron publicados en 1913 y son: • Los electrones giran alrededor del núcleo en ciertas órbitas circulares estacionarias (no emiten energía) con una energía definida. Estas órbitas presentan estabilidad mecánica: Fe = Fc • El átomo sólo emite energía cuando un electrón cambia de una órbita a otra de menor energía; esta energía se emite en forma de un cuanto de radiación cuya energía, hν, es igual a la diferencia de energías entre ambas órbitas: (∆E=hν). Cuando el salto es el inverso esa energía es absorbida por el electrón • El electrón sólo puede girar en órbitas cuyo momento angular esté cuantizado en múltiplos enteros de h/2π: (m·v·r = n·h/2π = n·ћ) Niels Bohr (1885-1962) Físico danés El modelo atómico de Bohr Del primer postulado Fe=Fc mv 2 − Ze 2 =− r 4πε 0 r 2 [1] v=n En cuanto a la energía: nh 2π Del tercer postulado, mvr = 1 − Z ·e 2 E = E p + Ec = + mv 2 4·π ·ε 0 ·r 2 h 2π mr Operando, se obtiene: Ze 2 m·v = 4πε 0 r 2 De [1] h 2ε 0 n 2 n2 = a0 r= 2 eπ m Z Z 1 Z ·e 2 1 Z ·e 2 Z E=− · =− 2 4·π ·ε 0 ·r 2 4·π ·ε 0 a0 ·n 2 Ver constantes donde a0=0,52918 Ǻ es el radio de Bohr El valor de la energía depende de n, al que se le denomina número cuántico principal y por tanto Luego la energía correspondiente a la órbita n es: En = − Z ·e 1 · 8·π ·ε 0 ·a0 n 2 2 2 El número cuántico principal, n, determina el radio de las órbitas así como la energía de las mismas El modelo atómico de Bohr De acuerdo con el 2º postulado de donde 1 λ = E f − Ei h·c ∆E = E f − Ei = hν = h 1 1 e 2 ·Z 2 = − 8·π ·ε 0 ·a0 ·h·c ni 2 n f 2 c λ tomando e 2 ·Z 2 8·π ·ε 0 ·a0 ·h·c el valor de 109737,3 cm-1 sorprendentemente próximo al de la constante de Rydberg El modelo atómico de Bohr El modelo atómico de Bohr El modelo atómico de Bohr-Sommerfeld El modelo atómico de Bohr, a pesar de su éxito y gran aplicabilidad, se encontró muy pronto con dificultades: • Explica los espectros del hidrógeno y de los átomos hidrogenoides (un solo electrón) pero no los de los átomos 1 2 3 + multielectrónicos1 H , 1H , 1H , 2 He • El uso de espectroscopios de mayor poder resolutivo mostró la llamada estructura fina del espectro del hidrógeno. En realidad cada línea antes observada estaba constituida por un conjunto de líneas muy próximas (dobletes, tripletes, multipletes) • En 1896 Pieter Zeeman descubre nuevos desdoblamientos cuando el hidrógeno es sometido a un intenso campo magnético. Efecto Zeeman George Eugene Uhlenbeck (1900-1988) Físico hidú Arnold Sommerfeld (1868-1951) Físico alemán • En 1925, Uhlenbeck y Goudsmit observan otro desdoblamiento de las líneas de Zeeman. Efecto Zeeman anómalo Samuel Goudsmit (1902-1978) Físico germanonorteamericano Pieter Zeeman (1865-1943) Físico holandés El modelo atómico de Bohr-Sommerfeld El modelo atómico de Sommerfeld introduce un número mayor de cuatizaciones: • Introduce una corrección de masa finita (consideración de la masa reducida del sistema núcleo-electrón) • Permite que las órbitas puedan ser elípticas, y cuantiza las posibles formas de las mismas mediante el número cuántico azimutal, l, con valores comprendidos entre 0 y n-1 s =+1/2 • Para explicar el efecto Zeeman habla de orientaciones de las órbitas en el espacio, que están cuantizadas mediante el número cuántico ml, magnético, con valores entre –l,…,0,…+ l • Para explicar el efecto Zeeman anómalo introduce otro número cuántico de spin, ms, asociado al giro del electrón, y con dos posibles valores, +1/2, -1/2 s =-1/2 m=2 m=1 m=0 m=-1 m=2 m=1 m=0 m=-1 m=-2 m=-2 Campo magnético Dificultades del modelo Bohr-Sommerfeld A pesar de la compleja formulación del átomo de Sommerfeld y de sus aciertos en las ideas de cuantización, su aplicación en átomos multielectrónicos seguía siendo complicada y daba pobres resultados. Además el átomo de Bohr-Sommerfeld resultaba ser una mezcla, a veces aparentemente arbitraria, de Mecánica Clásica y de Mecánica Cuántica Werner Heisenberg (1901-1976) Físico alemán Erwin Schrödinger (1887-1961) Físico austríaco Hacia 1925 existían ya numerosas razones para pensar en abandonar la teoría de Bohr-Sommerfeld La solución a todas estas dificultades se obtiene con el desarrollo de un nuevo tipo de Mecánica, la llamada Mecánica Cuántica. Así, en 1925, dos jóvenes físicos, Werner Heisenberg y Erwin Schrödinger, de manera independiente, resolvieron magistralmente el problema de la constitución atómica creando una doctrina que fue ampliada y estructurada posteriormente por Born, Jordan y Dirac. Pascual Jordan (1902-1980) Físico alemán Paul Dirac (1902-1984) Físico británico Max Born (1882-1970) Físico alemán Los principios del modelo atómico actual Heisenberg Schrödinger MECÁNICA DE MATRICES MECÁNICA ONDULATORIA Hipótesis de Planck Principio de incertidumbre de Heisenberg Principio de dualidad onda-partícula de Louis de Broglie La dualidad onda-partícula Louis Víctor de Broglie (1892-1987) Físico francés En 1924 Louis Víctor de Broglie, a raíz de los resultados de Planck y Einstein habla de que la naturaleza dual de la materia • Según el duque de Broglie, la materia presenta unas veces su naturaleza ondulatoria y otras su naturaleza corpuscular h λ= mv Longitud de onda asociada Constante de Planck Velocidad de la partícula • De manera que toda partícula con masa lleva asociada una onda cuya lontigud de onda está determinada por la expresión de de Broglie Masa de la partícula La dualidad onda-partícula • En 1927 Davisson y Germer obtienen figuras de difracción de un haz de electrones, confirmando así la hipótesis de Broglie • La difracción de neutrones, protones, átomos de He, apoyan la idea de la dualidad • Inventos tan importantes como el microscopio electrónico tienen su base de funcionamiento en la dualidad onda-partícula Fotografía con microscópio electrónico de barrido de un linfocito T Diagrama de difracción de rayos X al pasar a través de una lámina de aluminio Joseph Davisson (1881-1958) Halbert Germer (1896-1971) Físicos estadounidenses Diagrama de difracción de electrones al pasar a través de una lámina de aluminio El principio de incertidumbre de Heisenberg En 1927 Heisenberg postula que cuando se realizan medidas simultáneas de dos variables que él denomina conjugadas, x e y, el aumento en la precisión en la medida de una de ellas afecta negativamente (disminuyendo) a la de la otra • La precisión o incertidumbre de la que habla Heisenberg no depende del instrumento de medida. En realidad, aunque el instrumento utilizado fuera infinitamente preciso, se seguiría cometiendo error en la medida de las variables conjugadas, de tal forma que el producto de sus incertidumbres siempre será mayor que la constante de Planck dividida por 4Π. Es la propia medida la que altera el sistema a medir haciendo imposible precisar la magnitud conjugada • Heisenberg establece como variables conjugas a la posición y la cantidad de movimiento de una partícula, así como a la energía y el tiempo ∆x·∆p ≥ Incertidumbre en la posición h 4·π Incertidumbre en la cantidad de movimiento Principios de la Mecánica Cuántica • El conocimiento del estado de un sistema en Mecáncia Cuántica implica siempre menos información que en Mecánica Clásica • La Mecáncia Cuántica de Schrödinger no es deducible. Se justifica a posteriori porque explica correctamente el comportamiento de los sistemas atómicos (también los macroscópicos) • Esta teoría cuántica se formula mediante postulados PRIMER POSTULADO El estado de un sistema está definido por una función de las coordenadas y del tiempo, Ψ(x,y,z,t), que se denomina función de onda o función de estado y que se describe como una amplitud de probabilidad La función valor absoluto de Ψ al cuadrado,│Ψ│2, es la densidad de probabilidad de encontrar el sistema de partículas en unas coordenadas del espacio TERCER POSTULADO La amplitud de probabilidad o función de onda de un sistema mecanocuántico, Ψ= Ψ (x,y,z,t) debe satisfacer la ecuación diferencial ⌢ ∂Ψ H Ψ − iℏ =0 ∂t ECUACIÓN DE SCHRÖDINGER DEPENDIENTE DEL TIEMPO SEGUNDO POSTULADO A cada variable dinámica u observable del sistema mecanocuántico le corresponde un operador lineal hermítico La Mecánica Cuántica en los átomos hidrogenoides La aplicación de la Mecánica Cuántica al átomo nos lleva a la siguiente ecuación de Schrödinger ℏ 2 ∂ 2ψ ∂ 2ψ ∂ 2ψ − + + 2µ ∂x 2 ∂y 2 ∂z 2 Ze 2 − 4πε r ψ = Eψ 0 Cuya resolución (realizada por Dirac) nos proporciona la función de onda Ψ cuyo producto |Ψ|2 representa la probabilidad de encontrar al electrón en una zona del espacio ψ n ,l ,m (r , θ , φ ) = Rn ,l (r )·χ l ,m (θ , φ ) l l Como se ve, esta función de onda depende de unos números cuánticos, n, l y ml. Dichas funciones se denominan orbitales atómicos y conforme los números cuánticos toman valores se obtienen las zonas donde podemos encontrar a los electrones que rodean al núcleo (orbitales). Estas funciones nos expresan la forma, energía, tamaño y orientación de los orbitales Algunas funciones asociadas de Laguerre o parte radial de la función de onda Resolución de la ecuación de Schrödinger n l Rn,l Función Z 2 a0 1 0 R1,0 2 0 R2,0 2 1 R2,1 3 0 R3,0 3 1 R3,1 1 Z 2 2 a0 3/ 2 1 Z 2 6 a0 1 Z 9 3 a0 3/ 2 1 Z 9 6 a0 3/ 2 e − Zr / a0 Zr − Zr / 2 a0 2 − e a 0 3/ 2 Zr − Zr / 2 a0 e a0 4 Zr 4Z 2 r 2 − Zr / 3a0 + e 6 − 2 a0 9a0 3/ 2 2Zr 2 Zr − Zr / 3a0 4 − e 3a0 3a0 Algunas funciones asociadas de Laguerre o parte radial de la función de onda Resolución de la ecuación de Schrödinger Algunas funciones de onda completas (orbitales) para el átomo de hidrógeno Resolución de la ecuación de Schrödinger n l ml 1 0 0 Función Ψn,l,ml Ψ 100 = Ψ 1s 1 1 π a0 3/ 2 3/ 2 2 0 0 Ψ 200 = Ψ 2s 2 1 0 Ψ 210 = Ψ 2pz 1 1 4 2π a0 3/ 2 1 1 4 2π a0 Ψ 211 = Ψ 2px 1 1 4 2π a0 2 1 -1 Ψ 21-1 = Ψ 2py 1 1 4 2π a0 2 1 1 3/ 2 3/ 2 e − r / a0 r − r / 2 a0 − 2 e a 0 r − r / 2 a0 e cos θ a0 r − r / 2 a0 e senθ cos φ a0 r − r / 2 a0 e senθ senφ a0 Algunas funciones de onda completas (orbitales) para el átomo de hidrógeno Resolución de la ecuación de Schrödinger n l ml 3 0 0 Ψ 300 = Ψ 3s 3 1 0 Ψ 310 = Ψ 3pz 3 1 -1 3 1 1 Función Ψn,l,ml 2 r r − r / 3a0 27 − 18 + 2 e a0 a0 3/ 2 2 1 r − r / 3a0 6 − cos θ e a0 81 π a0 1 1 81 3π a0 Ψ 31-1 = Ψ 3py Ψ 311 = Ψ 3px 3/ 2 2 1 81 π a0 3/ 2 2 1 81 π a0 r − r / 3a0 senθ cos φ 6 − e a 0 3/ 2 r − r / 3a0 − senθ senφ 6 e a 0 Algunas funciones de onda completas (orbitales) para el átomo de hidrógeno Resolución de la ecuación de Schrödinger n l 3 2 3 2 ml 0 1 3 2 -1 3 2 2 3 2 -2 Función Ψn,l,ml Ψ 320 = Ψ 3dz2 1 1 81 6π a0 3/ 2 2 r − r / 3a0 (3cos 2 θ − 1) e a0 3/ 2 Ψ 321 = Ψ 3dxz 2 1 81 π a0 r − r / 3a0 senθ cos θ cos φ e a 0 2 3/ 2 Ψ 32-1 = Ψ 3dyz 2 1 81 π a0 r − r / 3a0 senθ cos θ senφ e a 0 2 3/ 2 Ψ 322 = Ψ 3dx2-y2 1 1 81 π a0 r − r / 3a0 sen 2θ cos 2φ e a0 2 3/ 2 Ψ 32-2 = Ψ 3dxy 1 1 81 π a0 r − r / 3a0 sen 2θ sen2φ e a0 2 Algunas funciones de distribución radial de las funciones de onda del átomo de hidrógeno en función de la distancia al núcleo Resolución de la ecuación de Schrödinger Los orbitales atómicos Orbital 1s (1,0,0) Orbital 2s (2,0,0) Los orbitales atómicos Orbitales 2p Orbital 2py (2,1,-1) Orbital 2pz (2,1,0) Orbital 2px (2,1,+1) Los orbitales atómicos Orbitales 3d Orbital 3dx2-y2 (3,2,2) Orbital 3dxy (3,2,-2) Orbital 3dyz (3,2,-1) Orbital 3dxz (3,2,1) Orbital 3dz2 (3,2,0) Los orbitales atómicos Mueve los orbitales aquí Orbitales 4f (4,3,1) (4,3,-1) (4,3,3) (4,3,0) (4,3,3) (4,3,-1) (4,3,-2) (4,3,-3) (4,3,2) Los números cuánticos Número cuántico Principal Símbolo n Valores 1,2,3,4,5,… Significado Determina la energía del orbital Secundario o azimutal l Para cada n: 0,1,2,…,n-1 Determina parte de la energía del orbital y la forma del mismo Magnético ml Para cada l: -l,…,0,…+l Determina la orientación en el espacio De espín ms 1/2, -1/2 Relativo al giro del electrón sobre sí mismo Orbital Electrón Orbitales Capa K n 1 L 2 M 3 N 4 Orbital (3,2,1) 3dxy l 0 0 1 0 1 2 0 1 2 3 -1 -3 -2 -1 -1 -2 -2 -1 -1 -1 Electrón (3,2,1,+1/2) m 0 0 0 0 0 0 0 0 0 0 1 1 1 2 1 1 1 2 2 3 Tipo s s p s p d s p d f Representación 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f Nº electrones capa n=2n2 Energía orbital=f(n+l) Nº de electrones Nº 1 1 3 1 3 5 1 3 5 7 Orbitales 2 2 6 2 6 10 2 6 10 14 Capa 2 8 18 32 Diagrama de Möeller Constantes de Física atómica h = 6, 6256·10−34 J ·s ℏ = 1, 0545·10−34 J ·s e = 1, 602·10−19 C K = 8,9874·109 Nm 2 / C 2 me = 9,1091·10−31 kg m p = 1, 67252·10−27 kg R = 10967760m −1 1eV = 1, 6·10−19 J a0 = 5, 2917·10 −11 m = 0,53A