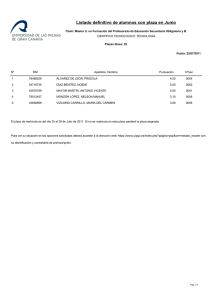
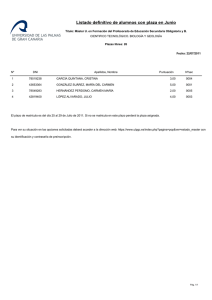
Efecto de cinco soluciones nutritivas vía fertigación sobre
Anuncio

Pontificia Universidad Católica de Valparaíso Fundación Isabel Caces de Brown Estación Experimental La Palma Casilla 4-D, Quillota-Chile Teléfonos 56-32-274501- 56-33-310524 Fax 56-32-274570, 56-33-313222 http://www.agronomia.ucv.cl TALLER DE LICENCIATURA EFECTO DE CINCO SOLUCIONES NUTRITIVAS VÍA FERTIGACIÓN SOBRE PARÁMETROS VEGETATIVOS Y REPRODUCTIVOS DE CEREZO (Prunus avium L). JAIME PINILLA OLIVARES. QUILLOTA CHILE 2006 INDICE 1. INTRODUCCIÓN ...................................................................................................1 1.1 Objetivo ..............................................................................................................3 2. REVISIÓN BIBLIOGRÁFICA..................................................................................4 2.1 Distribución en Chile .........................................................................................4 2.2 Descripción de la especie .................................................................................4 2.3 Botánica ............................................................................................................4 2.4 Características de la variedad Brooks...............................................................5 2.5 Crecimiento vegetativo......................................................................................6 2.5.1 Crecimiento longitudinal de brotes. ................................................................6 2.5.2 Crecimiento radial del brote ...........................................................................7 2.6 Nutrición. ...........................................................................................................8 2.6.1 Nitrógeno......................................................................................................8 2.6.2 Fósforo .........................................................................................................9 2.6.3 Potasio .......................................................................................................10 2.6.4 Magnesio....................................................................................................11 2.6.5 Zinc.............................................................................................................11 2.6.6 Boro............................................................................................................11 2.6.7 Hierro..........................................................................................................12 2.7 Fertigación.......................................................................................................12 2.7.1 La planta y la fertigación ............................................................................13 2.7.2 El cerezo y la fertigación. ...........................................................................14 3. MATERIAL Y MÉTODO .......................................................................................15 3.1 Ubicación y caracterización del huerto experimental ......................................15 3.2 Tratamientos ...................................................................................................15 3.3 Diseño experimental........................................................................................17 3.4 Mediciones. .....................................................................................................18 4. PRESENTACIÓN Y DISCUSIÓN DE RESULTADOS .........................................20 4.1 Efecto de la fertirrigación sobre crecimiento vegetativo..................................20 4.2 Efecto de la fertigación sobre parámetros reproductivos ................................27 5. CONCLUSIONES.................................................................................................33 6. RESUMEN ...........................................................................................................35 7. ABSTRACT ..........................................................................................................36 8. LITERATURA CITADA.........................................................................................37 1. INTRODUCCIÓN La fertilización es una de las labores culturales más importante en los cultivos de hoja caduca. Las exigencias nutricionales durante la formación de los árboles en sus primeras etapas, las producciones esperadas en los años previos a la plena producción y los requerimientos a través de los años varían. Factores tales como los sistemas de conducción, densidades de plantación, tipo de suelo y clima afectan dichos requerimientos. La necesidad de producir precozmente y a ritmo sostenido en el tiempo, requiere de la puesta a punto de la fertilización para cada situación en particular (SANCHEZ, 1999). La inadecuada dosificación y distribución de fertilizantes puede provocar varios efectos negativos. Es así como se pueden presentar daños sobre la calidad de la fruta, como por ejemplo el exceso de nitrógeno que disminuye la vida de poscosecha o el efecto del calcio sobre el problema de rajado en cerezas (HANSON y PROEBSTING, 1996). lixiviación de Además, la contaminación del ambiente por efecto de fertilizantes (DOMINGUEZ, 1993). que pueden llegar a las napas subterráneas Así mismo, se produce un deterioro de la economía del cultivo, al aumentar los costos de producción o por una disminución de los ingresos. Para evitar los efectos anteriores es necesario un planteamiento de racionalización de los aportes de fertilizantes a los cultivos (ROMAN, 2002). Experiencias realizadas en árboles manejados con la técnica de fertigación demuestran que es posible obtener respuestas optimizadas. Las modernas tecnologías de riego como es el riego localizado o de alta frecuencia, conjuntamente con la técnica de fertigación, que logra entregar uniformemente y de manera oportuna el fertilizante (ROMAN, 2002), permitirían mantener una relación más estrecha entre la nutrición mineral aplicada y los requerimientos del cultivo, según su estado fenológico, edad y condición fitosanitaria (DOMINGUEZ, 1993), además de un uso eficiente y no contaminante del agua. Las investigaciones acerca de los requerimientos nutricionales e hídricos en cerezo (Prunus avium L.) son escasas en comparación con otros frutales de hoja caduca. Esto exige realizar extrapolaciones de resultados obtenidos de ensayos en otros frutales para aplicarlos en cerezo, lo que sin duda no refleja sus necesidades específicas (SANCHEZ, 1999). De acuerdo a lo anterior, es necesario calibrar los requerimientos nutricionales del cerezo para cada condición, tomando en cuenta variables edafoclimáticas, fenológicas, fitosanitarias y productivas. Este hecho es aún más relevante cuando se utiliza la técnica de fertigación. La estimación de los requerimientos nutricionales específicos puede realizarse de dos formas. A través de la aplicación de los conocimientos obtenidos en estudios realizados en otros centros de producción de la especie y, eventualmente de otras especies, y por medio de experimentación local. Como se ha mencionado anteriormente, la respuesta de los árboles a tratamientos de fertigación puede variar substancialmente según las condiciones climáticas y edáficas en que éstos crecen. Las condiciones climáticas, particularmente del invierno (acumulación de horas frío) y de la primavera (temperatura y humedad ambiental), influyen en la determinación del momento de brotación, floración y cuaja, en la velocidad de crecimiento y en la de maduración. Por su parte, las condiciones del suelo afectan la disponibilidad local de nutrientes, en particular de los microelementos, el balance agua/aire, la capacidad de formación de raíces y otros. Consecuentemente, los estudios nutricionales desarrollados en otros centros productivos son difícilmente extrapolables a la condición local. La experimentación local realizada en sitios representativos de la zona productora o potencialmente productora, entregaría los resultados más confiables sobre el efecto de diversos niveles de fertilización vía fertigación, sobre los parámetros relevantes de crecimiento vegetativo y reproductivo. Esta investigación se enmarca en el proyecto FONDEF D021-1030 “Nuevas oportunidades para la producción intensiva y precoz de cerezas: Formulación y validación tecnológica en áreas con diferente acumulación de frío invernal.” 1.1 Objetivo Determinar el efecto de la aplicación de cinco concentraciones de una solución nutritiva (vía fertigación), sobre el crecimiento vegetativo y desarrollo reproductivo de árboles de cerezo de la variedad Brooks injertados sobre Maxma 14 en la localidad de Quillota. 2. REVISIÓN BIBLIOGRÁFICA 2.1 Distribución en Chile: Hasta el año 2004 en Chile existen alrededor de 7.100 ha de cerezo, ocupando desde la IV a la X región. La principal zona de cultivo se encuentra entre la VI y VII regiones con una superficie de 2.554 ha y 3.185 ha respectivamente (ODEPA, 2005). 2.2 Descripción de la especie: Los requerimientos de frío de esta especie son altos. Dependiendo de la variedad, el cerezo requiere entre 400 a 1500 horas de frío bajo 7 ºC (GIL, 2000). La misma fuente indica que cuando las precipitaciones toman valores próximos a 1200 mm/año es posible su cultivo, sin llevar a cabo riegos (esta situación no es conveniente para un huerto comercial), aunque el empleo de distintos patrones modifica los requerimientos hídricos, pudiendo cultivarse tanto en secano como en regadío. Cuando las precipitaciones son excesivas durante la maduración del fruto, se produce su agrietado al absorber humedad a mayor velocidad de la que se puede expandir (INFOAGRO, 2005). 2.3 Botánica: El cerezo dulce es un árbol de gran envergadura, que ocasionalmente puede llegar a los 20 m de altura. Las hojas son lanceoladas de unos 7,5 a 12,5 cm de longitud, presentan bordes dentados e irregulares. En la lámina están ubicadas unas glándulas son de color rojizo. Las flores completamente blancas, de aproximadamente 2,5 cm de diámetro. Estas son solitarias y se ubican en la axila de la madera del año anterior, o en grupos de más de cinco alrededor de una yema vegetativa llamada dardo, en madera vieja (WEBSTER, 1996). Los frutos de las especies silvestres son redondeados, de color rojo o negro, de tamaño pequeño, alrededor de 2 cm de diámetro (LOONEY y JACKSON, 1999). Normalmente en la parte aérea del árbol las yemas florales comienzan su actividad antes que las vegetativas, situación que puede verse alterada en algunas circunstancias (VALENZUELA, 1998). El crecimiento vegetativo se inicia en primavera (octubre) después de la floración. Las hojas nacen primero en los dardos y luego en los brotes laterales terminales. Asimismo los dardos detienen su crecimiento y definen su área foliar tempranamente, mientras los brotes terminales siguen hasta diciembre o enero, dependiendo de la edad, vigor y humedad del suelo (VALENZUELA, 1998). 2.4 Características de la variedad Brooks: La variedad Brooks fue originada en la Universidad de California (Davis), Estados Unidos, por el cruzamiento de Rainier y Early Burlat. Es un cultivar autoestéril, presenta un vigor medio a alto, con un hábito de crecimiento semi abierto y con una alta precocidad productiva (BARGIONI, 1996; CLAVERIE, 2002). Según lo indicado por CORTEZ (2002) la plena floración en Quillota ocurre el 13 de septiembre, y en Curicó el 14 de septiembre (JIL, 2002). Su fruto es de tamaño grande (28 mm de diámetro ecuatorial), reniforme, con un color de piel púrpura y pulpa rojo oscuro. Presenta un sabor muy bueno, firme, con poca resistencia a la partidura, de pedúnculo muy corto (CLAVERIE, 2002). 2.5 Crecimiento vegetativo: El crecimiento vegetativo puede ser longitudinal y radial en brotes y raíces y sólo radial en ramas y esqueleto de la raíz. De este modo cada año una planta incrementa la longitud a través de los brotes apicales de sus ramas, además del incremento de diámetro o grosor (COLETO, 1995; GIL, 2000). El ciclo anual de las plantas perennes de hoja caduca de clima templado incluye una gran actividad de crecimiento en la primavera, decreciendo en el verano y cesando hacia el otoño; cierra el ciclo un período de receso entre otoño e invierno (GILALBERT, 1996). 2.5.1 Crecimiento longitudinal de brotes: En un sentido amplio y estricto el crecimiento es el aumento irreversible en material vivo. Lo cual es el aumento irreversible en peso seco y fresco, en longitud, grosor, volumen, número o cantidad, entre otros (EVANS, 1972). Un brote consta de un ápice meristemático, generador de células (con una zona subapical de alargamiento celular), de un tallo con nudos (en los que se ubican hojas y yemas axilares, entrenudos y tejido como la epidermis), la corteza, el floema, el cambium, el xilema activo, el xilema inactivo (madera) y la médula central (GIL, 2000; AGUSTI, 2004). El crecimiento absoluto de brotes, es como en todo organismo multicelular; inicialmente exponencial y posteriormente polinómico cuadrático, formando una curva sigmoide. El primer crecimiento visible desde la brotación corresponde a la extensión de los entrenudos del brote preformado del año anterior en la yema (GIL, 2000). Desde un cierto momento el ápice indiferenciado de los brotes indeterminados comienza a producir nuevas células por división, hojas y yemas axilares, tallos con nudos y entrenudos a una tasa constante; las células se agrandan en el subapice, 2 a 5cm más abajo. Los entrenudos terminan de alargarse en un cierto tiempo que oscila entre 10 y 30 días (GIL, 2000). De este modo, el crecimiento se torna acelerado por la suma de la división y de la expansión celular. Su duración es variable según el vigor. Hasta este momento la velocidad depende de las condiciones nutritivas: reservas, agua, nuevos alimentos, y de las ambientales: temperatura, luz y fotoperíodo (COLETO, 1995; GIL 2000). Posteriormente la tasa de crecimiento decae y, finalmente, cesa, por fenómenos correlativos tales como competencia e inhibición relacionadas con hojas, engrosamiento del tallo, nuevos brotes anticipados, nuevos tejidos de rama, crecimiento de raíces y fruta, así como, por condiciones ambientales desfavorables como baja de temperatura y acortamiento de los días (COLETO, 1995). El crecimiento del brote tiene una relación directa con la orientación, es decir, con la fuerza de gravedad: mientras más vertical se encuentre el brote, mayor es su crecimiento, tanto por número de nudos generados, como por extensión de los entrenudos (SANCHEZ, 1999; AGUSTI, 2004). El crecimiento de brotes es muy sensible a la condición hídrica de la planta. Es máximo con plena disponibilidad de agua, generalmente cuando el suelo se encuentra a capacidad de campo, y se resiente con un potencial hídrico en tallo u hoja de -0.7 Mpa (GIL-ALBERT, 1996). 2.5.2 Crecimiento radial del brote El cambium es el tejido fundamental para el crecimiento radial o en grosor de brotes, ramas, tronco y raíz. Esta constituido por una capa de células meristemáticas conformando un anillo entre corteza y madera, la cual origina el floema hacia el exterior del brote y el xilema hacia el interior (BANNAN, 1962). La división celular en el cambium es periclinal para formar aditivamente las capas de células en el sentido radial y anticlinal, para producir más células en cada anillo del cambium y permitir el cierre de una circunferencia cada vez mayor. Solamente en las puntas de brotes o raíces, donde existe el procambium precursor, ocurre división transversal que produce células en dirección apical y basal para un crecimiento longitudinal (COLETO, 1995; GIL, 2000). El cambium permanece inactivo durante el invierno y se reactiva después que las yemas han salido de su letargo. El primer signo de la reactivación es un cambio de color tornándose translúcido y luego ocurre la división celular (EVERT, 1961). La actividad del cambium es dependiente de la actividad de yemas, de los ápices y de las hojas nuevas, pues no existe en ramas desyemadas o en receso, ni en brotes deshojados (COLETO, 1995). 2.6 Nutrición: 2.6.1 Nitrógeno Generalmente los suelos no aportan el nitrógeno necesario para satisfacer los requerimientos del cultivo, en cuyo caso los árboles presentan deficiencia de nitrógeno, bajo vigor y escasa productividad (SANCHEZ, 1999). Altas aplicaciones fuertes de nitrógeno raramente son tóxicas, pero se observa un excesivo vigor y crecimientos tarde en la temporada. Así aumenta el riesgo de daño que pudiese provocar una eventual helada, retraza la maduración, y debido al aumento de calibre, disminuye la firmeza de la fruta (HANSON y PROEBSTING, 1996). Las dosis de fertilización, dirigidas a mantener los niveles foliares adecuados, está influenciada por diversos factores, como es el portainjerto, las características fisicoquímicas del suelo, el aporte desde el suelo y el agua de riego, tenores de materia orgánica, entre otros. El nitrógeno presenta una respuesta favorable y lineal en frutales de carozo, debido a que el 50% del nitrógeno de la hoja está en la forma de la enzima ribulosa 1-5 bifosfato carboxilasa (rubisco), que es la encargada de tomar el CO2 desde el aire e incorporarlo a la planta (SANCHEZ, 1999). El nitrógeno es el elemento mineral más estrechamente relacionado con el crecimiento. Produciendo aumento con mayor concentración incluso hasta sobrepasar largamente el nivel crítico a tal punto que algunos investigadores lo denominan un regulador del crecimiento. La mayor parte del nitrógeno necesario para el primer crecimiento proviene de reservas y posteriormente de la absorción desde la solución del suelo. Se puede llegar a un crecimiento exorbitante de varios metros con amplia disponibilidad de agua, luz y nitrógeno, hasta que otro elemento se torne deficiente, comúnmente el potasio. Sin embargo, una provisión excesiva para ser metabolizada con los hidratos de carbono disponibles, puede ser depresiva e incluso tóxica, con clorosis de hojas y muerte de ápices, tejidos de hojas y tallos (COLETO, 1995, AGUSTI, 2004). 2.6.2 Fósforo Raramente los cerezos responden a aplicaciones de fósforo en condiciones de campo. Se cree que en plantaciones nuevas de cerezo aplicaciones de fósforo producen un crecimiento inicial más rápido, y que aplicaciones pequeñas de este mineral junto con el aporte desde el suelo, serian suficientes para mantener los niveles adecuados (HANSON y PROEBSTING, 1996). El fósforo participa en las reacciones de transferencia de energía a nivel celular, que es una función clave del metabolismo. Estructuralmente, forma parte de fosfolípidos y de los ácidos nucleicos (SANCHEZ, 1999). 2.6.3 Potasio Es uno de los nutrientes que se necesita en mayor cantidad, a pesar de no formar parte estructural de la planta. La principal función del potasio es mantener la turgencia de las células, a través de la apertura y cierre de los estomas (SANCHEZ, 1999). SANCHEZ (1999), indica que las deficiencias de potasio se observan primero en las hojas basales de la temporada, con bajo crecimiento en longitud de los brotes y tamaño de las hojas. Siendo más fuerte en árboles con mucha carga ya que los frutos acumulan altos niveles de potasio. Ademas un síntoma de deficiencia de potasio es una menor respuesta en crecimiento vegetativo y de fruto, debido a que las células necesitan estar turgentes para realizar la expansión célula (AGUIRREOLEA y SANCHEZ, 2000). Un accidente bastante típico en cerezos es el rajado de la fruta, conocido como “cracking”. Una relación nitrógeno/potasio demasiado elevada, acompañado de una estación lluviosa, favorece la aparición del rajado, por lo que el aporte conveniente de potasio en equilibrio con los otros elementos nutritivos, ayuda a evitarlo (SANCHEZ, 1999). El potasio, de los cuatro macronutrientes (N, P, K, Mg) es el que más directamente influye sobre la calidad del fruto (aproximadamente el 60% del potasio aplicado es absorbido por el fruto) aumentando el tamaño de la cereza y potenciando la resistencia a las plagas, la sequía y las heladas. (COMPO, 2005) Aplicaciones al suelo de entre 100 a 200 kg de K2O/ha/año y aplicaciones foliares de KNO3 después de floración son efectivos (HANSON y PROEBSTING, 1996). 2.6.4 Magnesio El magnesio, componente principal de la molécula de clorofila, interviene directamente en el desarrollo, ya que la clorofila es la responsable de realizar la transformación de los nutrientes absorbidos en materia vegetal (COMPO, 2005). SANCHEZ (1999), indica que alrededor del 20% del total de magnesio se encuentra en los cloroplastos, formando parte de la clorofila y como activador de la enzima rubisco. El resto del magnesio se encuentra como ión libre, participando en el transporte de azúcares. 2.6.5 Zinc El zinc forma parte de las enzimas anhidrasa carbónica y superóxido dismutasa, participando en el metabolismo de las proteínas. Además se piensa que participa en la síntesis de ácido indolacético, siendo un elemento clave en la nutrición mineral de los frutales (SANCHEZ, 1999). Deficiencias de zinc provocan una porción de la hoja quemada uniforme en todo el árbol, lo que se observa en suelos con pH relativamente altos, además detiene la elongación de los entrenudos (GIL, 2000). Las deficiencias son corregidas usualmente con aplicaciones foliares o al suelo con sulfato de zinc o compuestos quelatados (HANSON y PROEBSTING, 1996). 2.6.6 Boro El boro tiene participación en la síntesis de uracilo y en el metabolismo de azúcares, también mejora el metabolismo del calcio en la planta, estabilizando la pared celular (SANCHEZ, 1999). El boro presenta una influencia benéfica en la germinación del grano de polen, y la elongación del tubo polínico, por lo que los ramilletes florales son altamente demandantes de boro durante el período de floración. Aplicaciones foliares o al suelo pueden ser utilizadas para corregir deficiencias; basta con aplicaciones de 1 a 2 kg/ha de boro y un programa de manutención que considere 0.5 a 1 kg/ha de boro (HANSON y PROEBSTING, 1996). Los cerezos son relativamente sensibles a excesos de boro, produciendo muerte de ramilletes con exudación de goma (HANSON y PROEBSTING, 1996). 2.6.7 Hierro Una forma de mejorar la disponibilidad de hierro en el suelo es acidificándolo con enmiendas orgánicas o aplicación de ácido por el sistema de riego. Esto se debe a que el hierro se inmoviliza con pH alto, incrementando tal efecto con mal drenaje. Las deficiencias de hierro ocurren periódicamente en cerezos, no existiendo una buena relación con los niveles foliares. Aplicaciones al suelo de fertilizantes que contengan hierro, no son medidas correctivas efectivas (HANSON y PROEBSTING, 1996). 2.7 Fertigación: Corresponde a la aplicación de los fertilizantes, es decir de los elementos nutritivos que requieren los cultivos, junto con el agua de riego. Este método aprovecha el sistema de riego para la distribución de los elementos nutritivos. El vehículo es entonces el agua, encontrándose los elementos disueltos en ella, por lo que reduce en mayor o menor medida, el papel del suelo como suministro de los elementos nutricionales. Al ser utilizada el agua de riego se hace imprescindible tener una eficiente y uniforme aplicación de ésta, por lo cual, la fertigación se ve asociada solamente a riegos localizados de alta frecuencia, como es el caso de los goteros, cintas de exudación, microaspersor, entre otros (DOMINGUEZ, 1993). 2.7.1 La planta y fertigación Las raíces son el órgano de la planta encargado de la incorporación de agua y nutrientes desde el suelo, por esto las raíces cuentan con las enzimas necesarias, estructura física y coordinación con los sistemas de transporte para realizar la absorción. Un sistema de raíces abundante, vigoroso y sano presenta una absorción eficiente de agua y nutrientes, cumpliendo el primer objetivo del manejo agronómico nutricional. El desarrollo de raíces se debe promover mediante los sistemas de riego y fertilización, y aún mayormente en fertigación, dado el menor volumen de suelo que abarcan las raíces (ROMAN, 2002). Se debe tener en cuenta que las raíces van evolucionando, encontrándose en primer lugar pelos radiculares o radicales absorbentes, con un tamaño aproximado de 1-10 mm, los cuales absorben agua y nutrientes. Estas presentan un color blanquecino y poseen un período de absorción de nutrientes de 20-25 días, siendo las únicas que realizan esta función. Luego se encuentran las raíces suberizadas que presentan un grosor de 1-10 cm, teniendo como función absorber agua y algo de sostén; se distinguen por tener un color café claro. Por último, se encuentran las raíces primarias lignificadas con una longitud de 10-100 cm, presentando un color café oscuro. Estas cumplen la función de sujeción del árbol al suelo. Se debe tener en cuenta que una abundante cantidad de raicillas blancas indican un desarrollo radicular adecuado y por ende un buen suministro de agua y nutrientes (ROMAN, 2002). Para favorecer el desarrollo de las raíces, se puede utilizar la vía química, realizando una fertilización adecuada, lavando sales, evitando la acidificación del suelo e incorporando materia orgánica; o por la vía física, en donde se puede realizar una adecuada preparación del suelo, buen drenaje, evitar la compactación o realizando camellones (ROMAN, 2002). Un huerto frutal manejado tradicionalmente en cuanto a riego y nutrición presenta un muy abundante volumen radicular para absorber, en cambio en un sistema en donde se utiliza fertigación el volumen radicular para absorber se reduce notablemente llegando a ser medio-bajo a escaso, lo cual aumenta la dependencia del riego y la fertilización (ROMAN, 2002). La relación entre la nutrición vegetal y el desarrollo se rige por la ley del factor limitante, la que indica que la producción potencial de un huerto no podrá ser superada, por la que permita el nutriente que se encuentre como limitante (ROMAN, 2002). 2.7.2 El cerezo y la fertigación. Los frutales de carozo, como el ciruelo, damasco y cerezo, tienen como característica común tener un período desde floración a cosecha muy corto, siendo considerado como un factor crítico (DOMINGUEZ, 1993). El período más crítico en cuanto a suministro de nutrientes y riego, comprende desde endurecimiento del carozo hasta la recolección de la fruta (DOMINGUEZ, 1993). 3. MATERIAL Y MÉTODO 3.1 Ubicación y caracterización del huerto experimental: La investigación se realizó en la Estación Experimental La Palma de la Pontificia Universidad Católica de Valparaíso, ubicada en el sector La Palma, en la provincia de Quillota, V Región, Chile. marino. La zona presenta un clima de tipo mediterráneo Este se caracteriza por una temperatura media anual de 15.3 ºC, una máxima media anual de 27 ºC (enero) y una mínima media de 5.5 ºC (julio). Anualmente se acumulan 3700 grados-día (base 5 ºC) y 1900 grados-día (base 10ºC). El período libre de heladas se presenta desde septiembre a mayo y entre marzo y noviembre se acumulan 500 horas frío (HF). La precipitación anual es de 437 mm, y la evaporación potencial anual alcanza a 1361 mm, con un máximo en enero de 7.1 mm/día. La estación seca consta de ocho meses. (NOVOA et al., 1989). El ensayo se realizó en una plantación de cerezos (Prunus avium L.) cv. Brooks, sobre patrón Maxma 14, plantados en 2003, conducido en eje central con manejo de solaxe. Las plantas están espaciadas a 5 m entre hilera y 2 m sobre hilera. Los árboles en estudio pertenecen al sector tres de riego del huerto experimental, el cual posee 280 árboles. El área del huerto corresponde a un suelo aluvial franco arenoso. El sistema de riego por goteo es de ocho emisores/planta de 4 l/h que generan una precipitación de 3.2 mm/h. 3.2 Tratamientos: Los tratamientos corresponden a cinco concentraciones de una solución madre de fertilizante, aplicados vía fertigación (Cuadro 1). Cuadro 1. Tratamientos de fertigación aplicados a cerezos cv. Brooks. Código Tratamiento T0 T1 T2 T3 T4 Control. Sin fertilizante (solo agua) 100% solución nutritiva 50% solución nutritiva 200% solución nutritiva Solo fertilización nitrogenada, equivalente a N del T1 (100%). El plan de fertilización para la temporada 2004-2005 (control en Anexo 1) se presenta en el Cuadro 2. Cuadro 2. Dosis de nutrientes aplicados al tratamiento 100% (T1), durante la temporada 2004/05. Elemento N P K Mg Zn Unidades/ha 60,0 15,0 60,0 7,5 7,5 El plan de fertilización para la temporada 2005-2006 (control en Anexo 2) se presenta en el Cuadro 3. Cuadro 3. Dosis de nutrientes aplicados al tratamiento 100% (T1), durante la temporada 2005/06. Elemento N P K Mg Zn Unidades/ha 150,0 30,0 100,0 20,0 20,0 Todas las plantas fueron regadas por igual de acuerdo a la demanda diaria estimada a base de la evapotranspiración potencial según Penman-Monteith, a partir de datos de una estación meteorológica automática ubicada en la cercanía del huerto (Anexo 3). 3.3 Diseño experimental: En el ensayo se aplicó un diseño en bloques completamente al azar (BCA), con cinco tratamientos y tres repeticiones. La variable de bloqueo correspondió a la distancia de los árboles respecto de un canal cercano. La unidad experimental consta de tres árboles contiguos, que recibieron el mismo tratamiento, de los cuales se seleccionó el del centro para realizar las mediciones. En total se utilizaron 45 árboles (Figura 1). Se utilizó el test de Tukey (α = 0.05) para la separación de medias. 1 Bloque Nº Árbol 2 9 10 11 12 13 37 38 39 40 41 TRAT. Nº Árbol TRAT. 15 16 42 43 44 0 TRAT. Nº Árbol 14 4 60 61 3 63 64 1 17 18 19 20 21 22 45 46 47 48 49 50 3 2 62 3 66 67 24 25 51 52 53 1 1 65 23 4 68 0 69 70 2 3 2 71 72 73 26 54 4 74 75 76 77 0 FIGURA 1. Esquema de distribución en el campo experimental de los tratamientos de fertigación en cerezos cv. Brooks. 3.4 Mediciones: En el árbol central de cada unidad experimental, se seleccionaron cuatro ramas de similar vigor, dos orientadas hacia el norte y dos hacia el sur. Semanalmente se midió el crecimiento apical y mensualmente el diámetro basal. Además se midió el número de flores y el número de frutos a cosecha. Al fin de la temporada (febrero) se cuantificó el número de nudos formados. La caracterización del crecimiento vegetativo además consideró la medición mensual del diámetro de tronco, el cual fue medido 15 cm sobre la línea del injerto con cinta de medir. El desarrollo reproductivo se evaluó a base de la producción de fruta. Se cosechó, individualmente, la fruta de cada árbol (kg/árbol), la cual se efectuó en paralelo con la del resto del huerto. Además se realizó un submuestreo al azar de 25 frutos por árbol, en los cuales se evaluó: calibre, incidencia de “cracking”, daño por pájaros y sólidos solubles (ºBrix). El calibre de la fruta fue distribuido en categorías A, B, C, D, E y F (Cuadro 4), Con el fin de simplificar el análisis se agruparon las categorías en tres: fruta grande (A + B), fruta media (C + D) y fruta pequeña (E + F). CUADRO 4. Categorización de calibre de frutos de cerezo cv. Brooks Diámetro ecuatorial (mm) >30 28-30 26-28 24-26 22-24 <22 Categoría Grupo A B C D E F Grande Grande Media Media Pequeña Pequeña 4. PRESENTACION Y DISCUSIÓN DE RESULTADOS 4.1 Efecto de la fertigación sobre crecimiento vegetativo: El crecimiento vegetativo de los árboles fue evaluado en la temporada a través de las siguientes mediciones: crecimiento apical de brotes laterales (CABL), diámetro basal de brotes laterales (DBBL), diámetro de tronco (DTR) y número de nudos del brote lateral (NNBL). Dichas mediciones se pueden observar en los Anexos 4, 5, 6 y 7, respectivamente. Realizados los análisis estadísticos correspondientes (Bloques Completos al Azar y separación de medias por Tukey con α = 0.05) se determinó que DBBL y DTR no presentaron diferencias entre los tratamientos (Figuras 2 y 3). El efecto anterior sugiere que estas variables no son sensibles a los cambios en fertigación, al menos en la etapa juvenil de los árboles de cerezo. Esto coincide con lo observado por LAYNE et al., (1996) en duraznero, que sólo encontró diferencias para estas variables a partir del cuarto año. MOSRE (1991) no obtuvo diferencias en diámetro final del injerto en vid, con aplicaciones de 200 kg de nitrógeno respecto del tratamiento control, sin aplicación. Por su parte, CIFUENTES (1996) no encontró diferencias en diámetro de tronco en duraznero y ciruelo ante aplicaciones de diversas dosis de N en distintas épocas. Las variables crecimiento apical de brotes laterales (CABL) y número de nudos del brote lateral (NNBL) presentaron diferencias a partir de mediados del mes de noviembre. En el caso de CABL el tratamiento T3 (200%) creció a una tasa mayor que los restantes, los que a su vez no presentaron diferencias entre ellos (Figura 4). La variable NNBL por su parte, muestra que el T3 (200%) presenta un número de nudos por metro lineal de brote menor que T0 (0%) y T4 (sólo N), es decir mayor vigor (SANCHEZ 1999, GIL 2002, AGUSTI 2004). Por su parte los tratamientos T1 (100%) y T2 (50%) se encuentran en una situación intermedia ya que no se diferencian de T0 o T4 respectivamente (Figura 5). 3,00 T0 T1 2,75 T2 Diametro basal de rama (cm) T3 T4 2,50 2,25 2,00 1,75 1,50 1,25 Jun Jul Ago 2005 Sep Oct Nov Dic Ene Feb 2006 FIGURA 2. Evolución del diámetro basal de brote lateral de árboles con distinto nivel de fertilización aplicado vía fertigación durante la temporada. 9,00 T0 8,50 T1 T2 T3 Diametro de tronco (cm) 8,00 T4 7,50 7,00 6,50 6,00 5,50 5,00 Jun Jul Ago 2005 Sep Oct Nov Dic Ene Feb 2006 FIGURA 3: Evolución del diámetro de tronco de árboles con distinto nivel de fertilización aplicado vía fertigación durante la temporada de crecimiento. 70,0 T0 T1 Crecimiento apical de brotes laterales (cm) 60,0 T2 T3 T4 50,0 40,0 30,0 20,0 10,0 0,0 Ago Sep Oct 2005 Nov Dic Ene Feb 2006 FIGURA 4: Evolución del crecimiento apical de brotes laterales de árboles con distinto nivel de fertilización aplicado vía fertigación durante la temporada de crecimiento. 58 Nudos del brote lateral formados(Nudos/metro) 56 b b 54 52 ab ab 50 48 a 46 44 42 40 T0 T1 T2 T3 T4 Tratamiento FIGURA 5: Número de nudos del brote lateral formados por metro lineal de rama en árboles con distinto nivel de fertilización aplicado vía fertigación. Los resultados de crecimiento vegetativo observados en el presente estudio en general coinciden con los de otros autores. GONZALEZ (2002), obtuvo 23% de incremento en el crecimiento de ramilla en palto con el tratamiento de fertigación con N, P, K, Ca, Mg, B y Zn, respecto de una fertilización tradicional con nitrógeno (urea), boro y zinc. Por su parte LOPEZ (1997), obtuvo en ramillas de naranjos que el tratamiento con 100% de agua más fertigación mostró los mayores crecimientos, efecto que él atribuye a que el agua y nutrientes aportados contribuyen, determinantemente a la elongación celular. MOLINA (2004) trabajando con chirimoyos consiguió diferencias al hacer aplicaciones de 150% de fertigación, las que no mostraron a su vez diferencias respecto de 200% de fertigación. WHITING et al. (2005), demostraron, en ensayos de portainjertos, que el área de tronco es un buen indicador del vigor de la planta de cerezo. En injertos sobre Gisela 5, Gisela 6 y Mazzard, observaron diferencias a partir del segundo año de plantación. Por otra parte, indican que el vigor de la planta esta mayormente influenciado por el portainjerto y no tanto por los manejos agronómicos. Según GIL (2002), las plantas que reciben mucho N respiran aceleradamente, aumentan el tenor de citoquininas en la savia del xilema, disminuyen el contenido de ABA, brotan abundantemente, crecen vigorosamente, retardan la senectud de hojas y el letargo de yemas y magnifican las carencias de otros elementos. Sólo se presenta como contradictorio con estos resultados lo señalado por MOSRE (1991) en vid, que no obtuvo diferencias en crecimiento vegetativo y, lo que indican NIELSEN, NIELSEN y KAPPEL (2002), que obtuvieron el mayor crecimiento de área de tronco en plantas de cerezo fertigadas con bajo nivel de nitrógeno. Consecuentemente y desde el punto de vista del crecimiento vegetativo en los primeros años de formación del árbol, sería el tratamiento T3 el que provoca el crecimiento más vigoroso (NNBL) y de mayor longitud (CABL) y por tanto, el más conveniente para lograr una adecuada estructuración de los árboles en breve plazo. 4.2 Efecto de la fertigación sobre parámetros reproductivos: Se evaluó las siguientes variables con el objeto de definir algunos parámetros reproductivos: cuaja (CJ), producción (P), sólidos solubles (SS), calibre (CL) y “cracking” (CK), las variables CJ, P, SS y CK se pueden observar en Anexo 8, la variable CL se puede observar en Anexo 9. De éstos P, SS y CL no mostraron diferencias como consecuencia de la aplicación de los tratamientos de fertigación (Figuras 6, 7 y 8). Este efecto puede deberse a que se trata de árboles jóvenes que están en etapa de producción incipiente. CJ y CK presentan diferencias entre algunos de los tratamientos. Respecto de cuaja (CJ) se observó que el tratamiento T0 (0%) presenta una clara diferencia con T1 (100%) y que en una zona intermedia se encuentran T2 (50%), T3 (200%) y T4 (sólo N) (Figura 9). Por su parte el mayor valor para la variable “cracking” corresponde al tratamiento T3 (200%) y los menores a los tratamientos T0 (0%) y T1 (100%), encontrándose en una zona intermedia los correspondientes a T2 (50%) y T4 (sólo N) (Figura 10). Este efecto puede estar relacionado con un exceso de N y/o un inapropiado balance de nutrientes. 1100 Producción total 1000 Producción exportable Producción de fruta (kg/ha) 900 800 700 600 500 400 300 200 100 0 T0 T1 T2 T3 T4 Tratamiento FIGURA 6: Producción total y exportable de fruta en kilogramos/hectárea en árboles de cerezo en su tercera hoja con distinto nivel de fertilización aplicado vía fertigación. 24 21 Solidos solubles (º Brix) 18 15 12 9 6 3 0 T0 T1 T2 T3 T4 Tratamiento FIGURA 7. Contenido de sólidos solubles (ºBrix) en frutos de cereza cv. Brooks con distintos niveles de fertilizante aplicado vía fertigación. 100% 90% Porcentaje de fruta por categoría 80% 70% 60% EF CD AB 50% 40% 30% 20% 10% 0% T0 T1 T2 T3 T4 Tratamiento FIGURA 8. Distribución de calibre de fruta de cerezas cv. Brooks (%) proveniente de árboles con distinto nivel de fertilización aplicado vía fertigación 30,00 b 25,00 ab Cuaja final (%) 20,00 ab ab 15,00 10,00 a 5,00 0,00 T0 T1 T2 T3 T4 Tratamiento FIGURA 9. Cuaja (%) en árboles de cerezo cv. Brooks con distinto nivel de fertilización aplicado vía fertigación. 30 c bc 25 "Cracking" (%) 20 ab 15 a 10 a 5 0 T0 T1 T2 T3 T4 Tratamiento FIGURA 10. Rajadura de frutas o “cracking” (%) en árboles de cerezo cv. Brooks con distinto nivel de fertilización aplicado vía fertigación. 5. CONCLUSIONES De acuerdo a las variables estudiadas, se puede concluir acerca del desarrollo vegetativo lo siguiente: Los mejores indicadores de vigor fueron crecimiento apical del brote y número de nudos del brote lateral. En la etapa maduro joven de árboles de cerezo, tanto el diámetro de tronco como el diámetro de rama lateral son sensibles al efecto de distintos niveles de fertilizantes aplicados vía fertigación. El mejor efecto del crecimiento vegetativo se logró con aplicaciones de 200% de la fertilización programada (T3), por lo que sería este tratamiento el más conveniente para lograr una adecuada estructuración de los árboles en el plazo más breve posible. De las variables reproductivas se puede concluir lo siguiente: En la etapa maduro joven de los árboles de cerezo, que tienen una producción incipiente de fruta, no se ve afectada la producción (P), los sólidos solubles (SS) al igual que el calibre (CL), de los árboles tratados con distinto nivel de fertilización vía fertigación. El mejor efecto en cuaja (CJ) y “cracking” (CK) para la producción de fruta se obtuvo con el tratamiento T1 (100% de la fertilización programada). Finalmente, para árboles maduros jóvenes que se encuentran en proceso de crecimiento y llenado de espacio, T3 (200% de la fertilización programada) permite cumplir estos objetivos de mejor manera, siendo afectada la producción inicial de fruta solo en las variables cuaja (CJ) y “cracking” (CK), no así en la producción (P), sólidos solubles (SS) ni calibre (CL). 6. RESUMEN Las investigaciones referidas a fertilización y riego en cerezos (Prunus avium L.) son escasas, por lo que es necesario realizar una calibración de los requerimientos nutricionales, y más aún, en cada localidad o huerto en particular. Es por esto que por medio del proyecto FONDEF D021-1030 se determinó el efecto de distintas concentraciones de una solución nutritiva (vía fertigación) sobre el crecimiento vegetativo y desarrollo reproductivos de árboles de cerezo. La investigación se efectuó en la Estación Experimental La Palma perteneciente a la Pontificia Universidad Católica de Valparaíso. Esta se realizó en una plantación de cerezos (Prunas avium L.) cv. Brooks, sobre patrón Maxma 14, plantados en 2003, la cual presenta una distancia de plantación de 5*2 m, sobre un terreno aluvial franco arenoso. El ensayo contó con cinco tratamientos los cuales entregaban distintas dosis de fertilizantes según la concentración de una solución madre, el tratamiento T0 (0%), T1 (100%), T2 (50%), T3 (200%) y T4 solo fertilización nitrogenada (100%) de fertilización programada. El ensayo fue distribuido en bloques completamente al azar, con tres repeticiones por tratamiento, el análisis se realizó mediante el test de Tukey (α=0.05). Las variables vegetativas que se midió fueron crecimiento apical del brote lateral (CABL), diámetro basal del brote lateral (DBBL), diámetro de tronco (DTR) y número de nudos del brote lateral (NNBL), las variables reproductivas fueron cuaja (CJ), producción (P), sólidos solubles (SS), calibre (CL) y “cracking” (CK). En los parámetros vegetativos solo se observó diferencia en las variables CABL y NNBL, las que a partir de mediados de noviembre manifiestan tal diferencia, siendo el tratamiento T3 (200%) el que presenta el mayor CABL y NNBL, indicando un mayor vigor que el resto de los tratamientos. Queda demostrado que las variables DBBL y DTR no son sensibles, a la fecha, a los distintos niveles de fertigación aplicados. En los parámetros reproductivos se obtuvo diferencia en las variables CJ y CK, presentando la mejor cuaja T1 (100%). En cuanto a CK los menores niveles se obtuvieron con los tratamientos T0 (0%) y T1 (100%). El resto de las variables reproductivas, P, SS y CL no se ven afectadas por los distintos niveles de fertigación realizados. El mejor efecto del crecimiento vegetativo se logró con aplicaciones de 200% de la fertilización programada (T3), por lo que seria este tratamiento el más conveniente para lograr una adecuada estructuración de los árboles en el plazo más breve posible. En la etapa maduro joven de los árboles de cerezo, que tienen una producción incipiente de fruta, no se ve afectada la producción (P), los sólidos solubles (SS) ni el calibre (CL), de los árboles tratados con distinto nivel de fertilización vía fertirriego. El mejor efecto en cuaja (CJ) y “cracking” (CK) para la producción de fruta se tuvo con el tratamiento T1 (100%). Finalmente, para árboles maduros jóvenes que se encuentran en proceso de crecimiento y llenado de espacio, T3 (200%) permite cumplir estos objetivos de mejor manera. 7. ABSTRACT Irrigation and fertilization are key aspects in orchard management. Since the orchard has to produce fruit as soon as possible keeping a steady yield over time, stagespecific practices are required. When fertilizers are not applied at the right amount and / or time, the crop can be negatively affected. Using fertigation is easier to get a positive tree response, by carefully adjusting the requirements to the specific phenological stages, age and sanitary status. With, in addition, better uniformity and efficiency in fertilizer use, compared to conventional practices. Research on fertilizer and irrigation in cherry orchards (Prunus avium L.) is rather scarce, and more information is needed in order to calibrate the plant’s needs in specific regions or even individual orchards. In the context of a FONDEF research project we plan to determine the effect of the concentration of a nutrient solution (using fertigation) on the vegetative and reproductive growth of cherry trees. The information obtained then can be used to expand the current production zones into areas that seem to be adequate for the crop, but currently not planted with the specie. The experiments were done at the La Palma Experiment Station, part of the Faculty of Agricultural Sciences of the Pontificia Universidad Católica de Valparaíso. The orchard is in the vicinity of Quillota, in Region V. The orchard was established in 2003 using the cultivar Brooks grafted onto Maxma 14 rootstocks, in a 5 x 2 m setting, on a sandy loam soil from aluvial origin. The experiment consisted on 5 treatments with increasing concentrations of a nutrient solution, applied with an automated system: T0 (0%), T1 (100%), T2 (50%), T3 (200%) and T4 only with nitrogen. The experiment was conducted with a randomized block design with three replicates per treatment. Means were compared with Tukey’s test (α=0.05). Vegetative growth was quantified by the growth of lateral shoots in length (LSW), diameter, measured at its base, (LSD), trunk diameter (TD), and the number of nodes in the lateral shoots (NN). Reproductive growth was measured as the fruit set (FS), yield (Y), soluble solids (SS), fruit size (FZ), and fruit cracking (CK). Among the vegetative growth parameters, significant differences were found only in LSW and NN. Starting in November, T3 plants showed the highest values for LSW, indicating a more vigorous condition of the tree. After 2 years of treatment fertigation treatments have not affected LSD and TD. Among the reproductive parameters, significant differences were found in FS and Y. T1 showed the lowest FS. The lowest Y was observed in T0 and T1. The other reproductive variables were not influenced by the fertigation treatments. The largest effect on vegetative growth was observed in the programmed fertigation with 200% (T3), indicating that this treatment would be the best choice when the orchard goal is to build structural branches as early as possible. During the mature young stage, when the cherry trees have only a marginal yield, there are no effects of the fertilizer treatments on Y, SS, and FZ. The best performance in FS and CK was observed in T1. Finally, when mature young trees are still growing and filling up the in-row space, T3 seems the most adequate to meet the goals, although loosing some FS and increasing CK, but without affecting Y, SS or FZ. 8. LITERATURA CITADA AGUSTI, M. 2004. Fruticultura. Madrid, Ediciones Mundi Prensa. 493p. BANNAN, M. 1962. The vascular cambium and tree-ring development. In: Tree growth, p. 3-21, T.T. Kozlowski (Ed.). Ronald, New York. EE.UU. BARGIONI, G. 1996. Sweet cherry scions: characteristics of the principal commercial cultivars, breeding objectives and methods. In: Webster A.D. y Looney N.E.. Cherries: eds. Crop physiology, production and uses. Wallingford, Cab International. pp 73-112. CIFUENTES, S. 1996. Influencia de la dosis y época de aplicación de nitrógeno en duraznero cv. O´henry y ciruelo cv. Angeleno, sobre el contenido de nitrógeno, nitrato reductasa, arginina y productividad. Tesis Ing. Agr. Santiago, Pontificia Universidad Católica de Chile. Facultad de Agronomía. 50 p. CLAVERIE, J. 2002. Mejoramiento genético varietal del cerezo en Francia. Universidad Católica de Valparaíso. Facultad de Agronomía Seminario “Cultivo del cerezo en la zona centro norte de Chile”. Quillota, 25 de Noviembre de 2002. pp 1-15. COLETO, M. 1995. Crecimiento y desarrollo de las especies frutales. Madrid, Ediciones Mundi Prensa. 168p. COMPO. 2005. Compo agricultura: Cerezo, (on line). www.compo.es/agricultura/cultivos/frutales/cerezo/ CORTEZ, A. 2002. Comportamiento fenológico y productivo del cerezo dulce (Prunas avium L.) en la localidad de la Palma, Quillota, V región. Taller de licenciatura Ing. Agr. Quillota, Universidad Católica de Valparaíso. Facultad de Agronomía. 97p. DOMINGUEZ, A. 1993. Fertirrigación. Madrid, Ediciones Mundi Prensa. 217p. EVANS, G. 1972. The quantitative análisis of plant growth. Univ. Calif. Press.Berkeley. California. EE.UU. EVERT, R. 1961. Some aspect of cambial development in Pyrus communis. Am. J. Bot. 48: 479-488. GIL-ALBERT, F. 1996. Tratado de arboricultura frutal. Morfología y Fisiología del árbol frutal. Madrid, Ediciones Mundi Prensa. 106p. (vol 1) GIL, G. 2000. La producción de fruta. Santiago, Ediciones Universidad Católica de Chile. 583p. --------. 2000. El potencial productivo. Santiago, Ediciones Universidad Católica de Chile. 342p. GONZALEZ, F. 2002. Efecto de la fertilización con N-P-K-Ca en palto (Persea americana Mill.) cv. Hass sobre su desarrollo, productividad y poscosecha. Taller de licenciatura. Quillota, Universidad Católica de Valparaíso, Facultad de Agronomia. 100p. HANSON, E and PROEBSTING, E. 1996. Cherry nutrient requirements and water relations. In: Webster, A and Looney, N. eds. Cherries: Crop physiology, production and uses. Wallingford, Cab internacional. Pp 243-257. INFORMACION AGRICOLA. 2005. El cultivo de las cerezas (en línea). España. (fecha de consulta: 16 noviembre, 2005) . Disponible en: http://www.infoagro.com/frutas/frutas_tradicionales/cerezas.asp JIL, M. 2002. Caracterización de nuevos cultivares de cerezo dulce Prunas Avium L. en la zona de Romeral, provincia de Curicó, VII región. Taller de Licenciatura Ing. Agr. Quillota, Universidad Católica de Valparaíso. Facultad de Agronomía. 63p. LAYNE, R. TAN, C. and HUNTER, M. 1996. Irrigation and fertilizer application methods affect performance of high-density peach orchard. Hort Science,. 31(3): 370-375. LOONEY, N and JACKSON, D. 1999. Stonefruit. In: Jackson, D and Looney, N. eds. Temperate and subtropical fruit production. 2nd edition. Wallingford, Cabi Publishing. Pp 171-188. LOPEZ, C. 1997. Relación agua y fertigación en naranjos (Citrus sinensis (l) Osbeck) de 16 años de edad. Tesis Ing. Agr. Chillan, Universidad de Concepción, Facultad de Agronomía. 27p. MOLINA, F. 2004. Determinación de los requerimientos de fertirrigación para plantas de chirimoyo (Annona cherimola Mill.) cv. Bronceada en la localidad de Quillota. Taller de Licenciatura. Quillota, Universidad Católica de Valparaíso, Facultad de Agronomía. 62 p. MOSRE, R. 1991. Efecto de la aplicación consecutiva y alternada de nitrógeno y nematicida sobre el crecimiento vegetativo y la producción en vid cv. Flame sedles injertado sobre patrón Semillón. Tesis In. Agr. Pontifica Universidad Católica de Chile. Facultad de Agronomía. 32p. NIELSEN, G. NIELSEN, D. and KAPPEL, F. 2002. Nutrient and water management of Lapins sweet cherry on Gisela 5. The compact fruit tree, 35(2): 59-62. NOVOA, R., VILLASECA, S., Del CANTO, P., ROUANET, J., SIERRA, C. y POZO, A. 1989. Mapa agroclimático de Chile, Santiago. Instituto de Investigaciones Agropecuarias. 221p. OFICINA DE ESTUDIOS Y POLITICAS AGRARIAS. 2005. Tabla de superficie y producción nacional, (on line). www.odepa.cl ROMAN, S. 2002. Libro azul: Manual básico de fertirriego. Santiago, Soquimich. 177p. SANCHEZ-DIAZ, M y AGUIRREOLEA, J. 2000. El agua en la planta. In: AzcónBieto J. y Talón M. Fundamentos de fisiología vegetal. Barcelona, Ediciones Universitat de Barcelona. 515p. SANCHEZ, M. 1999. Nutrición mineral de frutales de pepita y carozo. Río Negro, Ediciones INTA. 195p. VALENZUELA, L. 1998. El cultivo del Cerezo en Chile: Aspectos Técnicos. Revista Frutícola.19(2): pp.55-68. WEBSTER, A. 1996. The taxonomic classification of sweet and sour cheeries and a brief history of their cultivation. In: Webster, A and Looney, N. eds. Cherries: Crop physiology, production and uses. Wallingford, Cab Internacional. Pp 3-24. WHITING, M. LANG, G. and DAVID, O. 2005. Rootstock and training system affect sweet cherry growth, yield, and fruit quality. Hort Science, 40(3): 582-586. Anexos ANEXO 1: Control de fertigación temporada 2004-2005. Kg. ó Lts. De Productos por planta Fecha Tpo de Aplicación riego (hr) Tpo Inyección (hr) Urea Ac. Fosf. Nit. Pot. Sulf. Mg Sulf. Zn 08/10/2004 4 2 0,007 0,001648 0,0112 0,003777 0,00172 26/10/2004 4 2 0,007 0,001648 0,0112 0,003777 0,00172 0,05 0 0 0 0 30/10/2004 05/11/2004 4 2 0,007 0,001648 0,0112 0,003777 0,00172 07/11/2004 4 2 0,007 0,001648 0,0112 0,003777 0,00172 23/11/2004 10 2 0,007 0,001648 0,0112 0,003777 0,00172 24/11/2004 2 2 0,007 0,001648 0,0112 0,003777 0,00172 02/12/2004 6 0,025 0 0 0 0 06/12/2004 4 2 0,007 0,001648 0,0112 0,003777 0,00172 2 0,025 0,006 0,04 0,0134 0,00614 22/12/2004 28/12/2004 8 2 0,007 0,001648 0,0112 0,003777 0,00172 01/01/2005 6,5 2 0,007 0,001648 0,0112 0,003777 0,00172 06/01/2005 6 2 0,007 0,001648 0,0112 0,003777 0,00172 07/01/2005 6 2 0,007 0,001648 0,0112 0,003777 0,00172 0,177 0,024128 0,1632 0,054947 0,02506 Total Obs. Solo Urea Solo Urea Prep. espec. ANEXO 2: Control de fertigación temporada 2005-2006. Kg. Ó Lts. De Productos por planta Tpo de Tpo Fecha Aplicación Riego (Hr) Inyección (Hr) Urea Ac. Fosf. Nit. Pot. Sulf. Mg Sulf. Zn Obs. 21/10/2005 3 2 0,0096 0,0020 0,0081 0,0055 0,0020 solución 1 24/10/2005 3 2 0,0096 0,0020 0,0081 0,0055 0,0020 solución 1 27/10/2005 3 2 0,0096 0,0020 0,0081 0,0055 0,0020 solución 1 03/11/2005 3 2 0,0096 0,0020 0,0081 0,0055 0,0020 solución 1 09/11/2005 4 2 0,0096 0,0020 0,0081 0,0055 0,0020 solución 1 20/12/2005 2 1 0,0022 0,0005 0,0018 0,0005 0,0005 solución 2 21/12/2005 2 1 0,0022 0,0005 0,0018 0,0005 0,0005 solución 2 22/12/2005 2 1 0,0022 0,0005 0,0018 0,0005 0,0005 solución 2 23/12/2005 2 1 0,0022 0,0005 0,0018 0,0005 0,0005 solución 2 25/12/2005 2 1 0,0022 0,0005 0,0018 0,0005 0,0005 solución 2 27/12/2005 2 1 0,0022 0,0005 0,0018 0,0005 0,0005 solución 2 05/01/2006 2 1 0,0022 0,0005 0,0018 0,0005 0,0005 solución 2 11/01/2005 12/01/2005 2 2 1 1 0,0022 0,0022 0,0005 0,0005 0,0018 0,0018 0,0005 0,0005 0,0005 solución 2 0,0005 solución 2 14/01/2006 2 1 0,0022 0,0005 0,0018 0,0005 0,0005 solución 2 16/01/2006 3 2 0,0043 0,0009 0,0037 0,0010 0,0009 solución 2 18/01/2006 3 2 0,0043 0,0009 0,0037 0,0010 0,0009 solución 2 19/01/2006 2 1 0,0022 0,0005 0,0018 0,0005 0,0005 solución 2 21/01/2006 2 1 0,0022 0,0005 0,0018 0,0005 0,0005 solución 2 23/01/2002 2 1 0,0022 0,0005 0,0018 0,0005 0,0005 solución 2 27/01/2006 3 2 0,0043 0,0009 0,0037 0,0010 0,0009 solución 2 28/01/2006 3 2 0,0043 0,0009 0,0037 0,0010 0,0009 solución 2 0,0938 0,0201 0,0787 0,038 0,0201 subtotal *Falta la aplicación de fertilizantes comprendida entre Marzo y Abril de 2006. ANEXO 3. Control de riego por mes. Mes mar-05 abr-05 may-05 jun-05 jul-05 ago-05 sep-05 oct-05 nov-05 dic-05 ene-06 feb-06 ET0 mm Riego mm Precipitación mm 78,15 49,60 16,50 51,59 22,40 1,50 26,87 0,00 53,50 21,01 0,00 100,20 24,39 0,00 72,10 34,70 50,60 73,30 101,00 109,20 121,90 87,10 0,00 96,60 18,40 21,60 18,60 0,00 0,00 0,00 0,00 35,20 73,60 83,20 105,60 89,60 ANEXO 4: Crecimiento apical del brote lateral (CABL) por tratamiento y diferencia estadística durante el período de crecimiento. Largo de brote (cm) T0 T1 T2 T3 T4 0,0 a 0,0 a 0,0 a 0,0 a 0,0 a 17/08/2005 0,0 a 0,0 a 0,0 a 0,0 a 0,0 a 22/08/2005 0,0 a 0,0 a 0,0 a 0,0 a 0,0 a 30/08/2005 0,0 a 0,0 a 0,0 a 0,0 a 0,0 a 06/09/2005 1,5 a 1,3 a 1,6 a 1,0 a 1,5 a 13/09/2005 3,2 a 2,8 a 3,3 a 2,2 a 3,2 a 22/09/2005 4,7 a 4,7 a 5,1 a 3,8 a 5,2 a 28/09/2005 7,2 a 7,8 a 7,6 a 6,0 a 7,8 a 05/10/2005 13/10/2005 11,0 a 12,3 a 12,5 a 9,7 a 12,1 a 20/10/2005 16,2 a 17,6 a 18,1 a 14,8 a 17,6 a 26/10/2005 20,4 a 22,0 a 23,1 a 19,3 a 21,8 a 02/11/2005 27,1 a 27,9 a 29,0 a 25,8 a 27,5 a 08/11/2005 31,4 a 31,8 a 33,8 a 31,2 a 31,2 a 16/11/2005 36,5 a 37,0 a 37,9 a 38,7 a 34,8 a 22/11/2005 40,5 a 40,8 a 40,9 a 44,9 a 37,0 a 30/11/2005 44,4 ab 44,5 ab 43,0 ab 52,5 a 38,2 b 07/12/2005 46,3 b 46,6 b 44,6 b 57,9 a 38,7 b 13/12/2005 47,7 b 47,9 b 46,4 b 61,2 a 39,4 b 20/12/2005 48,3 b 49,2 b 47,4 b 63,0 a 39,7 b 26/12/2005 48,7 b 49,4 b 47,9 b 63,9 a 39,8 b 03/01/2006 48,8 b 49,4 b 48,0 b 64,8 a 40,0 b 10/01/2006 48,8 b 49,5 b 48,0 b 65,2 a 40,0 b Letras diferentes indican diferencia significativa (5%), en cada columna ANEXO 5: Diámetro basal brotes laterales (DBBL) por tratamiento durante la temporada de crecimiento. T0 T1 T2 T3 T4 Invierno 1,74 1,75 1,65 1,74 1,52 17/08/2005 1,70 1,72 1,68 1,74 1,52 14/09/2005 1,70 1,71 1,70 1,75 1,53 20/10/2005 1,72 1,82 1,75 1,83 1,60 16/11/2005 1,83 2,00 1,88 2,02 1,66 20/12/2005 2,09 2,25 2,19 2,32 1,87 20/01/2006 2,30 2,41 2,48 2,50 2,00 17/02/2006 2,49 2,57 2,67 2,78 2,21 No existe diferencia significativa con α=0.05 ANEXO 6: Diámetro de tronco (DTR) por tratamiento durante la temporada de crecimiento. T0 T1 T2 T3 6,09 6,29 6,39 6,45 Invierno 5,96 6,15 6,14 6,46 17/08/2005 5,89 6,20 6,13 6,44 14/09/2005 6,02 6,59 6,44 6,65 20/10/2005 6,21 6,78 6,61 7,06 16/11/2005 6,75 7,37 7,38 7,45 20/12/2005 7,51 7,79 7,75 8,07 17/01/2006 8,02 8,36 8,52 8,54 17/02/2006 No existe diferencia significativa al 5% con α=0.05. T4 6,21 5,99 5,92 6,29 6,46 6,93 7,52 8,17 ANEXO 7: Evolución del numero de nudos del brote lateral por árbol. Tratamiento –número de planta Nº nudos Largo rama (cm) nudos/cm nudos/mt t0t1t2t3t4t0t1t2t3t4t0t1t2t3t413 64 41 61 38 67 44 70 16 47 73 22 50 25 53 28,8 19,7 31 21,7 16,3 29,7 27,3 26,2 34 23 24 27,3 25,2 26,5 31,7 50,2 36,3 61,8 44,5 27,9 60,8 60,6 54,7 72,3 45,1 48,9 54,8 50,9 59,2 64,1 0,58 0,52 0,53 0,55 0,6 0,51 0,46 0,52 0,49 0,52 0,51 0,51 0,41 0,47 0,52 59,1 51,8 55,3 45,8 58,9 50,9 47,2 51,4 46,9 54,9 53,5 50,7 48,1 46,2 52,6 ANEXO 8: Datos de producción y calidad por planta. Tratamiento-número de planta Producción (kg) Cracking (%) Dañado por Pájaro (%) Sólidos solubles (ºBrix) Producción Exportable (Kg) t0-13 0,79 12 8 17 0,63 t1-64 1,16 6 22 20 0,84 t2-41 0,84 20 12 20 0,57 t3-61 0,72 24 21 19 0,40 t4-38 0,67 21 19 23 0,40 t0-67 0,77 7 15 18 0,60 t1-44 1,24 8 16 20 0,94 t2-70 0,82 16 24 20 0,49 t3-16 1,04 32 4 18 0,67 t4-47 0,99 24 4 20 0,71 t0-73 0,72 12 16 19 0,52 t1-22 0,74 10 16 17 0,55 t2-50 0,95 16 4 20 0,76 t3-25 0,71 28 12 20 0,43 t4-53 0,55 28 0 18 0,40 ANEXO 9: Distribución porcentual de fruta en las categorías correspondientes según su diámetro, por árbol. Categoría A+B C+D E+F t0-13 30 50 20 t1-64 40 50 10 t2-41 40 40 20 t3-61 90 10 0 t4-38 100 0 0 t0-67 80 20 0 t1-44 30 70 0 t2-70 80 20 0 t3-16 60 20 20 t4-47 50 40 10 t0-73 80 20 0 t1-22 30 60 10 t2-50 20 80 0 t3-25 60 40 0 t4-53 50 30 20