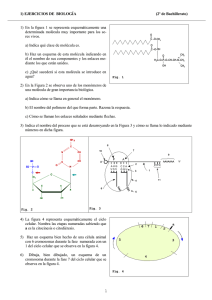
Cl F CH Br Cl - Consejo de Estudiantes de la EPS
Anuncio

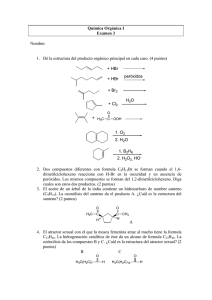
GRADO EN INGENIERÍA ELÉCTRICA. EXAMEN DE FEBRERO 2013 GRUPO A Nombre: CUESTIONES 1) A) Indica, razonadamente, si las siguientes afirmaciones son verdaderas o falsas: a.1. Algunas reacciones exotérmicas no son espontáneas. a.2. En el equilibrio, el potencial de una pila es cero. B) Contesta de manera razonada (no marcar simplemente la opción): b.1. Una determinada disolución contiene 74,6 g de KCl por cada 72 g de H2O. La fracción molar del KCl es: a) 0,25 b) 1,25 c) 0,2 d) 1 e) Ninguna de las anteriores Dato: peso molecular de KCl: 74,6 g. Peso molecular del H2O: 18g b.2. Se mezclan 1,5L de una disolución de concentración 8M en HCl con 0,5L de HCl 2M. La concentración de la disolución restante es: a) 5M b) 5,5M c) 6M d) 6,5M e) Ninguna de las anteriores 2) A) ¿Qué tipo de isomería presentan entre sí los siguientes compuestos? CH3 CH3 H3C CH3 a.1. CH3 H3C y CH3 CH3 H3C a.2. OH respecto a H3C OH ? B) Indica qué tipo de isomería presentan los siguientes compuestos y determina la configuración correspondiente. Cuando sea posible, dibuja el enantiómero y un diastereoisómero. H a b Cl F CH2 Cl Br C O OH Cl HOH2C H HOOC OH Br Cl CH2OH 3) Dada la molécula de PH3: a) Escribe la estructura de Lewis e indica la geometría de la molécula según la TRPECV. b) ¿Será una molécula polar o apolar? c) ¿Qué tipo de hibridación presentará el átomo central de la molécula? d) ¿qué tipo de interacción existirá entre una molécula de PH3 y otra de He? ¿Y entre el Ne y el CH3OH? ¿y entre H2O y el Na+? 4) El ácido ascórbico (Vitamina C) cura el escorbuto y ayuda a evitar el resfriado común. Está compuesto por 40,92% de carbono, 4,58% de hidrógeno y 54,50% de oxígeno en masa. Determinar su fórmula empírica (Masas atómicas: C=12; H=1; O=16) 5) Para la reacción redox indicada, de los enunciados siguientes indica razonadamente los que falsos y los que son verdaderos: K2Cr2O7 + 6 HI + 8 HClO4 2 Cr(ClO4)3 + 2 KClO4 + 3 I2 + 7 H2O a) El cromo se reduce. b) El cloro actúa como oxidante, al ser su estado de oxidación +7. c) El yodo es el reductor conjugado del yoduro. d) El potasio no interviene en el proceso de oxidación-reducción. 6) En unos años te conviertes en ingenier@ eléctrico y tu jefe te plantea la siguiente pregunta: Tengo dos bidones. En uno de ellos tengo una disolución de cloruro férrico y en el otro una disolución de cloruro cuproso. Pretendo recuperar los metales por electrolisis. ¿En cuál de los dos casos necesitaré un mayor consumo de electricidad por tonelada de metal recuperada? Justifica la respuesta, mediante los cálculos correspondientes. Dato: masas atómicas, Fe (55,85), Cu (63,55) GRADO EN INGENIERÍA ELÉCTRICA. EXAMEN DE FEBRERO 2013 (05/02/2013) GRUPO A PROBLEMAS 1) Se tiene una disolución reguladora con las siguientes concentraciones: acetato sódico 0,06 M y ácido acético 0,07 M a 25ºC. (Dato: Ka=1,80·10-5) Calcula: a) la variación de pH que se añaden 0,02 moles de HCl a 600mL la disolución anterior. b) ¿Qué variación de pH se produce cuando añadimos 0,02 moles de HCl a 600mL de agua (suponer que el volumen no varía)? 2) Los calores normales de combustión del hidrógeno, carbono, metano y etano son, respectivamente, -68.32, -94.05, -212.80 y –372.82 kcal/mol. A) Calcular los calores de formación del metano y etano y el calor de la reacción C2H6 (g) + H2 (g) → 2 CH4 (g). B) Calcular la masa de agua que puedo calentar desde 20 a 40ºC con el calor desprendido en la reacción anterior. Dato: calor específico del agua 1 cal/g ºC 3) El ácido clorhídrico reacciona con el dióxido de manganeso (IV) obteniéndose dicloruro de manganeso además de cloro y agua. a) Ajuste esta reacción por el método del ion-electrón. b) Dada la reacción de oxidación del aluminio ajustada en medio básico: 2Al + 2NaOH + 2H2O 2NaAlO2 + 3H2 Calcular el volumen de hidrógeno que se desprende, medido a 250ºC y 600 mm de Hg, cuando se oxidan 2 kg de aluminio. Datos. R = 0,082 atm· L· K-1· mol-1. Masa atómica: Al=27. 4) La tostación de la pirita se produce según la reacción: 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 Calcula: a) La cantidad de Fe2O3 que se obtiene al tratar 380 kg de pirita de un 85% de riqueza en FeS2, con exceso de oxígeno. b) El volumen de oxígeno, medido a 20 ºC y 700 mm de Hg, necesario para tostar los 380 kg de pirita del 85 % de riqueza. Datos: R = 0,082 atm·L·K-1·mol-1. Masas atómicas: Fe=55,9; S=32; O=16. Formulación orgánica e inorgánica (se deben superar 16 de las 20 preguntas) 1 H3C CH3 2 CH3 3 4 O H3C CH3 H3C NH2 CH3 H3C 6 3‐metilpentano 7 Ciclobuteno 8 Butanal 9 Pentanoato de etilo 10 1‐butino 11) Nitrito sódico 12) Ácido sulfúrico 13) Bicarbonato potásico (o carbonato ácido de potasio) 14) Ácido hipocloroso 15) Permanganato potásico 16) K2Cr2O7 17) FeO 18) H2S 19) NO2 20) BaO2 5 O CH3 GRADO EN INGENIERÍA ELÉCTRICA. EXAMEN DE FEBRERO 2013 GRUPO B Nombre: CUESTIONES 1) A) Contesta de manera razonada (no marcar simplemente la opción): A.1. Se mezcla 1L de disolución 1M de HCl con 2L de disolución 4M de HCl ¿cuál es la concentración de la disolución resultante? a) 2M b) 2,5M c) 3M d) 6M e) Ninguna de las anteriores A.2. Una determinada disolución contiene 58,5 g de NaCl por cada 36 g de H2O. La fracción molar del NaCl es: f) 0,5 g) 1,33 h) 1 i) 0,33 j) Ninguna de las anteriores Dato: peso molecular de NaCl: 58,5 g. Peso molecular del H2O: 18g B) Indica, razonadamente, si las siguientes afirmaciones son verdaderas o falsas: B.1. Algunas reacciones endotérmicas son espontáneas. B.2. Los números cuánticos (3, 0, -1, 1) corresponden a un electrón en un orbital 3s 2) A) A.1. Representa todos los isómeros cíclicos de fórmula C6H12 A.2. Pon un ejemplo de isomería de función B) Indica qué tipo de isomería presentan los siguientes compuestos y determina la configuración correspondiente. Cuando sea posible, dibuja el enantiómero y un diastereoisómero. H A C H3C H HOOC Cl B O F H OH Cl CH2OH F Cl Br CH3 3) Dada la molécula de H2O: a) Escribe la estructura de Lewis e indica la geometría de la molécula según la TRPECV. b) ¿Será una molécula polar o apolar? c) ¿Qué tipo de hibridación presentará el átomo central de la molécula? d) ¿Qué tipo de interacción presentará una molécula de agua con otra de N2? ¿y una molécula de agua con NH3? ¿y una molécula de He con otra de Ar? 4) En unos años te conviertes en ingenier@ eléctrico y tu jefe te plantea la siguiente pregunta: Tengo tres bidones. En uno de ellos tengo una disolución que contiene iones sodio, en otro iones magnesio y en el último una sal de aluminio. Pretendo recuperar los metales por electrolisis. ¿En cuál de los tres casos necesitaré un mayor consumo de electricidad por tonelada de metal recuperada? Justifica la respuesta mediante los cálculos correspondientes. Dato: masas atómicas, Na (23,0), Mg (24,3), Al (27,0). 5) El fosgeno es un gas venenoso que contiene: C 12,1%; O 16,2%; Cl 71,7 %. Sabiendo que el peso molecular es de 99 uma. Calcula la fórmula empírica y molecular de este compuesto. 6) Para esta reacción redox, de los enunciados siguientes indica razonadamente los que son falsos y los que son verdaderos: 2KMnO4 +5 Fe+ 16 HCl 5 FeCl2 + 2 MnCl2 + 2 KCl+8 H2O a) El potasio actúa como reductor del permanganato. b) El hierro actúa como oxidante. c) El manganeso (II) es el reductor conjugado del permanganato. d) El cloro se reduce a cloruro. GRADO EN INGENIERÍA ELÉCTRICA. EXAMEN DE FEBRERO 2013 (05/02/2013) GRUPO B PROBLEMAS 1) La tostación de la pirita se produce según la reacción: 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 Calcula: a) La cantidad de Fe2O3 que se obtiene al tratar 250 kg de pirita de un 90% de riqueza en FeS2, con exceso de oxígeno. b) El volumen de oxígeno, medido a 20 ºC y 700 mm de Hg, necesario para tostar los 250 kg de pirita del 90% de riqueza. Datos: R = 0,082 atm·L·K-1·mol-1. Masas atómicas: Fe=55,9; S=32; O=16. 2) Se tiene una disolución reguladora con las siguientes concentraciones: acetato sódico 0,07M y ácido acético 0,06 M a 25ºC. (Dato: Ka=1,80·10-5) Calcula: a) la variación de pH que se añaden 0,8g de NaOH a 600mL la disolución anterior. b) ¿Qué variación de pH se produce cuando añadimos 0,8g de NaOH a 600mL de agua (suponer que el volumen no varía)? Dato: pesos atómicos: Na (23), O (16), H (1) 3)La gasolina es una mezcla de diferentes hidrocarburos, considerar que su composición media es la del octano y que su densidad es 0,78 g/mL. A) Calcula el volumen de aire a 1 atm y 30ºC necesario para la combustión de 25L de gasolina. Considerar que el aire tiene un 20% de oxígeno en volumen. B) Se sabe que el calor producido en quemar un mol de octano es de -5471kJ. Calcula qué volumen de agua podría calentarse con el calor desprendido en la combustión de los 25L de gasolina si se eleva la temperatura de 30ºC a 80ºC. Pa: C =12; O = 16, H =1. Calor específico del agua: 1 cal/g ºC 4)El ión nitrato en medio ácido oxida al cadmio. El cadmio se oxida a Cd(II) mientras que el ión nitrato se reduce a monóxido de nitrógeno. A) Ajusta la reacción redox por el método del ión electrón. B) Calcula la constante de equilibrio para este proceso redox. Datos: Eºred Cd2+/Cd = 0,4V; Eºred NO 3-/NO = 0,96 V. Formulación orgánica e inorgánica (se deben superar 16 de las 20 preguntas) CH3 1 2 H3C H3C CH3 3 CH3 O OH 4 H3C H3C H3C 6 ciclopenteno 7 2‐hexeno 8 2‐metilheptano 9 2‐pentanona 10 Butanoato de metilo 11) Sulfato amónico 12) Fosfato sódico 13) Amoníaco 14) Peróxido de hidrogeno 15) Óxido de cobalto (III) (u óxido cobáltico) 16) KNO2 17) KHSO4 18) HClO 19) N2O5 20) NiO 5 NH2